Применение производных имидазо[1,2-a]пиридин-3-ацетамида для лечения нейропсихиатрических синдромов, связанных с дисфункцией нервных цепей базальных ганглиев
Формула / Реферат
1. Применение производных имидазо[1,2-а]пиридин-3-ацетамида общей формулы (I)
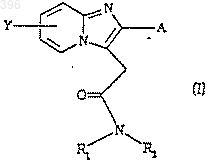
где Y представляет атом водорода или галогена или С1-4алкильную группу,
А представляет радикал нафтил или радикал
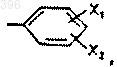
где каждый из Х1 и Х2, независимо один от другого, представляет атом водорода или галогена, С1-4 алкоксигруппу, С1-6 алкильную группу или СF3, СН3S-, СН3SO2- или -NO2, и каждый из R1 и R2, независимо один от другого, представляет либо атом водорода, либо линейную или разветвленную С1-5 алкильную группу, которая является незамещенной или замещенной одним или несколькими атомами галогена, гидроксильными группами, -N(C1-4 алкилом)2, карбамоилом или С1-4 алкоксигруппами, или аллильную группу, или пропаргиловую группу или С3-С6 циклоалкильную группу или бензил, или фенил, но оба R1 и R2 не являются атомами водорода, или -NR1R2 представляет собой гетероциклическое кольцо, содержащее от 3 до 6 атомов углерода, или гетероциклическое кольцо формулы
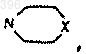
где X - О, S, CHOR' или N-R, R' является водородом или бензилом и R представляет собой водород, С1-4 алкильную группу или фенил, который является незамещенным или замещенным метоксигруппой или атомом галогена, при условии, что если Y представляет 6-хлор, А не является 4-хлорфенилом,
для получения лекарственного средства для лечения нейропсихиатрических синдромов, связанных с дисфункцией нервных цепей базальных ганглиев.
2. Применение по п.1, отличающееся тем, что указанные соединения общей формулы (А) используют для получения лекарственного средства для лечения болезни Паркинсона, синдромов паркинсонизма, других внепирамидальных синдромов, классифицируемых как "паркинсонизм плюс" (синдром Stule-Richardson-Olszewski, дегенерация кортикальных базальных ядер, мультисистемная атрофия, болезнь Вильсона, болезнь Халлерворден-Спатца, болезнь Хаттингтона и нейроакантоцитоз), навязчиво-компульсивного расстройства и других навязчиво-компульсивных синдромов, лобной и подкорковой деменций.
3. Применение по п.1, отличающееся тем, что производное имидазо[1,2-а]пиридин-3-ацетамида имеет следующую формулу (II)
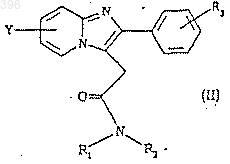
где R3 представляет галоген, предпочтительно хлор, или С1-4 алкильную группу;
Y представляет галоген, предпочтительно хлор, или С1-4 алкильную группу; и
R1 и R2, одинаковые или различные, представляют водород или С1-4 алкильную группу, при условии, что если Y представляет 6-хлор, R3 не является 4-хлором.
4. Применение по п.3, отличающееся тем, что имидазо[1,2-а]пиридин-3-ацетамидом является золпидем-[N,N,6-триметил-2-(4-метилфенил)имидазо[1,2-а]пиридин-3-ацетамид гемитартрат].
Текст
1 Настоящее изобретение относится к применению производных имидазо[1,2-а]пиридин 3-ацетамида при лечении болезни Паркинсона,синдрома паркинсонизма, других внепирамидных синдромов ("паркинсонизм плюс"), навязчиво-компульсивного расстройства и других навязчиво-компульсивных синдромов и лобной и подкорковой деменции. Такие производные имидазо[1,2 а]пиридин-3-ацетамида опубликованы в ЕР-В-0050563 и имеют общую формулу (I): где Y представляет атом водорода или галогена или С 1-4 алкильную группу,А представляет радикал нафтил или радикал где каждый из X1 и Х 2, независимо один от другого, - атом водорода или галогена или С 1-4 алкоксигруппа, С 1-6 алкильная группа или СF3,СН 3S-, СН 3SО 2- или -NO2, и каждый из R1 и R2, независимо один от другого, представляет либо атом водорода, либо линейную или разветвленную С 1-5 алкильную группу, которая является незамещенной или замещенной одним или несколькими атомами галогена, группами гидроксила -N(C1-4 алкил)2,карбамоила или С 1-4 алкоксигруппами; либо группу аллила, или группу пропаргила, или группу С 3-6 циклоалкила, или группу бензила,или группу фенила, но оба R1 и R2 не являются атомами водорода, или -NR1R2 представляет гетероциклическое кольцо, содержащее от 3 до 6 атомов углерода, или гетероциклическое кольцо формулы где Х - О, S, CHOR' или N-R, R' является водородом или бензилом, и R представляет водород,С 1-4 алкильную группу или фенил, который является незамещенным или замещенным метокси или атомом галогена, при условии, что если Y 6-хлор, А не является 4-хлорфенилом. Среди этих производных имидазо[1,2 а]пиридин-3-ацетамида предпочтительными являются имидазо[1,2-а]пиридин-3-ацетамиды следующей формулы (II)R1 и R2, одинаковые или разные, - водород или С 1-4 алкильная группа, при условии, что,если Y - хлор, R3 - не является 4-хлор, и особенно предпочтительным является золпидем [гемитартрат N,N,6-триметил-2-(4-метилфенил)имидазо[1,2-а]пиридин-3-ацетамида]. Золпидем [гемитартрат N,N,6-триметил-2(4-метилфенил)имидазо[1,2-а]пиридин-3-ацетамида] до сих пор использовался исключительно как снотворное лекарство. Для лечения бессоницы принимают 5-20 мг золпидема перед сном. Золпидем абсорбируется быстро и полностью даже при пероральном введении. Абсолютная биодоступность в организме человека составляет приблизительно 70%. Когда 10 мг золпидема вводят перорально здоровым добровольцам, пиковый уровень в плазме достигается после 0,5-3 ч, а полупериод существования в плазме составляет 0,7-3,5 ч. Фракция, которая остается не связанной с белками плазмы, составляет приблизительно 8% (Thenot et al.,Pharmacokinetics and metabolism of zolpidem ineffects, J. Pharmacol, Exp. Ther., 237:649-60,1986). Хотя золпидем обладает действиями, характерными для бензодиазепинов, они проявляются иначе, когда доза увеличивается. Седативный и снотворный эффекты проявляются при более низких дозах, чем те, которые требуются для получения других его эффектов (противосудорожного, анксиолитического и релаксирующего мышцы) (Zivkovic et al., P. BartlouilMedica, 1990). Золпидем уменьшает скрытое состояние наступления сна и число ночных пробуждений, увеличивая тем самым общее время сна. Флумазенил антагонизирует все эффекты золпидема, которые у него проявляются как у бензодиазепинов (Depoortere et al., Zolpidem, aExp. Ther., 237:649-60, 1986). Острая, подострая и хроническая токсичность золпидема являются минимальными (J.C. Friedmann, A. Prenez, Safetydisorders, Raven Press, NY, 1988). Исследование профиля безопасности на пациентах показывает, что золпидем является безопасным лекарством, которое может вызывать вредные последствия, которые обычно относятся к дозе и могут рассматриваться как распространение его фармакологических свойств. Такие вредные последствия включают головокружение, головную боль и спутанность сознания (R. Раlminteri, G. Narbonne, Safety profile ofzolpidem, in: Sauvanet, Langer, Morselli, Imidasopyridines in sleep disorders, Raven Press, NY,1988). Золпидем отличается от бензодиазепинов тем, что он имеет нетипичный профиль связывания с сайтами рецептора . Комплекс рецептора GABA (гамма-аминомасляная кислота) -А содержит рецептор для GABA-A, канал для Clиона и сайт(сайт распознавания бензодиазепинов, имидазопиридинов, циклопирролонов). Золпидем взаимодействует с сайтамии подобно бензодиазепинам усиливает ответ рецептора на GABA путем повышения частоты, с которой Cl-каналы открываются в ответ на GABA. Большинство бензодиазепинов имеют плохую селективность для различных подтипов рецептора(1, 2 и 3). Важно отметить, что многие имидазо[1,2 а]пиридин-3-ацетамиды (включая золпидем),наоборот, обнаруживают высокую селективность для подтипа рецептора 1 (BZ1) (Langer etvivo на крысах и обезьянах показывают, что золпидем селективно связывается с подтипомPharmacol., 330:248-251, 1985) и in vivo (Zivkovic et al., P. Bathouil (Ed.), Insomnia et Imidazopyridines, Excerpta Medica, 1990), показывают, что золпидем является более эффективным, чем бензодиазепины в индуцировании эффектов, опосредуемых GАВАергическими механизмами. Наивысшая плотность рецепторов BZ1 наблюдается в вентральном бледном шаре и сетчатой части черного вещества мозга (Langer etof zolpidem, in: Sauvanet, Langer and Morselli,Imidasopyridines in sleep disorders, Raven Press,NY, 1988), двух выводящих структурах базальных ядер. В других структурах центральной нервной системы (ЦНС), напротив, либо доми 000396 4 нируют рецепторы BZ2 (хвостатое ядро, скорлупа - наиболее латерально расположенная часть чечевицеобразного ядра), либо присутствуют оба рецептора BZ1 и BZ2 (лобно-теменная кора,таламус). Однако отсутствует связь между уже известным применением золпидема как снотворного и тем, что составляет предмет настоящего изобретения. В настоящее время обнаружено, что золпидем является эффективным в лечении болезни Паркинсона, синдромов паркинсонизма, других внепирамидных синдромов ("паркинсонизм плюс"), навязчиво-компульсивного расстройства и других навязчиво-компульсивных синдромов и лобной и подкорковой деменции. Болезнь Паркинсона (БП) характеризуется появлением дегенеративных повреждений в компактной части черного вещества и его допаминергических проекциях (проводящих путях) в полосатое тело (хвостатое ядро и скорлупу). Клинически болезнь характеризуется наличием,по меньшей мере, двух из следующих трех кардинальных признаков: брадикинезия, ригидность, тремор. У людей кавказского типа уровень распространения БП находится в пределах от 84 до 187 случаев на 100000 человек. При БП уменьшенная допаминергическая иннервация дает, посредством двух раздельных цепей (прямой и непрямой), рост избыточной активности внутреннего сегмента бледного шара (Vitek et al., Soc. Neurosci. Abstracts, 19:1584,1993), что оказывает тормозящие воздействия на следующие структуры:(а) на вентролатеральное ядро таламуса, в результате чего уменьшается возбуждение таламусом некоторых участков коры мозга, в частности, дополнительной двигательной зоны (L.(б) на ядра ножек и варолиева моста, в результате чего уменьшается возбуждение вестибулоспинальных и ретикулоспинальных нисходящих проводящих путей. Эта ингибирующая гиперактивность внутреннего сегмента бледного шара, наблюдаемая при БП, достигается посредством следующих двух цепей: (1) "прямой" цепи: в этой цепи допамин имеет возбуждающие эффекты, опосредуемые рецепторами D1. Отсюда, при БП уменьшенное допаминергическое нигростриарное (имеющее отношение к эфферентной связи черного вещества с полосатым телом) возбуждение нейронов скорлупы, которые проецируют во внутренний сегмент бледного шара, уменьшает ингибирование скорлупой внутреннего сегмента бледного шара, которое, поэтому, возбуждается; (2) "непрямая" цепь: в этой цепи допамин имеет ингибирующие эффекты, опосредуемые рецепторами D2. Отсюда, при БП уменьшенное допаминергическое нигростриар 5 ное торможение нейронов скорлупы, которые проецируют во внешний сегмент бледного шара, вызывает повышенное ингибирование скорлупой внешнего сегмента бледного шара, за счет чего уменьшается ингибирующее воздействие внешнего бледного шара на субталамическое ядро; в результате субталамическое ядро возбуждается и, в свою очередь, возбуждает внутренний сегмент бледного шара. На протяжении многих лет наиболее широко применяемым при БП лекарством является леводопа (L-допа), метаболический предшественник допамина, который не способен проходить через гематоэнцефалический барьер. Наибольшая часть L-допа подвергается метаболизму периферически прежде, чем он достигает сайтов его действия в ЦНС. Отсюда, L-допа,используемый один, эффективен против паркинсонизма только в очень высоких дозах, которые часто вызывают тяжелые побочные эффекты (потерю аппетита, тошноту и рвоту, ортостатическую гипотензию и т.п.). Поэтому целесообразно комбинировать Lдопа с лекарственными средствами, которые создают периферическое ингибирование фермента допа-декарбоксилазы. Эти лекарственные средства (бенсеразид и карбидопа) препятствуют периферическому метаболизму L-допа (прежде, чем он достигнет ЦНС) и, поэтому, уменьшают дозы L-допа, необходимые для достижения терапевтических эффектов, снижая, тем самым, вышеупомянутые побочные эффекты. У пациентов с БП продолжительное лечение с применением L-допа (даже при введении в комбинации с периферическими ингибиторами допа-декарбоксилазы) может часто вызывать другие неприятные побочные эффекты, такие как обычно наблюдаемые дискинезии (хорееподобные движения головы, туловища и конечностей), вызываемые гиперчувствительностью кL-допа. Главным недостатком лечения с применением L-допа является то, что со временем это лекарственное средство может потерять свою первоначальную эффективность в организме пациентов с БП. После немногих лет непрерывного лечения с применением L-допа симптомы паркинсонизма имеют тенденцию становиться все менее контролируемыми этим лекарственным средством. Начало флюктуаций в двигательной активности (флюктуации "включениеотключение") также является обычным: периоды "включения", характеризующиеся хорошей двигательной активностью, длящиеся в течение нескольких часов после приема дозы L-допа,перемежаются в течение суток периодами "отключения", характеризующимися обострением двигательных симптомов. Эти эффекты "включения-отключения" не наблюдаются до начала лечения с применением L-допа. Прогрессирующая потеря эффективностиL-допа у пациентов с БП ставит некоторое чис 000396 6 ло комплексных терапевтических проблем. Предполагается, что полезно начинать с введения этого лекарственного средства в наименьших возможных дозах. Однако в настоящее время предметом обсуждения является целесообразность применения L-допа на ранних стадиях заболевания. Агонисты допамина (бромкриптин, лизурид, перголид) действуют непосредственно на допаминергические рецепторы и представляют возможную альтернативу L-допа, в комбинации с которым они также могут быть использованы. Однако агонисты допамина также могут вызывать серьезные побочные эффекты (психиатрические расстройства, тошноту, рвоту, гипотензию, эритромелалгию). Эти эффекты, подобно таковым L-допа, могут быть настолько тяжелыми, что появляется необходимость прекратить лечение. Исследования в области лечения БП в настоящее время рассматривают следующие классы лекарственных средств: новые допаминергические агонисты, ингибиторы катехол-O-метилтрансферазы, антагонисты глутамергическихNMDA рецепторов, ингибиторы выделения глутамата (D.B. Calne, Treatment of Parkinson's Disease, N. Engl. J. Med., 329:1021-1027, 1993). Ранее предполагалось, в теории, что лекарственные средства, которые действуют наGАВАергическую систему, могут быть получены при лечении БП (J. Jankovich, C.D. Marsden,Therapeutic strategies in Parkinson's disease, in: J.and movement disorders, UrbanSchwarzenberg,1988). Однако существует слишком мало экспериментальных доказательств, показывающих,что эти препараты могут быть действительно эффективными. Были отдельные сообщения о слабом полезном воздействии на пациентов с БП после введения прогабида, GABA-агониста,который, как полагают, уменьшает "стирающий" эффект (K.J. Bergman, Progabide: a newGABA-mimetic agent clinical use, Clin. Neuropharmacol., 8:6-13, 1985). Недавно также были сообщения, что новый нейрохирургический подход, заключающийся в индуцировании стереотаксических повреждений постеровентрального бледного шара,является эффективным у пациентов с БП (Laitinen et al., Leksell's posteroventral pallidotomy inParkinson's akinesia by pallidotomy. Lancet 343:418-419, 1994). Этот подход является, видимо, более эффективным, чем трансплантаты эмбриональной ткани, и способен улучшать все три кардинальных симптома болезни (акинезия,ригидность, тремор). Лечебный эффект этой процедуры является следствием прерывания проекций (проводящих путей мозга), которые берут начало от внутреннего сегмента бледного шара и направ 7 лены к (а) таламусу (вентролатеральное ядро), с одной стороны, и (б) ядрам ножек и моста, с другой (J.E. Hoover, P.L. Strick, Multiple outputchannels in the basal ganglia. Science 259:819-821,1993). Эффективность золпидема впервые наблюдалась у 62-летней пациентки, которой был предписан золпидем в качестве снотворного средства. Пациентка страдала от болезни Паркинсона много лет и имела также развивавшиеся примерно в течение двух предшествующих лет навязчиво-компульсивные поведенческие реакции и деменцию как результат подкоркового ишемического повреждения сосудов мозга в скорлупе левого полушария. Умственная деградация, проявляемая пациенткой, могла быть определена как подкорковая деменция с признаками, подобными признакам лобных деменций (М.А. Albert et al., The "subcortical dementia"in patients with progressive supranuclear palsy,Brain 108:785-799,1985). Навязчивокомпульсивное поведение характеризовалось,главным образом, постоянными словесными итерациями (навязчивым повторением слов или фраз на протяжении большей части дня). Следует подчеркнуть, что навязчивокомпульсивное расстройство также наблюдается как следствие дисфункции нервных цепей,включающих базальные ядра (J.L. Cummings, К.other behavioural changes with bilateral basal ganglia lesions. Brain 112:699-725, 1989). После приема 10 мг золпидема пациентка не обнаруживала никаких признаков сонливости, но она показала заметное улучшение и в симптомах паркинсонизма (акинезия и ригидность), и в навязчиво-компульсивных симптомах (прекращение словесных итераций). У пациентки появилось также некоторое умственное улучшение с неожиданной ремиссией симптомов деменции. На этой пациентке было проведено исследование двойным слепым методом с контролем плацебо для оценки возможных эффектов различных веществ на симптомы паркинсонизма и компульсивные симптомы. Золпидем вводили в два отдельных периода и получали эффекты антипаркинсонизма,эквивалентные эффектам от L-допа. Лекарственные средства, которые являются агонистамиBZ сайтов, но не имеют селективности по отношению к BZ1 рецептору, такие как триазолам(бензодиазепин с коротким полупериодом существования в плазме) и зопиклон (циклопирролон), не оказывали воздействия на симптомы паркинсонизма. 8 Золпидем, вводимый в 2 отдельных периода, также устранял навязчивые и компульсивные симптомы и проявлял заметное улучшение в умственной деятельности при нейрофизиологических тестах при почти полной ремиссии деменции. Напротив, ни L-допа, ни зопиклон не оказывали никакого воздействия на компульсивное поведение или на умственную деятельность. Триазолам проявлял только небольшое воздействие на компульсивное поведение или на умственную деятельность. Как результат этого первого наблюдения было проведено исследование двойным слепым методом с контролем плацебо на десяти пациентах, которые были клинически диагностированы как страдающие от БП, с использованием критериев Варда (Ward) и Гибба (Gibb) (C.D. Ward,W.R.G. Gibb, Research diagnostic criteria for Parkinson's disease. Adv. Neurol., 53:245-249, 1990). Демографические и клинические характеристики группы пациентов с БП показаны в табл. 1. Таблица 1. Характеристики группы БП Общее количествоn = 10 Соотношение полов (м/ж) 3/7 Средний возраст (станд. откл.) 69,9 (12,0) лет Средняя продолжительность заболевания (станд. откл.) 9,0 (6,8) лет Среднее количество баллов по шкале Hoehn-Yahr 2,9 (1,2) Серьезность двигательных признаков оценивалась с помощью исследования двигательной функции по Унифицированной шкале оценки болезни Паркинсона (UPDRS-III) (S. Fahn,R.L. Elton, United Parkinson's Disease RatingScale Developmental Commitee, United Parkinson's Disease Rating Scale, in: S. Fahn et al Recent developments in Parkinson's disease, MacMillan, 1987). Согласно существующему в настоящее время в литературе критерию, улучшение двигательной функции, равное величине сокращения порядка 20%-ного уменьшения по шкалеet al., Apomorphine test for dopaminergic responsiveness in patients with previously untreated Parkinson's disease. Arch. Neurol. 49:1131-1134, 1992). Золпидем вводили разовой пероральной дозой 10 мг. Эффект оценивали через один час после введения. Результаты показаны в табл. 2. Мы обнаружили, что золпидем, в отличие от плацебо, дает значительное улучшение в двигательных симптомах в группе пациентов с БП. плацебо исходный уровень 1 ч после введения золпидем исходный уровень 43,5 (22,1) 1 ч после введения 33,9 (18,2) р 0,009 В частности, наши результаты показывают, что у 6 из 10 пациентов золпидем давал заметное улучшение 20% в симптомах паркинсонизма. Процентное улучшение у восприимчивых находится в диапазоне между 21 и 65%. У пациентов, которые благоприятно реагировали на золпидем, были отмечены улучшения в ригидности, акинезии и брадикинезии, что положительно сказалось на позе и походке. Были также улучшения в выражении лица и уменьшение тремора тела. На этом этапе анализировали раздельно работоспособность двух подгрупп пациентов с БП, т.е. восприимчивых и невосприимчивых к золпидему (табл. 3). Таблица 3. Оценки по UPDRS-III у восприимчивых и невосприимчивых пациентов с БП Восприимчивые Невосприимчивые плацебо исходный уровень 1 ч после введения золпидем исходный уровень 1 ч после введения Результаты этого анализа показывают, что среднее процентное улучшение двигательной функции было 31,9% в подгруппе восприимчивых и 0,6% у невосприимчивых. Две подгруппы пациентов не имели существенных различий по возрасту, продолжительности заболевания или серьезности БП (табл. 4). Таблица 4. Характеристики восприимчивых и невосприимчивых пациентов с БП Восприимчивые Несмотря на это, проявленная средняя продолжительность заболевания была более длительной, и серьезность - более тяжелой у 10 восприимчивых, хотя эти различия были незначительными. Различие в продолжительности заболевания между двумя группами было в среднем 25%. Различие в серьезности заболевания было 10% при расчете по шкале HoehnYahr, но 14,5-16,6% при расчете на основе оценок, полученных по UPDRS-III в состояниях исходного уровня (т.е. без лечения). Ограниченное число пациентов с БП в нашем испытании, вероятно, не позволяет сделать определенные заключения по поводу возможности идентификации различных клинических или демографических характеристик в двух подгруппах пациентов с БП (восприимчивых и невосприимчивых к золпидему). Однако интересно отметить, что было значительное улучшение в двигательных симптомах БП у 3 из 4 наиболее тяжело пораженных болезнью пациентов (пациенты 1, 2, 10) и у 3 из 6 менее тяжело пораженных болезнью пациентов (пациенты 3, 4, 7). Из 4 пациентов, которые не показали значительных улучшений,три имели БП в легкой форме (пациенты 5, 6,8), и один имел БП в тяжелой форме (пациент 9). Двум тяжело пораженным болезнью пациентам ( 1 и 2) давали также L-допа при соблюдении условий двойного слепого метода исследования. Эффекты антипаркинсонизма от золпидема были, по существу, сравнимыми с эффектами L-допа, в обоих случаях (улучшения,наблюдавшиеся у пациента 1: золпидем =+29,5%, L-допа = +26,6%; улучшения, наблюдавшиеся у пациента 2: золпидем = +65,2%,L-допа = +69%). Пациенты 1, 2 и 7 были подвергнуты продолжительному лечению золпидемом (до 4 лет); это дало удовлетворительные результаты с улучшением в оценках UPDRS-III,находящимися в диапазоне от 27 до 52%. Эти пациенты получали препарат перорально в дозировке до 50-60 мг/сутки, разделенной на 3 или 4 суточные дозы. Поэтому лекарственное средство имело эффективное действие против паркинсонизма в этих условиях без заметных побочных эффектов (в частности, не было сонливости). Интересно отметить, что золпидем не дает сонливости у шести из десяти пациентов. В частности, сонливость не наблюдалась у трех из четырех наиболее тяжело пораженных болезнью пациентов. У четырех пациентов наблюдалась сонливость различной интенсивности: один пациент ( 3) обнаруживал только слабую сонливость в то время, как два других ( 4 и 6) показали умеренную сонливость, хотя это не помешало взаимодействию с ними во время двигательного теста по UPDRS. И, наконец, пациентка 9, которая имела БП в тяжелой форме, обнаружила чрезвычайную сонливость, которая затруднила взаимодействие с ней во время двигательного теста по UPDRS. 11 Результаты этого клинического исследования показали, что, по меньшей мере, в группе популяции пациентов с БП золпидем является эффективным в качестве лекарственного средства против паркинсонизма. Что касается отсутствия ответа на золпидем, наблюдавшегося у пациентов 5, 6, 8 и 9,то следует подчеркнуть, что даже L-допа, когда его экстренно вводят популяции пациентов с БП различной степени тяжести, не проявляет заметных улучшений в двигательных симптомах примерно у 20% пациентов. Этот процент невосприимчивых к экстренному введению является даже более высоким для пациентов с БП в легкой форме (A.J. Hughes, A.J. Lees, G.M. Stern,Apomorphine test to predict dopaminergic responsiveness in Parkinsonian syndromes, Lancet 336(2):32-34, 1990). Поэтому может быть принято без доказательства, что имидазопиридины будут особенно эффективными в группе популяции пациентов с паркинсонизмом, возможно, в более тяжелой форме заболевания. Единственным наблюдавшимся побочным эффектом была сонливость,хотя она была непостоянной и варьировалась по интенсивности. Удивительно также то, что золпидем, снотворное лекарственное средство,могло иметь маленький, если был, вызывающий сон эффект, по меньшей мере, в группе популяции пациентов с БП. На крысах после индуцирования экспериментальных стриарных повреждений каинатом наблюдалось повышенное связывание бензодиазепинов в бледном шаре, сетчатой части черного вещества и ядрах внутри ножек (Pan etPharmacol. Exper. Therapeutics, 230:768-775,1984). Может быть постулировано, что при БП также может быть ап-регуляция BZ рецепторов в бледном шаре и/или сетчатой части черного вещества и в результате с повышенным откликом на агонисты рецептора GABA-BDZ. Эти структуры являются решающими для патофизиологии БП, не имеющей очевидной роли в индуцировании сна. Феномен ап-регуляции во внутреннем сегменте бледного шара и/или сетчатой части черного вещества может, с одной стороны, объяснить терапевтические эффекты золпидема при БП, а с другой стороны, объяснить тот факт, что у пациентов с БП золпидем может не иметь снотворного эффекта или, по меньшей мере, иметь меньший снотворный эффект, чем тот, который обычно наблюдается у нормальных субъектов. Теоретически интересная аналогия может быть также проведена между фармакологическим эффектом золпидема в индуцировании селективного торможения внутреннего сегмента бледного шара и эффектами нейрохирургии в форме постеровентральной паллидотомии. Обе 12 формы лечения могут иметь терапевтические воздействия на все кардинальные симптомы БП. Очевидно, что доступность эффективной альтернативной формы лечения, основанного на введении золпидема, для пациентов с БП, которые прекратили реагировать на L-допа, может в некоторых случаях представлять обоснованное разрешение проблемы, которое позволяет избежать риска и осложнения нейрохирургии. Также проводили исследование двойным слепым методом с контролем плацебо на 59 летнем пациенте с синдромом Steele-RichardsonOlszewski (прогрессивный надъядерный паралич). Этот пациент-мужчина страдал от этой болезни 4 года. Пероральное введение золпидема (10 мг) дало улучшение некоторых клинических признаков, таких как дизартрия, вертикальная и боковая неподвижность взгляда, акинезия и брадикинезия, состояние равновесия корпуса и походка. Оценки пациентов по UPDRS-III (который принимает во внимание многие из двигательных симптомов синдромаSteele-RichardsonOlszewski) опускаются от 39 (исходный уровень, без лекарства) до 26 (после золпидема),указывая на значительное улучшение двигательной функции (+33%), в то время как улучшение в оценке UPDRS-III после плацебо было незначительным (+5%). Важность этого наблюдения заключается в том, что пациенты с синдромом SteeleRichardson-Olszewski редко реагируют на лечение лекарственным средством (A.J. Hughes, A.J.Lees, G.M. Stern, Apomorphine test to predict dopaminergic responsiveness in Parkinsonian syndromes, Lancet, 336 (2):32-34, 1990). В последнем посмертном исследовании церебральной ткани пациентов с синдромомSteele-Richardson-Olszewski было показано наличие уменьшения в GАВАергическом проведении нервного возбуждения в полосатом теле и бледном шаре (R. Levy et al., Alterations ofwith progressive supranuclear palsy: an in situ hybridization study of GAD67 messenger RNA, Neurology 45:127-134, 1995). Такое исследование подтверждает потенциальную ценность для пациентов с синдромомSteele-RichardsonOlszewski GАВАергических агонистов, лекарственных средств, которые специфически действуют в GАВАергических системах базальных ядер. Эффект, который наблюдали при синдроме Steele-Richardson-Olszewski, вероятно, может быть объяснен на основе того факта, что золпидем действует во внутреннем сегменте бледного шара и сетчатой части черного вещества, т.е. в выводящих GАВАергических структурах цепей,которые включают базальные ядра. Другими словами, золпидем может быть даже более эффективным, чем L-допа, при "паркинсонизме плюс" из-за того, что он способен действовать на такие структуры, к которым эти цепи имеют 13 отношение, которые находятся "ниже по потоку" от полосатого тела. В свете этих предварительных клинических данных и указанных выше патофизиологических соображений возможно, что золпидем может также иметь некоторую степень эффективности не только при БП и вторичных синдромах паркинсонизма, но также и при других внепирамидных синдромах, таких которые классифицированы под заголовком "паркинсонизм плюс", одним из которых является синдром Steele-Richardson-Olszewski. Термин "паркинсонизм плюс" применяют по отношению к расстройствам, которые могут иметь разнообразные симптомы иные, чем внепирамидные и относящиеся к болезни Паркинсона признаки, и могут быть вторичными, относящимися к повреждениям различных структур (базальных ядер, черного вещества и других энцефалических структур). Синдромы, классифицированные как "паркинсонизм плюс", включают синдром Steele-Richardson-Olszewski, дегенерацию кортикальных-базальных ядер,мультисистемную атрофию, болезнь Вильсона, болезнь Халлерворден-Спатца, болезнь Хантингтона и нейроакантоцитоз. Продемонстрировано, что при болезни Хантингтона (БХ) происходит селективная потеря GABAергических нейронов, таких как стриарные нейроны, проводящие торможение к внутреннему и внешнему сегменту бледного шара и сетчатой части черного вещества. Селективная нейродегенерация таких субпопуляцийGАВАергических нейронов считается правдоподобным объяснением хореи и глазодвигательных аномалий, которые являются ранним признаком БХ (R.L. Albin, Selective neurodegeneration in Huntington's Disease, Ann. Neurol. 38:835-836, 1995). Стратегия облегчения GАВАергического проведения возбуждения у пациентов с БХ была предложена ранее (R.D. Adams, M. Victor, Principles of Neurology, McGrawHill, 1985). Однако до настоящего времени лечение БХ лекарственными средствами GABAмиметиками имеет только ограниченный успех. В соответствии с вышеупомянутыми патофизиологическими соображениями и предварительными данными по "паркинсонизму плюс", имидазопиридины (включая золпидем) могут принести успех в лечении двигательных и познавательных симптомов БХ. Среди имидазопиридинов лекарственные средства,селективные 1 агонисты, как золпидем, могут фактически рассматриваться какGАВАергические агонисты, специфические по отношению к GАВАергическим системам в базальных ядрах. Поэтому ввиду потери специфических GАВАергических нейронов,имидазопиридины могут представлять заместительную терапию при БХ, которая могла бы восстанавливать эффект торможения бледного шара и сетчатой части черного вещества. 14 Соответственно,золпидем является имеющим цену в следующем:(1) пациенты с БП и паркинсонизмом вследствие различных причин (инфекционные агенты, токсичные вещества, лекарственные средства, повреждения головы, сосудистые и онкологические повреждения и т.п.). Как при БП, так и при паркинсонизме золпидем может быть применен (либо один, либо в сочетании сL-допа или допамин-агонистом) для пациентов,которые прекратили реагировать на L-допа или допамин-агонисты (например, на стадиях прогрессирования болезни), а также для субъектов,лечение которых этими лекарственными средствами было прекращено из-за побочных эффектов;(прогрессивный надъядерный паралич), дегенерация кортикальных-базальных ядер, мультисистемная атрофия (дегенерация, имеющая отношение к связи черного вещества с полосатым телом, синдром Шай-Драгера, дегенерация оливы мозжечка и варолиева моста), болезнь Вильсона, болезнь Халлерворден-Спатца, болезнь Хантингтона и нейроакантоцитоз. Как упомянуто выше, наряду с собственно болезнью Паркинсона, которая является болезнью неясного происхождения, существуют различные синдромы паркинсонизма или формы паркинсонизма, которые могут быть вторичными по отношению к различным случаям (инфекционные агенты, токсичные вещества, лекарственные средства, повреждения головы,сосудистые и онкологические повреждения и т.п.). В последнее время наблюдалась форма паркинсонизма у людей, пристрастившихся к лекарственным средствам, которые делали себе инъекции аналогов меперидина, незаконный синтез которого дает МРТР и МРРР. Фактически,1-метил-4-фенил-1,2,3,6-тетрагидропиридин (МРТР или N-MPTP) и 1 метил-4-фенил-4-пропоксипиперидин(МРРР) селективно разрушают допаминергические нейроны в черном веществе и вызывают как у человека, так и у других приматов синдром паркинсонизма, который подобен болезни Паркинсона неясного происхождения по своим клиническим,анатомо-патологическим и биохимическим проявлениям и реакциям на лекарственные средства (Davies et al., Chronictetrahydropyridine, Proc. Natl. Acad. Sci. USA, 80,4546-4550, July 1983). Сходство между болезнью Паркинсона неясного происхождения и МРТР-интуцированным паркинсонизмом (Burns et al., The neurutoxiciryNeur. Sci. 11, n.1 (supplement), 166-168, February 1984) позволяет выдвинуть гипотезу, что болезнь Паркинсона вызывается токсином. Несмотря на то, что для целей настоящего изобретения нет необходимости выдвигать или придерживаться какого-либо теоретического объяснения эффективности золпидема при лечении болезни Паркинсона, может быть выдвинута следующая гипотеза. Золпидем, в отличие от бензодиазепинов,вызывает селективное торможение как (а) внутреннего сегмента бледного шара, так и (б) сетчатой части черного вещества.(а) Торможение внутреннего сегмента бледного шара, вызываемое золпидемом,уменьшает избыточное торможение внутренним сегментом бледного шара как таламуса, так и ядер ножек и моста; результатом этого является возбуждение дополнительной двигательной зоны и нисходящих ретикулоспинальных и вестибулоспинальных путей.(б) Торможение сетчатой части черного вещества, вызываемое золпидемом, уменьшает торможение таламуса (вентролатеральных ядер) сетчатой частью черного вещества, результатом чего является возбуждение дополнительной двигательной зоны. Также было обнаружено, что золпидем является эффективным в лечении навязчивокомпульсивного расстройства, других навязчиво-компульсивных синдромов и лобной и подкорковой деменций. Навязчиво-компульсивное расстройство(НКР) является психиатрической болезнью, характеризующейся повторяющимся появлением обсессий (навязчивых мыслей или идей) и компульсивности (повторяющиеся поведенческие реакции обычно в ответ на обсессию). Уровень распространения НКР, обнаруженный у субъектов в возрасте старше 18 лет в основной популяции, варьируется между 1,9 и 3% (L.L. Judd, L.Y. Huey, in: Harrison's Principlesof Internal Medicine, McGraw-Hill, 1987). В патофизиологии навязчиво-компульсивного расстройства особенно важную роль играет дисфункция цепей, вовлекающих базальные ядра (хвостатое ядро, скорлупа и бледный шар), таламус и лобная часть коры мозга (Hymas et al., The neurolory of obsessional slowness,Brain, 114:2203-2233, 1991; J.L. Cummings, K. 16 У пациентов с НКР часто можно определить изменения в церебральном метаболизме и потоке, особенно в лобной доле и базальных ядрах, посредством компьютерной томографии с эмиссией одиночных фотонов (SPECT) и позитронной эмиссионной томографии (PET) (L.R.controls, Arch. Gen. Psychiatry, 44:211-218, 1987). Многочисленные исследования показали,что НКР или подобные навязчивокомпульсивные синдромы появляются у пациентов с неврологическими синдромами, обычно поражающими базальные ядра (Laplane et al.,Obsessive-compulsive and other behaviouralobsessional slowness, Brain, 114:2203-2233,1991). Такие неврологические синдромы включают синдром Жилль де ла Туретта, токсические и аноксические энцефалопатии, болезнь Паркинсона неясного происхождения, постэнцефалический паркинсонизм, хорею Сиденгама,болезнь Хантингтона. Ингибиторы повторного усвоения серотонина (хлоримипрамин, флуоксетин) считаются в настоящее время наиболее эффективными лекарственными средствами для лечения навязчиво-компульсивного расстройства (J. Anath, Clomipramine: an anti-obsessive drug, Can. J. Psychiatny, 31:253-258, 1986; R. Fontaine, G. Chouinard, An open clinical trial of fluoxetine in thePsychopharmacol., 6:98-101, 1986). Полученные данные об эффективности этих лекарственных средств являются главным косвенным доказательством, что серотонинергические системы вовлекаются в патогенез навязчивокомпульсивного расстройства (Insel et al., Obsessive-compulsive disorder and serotonin: is therea connection, Biol. Psychiatry, 20:1174-1188,1985). Обычно бензодиазепины имеют малый эффект на кардинальные симптомы НКР (Р.Т.Lelliot, W.O. Monteiro, Drug treatment of obsessive-compulsive disorder. Drugs, 31:75-80, 1986; Т. Perse, Obsessive-compulsive disorder: a treatment review, J. Clin. Psychiatry, 49:48-55, 1988). Обнаружено, что клоназепам обладал некоторым полезным эффектом для пациентов с НКР при исследовании, проведенном с несколькими конкретными пациентами (W.A. Hewlett et al.,Clonazepam treatment of obsessions and compulsions, J. Clin. Psychiatry, 51:158-161, 1990). Лекарственные средства вводили повторяющимися дозами в течение нескольких месяцев. Полезное воздействие наблюдалось через одну-две недели после начала лечения. Авторы подчеркнули тот факт, что этот бензодиазепин является необычным в том, что он влияет на серотонинергические системы, хотя механизмы воздей 17 ствия не совсем понятны (Wagner et al., Clonazepam-induced upregulation of serotonin-1 andNeurol. 43:645-651, 1986). Были обследованы девять пациентов, которые были диагностированы как страдающие от НКР согласно критерию "Diagnostic and statistical manual of mental disorders, third editionrevised" (DSM III-R) (American Psychiatric Association, Washington D.C. 1987), которым золпидем вводили перорально одной дозой 10 мг. Демографические и клинические характеристики группы пациентов с НКР показаны в табл. 5. слепых условий, до и после введения плацебо или золпидема. Таблица 5. Характеристики группы НКР Общее количествоn=9 Соотношение полов (м/ж) 4/5 Средний возраст (станд. откл.) 49,6 (22,1) года Средняя продолжительность заболевания (станд. откл.) 9,2 (9,6) года Исследование двойным слепым методом с контролем плацебо было проведено на восьми пациентах; лекарственное средство вводили в условиях открытости одному пациенту ( 9). Серьезность расстройства оценивали по шкале Yale-Brown (диапазон 0-40) (Goodman etArch. Gen. Psychiatry, 46:1006-1011, 1989). Улучшение в 25% по шкале было признано существенным (Liebowitz et al., J. Clin. Psychopharmacol., 9: 423, 1989). У четырех пациентов( 1, 2, 3, 4) НКР не ассоциировалось с неврологическими расстройствами, субъекты имели отношение только к психиатрическим проявлениям. У других пяти пациентов, однако, НКР ассоциировалось с неврологическими расстройствами: пациент 5 также обнаруживал БП,пациент 8 - умеренную деменцию, и пациенты 6, 7 и 9 - синдром паркинсонизма и деменцию (в легкой форме у пациента 6, в тяжелой - у двух остальных). У всех четырех пациентов с деменцией умственная деградация могла быть классифицирована как подкорковая деменция с характеристиками, подобными характеристикам лобных деменций (М.А. Albert et al., The subcortical dementia of progressive supranuclear palsy, J. Neurol.Parkinson's Disease, Brain, 106:257-270, 1983). У трех пациентов с более серьезной интеллектуальной деградацией (7, 8 и 9) было возможно только сделать оценку с использованием части шкалы Yale-Brown, относящейся к компульсивности (диапазон 0-20). Эффект оценивался через один час после введения лекарственного средства. Табл. 6 показывает баллы,полученные по шкале Yale-Brown 8 пациентами,обследовавшимися при соблюдении двойных Таблица 6. Баллы, полученные по шкале YaleBrown группой пациентов (8) с НКР,которые принимали участие в исследовании двойным слепым методом Оценки Y-BOCS: плацебо исходный уровень 1 ч после введения золпидем исходный уровень 1 ч после введения Результаты этого клинического исследования показали, что золпидем дает значительное улучшение симптомов у всех 8 пациентов с НКР. Процент улучшения у конкретных пациентов находился в диапазоне от 33 до 90%. Только пациент 2 показал значительный отклик на плацебо (32%-ное улучшение); однако,даже у этого пациента улучшение, даваемое золпидемом, было более значительным, чем полученное с плацебо. Пациент 9, который обнаруживал тяжелую деменцию и получал золпидем в условиях открытости, показал 33%ное улучшение. У трех из четырех пациентов с НКР, которые обнаруживали клинические признаки подкорковой деменции лобного типа (пациенты 6, 7 и 8), золпидем, вводимый разовой пероральной дозой 10 мг, давал явное улучшение клинических признаков деменции. Нейрофизиологическое исследование двойным слепым методом с контролем плацебо было проведено на пациентке 7, которая имела серьезную умственную деградацию. После введения золпидема она показала значительное улучшение в тестах словесной памяти,способности к выполнению целенаправленных движений и дедуктивных умственных способностей, а также в тестах, чувствительных к лобному повреждению. Ее оценка по миниобследованию психического состояния (M.F.clinician, J. Psychiat. Res. 12:189-198, 1975) повысилась с 10 (плохая работоспособность) на исходном уровне (без лекарственного средства) до 22 после введения золпидема (10 мг перорально), что означает работоспособность в нормальных пределах для ее возраста и образовательного уровня. И наоборот, ее оценка после введения плацебо была 8. Следовательно, пациентка 7 неожиданно обнаружила наиболее полную ремиссию признаков деменции. Пациент 6, который обнаруживал умственную деградацию в слабой форме и на котором было проведено сравнение золпидема с 19 плацебо при соблюдении двойных слепых условий, показал клиническое улучшение в когнитивных функциях и, особенно, в проявлении внимания, с ремиссией деменции. Ее оценка по мини-обследованию психического состояния(MMSE) повысилась с 17 (состояние исходного уровня без лекарства) до 24 (после 10 мг золпидема перорально), что означает работоспособность в нормальных пределах для ее возраста и образовательного уровня. Напротив, ее оценка была 18 после введения плацебо. Пациент 8, который обнаруживал умеренную умственную деградацию, показал клиническое улучшение в познавательных функциях и, особенно, функциях внимания, с частичной ремиссией деменции. Семь из 9 пациентов с НКР не обнаруживали признаков сонливости. Остальные 2 обнаруживали умеренную сонливость. Нескольким пациентам с НКР ( 4, 5, 6, 7, 9) давали золпидем перорально в течение длительного периода(в дозах от 20 до 60 мг/сутки), и во всех случаях лекарственное средство давало резко выраженное и длящееся улучшение навязчивых и компульсивных симптомов (снижение оценок YBOCS в пределах от 30 до 80%). У пациентов с НКР эффекты от золпидема,вероятно, являются следствием торможения внутреннего сегмента бледного шара в кортикальной-стриарной-паллидальной-таламической цепи, как постулировано выше (T.R. Insel. Toward a neuroanatomy of obsessive-compulsive disorder, Arch. Gen. Psychiatry, 49:739-744, 1992). Эти результаты являются интересными с двух точек зрения: (а) у пациентов с НКР золпидем является эффективным в улучшении навязчивых и компульсивных симптомов даже после разовой дозы (в отличие от серотонинергического антидепрессанта, который должен вводиться повторно в течение нескольких недель прежде, чем они дадут эффект; (б) наблюдавшийся терапевтический эффект подтверждает, что GАВАергические системы в кортикальной-стриарной-паллидальной-таламической цепи могут играть роль в патофизиологии НКР. Интересно отметить, что терапевтический отклик на золпидем у пациентов с НКР и подкорковой деменцией (с характеристиками,идентичными характеристикам лобной деменции) сопровождается улучшением познавательной функции. Некоторым пациентам с подкорковой деменцией ( 6 и 7) золпидем вводили перорально в течение длительного периода времени (в дозах от 30 до 60 мг/сутки) и получали резко выраженное и длящееся улучшение в познавательных функциях (повышение оценок где Y представляет атом водорода или галогена или С 1-4 алкильную группу,А представляет радикал нафтил или радикал где каждый из Х 1 и Х 2, независимо один от другого, представляет атом водорода или галогена,С 1-4 алкоксигруппу, С 1-6 алкильную группу или СF3, СН 3S-, СН 3SO2- или -NO2, и каждый из R1 иR2, независимо один от другого, представляет либо атом водорода, либо линейную или разветвленную С 1-5 алкильную группу, которая является незамещенной или замещенной одним или несколькими атомами галогена, гидроксильными группами, -N(C1-4 алкилом)2, карбамоилом или С 1-4 алкоксигруппами, или аллильную группу, или пропаргиловую группу или С 3-С 6 циклоалкильную группу или бензил, или фенил, но оба R1 и R2 не являются атомами водорода, или -NR1R2 представляет собой гетероциклическое кольцо, содержащее от 3 до 6 атомов углерода, или гетероциклическое кольцо формулы где X - О, S, CHOR' или N-R, R' является водородом или бензилом и R представляет собой водород, С 1-4 алкильную группу или фенил, который является незамещенным или замещенным метоксигруппой или атомом галогена, при условии, что если Y представляет 6-хлор, А не является 4-хлорфенилом,для получения лекарственного средства для лечения нейропсихиатрических синдромов,связанных с дисфункцией нервных цепей базальных ганглиев. 2. Применение по п.1, отличающееся тем,что указанные соединения общей формулы (А) используют для получения лекарственного средства для лечения болезни Паркинсона, синдромов паркинсонизма, других внепирамидальных синдромов, классифицируемых как "паркинсонизм плюс" (синдром Stule-RichardsonOlszewski, дегенерация кортикальных базальных ядер, мультисистемная атрофия, болезнь Вильсона, болезнь Халлерворден-Спатца, болезнь Хаттингтона и нейроакантоцитоз), навязчиво-компульсивного расстройства и других навязчиво-компульсивных синдромов, лобной и подкорковой деменций. 3. Применение по п.1, отличающееся тем,что производное имидазо[1,2-а]пиридин-3 ацетамида имеет следующую формулу (II)R1 и R2, одинаковые или различные, представляют водород или С 1-4 алкильную группу,при условии, что если Y представляет 6-хлор, R3 не является 4-хлором. 4. Применение по п.3, отличающееся тем,что имидазо[1,2-а]пиридин-3-ацетамидом является золпидем-[N,N,6-триметил-2-(4-метилфенил)имидазо[1,2-а]пиридин-3-ацетамид гемитартрат].
МПК / Метки
МПК: A61K 31/415
Метки: нервных, ганглиев, имидазо[1,2-a]пиридин-3-ацетамида, связанных, применение, синдромов, нейропсихиатрических, производных, лечения, базальных, дисфункцией, цепей
Код ссылки
<a href="https://eas.patents.su/12-396-primenenie-proizvodnyh-imidazo12-apiridin-3-acetamida-dlya-lecheniya-nejjropsihiatricheskih-sindromov-svyazannyh-s-disfunkciejj-nervnyh-cepejj-bazalnyh-gangliev.html" rel="bookmark" title="База патентов Евразийского Союза">Применение производных имидазо[1,2-a]пиридин-3-ацетамида для лечения нейропсихиатрических синдромов, связанных с дисфункцией нервных цепей базальных ганглиев</a>
Предыдущий патент: Синергичная гербицидная композиция и способ ее применения
Следующий патент: Способ и установка для производства минеральной листовой фибры
Случайный патент: Способ нормализации липопротеидного профиля плазмы крови у млекопитающего и фармацевтическая композиция для его осуществления












