Монопегилированный интерферон-альфа линейной структуры и фармацевтическая композиция для приготовления лекарственного средства, обладающего активностью интерферона-альфа
Номер патента: 21643
Опубликовано: 30.07.2015
Авторы: Маркова Инна Николаевна, Марков Илья Александрович, Маркова Елена Алексеевна, Гапонюк Полина Петровна, Гапонюк Петр Яковлевич
Формула / Реферат
1. Монопегилированный интерферон-альфа (IFN α-2b) линейной структуры, отличающийся тем, что содержит фрагмент полиэтиленгликоля, присоединенный к белку через фенилаланиновый линкер с помощью амидной связи, как представлено общей формулой
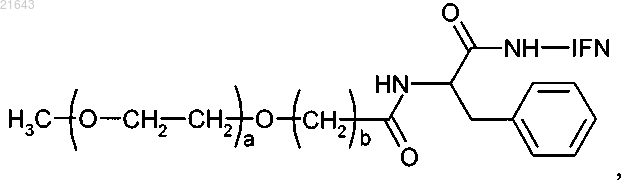
где а - целое число от 200 до 1800;
b - целое число от 1 до 5 и
IFN обозначает остаток интерферона α-2b (IFN α-2b).
2. Фармацевтическая композиция для приготовления лекарственного средства, обладающего активностью интерферона-альфа, содержащая активное вещество и фармацевтически приемлемые вспомогательные вещества, отличающаяся тем, что в качестве активного вещества содержит монопегилированный интерферон IFN α-2b линейной структуры, в котором фрагмент полиэтиленгликоля присоединен к белку через фенилаланиновый линкер с помощью амидной связи, как представлено общей формулой
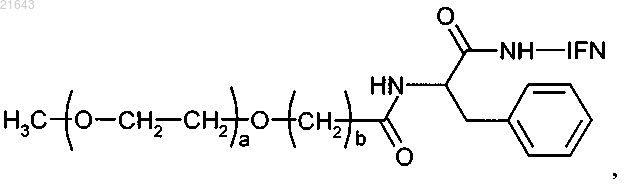
где а - целое число от 200 до 1800;
b - целое число от 1 до 5 и
IFN обозначает остаток интерферона α-2b (IFN α-2b).
Текст
МОНОПЕГИЛИРОВАННЫЙ ИНТЕРФЕРОН-АЛЬФА ЛИНЕЙНОЙ СТРУКТУРЫ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПРИГОТОВЛЕНИЯ ЛЕКАРСТВЕННОГО СРЕДСТВА, ОБЛАДАЮЩЕГО АКТИВНОСТЬЮ ИНТЕРФЕРОНА-АЛЬФА Изобретение относится к областям фармацевтики и медицины, в частности к монопегилированному интерферону IFN -2b линейной структуры, в котором фрагмент полиэтиленгликоля присоединен к белку через фенилаланиновый линкер с помощью амидной связи. Технический результат изобретения заключается в получении ковалентного конъюгата IFN-2b с длительной циркуляцией в кровотоке и улучшенными характеристиками противовирусной активности и иммуногенности, а также фармацевтической композиции для приготовления лекарственного средства, обладающего активностью интерферона альфа. Марков Илья Александрович,Маркова Елена Алексеевна, Гапонюк Полина Петровна, Маркова Инна Николаевна (RU), Гапонюк Петр Яковлевич (умер) Скибневский А.Ю. (RU) Область техники, к которой относится изобретение Изобретение относится к областям фармацевтики и медицины, в частности к соединению с активностью интерферона-альфа, представляющему собой монопегилированный интерферон IFN -2b линейной структуры, в котором фрагмент полиэтиленгликоля (ПЭГ) присоединен к белку через фенилаланиновый линкер с помощью амидной связи, как представлено общей формулой (I) где а - целое число от 200 до 1800;b - целое число от 1 до 5 иIFN обозначает остаток IFN -2b. Изобретение также представляет фармацевтическую композицию для приготовления лекарственного средства, обладающего активностью интерферона-альфа, активным веществом которой является указанный монопегилированный IFN -2b. Предшествующий уровень техники Интерфероны (IFN) - биологически активные белки или гликопротеины, продуцируемые в организме в ответ на вирусную инфекцию (Pestka S. The interferons: 50 years after their discovery, there is muchmore to learn, J. Biol. Chem., Vol. 282, No. 28 (July 2007), р. 20047-20051. IFN взаимодействуют с рецепторами, что индуцирует синтез ряда внутриклеточных белков, которые опосредуют противовирусное, иммуномодулирующее и антипролиферативное действие IFN (Pestka S., Krause C.D., Walter M.R. Interferons,interferon-like cytokines, and their receptors, Immunol. Rev., Vol. 202 (2004), р. 8-32). Лекарственные средства, содержащие рекомбинантные IFN, применяются в лечении вирусных, онкологических и иммунных заболеваний. Наиболее широко препараты IFN применяют для лечения вирусных гепатитов, представляющих одну из наиболее значимых социальных и медицинских проблем(Chevaliez S., Pawlotsky J.M. Interferons and their use in persistent viral infections, Handb. Exp. Pharmacol.,2009, р. 203-241). Эффективность препаратов IFN ограничена их быстрым выведением, малой стабильностью, большим объемом распределения, коротким периодом циркуляции, а также высокой иммуногенностью и реактогенностью (Wills R.J. Clinical pharmacokinetics of interferons, Clin. Pharmacokinet., 1990, No. 19, р. 390399). Эффективность IFN увеличивается при использовании препаратов пролонгированного действия,например ковалентных конъюгатов с полимером (Hadziyannis S. et al. Ann. Intern. Med., Vol. 140 (2004),р. 346). Полиэтиленоксид или полиэтиленгликоль (ПЭГ) является широко распространенным полимером для ковалентной модификации (пегилирования) биологических макромолекул, например полипептидов,имеющей большое значение в современной фармакологии и медицине. Цель пегилирования - предотвращение деградации белков протеолитическими ферментами и защита от антигенных и иммуногенных эпитопов. Кроме того, пегилирование увеличивает размеры полипептидов, уменьшая почечную фильтрацию, а также изменяет объем биораспределения. Наибольшее значение в пегилировании полипептидов имеет выбор пегилирующего агента и способа конъюгации, от которых зависит вид и структура конечного конъюгата, и, следовательно, его биологическая активность, стабильность и время циркуляции в крови. Так, например, противовирусная активность пегилированных IFN в значительной степени зависит как от размера и геометрии ПЭГ, так и от места прикрепления полимера к молекуле белка, т.е. от функциональной группы IFN, с которой непосредственно взаимодействует соответствующий пегилирующий агент (Roberts M.J. et al. Chemistry for peptide and protein PEGylation, Adv. Drug Delivery Rev., Vol. 54,(2002), р. 459-476). Известны конъюгаты ПЭГ-IFN -2b, полученные конъюгацией IFN -2b с линейными (RU 2311930,опубл. 20.08.2008) или разветвленными (RU 2382048, опубл. 20.02.2010) производными ПЭГ с молекулярной массой 13-17 кДа, обладающие противовирусной активностью от 29 до 38% от активности немодифицированного IFN. Недостатки полученных коньюгатов и способов их синтеза обусловлены применением трезил-производных ПЭГ, имеющих время полужизни в водных растворах не более 20 мин. В результате реакции трезил-производных ПЭГ с аминогруппами белков образуются не только стабильные амиды, но также и нестабильные сульфаматы (Gais H.J., Ruppert S. Modification and immobilization of proteins with polysaccharide tresylates: evidence suggesting a revision of the coupling mechanism and the structureof the polymer-polymer linkage, Tetrahedron Lett., Vol. 36. No. 22 (1995), р. 3837-3838). Известен коньюгат IFN -2b, полученный конъюгацией IFN -2b с разветвленным триазиновым производным мПЭГ с молекулярной массой 7,5-35 кДа (RU 2298560, опубл. 10.05.2007), противовирусная активность которого составляет 7% от активности немодифицированного IFN. Недостатком данного конъюгата является низкая противовирусная активность и использование цианурхлоридного производ-1 021643 ного ПЭГ, способного, помимо целевых аминогрупп, реагировать с другими функциональными группами аминокислот с образованием нестабильных или фармацевтически неактивных соединений. Цианурхлоридные производные также проявляют высокую токсичность (Veronese F., Pasut G. PEGylation, successful approach to drug delivery, Drug Discovery Today, Vol. 10, No. 21 (2005), р. 1451-1458), что требует тщательной очистки продукта перед приготовлением медицинского препарата. Наиболее часто для пегилирования применяют активированные эфиры ПЭГ-производных, которые взаимодействуют с аминогруппами белков. Активированные эфиры представляют собой удобные в обращении ацилирующие агенты с высокой реакционной способностью. Однако им присущ ряд недостатков, к которым, в первую очередь, относятся невысокая стабильность при хранении и способность вызывать рацемизацию субстрата, что в конечном итоге может сказаться на биологической активности полученного конъюгата. Их типичные представители - активированные эфиры, как правило, не являются высокоспецифичными реагентами и, помимо аминогрупп, способны взаимодействовать с имидазольным фрагментом гистидина, фенольным гидроксилом тирозина, спиртовыми гидроксилами серина и треонина, а также тиольной группой цистеина, что, в свою очередь, снижает долю высокоактивных конъюгатов в общей смеси позиционных изомеров. В настоящее время наиболее изученными и широко применяемыми в клинике препаратами данной группы являются пегилированные интерфероны-альфа (IFN-). Препарат "ПегИнтрон" (товарный знак,зарегистрированный фирмой Schering-Plough) представляет собой монопегилированный IFN -2b, ковалентно связанный с линейной молекулой ПЭГ, имеющей молекулярную массу 12 кДа. Препарат "Пегасис" (товарный знак, зарегистрированный фирмой Hoffmann La Roche) является монопегилированнымIFN -2a, в котором белок ковалентно связан с разветвленной молекулой ПЭГ с молекулярной массой 40 кДа. Оба препарата получены с помощью гидроксисукцинимидных эфиров ПЭГ соответствующих структур. Так, например, "Пегасис" (RU 2180595, опубл. 20.03.2002) получают взаимодействием Nгидроксисукцинимидного эфира дипегилированного лизина с IFN -2a. Недостатком данного процесса является частичная рацемизация субстрата. По-видимому, это приводит к существенному снижению противовирусной активности конъюгата, которая составляет только 1-7% от активности немодифицированного IFN -2a (Boulestin A. et al. Twenty-four hour kinetics of hepatitis С virus and antiviral effect of alpha-interferon, J. Med. Virol., Vol. 78, No. 3 (March, 2006), р. 365-371). В качестве ближайшего аналога настоящего изобретения авторы рассматривают монопегилированный IFN -2b, ковалентно связанный с линейной молекулой ПЭГ массой 12 кДа - препарат "ПегИнтрон",получение и свойства которого раскрыты в US 5951974 (опубл. 14.09.1999). Данный конъюгат получен взаимодействием линейного ПЭГ, активированного сукцинимидилкарбонатной группой, с IFN -2b. Противовирусная активность препарата "ПегИнтрон" составляет 28% активности немодифицированного белка, время циркуляции - порядка 72 ч. Недостатками данного конъюгата являются относительно малые показатели противовирусной активности и времени циркуляции в крови, что, вероятно, обусловлено частичной рацемизацией субстрата и существенной долей легкогидролизуемых сложноэфирных и карбаматных связей с функциональными группами аминокислотных фрагментов. Причиной тому служит применение сукцинимидилкарбонатного пегилирующего агента. Таким образом, технической задачей изобретения является разработка пегилированного интерферона-альфа, создание содержащей его фармацевтической композиции с улучшенными фармакологическими свойствами и расширение арсенала противовирусных средств на основе интерферона-альфа. Техническим результатом изобретения является получение ковалентного конъюгата IFN -2b с ПЭГ, характеризующегося длительной циркуляцией в кровотоке и улучшенными характеристиками противовирусной активности и иммуногенности, а также получение фармацевтической композиции для приготовления лекарственного средства, обладающего активностью интерферона-альфа. Для достижения указанного технического результата монопегилированный интерферон-альфа (IFN-2b) линейной структуры согласно изобретению содержит фрагмент полиэтиленгликоля (ПЭГ), присоединенный к белку через фенилаланиновый линкер с помощью амидной связи, как представлено общей формулой (I) где а - целое число от 200 до 1800;b - целое число от 1 до 5 иIFN обозначает остаток интерферона -2b (IFN -2b). Фармацевтическая композиция для приготовления лекарственного средства, обладающего активностью интерферона-альфа, содержащая активное вещество и фармацевтически приемлемые вспомога-2 021643 тельные вещества согласно изобретению в качестве активного вещества содержит монопегилированный интерферон IFN -2b линейной структуры, в котором фрагмент полиэтиленгликоля (ПЭГ) присоединен к белку через фенилаланиновый линкер с помощью амидной связи, как представлено общей формулой (I) где а - целое число от 200 до 1800;b - целое число от 1 до 5 иIFN обозначает остаток интерферона -2b (IFN -2b). Сущность изобретения В результате обширных исследований авторы установили, что техническая задача изобретения может быть решена применением для образования пептидной связи между полимером и белком азидного метода, который, как известно, не приводит к рацемизации субстрата и не затрагивает гидроксильных групп полипептида (Гринштейн Дж., Виниц М. Химия аминокислот и пептидов. - М.: Мир, 1965, с. 446464). Таким образом, настоящее изобретение обеспечивает монопегилированный интерферон-альфа (IFN-2b) линейной структуры, который содержит фрагмент полиэтиленгликоля (ПЭГ), присоединенный к белку через фенилаланиновый линкер с помощью амидной связи, как представлено общей формулой (I) где а - целое число от 200 до 1800;b - целое число от 1 до 5 иIFN обозначает остаток интерферона -2b (IFN -2b). Изобретение также обеспечивает получение фармацевтической композиции для приготовления лекарственного средства, обладающего активностью интерферона-альфа, содержащей активное вещество и фармацевтически приемлемые вспомогательные вещества, которая в качестве активного вещества содержит монопегилированный интерферон IFN -2b линейной структуры, в котором фрагмент полиэтиленгликоля (ПЭГ) присоединен к белку через фенилаланиновый линкер с помощью амидной связи, как представлено общей формулой (I) где а - целое число от 200 до 1800;b - целое число от 1 до 5 иIFN обозначает остаток интерферона -2b (IFN -2b). Выбор фармацевтически приемлемых вспомогательных веществ для целей настоящего изобретения очевиден среднему специалисту в области фармакологии. Например, вспомогательными веществами могут быть натрия гидрофосфат, натрия дигидрофосфат, натрия ацетат, уксусная кислота, лимонная кислота, цитрат натрия, глутамат натрия, сахароза, бензиловый спирт, полисорбаты и др. Для получения монопегилированного IFN -2b линейной структуры (конъюгата) в соответствии с изобретением используют IFN -2b и гидразид пегилированного фенилаланина с молекулярными массами 20 и 30 кДа. Пегилированный IFN -2b получают конденсацией азида ПЭГ-фенилаланина, приготовленного из гидразида ПЭГ-фенилаланина непосредственно перед пегилированием, со свободной аминогруппой белка Состав полученного конъюгата определяют общеизвестными методами обращено-фазовой ВЭЖХ и эксклюзионной ВЭЖХ. Например, для этого можно применять колонку VYDAC MS C18 1504,6 мм(22C, расход элюента: 1 мл/мин в линейном градиенте от 0,1% ТФУ/Н 2 О до 0,085% ТФУ/MeCN в течение 20 мин) или колонку Superose 6, 10/300 GL (22C, расход элюента (50 ммоль натрия фосфат, 300 ммоль NaCl, 10% этанол, pH 6,8): 0,4 мл/мин соответственно). Значения индексов a и b в формуле (I) определяют методами исследования, известными из уровня техники. В частности, ориентировочные значения индекса а можно вычислить с помощью метода MALDI по молекулярной массе конъюгата, а значения индекса b рассчитать по результатам хромато-массспектрометрического определения после полного гидролиза образца концентрированной бромистоводородной или иодисто-водородной кислотой с идентификацией соответствующих бром-, йод- или гидроксикислот. Фармакологические и медицинские преимущества конъюгата в соответствии с изобретением следуют из результатов определений, выполненных в соответствии с действующими нормативными актами с использованием сертифицированных приборов и/или диагностических наборов, рекомендованных уполномоченными органами к применению в этих целях. В исследованиях in vivo на беспородных лабораторных белых мышах было показано, что конъюгаты ПЭГ-IFN- в соответствии с изобретением являются нетоксичными при введении максимально переносимой дозы 10 млн МЕ/мышь. Время циркуляции немодифицированных и монопегилированных IFN -2b определяют на мышиной модели по содержанию IFN- в сыворотке крови методом иммуно-ферментного анализа, например, с помощью набора Human IFN- ELISA Kit (номер в каталоге: CK2003-1). Время циркуляции конъюгатов ПЭГ 20-IFN -2b и ПЭГ 30-IFN -2b в 1,5-2 раза превосходит аналогичный показатель для известного препарата "ПегИнтрон". Медицинские преимущества конъюгата в соответствии с изобретением следуют из его показателей антипролиферативной и противовирусной активностей. В соответствии с ОФС "Бактериальные эндотоксины" (42-000-2-00) с помощью LAL-теста, выполняемого, например, с применением диагностического набора фирмы "Lonza", США. ЛАЛ-реактив PYROGENT с чувствительностью 0,03 ЕС/мл (номер в каталоге: 0000184452), контрольный стандарт эндотоксина (номер в каталоге: 0000167426; активность КСЭ 10 ЕЭ/нг; ЛАЛ-вода (номер в каталоге: 01022012), уровень бактериальных эндотоксинов в образцах составляет менее 0,015 ЕЭ/мкг, что значительно ниже допустимого значения (0,25 ЕЭ/мкг), разрешенного Европейской Фармакопеей для рекомбинантных белков. Антипролиферативную активность конъюгатов ПЭГ 20-IFN -2b и ПЭГ 30-IFN -2b определяют на человеческих клетках с помощью колориметрического теста с бромидом 3-(4,5-диметилтиазол-2-ил)-2,5 дифенилтетразола по отношению к международному стандартному препарату сравнения IFN -2b (код 95/566) в сериях разведений и выражают в виде доз, вызывающих 50% снижение пролиферации. Антипролиферативные активности конъюгатов ПЭГ 20-IFN -2b и ПЭГ 30-IFN -2b составляют соответственно 53 и 44% от активности стандарта, тогда как препарат "ПегИнтрон" (по данным Grace M. et al. Structuraland biological characterization of pegylated recombinant IFN-alpha2b, J. Interferon Cytokine Res., Vol. 21, No. 12 (December 2001), р. 1103-1115) обладает антипролиферативной активностью на уровне 29%. Специфическую противовирусную активность конъюгатов ПЭГ 20-IFN -2b и ПЭГ 30-IFN -2b определяют микрометодом в 96-луночных планшетах с плоским дном по подавлению цитопатического действия тест-вируса везикулярного стоматита в дозе 100 ЦПД 50 в диплоидной культуре клеток MDBK, чувствительных к интерферону-альфа. Противовирусная активность конъюгатов в соответствии с изобретением на 20-45% выше аналогичного показателя известного препарата "ПегИнтрон". Из приведенного выше следует, что конъюгаты IFN -2b в соответствии с изобретением дольше циркулируют в кровотоке и имеют большую биологическую активность по сравнению с препаратом сравнения, что является их преимуществами по отношению к решениям, известным из уровня техники, и характеризует изобретательский уровень настоящего изобретения. Далее изобретение проиллюстрировано примерами его осуществления, подтверждающими достижение технического результата. Сведения, подтверждающие возможность осуществления изобретения Пример 1. Получение монопегилированного IFN -2b. К охлажденному до 0-5C раствору 5 мкмоль гидразида ПЭГ-фенилаланина в 0,1 М CH3COOH приливают раствор 10 мкмоль NaNO2 и перемешивают в течение 15 мин. Избыток NaNO2 удаляют добавлением азида натрия. Полученный раствор азида ПЭГ-фенилаланина приливают к охлажденному до 0-5C раствору 1 мкмоль IFN -2b в фосфатном буфере с pH 7,5. Реакционную смесь при охлаждении перемешивают в течение 5 ч. Через различные промежутки времени для контроля протекания реакции из реакционной смеси отбирают аликвоты, которые анализируют обращено-фазовой ВЭЖХ (колонка Superose 6, 10/300 GL, 22C, расход элюента (50 ммоль натрия фосфат, 300 ммоль NaCl, 10% этанол, pH 6,8): 0,4 мл/мин). По достижении необходимой степени превращения IFN -2b (75-85%) реакцию останавливают прибавлением избытка глицина. Реакционную смесь разбавляют в 10 раз добавлением CH3COOH, устанавливают pH 5,0 и наносят на СМ-сефарозу, предварительно уравновешенную 20 мМ ацетатным буфером с pH 5,0. После нанесения реакционной смеси сорбент промывают уравновешивающим буфером и далее градиентом от 0,1 до 0,8 МNaCl. Отобранные фракции анализируют обращено-фазовой ВЭЖХ на содержание моно-ПЭГ-IFN -2b. Целевые фракции объединяют и повторно анализируют, определяя чистоту и содержание моно-ПЭГ-IFN-2b. Выход (в пересчете на IFN -2b) очищенного ПЭГ 20-IFN -2b составляет 54%, выход ПЭГ 30-IFN 2b равен 42%. Чистота ПЭГ 20-IFN -2b составляет 95,5%, чистота ПЭГ 30-IFN -2b составляет 97,3%. Время удерживания дано в табл. 1. Таблица 1 Перед проведением последующих исследований проводят стерилизующую фильтрацию водного раствора полученного продукта. Пример 2. Исследование токсичности ПЭГ 20-IFN -2b и ПЭГ 30-IFN -2b. Самцам белых нелинейных мышей массой 201 г вводят конъюгаты в дозах от 1 до 10 млн ME в объеме 0,1 мл. У животных ежедневно в течение недели регистрируют клинические симптомы, взвешивают, отбирают пробы крови для проведения общего и биохимического анализа. В последний день животных подвергают эвтаназии и некропсии с забором органов для последующего гистологического анализа. Гибели подопытных животных на протяжении всего исследования выявлено не было, показатели крови были в норме. При патологоморфологическом исследовании лабораторных животных не было обнаружено каких-либо значимых патологических изменений. Таким образом, коньюгаты не обладают токсичностью и реактогенностью и соответствуют требованиям 4 класса опасности "вещества малоопасные" (ГОСТ 12.1.007-76 "Вредные вещества"). Пример 3. Исследование времени циркуляции немодифицированных и монопегилированных IFN 2b. Нелинейных белых мышей (самцы) разделяют на группы по количеству исследуемых препаратов. Исследуемые конъюгаты в дозе 1 млн ME в 0,1 мл вводят внутрибрюшинно. Параллельно другим группам мышей вводят немодифицированный IFN -2b и препарат "ПегИнтрон". Через каждые 6 ч у животных отбирают пробы крови и стандартным методом готовят из нее сыворотку. Содержание IFNв образцах сыворотки (нг/мл) определяют с помощью иммуно-ферментного аналитического набора (ИФАнабора) Human IFN- ELISA Kit (номер в каталоге CK2003-1). Результаты представлены в табл. 2. Таблица 2 Пример 4. Исследование уровня бактериальных эндотоксинов. Содержание бактериальных эндотоксинов в конъюгате моно-ПЭГ-IFN -2b определяли in vitro с помощью ЛАЛ-теста по стандартной методике (ГФ XII, ч. 1, с. 128). В работе использовали набор фирмы"Lonza", США. ЛАЛ-реактив PYROGENT с чувствительностью 0,03 ЕС/мл (номер в каталоге: 0000184452) и контрольный стандарт эндотоксина (номер в каталоге: 0000167426). Активность КСЭ 10 ЕЭ/нг. ЛАЛ-вода (номер в каталоге: 01022012). На основании проведенных исследований было показано, что содержание эндотоксинов в конъюгатах моно-ПЭГ-IFN -2b составило менее 2,5 ед. эндотоксина на 1 мг белка, что гораздо ниже уровня эн-5 021643 дотоксинов, разрешенных Европейской Фармакопеей для рекомбинантных белков. Пример 5. Исследование антипролиферативной активности коньюгатов ПЭГ 20-IFN -2b и ПЭГ 30IFN -2b. Антипролиферативную активность определяют на человеческих клетках линии Daudi колориметрическим тестом с бромидом 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразола. Препаратом сравнения служит международный стандарт IFN -2b (код 95/566). Клетки (2104) в 100 мкл среды RPMI 1540, содержащей 10%-ную сыворотку эмбриона теленка и 2 мМ глутамина, вносят в лунки планшетов для микротитрования. В лунки добавляют серии разведений объемом 100 мкл, содержащие различные концентрации конъюгатов ПЭГ 20-IFN -2b и ПЭГ 30-IFN -2b или стандарта IFN -2b. Планшеты инкубируют при 37C в среде 5% CO2 в течение 72 ч, после чего добавляют раствор МТТ (5 мг/мл) в фосфатносолевом буфере до концентрации 0,5 мг/мл и инкубируют в течение 3 ч в тех же условиях. Среду удаляют, к клеткам добавляют по 100 мкл ДМСО и измеряют поглощение при 570 и 620 нм. Относительные активности IFN -2b и исследуемых конъюгатов определяют, сравнивая дозы, вызывающие 50% снижение пролиферации для стандартного и испытуемых препаратов. Антипролиферативная активность ПЭГ 20-IFN -2b составляет 53%, а для конъюгата ПЭГ 30-IFN 2b она равна 44% от активности стандарта. Препарат "ПегИнтрон" обладает более низкой антипролиферативной активностью (29% по данным Grace M. et al. Structural and biological characterization of pegylatedrecombinant IFN-alpha2b, J. Interferon Cytokine Res., Vol. 21, No. 12 (December 2001), р. 1103-1115). Пример 6. Определение специфической противовирусной активности конъюгатов ПЭГ 20-IFN -2b и ПЭГ 30-IFN -2b. Противовирусную активность определяют микрометодом в 96-луночных планшетах с плоским дном по подавлению цитопатического действия тест-вируса везикулярного стоматита в диплоидной культуре клеток MDBK, чувствительных к интерферону-альфа. Для этого используют тест-вирус в дозе 100 ЦПД 50 и питательную среду Игла MEM с добавлением 10% сыворотки КРС. В качестве стандарта применяют международный стандарт IFN -2b. Результаты приведены в табл. 2. Пример 7. Исследование иммуногенности конъюгатов IFN -2b. Конъюгаты ПЭГ 20-IFN -2b и ПЭГ 30-IFN -2b, полученные в соответствии с примером 1, в дозе 1 млн ME в объеме 0,1 мл внутримышечно вводят мышам СВА с массой тела 18-22 г 1 раз в неделю в течение 8 недель. Аналогично вводят немодифицированный IFN. По прошествии 8 недель у животных отбирают пробы крови и готовят сыворотку стандартным методом. Титр антител определяют прямым твердофазным ИФА-методом. В лунки микропланшета вносят по 100 мкл раствора немодифицированного IFN -2b в концентрации 0,2 мкг/100 мкл. Антисыворотки от разных групп животных вносят в лунки планшета в серии из последовательных разведений в два раза. Иммунный комплекс обнаруживают антимышиными иммуноглобулинами, конъюгированными с пероксидазой. Иммуногенность конъюгатов ПЭГ 20-IFN -2b и ПЭГ 30-IFN -2b в 4 раза ниже, чем у немодифицированного IFN. Пример 8. Приготовление фармацевтической композиции, содержащей конъюгаты ПЭГ 20-IFN -2b или ПЭГ 30-IFN -2b. Все операции проводят в стерильных условиях. В мерный стакан вместимостью 100 мл, снабженный комбинированным потенциометрическим электродом "ЭКОМ pH ком", соединенным с pH-метром"Экотест-2000" при перемешивании магнитной мешалкой последовательно вносят стерильные растворы 520 мг моногидрата лимонной кислоты в 10 мл воды, 380 мг NaH2PO42H2O в 10 мл, 2,00 г сорбита в 10 мл воды, 500 мг L-глутамата натрия в 10 мл воды и 10 мг полисорбата 20 в 10 мл воды. К полученной смеси при перемешивании по каплям прибавляют 5% NaOH до установления величины pH 6,3-6,5 и приливают 30 мл раствора соответствующего ПЭГ-ИНФ -2b с концентрацией 1 мг/мл. Значение pH полученного раствора корректируют прибавлением 5% NaOH и общий объем смеси доводят до 100 мл водой для инъекций. Раствор фильтруют через стерилизующий фильтр с размером пор 0,22 мкм и в асептических условиях разливают в стерильные флаконы по 100 мл с содержанием конъюгата ПЭГ 20-IFN -2b или ПЭГ 30-IFN -2b 0,3 мг/мл. На флаконы наносят маркировку для целей идентификации и дальнейшего применения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Монопегилированный интерферон-альфа (IFN -2b) линейной структуры, отличающийся тем,что содержит фрагмент полиэтиленгликоля, присоединенный к белку через фенилаланиновый линкер с помощью амидной связи, как представлено общей формулой где а - целое число от 200 до 1800;b - целое число от 1 до 5 иIFN обозначает остаток интерферона -2b (IFN -2b). 2. Фармацевтическая композиция для приготовления лекарственного средства, обладающего активностью интерферона-альфа, содержащая активное вещество и фармацевтически приемлемые вспомогательные вещества, отличающаяся тем, что в качестве активного вещества содержит монопегилированный интерферон IFN -2b линейной структуры, в котором фрагмент полиэтиленгликоля присоединен к белку через фенилаланиновый линкер с помощью амидной связи, как представлено общей формулой где а - целое число от 200 до 1800;b - целое число от 1 до 5 иIFN обозначает остаток интерферона -2b (IFN -2b).
МПК / Метки
МПК: A61P 31/12, A61K 38/21, A61K 47/48, A61P 37/00, C07K 14/715, A61P 35/00
Метки: активностью, приготовления, интерферона-альфа, композиция, средства, фармацевтическая, линейной, лекарственного, интерферон-альфа, обладающего, монопегилированный, структуры
Код ссылки
<a href="https://eas.patents.su/8-21643-monopegilirovannyjj-interferon-alfa-linejjnojj-struktury-i-farmacevticheskaya-kompoziciya-dlya-prigotovleniya-lekarstvennogo-sredstva-obladayushhego-aktivnostyu-interferona-alfa.html" rel="bookmark" title="База патентов Евразийского Союза">Монопегилированный интерферон-альфа линейной структуры и фармацевтическая композиция для приготовления лекарственного средства, обладающего активностью интерферона-альфа</a>
Предыдущий патент: Удобрение, содержащее продукты реакции формальдегида, источника аммиака и ингибитора нитрификации, способы их получения и уменьшения нитрификации в почве
Следующий патент: Человеческое моноклональное антитело против cd20 и его применение
Случайный патент: Машинка для стрижки волос с приводным направляющим механизмом для стрижки












