4r,5s-энантиомер 2-(5-метил-2-оксо-4-фенилпирролидин-1-ил)ацетамида с ноотропной активностью
Номер патента: 19890
Опубликовано: 30.07.2014
Авторы: Звейниеце Лига, Дамброва Мая, Чернобровый Александр, Ворона Максим, Вейнберг Григорий, Калвиньш Иварс, Лебедев Антон
Формула / Реферат
1. 2-(5S-Метил-2-оксо-4R-фенилпирролидин-1-ил)ацетамид (I)
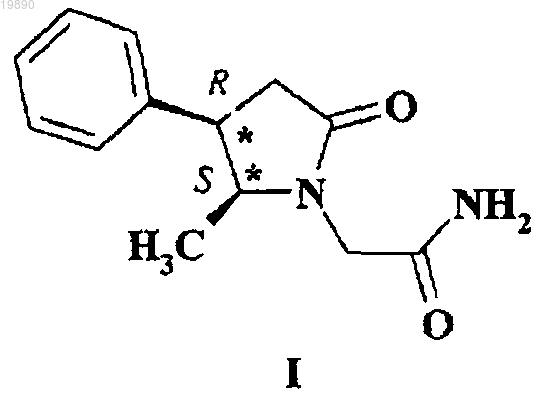
2. Применение 2-(5S-метил-2-оксо-4R-фенилпирролидин-1-ил)ацетамида для приготовления ноотропного лекарственного препарата.
3. Применение 2-(5S-метил-2-оксо-4R-фенилпирролидин-1-ил)ацетамида для приготовления лекарственного препарата, усиливающего познавательную способность.
4. Применение 2-(5S-метил-2-оксо-4R-фенилпирролидин-1-ил)ацетамида для приготовления лекарственного препарата для лечения когнитивных расстройств.
5. Способ получения 2-(5S-метил-2-оксо-4R-фенилпирролидин-1-ил)ацетамида (I)

который включает следующие стадии:
a) присоединение 2-нитропроп-1-енилбензола к диэтиловому эфиру малоновой кислоты в присутствии комплексных катализаторов, содержащих хиральный 2,2'-циклопропилиден-бис-(оксазолин)трифторметилсульфонат магния и органическое основание;
b) превращение диэтилового эфира 2-(2-нитро-1R-фенилпропил)малоновой кислоты в энантиомерный 5S-метил-4R-фенилпирролидин-2-он путем гидрирования диэтилового эфира 2-(2-нитро-1R-фенилпропил)малоновой кислоты в присутствии никеля Ренея, расщепление диастереоизомерной смеси этилового эфира 5-метил-2-оксо-4(R)-фенилпирролидин-3(S)-карбоновой кислоты на индивидуальные 5S,4R- и 5R,4-энантиомеры, декарбоксилирование этилового эфира 5(S)-метил-2-оксо-4(R)-фенилпирролидин-3(S)-карбоновой кислоты в растворе изопропилацетата, в присутствии пара-толуолсульфокислоты;
c) замена атома водорода в амидной группе 5S-метил-4R-фенилпирролидин-2-она ионом натрия в подходящем органическом растворителе;
d) N-алкилирование N-металлированного 5S-метил-4R-фенилпирролидин-2-она эфирами галоидуксусной кислоты в подходящем органическом растворителе;
e) амидирование этилового эфира 2-(5S-метил-2-оксо-4R-фенилпирролидин-1-ил)уксусной кислоты аммиаком в подходящем растворителе.
6. Способ по п.5, в котором на стадии а) хиральный 2,2'-циклопропилиден-бис-(оксазолин) представляет собой (3aR,3'aR,8aS,8'aS)-2,2'-циклопропилиден-бис-[3а,8а]-дигидро-8Н-индено-[1,2-d]-оксазол.
7. Способ по п.5, в котором на стадии а) органическое основание выбирают из группы, состоящей из морфолина, N-метилморфолина, 1,1,3,3-тетраметилгуанидина и их смесей.
8. Способ по п.6, в котором на стадии с) ион натрия вводится в амидную группу 5S-метил-4R-фенилпирролидин-2-она с использованием гидрида натрия или этилата натрия.
9. Способ по п.5, в котором на стадии d) эфир галоидуксусной кислоты представляет собой этиловый эфир бромуксусной кислоты.
10. Способ по п.5, в котором на стадии е) амидирование этилового эфира 2-(5S-метил-2-оксо-4R-фенилпирролидин-1-ил)уксусной кислоты осуществляют в водном аммиаке или его смесью с подходящим органическим растворителем.
11. Способ по п.5, в котором на стадии е) амидирование этилового эфира 2-(5S-метил-2-оксо-4R-фенилпирролидин-1-ил)уксусной кислоты осуществляют в подходящем органическом растворителе путем его насыщения газообразным аммиаком.
12. Способ по пп.10 и 11, в котором органический растворитель, используемый в реакциях, выбирают из группы, состоящей из метанола, этанола, пропанола, хлороформа, метиленхлорида; этилацетата и 1,4-диоксана.
Текст
(71)(73) Заявитель и патентовладелец: ГРИНДЕКС, ДЖОИНТ СТОК КАМПАНИ (LV) Область изобретения Настоящее изобретение относится к получению и медицинскому применению 4R,5S-энантиомера 2-(5-метил-2-оксо-4-фенилпирролидин-1-ил)ацетамида для применения в качестве ноотропного лекарственного препарата. Уровень техники Известно, что лекарственные препараты, усиливающие познавательную способность, способствуют улучшению внимательности и восприимчивости, хранению и восстановлению информации и ослабляют ухудшение когнитивных функций, связанное с травмами головы, ударом, возрастом и возрастными патологиями. Рацемическая молекула 2-(5-метил-2-оксо-4-фенилпирролидин-1-ил)ацетамида, структурная производная пирацетама, была упомянута в 2001 г. (М.V. Berestovitskaya, М.М. Zobachova, В.М. Novikov, О.S.Vasil'eva, N.V. Usik, S.M. Aleksandrova, I.N. Turenkov. Международная конференция по синтезу азотных гетероциклов, Москва, окт. 9-12, 2001, т. 1, с. 229-233). Однако не были приведены какие-либо данные о химической структуре и биологических характеристиках указанного соединения. В патенте ЕР 2013166 В (AKCIJU SABIEDRIBA OLAINFARM) 10.03.2010 г. раскрыт R-энантиомерN-карбамоилметил-4-фенил-2-пирролидинона с нейротропной активностью, который отличается от представленного в изобретении вещества тем, что в нем отсутствует 5-метильная группа. Согласно настоящему изобретению при фармакологическом исследовании рацемического 2-(5 метил-2-оксо-4-фенилпирролидин-1-ил)ацетамида, содержащего два хиральных центра в положениях 4 и 5-кольца пирролидона, было неожиданно обнаружено, что это вещество обладает довольно перспективными свойствами усиления познавательной способности. Однако, когда авторы изобретения получили индивидуальный 4R,5S-энантиомер 2-(5-метил-2-оксо-4-фенилпирролидин-1-ил)ацетамида и подвергли его ноотропному исследованию, неожиданно оказалось, что указанный энантиомер обладает гораздо большей фармакологической активностью по сравнению с родственным рацемическим соединением. Согласно настоящему изобретению авторы описывают получение 4R,5S-энантиомера 2-(5-метил-2 оксо-4-фенилпирролидин-1-ил)ацетамида формулы 1 со свойствами усиления познавательной способности, имеющими большое фармакологическое значение который представляет собой новое химическое вещество с ноотропной активностью. Согласно настоящему изобретению, химическая схема получения 2-(5S-метил-2-оксо-4Rфенилпирролидин-1-ил)ацетамида (1) включает синтез 4R,5S-энантиомера 5-метил-4-фенилпирролидин 2-она (2) и введение ацетамидной группы в положение 1-кольца пирролидона Способы получения рацемического 5-метил-4-фенилпирролидин-2-она и его разделение на энантиомерную смесь эритро- и треоизомеров описаны в литературе (Colonge J., Pouchol J.M., Bull. Soc.Chim., 1962, 598-603; Langlois M. et al. Bull. Soc. Chim., 1971, 2976-2982; Lesniak S., Pasternak В., Tetrahedron Lett., 2005, 46, 3093-3095). Однако не обнаружено никаких письменных доказательств о расщеплении рацемического 5-метил-4-фенилпирролидин-2-она на индивидуальные энантиомеры или о прямом синтезе из хиральных или нехиральных химических соединений. Согласно настоящему изобретению указанная проблема решена путем асимметричного присоединения Михаэля 2-нитропроп-1-енилбензола (3) к диэтиловому эфиру малоновой кислоты (4) в присутствии комплексного катализатора, состоящего из хирального 2,2'-циклопропилиден-бис-оксазолина (5),трифторметилсульфоната магния (Mg(OTf)2) и органического основания, с образованием диастереоизомерной смеси диэтилового эфира 2-[2(R,S)-нитро-1R-фенилпропил]малоновой кислоты (6) Образовавшееся промежуточное соединение (6) превращается в 5S-метил-4R-фенилпирролидин-2 он (2) с использованием следующих ниже стадий (см. схему ниже):a) присоединение 2-нитропроп-1-енилбензола к диэтилмалоновой кислоте в присутствии комплексного катализатора, состоящего из хирального 2,2'-циклопропилиден-бис-оксазолина, трифторметилсульфоната магния и органического основания;b) превращение диэтилового эфира 2-(2-нитро-1R-фенилпропил)малоновой кислоты в энантиомерный 5S-метил-4R-фенилпирролидин-2-он путем гидрирования диэтил 2-(2-нитро-1Rфенилпропил)малоновой кислоты в присутствии никеля Ренея, расщепления диастереоизомерной смеси этилового эфира 5-метил-2-оксо-4(R)-фенилпирролидин-3(S)-карбоновой кислоты на индивидуальные 5S,4R- и 5R,4-энантиомеры, и декарбоксилирования этилового эфира 5(S)-метил-2-оксо-4(R)фенилпирролидин-3(S)-карбоновой кислоты;c) замещение атома водорода в амидной группе 5S-метил-4R-фенилпирролидин-2-она ионом натрия в подходящем органическом растворителе;d) N-алкилирование N-металлированного 5S-метил-4R-фенилпирролидин-2-она эфиром галоидуксусной кислоты в подходящем органическом растворителе;e) амидирование этилового эфира 2-(5S-метил-2-оксо-4R-фенилпирролидин-1-ил)уксусной кислоты аммиаком в подходящем растворителе. Превращение 5S-метил-4R-фенилпирролидин-2-она (2) в 2-(5S-метил-2-оксо-4R-фенилпирролидин 1-ил)ацетамид (1) включает замещение водорода в NH группе (2) натрием, алкилирование металлированного пирролидин-2-она (13) этиловым эфиром галоидуксусной кислоты и обработку промежуточного этилового эфира 2-(5S-метил-2-оксо-4R-фенилпирролидин-1-ил)уксусной кислоты (14) аммиаком в подходящем растворителе. Согласно настоящему изобретению сравнительная фармакологическая оценка 2-(4R-фенил-2 оксопирролидин-1-ил)ацетамида, рацемического 2-(5-метил-2-оксо-4-фенилпирролидин-1-ил)ацетамида и 2-(5S-метил-2-оксо-4R-фенилпирролидин-1-ил)ацетамида, с использованием стандартного испытания пассивного уклонения, показала высокую эффективность оптически активного 2-(5S-метил-2-оксо-4Rфенилпирролидин-1-ил)ацетамида (1) в качестве усилителя обучения и памяти. Следовательно, 2-(5S-метил-2-оксо-4R-фенилпирролидин-1-ил)ацетамид может быть использован как высокоэффективное средство для применения в качестве лекарственного препарата с ноотропной активностью. Описание вариантов осуществления Объем изобретения не должен ограничивается рабочими примерами, которые приведены с демонстрационной целью. Специалист в данной области сможет осуществить это изобретение на практике, на основе данного описания настоящей заявки на патент. Следующие ниже примеры иллюстрируют, но не ограничивают настоящее изобретение. Примеры Пример 1. Раствор (3aR,3'aR,8aS',8'aS)-2,2'-циклопропилиден-бис-[3 а,8 а]-дигидро-8 Н-индено-[1,2-d]-оксазола(420 мг, 1,18 ммоль/л) в хлороформе (стабилизирован углеводородом) (5 мл), трифторметилсульфоната магния (378 мг, 1,18 ммоль/л) и воду (25 мл) при комнатной температуре добавляют в реакционную колбу на 250 мл и смесь перемешивают под аргоном в течение 1 ч. К полученной смеси добавляют молекулярные сита (1,0 г) и 1,4-диоксан (30 мл) и дополнительно перемешивают в течение 30 мин. Полученную суспензию разбавляют 45 мл раствора, содержащего диэтилмалоновой кислоты (1,67 г, 10,2 ммоль/л), 2 нитропроп-1-енилбензола (1,63 г, 10,0 ммоль/л) и морфолин (46 мкл) в хлороформе. Реакционную смесь перемешивают при комнатной температуре. Степень превращения и селективность определяют методом хиральной жидкостной хроматографии высокого давления (ЖХВД) [Chiralpak IC, 4,6250 мм, 1,0 мл/мин, элюент - смесь изопропанол/гексан (1:9)] каждые 24 ч. После завершения реакции реакционную смесь разбавляют гексаном (50 мл), перемешивают 20 мин и твердое вещество отфильтровывают. Фильтрат промывают 5% раствором HCl в воде (250 мл), рассолом (250 мл) и сушат над безводным Na2SO4. Обезвоживающий агент удаляют путем фильтрации и раствор концентрируют при пониженном давлении. Остаток очищают хроматографически на колонке с силикагелем и элюентом этилацетат/гексан(1:10). Собирают фракцию, имеющую R/0,28, с выходом 87% (2,8 г). Полученное легкоплавкое желтое тврдое вещество согласно хиральной ЖХВД представляет собой смесь эритро- и трео-изомеров диэтилового эфира 2-(2-нитро-1R-фенилпропил)малоновой кислоты в соотношении 3:1. Оптическая чистота: 93%. 1 Н ЯМР (CDCl3), , м.д. (J, Гц): 0,85 (2,25 Н, т, J=7,0 эритро-СН 2 СН 3); 0,93 (0,75 Н, т, J=7,0 треоСН 2 СН 3); 1,15-1,27 (3 Н, м, СН 2 СН 3); 1,29 (0,75 Н, д, J=6,8, трео-CH3CNO2); 1,37 (2,25 Н, д, J=6,8, эритроCH3CNO)2); 3,63-3,93 (3 Н, м, СН 2 СН 3, СОСНСО); 4,07-4,29 (3 Н, м, СН 2 СН 3, PhCH); 4,29-5,06 (0,25 Н, м,трео-CHNO2); 5,07-5,16 (0,75 Н, м, эритро-CHNO2); 6,99-7,28 (5H, м, С 6 Н 5). Пример 2. Замена морфолина в примере 1 N-метилморфолином приводит к образованию диэтилового эфира 2(2-нитро-1R-фенилпропил)малоновой кислоты, в виде смеси эритро- и трео-изомеров 3:1. Оптическая чистота: 94%, выход 85%. Пример 3. Замена морфолина в примере 1 смесью морфолина (46 мл) и тетра-метилгуанидина (46 мл) приводит к образованию диэтилового эфира 2-(2-нитро-1R-фенилпропил)малоновой кислоты в виде смеси эритро- и треоизомеров 3:1. Оптическая чистота: 95%, выход 87%. Пример 4. Перемешиваемую суспензию диэтилового эфира 2-(2-нитро-1R-фенилпропил)малоновой кислоты(2,34 г, 7,22 ммоль/л) в этаноле (50 мл) и 1 мл 50%-ной суспензии никеля Ренея в воде подвергают гид-3 019890 рированию при 50 С и 50 атм (5,0 МПа) в течение 18 ч. После завершения реакции реакционную смесь охлаждают, катализатор отфильтровывают и промывают этанолом (30 мл). Фильтрат концентрируют при пониженном давлении. Остаток очищают методом жидкостной хроматографии на колонке с силикагелем и элюентом CH2Cl2/этанол (10:11:10). Собирают фракции с Rf 0,28; выход 80% (1,43 г). Согласно спектру 1 Н ЯМР полученное белое тврдое вещество представляет собой смесь эритро- и трео-изомеров этилового эфира 5-метил-2-оксо-4(R)-фенилпирролидин-3(S)-карбоновой кислоты в соотношении 17:3. Выход 80% (1,43 г). 1 Н ЯМР (CDCl3), , м.д. (J, Гц): 0,76 (2,55 Н, д, J=6,3 эритро-5-СН 3); 1,18-1,23 (3,45 Н, м, трео-5-СН 3 и СН 2 СН 3); 3,73 (1 Н, д, J=9,0, 3-Н); 4,02-4,22 (4 Н, м, СН 2 СН 3, 4-Н, 5-Н); 6,23 (1 Н, шир. с, NH); 7,09-7,33(5 Н, м, С 6 Н 5). При перекристаллизации полученного продукта из этанола выделяют 785 мг 5S-метил-4R-фенил-2 пирролидинон-3S-карбоксилата. Температура пл. 141-143 С. Анализ - вычислено для C14H17NO3 (247,30): С 68,00; Н 6,93; N 5,66. Найдено: С 67,93; Н 6,87; N 5,64. 1 Н ЯМР (CDCl3), , м.д. (J, Гц): 0,76 (3 Н, д, J=6,3 эритро-5-СН 3); 1,18-1,23 (3 Н, м, СН 2 СН 3); 3,73(1 Н, д, J=9,0, 3-Н); 4,02-4,22 (4 Н, м, CH2CH3, 4-Н, 5-Н); 6,23 (1 Н, шир. с, NH); 7,09-7,33 (5 Н, м, С 6 Н 5). Пример 5. Гидроксид калия (672 мг, 12 ммоль/л) добавляют в раствор этилового эфира 5S-метил-4R-фенил-2 пирролидинон-3S-карбоновой кислоты (900 мг, 4,00 ммоль/л) в метаноле (50 мл) и полученную смесь кипятят с обратным холодильником 3 ч. Реакционную смесь охлаждают и выпаривают при пониженном давлении. Остаток растворяют в 20 мл воды, водный раствор промывают этилацетатом (330 мл), доводят до значения рН 2 разбавленной соляной кислотой и выпаривают при пониженном давлении. Полученный остаток суспендируют в растворе этанол/CH2Cl2 (1:1), перемешивают 1 ч, фильтруют и фильтрат выпаривают при пониженном давлении. Остаток растворяют в смеси изопропилацетата (40 мл) и паратолуолсульфокислоты (100 мг). Полученную смесь кипятят с обратным холодильником 24 ч, охлаждают и концентрируют при пониженном давлении. Остаток очищают методом жидкостной хроматографии на колонке с силикагелем и элюентом CH2Cl2/этанол (20:1), собирая фракции с Rf 0,40. Согласно хиральной ЖХВД полученное желтое тврдое вещество представляет собой эритро-изомер 5S-метил-4Rфенилпирролидин-2-она. Выход 65% (455 мг). Анализ - вычислено для C11H13NO (175,23) С 75,40; Н 7,48; N 7,99. Найдено: С 75,63; Н 7,55; N 8,07. 1 Н ЯМР (CDCl3), , м.д. (J, Гц): 0,75 (3,00 Н, д, J=6,5 5-CH3); 2,55-2,69 (2 Н, м, 3-СН 2); 3,64-3,72 (1H,м, 4-Н); 3,96-4,04 (1H, м, 5-Н); 6,78 (1H, шир. с, NH); 7,07-7,33 (5 Н, м, С 6 Н 5). Пример 6. Замена гидроксида калия в примере 5 гидроксидом натрия приводит к образованию 5S-метил-4Rфенил-2-пирролидинона; выход 62%. Пример 7. Раствор 5S-метил-4R-фенил-2-пирролидинона (351 мг, 2,00 ммоль/л) в толуоле (30 мл) добавляют в суспензию гидрида натрия (56 мг, 2,35 ммоль/л) в толуоле (30 мл). Перемешиваемую смесь нагревают при 80-90 С в течение 30 мин и затем охлаждают до комнатной температуры. К реакционной смеси добавляют этилбромацетат (368 мг, 2,20 ммоль/л), нагревают при 110-120 С в течение 6 ч и затем концентрируют при пониженном давлении. Остаток растворяют в толуоле (30 мл). Полученный раствор промывают 5%-ной соляной кислотой (250 мл), рассолом (250 мл), сушат над безводным Na2SO4. Обезвоживающий агент удаляют путем фильтрации и раствор концентрируют при пониженном давлении. Остаток очищают хроматографически на колонке с силикагелем и элюентом CH2Cl2/метанол (20:1). Собирают фракции, имеющие Rf 0,48, и выпаривают при пониженном давлении, получая этил 2-(5S-метил-2-оксо 4R-фенилпирролидин-1-ил)ацетат (381 мг, 73%) в виде бесцветного масла. 1 Н ЯМР (CDCl3), , м.д. (J, Гц): 0,72 (3,00 Н, д, J=6,6 5-СН 3); 1,23 (3 Н, т, J=7,0, СН 2 СН 3); 2,60-2,91(2 Н, д, J=8,5, 3-СН 2); 3,65-3,74 (1H, м, 4-Н); 3,66 (2 Н, д, J=17,7, NCH2COO); 4,01-4,10 (1 Н, м, 5-Н); 4,104,20 (2 Н, м, СН 2 СН 3); 4,38 (1H, д, J=17,7, NCH2COO); 7,09-7,31 (5 Н, м, С 6 Н 5). Пример 8. Замена гидрида натрия в примере 7 этилатом натрия приводит к образованию этил 2-(5S-метил-2 оксо-4R-фенилпирролидин-1-ил)ацетата с выходом 68%. Пример 9. Замена этилбромацетата в примере 7 этилхлорацетатом приводит к образованию этил 2-(5S-метил 2-оксо-4R-фенилпирролидин-1-ил)ацетата с выходом 70%. Пример 10. Замена толуола в примере 7 гексаном приводит к образованию этил 2-(5S-метил-2-оксо-4Rфенилпирролидин-1-ил)ацетата с выходом 71%). Пример 11. Замена толуола в примере 7 бензолом приводит к образованию этил 2-(5S-метил-2-оксо-4R-4 019890 фенилпирролидин-1-ил)ацетата с выходом 70%. Пример 12. Замена толуола в примере 7 на 1,4-диоксан приводит к образованию этил 2-(5S-метил-2-оксо-4Rфенилпирролидин-1-ил)ацетата с выходом 72%. Пример 13. Замена толуола в примере 7 дихлорметаном приводит к образованию этил 2-(5S-метил-2-оксо-4Rфенилпирролидин-1-ил)ацетата с выходом 67%. Пример 14. Раствор этил 2-(5S-метил-2-оксо-4R-фенилпирролидин-1-ил)ацетата (350 мг, 1,34 ммоль/л) в метаноле (30 мл) насыщается газообразным аммиаком в течение 5 ч. Реакционную смесь концентрируют при пониженном давлении, и остаток очищают хроматографически с элюентом CH2Cl2/этанол (20:1). Собирают фракции, имеющие R/0,32, и выпаривают при пониженном давлении, получая 2-(5S-метил-2-оксо 4R-фенилпирролидин-1-ил)ацетамид (249 мг, 80%) в виде белого тврдого вещества после перекристаллизации из воды. Температура пл. 169-171 С. Вычислено для C13H16N2O2 (232,28) С 67,22; Н 6,94; N 12,06. Найдено: С 67,31; Н 6,99; N 12,10. 1 Н ЯМР (CDCl3), : 0,77 (3,00 Н, д, J=6,6 5-CH3); 2,62-2,81 (2 Н, м, 3-СН 2); 3,66-3,75 (1H, м, 4-Н); 3,75(1 Н, д, J=16, NCH2COO); 3,98-4,08 (1 Н, м, 5-Н); 4,04 (1H, д, J=16, NCH2COO); 5,48 и 6,29 (2 Н, шир. с,шир. с, NH2); 7,07-7,32 (5 Н, м, С 6 Н 5). Пример 15. Замена газообразного аммиака в примере 13 на 25%-ный водный аммиак приводит к образованию 2-(5S-метил-2-оксо-4R-фенилпирролидин-1-ил)ацетамида с выходом 78%. Пример 16. Замена метанола в примере 13 на этанол приводит к образованию 2-(5S-метил-2-оксо-4Rфенилпирролидин-1-ил)ацетамида с выходом 81%. Пример 17. Замена метанола в примере 13 на н-пропанол приводит к образованию 2-(5S-метил-2-оксо-4Rфенилпирролидин-1-ил)ацетамида с выходом 77%. Пример 18. Рацемический 2-(5-метил-2-оксо-4-фенилпирролидин-1-ил)ацетамид получают путем(2 Н, м, 3-СН 2); 3,66-3,75 (1 Н, м, 4-Н); 3,75 (0,5 Н, д, J=16, эритро-NCH2COO); 3,86 (0,5 Н, д, J=16, треоNCH2COO); 3,95 (0,5 Н, д, J=16, трео-NCH2COO); 3,98-4,08 (1 Н, м, 5-Н); 4,04 (0,5 Н, д, J=16, эритроNCH2COO); 5,48 и 6,29 (2 Н, шир. с, шир. с, NH2); 7,07-7,32 (5 Н, м, С 6 Н 5). Биологические испытания. Обучение и память. Испытание пассивного уклонения осуществляли в устройстве с челночной коробкой (фирма UgoBasile, Италия) с двумя сообщающимися отделениями одинакового размера (201016 см) и рештчатым полом из нержавеющей стали (расстояние между планками 0,7 см). Правое отделение (шоковое отделение) было окрашено в чрный цвет, чтобы получить темную камеру. Левое отделение было окрашено в белый цвет и освещалось электрической лампой (100 Вт), вставленной наверху в колпачок из органического стекла. Указанные отделения разделялись опускной дверью (54 см). В первый день (контрольного обучения) мышей размещали в освещенном отделении, причем дверь между двумя отделениями открывалась через 60 с. Когда мыши входили в темное отделение всеми четырьмя лапами, дверь автоматически закрывалась, и лапы мышей подвергались неизбежному поражению электрическим током (0,1 мА; 3 с), который подавался через рештчатый пол. Время ожидания перехода в темное отделение (тренировочное время ожидания) замерялось автоматически. Тест на сохранение приобретенной информации проводили через 24 ч (2-й день). Мышей размещали в освещенном (безопасном) отделении с допуском в темное отделение (в течение 10 с) на период 300 с (время закрывания). Время ожидания перехода в темное отделение всеми четырьмя лапами замерялось автоматически (сохранение в памяти времени ожидания). Влияние 2-(4R-фенил-2-оксопирролидин-1-ил)ацетамида, рацемического 2-(5-метил-2-оксо-4 фенилпирролидин-1-ил)ацетамида и 2-(5S-метил-2-оксо-4R-фенилпирролидин-1-ил)ацетамида на сохранение реакции пассивного уклонения (памяти) у самцов мыши ICR. Представленные в таблице данные демонстрируют влияние 2-(4R-фенил-2-оксопирролидин-1 ил)ацетамида, рацемического 2-(5-метил-2-оксо-4-фенилпирролидин-1-ил)ацетамида и 2-(5S-метил-2 оксо-4R-фенилпирролидин-1-ил)ацетамида на память мышей в испытании пассивного уклонения. Влияние введенных веществ на память мышей в испытании пассивного уклонения Указанные вещества вводились внутрибрюшинно, с дозой 46 мкмоль/кг, за 60 мин до контрольного обучения (первый день). Контрольная группа, получившая солевой раствор, исследовалась одновременно с группами, получившими указанные вещества. Статистический анализ был осуществлен с использованием критерия Стьюдента. Данные приведены как "среднее значениесреднеквадратичная ошибка". р 0,05, p0,05, р 0,05 относительно контрольной группы, группы, обработанной 2-(4R-фенил-2 оксопирролидин-1-ил)ацетамидом, и группы, обработанной рацемическим 2-(5-метил-2-оксо-4 фенилпирролидин-1-ил)ацетамидом соответственно; n10. Как видно из таблицы, обработка 2-(5S-метил-2-оксо-4R-фенилпирролидин-1-ил)ацетамидом дозой 46 мкмоль/кг приводит к статистически значимому влиянию на память. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. 2-(5S-Метил-2-оксо-4R-фенилпирролидин-1-ил)ацетамид (I) 2. Применение 2-(5S-метил-2-оксо-4R-фенилпирролидин-1-ил)ацетамида для приготовления ноотропного лекарственного препарата. 3. Применение 2-(5S-метил-2-оксо-4R-фенилпирролидин-1-ил)ацетамида для приготовления лекарственного препарата, усиливающего познавательную способность. 4. Применение 2-(5S-метил-2-оксо-4R-фенилпирролидин-1-ил)ацетамида для приготовления лекарственного препарата для лечения когнитивных расстройств. 5. Способ получения 2-(5S-метил-2-оксо-4R-фенилпирролидин-1-ил)ацетамида (I) который включает следующие стадии:a) присоединение 2-нитропроп-1-енилбензола к диэтиловому эфиру малоновой кислоты в присутствии комплексных катализаторов,содержащих хиральный 2,2'-циклопропилиден-бис(оксазолин)трифторметилсульфонат магния и органическое основание;b) превращение диэтилового эфира 2-(2-нитро-1R-фенилпропил)малоновой кислоты в энантиомерный 5S-метил-4R-фенилпирролидин-2-он путем гидрирования диэтилового эфира 2-(2-нитро-1Rфенилпропил)малоновой кислоты в присутствии никеля Ренея, расщепление диастереоизомерной смеси этилового эфира 5-метил-2-оксо-4(R)-фенилпирролидин-3(S)-карбоновой кислоты на индивидуальные 5S,4R- и 5R,4-энантиомеры, декарбоксилирование этилового эфира 5(S)-метил-2-оксо-4(R)фенилпирролидин-3(S)-карбоновой кислоты в растворе изопропилацетата, в присутствии паратолуолсульфокислоты;c) замена атома водорода в амидной группе 5S-метил-4R-фенилпирролидин-2-она ионом натрия в подходящем органическом растворителе;d) N-алкилирование N-металлированного 5S-метил-4R-фенилпирролидин-2-она эфирами галоидуксусной кислоты в подходящем органическом растворителе;e) амидирование этилового эфира 2-(5S-метил-2-оксо-4R-фенилпирролидин-1-ил)уксусной кислоты аммиаком в подходящем растворителе. 6. Способ по п.5, в котором на стадии а) хиральный 2,2'-циклопропилиден-бис-(оксазолин) представляет собой (3aR,3'aR,8aS,8'aS)-2,2'-циклопропилиден-бис-[3 а,8 а]-дигидро-8 Н-индено-[1,2-d]-оксазол. 7. Способ по п.5, в котором на стадии а) органическое основание выбирают из группы, состоящей из морфолина, N-метилморфолина, 1,1,3,3-тетраметилгуанидина и их смесей. 8. Способ по п.6, в котором на стадии с) ион натрия вводится в амидную группу 5S-метил-4Rфенилпирролидин-2-она с использованием гидрида натрия или этилата натрия. 9. Способ по п.5, в котором на стадии d) эфир галоидуксусной кислоты представляет собой этиловый эфир бромуксусной кислоты. 10. Способ по п.5, в котором на стадии е) амидирование этилового эфира 2-(5S-метил-2-оксо-4Rфенилпирролидин-1-ил)уксусной кислоты осуществляют в водном аммиаке или его смесью с подходящим органическим растворителем. 11. Способ по п.5, в котором на стадии е) амидирование этилового эфира 2-(5S-метил-2-оксо-4Rфенилпирролидин-1-ил)уксусной кислоты осуществляют в подходящем органическом растворителе путем его насыщения газообразным аммиаком. 12. Способ по пп.10 и 11, в котором органический растворитель, используемый в реакциях, выбирают из группы, состоящей из метанола, этанола, пропанола, хлороформа, метиленхлорида; этилацетата и 1,4-диоксана.
МПК / Метки
МПК: A61P 25/00, A61P 25/28, A61K 31/4015, C07D 207/263
Метки: 2-(5-метил-2-оксо-4-фенилпирролидин-1-ил)ацетамида, 4r,5s-энантиомер, ноотропной, активностью
Код ссылки
<a href="https://eas.patents.su/8-19890-4r5s-enantiomer-2-5-metil-2-okso-4-fenilpirrolidin-1-ilacetamida-s-nootropnojj-aktivnostyu.html" rel="bookmark" title="База патентов Евразийского Союза">4r,5s-энантиомер 2-(5-метил-2-оксо-4-фенилпирролидин-1-ил)ацетамида с ноотропной активностью</a>
Предыдущий патент: Устройство для обнаружения дефектов во вращающихся металлических телах магнитопорошковым методом контроля
Следующий патент: Способ приготовления хлеба
Случайный патент: Устройство для перемещения двери лифта












