Способ получения солифенацина
Формула / Реферат
1. Способ получения (1S)-(3R)-1-азабицикло[2.2.2]окт-3-ил-3,4-дигидро-1-фенил-2(1Н)-изохинолинкарбоксилата (солифенацина) или его фармацевтически приемлемых солей с высокой степенью оптической чистоты, характеризующийся тем, что неочищенное основание солифенацина переводят в гидротартрат, который затем, при необходимости, переводят в другую фармацевтически приемлемую соль или в основание солифенацина.
2. Способ по п.1, характеризующийся тем, что основание солифенацина переводят в гидротартрат, осуществляя взаимодействие с L-винной кислотой, и затем выделяют кристаллический гидротартрат солифенацина.
3. Способ по п.2, характеризующийся тем, что гидротартрат солифенацина далее перекристаллизовывают из полярного растворителя или смеси полярных растворителей, предпочтительно из группы С1-С4 спиртов или их смесей с водой.
4. Способ по пп.2 и 3, характеризующийся тем, что неочищенное основание солифенацина получают взаимодействием 1(S)-алкил-1-фенил-1,2,3,4-тетрагидро-2-изохинолинкарбоксилата, где под алкилом понимаются первичные С1-С4 алкилы, с 3-(R)-хинуклидолом в среде ненуклеофильного основания.
5. Способ по п.4, характеризующийся тем, что используют ненуклеофильное основание, выбранное из группы, включающей стерически затрудненные алкоголяты или амины, соединения лития или фосфазены.
6. Способ по п.5, характеризующийся тем, что используют трет-бутилат калия, натрия или лития.
7. Способ по п.5, характеризующийся тем, что используют трет-амилат калия или натрия.
8. Кристаллическая соль, представляющая собой гидротартрат солифенацина.
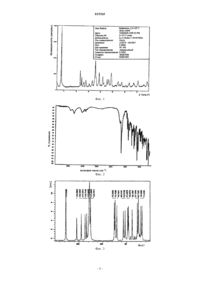
9. Кристаллическая соль по п.8, характеризующаяся рентгеновским спектром с характеристическими сигналами при следующих углах 2q: 3,9; 11,6; 12,1; 13,9; 17,8; 19,5 и 24,5±0,2°.
10. Кристаллическая соль по п.8, характеризующаяся кривой дифференциальной сканирующей калориметрии, имеющей одну эндотерму с пиком при 200°С, при скорости нагревания 10°С/мин.
11. Кристаллическая соль по п.8, характеризующаяся сигналами в спектре 13С ЯМР в режиме кросс-поляризации и вращения под магическим углом (13С ЯМР КП-ВМУ) при 11,2; 19,6; 24,7; 27,1; 38,1; 45,8; 47,4; 52,9; 56,4; 70,1; 73,7; 75,3; 125,7; 127,9; 128,8; 133,7; 137,2; 145,2; 154,6; 177,0 м.д.
Текст
(1S)-(3R)-1-азабицикло[2.2.2]окт-3-ил-3,4-дигидро-1-фенил-2(1 Н)изохинолинкарбоксилата (солифенацина) или его фармацевтически приемлемых солей с высокой степенью оптической чистоты, при котором неочищенное основание солифенацина переводят в гидротартрат, который затем, при необходимости, переводят в другую фармацевтически приемлемую соль или в основание солифенацина. Кристаллическая соль гидротартрат солифенацина. 015365 Область техники, к которой относится изобретение Изобретение относится к новому способу получения (1S)-(3R)-1-азабицикло[2.2.2]окт-3-ил-3,4 дигидро-1-фенил-2(1H)-изохинолинкарбоксилата формулы III (солифенацина), который используют для симптоматического лечения недержания мочи и/или частых позывов к мочеиспусканию у пациентов с гиперактивным мочевым пузырем. Уровень техники В оригинальной патентной литературе (ЕР 0801067, WO 9620194) описано несколько способов получения солифенацина. Первый способ заключается в реакции (1S)-этил-1-фенил-1,2,3,4-тетрагидро-2-изохинолинкарбоксилата формулы II с 3-(R)-хинуклидолом формулы I в суспензии с толуолом и в присутствии гидрида натрия. Реакционную смесь кипятят с одновременной отгонкой образующегося этанола, который находится в азеотропной смеси с толуолом В ЕР 0801067 или WO 9620194 опубликован другой вариант, в котором 3-(R)-хинуклидилалкилкарбонат вступает в реакцию с 1-фенил-1,2,3,4-тетрагидро-2-изохинолином с образованием солифенацина. Неочищенный солифенацин, полученный одним из указанных выше способов получения, далее выделяют в виде гидрохлорида или оксалата, и при их кристаллизации происходит очистка от непрореагировавших исходных веществ и побочных продуктов. Однако эффективность очистки путем перевода вещества в указанные соли мала. Для достижения степени чистоты, требуемой для синтеза конечного продукта - солифенацина сукцината, используемого для получения медикаментов, необходимо несколько раз повторить кристаллизацию соли с HCl или оксалата, что, естественно, приводит к снижению выхода. Раскрытие изобретения В соответствии с изобретением предложен способ получения оптически чистого (1S)-(3R)-1 азабицикло[2.2.2]окт-3-ил-3,4-дигидро-1-фенил-2(1 Н)-изохинолинкарбоксилата (солифенацина) или его фармацевтически приемлемых солей, который включает получение солифенацина гидротартрата в кристаллической форме. Изобретение основано на достижении исключительно высокой эффективности очистки при переводе неочищенного основания в гидротартрат путем осуществления взаимодействия с Lвинной кислотой и последующим выделением кристаллического солифенацина гидротартрата. Способ по изобретению можно использовать для очистки солифенацина, полученного любым известным способом, в частности солифенацина, полученного реакцией (1S)-алкил-1-фенил-1,2,3,4-тетрагидро-2 изохинолинкарбоксилата с 3-(R)-хинуклидолом в присутствии катализатора, являющегося ненуклеофильным основанием. До настоящего времени солифенацина гидротартрат не был получен и охарактеризован. Кристаллический солифенацина гидротартрат является стабильной солью, которую можно перевести в другую фармацевтически приемлемую соль, например сукцинат, а можно непосредственно использовать для производства лекарственных средств. Данная соль охарактеризована методами рентгенографии, дифференциальной сканирующей калориметрии (ДСК), ИК и 13 С ЯМР-спектроскопии в режиме кросс-поляризации и вращения под магическим углом (13 С ЯМР КП-ВМУ). Способ по изобретению можно осуществлять, например, следующим образом. Реакционную смесь с неочищенным солифенацином, полученным любым известным способом (см. выше), после завершения превращения охлаждают и затем к смеси добавляют воду. После отделения органической фазы водный слой промывают другой порцией органического растворителя. Объединенные органические экстракты промывают водой, солевым раствором и снова водой. Органический слой далее упаривают до сухого остатка.-1 015365 После такой очистки некоторые примеси, такие как (1R)-(3R)-1-азабицикло[2.2.2]окт-3-ил-3,4 дигидро-1-фенил-2(1 Н)-изохинолинкарбоксилат,(1S)-(3S)-1-азабицикло[2.2.2]окт-3-ил-3,4-дигидро-1 фенил-2(1H)-изохинолинкарбоксилат и 1(S)-фенил-1,2,3,4-тетрагидроизохинолин, все еще остаются в реакционной смеси. Поскольку была отмечена низкая эффективность очистки солифенацина при кристаллизации в виде соли с HCl или оксалата, предпринимались попытки найти более подходящий способ очистки неочищенного солифенацина. Более подходящим способом оказалось превращение основания солифенацина в сукцинат при взаимодействии с янтарной кислотой. Однако гораздо большая эффективность очистки была достигнута при переводе неочищенного основания солифенацина в кристаллическую соль гидротартрат при взаимодействии с L-винной кислотой. Кристаллическая форма гидротартрата (1S)-(311)-1-азабицикло[2.2.2]окт-3-ил-3,4-дигидро-1-фенил 2(1 Н)-изохинолинкарбоксилата охарактеризована дифракционной рентгенограммой (сигналы при следующих углах 2: 3.9, 11.6, 12.1, 13.9, 17.8, 19.5 и 24.50.2), ИК- и 13 С ЯМР КП-ВМУ-спектроскопией, а также ДСК (1 пик при 200,0 С) (фиг. 1-4). Предлагаемый способ, который, как доказано, является наиболее эффективным способом получения солифенацина, включает получение основания солифенацина реакцией (1S)-аликл-1-фенил-1,2,3,4 тетрагидро-2-изохинолинкарбоксилата с 3-(R)-хинуклидолом в присутствии катализатора, являющегося ненуклеофильным основанием (схема 1),Схема 1 последующее выделение неочищенного основания и далее окончательную очистку, которая состоит в переводе основания солифенацина в гидротартрат при взаимодействии с L-винной кислотой в среде полярного растворителя или смеси полярных растворителей, и выделение кристаллического гидротартрата солифенацина. Чистую соль солифенацина гидротартрат, полученную таким образом, можно перевести в традиционно используемый в фармации солифенацина сукцинат или непосредственно использовать для производства лекарственных средств. Ненуклеофильное основание представляет собой основание, характеризующееся сравнительно низкой способностью к нуклеофильному замещению. Главным образом, это стерически затрудненные алкоголяты или амины, а также литийсодержащие соединения или группа веществ, называемых фосфазенами, в частности, например, трет-бутилат калия, трет-бутилат натрия, трет-бутиллитий, диизопропиламид лития (ЛДА), гексаметилдисилазан калия (К-ГМДС), 1,8-диазабицикло[5.4.0]ундецен-7 (ДБУ), 1,5 диазабицикло[4.3.0]нонен-5 (ДБН), 2,6-ди-трет-бутил-4-метилпиридин, основание P1-трет-Bu, третбутилимино-2-диэтиламино-1,3-диметилпергидро-1,3,2-диазафосфоран(ВЕМР),трет-бутилиминотри(пирролидино)фосфоран (ВТРР) и основание P2-трет-Bu, особенно предпочтительными являются трет-бутилат калия и натрия или трет-амилат калия. Из группы полярных растворителей, пригодных для получения и выделения гидротартрата, наиболее удобно использовать С 1-С 4-спирты, их смеси и, возможно, их сочетания с водой. Тартрат солифенацина иначе можно получить путем добавления L-винной кислоты непосредственно к органической фазе, в которой содержится основание солифенацина, т.е. без предварительного выделения основания, например добавляя эквивалент насыщенного раствора L-винной кислоты в спирте к неочищенному основанию в неполярном растворителе. Выпавший гидротартрат солифенацина отфильтровывают и далее кристаллизуют обычным способом. Краткое описание чертежей Фиг. 1 представляет дифракционную рентгенограмму (1S)-(3R)-1-азабицикло[2.2.2]окт-3-ил-3,4 дигидро-1-фенил-2(1H)-изохинолинкарбоксилата гидротартрата,фиг. 2 - ИК-спектр (1S)-(3R)-1-азабицикло[2.2.2]окт-3-ил-3,4-дигидро-1-фенил-2(1 Н)-изохинолинкарбоксилата гидротартрата,фиг. 3 - 13 С ЯМР КП-ВМУ-спектр (13 С ЯМР-спектр с применением кросс-поляризации и вращения под магическим углом) (1S)-(3R)-1-азабицикло[2.2.2]окт-3-ил-3,4-дигидро-1-фенил-2(1H)-изохинолинкарбоксилата гидротартрата,фиг. 4 - кривую дифференциальной сканирующей калориметрии (ДСК) (1S)-(3R)-1-азабицикло[2.2.2]окт-3-ил-3,4-дигидро-1-фенил-2(1 Н)-изохинолинкарбоксилата гидротартрата.-2 015365 Примеры Основная методика примеров 1-6. 3(R)-Хинуклидол (0,1-0,15 ммоль) добавили к раствору 1(S)-этил-1-фенил-1,2,3,4-тетрагидро-2 изохинолинкарбоксилата (0,1 ммоль) в толуоле (25 мл). После нагревания до 90 С и полного растворения исходных реагентов к смеси добавили трет-бутилат калия (0-0,05 ммоль) при непрерывном перемешивании и полученную суспензию нагревали до кипения. Азеотропную смесь толуол-спирт постепенно отогнали из смеси. Реакция завершилась по достижении соответствующего превращения. За ходом реакции (превращением веществ) следили с помощью газовой хроматографии. Оптическую чистоту продукта определяли капиллярным электрофорезом. Результаты анализа продуктов, полученных в соответствии с примерами 1-6, приведены в таблице. Пример 7. 4 г солифенацина в форме основания, полученного по процедуре 6, содержащего 4,5% (1R)-(3R)-1 азабицикло[2.2.2]окт-3-ил-3,4-дигидро-1-фенил-2(1 Н)-изохинолинкарбоксилата, 1,4% (1S)-(3S)-1-азабицикло[2.2.2]окт-3-ил-3,4-дигидро-1-фенил-2(1 Н)-изохинолинкарбоксилата и 4,0% (1S)-фенил-1,2,3,4 тетрагидроизохинолина растворили в 30 мл метилэтилкетона. К раствору добавили эквивалент 3 М раствора хлороводорода в метаноле и смесь оставили кристаллизоваться при комнатной температуре. После фильтрования и промывания получили 42% солифенацина гидрохлорида, содержащего 1,7% (1R)-(3R)-1 азабицикло[2.2.2]окт-3-ил-3,4-дигидро-1-фенил-2(1H)-изохинолинкарбоксилата гидрохлорида, 0,6% (1S)(3S)-1-азабицикло[2.2.2]окт-3-ил-3,4-дигидро-1-фенил-2(1 Н)-изохинолинкарбоксилата гидрохлорида и 1,3% (1S)-фенил-1,2,3,4-тетрагидроизохинолина гидрохлорида. При кристаллизации продукта из метилэтилкетона было получено 58% солифенацина гидрохлорида, содержащего 0,9% (1H)-(3R)-1 азабицикло[2.2.2]окт-3-ил-3,4-дигидро-1-фенил-2(1 Н)-изохинолинкарбоксилата гидрохлорида, 0,4% (1S)(3S)-1-азабицикло[2.2.2]окт-3-ил-3,4-дигидро-1-фенил-2(1 Н)-изохинолинкарбоксилата гидрохлорида и 0,3% (1S)-фенил-1,2,3,4-тетрагидроизохинолина гидрохлорида. Пример 8. 3(R)-Хинуклидол (44,3 ммоль) добавили к раствору 1(S)-этил-1-фенил-1,2,3,4-тетрагидро-2 изохинолинкарбоксилата (36,7 ммоль) в 250 мл толуола. После нагревания до 90 С и полного растворения исходных реагентов к смеси при постоянном перемешивании добавили трет-амилат калия (7,4 ммоль), полученную суспензию нагрели до кипения. Азеотропную смесь толуол-спирт постепенно отогнали из смеси. Реакция завершилась после 3-часового кипячения, согласно ГХ конверсия составила 96%. К смеси добавили воду (100 мл), далее смесь перемешивали при комнатной температуре в течение 30 мин. После отделения слоя толуола в сепараторе, водный слой промыли толуолом (2100 мл). Объединенные органические фазы далее экстрагировали 150 мл разбавленной соляной кислоты (6,1 ммоль),фазу толуола промыли водой (2 50 мл). Затем водный экстракт подщелочили карбонатом калия (10,9 ммоль) и экстрагировали толуолом (3 100 мл). Органические слои промыли 100 мл воды, 50 мл солевого раствора, 50 мл воды и упарили в ротационном вакуумном испарителе, получив 12,7 г солифенацина в форме основания, содержащего следующие примеси (капиллярный электрофорез): 3,2% (1R)-(3R)-1 азабицикло[2.2.2]окт-3-ил-3,4-дигидро-1-фенил-2(1H)-изохинолинкарбоксилата, 1,1% (1S)-(3S)-1-азабицикло[2.2.2]окт-3-ил-3,4-дигидро-1-фенил-2(1H)-изохинолинкарбоксилата и 6,0% (1S)-фенил-1,2,3,4 тетрагидроизохинолина. Пример 9. Половину основания, полученного по примеру 8, растворили в 50 мл смеси метанол:2-пропанол(1:1), добавили раствор эквивалента L-винной кислоты в смеси метанол:2-пропанол (1:1), далее смесь оставили кристаллизоваться при комнатной температуре. После фильтрации и промывки получили 79% солифенацина гидротартрата, содержащего 1,1% (1R)-(3R)-1-азабицикло[2.2.2]окт-3-ил-3,4-дигидро-1 фенил-2(1 Н)-изохинолинкарбоксилата, 0,6% (1S)-(3S)-1-азабицикло[2.2.2]окт-3-ил-3,4-дигидро-1-фенил 2(1 Н)-изохинолинкарбоксилата и не содержащего (1S)-фенил-1,2,3,4-тетрагидроизохинолин. При кристаллизации продукта из смеси метанол:2-пропанол (3:4) получили 94% солифенацина гидротартрата,содержащего 0,6% (1R)-(3R)-1-азабицикло[2.2.2]окт-3-ил-3,4-дигидро-1-фенил-2(1 Н)-изохинолинкарбоксилата, 0,4% (1S)-(3S)-1-азабицикло[2.2.2]окт-3-ил-3,4-дигидро-1-фенил-2(1H)-изохинолинкарбоксилата. После второй кристаллизации из этанола получили 89% солифенацина гидротартрата, не содержащего-3 015365 примесей в детектируемых количествах. Продукт характеризовали следующими аналитическими методами: рентгенография, ИК и СР-МАСС 13 С ЯМР спектроскопия и ДСК. Пример 10. Вторую половину основания солифенацина, полученного по примеру 8, растворили в 15 мл 2 пропанола, добавили эквивалент янтарной кислоты в 55 мл 2-пропанола и смесь оставили кристаллизоваться при комнатной температуре. После фильтрации и промывки получили 66% солифенацина сукцината, содержащего 0,1% (1R)-(3R)-1-азабицикло[2.2.2]окт-3-ил-3,4-дигидро-1-фенил-2(1 Н)-изохинолинкарбоксилата, 0,7% (1S)-(3S)-1-азабицикло[2.2.2]окт-3-ил-3,4-дигидро-1-фенил-2(1 Н)-изохинолинкарбоксилата и 0,3% (1S)-фенил-1,2,3,4-тетрагидроизохинолина. При кристаллизации продукта из 2 пропанола получили 86% солифенацина сукцината, содержащего 0,41% (1R)-(3R)-1-азабицикло[2.2.2]окт-3-ил-3,4-дигидро-1-фенил-2(1H)-изохинолинкарбоксилата и 0,1% (1S)-фенил-1,2,3,4-тетрагидроизохинолина. После повторной кристаллизации из 2-пропанола получили 89% солифенацина сукцината, содержащего 0,17% (1R)-(3R)-1-азабицикло[2.2.2]окт-3-ил-3,4-дигидро-1-фенил-2(1 Н)-изохинолинкарбоксилата, 0,33% (1S)-(3S)-1-азабицикло[2.2.2]окт-3-ил-3,4-дигидро-1-фенил-2(1 Н)-изохинолинкарбоксилата и 0,07% (1S)-фенил-1,2,3,4-тетрагидроизохинолина. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения(1S)-(3R)-1-азабицикло[2.2.2]окт-3-ил-3,4-дигидро-1-фенил-2(1 Н)изохинолинкарбоксилата (солифенацина) или его фармацевтически приемлемых солей с высокой степенью оптической чистоты, характеризующийся тем, что неочищенное основание солифенацина переводят в гидротартрат, который затем, при необходимости, переводят в другую фармацевтически приемлемую соль или в основание солифенацина. 2. Способ по п.1, характеризующийся тем, что основание солифенацина переводят в гидротартрат,осуществляя взаимодействие с L-винной кислотой, и затем выделяют кристаллический гидротартрат солифенацина. 3. Способ по п.2, характеризующийся тем, что гидротартрат солифенацина далее перекристаллизовывают из полярного растворителя или смеси полярных растворителей, предпочтительно из группы С 1 С 4 спиртов или их смесей с водой. 4. Способ по пп.2 и 3, характеризующийся тем, что неочищенное основание солифенацина получают взаимодействием 1(S)-алкил-1-фенил-1,2,3,4-тетрагидро-2-изохинолинкарбоксилата, где под алкилом понимаются первичные С 1-С 4 алкилы, с 3-(R)-хинуклидолом в среде ненуклеофильного основания. 5. Способ по п.4, характеризующийся тем, что используют ненуклеофильное основание, выбранное из группы, включающей стерически затрудненные алкоголяты или амины, соединения лития или фосфазены. 6. Способ по п.5, характеризующийся тем, что используют трет-бутилат калия, натрия или лития. 7. Способ по п.5, характеризующийся тем, что используют трет-амилат калия или натрия. 8. Кристаллическая соль, представляющая собой гидротартрат солифенацина. 9. Кристаллическая соль по п.8, характеризующаяся рентгеновским спектром с характеристическими сигналами при следующих углах 2: 3,9; 11,6; 12,1; 13,9; 17,8; 19,5 и 24,50,2. 10. Кристаллическая соль по п.8, характеризующаяся кривой дифференциальной сканирующей калориметрии, имеющей одну эндотерму с пиком при 200 С, при скорости нагревания 10 С/мин. 11. Кристаллическая соль по п.8, характеризующаяся сигналами в спектре 13 С ЯМР в режиме кроссполяризации и вращения под магическим углом (13 С ЯМР КП-ВМУ) при 11,2; 19,6; 24,7; 27,1; 38,1; 45,8; 47,4; 52,9; 56,4; 70,1; 73,7; 75,3; 125,7; 127,9; 128,8; 133,7; 137,2; 145,2; 154,6; 177,0 м.д.
МПК / Метки
МПК: C07D 453/00
Метки: способ, солифенацина, получения
Код ссылки
<a href="https://eas.patents.su/7-15365-sposob-polucheniya-solifenacina.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения солифенацина</a>
Следующий патент: Производное триазола в качестве ингибитора hsp90