6,6′-диизопропил-8,8′-диметил-2,2′-динитро-3,3′-бис(трифторметил)- 3н,3′н-[9,9']ди[бензо(f)хроменил]-5,10,5′,10′-тетраол, обладающий противоопухолевой и противогрибковой активностью, и способ его получения
Номер патента: 15364
Опубликовано: 30.06.2011
Авторы: Антипин Михаил Ювенальевич, Узбеков Вячеслав Вадимович, Чкаников Николай Дмитриевич, Кадыров Александр Анатольевич, Смирнов Алексей Николаевич, Егоров Цезий Алексеевич, Каграманов Николай Дмитриевич, Салихов Шавкат Исмаилович, Гусев Дмитрий Васильевич, Вешкурова Ольга Николаевна, Рогожин Евгений Александрович, Штиль Александр Альбертович, Перегудов Александр Сергеевич, Калюжный Дмитрий Николаевич, Лысенко Константин Александрович, Дутикова Юлия Вячеславовна
Формула / Реферат
1. 6,6'-Диизопропил-8,8'-диметил-2,2'-динитро-3,3'-бистрифторметил-3Н,3'Н-[9,9']ди[бензо(f)хроменил]-5,10,5',10'-тетраол формулы
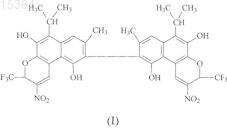
обладающий противоопухолевой и противогрибковой активностью.
2. Способ получения соединения по п.1, заключающийся во взаимодействии 2,2'-ди-(1,6,7-триокси-3-метил-5-изопропил-8-нафтальдегида с трифторнитропропеном при мольном соотношении 1:2 в диэтиловом эфире в качестве растворителя в присутствии катализатора триэтиламина при перемешивании при 20-25°С, с последующим осаждением полученного продукта гексаном и выделением конечного продукта.
Текст
Изобретение относится к новому конденсированному полициклическому соединению, обладающему противоопухолевой и противогрибковой активностью, а именно к 6,6'-8,8'-диметил-2,2'-динитро-3,3'-бис(трифторметил)-3 Н,3'Н[9,9']ди[бензо(f)хроменил]-5,10,5',10'-тетраолу формулы (I) и к способу его получения, который заключается во взаимодействии 2,2'-ди-(1,6,7-триокси-3-метил-5-изопропил-8 нафтальдегида (госсипола) с трифторнитропропеном при мольном соотношении 1:2 в диэтиловом эфире в качестве растворителя в присутствии катализатора триэтиламина при перемешивании при 20-25 С, с последующим осаждением полученного продукта гексаном и выделением конечного продукта. Т.пл. 181-183 С (с разл.). Выход 80%. Изобретение может найти применение в создании препаратов для медицины и сельского хозяйства. Гусев Дмитрий Васильевич, Кадыров Александр Анатольевич, Чкаников Николай Дмитриевич (RU), Вешкурова Ольга Николаевна,Узбеков Вячеслав Вадимович, Салихов Шавкат Исмаилович (UZ), Дутикова Юлия Вячеславовна, Штиль Александр Альбертович,Калюжный Дмитрий Николаевич, Перегудов Александр Сергеевич, Каграманов Николай Дмитриевич, Антипин Михаил Ювенальевич,Лысенко Константин Александрович, Смирнов Алексей Николаевич, Егоров Цезий Алексеевич, Рогожин Евгений Александрович (RU)(71)(73) Заявитель и патентовладелец: УЧРЕЖДЕНИЕ РОССИЙСКОЙ АКАДЕМИИ НАУК ИНСТИТУТ ЭЛЕМЕНТООРГАНИЧЕСКИХ СОЕДИНЕНИЙ ИМ. А.Н. НЕСМЕЯНОВА РАН (ИНЭОС РАН); РОССИЙСКАЯ ФЕДЕРАЦИЯ, ОТ ИМЕНИ КОТОРОЙ ВЫСТУПАЕТ МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ (RU) 015364 Изобретение относится к органической химии, конкретно к химий конденсированных полициклических соединений, содержащих оксигруппы, нитрогруппы и фторалкильные группы, а именно к новому соединению 6,6'-диизопропил-8,8'-диметил-2,2'-динитро-3,3'-бис(трифторметил)-3 Н,3-[9,9']ди[бензо(f) хроменил]-5,10,5',10'-тетраолу (АФБХ) формулы: обладающему противоопухолевой и противогрибковой активностью, и способу его получения. Изобретение может найти применение в фармакологии и медицине, в сельском хозяйстве и других областях, в частности, изобретение может быть использовано для создания лекарственных препаратов. Указанное соединение, его свойства и способ получения в литературе не описаны. Соединение содержит неизвестное ранее уникальное сочетание двух конденсированных трициклических систем, содержащих хроменовый фрагмент, двух трифторметильных групп, двух нитрогрупп и четырх гидроксильных групп, что позволяет рассматривать его как новый класс соединений, обладающих биологической активностью. Известны производные хроменов (бензопиранов), которые проявляют биологическую активность. Известен 3-нитро-2-гидрохромен, обладающий бактерицидной активностью против E.coli (кишечная палочка) и стафилококка (Dauzonne, D.; Royer, R.; Eur. J. Med. Chem. Chim. Ther., 19, 5; 1984; 477486), однако не имеется сообщений о его противоопухолевой или фунгицидной активности. Известен 7-гидрокси-3,6,8-тринитрохромен-2-он, обладающий противоопухолевой активностью(Finn, G.J.; Creaven, B.S.; Egan, D. A.; Eur. J. Pharm. Sci; 26; 1; 2005; 16 - 25). Однако данное соединение является труднодоступным, так как его получают трудомким многостадийным способом. Известно производное нафтохинона, содержащее хроменовый фрагмент, а именно 2,3-бис-(4 гидрокси-2-оксо-2-гидрохромен-3-ил)-[1,4]-нафтохинон, которое обладает активностью против вируса иммунодефицита человека (M.R. Boyd, e.a., US Pat 5,672,607). Указанное производное получают путем извлечения из экзотического растения Коноспермума эллиптического (Conospermum ellipticum), произрастающего только в некоторых регионах Австралии и Африки, причм способ его выделения является сложным и трудомким процессом. Известен противовирусный препарат Конвокурвон (тример 7-метил-7-(4-метилпент-3-енил)-7,8 дигидрофенантрен-1,4-диона), содержащий хроменовые фрагменты в своей структуре, который выделяют из растений или получают синтетически (K.W. Stagliano and H.C. Malinakova, J. Org. Chem. 1999, 64,8034-8040). Однако использование указанного вещества и включающих его композиций ограничено из-за его токсичности и недостаточной терапевтической эффективности. Кроме того, это соединение является-1 015364 труднодоступным, так как его получают многостадийным способом с невысокими выходами или выделяют из малораспространенных растений. Известен полифенольный сесквитерпен госсипол - 2,2'-Ди-(1,6,7-триокси-3-метил-5-изопропил-8 нафтальдегид)(Gossypolum) Госсипол является отходом переработки семян и корней хлопчатника и других растений семейства мальвовых (Malvaceae), в связи с чем существует потребность в утилизации госсипола и разработке новых способов его использования. Известно, что госсипол и ряд его производных обладают выраженными противовирусными и противоопухолевыми свойствами (Carruthers, N.J.; Dowd, M.K.; Stemmer, P.M., European Journal of Pharmacology, 555, 2-3, 2007, 106-114). Известен способ получения фторированных производных хроменов, конкретно трифторметилированного кумарина, взаимодействием тетрафторида серы с хроменилкарбоновой кислотой (Dmowski W.; Однако данный способ синтеза не технологичен из-за труднодоступности тетрафторида серы. Кроме того, данный способ не является селективным, что снижает выход конечного продукта. Известен способ получения трифторметильных производных хроменов взаимодействием Me3SiCF3(реактива Рупперта) или метилдифтор(фторсульфонил)ацетата с соединениями, содержащими бициклический хроменовый фрагмент (Wang Cai-Ling; Li Hong-Qi; Meng Wei-Dong; Qing Feng-Ling; Bioorganic Однако этот способ получения трифторметилированных хроменов требует использования труднодоступных исходных реагентов и дат невысокие выходы целевых продуктов. Известен способ получения фторсодержащих производных хроменов, заключающийся в ацилировании диметиламинонафталина ангидридом хлордифторуксусной кислоты с последующим взаимодействием полученного продукта с ароматическими альдегидами в присутствии тетрадиметиламиноэтилена и дальнейшей внутримолекулярной N-O заместительной циклизации. (Medebielle M.; Keirouz R.; Okada E.; Недостатками данного способа являются использование труднодоступных исходных фторсодержащих соединений и многостадийность процесса. Известен способ получения 3-нитро-2-трифторметил-2-гидрохроменов реакцией производных са-2 015364 лицилового альдегида с трифторнитропропеном в хлористом метилене (V.Yu. Korotaev, LB. Kutyashev,V.Ya. Sosnovskikh, Heteroatom Chemistry, 16, 6, 2005, 492-496). Этот способ позволяет получать фторированные производные хроменов в одну стадию, так как одновременно осуществляется циклизация с образованием бициклической хроменовой системы и введение фторсодержащей группы. Однако указанный способ известен только для производных салицилового альдегида, и не имеется сообщений о возможности осуществления способа с производными других ароматических альдегидов. Задачей настоящего изобретения является получение нового соединения - 6,6'-диизопропил-8,8'диметил-2,2'-динитро-3,3'-бис(трифторметил)-3 Н,3'Н-[9,9']-ди[бензо(f)хроменил]-5,10,5', 10'-тетраола (АФБХ) формулы I, обладающего противоопухолевой и противогрибковой активностью, и разработка нового способа его получения. Изобретение позволяет получать новое соединение - 6,6'-диизопропил-8,8'-диметил-2,2'-динитро 3,3'-бис(трифторметил)-3 Н,3'Н-[9,9']-ди[бензо(f)хроменил]-5,10,5',10'-тетраол, обладающее противоопухолевой и противогрибковой активностью - способом, позволяющим утилизировать отходы переработки хлопчатника (госсипол). Поставленная задача достигается новой структурой соединения формулы (I) и способом его получения, который заключается во взаимодействии 2,2'-ди-(1,6,7-триокси-3-метил-5-изопропил-8-нафтальдегида (госсипола) с трифторнитропропеном (II) при мольном соотношении 1:2 в диэтиловом эфире в качестве растворителя в присутствии катализатора триэтиламина и перемешивании при температуре 2025 С с последующим осаждением полученного продукта гексаном и выделением конечного продукта известными методами. Строение полученного соединения доказано с помощью 1 Н и 19F ЯМР и масс-спектроскопии и рентгеноструктурным анализом. Чистота продукта подтверждена данными элементного анализа. Способ осуществляют следующим образом: к раствору (+/-) госсипола в диэтиловом эфире прибавляют трифторметилнитропропен (II) при мольном соотношении реагентов 1:2 и перемешивают при 2025 С в течение часа. После прибавления нескольких капель триэтиламина раствор перемешивают до появления темно-красного окрашивания. Прибавляют воду, раствор перемешивают 2 ч и оставляют на ночь. Органический слой отделяют, сушат и концентрируют. Полученное соединение I в виде красного порошка осаждают из раствора гексаном. После перемешивания порошок отфильтровывают, промывают гексаном, сушат и выделяют. Выход полученного соединения составляет 80%. Т.пл. 181-183 С (с разложением). Соединение формулы I представляет собой красный порошок без запаха, хорошо растворимый в органических растворителях и нерастворимый в воде. Исходные соединения, необходимые для получения заявляемого соединения формулы I, представляют собой известные и коммерчески доступные вещества госсипол (CAS 303-45-7, SIGMAG8761),3,3,3-трифтор-1-нитропропен (Beilstein 1706332, CAS 371-96-0, 37468-00-1), триэтиламин (ГОСТ 996688), диэтиловый эфир (ГОСТ 22300), гексан (ГОСТ 2603-79), сульфат магния (ГОСТ 4523). Из анализа уровня техники видно, что существенным отличием заявляемого способа получения нового соединения - 6,6'-диизопропил-8,8'-диметил-2,2'-динитро-3,3'-бис(трифторметил)-3 Н,3'Н-[9,9']-ди[бензо(f)хроменил]-5,10,5',10'-тетраола - является использование в качестве исходного вещества госсипола (2,2'-ди-(1,6,7-триокси-3-метил-5-изопропил-8-нафтальдегида), что позволяет использовать доступное сырье и утилизировать отходы переработки хлопчатника. Кроме того, предлагаемый способ технологичен и приводит к неочевидному результату, в связи с чем можно утверждать, что заявляемое изобретение соответствует условию изобретательского уровня. Ниже приведн пример конкретного выполнения способа. Пример 1. Получение 6,6'-диизопропил-8.8'-диметил-2,2'-динитро-3.3'-бистрифторметил-3 Н, 3'Н[9,9']ди[бензо(f)хроменил]-5,10,5',10'-тетраола (I). К раствору 0,62 г (1,2 ммоль) (+/-) госсипола в 10 мл диэтилового эфира прибавляют 0,35 г (2,5 ммоль) трифторметилнитропропена и перемешивают при комнатной температуре в течение 1 ч. Затем прибавляют 4 капли триэтиламина и перемешивают до образования темно-красного раствора в течение 2 ч. В реакционную смесь прибавляют 1 мл воды, перемешивают еще 2 ч и оставляют на ночь при ком-3 015364 натной температуре. Органический слой отделяют, сушат сульфатом натрия и концентрируют (упаривают) до общего объема 5 мл. Прибавляют 20 мл гексана и перемешивают в течение 30 мин. Отфильтровывают выпавший в осадок красный порошок, промывают гексаном и сушат прокаленным сульфатом магния, получая 0,73 г указанного в заголовке соединения (I) (выход 80%). Т.пл.=181-183 С (с разложением). Найдено: С 57,01%; Н 3,87%; F 14,98%; N 3,72%. C36H30F6N2O10. Вычислено: С 56,55%; Н 3,95%; F 14,91%; N 3,66%. Спектры ЯМР соединения I CD3)2CO), , м.д. J, Гц): 1 Н ЯМР: 1,62; 1,63; 1,64 с, 6 Н, 2,16; 2,22; 2,28 уш.с. 1H, 4,01 уш.с. 1H, 5,63; 5,78; 5,86 уш.с. 1 Н, 6,05 уш.с. ОН, 6,23-6,48 м, 1H, 7,83; 7,85; 7,87 уш.с. 1H,9,75; 9,78 уш.с. ОН; 19F ЯМР: 0,11 д, J = 3,45 Гц; 0,46; 0,15 уш. с. Масс-спектр, m/z: 764 [M]+. Определение противоопухолевой и противогрибковой активности проводят по методикам, описанным ниже. Результаты представлены ниже в тексте описния и в табл. 1. Определение противоопухолевой активности Испытания на противоопухолевую активность проводили на модели линии рака толстой кишки человека НСТ 116. Соединение I растворяют в диметилсульфоксиде до концентрации 10 мМ; в день эксперимента готовят разведения соединений в культуральной среде (модифицированная Дальбекко среда Игла с добавлением 5% эмбриональной телячьей сыворотки, 2 мМ L-глутамина, 100 ЕД/мл пенициллина и 100 мкг/мл стрептомицина при 37 С, 5% CO2 в увлажненной атмосфере). Клетки рассевают в 96-луночные планшеты (Costar, США) (510 клеток в 200 мкл культуральной среды). В лунки вносят препарат в концентрациях 0-25 мкМ. Культуры инкубируют при 37 С, 5% CO2 до 72 ч. По окончании инкубации в лунки вносят 20 мкл 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия бромида, и планшеты инкубируют 3 ч. О жизнеспособности клеток судят по цветной реакции [14], развивающейся при восстановлении тетразолия в формазан дегидрогеназами митохондрий. Окраску регистрируют на спектрофотометре при длине волны возбуждения 540 нм. Оптическую плотность в лунках, где клетки инкубировали без нового соединения (контроль), принимают за 100%. Показатели оптической плотности в лунках с каждой концентрацией испытуемых препаратов усредняют и вычисляют процент выживших клеток при той или иной концентрации исследуемого соединения. Клетки инкубируют с соединением I (конечные концентрации 0-50 мкМ) в течение 72 ч. Установлено, что концентрация I, вызывавшая гибель 50% клеток (ИК 50), равна 4,6+1,0 мкМ. Для сравнения: определнная таким же методом цитотоксичность известных противоопухолевых препаратов цитозина арабинозида (цитозара) и цисплатина равна соответственно 8,2+1,7 мкМ и 11,0+2,5 мкМ. Определение противогрибковой активности. Метод чувствительности грибов и оомицетов к фунгицидам (www.frac.info) Подготовку чашек Петри проводят следующим образом: в расплавленном картофельно-глюкозном агаре (КГА) в количестве 96 мл диффузно растворяют тестируемое вещество в необходимой концентрации, после чего объем немедленно разливают в чашки по 4 мл в каждую до полного застывания среды. Затем с колоний грибов и оомицетов возрастом 10-14 дней производят нарезание агаровых блоков с мицелием площадью 100-120 мм 2, которые помещают в центр среды КГА каждой из чашек Петри диаметром 40 мм с различными концентрациями вещества. Инкубирование осуществляют при температуре 1822C в течение 72-192 ч в зависимости от биологических особенностей микроорганизмов. Каждый вариант засевают в трехкратной повторности. Оценку линейного роста мицелия грибов и оомицетов проводят с использованием бальной шкалы учета на средах с различными концентрациями тестируемого вещества. Определяют: а) подавляющую концентрацию - минимальная концентрация с отсутствием роста колонии (балл 0-1) - ИК 90-100; б) сдерживающую концентрацию - минимальная концентрация с резко ограниченным ростом (балл 1 А) - ИК 50. Интерпретацию полученных результатов проводят в случае развития колоний микроорганизмов в контрольных вариантах до уровня, соответствующего значению балла 3 рост колоний на момент учета более 30 мм в диаметре. Биологический материал. Микроорганизмы. В системе биологических испытаний были использованы следующие культуры грибов: a) Phoma betae штамм VKM F-2532, б) Pythium debaryanum штамм VKM F-1505, полученные из Всероссийской коллекции микроорганизмов (ВКМ) Института биохимии и физиологии микроорганизмов (ИБФМ) имени Г.К.Скрябина РАН в 2008 году; в) Botritys cinerea штамм СГР-1, выделенный из пораженных листьев декоративной розы в 2005 году; г) Phytophthora infestans штамм M1 выделенный из листьев картофеля сорта "Ильинский" в Лаборатории защиты растений РГАУ - МСХА имени К.А.Тимирязева в августе 2008 года.-4 015364 Таблица 1. Противогрибковая активность соединения (I) Интенсивность спороношения гриба на 40-50% слабее контрольного варианта. Кроме того, новое соединение формулы I проявляет высокую биологическую активность по отношению к ряду фитопатогенных грибов и оомицетов (табл. 1, пример 4). Исследуемое вещество проявило активность на четырех микроорганизмах: ИК 50 составила 48-96 мкг/мл, причем максимальный эффект(высокая активность) выражен на Ph.betae (ИК 90-100 = 120 мкг/мл) и B.cinerea (ИК 90-100 = 65 мкг/мл). Как видно из результатов, по отношению к Ph.betae и B.cinerea - высокой; на оомицеты действие соединенияI было аналогичным, причем на P.debaryanum биологический эффект был выше, чем на Phinfestans. Данные биологических испытаний показывают, что наличие противогрибковой активности у заявляемого соединения позволяет использовать его для создания новых фунгицидных препаратов для сельского хозяйства и медицины. Данные биологических испытаний показывают, что использование соединения (I) для подавления роста опухолевых клеток вызывает необратимую гибель клеток линии рака толстой кишки человека НСТ 116, Установлено, что концентрация соединения I, вызывающая гибель 50% клеток (ИК 50), равна 4,6+1,0 мкМ. Для сравнения: определнная таким же методом цитотоксичность известных противоопухолевых препаратов цитозина арабинозида (цитозара) и цисплатина равна соответственно 8,2+1,7 мкМ и 11,0+2,5 мкМ. Таким образом, заявляемое соединение формулы I обладает противоопухолевой активностью, оно токсично для вышеуказанных опухолевых клеток в диапазоне концентраций, принятых для современных противоопухолевых препаратов, а также проявляет противогрибковую активность. Свойства соединенияI позволяют использовать его в создании новых противоопухолевых лекарственных препаратов и противогрибковых средств. Предложен новый и легко реализуемый способ получения заявляемого соединения формулы I из доступных исходных реагентов, в частности госсипола, который является отходом переработки хлопчатника и реализация изобретения позволит решить актуальную практическую задачу утилизации госсипола. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. 6,6'-Диизопропил-8,8'-диметил-2,2'-динитро-3,3'-бистрифторметил-3 Н,3'Н-[9,9']ди[бензо(f) хроменил]-5,10,5',10'-тетраол формулы обладающий противоопухолевой и противогрибковой активностью. 2. Способ получения соединения по п.1, заключающийся во взаимодействии 2,2'-ди-(1,6,7-триокси-3 метил-5-изопропил-8-нафтальдегида с трифторнитропропеном при мольном соотношении 1:2 в диэтиловом эфире в качестве растворителя в присутствии катализатора триэтиламина при перемешивании при 20-25 С, с последующим осаждением полученного продукта гексаном и выделением конечного продукта.
МПК / Метки
МПК: A61P 31/10, C07D 311/92, A61P 35/00, A61K 31/352
Метки: получения, 6,6'-диизопропил-8,8'-диметил-2,2'-динитро-3,3'-бис(трифторметил, способ, обладающий, противоопухолевой, активностью, 3н,3'н-[9,9']ди[бензо(f)хроменил]-5,10,5',10'-тетраол, противогрибковой
Код ссылки
<a href="https://eas.patents.su/6-15364-66-diizopropil-88-dimetil-22-dinitro-33-bistriftormetil-3n3n-99dibenzofhromenil-510510-tetraol-obladayushhijj-protivoopuholevojj-i-protivogribkovojj-aktivnostyu-i-sposob-ego-poluch.html" rel="bookmark" title="База патентов Евразийского Союза">6,6′-диизопропил-8,8′-диметил-2,2′-динитро-3,3′-бис(трифторметил)- 3н,3′н-[9,9']ди[бензо(f)хроменил]-5,10,5′,10′-тетраол, обладающий противоопухолевой и противогрибковой активностью, и способ его получения</a>
Предыдущий патент: Агенты, специфически связывающие фактор роста гепатоцитов, и их применение
Следующий патент: Способ получения солифенацина
Случайный патент: Способ повышения давления газа, мембранный компрессор для его осуществления, распределитель потоков и устройство управления распределителем потоков










