Способ получения периндоприла и его солей
Формула / Реферат
1. Способ получения периндоприла формулы I или его фармацевтически приемлемых солей
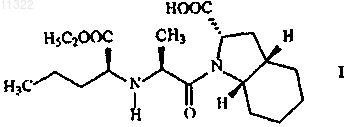
отличающийся тем, что хлорангидрид формулы III или его соль

подвергают реакции с (2S,3aS,7aS)-октагидроиндол-2-карбоновой кислотой формулы IV
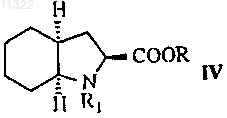
где R обозначает защитную группу, такую как бензиловая, трет-бутиловая, триметилсилиловая группа, или водород, a R1 обозначает водород,
с образованием соединения формулы V
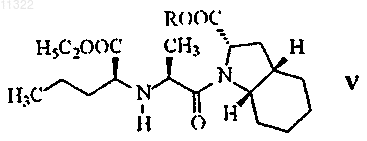
где R имеет значение, указанное выше,
которое, в случае если R не является водородом, преобразуют в периндоприл формулы I путем гидрогенолиза или гидролиза.
2. Способ по п.1, отличающийся тем, что хлорангидрид формулы III
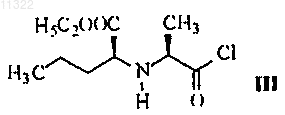
получают путем преобразования из N-((S)-1-карбетоксибутил)-L-аланина формулы II
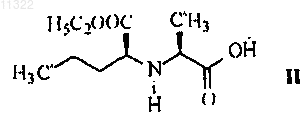
3. Способ по п.1, отличающийся тем, что в нем используют соль хлорангидрида формулы III.
4. Способ по п.3, отличающийся тем, что в нем используют гидрохлорид хлорангидрида III.
5. Способ по любому из пп.1-4, отличающийся тем, что реакцию образования пептидной связи проводят в присутствии основания в органических растворителях, таких как ацетон, ацетонитрил, диоксан, хлороформ, метиленхлорид, тетрагидрофуран.
6. Способ по любому из пп.1-5, отличающийся тем, что реакцию образования пептидной связи проводят при температуре от -20 до +20шС, предпочтительно при температуре от 0 до -20шС.
7. Соединение формулы III в форме его соли

8. Соединение по п.7 в форме его гидрохлорида.
9. Способ получения соединения по п.7 или 8, отличающийся тем, что в нем используют соединение формулы II и реагенты для получения хлоридов, такие как пентахлорид фосфора, трихлорид фосфора, фосфорилхлорид и тионилхлорид.
10. Способ получения соединения по п.7 или 8, отличающийся тем, что в нем используют соединение формулы II в форме соли, предпочтительно в форме гидрохлорида.
11. Способ по п.9 или 10, отличающийся тем, что реакцию проводят в инертном растворителе, предпочтительно в метиленхлориде.
12. Способ по любому из пп.9-11, отличающийся тем, что реакцию проводят при температуре от -30 до 30шС, предпочтительно от 0 до 10шС.
13. Способ получения периндоприла или его фармацевтически приемлемых солей, отличающийся тем, что в нем используют соединение по п.7 или 8.
14. Применение соединения по п.7 или 8 для получения периндоприла или его фармацевтически приемлемых солей.
Текст
011322 Настоящее изобретение относится к области органической химии, в частности, к способу получения периндоприла и к соли, используемой в качестве промежуточного соединения при синтезе периндоприла. Периндоприл, предпочтительно его трет-бутиламиновая соль, является соединением, обладающим способностью ингибировать ангиотензинпревращающий фермент (АПФ). Существует потребность в улучшенном способе синтеза периндоприла для использования в промышленных масштабах, с помощью которого можно достичь высокой чистоты и высокого выхода конечного продукта без образования нежелательных побочных продуктов. Периндоприл, химическое наименование которого (2S,3aS,7aS)-1-2S)-2-1S)-1-(этоксикарбонил) бутил)амино)-1-оксопропил)октагидро-1 Н-индол-2-карбоновая кислота, раскрыт в ЕР 49658. Описанный в этом источнике синтез является многостадийным процессом и включает разделение изомеров колоночной хроматографией. ЕР 308341 описывает улучшенный способ крупномасштабного синтеза периндоприла в форме третбутиламиновой соли. п-Толуолсульфоновую соль бензилового эфира (2S,3aS,7aS)-октагидроиндол-2 карбоновой кислоты и N-S)-1-карбетоксибутил)-L-аланин подвергают взаимодействию в присутствии триэтиламина, N,N-дициклогексилкарбодиимида и 1-гидроксибензотриазола. После завершения реакции получают бензиловый эфир периндоприла, который сжижают, подвергают лиофильной сушке и превращают в соль с трет-бутиламином в этилацетате. В WO 01/58868 раскрыто использование более низкого соотношения п-толуолсульфоновой соли бензилового эфира (2S,3aS,7aS)-октагидроиндол-2-карбоновой кислоты, N-S)-1-карбетоксибутил)-Lаланина, триэтиламина, N,N-дициклогексилкарбодиимида и 1-гидроксибензотриазола с целью уменьшить образование побочных продуктов реакции между бензиловым эфиром периндоприла и N,Nдициклогексилкарбодиимидом. Несмотря на низкое соотношение, побочные продукты все равно присутствуют. В WO 03/064388 раскрыт синтез периндоприла без побочных продуктов реакции с N,Nдициклогексилкарбодиимидом. Реакцию проводят между (2S,3aS,7aS)-октагидроиндол-2-карбоновой кислотой и хлоридом-N-S)-1-карбетоксибутил)-L-аланина, защищенного N-ацилом. Хлорангидрид получают с использованием тионил хлорида и предварительно защищенного N-S)-1-карбетоксибутил)-Lаланина. Недостатком указанного способа является низкий выход, получаемый после конденсации и удаления защитной группы, а именно всего лишь от 35 до 55%. Было неожиданно обнаружено, что с помощью настоящего изобретения, направленного на разработку метода синтеза периндоприла с использованием незащищенного-N-S)-1-карбетоксибутил)-Lаланина в форме его хлорангидрида или соли хлорангидрида можно избежать вышеупомянутых недостатков. К основным преимуществам настоящего изобретения относится получение периндоприла высокого качества и чистоты с высоким выходом без побочных продуктов. Подробное описание изобретения Изобретение относится, прежде всего, к способу получения периндоприла формулы I или его фармацевтически приемлемых солей характеризующегося тем, что хлорангидрид формулы III или его соль где R обозначает защитную группу, такую как бензиловая, трет-бутиловая, триметилсилиловая группа,или водород, a R1 обозначает водород,с образованием соединения формулы V-1 011322 где R имеет значение, указанное выше,которое, в случае если R не является водородом, преобразуют в периндоприл формулы I путем гидрогенолиза или гидролиза. После этой реакции периндоприл могут преобразовывать в желаемую соль. Предпочтительно, чтобы в конкретном случае реакции хлорангидрида формулы III с (2S,3aS,7aS)-октагидроиндол-2 карбоновой кислотой формулы IV R не являлся бензилом. Также предпочтительно, чтобы хлорангидрид формулы III был получен путем преобразования из N-S)-1-карбетоксибутил)-L-аланина формулы II Также было показано, что в способе по изобретению предпочтительно использовать соль хлорангидрида формулы III, предпочтительно гидрохлорид. Эти соли легче очищать, чем соединение III, благодаря чему можно использовать высокоочищенное исходное вещество. Это, в свою очередь, позволяет получить более чистый конечный продукт. Реакцию конденсации, т.е. образование пептидной связи между соединением формулы III и соединением формулы IV, предпочтительно проводить в органических растворителях, таких как ацетон, ацетонитрил, диоксан, хлороформ, метиленхлорид, тетрагидрофуран, предпочтительно в присутствии основания, при температуре от -20 до +20 С, предпочтительно при температуре от 0 до -20 С. Соединение формулы I и его фармацевтически приемлемые соли выделяют известными или обычными способами. Соединение можно выделить в форме трет-бутиламиновой соли, которая известна из ЕР 308341 и может существовать в виде различных полиморфных форм, таких как, например, раскрытые в WO 01/87835 (полиморфная форма альфа), WO 01/87836 (полиморфная форма бета) и WO 01/83439 (полиморфная форма гамма). Соединение I может быть также выделено в виде других фармацевтически приемлемых солей, таких как, например, аргининовая соль, раскрытая в WO 03/087050. Изобретение относится также к соединению формулы III в форме его соли. Эта соль предпочтительно представляет собой гидрохлорид. Соль по изобретению можно получить соответствующим преобразованием соединения III. Однако эту соль также можно получить непосредственно из соединения формулы II в форме соли,предпочтительно в форме гидрохлорида. Гидрохлорид соединения формулы II описан в Tetrahedron Lett. 1982, 23 (16) 1677-1680, Drug Designand Discovery 1992, 9 (1) 11-28 и в ЕР 1403278. Предпочтительно на первой стадии осуществлять преобразование соединения II, например, с использованием HCl в дихлорметане, в его соль, а затем преобразовывать эту соль в соединение III по изобретению. Соединение формулы III можно получить из N-S)-1-карбетоксибутил)-L-аланина, т.е. соединенияII, используя реагенты для получения хлоридов, такие как пентахлорид фосфора, трихлорид фосфора,хлористый фосфорил или хлористый тионил. Для получения хлорида можно использовать избыток реагента от 10 до 50%, причем реакцию обычно проводят в инертном растворителе, таком как метиленхлорид, при температуре от -30 до +30 С, предпочтительно от 0 до +10 С. Соединение формулы III в форме соли, предпочтительно в форме гидрохлорида, можно выделить частичным испарением растворителя и осаждением с помощью осаждающего реагента, такого как различные простые эфиры или углеводороды. Кроме того, изобретение также относится к способу получения периндоприла или его фармацевтически приемлемых солей, при котором используют соль по изобретению. Наконец, изобретение относится также к использованию соли по изобретению для получения периндоприла или его фармацевтически приемлемых солей. Публикации, относящиеся к реагентам, используемым в вышеупомянутых способах, приведены ниже. Производное L-аланина формулы II раскрыто в ЕР 308340, ЕР 308341, ЕР 309324, ЕР 1362845, ЕР-2 011322 1400431, ЕР 1400531, WO 01/56353 и WO 01/56972. Октагидроиндол-2-карбоновая кислота формулы IV хорошо известна из ЕР 37231, ЕР 308339, ЕР 308341, ЕР 1323729, US 5258525 и ЕР 1338591. Настоящее изобретение проиллюстрировано, но не ограничено следующими примерами. Примеры Пример 1. Получение гидрохлорида N-S)-1-карбетоксибутил)-L-аланил хлорида. К суспензии N-S)-1-карбетоксибутил)-L-аланина (13,2 г) в дихлорметане (80 мл) добавляли газообразный HCl при перемешивании при температуре от 20 до 25 С до получения прозрачного раствора. Прозрачный раствор охлаждали до температуры от -5 до 0 С, добавляли PCl5 (12,9 г) и продолжали перемешивание при той же температуре в течение следующих 5 ч. Приблизительно половину дихлорметана выпаривали из суспензии, добавляли диизопропиловый эфир (180 мл) и продолжали перемешивание при температуре от 10 до 25 С в течение следующего часа. Выпавшие в осадок кристаллы отфильтровывали и промывали диизопропиловым эфиром (90 мл). Получали гидрохлорид N-S)-1-карбетоксибутил)-L-аланилхлорида (15,1 г). Температурный интервал плавления 89-98 С (разложение), ИК (см-1): 2972, 1793, 1742, 1470 и 1206. 1 Н ЯМР (300 МГц, ДМСО-d6)0.90 (3 Н, t, J = 7.15 Гц), 1.24 (3 Н, t, J = 7.14 Гц), 1.40 (2 Н, m), 1.51(3 Н, d, J = 7.14 Гц), 1.86 (2 Н, m), 4.07 (2 Н, m), 4.21 (2 Н, m, J = 7.14 Гц) и 9.71 (2 Н, b). Пример 2. Получение периндоприла эрбумина (2-метилпропан-2-аминовой соли 2S,3aS,7aS)-12S)-2-1S)-1-(этоксикарбонил)бутил)амино)-1-оксопропил)октагидро-1 Н-индол-2-карбоновой кислоты). Триметилхлорсилан (2,86 мл) и триэтиламин (3,08 мл) добавили к (2S,3aS,7aS)-октагидроиндол-2 карбоновой кислоте (3,72 г) в дихлорметане (60 мл) при 20-25 С и перемешивали при 20-25 С в течение 2 ч. Через 2 ч туда добавляли триэтиламин (2,8 мл) и охлаждали суспензию до -15 С. Далее туда добавляли суспензию гидрохлорида N-S)-1-карбетоксибутил)-L-аланилхлорида (5,5 г) в дихлорметане (60 мл), предварительно охлажденную до -15 С, и продолжали перемешивание при -15 С в течение 2 ч. Реакционный раствор нагревали до 0 С, добавляли 25 мл раствора NaOH (0,8 г) и доводили рН до 4,2 с помощью 20% раствора NaOH. Органическую фазу отделяли, а водную фракцию повторно экстрагировали дихлорметаном (20 мл). Объединенные дихлорметановые фракции выпаривали, осадок растворяли в этилацетате (100 мл), нерастворившуюся часть отфильтровывали, а к фильтрату добавляли третбутиламин (2,2 мл). Осажденные кристаллы растворяли при температуре кипения раствора, прозрачный раствор охлаждали до 10-20 С и продолжали перемешивание в течение 2 ч. Спустя 2 ч осажденные кристаллы отфильтровывали, промывали этилацетатом (12 мл) и сушили при 35-40 С в воздушной сушилке. Получали периндоприл эрбумин (7,1 г; 80%) в форме , с чистотой более 99%, с содержанием отдельных примесей не более 0,1% каждой. Пример 3. Получение периндоприла эрбумина (2-метилпропан-2-аминовой соли 2S,3aS,7aS)-12S)-2-1S)-l-(этоксикарбонил)бутил)амино)-1-оксопропил)октагидро-1 Н-индол-2-карбоновой кислоты) с использованием изопропил ацетата. Триметилхлорсилан (2,92 мл) и триэтиламин (3,2 мл) добавляли к (2S,3aS,7aS)-октагидроиндол-2 карбоновой кислоте (3,72 г) в дихлорметане (40 мл) при 20-25 С и перемешивали при 20-25 С в течение 2 ч. Через 2 ч туда добавляли триэтиламин (2,77 мл), суспензию охлаждали до -15 С, туда же добавляли предварительно охлажденную до -15 С суспензию гидрохлорида N-S)-1-карбетоксибутил)-Lаланилхлорида (5,5 г) в дихлорметане (80 мл) и продолжали перемешивание при -15 С в течение 2 ч. Реакционный раствор нагревали до 0 С, осадок гидрохлорида триэтиламина отфильтровывали и промывали дихлорметаном (10 мл), затем добавляли к фильтрату 33 мл воды с растворенным в ней 0,8 г NaOH и затем рН доводили до 4,2 20% раствором NaOH. Органическую фазу отделяли, а водную фракцию дважды экстрагировали дихлорметаном (220 мл). Объединенные дихлорметановые фракции выпаривали,осадок растворяли в изопропилацетате (125 мл), нерастворившуюся часть отфильтровывали и добавляли к фильтрату трет-бутиламин (2,2 мл). Выпавшие в осадок кристаллы растворяли при температуре кипения раствора, прозрачный раствор охлаждали до 10-20 С и перемешивали в течение 2 ч. Через 2 ч выпавшие кристаллы отфильтровывали, промывали изопропилацетатом (15 мл) и сушили при 35-40 С в воздушной сушилке. Был получен периндоприл эрбумин (7.65 г; 86%) в форме а с чистотой более 99% с содержанием отдельных примесей не более 0,1% каждой. Пример 4. Получение периндоприл эрбумина (2-метилпропан-2-аминовой соли 2S,3aS,7aS)-12S)-2-1S)-1-(этоксикарбонил)бутил)амино)-1-оксопропил)октагидро-1 Н-индол-2-карбоновой кислоты) с использованием N,N-диметилформамида. Триметилхлорсилан (2,92 мл) и триэтиламин (3,2 мл) добавляли к (2S,3aS,7aS)-октагидроиндол-2 карбоновой кислоте (3,77 г) в дихлорметане (40 мл) при 20-25 С и перемешивали при 20-25 С в течение 2 ч. Через 2 ч добавляли триэтиламин (2,77 мл), суспензию охлаждали до -15 С, туда же добавляли предварительно охлажденную до -15 С суспензию гидрохлорида N-S)-1-карбетоксибутил)-L-аланилхлорида(5,5 г) в дихлорметане (40 мл) и перемешивали при -15 С в течение 2 ч. Реакционный раствор нагревали до 0 С, выпавший в осадок гидрохлоридтриэтиламин отфильтровывали и промывали дихлорметаном (10 мл), затем добавляли к фильтрату 33 мл воды с растворенным в ней NaOH (0,8 г), а затем доводили рН до 4,2 20% раствором NaOH. Органическую фазу отделяли, а водную фракцию дважды экстргировали дихлорметаном (220 мл). Объединенные дихлорметановые фракции выпаривали, остаток растворяли вN,N-диметилформамиде (90 мл). Нерастворившуюся часть отфильтровывали и добавляли к фильтрату трет-бутиламин (2,2 мл). Выпавшие в осадок кристаллы растворяли при 80 С, прозрачный раствор охлаждали до 10-20 С и перемешивали в течение 2 ч. Через 2 ч выпавшие в осадок кристаллы отфильтровывали, промывали N,N-диметилформамидом (9 мл) и сушили при 35-40 С в воздушной сушилке. Был получен периндоприл эрбумин (6,9 г; 78%) в формес чистотой более 99% с содержанием отдельных примесей не более 0,1% каждой. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения периндоприла формулы I или его фармацевтически приемлемых солей отличающийся тем, что хлорангидрид формулы III или его соль где R обозначает защитную группу, такую как бензиловая, трет-бутиловая, триметилсилиловая группа, или водород, a R1 обозначает водород,с образованием соединения формулы V где R имеет значение, указанное выше,которое, в случае если R не является водородом, преобразуют в периндоприл формулы I путем гидрогенолиза или гидролиза. 2. Способ по п.1, отличающийся тем, что хлорангидрид формулы III получают путем преобразования из N-S)-1-карбетоксибутил)-L-аланина формулы II 3. Способ по п.1, отличающийся тем, что в нем используют соль хлорангидрида формулы III. 4. Способ по п.3, отличающийся тем, что в нем используют гидрохлорид хлорангидрида III. 5. Способ по любому из пп.1-4, отличающийся тем, что реакцию образования пептидной связи проводят в присутствии основания в органических растворителях, таких как ацетон, ацетонитрил, диоксан,хлороформ, метиленхлорид, тетрагидрофуран. 6. Способ по любому из пп.1-5, отличающийся тем, что реакцию образования пептидной связи проводят при температуре от -20 до +20 С, предпочтительно при температуре от 0 до -20 С. 7. Соединение формулы III в форме его соли 8. Соединение по п.7 в форме его гидрохлорида. 9. Способ получения соединения по п.7 или 8, отличающийся тем, что в нем используют соединение формулы II и реагенты для получения хлоридов, такие как пентахлорид фосфора, трихлорид фосфора, фосфорилхлорид и тионилхлорид. 10. Способ получения соединения по п.7 или 8, отличающийся тем, что в нем используют соединение формулы II в форме соли, предпочтительно в форме гидрохлорида. 11. Способ по п.9 или 10, отличающийся тем, что реакцию проводят в инертном растворителе,предпочтительно в метиленхлориде. 12. Способ по любому из пп.9-11, отличающийся тем, что реакцию проводят при температуре от -30 до 30 С, предпочтительно от 0 до 10 С. 13. Способ получения периндоприла или его фармацевтически приемлемых солей, отличающийся тем, что в нем используют соединение по п.7 или 8. 14. Применение соединения по п.7 или 8 для получения периндоприла или его фармацевтически приемлемых солей.
МПК / Метки
МПК: A61P 9/12, C07D 209/42
Метки: периндоприла, получения, способ, солей
Код ссылки
<a href="https://eas.patents.su/6-11322-sposob-polucheniya-perindoprila-i-ego-solejj.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения периндоприла и его солей</a>
Предыдущий патент: Пробиотическая таблетка
Следующий патент: Добавка к алкогольному напитку и способ обработки алкогольного напитка
Случайный патент: Гербицидные соединения










