Способ простого получения (3-хлор-4-фторфенил)-[7-(3-морфолин-4-ил-пропокси)-6-нитрохиназолин-4 -ил] амина или (3-хлор-4-фторфенил)-[7-(3-морфолин-4-ил-пропокси)-6 -аминохиназолин-4-ил] амина
Формула / Реферат
1. Способ получения (3-хлор-4-фторфенил)-[7-(3-морфолин-4-илпропокси)-6-нитрохиназолин-4-ил]амина (I)
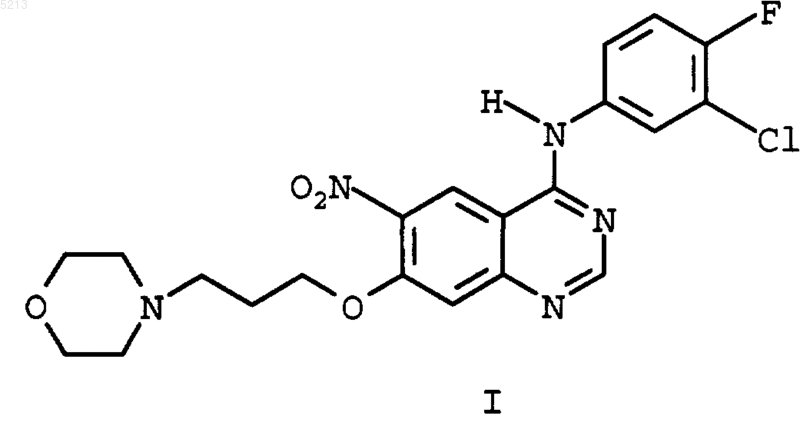
или (3-хлор-4-фторфенил)-[7-(3-морфолин-4-ил-пропокси)-6-аминохиназолин-4-ил]амина (VII)
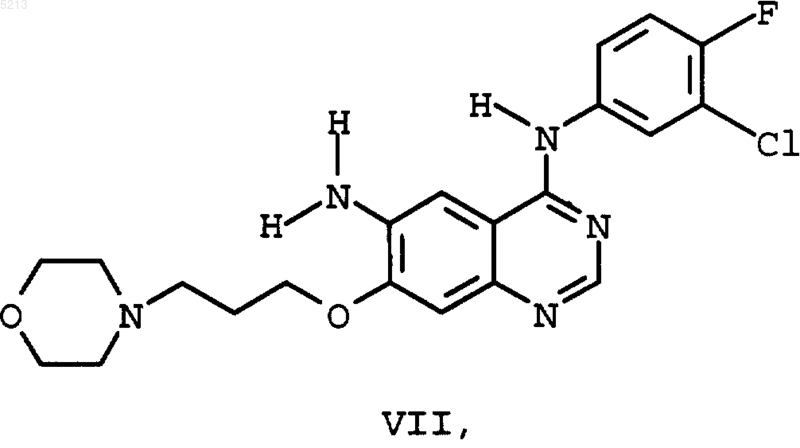
отличающийся тем, что в реакции, осуществляемой в одном реакционном сосуде в 3, соответственно 4 стадии, получают вначале 7-фтор-6-нитрохиназолин-4(3H)-он (III)
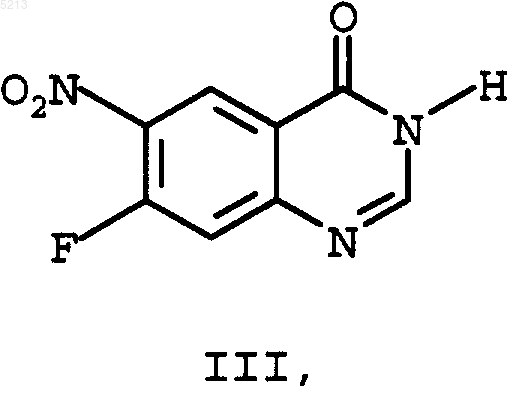
с помощью тионилхлорида превращают в 4-хлор-7-фтор-6-нитрохиназолин (IV)
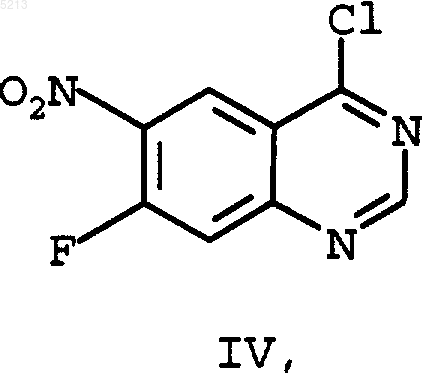
который с помощью 3-хлор-4-фторанилина превращают в 4-(3-хлор-4-фторанилино)-7-фтор-6-нитрохиназолин (V)
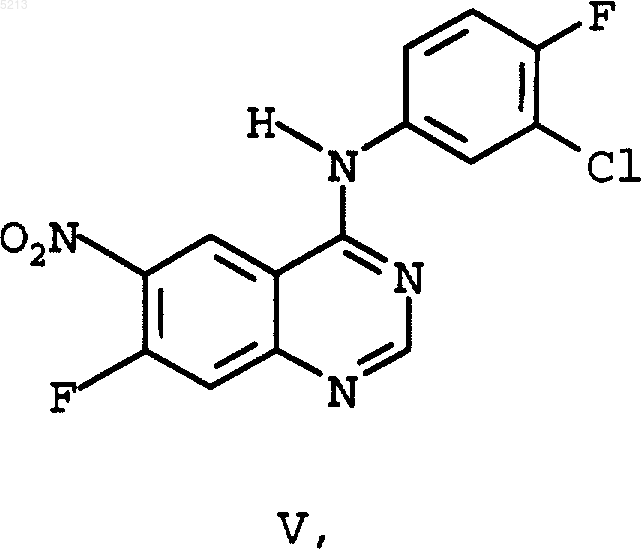
который в заключение с помощью 3-морфолин-4-илпропан-1-ола (VI)
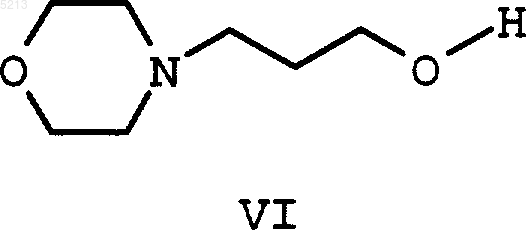
превращают в (I) и, при необходимости, (I) в реакционном растворе непосредственно гидрируют в (VII).
Текст
речь идет об основном соединении для получения дигидрохлорида N-[4-[(3-хлор-4-фторфе нил)амино]-7-[3-(4-морфолинил)пропокси]хиназолинил]-2-пропенамида (II) являющегося представителем нового класса высокоэффективных необратимых тирозинкиназа ингибиторов РФРЭ (рецепторов факторов роста эпидермиса), которые должны применяться для лечения различных опухолей, как, например, описано в WO 97/38983. У вышеназванных необратимых тирозинкиназа ингибиторов РФРЭ речь идет о замещенных 4-анилинохиназолинпроизводных, которые до сих пор частично можно было получить при синтезе с числом стадий до 12. Исходные стадии синтеза описаны в J. Med. Chem., 1996, 39,918-928 и WO 97/38983. Исходным материалом для синтеза до настоящего времени являлся изомерночистый 7 фтор-6-нитрохиназолин-4(3 Н)-он (III) который превращают без растворителя при 55 молярном избытке тионилхлорида при добавлении каталитических количеств ДМФ в 4-хлор-7 фтор-6-нитрохиназолин (IV) После отгонки тионилхлорида выпадающий в осадок сырьевой продукт 4-хлор-7-фтор 6-нитрохиназолин порциями подвергают взаимодействию с раствором 1 эквивалента 3-хлор 4-фторанилина и 2 эквивалентов высокотоксичного N,N-диметиланилина в 2-пропаноле. После 6-часового перемешивания при 25 С получают после обработки водой 4-(3-хлор-4-фторанилино)-7-фтор-6-нитрохиназолин (V) в диметилсульфоксиде (ДМСО) добавляют каплями раствор 3 эквивалентов триметилсиланолата калия в ДМСО и реакционную смесь перемешивают около 6 ч. После обработки водой получают(3-хлор-4-фторфенил)-[7-(3-морфолин-4-ил-пропокси)-6-нитрохиназолин-4-ил] амин (I) с примерно 89% выходом. Эта стадия синтеза оказалась особенно проблематичной, так как при увеличении состава были получены сильно колеблющиеся выходы и отчасти отчетливо меньшие выходы, чем описано выше. Реакции 4-(3-хлор-4-фторанилино)-7-фтор 6-нитрохиназолина(V) и 3-(4-морфолино)пропан-1-ола (VI) и твердого гидрида натрия в ТГФ (тетрагидрофуран), аналогично способу,описанному в WO 97/38983, также характеризуются неудовлетворительными результатами. Полученный (3-хлор-4-фторфенил)-[7-(3 морфолин-4-ил-пропокси)-6-нитрохиназолин-4 ил]амин (I) в заключение с помощью никеля Ренея в ТГФ, в качестве растворителя, гидрируют в (3-хлор-4-фторфенил)-[7-(3-морфолин-4 ил-пропокси)-6-аминохиназолин-4-ил]-амин который дальше превращают в (II), соответственно, его дигидрохлорид-тригидрат. Поэтому цель изобретения состояла в том,чтобы создать экономичный и технически осуществимый способ получения вышеназванных ключевых соединений (I), соответственно, (VII). При этом следовало 1) уменьшить количество используемого тионилхлорида,2) исключить применение высокотоксичного N,N-диметиланилина,3) заменить ДМСО более дешевым растворителем,4) заменить триметилсиланолат или гидрид натрия, 3 5) чтобы выходы реакций при образовании(I) и (VII) были постоянно хорошими,6) чтобы можно было пренебречь необходимостью каждый раз выделять отдельные соединения (IV), (V) и, при необходимости, (I). Поэтому предметом данного изобретения является объединение отдельных стадий реакции в реакцию, происходящую в одном сосуде. Неожиданно было обнаружено, что реакция хлорирования (III) с помощью тионилхлорида в (IV), превращение образованного хлорида (IV) с помощью 3-хлор-4-фторанилина в (V) и последующая реакция (V) с 3-морфолин-4-илпропан-1-олом (VI) с образованием ключевого соединения (I) происходят с очень хорошим общим выходом, причем отпадает необходимость выделять промежуточные соединения,что позволяет объединить в реакцию, происходящую в одном сосуде, с тремя стадиями реакции, как показано на схеме реакции (фиг. 1). Далее неожиданно было обнаружено, что нет необходимости в выделении соединения (I),и что реакционная смесь, полученная при вышеназванной реакции, происходящей в одном сосуде, может быть непосредственно использована для гидрирования в (VII), то есть мы имеем дело с реакцией, происходящей в одном сосуде,с 4 стадиями реакции. Далее при реакции хлорирования удалось уменьшить 55 молярный избыток тионилхлорида до 11,5 молярного избытка. После отгонки тионилхлорида остаточный тионилхлорид отгоняют многократно азеотропно с толуолом. При последней отгонке толуола отгонку толуола продолжают только до тех пор, чтобы оставался еще хорошо перемешиваемый крупнокристаллический остаток. Образованный таким образом хлорид (IV) очень чистый и в него непосредственно добавляют смесь тетрагидрофуран/третбутанол (7:3). Для дальнейшего протекания реакции добавление этой смеси тетрагидрофуран/трет-бутанол является очень важной. Неожиданно было обнаружено, что третбутиловый спирт, добавленный к реакционной смеси, катализирует нужную реакцию замещения. При последующей реакции хлорида (IV) с 3-хлор-4-фторанилином оказалось возможным заменить высокотоксичныйN,N-диметиланилин, обычно используемый для улавливания кислоты, на необходимый в 3-ей стадии реакции амин 3-морфолин-4-ил-пропан-1-ол (VI). После перемешивания в течение около 24 ч при комнатной температуре хлорид (IV) полностью превращается в производное анилина (V). Неожиданным для этой реакции оказалось то, что не реагировала спиртовая группа добавленного основания. К образовавшейся при этом суспензии от желтого до оранжевого цвета непосредственно добавляют раствор калий-третбутилат/ТГФ. При этом 3-морфолин-4-илпропан-1-ол (VI), добавленный на третьей ста 005213 4 дии для улавливания кислоты, снова переводят в свободное основание, которое затем в присутствии калий-трет-бутилата сразу желательным способом дальше реагирует с уже находящимся в реакционной смеси производным анилина (VI) с образованием нужного соединения (I), которое после резкого охлаждения смесью лед/этанол/соляная кислота получается с неожиданно хорошим общим выходом около 95%, с также неожиданной хорошей чистотой 98 %. Это очень хорошее протекание реакции было тем более неожиданным, что находящийся в реакционной смеси, а также вновь образующийся третбутиловый спирт не реагировал аналогично тому,как 3-морфолин-4-ил-пропан-1-ол (VI) реагировал с(V) с образованием соответствующего третбутилового эфира. Кроме того, неожиданным оказалось то,что используемые для таких реакций замещенияOrg. Chem., 59, 21, 1994, 6194-6199) или калийтриметилсилонат могут быть заменены на доступный калий-трет-бутилат. Неожиданно оказалось, что выпадающий из реакционной смеси продукт (I) имеет такую высокую чистоту, что реакционный раствор можно без выделения (I) напрямую использовать для последующего гидрирования. Пример 1. Реакция, проводимая в одном сосуде, для получения (3-хлор-4-фторфенил)-[7-(3-морфолин-4-ил-пропокси)-6-нитрохиназолин-4-ил]амина (I). 150 г 7-фтор-6-нитрохиназолин-4(3 Н)-она(III) суспензируют в 600 мл тионилхлорида и после добавления 6 мл ДМФ кипятят в течение 24 ч с обратным холодильником. При этом образуется прозрачный раствор. В вакууме отгоняют около 350 мл тионилхлорида. К образующейся суспензии с крупными кристаллами добавляют около 600 мл толуола. В вакууме отгоняют около 800 мл. Эту перегонку повторяют еще 3 раза каждый раз с 600 мл свежего толуола. При последней перегонке толуол отгоняют насколько возможно. Остается суспензия с крупными кристаллами, которая постоянно остается хорошо перемешиваемой. К почти сухому остатку добавляют 1,2 л смеси тетрагидрофуран/трет-бутанол (7:3). Образовавшуюся суспензию охлаждают до примерно 10 С. При хорошем перемешивании и охлаждении добавляют каплями в течение 20 мин раствор из 114 г 3-хлор-4-фторанилина и 258 г 3-морфолин-4-ил-пропан-1-ола (VI) в 300 мл смеси ТГФ/трет-бутанол (7:3) так, что температура в реакторе остается между 10 и 15 С. Вначале желтоватая суспензия в ходе добавления капель становится более жидкой и перекрашивается в оранжевый цвет. 5 Реакционную смесь оставляют, чтобы она медленно достигла комнатной температуры, и в заключение перемешивают, как минимум, 24 ч при комнатной температуре. К желто-оранжевой суспензии добавляют каплями при хорошем перемешивании и небольшом охлаждении в течение 20 мин раствор 324 г калий-трет-бутилата в 1,86 л тетрагидрофурана так, что температура в реакторе остается между 15 и 20 С. После добавления примерно 1/3 раствора калий-трет-бутилат/ТТФ вся реакционная смесь становится тмно-красной. После последующего перемешивания в течение около 30 мин реакционную смесь сразу примешивают к смеси, состоящей из 5,4 кг льда,6,0 л этанола и 1,8 л соляной кислоты (рН раствора около 8). При этом сразу образуется желто-оранжевый раствор. После недолгого перемешивания выкристаллизовывается желтый продукт. Образовавшуюся суспензию перемешивают около 5 ч при температуре около 0 С и в заключение отсасывают. Осадок, остающийся на фильтре, 2 раза промывают каждый раз 500 мл этанола, охлажденного до температуры льда. Продукт помещают в сушильный шкаф с циркуляцией воздуха и предварительно сушат при 40 С и в заключение досушивают при 60 С до постоянства веса.(Выход: 316,5 г = 95,5 %; чистота, согласно жидкостной хроматографии на приборе Хьюлетт-Паккард: 98,48 отн. %; Н 2O (K.F.): 3,69 %;(III) суспензируют в 80 мл тионилхлорида и после добавления 20 капель ДМФ кипятят в течение 24 ч с обратным холодильником. При этом образуется прозрачный раствор. В вакууме отгоняют около 60 мл тионилхлорида. К образующейся суспензии с крупными кристаллами добавляют около 60 мл толуола. В вакууме отгоняют около 60 мл. Эту перегонку повторяют еще 3 раза каждый раз с 60 мл свежего толуола. При последней перегонке толуол отгоняется насколько возможно. Остается суспензия с крупными кристаллами, которая постоянно остается хорошо перемешиваемой. К почти сухому остатку добавляют 160 мл смеси тетрагидрофуран/трет-бутанол (7:3). Образовавшуюся суспензию охлаждают до примерно 10 С. При хорошем перемешивании и охлаждении добавляют каплями в течение 20 мин раствор из 15,2 г 3-хлор-4-фторанилина и 34,4 г 3-морфолин-4-ил-пропан-1-ола (VI) в 40 мл смеси ТГФ/трет-бутанол (7:3) так, что температура в реакторе остается между 10 и 15 С. Вначале желтоватая суспензия в ходе добавле 005213 6 ния капель становится более жидкой и перекрашивается в оранжевый цвет. Реакционную смесь оставляют, чтобы она медленно достигла комнатной температуры, и в заключение перемешивают, как минимум, 24 ч при комнатной температуре. К желто-оранжевой суспензии добавляют каплями при хорошем перемешивании и небольшом охлаждении в течение 20 мин раствор 43,2 г калий-трет-бутилата в 250 мл тетрагидрофурана так, что температура в реакторе остается между 15 и 20 С. После добавления примерно 1/3 раствора калий-трет-бутилат/ТТФ вся реакционная смесь становится тмно-красной. После последующего перемешивания в течение около 30 мин к реакционной смеси при 05 С примешивают смесь, состоящую из 20 мл соляной кислоты и 30 мл воды, и разбавляют дополнительными 200 мл ТГФ. После 20 минутного перемешивания в ледяной бане реакционная смесь фильтруется до прозрачности через 50 г целита. Отфильтрованный осадок промывают 100 мл ТГФ. К фильтрату добавляют 31 г никеля Ренея и при комнатной температуре в течение 3 ч гидрируют водородом при давлении 3,5 бар. После отсасывания из катализатора фильтрат высушивают до сухого и остаток перемешивают с 80 мл этанола при около 2 С. Выпадающий продукт отсасывают и промывают небольшим количеством охлажденного этанола. После высушивания в сушильном шкафу с циркуляцией воздуха при 60 С получают 32,1 отличающийся тем, что в реакции, осуществляемой в одном реакционном сосуде в 3, соответственно 4 стадии, получают вначале 7-фтор 6-нитрохиназолин-4(3 Н)-он (III) превращают в (I) и, при необходимости, (I) в реакционном растворе непосредственно гидрируют в (VII). с помощью тионилхлорида превращают в 4 хлор-7-фтор-6-нитрохиназолин (IV)
МПК / Метки
МПК: C07D 239/94
Метки: аминохиназолин-4-ил, простого, амина, 3-хлор-4-фторфенил)-[7-(3-морфолин-4-ил-пропокси)-6-нитрохиназолин-4, получения, ил, 3-хлор-4-фторфенил)-[7-(3-морфолин-4-ил-пропокси)-6, способ
Код ссылки
<a href="https://eas.patents.su/5-5213-sposob-prostogo-polucheniya-3-hlor-4-ftorfenil-7-3-morfolin-4-il-propoksi-6-nitrohinazolin-4-il-amina-ili-3-hlor-4-ftorfenil-7-3-morfolin-4-il-propoksi-6-aminohinazolin-4-il-amina.html" rel="bookmark" title="База патентов Евразийского Союза">Способ простого получения (3-хлор-4-фторфенил)-[7-(3-морфолин-4-ил-пропокси)-6-нитрохиназолин-4 -ил] амина или (3-хлор-4-фторфенил)-[7-(3-морфолин-4-ил-пропокси)-6 -аминохиназолин-4-ил] амина</a>
Предыдущий патент: Азаиндолы
Следующий патент: Галоидпроизводные 9-деоксо-9а-аза-9а-гомоэритромицина а
Случайный патент: Антигенсвязывающие белки, связывающие c-fms человека









