Ингибитор вторичной катаракты.
Формула / Реферат
1. Фармацевтическая композиция для предотвращения или лечения вторичной катаракты, включающая активный ингредиент и фармацевтически приемлемый носитель, отличающаяся тем, что в качестве активного ингредиента используют N-(3,4-диметоксициннамоил)антраниловую кислоту, представленную формулой
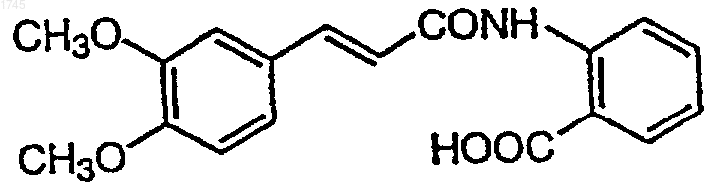
или ее фармацевтически приемлемую соль.
2. Способ профилактики или лечения вторичной катаракты, который включает введение N-(3,4-диметоксициннамоил)антраниловой кислоты, представленной формулой

или ее фармацевтически приемлемой соли.
3. Применение N-(3,4-диметоксициннамоил)антраниловой кислоты, представленной формулой
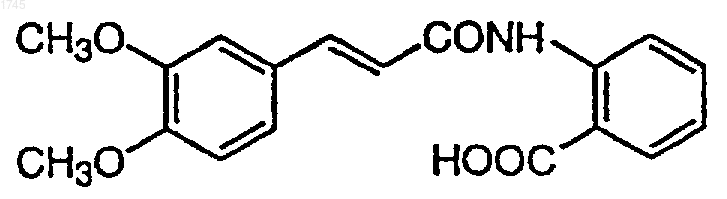
или ее фармацевтически приемлемой соли для получения фармацевтической композиции для профилактики или лечения вторичной катаракты.
4. Применение N-(3,4-диметоксициннамоил)антраниловой кислоты, представленной формулой
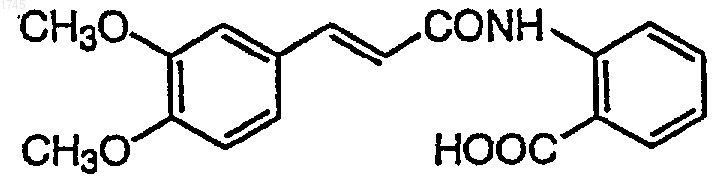
или ее фармацевтически приемлемой соли в качестве ингибитора катаракты.
Текст
1 Данное изобретение относится к фармацевтической композиции, которую можно использовать в качестве ингибитора вторичной катаракты. Особенно данное изобретение относится к ингибитору вторичной катаракты после хирургической операции по поводу катаракты, причем ингибитор включает в качестве активного ингредиента N-(3,4-диметоксициннамоил)антраниловую кислоту, представленную формулой или ее фармацевтически приемлемую соль. Катаракта представляет собой неподдающуюся лечению глазную болезнь, которая протекает и развивается под действием различных факторов и впоследствии ведет к пониженному зрению вследствие помутнения хрусталика. Большинство катаракт является возрастной сенильной (старческой) катарактой. Считается,что распространенность катаракты составляет 60-70% у шестидесятилетних и почти 100% у восьмидесятилетних или более старых людей. При развитии общества, состоящего главным образом из пожилого населения, профилактика и лечение катаракты в будущем будет становиться более важной проблемой. Однако в настоящее время не существует надежного терапевтического агента, оказывающего ингибирующее действие на развитие катаракты. Следовательно, желательна разработка такого эффективного терапевтического агента. В соответствии с этим, в настоящем состоянии лечение катаракты в конце концов будет зависеть от коррекции зрения с использованием глазных очков, контактных линз и так далее или хирургических операций, таких как введение внутриглазного хрусталика в капсулу хрусталика после экстракапсулярного извлечения катаракты. В хирургии катаракты в качестве проблемы, появляющейся после хирургии, отмечается вторичная катаракта. Эта вторичная катаракта означает помутнение на поверхности оставшейся задней капсулы после экстракапсулярного извлечения катаракты. Механизм вторичной катаракты в основном следующий. После эксцизии эпителиальных клеток хрусталика (передней капсулы) вторичная катаракта является результатом миграции и пролиферации остаточных эпителиальных клеток хрусталика, которые не полностью удаляют во время извлечения наружного покрова хрусталика, на задней капсуле, что приводит к помутнению задней капсулы. Кроме того, вторичная катаракта является результатом аномальной пролиферации остаточных эпителиальных клеток хрусталика в экваторе хрусталика с последующим образованием гранул Elschnig. При хирургии катаракты невозможно удалить эпителиальные клетки полностью и, следовательно, трудно совершенно предотвратить 2 появление вторичной катаракты. Сообщается,что частота появления указанного выше помутнения задней капсулы составляет 40-50% у афакических глаз и 7-20% у псевдоафакических глаз. С другой стороны, в области лекарственной терапии катаракты активно проводились экстенсивные исследования с целью найти вещества, способные ингибировать вторичную катаракту. Вплоть до этого времени, например,было подтверждено, что эффективны метаболические антагонисты, такие как митомицин, дауномизин, 5-FU и колхицин. Однако эти лекарственные средства вызывали серьезные побочные действия [Atarashii Ganka, Vol. 12,3, рр 451452 (1995); Japanese Journal of Ophthalmic Surgery, Vol. 8,3, рр 439-446 (1995)], которые не позволяли их использование в клинике. Кроме того, сообщалось, что образование вторичной катаракты значительно ингибировалось, когда вставленные внутриглазные хрусталики были покрыты индометацином, а также, что этилендиаминтетрауксусная кислота (ЭДТУ) эффективна в отношении вторичной катаракты (Japanese Journal of Ophthalmic Surgery, Vol. 8,3.,pp. 439-446 (1995); IOR and RS, Vol. 19,2, pp. 78-82 (1995); Japanese Patent Application Publication (kokai)Hei. 8-175984]. Однако все же не были разработаны клинически удовлетворительные лекарственные средства, предотвращающее и ингибирующие образование вторичной катаракты.(I) данного изобретения, широко использовали в качестве лекарственных средств для лечения аллергических нарушений, таких как бронхиальная астма, аллергический ринит, атонический дерматит и аллергический конъюнктивит и кожные нарушения, такие как келоидный рубец и гипертрофический рубец. Было известно, например, что траниласт оказывает ингибирующее действие на высвобождение химического медиатора, вызванное аллергической реакцией,избыточное аккумулирование коллагена фибробластными клетками и избыточную пролиферацию клеток гладких мышц в коронарных артериальных сосудах. Однако не было известно, что траниласт ингибирует образование вторичной катаракты и может использоваться в качестве ингибитора вторичной катаракты. Данное изобретение относится к ингибитору вторичной катаракты, который включает в качестве активного ингредиента или ее фармацевтически приемлемую соль. 3 Данное изобретение относится к способу профилактики или лечения вторичной катаракты, который включает введение N-(3,4 диметоксициннамоил)антраниловой кислоты,представленной приведенной выше формулой(I), или ее фармацевтически приемлемой соли. Данное изобретение относится также к применениюN-(3,4-диметоксициннамоил) антраниловой кислоты, представленной приведенной выше формулой (I), или ее фармацевтически приемлемой соли для приготовления фармацевтической композиции для профилактики или лечения вторичной катаракты. Кроме того, данное изобретение относится к применению N-(3,4-диметоксициннамоил)антраниловой кислоты, представленной приведенной выше формулой (I), или ее фармацевтически приемлемой соли в качестве ингибитора вторичной катаракты. Авторами данного изобретения было проведено обширное исследование для выявления соединений, оказывающих ингибирующее действие на образование вторичной катаракты. В результате этого было обнаружено, что N-(3,4 диметоксициннамоил)антраниловая кислота,представленная приведенной выше формулой(I), оказывает заметное ингибирующее действие на пролиферацию, эпителиальных клеток хрусталика и чрезвычайно полезна в качестве ингибитора вторичной катаракты, тем самым образуя основу данного изобретения. В соответствии с этим, авторы данного изобретения подтвердили, что траниласт значительно подавлял пролиферацию эпителиальных клеток хрусталика в испытании in vitro с использованием эпителиальных клеток хрусталика крыс для подтверждения ингибирующего действия на пролиферацию клеток. В результате этого траниласт оказывает превосходное ингибирующее действие на пролиферацию эпителиальных клеток хрусталика и представляет собой соединение, очень полезное в качестве ингибитора вторичной катаракты. Следовательно, фармацевтические композиции, которые можно использовать в качестве ингибиторов вторичных катаракт, можно получить включением в качестве активного ингредиента траниласта или его фармацевтически приемлемой соли. Известны различные способы получения траниласта и его солей, которые являются активными ингредиентами, эти соединения можно легко получить способами, описанными в литературе и тому подобное (публикация заявки на патент Японии (kokoku)56-40710; ibid.Hei. 01-50219; ibid.Hei. 03-3753 и так далее). В качестве примеров фармацевтически приемлемых солей траниласта можно указать соли с неорганическими основаниями, такие как 4 соль натрия и соль калия, соли, образованные с органическими аминами, такими как морфолин,пиперазин и пирролидин, и соли, образованные с аминокислотами. При применении фармацевтических композиций данного изобретения в практическом лечении, в зависимости от способа их применения, можно использовать различные лекарственные формы фармацевтических композиций. В качестве предпочтительных можно указать глазные капли, инъекции, глазные мази или способы, такие как имплантация после включения в гранулу или микрокапсулу и введение после предварительного покрытия внутриглазного хрусталика. Фармацевтические композиции можно изготовить смешиванием, разбавлением или растворением, иногда с подходящими фармацевтическими добавками, такими как наполнители,дезинтегрирующие средства, связующие, смазывающие вещества, разбавители, буферы,средства для установления изотоничности, антисептики, увлажняющие агенты, эмульгаторы,диспергирующие агенты, стабилизирующие агенты и вспомогательные средства для растворения в соответствии с общепринятыми способами и получить препаративную форму обычным образом в зависимости от лекарственных форм. Например, глазные капли можно изготовить растворением траниласта или фармацевтически приемлемой соли вместе с основным веществом при нагревании в стерилизованной воде, в которой растворяется поверхностноактивное вещество, добавлением поливинилпирролидона, необязательным добавлением подходящих фармацевтических добавок, таких как консервант, стабилизирующий агент, буфер,агент для установления изотоничности, антиоксидант и средство для улучшения вязкости, и достижением полного растворения. Инъекции можно делать непосредственно в пораженные ткани, такие как роговица, хрусталик и стекловидное тело или соседние с ними ткани, с использованием тонкой иглы, их можно также использовать в качестве внутриглазного перфузата. Фармацевтические композиции данного изобретения можно ввести в виде препаратов пролонгированного действия. Например, траниласт или его соль вводят в гранулу или микрокапсулу полимера с длительным высвобождением в качестве носителя и гранулу или микрокапсулу хирургическим образом имплантируют в ткани, которые нужно лечить. Траниласт или его соль можно также применять путем включения в предварительно трансплантированного внутриглазного хрусталика. В качестве примеров полимеров с длительным высвобождением указываются сополимер этиленвинилацетат,полигидрометакрилат, полиакриламид, поливинилпирролидон, метилцеллюлоза, полимер 5 молочной кислоты, сополимер молочной и гликолевой кислот и тому подобное, предпочтителен биоразлагаемый полимер, такой как сополимер молочной гликолевой кислоты. При использовании фармацевтических композиций согласно данному изобретению в практическом лечении, дозу траниласта или его фармацевтически приемлемой соли в качестве активного ингредиента выбирают в зависимости от массы тела, возраста, пола, степени симптомов каждого пациента, которого нужно лечить. Например, при закапывании в глаза эти соединения вводят приблизительно в интервале от 10 мкг до 50 мг в день для взрослого человека. Дозу траниласта или его фармацевтически приемлемой соли можно повысить или понизить в зависимости от состояния каждого пациента,которому необходимо лечение. Данное изобретение далее иллюстрируется следующими примерами. Пример. Ингибирующее действие на пролиферацию эпителиальных клеток хрусталика. 1) Культура эпителиальных клеток хрусталика крысы. Вынимают хрусталик крысы и нарезают его на узкие полоски. Полоски приклеивают к культуральному планшету и пересевают в модифицированной по способу Дульбекко среде Игла (DMEM), содержащей 10% фетальную телячью сыворотку (ФТС), при 37 С в атмосфере воздуха с 5% CO2 в течение 4 дней. После 4 дней (в точке, когда эпителиальные клетки хрусталика мигрировали из ткани хрусталика и пролиферировали), среду отсасывают и клетки осторожно промывают забуференным фосфатом солевым раствором (PBS(-. Затем РВS(-) отсасывают, к культуральному планшету добавляют аликвоту 0,25% раствора трипсина, содержащего 0,02% ЭДТУ, и морфологию клеток изучают фазово-контрастной микроскопией. Когда клетки округляются, действие трипсина останавливают добавлением к раствору равного количества DMEM, содержащего 10% ФТС. Прикрепленные клетки собирают с планшета пипетированием среды с использованием тонкой пастеровской пипетки. Суспензию клеток переносят в слюну, затем к слюне добавляют среду и суспензию клеток энергично смешивают 20 раз пипетированием пастеровской пипеткой и центрифугируют при 100-110 х г в течение 1 мин. После выгрузки супернатанта к осадку добавляют свежую среду и суспензию эпителиальных клеток хрусталика получают пипетированием с использованием пастеровской пипетки. Суспензию далее пересевают в DMEM, содержащей 10% ФТС, для использования в эксперименте. 2) Получение испытуемых лекарственных средств. Траниласт добавляют к 1% водному раствору бикарбоната натрия для получения 1,0% раствора и растворяют нагреванием при 70 С. Раствор стерилизуют миллипоровым фильтром 6 и разбавляют DMEM, содержащим 10% ФБС, до конечной предварительно описанной концентрации. 3) Экспериментальный способ. Суспензию клеток (2104 клеток/0,1 мл) и среду DMEM (1,9 мл), содержащую разные концентрации траниласта и 10% ФБС, добавляют в культуральную планшету (60 мм) и культивируют при 37 С в атмосфере воздуха с 5% CO2. Через 4 дня среду отсасывают, клетки промывают PBS(-) и к планшету добавляют 1 мл 0,25% раствора трипсина, содержащего 0,02% ЭДТУ. После сбора клеток из планшета пипетированием с использованием пастеровской пипетки число живых клеток подсчитывают с использованием гемоцитометра. 4) Оценка действия. Была вычислена средняя и стандартная величина отклонения для каждой группы. Статистический анализ значимости проведен однофакторным дисперсионным анализом и подтверждена статистическая значимость. Согласно этому, анализ значимости между группами выполняли множественным тестом Dunnett. 5) Результаты. Как показано на чертеже, траниласт значительно подавляет пролиферацию эпителиальных клеток в зависимости от концентрации. Краткое описание чертежа Чертеж представляет собой график, илллюстрирующий ингибирующее действие траниласта на пролиферацию эпителиальных клеток хрусталика. Ось ординат показывает число эпителиальных клеток хрусталика крыс ( 104 клеток) и ось абсцисс показывает концентрации траниласта, которые были добавлены (мкг/мл). Символыив графике показывают значительное различие при р 0,05 и р 0,01, соответственно. Фармацевтическая композиция, включающая в качестве активного ингредиента траниласт или его фармацевтически приемлемую соль, оказывает заметное ингибирующее действие на пролиферацию эпителиальных клеток хрусталика и пригодна в качестве ингибитора вторичной катаракты. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция для предотвращения или лечения вторичной катаракты,включающая активный ингредиент и фармацевтически приемлемый носитель, отличающаяся тем, что в качестве активного ингредиента используют или ее фармацевтически приемлемую соль. 2. Способ профилактики или лечения вторичной катаракты, который включает введение ки или ее фармацевтически приемлемой соли. 3. Применение N-(3,4-диметоксициннамоил)антраниловой кислоты,представленной формулой или ее фармацевтически приемлемой соли для получения фармацевтической композиции для профилактики или лечения вторичной катаракты. 4. Применение N-(3,4-диметоксициннамоил)антраниловой кислоты,представленной формулой или ее фармацевтически приемлемой соли в качестве ингибитора катаракты.
МПК / Метки
МПК: A61P 27/12, A61K 31/195
Метки: катаракты, ингибитор, вторичной
Код ссылки
<a href="https://eas.patents.su/5-1745-ingibitor-vtorichnojj-katarakty.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибитор вторичной катаракты.</a>
Предыдущий патент: Новые эритромицины и способы их получения
Следующий патент: Дополнительный канал с высокой скоростью передачи данных для системы связи мдкр
Случайный патент: Вертикально стоящий пакет с наклоняемым запирающим элементом









