Соединения пиримидотиофена
Номер патента: 9920
Опубликовано: 28.04.2008
Авторы: Джордан Аллан, Баррил-Алонсо Ксавьер, Фромонт Кристоф, Димок Брайан Уильям, Драйсдейл Мартин Джеймс
Формула / Реферат
1. Применение соединения формулы (I) или его соли, N-оксида, гидрата или сольвата для приготовления композиции для ингибирования активности HSP90 in vitro или in vivo:

в котором
R2 представляет собой группу формулы (IA)
-(Ar1)m-(Alk1)p-(Z)r-(Alk2)s-Q (IA)
в которой
Ar1 является необязательно замещенным арильным или гетероарильным радикалом,
Alk1 и Alk2 являются необязательно замещенными двухвалентными C1-С3 алкиленовым или С2-С3 алкениленовым радикалами,
m, р, r и s независимо равны 0 или 1,
Z представляет собой -O-, -S-, -(С=O)-, -(C=S)-, -SO2-, -С(=O)O-, -C(=O)NRA-, -C(=S)NRA-, -SO2NRA-, -NRAC(=O)-, -NRASO2- или -NRA-, причем RA представляет собой водород или C1-С6алкил, и
Q представляет собой водород или необязательно замещенный карбоциклический или гетероциклический радикал;
R3 представляет собой водород или галоген; и
R4 представляет собой сложный эфир карбоновой кислоты, карбоксамид или сульфонамид,
и в котором термин "замещенный" означает замещенный по крайней мере одним заместителем, выбранным из (C1-С6)алкила, (C1-С6)алкокси, гидрокси, гидрокси(C1-С6)алкила, меркапто, меркапто (C1-С6)алкила, (C1-С6)алкитио, галогена, трифторметила, трифторметокси, нитро, нитрил(-CN), оксо, фенила, -СООН, -COORA, -CORA, -SO2Ra, -CONH2, -SO2NH2, -CONHRA, -SO2NHRA, -CONRARB, -SO2NRARB,
-NH2, -NHRA, -NRARB, -OCONH2, -OCONHRA, -OCONRARB, -NHCORA, -NHCOORA, -NRBCOORA,
-NHSO2ORA, -NRBSO2ORA, -NHCONH2, -NRACONH2, -NHCONHRB, -NRACONHRB, -NHCONRARB или
-NRACONRARB, в которых RA и RB независимо представляют собой (C1-С6) алкильную группу;
и в котором термин "карбоциклический" означает циклический радикал, кольцевыми атомами которого является углерод;
и в котором термин "гетероциклический" означает моно-, би- или трициклический неароматический радикал, содержащий один или более гетероатомов, которые выбирают из S, N и О, или группу, состоящую из моноциклических неароматических радикалов, содержащих один или более таких гетероатомов, которые ковалентно связаны с другим таким радикалом или с моноциклическим карбоциклическим радикалом;
и в котором термин "арил" означает моно-, би- или трициклический ароматический радикал;
и в котором термин "гетероарил" означает моно-, би- или трициклический ароматический радикал, содержащий один или более гетероатомов, которые выбирают из S, N и О.
2. Применение по п.1 для иммуносупрессии или лечения вирусных заболеваний, воспалительных заболеваний, таких как ревматоидный артрит, астма, множественный склероз, диабет 1 типа, волчанка, псориаз и воспаление кишечника; болезней, связанных с ангиогенезом кистозного фиброза, таких как диабетическая ретинопатия, гемангиомы и эндометриоз; или для защиты нормальных клеток от токсикоза, вызванного хемотерапией; или заболеваний, главной чертой которых является неспособность к апоптозу; или для защиты от последствий гипоксии-ишемии из-за повышения уровня Hsp70 в сердце и мозгу; энцефалопатии/CJD, болезней Хантингтона и Альцгеймера.
3. Применение по п.1 для лечения рака.
4. Применение по любому из предыдущих пунктов, при котором в соединении (I) m равен 1, а каждый из р, r и s равен 0, a Q представляет собой водород.
5. Применение по любому из предыдущих пунктов, при котором R2 в соединении (I) представляет собой необязательно замещенный фенил, 2- или 3-тиенил, 2- или 3-фуранил, 2-, 3- или 4-пиридинил, морфолинил или пиперидинил.
6. Применение по п.5, при котором в соединении (I) R2 представляет собой фенил, необязательно замещенный одним или более заместителями, которые выирают из метила, этила, н- или изопропила, винила, аллила, метоксила, этоксила, н-пропилоксила, бензилоксила, аллилоксила, цианметоксихлора, брома, циано, формила, метил-, этил- или н-пропилкарбонилоксила, метил- или этиламинокарбонила, и заместители формулы -O(CH2)nZ1 , в которой n равен 1, 2 или 3 и Z1 представляет собой первичную, вторичную, третичную или циклическую аминогруппу или C1-С6 алкоксил; или формулы -(Alk3)mZ1, в которой Alk3 представляет собой двухвалентную нормальную или разветвленную цепь (С1-С3) алкилен, m равен 0 или 1 и Z1 является первичной, вторичной, третичной или циклической аминогруппой или C1-С6 алкоксилом.
7. Применение по п.6, при котором необязательные заместители находятся в положениях 2-, и/или 4-, и/или 5 фенильного кольца.
8. Применение по любому из предшествующих пунктов, при котором в соединении (I) m равен 1, а р, r и s равны 0 и Q представляет собой необязательно замещенное карбоциклическое или гетероциклическое кольцо.
9. Применение по любому из предшествующих пунктов, при котором в соединении (I) Ar1 представляет собой фенил или пиридильное кольцо.
10. Применение по любому из предшествующих пунктов, при котором в соединении (I) R3 является водородом.
11. Применение по любому из предшествующих пунктов, при котором в соединении (I) R4 представляет собой карбоксамидную группу формулы -CONRB(Alk)nRA или сульфонамидную группу формулы -SO2NRB(Alk)nRA, в которой
Alk является необязательно замещенным двухвалентным алкиленовым, алкениленовым или алкиниленовым радикалом,
n равен 0 или 1,
RB представляет собой водород или C1-С6 алкильную или С2-С6 алкенильную группу,
RA представляет собой гидроксил или необязательно замещенный карбоциклил или гетероциклил,
или RA и RB вместе с азотом, к которому они присоединены, образуют N-гетероциклическое кольцо, которое может необязательно содержать один или более дополнительных гетероатомов, выбранных из О, S и N, и которое может необязательно быть замещено при одном или более атомах С или N кольца.
12. Применение по п.11, при котором
Alk представляет собой необязательно замещенный -СН2-, -СН2СН2-, -СН2СН2СН2-, -СН2СН=СН- или -СН2СССН2-,
RB представляет собой водород или метил, этил, н- или изопропил или аллил,
RA представляет собой гидроксил или необязательно замещенный фенил, 3,4 метилендиоксифенил, пиридил, фурил, тиенил, N-пиперазинил или N-морфолил,
или RA и RB вместе с азотом, к которому они присоединены, образуют N-гетероциклическое кольцо, которое может необязательно содержать один или более дополнительных гетероатомов, выбранных из О, S и N, и которое может необязательно быть замещено при одном или более атомах С или N кольца.
13. Применение по любому из пп.1-10, при котором в соединении (I) R4 представляет сложноэфирную группу формулы -COORС, в которой RС представляет собой C1-С6алкил шыш C2-С6алкенил, или необязательно замещенный арил или гетероарил, или необязательно замещенный арил(C1-С6алкил)- или гетероарил(C1-С6 алкил)-, или необязательно замещенный циклоалкил.
14. Применение по любому из пп.1-10, при котором в соединении (I) R4 представляет сложноэфирную группу формулы -COORC, в которой RC представляет собой необязательно замещенный метил, этил н- или изопропил, аллил, фенил, пиридил, тиазолил, бензил, пиридилметил, циклопентил или циклогексил.
15. Применение по любому из пп.1-3, при котором соединение (I) отвечает формуле (II)
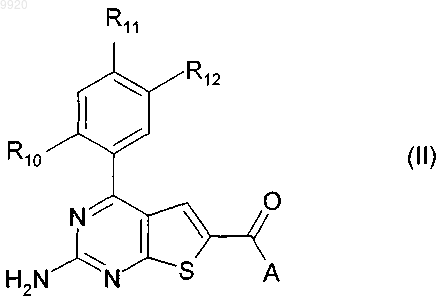
в которой А является вторичной аминогруппой;
R10 представляет собой Н, Cl, Br или СН3;
R11 представляет собой водород, Cl, Br, CN, метил, этил, н- или изопропил, винил или аллил;
R12 представляет собой (i) радикал формулы -O(CH2)nZ1, в которой n равен 1, 2 или 3 и Z1 является первичной, вторичной, третичной или циклической аминогруппой или C1-С6алкоксигруппой; или (ii) радикал формулы -(Alk3)mZ1, в которой Alk3 представляет собой двухвалентную нормальную или разветвленную цепь (C1-С3)алкилена, m равен 0 или 1 и Z1 представляет собой первичную, вторичную, третичную или циклическую аминогруппу или C1-С6алкоксигруппу.
16. Применение по п.15, при котором в соединении (II) А является вторичной C1-С6алкиламиногруппой.
17. Применение или способ по п.15 или 16, при которых в соединении (II) R12 является (i) радикалом формулы -O(CH2)nZ1, в которой n равен 1, 2 или 3 и Z1 представляет собой ди(C1-С3алкил)амино или C1-C3алкоксигруппу.
18. Соединение формулы (I) или его соль, N-оксид, гидрат или сольват

в которой
R2 представляет собой группу формулы (IA)
-(Ar1)m(Alk1)p-(Z)r-(Alk2)S-Q (IA)
в которой
Ar1 является необязательно замещенным арильным или гетероарильным радикалом,
Alk1 и Alk2 являются необязательно замещенными двухвалентными C1-С3алкиленовым или С2-С3алкениленовым радикалами,
m, р, r и s независимо равны 0 или 1,
Z представляет собой -O-, -S-, -(С=O)-, -(C=S)-, -SO2-, С(=O)O-, -C(=O)NRA-, -C(=S)NRA-, -SO2NRA-, -NRAC(=O)-, -NRASO2- или -NRA-, причем RA представляет собой водород или C1-С6 алкил, и
Q представляет собой водород или необязательно замещенный карбоциклический или гетероциклический радикал;
R3 представляет собой водород или галоген; и
R4 представляет собой сложный эфир карбоновой кислоты, карбоксамид или сульфонамид,
при условии, что (i) когда R4 является -COOCH3 и R3 представляет собой водород, тогда R2 не является группой -NH2, этиламино, диэтиламино, фениламино или -N(Ph)(C2H5) , где Ph означает фенил, и (ii) когда R4 представляет собой -CONH2 и R3 представляет собой водород, тогда R2 не является группой -NH2;
и в котором термин "замещенный" означает замещенный по крайней мере одним заместителем, выбранным из (C1-С6) алкила, (C1-С6)алкокси, гидрокси, гидрокси(C1-С6)алкила, меркапто, меркапто(C1-С6)алкила, (C1-С6)алкитио, галогена, трифторметила, трифторметокси, нитро, нитрил(-CN), оксо, фенила, -СООН, -COORA, -CORA, -SO2RA, -CONH2, -SO2NH2, -CONHRA, -SO2NHRA, -CONRARB, -SO2NRARB,
-NH2, -NHRA, -NRARB, -OCONH2, -OCONHRA, -OCONRARB, -NHCORA, -NHCOORA, -NRBCOORA,
-NHSO2ORA, -NRBSO2ORA, -NHCONH2, NRACONH2, -NHCONHRB, -NRACONHRB, -NHCONRARB или
-NRACONRARB, в которых RA и RB независимо представляют собой (C1-С6)алкильную группу;
и в котором термин "карбоциклический" означает циклический радикал, кольцевыми атомами которого является углерод;
и в котором термин "гетероциклический" означает моно-, би- или трициклический неароматический радикал, содержащий один или более гетероатомов, которые выбирают из S, N и О, или группу, состоящую из моноциклических неароматических радикалов, содержащих один или более таких гетероатомов, которые ковалентно связаны с другим таким радикалом или с моноциклическим карбоциклическим радикалом;
и в котором термин "арил" означает моно-, би- или трициклический ароматический радикал;
и в котором термин "гетероарил" означает моно-, би- или трициклический ароматический радикал, содержащий один или более гетероатомов, которые выбирают из S, N и О.
19. Соединение по п.18, в котором R3 представляет собой водород.
20. Соединение по п.18 или 19, в котором m равен 1, каждый из р, r и s равен 0 и Q представляет собой водород.
21. Соединение по п.20, в котором R2 представляет собой необязательно замещенный фенил, 2- или 3-тиенил, 2- или 3-фуранил, 2-, 3- или 4-пиридинил, морфолинил или пиперидинил.
22. Соединение по п.20, в котором R2 представляет собой фенил, необязательно замещенный метилом, этилом, н- или изопропилом, винилом, аллилом, метоксилом, этоксилом, н-пропилоксилом, бензилоксилом, аллилоксилом, цианометоксихлором, бромом, циано, формилом, метил-, этил- или н-пропилкарбонилоксилом, метил- или этиламинокарбонилом.
23. Соединение по п.22, в котором необязательные заместители находятся в положениях 2-, и/или 4-, и/или 5 фенильного кольца.
24. Соединение по п.18 или 19, в котором m равен 1 и р, r и s равны 0, a Q представляет собой необязательно замещенное карбоциклическое или гетероциклическое кольцо.
25. Соединение по п.18 или 19, в котором m равен 1 и по меньшей мере один показатель из р, r и s равен 1.
26. Соединение по любому из пп.18-19, в котором Ar1 представляет собой необязательно замещенное фенильное кольцо.
27. Соединение по п.18 или 19, в котором m равен 0.
28. Соединение по п.25 или 26, в котором Alk1, когда присутствует, необязательно замещен группами -СН2, СН2СН2- или -СН=СН-; Alk2, когда присутствует, необязательно замещен группами -СН2, СН2СН2- или -СН=СН-; Z, когда присутствует, представляет собой -О- или -NH-; и Q представляет собой водород.
29. Соединение по п.28, в котором присутствуют Z и Alk2 и Alk2 замещен ди(C1-С3алкил)амино или C1-С3алкоксигруппами.
30. Соединение по любому из пп.18-29, в котором R4 представляет собой карбоксамидную группу формулы -CONRB(Alk)nRA или сульфонамидную группу формулы -SO2NRB (Alk)nRA, в которых Alk представляет собой необязательно замещенный двухвалентный алкиленовый, алкениленовый или алкиниленовый радикал,
n равен 0 или 1,
RB представляет собой водород или C1-С6алкильную или C2-С6алкенильную группу,
RA представляет собой гидроксильную или необязательно замещенную карбоциклическую группу, например фенил, замещенный гидроксилом и/или хлором, или 3,4-метилендиоксифенил; или гетероциклил, например пиридил, фурил, тиенил, N-пиперазинил или N-морфолинил, в которых любое гетероциклическое кольцо может быть замещенным,
или RA и RB вместе с азотом, к которому они присоединены, образуют N-гетероциклическое кольцо, которое может необязательно содержать один или более дополнительных гетероатомов, выбранных из О, S и N, и которое может необязательно быть замещено при одном или более атомах С или N кольца.
31. Соединение по п.30, в котором Alk необязательно замещен группами -СН2-, -CH2CH2-, -СН2СН2СН2-, -СН2СН=СН- или -СН2СССН2-,
RB представляет собой водород или метил, этил, н- или изопропил или аллил,
RA представляет собой гидроксил или необязательно замещенный фенил, 3,4-метилендиоксифенил, пиридил, фурил, тиенил, N-пиперазинил или N-морфолинил,
или RA и RB вместе с азотом, к которому они присоединены, образуют N-гетероциклическое кольцо, которое может необязательно содержать один или более дополнительных гетероатомов, выбранных из О, S и N, и которое может необязательно быть замещено при одном или более атомах С или N кольца.
32. Соединение по п.30 или 31, в котором R4 представляет собой карбоксамидную группу.
33. Соединение по любому из пп.18-29, в котором R4 представляет собой карбоксильную группу формулы -COORC, в которой RC представляет собой C1-С6алкил или C2-С6алкенил, или необязательно замещенный арил или гетероарил, или необязательно замещенный арил(C1-С6алкил)- или гетероарил (C1-С6 алкил)-, или необязательно замещенный циклоалкил.
34. Соединение по любому из пп.18-29, в котором R4 представляет собой карбоксильную группу формулы -COORC, в которой RC представляет собой необязательно замещенный метил, этил, н- или изопропил, аллил, фенил, пиридил, тиазолил, бензил, пиридилметил, циклопентил или циклогексил.
35. Соединение по п.18, имеющее формулу (II)
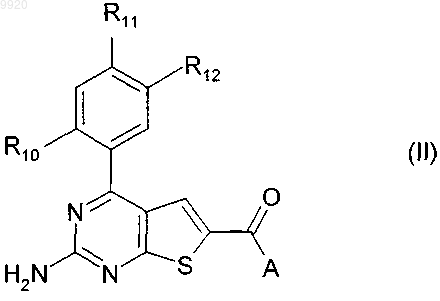
в которой
А является вторичной аминогруппой,
R10 представляет собой Н, Cl, Br или СН3;
R11 представляет собой водород, Cl, Br, CN, метил, этил, н- или изопропил, винил или аллил;
R12 представляет собой (i) радикал формулы -O(CH2)nZ1, в которой n равен 1, 2 или 3 и Z1 является первичной, вторичной, третичной или циклической аминогруппой или C1-С6 алкоксигруппой; или (ii) радикал формулы -(Alk3)mZ1, в которой Alk3 представляет собой двухвалентную прямую или разветвленную цепь (C1-С3)алкилена, m равен 0 или 1 и Z1 представляет собой первичную, вторичную, третичную или циклическую аминогруппу или C1-С6алкоксигруппу.
36. Соединение по п.35, в котором А является вторичной C1-С6алкиламиногруппой.
37. Соединение по п.35 или 36, в котором R12 представляет собой (i) радикал формулы -O(CH2)nZ1, в которой n равен 1, 2 или 3 и Z1 представляет собой ди(С1-С3алкил)амино или C1-C3алкоксигруппу.
38. Соединение по п.37, выбранное из группы, состоящей из
этиламида 2-амино-4-[2,4-дихлор-5-(2-диэтиламиноэтокси)фенил]тиено[2,3-d]пиримидин-6-карбоновой кислоты,
этиламида 2-амино-4-[2,4-дихлор-5-(2-циклогексиламиноэтокси)фенил]тиено[2,3-d]пиримидин-6-карбоновой кислоты,
циклопропиламида 2-амино-4-[2,4-дихлор-5-(2-диэтиламиноэтокси)фенил]тиено[2,3-d]пиримидин-6-карбоновой кислоты,
этиламида 2-амино-4-[2,4-дихлор-5-(2-гидроксиэтокси)фенил]тиено[2,3-d]пиримидин-6-карбоновой кислоты,
этиламида 2-амино-4-[2,4-дихлор-5-(3-диметиламино-2-метилпропокси)фенил]тиено[2,3-d]пиримидин-6-карбоновой кислоты,
этиламида 2-амино-4-[2,4-дихлор-5-(3-диметиламинопропокси)фенил]тиено[2,3-d]пиримидин-6-карбоновой кислоты,
этиламида 2-амино-4-[2,4-дихлор-5-(2-пирролидин-1-ил-этокси)фенил]тиено[2,3-d]пиримидин-6-карбоновой кислоты,
этиламида 2-амино-4-[2,4-дихлор-5-(2-диметиламиноэтокси)фенил]тиено[2,3-d]пиримидин-6-карбоновой кислоты,
этиламида 2-амино-4-{2,4-дихлор-5-[2-(4-метилпиперазин-1-ил)этокси]фенил}тиено[2,3-d]пиримидин-6-карбоновой кислоты,
этиламида 2-амино-4-{2,4-дихлор-5-[2-(2-метоксиэтиламино)этокси]фенил}тиено[2,3-d]пиримидин-6-карбоновой кислоты,
этиламида 2-амино-4-[2,4-дихлор-5-цианометоксифенил]тиено[2,3-d]пиримидин-6-карбоновой кислоты,
этиламида 2-амино-4-(5-карбамоилметокси-2,4-дихлорфенил]тиено[2,3-d]пиримидин-6-карбоновой кислоты,
этиламида 2-амино-4-[2,4-дихлор-5-(2-пиперидин-1-илэтокси)фенил]тиено[2,3-d]пиримидин-6-карбоновой кислоты,
изопропиламида 2-амино-4-[2,4-дихлор-5-(2-пирролидин-1-илэтокси)фенил]тиено[2,3-d]пиримидин-6-карбоновой кислоты,
этиламида 2-амино-4-[2,4-дихлор-5-(2-морфолин-4-илэтокси)фенил]тиено[2,3-d]пиримидин-6-карбоновой кислоты.
39. Фармацевтическая или ветеринарная композиция, включающая соединение по любому из пп.18-38 вместе с одним или более фармацевтически или ветеринарно приемлемыми носителями и/или эксцкпиентами.
Текст
009920 Область техники Настоящее изобретение относится к замещенным бициклическим тиено[2,3-d]пиримидиновым (называемым здесь пиримидотиофеновыми) соединениям, обладающим ингибирующей активностью по отношению к белкам теплового шока HSP90, использованию таких соединений в медицине для лечения заболеваний, которые чувствительны к ингибированию активности HSP90, например, различных видов рака, и фармацевтическим композициям на основе таких соединений. Уровень техники Молекулярные шапероны поддерживают необходимые фолдинг и конформацию белков и играют важную роль в регулировании баланса между синтезом белков и их разрушением. Было показано, что они важны для регулирования многих ответственных функций клеток, таких как пролиферация и апоптоз(Jolly and Morimoto, 2000; Smith et al., 1998; Smith, 2001). Воздействие на клетку различных стрессов, включая тепловой шок, спирты, тяжелые металлы и окислительный стресс, приводит к накоплению в клетке большого числа шаперонов, известных как белки теплового шока (HSP). Появление HSP защищает клетку от атаки начального стресса, ускоряет восстановление и ведет к сохранению состояния, толерантного к стрессу. Однако выяснилось, что некоторые HSP могут также играть роль молекулярного шаперона в нормальных нестрессовых условиях путем регулирования правильного фолдинга, деградации, локализации и функции роста важных клеточных белков. Существует множество мультигенных семейств HSP с индивидуальными генными продуктами,различающимися экспрессией, функциями и локализацией клеток. Их классифицируют по молекулярной массе, например, HSP70, HSP90 и HSP27. Некоторые заболевания у людей могут быть результатом денатурирования белков (обзоры Tytell et al., 2001; Smith et al., 1998). Следовательно, разработка терапии, которая прерывает действие молекулярного шаперона, может оказаться успешной. В некоторых условиях (например, болезнь Альцгеймера, прионовые болезни и болезнь Хантингтона), денатурированные белки могут вызвать агрегацию белка, приводящую к нейродегенеративным заболеваниям. Кроме того, денатурированные белки могут вызывать потерю функции немутантного белка, приводящую к разрегулированию молекулярной и физиологической функций в клетке.HSP участвуют также в развитии рака. Например, имеется доказательство диференциальной экспрессии HSP, которая может относиться к стадии роста опухоли (Martin et al., 2000; Conroy et al., 1996;HSP90 в различных критических онкогенных механизмах и на основании того, что некоторые природные продукты с противораковой активностью направлены на этот молекулярный шаперон, была разработана новая концепция, заключающаяся в том, что функция ингибирования HSP может быть использована в лечении рака. Первый ингибитор молекулярного шаперона сейчас проходит клинические испытания.HSP90 составляет примерно 1-2% от всего белка клетки и обычно присутствует в клетке в виде димера вместе с одним из множества других белков (см., например, Pratt, 1997). Он существенен для жизнеспособности клетки и проявляет двойные функции шаперона (Young et al., 2001). Он играет ключевую роль в отклике клетки на стресс благодаря взаимодействию со многими белками после того, как их нативная конформация изменилась под действием различных стрессов от окружающей среды, таких как тепловой шок, обеспечивая адекватный фолдинг белка и препятствуя неспецифической агрегации (Smithet al., 1998). Кроме того, последние данные показывают, что HSP90 может участвовать в создании буфера, препятствующего мутации, преимущественно путем коррекции несоответствующего фолдинга мутантных белков (Rutherford and Lindquist, 1998). Однако HSP90 играет также важную регуляторную роль. В нормальных физиологических условиях, вместе с его эндоплазматическим ретикулярным гомологомGRP94, HSP90 играет служебную роль в клетке в отношении конформационной стабильности и развития нескольких ключевых зависимых белков. Их можно разделить на три группы: (а) рецепторы стероидных гормонов, (b) Ser/Thr или тирозинкиназы (например, ERBB2, RAF-1, CDK4 и LCK), и (с) набор предположительно неродственных белков, например, мутанта р 53 и каталитической субъединицы теломеразыhTERT. Все эти белки играют ключевые регуляторные роли во многих физиологических и биохимических процессах в клетке. Сейчас постоянно обнаруживают новые HSPP90-зависимые белки. Высококонсервативное семейство HSP90 человека состоит из четырех генов, а именно цитозольных изоформ HSP90 и HSP90 (Hickey et al., 1989), GRP94 в эндоплазмической сети (Argon et al., 1999) иHSP75/TRAP1 в митохондриальной матрице (Felts et al., 2000). Считается, что все члены семейства действуют одинаково, но связаны с различными зависимыми белками, в зависимости от их локализации внутри клетки. Например, известно, что ERBB2 является специфическим GRP94-зависимым белком (Argon et al., 1999) и рецептором фактора некроза опухоли типа 1 (TNFR1), и было показано, что оба RB являются TRAP1-зависимыми белками (Song et al., 1995; Chen et al., 1996).HSP90 участвует в сложных взаимодействиях с рядом зависимых и регуляторных белков (Smith,2001). Хотя точные детали молекулярного строения еще предстоит выяснить, биохимические и рентгеновские криталлографические исследования (Prodromou et al., 1997; Stebbins et al., 1997), выполненные за последние несколько лет, пролили свет на детали функционирования HSP90. Прошедшие ранее дискуссии на эту тему привели к выводу, что HSP90 является АТФ-зависимым-1 009920 молекулярным шапероном (Prodromou et al, 1997), причем димеризация связанных нуклеотидами дименов существенна для гидролиза АТФ, который в свою очередь важен для функционирования шаперона(Prodromou et al., 2000a). Связывание АТФ приволит к образованию тороидальной структуры домена, в которой N-терминальные домены приходят в более тесный контакт друг с другом, приводящим к переключению конформации, известному как 'clamp mechanism' ("механизм зажима") (Prodromou and Pearl,2000b). Первым классом ингибиторов HSP90 следует считать класс бензохинонансамицинов, который включает соединения гербимицин А и гельданамицин. Было показано, что они обращают злокачественный фенотип фибробластов, превращенных под действием онкогена v-Src (Uehara et al., 1985), и следовательно, проявляют потенциальную противоопухолевую активность как in vitro (Schulte et al., 1998), так иin vivo в модельных животных (Supko et al., 1995). Изучение иммуноосаждения и матриц сродства показало, что основной механизм действия гельданамицина включает связывание с HSP90 (Whitesell et al., 1994; Schulte and Neckers, 1998). Более того,исследование методом рентгеноструктурного анализа показало, что гельданамицин конкурирует за центр связывания АТФ и ингибирует собственную АТФ-ную активность HSP90 (Prodromou et al., 1997; Panaretou et al., 1998). Это, в свою очередь, препятствует образованию зрелых многомерных комплексов HSP90,способных быть шаперонами зависимых белков. В результате зависимые белки становятся мишенями для деградации по протеасомному убиквитинному механизму. 17-Аллиламино,17-деметоксигельданамицин (17AAG) сохраняет способность ингибировать HSP90, что приводит к инактивации зависимых белков и противоопухолевой активности культуры клеток и ксенотрансплантатных моделей (Schulte et al,1998; Kelland et al., 1999), но обладают значительно меньшей гепатотоксичностью, чем гельданамицин(Page et al., 1997). В настоящее время 17AAG проверяется в фазе I клинических испытаний. Радицикол представляет собой макроциклический антибиотик, способный обращать злокачественный фенотип фибробластов, превращенных под действием v-Src и v-Ha-Ras (Kwon et al., 1992; Zhao et al.,1995). Было показано, что он вызывает деградацию многих сигнальных белков в результате ингибирования HSP90 (Schulte et al., 1998). Данные рентгеноструктурного анализа подтвердили, что радицикол также связывается с N-терминальным доменом HSP90 и ингибирует собственную АТФ-ную активность(Roe et al., 1998). Радицикол in vivo теряет противоопухолевую активность из-за нестабильной химической природы этого соединения. Известно, что антибиотики кумаринового ряда связываются с бактериальной ДНК гиразой в центре связывания АТФ, гомологичном центру HSP90. Было показано, что кумарин и новобиоцин связываются с карбоксильным концом HSP90, т.е. на центре, отличном от того, который занимают бензохинонансамицин и радицикол, связывающиеся с N-концом (Marcu et al., 2000b). Однако это все же приводит к ингибированию функции HSP90 и деградации многих сигнальных белков, шапероном которых являетсяHSP90 (Marcu et al., 2000 а). Гельданамицин не может связывать HSP90 после новобиоцина; это заставляет предположить, что может существовать некоторое взаимодействие между N- и С-терминальными доменами, что согласуется с точкой зрения, согласно которой оба центра определяют свойства шаперонаHSP90. Было показано, что ингибитор HSP90 на основе пурина, PU3, приводит к деградации сигнальных молекул, включая ERBB2, и вызывает цикличекое купирование и диференциацию клеток при раке грудной железы (Chiosis et al., 2001). Патенты WO 2004/050087 и WO 2004/056782 относятся к известным классам производных пиразола- ингибиторов HSP90. Благодаря участию в регулировании многих сигнальных механизмов, важных для управления фенотипом опухоли, и тому обстоятельству, что некоторые биоактивные природные вещества реализуют свою активность через активность HSP90, молекулярный шаперон HSP90 в настоящее время является новой мишенью при разработке антираковых препаратов (Neckers et al., 1999). Основной механизм действия гельданамицина 17AAG и радицикола включает связывание с HSP90 на центре связывания АТФ, расположенном в N-терминальном домене белка, что приводит к ингибированию собственной АТФ-ной активности HSP90 (см., например, Prodromou et al., 1997; Stebbins et al.,1997; Panaretou et al., 1998). Ингибирование АТФ-ной активности HSP90 препятствует рекрутингу кошаперонов и облегчает образование гетерокомплекса HSP90, из которого зависимые белки становятся мишенью для деградации по убиквитинному протеазному механизму (см., например, Neckers et al., 1999; Kelland et al., 1999). Лечение с помощью ингибиторов HSP90 приводит к селективной деградации важных белков, участвующих в пролиферации клеток, регуляции клеточного цикла и апоптозе - процессах, которые имеют основополагающее значение для лечения рака. Было показано, что ингибирование функции HSP90 вызывает селективную деградацию важных сигнальных белков, участвующих в пролиферации клеток, регуляции клеточного цикла и апоптозе-процессах, которые имеют основополагающее значение и которые обычно разрегулированы при раке (см. например, Hostein et al., 2001). Привлекательным доводом в пользу разработки лекарств против этой мишени для использования в клинике является то, что вместе с ослаблением белков, связанных с модифи-2 009920 цированным фенотипом, можно получить сильный противоопухолевый эффект и достичь успеха в терапии рака без поражения нормальных клеток. Можно полагать, что процессы, протекающие вслед за ингибированием HSP90, ответственны за противоопухолевую активность ингибиторов HSP90 в культуре клеток и модельных животных (см., например, Schulte et al., 1998; Kelland et al., 1999). Сущность изобретения Настоящее изобретение относится к использованию класса замещенных тиено[2,3-d]пиримидиновых соединений (называемых здесь пиримидотиофенами) в качестве ингибиторов HSP90, например, для ингибирования пролиферации раковых клеток. Ядро в виде пиримидотиофенового цикла с ароматическими заместителями при циклическом атоме углерода является главной характеристической особенностью соединений настоящего изобретения. Подробное описание изобретения В широком аспекте настоящее изобретение предлагает использование соединения формулы (I) соединения формулы (I) или его соли, N-оксида, гидрата или сольвата для приготовления композиции для ингибирования активности HSP90 in vitro или in vivo:R2 представляет собой группу формулы (IA):Ar1 является необязательно замещенным арильным или гетероарильным радикалом,Alk1 и Alk2 являются необязательно замещенными двухвалентными С 1-С 3 алкиленовым или С 2-С 3 алкениленовым радикалами, m, р, r и s независимо равны 0 или 1,Z представляет собой -O-, -S-, -(С=O)-, -(C=S)-, -SO2-, -С(=O)O-, -C(=O)NRA-, -C(=S)NRA-, -SO2NRA-,A-NR C(=O)-, -NRASO2- или -NRA-, причем RA представляет собой водород или C1-С 6 алкил, и Q представляет собой водород или необязательно замещенный карбоциклический или гетероциклический радикал; R3 представляет собой водород или галоген; иR4 представляет собой сложный эфир карбоновой кислоты, карбоксамид или сульфонамид,и в котором термин замещенный означает замещенный по крайней мере одним заместителем,выбранным из (C1-С 6)алкила, (C1-С 6)алкокси, гидрокси, гидрокси (C1-С 6)алкила, меркапто, меркапто (C1 С 6)алкила, (C1-С 6)алкитио, галогена, трифторметила, трифторметокси, нитро, нитрил(-CN), оксо, фенила,-COOH, -COORA, -CORA, -SO2RA, -CONH2, -SO2NH2, -CONHRA, -SO2NHRA, -CONRARB, -SO2NRARB,-NH2, -NHRA, -NRARB, -OCONH2, -OCONHRA, -OCONRARB, -NHCORA, -NHCOORA, -NRBCOORA,-NHSO2ORA, -NRBSO2ORA, -NHCONH2, -NRACONH2, -NHCONHRB, -NRACONHRB, -NHCONRARB или-NRACONRARB, в которых RA и RB независимо представляют собой (C1-С 6)алкильную группу; и в котором термин карбоциклический означает циклический радикал, кольцевыми атомами которого является углерод; и в котором термин гетероциклический означает моно-, би- или трициклический неароматический радикал, содержащий один или более гетероатомов, которые выбирают из S, N и О, или группу,состоящую из моноциклических неароматических радикалов, содержащих один или более таких гетероатомов, которые ковалентно связаны с другим таким радикалом или с моноциклическим карбоциклическим радикалом; и в котором термин арил означает моно-, би- или трициклический ароматический радикал; и в котором термин гетероарил означает моно-, би- или трициклический ароматический радикал,содержащий один или более гетероатомов, которые выбирают из S, N и О. В другом широком аспекте изобретение предлагает лечение заболеваний, которые чувствительны к ингибированию активности HSP90 у млекопитающих, и метод лечения включает введение млекопитающему соединения, как определено в п.1, в количестве, эффективном для ингибирования указанной активности HSP90. Использование in vivo и способ настоящего изобретения применимы для лечения заболеваний, в которых важна активность HSP90, включая применение для иммуносупрессии или лечения вирусных заболеваний, воспалительных заболеваний, таких как ревматоидный артрит, астма, множественный склероз, диабет I типа, волчанка, псориаз, воспаление кишечника; болезней, связанных с ангиогенезом кистозного фиброза, таких как диабетическая ретинопатия, гемангиоз и эндометриоз; или для защиты нормальных клеток от токсикоза, вызванного химиотерапией; или заболеваний, главной чертой которых является неспособность к апоптозу; или для защиты от последствий гипоксии-ишемии из-за повышения уровня Hsp70 сердца и мозга; энцефалопатии/CJD, болезней Хантингтона и Альцгеймера. Особенно показано лечение рака.-3 009920 Публикации WO 01/62233, Transition Metal Chemistry Vol. 19, 1994, pages 335-339, Journal of Heterocyclic Chemistry Vol. 30, 1993, pages 1065-1072, and Synthesis No.5, 1983, pages 402-404, раскрывают конкретные соединения, отвечающие указанной формуле (I), или относятся к классам соединений, которые включают некоторые соединения формулы (I). Однако большинство соединений формулы (I), к которым относятся указанные выше широкие аспекты изобретения, являются новыми. Изобретение включает такие новые соединения и в частности соединения формулы (I) или его соль, N-оксид, гидрат или сольват: в которой Alk1 и Alk2 являются необязательно замещенными двухвалентными С 1-С 3 алкиленовым или С 2-С 3 алкениленовым радикалами,m, p, r и s независимо равны 0 или 1, Z представляет собой -O-, -S-, -(С=O)-, -(C=S)-, -SO2-,-С(=O)O-, -C(=O)NRA-, -C(=S)NRA-, -SO2NRA-, -NRAC(=O)-, -NRASO2- или -NRA-, причемRA представляет собой водород или C1-С 6 алкил, и Q представляет собой водород или необязательно замещенный карбоциклический или гетероциклический радикал;R3 представляет собой водород или галоген; иR4 представляет собой сложный эфир карбоновой кислоты, карбоксамид или сульфонамид,При условии, что (i) когда R4 является -COOCH3 и R3 представляет собой водород, тогда R2 не является группой -NH2, этиламино, диэтиламино, фениламино или -N(Ph)(C2H5), где Ph означает фенил, и(ii) когда R4 представляет собой -CONH2 и R3 представляет собой водород, тогда R2 не является группой -NH2; и в котором термин замещенный означает замещенный по крайней мере одним заместителем,выбранным из (C1-С 6)алкила, (C1-С 6)алкокси, гидрокси, гидрокси(C1-С 6)алкила, меркапто, меркапто(C1 С 6)алкила, (C1-С 6)алкитио, галогена, трифторметила, трифторметокси, нитро, нитрил (-CN), оксо, фенила, -COOH, -COORA, -CORA, -SO2RA, -CONH2, -SO2NH2, -CONHRA, -SO2NHRA, -CONRARB, -SO2NRARB,-NH2, -NHRA, -NRARB, -OCONH2, -OCONHRA, -OCONRARB, -NHCORA, -NHCOORA, -NRBCOORA,-NHSO2ORA, -NRBSO2ORA, -NHCONH2, -NRACONH2, -NHCONHRB, -NRACONHRB, -NHCONRARB или- NRACONRARB, в которых RA и RB независимо представляют собой (C1-С 6)алкильную группу; и в котором термин карбоциклический означает циклический радикал, кольцевыми атомами которого является углерод; и в котором термин гетероциклический означает моно-, би- или трициклический неароматический радикал, содержащий один или более гетероатомов, которые выбирают из S, N и О, или группу,состоящую из моноциклических неароматических радикалов, содержащих один или более таких гетероатомов, которые ковалентно связаны с другим таким радикалом или с моноциклическим карбоциклическим радикалом; и в котором термин арил означает моно-, би- или трициклический ароматический радикал; и в котором термин гетероарил означает моно-, би- или трициклический ароматический радикал,содержащий один или более гетероатомов, которые выбирают из S, N и О. Здесь использованы: термин карбоксильная группа относится к группе формулы -COOH; термин сложный эфир карбоновой кислоты относится к группе формулы -COOR, в которой R является радикалом, полученным из гидроксилсодержащего соединения ROH; и термин карбоксамидная группа относится к группе формулы CONRaRb, в которой -NRaRb является аминогруппой (в том числе циклической аминогруппой), полученной из аммиака или амина HNRaRb.; термин сульфонамидная группа относится к группе формулы SO2NRaRb, в которой -NRaRb является аминогруппой (в том числе циклической аминогруппой), полученной из аммиака или аминаHNRaRb. Использованный здесь термин (Ca-Cb)алкил, в котором а и b являются целыми числами, относится к прямым или разветвленным цепям алкильных радикалов с а-b атомами углерода. Так, когда а равен 1 и b равен 6, например, термин включает метил, этил, н-пропил, изопропил, н-бутил, изобутил, вторбутил, трет-бутил, н-пентил и н-гексил. Использованный здесь термин двухвалентный (Ca-Cb)алкиленовый радикал, в котором а и b являются целыми числами, относится к насыщенной углеводородной цепи с а-b атомами углерода и двумя ненасыщенными валентностями. Использованный здесь термин (Ca-Cb)алкенил, в котором а и b являются целыми числами, относится к фрагменту прямой или разветвленной алкенильной цепи с а-b атомами углерода, содержащей по меньшей мере одну двойную связь со стереохимией либо Е, либо Z, когда это возможно. Термин включает, например, винил, аллил, 1- и 2-бутенил и 2-метил-2-пропенил.-4 009920 Использованный здесь термин двухвалентный (Са-Сb)алкениленовый радикал относится к углеводородной цепи с а-b атомами углерода, по меньшей мере с одной двойной связью и двумя ненасыщенными валентностями. Использованный здесь термин циклоалкил относится к насыщенному карбоциклическому радикалу, содержащему 3-8 атомов углерода, и включает, например, циклопропил, циклобутил, циклопентил,циклогексил, циклогептил и циклооктил. Использованный здесь термин циклоалкенил относится к карбоциклическому радикалу с 3-8 атомами углерода, содержащему по меньшей мере одну двойную связь, и включает, например, циклопентенил, циклогексенил, циклогептенил и циклооктенил. Использованный здесь термин арил относится к моно-, ди- или трициклическим карбоциклическим ароматическим радикалам. Примерами таких радикалов являются фенил, дифенил и нафтил. Использованный здесь термин карбоциклический относится к циклическому радикалу, в котором все атомы цикла являются атомами углерода, и включает моноциклический арильный, циклоалкильный и циклоалкенильный радикалы. Использованный здесь термин гетероарил относится к моно-, ди- или трициклическим карбоциклическим ароматическим радикалам, содержащим один или более гетероатомов, которые выбирают из S,N и О. Примерами таких радикалов являются тиенил, бензтиенил, фурил, бензфурил, пирролил, имидазолил, бензимидазолил, тиазолил, бензтиазолил, изотиазолил, бензизотиазолил, пиразолил, оксазолил,бензоксазолил, изоксазолил, бензизоксазолил, изотиазолил, триазслил, бензтриазолил, тиадиазолил, оксадиазолил, пиридинил, пиридазинил, пиримидинил, пиразинил, триазинил, индолил и индазслил. Использованный здесь общий термин гетероциклил или гетероциклический включает гетероарил, как определено выше, и в особенности относится к моно-, ди- или трициклическим неароматическим радикалам, содержащим один или более гетероатомов, которые выбирают из S, N и О, и группам,состоящим из моноциклических неароматических радикалов, содержащих один или более таких гетероатомов, которые ковалентно связаны с другим таким радикалом или с моноциклическим карбоциклическим радикалом. Примерами таких радикалов являются пирролил, фуранил, тиенил, пиперидинил, имидазолил, оксазолил, изоксазолил, тиазолил, тиадиазолил, пиразолил, пиридинил, пирролидинил, пиримидинил, морфолинил, пиперазинил, индолил, морфолинил, бензфуранил, пиранил, изоксазолил, бензимидазолил, метилендиоксифенил, этилендиоксифенил, малеимидо- и сукцинимидогруппы. Если в контексте не оговорено иначе, термин замещенный в применении к любому фрагменту здесь означает замещенный по меньшей мере одним заместителем, например, выбранным из (C1-С 6)алкила, (C1-С 6)алкоксила, гидроксила, гидрокси(C1-С 6)алкила, меркапто, меркапто(C1-С 6) алкила, (C1-С 6) алкилтио, галоида (включая фтор и хлор), трифторметила, трифторметоксила, нитро, нитрила (-CN), оксо, фенила, -СООН, -COORA, -CORA, -SO2RA, -CONH2, -SO2NH2, -CONHRA, -SO2NHRA, -CONRARB,-SO2NRARB, -NH2, -NHRA, -NRARB, -OCONH2, -OCONHRA , -OCONRARB, -NHCORA, -NHCOORA,-NRBCOORA, -NHSO2ORA, -NRBSO2ORA, -NHCONH2, -NRACONH2, -NHCONHRB, -NRACONHRB,-NHCONRARB или -NRACONRARB, в которых RA и RB независимо представляют собой (C1-С 6)алкильную группу. Представляют собой (C1-С 6)алкильную группу. Необязательный заместитель может быть одним из вышеприведенных заместителей. Использованный здесь термин соль включает соединения, образованные за счет присоединения основания или кислоты, а также четвертичные соли. Соединения изобретения, которые являются кислотами, могут образовывать соли, включая фармацевтически приемлемые соли или применимые в ветеринарии, с основаниями, такими как гидроксиды щелочных металлов, например, гидроксиды натрия и калия; гидроксиды щелочно-земельных металлов, например, гидроксиды кальция, бария и магния; с органическими оснозаниями, например, N-этилпиперидином, дибензиламином и т.п. Те соединения (I), которые являются основаниями, могут образовывать соли, в том числе фармацевтически приемлемые соли или применимые в ветеринарии, с неорганическими кислотами, например, хлористо-водородной или бромисто-водородной кислотами, серной кислотой, азотной кислотой или фосфорной кислотой и т.д., и с органическими кислотами, например, уксусной, винной, янтарной, фумаровой, малеиновой, яблочной,салициловой, лимонной, метансульфоновой и п-толуолсульфоновой кислотами и т.д. Обзор подходящих солей см. Справочник по фармацевтическим солям: свойства, подбор и применение (Handbook of Pharmaceutical Salts: Properties, Selection, and Use by Stahl and Wermuth (Wiley-VCH,Weinheim, Germany, 2002). Термин сольват используется здесь для обозначения молекулярного комплекса, состоящего из соединения изобретения и стехиометрического количества молекул одного или более фармацевтически приемлемых растворителей, например, этанола. Термин гидрат применяется, когда вода является этим растворителем. Соединения, которые относятся к изобретению, могут существовать в одной или более стереоизомерных формах из-за присутствия асимметрических атомов или из-за заторможенного вращения; они могут существовать в виде многих стереоизомеров с R- или S- стереохимией каждого хирального центра или в виде атропоизомеров R- или S- конфигурации при каждой хиральной оси.-5 009920 Изобретение включает все такие энантиомеры и диастереоизомеры и их смеси. Так называемые пролекарства из соединений формулы (I) также входят в объем изобретения. Так, некоторые производные соединений формулы (I), которые сами по себе обладают слабой фармакологической активностью или вообще ей не обладают, могут при введении внутрь организма или на его поверхность превращаться в соединения формулы (I), проявляющие необходимую активность, например,в результате гидролитического расщепления. Такие производные называются пролекарствами. Дополнительные сведения по применению пролекарств можно найти в работе Пролекарства как новые системы доставки (Pro-drugs as Novel Delivery Systems), Vol. 14, ACS Symposium Series (T. Higuchi and W.Stella) и монографии Биообратимые носители в разработке лекарств (Bioreversible Carriers in Drug Design), Pergamon Press, 1987 (ed. E. B. Roche, American Pharmaceutical Association). Согласно изобретению, пролекарства могут быть получены, например, заменой соответствующих функциональных групп, присутствующих в соединениях формулы (I), на некоторые фрагменты, известные специалистам как прогруппы ('pro-moieties'), как описано, например, в монографии Разработка пролекарств (Design of Prodrugs) by H. Bundgaard (Elsevier, 1985). Метаболиты соединений формулы (I), т.е. соединения, образовавшиеся in vivo после введения лекарства, также входят в объем, изобретения. Примеры метаболитов включают:(i) когда соединение формулы (I) содержит метильную группу, то его гидроксиметильную производную (-СН 3-СН 2 ОН):(ii) когда соединение формулы (I) содержит алкоксильную группу, то его гидроксипроизводную(iii) когда соединение формулы (I) содержит третичную аминогруппу, то его вторичную аминопроизводную (-NR1R2-NHR1 или -NHR2);(iv) когда соединение формулы (I) содержит вторичную аминогруппу, то его первичную производную (-NHR1-NH2);(v) когда соединение формулы (I) содержит фенильную группу, то его фенольную производную(vi) когда соединение формулы (I) содержит амидную группу, то его производную с карбоновой кислотой (-CONH2 СООН). Радикал R2 Как утверждалось, R2 является группой формулы (IA):(IA) в которой при любой допустимой комбинации Ar является необязательно замещенным арильным или гетероарильным радикалом, Alk1 и Alk2 являются необязательно замещенными двухвалентными С 1-С 3 алкиленовым или С 2-С 3 алкениленовым радикалами, m, р, r и s независимо равны 0 или 1, Z представляет собой -O-, -S-, -(С=O)-, -(C=S)-, -SO2-, -С(=O)O-, -C(=O)NRA-, -C(=S)NRA-, -SO2NRA-, NRAC(=O)-, -NRASO2- или -NRA-, причем RA представляет собой водород или C1-С 6 алкил, и Q представляет собой водород или необязательно замещенный карбоциклический или гетероуциклический радикал. Когда присутствуют в радикале R2,Ar1 может представлять собой, например, фенил, циклогексил, пиридил, морфолино, пиперидинильное или пиперазинильное кольцо. Здесь предпочтительно, чтобы если Ar1 присутствует, то он представляет собой фенильное кольцо;Alk1 и Alk2 могут быть, например, необязательно замещенными двухвалентными радикалами, которые выбирают из -СН 2, СН 2 СН 2-или -СН=СН-. Необязательные заместители в Alk1 и Alk2 включают, например, моно- или ди(С 1-С 3 алкил)амино и С 1-С 3 алкоксигруппы; иZ может представлять собой, например, -О- или -NH-; и Q является водородом. В простом подклассе соединений настоящего изобретения m равен 1 и каждый из р, r и s равен 0, aQ представляет собой водород, так что R2 является необязательно замещенным арилом или гетероарилом. В таких случаях R2 может представлять собой, например, необязательно замещенный фенил, 2- или 3-тиенил, 2-или 3-фуранил, 2-, 3- или 4-пиридинил, морфолинил или пиперидинил. В настоящее время предпочтительны соединения, в которых R2 представляет собой необязательно замещенный фенил, например, с необязательными заместителями, которые выбирают из метила, этила, н- или изопропила, винила, аллила, метоксила, этоксила, н-пропилоксила, бензилоксила, аллилоксила, цианметоксихлора, брома, циано, формила, метил-, этил- или н-пропилкарбонилоксила, метил- или этиламинокарбонила. В кольце R2 могут присутствовать более сложные заместители, которые включают заместители (i) формулы -O(CH2)nZ1, в которой п равен 1, 2 или 3 и Z1 представляет собой первичную, вторичную, третичную или циклическую аминогруппу или С 1-С 6 алкоксил; или (ii) формулы -(Alk3)mZ1, в которой Alk3 представляет собой двухвалентную прямую или разветвленную цепь (С 1-С 3) алкилена, m равен 0 или 1 и Z1 представляет собой первичную, вторичную, третичную или циклическую аминогруппу или С 1-С 6 алкоксил. Предпочтительными для замещения являются положения 2, 4 и 5 фенильного кольца. В других простых структурах m равен 1, р, r и s снова каждый равен 0, a Q может быть необязательно замещенным карбоциклическим или гетероциклическим кольцом, например, фенилом, циклогек-6 009920 силом, пиридилом, морфолилом, пиперидинилом или пиперазинилом. В таких случаях Q является непосредственным заместителем в кольце, необязательно замещенном Ar1. В более сложных структурах настоящего изобретения один или более показателей m, р, r и s может быть равен 1, a Q может представлять собой водород или необязательно замещенное карбоциклическое или гетероциклическое кольцо. Например, р и/или s могут быть 1 и r может быть 0, так что Q связан с Аr1 через алкиленовый или алкениленовый радикал, например, С 1-С 3 алкиленовый радикал, который может быть необязательно замещенным. В других случаях каждый из показателей р, r и s может быть равен 1, и тогда Q связан с Ar1 через алкиленовый или алкениленовый радикал, который прерывается радикалом Z,содержащим гетероатом. Еще в некоторых случаях р и s могут быть равны 0 и r может быть равен 1, тогда Q связан с Ar1 через радикал Z, содержащий гетероатом. Отдельные примеры групп R2, используемых в соединениях настоящего изобретения, включают группы, присутствующие в соединениях, приведенных здесь в примерах. Необязательный заместитель R3R3 представляет собой водород или необязательный заместитель, как показано выше. В настоящее время предпочтительно, чтобы R3 являлся водородом. Группа R4 Когда R4 представляет собой карбоксамидную или сульфонамидную группу, примеры включают соединения формулы -CONRB(Alk)nRA или -SO2NRB (Alk) nRA, в которых Alk является двухвалентным алкиленовым, алкениленовым или алкиниленовым радикалом, например, радикалом -СН 2-, -CH2CH2-,-СН 2 СН 2 СН 2-, -СН 2 СН=СН- или -СН 2 СССН 2-, и радикал Alk может быть необязательно замещенным,n равен 0 или 1,RB представляет собой водород или C1-C6 алкил или С 2-С 6 алкенил, например, метил, этил, н- или изопропил или аллил. Здесь предпочтительно, чтобы RB представлял собой водород.RA является необязательным заместителем, таким как гидроксил, амино (включая моно- и ди-(С 1 С 3)алкиламино), карбамоил (-C(=O)NH2), -SO2OH, трифторметил; или необязательно замещенным карбоциклом, таким как, например, циклопропил, циклопентил, циклогексил, фенил, необязательно замещенный гидроксилом, амино, фтором, хлором, бромом, 3,4-метилендиоксилом, сульфамоилом(-SO2NH2), -SO2OH, метоксилом, метилсульфонилом, трифторметилом; или гетероциклилом, такими как,например, пиридил, фурил, тиенил, диазолил, N-пиперазинил, пирролилил, тетрагидрофуранил, тиазолил, 1-азабицикло[2,2,2]октанил, или N-морфолинилом, причем любое из гетероциклических колец может содержать заместитель, например, (С 1-С 3)алкил при атоме азота кольца, или RA и RB вместе с азотом,к которому они присоединены, образуют N-гетероциклическое кольцо, которое может необязательно содержать один или более гетероатомов, которые выбирают из О, S и N, и которое может быть необязательно замещено при одном или более атомах С или N кольца, а примеры таких N-гетероциклических колец включают морфолил, пиперидинил, пиперазинил и N-фенилпиперазинил. Здесь предпочтительно, чтобы R4 представлял собой карбоксамидную группу. В случае, когда R4 представляет собой сложный эфир карбоновой кислоты, примеры включают соединения формулы -COORc, в которой Rc является С 1-С 6 алкильной или С 2-С 6 алкенильной группой, такой как, например, метил, этил, н- или изо-пропил или аллил; или необязательно замещенной арильной или гетероарильной группой, такой как, например, необязательно замещенный фенил, пиридил или тиазолил; или необязательно замещенной группой арил(С 1-С 6 алкил)- или гетероарил (C1-С 6 алкил)-, такой как бензил или пиридилметил; или необязательно замещенной циклоалкильной группой, например, циклопентилом или циклогексилом. Отдельные примеры групп R4, используемых в соединениях настоящего изобретения, включают группы, присутствующие в соединениях, приведенных здесь в примерах. Предпочтительный подкласс соединений настоящего изобретения имеет формулу (II)R12 представляет собой (i) радикал формулы -O(CH2)nZ1, в которой n равен 1, 2 или 3 и Z1 является первичной, вторичной, третичной или циклической аминогруппой или C1-С 6 алкоксилом; или (ii) радикал формулы-(Alk3)mZ1, в которой Alk3 представляет собой двухвалентную прямую или разветвленную-7 009920 цепь (С 1-С 3) алкилена, m равен 0 или 1 и Z1 является первичной, вторичной, третичной или циклической аминогруппой или C1-C6 алкоксилом. Предпочтительно, чтобы в этом подклассе соединений (II) А представлял собой вторичную C1-С 6 алкиламиногруппу, например, такую, в которой заместитель C1-С 6 алкил выбирают из метила, этила, н- и изопропила, и R12 представляет собой (i) радикал формулы -O(CH2)nZ1,в которой n равен 1, 2 или 3 и Z1 представляет собой ди(С 1-С 3 алкил)амино или С 1-С 3 алкоксигруппу, например, такую, в которой компонент(ы) С 1-С 3 алкил выбирают из метила, этила и н- или изопропила. Отдельные соединения настоящего изобретения приведены в примерах, особенно соединения с указанной выше структурой (II). Существует множество стратегий синтеза соединений (I) настоящего изобретения, но все они основаны на известных химических методиках, которые известны химикам-синтетикам в области органической химии. Так, соединения формулы (I) можно синтезировать по методикам, описанным в стандартной литературе и хорошо известны специалистам. Типичными литературными источниками являются "Advanced organic chemistry", 4th Edition (Wiley), J. March, "Comprehensive Organic Transformation", 2nd Edition(Wiley), R.C. Larock, "Handbook of Heterocyclic Chemistry", 2nd Edition (Pergamon), A.R. Katritzky, обзорные статьи в сборниках "Synthesis", "Асc. Chem. Res.", "Chem. Rev.", или первичные литературные источники, которые можно найти стандартным литературным поиском или по вторичным источникам, таким как "Chemical Abstracts" или "Beilstein". Такие литературные методы касаются также приведенных здесь препаративных примеров и аналогичных методов. Например, можно использовать следующую общую схему реакции: Исходные вещества либо выпускаются промышленностью, либо могут быть синтезированы по литературным методикам. Кроме того, можно проводить реакции с различными R2, R3 или R4 для получения других соединений формулы (I). Соединения настоящего изобретения являются ингибиторами HSP90 и применимы в лечении заболеваний, чувствительных к ингибированию активности HSP90, таких как рак; вирусных заболеваний,таких как гепатит С (HCV) (Waxman, 2002); иммуносупрессии, например, при трансплантации (Bijlmakers, 2000 и Yorgin, 2000); воспалительных заболеваний (Bucci, 2000), таких как ревматоидный артрит,астма, MS, диабет I типа, волчанка, псориаз и воспаление кишечника; кистозный фиброз (Fuller, 2000); заболевания, связанные с ангиогенезом (Hur, 2002 и Kurebayashi, 2001): диабетическая ретинопатия, гемангиомы, псориаз, эндометриоз и опухолевый ангиогенез. Кроме того, ингибитор Hsp90 настоящего изобретения может защищать нормальные клетки от токсикоза, вызванного хемиотерапией, и могут использоваться в лечении заболеваний, главной чертой которых является неспособность к апоптозу. Ингибитор Hsp90 можно применять также для лечения заболеваний, при которых была бы полезна индукция стресса клеток или отклик белков на тепловой шок, например, для защиты от гипоксии при ишемии, возникающей из-за повышения уровня Hsp70 в сердце (Hutter, 1996 и Trost, 1998) и мозгу (Plumier, 1997 иRajder, 2000) . Индуцированное ингибитором Hsp90 повышение уровня Hsp70 может также быть полезно для лечения заболеваний, обусловленных главным образом денатурированием белка или его агрегацией,например, нейродегенеративные заболевания, такие как энцефалопатия/CJD, болезни Хантингтона и Альцгеймера (Sittler, 2001; Trazelt, 1995 и Winklhofer, 2001). Соответственно, изобретение также включает:(i) Фармацевтическую или ветеринарную композицию, содержащую соединение формулы (I), приведенной выше, вместе с фармацевтически или ветеринарно премлемым носителем.(ii) Применение соединения формулы (I), приведенной выше, в приготовлении композиции для ингибирования активности HSP90 in vitro или in vivo.(iii) Способ лечения заболеваний или состояний, чувствительных к ингибированию активностиHSP90 у млекопитающих, который включает введение млекопитающему количество соединения приведенной выше формулы (I), эффективное для ингибирования указанной активности HSP90. Понятно, что специальная доза для данного пациента будет зависеть от многих факторов, включая активность применяемого соединения, возраста больного, веса тела, общего состояния здоровья, пола,диеты, времени введения, пути введения, скорости выделения, комбинации с другими лекарствами, а также причины и тяжести данного заболевания, подвергающегося терапии. Вообще подходящая доза в составах для перорального введения будет составлять от 0,1 до 3000 мг один, два или три раза в день или эквивалентная дневная доза, введенная путем инъекции или другим путем. Однако оптимальная доза и частота дозирования будут определены клиническими испытаниями, что составляет обычную практику. Соединения настоящего изобретения можно приготовить для введения любым способом, совместимым с их фармакокинетическими свойствами. Композиции для перорального введения могут быть в-8 009920 виде таблеток, капсул, порошков, гранул, драже, жидких или загущенных составов для перорального и местного применения и в виде стерильных парентеральных растворов или суспензий. Таблетки и капсулы для перорального введения могут содержать единичную дозу и могут содержать традиционные эксципиенты, такие как связующие, например, сироп, акацию, желатин, сорбит, трагакант или поливинилпирролидон; наполнители, например, лактозу, сахар, кукурузный крахмал, фосфат кальция, сорбит или глицин; смазки для таблеток, например, стеарат магния, тальк, полиэтиленгликоль или силикагель; дезинтеграторы, например, картофельный крахмал, или приемлемые смачивающие реагенты, такие как лаурилсульфат натрия. Таблетки могут быть покрыты в соответствии со способами, хорошо известными в обычной фармацевтической практике. Персральные жидкие препараты могут быть в виде, например,водных или масляных суспензий, растворов, эмульсий, сиропов или эликсиров, или могут быть представлены в виде сухого вещества для растворения в воде или другой подходящей среде перед использованием. Такие жидкие препараты могут содержать традиционные добавки, такие как суспендирующие реагенты, например, сорбит, сироп, метилцеллюлоза, глюкозный сироп, желатин, гидрированние пищевые жиры; эмульгаторы, например, лецитин, сорбитмоноолеат или акация; неводные носители (которые могут включать пищевые масла), например, миндальное масло, фракционированное кокосовое масло,маслянистые сложные эфиры типа глицерина, пропиленгликоля или этиловый спирт; стабилизаторы,например, метил- или пропил-п-гидроксибензоат или сорбиновая кислота, и при желании традиционные отдушки или красители. Для местного применения на кожу лекарство можно приготовить в виде крема, лосьона или мази. Составы в виде крема или мази являются традиционными и хорошо известны специалистам, например,они описаны в стандартных пособиях для фармацевта, например, в Британской фармакопее. Активный ингредиент может быть также введен парентерально в стерильной среде. В зависимости от носителя и использованной концентрации, лекарство можно или суспендировать или растворить в носителе. Адъюванты, такие как местный анестетик, стабилизатор и буферные реагенты, лучше всего растворять в носителе. Следующие примеры иллюстрируют приготовление и активность отдельных соединений, относящихся к настоящему изобретению. Пример 1. Этиловый эфир 2-амино-4-фенилтиено[2,3-d]пиримидин-6-карбоновой кислоты К смеси 2-амино-4,6-дихлор-5-формилпиримидина (1 экв) и карбоната калия (1 экв) в ацетонитриле при перемешивании добавляли при комнатной температуре этил-2-меркаптоацетат (0,95 экв) и смесь перемешивали при обычной температуре три часа с последующим нагреванием при 80 С в течение часа. После охлаждения смесь упаривали досуха в вакууме. После хроматографирования в колонке с силикагелем, элюирования с этилацетатом и гексаном получали соединение, указанное в заголовке примера 1, в виде желтого порошка. ЖХ-МС время удерживания: 2.371 мин, [М+Н]+ 258.0 Стадия 2 (реакция Сузуки). Этиловый эфир 2-амино-4-фенилтиено[2,3-d]пиримидин-6-карбоновой кислоты Раствор вещества, полученного в примере 1, стадия 1 (1 экв) , фенилборной кислоты (1,2 экв) и карбоната натрия (1,2 экв) в 1,4-диоксане и воде (3,5:1) дезаэрировали продуванием азота в течение 5 мин. Добавляли Pd(PPh3)4 (0,05 экв) и смесь нагревали в микроволновой печи (Personal Chemistry Synthesisermicrowave) при 150C в течение 10 мин. После охлаждения, концентрирования в вакууме и препаративной ВЭЖХ получали соединение, указанное в заголовке примера 1, стадия 2, в виде белого порошка. ЖХ-МС время удерживания: 2,545 мин, [М+Н]+ 300,10. Это соединение проявило активность 'А' в анализе методом флуоресцентной поляризации, описанном ниже.(1 Н, s), 7.76 (2 Н, d, J = 8.0 Гц), 7.85 (2 Н, d, J = 8.0 Гц). Это соединение проявило активность 'В' в анализе методом флуоресцентной поляризации, описанном ниже. Следующие соединения таблицы 1 синтезированы и испытаны методом флуоресцентной поляризации, описанном ниже. Реакцию Сузуки проводили как в примере 1, стадия 2. Восстановительное аминирование проводили как в примере 33 следующим образом. Этиловый эфир 2-амино(4-пиперидин-1-илметилфенил)тиено[2,3-d]пиримидин-6-карбоновой кислоты (пример 33 в табл. 1) Пирролидин (5 экв) добавляли к суспензии этилового эфира 2-амино 4-(4-формилфенил)тиено[2,3d]пиримидин-6-карбоновой кислоты (1 экв) в метаноле. Реакционную смесь нагревали с обратным холодильником в течение 3,5 ч, затем охлаждали до комнатной температуре. Добавляли боргидрид натрия (3 экв) и перемешивали в течение 10 мин. Смесь концентрировали в вакууме, затем обрабатывали этилацетатом и водой. Водную и органическую фазы разделяли и органический слой промывали насыщенным раствором хлорида натрия, сушили и упаривали до получения желтого масла. Сырой продукт очищали препаративной ВЭЖХ. ЖХ-МС время удерживания: 1,803 мин, [М+Н]+ 383. Реакции замещения хлорида проводили как в примере 22 следующим образом: Метиловый эфир 2-амино-4-бензиламинотиено[2,3-d]пиримидин-6-карбоновой кислоты (пример 22 в табл. 1) Метиловый эфир 2-амино-4-хлортиено[2,3-d]пиримидин-6-карбоновой кислоты (100 мг, 0,39 ммоль), бензиламин (100 мкл) в 4 мл ТГФ облучали СВЧ при 110 С в течение 35 мин. Реакционную смесь охлаждали до комнатной температуры, подкисляли и очищали в стандартных условиях для нейтрального соединения. ЖХ-МС: RT = 2,391 мин; MS m/z = 329 (M+1). Примечание: интенсивность и время реакции зависят от реакционной способности амина. Например, для менее реакционноспособных аминов (таких как N-метиланилин) необходимы такие условия реакции: СВЧ-облучение при 160 С в течение 30 мин и 0,5 мл амина. Четвертая колонка табл. 1 показывает активность соединения в анализе методом флуоресцентной поляризации, описанном ниже. Соединение примера 1 суспендировали в концентрированном растворе гидроксида аммония и нагревали в микроволновой печи (Personal Chemistry Synthesiser microwave) при 140C в течение 20 мин. Концентрировали в вакууме и получали соединение, указанное в заголовке примера 42, в виде белого порошка. ЖХ-МС время удерживания: 1,824 мин, [М+Н]+ 271,10. Пример 43. Этиламид 2-амино-4-фенилтиено[2,3-d]пиримидин-6-карбоновой кислоты Гидроксид натрия (0,66 г; 16,5 ммоль) добавляли к суспензии этилового эфира 2-амино-4 фенилтиено[2,3-d]пиримидин-6-карбоновой кислоты (пример 1) (1,00 г; 3,34 ммоль) в смеси этанола (20 мл) и воды (2 мл). Смесь нагревали с обратным холодильником в течение 1 ч (до получения гомогенного светло-желтого растзора) и давали остыть до комнатной температуры. Растворители удаляли в вакууме и твердый остаток растворяли в воде (30 мл) и охлаждали на водяной бане со льдом. Смесь перемешивали и доводили до рН 1-2, прибавляя по каплям концентрированную хлористоводородную кислоту. Полученный осадок отфильтровывали, промывали водой, затем этанолом и диэтиловым эфиром. Беловатый продукт сушили в вакууме и получали 2-амино-4-фенилтиено[2,3-d]пиримидин-6-карбоновую кислоту в виде бесцветного твердого вещества (0,784 г; 87%). LC/MS RT = 1,845 мин; m/z = 272 (М+Н)+ Стадия 2. Этиламид 2-амино-4-фенилтиено[2,3-d]пиримидин-6-карбоновой кислоты О-(7-Азабензотриазол-1-ил)-N,N,N',N'-тетраметилуроний гексафторфосфат (0,380 г, 1,0 ммоль) добавляли к 2-амино-4-фенилтиено[2,3-d]пиримидин-6-карбоновой кислоте (0,187 г, 0,69 ммоль). Эту смесь суспендировали в диметилформамиде (ДМФА) (5,0 мл) и диизопропилэтиламине (0,696 мл; 4,0 ммоль) и получали желтый раствор. Добавляли диэтиламин гидрохлорид (0,122 г; 5,0 ммоль) и реакционную смесь нагревали в течение десяти минут при 100 С в запаянной ампуле, помещенной в микроволновой синтезатор. Удаляли ДМФА в вакууме и остаток экстрагировали этилацетатом (30 мл) и водой (30 мл). Фазы разделяли, органическую фазу промывали насыщенным раствором хлорида натрия и сушили над сульфатом натрия. Смесь отфильтровывали и растворители из фильтратов удаляли в вакууме, после чего оставался желтый твердый остаток, который адсорбировали на силикагель и очищали флэшхроматографией на силикагеле (20 г), элюируя с градиентом растворителя от 15 до 50% этилацетата в гексане. Получали этиламид 2-амино-4-фенилтиено [2, 3-d] пиримидин-6-карбоновой кислоты в виде светло-желтого твердого вещества (0.051 г; 25%). LC/MS RT = 2,08 мин; m/z = 299 (М+Н)+ 1 Н ЯМР (400 МГц, d6 ДМСО)1,.11 (t, 3H), 3.26 (m, 2H), 7.12 (s, 2H), 7.61 (m, 3H), 7.86 (m, 2 Н), 8.03 (s, 1H), 8.71 (t,1H). Соединение примера 43 проявило активность 'А' в анализе методом флуоресцентной поляризации,описанном ниже. Следующие соединения (табл. 2) получены по способу примера 43 из соответствующего сложного эфира (табл. 1) и подходящего амина. В последней колонке табл. 2 приведена активность соединения в анализе методом флуоресцентной поляризации, описанном ниже. Таблица 2 Бензальдегид (15 г, 141,3 ммоль, 1 экв), гуанидинкарбонат (25,47 г, 141.3 ммоль, 1 экв), этилцианоацетат (15.99 г, 141,3 ммоль, 1 экв) и безводный ацетат натрия (11,59 г, 141,3 ммоль, 1 экв) добавляли к 300 мл безводного пиридина и нагревали с обратным холодильником в течение 4 ч. Реакционную смесь затем охлаждали до комнатной температуры и растворитель удаляли при пониженном давлении. Коричневый остаток растирали с 400 мл водной (30%) уксусной кислоты и отфильтровывали. Желтый тведый остаток затем растирали с 300 мл диэтилового эфира и отфильтровывали, получая 2-амино-6-оксо-4 фенил-1,6-дигидропиримидин-5-карбонитрил в виде беловатого твердого вещества. Выход: 14.46 г (48%) 2-Амино-6-оксо-4-фенил-1,6-дигидропиримидин-5-карбонитрил (0,200 г, 0,942 ммоль, 1 экв) и пентасульфид фосфора (0,838 г, 3.770 ммоль, 4 экв) растворяли в 5 мл пиридина. Реакционную смесь нагревали с обратным холодильником в течение 2 ч, охлаждали до комнатной температуры и выливали в 100 мл воды. Смесь кипятили 1 ч, охлаждали до комнатной температуры и экстрагировали дихлорметаном. Объединенные органические экстракты промывали насыщенным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворитель удаляли в вакууме, оранжевый остаток растирали с диэтиловым эфиром и получали 2-амино-4-фенил-б-тиоксо-1,6-дигидропиримидин-5-карбонитрил в виде желтого твердого вещества. Выход: 0.118 г (55%) Металлический натрий (0,010 г, 0.438 ммоль, 1 экв) растворяли в 4 мл безводного этанола в атмосфере азота. Добавляли 2-амино-4-фенил-6-тиоксо-1,6-дигидропиримидин-5-карбонитрил (0,100 г, 0,438 ммоль, 1 экв) и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Добавляли 2-бромэтилацетат (0,073 г, 0,438 ммоль, 1 экв). Реакционную смесь перемешивали еще 30 мин при комнатной температуре. Затем добавляли раствор натрия (0,010 г, 0.438 ммоль, 1 экв) в 1 мл безводного этанола. Реакционную смесь кипятили с обратным холодильником в течение 5 ч. Реакционную смесь охлаждали до комнатной температуры и останавливали реакцию с помощью воды. Осадок отфильтровывали,растирали с диэтиловым эфиром и получали этиловый эфир 2,5-диамино-4-фенилтиено[2,3-d]пиримидин-6-карбоновой кислоты в виде желтого твердого вещества.LCMS время удерживания = 2,42 мин, m/z рассчитано для C15H15N4O2S 315.38 (М + Н), найдено 315.1. 1 Н ЯМР (ДМСО-d6, 2.50)1.19 (t, 3 Н, J = 7.1), 4.13 (q, 2H, J =7.1), 5.79 (bs, 2H), 7.29 (bs, 2 Н), 7.507.56 (m, 5H). Это соединение проявило активность В в анализе методом флуоресцентной поляризации, описанным ниже. Пример 75. Амид 2-амино-5-метил-4-фенилтиено [2, 3-d] пиримидин-6-карбоновой кислоты Получен по опубликованной методике Bryan P. McKibben, Craig H. Cartwright, Arlindo L. Castelhano Гуанидинкарбонат добавляли к раствору этилового эфира 5-амино-4-бензоил-3-метилтиофен-2 карбоновой кислоты и суспензию нагревали при 175 С в течение 3 ч в атмосфере азота. Суспензии давали остыть и добавляли воду. Смесь экстрагировали этилацетатом, экстракты промывали и сушили. Раствор концентрировали и остаток очищали хроматогрфически, элюируя смесью этилацетата и гексана. ЖХ время удерживания 2,17 мин, [М+Н]+ 285,1 (Время выхода 3,75 мин). Это соединение проявило активность В в анализе методом флуоресцентной поляризации, описанном ниже. Примеры соединений, полученных способами, подобными описанным выше, приведены в табл. 3. Четвертая колонка табл. 3 показывает активность соединения в анализе методом флуоресцентной поляризации, описанном ниже. Таблица 3
МПК / Метки
МПК: A61K 31/00, C07D 495/04, A61P 35/00
Метки: пиримидотиофена, соединения
Код ссылки
<a href="https://eas.patents.su/30-9920-soedineniya-pirimidotiofena.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения пиримидотиофена</a>
Предыдущий патент: Соединения изоксазола
Следующий патент: Способ лечения синдрома отвыкания от зависимости у беременных женщин
Случайный патент: Устройство обеззараживания воздуха, например, в ламинарном боксе












