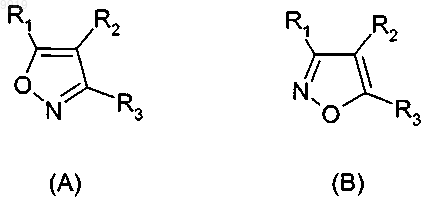
Соединения изоксазола
Номер патента: 9919
Опубликовано: 28.04.2008
Авторы: Драйсдейл Мартин Джеймс, Вебб Пол, Джеймс Карен Элизабет, Мэтьюз Томас Питер, Макдоналд Эдвард, Димок Брайан Уилльям, Чеунг Квай Минг, Финч Хэрри
Формула / Реферат
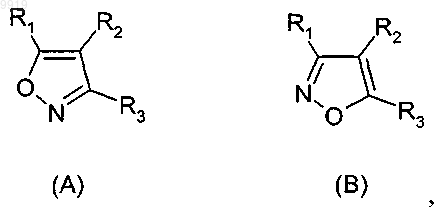
1. Применение соединения формулы (А) или (В) или его соли, N-оксида, гидрата, или сольвата, или его пролекарства для получения композиции для ингибирования HSP-90 активности
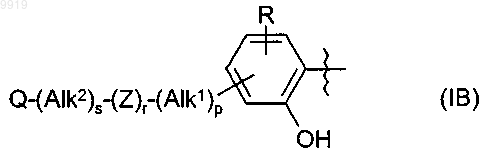
где R1 представляет собой группу формулы (IB)
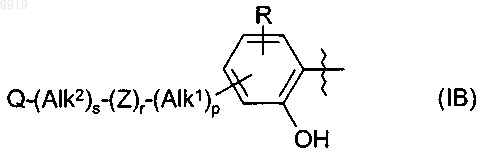
в которой в любой совместимой комбинации R представляет собой необязательный заместитель;
Alk1 и Alk2 представляют собой необязательно замещенный двухвалентный C1-C6алкиленовый или C2-C6алкениленовый радикалы;
p, r и s независимо имеют значения 0 или 1;
Z представляет собой -О-, -S-, -(С=O)-, -(C=S)-, -SO2-, -C(=O)O-, -C(=O)NRA-, -C(=S)NRA-,
-SO2NRA-, -NRAC(=O)-, -NRASO2- или -NRA-, где RA представляет собой водород или C1-C6алкил;
Q представляет собой водород или необязательно замещенный карбоциклический или гетероциклический радикал;
R2 представляет собой:
(i) группу формулы (IA)
| -Ar1-(Alk1)p-(Z)r-(Alk2)s-Q, | (IA) |
в которой в любой совместимой комбинации
Ar1 представляет собой необязательно замещенный арильный или гетероарильный радикал и
Alk1, Alk2, p, r, s, Z, RA и Q являются такими, как определено в отношении R1;
(ii) карбоксамидный радикал или
(iii) неароматическое карбоциклическое или гетероциклическое кольцо, где углерод в кольце является необязательно замещенным и/или азот в кольце является необязательно замещенным с помощью группы формулы
-(Alk1)p-(Z)r-(Alk2)s-Q,
где Q, Alk1, Alk2, Z, p, r и s имеют значения, как определено выше в отношении группы (IA);
R3 представляет собой водород, необязательно замещенный циклоалкил, циклоалкенил, C1-C6алкил, C1-C6алкенил или C1-C6алкинил, или карбоксил, карбоксамид, или карбоксильную сложноэфирную группу,
причем возможные заместители выбраны из (C1-C6)алкила, (C1-C6)алкокси, гидрокси, гидрокси(C1-C6)алкила, меркапто, меркапто(C1-C6)алкила, (C1-C6)алкилтио, галогена, трифторметила, трифторметокси, нитро, нитрил (-CN), оксо, фенила, -СООН, -COORA, -CORA, -SO2RA, -CONH2, -SO2NH2, -CONHRA,
-SO2NHRA, -CONRARB, -SO2NRARB, -NH2, -NHRA, -NRARB, -OCONH2, -OCONHRA, -OCONRARB,
-NHCORA, -NHCOORA, -NRBCOORA, -NHSO2ORA, -NRBSO2ORA, -NHCONH2, -NRACONH2, -NHCONHRB, -NRACONHRB, -NHCONRARB или -NRACONRARB, где RA и RB независимо представляют собой
(C1-C6)алкильную группу; и
"карбоциклический" означает моно-, би- или трициклический радикал, имеющий от 3 до 14 кольцевых атомов углерода;
"гетероциклический" означает моно-, би- или трициклический неароматический радикал, имеющий от 3 до 14 кольцевых атомов и содержащий один или большее количество гетероатомов, выбранных из S, N и О или группы, состоящей из моноциклического неароматического радикала, имеющего от 3 до 14 кольцевых атомов и содержащего один или большее количество таких гетероатомов, которые ковалентно связаны с другим таким радикалом или с моноциклическим карбоциклическим радикалом, имеющим от 3 до 7 кольцевых атомов;
"арил" означает карбоциклический радикал, как указано выше, который является ароматическим;
"гетероарил" означает гетероциклический радикал, как указано выше, который является ароматическим.
2. Применение соединения формулы (А) или (В) или его соли, N-оксида, гидрата, или сольвата, или его пролекарства для получения композиции для ингибирования HSP-90 активности

где R1 представляет собой группу формулы (IA)
| Ar1-(Alk1)p-(Z)r-(Alk2)s-Q, | (IA) |
в которой в любой совместимой комбинации
Ar1 представляет собой необязательно замещенный арильный или гетероарильный радикал,
Alk1 и Alk2 представляют собой необязательно замещенный двухвалентный C1-C6алкиленовый или C2-C6алкениленовый радикалы,
p, r и s независимо имеют значения 0 или 1,
Z представляет собой -О-, -S-, -(С=O)-, -(C=S)-, -SO2-, -C(=O)O-, -C(=O)NRA-, -C(=S)NRA-,
-SO2NRA-, -NRAC(=O)-, -NRASO2- или -NRA-, где RA представляет собой водород или C1-C6алкил, и
Q представляет собой водород или необязательно замещенный карбоциклический или гетероциклический радикал;
R2 представляет собой:
(i) группу формулы (IA), как определено в отношении R1;
(ii) карбоксамидный радикал или
(iii) неароматическое карбоциклическое или гетероциклическое кольцо, где углерод в кольце является необязательно замещенным и/или азот в кольце является необязательно замещенным с помощью группы формулы
-(Alk1)p-(Z)r-(Alk2)s-Q,
где Q, Alk1, Alk2, Z, p, r и s имеют значения, как определено выше в отношении группы (IA); и
R3 представляет собой карбоксамидную группу,
причем возможные заместители выбраны из (C1-C6)алкила, (C1-C6)алкокси, гидрокси,
гидрокси(C1-C6)алкила, меркапто, меркапто(C1-C6)алкила, (C1-C6)алкилтио, галогена, трифторметила, трифторметокси, нитро, нитрил (-CN), оксо, фенила, -COOH, -COORA, -CORA, -SO2RA, -CONH2,
-SO2NH2, -CONHRA, -SO2NHRA, -CONRARB, -SO2NRARB, -NH2, -NHRA, -NRARB, -OCONH2, -OCONHRA,
-OCONRARB, -NHCORA, -NHCOORA, -NRBCOORA, -NHSO2ORA, -NRBSO2ORA, -NHCONH2, -NRACONH2, -NHCONHRB, -NRACONHRB, -NHCONRARB или -NRACONRARB, где RA и RB независимо представляют собой (C1-C6)алкильную группу, и
"карбоциклический" означает моно-, би- или трициклический радикал, имеющий от 3 до 14 кольцевых атомов углерода;
"гетероциклический" означает моно-, би- или трициклический неароматический радикал, имеющий от 3 до 14 кольцевых атомот ш содержащий один или большее количество гетероатомов, выбранных из S, N и О или группы, состоящей из моноциклического неароматического радикала, имеющего от 3 до 14 кольцевых атомов и содержащего один или большее количество таких гетероатомов, которые ковалентно связаны с другим таким радикалом или с моноциклическим карбоциклическим радикалом, имеющим от 3 до 7 кольцевых атомов;
"арил" означает карбоциклический радикал, как указано выше, который является ароматическим;
"гетероарил" означает гетероциклический радикал, как указано выше, который является ароматическим.
3. Применение по п.1 или 2, где соединение представлено соединенитем формулы (А) или его солью, N-оксидом, гидратом или сольватом или его пролекарством.
4. Применение по п.2 или 3, при зависимости от п.2, где R1 имеет формулу (IB)
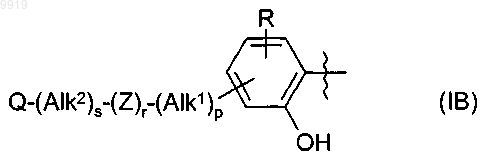
где Alk1, Alk2, р, r, s, Z и Q являются такими, как определено в п.1, и
R представляет собой один или большее количество необязательных заместителей.
5. Применение по любому из предыдущих пунктов, где кольцевой атом углерода, смежный с гидроксильной группой в радикале формулы (1H), является незамещенным.
6. Применение по любому из пп.1-3, где в R1 каждый из p, r и s имеет значение 0 и Q представляет собой водород.
7. Применение по п.2 или любому из пп.3-6 при зависимости от п.2, где R1 представляет собой необязательно замещенный фенил.
8. Применение по п.6, где R1 представляет собой 2-гидроксифенил, необязательно замещенный с помощью одного или большего количества гидроксигрупп, метила, этила, метокси, этокси, хлора или брома.
9. Применение по п.6, где R1 представляет собой 2,4-дигидроксифенил, замещенный в 5 положении с помощью небольшого липофильного заместителя.
10. Применение по п.9, где небольшой липофильный заместитель представляет собой метил, этил, изопропил, изобутил, трет-бутил, хлор или бром.
11. Применение по п.9 или 10, где гидроксильные группы в R1 являются защищенными с помощью групп, которые отщепляются в организме для того, чтобы высвободить гидроксильные группы.
12. Применение по п.11, где защитные группы представляют собой метилкарбонилокси или изопропиламинокарбонилоксигруппы.
13. Применение по любому из пп.1-3, где в R1 каждый из p, r и s имеет значение 0 и Q представляет собой необязательно замещенное карбоциклическое или гетероциклическое кольцо.
14. Применение по п.13, где Q представляет собой необязательно замещенное фенильное или пиридильное кольцо.
15. Применение по любому из пп.1-3, где в R1 каждый из р и s имеет значение 1 и r имеет значение 0.
16. Применение по любому из пп.1-3, где в R1 каждый из p, r и s имеет значение 1.
17. Применение по любому из пп.1-3, где в R1 каждый из р и s имеет значение 0 и r имеет значение 1.
18. Применение по любому из предыдущих пунктов, где R2 представляет собой группу формулы (IA).
19. Применение по п.18, где R2 представляет собой необязательно замещенный 2-, 3- или
4-пиридил, 2- или 3-фуранил, 2- или 3-тиенил или тиазолил.
20. Применение по п.19, где необязательные заместители, присутствующие в R2, выбраны из метокси, этокси, метилендиокси, этилендиокси, фтора, хлора, брома и трифторметила.
21. Применение по п.18, где R2 представляет собой фенил, замещенный в 4 положении метокси, этокси, фтором, хлором, бромом, пиперазинилом, N-метилпиперазинилом или пиперидинилом.
22. Применение по любому из пп.1-17, где R2 имеет частично структуру

где замещенная аминогруппа -NR10Rn представляет собой растворимую группу.
23. Применение по п.22, где растворимая группа выбрана из морфолинила, пиперидинила, пиперазинила, пирролидинила, этиламино изопропиламино, диэтиламино, циклогексиламино, циклопентиламино, метоксиэтиламино, пиперидин-4-ила, N-ацетилпиперазинила, метилсульфониламино, тиоморфолинила, тиоморфолинилдиоксида, 4-гидроксиэтилпиперидинила и 4-гидроксипиперидинила.
24. Применение по любому из пп.1-17, где R3 представляет собой карбоксамидную группу формулы
-CONRB(Alk)nRA,
где Alk представляет собой двухвалентный алкиленовый, алкениленовый или алкиниленовый радикал, например -CH2-, -CH2CH2-, -CH2CH2CH2-, -CH2CH=CH- или -CH2CCCH2-радикал, и Alk радикал может быть необязательно замещенным;
n имеет значение 0 или 1;
RB представляет собой водород или C1-C6алкильную или C2-C6алкенильную группу, например метил, этил, н- или изопропил или аллил;
RA представляет собой гидроксигруппу или необязательно замещенный карбоцикл, например гидрокси и/или хлорзамещенный фенил и 3,4 метилендиоксифенил; или гетероциклил, например пиридил, фурил, тиенил, N-пиперазинил или N-морфолинил, в которых любые из гетероциклических колец могут быть замещенными, или
RA и RB, взятые вместе с атомом азота, к которому они присоединены, образуют
N-гетероциклическое кольцо, которое может необязательно содержать один или большее количество дополнительных гетероатомов, выбранных из О, S и N, и которое может необязательно быть замещенным по одому или большему количеству кольцевых С или N атомов, примеры таких N-гетероциклических колец включают морфолино, пиперидинил, пиперазинил и N-фенилпиперазинил.
25. Применение по п.1 или любому из пп.3-24 при зависимости от п.1, где R3 представляет собой водород, метил, этил, н- или изопропил, трифторметил, гидроксиэтил, метилсульфонаминометил или карбоксамидную группу -CONRB(Alk)nRA.
26. Применение по любому из предыдущих пунктов, где R3 представляет собой карбоксамидную группу -CONRB(Alk)nRA.
27. Применение по любому из пп.1-24, где R3 представляет собой этиламинокарбонил или изопропиламинокарбонил.
28. Применение по п.1 или 2, где соединение имеет формулу (ID) или формулу В его регоизомера
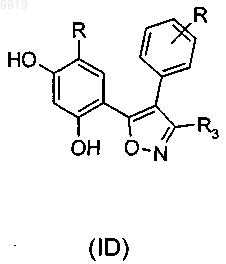
где каждый R независимо представляет собой необязательный заместитель и R3 представляет собой карбоксамидную группу.
29. Применение по п.1 или 2, где соединение имеет формулу (IE) или формулу В его регоизомера
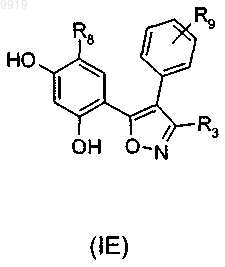
где R3 представляет собой карбоксамидную группу;
R9 представляет собой -CH2NR10R11 или -NR10R11, где замещенная аминогруппа -NR10R11 представляет собой растворимую группу;
R8 представляет собой необязательный заместитель.
30. Применение по п.29, где R3 представляет собой этиламинокарбонил CH3H2NHC(=O)- или изопропиламинокарбонил (CH3)2CHNHC(=O)-; замещенная аминогруппа -NR10R11 в R9 представляет собой морфолинил, пиперидинил, пиперазинил, пирролидинил, этиламино, изопропиламино, диэтиламино, циклогексиламино, циклопентиламино, метоксиэтиламино, пиперидин-4-ил, N-ацетилпиперазинил,
N-метилпиперазинил, метилсульфониламино, тиоморфолинил, тиоморфолинилдиоксид,
4-гидроксиэтилпиперидинил или 4-гидроксипиперидинил; и R8 представляет собой этил, изопропил, бром или хлор.
31. Применение по п.1 или 2, где соединение выбрано из
этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты,
этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-пиперидин-1-илметилфенил)изоксазол-3-карбонотющ кислоты,
этиламида 4-(4-диэтиламинометилфенил)-5-(2,4-дигидрокси-5-изопропилфенил)-изоксазол-3-карбоновой кислоты,
этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3-карбоновой кислоты,
этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-этиламинометилфенил)изоксазол-3-карбоновой кислоты,
этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-[4-(изопропиламинометил)фенил]изоксазол-3-карбоновой кислоты,
этиламида 4-(4-циклогексиламинометилфенил)-5-(2,4-дигидрокси-5-изопропилфенил)изоксазол-3-карбоновой кислоты,
этиламида 4-[4-(трет-бутиламинометил)фенил]-5-(2,4-дигидрокси-5-изопропилфенил)изоксазол-3-карбоновой кислоты,
этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-{4-[(2-метоксиэтиламино)метил]фенил}изоксазол-3-карбоновой кислоты,
изопропиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты,
изопропиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3-карбоновой кислоты,
этиламида 5-(5-трет-бутил-2,4-дигидроксифенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3-карбоновой кислоты,
этиламида 5-(5-трет-бутил-2,4-дигидроксифенил)-4-(4-пиперидин-1-илметилфенил)изоксазол-3-карбоновой кислоты,
этиламида 5-(2,4-дигидрокси-5-изобутилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты,
этиламида 5-(2,4-дигидрокси-5-изобутилфенил)-4-(4-пиперидин-1-илметилфенил)изоксазол-3-карбоновой кислоты,
этиламида 5-(5-трет-бутил-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты,
этиламида 5-(5-трет-бутил-2,4-дигидроксифенил)-4-(4-диэтиламинометилфенил)изоксазол-3-карбоновой кислоты,
этиламида 3-(5-хлор-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-5-карбоновой кислоты,
этиламида 4-(4-диэтиламинометилфенил)-5-(4,6-дигидрокси-2'-метилбифенил-3-ил)изоксазол-3-карбоновой кислоты,
этиламида 4-(4-диэтиламинометилфенил)-5-(4'-фтор-4,6-дигидроксибифенил-3-ил)изоксазол-3-карбоновой кислоты,
этиламида 4-(4-диэтиламинометилфенил)-5-(4,6-дигидроксибифенил-3-ил)изоксазол-3-карбоновой кислоты,
этиламида 5-(2'-фтор-4,6-дигидроксибифенил-3-ил)-4-(4-пирролидин-1-илметилфенил)изоксазол-3-карбоновой кислоты,
этиламида 5-(4,6-дигидроксибифенил-3-ил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты,
этиламида 5-(2,4-дигидрокси-5-фенэтилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты,
этиламида 5-(5-хлор-2,4-дигидроксифенил)-4-(4-пиперидин-1-илметилфенил)изоксазол-3-карбоновой кислоты изопропиламид,
этиламида 4-(4-диэтиламинометилфенил)-5-(5-этил-2,4-дигидроксифенил)изоксазол-3-карбоновой кислоты,
этиламида 5-(5-этил-2,4-дигидроксифенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3-карбоновой кислоты,
этиламида 5-(5-этил-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты,
этиламида 5-(5-хлор-2,4-дигидроксифенил)-4-(4-диэтиламинометилфенил)изоксазол-3-карбоновой кислоты,
этиламида 5-(5-хлор-2,4-дигидроксифенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3-карбоновой кислоты,
этиламида 5-(5-хлор-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты
и их солей, гидратов, сольватов и пролекарств.
32. Применение по любому из пп.1-31, где заболевание или состояние представляет собой рак, вирусное заболевание, ревматоидный артрит, бронхиальную астму, рассеянный склероз, сахарный диабет 1 типа, СКВ, псориаз и воспалительные заболевание кишки, кистозный фиброз, диабетическую ретинопатию, гемангиомы, псориаз, эндометриоз, опухолевый ангиогенез, токсичность, вызванную химиотерапией, нарушение индукции апоптоза, гипоксические ишемические повреждения, обусловленные увеличением количества HSP-70 в сердце и мозге, скрепи/болезнь Крейцфельда-Якоба, болезни Гентингтона или Альцгеймера.
33. Соединение формулы (А) или (В) или его соль, N-оксид, гидрат или сольват или его пролекарства
где R1 представляет собой группу формулы (IB)
в которой в любой совместимой комбинации
R представляет собой один или большее количество необязательных заместителей;
Alk1 и Alk2 представляют собой необязательно замещенный двухвалентный C1-C6алкиленовый или C2-C6алкениленовый радикалы;
p, r и s независимо имеют значения 0 или 1;
Z представляет собой -О-, -S-, -(С=O)-, -(OS)-, -SO2-, -C(=O)O-, -C(=O)NRA-, -C(=S)NRA-, -SO2NRA-, -NRAC(=O)-, -NRASO2- или -NRA-, где RA представляет собой водород или C1-C6алкил, и
Q представляет собой водород или необязательно замещенный карбоциклический или гетероциклический радикал;
R2 представляет собой:
(i) группу формулы (IA)
| -Ar1-(Alk1)p-(Z)r-(Alk2)s-Q, | (IA) |
в которой в любой совместимой комбинации
Ar1 представляет собой необязательно замещенный арильный или гетероарильный радикал и
Alk1, Alk2, p, r, s, Z, RA и Q являются такими, как определено в отношении R1;
(ii) карбоксамидный радикал или
(iii) неароматическое карбоциклическое или гетероциклическое кольцо, где углерод в кольце является необязательно замещенным и/или азот в кольце является необязательно замещенным с помощью группы формулы
-(Alk1)p-(Z)r-(Alk2)s-Q,
где Q, Alk1, Alk2, Z, p, r и s имеют значения, как определено выше в отношении группы (IA);
R3 представляет собой водород, необязательно замещенный циклоалкил, циклоалкенил, C1-C6алкил, C1-C6алкенил или C1-C6алкинил; или
карбоксил, карбоксамид или карбоксильную сложноэфирную группу, причем возможные заместители выбраны из (C1-C6)алкила, (C1-C6)алкокси, гидрокси, гидрокси(C1-C6)алкила, меркапто,
меркапто(C1-C6)алкила, (C1-C6)алкилтио, галогена, трифторметила, трифторметокси, нитро, нитрил
(-CN), оксо, фенила, -COOH, -COORA, -CORA, -SO2RA, -CONH2, -SO2NH2, -CONHRA, -SO2NHRA,
-CONRARB, -SO2NRARB, -NH2, -NHRA, -NRARB, -OCONH2, -OCONHRA, -OCONRARB, -NHCORA,
-NHCOORA, -NRBCOORA, -NHSO2ORA, -NRBSO2ORA, -NHCONH2, -NRACONH2, -NHCONHRB,
-NRACONHRB, -NHCONRARB или -NRACONRARB, где RA и RB независимо представляют собой
(C1-C6)алкильную группую; и
"карбоциклический" означает моно-, би- или трициклический радикал, имеющий от 3 до 14 кольцевых атомов углерода;
"гетероциклический" означает моно-, би- или трициклический неароматический радикал, имеющий от 3 до 14 кольцевых атомов и содержащий один или большее количество гетероатомов, выбранных из S, N и О или групяы, состоящей из моноциклического неароматического радикала, имеющего от 3 до 14 кольцевых атомов и содержащего один или большее количество таких гетероатомов, которые ковалентно связаны с другим таким радикалом или с моноциклическим карбоциклическим радикалом, имеющим от 3 до 7 кольцевых атомов;
"арил" означает карбоциклический радикал, как указано выше, который является ароматическим;
"гетероарил" означает гетероциклический радикал, как указано выше, который является ароматическим;
при условии, что соединение не соответствует ни одной из формул (X), (Y) или (Z)

и, кроме того, при условии, что соединение не является ни одним из соединений, представленных в следующей таблице:
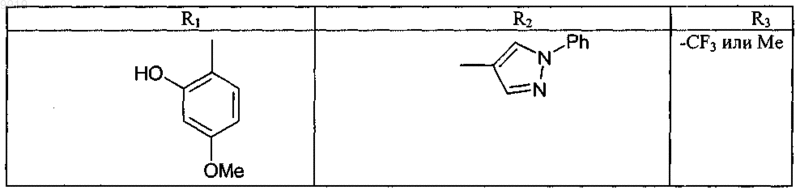
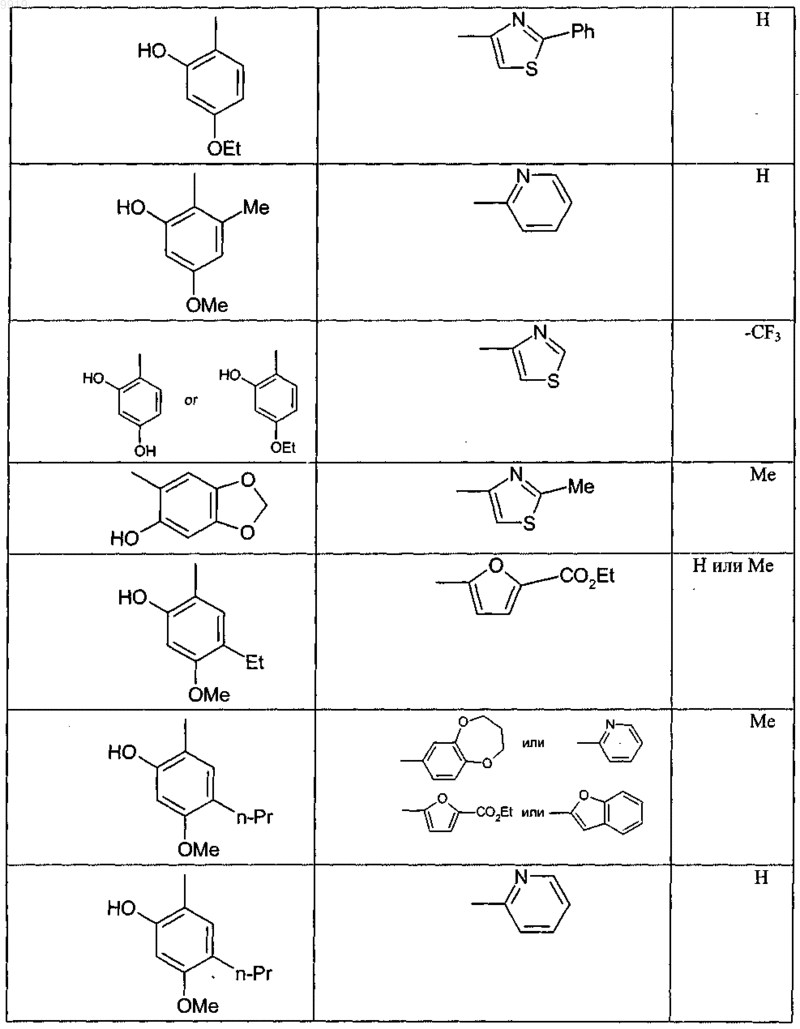
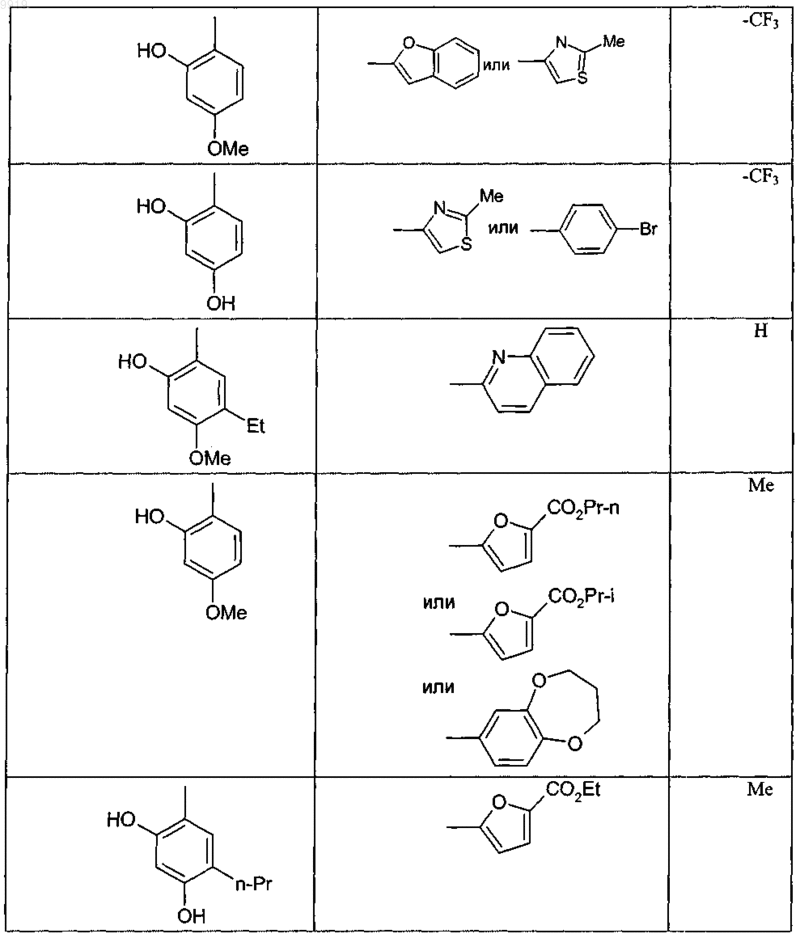
34. Соединение формулы (А) или (В) или его соль, N-оксид, гидрат или сольват или его пролекарство
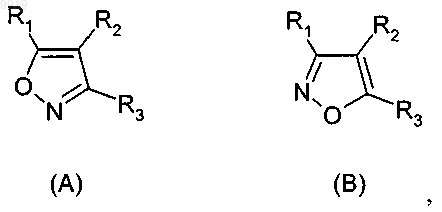
где R1 представляет собой группу формулы (IA)
| -Ar1-(Alk1)p-(Z)r-(Alk2)s-Q, | (IA) |
в которой в любой совместимой комбинации
Ar1 представляет собой необязательно замещенный арильный или гетероарильный радикал,
Alk1 и Alk2 представляют собой необязательно замещенный двухвалентный C1-C6алкиленовый или C2-C6алкениленовый радикалы,
p, r и s независимо имеют значения 0 или 1,
Z представляет собой -О-, -S-, -(C=O)-, -(C=S), -SO2-, -C(=O)O-, -C(=O)NRA-, -C(=S)NRA-, -SO2NRA-, -NRAC(=O)-, -NRASO2- или -NRA-, где RA представляет собой водород или C1-C6алкил и
Q представляет собой водород или необязательно замещенный карбоциклический или гетероциклический радикал;
R2 представляет собой:
(i) группу формулы (IA), как определено в отношении R1;
(ii) карбоксамидный радикал или
(iii) неароматическое карбоциклическое или гетероциклическое кольцо, где углерод в кольце является необязательно замещенным и/или азот в кольце является необязательно замещенным с помощью группы формулы
-(Alk1)p-(Z)r-(Alk2)s-Q,
где Q, Alk1, Alk2, Z, p, r и s имеют значения, как определено выше в отношении группы (IA); и
R3 представляет собой карбоксамидную группу,
причем возможные заместители выбраны из (C1-C6)алкила, (C1-C6)алкокси, гидрокси,
гидрокси(C1-C6)алкила, меркапто, меркапто(C1-C6)алкила, (C1-C6)алкилтио, галогена, трифторметила, трифторметокси, нитро, нитрил (-CN), оксо, фенила, -COOH, -COORA, -CORA, -SO2RA, -CONH2,
-SO2NH2, -CONHRA, -SO2NHRA, -CONRARB, -SO2NRARB, -NH2, -NHRA, -NRARB, -OCONH2, -OCONHRA,
-OCONRARB, -NHCORA, -NHCOORA, -NRBCOORA, -NHSO2ORA, -NRBSO2ORA, -NHCONH2, -NRACONH2, -NHCONHRB, -NRACONHRB, -NHCONRARB или -NRACONRARB, где RA и RB независимо представляют собой (C1-C6)алкильную группую; и
"карбоциклический" означает моно-, би- или трициклический радикал, имеющий от 3 до 14 кольцевых атомов углерода;
"гетероциклический" означает моно-, би- или трициклический неароматический радикал, имеющий от 3 до 14 кольцевых атомов и содержащий один или большее количество гетероатомов, выбранных из S, N и О или группы, состоящей из моноциклического неароматического радикала, имеющего от 3 до 14 кольцевых атомов и содержащего один или большее количество таких гетероатомов, которые ковалентно связаны с другим таким радикалом или с моноциклическим карбоциклическим радикалом, имеющим от 3 до 7 кольцевых атомов;
"арил" означает карбоциклический радикал, как указано выше, который является ароматическим;
"гетероарил" означает гетероциклический радикал, как указано выше, который является ароматическим.
35. Соединение по п.33 или 34, где соединение представлено формулой (А) или его солью,
N-оксидом, гидратом или сольватом или его пролекарством.
36. Соединение по п.34 или 35, где R1 имеет формулу (IB)
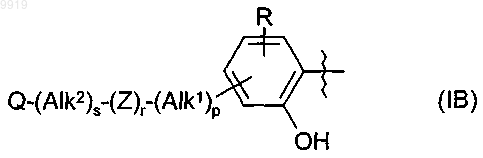
где Alk1, Alk2, p, r, s, Z и Q являются такими, как определено в п.1, и R представляет собой один или большее количество необязательных заместителей.
37. Соединение по любому из пп.33-36, где кольцевой атом углерода, смежный с гидроксильной группой в радикале формулы (IB), является незамещенным.
38. Соединение по любому из пп.33-35, где в R1 каждый из p, r и s имеет значение 0 и Q представляет собой водород.
39. Соединение по п.33 или любому из пп.35-38 при зависимости от п.34, где R1 представляет собой необязательно замещенный фенил.
40. Соединение по п.38, где R1 представляет собой 2-гидроксифенил, необязательно замещенный одним или более из гидроксигрупп, метила, этила, метокси, этокси, хлора или брома.
41. Соединение по п.38, где R1 представляет собой 2,4-дигидроксифенил, замещенный в 5 положении с помощью небольшого липофильного заместителя.
42. Соединение по п.41, где небольшой липофильный заместитель представляет собой метил, этил, изопропил, изобутил, трет-бутил, хлор или бром.
43. Соединение по п.41 или 42, где гидроксильные группы в R1 являются защищенными с помощью группы, которая отщепляется в организме, чтобы высвободить гидроксильные группы.
44. Соединение по п.43, где защитные группы представляют собой алкилкарбонилокси или алкиламинокарбонилоксигруппы.
45. Соединение по п.43, где защитные группы представляют собой метилкарбонилокси или изопропиламинокарбонилокси.
46. Соединение по любому из пп.33-35, где в R1 каждый из p, r и s имеет значение 0 и Q представляет собой необязательно замещенное карбоциклическое или гетероциклическое кольцо.
47. Соединение по п.46, где Q представляет собой необязательно замещенный фенил или пиридильное кольцо.
48. Соединение по любому из пп.33-35, где в R1 каждый р и/или s имеет значение 1 и r имеет значение 0.
49. Соединение по любому из пп.33-35, где в R1 каждый из p, r и s имеет значение 1.
50. Соединение по любому из пп.33-35, где в R1 каждый р и s имеет значение 0 и r имеет значение 1.
51. Соединение по любому из пп.33-50, где R2 представляет собой группу формулы (IA).
52. Соединение по п.51, где R2 представляет собой необязательно замещенный 2-, 3- или 4-пиридил, 2- или 3-фуранил, 2- или 3-тиенил или тиазолил.
53. Соединение по п.52, где необязательные заместители, присутствующие в R2, выбраны из метокси, этокси, метилендиокси, этилендиокси, фтора, хлора, брома и трифторметила.
54. Соединение по п.51, где R2 представляет сосющ фенил, замещенный в 4 положении с помощью метокси, этокси, фтора, хлора, брома, пиперазинила, N-метилпиперазинила или пиперидинила.
55. Соединение по любому из пп.33-51, где R2 имеет частично структуру

где замещенная аминогруппа -NR10R11 представляет собой растворимую группу.
56. Соединение по п.55, где растворимая группа выбрана из морфолинила, пиперидинила, пиперазинила, пирролидинила, этиламино, изопропиламино, диэтиламино, циклогексиламино, циклопентиламино, метоксиэтиламино, пиперидин-4-ила, N-ацетилпиперазинила, метилсульфониламино, тиоморфолинила, тиоморфолинилдиоксида, 4-гидроксиэтилпиперидинила и 4-гидроксипиперидинила.
57. Соединение по любому из пп.33-50, где R3 представляет собой карбоксамидную группу формулы
-CONRB(Alk)nRA,
где Alk представляет собой двухвалентный алкиленовый, алкениленовый или алкиниленовый радикал, например -CH2-, -CH2CH2-, -CH2CH2CH2-, -CH2CH=CH- или -CH2CCCH2-радикал, и Alk радикал может быть необязательно замещенным,
n имеет значение 0 или 1,
RB представляет собой водород или C1-C6алкильную или C2-C6алкенильную группу, например метил, этил, н- или изопропил или аллил,
RA представляет собой гидрокси или необязательно замещенный карбоцикл, например гидрокси и/или хлорзамещенный фенил и 3,4 метилендиоксифенил; или гетероциклил, например пиридил, фурил, тиенил, N-пиперазинил или N-морфолинил, в которых любые из гетероциклических колец могут быть замещенными,
или RA и RB, взятые вместе атомом азота, к которому они присоединены, образуют
N-гетероциклическое кольцо, которое может необязательно содержать один или большее количество дополнительных гетероатомов, выбранных из О, S и N и которое может необязательно быть замещенным по одному или большему количеству кольцевых С или N атомов, примеры таких N-гетероциклических колец включают морфолино, пиперидинил, пиперазинил и N-фенилпиперазинил.
58. Соединение по п.33 или любому из пп.35-57, при зависимости от п.34, где R3 представляет собой водород, метил, этил, н- или изопропил, трифторметил, гидроксиэтил, метилсульфонаминометил или карбоксамидную группу -CONRB(Alk)nR, как определено в п.58.
59. Соединение по любому из пп.33-58, где R3 представляет собой карбоксамидную группу
-CONRB(Alk)nR, как определено в п.58.
60. Соединение по любому из пп.33-59, где R3 представляет собой этиламинокарбонил или изопропиламинокарбонил.
61. Соединение по п.33 или 34, которое имеет формулу (ID) или формулу (В) его регоизомера,
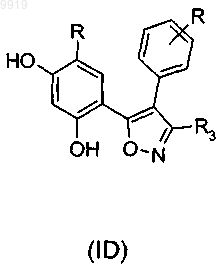
где каждый R независимо представляет собой необязательный заместитель и R3 представляет собой карбоксамидную группу.
62. Соединение по п.33 или 34, которое имеет формулу (IE) или формулу (В) его регоизомера
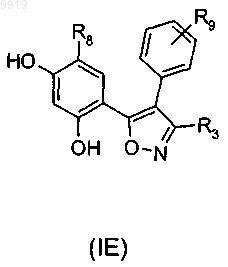
где R3 представляет собой карбоксамидную группу;
R9 представляет собой -CH2NR10R11 или -NR10R11, где замещенная аминогруппа -NR10R11 представляет собой растворимую группу;
R8 представляет собой необязательный заместитель.
63. Соединение по п.62, в котором R3 представляет собой этиламинокарбонил CH3CH2NHC(=O)- или изопропиламинокарбонил (CH3)2CHNHC(=O)-; замещенная аминогруппа -NR10R11 в R9 представляет собой морфолинил, пиперидинил, пиперазинил, пирролидинил, этиламино, изопропиламино,
диэтиламино, циклогексиламино, циклопентиламино, метоксиэтиламино, пиперидин-4-ил,
N-ацетилпиперазинил, N-метилпиперазинил, метилсульфониламино, тиоморфолинил, тиоморфолинилдиоксид, 4-гидроксиэтилпиперидинил или 4-гидроксипиперидинил; и R8 представляет собой этил,
изопропил, бром или хлор.
64. Соединение по п.33 или 34, выбранное из
этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты,
этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-пиперидин-1-илметилфенил)изоксазол-3-карбоновой кислоты,
этиламида 4-(4-диэтиламинометилфенил)-5-(2,4-дигидрокси-5-изопропилфенил)изоксазол-3-карбоновой кислоты,
этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3-карбоновой кислоты,
этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-этиламинометилфенил)изоксазол-3-карбоновой кислоты,
этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-[4-(изопропиламинометил)фенил]изоксазол-3-карбоновой кислоты,
этиламида 4-(4-циклогексиламинометилфенил)-5-(2,4-дигидрокси-5-изопропилфенил)изоксазол-3-карбоновой кислоты,
этиламида 4-[4-(трет-бутиламинометил)фенил]-5-(2,4-дигидрокси-5-изопропилфенил)изоксазол-3-карбоновой кислоты,
этиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-{4-[(2-метоксиэтиламино)метил]фенил}изоксазол-3-карбоновой кислоты,
изопропиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты,
изопропиламида 5-(2,4-дигидрокси-5-изопропилфенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3-карбоновой кислоты,
этиламида 5-(5-трет-бутил-2,4-дигидроксифенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3-карбоновой кислоты,
этиламида 5-(5-трет-бутил-2,4-дигидроксифенил)-4-(4-пиперидин-1-илметилфенил)изоксазол-3-карбоновой кислоты,
этиламида 5-(2,4-дигидрокси-5-изобутилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты,
этиламида 5-(2,4-дигидрокси-5-изобутилфенил)-4-(4-пиперидин-1-илметилфенил)изоксазол-3-карбоновой кислоты,
этиламида 5-(5-трет-бутил-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты,
этиламида 5-(5-трет-бутил-2,4-дигидроксифенил)-4-(4-диэтиламинометилфенил)изоксазол-3-карбоновой кислоты,
этиламида 3-(5-хлор-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-5-карбоновой кислоты,
этиламида 4-(4-диэтиламинометилфенил)-5-(4,6-дигидрокси-2'-метилбифенил-3-ил)изоксазол-3-карбоновой кислоты,
этиламида 4-(4-диэтиламинометилфенил)-5-(4'-фтор-4,6-дигидроксибифенил-3-ил)изоксазол-3-карбоновой кислоты,
4-(4-диэтиламинометилфенил)-5-(4,6-дигидроксибифенил-3-ил)изоксазол-3-карбоновой кислоты,
этиламида 5-(2'-фтор-4,6-дигидроксибифенил-3-ил)-4-(4-пирролидин-1-илметилфенил)изоксазол-3-карбоновой кислоты,
этиламида 5-(4,6-дигидроксибифенил-3-ил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты,
этиламида 5-(2,4-дигидрокси-5-фенэтилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты,
изопропиламида 5-(5-хлор-2,4-дигидроксифенил)-4-(4-пиперидин-1-илметилфенил)изоксазол-3-карбоновой кислоты,
этиламида 4-(4-диэтиламинометилфенил)-5-(5-этил-2,4-дигидроксифенил)изоксазол-3-карбоновой кислоты,
этиламида 5-(5-этил-2,4-дигидроксифенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3-карбоновой кислоты,
этиламида 5-(5-этил-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты,
этиламида 5-(5-хлор-2,4-дигидроксифенил)-4-(4-диэтиламинометилфенил)изоксазол-3-карбоновой кислоты,
этиламида 5-(5-хлор-2,4-дигидроксифенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3-карбоновой кислоты,
этиламида 5-(5-хлор-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты
и его солей, гидратов, сольватов и его пролекарств.
65. Соединение по любому из пп.33-64, предназначенное для применения в области лечения человека или ветеринарной медицине.
66. Фармацевтическая композиция, содержащая соединение по любому из пп.33-64 или его соль, гидрат, или сольват вместе с фармацевтически приемлемым носителем.
67. Фармацевтическая композиция по п.66 в виде раствора или суспензии соединения в стерильном, физиологически приемлемом носителе, например солевом растворе.
68. Фармацевтическая композиция по п.66 в виде раствора или суспензии соединения в стерильном солевом растворе.
69. Способ ингибирования HSP-90 активности, включающий введение в контакт in vitro HSP-90 фермента и соединения по любому из пп.33-64.
Текст
009919 Настоящее изобретение относится к замещенным изоксазолам, имеющим ингибирующую активность по отношению к HSP-90, к использованию этих соединений в медицине для лечения заболеваний,чувствительных к ингибированию HSP-90, таких как раковые заболевания; а также к фармацевтическим композициям, содержащим такие соединения. Уровень техники Молекулярные шапероны поддерживают соответствующую укладку и конформацию белков и являются ключевыми в регуляции баланса синтеза и распада белков. Было показано их большое значение в регуляции многих важных клеточных функций, таких как пролиферация клетки и апоптоз (Jolly and Morimoto, 2000; Smith et al., 1998; Smith, 2001). Белки теплового шока (HSPs) Воздействие на клетки различных стрессовых факторов окружающей среды, включая тепловой шок, алкоголь, тяжелые металлы и оксидативный стресс, приводит к накоплению в клетке некоторого количества шаперонов, известных как белки теплового шока (HSPs). Индукция HSPs защищает клетку от начального стрессового повреждения, ускоряет восстановление и обеспечивает поддержание состояния устойчивости к стрессу. Кроме того, становится ясно, что некоторые HSPs могут также играть роль молекулярных шаперонов при нормальных условиях в отсутствие стресса за счет регуляции правильной укладки, деградации, локализации и функционирования важных клеточных белков, которых становится известно все больше и больше. Существует довольно много мультигенных семейств HSPs с характерными генными продуктами,отличающихся по уровню экспрессии в клетках, функциям и локализации. Они обозначаются, например,как HSP70, HSP-90 и HSP27 в соответствии с их молекулярным весом. Некоторые болезни людей могут являться результатом неправильной укладки белка (описано вTytell et al., 2001; Smith et al., 1998). Таким образом, может оказаться полезной разработка видов лечения,направленных на коррекцию нарушенной деятельности молекулярных шаперонов. В ряде ситуаций (например, болезнь Альцгеймера, прионные болезни и болезнь Гентингтона) белки с нарушенной укладкой могут приводить к агрегации белка и проявляться в виде нейродегенеративных расстройств. Также белки с нарушенной укладкой могут терять свою первоначальную функцию, что приводит к нерегулируемым молекулярным и физиологическим функциям в клетке.HSPs могут также вызывать рак. Например, есть доказательства того, что встречаются разные уровни экспрессии HSPs, которые могут быть соотнесены со стадией опухолевой прогрессии (Martin et al.,2000; Conroy et al., 1996; Kawanishi et al., 1999; Jameel et al., 1992; Hoang et al., 2000; Lebeau et al., 1991). В результате вовлечения HSP-90 в различные ключевые пути онкогенеза и открытия того, что ряд природных веществ с противораковой активностью воздействуют на этот молекулярный шаперон, была выдвинута новая гипотеза о возможности лечения рака путем ингибирования функции HSP. Первый ингибитор молекулярного шаперона в настоящее время проходит клинические испытания.HSP-90 составляет около 1-2% всего клеточного белка и обычно представлен в клетке в виде димера, ассоциированного с одним из множества других белков (см., например, Pratt, 1997). Этот белок необходим для жизнедеятельности клетки и проявляет двойственные функции шаперона (Young et al., 2001). Он играет ключевую роль в клеточном ответе на стресс путем взаимодействия со многими белками после того, как их нативная конформация изменяется под действием различных стрессов внешней среды,таких как тепловой шок, обеспечивая адекватную укладку белка и предотвращая неспецифическую агрегацию (Smith et al., 1998). Кроме того, результаты последних лет позволяют предполагать, что HSP-90 может также играть роль в предотвращении мутации, предположительно путем исправления неверной укладки мутантного белка (Rutherford and Lindquist, 1998). Однако HSP-90 также играет важную регуляторную роль. При нормальных физиологических условиях вместе с его гомологом в эндоплазматическом ретикулуме GRP94 HSP-90 играет роль в поддержании домашнего хозяйства в клетке, обеспечивая конформационную стабильность и созревание нескольких ключевых белков-клиентов. Последние могут быть разделены на три группы:(с) ряд предположительно неродственных белков, например мутантный р 53 и каталитическая субъединица теломеразы hTERT. Все эти белки играют ключевые регуляторные роли во многих физиологических и биохимических процессах в клетке. Постоянно выявляются новые белки-клиенты HSP-90. Высоко консервативное семейство HSP-90 человека состоит из четырех генов, а именно: цитозольные HSP-90- и HSP-90- изоформы (Hickey et al., 1989), GRP-94 в эндоплазматическом ретикулуме(Argon et al., 1999) и HSP75/TRAP1 в матриксе митохондрий (Felts et al., 2000). Предполагается, что все члены семейства обладают одинаковым механизмом действия, но связываются с различными белкамиклиентами в зависимости от их локализации в клетке. Например, ERBB2 известен как специфичный белок-клиент GRP-94 (Аргон et al., 1999), а рецептор фактора некроза опухоли 1 типа (TNFR1) и белокHSP-90 принимает участие в сложных взаимодействиях с рядом белков-клиентов и регуляторных белков (Smith, 2001). Хотя точные молекулярные детали еще предстоит прояснить, биохимические и рентгенкристаллографические исследования (Prodromou et al., 1997; Stebbins et al., 1997), проведенные за последние несколько лет, обеспечили все более глубокое понимание функции шаперона HSP-90. Имевшие место ранее разногласия по данному вопросу сменились пониманием того, что HSP-90 является АТФ-зависимым молекулярным шапероном (Prodromou et al., 1997) с димеризацией нуклеотидсвязывающих доменов, необходимых для гидролиза АТФ, который в свою очередь необходим для функции шаперона (Prodromou et al., 2000a). Связывание с АТФ приводит к формированию торообразной димерной структуры, в которой N-концевые домены приведены в тесный контакт друг с другом, образуя конформационный переход, известный как зажимной механизм ('clamp mechanism') (Prodromou andPearl, 2000b). Известные ингибиторы HSP-90 Первым открытым классом ингибиторов HSP-90 является класс ансамицинбензохинон, который включает соединения гербимицина A и гелданамицина. Было показано, что они вызывают реверсию злокачественного фенотипа фибробластов, перерожденных под воздействием v-Src онкогена (Uehara et al.,1985), и, соответственно, демонстрируют мощное противоопухолевое действие как in vitro (Schulte et al.,1998), так и в животных моделях in vivo (Supko et al., 1995). Иммунопреципитация и исследования сродства матрицы показали, что основной механизм действия гелданамицина включает связывание с HSP-90 (Whitesell et al., 1994; Schulte and Neckers, 1998). Более того, рентгенкристаллографические исследования показали, что гелданамицин конкурирует за АТФ-связывающий сайт и ингибирует внутреннюю АТФазную активность HSP-90 (Prodromou et al.,1997; Panaretou et al., 1998). Это, в свою очередь, предотвращает формирование зрелых мультимерных комплексов HSP-90, способных к укладке белков-клиентов. В результате белки-клиенты становятся целью для деградации через убиквитин протеосомный путь. 17-Аллиламино,17-деметоксигелданамицин (17AAG) сохраняет свойство ингибировать HSP-90, что приводит к элиминации белков-клиентов и обеспечению противоопухолевой активности в клеточной культуре и на ксенотрансплантатных моделях (Schulte et al., 1998; Kelland et al., 1999), но обладает значительно меньшей гепатотоксичностью по сравнению с гелданамицином (Pare et al., 1997). 17AAG в настоящее время находится на первой (I) фазе клинических испытаний. Радицикол является макроциклическим антибиотиком и проявляет свойство вызывать реверсию злокачественного фенотипа фибробластов, трансформированных v-Src и v-Ha-Ras (Kwon et al., 1992;Zhao et al., 1995). Он снижает количество сигнальных белков, как результат ингибирования HSP-90(Schulte et al., 1998). Данные рентгенкристаллографии подтвердили, что радицикол также связывается сN-концевым доменом HSP-90 и ингибирует его внутреннюю АТФазную активность (Roe et al., 1998). Радицикол теряет противоопухолевую активность in vivo за счет нестабильности химических свойств соединения. Известно, что кумариновые антибиотики связываются с бактериальной ДНК-гиразой в сайте связывания АТФ, гомологичном таковому у HSP-90. Кумарин, новобиоцин, как было показано, связывается с карбоксильным концом HSP-90, т.е. с другим сайтом, нежели бензохинонансамицины и радицикол, которые связываются с N-концом (Marcu et al., 2000b). Тем не менее, это также приводит к ингибированию функции HSP-90 и снижению числа сигнальных протеинов, уложенных с помощью HSP-90 (Marcu et al.,2000a). Гелданамицин не может последовательно связаться HSP-90 с новобиоцином; это означает, что должны существовать некоторые взаимодействия между N- и С-концевыми доменами и соответствует представлению о том, что оба сайта важны для свойств шаперона HSP-90. Ингибитор HSP-90 PU3, основанный на пурине, вызывает деградацию сигнальных молекул, включая ERBB2, а также вызывает блокировку клеточного цикла и дифференцировку в клетках рака молочной железы (Chiosis et al., 2001).HSP-90 в качестве терапивтической мишени Благодаря своему участию в регуляции разных сигнальных путей, которые имеют ключевое значение в развитии опухолевого фенотипа, и открытию того, что некоторые природные биологически активные вещества оказывают свои эффекты через активность HSP-90, молекулярный шаперон HSP-90 в настоящее время рассматривается как новая мишень для противораковой терапии (Neckers et al., 1999). Преобладающий механизм действия гелданамицина, 17AAG и радицикола включает связывание сHSP-90 в АТФ-связывающем сайте, расположенном в N-концевом домене, что приводит к ингибированию внутренней АТФазной HSP-90 активности (см., например, Prodromou et al., 1997; Stebbins et al.,1997; Panaretou et al., 1998). Ингибирование АТФазной HSP-90 активности предотвращает вовлечение в процесс ко-шаперонов и способствует образованию такого типа гетерокомплекса HSP-90, посредством которого эти белкиклиенты становятся мишенью для деградации через убиквитин - протеосомный путь (см, например,Neckers et al., 1999; Kelland et al., 1999). Лечение ингибиторами HSP-90 приводит к избирательной деградации белков, задействованных в пролиферации клетки, регуляции клеточного цикла и апоптозе - процессов, имеющих основополагающее-2 009919 значение в развитии рака. Ингибирование функции HSP-90 вызывает избирательную деградацию важнейших сигнальных белков, участвующих в пролиферации клетки, регуляции клеточного цикла и апоптозе - процессах,имеющих основополагающее значение, и обычно нарушенных при раке (см., например, Hostein et al.,2001). Заманчивая перспектива для применения в клинике лекарств, воздействующих на эту мишень,заключается в том, что, одновременно уменьшая количество белков, связанных с трансформированным фенотипом, такая терапия может обеспечивать мощный противоопухолевый эффекта и действовать в большей степени на раковые клетки, чем на нормальные. Эти события, происходящие в результате ингибирования HSP-90, как предполагается, обусловливают противоопухолевую активность ингибиторовHSP-90 в культуре клеток и в животных моделях (см., например, Schulte et al., 1998; Kelland et al., 1999). Краткое описание изобретения Настоящее изобретение относится к замещенным изоксазолам, обладающих HSP-90 ингибиторной активностью, например, для использования в медицине для подавления пролиферации раковых клеток. Изобретение также включает, по существу, новые соединения изоксазола и фармацевтические композиции их содержащие. Подробное описание изобретения В соответствии с настоящим изобретением обеспечивется применение соединения формулы (А) или (В) или его соли, N-оксида, гидрата или сольвата или его пролекарства, для получения композиции для ингибирования HSP-90 активности где R1 представляет собой группу формулыAr1 представляет собой необязательно замещенный арильный или гетероарильный радикал,Alk1 и Alk2 представляют собой необязательно замещенный двухвалентный C1-C6 алкиленовый илиC2-C6 алкениленовый радикалы,p, r и s независимо имеют значения 0 или 1,Z представляет собой -О-, -S-, -(С=O)-, -(C=S)-, -SO2-, -C(=O)O-, -C(=O)NRA-, -C(=S)NRA-,-SO2NRA-, -NRAC(=O)-, -NRASO2- или -NRA-, RA представляет собой водород или C1-C6 алкил, иQ представляет собой водород или необязательно замещенный карбоциклический или гетероциклический радикал;(iii) неароматическое карбоциклическое или гетероциклическое кольцо, где углерод в кольце является необязательно замещенным и/или азот в кольце является необязательно замещенным с помощью группы формулы-(Alk1)p-(Z)r-(Alk2)s-Q,1 2 где Q, Alk , Alk , Z, p, r и s имеют значения, как определено выше в отношении группы (IA);R3 представляет собой водород, необязательно замещенный циклоалкил, циклоалкенил, C1-C6 алкил,C1-C6 алкенил, или C1-C6 алкинил; или карбоксил, карбоксамид или сложноэфирную карбоксильную группу. В целом, класс соединений, определенных выше в отношении формулы (I), как полагают, является новым, и изобретение включает все новые члены того класса и их соли, гидраты и сольваты, а также их пролекарства. Как используется в настоящем изобретении термин "карбоксильная группа" относится к группе формулы -COOH; термин "сложноэфирная карбоксильная группа" относится к группе формулы -COOR, где R представляет собой радикал, фактически или теоретически полученный из гидроксильного соединения ROH; термин "карбоксамидная группа" относится к группе формулы -CONRaRb, где -NRaRb представляет собой первичную или вторичную (включая циклическую) аминогруппу, фактически или теоретически полученную из аммиака или HNRaRb амина. Как используется в настоящем изобретении, термин "(Ca-Cb)алкил", где a и b являются целыми числами, относится к прямой или разветвленной цепи алкильного радикала, имеющего от a до b атомов углерода. Таким образом, когда, например, a имеет значение 1 и когда b имеет значение 6, термин включает метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил и н-гексил. Как используется в настоящем изобретении, термин "двухвалентный алкиленовый радикал (Ca-Cb)",где a и b являются целыми числами, относится к насыщенной углеводородной цепи, имеющей от a до b-3 009919 атомов углерода и две ненасыщенные валентности. Как используется в настоящем изобретении, термин "(Ca-Cb)алкенил", где a и b являются целыми числами, относится к прямой или разветвленной цепи алкенильного радикала, имеющего от a до b атомов углерода и содержащего по крайней мере одну двойную связь Е- или Z-конфигурации, включая, например, этенил и аллил. Как используется в настоящем изобретении, термин "двухвалентный алкениленовый радикал(Ca-Cb)", где a и b являются целыми числами, относится к углеводородной цепи, имеющей от a до b атомов углерода по крайней мере одну двойную связь и две ненасыщенные валентности. Как используется в настоящем изобретении, термин "(Ca-Cb)алкинил", где a и b являются целыми числами, относится к прямой или разветвленной цепи алкенильного радикала, имеющего от a до b атомов углерода и содержащего по крайней мере одну тройную связь, включая, например, этинил и проп-2-инил. Как используется в настоящем изобретении, термин "двухвалентный алкиниленовый радикал(Ca-Cb)", где a и b являются целыми числами, относится к прямой или разветвленной цепи алкинильного радикала, имеющего от a до b атомов углерода и содержащего по крайней мере одну тройную связь, и две ненасыщенные валентности. Как используется в настоящем изобретении термин, "циклоалкил" относится к насыщенному карбоциклическому радикалу, имеющему от 3-8 атомов углерода и включающему, например, циклопропил,циклобутил, циклопентил, циклогексил, циклогептил и циклооктил. Как используется в настоящем изобретении, термин "циклоалкенил" относится к карбоциклическому радикалу, имеющему от 3-8 атомов углерода, содержащего по крайней мере одну двойную связь, и включает, например, циклопентенил, циклогексенил, циклогептенил и циклооктенил. Как используется в настоящем изобретении, термин "арил" относится к моно-, би- или трициклическому карбоциклическому ароматическому радикалу. Иллюстрациями таких радикалов являются фенил,бифенил и нафтил. Как используется в настоящем изобретении, термин "карбоциклический" относится к циклическому радикалу, чьи все атомы в кольце представляют собой углерод и включают моноциклический арил,циклоалкильный и циклоалкенильный радикалы. Как используется в настоящем изобретении, термин "гетероарил" относится к моно-, би- или три-циклическому ароматическому радикалу, содержащему один или большее количество гетероатомов,выбранных из S, N и O. Иллюстрациями таких радикалов являются тиенил, бензотиенил, фурил,бензофурил, пирролил, имидазолил, бензоимидазолил, тиазолил, бензотиазолил, изотиазолил, бензоизотиазолил, пиразолил, оксазолил, бензоксазолил, изоксазолил, бензизоксазолил, изотиазолил, триазолил,бензотриазолил, тиадиазолил, оксадиазолил, пиридинил, пиридазинил, пиримидинил, пиразинил,триазинил, индолил и индазолил. Как используется в настоящем изобретении, нестандартный термин "гетероциклил" или "гетероциклический" включает "гетероарил", как определено выше, и, в частности, означает моно-, би- или трициклический неароматический радикал, содержащий один или большее количество гетероатомов,выбранных из S, N и O, а также группы, состоящие из моноциклического неароматического радикала,содержат один или большее количество таких гетероатомов, которые ковалентно связаны с другим таким радикалом или с моноциклическим карбоциклическим радикалом. Иллюстрациями таких радикалов являются пирролил, фуранил, тиенил, пиперидинил, имидазолил, оксазолил, изоксазолил, тиазолил,тиадиазолил, пиразолил, пиридинил, пирролидинил, пиримидинил, морфолинил, пиперазинил, индолил,морфолинил, бензфуранил, пиранил, изоксазолил, бензимидазолил, метилендиоксифенил, этилендиоксифенил, малеимидную и сукцинимидную группы. Если иначе не определено в контексте, в котором встречается термин "замещенный", который используют в любой части настоящего изобретения, он означает замещенные с помощью до четырех совместимых заместителей, каждый из которых независимо может быть, например, (C1-C6)алкилом,(C1-C6)алкокси, гидрокси, гидрокси(C1-C6)алкилом, меркапто, меркапто(C1-C6)алкилом, (C1-C6)алкилтио,галогеном (включая фтор, бром и хлор), трифторметилом, трифторметокси, нитро, нитрил (-CN), оксо,фенилом, -COOH, -COORA, -CORA, -SO2RA, -CONH2, -SO2NH2, -CONHRA, -SO2NHRA, -CONRARB,-SO2NRARB, -NH2, -NHRA, -NRARB, -OCONH2, -OCONHRA, -OCONRARB, -NHCORA, -NHCOORA,-NRBCOORA, -NHSO2ORA, -NRBSO2OH, -NRBSO2ORA, -NHCONH2, -NRACONH2, -NHCONHRB,-NRACONHRB, -NHCONRARB или -NRACONRARB, где RA и RB независимо представляют собой(C1-C6)алкильную группу. Термин "необязательный заместитель" может быть одной из предшествующих групп заместителя. Из описанных выше заместителей (C1-C6)алкил, галоген, трифторметил, трифторметокси, трифторметилсульфонил и фенил в большинстве случаев рассматриваются как липофильные. Другие перечисленные заместители, которые содержат алкильные группы, могут быть липофильными в зависимости от особенностей присутствующих алкильных групп. Как используется в настоящем изобретении, термин "соль" включает аддитивно-основные, аддитивно-кислотные и четвертичные соли. Соединения по настоящему изобретению, которые являются кис-4 009919 лыми, могут образовывать соли, включая фармацевтически или ветеринарно-приемлемые соли с основаниями, такими как гидроксиды щелочного металла, например натрий и гидроксид калия; гидроксиды щлочно-земельного металла, например кальций, барий и гидроксид магния; с органическими основаниями, например N-метил-D-глюкамин, холин трис-(гидроксиметил)аминометан, L-аргинин, L-лизин,пиперидин N-этил, дибензиламин и им подобные. Те соединения (I), которые являются основными, могут образовывать соли, включая фармацевтически или ветеринарно-приемлемые соли с минеральными кислотами, например с гидрогалоидными кислотами, такими как соляная или бромисто-водородная кислоты, серная, азотная или фосфорная кислоты и им подобные, и с органическими кислотами, например уксусная, винная, янтарная, фумаровая, малеиновая, яблочная, салициловая, лимонная, метансульфоновая, п-толуолсульфоновая, бензойная, бензолсульфоновая, глутаминовая, молочная и миндальная кислоты и им подобные. Термин "липофильный", как используется в настоящем изобретении, в отношении заместителя означает, что он имеет положительную заместительную константу гидрофобности . (Положительное значениеуказывает на то, что заместитель является более липофильным, чем водород, тогда как отрицательное значение указывает на то, что он менее липофильный, т.е. более гидрофильный, чем водород). Некоторые из соединений по изобретению содержат один или большее количество фактических или потенциально хиральных центров из-за наличия асимметричных атомов углерода. Наличие нескольких асимметричных атомов углерода дает увеличение числа диастереоизомеров с R или стереохимией С при каждом хиральном центре. Изобретение включает все такие диастереоизомеры и их смеси. Один из аспектов изобретения включает соединения формулы (А) или (В), указанной выше, и их соли, N-оксиды, гидраты или сольваты и их пролекарства, за исключением следующих трех соединений(X), (Y) и (Z), которые являются коммерчески доступными: Предмет таких исключений по изобретению, в частности, включает те, где заместители R1, R2 и R3,рассмотренные и определенные в нижеследующих разделах, озаглавлены "Радикал R1", "Радикал R2" и"Радикал R3". Другой аспект включает использование таких соединений для лечения заболеваний, чувствительных к ингибированию HSP-90 активности. Радикал R1. В целом, в настоящее время предпочтительным является то, что радикал Ar1, присутствующий в R1 группе, представляет собой необязательно замещенный фенил, предпочтительно с одним из необязательных заместителей, являющихся гидроксигруппой в положении 2 относительно точки присоединения фенильного кольца к изоксазольному кольцу. Другими словами, группа R1 предпочтительно имеет формулу где Alk1, Alk2, р, r, s, Z и Q имеют значения, как определено выше в отношении R1, и R представляет собой один или большее количество необязательных заместителей. В таких структурах, кроме того, предпочтительным является то, что атом углерода кольца, смежный с гидроксильной группой, является незамещенным. При дальнейшем последующем рассмотренииR1, это предпочтение применяется в дополнение к любым другим упомянутым возможностям. В самых простых структурах, которые касаются настоящего изобретения, каждый из p, r и s может иметь значение 0 и Q может быть водородом, так чтобы R1 представлял собой необязательно замещенный арил или гетероарил. В таких случаях R1 может быть, например, необязательно замещенным фенилом, предпочтительно 2-гидроксифенилом, который может в дальнейшем быть замещенным, например,одним или большим количеством гидроксигрупп, метилом, этилом, метокси, этокси, хлором или бромом. В настоящее время предпочтительными являются соединения, где R1 представляет собой 2,4-дигидроксифенил, замещенный на 5 положении с помощью небольшого липофильного заместителя,например, имеющего молекулярный объем, равный или меньший, чем у трет-бутила, такой как метил,этил, изопропил, изобутил, трет-бутил, хлор или бром, в особенности этил, изопропил или хлор. В таких 5-замещенных, 2,4-дигидроксифенильных соединениях по изобретению гидроксильные группы могут быть защищены с помощью групп, которые ращепляются в организме так, чтобы высвободить гидро-5 009919 ксильные группы. Известные группы пролекарств этого класса, которые ращепляются до гидроксилов,включают алкилкарбонилоксигруппы, такие как метилкарбонилокси и алкиламинокарбонилоксигруппы,такие как диалкиламино- или изопропиламинокарбонилокси. В других простых структурах, которые относятся к настоящему изобретению, p, r и s, каждый из них, может снова иметь значение 0 и Q может быть необязательно замещенным карбоциклическим или гетероциклическим кольцом, например фенильным или пиридильным кольцом. В этом случае Q является непосредственным заместителем в необязательно замещенном Ar1 кольце. В более комплексных структурах, которые относятся к настоящему изобретению, один или большее количество p, r и s могут иметь значение 1 и Q может быть водородом или необязательно замещенным карбоциклическим или гетероциклическим кольцом. Например, p и/или s могут иметь значение 1 и r может иметь значение 1, так чтобы Q связан с Ar1 с помощью алкилена или алкениленового радикала, например алкиленовый радикал C1-C3, который является необязательно замещенным. В других случаях каждый из p, r и s может иметь значение 1, в этих случаях Q связан с Ar1 с помощью алкилена или алкениленового радикала, который прерван с помощью гетероатома, содержащего Z радикал. В еще других случаях p и s могут иметь значение 0 и r может иметь значение 1, в этом случае Q связан с Ar через гетероатом, содержащий Z радикал. Определенные примеры R1 групп указанных типов присутствуют в соединениях примеров по изобретению. Радикал R2. Когда R2 представляет собой тип (i), т.е. группу формулы (IA), примеры включают фенил, 2-, 3- или 4-пиридил, 2- или 3-фуранил, 2- или 3-тиенил и тиазолил, где необязательные заместители включают любые из тех, которые перечислены выше в определении "замещенный", например метокси, этокси, метилендиокси, этилендиокси, фтор, хлор, бром, и трифторметил, например R2 может быть фенилом, замещенным в 4 положении с помощью C1-C6 алкокси, таким как метокси или этокси или с помощью фтора,хлора, брома, пиперазинила, N-метилпиперазинила или пиперидинила. В настоящее время предпочтительные R2 заместители включают те, которые имеют частичную структуру где замещенная аминогруппа -NR10R11 представляет собой растворимую группу. Много таких растворимых групп известны в медицинской химии. Примеры включают морфолинил,пиперидинил, пиперазинил, пирролидинил, этиламино, изопропиламино, диэтиламино, циклогексиламино, циклопентиламино, метоксиэтиламино, пиперидин-4-ил, N-ацетилпиперазинил, метилсульфониламино, тиоморфолинил, тиоморфолинилдиоксид, 4-гидроксиэтилпиперидинил, и 4-гидроксипиперидинил. Находящяяся на рассмотрении международная патентная заявка PCT/GB2003/005275 раскрывает ингибирование HSP-90 соединениями пиразола, аналогичными изооксазолам, которые относятся к настоящему изобретению и которые, как полагают, связаны аналогичным способом с мишеньюHSP-90. Эти соединения пиразола имеют карбоксамидную группу в положении, соответствующем положению R2 в настоящих изоксазолах. Следовательно, когда R2 в настоящих изоксазолах представляет собой карбоксамидный радикал типа (ii), указанный выше, примеры включают те, которые присутствуют в соединениях пиразола в соответствии с PCT/GB2003/005275, например карбоксамиды формулы-CONRB(Alk)nRA,где Alk представляет собой двухвалентный алкилен, алкениленовый или алкиниленовый радикал, например -CH2-, -CH2CH2-, -CH2CH2CH2-, -CH2CH=CH- или -CH2CCCH2-, и радикал Alk может быть необязательно замещенным;RB представляет собой водород или C1-C6 алкильную или C2-C6 алкенильную группу, например метильную, этильную, н-, или изопропильную, или аллильную;RA представляет собой гидрокси или необязательно замещенный карбоцикл, например любой гидрокси и/или хлорзамещенный фенил и 3,4-метилендиоксифенил; или гетероциклил, например пиридил,фурил, тиенил, N-пиперазинил или N-морфолинил, в которых гетероциклические кольца могут быть замещены,или RA и RB, взятые вместе с атомом азота, к которому они присоединены, образуютN-гетероциклическое кольцо, которое может необязательно содержать один или большее количество дополнительных гетероатомов, выбранных из О, S и N, и которые могут необязательно быть замещены на один или большее количество С или N атомов в кольце, примеры таких N-гетероциклических колец включают морфолино, пиперидинил, пиперазинил и N-фенилпиперазинил.R3 может быть, например, водородом, метилом, этилом, н- или изопропилом, трифторметилом, гидроксиэтилом, метилсульфонаминометилом или карбоксамидной группой -CONRB(Alk)nRA, как рассмотрено выше для R2. Карбоксамидная группа является в настоящее время предпочтительнее, в особенности этиламинокарбонил и изопропиламинокарбонил. Особенная группа соединений, которые относятся к настоящему изобретению, состоит из тех, которые имеют формулу (ID) и формулы В его региоизомеров и его солей, сольватов и гидратов, а также его пролекарств где каждый R независимо представляет собой необязательный заместитель и R3 представляет собой карбоксамидную группу. Предпочтительную группу соединений, которые относятся к настоящему изобретению, составляют соединения формулы (IE) и формулы (В) его региоизомеров и его солей, сольватов и гидратов, а также его пролекарств где R3 представляет собой карбоксамидную группу (такую как этиламинокарбонил CH3CH2NHC(=O)или изопропиламинокарбонил (CH3)2CHNHC(=O)-;R9 представляет собой -CH2NR10R11 или -NR10R11, здесь замещенная аминогруппа -NR10R11 представляет собой растворимую группу (такую как морфолинил, пиперидинил, пиперазинил, пирролидинил,этиламино, изопропиламино, диэтиламино, циклогексиламино, циклопентиламино, метоксиэтиламино,пиперидин-4-ил, N-ацетилпиперазинил, N-метилпиперазинил, метилсульфониламино, тиоморфолинил,тиоморфолинилдиоксид,4-гидроксиэтилпиперидинил, и 4-гидроксипиперидинил);R8 представляет собой необязательный заместитель, в особенности небольшую липофильную группу (такую как этил, изопропил, бром или хлор). Определенные соединения, которые относятся к настоящему изобретению, включают соединения по примерам, в особенности нижеследующие соединения и их соли. N-оксиды, гидраты и сольваты и их пролекарства: Этиламид 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3 карбоновой кислоты Этиламид 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-пиперидин-1-илметилфенил)изоксазол-3 карбоновой кислоты Этиламид 4-(4-диэтиламинометилфенил)-5-(2,4-дигидрокси-5-изопропилфенил)изоксазол-3 карбоновой кислоты Этиламид 5-(2,4-дигидрокси-5-изопропилфенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3-карбоновой кислоты Этиламид 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-этиламинометилфенил)изоксазол-3 карбоновой кислоты Этиламид 5-(2,4-дигидрокси-5-изопропилфенил)-4-[4-(изопропиламинометил)фенил]изоксазол-3 карбоновой кислоты Этиламид 4-(4-циклогексиламинометилфенил)-5-(2,4-дигидрокси-5-изопропилфенил)изоксазол-3 карбоновой кислоты Этиламид 4-[4-(трет-бутиламинометил)фенил]-5-(2,4-дигидрокси-5-изопропилфенил)изоксазол-3 карбоновой кислоты Этиламид 5-(2,4-дигидрокси-5-изопропилфенил)-4-4-[(2-метоксиэтиламино)метил]фенилизоксазол-3-карбоновой кислоты Изопропиламид 5-(2,4-дигидрокси-5-изопропилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол 3-карбоновой кислоты-7 009919 Изопропиламид 5-(2,4-дигидрокси-5-изопропилфенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3-карбоновой кислоты Этиламид 5-(5-трет-бутил-2,4-дигидроксифенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3-карбоновой кислоты Этиламид 5-(5-трет-бутил-2,4-дигидроксифенил)-4-(4-пиперидин-1-илметилфенил)изоксазол-3 карбоновой кислоты Этиламид 5-(2,4-дигидрокси-5-изобутилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3 карбоновой кислоты Этиламид 5-(2,4-дигидрокси-5-изобутилфенил)-4-(4-пиперидин-1-илметилфенил)изоксазол-3 карбоновой кислоты Этиламид 5-(5-трет-бутил-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3 карбоновой кислоты Этиламид 5-(5-трет-бутил-2,4-дигидроксифенил)-4-(4-диэтиламинометилфенил)изоксазол-3 карбоновой кислоты Этиламид 3-(5-хлор-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-5 карбоновой кислоты Этиламид 4-(4-диэтиламинометилфенил)-5-(4,6-дигидрокси-2'-метилбифенил-3-ил)изоксазол-3 карбоновой кислоты Этиламид 4-(4-диэтиламинометилфенил)-5-(4'-фтор-4,6-дигидроксибифенил-3-ил)изоксазол-3 карбоновой кислоты Этиламид 4-(4-диэтиламинометилфенил)-5-(4,6-дигидроксибифенил-3-ил)изоксазол-3-карбоновой кислоты Этиламид 5-(2'-фтор-4,6-дигидроксибифенил-3-ил)-4-(4-пирролидин-1-илметилфенил)изоксазол-3 карбоновой кислоты Этиламид 5-(4,6-дигидроксибифенил-3-ил)-4-(4-морфолин-4-илметилфенил)изоксазол-3 карбоновой кислоты Этиламид 5-(2,4-дигидрокси-5-фенэтилфенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3 карбоновой кислоты Изопропиламид 5-(5-хлор-2,4-дигидроксифенил)-4-(4-пиперидин-1-илметилфенил)изоксазол-3 карбоновой кислоты Этиламид 4-(4-диэтиламинометилфенил)-5-(5-этил-2,4-дигидроксифенил)изоксазол-3-карбоновой кислоты Этиламид 5-(5-этил-2,4-дигидроксифенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3 карбоновой кислоты Этиламид 5-(5-этил-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3-карбоновой кислоты Этиламид 5-(5-хлор-2,4-дигидроксифенил)-4-(4-диэтиламинометилфенил)изоксазол-3-карбоновой кислоты Этиламид 5-(5-хлор-2,4-дигидроксифенил)-4-[4-(4-метилпиперазин-1-илметил)фенил]изоксазол-3 карбоновой кислоты Этиламид 5-(5-хлор-2,4-дигидроксифенил)-4-(4-морфолин-4-илметилфенил)изоксазол-3 карбоновой кислоты Соединения, которые относятся к настоящему изобретению, могут быть получены с помощью способов, известных из уровня техники, таких как способы получения примеров по изобретению и способов,аналогичных им. Например, некоторые из соединений формулы (IA) могут быть получены путем взаимодействия гидроксиламина и соединения формулы (III) где кольцо A соответствует группе R1 соединений (IA) и R2 и R3 являются теми, как определено в отношении формулы (I). Соединения, полученные таким образом, могут затем быть химически модифицированы, чтобы ввести желаемые заместители для получения других соединений формулы (А). Например, в соединения,где R1 представляет собой фенильное кольцо, необязательно уже несущее заместители, введение в качестве заместителя брома будет давать широкую возможность ввести другие заместители на место брома с помощью конденсации по типу SP2. По другому пути в некоторых соединениях формулы (А) изоксазольное кольцо образуется путем взаимодействия соединения (IV) с гидроксиламином где R11 и R13 являются членами классов заместителя R1 и R3, определенных выше, чтобы получить изоксазол (V) с последующим введением дополнительного заместителя R2 (например, путем бромирования или йодирования углеродного кольца в (V) и путем взаимодействия по типу SP2 и/или модифицирования полученных R11, R13 и R2 заместителей изоксазола. Кроме того, некоторые изоксазольные региоизомеры (В) могут быть получены из оксазолов (А) путем взаимодействия с триметилоксонием трихлорида бора и, кроме того, соединения, полученные таким образом, могут затем быть химически модифицированы, чтобы ввести желаемые заместители для получения других соединений формулы (IA). Будет понятно, что в течение указанных выше синтезов может быть желательно защитить любые реакционноспособные группы, такие как гидроксилы с последующим снятием защиты. Дальнейшие детали синтеза представлены в примерах настоящего описания. Соединения изобретения являются ингибиторами HSP-90 и, соответственно, пригодны в лечении заболеваний, чувствительных к ингибированию HSP-90 активности, таких как раковые заболевания; вирусные заболевания, такие как гепатит С (HCV) (Waxman, 2002); иммунодепрессивные состояния, например при трансплантации (Bijlmakers, 2000 and Yorrin, 2000); иммуновоспалительные заболевания (Bucci, 2000), такие как ревматоидный артрит, бронхиальная астма, рассеянный склероз, сахарный диабет 1 типа, СКВ, псориаз и воспалительные заболевания кишки; муковисцидоз (Fuller, 2000); ангиогенеззависимые заболевания (Hur, 2002 and Kurebayashi, 2001): диабетическая ретинопатия,гемангиомы, псориаз, эндометриоз, опухолевый ангиогенез. Также ингибитор HSP-90 изобретения может защищать нормальные клетки от токсичности химиотерапевтических препаратов и может быть полезен в лечении заболеваний, в основе которых лежит нарушение индукции апоптоза. Этот ингибитор HSP-90 также может быть полезен в лечении болезней, при которых необходима коррекция индукции клеточного стресса и ответа белков теплового шока, например защита от гипоксического ишемического повреждения, обусловленного увеличением количества HSP-70 в сердце (Hutter, 1996 and Trost, 1998) или головном мозгу (Plumier, 1997 and Rajder, 2000). ИнгибиторHSP-90 также может быть пригоден в лечении болезней, основной причиной которых являются нарушенная укладка или агрегация белков, например скрепи/болезнь Крейцфельда-Якоба, болезни Гентингтона и Альцгеймера (Sittler, 2001; Trazelt, 1995 and Winklhofer, 2001). Соответственно, также изобретение включает:(i) способ лечения заболеваний и состояний, чувствительных к ингибированию HSP-90 активности у млекопитающих, в частности у людей. Этот способ включает введение животному количества соединения формулы (А) или (В), как это описано выше, или их соли, гидрата или сольвата, эффективного для ингибирования указанной HSP-90 активности;(ii) соединения формулы (А) или (В), как это описано выше, или их соль, гидрат или сольват для применения в медицине или ветеринарии, в частности в лечении заболеваний или состояний, чувствительных к ингибированию HSP-90 активности;(iii) фармацевтическую композицию, состоящую из соединения формулы(А) или (В), как это описано выше, вместе с фармацевтически приемлемым носителем. В частности, изобретение включает раствор или суспензию такого соединения в стерильном, фармацевтически приемлемом носителе, например, в водно-солевом растворе. Необходимо понимать, что конкретная дозировка для каждого конкретного пациента будет зависеть от множества факторов, включая активность применяемого соединения, возраст, массу тела, общее состояние, пол, диету, время введения, путь введения, уровень экскреции, сочетание лекарственных средств, а также механизм развития и тяжесть заболевания, по поводу которого назначено лечение. Обычно подходящая для применения внутрь доза составляет от 0,1 до 3000 мг один, два или три раза в день или такая же суточная доза, введенная путем инфузии или другим путем. Однако оптимальные дозировка и частота введения будут определены в клинических испытаниях, как это принято в медицине. Соединения, описанные в изобретении, могут быть приготовлены для введения любым путем в соответствии с их фармакокинетическими свойствами. Композиции для применения внутрь могут быть в форме таблеток, капсул, порошков, гранул, пастилок, жидких или гелевых препаратов, таких как пероральные, местного применения или стерильные парентеральные растворы и суспензии. Таблетки и кап-9 009919 сулы для приема внутрь могут быть в унифицированной дозе и могут содержать традиционные среды для лекарства, такие как связывающие агенты, например сироп, гуммиарабик,желатин, сорбитол, трагакант или поливинилпирролидон; наполнители, например лактозу, сахар, кукурузный крахмал, фосфат кальция, сорбитол или глицин; смазывающие вещества, например, стеарат магния, тальк, полиэтиленгликоль или двуокись кремния; дезинтегранты, например картофельный крахмал, или приемлемые смачивающие вещества, такие как натрия лаурил сульфат. Эти таблетки могут быть покрыты оболочкой согласно общепринятым в фармацевтической практике методикам. Жидкие препараты для приема внутрь могут быть в виде, например, водных или масляных суспензий, растворов, эмульсий, сиропов или эликсиров или могут быть представлены в сухом виде для растворения перед применением в воде или в другом приемлемом растворителе. Такие жидкие препараты могут содержать традиционные добавки, такие как суспендирующие агенты, например сорбитол, сироп, метилцеллюлозу, крахмальную патоку, гидрогенизированные желатином пищевые жиры; эмульсификаторы, например лецитин, моноолеат сорбитана или гуммиарабик; неводные растворители (которые могут включать пищевые масла), например миндальное масло,фракционированное кокосовое масло, масляные сложные эфиры, например глицерин, пропилен гликоля,этанола; консерванты, например метил- или пропил-р-гидроксибензоат или сорбиновая кислота, и, если необходимо, традиционные ароматизаторы и красители. Для местного применения на кожу лекарство может быть произведено в виде крема, лосьона или мази. Пропись крема или мази, используемых в препарате, является традиционной прописью, например,описанной в обычных фармацевтических руководствах, таких как British Pharmacopoeia. Активный ингредиент может также вводиться парентерально в стерильной среде. В зависимости от применяемого растворителя и концентрации, лекарство может быть как суспендировано, так и растворено в растворителе. Растворитель может содержать полезные добавки, такие как местный анестетик, консервант или буферное вещество. Соединения изобретения также применимы в исследованиях in vitro, связанных с ингибированиемHSP-90 активности, например в выборе альтернативных классов ингибиторов HSP-90, при котором исследуемое соединение конкурирует с соединением данного изобретения или замещает его. Соответственно, при еще одном подходе изобретение включает способ ингибирования HSP-90 активности, заключающийся в контактировании in vitro фермента HSP-90 и соединения формулы (А) или (В), как это описано и уточнено выше. Следующие примеры демонстрируют получение и активность ряда соединений по изобретению. Примеры 1-4. Схема 1. Получение бромсодержащего промежуточного и последующее арилирование Резорцин (4,4 г, 40 ммоль) и 4-метоксифенилуксусную кислоту (6,6 г, 40 ммоль) в среде эфирата трихлорида бора (25 мл, 0,2 моль) нагревают в атмосфере азота при температуре 90 С в течение 90 мин,что дает раствор бледно-красного цвета. Раствору дают возможность остыть и выливают в водный раствор ацетата натрия (200 мл, 10%) и смесь перемешивают, что дает осадок бледно-желтого цвета. Затем твердое вещество удаляют фильтрованием и промывают водой (200 мл). Твердое вещество помещают в этилацетат (250 мл) и промывают водой (200 мл). Раствор высушивают над безводным сульфатом магния и концентрируют до получения полутвердого вещества желтого цвета. Растирание в порошок с диэтиловым эфиром (100 мл) дает 1-(2,4-дигидроксифенил)-2-(4-метоксифенил)этанон в виде твердого вещества бледно-оранжевого цвета, после сушки в вакууме (2,2 г). Уксусный ангидрид (3 мл, 30 ммоль) добавляют в суспензию карбоната калия (4,0 г, 29 ммоль) и 1-(2,4-дигидроксифенил)-2-(4-метоксифенил)этанона (1,95 г, 7,5 ммоль) в ДМФА (10 мл) и полученную суспензию нагревают при температуре 115 С в течение 90 мин. Смеси дают возможность остыть,после чего выливают в воду (200 мл), что дает осадок грязно-белого цвета. Твердое вещество удаляют фильтрованием и промывают водой (100 мл), а затем диэтиловым эфиром (240 мл), что дает 7-гидрокси-3-(4-метоксифенил)-2-метилхромен-4-он в виде порошка грязно-белого цвета, после сушки в вакууме (1,65 г).(0,35 г,5 ммоль) добавляют в суспензию 7-гидрокси-3-(4-метоксифенил)-2-метилхромен-4-она (0,14 г, 0,5 ммоль) в пиридине (3 мл) и смесь нагревают при температуре кипения с обратным холодильником в течение 4 ч. Раствору дают возможность остыть и выливают в воду (50 мл), а затем экстрагируют диэтиловым эфиром (50 мл). Экстракты промывают водой (350 мл) и насыщенным водным раствором хлорида натрия (30 мл). Раствор высушивают над безводным сульфатом магния и концентрируют, что дает смолу бледно-коричневого цвета. Сырой продукт очищают с помощью колоночной хроматографии на силикагеле, элюируя смесью этилацетат/гексан (1:2), что дает бесцветную смолу. Растирание в порошок с гексаном дает 4-[4-(4-метоксифенил)-3-метилизоксазол-5-ил]бензол-1,3-диол в виде порошка белого цвета после сушки в вакууме (0,087 г). Трибромид бензилтриметиламмония (3,95 г, 10 ммоль) добавляют порционно к охлажденной льдом суспензии 4-[4-(4-метоксифенил)-3-метилизоксазол-5-ил]бензол-1,3-диола (пример 1) (2,95 г, 10 ммоль) в дихлорметане (50 мл) и смесь перемешивают в течение 60 мин, при комнатной температуре. Добавляют этилацетат (300 мл) и смесь промывают водой (3200 мл) и насыщенным водным раствором хлорида натрия (50 мл). Раствор высушивают над безводным сульфатом магния и концентрируют,что дает твердое вещество бледно-коричневого цвета. Сырой продукт очищают с помощью колоночной хроматографии на силикагеле,элюируя смесью этилацетат/гексан(1:2),что дает 4-бром-6-[4-(4-метоксифенил)-3-метилизоксазол-5-ил]бензол-1,3-диол в виде твердого вещества белого цвета, после сушки в вакууме (3,42 г). Бензилбромид (0,36 мл, 3 ммоль) добавляют в суспензию 4-бром-6-[4-(4-метоксифенил)-3 метилизоксазол-5-ил]бензол-1,3-диола (пример 2) (0,55 г, 1,5 ммоль) и карбоната цезия (0,85 г,2,6 ммоль) в ДМФА (5 мл) и смесь перемешивают в течение 18 ч при комнатной температуре. Добавляют воду (100 мл) и смесь экстрагируют диэтиловым эфиром (230 мл). Объединенные экстракты промывают водой (475 мл) и насыщенным водным раствором хлорида натрия (50 мл). Раствор высушивают над безводным сульфатом магния и концентрируют, что дает смолу бледно-коричневого цвета. Растирание в порошок с гексаном дает 5-(2,4-бис-бензилокси-5-бромфенил)4-(4-метоксифенил)-3-метилизоксазол в виде твердого вещества грязно-белого цвета, после сушки в вакууме (0,5 г). Фосфат калия (0,1 г, 0,5 ммоль) добавляют в раствор 5-(2,4-бис-бензилокси-5-бромфенил)-4-(4 метоксифенил)-3-метилизоксазола (0,14 г, 0,25 ммоль) и фенилбороновой кислоты (0,095 г, 0,75 ммоль) в 1,4 диоксане (4 мл) в атмосфере азота. Добавляют тетракис-(трифенилфосфин)палладия (0) (каталитическое количество) и суспензию нагревают при температуре 80 С в течение 18 ч. Суспензии дают возможность остыть и добавляют этилацетат (25 мл). Смесь промывают водой (325 мл) и насыщенным водным раствором хлорида натрия (25 мл). Раствор высушивают над безводным сульфатом магния и концентрируют, что дает смолу бледно-коричневого цвета. Растирание в порошок с гексаном дает 5-(4,6-бис-бензилоксибифенил-3-ил)-4-(4-метоксифенил)-3-метилизоксазол в виде твердого вещества грязно-белого цвета, после сушки в вакууме. Формиат аммония (3,2 г, 50 ммоль) добавляют в раствор 5-(4,6-бис-бензилоксибифенил-3-ил)-4-(4 метоксифенил)-3-метилизоксазола (1,4 г, 2,5 ммоль) в смеси метанол (20 мл)/этилацетат (10 мл) в атмосфере азота. Добавляют палладий на угле (10%) (каталитическое количество) и суспензию нагревают при температуре 60 С в течение 18 ч. Суспензии дают возможность остыть, добавляют этилацетат (150 мл) и суспензию отфильтровывают. Фильтрат промывают водой (3100 мл) и насыщенным водным раствором хлорида натрия (50 мл). Раствор высушивают над безводным сульфатом магния и концентрируют,что дает смолу бледно-коричневого цвета. Растирание в порошок с метанолом дает 7-гидрокси-3-(4 метоксифенил)-2-метил-6-фенилхромен-4-он в виде твердого вещества грязно-белого цвета, после сушки в вакууме. Гидрохлорид гидроксиламина (75 мг, 1,08 ммоль) добавляют в суспензию 7-гидрокси-3-(4 метоксифенил)-2-метил-6-фенилхромен-4-она (105 мг, 0,29 ммоль) в пиридине (2 мл) и смесь нагревают при температуре кипения с обратным холодильником в течение 6 ч, что дает раствор бледно-желтого цвета. Раствору дают возможность остыть и добавляют воду (20 мл). Смесь экстрагируют диэтиловым эфиром (210 мл). Объединенные экстракты промывают водой (220 мл) и насыщенным водным раствором хлорида натрия (10 мл). Раствор высушивают над безводным сульфатом магния и концентрируют. Сырой продукт очищают с помощью колоночной хроматографии на силикагеле, элюируя смесью этилацетат/гексан (1:1), что дает названное соединение в виде порошка грязно-белого цвета (80 мг). Гидрохлорид гидроксиламина (0,7 г, 10 ммоль) добавляют в суспензию 6-хлор-7-гидрокси-3-(4 метоксифенил)-2-метилхромен-4-она [получают в соотвтетствии с методикой, аналогичной методике получения соединения примера 1, стадия 2] (0,32 г, 1,0 ммоль) в пиридине (4 мл) и смесь нагревают при температуре кипения с обратным холодильником в течение 6 ч, что дает раствор бледно-желтого цвета. Раствору дают возможность остыть и добавляют воду (20 мл). Смесь экстрагируют диэтиловым эфиром(210 мл). Объединенные экстракты промывают водой (220 мл) и насыщенным водным раствором хлорида натрия (10 мл). Раствор высушивают над безводным сульфатом магния и концентрируют. Сырые продукты очищают с помощью колоночной хроматографии на силикагеле, элюируя смесью этилацетат/гексан (1:1), что дает 4-хлор-6-[4-(4-метоксифенил)-3-метилизоксазол-5-ил]бензол-1,3-диол в виде порошка грязно-белого цвета (0,103 г).- 13009919 ЯМР (ацетон-d6) 7,2 (д, J=8,8 Гц, 2ArH), 7,15 (с, ArH), 6,9 (д, J=8,8 Гц, 2ArH), 6,6 (с, ArH), 3,85 (с,3OCH3), 2,25 (с, 3CH3). Соединения по примерам 1-4 имеют IC50 HSP-90 в интервале А, когда их тестируют в опыте с АТФазой с помощью малахитовой зелени, описанной ниже. В следующих таблицах в последней колонке приведены результаты, полученные на той же основе, что и обследуемое соединение, за исключением соединения по примеру 12b, где активность определена в опыте по измерению поляризации флуоресценции, описанной ниже. Соединения по примерам 5-16 получают, используя реакцию, описанную для соединений по примерам 1-4. Другие детали, касающиеся получения соединений по примерам 6 и 7, являются аналогичными тем, которые приведены в примерах 86 и 87. Также коммерчески доступный из Interbioscreen. Коммерчески доступный из Enamine. Получают из защищенного промежуточного бромрезорцина с цианидом меди(I) в диметилформамиде при температуре 150 С. получают из стирилбороновой кислоты, которую конденсируют с бромизоксазольным соединением примера 2, стадия 1, как описано выше, с последующим восстановлением и обработкой гидроксиламином, в соответствии с аналогичной методикой, изложенной в примере 3.N-метилпиперазин (0,125 мл, 1,1 ммоль) добавляют в суспензию 4-[4-(4-метоксифенил)-3 метилизоксазол-5-ил]бензол-1,3-диола (0,15 г, 0,5 ммоль) и параформальдегида (0,040 г) в 1,4-диоксане (4 мл) и смесь нагревают при температуре кипения с обратным холодильником в течение 18 ч, что дает раствор желто-коричневого цвета. Раствору дают возможность остыть и затем добавляют этилацетат (25 мл). Смесь промывают водой (325 мл) и насыщенным водным раствором хлорида натрия(25 мл). Раствор высушивают над безводным сульфатом магния и концентрируют до образования смолы бледно-коричневого цвета. Растирание в порошок с гексаном, дает 4-[4-(4-метоксифенил)-3 метилизоксазол-5-ил]-2,6-бис-(4-метилпиперазин-1-илметил)бензол-1,3-диол (0,121 г) в виде порошка бледно-коричневого цвета. Стадия 1. н-Бутиллития (100 (1) добавляют в раствор 5-(2,4-бис-бензилокси-5-бромфенил)-4-(4 метоксифенил)-3-метилизоксазола (154 мг, 0,28 ммоль) в тетрагидрофуране (2,5 мл) в атмосфере азота при температуре -78 С. Раствор перемешивают при температуре -70 С в течение 30 мин, что измененяет его цвет до оранжевого. Ион гасят метилхлорформиатом (100 мкл, 3 экв.) и дают возможность нагреться до комнатной температуры в течение 30 мин. Раствор гасят насыщенным водным раствором хлорида аммония (5 мл). Смесь экстрагируют этилацетатом (35 мл). Объединенные экстракты промывают водой(25 мл) и насыщенным водным раствором хлорида натрия (5 мл). Раствор высушивают над безводным сульфатом магния и концентрируют. Сырые продукты очищают с помощью колоночной хроматографии на силикагеле, элюируя смесью этилацетат в гексане (градиент от 20 до 60% этилацетат), что дает метиловый эфир 2,4-бис-бензилокси-5-[4-(4-метоксифенил)-3-метилизоксазол-5-ил]бензойной кислоты[М+Н]+ 536,4 (продолжительность выполнения 7,5 мин). ЯМР (ДМСО-d6) 7,8 (с, ArH), 7,55 (д, J=7,1 Гц, 2ArH), 7,4 (т, J=6,2 Гц, 2ArH), 7,35 (д, J=6,1 Гц, ArH),7,3 (м, 3ArH), 7,1 (м, 4ArH), 7,0 (с, ArH), 6,9 (д 8,8 Гц, 2ArH), 5,3 (с, 2CH2), 5,1 (с, 2CH2), 3,78 (с, OCH3),3,76 (с, OCH3), 2,28 (с, CH3). Стадия 2. Формиат аммония (172 мг, 20 экв.) добавляют в раствор метилового эфира 2,4-бис-бензилокси-5-[4(4-метоксифенил)-3-метилизоксазол-5-ил]бензойной кислоты (72 мг, 0,13 ммоль) в смеси метанол(2 мл)/этилацетат (1 мл) в атмосфере азота. Добавляют 10% палладия на угле (каталитическое количество) и суспензию нагревают при температуре 60 С в течение ночи. Раствору дают возможность остыть. Добавляют этилацетат (5 мл), раствор промывают водой (25 мл) и насыщенным водным раствором хлорида натрия (5 мл). Раствор высушивают над безводным сульфатом магния и концентрируют. Сырые продукты очищают с помощью колоночной хроматографии на силикагеле, элюируя смесью этилацетат в гексане (градиент от 25 до 45% этилацетат), что дает метиловый эфир 2,4-дигидрокси-5-[4(4-метоксифенил)-3-метилизоксазол-5-ил]бензойной кислоты (7,0 мг).[М+Н]+ 356,3 (продолжительность выполнения 3,75 мин). ЯМР (CDCl3)10,85 (с, ArOH), 7,52 (с, ArOH), 7,12 (д, J=8 Гц, 2ArH), 6,98 (с, ArH), 6,91 (д,J=8 Гц, 2ArH), 6,45 (с, ArH), 3,78 (с, 3OCH3), 3,71 (с, 3OCH3), 2,21 (с, 3CH3). Соединения по примерам 14-16 имеют IC50 HSP-90 в интервалах 'А', 'В' и 'В' соответственно, когда их тестируют в опытах с АТФазой с помощью малахитовой зелени, описанной ниже. Аналогичным способом соединения по примерам 17-20 получают гашениемN-формилпиперидином, фенилтиоизоцианатом, 2-метоксифенилизоцианатом и бензальдегидом, соответственно. Заключительную реакцию снятия защиты выполняют с помощью трихлорида бора, как описано для получения соединения по примеру 23 (заключительная реакция представлена на схеме 5). Соединение по примеру 21 представляет собой побочный продукт из примера 16, стадия 1. Представленные данные по активности получают в опытах с малахитовой зеленью, описанной ниже. Триэтиламин (10 мл, 72,2 ммоль) добавляют в раствор 2,4-дигидроксибензофенона (1) (5,4 г,23,3 ммоль) в ТГФ (50 мл) и раствор охлаждают до температуры 0 С. Медленно добавляют этилхлорформиат (6,9 мл, 72,2 ммоль) и суспензию перемешивают в течение 30 мин при температуре 0 С и в течение 3 ч при комнатной температуре. Добавляют воду (150 мл) и смесь экстрагируют диэтиловым- 17009919 эфиром (150 мл). Экстракты промывают водой (2150 мл) и насыщенным водным раствором хлорида натрия (100 мл). Раствор высушивают над безводным сульфатом магния и концентрируют, что дает 4-бензилбензол-1,3-диол в виде смолы бледно-зеленого цвета, затвердевающей при стоянии, (8,2 г). Раствор боргидрида натрия (1,85 г,49 ммоль) в воде (30 мл) добавляют к охлажденному льдом раствору этилового эфира 2-бензоил-5-этоксикарбонилоксифенилового эфира угольной кислоты (3,6 г,10 ммоль) в ТГФ (30 мл). Смесь перемешивают в течение 60 мин при температуре 0 С и в течение 60 ч при комнатной температуре, что дает суспензию бледно-красного цвета. Добавляют воду (150 мл) и смесь экстрагируют диэтиловым эфиром (150 мл). Экстракты промывают водой (2100 мл) и насыщенным водным раствором хлорида натрия (50 мл). Раствор высушивают над безводным сульфатом магния и концентрируют, что дает смолу бледно-желтого цвета. Смолу помещают в водный раствор гидроксида натрия (20 мл, 10%), и раствор нагревают при температуре кипения с обратным холодильником в течение 60 мин. Раствору дают возможность остыть, после чего подкисляют соляной кислотой (5 мл, 37%). Смесь экстрагируют диэтиловым эфиром (50 мл). Экстракты промывают водой (340 мл) и насыщенным водным раствором хлорида натрия (30 мл). Раствор высушивают над безводным сульфатом магния и концентрируют, что дает 4-бензилбензол-1,3-диол в виде смолы темно-красного цвета (2,1 г).[М+Н]+ ион отсутствует (продолжительность выполнения 3,75 мин).(хлороформ-d) 7,2 (м, 3ArH), 7,1 (м, 2ArH), 6,85 (д, J=8,1 Гц, ArH), 6,3 (д, J=8,1 Гц, ArH), 6,2 (с,ArH), 3,85 (с, 2CH2). 4-Бензилбензол-1,3-диол используют в виде исходного продукта в синтезе по схеме 1, что обеспечивает соединение по примеру 23. Пример 23. 3-2,4-Дигидрокси-5-[4-(4-метоксифенил)-3-метилизоксазол-5-ил]фенилакриловой кислоты Схема 5. Реакция по Хеку и снятие защиты трихлоридом бора(1 мл,5,7 ммоль) добавляют в суспензию 5-(2,4-бис-бензилокси-5-бромфенил)-4-(4-метоксифенил)-3-метилизоксазола (0,56 г, 1,0 ммоль) в трет-бутилакрилате (1 мл, 6,8 ммоль) и 1-бутаноле (8 мл) в атмосфере азота. Добавляют дихлор-бис-(три-о-толилфосфин)палладия (II) (каталитическое количество) и суспензию нагревают при температуре 140 С в течение 18 ч, что дает раствор желтого/зеленого цвета. Раствору дают возможность остыть и концентрируют до образования смолы желтого/зеленого цвета. Сырой продукт очищают с помощью колоночной хроматографии на силикагеле, элюируя смесью этилацетат/гексан (1:9), что дает трет-бутиловый эфир 3-2,4-бис-бензилокси-5-[4-(4-метоксифенил)-3 метилизоксазол-5-ил]фенилакриловой кислоты в виде смолы желтого/зеленого цвета (315 мг). Исход- 18009919 ный продукт (170 мг) восстанавливают. Раствор трихлорида бора (2 мл, 1,0 М в дихлорметане) медленно добавляют в раствор трет-бутилового эфира 3-2,4-бис-бензилокси-5-[4-(4-метоксифенил)-3-метилизоксазол-5 ил]фенилакриловой кислоты (50 мг, 0,09 ммоль) в дихлорметане (1 мл) при температуре -78 С (сухой лед/ацетон) в атмосфере азота. Полученный раствор перемешивают в течение 1 ч при температуре-78 С и в течение 90 мин при комнатной температуре. Раствор охлаждают до температуры -78 С, добавляют воду (2 мл) и смесь перемешивают в течение 30 мин при комнатной температуре. Добавляют этилацетат (30 мл) и раствор промывают водой (25 мл) и насыщенным водным раствором хлорида натрия (10 мл). Раствор высушивают над безводным сульфатом магния и концентрируют до образования смолы бледно-желтого цвета. Растирание в порошок с гексаном дает твердое вещество желтого цвета,твердое вещество удаляют фильтрованием и промывают гексаном, сушат в вакууме, что дает 3-2,4-дигидрокси-5-[4-(4-метоксифенил)-3-метилизоксазол-5-ил]фенилакриловую кислоту (10 мг) в виде порошка желтого цвета.[М+Н]+ 368,3 (продолжительность выполнения 3,75 мин). ЯМР (ацетон-d6) 7,85 (д, J=16,1 Гц, CH), 7,5 (с, ArH), 7,25 (д, J=8,8 Гц, 2ArH), 6,95 (д, J=8,8 Гц,2ArH), 6,6 (с, ArH), 6,35 (д, J=16,1 Гц, CH), 3,8 (с, 3OCH3), 2,25 (с, 3CH3). Аналогичным образом получают 4-[4-(4-метоксифенил)-3-метилизоксазол-5-ил]-6-стирилбензол 1,3-диол (пример 24) путем снятия защиты трихлоридом бора с 5-(2,4-бис-бензилокси-5-стирилфенил)-4(4-метоксифенил)-3-метилизоксазола (получают из стирилбороновой кислоты, конденсируя промежуточный бромизоксазол, пример 3)[М+Н]+ 368,3 (продолжительность выполнения 3,75 мин). Соединения по примерам 22-24 имеют HSP-90 IC50 в интервалах 'А', 'В' и 'С' соответственно, когда тестируют при исследовании АТФазы с помощью малахитовой зелени, описанной ниже. Схема 6. Синтез 5-карбоксамидооксазолов Уксусную кислоту (17,5 мл) добавляют по каплям в суспензию 4-хлоррезорцина (42,5 г,0,293 ммоль) в эфирате трифторида бора (200 мл) в атмосфере азота. Реакционную смесь нагревают при температуре 90 С в течение 3,5 ч и затем дают возможность остыть до комнатной температуры. Твердое вещество получают после охлаждения в течение около 1 ч. Смесь выливают в 700 мл 10% вес./об. водный раствор ацетата натрия. Эту смесь энергично перемешивают в течение 2,5 ч. Получают твердое вещество светло-коричневого цвета, которое отфильтровывают, промывают водой и высушивают на воздухе в течение ночи, что дает 1-(5-хлор-2,4-дигидроксифенил)этанон (31,6 г, 58%). ЖХМС: [М-Н]+ 185. Стадия 2. 1-(2,4-бис-Бензилокси-5-хлорфенил)этанон Бензилбромид (30 мл) добавляют в смесь 1-(5-хлор-2,4-дигидроксифенил)этанона (20 г, 0,107 молей) и карбоната калия (37 г, 2,5 экв.) в ацетонитриле (350 мл). Смесь нагревают при температуре кипения с обратным холодильником в течение 6 ч, затем дают возможность остыть и перемешивают в течение ночи. Смесь отфильтровывают, и твердое вещество промывают дихлорметаном (3100 мл). Объединенные органические экстракты выпаривают в вакууме до получения твердого вещества бледно-желтого цвета, которое растирают в порошок со смесью гексан (350 мл)/этилацетат (15 мл) и отфильтровывают,что дает твердое вещество грязно-белого цвета, 1-(2,4-бис-бензилокси-5-хлорфенил)этанон (35,4 г, 90%). 1 Металлический натрий (1,35 г, 0,058 моль) добавляют в небольшими частями в течение 20 мин в перемешиваемый безводный этанол в атмосфере азота. Реакционную смесь затем перемешивают в течение еще 10 мин, пока весь натрий не прореагирует, что дает гомогенный раствор. Добавляют порциями в течение 2-3 мин 1-(2,4-бис-бензилокси-5-хлорфенил)этанон (10,0 г, 0,027 моль) и полученную суспензию перемешивают в течение 5 мин перед добавлением диэтилоксалата (6 мл, 0,043 моль), что ведет к образованию плотного осадка желтого цвета. Реакционную смесь нагревают до температуры кипения с обратным холодильником (получая гомогенный раствор коричневого цвета) в течение 4 ч, затем дают возможность остыть до комнатной температуры и добавляют уксусную кислоту (6 мл). Полученные твердые формы растирают в порошок, отфильтровывают, промывают этанолом и высушивают, что дает твердое вещество желтого цвета (12,0 г, 95%). 1 Гидрохлорид гидроксиламина (0,89 г; 12,8 ммоль) добавляют в суспензию этилового эфира 4-(2,4-бис-бензилокси-5-хлорфенил)-2-гидрокси-4-оксобут-2-еновой кислоты (5,00 г; 10,7 ммоль) в абсолютном этаноле (100 мл). Реакционную смесь нагревают при температуре кипения с обратным холодильником в течение 4 ч, затем дают возможность остыть до температуры окружающей среды (в течение этого времени смесь остается гетерогенной, но приобретает окраску светло-желтого цвета). Смесь отфильтровывают и отфильтрованное твердое вещество промывают водой (220 мл),этанолом (220 мл) и высушивают в вакууме при температуре 45 С. Это дает этиловый эфир 5-(2,4-бис-бензилокси-5-хлорфенил)изоксазол-3-карбоновой кислоты в виде пушистого твердого вещества желтого цвета, 4,49 г (91%). ЖХМС: [М+Н]+ 466, 464 (37Cl; 35Cl). 1 Раствор этиламина в растворе метанола (2,0 М; 40 мл; 80 ммоль) добавляют в перемешиваемую суспензию этилового эфира 5-(2,4-бис-бензилокси-5-хлорфенил)изоксазол-3-карбоновой кислоты(4,40 г; 9,51 ммоль) в абсолютном этаноле (50 мл). Реакционную смесь нагревают до температуры 80 С(температура масляной бани) в течение пяти ч. Реакционной смеси дают возможность остыть до температуры окружающей среды и оставляют стоять в течение ночи. Получают бесцветный твердый продукт и затем реакционную смесь еще охлаждают в водяной бане со льдом, отфильтровывают и промывают холодным этанолом (220 мл). Бесцветный продукт высушивают в вакууме, что дает этиламид 5-(2,4-бис-бензилокси-5-хлорфенил)изоксазол-3-карбоновой кислоты 3,42 г (78%). ЖХМС: [М+Н]+ 465, 463 (37Cl; 35Cl). 1 Раствор брома в уксусной кислоте (0,6 М; 7,2 мл; 4,32 ммоль) добавляют в перемешиваемую суспензию этиламида 5-(2,4-бис-бензилокси-5-хлорфенил)-4-бромизоксазол-3-карбоновой кислоты (2,00 г; 4,32 ммоль) и ацетата натрия (0,708 г, 8,64 ммоль) в уксусной кислоте (30 мл) при температуре окружающей среды. Смесь нагревают до температуры 80 С и она становится гомогенной в течение 5-10 мин,что дает раствор темно-красного цвета. После нагревания в течение 2,5 ч раствор окрашивается в желтый цвет. TLC (ТСХ)-анализ показывает наличие исходного продукта и продукта. Добавляют еще 2,0 мл(1,2 ммоль) раствора брома в уксусной кислоте в течение последующих 2 ч. Реакционной смеси дают возможность остыть до температуры окружающей среды и удаляют уксусную кислоту в вакууме, что дает твердый остаток, который распределяют между эфиром (200 мл) и водой (200 мл). Фазы отделяют и органическую фазу промывают водой (3100 мл), насыщенным водным раствором бикарбоната натрия(2100 мл) и насыщенным раствором хлорида натрия (1200 мл). Органическую фазу высушивают над сульфатом натрия, отфильтровывают и отфильтрованные растворители удаляют в вакууме, что дает масло желтого цвета, которое очищают с помощью флэш-хроматографии на силикагеле, элюируя 1-20% этилацетата в гексане. Это дает продукт в виде бесцветного твердого вещества, 1,2 г (52%). ЖХМС: [М+Н]+ 543, 541 (81Br; 79Br). 1 В смесь 4-метоксифенилбороновой кислоты (0,178 г, 1,17 ммоль) и этиламида 5-(2,4-бис-бензилокси-5-хлорфенил)-4-бромизоксазол-3-карбоновой кислоты (0,507 г, 0,94 ммоль) добавляют гидрокарбонат натрия (237 мг, 2,82 ммоль), затем ДМФА (5 мл) и воду (1,0 мл). Смесь дегазируют вакуумированием и продувают азотом (три раза), затем пробулькивают газообразный азот через смесь в течение 5 мин. Добавляют дихлор-бис-(трифенилфосфин)палладия (II) (66 мг,0,094 ммоль) и реакционную смесь нагревают в атмосфере азота до температуры 90 С в течение 2 ч(реакционная смесь становится окрашенной в темно-коричневый цвет). Добавляют еще 10 мг дихлор-бис-(трифенилфосфин)палладия (II) и реакционную смесь нагревают при температуре 90 С в течение 15 ч, затем ей дают возможность остыть до температуры окружающей среды. Большую часть растворителей удаляют в вакууме и остаток распределяют между этилацетатом (50 мл) и водой(50 мл). Эту смесь отфильтровывают через подушку из целита, чтобы удалить остатки палладия и, затем фазы отделяют и органическую фазу промывают водой (230 мл), насыщенным водным раствором хлорида натрия (50 мл), затем высушивают над сульфатом натрия. Смесь отфильтровывают и отфильтрованные растворители удаляют в вакууме, что дает масло желтого цвета (598 мг). Сырой продукт реакции очищают адсорбированием на силикагеле, затем флэш-хроматографией на силикагеле (20 г IST),элюируя градиентом растворителя от 1 до 20% смесью этилацетата в гексане. Это дает этиламид 5-(2,4-бис-бензилокси-5-хлорфенил)-4-(4-метоксифенил)изоксазол-3-карбоновой кислоты в виде бесцветного твердого вещества (0,223 г, 40%). ЖХМС: [М+Н]+ 571, 569 (37Cl; 35Cl). 1 В охлажденный в бане со льдом раствор этиламида 5-(2,4-бис-бензилокси-5-хлорфенил)-4-(4 метоксифенил)изоксазол-3-карбоновой кислоты (0,213 мг, 0,374 ммоль) в дихлорметане (5 мл) в атмосфере азота добавляют 1,0 М раствор трихлорида бора в дихлорметане (1,12 мл; 1,12 ммоль). Реакционную смесь перемешивают при температуре 0 С в течение 15 мин, затем при температуре окружающей среды в течение 35 мин. Реакционную смесь повторно охлаждают до температуры 0 С и гасят добавлением насыщенного водного раствора кислого углекислого натрия (5 мл). После перемешивания в течение 5 мин дихлорметан удаляют в вакууме и остаток распределяют между этилацетатом (30 мл) и водой(30 мл). Фазы отделяют и органическую фазу промывают водой (30 мл), насыщенным водным раствором хлорида натрия (30 мл), затем высушивают над сульфатом натрия. Смесь отфильтровывают и отфильтрованный растворитель удаляют в вакууме, что дает пенообразное бесцветное твердое вещество, которое очищают адсорбированием на силикагеле, затем флэш-хроматографией на силикагеле (10 г IST), элюируя смесью 50% этилацетата в гексане. Это дает этиламид 5-(5-хлор-2,4-дигидроксифенил)-4-(4 метоксифенил)изоксазол-3-карбоновой кислоты в виде бесцветного твердого вещества (0,097 г; 67%). ЖХМС: [М+Н]+ 391, 389 (37Cl; 35Cl). 1H ЯМР (400 МГц, d6-ДМСО)1,08 (т, 3H), 3,22 (м, 2 Н), 3,73 (с, 3H), 6,59 (с, 1H), 6,87 (д, 1H), 7,137,17 (м, 3H), 8,88 (уширенный т, 1H), 10,09 (с, 1H), 10,62 (с, 1H). Соединение по примеру 25 имеет активность 'А' в исследовании поляризации флуоресценции, как описано ниже. Аналогичным образом, получают соединение по примеру 26 путем конденсации Boc защищенного 4-пиперазинофенилборонатного эфира, как указано выше. Указанный боронатный эфир получают из 1-(4-бромфенил)пиперазина с помощью введения Boc защиты, затем образования боронатного эфира с помощью Pd-каталитического взаимодействия с бис-(тетраметилпинаколато)дибором. Соединение по примеру 27 получают аналогичным образом. Соединение по примеру 27 а получают путем снятия защи- 22009919 ты с этиламида 5-(2,4-бис-бензилокси-5-хлорфенил)-4-бромизоксазол-3-карбоновой кислоты. Стадия 1. 1-(2,4-бис-Бензилокси-5-хлорфенил)-3-гидроксибут-2-ен-1-он. В раствор кетона (15 г) в EtOAc (200 мл) добавляют небольшими частями металлический натрий(3,0 г). Суспензию перемешивают при комнатной температуре в течение 15 мин, затем нагревают до температуры кипения с обратным холодильником в течение ночи. Реакционную смесь гасят уксусной кислотой и осадок желтого цвета отфильтровывают. Его растирают в порошок в гексане, что дает кристаллы ярко-желтого цвета. ЯМР показывает наличие требуемого продукта, главным образом, в енольной форме и небольшие следы в виде кетоформы. Стадия 2. 5-(2,4-бис-Бензилокси-5-хлорфенил)-3-метилизоксазол. Дикетон (4,0 г) суспендируют в 80% водном растворе EtOH. Добавляют гидрохлорид гидроксиламина (3,4 г) и ацетат натрия (4,0 г) и рН доводят до значения 8/9 с помощью 2 М NaOH. Раствор нагревают до температуры кипения с обратным холодильником в течение 24 ч (трудно наблюдать ТСХ из-за очень схожих значений Rf), затем раствор подкисляют до значения рН 5 с помощью 1 М HCl и выливают в воду. Осадок белого цвета отфильтровывают, промывают водой и растирают в порошок с гексаном, что дает твердое вещество белого цвета.- 23009919 Замечания: Соединение может также быть промыто эфиром, если необходимо, чтобы удалить следы примесей, но это обычно не требуется. ЯМР показывает наличие требуемого продукта. Стадия 3. 5-(2,4-бис-Бензилокси-5-хлорфенил)-4-йод-3-метилизоксазол. Изоксазол (2 г) помещают в смесь уксусной кислоты (24 мл) и воды (30 мл). Добавляют монохлорид йода (2 г избыток) и раствор нагревают при температуре 80 С в течение 2-3 ч. После охлаждения до комнатной температуры добавляют 10% раствор Na2SO3 (сульфит натрия) в воде (50 мл). Вязкое оранжевого цвета твердое вещество/масло отделяют из смеси и промывают водой, затем его растворяют в ацетоне и отфильтровывают. Удаление ацетона под вакуумом дает вязкое оранжевого цвета масло, которое затвердевает до твердого вещества оранжевого цвета в течение ночи. ЯМР и ЖХМС показывает наличие этого требуемого продукта. Стадия 4. 3-[5-(2,4-бис-Бензилокси-5-хлорфенил)-3-метилизоксазол-4-ил]бензальдегид(200 мг,0,38 ммоль) и 3-формилбензолбороновую кислоту (85 мг, 1,5 экв.) растворяют в ДМФА (12 мл) перед добавлением при перемешивании 1 М раствора гидрокарбоната натрия (1,1 мл, 3,0 экв.) и Pd(Ph3P)2Cl2 (21 мг, 0,08 экв.). Реакционную смесь распределяют на три микроволновые трубки, которые герметизируют и находящиеся в них смеси дегазируют, перед облучением в микроволновом приборе СЕМ с исходной мощностью 200 Вт до температуры 150 С в течение 15 мин. При охлаждении реакционные смеси объединяют и распределяют между этилацетатом (10 мл) и водой (10 мл). Водный слой отделяют, а затем экстрагируют снова этилацетатом (10 мл). Органику затем объединяют, промывают водой (220 мл), рассолом (20 мл),высушивают над Na2SO4 перед отгонкой в вакууме и очищают с помощью флэш-хроматографии на силикагеле, элюируя смесью 25% этилацетата в гексане. ЖХМС tR=9,06, MS м/е 510,4 [М+Н]+. Стадия 5. 4-3-[5-(2,4-бис-Бензилокси-5-хлорфенил)-3-метилизоксазол-4-ил]бензилморфолин 3-[5-(2,4-бис-Бензилокси-5-хлорфенил)-3-метилизоксазол-4-ил]бензальдегид (25 мг, 0,05 ммоль) и морфолин (0,3 мл) смешивают с DCE (0,5 мл) в микроволновой трубке. Добавляют триацетоксиборгидрид натрия (15 мг, 1,4 экв.), трубку герметизируют и помещают в атмосферу азота. Через 1 ч добавляют еще одну часть триацетоксиборгидрида натрия (15 мг) и реакционную смесь оставляют перемешиваться в течение ночи. ТСХ анализ показывает, что реакция не дошла до завершения, поэтому добавляют каплю уксусной кислоты и реакционную смесь снова оставляют перемешиваться в течение ночи, после чего реакционную смесь гасят 1 М раствором NaHCO3 (7 мл), а затем экстрагируют в EtOAc (5 мл). Ее высушивают над MgSO4 и растворитель удаляют в вакууме, что обеспечивает 13 мг сырого продукта в виде порошка грязно-белого цвета, который оставляют для стадии снятия защиты. Стадия 6. 4-Хлор-6-[3-метил-4-(3-морфолин-4-илметилфенил)изоксазол-5-ил]бензол-1,3-диол С 4-3-[5-(2,4-бис-бензилокси-5-хлорфенил)-3-метилизоксазол-4-ил]бензилморфолина снимают защиту, как ранее показано, и сырой продукт очищают с помощью препаративной ТСХ, элюируя смесью 10% этанола в дихлорметане, что обеспечивает 0,6 мг (7% выход) продукта в виде порошка белого цвета. ЖХМС tR=5,46, MS м/е 399,3 [М-Н]-. Соединение по примеру 28 имеет активность 'А' в исследовании поляризации флуоресценции, как описано ниже. Получают с использованием методики, аналогичной методике получения 4-хлор-6-[3-метил-4-(3 морфолин-4-илметилфенил)изоксазол-5-ил]бензол-1,3-диола, за исключением того, что изонипекотамид заменяют морфолином и триацетоксиборгидридом натрия (3 экв.) и уксусную кислоту (1 каплю) добавляют в начальной стадии. Реакцию завершают после 18 ч и сырой продукт, полученный после обработки,оставляют для стадии снятия защиты. Амид 1-3-[5-(5-хлор-2,4-дигидроксифенил)-3-метилизоксазол-4-ил]бензилпиперидин-4 карбоновой кислоты С амида 1-3-[5-(2,4-бис-бензилокси-5-хлорфенил)-3-метилизоксазол-4-ил]бензилпиперидин-4 карбоновой кислоты снимают защиту, как ранее показано, и сырой продукт очищают с помощью препаративной ТСХ, элюируя смесью 10% этанола в дихлорметане, что обеспечивает 0,7 мг (3% выход) продукта в виде порошка белого цвета. ЖХМС tR=5,36, MS м/е 442,3 [М+Н]+. Соединение по примеру 29 имеет активность 'А' в исследовании поляризации флуоресценции, как описано ниже. Аналогичным способом получают соединение по примеру 30. Этиламид 5-(2,4-бис-бензилокси-5-хлорфенил)изоксазол-3-карбоновой кислоты (0,90 г, 1,94 ммоль),N-йодсукцинимид (0,44 г, 1 экв.) и аммонийный нитрат церия (IV) (0,53 г, 0,5 экв.) суспендируют в ацетонитриле (55 мл) перед нагреванием до температуры кипения с обратным холодильником (масляная баня 100 С), после чего смесь становится гомогенной. Через 18 ч раствор охлаждают и растворитель удаляют в вакууме, что дает густое масло оранжевого цвета. Его распределяют между DCM (25 мл) и водой (10 мл), органический слой оставляют и промывают рассолом (225 мл) перед высушиванием над 1,3-Дибромбензол (0,90 мл, 7,49 ммоль), N-метилпиперазин (0,28 мл, 2,50 ммоль) и безводный толуол (7 мл) добавляют с помощью шприца в сухую, наполненную аргоном колбу. Раствор тщательно смешивают перед внесением BINAP (47 мг) и Pd2dba3 (23 мг) и колбу наполняют снова аргоном и добавляют через шприц DBU (0,93 г, 2,5 экв.). Реакционную смесь нагревают до температуры 60 С перед добавлением одной порции недавно растертого в порошок трет-бутоксида натрия с исходную реакционную смесь. Реакционную смесь оставляют перемешиваться при температуре 60 С в течение ночи и ТСХ анализ выявляет присутствие еще некоторого количества пиперазина, поэтому реакционную смесь нагревают до температуры 100 С и перемешивают в течение еще 24 ч, после чего ее распределяют между EtOAc(20 мл) и водой (20 мл). Водный слой экстрагируют снова EtOAc и объединенную органику промывают 1,6 М раствором HCl (210 мл). Кислый раствор, содержащий продукт, затем подщелачивают сначала небольшим количеством 1 М раствора NaOH до образования кислого раствора и затем осторожно добавляют твердый гидрокарбоната натрия, чтобы довести значение рН 8,5, перед экстрагированием обратно вEtOAc (215 мл), после чего промывают рассолом, высушивают над MgSO4 и выпаривают досуха, что обеспечивает 0,50 г (78% выход) чистого продукта в виде масла желтого цвета. ЖХМС tR=4,55, MS м/е 255,4/257,3 [М+Н]+. Стадия 3. 1-Метил-4-[3-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]пиперазин В раствор PdCl2 (dppf).DCM (10 мг, 0,012 ммоль) в безводном толуоле (4 мл) в заполненной аргоном герметичной микроволновой трубке добавляют 1-(3-бромфенил)-4-метилпиперазин (100 мг,0,39 ммоль), Et3N (0,11 мл, 2 экв.), и 4,4,5,5-тетраметил-1,3,2-диоксаборолан (0,09 мл, 1,5 экв.). Микроволновую трубку вакуумируют и заполняют аргоном, перед облучением в СЕМ микроволновом реакторе при температуре 100 С в течение 1 ч, используя исходную мощность 200 Вт. Реакционную смесь распределяют в основном между толуолом (6 мл) и водой (10 мл), органический слой отделяют, промывают водой (110 мл), высушивают над MgSO4 и затем выпаривают в вакууме до получения пурпурного/коричневого цвета остадка, который используют в реакции конденсации по Судзуки без дальнейшей очистки. ЖХМС tR=0,97, MS м/е 303,5 [М+Н]+. Стадия 4. Этиламид 5-(2,4-бис-бензилокси-5-хлорфенил)-4-[3-(4-метилпиперазин-1 ил)фенил]изоксазол-3-карбоновой кислоты Этиламид 5-(2,4-бис-бензилокси-5-хлорфенил)-4-бромизоксазол-3-карбоновой кислоты (38 мг,0,07 ммоль) и 1-метил-4-[3-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]-пиперазин (31 мг,2 экв.) конденсируют вместе, используя ранее описанную методику по Судзуки, что обеспечивает 37 мг(83% выход) сырого продукта в виде масла коричневого цвета, которое оставляют для стадии снятия защиты. Стадия 5. Этиламид 5-(5-хлор-2,4-дигидроксифенил)-4-[3-(4-метилпиперазин-1-ил)фенил]изоксазол-3-карбоновой кислоты С этиламида 5-(2,4-бис-бензилокси-5-хлорфенил)-4-[3-(4-метилпиперазин-1-ил)фенил]изоксазол-3 карбоновой кислоты снимают защиту, как ранее показано. Образовавшийся в реакции осадок отделяют,- 26009919 распределяют между EtOAc и водой. Водный слой оставляют, подщелачивают, используя твердый гидрокарбонат натрия и продукт экстрагируют, используя EtOAc (210 мл). Объединенную органику промывают рассолом (10 мл) высушивают над MgSO4 и выпаривают в вакууме, что обеспечивает 5,2 мгn (d4-MeOH), 7,17 (1H, м, ArH), 7,09 (1H, c, ArH), 6,94 (1H, м, ArH), 6,80 (1H, м, ArH), 6,49 (1H, с,ArH), 3,13 (4H, т, NCH2CH2N-CH3), 2,69 (2H, кв, CONHCH2CH3), 2,61 (4H, т, NCH2CH2N-CH3), 2,37 (3H,c, NCH2CH2N-CH3), 1,19 (3H, т, CONHCH2CH3). Соединение по примеру 31 имеет активность 'А' в исследовании поляризации флуоресценции, как описано ниже. Соединения по примерам 32-38 в таблице, представленной ниже, получают аналогичным образом,но со следующими вариациями. 1. Для примера 36 промежуточный диоксаборолан получают следующим образом: Схема 1-(4-Бромфенил)пиперазин (1 г, 4,1 ммоль) и карбонат калия (1,8 г, 3 экв.) в ДМФА (15 мл) нагревают с метилйодиде (250 мкл, 1,1 экв.), раствор перемешивают при комнатной температуре в течение ночи. Реакционную смесь гасят деионизированной водой (10 мл), экстрагируют этилацетатом. Органическую фазу промывают гидрокарбонатом натрия, чтобы удалить любую диметилированную примесь, высушивают и растворитель удаляют, что дает 1-(4-бромфенил)-4-метилпиперазин с 73% выходом. 1-(4-Бромфенил)-4-метилпиперазин (750 мг, 3 ммоль) в ДМСО (15 мл) объединяют с бис-(пинаколато)дибораном (1,1 г, 1,5 экв.) и ацетатом калия (900 мг, 3 экв.). Суспензию дегазируют перед обработкой PdCl2 (dppf) (каталитическое количество), перемешивают при температуре 80 С. Дополнительно через 3 ч добавляют бис-(пинаколато)диборан (1 экв.), перемешивают в течение еще 2 ч. Суспензию распределяют между этилацетатом и водой. Очистка с помощью колоночной хроматографии с градиентом 0-8% метанола в дихлорметане, дает 1-метил-4-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан 2-ил)фенил]пиперазин с 62% выходом.[М+Н]+ 303 (продолжительность выполнения 3,75 мин). 2. Для примеров 37 и 38 промежуточное соединение бороновой кислоты используют вместо диаоксаборолана и получают в следующем виде.- 27009919 4-[(2-Метилсульфонил)этиламинометил]фенил бороновой кислоты (промежуточное соединение для примера 37) Гидрохлорид 4-аминометилфенилбороновой кислоты (560 мг, 3 ммоль) в этаноле (5 мл) нагревают с метилвинилсульфоном (260 мкл, 1 экв.) и триэтиламином (1,2 мл, 3 экв.). Раствор перемешивают при температуре 100 С в течение 2 ч. Этанол удаляют под вакуумом, распределяют в воде и бутаноле, что дает 4-[(2-метилсульфонил)этиламинометил]фенилбороновую кислоту с 94% выходом.[М+Н]+ 258 (продолжительность выполнения 3,75 мин). 4-[N-метил-S,S-диоксотиоморфолино]фенилбороновая кислота (промежуточное соединение для примера 38) Гидрохлорид 4-аминометилфенилбороновой кислоты (456 мг, 2,4 ммоль) в этаноле (8 мл) нагревают с метилвинилсульфоном (244 мкл, 1 экв.) и триэтиламином (2 экв.), раствор перемешивают при температуре 100 С в течение 3 ч. Этанол удаляют под вакуумом, распределяют в воде и бутаноле, что дает продукт с 88% выходом. Этиламид 5-(2,4-бис-бензилокси-5-хлорфенил)-4-бромизоксазол-3-карбоновой кислоты (60 мг,0,11 ммоль) и 3-хлорбензолбороновую кислоту (23 мг, 1,3 экв.) конденсируют, используя описанную ранее методику кондесирования по Судзуки, что обеспечивает 35 мг (55% выход) сырого продукта в виде порошка коричневого цвета, который оставляют для следующей стадии. В раствор этиламида 5-(2,4-бис-бензилокси-5-хлорфенил)-4-(3-хлорфенил)изоксазол-3-карбоновой кислоты (36 мг, 0,06 ммоль) в безводном ТГФ в атмосфере аргона добавляют комплекс 1 М Боран-ТГФ(1 мл) и раствор нагревают до температуры кипения с обратным холодильником в течение ночи. После охлаждения раствор выливают в Isolute SPE Flash SCX-25 г колонку, которую быстро элюируют с метанолом (220 мл). Желаемый продукт затем выделяют, элюируя смесью 10% аммиака в метаноле (210 мл), который выпаривают в вакууме, что обеспечивает 23 мг (65% выход) светло-желтого цвета. ЖХМС (LCT) tR=8,18, MS м/е 558,8 [М+Н]+. Соединение по примеру 39 имеет активность 'А' в исследовании поляризации флуоресценции, как описано ниже. Соединение по примеру 40 получают аналогичным образом:(получают как для примера 31) (2 г, 3,4 ммоль),4-формилбороновую кислоту (0,612 г, 4,08 ммоль),NaHCO3 (10,2 мл, 1 М водный раствор, 10,2 ммоль), PdCl2(PPh3)2 (119 мг, 0,17 ммоль) и ДМФА (50 мл). Затем смесь дегазируют пробулькиванием N2 в течение 5 мин перед нагреванием при температуре 80 С в течение 1 ч. Смесь затем выпаривают в вакууме и распределяют между EtOAc (350 мл) и водой (50 мл). Объединенную, высушенную (Na2SO4) органику выпаривают в вакууме, что дает сырое масло. Его растворяют в EtOAc и пропускают через подушку SiO2, промывая EtOAc. Фильтрат выпаривают в вакууме и полученное масло растирают в порошок с Et2O, что дает этиламид 5-(2,4-бис-бензилокси-5-хлорфенил)4-(4-формилфенил)изоксазол-3-карбоновой кислоты (1,577 г, 82%) в виде окрашенного в бледный цвет твердого вещества,LC/MS: время задержки 2,908 мин. 567,3 (МН+).
МПК / Метки
МПК: C07D 261/08, C07D 413/10, A61P 35/00, C07D 417/04, C07D 261/10, C07D 413/04, C07D 495/04
Метки: изоксазола, соединения
Код ссылки
<a href="https://eas.patents.su/30-9919-soedineniya-izoksazola.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения изоксазола</a>
Предыдущий патент: Фармацевтические композиции, содержащие высшие первичные алифатические спирты и ингибитор гмг-коа-редуктазы, и способ их получения
Следующий патент: Соединения пиримидотиофена
Случайный патент: Способ уменьшения выбросов парниковых газов в атмосферу












