Замещённые тетралины и инданы и их применение
Номер патента: 9554
Опубликовано: 28.02.2008
Авторы: Демарест Кит Т., Чен Сяоли, Рибжински Филип, Мэттьюз Джей М., Ли Джанг
Формула / Реферат
1. Способ лечения или ингибирования развития заболевания, опосредуемого PPAR-альфа, включающий введение пациенту, нуждающемуся в лечении, фармацевтически эффективного количества композиции, содержащей соединение формулы I
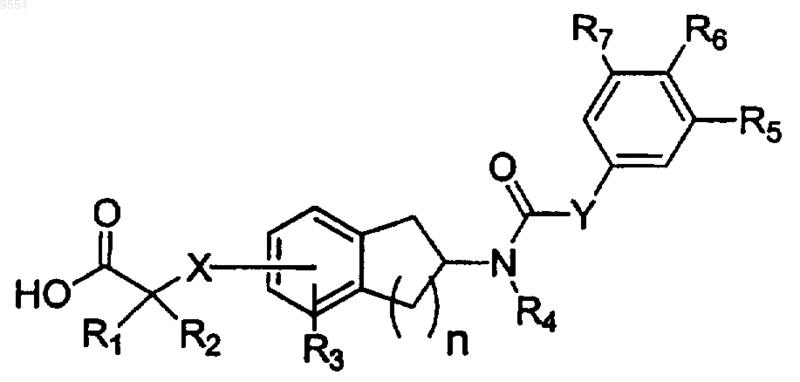
Формула I
или его фармацевтически приемлемую соль, C1-6сложный эфир или C1-6амид, где
каждый из R1 и R2 независимо представляет собой Н, С1-6алкил, или R1 и R2, взятые вместе с атомом углерода, к которому они присоединены, представляют собой С3-7циклоалкил;
n равно 1 или 2;
X представляет собой О или S; в котором X находится в 5 или 6 положении, когда n равно 1; и в котором X находится в 6 или 7 положении, когда n равно 2;
R3 представляет собой Н, C1-6алкил, C1-3алкокси, галоген, фенил; и R3 находится в орто- или мета-положении по отношению к X;
R4 представляет собой Н или -(C1-5aлкилен)Rl5, где R15 представляет собой Н, C1-7алкил, C1-6алкокси, С3-7алкенил, С3-6циклоалкил, [ди(С1-2алкил)амино](C1-6алкилен);
Y представляет собой NH или О;
каждый из R5 и R7 независимо выбран из Н, C1-6алкила, галогена, нитро, C1-4алкокси;
R6 выбран из C1-6алкила, галогена, гидрокси, C1-4алкокси, C1-4алкилтио, фенила, NR13R14;
каждый из R13 и R14 независимо представляет собой Н или C1-6алкил;
либо R5 и R6 могут быть взяты вместе, чтобы представлять собой двухвалентный насыщенный остаток -(СН2)3-;
где каждый из указанных выше гидрокарбильных остатков может быть замещен заместителями в количестве, находящемся в пределах между 1 и 3, независимо выбранными из F, Cl, Br, I, амино, метила, этила, гидрокси, нитро, циано и метокси, где указанное заболевание, опосредуемое PPAR-альфа, выбрано из ослабленной толерантности к глюкозе, гиперинсулинемии, гипергликемии, устойчивости к инсулину и раннего, промежуточного или позднего (NIDDM) диабета типа II и их осложнений.
2. Способ по п.1, где указанное осложнение выбрано из ретинопатии, нефропатии и невропатии.
3. Способ по п.1, где указанное заболевание, опосредуемое PPAR-альфа, выбрано из ослабленной толерантности к глюкозе, устойчивости к инсулину, гипергликемии, гиперинсулинемии и раннего диабета типа II и их осложнений.
4. Способ по п.1, где указанное заболевание, опосредуемое PPAR-альфа, выбрано из промежуточного или позднего диабета типа II и их осложнений.
5. Способ по п.1, где указанное соединение формулы I представляет собой первый противодиабетический агент, и в котором указанный способ дополнительно включает в себя стадию введения пациенту совместно-эффективного количества второго противодиабетического агента.
6. Способ по п.5, где указанный второй противодиабетический агент выбран из агентов, модулирующих PPAR альфа и PPAR гамма.
7. Способ по п.5, где указанный второй противодиабетический агент представляет собой инсулин.
8. Способ по п.1, дополнительно включающий стадию введения совместно-эффективного количества третьего фармацевтически активного агента.
9. Способ по п.8, где указанный третий фармацевтически активный агент выбран из противодиабетического агента, агента, понижающего уровень липидов, и агента, понижающего давление крови.
10. Способ для лечения или ингибирования развития заболевания, опосредуемого PPAR-альфа, а также лечения или ингибирования развития дислипидемии, включающий введение пациенту, нуждающемуся в лечении, фармацевтически эффективного количества композиции, содержащей соединение формулы I
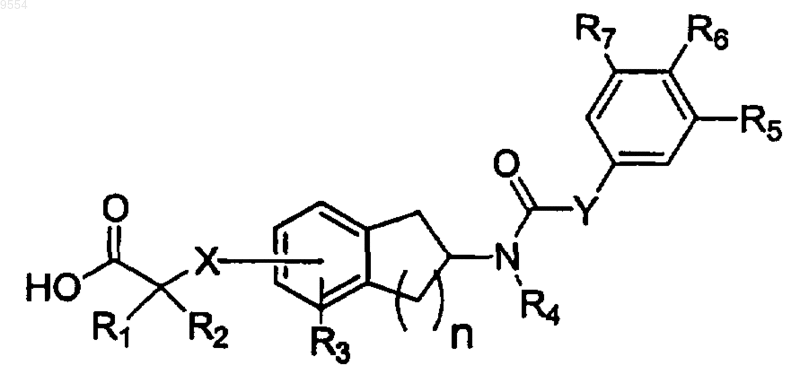
Формула I
или его фармацевтически приемлемую соль, C1-6сложный эфир или C1-6амид, где
каждый из R1 и R2 независимо представляет собой Н, C1-6алкил, или R1 и R2, взятые вместе с атомом углерода, к которому они присоединены, представляют собой С3-7циклоалкил;
n равно 1 или 2;
X представляет собой О или S; в котором X находится в 5 или 6 положении, когда n равно 1; и в котором X находится в 6 или 7 положении, когда n равно 2;
R3 представляет собой Н, C1-6алкил, C1-3алкокси, галоген, фенил; и R3 находится в орто или мета положении по отношению к X;
R4 представляет собой Н или -(C1-5aлкилен)Rl5, где R15 представляет собой Н, C1-7алкил, C1-6алкокси, С3-7алкенил, С3-6циклоалкил, [ди(С1-2алкил)амино] (C1-6алкилен);
Y представляет собой NH или О;
каждый из R5 и R7 независимо выбран из Н, C1-6алкила, галогена, нитро, C1-4алкокси;
R6 выбран из C1-6алкила, галогена, гидрокси, C1-4алкокси, C1-4алкилтио, фенила, NR13R14;
каждый из R13 и R14 независимо представляет собой Н или C1-6алкил;
либо R5 и R6 могут быть взяты вместе, чтобы представлять собой двухвалентный насыщенный остаток -(СН2)3-;
где каждый из указанных выше гидрокарбильных остатков может быть замещен заместителями, в количестве, находящемся в пределах между 1 и 3, независимо выбранными из F, Cl, Br, I, амино, метила, этила, гидрокси, нитро, циано и метокси, где указанное заболевание, опосредуемое PPAR-альфа, выбрано из ослабленной толерантности к глюкозе, гиперинсулинемии, устойчивости к инсулину и раннего, промежуточного или позднего диабета типа II (NIDDM) и их осложнений.
11. Способ по п.1 или 10, в котором R3 представляет собой Н, R4 представляет собой С2-7алкил и Y представляет собой NH.
12. Способ по п.1 или 10, в котором
каждый из R1 и R2 независимо представляет собой Н, C1-6 алкил;
n равно 1 или 2;
X представляет собой О или S; в котором X находится в 5 или 6 положении, когда n равно 1; и в котором X находится в 6 или 7 положении, когда n равно 2;
R3 представляет собой Н, фенил, C1-3алкокси, галоген, C1-6алкил, и R3 находится в орто- или мета-положении по отношению к X;
R4 представляет собой Н или -(C1-5алкилен)R15, в котором R15 представляет собой Н, C1-7алкил, C1-6алкокси, С3-7алкенил, С3-6циклоалкил, [ди(С1-2алкил)амино] (C1-6алкилен);
Y представляет собой NH;
каждый из R5 и R7 независимо выбран из Н, C1-6алкила, галогена, C1-4алкокси;
R6 выбран из C1-6алкила, галогена, C1-4алкокси, C1-4алкилтио, фенила, NR13R14;
каждый из R13 и R14 независимо представляет собой Н или C1-6алкил;
в котором каждый из указанных выше гидрокарбильных остатков может быть замещен заместителями в количестве, находящемся в пределах между 1 и 3, независимо выбранными из F, Cl, амино, метила, этила, гидрокси и метокси.
13. Способ по п.1 или 10, где соединение формулы I выбирают из
2-{6-[1-этил-3-(4-трифторметоксифенил)уреидо]-5,6,7,8-тетрагидронафталин-2-илсульфанил}-2-метилпропионовой кислоты;
2-{2-[1-этил-3-(4-трифторметоксифенил)уреидо]индан-5-илсульфанил}-2-метилпропионовой кислоты;
2-{2-[1-этил-3-(4-трифторметилсульфанилфенил)уреидо]индан-5-илсульфанил}-2-метилпропионовой кислоты;
2-метил-2-{2-[1-пентил-3-(4-трифторметилсульфанилфенил)уреидо]индан-5-илсульфанил}пропионовой кислоты;
2-{2-[1-этил-3-(4-изопропилфенил)уреидо]индан-5-илсульфанил}-2-метилпропионовой кислоты;
2-метил-2-{2-[1-пентил-3-(4-трифторметоксифенил)уреидо]индан-5-илсульфанил}-2-метилпропионовой кислоты;
2-{2-[3-(4-диметиламинофенил)-1-этилуреидо]индан-5-илсульфанил}-2-метилпропионовой кислоты;
2-метил-2-{2-[1-(3-метилбутил)-3-(4-трифторметоксифенил)уреидо]индан-5-илсульфанил}-2-метилпропионовой кислоты;
2-{2-[3-(4-изопропилфенил)-1-(3-метилбутил)уреидо]индан-5-илсульфанил}-2-метилпропионовой кислоты;
2-метил-2-{2-[1-пент-4-енил-3-(4-трифторметоксифенил)уреидо]индан-5-илсульфанил}пропионовой кислоты;
2-{6-[1-этил-3-(4-трифторметоксифенил)уреидо]-3-метокси-5,6,7,8-тетрагидронафталин-2-илсульфанил}-2-метилпропионовой кислоты;
2-{6-[1-этил-3-(4-трифторметоксифенил)уреидо]-3-фтор-5,6,7,8-тетрагидронафталин-2-илсульфанил}-2-метилпропионовой кислоты;
2-{6-[1-этил-3-(4-трифторметоксифенил)уреидо]-3-хлор-5,6,7,8-тетрагидронафталин-2-илсульфанил}-2-метилпропионовой кислоты;
2-{6-[1-этил-3-(4-трифторметоксифенил)уреидо]-3-бром-5,6,7,8-тетрагидронафталин-2-илсульфанил}-2-метилпропионовой кислоты;
2-{6-[1-этил-3-(4-трифторметоксифенил)уреидо]-3-метил-5,6,7,8-тетрагидронафталин-2-илсульфанил}-2-метилпропионовой кислоты; и
2-{6-[1-этил-3-(4-трифторметоксифенил)уреидо]-3-трифторметокси-5,6,7,8-тетрагидронафталин-2-илсульфанил}-2-метилпропионовой кислоты.
14. Способ по п.1 или 10, где соединение формулы I выбирают из
2-{2-[1-этил-3-(4-трифторметоксифенил)уреидо]индан-5-илсульфанил}-2-метилпропионовой кислоты;
2-{2-[1-этил-3-(4-трифторметилсульфанилфенил)уреидо]индан-5-илсульфанил}-2-метилпропионовой кислоты;
2-метил-2-{2-[1-пропил-3-(4-трифторметоксифенил)уреидо]индан-5-илсульфанил}пропионовой кислоты; и
2-{6-[1-этил-3-(4-трифторметоксифенил)уреидо]-3-фтор-5,6,7,8-тетрагидронафталин-2-илсульфанил}-2-метилпропионовой кислоты.
Текст
009554 Перекрестные ссыпки на родственные заявки Эта заявка представляет собой не-предварительную заявку на патент США, предварительную заявку на патент США 60/420026, поданную 21 октября 2002 г., и предварительную заявку на патент США 60/495788, поданную 15 августа 2003 г., озаглавленную Способы применения замещенных тетралинов и инданов. Область техники, к которой относится изобретение Настоящее изобретение относится к производным замещенных тетралинов и инданов, к композициям, содержащим их, и к способам их применения. Уровень техники Представитель семейства ядерных рецепторов, группы лиганд-активируемых факторов транскрипции, активируемый пероксисомным пролифератором рецептор альфа (PPAR альфа), представляет собой необходимый фактор транскрипции, регулирующий гены, относящиеся к метаболизму жирных кислот и действию инсулинов. Рецепторы PPAR альфа находятся, прежде всего, в печени. Гены, регулируемые PPAR альфа, содержат ферменты, вовлеченные в бета-окисление жирных кислот, транспортный белок жирных кислот печени и апо А 1, важный компонент липопротеинов высокой плотности (HDL). Селективные, обладающие высоким сродством агонисты PPAR альфа увеличивают окисление печеночных жирных кислот, что,в свою очередь, уменьшает циркуляцию триглицеридов и свободных жирных кислот. Уменьшение количества циркулирующих триглицеридов может опосредовать наблюдаемое уменьшение или улучшение при устойчивости к инсулину у устойчивых к инсулину или страдающих диабетом животных при лечении агонистами PPAR альфа. Такое лечение тучности у животных моделей ассоциируется с потерями веса. Фибраты, известные как средства для лечения гиперлипидемии, представляют собой слабые агонисты PPAR альфа. Примеры известных агонистов PPAR альфа, различным образом используемых при гиперлипидемии, диабете или атеросклерозе, включают в себя фибраты, такие как фенофибрат (Fournier), гемфиброзил (Parke-Davis/Pfizer, Mylan, Watson), клофибрат (Wyeth-Ayerst, Novopharm), безафибрат и ципрофибрат, и уреидофибраты, такие как GW 7647, GW 9578 и GW 9820 (GlaxoSmithKline). Известные двойные агонисты PPAR альфа/гамма, которые могут быть использованы в качестве сенсибилизаторов к инсулину, включают в себя рагаглитазар (Novo Nordisk), тезаглитазар (AstraZeneca), и GW 409544 (GlaxoSmaithKline/Ligand Pharmaceuticals). Сущность изобретения Настоящее изобретение относится к соединениям формулы (I) ниже Формула (I) или их фармацевтически приемлемым солям, сложным C1-6 эфирам или C1-6 амидам, где каждый изR1 и R2 независимо представляет собой Н, C1-6 алкил, (CH2)mNRaRb, (CH2)mOR8, (CH2)mNH(CO)R8 или(CH2)mCO2R8, где каждый из Ra, Rb и R8 независимо представляет собой Н или C1-6 алкил, или R1 и R2,взятые вместе с атомом углерода, к которому они присоединены, представляют собой С 3-7 циклоалкил;R3 представляет собой Н, фенил, C1-3 алкокси, C1-3 алкилтио, галоген, циано, C1-6 алкил, нитро,NR9R10, NHCOR10, CONHR10; и COOR10; и R3 находится в орто или мета положении по отношению к X;R4 имеет не более чем 9 атомов углерода; R4 может также представлять собой -(C1-5 алкилен)R15, где R15 представляет собой С 3-6 циклоалкил, фенил, фенил-О-, фенил-S-, или 5-6-членный гетероциклил с количеством гетероатомов, выбранных из N, О и S, находящимся в пределах между 1 и 2;Y представляет собой NH, NH-СН 2, или О; каждый из R5 и R7 независимо выбран из Н, C1-6 алкила, галогена, циано, нитро, COR11, COOR11, C1-4 алкокси, C1-4 алкилтио, гидрокси, фенила, NR11R12 и 5-6-членного гетероциклила с количеством гетероатомов, находящимся в пределах между 1 и 2, выбранных из N, О, и S;R6 выбран из C1-6 алкила, галогена, циано, нитро, COR13, COOR13, C1-4 алкокси, C1-4 алкилтио, гидрокси, фенила, NR13R14 и 5-6-членного гетероциклила с количеством гетероатомов, выбранных из N, О, и S,-1 009554 находящимся в пределах между 1 и 2; в дополнение к этому, либо R5 и R6, либо R6 и R7 могут быть взяты вместе, чтобы представлять собой двухвалентный остаток, насыщенный или ненасыщенный, выбранный из -(СН 2)3-, -(СН 2)4- и (CH1-2)pN(CH1-2)q,р равно 0-2 и q равно 1-3, где сумма (p+q) равна по меньшей мере 2; каждый из R9 и R10 независимо представляет собой C1-6 алкил; каждый из R11, R12, R13 и R14 независимо представляет собой Н или С 1-6 алкил; где каждый из указанных выше гидрокарбильных и гетерокарбильных остатков может быть замещен заместителями в количестве, находящемся в пределах между 1 и 3, независимо выбранными из F,C1, Br, I, амино, метила, этила, гидрокси, нитро, циано и метокси. Настоящее изобретение также относится к композициям, которые содержат одно или несколько соединений формулы (I) и фармацевтический носитель или эксципиент. Эти композиции и способы, указанные ниже, могут, кроме того, включать дополнительные фармацевтически активные агенты, такие как агенты, понижающие уровни липидов, или агенты, понижающие давление крови, или их обоих. Другой аспект настоящего изобретения относится к способам применения описанных соединений или композиций в различных способах для профилактики, лечения или ингибирования развития заболевания, опосредованного PPAR альфа. Примеры заболеваний, опосредованных PPAR альфа, включают в себя дислипидемию и атеросклероз. Дислипидемия включает в себя гипертриглицеридемию, гиперхолестеринемию, смешанную гиперлипидемию и гипо-HDL-холестеринемию. Например, дислипидемия может представлять собой одно или несколько из следующих состояний: с низким содержанием HDL ( 35 или 40 мг/дл), с высоким содержанием триглицеридов (200 мг/дл) и с высоким содержанием LDL (липидов низкой плотности) (150 мг/дл). Дополнительные признаки и преимущества настоящего изобретения станут ясны из подробного обсуждения примеров и формулы изобретения, приведенных ниже. Подробное описание Настоящее изобретение относится к соединениям, описанным здесь и имеющим формулу (I) из указанного выше раздела "Сущность изобретения", композициям, содержащим их, и способам их применения. В соответствии с одним из аспектов настоящего изобретения способ лечения может ассоциироваться с улучшениями (например, с уменьшением) по степени, продолжительности или уровню отека или увеличения веса, обычно ассоциирующимися с другими существующими способами терапии, такими,например, как агонисты PPAR гамма. Терапия, которая ассоциируется с потерей веса, или которая является, по меньшей мере, нейтральной по отношению к весу, является желательной. Уменьшение степени увеличения веса или отека, или возможное уменьшение веса, как правило, увеличивает общее здоровье и комфорт пациента. В соответствии с другим аспектом настоящего изобретения способ лечения может представлять собой лечение как для дислипидемии, так и для какой-либо формы устойчивости к инсулину, ослабленной толерантности к глюкозе, гиперинсулинемии или диабета типа II (на ранней, промежуточной, поздней стадии), путем введения одного или нескольких из описанных соединений, необязательно, вместе с одним или несколькими дополнительными фармацевтически активными агентами. Страдающие диабетом пациенты могут также иметь некоторую степень дислипидемии. Дислипидемия включает в себя гипертриглицеридемию, гиперхолестеринемию, смешанную гиперлипидемию, и гипо-HDL-холестеринемию. Например, дислипидемия может представлять собой одно или несколько из следующих состояний: с низким содержанием HDL (35 мг/дл для мужчин, или 39 мг/дл для женщин), с высоким содержанием триглицеридов (200 мг/дл) и с высоким содержанием LDL (150 мг/дл). Предпочтительные соединения по настоящему изобретению представляют собой сильнодействующие агонисты PPAR альфа, обеспечивающие такие воздействия, как повышение уровней липопротеинов высокой плотности (HDL) в сыворотке, улучшенные уровни липопротеинов промежуточной плотности (IDL) и более низкие уровни триглицеридов липопротеинов низкой плотности (LDL), атерогенных молекул и/или свободных жирных кислот (FFA) в сыворотке. Такие воздействия являются преимущественными для здоровья сердечнососудистой системы, для предотвращения или ингибирования развития атеросклероза или заболевания коронарных артерий (CAD). По этой причине желательно понижение уровней триглицеридов и LDL,понижение уровней HDL и понижение общего уровня холестерина, например, до параметров, находящихся в общепринятых пределах значений для этих компонентов. Целью настоящего изобретения является способ лечения как дислипидемии, так и заболевания,оспосредуемого PPAR-альфа (такого как диабет, устойчивость к инсулину, ослабленная толерантность к глюкозе или гиперинсулинемия), путем введения единственного агониста PPAR альфа. Другой целью настоящего изобретения является агонист, селективный по отношению к PPARальфа, который может быть использован для (а) лечения, профилактики или ингибирования развития как дислипидемии, так и заболевания, опосредуемого PPAR-альфа (такого как диабет, устойчивость к инсулину, ослабленная толерантность к глюкозе или гиперинсулинемия); (b) улучшения (например, пониже-2 009554 ния) содержания глюкозы в сыворотке; (с) улучшения толерантности к глюкозе; (d) улучшения уровней инсулина в сыворотке; (е) улучшения чувствительности к инсулину; (f) улучшения (например, понижения) уровней триглицеридов в сыворотке; (g) понижения уровней LDL; (h) увеличения уровней HDL; (i) понижения общих уровней холестерина или (j) любого сочетания указанных выше изменений. Настоящее изобретение дополнительно описывается ниже. А. Термины Следующие далее термины определены ниже и при их использовании по всему настоящему описанию. Алкил включает в себя необязательно замещенные углеводороды с прямой и разветвленной цепью по меньшей мере с одним атомом водорода, удаленным для образования радикальной группы. Алкильные группы включают в себя метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, 1 метилпропил, пентил, изопентил, втор-пентил, гексил, гептил, октил и т.д. Алкил включает в себя циклоалкил, такой как циклопропил, циклобутил, циклопентил и циклогексил. Алкенил включает в себя необязательно замещенные углеводородные радикалы с прямой цепью и разветвленной цепью, как выше, по меньшей мере с одной двойной связью углерод-углерод (sp2). Алкенилы включают в себя этенил (или винил), проп-1-енил, проп-2-енил (или аллил), изопропенил (или 1 метилвинил), бут-1-енил, бут-2-енил, бутадиенилы, пентенилы, гекса-2,4-диенил и т.д. Углеводородные радикалы, имеющие смесь двойных связей и тройных связей, такие как 2-пентен-4-инил, сгруппированы здесь как алкенилы. Алкенил включает в себя циклоалкенил. Цис и транс или (Е) и (Z) формы включены в настоящее изобретение. Алкинил включает в себя необязательно замещенные углеводородные радикалы с прямой цепью и разветвленной цепью, как выше, по меньшей мере с одной тройной связью углерод-углерод (sp). Алкинилы включают в себя этинил, пропинилы, бутинилы и пентинилы. Углеводородные радикалы, имеющие смесь двойных связей и тройных связей, такие как 2-пентен-4-инил, сгруппированы здесь как алкинилы. Алкинил не включает в себя циклоалкинил. Алкокси включает в себя необязательно замещенную алкильную группу с прямой или разветвленной цепью, с атомом кислорода на конце, соединяющим алкильную группу с остальной частью молекулы. Алкокси включает в себя метокси, этокси, пропокси, изопропокси, бутокси, трет-бутокси, пентокси и т.д. Аминоалкил, тиоалкил, и сульфонилалкил являются аналогичными алкокси, с заменой концевого атома кислорода алкокси, соответственно, на NH (или NR), S и SO2. Гетероалкил включает в себя алкокси, аминоалкил, тиоалкил и т.д. Арил включает в себя фенил, нафтил, бифенилил, тетрагидронафтил, инденил и т.д., каждый из которых может быть необязательно замещен. Арил также включает в себя арилалкильные группы, такие как бензил, фенетил и фенилпропил. Арил включает в себя кольцевую систему, содержащую необязательно замещенное 6-членное карбоциклическое ароматическое кольцо, такая система может быть бициклической, мостиковой и/или конденсированной. Система может включать в себя кольца, которые являются ароматическими или частично или полностью насыщенными. Примеры кольцевых систем включают в себя инденил, пенталенил, 1-4-дигидронафтил, инданил, бензимидазолил, бензотиофенил,индолил, бензофуранил, изохинолинил и т.д. Гетероциклил включает в себя необязательно замещенные ароматические и неароматические кольца, имеющие в кольце атомы углерода и по меньшей мере один гетероатом (О, S, N) или гетероатомную группу (SO2, CO, CONH, COO). Если не указано иного, гетероциклический радикал может иметь валентную группу, соединяющую ее с оставшейся частью молекулы через атом углерода, такую как 3 фурил или 2-имидазолил, или через гетероатом, такую как N-пиперидил или 1-пиразолил. Предпочтительно моноциклический гетероциклил имеет количество атомов в кольце, находящееся в пределах между 5 и 7 атомами, или между 5 и 6 атомами; в кольце может быть количество гетероатомов или гетероатомных групп, находящееся в пределах между 1 и 5 и предпочтительно в пределах между 1 и 3, или между 1 и 2. Гетероциклил может быть насыщенным, ненасыщенным, ароматическим (например, гетероарил), неароматическим или конденсированным. Гетероциклил также включает в себя конденсированные, например, бициклические кольца, такие как те, которые необязательно конденсируются с необязательно замещенным карбоциклическим или гетероциклическим пяти- или шестичленным ароматическим кольцом. Например, гетероарил включает в себя необязательно замещенное шестичленное гетероароматическое кольцо, содержащее 1, 2 или 3 атома азота, конденсированное с необязательно замещенным пяти- или шестичленным карбоциклическим или гетероциклическим ароматическим кольцом. Такое гетероциклическое пяти- или шестичленное ароматическое кольцо, конденсированное с указанным пяти- или шестичленным ароматическим кольцом, может содержать 1, 2 или 3 атома азота там, где оно является шестичленным кольцом, или 1, 2 или 3 гетероатома, выбранных из кислорода, азота и серы, там, где оно является пятичленным кольцом. Примеры гетероциклилов включают в себя тиазоилил, фурил, тиенил, пиранил, изобензофуранил,пирролил, имидазолил, пиразолил, изотиазолил, изоксазолил, пиридил, пиразинил, пиримидинил, пиридазинил, индолизинил, изоиндолил, индолил, индазолил, пуринил, хинолил, фуразанил, пирролидинил,пирролинил, имдазолидинил, имидазолинил, пиразолидинил, пиразолинил, пиперидил, пиперазинил,-3 009554 индолинил и морфолинил. Например, предпочтительные гетероциклилы или гетероциклические радикалы включают в себя морфолинил, пиперазинил, пирролидинил, пиридил, циклогексилимино, тиенил, и более предпочтительно, пиперидил или морфолинил. Примеры, иллюстрирующие гетероарил, представляют собой тиенил, фуранил, пирролил, имидазолил, оксазолил, тиазолил, бензотиенил, бензофуранил, бензимидазолил, бензоксазолил, бензотиазолил. Ацил относится к карбонильному остатку, присоединенному либо к атому водорода (то есть к формильной группе), либо к необязательно замещенной алкильной или алкенильной цепи, или к гетероциклилу. Гало или галоген включает в себя фтор, хлор, бром и йод, и предпочтительно, фтор или хлор, в качестве заместителя на алкильной группе, с одним или несколькими атомами галогена, такой как трифторметил, трифторметокси, трифторметилтио, дифторметокси или фторметилтио. Алкандиил или алкилен представляет собой необязательно замещенные двухвалентные алкановые радикалы с прямой или разветвленной цепью, такие как, например, метилен, этилен, пропилен,бутилен, пентилен или гексилен. Алкендиил представляет собой, по аналогии с указанным выше, необязательно замещенные двухвалентные алкеновые радикалы с прямой или разветвленной цепью, такие как, например, пропенилен, бутенилен, пентенилен или гексенилен. В таких радикалах атом углерода, соединенный с азотом,предпочтительно не должен быть ненасыщенным. Ароил относится к карбонильному остатку, присоединенному к необязательно замещенной арильной или гетероарильной группе, где арил и гетероарил имеют определения, приведенные выше. В частности, бензоил представляет собой фенилкарбонил. Как определено здесь, два радикала вместе с атомом (атомами), к которым они присоединены, могут образовывать необязательно замещенное 4-7-, 5-7- или 5-6-членное карбоциклическое или гетероциклическое кольцо, причем это кольцо может быть насыщенным, ненасыщенным или ароматическим. Такие кольца могут быть такими, как определено выше в разделе Сущность изобретения настоящего изобретения. Конкретные примеры таких колец являются такими, как приведено в следующем разделе. Фармацевтически приемлемые соли, сложные эфиры и амиды включают в себя карбоксилатные соли, аддитивные соли аминокислот, сложные эфиры и амиды, которые имеют разумное соотношение выгода/риск, являются фармакологически эффективными и пригодными для контакта с тканями пациентов без излишней токсичности, раздражения или аллергической реакции. Эти соли, сложные эфиры и амиды могут представлять собой, например, C1-8 алкильные, С 3-8 циклоалкильные, арильные, С 2-10 гетероарильные или С 2-10 неароматические гетероциклические соли, сложные эфиры и амиды. Соли, свободные кислоты и сложные эфиры являются более предпочтительными, чем амиды, на концевой группе карбоксилата/карбоновой кислоты в левой части формулы (I). Репрезентативные соли включают в себя гидробромид, гидрохлорид, сульфат, бисульфат, нитрат, ацетат, оксалат, валерат, олеат, пальмитат, стеарат,лаурат, борат, бензоат, лактат, фосфат, тозилат, цитрат, малеат, фумарат, сукцинат, тартрат, нафтилат,мезилат, глюкогептонат, лактиобионат и лаурилсульфонат. Они могут включать катионы щелочного металла и щелочно-земельного металла, такого как натрий, калий, кальций и магний, а также нетоксичного аммония, четвертичного аммония, и аминовые катионы, такие как тетраметиламмоний, метиламин, триметиламин и этиламин. См., например, публикацию S.M. Berge, et al., "Pharmaceutical Salts," J. Pharm.Sci., 1977, 66:1-19, которая включена в данное описание в качестве ссылки. Репрезентативные фармацевтически приемлемые амиды по настоящему изобретению включают в себя те, которые получают из аммония, первичных C1-6 алкиламинов и вторичных ди(С 1-6 алкил)аминов. Вторичные амины включают в себя 5- или 6-членные гетероциклические или гетероароматические кольцевые группы, содержащие по меньшей мере один атом азота и, необязательно, дополнительные гетероатомы в количестве, находящемся в пределах между 1 и 2. Предпочтительные амиды получают из аммония, первичных C1-3 алкиламинов и ди(С 1-2 алкил)аминов. Репрезентативные фармацевтически приемлемые сложные эфиры по настоящему изобретению включают в себя сложные C1-7 алкиловые, С 5-7 циклоалкиловые, фениловые и фенил(C16)алкиловые эфиры. Предпочтительные сложные эфиры включают в себя сложные метиловые и этиловые эфиры. Пациент или субъект включает в себя млекопитающих, таких как люди и животные (собаки,кошки, лошади, крысы, кролики, мыши, приматы, исключая людей), нуждающихся в наблюдении, эксперименте, лечении или профилактике в связи с соответствующим заболеванием или состоянием. Предпочтительно, пациентом или субъектом является человек. Композиция включает в себя продукт, содержащий указанные ингредиенты в указанных количествах, а также любой продукт, который получается при объединении указанных ингредиентов в указанных количествах. Терапевтически эффективное количество или эффективное количество означает такое количество активного соединения или фармацевтического агента, которое вызывает биологическую или оздоравливающую реакцию в системе тканей у животного или человека, который рассматривается исследователем, ветеринаром, врачом или другим клиницистом, которая включает в себя облегчение симптомов состояния или расстройства, которое лечится.-4 009554 Относительно различных радикалов в настоящем описании и в формуле изобретения делаются три общих замечания. Первое замечание относится к валентности. Для всех углеводородных радикалов, являются ли они насыщенными, ненасыщенными или ароматическими, и являются ли они циклическими или нет, имеют ли они прямую или разветвленную цепь, а также подобным образом для всех гетероциклических радикалов, каждый радикал включает в себя замещенные радикалы этого типа и одновалентные, двухвалентные и многовалентные радикалы, как указывается в контексте формулы изобретения. Контекст будет указывать, что заместитель представляет собой алкиленовый или углеводородный радикал по меньшей мере с двумя удаленными атомами водорода (двухвалентный) или с большим количеством удаленных атомов водорода (многовалентный). Пример двухвалентного радикала, соединяющего две части молекулы, представляет собой Y в формуле (I), который связывает фенил, замещенный R5, R6 иR7, с оставшейся частью молекулы. Во-вторых, радикалы или структурные фрагменты, как здесь определено, понимаются как включающие в себя замещенные радикалы или структурные фрагменты. Гидрокарбилы включают в себя одновалентные радикалы, содержащие углерод и водород, такие как алкил, алкенил, алкинил, циклоалкил и циклоалкенил (либо ароматический, либо ненасыщенный), а также соответствующие двухвалентные(или многовалентные) радикалы, такие как алкилен, алкенилен, фенилен и т.д. Гетерокарбилы включают в себя одновалентные и двухвалентные (или многовалентные) радикалы, содержащие углерод, необязательно, водород и по меньшей мере один гетероатом. Примеры одновалентных гетерокарбилов включают в себя ацил, ацилокси, алкоксиацил, гетероциклил, гетероарил, ароил, бензоил, диалкиламино, гидроксиалкил и т.д. Используя алкил в качестве примера, алкил должен пониматься как включающий в себя замещенный алкил, имеющий одно или несколько замещений, например, количество их, находящееся в пределах между 1 и 5, 1 и 3, или 2 и 4 заместителями. Заместители могут быть одинаковыми (дигидрокси, диметил), сходными (хлорфтор) или различными (хлорбензил- или аминометил-замещенные). Примеры замещенного алкила включают в себя галогеналкил (такой как фторметил, хлорметил, дифторметил, перхлорметил, 2-бромэтил, трифторметил, и 3-йодциклопентил), гидроксиалкил (такой как гидроксиметил, гидроксиэтил, 2-гидроксипропил), аминоалкил (такой как аминометил, 2-аминоэтил, 3 аминопропил и 2-аминопропил), нитроалкил, алкилалкил и т.д. Ди(С 1-6 алкил)аминогруппа включает в себя независимо выбранные алкильные группы с образованием, например, метилпропиламино и изопропилметиламино, кроме того, диалкиламиногруппы, имеющие две одинаковых алкильных группы, таких как диметиламино или диэтиламино. В-третьих, имеются в виду только стабильные соединения. Например, там, где имеется группаNR11R12 и R может быть алкенильной группой, двойная связь представляет собой по меньшей мере один атом углерода, удаленный с атома азота для предотвращения образования енамина. Подобным образом,там, где -(СН 2)p-N-(СН 2)q- может быть ненасыщенным, соответствующий атом (атомы) водорода включены или исключены, как показано в -(СН 2)-N=(CH)-(CH2)- или -(CH2)-NH-(CH)=(CH)-. Соединения по настоящему изобретению дополнительно описаны в следующем разделе. В. Соединения Настоящее изобретение включает композиции, содержащие соединения формулы (I), как описано в разделе Сущность изобретения выше, и способы их применения. Примеры включают в себя такие соединения, где: (а) один из R1 и R2 представляет собой метил или этил; (b) где каждый из R1 и R2 представляет собой метил; (с) R1 и R2, взятые вместе, представляют собой циклобутил или циклопентил; (d)R3 представляет собой Н; (е) R4 представляет собой Н или С 2-7 алкил; (е) R4 представляет собой Н или С 2-5 алкил; (f) R4 представляет собой этил; (g) R4 представляет собой Н; (h) n равно 1; (i) n равно 2; (j) Y представляет собой NHCH2; (k) Y представляет собой NH; (l) X представляет собой S; (m) X представляет собой О; (n) по меньшей мере один из R5 и R7 представляет собой Н; (о) R6 представляет собой C1-4 алкил,галогенметокси или галогентиометокси; (р) R6 представляет собой трет-бутил, изопропил, трифторметил,трифторметокси, трифтортиометокси, дифторметокси или диметиламино; (q) R3 представляет собой Н,R4 представляет собой С 2-7 алкил и Y представляет собой NH; (r) R4 представляет собой С 2-5 алкил; (s) R6 представляет собой циклопропилметил, изопропил, изобутил, метилэтиламино или диэтиламино; (t) (S) энантиомер в С-2 положении на индане или тетралине; (u) (R) энантиомер в С-2 положении на индане или тетралине; (v) где R15 представляет собой C1-7 алкил, [ди(С 1-2 алкил)амино](C1-6 алкилен), (C13 алкоксиацил)(C1-6 алкилен), C1-6 алкокси, С 3-7 алкенил или С 3-8 алкинил; (w) R6 представляет собой трифторметилтио или трифторметокси; или (х) сочетания перечисленных выше. Дополнительные предпочтительные соединения включают в себя 2-6-[этил-(4-трифторметоксифеноксикарбонил)амино]-3-фтор-5,6,7,8-тетрагидронафталин-2 илсульфанил-2-метилпропионовую кислоту; 2-6-[1-этил-3-(4-трифторметоксифенил)уреидо]-3-метокси-5,6,7,8-тетрагидронафталин-2-илсульфанил-2-метилпропионовую кислоту; 2-6-[1-этил-3-(4-трифторметоксифенил)уреидо]-3-хлор-5,6,7,8-тетрагидронафталин-2-илсульфанил-2-метилпропионовую кислоту; 2-6-[1-этил-3-(4-трифторметоксифенил)уреидо]-3-бром-5,6,7,8-тетрагидронафталин-2-илсульфанил-2-метилпропионовую кислоту; 2-6-[1-этил-3-(4-трифторметоксифенил)уреидо]-3-метил-5,6,7,8-тетрагидронафталин-2-илсульфанил-2-метилпропионовую кислоту; 2-6-[1-этил-3-(4-трифторметоксифенил)уреидо]-3-трифторметокси-5,6,7,8-тетрагидронафталин-2 илсульфанил-2-метилпропионовую кислоту; 2-6-[1-этил-3-(4-гидроксифенил)уреидо]-5,6,7,8-тетрагидронафталин-2-илсульфанил-2-метилпропионовую кислоту; 2-6-[4-аминофенил)-1-этилуреидо]-5,6,7,8-тетрагидронафталин-2-илсульфанил-2-метилпропионовую кислоту. Наиболее предпочтительные соединения выбраны из 2-6-[1-этил-3-(4-трифторметоксифенил)уреидо]-5,6,7,8-тетрагидронафталин-2-илсульфанил-2 метилпропионовой кислоты; 2-6-[3-(4-трифторметоксифенил)уреидо]-5,6,7,8-тетрагидронафталин-2-илсульфанил-2-метилпропионовой кислоты; 2-2-[1-этил-3-(4-трифторметоксифенил)уреидо]индан-5-илсульфанил-2-метилпропионовой кислоты; 2-2-[1-этил-3-(4-трифторметилсульфанилфенил)уреидо]индан-5-илсульфанил-2-метилпропионовой кислоты; 2-6-[1-этил-3-(4-трифторметоксифенил)уреидо]-3-фтор-5,6,7,8-тетрагидронафталин-2-илсульфанил-2-метилпропионовой кислоты и 2-метил-2-2-[1-пропил-3-(4-трифторметоксифенил)уреидо]индан-5-илсульфанилпропионовой кислоты. Родственные соединения Настоящее изобретение охватывает описанные соединения и близко связанные с ними фармацевтически приемлемые формы описанных соединений, такие как их соли, сложные эфиры, амиды, кислоты,гидраты или сольватированные формы; замаскированные или защищенные формы и рацемические смеси или энантиомерно или оптически чистые формы. Родственные соединения также включают в себя соединения по настоящему изобретению, которые модифицируют, чтобы их можно было аналитически определить, например, изотопно меченные 18F, для использования в качестве зонда при позитронной эмиссионной томографии (PET) или однофотонной эмиссионной компьютерной томографии (SPECT). Настоящее изобретение также включает в себя описанные соединения, имеющие одну или несколь-6 009554 ко функциональных групп (например, гидроксильные, амино или карбоксильные), замаскированных с помощью защитной группы. См., например, Greene and Wuts, Protective Groups in Organic Synthesis, 3rded., (1999) John WileySons, NY. Некоторые из этих замаскированных или защищенных соединений являются фармацевтически приемлемыми; другие могут быть использованы в качестве промежуточных соединений. Синтетические промежуточные соединения и способы, описанные здесь, и их небольшие модификации, также находятся в рамках настоящего изобретения. Гидроксизащитные группы Защита гидроксильной группы включает в себя простые метиловые эфиры, замещенные простые метиловые эфиры, замещенные простые этиловые эфиры, замещенные простые бензиловые эфиры и простые силиловые эфиры. Замещенные простые метиловые эфиры Примеры замещенных простых метиловых эфиров включают в себя метилоксиметиловый, метилтиометиловый, трет-бутилтиометиловый, бензилоксиметиловый, п-метоксибензилоксиметиловый, (4 метоксифенокси)метиловый, трет-бутоксиметиловый. Замещенные простые этиловые эфиры Примеры замещенных простых этиловых эфиров включают в себя 1-этоксиэтиловый, 1-метил-1 метоксиэтиловый, 1-метил-1-бензилоксиэтиловый, 2,2,2-трихлорэтиловый, трет-бутиловый, аллиловый,п-хлорфениловый, п-метоксифениловый и бензиловый. Замещенные простые бензиловые эфиры Примеры замещенных простых бензиловых эфиров включают в себя п-метоксибензиловый, 3,4 диметоксибензиловый,п-галогенбензиловый,2,6-дихлорбензиловый,п-цианобензиловый,пфенилбензиловый, дифенилметиловый. Сложные эфиры Помимо простых эфиров, гидроксильная группа может быть защищена в виде сложного эфира. Примеры сложных эфиров включают в себя формиат, бензоилформиат, ацетат, трихлорацетат, трифторацетат, метоксиацетат, феноксиацетат, п-хлорфеноксиацетат, бензоат. Сульфонаты Примеры сульфонатов включают в себя сульфат, метансульфонат (мезилат), бензилсульфонат, и тозилат. Аминозащитные группы Защита аминогруппы включает в себя карбаматы, амиды и специальные -NH защитные группы. Примеры карбаматов включают в себя метил- и этилкарбаматы, замещенные этилкарбаматы, карбаматы для облегчения расщепления, карбаматы для фотолитического расщепления, производные типа мочевины и разнообразные карбаматы. Карбаматы Примеры метил- и этилкарбаматов включают в себя метил и этил, 9-флуоренилметил и 4 метоксифенацил. Замещенные этилкарбаматы Примеры замещенных этилкарбаматов включают в себя 2,2,2-трихлорэтил, 2-фенилэтил, третбутил, винил, аллил, 1-изопропилаллил, бензил, п-метоксибензил, п-нитробензил, р-бромбензил, пхлорбензил, 2,4-дихлорбензил и дифенилметил. Карбаматы для фотолитического расщепления Примеры карбаматов для фотолитического расщепления включают в себя м-нитрофенил, 3,5 диметоксибензил, о-нитробензил, 3,4-диметокси-6-нитробензил и фенил(о-нитрофенил)метил. Амиды Примеры амидов включают в себя N-формил, N-ацетил, N-трихлорацетил, N-трифторацетил, Nфенилацетил, N-3-фенилпропионил, N-пиколиноил, N-3-пиридилкарбокамид, N-бензоил, N-пфенилбензоил и фталоил. Защита карбонильной группы Циклические ацетали и кетали Примеры циклических ацеталей и кеталей включают в себя 1,3-диоксаны и 5-метилен-1,3-диоксан. Защита карбоксильной группы Сложные эфиры Замещенные сложные метиловые эфиры Примеры замещенных сложных метиловых эфиров включают в себя 9-флуоренилметиловый, метоксиметиловый, метилтиометиловый, метоксиэтоксиметиловый, 2-(триметилсилил)этоксиметиловый,бензилоксиметиловый,фенациловый,п-бромфенациловый,-метилфенациловый и пметоксифенациловый. Примеры сложных эфиров также включают в себя сложные алкиловые эфиры с прямой или разветвленной цепью, такие как трет-бутиловый, этиловый, пропиловый, изопропиловый и бутиловый. Замещенные сложные бензиловые эфиры Примеры замещенных сложных бензиловых эфиров включают в себя трифенилметиловый, дифе-7 009554 нилметиловый, 9-антрилметиловый, 2,4,6-триметилбензиловый, п-бромбензиловый, о-нитробензиловый,п-нитробензиловый, п-метоксибензиловый, 2,6-диметоксибензиловый, пиперониловый, 4-пиколиловый и п-Р-бензиловый. Сложные силиловые эфиры Примеры сложных силиловых эфиров включают в себя триметилсилиловый, триэтилсилиловый,трет-бутилдиметилсилиловый, изопропилдиметилсилиловый, фенилдиметилсилиловый и ди-третбутилметилсилиловый. С. Способы синтеза Настоящее изобретение предусматривает способы получения описанных соединений в соответствии с традиционными способами органического синтеза, а также способы матричного или комбинаторного синтеза. Схемы 1-10 описывают предлагаемые пути синтеза. Используя эти схемы, указания, приведенные ниже, и примеры, специалист в данной области может разработать аналогичные или подобные способы для данного соединения, которые находятся в рамках настоящего изобретения. Специалист в данной области заметит, что синтез соединений по настоящему изобретению может осуществляться, используя коммерчески доступные промежуточные или защищенные промежуточные соединения, описанные в любой из схем, приведенных здесь. Специалист в данной области заметит,кроме того, что во время любого из процессов для получения соединений по настоящему изобретению может быть необходимой и/или желательной защита чувствительных или реакционноспособных групп на любой из рассматриваемых молекул. Это может быть достигнуто посредством обычных защитных групп, таких как те, которые описаны в "Protective Groups in Organic Synthesis", John WileySons, 1991. Эти защитные группы могут быть удалены на удобной стадии с использованием способов, известных в данной области. Примеры описанных путей синтеза включают в себя примеры синтеза 1-57. Соединения, аналогичные целевым соединениям по этим примерам, могут, а во многих случаях должны, получаться в соответствии со сходными путями синтеза. Описанные соединения являются полезными при фундаментальных исследованиях и в качестве фармацевтических агентов, как описано в следующем разделе. Общие указания Предпочтительный синтез соединения формулы 14, когда X представляет собой S (и R3 представляет собой Н), показан на схемах 1-5. Сокращения или акронимы, используемые здесь, включают в себя: АсОН (ледяная уксусная кислота); DCC (1,3-дициклогексилкарбодиимид); DCE (1,2-дихлорэтан); В соответствии со схемой 1 тетралины могут быть получены путем преобразования соединения 1 в соединение 2. Например, метокси-2-тетралон, такой как 6-метокси-2-тетралон, может быть обработан реагентом, таким как ацетат аммония или аммиак, или гидроксиламин. Соответствующий имин может быть восстановлен с помощью соответствующего восстанавливающего агента, такого как боргидрид натрия, цианоборгидрид натрия или триацетоксиборгидрид натрия, и полученный оксим может быть восстановлен каталитически с использованием палладия или платины в полярном протонном растворителе,таком как метанол, этанол или этилацетат, с получением рацемического соединения 2. Получение соли хлористо-водородной кислоты может быть легко осуществлено специалистом в данной области. Схема 2 В соответствии со схемой 2 инданы могут быть получены путем преобразования соединения 3 в соединение 5. Например, когда метоксиинданон, такой как 5-метокси-1-инданон, обрабатывают ацилирующим агентом, таким как бутилнитрит или изоамилнитрит, в присутствии каталитического количества кислоты, такой как хлористо-водородная кислота или бромисто-водородная кислота, в полярном растворителе, таком как метанол или простой эфир, получают кето-оксим 4. Восстановление соединения 4 может быть достигнуто с использованием соответствующего восстанавливающего агента (агентов), таких как литийалюминийгидрид или водород, и катализатора, такого как палладий или платина, в подходящем растворителе, таком как уксусная кислота-серная кислота, ТГФ или метанол, при подходящей темпера-8 009554 туре. Выбор способов получения солей может быть легко определен специалистом в данной области. Схема 3 В соответствии со схемой 3 соединение 2 или 5 может быть преобразовано в соединение 12. Например, когда рацемический гидрохлорид амина обрабатывают основанием, таким как гидрид натрия или гидрид лития, в полярном апротонном растворителе, таком как ДМФА или ТГФ, а затем подвергают взаимодействию с ангидридом, таким как фталевый ангидрид, при повышенных температурах, может быть получен циклический имид 6. Расщепление простых метилариловых эфиров формулы 6 до соединения формулы 7 может быть осуществлено с использованием кислоты Льюиса, такой как трибромид бора, трихлорид бора, трихлорид алюминия или триметилсилилйодид, в неполярных апротонных растворителях, таких как толуол, дихлорметан или дихлорэтан, с охлаждением или без него. Ацилирование фенолов формулы 7 до соединения формулы 8 может быть достигнуто с использованием тиокарбамоилхлоридов, таких как диметиламинотиокарбамоилхлорид или диэтилтиокарбамоилхлорид, и нереакционноспособного третичного амина, такого как триэтиламин, 1,8-диазабицикло[5.4.0]ундец-7-ен или 1,4 диазабицикло[2.2.2.]октан, в апротонном растворителе, таком как дихлорметан, ДМФА или ТГФ, с охлаждением или без него. Соединения формулы 8 могут быть перегруппированы термически в соединения формулы 9 при температуре в пределах между 180 и 350 С, либо в неразбавленном виде как расплав, либо с использованием растворителей с высокими температурами кипения, таких как DOWTHERM А (смесь бифенила и простого бифенилового эфира, продаваемая, например, Fluka Chemical Corp., Milwaukee, WI USA), N,Nдиметиланилин, простой дифениловый эфир или декалин. Соединения формулы 10 могут быть получены из соединений формулы 9 при обработке соответствующим нуклеофилом, таким как гидразин, динатрийсульфид или метиламин, в подходящем полярном растворителе, таком как этанол или ТГФ, при повышенной температуре. Преобразование соединений формулы 10 в соединения формулы 11 может быть достигнуто с использованием соответствующего реагента, такого как гидроксид калия, в спиртовом растворителе, таком как этанол или метанол, или литийалюминийгидрид в ТГФ или простом эфире, с последующим алкилированием с использованием соответственно замещенного алкилгалогенида, такого как трет-бутил-2-бромизобутират, этилбромацетат или этил-2-бромбутират, и восстанавливающего агента, такого как боргидрид лития или боргидрид натрия. Соединения формулы 11 могут быть замещены для получения соединений формулы 12 с использованием карбоновой кислоты или хлорангидрида и соответствующего восстанавливающего агента, такого как боран-ТГФ или боран-диметилсульфид, с использованием апротонных растворителей, таких как ТГФ, дихлорметан или гексан. Альтернативно, замещение может быть осуществлено с использованием альдегида и восстанавливающего агента, такого как цианоборгидрид натрия или триацетоксиборгидрид натрия, в соответствующих апротонных растворителях, таких как ТГФ, дихлорметан или дихлорэтан. В соответствии со схемой 4 соединения формулы 13 могут быть получены из соединений формулы 12 при ацилировании вторичного амина арилуксусной кислотой с использованием тионилхлорида или оксалилхлорида, неразбавленного или в толуоле или в дихлорметане, с каталитическим количеством ДМФА или без него. Альтернативно, связывание может быть достигнуто с использованием стандартных условий для пептидов, таких как EDC, DCC или DIC, в дихлорметане. Когда Y=NH или О, арилизоцианат или арилхлорформиат, соответственно, в неполярном апротонном растворителе, таком как ТГФ, дихлорметан или гексан, может быть использован для получения соединений формулы 13. Выбор способов снятия защиты для получения соединения формулы 14 может быть легко определен специалистом в данной области. Схема 5 Подобным образом, соединения формулы 16 могут быть получены из соединений формулы 11 при ацилировании первичного амина, как показано на схеме 5, с получением соединений формулы 15. Выбор способов снятия защиты для получения соединений формулы 16 может быть легко определен специалистом в данной области. Схема 6 Соединение формулы 18 может быть получено из соединения формулы 10, как показано на схеме 6. Например, соединение формулы 10 может быть обработано этилформиатом или формиатом аммония,либо неразбавленным, либо в присутствии подходящего растворителя, такого как дихлорметан или дихлорэтан, при нагревании или без него, с получением соединения формулы 17. Соединения формулы 17 могут быть преобразованы в соединения формулы 18 с помощью соответствующего реагента, такого как литийалюминийгидрид, в подходящем растворителе, таком как ТГФ или простой эфир, с последующим алкилированием, используя соответствующим образом замещенный алкилгалогенид, такой как третбутил-2-бромизобутират, этилбромацетат или этил-2-бромбутират, и восстанавливающий агент, такой как боргидрид лития или боргидрид натрия. Предпочтительный синтез соединения формулы 21, когда X представляет собой О (и R3 представляет собой Н) показан на схеме 7. Например, когда соединения формулы 2 или 5 ацилируют карбоновой кислотой или хлорангидридом, как описано ранее, получают соединения формулы 19. Расщепление простых метилариловых эфиров формулы 19 до соединения формулы 20 может быть осуществлено с использованием кислоты Льюиса, такой как трибромид бора, трихлорид бора, хлорид алюминия или триметилсилилйодид, в неполярных апротонных растворителях, таких как толуол, дихлорметан или дихлорэтан, с охлаждением или без него. Соединения формулы 20 могут быть преобразованы в соединения формулы 21 при обработке соответствующим основанием, таким как карбонат калия, карбонат цезия или гидроксид калия, и соответствующим образом замещенным алкилгалогенидом, таким как трет-бутил-2 бромизобутират, этилбромацетат или этил-2-бромбутират, в подходящем растворителе, таком как ДМФА или метанол. Схема 8 Соединения формулы 24 могут быть получены из соединений формулы 22, как показано на схеме 8. Например, соединение формулы 22 может быть обработано соответствующим основанием, таким как бутиллитий или втор-бутиллитий, в соответствующем растворителе, таком как простой эфир или ТГФ, в присутствии или в отсутствие TMEDA при охлаждении, и соответствующим электрофилом, таким как алкилгалогениды, альдегиды или дисульфиды, с получением соединений формулы 23. Соединения формулы 23 могут быть преобразованы в соединения формулы 24 способом, аналогичным тому, который описан на схеме 3 для преобразования соединения 8 в соединение 9. Схема 9 Альтернативный синтез соединений формулы 32 показан на схеме 9. Например, когда 4 метилтиофенилуксусную кислоту, формула 2 6, обрабатывают оксалилхлоридом или тионилхлоридом в присутствии метанола, получают соединение формулы 27. Обработка соединений формулы 27 кислотой Льюиса, такой как хлорид алюминия, в хлорированном растворителе, таком как хлороформ или дихлорэтан, в присутствии алкена, такого как этилен, дает тетралоны формулы 28. При использовании способа,изображенного на схеме 1, могут быть получены тетралины формулы 29. Соединения формулы 29 могут быть замещены с получением соединений формулы 30 при использовании карбоновой кислоты, в условиях связывания, обсужденных ранее, или хлорангидрида с третичным амином, таким как диизопропи- 11009554 лэтиламин или триэтиламин, в подходящем растворителе, таком как дихлорметан или дихлорэтан. Соединение формулы 30 может быть преобразовано в соединение формулы 31 с использованием окисляющего агента, такого как mСРВА или перекись водорода, в подходящем растворителе, таком как метиленхлорид, с последующей обработкой соединений формулы 30 трифторуксусным ангидридом в растворителе, таком как хлороформ, или без него, с последующей обработкой третичным амином, таким как триэтиламин или диизопропилэтиламин, в подходящем растворителе, таком как метанол, с получением соединений формулы 31. Альтернативно, снятие защиты с простого тиоэфира в соединениях формулы 30 может быть достигнуто с использованием основания, такого как натрий трет-бутилсульфид, натрий, натрий метилтиол, в подходящем растворителе, таком как ДМФА, N-метил-2-пирролидон или аммиак, с получением соединений формулы 31. При использовании способов синтеза, аналогичных тому, который описан на схеме 3 для преобразования соединения 10 в соединение 11, соединения формулы 31 могут быть легко преобразованы в соединения формулы 32. Схема 10 В соответствии со схемой 10 соединения формулы 22 могут быть легко преобразованы в соединения формулы 32 а, где R3=ОСН 3. Например, соединения формулы 22 могут быть обработаны соответствующим основанием, таким как бутиллитий или втор-бутиллитий, в соответствующем растворителе, таком как простой эфир или ТГФ, в присутствии или в отсутствие TMEDA при охлаждении, и соответствующим дисульфидом, таким как диметилдисульфид или дибензилдисульфид, с получением соединений формулы 33. Удаление диметиламинотиокарбамата из соединений формулы 33 достигается с помощью гидроксида калия или натрия в соответствующем растворителе, таком как вода, метанол или этанол, при нагревании или без него, с получением соединения формулы 34. Соединения формулы 34 могут быть метилированы с получением соединений формулы 19 а с помощью метилйодида, диметилсульфата или диазометана в соответствующем растворителе, таком как ДМФА, метанол или дихлорметан, в присутствии основания, такого как карбонат цезия или карбонат калия, или без него. Используя способ синтеза,аналогичный тому, который описан на схеме 9 для преобразования соединений формулы 30 в соединения формулы 32, соединения формулы 32 а могут быть легко синтезированы из соединений формулы 19 а. Путь синтеза 1A. Гидрохлорид 6-метокси-1,2,3,4-тетрагидронафталин-2-иламина. Схема 1. К раствору 6-метокси-2-тетралона (10,0 г; 56,7 ммоль), растворенного в МеОН (400 мл),добавляют ацетат аммония (65 г; 0,84 моль) и реакционную смесь перемешивают в течение 30 мин при комнатной температуре. Затем в реакционную смесь добавляют цианоборгидрид натрия (17,8 г; 0,28 моль) и реакционную смесь нагревают с обратным холодильником в течение 1-2 ч. Реакционную смесь охлаждают, растворитель удаляют при пониженном давлении, остаток разбавляют EtOAc и добавляют 1N NaOH для гашения реакции. Водную фазу отделяют и органическую фазу промывают Н 2 О, насыщенным раствором соли, сушат над Na2SO4, фильтруют и удаляют растворитель при пониженном давлении с получением сырого остатка, который очищают с помощью флэш-хроматографии (SiO2), элюируяCH2Cl2/MeOH:NH4OH (10%), с получением 5,0 г (50%) 6-метокси-1,2,3,4-тетрагидронафталин-2-иламина в виде темного масла. Раствор указанного в заголовке соединения в простом эфире (100 мл), охлажденный до 0 С, барботируют НСl (газ) до насыщения раствора. Суспензию перемешивают в течение дополнительных 30 мин при комнатной температуре и растворитель выпаривают при пониженном давлении. Оставшийся твердый продукт перетирают с простым эфиром, фильтруют, промывают простым эфиром и сушат при пониженном давлении с получением 4,9 г гидрохлорида 6-метокси-1,2,3,4 тетрагидронафталин-2-иламина в виде белого твердого продукта. ЖХ/МС: C11H15NO: m/z 178 (M+1)B. 2-(6-Метокси-1,2,3,4-тетрагидронафталин-2-ил)изоиндол-1,3-дион. Схема 3. К перемешиваемой суспензии 60% NaH (6 г; 0,182 ммоль) в ДМФА (400 мл) добавляют 6 метокси-1,2,3,4-тетрагидронафталин-2-иламин (30 г; 0,140 моль), порциями при 0 С. Реакционную смесь нагревают до комнатной температуры и перемешивают в течение 1 дополнительного часа. Добавляют фталевый ангидрид (20,7 г; 0,139 моль), одной порцией при комнатной температуре, при этом реакционную смесь перемешивают в течение 1 дополнительного часа, а затем 18 ч при 120 С. Реакционной смеси дают охладиться до комнатной температуры, разбавляют Н 2 О и экстрагируют несколько раз EtOAc. Объединенные органические экстракты промывают водой, насыщенным раствором соли, сушат над Na2SO4 и удаляют растворитель при пониженном давлении. Сырой твердый продукт перетирают с МеОН, фильтруют и сушат в вакууме с получением 29,1 г (67%) 2-(6-метокси-1,2,3,4-тетрагидронафталин-2 ил)изоиндол-1,3-диона в виде беловатого твердого продукта. 1H-ЯМР (300 МГц, CDCl3):7,83-7,86 (м, 2 Н), 7,70-7,73 (м, 2 Н), 6,96-6,99 (д, 1 Н), 6,67-6,72 (м, 2 Н),4,50-4,59 (м, 1 Н), 3,78 (с, 3 Н), 3,52-3,61 (м, 1 Н), 2,95-2,98 (м, 2 Н), 2,81-2,88 (м, 1 Н), 2,65-2,76 (м, 1 Н),1,97-2,01 (м, 1 Н) ЖХ/МС: C19H17NO3: m/z 308 (М+1) С. 2-(6-Гидрокси-1,2,3,4-тетрагидронафталин-2-ил)изоиндол-1,3-дион. Схема 3. К 2-(6-метокси-1,2,3,4-тетрагидронафталин-2-ил)изоиндол-1,3-диону (29 г; 94,3 ммоль),растворенному в безводном CH2Cl2 (500 мл), охлажденному до -60 С, добавляют по каплям 1,0 М раствор трибромида бора-CH2Cl2 (471 мл) для поддержания температуры реакции в пределах между (-50)-(-60 С). По завершении добавления реакционной смеси дают нагреться до комнатной температуры и перемешивают ее в течение дополнительных 4 ч. Реакционную смесь охлаждают до 0 С, гасят насыщенным NaHCO3 (400 мл) и перемешивают в течение дополнительных 0,5 ч при комнатной температуре. Осадок фильтруют, тщательно промывают Н 2 О, суспендируют в простом эфире, фильтруют и сушат в вакууме с получением 25,4 г (92%) 2-(6-гидрокси-1,2,3,4-тетрагидронафталин-2-ил)изоиндол-1,3-диона в виде беловатого твердого продукта. 1 Н-ЯМР (300 МГц, ДМСО-d6):9,11 (шир.с, 1 Н), 7,82-7,89 (м, 4 Н), 6,84-6,87 (д, 1 Н), 6,52-6,56 (м,2 Н), 4,29-4,37 (м, 1 Н), 3,45 (шир.с, 1 Н), 3,25-3,34 (м, 1 Н), 2,73-2,84 (м, 3 Н), 2,37-2,47 (м, 1 Н), 1,94-1,98 (м,1 Н) ЖХ/МС: C18H15NO3: m/z 294 (М+1)D. О-[6-(1,3-Диоксо-1,3-дигидроизоиндол-2-ил)-5,6,7,8-тетрагидронафталин-2-иловый] эфир диметилтиокарбаминовой кислоты. Схема 3. К 2-(6-гидрокси-1,2,3,4-тетрагидронафталин-2-ил)изоиндол-1,3-диону (25,4 г; 86,5 ммоль), растворенному в безводном ДМФА (200 мл), добавляют 1,4-диазабицикло[2.2.2]октан (48,5 г; 4,32 моль), затем диметиламинотиокарбамоилхлорид (53,4 г; 4,32 моль) и раствор перемешивают при комнатной температуре в течение 4 ч. Реакционную смесь выливают в воду со льдом (1 л) и перемешивают в течение 18 ч. Осадок фильтруют, промывают Н 2 О и сушат в вакууме. Сырой твердый продукт очищают с помощью флэш-хроматографии (SiO2), элюируя градиентом гексан-EtOAc, с получением 30 г (91%) О-[6-(1,3 диоксо-1,3-дигидроизоиндол-2-ил)-5,6,7,8-тетрагидронафталин-2-илового] эфира диметилтиокарбаминовой кислоты в виде белого твердого продукта. 1(м, 1 Н) ЖХ/МС: C21H20N2O3S: m/z 381 (М+1) Е. S-[6-(1,3-Диоксо-1,3-дигидроизоиндол-2-ил)-5,6,7,8-тетрагидронафталин-2-иловый] эфир диметилтиокарбаминовой кислоты. Схема 3. В 50 мл круглодонную колбу, снабженную обратным холодильником и бруском мешалки, предварительно нагретую до 330 С на песчаной бане, добавляют О-[6-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)5,6,7,8-тетрагидронафталин-2-иловый] эфир диметилтиокарбаминовой кислоты (5,32 г; 13,9 ммоль), одной порцией. Расплав перемешивают в течение 7-8 мин при 330 С, затем быстро охлаждают до комнатной температуры в токе N2. Сырой остаток очищают с помощью флэш-хроматографии (SiO2), элюируя градиентом гексан-EtOAc, с получением 3,1 г (58%) S-[6-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)-5,6,7,8 тетрагидронафталин-2-илового] эфира диметилтиокарбаминовой кислоты в виде белого твердого продукта. 1F. S-[6-Амино-5,6,7,8-тетрагидронафталин-2-иловый) эфир диметилтиокарбаминовой кислоты. Схема 3. В 3-горлую колбу, снабженную обратным холодильником и механической мешалкой, загружают EtOH (115 мл) и S-[6-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)-5,6,7,8-тетрагидронафталин-2- 13009554 иловый] эфир диметилтиокарбаминовой кислоты (8,7 г; 23,5 ммоль). Гидразин (6,6 мл; 2,11 моль) добавляют одной порцией при комнатной температуре и реакционную смесь нагревают с обратным холодильником при механическом перемешивании в течение 40 мин. Реакционную смесь охлаждают до комнатной температуры и желатинообразный, белый твердый продукт фильтруют и тщательно промывают простым эфиром. Эфирные промывки объединяют, выпаривают при пониженном давлении и сырой остаток дополнительно перетирают с простым эфиром, фильтруют и выпаривают простой эфир при пониженном давлении с получением 6,1 г (100%) S-[6-амино-5,6,7,8-тетрагидронафталин-2-илового) эфира диметилтиокарбаминовой кислоты в виде желтого масла. ЖХ/МС: C13H18N2OS: m/z 251 (М+1)G. трет-Бутиловый эфир 2-(6-амино-5,6,7,8-тетрагидронафталин-2-илсульфанил)-2-метилпропионовой кислоты. Схема 3. К S-[6-амино-5,6,7,8-тетрагидронафталин-2-иловому) эфиру диметилтиокарбаминовой кислоты (6,1 г; 24,4 ммоль), растворенному в МеОН (25 мл), добавляют раствор KОН (4,1 г; 73,2 ммоль) в МеОН (25 мл) при комнатной температуре. Раствор перемешивают при нагревании с обратным холодильником в течение 5 ч и охлаждают до комнатной температуры. К раствору добавляют трет-бутил-2 бромизобутират (16,3 г; 73,2 ммоль) и перемешивают в течение 16 ч при комнатной температуре. Добавляют NaBH4 (9,2 г; 2,44 моль) и реакционную смесь перемешивают в течение дополнительных 48 ч при комнатной температуре. Реакцию гасят H2O, растворитель выпаривают при пониженном давлении и сырой остаток распределяют между Н 2 О и CH2Cl2. Водную фазу экстрагируют CH2Cl2 и объединенные органические экстракты сушат над Na2SO4, фильтруют и выпаривают при пониженном давлении с получением 4,7 г (60%) трет-бутилового эфира 2-(6-амино-5,6,7,8-тетрагидронафталин-2-илсульфанил)-2 метилпропионовой кислоты в виде коричневого масла. ЖХ/МС: C181H27NO2S: m/z 266 (М+1) Н. трет-Бутиловый эфир 2-(6-ацетиламино-5,6,7,8-тетрагидронафталин-2-илсульфанил)-2 метилпропионовой кислоты. Схема 3. К трет-бутиловому эфиру 2-(6-амино-5,6,7,8-тетрагидронафталин-2-илсульфанил)-2 метилпропионовой кислоты (4,7 г; 14,6 ммоль), растворенному в CH2Cl2 (25 мл), добавляют DIEA (3,3 мл; 18,9 ммоль) и реакционную смесь охлаждают до 0 С. Добавляют по каплям ацетилхлорид (1,25 мл; 17,5 ммоль) с определенной скоростью для поддерживания температуры в пределах между 0 и 5 С. Реакционной смеси дают нагреться до комнатной температуры и перемешивают в течение 16 ч. Реакционную смесь разбавляют CH2Cl2, промывают Н 2 О, сушат над Na2SO4 и выпаривают при пониженном давлении. Сырое масло очищают с помощью флэш-хроматографии (SiO2), элюируя градиентом гексанEtOAc, с получением 1,7 г (32%) трет-бутилового эфира 2-(6-ацетиламино-5,6,7,8-тетрагидронафталин-2 илсульфанил)-2-метилпропионовой кислоты в виде желто-коричневого твердого продукта. 1 Н-ЯМР (300 МГц, CDCl3):7,23-7,26 (м, 2 Н), 6,99-7,01 (д, 1 Н), 5,46-5,48 (м, 1 Н), 4,25-4,29 (м, 1 Н),3,08-3,15 (дд, 1 Н), 2,82-2,88 (м, 2H), 2,58-2,66 (м, 1 Н), 2,01-2,04 (м, 1 Н), 1,98 (с, 3 Н), 1,70-1,82 (м, 1 Н),1,43 (с, 15 Н) ЖХ/МС: C20H29NO3S: m/z 308 (М+1)I. трет-Бутиловый эфир 2-(6-этиламино-5,6,7,8-тетрагидронафталин-2-илсульфанил)-2 метилпропионовой кислоты. Схема 3. К раствору трет-бутилового эфира 2-(6-ацетиламино-5,6,7,8-тетрагидронафталин-2 илсульфанил)-2-метилпропионовой кислоты (1,7 г; 4,64 ммоль) в ТГФ (42 мл) добавляют по каплям раствор 1,0 М боран-ТГФ (42 мл) при комнатной температуре. Реакционной смеси дают перемешиваться в течение 18 ч при комнатной температуре, осторожно гасят МеОН и выпаривают растворитель при пониженном давлении. Остаток масла дополнительно подвергают азеотропной перегонке вместе с МеОН (3 х) с получением 1,9 г (100%) смеси трет-бутилового эфира 2-(6-этиламино-5,6,7,8-тетрагидронафталин-2 илсульфанил)-2-метилпропионовой кислоты и его комплекса с бораном в виде масла. ЖХ/МС: C20H31NO2SBH3: m/z 308 (M+BH3)+1)J. трет-Бутиловый эфир 2-6-[1-этил-3-(4-трифторметоксифенил)уреидо]-5,6,7,8-тетрагидронафталин-2-илсульфанил-2-метилпропионовой кислоты. Схема 4. К смеси трет-бутилового эфира 2-(6-этиламино-5,6,7,8-тетрагидронафталин-2 илсульфанил)-2-метилпропионовой кислоты и его комплекса с бораном (1,9 г; 5,2 ммоль), растворенной в CH2Cl2 (15 мл), добавляют 4-трифторметоксифенилизоцианат (1,6 г; 7,8 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 18 ч. Растворитель удаляют при пониженном давлении и сырой остаток очищают с помощью флэш-хроматографии (SiO2), элюируя градиентом гексанEtOAc,с получением 1,66 гCH2Cl2 (15 мл), добавляют ТФУК (15 мл) и реакционную смесь перемешивают при комнатной температуре в течение 1,5 час. Растворитель удаляют при пониженном давлении и остаток очищают с помощью флэш-хроматографии (SiO2), элюируя градиентом гексан-EtOAc, с получением 0,643 г (43%) 2-6-[1 этил-3-(4-трифторметоксифенил)уреидо]-5,6,7,8-тетрагидронафталин-2-илсульфанил-2-метилпропионовой кислоты в виде белого твердого продукта. 1 2-2-[1-Этил-3-(4-трифторметоксифенил)уреидо]индан-5-илсульфанил-2-метилпропионовая кислота. Соединение 2.0 (пример 2) А. 5-Метоксииндан-1,2-дион-2-оксим. Схема 2. К раствору 5-метоксииндан-1-она (75,8 г; 0,467 моль) в МеОН (1,4 л) при 45 С добавляют по каплям бутилнитрит (81 мл; 0,693 моль) в течение 45 мин. Затем к горячему раствору добавляют концентрированную НСl (45 мл) в течение 20 мин и реакционной смеси дают перемешиваться при 45 С в течение дополнительных 1,5-2 ч. Реакционную суспензию охлаждают, осадок фильтруют, промывают несколько раз холодным МеОН и сушат в вакууме с получением 55,8 г (62%) 5-метоксииндан-1,2-дион 2-оксима в виде бежевого твердого продукта. 1 ЯМР (300 МГц,СD3DО):7,80-7,83 (м, 1 Н), 6,95 (шир.с, 2 Н), 3,92 (с, 3 Н), 3,78 (с, 2 Н), 3,47 (шир.с,1 Н) ЖХ/МС: C10H9NO3: m/z 192 (М+1)B. Гидрохлорид 5-метоксииндан-2-иламина. Схема 2. К 5-метоксииндан-1,2-дион-2-оксиму (55,7 г; 0,291 моль), суспендированному в ледяной уксусной кислоте (0,99 л), добавляют концентрированную H2SO4 (67 мл), а затем 10% Pd-C (27 г), и реакционную смесь перемешивают в аппарате Парра в атмосфере Н 2 при 60 фунт/кв.дюйм в течение 18 ч. Реакционную смесь продувают N2, фильтруют через слой целита и промывают АсОН. Растворитель удаляют при пониженном давлении до 1/5 объема и оставшийся растворитель разбавляют Н 2 О (500 мл), охлаждают до 0 С и нейтрализуют до рН 10 50% водным раствором NaOH. Водную фазу несколько раз обильно экстрагируют CHCl3 и экстракты объединяют, промывают Н 2 О, насыщенным раствором соли,сушат над Na2SO4, фильтруют и выпаривают при пониженном давлении с получением 77,3 г (66%) сырого масла. Масло подвергают флэш-хроматографии (SiO2), элюируя 40:2,2:0,2 CHCl3:MeOH:NH4OH, с получением 43,8 г (37%) темного масла. Масло растворяют в простом эфире (1 л), охлаждают до 0 С и раствор насыщают HCl (газ). Растворитель удаляют при пониженном давлении и твердый продукт перетирают с простым эфиром, фильтруют и промывают простым эфиром с получением 43,8 г (30%) гидрохлорида 5-метоксииндан-2-иламина в виде белого твердого продукта. 1C. 2-(5-Метоксииндан-2-ил)изоиндол-1,3-дион. Схема 3. К суспензии 60% NaH (8 г; 0,240 моль) в ДМФА (250 мл), охлажденной до 0 С, добавляют гидрохлорид 5-метоксииндан-2-иламина (40,0 г; 0,2 моль) и суспензию перемешивают в течение 1 ч при комнатной температуре. Добавляют одной порцией фталевый ангидрид (30 г; 0,2 моль) и суспензию перемешивают в течение дополнительных 1-1,5 ч при комнатной температуре, затем перемешивают при 120 С в течение 96 ч. Реакционную смесь охлаждают и разбавляют EtOAc. Органическую фазу промывают Н 2 О, полученный осадок фильтруют, промывают EtOAc, MeOH и сушат в вакууме с получением 25,2 г (43%) 2-(5-метоксииндан-2-ил)изоиндол-1,3-диона в виде белого твердого продукта. Органическую фазу промывают Н 2 О, выпаривают при пониженном давлении и твердый продукт перетирают с МеОН, фильтруют и сушат с получением дополнительных 19,7 г (33%) 2-(5-метоксииндан-2 ил)изоиндол-1,3-диона в виде белого твердого продукта. 1 Н-ЯМР (300 МГц, CD3OD):7,83-7,87 (м, 2 Н), 7,68-7,74 (м, 2 Н), 7,10-7,13 (д, 1 Н), 6,73-6,78 (м,2 Н), 5,08-5,21 (м, 1 Н), 3,79 (с, 3 Н), 3,48-3,65 (м, 2 Н), 3,07-3,18 (м, 2 Н)CH2Cl2 (350 мл) и охлажденному до -60 С, добавляют 1,0 М раствор трибромида бора-CH2Cl2 (340 мл), по каплям с определенной скоростью для поддержания внутренней температуры в пределах между -50 и -60 С. Реакционной смеси дают нагреться до комнатной температуры и перемешивают в течение дополнительных 5 ч. Реакционную смесь охлаждают до 0 С, гасят насыщенным NaHCO3 (500 мл) и перемешивают в течение дополнительных 0,5 ч при комнатной температуре. Осадок фильтруют, промывают Н 2 О, суспендируют в простом эфире,фильтруют и сушат в вакууме с получением 14,8 г (79%) 2-(5-гидроксииндан-2-ил)изоиндол-1,3-диона в виде бежевого твердого продукта. 1F. О-[2-(1,3-Диоксо-1,3-дигидроизоиндол-2-ил)индан-5-иловый эфир диметилтиокарбаминовой кислоты. Схема 3. К 2-(5-гидроксииндан-2-ил)изоиндол-1,3-диону (31 г; 0,11 моль), растворенному в водном ДМФА (400 мл), добавляют 1,4-диазабицикло[2,2,2]октан (62 г; 0,55 моль), а затем диметиламинотиокарбамоилхлорид (68 г; 0,55 моль), и раствор перемешивают при комнатной температуре в течение 16 ч. Реакционную смесь выливают в воду со льдом (1 л) и перемешивают в течение 18 ч. Осадок фильтруют,промывают Н 2 О и сушат в вакууме с получением 41,6 г (100%) О-[2-(1,3-диоксо-1,3-дигидроизоиндол-2 ил)индан-5-илового] эфира диметилтиокарбаминовой кислоты в виде бежевого твердого продукта. 1 Н-ЯМР (300 МГц, CDCl3):7,82-7,87 (м, 2 Н), 7,69-7,75 (м, 2 Н), 7,17-7,24 (д, 1 Н), 6,87-6,93 (м, 2 Н),5,13-5,25 (м, 1 Н), 3,53-3,68 (м, 2 Н, 3,46 (с, 3 Н), 3,34 (с, 3 Н), 3,09-3,23 (м, 2 Н)G. S-[2-(1,3-Диоксо-1,3-дигидроизоиндол-2-ил)индан-5-иловый] эфир диметилтиокарбаминовой кислоты. Схема 3. В 50 мл круглодонную колбу, снабженную обратным холодильником и бруском мешалки,предварительно нагретую до 330 С на песчаной бане, добавляют одной порцией О-[2-(1,3-диоксо-1,3 дигидроизоиндол-2-ил)индан-5-иловый] эфир диметилтиокарбаминовой кислоты (6,30 г; 18,7 ммоль). Расплав перемешивают в течение 12 мин при 338 С, быстро охлаждают до комнатной температуры в токе N2 и сырой остаток очищают с помощью флэш-хроматографии (SiO2), элюируя градиентом гексанEtOAc, с получением 3,88 г (61%) S-[2-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)индан-5-илового] эфира диметилтиокарбаминовой кислоты в виде беловатого твердого продукта. 1 Н-ЯМР (300 МГц, CDCl3):7,81-7,87 (м, 2 Н), 7,69-7,74 (м, 2 Н), 7,22-7,36 (м, 3 Н), 5,10-5,22 (м, 1 Н),3,59-3,67 (м, 2 Н), 3,06-3,23 (м, 9 Н) ЖХ/МС: C20H18N2O3S: m/z 367 (М+1) Н. S-(2-Аминоиндан-5-иловый) эфир диметилтиокарбаминовой кислоты. Схема 3. 3-горлую колбу, снабженную обратным холодильником и механической мешалкой, загружают EtOH (98 мл) и S-[2-(l,3-диоксо-1,3-дигидроизоиндол-2-ил)индан-5-иловым] эфиром диметилтиокарбаминовой кислоты (6,9 г; 20,6 ммоль). Добавляют гидразин (5,8 мл; 18,6 ммоль), одной порцией при комнатной температуре, и реакционную смесь нагревают с обратным холодильником при механическим перемешивании в течение 30 мин. Реакционную смесь охлаждают до комнатной температуры и желатинообразный, белый твердый продукт фильтруют и промывают несколько раз простым эфиром. Эфирные промывки объединяют, выпаривают при пониженном давлении и сырой остаток дополнительно перетирают с простым эфиром, фильтруют и выпаривают простой эфир при пониженном давлении с получением 4,6 г (95%) S-[2-аминоиндан-5-илового) эфира диметилтиокарбаминовой кислоты в виде коричневого масла. 1 Н-ЯМР (300 МГц, CDCl3) :7,15-7,33 (м, 3 Н), 3,80-3,88 (м, 1 Н), 3,05-3,22 (м, 8 Н), 2,64-2,72 (м, 1 Н),2,17 (шир.с, 2 Н) ЖХ/МС: C12H15N2OS: m/z 237 (М+1)I. трет-Бутиловый эфир 2-(2-аминоиндан-5-илсульфанил)-2-метилпропионовой кислоты. Схема 3. К S-(2-аминоиндан-5-иловому) эфиру диметилтиокарбаминовой кислоты (4,9 г; 20,9 ммоль), растворенному в МеОН (60 мл), при комнатной температуре добавляют раствор KОН (11,8 г; 0,210 моль) в МеОН (110 мл). Раствор перемешивают при температуре кипения с обратным холодильником в течение 5 ч и охлаждают до комнатной температуры. К раствору добавляют трет-бутил-2 бромизобутират (7,0 г; 31,3 ммоль) и перемешивают в течение 18 ч при комнатной температуре. Растворитель выпаривают при пониженном давлении и сырой остаток распределяют между Н 2 О и EtOAc. Водную фазу экстрагируют EtOAc и объединенные органические экстракты промывают Н 2 О, насыщенным раствором соли, сушат над Na2SO4, фильтруют и выпаривают при пониженном давлении с получением 4,9 г (76%) трет-бутилового эфира 2-(2-аминоиндан-5-илсульфанил)-2-метилпропионовой кислоты в виде коричневого масла. ЖХ/МС: C17H25NO2S: m/z 308 (М+1)(14,6 г; 47,4 ммоль), растворенному в CH2Cl2 (100 мл), добавляют TEA (8,6 мл; 61,7 ммоль) и реакционную смесь охлаждают до 0 С. Добавляют по каплям ацетилхлорид (4,1 мл; 57,6 ммоль) с определенной скоростью для поддержания температуры в пределах между 0-5 С. Реакционной смеси дают нагреться до комнатной температуры, перемешивают в течение 16 ч, разбавляют CH2Cl2, промывают Н 2 О, сушат надNa2SO4 и выпаривают при пониженном давлении. Сырое масло очищают с помощью флэшхроматографии (SiO2), элюируя градиентом гексан-EtOAc, с получением 11,7 г (71%) трет-бутилового эфира 2-(2-ацетиламиноиндан-5-илсульфанил)-2-метилпропионовой кислоты в виде бежевого твердого продукта. 1 Н-ЯМР (300 МГц, CDCl3):7,31-7,35 (м, 2 Н), 7,15-7,18 (д, 1 Н), 5,73 (м, 1 Н), 4,68-4,78 (м, 1 Н), 3,253,39 (дд, 2 Н), 2,74-2,80 (д, 2 Н), 1,94 (с, 3 Н), 1,43(с, 15 Н) ЖХ/МС: C19H27NO3S: m/z 294 (М+1)(11,7 г; 33,5 ммоль) в ТГФ (280 мл) добавляют по каплям раствор 1,0 М борана-ТГФ (226 мл) при комнатной температуре. Реакционной смеси дают перемешиваться при комнатной температуре в течение 5 ч, охлаждают до 0 С, гасят МеОН (100 мл) и выпаривают при пониженном давлении. Остаток масла дополнительно подвергают азеотропной перегонке вместе с МеОН (3 х) с получением 11 г (100%) смеси трет-бутилового эфира 2-(2-этиламиноиндан-5-илсульфанил)-2-метилпропионовой кислоты и его комплекса с бораном в виде масла. ЖХ/МС: C19H29NO2SBH3: m/z 336 М+ВН 3)+1)L. трет-Бутиловый эфир 2-2-[1-этил-3-(4-трифторметоксифенил)уреидо]индан-5-илсульфанил-2 метилпропионовой кислоты. Схема 4. К смеси трет-бутилового эфира 2-(2-этиламиноиндан-5-илсульфанил)-2 метилпропионовой кислоты и его комплекса с бораном (11,0 г; 33 ммоль), растворенной в CH2Cl2 (100 мл), добавляют 4-трифторметоксифенилизоцианат (10,2 г; 50,2 ммоль) и реакционной смеси дают перемешиваться при комнатной температуре в течение 18 ч. Растворитель удаляют при пониженном давлении и сырой остаток очищают с помощью флэш-хроматографии (SiO2), элюируя градиентом гексанEtOAc,с получением 11,2 гH-ЯМР (300 МГц, CDCl3):7,30-7,36 (м, 4 Н), 7,10-7,19 (м, 3 Н), 6,31 (с, 1 Н), 4,97-5,08 (м, 1 Н), 3,223,39 (м, 4 Н), 3,01-3,09 (дд, 2 Н), 1,42-1,44 (м, 15 Н), 1,23-1,28 (т, 3 Н) ЖХ/МС: C27H33F3N2O4S: m/z 483 М-С 4 Н 8)+1) М. 2-2-[1-Этил-3-(4-трифторметоксифенил)уреидо]индан-5-илсульфанил-2-метилпропионовая кислота Схема 4. К трет-бутиловому эфиру 2-2-[1-этил-3-(4-трифторметоксифенил)уреидо]индан-5 илсульфанил-2-метилпропионовой кислоты (4,8 г; 8,91 ммоль), растворенной в CH2Cl2 (15 мл), добавляют ТФУК (15 мл) и реакционную смесь перемешивают при комнатной температуре в течение 2 ч. Растворитель удаляют при пониженном давлении и остаток очищают с помощью флэш-хроматографии(SiO2), элюируя градиентом гексан-EtOAc, с получением 3,13 г (73%) 2-2-[1-этил-3-(4 трифторметоксифенил)уреидо]индан-5-илсульфанил-2-метилпропионовой кислоты в виде белого твердого продукта. 1 Н-ЯМР (300 МГц, CDCl3):7,29-7,35 (м, 4 Н), 7,15-7,17 (д, 1 Н), 7,08-7,11 (д, 2 Н), 6,45 (с, 1 Н), 4,945,04 (м, 1 Н), 3,18-3,36 (м, 4 Н), 2,98-3,07 (м, 2 Н), 1,48 (с, 6 Н), 1,19-1,28 (т, 3 Н) ЖХ/МС: C23H25F3N2O4S: m/z 483 (М+1) Т.пл.=73-77 С Следующие 14 соединений получают, следуя схемам 3 и 4 и стадиям J, К, L и М пути синтеза 2, заменяя реагенты и создавая необходимые реакционные условия: Соединение 2.2 (0,33 г; 57% в течение 2 стадий; белый твердый продукт) получают, следуя пути синтеза 2, заменяя 4-трифторметоксифенилизоцианат 4-трифтортиометоксиизоцианатом. 1 Соединение 2.3 (0,22 г; 32% в течение 2 стадий; белый твердый продукт) получают, следуя пути синтеза 2 и соединению 2.2, заменяя ацетилхлорид валерилхлоридом. 1 Н-ЯМР (CD3OD):0,844-0,890 (т, 3 Н), 1,20-1,31 (м, 4 Н), 1,39 (с, 6 Н), 1,45-1,58 (м, 2 Н), 3,07-3,22 Соединение 2.4 (0,18 г; 34% в течение 2 стадий; белый твердый продукт) получают, следуя пути синтеза 2, заменяя 4-трифторметоксифенилизоцианат 4-изопропилфенилизоцианатом. 1 Соединение 2.5 (0,34 г; 66% в течение 2 стадий; белый твердый продукт) получают, следуя пути синтеза 2, заменяя 4-трифторметоксифенилизоцианат 4-диметиламинофенилизоцианатом. 1H-ЯМР (CD3OD):1,15-1,20 (т, 3 Н), 1,42 (с, 6 Н), 2,88 (с, 1 Н), 3,05-3,69 (м, 4 Н), 3,31-3,69 (м, 2 Н),4,94-5,06 (м, 1 Н), 6,78-6,81 (м, 2 Н), 7,16-7,21 (м, 3 Н), 7,29-7,41 (м, 2 Н) ЖХ/МС: C24H31N3O3S: m/z 442 (М+1) 2-Метил-2-2-[1-пентил-3-(4-трифторметоксифенил)уреидо]индан-5-илсульфанил-2-метилпропи- 18009554 оновая кислота Соединение 2.6 (пример 8) Соединение 2.6 (0,29 г; 77% в течение 2 стадий; белый твердый продукт) получают, следуя пути синтеза 2, заменяя ацетилхлорид валерилхлоридом. 1 Соединение 2.7 (0,25 г; 36% в течение 2 стадий; белый твердый продукт) получают, следуя пути синтеза 2 и соединению 2.5, заменяя ацетилхлорид валерилхлоридом. 1 Н-ЯМР (CD3OD):0,869-0,915 (т, 3 Н), 1,17-1,31 (м, 4 Н), 1,44 (с, 6 Н), 1,57-1,65 (м, 2 Н), 2,91 (с, 6 Н),3,12-3,29 (м, 6 Н), 4,94-5,02 (м, 1 Н), 6,80-6,33 (д, 2 Н), 7,17-7,23 (м, 3 Н), 7,32-7,38 (м, 2 Н) ЖХ/МС: C27H37N3O3S: m/z 484 (М+1) 2-2-[3-(4-Изопропилфенил)-1-(3-пентил)уреидо]индан-5-илсульфанил-2-метилпропионовая кислота Соединение 2.8 (пример 10) Соединение 2.8 (5 мг; 14% в течение 2 стадий; белый твердый продукт) получают, следуя пути синтеза 2 и соединению 2.4, заменяя ацетилхлорид валерилхлоридом. ЖХ/МС: C28H38N2O3S: m/z 483 (М+1) 2-2-[3-(4-трет-Бутилфенил)-1-(3-пентил)уреидо]индан-5-илсульфанил-2-метилпропионовая кислота Соединение 2.9 (пример 11) Соединение 2.9 (4 мг; 9% в течение 2 стадий; белый твердый продукт) получают, следуя пути синтеза 2 и соединению 2.3, заменяя 4-трифтортиофенилизоцианат 4-трет-бутилфенилизоцианатом. ЖХ/МС: C29H40N2O3S: m/z 497 (М+1) 2-[2-(3-(Бифенил-4-ил-1-пентилуреидо)индан-5-илсульфанил]-2-метилпропионовая кислота Соединение 2.10 (3 мг; 7% в течение 2 стадий; белый твердый продукт) получают, следуя пути синтеза 2 и соединению 2.3, заменяя 4-трифтортиофенилизоцианат 4-бифенилилизоцианатом. ЖХ/МС: C31H36N2O3S: m/z 517 (М+1) 2-2-[3-(4-Изопропилфенил)-1-(3-гексил)уреидо]индан-5-илсульфанил-2-метилпропионовая кислота Соединение 2.11 (пример 13) Соединение 2.11 (13 мг; 44% в течение 2 стадий; масло) получают, следуя пути синтеза 2 и соединению 2.4, заменяя валерилхлорид капроилхлоридом. ЖХ/МС: C29H40N2O3S: m/z 497 (М+1) 2-Метил-2-2-[1-гексил-3-(4-трифторметоксифенил)уреидо]индан-5-илсульфанилпропионовая кислота Соединение 2.12 (пример 14) Соединение 2.12 (18 мг; 54% в течение 2 стадий; белый твердый продукт) получают, следуя пути синтеза 2, заменяя валерилхлорид капроилхлоридом. ЖХ/МС: C27H33F3N2O4S: m/z 539 (M+1) 2-Метил-2-2-[1-гексил-3-(4-трифторметилсульфанилфенил)уреидо]индан-5-илсульфанилпропионовая кислота Соединение 2.13 (пример 15) Соединение 2.13 (14 мг; 36% в течение 2 стадий; белый твердый продукт) получают, следуя пути синтеза 2 и соединению 2.2, заменяя валерилхлорид капроилхлоридом. ЖХ/МС: C27H33F3N2O3S2: m/z 555 (М+1) 2-Метил-2-2-[1-пропил-3-(4-трифторметоксифенил)уреидо]индан-5-илсульфанилпропионовая кислота Соединение 2.14 (1,2 мг; 3% в течение 2 стадий; масло) получают, следуя пути синтеза 2, заменяя ацетилхлорид пропионилхлоридом. ЖХ/МС: C24H27F3N2O4S: m/z 497 (М+1) 2-Метил-2-2-[1-бутил-3-(4-трифторметилсульфанилфенил)уреидо]индан-5-илсульфанилпропионовая кислота Соединение 2.15 (пример 17) Соединение 2.15 (11 мг; 32% в течение 2 стадий; масло) получают, следуя пути синтеза 2 и соединению 2.2, заменяя ацетилхлорид бутирилхлоридом. ЖХ/МС: C25H29F3N2O3S2: m/z 527 (М+1) 2-Метил-2-2-[3-(4-трифторметоксифенил)уреидо]индан-5-илсульфанилпропионовая кислота Соединение 2.16 (пример 18) Соединение 2.16 (11 мг; 49% в течение 2 стадий; масло) получают, следуя пути синтеза 2, ацилируя 4-трифторметоксифенилизоцианатом. ЖХ/МС: C21H21F3N2O4S: m/z 455 (М+1) Путь синтеза 3 2-Метил-2-2-[1-пент-4-енил-3-(4-трифторметоксифенил)уреидо]индан-5-илсульфанилпропионовая кислота Соединение 3.0 (пример 19) К трет-бутиловому эфиру 2-(2-аминоиндан-5-илсульфанил)-2-метилпропионовой кислоты (0,220 г; 0,72 ммоль), растворенному в DCE (4 мл), добавляют пент-4-енал (0,060 мг; 0,72 ммоль), а затем триацетоксиборгидрид натрия (0,21 г; 1,0 ммоль), и реакционную смесь перемешивают в течение 18 ч при комнатной температуре. Реакционную смесь разбавляют CH2Cl2, промывают Н 2 О, насыщенным раствором соли, сушат над Na2SO4, фильтруют и выпаривают растворитель при пониженном давлении с получением трет-бутилового эфира 2-метил-2-(2-пент-4-ениламиноиндан-5-илсульфанил)пропионовой кислоты в виде сырого масла. Соединение 3.0 (0,149 мг; 40% в течение 3 стадий; белый твердый продукт) получают, следуя пути синтеза 2 и стадиям L и М, ацилируя 4-трифторметоксифенилизоцианатом. ЖХ/МС: C26H29F3N2O4S: m/z 522 (М+1) Следующие 2 соединения получают, следуя схемам 3 и 4, пути синтеза 3, стадиям L и M пути синтеза 2, заменяя реагенты и создавая необходимые условия реакции: 2-Метил-2-2-[1-(3-метилбутил)-3-(4-трифторметоксифенил)уреидо]индан-5-илсульфанил-2 метилпропионовая кислота Соединение 3.1 (13 мг; 29% в течение 3 стадий; белый твердый продукт) получают, следуя пути синтеза 3, заменяя пент-4-енал изобутиральдегидом и ацилируя 4-трифторметоксифенилизоцианатом. ЖХ/МС: C26H31F3N2O4S: m/z 525 (М+1) 2-2-[3-(4-Изопропилфенил)-1-(3-метилбутил)уреидо]индан-5-илсульфанил-2-метилпропионовая кислота Соединение 3.2 (пример 21) Соединение 3.2 (11 мг; 27% в течение 3 стадий; белый твердый продукт) получают, следуя пути синтеза 3 и соединению 3.1, заменяя 4-трифторметоксифенилизоцианат 4-изопропилфенилизоцианатом. 1H-ЯМР (CD3OD):0,877-0,895 (дд, 6 Н), 1,19-1,22 (дд, 6 Н), 1,42-1,53 (м, 9 Н), 2,80-2,89 (м, 1 Н),2,99-3,08 (м, 2 Н), 3,17-3,48 (м, 4 Н), 4,98-5,03 (м, 1 Н), 6,26 (с, 1 Н), 7,10-7,22 (м, 5 Н), 7,32-7,35 (м, 2 Н) ЖХ/МС: C28H38N2O3S: m/z 483 (M+1) Следующие 3 соединения получают, следуя схемам 1 и 3 и стадиям J и K пути синтеза 1, заменяя реагенты и создавая необходимые условия реакции: 2-6-[1-Бутил-3-(4-трифторметоксифенил)уреидо]-5,6,7,8-тетрагидронафталин-2-илсульфанил-2 метилпропионовая кислота Соединение 1.1 (пример 22) Соединение 1.1 (41 мг; 68% в течение 2 стадий; белый твердый продукт) получают, следуя пути синтеза 1, заменяя ацетилхлорид бутирилхлоридом. ЖХ/МС: C26H31F3N2O4S: m/z 525 (М+1) 2-6-[1-Бутил-3-(4-трифторметилсульфанилфенил)уреидо]-5,6,7,8-тетрагидронафталин-2-илсульфанил-2-метилпропионовая кислота Соединение 1.2 (пример 23) Соединение 1.2 (23 мг; 34% в течение 2 стадий; белый твердый продукт) получают, следуя пути синтеза 1 и соединению 1.1, заменяя ацетилхлорид бутирилхлоридом, а 4-трифторметоксифенилизоцианат 4-трифтортиофенилизоцианатом. ЖХ/МС: C26H31F3N2O3S2: m/z 541 (М+1) 2-6-[1-Гексил-3-(4-трифторметоксифенил)уреидо]-5,6,7,8-тетрагидронафталин-2-илсульфанил-2 метилпропионовая кислота Соединение 1.3 (36 мг; 57% в течение 2 стадий; белый твердый продукт) получают, следуя пути синтеза 1, заменяя ацетилхлорид капроилхлоридом. ЖХ/МС: C28H35F3N2O4S: m/z 553 (М+1) Следующие 2 соединения получают, следуя схемам 3 и 4 и стадиям L и М пути синтеза 2, заменяя реагенты и создавая необходимые условия реакции: 2-2-[3-(3-Бром-4-трифторметоксифенил)-1-этилуреидо]индан-5-илсульфанил-2-метилпропионовая кислота Соединение 2.17 (пример 25) Соединение 2.17 (0,018 г; 19% в течение 3 стадий; белый твердый продукт) получают, следуя пути синтеза 2, заменяя 4-трифторметоксифенилизоцианат 3-бром-4-трифторметоксифенилизоцианатом. К 3 бром-4-трифторметоксианилину (0,214 г; 0,836 ммоль) в ТГФ (1 мл) добавляют ди-трет-бутилдикарбонат(0,255 г; 1,17 ммоль), а затем 4-диметиламинопиридин (0,102 г; 0,835 ммоль). После прекращения бурного выделения газа (30 мин) добавляют раствор трет-бутилового эфира 2-(2-этиламиноиндан-5 илсульфанил)-2-метилпропионовой кислоты (0,058 г; 0,167 ммоль) в ТГФ (1 мл) и реакционную смесь перемешивают в течение 18 ч при комнатной температуре. Используя стадии К и L пути синтеза 2, получают указанное в заголовке соединение. ЖХ/МС: C23H24BrF3N2O4S: m/z 563 (М+1). 2-2-[1-Этил-3-(3-трифторметоксифенил)уреидо]индан-5-илсульфанил-2-метилпропионовая кислота Соединение 2.18 (пример 26) Соединение 2.18 (13 мг; 12% в течение 3 стадий; белый твердый продукт) получают, следуя примеру 2.0, заменяя 4-трифторметоксифенилизоцианат 3-трифторметоксифенилизоцианатом. К раствору карбонилдиимидазола (0,454 г; 2,8 ммоль) в ТГФ (2 мл), нагретому до 50 С, добавляют по каплям 3 трифторметоксианилин (0,522 г; 2,94 ммоль). Через 15 мин реакционную смесь охлаждают и добавляют к раствору трет-бутилового эфира 2-(2-этиламиноиндан-5-илсульфанил)-2-метилпропионовой кислотыA. S-(2-Формиламиноиндан-5-иловый) эфир диметилтиокарбаминовой кислоты. Схема 6. К S-[2-аминоиндан-5-иловому) эфиру диметилтиокарбаминовой кислоты (2,0 г; 8,46 ммоль) в СНСl3 (10 мл) добавляют этилформиат (50 мл) и реакционную смесь нагревают при 55 С в течение 24 ч. Реакционную смесь охлаждают, растворитель удаляют при пониженном давлении и сырое масло очищают с помощью флэш-хроматографии (SiO2), элюируя градиентом этилацетат-метанол, с получением 0,77 г (35%) S-(2-формиламиноиндан-5-илового) эфира диметилтиокарбаминовой кислоты в- 23009554 виде белого твердого продукта. ЖХ/МС: C13H16N2O2: m/z 264 (М+1)B. трет-Бутиловый эфир 2-метил-2-(2-метиламиноиндан-5-илсульфанил)пропионовой кислоты. Схема 6. К S-(2-формиламиноиндан-5-иловому) эфиру диметилтиокарбаминовой кислоты (0,772 г; 2,9 ммоль) в ТГФ (9 мл) в атмосфере N2 добавляют раствор 1,0 М литийалюминийгидрида (9 мл) при 0 С. Реакционную смесь нагревают до комнатной температуры, затем перемешивают при нагревании с обратным холодильником в течение 24 ч. Реакционную смесь охлаждают до 0 С, гасят Н 2 О и удаляют растворитель при пониженном давлении. Остаток растворяют в МеОН (4 мл), к раствору добавляют Cs2CO3(0,304 г; 0,93 ммоль), трет-бутил-2-бромизобутират (0,311 мл; 1,39 ммоль) и NaBH4 (2.0 г; 52,8 ммоль). Реакционную смесь перемешивают в течение 18 ч, удаляют при пониженном давлении и остаток распределяют между EtOAc и Н 2 О. Слои разделяют, водную фазу экстрагируют EtOAc, органические экстракты объединяют, промывают насыщенным раствором соли, сушат над Na2SO4, фильтруют и выпаривают при пониженном давлении. Сырой остаток очищают с помощью флэш-хроматографии (SiO2), элюируя градиентом CH2Cl2-МеОН, с получением 0,186 г (20%) трет-бутилового эфира 2-метил-2-(2 метиламиноиндан-5-илсульфанил)пропионовой кислоты в виде масла. ЖХ/МС: C18H27NO2S: m/z 321 (М+1) Соединение 2.19 (44 мг; 65% в течение 2 стадий; белый твердый продукт) получают, следуя пути синтеза 2 и стадиям L и М, заменяя 4-трифторметоксифенилизоцианат 4-диметиламинофенилизоцианатом. ЖХ/МС: C23H29N3O3S: m/z 428 (М+1) 2-2-[1-(3-Циклопентилпропил)-3-(4-трифторметоксифенил)уреидо]индан-5-илсульфанил-2-метилпропионовая кислота Соединение 2.20 (пример 28) Соединение 2.20 (39 мг; 49% в течение 2 стадий; белый твердый продукт) получают, следуя пути синтеза 2, заменяя ацетилхлорид 3-циклопентилпропионилхлоридом. ЖХ/МС: C29H35F3N2O4S: m/z 565 (М+1) 2-[2-(3-Индан-5-ил-1-пентилуреидо)индан-5-илсульфанил-2-метилпропионовая кислота Соединение 2.21 (пример 29) Соединение 2.21 (9,3 мг; 24% в течение 2 стадий; белый твердый продукт) получают, следуя пути синтеза 2 и соединению 2.3, заменяя ацетилхлорид валерилхлоридом, а 4-трифторметоксифенилизоцианат инданилизоцианатом. ЖХ/МС: C28H36N2O3S: m/z 481 (М+1) 2-Метил-2-2-[3-(4-метил-3-нитрофенил)-1-пентилуреидо]индан-5-илсульфанилпропионовая кислота Соединение 2.22 (пример 30) Соединение 3.4 (2,9 мг; 4% в течение 2 стадий; белый твердый продукт) получают, следуя пути синтеза 3, заменяя пент-4-енал 1-нафтальдегидом. ЖХ/МС: C32H29F3N2O4S: m/z 595 (M+1) 2-2-[3-(4-Метоксифенил)-1-пропилуреидо]индан-5-илсульфанил-2-метилпропионовая кислота Соединение 2.23 (пример 32) Соединение 2.23 (21 мг; 64% в течение 2 стадий; белый твердый продукт) получают, следуя пути синтеза 2 и соединению 2.14, заменяя 4-трифторметоксифенилизоцианат 4-метоксифенилизоцианатом. ЖХ/МС: C24H27F3N2O4S: m/z 443 (М+1) 2-2-[3-(3,5-Диметилфенил)-1-пропилуреидо]индан-5-илсульфанил-2-метилпропионовая кислота Соединение 2.24 (пример 33) Соединение 2.24 (19 мг; 57% в течение 2 стадий; белый твердый продукт) получают, следуя пути синтеза 2 и соединению 2.14, заменяя 4-трифторметоксифенилизоцианат 3,5-диметилфенилизоцианатом. ЖХ/МС: C25H32N2O3S: m/z 441 (М+1) 2-2-[1-(2-Метоксиэтил)-3-(4-трифторметилсульфанилфенил)уреидо]индан-5-илсульфанил-2 метилпропионовая кислота Соединение 2.25 (пример 34) Соединение 2.25 (7,0 мг; 16% в течение 2 стадий; масло) получают, следуя пути синтеза 2 и соединению 2.2, заменяя ацетилхлорид метоксиацетилхлоридом. ЖХ/МС: C24H27F3N2O4S2: m/z 529 (М+1) 2-Метил-2-2-[1-пропил-3-(4-трифторметилфенил)уреидо]индан-5-илсульфанилпропионовая кислота Соединение 2.26 (пример 35) Соединение 2.26 (20 мг; 56% в течение 2 стадий; белый твердый продукт) получают, следуя пути синтеза 2 и соединению 2.14,заменяя 4-трифторметоксифенилизоцианат 4 трифторметилфенилизоцианатом. ЖХ/МС: C24H27F3N2O3S2: m/z 481 (М+1) 2-Метил-2-2-[1-(4,4,4-трифторбутил)-3-(4-трифторметоксифенил)уреидо]индан-5-илсульфанилпропионовая кислота Соединение 2.27 (пример 36) Соединение 2.27 (10 мг; 26% в течение 2 стадий; масло) получают, следуя пути синтеза 2 и соединению 2.0, заменяя ацетилхлорид трифторметилбутирилхлоридом. ЖХ/МС: C25H26F6N2O4S: m/z 564 (М+1) 2-2-[1-(3-Циклопентилпропил)-3-фенилуреидо]индан-5-илсульфанил-2-метилпропионовая кислота Соединение 2.28 (пример 37) Соединение 2.28 (38 мг; 56% в течение 2 стадий; масло) получают, следуя пути синтеза 2 и соединению 2.0, заменяя ацетилхлорид циклопентилпропионилхлоридом, а 4-трифторметоксифенилизоцианат фенилизоцианатом. ЖХ/МС: C28H36N2O3S: m/z 481 (М+1) Метиловый эфир 6-[1-[5-(1-карбокси-1-метилэтилсульфанил)индан-2-ил]-3-(4-изопропилфенил)уреидо]гексановой кислоты Соединение 2.29 (пример 38) Соединение 2.29 (12 мг; 38% в течение 2 стадий; белый твердый продукт) получают, следуя пути синтеза 2 и соединению 2.4, заменяя ацетилхлорид метиловым эфиром 5-хлоркарбонилпентановой кислоты. ЖХ/МС: C30H40N2O5S: m/z 541 (М+1) 2-Метил-2-[2-(3-нафталин-2-ил-1-пентилуреидо)индан-5-илсульфанил]пропионовая кислота Соединение 2.30 (15 мг; 39% в течение 2 стадий; белый твердый продукт) получают, следуя пути синтеза 2 и соединению 2.3, заменяя 4-трифтортиометоксифенилизоцианат 2-нафтилизоцианатом. ЖХ/МС: C29H34N2O3S: m/z 491 (M+1) 2-2-[1-Циклогексилметил-3-(4-трифторметоксифенил)уреидо]индан-5-илсульфанил]-2-метилпропионовая кислота Соединение 2.31 (пример 40) Соединение 2.31 (15 мг; 25% в течение 2 стадий; белый твердый продукт) получают, следуя пути синтеза 2 и соединению 2.0, заменяя ацетилхлорид циклогексилацетилхлоридом. ЖХ/МС: C28H33F3N2O4S: m/z 551 (М+1) 2-2-[1-Изобутил-3-(4-трифторметоксифенил)уреидо]индан-5-илсульфанил-2-метилпропионовая кислота Соединение 3.5 (пример 41) Соединение 3.5 (10 мг; 12% в течение 2 стадий; масло) получают, следуя пути синтеза 3 и соединению 3.0, заменяя пент-5-енал 2-метилпропиональдегидом. ЖХ/МС: C25H29F3N2O4S: m/z 511 (М+1) 2-2-[3-(3,4-Дихлорфенил)-1-гептилуреидо]индан-5-илсульфанил-2-метилпропионовая кислота Соединение 2.32 (пример 42) Соединение 2.32 (6,7 мг; 12% в течение 2 стадий; масло) получают, следуя пути синтеза 2 и соединению 2.0, заменяя ацетилхлорид гептаноилхлоридом, а 4-трифторметоксифенилизоцианат 3,4 дихлорфенилизоцианатом. ЖХ/МС: C27H34Cl2N2O3S: m/z 538 (М+1) 2-2-[1-(2-Диметиламиноэтил)-3-(4-трифторметилсульфанилфенил)уреидо]индан-5-илсульфанил 2-метилпропионовая кислота Соединение 2.33 (1,9 мг; 4% в течение 2 стадий; масло) получают, следуя пути синтеза 2 и соединению 2.2, заменяя ацетилхлорид диметиламиноацетилхлоридом, а 4-трифторметоксифенилизоцианат 4 трифторметилтиофенилизоцианатом. ЖХ/МС: C25H30F3N3O3S2: m/z 542 (М+1) 2-(2-[3-(3-Хлорфенил)-1-гептилуреидо]индан-5-илсульфанил-2-метилпропионовая кислота Соединение 2.34 (пример 44) Соединение 2.34 (7,4 мг; 14% в течение 2 стадий; белый твердый продукт) получают, следуя пути синтеза 2 и соединению 2.32 и заменяя 4-трифторметоксифенилизоцианат 3-хлорфенилизоцианатом. ЖХ/МС: C27H35ClN2O3S: m/z 542 (М+1) 1-2-[1-Гептил-3-(4-трифторметоксифенил)уреидо]индан-5-илсульфанилциклобутанкарбоновая кислота Соединение 2.35 (пример 45) Соединение 2.35 (1,0 мг; 1,3% в течение 2 стадий; белый твердый продукт) получают, следуя пути синтеза 2 и соединению 2.32,заменяя трет-бутил-2-бромизобутират этил-1 бромциклобутанкарбоксилатом. ЖХ/МС: C29H35F3N2O4S: m/z 565 (М+1) 2-Метил-2-7-[1-пропил-3-(4-трифторметоксифенил)уреидо-5,6,7,8-тетрагидронафталин-2-илсульфанилпропионовая кислота Соединение 1.4 (пример 46) Соединение 1.4 (53 мг; 25% в течение 2 стадий; масло) получают, следуя пути синтеза 1 и соединению 1.0, заменяя ацетилхлорид пропионилхлоридом. ЖХ/МС: C25H29F3N2O4S: m/z 511 (М+1) Следующие два соединения могут быть получены, следуя схемам 10 и 4, стадиям I, J и K пути синтеза 1, заменяя реагенты и создавая необходимые условия реакции: 2-6-[1-Этил-3-(4-трифторметоксифенил)уреидо]-3-метокси-5,6,7,8-тетрагидронафталин-2-илсульфанил-2-метилпропионовая кислота. Соединение 1.5 (9,8 мг; масло) может быть получено, следуя пути синтеза 1, стадиям I, J и K и схемам 4 и 10. 1 2-6-[1-Этил-3-(4-трифторметоксифенил)уреидо]-5,6,7,8-тетрагидронафталин-2-илокси-2 метилпропионовая кислота Соединение 4.0 (пример 48)A. N-(6-Метокси-1,2,3,4-тетрагидронафталин-2-ил)ацетамид Схема 7. К перемешиваемой суспензии 6-метокси-1,2,3,4-тетрагидронафталин-2-иламина (2,54 г; 14,3 ммоль) в CH2Cl2 (20 мл) добавляют DIEA (3,4 мл) и реакционную смесь охлаждают до 0 С. Добавляют по каплям ацетилхлорид (1,22 мл; 17,1 ммоль) при 0 С и реакционной смеси дают нагреться до комнатной температуры и перемешивают в течение 18 ч. Реакционную смесь разбавляют CH2Cl2, промывают Н 2 О, сушат над Na2SO4, фильтруют и удаляют растворитель при пониженном давлении с получением сырого твердого продукта. Очистка с помощью флэш-хроматографии (SiO2) с элюированием гексанEtOAc дает 1,57 г (50%) N-(6-метокси-1,2,3,4-тетрагидронафталин-2-ил)ацетамида в виде белого твердого продукта. ЖХ/МС: C13H17NO2: m/z 220 (М+1)B. N-(6-Гидрокси-1,2,3,4-тетрагидронафталин-2-ил)ацетамид Схема 7. К суспензии N-(6-метокси-1,2,3,4-тетрагидронафталин-2-ил)ацетамида (1,57 г; 7,2 ммоль) в CH2Cl2 (70 мл), охлажденной до -60 С, добавляют раствор трибромида бора-CH2Cl2 (36 мл), по каплям для поддерживания температуры реакции в пределах между (-50)-(-60 С). Желатинообразной суспензии дают нагреться до комнатной температуры и перемешивают в течение 30 мин. Реакционную смесь охлаждают до 0 С, гасят насыщенным NaHCO3 и перемешивают в течение 30 мин при комнатной температуре. Смесь экстрагируют CH2Cl2 (2 х), экстракты объединяют, сушат над Na2SO4, фильтруют и выпаривают при пониженном давлении с получением сырого твердого продукта, который очищают с помощью флэш-хроматографии (SiO2), элюируя градиентом CH2Cl2-МеОН, с получением 1,13 г (76%) N-(6 гидрокси-1,2,3,4-тетрагидронафталин-2-ил)ацетамида в виде бежевого твердого продукта. ЖХ/МС: C12H15NO2: m/z 206 (М+1) С. трет-Бутиловый эфир 2-(6-ацетиламино-5,6,7,8-тетрагидронафталин-2-илокси)-2-метилпропионовой кислоты. Схема 7. К суспензии N-(6-гидрокси-1,2,3,4-тетрагидронафталин-2-ил)ацетамида (0,439 г; 2,1 ммоль) в ДМФА (6 мл) добавляют Cs2CO3 (1/7 г; 5,2 ммоль) и трет-бутил-2-бромизобутират (2,1 мл; 9,4 ммоль) и реакционную смесь перемешивают при 100 С в течение 18 ч. Реакционную смесь охлаждают до комнатной температуры, разбавляют EtOAc, промывают Н 2 О, насыщенным раствором соли, сушат над Na2SO4, фильтруют и удаляют растворитель при пониженном давлении с получением сырого масла,которое очищают с помощью флэш-хроматографии (SiO2), элюируя градиентом гексан-EtOAc, с получением 0,51 г (69%) трет-бутилового эфира 2-(6-ацетиламино-5,6,7,8-тетрагидронафталин-2-илокси)-2 метилпропионовой кислоты в виде масла. 1 Н-ЯМР (300 МГц, CDCl3):6,89-6,92 (д, 1 Н), 6,58-6,65 (м, 2 Н), 5,85-5,88 (м, 1 Н), 4,24-4,30 (м, 1 Н),2,99-3,06 (дд, 1 Н), 2,76-2,86 (м, 2 Н), 2,51-2,59 (дд, 1 Н), 2,04 (с, 2 Н), 1,98-2,02 (м, 1 Н), 1,74-1,79 (м, 1 Н),1,54 (с, 6 Н), 1,46 (с, 9 Н) ЖХ/МС: C20H29NO4: m/z 292 (М+1) Следующее соединение получают, следуя схемам 3 и 4 и стадиям I, J и K пути синтеза 1, заменяя реагенты и создавая необходимые условия реакции: Соединение 4.0 (0,0168 г; 23% в течение 2 стадий; масло) получают, следуя пути синтеза 1 и соединению 1.0. ЖХ/МС: C24H27F3N2O5: m/z 481 (М+1) 2-6-[3-(4-трет-Бутилфенил)-1-этилуреидо]-3-метокси-5,6,7,8-тетрагидронафталин-2-илсульфанил 2-метилпропионовая кислота. Соединение 1.6 (10 мг; масло) может быть получено, заменяя 4-трифторметоксифенилизоцианат 4 трет-бутилфенилизоцианатом и используя путь синтеза 1, стадии I, J и K и схемы 4 и 10. ЖХ/МС: C28H38N2O4S: m/z 499 (М+1) 2-6-[1-Этил-3-(4-трифторметоксифенил)уреидо]-3-фтор-5,6,7,8-тетрагидронафталин-2-илсульфанил-2-метилпропионовая кислота Соединение 1.7 (пример 50) Соединение 1.7 (16 мг; 30% после 2 стадий; белый твердый продукт) может быть получено, следуя пути синтеза 1, стадиям I, J и K и схемам 4 и 10. 1 Соединение 1.8 (15 мг; 22% после 2 стадий; белый твердый продукт) может быть получено, следуя пути синтеза 1, стадиям I, J и K и схемам 4 и 10. ЖХ/МС: C25H29F3N2O5S: m/z 532 (М+1) 2-6-[1-Этил-3-(4-трифторметоксифенил)уреидо]-3-бром-5,6,7,8-тетрагидронафталин-2-илсульфанил-2-метилпропиановая кислота Соединение 1.9 (пример 52)
МПК / Метки
МПК: C07C 271/56, C07C 275/34, C07C 323/52, A61K 31/16, C07C 323/61
Метки: тетралины, инданы, замещённые, применение
Код ссылки
<a href="https://eas.patents.su/30-9554-zameshhyonnye-tetraliny-i-indany-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Замещённые тетралины и инданы и их применение</a>
Предыдущий патент: Замещённые тетралины и инданы
Следующий патент: Пептид, обладающий иммуномодулирующей активностью, и фармацевтическая композиция
Случайный патент: Аморфные бензотиофены, способы получения и способы применения