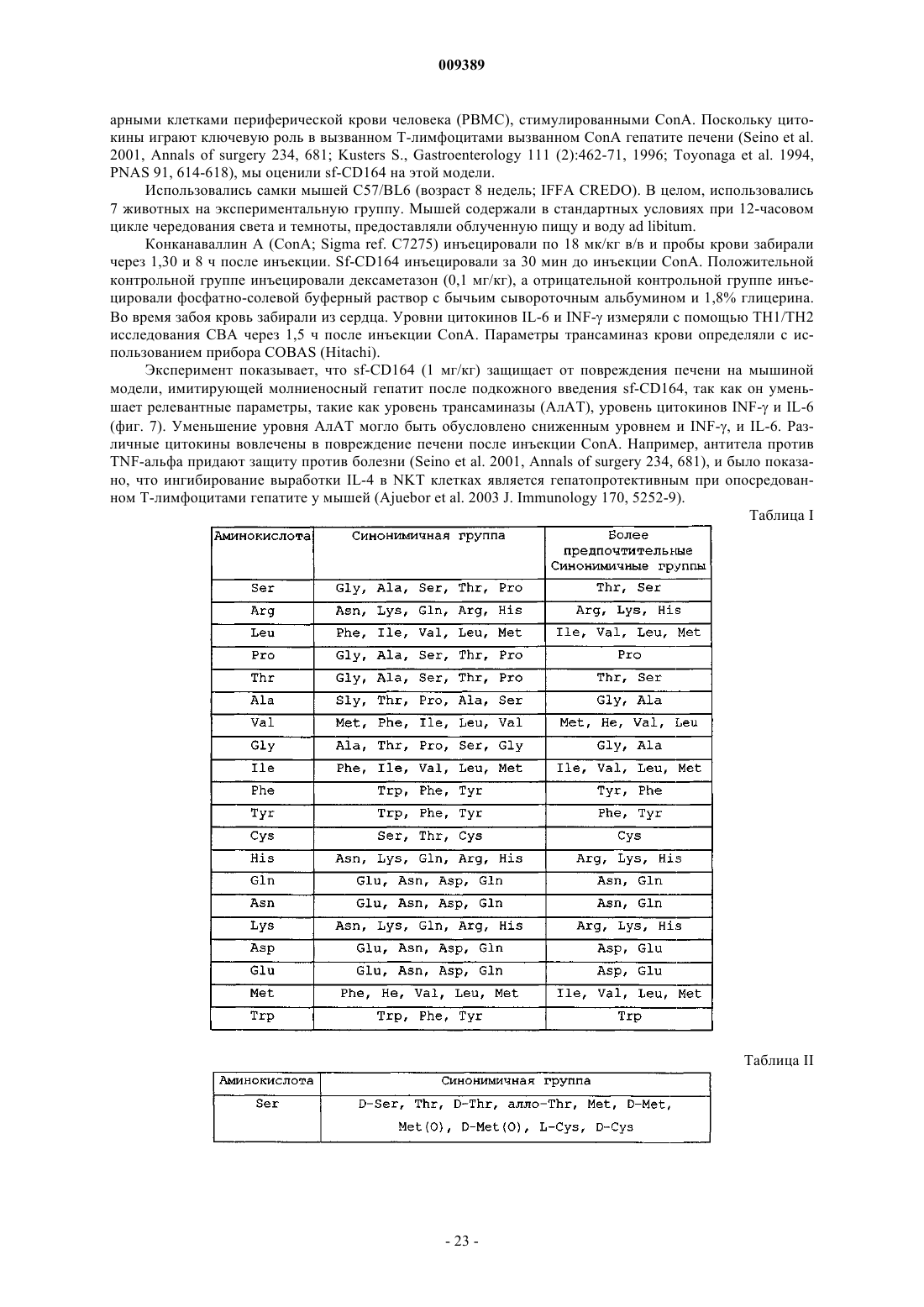
Использование растворимого cd 164 при воспалительных и/или аутоимунных нарушениях
Формула / Реферат
1. Применение растворимого белка, содержащего последовательность, который по меньшей мере на 85% гомологичен зрелой форме внеклеточного домена человеческого CD164 (SEQ ID NO: 1), для получения препарата для лечения и/или профилактики воспалительных или/и аутоиммунных нарушений.
2. Применение по п.1, где указанный растворимый белок выбран из
a) SEQ ID NO: 1 или
b) SEQ ID NO: 1, слитой с сигнальной последовательностью человеческого CD164.
3. Применение по п.1, где указанный растворимый белок является активным мутеином или изоформой SEQ ID NO: 1.
4. Применение по п.3, где указанный растворимый белок выбран из
a) MGC-24 (SEQ ID NO: 6) или
b) зрелой формы внеклеточного домена любой из следующих изоформ человеческого CD164: CD164-дельта 4 (SEQ ID NO: 4), CD164-дельта 5 (SEQ ID NO: 5).
5. Применение по любому из предыдущих пунктов, где упомянутый растворимый белок гликозилирован.
6. Применение по п.5, где упомянутый растворимый белок гликозилирован по любому положению SEQ ID NO: 1.
7. Применение по любому из предыдущих пунктов, где упомянутый растворимый белок фосфорилирован.
8. Применение по п.7, где упомянутый растворимый белок фосфорилирован по любому положению SEQ ID NO: 1.
9. Применение по любому из предыдущих пунктов, где упомянутый растворимый белок миристоилирован.
10. Применение по п.9, где упомянутый растворимый белок миристоилирован по любому положению SEQ ID NO: 1.
11. Применение по любому из предыдущих пунктов, где упомянутый растворимый белок является растворимым слитым белком.
12. Применение по п.11, где упомянутый растворимый слитый белок содержит сигнальную последовательность.
13. Применение по п.11 или 12, где указанный растворимый слитый белок содержит гистидиновый таг (гистидиновую метку).
14. Применение по п.13, где указанный растворимый слитый белок представляет собой SEQ ID NO: 2.
15. Применение по п.11 или 12, где указанный растворимый слитый белок содержит Fc-фрагмент иммуноглобулина.
16. Применение по любому из предыдущих пунктов, где указанный растворимый белок является активным производным, устойчивой к протеолизу модифицированной формой, конъюгатом, комплексом, фракцией, предшественником и/или солью.
17. Применение полинуклеотидной последовательности, кодирующей растворимый белок, содержащей последовательность, которая по меньшей мере на 85% гомологична зрелой форме внеклеточного домена человеческого CD164 (SEQ ID NO: 1), для получения лекарственного препарата для лечения и/или профилактики воспалительных или/и аутоиммунных нарушений.
18. Применение по любому из предыдущих пунктов, где указанное воспалительное и/или аутоиммунное заболевание выбрано из группы, включающей рассеянный склероз, системную красную волчанку, ревматоидный артрит, ювенильный идиопатический артрит, псориатический артрит, остеоартрит, спондилоартропатию, воспалительное заболевание кишечника, эндотоксинемию, болезнь Крона, болезнь Стилла, увеит, гранулематоз Вегенера, болезнь Бехчета, склеродермию, синдром Шегрена, саркоидоз, гангренозную пиодермию, полимиозит, дерматомиозит, миокардит, псориаз, системную склеродермию, гепатит С, аллергию, аллергическое воспаление, аллергическое воспаление дыхательных путей, хроническую обструктивную болезнь легких (ХОБЛ), инфаркт кишечника, инсульт, неспецифический язвенный колит, аллергическую астму, бронхиальную астму, фиброз, постишемическое воспаление мышцы, почек и сердца, воспаление кожи, гломерулонефрит, ювенильный сахарный диабет типа I, болезнь гиперчувствительности, вирусные или острые болезни печени, алкогольную печеночную недостаточность, туберкулез, септический шок, ВИЧ-инфекцию, реакцию "трансплантат против хозяина" (GVHD) и атеросклероз.
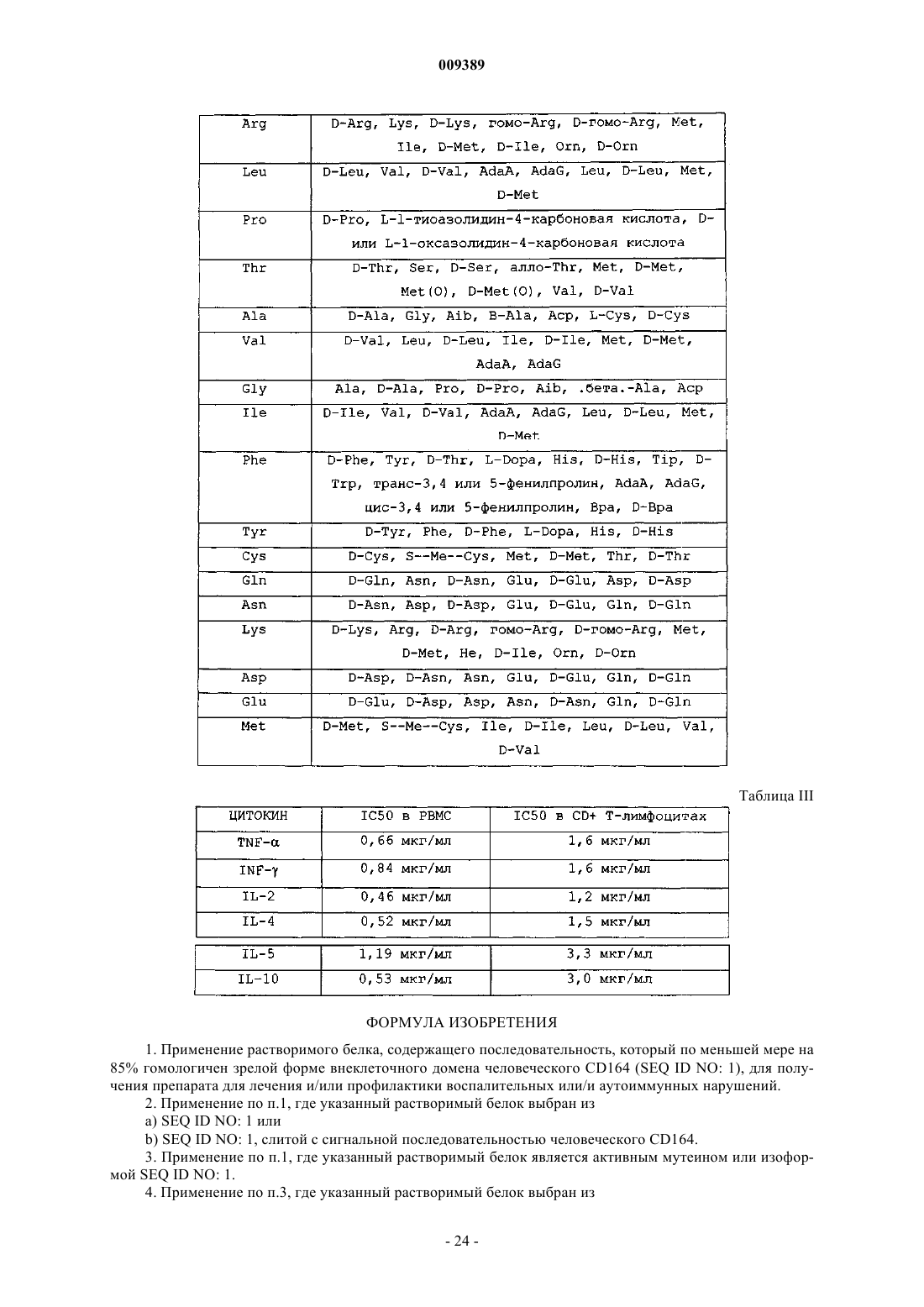
19. Способ ингибирования экспрессии одного или нескольких цитокинов у индивидуума, предусматривающий введение указанному индивидууму композиции, содержащей растворимый белок, содержащий последовательность, которая по меньшей мере на 85% гомологична зрелой форме внеклеточного домена человеческого CD164 (SEQ ID NO: 1).
20. Способ по п.19, где указанный цитокин является TNF-a, INF-g, IL-2, IL-4, IL-5 или IL-10.
21. Метод скрининга, включающий растворимый белок, содержащий последовательность, которая по меньшей мере на 85% гомологична зрелой форме внеклеточного домена человеческого CD164 (SEQ ID NO: 1), для идентификации и сравнения свойств соединений в качестве ингибиторов секреции и экспрессии цитокинов.
Текст
009389 Область техники, к которой относится изобретение Настоящее изобретение относится к области воспаления и аутоиммунных нарушений, в частности,к открытию новых белков, подходящих для профилактики и/или лечения воспалительных и/или аутоиммунных нарушений. Уровень техники Последующее обсуждение предназначено для того, чтобы облегчить понимание изобретения, но его не следует рассматривать или считать уровнем техники изобретения.CD164 является членом надсемейства гликопротеинов рецепторов муциноподобных веществ или сиаломуцинов. Сиаломуцины являются трансмембранными гликопротеидами с массой от 50 до 3000 кДа, проявляющими ограниченное сходство на уровне кДНК и аминокислот. Муциноподобные экспрессированные белки имеют общую характеристику - многочисленные остатки серина и треонина Огликозилированы и как следствие образуют множество взаимодействий клетка - клетки или клетка внеклеточный матрикс. Плотный массив О-связанных боковых цепей характеризуется расширенной структурой, которая делает многие из муциноподобных молекул достаточно длинными, чтобы выступать за пределы полисахаридного гликокаликса, который окружает клетку, а также оптимальным обнажением и высокой кратностью терминальных сахаров. Благодаря структурной конфигурации, а также отрицательному заряду муциноподобные гликопротеиды могут действовать как отталкивающий барьер, если только клетки не несут специфических рецепторов муцина (адгезии). Функции рецепторов муцина зависят от типов клеток и состояний активации, находящихся в соотношении с центральным пептидом муцина и со специфической для клетки экспрессией гликозилтрансфераз, которые в свою очередь регулируют структуру и представление О-связанных боковых олигосахаридных цепей, закрепление в мембране, способность к трансдукции сигнала и/или транспортировки муцина к правильному клеточному домену. Человеческий CD164 является ортологом мышиного MGC-24v (M.musculus) и эндолина крысы(R.norvegicus), мембранного белка, обнаруженного в лизосомальном и эндосомальном компартментах клеток млекопитающих. Были описаны связи различных изоформ, а также функционально важными доменами и субклеточным распределением CD164/эндолина (Chan Y.H. et al., J Biol. Chem, 276:, 2139-2152,2001). В своем природном состоянии человеческий CD164 представляет собой гомодимер из двух связанным дисульфидными связями субъединиц массой 80-85 кДа. CD164 высоко гликозилирован, содержит и О-, и N-связанные гликаны. Внеклеточная область состоит из двух доменов муцина (I и II), связанных немуциновым доменом, содержащим внутренние дисульфидные мостики, а также богатый цистеином мотив, который напоминает консенсусную структуру, ранее обнаруженную в рецепторах факторов роста и цитокинов. CD164 также содержит трансмембранный домен, однократно пронизывающий мембрану, и внутриклеточную область из 13 аминокислот, которая содержит С-концевой мотив (т.е. YHTL), способный делать белок целью эндосом и лизосом. Описаны четыре разновидности человеческой мРНК CD164, возникающие при альтернативном сплайсинге шести истинных экзонов из единственной геномной единицы транскрипции, расположенной на хромосоме человека 6q21 (Zannettino A., J Biol Regul Homeost Agents, 15: 394-396, 2001; Watt andChan, Leuk Lymph, 37 (1-25. 2000). Вероятно, существуют 4 альтернативных промотора, два неперекрывающихся альтернативных последних экзона и один внутренний интрон, который не всегда вырезается. Преобладающая изоформа CD164 (Е 1-6) представляет собой трансмембранный гликопротеид типа I из 178 аминокислот. Другие описанные изоформы представляют собой сиаломуцин CD164 или изоформуCD164 дельта 5, содержащие 178 аминокислот; изоформу CD164 дельта 4 из 184 остатков; и преимущественно растворимую изоформу массой 200 кДа, названную MGC-24 (от Multi-Glycosylated Core proteinof 24 kD - мультигликозилированного белка сердцевины массой 24 кДа), которая лишена мотива, фиксирующего ее в мембране, и содержит 189 остатков. Все изоформы являются высокогликозилированными белками с О- и N-связанными участками гликозилирования (фиг. 1). Функции CD164 включают опосредование или регулирование адгезии гемопоэтических клетокпредшественниц и отрицательное регулирование их роста и/или дифференцировки. CD164 обычно экспрессируется CD34+ и CD34Io/- стволовыми гемопоэтическими клетками и связанными с ними клетками микроокружения (Watt et al., Blood, 92: 849-866, 1998). CD164 также экспрессируется коммитированными миелоидными и эритроидными колониеобразующими клетками, на стромальных и эндотелиальных клетках костного мозга, слабо - на лимфоцитах и на мезенхимальных стволовых клетках. CD164 может играть ключевую роль в гемопоэзе посредством облегчения адгезии человеческих CD34+ клеток к строме костного мозга и подавления пролиферации CD34+ CD38Io/- гемопоэтических клетокпредшественниц, действуя как мощная сигнальная молекула (Zannettino et al. Blood, 92: 2613-2 628,1998). Данные влияния вовлекают эпитопы CD164 класса I и/или II, распознаваемые моноклональными антителами (mAbs) 105A5 и 103 В 2/9 Е 10. Данные эпитопы зависят от углеводов и расположены на Nконцевом домене I муцина (Watt et al., Blood, 95, 3113-3124, 2000; Doyonnas et al., J Immunol, 165: 840851, 2000). Полагают, что взаимодействие гемопоэтических клеток со стромальными/эндотелиальными клетками в их непосредственном микроокружении имеет главное значение в регулировании самообнов-1 009389 ления, покоя, коммитирования и миграции стволовых гемопоэтических клеток. Данные взаимодействия включают кооперацию между рецепторами адгезии, их родственными лигандами и цитокинами. Совокупность молекул клеточной адгезии (САМ) включает семейства Ig, интегринов, кадхеринов, селектинов и муциноподобных белков, участвующих в данных процессах. Была показана in vitro роль CD164 в миогенной дифференцировке (Lee et al., Mol Cell Biol, 21: 76967706, 2001). Чрезмерная экспрессия CD164 на клеточных линиях миобластов ускоряла экспрессию биохимических маркеров дифференцировки и усиливала формирование многоядерных мышечных трубочек,а антисмысловой CD164 или растворимые внеклеточные области CD164 ингибировали миогенез. Участок растворимого MGC-24, связывающий агглютинин арахиса (PNA), представляет опухолевый углеводный маркер, который экспрессируется во многих раковых опухолях. Обнаружено, что общее количество мРНК MGC-24 в раковых опухолях толстой кишки человека ниже, чем в прилегающих тканях нормальной слизистой оболочки (Matsui et al., J Biochem, 127: 1103-1107, 2000). Инвазия раковой опухоли в лимфатические сосуды коррелировала с низким уровнем мРНК MGC-24 в раковых опухолях толстой кишки, в то время как высокие уровни хорошо коррелировали с меньшей инвазией в вены и меньшим количеством отдаленных метастазов. Моноклональные антитела, специфичные против CD164,могли бы оказаться применимыми для диагностики или лечения рака, а также ингибирования гемопоэза(ЕР 889054, ЕР 761814). Были описаны другие белки, подобные CD164 (NOV25, WO 02/098917; SEQ ID NO: 7852, ЕР 1033401; фиг. 1), но их биологические свойства не были проанализированы. Сущность изобретения Неожиданно было обнаружено, что растворимый белок, содержащий зрелую форму внеклеточного домена человеческого CD164, обладает ингибирующим действием на экспрессию цитокинов (а именно,интерферона-, IL-2, IL-4, IL-5, IL-10 и TNF-) в клетках, которые в норме производят цитокины, когда они стимулированы такими веществами, как конканавалин А. Кроме того, данный растворимый фрагмент CD164 ингибирует релевантные физиологические реакции (такие как миграция лимфоцитов или макрофагов) на животных моделях, релевантных для воспалительных и/или аутоиммунных болезней. Следовательно, растворимые белки, содержащие последовательность, которая по меньшей мере на 85% гомологична зрелой форме внеклеточного домена человеческого CD164, могут использоваться для производства препарата для лечения и/или профилактики воспалительных и/или аутоиммунных нарушений. Фармацевтические композиции, содержащие любой из данных растворимых белков, подходят для лечения и/или профилактики воспалительных и/или аутоиммунных нарушений, и обычно могут вводиться индивидууму, чтобы ингибировать экспрессию цитокинов. Другие особенности и преимущества изобретения станут очевидными из следующего подробного описания. Описание чертежей Фиг. 1: (А) сравнение аминокислот полной длины человеческого CD 164 (hCD164; NCBI Acc. No.(hMGC-24; NCBI Acc. No. Q04900; SEQ ID NO: 6). Сигнальные последовательности взяты в рамку. Конец внеклеточной области обозначен стрелкой. Участки гликозилирования обозначены звездочками;(В) выравнивание аминокислот зрелой формы внеклеточных доменов CD164 (аминокислоты 1-140 из SEQ ID NO: 1 соответствуют аминокислотам 24-163 из SEQ ID NO: 3 и аминокислотам 1-140 из SEQSEQ ID NO: 4), CD164-дельта 5 (аминокислоты 24-145 из SEQ ID NO: 5), SEQ ID NO: 7852 (ЕР 1033401; аминокислоты 24-163 из SEQ ID NO: 7) и NOV25 (WO 02/098917; аминокислоты 24-161 из SEQ ID NO: 8). Положения в NOV25, отличающиеся от SEQ ID NO: 1, подчеркнуты. Фиг. 2: влияние введения sf-CD164 в стимулированную ConA смесь РВМС клеток человека на экспрессию IL-2 (А) и TNF- (В). Ось X представляет концентрацию sf-CD164 в мкг/мл. Ось Y представляет процентное содержание цитокина, выделенного секрецией. Фиг. 3: влияние введения sf-CD164 в стимулированные ConA CD4 Т-лимфоциты на экспрессию IL2 (А) и TNF- (В). Ось X представляет концентрацию sf-CD164 в мкг/мл. Ось Y представляет процентное содержание цитокина, выделенного секрецией. Фиг. 4: влияние введения sf-CD164 на выделение TNF- в животной модели выделения TNF-, вызванного ЛПС. Звездочки указывают на статистическую значимость. Фиг. 5: влияние введения sf-CD164 на миграцию клеток в животной модели накопления клеток в брюшине, вызванного тиогликолятом (А) или ЛПС (В). Ось Y представляет концентрацию клеток в мкл(макрофагов на А, активированных лимфоцитов на В). Звездочки указывают на статистическую значимость. Фиг. 6: влияние введения sf-CD164 на пролиферацию аутоантигенных МВР-специфических Тлимфоцитов. Ось Y представляет радиоактивность (СРМ, импульсов в минуту), связанную с встраиванием меченных радиоактивным изотопом нуклеотидов (3 Н тимидина) в делящиеся клетки. Звездочки ука-2 009389 зывают на статистическую значимость. Фиг. 7: влияние введения sf-CD164 печеночной животной модели, вызванной ConA, на уровень трансаминазы (АлАТ; А) выделение IL-6 (В) и выделение INF- (С). Декса означает дексаметазон. Звездочки указывают на статистическую значимость. Подробное описание изобретения Обнаружено, что в соответствии с настоящим изобретением зрелая форма внеклеточного домена человеческого CD164 (SEQ ID NO: 1) оказывает ингибирующее действие на клеточную экспрессию различных цитокинов (а именно, интерферона-, IL-2, IL-4, IL-5, IL-10 и TNF-) после стимуляции данных клеток такими веществами, как конканавалин А (ConA). Дальнейшие подтверждения терапевтической применимости данной белковой последовательности были получены на животных моделях болезней, на которых было показано, что растворимый белок обладает ценными биологическими свойствами in vivo,такими как сокращение миграции лимфоцитов или торможение специфичной для МВР (основного белка миелина) пролиферации Т-лимфоцитов. В известном уровне техники нет указаний на то, что внеклеточный домен человеческого CD164, который изолирован от остальной части молекулы в виде растворимого белка, имеет какое-либо влияние на экспрессию цитокинов или на любые другие явления, связанные с аутоиммунными и/или воспалительными болезнями. Главным объектом настоящего изобретения является применение растворимого белка, содержащего последовательность, которая по меньшей мере на 85% гомологична зрелой форме внеклеточного домена человеческого CD164 (SEQ ID NO: 1), для получения препарата для лечения и/или профилактики воспалительных или/и аутоиммунных нарушений. Среди растворимых белков, которые могут использоваться по настоящему изобретению, наиболее предпочтительными являются растворимые белки, которые представляют собой зрелую форму внеклеточного домена человеческого CD164 (SEQ ID NO: 1) или данную последнюю последовательность, слитую с сигнальной последовательностью человеческого CD164. Другими предпочтительными растворимыми белками, которые могут использоваться по настоящему изобретению, являются варианты SEQ ID NO: 1 в форме активных мутеинов или изоформ SEQ IDNO: 1. Изоформы человеческого CD164, имеющие по меньшей мере 85% гомологии со зрелой формой внеклеточного домена человеческого CD164 (SEQ ID NO: 1), известны в литературе (Chan Y.H. et al., JBiol Chem, 276: 2139-2152, 2001; fig. 1). Известно, что один из них, называемый MGC-24 (SEQ ID NO: 6),является растворимым, так как он лишен функционального трансмембранного домена, в то время как два других, называемые CD164-дельта 4 (SEQ ID NO: 4) и CD164-дельта 5 (SEQ ID NO: 5), по-прежнему сохраняют трансмембранный домен. Следовательно, зрелую форму внеклеточного домена данных последних изоформ, связанных с мембраной, можно считать применимой по данному изобретению. Под растворимыми белками в настоящем изобретении понимают белковые последовательности,не содержащие каких-либо последовательностей, обеспечивающих интеграцию в клеточную мембрану,таких как трансмембранный домен человеческого CD164 полной длины. Поэтому ожидается, что при экспрессии клетками данных растворимых белков, они будут локализоваться в клетках или предпочтительно секретироваться во внеклеточное пространство, если они слиты с сигнальной последовательностью. Растворимые белки, содержащие последовательность, которая по меньшей мере на 85% гомологична зрелой форме внеклеточного домена человеческого CD164 (SEQ ID NO: 1), известны в литературе(Lee Y.N. et al., Mol Cell Biol, 21: 7696-7706, 2001), но нет никаких указаний относительно какой-нибудь применимости для лечения и/или профилактики воспалительных и/или аутоиммунных нарушений. Растворимые белковые последовательности по настоящему изобретению, которые можно использовать для лечения и/или профилактики воспалительных и/или аутоиммунных нарушений, также отчетливо отличаются от любой другой человеческой последовательности, обладающей или предположительно обладающей подобными свойствами. В WO 02/098917 описан белок NOV25 (SEQ ID NO: 8; фиг. 1 В), содержащий последовательность,гомологичную на 80% зрелой форме внеклеточного домена человеческого CD164 (SEQ ID NO: 1), и предполагается, что он может быть применимым при ряде болезней, включая аутоиммунную болезнь. Однако данное применение только теоретическое и, кроме того, документ не в состоянии признать терапевтическую применимость растворимого фрагмента, который может быть отделен от потенциального внеклеточного домена данного белка, который согласно прогнозу локализован на клеточной мембране. В ЕР 1033401 описан белок (SEQ ID NO: 7582), содержащий последовательность, идентичную зрелой форме внеклеточного домена человеческого CD164 (SEQ ID NO: 7; фиг. 1 В). Несмотря на то, что там предлагается гипотетическое терапевтическое применение данного белка в медицине против болезни любой разновидности, в данном документе тоже не осознается терапевтическая пригодность растворимого фрагмента, который может быть отделен от потенциального внеклеточного домена данного белка. В качестве активного в настоящем изобретении определен любой вариант зрелой формы внекле-3 009389 точного домена человеческого CD164 (SEQ ID NO: 1), имеющий по меньшей мере 85% гомологии с данной последовательностью, которая согласно любому анализу, представленному в примерах, имеет сопоставимую или даже повышенную активность по сравнению с SEQ ID NO: 1, и она также должна считаться подходящей для любого из заявленных применений и способов. Под сопоставимой активностью подразумевается активность, измеренная в любом из описанных анализов для варианта растворимого белка, которая имеет, по меньшей мере, тот же самый порядок величины и предпочтительно составляет 75, 80, 85, 90, 95, 96, 97, 98, 99 или 100% и не больше чем 101,102, 103, 104, 105, 110, 115, 120 или 125% активности, измеренной при использовании растворимого белка, определенного SEQ ID NO: 1. Под повышенной активностью подразумевается активность, измеренная в любом из описанных анализов для варианта растворимого белка, которая составляет по меньшей мере 125, 130, 135, 140, 145,150%, 155, 160, 170, 180, 190, 200, 225, 250, 275, 300, 325, 350, 375, 400, 450 или 500% активности, измеренной при использовании растворимого белка, определенного SEQ ID NO: 1. Как используется здесь, термин мутеины относится к любой последовательности, имеющей по меньшей мере 85% гомологии со зрелой формой внеклеточного домена человеческого CD164 (SEQ IDNO: 1), которая может быть создана посредством вставки, делеции и/или замены одного и более аминокислотных остатков в SEQ ID NO: 1. Подобные активные мутеины могут быть природными, как мутеины, соответствующие ортологичному белку (т.е. кодируемому отличным от человеческого геном, который возник от общего с CD164 предка), или происходить от полиморфизмов в человеческом геноме. В случаях, где нуклеотидные замены приводят к замене одной и более аминокислот, предпочтительные растворимые белки включают те, которые сохраняют одно и более из противовоспалительных или/и антиаутоиммунных действий. Альтернативно последовательности являются синтетическими или искусственными, которые могут быть изготовлены посредством известного химического синтеза, технологии рекомбинантной ДНК, сайтнаправленного мутагенеза или любой другой известной методики, подходящей для этого, которая обеспечивает конечный набор в значительной степени соответствующих мутированных или укороченных пептидов или полипептидов, которые может в плановом порядке получить и проверить средний специалист в технике, использующий идеи, представленные в известном уровне техники и в примерах настоящего изобретения. Предпочтительные изменения в активных мутеинах широко известны как консервативные или безопасные замены. Консервативные аминокислотные замены представляют собой замены на аминокислоты, имеющие достаточно схожие химические свойства для сохранения строения и биологической функции молекулы. Ясно, что вставки и делеции аминокислот можно сделать в определенных выше последовательностях, не изменяя их функцию, особенно если вставки или делеции вовлекают только несколько аминокислот, например менее десяти и предпочтительно менее трех, и не удаляют или замещают аминокислоты, которые необходимы для функциональной конформации белка или пептида. В литературе представлено множество моделей, по которым может быть выполнен выбор консервативных замен аминокислот на основе статистических и физико-химических исследований последовательности и/или структуры природного белка (Rogov S.I. and Nekrasov A.N., Protein Eng, 14: 459-463,2001). Эксперименты с моделями белков показали, что использование определенных подклассов аминокислот может дать способные к приобретению конформации и активные белки, помогая в классификации синонимичных аминокислотных замен, которых легче приспособить к структуре белка (MurphyL.R. et al., Protein Eng, 13:14 9-52, 2000). Синонимичные аминокислотные группы и более предпочтительные синонимичные группы представляют собой те, которые определены в табл. 1. Альтернативно аминокислоты в растворимых белках по изобретению, которые необходимы для функции, можно также определить способами, известными в технике, такими как сайт-направленный мутагенез или аланин-сканирующий мутагенез (см., например, Cunningham, et al., Science, 244:1081-5,1989). Особо интересны замены заряженных аминокислот другими заряженными или нейтральными аминокислотами, которые могут дать белки с очень желаемыми улучшенными свойствами, такими как более слабая агрегация. Агрегация не только снижает активность, но и создает трудности при приготовлении фармацевтических или физиологически приемлемых композиций, потому что агрегаты могут быть иммуногенными (Cleland et al., Crit Rev Ther Drug Carrier Syst, 10: 307-77, 1993). Другие примеры производства аминокислотных замен в белках, которые могут использоваться для получения мутеинов растворимых белков для применения по настоящему изобретению, включают любые известные этапы способов, такие как представленные в американских патентах 4959314, 4588585 4737462, 5116943, 4965195; 4879111, 5017691 и 4904584. Альтернативно активный мутеин может явиться результатом изменений последовательности,уменьшающих иммуногенность упомянутого растворимого белка, когда он вводится млекопитающему. В литературе представлено много примеров по данным изменениям последовательности, которые могут быть разработаны и введены в данном объеме или для других функциональных оптимизаций, которые делают возможным безопасное и эффективное введение терапевтического белка, особенно когда он является белком не человека, не млекопитающего или не природным белком (Vasserot А.Р. et al., Drug DiscPharm Biotechnol, 3: 285-97, 2002; WO 03/104263; WO 03/006047; WO 02/98454; WO 02/96454; WO 02/79415; WO 02/79232; WO 02/66514; WO 01/40281; WO 98/52976; WO 96/40792; WO 94/11028). Ясно, что вставки и делеции аминокислот могут также быть сделаны в определенных выше последовательностях без изменения их функции, особенно, если вставки или делеции вовлекают только несколько аминокислот, например менее тридцати и предпочтительно менее десяти, и не удаляют или замещают аминокислоты, необходимые для функциональной конформации, например цистеин или пролин. Данные изменения могут происходить в N- или С-конце или в любом месте между данными крайними положениями, помещенном либо обособленно среди остатков в последовательности, либо в одной или более смежных группах в пределах последовательности. На практике вопрос о процентном соотношении гомологии какого-либо отдельного полипептида и зрелой формы внеклеточного домена человеческого CD164 (SEQ ID NO: 1) может быть определен, традиционно используя известные компьютерные программы. Такие алгоритмы и программы включают, но никоим образом не ограничиваются TBLASTN, BLASTP, FASTA, TFASTA и CLUSTALW (Pearson andAltschul et al., (1997) Nuc Acids Res 25:3389-3402; Altschul et al., (1993) Nature Genetics 3:266-272). В особенно предпочтительном варианте осуществления гомология белков и последовательностей нуклеиновых кислот оценивается с использованием Basic Local Alignment Search Tool (BLAST), которая хорошо известна в данной области техники (см., например, Karlin and Altschul (1990) Proc Natl Acad Sci USA 87(6):2264-8; Altschul et al., 1990, 1993, 1997, все выше). Программы BLAST определяют гомологичные последовательности посредством определения схожих сегментов, которые упоминаются здесь как пары сегментов с высокими показателями, у исследуемой последовательности аминокислот или нуклеиновых кислот и тестовой последовательности, которую предпочтительно получают из базы данных последовательностей белков или нуклеиновых кислот. Пары сегментов с высокими показателями предпочтительно идентифицируются (то есть выравниваются) посредством матрицы количественных показателей, многие из которых известны в технике. Предпочтительно используемая матрица количественных показателей представляет собой матрицу BLOSUM62 (см.Gonnet et al., (1992) Science 256(5062):1443-5; Henikoff and Henikoff (1993) Proteins 17(1):49-61). Менее предпочтительны, но также могут использоваться матрицы РАМ или РАМ 250 (см., например, Schwartzand Dayhoff, eds, (1978) Matrices for Detecting Distance Relationships: Atlas of Protein Sequence and Structure, Washington: National Biomedical Research Foundation). Программы BLAST оценивают статистическую значимость всех идентифицированных пар сегментов с высокими показателями и предпочтительно выбирают те сегменты, которые удовлетворяют указанному пользователем порогу значимости, такому как указанному пользователем процентному значению гомологии. Предпочтительно статистическую значимость пар сегментов с высокими показателями оценивают, используя формулу статистической значимости Karlin (см., например, Karlin and Altschul, (1990) Proc Natl Acad Sci USA 87(6):2264-8). Программы BLAST могут использоваться с параметрами по умолчанию или с измененными параметрами,введенными пользователем. Предпочтительно параметры являются параметрами по умолчанию. Предпочтительный способ определения лучшего общего совпадения исследуемой последовательности (последовательности по настоящему изобретению) с подчиненной последовательностью, также называемый общим выравниванием последовательности, может быть определен с использованием компьютерной программы FASTDB, основанной на алгоритме Brutlag и др. (1990) Сотр. Арр. Biosci. 6:237245. В выравнивании последовательности исследуемая и подчиненная последовательности обе представляют собой аминокислотные последовательности. Результат упомянутого общего выравнивания последовательностей выражается процентом идентичности. Предпочтительные параметры, используемые в выравнивании аминокислот FASTDB, следующие: Matrix=PAM 0, k-tuple=2, Mismatch Penalty=1, JoiningPenalty=20, Randomization Group=25, Length=0, Cutoff Score=1, Window Size= длине последовательности,Gap Penalty=5, Gap Size Penalty=0,05, Window Size=247 или длине исследуемой последовательности аминокислоты, что из них короче. Если подчиненная последовательность короче, чем исследуемая последовательность, из-за делеций в N- или С-конце, не из-за внутренних делеций, результаты в процентах идентичности должны быть вручную исправлены, поскольку программа FASTDB не отвечает за укорочения N- и C-конца подчиненной последовательности, когда вычисляет процент общей идентичности. Для подчиненных последовательностей, укороченных по N- и С-концам относительно исследуемой последовательности, процент идентичности исправляется посредством вычисления числа остатков исследуемой последовательности,которые являются N- и С-концами подчиненной последовательности, которые не соответствуют/выровнены с соответствующим подчиненным остатком, как процент полных оснований исследуемой последовательности. Подобран/выровнен ли остаток, определяется результатами FASTDB выравнивания последовательности. Данный процент затем вычитается из процента идентичности, вычисленной вышеупомянутой программой FASTDB с использованием указанных параметров, чтобы придти к окончатель-5 009389 ному показателю процента идентичности. Данный окончательный показатель процента идентичности является тем, что используется в целях настоящего изобретения. Только остатки N- и С-конца подчиненной последовательности, которые не соответствуют/выровнены с исследуемой последовательностью,рассматривают с целью ручной корректировки показателя процента идентичности. Таким образом, только аминокислотные остатки исследуемой последовательности вне самых дальних остатков N- и С-конца подчиненной последовательности. Например, подчиненная последовательность из 90 аминокислотных остатков выровнена с исследуемой последовательностью, чтобы определить процент индентичности. Делеция произошла в N-конце подчиненной последовательности, и следовательно, выравнивание FASTDB не соответствует/не выровнена с первым остатком с N-конца. 10 непарных остатков представляют 10% последовательности (число не соответствующих остатков N- и С-концов/общее число остатков в исследуемой последовательности),значит 10% вычитается из числа процентов идентичности, вычисленных программой FASTDB. Если оставшиеся 90 остатков будут точно соответствовать, окончательный процент идентичности будет равен 90%. В предпочтительных вариантах осуществления подвергшиеся посттрансляционной модификации формы растворимых белков, содержащих последовательность, которая по меньшей мере на 85% гомологична зрелой форме внеклеточного домена человеческого CD164 (SEQ ID NO: 1), могут использоваться для производства препарата для лечения и/или профилактики воспалительных или/и аутоиммунных нарушений. В частности, данные белки могут быть ацетилированием, амидированием, гликозилированы,фосфорилированы и/или миристоилированы. Известно, что человеческий CD164 модифицируется такими группами и ряд определенных положений может быть обозначен как сформулировано в SEQ ID NO: 1.a). Потенциальные участки N-гликозилирования располагаются на остатках 3, 9, 18, 49, 54, 71, 81,98 и 123;b). Потенциальные участки О-гликозилирования располагаются на остатках 11, 12, 17, 20, 21, 25, 26,31, 32, 89, 90, 92, 96, 99, 100, 104, 108, 110, 111, 112, 113, 115, 117, 118, 119, 121, 122, 125, 127, 129, 130,136;c). Потенциальные участки фосфорилирования цАМФ- и цГМФ-зависимыми протеинкиназами располагаются на остатках 134-137;d). Потенциальные участки фосфорилирования протеинкиназой С располагаются на остатках с 100 по 102 и с 112 по 114;e). Потенциальные участки фосфорилирования казеинкиназой II располагаются на остатках 73-76 и с 136 по 139;f). Потенциальный участок N-миристоилирования в sf-CD164 располагается на остатке 119. Очевидно, что такие модификации могут также присутствовать в соответствующих положениях гомологичных растворимых белков, определенных выше как идентифицированные выравниванием последовательности (фиг. 1). В дополнительном предпочтительном варианте осуществления растворимый белок, содержащий последовательность, которая по меньшей мере на 85% гомологична зрелой форме внеклеточного домена человеческого CD164 (SEQ ID NO: 1), является растворимым слитым белком. Данные растворимые составные белки могут быть получены при клонировании полинуклеотида,кодирующего растворимый белок, содержащий последовательность, которая по меньшей мере на 85% гомологична зрелой форме внеклеточного домена человеческого CD164 (SEQ ID NO: 1), в рамке кодирующих последовательностей для последовательности гетерологичного белка. Термин гетерологичный, если используется здесь, предназначен для обозначения любого полипептида, кроме человеческого полипептида CD164. Примеры гетерологичных последовательностей, которые можно включить в растворимые составные белки либо у N-, либо у С-конца, следующие: внеклеточные домены связанного с мембраной белка,константные области иммуноглобулинов (Fc-область), домены мультимеризации, домены внеклеточных белков, сигнальные последовательности, экспортные последовательности или последовательности, делающие возможной очистку афинной хроматографией. Многие из данных гетерологичных последовательностей коммерчески доступны в экспрессионных плазмидах, так как данные последовательности обычно включаются в составные белки, чтобы обеспечить дополнительные свойства без значительного ухудшения специфической биологической активности белка, полученного путем слияния с ними (Terpe K, Appl Microbiol Biotechnol, 60: 523-33, 2003). Примерами таких дополнительных свойств являются более длительное время полужизни в жидкостях организма, внеклеточная локализация или более легкая процедура очистки, что делается возможным благодаря участку гистидинов, формирующих так называемый гистидиновый таг (Gentz et al., Proc Natl Acad SciUSA, 86: 821-4, 1989) или НА таг - эпитоп, полученный из белка гемагглютинина гриппа (Wilson et al.,Cell, 37: 767-78, 1994). Если нужно, гетерологичная последовательность может быть удалена протеолитическим расщеплением, например посредством вставки участка протеолитического расщепления между растворимым белком и гетерологичной последовательностью, и подвергания очищенного растворимого-6 009389 составного белка действию подходящей протеазы. Данные особенности имеют особое значение для растворимых составных белков, так как они облегчают их производство и использование в приготовлении фармацевтических композиций. Например, растворимый белок, использованный в примерах (sf-CD164;SEQ ID NO: 2), был очищен посредством гексапептида гистидина, слитого с С-концом растворимогоCD164. Если растворимый слитый белок содержит область иммуноглобулина, слияние может быть прямым или через короткий пептид-линкер, который может быть коротким (1-3 аминокислотных остатка) или длинным, например длиной 13 аминокислотных остатков. Упомянутый линкер может быть трипептидом с последовательностью E-F-M (Glu-Phe-Met), например, или линкерной последовательностью из 13 аминокислот, состоящей из Glu-Phe-Gly-Ala-Gly-Leu-Val-Leu-Gly-Gly-Gln-Phe-Met, введенных между последовательностью веществ по изобретению и последовательностью иммуноглобулина. Полученный в результате слитый белок обладает улучшенными свойствами, такими как удлиненное время пребывания в жидкостях организма (полужизни), повышенная специфическая активность, повышенный уровень экспрессии или облегченная очистка составного белка. В предпочтительном варианте осуществления растворимый белок сливается с константной областью молекулы Ig. Предпочтительно слияние производится с областями тяжелых цепей, подобными СН 2 и СН 3 доменам человеческого IgG1, например. Другие изоформы молекул Ig тоже подходят для создания составных белков по настоящему изобретению, такие как изоформы IgG2 или IgG4, или другие классы Ig,подобные IgM или IgA, например. Составные белки могут быть мономерными или мультимерными, гетеро- или гомодимерными. В дополнительном предпочтительном варианте осуществления функциональное производное содержит по меньшей мере один остаток, прикрепленный к одной или более функциональным группам,которые встречаются в виде одной или более боковых цепей на аминокислотных остатках. Предпочтительно остаток является остатком полиэтилена (ПЭГ). ПЭГилирование может быть выполнено известными способами, такими как описанные в WO 99/55377, например. Растворимые белки и растворимые составные белки, содержащие последовательность, которая по меньшей мере на 85% гомологична зрелой форме внеклеточного домена человеческого CD164 (SEQ IDNO: 1), могут быть извлечены и выделены из жидкостей организма, клеток или тканей человека или млекопитающих, экспрессирующих их естественным путем. В частности, клетки, непосредственно выделенные или культивируемые, могут экспрессировать данные растворимые белки (естественным путем или после воздействия индуцирующиего вещества) и секретировать их. Способы очистки белков известны в технике и включают использование детергентов или разобщающих агентов, чтобы разрушить частицы,вслед за чем следует дифференциальная экстракция и разделение полипептидов ионообменной хроматографией, афинной хроматографией, осаждением в градиенте плотности и электрофорезом в геле. В общем, растворимые белки и растворимые составные белки могут быть приготовлены любой методикой, известной в технике, включая технологии, связанные с рекомбинантной ДНК, и химические технологии синтеза. Технологии рекомбинантной ДНК позволяют производить растворимые белки и растворимые составные белки, вначале создавая полинуклеотиды, кодирующие их. Данные нуклеиновые кислоты могут быть получены посредством ПЦР из геномной ДНК или, более эффективно, из вектора, содержащего полную последовательность человеческого CD164 (SEQ ID NO: 3) или любые другие релевантные гомологичные последовательности. Олигонуклеотидные праймеры, комплементарные желаемой последовательности, содержат последовательности рестрикционной эндонуклеазы, делающие возможным переваривание специфическими рестрикционными эндонуклеазами для дальнейшего клонирования, заботясь, чтобы гарантировать, что последовательность, кодирующая растворимый белок, позиционирована должным образом относительно поли-А сигнала и остальной части других последовательностей в экспрессионной плазмиде. Используя общие методики генной инженерии, данные полинуклеотиды могут клонироваться в воспроизводимом экспрессионном векторе вирусного или плазмидного происхождения, которые используются, чтобы трансформировать прокариотическую или эукариотическую клетку хозяина с использованием эписомальных или не-/гомологично интегрированных векторов, так же как методики, основанные на трансформации, инфекции, осаждении или трансфекции. Данные векторы должны делать возможной экспрессию рекомбинантных белков в прокариотической или эукариотической клетке хозяина под контролем их собственных транскрипционных последовательностей, регулирующих инициацию/терминирование, которые выбираются конституитивно активными или индуцибельными в упомянутой клетке. Клеточная линия, в значительной степени обогащенная такими клетками, затем может быть выделена, чтобы предоставить устойчивую клеточную линию, экспрессирующую интересующий белок. Во многих книгах и обзорах содержатся уроки того, как клонировать и производить рекомбинантные белки, используя векторы и прокариотические или эукариотические клетки-хозяева, в таких как некоторые книги из серии A Practical Approach, изданной Oxford University Press (DNA Cloning 2: Expression Systems, 1995; DNA Cloning 4: Mammalian Systems, 1996; Protein Expression, 1999; Protein-7 009389 Типичный экспрессионный вектор должен содержать:a) последовательности ДНК, кодирующие растворимый белок или растворимый слитый белок, содержащий последовательность, которая по меньшей мере на 85% гомологична зрелой форме внеклеточного домена человеческого CD164 (SEQ ID NO: 1); иb) экспрессионную кассету; где упомянутая последовательность (а) функционально связана с тканеспецифичным или конституитивным промотором, включенным в последовательность (b). Экспрессионный вектор является любым для экспрессионных систем из клеток млекопитающих,дрожжей, насекомых или бактерий, известных в технике. Коммерчески доступные векторы и экспрессионные системы поступают от ряда поставщиков, включая Genetics Institute (Кембридж, Массачусетс),Stratagene (Ла Джолла, Калифорния), Promega (Мэдисон, Висконсин) и Invitrogen (Сан Диего, Калифорния). Если желательно усилить экспрессию и облегчить приобретение надлежащей конформации белка,окружение кодона и конъюгацию кодона последовательности могут быть оптимизированы для конкретного экспрессионного организма, в который вводится экспрессионный вектор (патент США 5082767;Gustafsson С. et al., Trends Biotechnol, 22: 346-53, 2004). Факторы, важные при отборе конкретной плазмиды или вирусного вектора, включают легкость, с который клетки реципиента, которые содержат вектор, могут быть опознаны и отделены от тех клеток реципиента, которые не содержат вектор; количество копий вектора, которые желательны в конкретном хозяине; и желательно ли, чтобы вектор был в состоянии курсировать между клетками хозяев различных видов. Рекомбинантный вектор по изобретению включает, но не ограничивается, YAC (Yeast Artificial Chromosome - дрожжевой искусственной хромосомой), ВАС (Bacterial Artificial Chromosome бактериальной искусственной хромосомой), бактериофагом, фагмидой, космидой, плазмидой или даже линейной молекулой ДНК, которая может состоять из хромосомной, нехромосомной, полусинтетической или синтетической ДНК. Как правило, рекомбинантные экспрессионные векторы будут содержать точки инициации репликации, селектируемые маркеры, дающие возможность трансформации клетки хозяина, и промотор, полученный из высокоэкспрессированного гена, чтобы направить транскрипцию расположенной далее структурной последовательности. Гетерологичная структурная последовательность компонуется в подходящую фазу с последовательностями инициации трансляции и терминации и предпочтительно с лидерной последовательностью, способной направлять секрецию транслированного белка в периплазматическое пространство или внеклеточную среду. В конкретном варианте осуществления, в котором вектор адаптирован для трансфекции и экспрессии желаемых последовательностей в клетках млекопитающего,предпочтительные векторы будут содержать точку инициации репликации желаемого хозяина, подходящий промотор и энхансер, а также любые необходимые участки прикрепления рибосом, участки полиаденилирования, донорные и акцепторные участки сплайсинга, последовательности терминации транскрипции и 5'-фланкирующие нетранскрибируемые последовательности. Последовательности ДНК, полученные из вирусного генома SV40, например точка инициации репликации SV40, ранний промотор, энхансер, участки сплайсинга и полиаденилирования, могут использоваться, чтобы предоставить необходимые нетранскрибируемые генетические элементы. Подходящие промоторные участки, используемые в экспрессионных векторах по настоящему изобретению, выбираются, принимая во внимание клетки хозяина, в которых экспрессируется гетерологичный ген. Считается, что конкретный промотор, используемый для управления экспрессией интересующей последовательности нуклеиновых кислот, не важен, при условии, что он способен управлять экспрессией нуклеиновой кислоты в намеченной клетке. Таким образом, если целью является клетка человека, предпочтительно поместить участок, кодирующий нуклеиновую кислоту, рядом с и под контролем промотора, который способен экспрессироваться в клетке человека, такого как, например, промотор человека или вируса. Используемый промотор может быть конституитивным или индуцибельным. Подходящий промотор может быть гетерологичным относительно нуклеиновой кислоты, экспрессией которой он управляет, или альтернативно может быть эндогенным для природного полинуклеотида,содержащего кодирующую последовательность, которая экспрессируется. Кроме того, промотор, как правило, гетерологичен относительно рекомбинантных векторных последовательностей, в которые внедрена сконструированная промоторная/кодирующая последовательность. Промоторные участки могут быть выбраны из любого желаемого гена, используя, например, векторы CAT (хлорамфениколтрансферазы) и более предпочтительно векторы pKK232-8 и рСМ 7. Предпочтительными бактериальными промоторами являются промоторы РНК-полимеразы бактериофагов Lacl,LacZ, Т 3 или Т 7, промоторы gpt, лямбда PR, PL, MH и trp (ЕР 0036776), промотор полиэдрина или промотор белка р 10 из бакуловируса (Kit Novagen) (Smith et al., (1983) Mol Cell Biol 3(12):2156-65; O'Reilly etal., 1992), промотор лямбда PR или также trc промотор. Эукариотические промоторы включают непосредственный ранний CMV, тимидинкиназы HSV, ранний и поздний SV40, LTR из ретровируса и мышиного металлотионеина-L. Кроме того, могут выбираться промоторы, специфичные для конкретного типа клеток, такие как промоторы, облегчающие экспрессию в жировой ткани, мышечной ткани или печени. Выбор удобного вектора и промотора полностью относится к среднему уровню компетенции в тех-8 009389 нике. Если используется вставка кДНК, обычно желательно включить сигнал полиаденилирования, чтобы осуществить надлежащее полиаденилирование генного транскрипта. Считается, что природа сигнала полиаденилирования не является критической для успешного применения изобретения на практике, и любая такая последовательность может использоваться, такая как сигналы полиаденилирования человеческого гормона роста и SV40. Также в качестве элемента экспрессионной кассеты рассмотрен терминатор. Данные элементы могут служить, чтобы усилить уровни передачи сигнала и минимизировать сквозное прочитывание из кассеты в другие последовательности. Векторы могут также содержать дополнительные, некодирующие последовательности, включая,например, но не ограничиваясь некодирующими 5' и 3' последовательностями, векторной последовательностью, последовательностями, используемыми для очистки, в качестве зонда или затравки. Например, гетерологичные последовательности включают транскрибируемые, нетранслируемые последовательности, которые могут играть роль в транскрипции и процессинге мРНК, например, связывании рибосом и стабильности мРНК. Селектируемые маркеры придают клетке идентифицируемое изменение, позволяющее легко идентифицировать клетки, содержащие экспрессионную конструкцию. Гены селектируемого маркера для отбора трансформированных клеток хозяина предпочтительно являются генами дигидрофолатредуктазы или устойчивости к неомицину для эукариотической клеточной культуры, TRP1 для S. cerevisiae или устойчивости к тетрациклину, рифампицину или ампициллину для Е. coli или леван-сахаразы для микобактерий, последний маркер является маркером негативной селекции. В качестве показательного, но неограничивающего примера применимые экспрессионные векторы для использования у бактерий могут содержать селектируемый маркер и бактериальную точку инициации репликации, полученные из имеющихся в продаже плазмид, содержащих генетические элементыpBR322 (ATCC 37017). Такие коммерческие векторы включают, но не ограничиваются pKK223-3 (Pharmacia, Упсала, Швеция) и pGEM1 (Promega Biotec, Мэдисон, Висконсин, США). Специалистам в технике известно и коммерчески доступно большое количество других подходящих векторов, таких как следующие бактериальные векторы: pTrc-His, рЕТ 30-His, pQE70, pQE60, pQE-9(Stratagene); ptrc99a, pKK223-3, pKK233-3, pDR540, pRIT5 (Pharmacia); pWLNEO, pSV2CAT, pOG44,pXT1, pSG (Stratagene); pSVK3, pBPV, pMSG, pSVL (Pharmacia); pQE-30 (QIAexpress). Подходящим вектором для экспрессии полипептидов является бакуловирусный вектор, который может размножаться в клетках насекомых и клеточных линиях насекомых. Конкретной подходящей векторной системой хозяина является pVL1392/1393 бакуловирусный переносящий вектор (Pharmingen),который используется для трансфекции клеточной линии SF9 (ATCC NCRL 1711), которая получена изSpodoptera frugiperda. Специалистам в данной области техники известны дополнительные подходящие бакуловирусные векторы, например, FastBacHT. Другие векторы, подходящие для экспрессии глобулярного головного полипептида АРМ 1 в бакуловирусной экспрессионной системе, включают, но не ограничиваются описанными Chai и др. (1993; Biotechnol Appl Biochem. Dec;18 (Pt 3):259-73); Vlasak и др.(1983; Eur J Biochem Sep 1;135(1):123-6); и Lenhard и др. (1996; Gene Mar 9; 169(2): 187-90). Дополнительными подходящими векторами для экспрессии полипептидов являются векторы млекопитающих. Специалистам в данной области техники известен ряд подходящих векторных систем, например pcDNA4HisMax, pcDNA3.1Hygro-His и pcDNA3.1Hygro. Дополнительными подходящими векторами для экспрессии полипептидов являются вирусные векторы, такие как полученные из аденовируса. Предпочтительными аденовирусными векторами по изобретению являются описанные Feldman и Steg (1996; Semin Interv Cardiol 1 (3):203-8) или Ohno и др. (1994;Science 265(5173):781-4). Ретровирусные векторы и векторы, связанные с аденовирусами, как правило, считаются предпочтительными рекомбинантными системами доставки генов для передачи in vivo экзогенных полинуклеотидов, особенно млекопитающим, включая людей. Данные векторы обеспечивают эффективную доставку генов в клетки, и переданные нуклеиновые кислоты устойчиво интегрируются в хромосомную ДНК хозяина. Другая возможность экспрессировать полипептиды заключается в эндогенной активации генов посредством введения регулирующей последовательности в правильный локус генома с помощью гомологичной рекомбинации, таким образом, в функциональном связывании регулирующей последовательности с геном, экспрессию которого необходимо вызвать (WO 91/09955; WO 02/10372). Клетки хозяина могут быть либо прокариотическими, либо эукариотическими. Предпочтительны эукариотические хозяева, например клетки млекопитающего, такого как человек, обезьяна, мышь и клетки яичника китайского хомячка (СНО), потому что они обеспечивают посттрансляционные модификации белковых молекул, включая приобретение правильной конформации или гликозилирование в правильных участках. Также дрожжевые клетки могут выполнять посттрансляционные модификации пептида, включая гликозилирование. Существует множество методик рекомбинантной ДНК, в которых используются сильные промоторные последовательности и высокое число копий плазмид, которые могут-9 009389 использоваться для производства желаемых белков дрожжами. Дрожжи опознают лидерную последовательности в клонированных продуктах генов млекопитающих и секретируют пептиды, несущие лидерную последовательность (т.е. пропептиды). Предпочтительными клетками-хозяевами, используемыми в качестве реципиентов для экспрессии растворимых белков, являются следующие:b) эукариотические клетки-хозяева: клетки HeLa (ATCC NCCL2; NCCL2.1; NCCL2.2), клетки Cv 1 (ATCC NCCL70), клетки COS (ATCC NCRL1650; NCRL1651), клетки Sf-9 (ATCC NCRL1711),клетки С 127 (ATCC NCRL-1804), 3T3 (ATCC NCRL-6361), CHO (ATCC NCCL-61), человеческой почки 293 (ATCC N45504; NCRL-1573), BHK (ECACC N84100501; N84111301), клетки PLC, HepG2 и Нер 3 В. Для эукариотических хозяев (например, дрожжей, клеток насекомых или млекопитающих), могут использоваться различные последовательности, регулирующие транскрипцию и трансляцию, в зависимости от природы хозяина. Их можно получить из вирусных источников, таких как аденовирус, вирус коровьей папилломы, вирус обезьян или подобных, где регулирующие сигналы связаны с конкретным геном, который имеет высокий уровень экспрессии. Примерами является TK промотор вируса герпеса,ранний промотор SV40, промотор гена дрожжей gal4 и т.д. Из сигналов, регулирующих инициацию транскрипции, могут выбираться те, которые позволяют репрессию и активацию, так, чтобы экспрессию генов можно было модулировать. Клетки, которые были устойчиво трансформированы введенной ДНК,могут быть также отобраны путем введения одного или более маркеров, которые позволяют отбирать клетки-хозяева, содержащие экспрессионный вектор. Маркер может также обеспечивать фототрофию для ауксотрофного хозяина, устойчивость к биоцидам, например антибиотикам или тяжелым металлам,таким как медь или чему-либо подобному. Ген селектируемого маркера можно либо непосредственно связать с генными последовательностями ДНК, которые экспрессируются, либо ввести в такую же клетку котрансфекцией. Для оптимального синтеза белков по изобретению могут также потребоваться дополнительные элементы. Если нуклеиновая кислота, кодирующая растворимый белок, лишена метионина, который служит участком инициации, инициирующий метионин может быть введен вслед за первым кодоном нуклеиновой кислоты, используя обычные методики. Подобным образом, если вставка кДНК растворимого полипептида CD164 лишена поли-А сигнала, данная последовательность может быть добавлена к конструкции, например, путем вырезания поли-А сигнала из pSG5 (Stratagene), используя Bgll и Sail ферменты,рестрикционные эндонуклеазы, и включения ее в экспрессионный вектор млекопитающего pXT1(Stratagene). pXT1 содержит LTRs и часть гена gag из вируса лейкоза мышей Moloney. Положение LTRs в конструкции делает возможной эффективную устойчивую трансфекцию. Вектор содержит промотор тимидинкиназы простого герпеса и селектируемый ген неомицина. В зависимости от хозяина, используемого в технологическом процессе рекомбинантной продукции,полипептиды по настоящему изобретению могут быть гликозилированными или негликозилированными. Кроме того, растворимые белки могут также содержать начальный модифицированный остаток метионина, в некоторых случаях как результат процессов, опосредованных хозяином. Таким образом, в технике хорошо известно, что N-концевой метионин, кодируемый кодоном инициации трансляции, как правило, удаляется с высокой эффективностью из любого белка после трасляции во всех эукариотических клетках. Хотя N-концевой метионин в большинстве белков тоже эффективно удаляется у большинства прокариотов, для некоторых белков данный прокариотический процесс удаления неэффективен, в зависимости от природы аминокислоты, с которой N-концевой метионин ковалентно связан. Растворимые белки, учитывая их ограниченную длину, можно также создавать технологиями химического синтеза, например твердофазным синтезом и жидкофазным синтезом. При твердофазном синтезе, например, аминокислоту, соответствующую С-концу синтезируемого пептида, связывают с основой, которая нерастворима в органических растворителях и с помощью поочередного повторения реакций: реакции, в которой аминокислоты с их аминогруппами и функциональными группами боковой цепи, защищенные подходящими защитными группами, конденсируют одну за другой по порядку от Сконца до N-конца; и реакции, в которой аминокислоты, связанные со смолой или защитными группами для аминогрупп пептидов, высвобождаются, таким образом, пептидная цепь удлиняется. Способы твердофазного синтеза в основном разделяются на способ tBoc и способ Fmoc, в зависимости от типа используемой защитной группы. Обычно используемые защитные группы включают tBoctBu (т-бутил) для гидроксильных групп. После синтеза желаемого пептида, его подвергают реакции удаления защитных групп и отделяют от твердой основы. Такая реакция отделения пептида может быть вы- 10009389 полнена с фтористым водородом или трифторметансульфоновой кислотой для способа Boc и с ТФУ для метода Fmoc. Полностью синтетические белки с длиной, сопоставимой с белками по изобретению, описаны в литературе (Brown A. et al., J Pept Sci 2 :40-46, 1996; Muir T.W., Annu Rev Biochem, 72:249-89,2003; Casi G. and Hilvert D., Curr Opin Struct Biol, 13: 589-94, 2003). Химический синтез растворимых белков позволяет расширить природный набор структуры и функции белков посредством использования синтетических аминокислот (Anthony-Cahill S.J. andMagliery T.J., Curr Pharm Biotechnol, 3: 285-97, 2002). Данные молекулы можно разрабатывать на последовательности и/или структуре растворимых белков, чтобы выбрать остатки, которые можно химически изменить на уровне боковых цепей аминокислот, хиральности аминокислот и/или пептидного каркаса, а затем улучшать релевантные свойства, такие как активность, легкость очистки, период полужизни. Предпочтительные альтернативные синонимичные группы для аминокислот, которые будут включены, определены в табл. II. Способы синтеза и разработки данных соединений хорошо известны в техникеDevel, 4:428-34, 2001; Villain M. et al., Chem Biol, 8: 673-9, 2001, WO 02/10195). Различная методология для включения синтетических аминокислот в белки, используя системы для трансляции как in vitro, такin vivo, чтобы исследовать и/или улучшить белковую структуру и функцию, тоже описана в литературе(Dougherty D.A., Curr Opin Chem Bio, 4: 645-52, 2000). Очистка синтетических или рекомбинантных растворимых белков, которые могут применяться по изобретению, может быть выполнена любым из способов, известных для этой цели, то есть любой общепринятой операцией, включая осаждение, хроматографию (анионо- или катионообменную хроматографию, хроматографии на фосфате целлюлозы, гидрофобную хроматографию, афинную хроматографию,хроматографию на гидроксиапатите и хроматографию на лектине), электрофорез, дифференциальную экстракцию, высаливание, центрифугирование или тому подобное. Ряд способов очистки белка см., например, в Methods in Enzymology. Процедура очистки, которая может предпочтительно использоваться, является афинной хроматографией с использованием моноклональных антител или любых других химических групп, которые связывают целевой белок (непосредственно растворимый CD164 или, если он является растворимым слитым белком, гетерологичную последовательность, такую как гистидиновый таг) с достаточным сродством и специфичностью. Связывающие группы создаются и иммобилизируются на гелевой матрице, заключенной в колонку. Загрязненные препараты, содержащие белки, пропускают через колонку. Растворимый белок свяжется с колонкой благодаря сродству, в то время как примеси пройдут. После вымывания оставшихся примесей растворимый белок можно элюировать с геля посредством изменения pH или ионной силы. Альтернативно может использоваться ВЭЖХ (высокоэффективная жидкостная хроматография). Элюирование можно вести, используя растворитель на основе воды и ацетонитрила, обычно используемый для очистки белков. Альтернативно растворимые белки можно выделить из молока трансгенных животных, экспрессирующих растворимые белки, используя любой из большого числа способов, описаных в литературе (Protein Purification Applications, A Practical Approach (New Edition), Edited by Simon Roe, AEA TechnologyProducts and Systems, Biosciences, Harwell; Clark (1998) J Mammary Gland Biol Neoplasia 3:337-50; патент США 6140552). Растворимый белок, содержащий последовательность, которая по меньшей мере на 85% гомологична зрелой форме внеклеточного домена человеческого CD164 (SEQ ID NO: 1), может быть произведен, из него может быть приготовлен препарат и введен, или его можно генетически использовать для производства препарата для лечения и/или профилактики воспалительных или/и аутоиммунных нарушений в качестве активного производного, устойчивой к протеолизу модифицированной формы, конъюгата, комплекса, фракции, предшественника и/или соли. Термин производные, как используется здесь, относится к производным, которые могут быть приготовлены из функциональных групп, представленных на боковых цепях остатков аминокислот или на N- или С-концевых группах, согласно известным способам. Такие производные включают, например,сложные эфиры или алифатические амиды карбоксильных групп и N-ацильные производные свободных аминогрупп или О-ацильные производные свободных гидроксильных групп, и образуются с ацильными группами, например, алканоильными или ароильными группами. Термин фракция относится к любому фрагменту полипептидной цепи самого соединения, одного или в комбинации со связанными молекулами или остатками, связанными с ним, например, остатками сахаров или фосфатов, или агрегатов первоначального полипептида или пептида. Такие молекулы могут также получаться вследствие других модификаций, которые обычно не изменяют первичную последовательность, например химического получения производных пептидов in vivo или in vitro (ацетилирования или карбоксилирования), сделанных посредством изменения характера фосфорилирования (введения остатков фосфотирозина, фосфосерина или фосфотреонина) или гликозилирования (путем подвергания пептида действию ферментов, которые влияют на гликозилирование, например гликозилирующих или дегликозилирующих ферментов млекопитающих) пептида во время его синтеза и процессинга или дальнейших этапов процессинга.- 11009389 Предшественники представляют собой соединения, которые могут быть преобразованы в соединения по настоящему изобретению посредством метаболического и ферментативного процессинга до или после введения в клетки или в организм. Термин соли здесь относится и к солям карбоксильных групп, и к солям присоединения кислоты аминогрупп пептидов, полипептидов или их аналогов по настоящему изобретению. Соли карбоксильной группы могут быть образованы способами, известными в технике, и включают неорганические соли, например соли натрия, кальция, аммония, железа или цинка, и соли с органическими основаниями, как те,которые образованы, например, с аминами, такими как триэтаноламин, аргинин или лизин, пиперидин,новокаин и т.п. Соли присоединения кислоты включают, например, соли с неорганическими кислотами,такими как, например, хлористо-водородная кислота или серная кислота, и соли с органическими кислотами, такими как, например, уксусная кислота или щавелевая кислота. Любые из таких солей должны иметь, по существу, активность, подобную таковой пептидов и полипептидов по изобретению или их аналогов. Конъюгат или комплекс может быть образован с молекулой, выбранной из радиоактивных меток,биотина, флюоресцентных меток, цитотоксических средств, средств доставки препаратов. Данные конъюгаты или комплексы могут быть образованы при использовании молекул и способов, известных в технике, например, позволяющих обнаружить взаимодействие с другими белками (радиоактивные или флюоресцентные метки, биотин), улучшающих терапевтическую эффективность (цитотоксические средства) или улучшающих эффективность доставки препарата, используя полимеры, такие как полиэтиленгликоль и другие природные или синтетические полимеры (Pillai О. and Panchagnula R., Curr Opin ChemBiol, 5:447-451, 2001). Полимер может иметь любую молекулярную массу и может быть разветвленным или неразветвленным. Для полиэтиленгликоля предпочтительная молекулярная масса составляет от приблизительно 1 до приблизительно 100 кДа (термин приблизительно показывает, что в препаратах полиэтиленгликоля некоторые молекулы будут иметь большую, некоторые меньшую молекулярную массу, чем заявленная) для удобства в обращении и производстве. Могут использоваться другие размеры, в зависимости от желаемого терапевтического профиля (например, продолжительности желаемого непрерывного высвобождения, влияний, если таковые имеются, на биологическую активность, удобства в обращении, степени или отсутствия антигенности и других известных влияний полиэтиленгликоля на терапевтический белок или аналог). Молекулы полиэтиленгликоля (или другие химические остатки) должны быть присоединены к полипептиду с учетом влияний на функциональные или антигенные домены полипептида. Существует множество способов присоединения, доступных для специалистов в данной области техники, например,по ЕР 0401384, включенному сюда посредством ссылки (связывание ПЭГ с Г-КСФ), см. также Malik et al.(1992) Exp Hematol 20(8): 1028-35, сообщивших о ПЭГилировании ГМ-КСФ с использованием трезилхлорида. Например, полиэтиленгликоль может быть ковалентно связан через аминокислотные остатки посредством реакционноспособной группы, такой как свободная аминогруппа или карбоксильная группа. Реакционноспособными группами являются те, с которыми может быть связана активизированная молекула полиэтиленгликоля. Аминокислотные остатки, имеющие свободную аминогруппу, могут включать остатки лизина и N-концевые аминокислотные остатки; остатки, имеющие свободную карбоксильную группу, могут включать остатки аспарагиновой кислоты, остатки глутаминовой кислоты и Сконцевые аминокислотные остатки. Сульфгидрильные группы тоже могут использоваться в качестве реакционноспособных групп для присоединения молекул полиэтиленгликоля. Предпочтительным для терапевтических целей является присоединение к аминогруппе, такое как присоединение к N-концу или группе лизина. Полипептид, устойчивый к протеолизу, может быть создан посредством замены пептидной связи-CONH- одним или более из следующего: (CH2NH) восстановленной связью; (NHCO) обратной обращенной связью; (СН 2-O) метиленокси связью; (CH2-S) тиометиленовой связью; а (СН 2 СН 2) углеродной связью; (CO-СН 2) цетометиленовой связью; (CHOH-СН 2) гидроксиэтиленовой связью; (N-N) связью; Еалкеновой связью; или -СН=СН-связью. Таким образом, изобретение также охватывает растворимыйCD164 или вариант его, в котором по меньшей мере одна пептидная связь была изменена как описано выше. Кроме того, аминокислоты в организме обладают хиральностьстью или L, или D. В некоторых вариантах осуществления предпочтительно изменить хиральность аминокислот, чтобы удлинить период полужизни в организме. Таким образом, в некоторых вариантах осуществления одна или более аминокислот предпочтительно находятся в конфигурации L. В других вариантах осуществления одна или более аминокислот предпочтительно находятся в конфигурации D. Терапевтические применения полипептидов по изобретению и имеющих к ним отношение реагентов могут быть оценены (с точки зрения безопасности, фармакокинетиках и эффективности) посредством анализов in vivo или in vitro, использующих клетки, ткани животных и животные модели, позволяющие обнаружить ингибирование выделения и/или экспрессии цитокинов, а также анализов in vivo или in vitro,таких как ингибирование миграции клеток. Дальнейшее исследование биологических и терапевтических действий, описываемых в настоящем изобретении, может быть получено путем применения различных- 12009389 технологий молекулярной биологии, таких как двумерного гель-электрофореза или интерференции РНК. Один конкретный вариант осуществления для способа in vivo доставки растворимого белка во внутреннее пространство клетки позвоночного включает этап введения препарата, содержащего физиологически приемлемый носитель и голый полинуклеотид, функционально кодирующий интересующий полипептид в интерстициальное пространство ткани, включающее клетку, посредством чего голый полинуклеотид перемещается во внутреннее пространство клетки и оказывает физиологическое действие. Это особенно применимо для передачи in vitro, но может быть применено и in vivo. Полинуклеотидная последовательность, кодирующая растворимый белок, содержащий последовательность, которая по меньшей мере на 85% гомологична зрелой форме внеклеточного домена человеческого CD164 (SEQ ID NO: 1), может использоваться для производства препарата для лечения и/или профилактики воспалительных или/и аутоиммунных нарушений. Данные полинуклеотиды также могут использоваться для создания отличных от человека животных и растений, которые экспрессируют рекомбинантные полипептиды CD164. Животные или растения могут быть трансгенными, то есть каждая из их клеток содержит ген, кодирующий полипептид CD164, или альтернативно полинуклеотид, кодирующий полипептид, может быть введен в соматические клетки животного или растения, например в секреторные эпителиальные клетки молочных желез млекопитающего. В предпочтительных вариантах осуществления отличное от человека животное является млекопитающим, таким как корова, овца, коза, свинья или кролик. Способы создания трансгенных животных, таких как млекопитающие, известны специалистам в технике, и любой такой способ может применяться в настоящем изобретении. Кроме того, могут быть созданы трансгенные млекопитающие, которые секретируют рекомбинантные растворимые полипептиды белков в свое молоко. Как правило, кодируемый полипептид будет содержать сигнальную последовательность, чтобы обеспечить секрецию белка в молоко. Композиции для использования in vitro и in vivo, содержащие голый полинуклеотид, описаны в известном уровне техники (WO 90/11092; WO 95/11307; Tascon et al., Nature Medicine 2: 888-892, 1996). Еще в одном варианте осуществления изобретения к передаче голого полинуклеотида в клетки можно приступить посредством бомбардировки частицами (биолистики), упомянутые частицы представляют собой покрытые ДНК микроснаряды, разогнанные до высокой скорости, позволяющей им пробивать клеточные мембраны и проникать в клетки, не уничтожая их, так как описано Klein et al. 1990) CurrGenet Feb; 17(2):97-103). В дополнительном варианте осуществления полинуклеотид по изобретению может быть заключен в липосому (Ghosh and Bacchawat, (1991) Targeted Diagn Ther 4:87-103; Wong et al.,(1980) Gene 10:87-94; Nicolau et al. (1987), Methods Enzymol 149:157-76). Данные липосомы могут в дальнейшем нацеливаться на клетки, экспрессирующие LSR посредством включения лептина, триглицеридов, ACRP30 или других известных лигандов LSR в липосомную мембрану. Количество вектора, вводимого в организм желаемого хозяина посредством инъекции, меняется в зависимости от места инъекции. В качестве показательной дозы будет вводиться от 0,1 до 100 мкг вектора в организм животного, предпочтительно организм млекопитающего, например организм мыши. В другом варианте осуществления вектора по изобретению, он может вводиться in vitro в клетку-хозяин, предпочтительно в клетку-хозяин,ранее взятую у животного, которое будут лечить, и более предпочтительно соматическую клетку, такую как мышечную клетку. На следующем этапе клетка, которая была трансформирована вектором, кодирующим желаемый полипептид CD164 или желаемый его фрагмент, повторно вводится в организм животного, чтобы доставить рекомбинантный белок в пределах организма или местно, или системно. Для введения in vivo полинуклеотиды могут применяться в любой подходящей композиции, в любом диапазоне концентраций (например, 1-500 мкг/мл, предпочтительно 50-100 мкг/мл), в любом объеме(например 1-100 мл, предпочтительно 1-20 мл) и могут применяться любое число раз (например, 1, 2, 3, 5 или 10 раз), с любой частотой (например, каждый 1-й, 2-й, 3-й, 5-й, 10-й день или любое количество дней). Подходящие концентрации, частоты, способы введения и т.д. будут зависеть от конкретного полинуклеотида, вектора, животного и т.д. и могут быть легко определены специалистом в данной области техники. Растворимый белок, содержащий последовательность, которая по меньшей мере на 85% гомологична зрелой форме внеклеточного домена человеческого CD164 (SEQ ID NO: 1), способен ингибировать провоспалительную и/или связанную с иммунитетом экспрессию цитокинов, и, таким образом, предотвращать и/или лечить воспалительные и/или аутоиммунные нарушения. Главная функция иммунной системы заключается в защите индивидуума от инфекции, вызванной чужеродными захватчиками, такими как микроорганизмы; может случиться, что иммунная система атакует собственные ткани индивидуума, приводя к патологическим состояниям, известным как аутоиммунные болезни, которые часто связаны с воспалительными процессами. В частности, CD4+ Тлимфоциты могут быть отнесены к двум различным субпопуляциям, называемым Т-хелперами типа 1(Th1) и Т-хелперами типа 2 (Th2) на основании отличающихся и неперекрывающихся особенностей экспрессии цитокинов. Th1 характеризуются секрецией IL-2, интерферона-, IL-12 и TNF-, а Th2 - секрецией IL-4, IL-5, IL-9, IL-10 и IL-13. Однако эти субпопуляции нестрогие, поскольку INF- и IL-10 могут подавлять влияния, связанные с Th1, так же как реакции Th2, а IL-4 и IL-13 также способны активизиро- 13009389 вать продукцию IL-12, таким образом активизируя Th1 и потенциально ингибируя реакции Th2. Тлимфоциты Th1 способны опосредовать активацию макрофагов и гиперчувствительность замедленного типа (ГЗТ), давая начало провоспалительным или клеточным иммунным ответам, тогда как Тлимфоциты Th2 активируют секрецию IgG1 и IgE, приводящую к реакциям гиперчувствительности немедленного типа (гуморальному иммунитету; стимулируют реакции, опосредованные антителами, активизируют тучные клетки и вызывают тканевую эозинофилию). Th1 являются главной особенностью патогенеза болезней, подобных ревматоидному артриту, саркоидозу и туберкулезу, тогда как Th2 вовлечены в аллергию, противопаразитарные реакции и в астматические дыхательные пути (например, роль в фиброзе). Неограничивающий список расстройств, при которых может применяться препарат или фармацевтическая композиция, содержащая растворимый белок, содержащий последовательность, которая по меньшей мере на 85% гомологична зрелой форме внеклеточного домена человеческого CD164 (SEQ IDNO: 1), включает рассеянный склероз, системную красную волчанку, ревматоидный артрит, ювенильный идиопатический артрит, псориатический артрит, остеоартрит, спондилоартропатии, воспалительные заболевания кишечника, эндотоксинемию, болезнь Крона, болезнь Стилла, увеит, гранулематоз Вегенера,болезнь Бехчета, склеродермию, синдром Шегрена, саркоидоз, гангренозную пиодермию, полимиозит,дерматомиозит, миокардит, псориаз, системную склеродермию, гепатит С, аллергии, аллергическое воспаление, аллергическое воспаление дыхательных путей, хроническую обструктивную болезнь легких(ХОБЛ), инфаркт кишечника, инсульт, неспецифический язвенный колит, аллергическую астму, бронхиальную астму, фиброз, постишемическое воспаление мышцы, почки и сердца, воспаление кожи, гломерулонефрит, ювенильный сахарный диабет типа I, болезни гиперчувствительности, вирусные или острые болезни печени, алкогольную печеночную недостаточность, туберкулез, септический шок, ВИЧинфекцию, реакцию трансплантат против хозяина (GVHD) и атеросклероз. Ревматоидный артрит является болезнью, отличающейся симптомами воспаления суставов. Системная красная волчанка (СКВ) характеризуется красными шелушащимися бляшками на коже и нарушением функции почек на поздней стадии болезни и вызывается воспалительными реакциями, которые вызываются отложением иммунных комплексов в кровеносных сосудах, особенно почечных. Рассеянный склероз является болезнью человека, характеризующейся рецидивированием, воспалительными условиями, которые могут вызвать слабость, тремор тела и, в крайних случаях, паралич, и вызывается атакой иммунной системы на защитный миелиновый футляр, окружающий периферические нервные клетки. Аллергическое воспаление согласуется с основанной на Th2-лимфоцитах этиологией аллергической болезни. Например, дефектное примирование Th2-лимфоцитов в отсутствии IL-4 приводит к неспособности порождать аллергические воспалительные реакции вслед за последующим воздействием аллергена на дыхательные пути. Показано, что IL-5 и IL-13 более непосредственно ответственны за характерные эозинофильные инфильтраты и гиперсекрецию слизи. Считается, что при рассеянном склерозе прогрессированию болезни способствуют опосредованныеTh1 иммунные реакции, в то время как считается, что опосредованные Th2 иммунные реакции оказывают ослабляющее действие на прогрессирование болезни. Показано, что Т-лимфоциты, экспрессирующиеIL-10, подавляют экспериментальный аутоиммунный энцефаломиелит (ЕАЕ), крысиную модель рассеянного склероза. Было предположено, что за индукцию ЕАЕ отвечает TNF- (TNF- может секретироваться культурой как Th1, так и Th2). Системная красная волчанка (СКВ) человека, как полагают, управляется реакцией Th2. Однако было показано, что INF- оказывает основное влияние на прогрессирование болезни на мышиной модели,тогда как IL-4, как ожидают, опосредует поддерживание болезни. Миокардит определяется воспалением мышцы сердца и, как считается, опосредуется аутоиммунной реакцией на специфический сердечный антиген после острой инфекции верхних дыхательных путей. Тяжесть экспериментального аутоиммунного миокардита (ЕАМ) на мышиной модели уменьшается введением антител к IL-4, что указывает на роль IL-4 в прогрессировании болезни. Дополнительным вариантом осуществления изобретения является способ ингибирования экспрессии одного или более цитокинов у индивидуума, включающий введение упомянутому индивидууму композиции, содержащей растворимый белок, содержащий последовательность, которая по меньшей мере на 85% гомологична зрелой форме внеклеточного домена человеческого CD164 (SEQ ID NO: 1). Цитокин может быть TNF-, INF-, IL-2, IL-4, IL-5 или IL-10. Данные способы включают предоставление или введение индивидуумам, нуждающимся в этом, упомянутой фармацевтической или физиологически приемлемой композиции, которая описана ниже, и могут рассматриваться как способы профилактики и/или лечения воспаления и/или аутоиммунных нарушений. Еще один вариант осуществления настоящего изобретения представлен фармацевтическими композициями, содержащими растворимый белок, содержащий последовательность, которая по меньшей мере на 85% гомологична зрелой форме внеклеточного домена человеческого CD164 (SEQ ID NO: 1), в присутствии одного или более фармацевтически приемлемых наполнителей, для лечения воспаления и/или аутоиммунных нарушений. Данные композиции могут дополнительно содержать дополнительный им- 14009389 мунодепрессант или противовоспалительное вещество. Альтернативно фармацевтические композиции,содержащие растворимый белок, могут быть комбинированы в коктейль для использования в различных режимах лечения. Фармацевтические композиции по изобретению могут также содержать любые подходящие фармацевтически приемлемые носители, биологически совместимые растворители и добавки, которые подходят для введения животному (например, физиологический раствор) и, в конечном счете, содержат вспомогательные средства (подобные наполнителям, стабилизаторам или разбавителям), которые облегчают переработку активных веществ в препараты, которые могут использоваться фармацевтически. Фармацевтические композиции могут быть приготовлены любым приемлемым способом, отвечающим потребностям способа введения. Например, использование биоматериалов и других полимеров для доставки препарата, также как различных методик и моделей, чтобы обосновать определенный способ введения,описано в литературе (Cleland J.L. et al., Curr Opin Biotechnol, 12: 212-9, 2001; Luo В. and Prestwich G.D.,Exp Opin Ther Patents, 11:1395-1410, 2001). Подразумевается, что фармацевтически приемлемый охватывает любой носитель, который не нарушает эффективности биологической активности активного ингредиента и не токсичен для хозяина,которому вводится. Например, для парентерального введения из вышеупомянутых активных ингредиентов может быть приготовлена дозированная лекарственная форма для инъекции в растворителях, таких как солевой раствор, раствор глюкозы, сывороточный альбумин и раствор Рингера. Любой принятый способ введения может использоваться и определяться специалистами в данной области техники, чтобы создать желаемые уровни активных ингредиентов в крови. Например, введение может осуществляться различными парентеральными путями, такими как подкожный, внутривенный,эпидуральный, местный, внутрикожный, интратекальный, прямой внутрижелудочковый, интраперитонеальный, чрескожный (например, в препаратах с медленным высвобождением), внутримышечный, интраперитонеальный, интраназальный, интрапульмональный (путем вдыхания), внутриглазной, пероральный или буккальный пути. Парентеральное введение может быть струйной инъекцией или постепенной перфузией в течение длительного времени. Другие особенно предпочтительные пути введения представляют собой аэрозольные и депо-препараты. Пролонгированные лекарственные формы, особенно депо-формы изобретенных препаратов, рассматриваются специально. Препараты для парентерального введения включают стерильные водные или неводные растворы,суспензии и эмульсии, которые могут содержать вспомогательные средства или наполнители, известные в технике, и могут быть приготовлены обычными способами. Кроме того, суспензии активных соединений могут вводиться в виде подходящих масляных суспензий для инъекций. Подходящие липофильные растворители или носители включают жирные масла, например кунжутное масло, или синтетические сложные эфиры жирных кислот, например этилолеат или триглицериды. Водные суспензии для инъекций, которые могут содержать вещества, увеличивающие вязкость суспензии, включают, например, натрий карбоксиметилцеллюлозу, сорбит и/или декстран. Необязательно суспензия может также содержать стабилизаторы. Фармацевтические композиции включают подходящие растворы для инъекционного введения и содержат приблизительно от 0,01 до 99%, предпочтительно приблизительно от 20 до 75% активного соединения вместе с инертным наполнителем. Композиции, которые могут вводиться ректально, включают суппозитории. Для парентерального (например, внутривенного, подкожного, внутримышечного) введения, из активного(ных) белка(ков) может быть приготовлен раствор, суспензия, эмульсия или лиофилизованный порошок в сочетании с фармацевтически приемлемым парентеральным растворителем (например, водой,солевым раствором, раствором глюкозы) и добавками, которые поддерживают изотоничность (например,маннит) или химическую стойкость (например, консерванты и буфера). Композиция стерилизуется обычно используемыми методиками. Для чресслизистого введения в композиции используются смачивающие вещества, соответствующие барьеру, через который она будет проникать. Такие смачивающие вещества общеизвестны в технике. Фармацевтически или физиологически приемлемые препараты, которые могут приниматься перорально, включают капсулы с крышечкой, сделанные из желатина, так же как мягкие герметизированные капсулы, сделанных из желатина и пластификатора, такого как глицерин или сорбит. Капсулы с крышечкой могут содержать активные ингредиенты в смеси с наполнителями, такими как лактоза, связующими,такими как крахмал, и/или смазками, такими как тальк или стеарат магния, и, необязательно, стабилизаторами. В мягких капсулах активные соединения могут быть растворены или взвешены в подходящих жидкостях, таких как жирные масла, вазелиновое масло или жидкие полиэтиленгликоли. Кроме того,могут быть добавлены стабилизаторы. Все композиции для перорального приема должны быть в дозах,подходящих для такого введения. Для буккального введения композиции могут принимать форму таблеток или лепешек, приготовленных обычным образом. Для введения путем ингаляции соединения для использования по настоящему изобретению удобно вводить в форме подачи аэрозоля из находящихся под давлением упаковок или распылителя с использованием газообразного вытеснителя, например диоксида углерода. В случае находя- 15009389 щегося под давлением аэрозоля единица дозы может быть определена путем введения клапана, выпускающего отмеренное количество. Капсулы и картриджи, например, из желатина, для использования в ингаляторе или инсуффляторе, могут быть приготовлены содержащими порошкообразную смесь соединения и подходящей порошковой основы, такой как лактоза или крахмал. Из соединений может быть приготовлена лекарственная форма для парентерального введения посредством инъекции, например струйной инъекции или непрерывной инфузии. Композиции для инъекций могут быть представлены в дозированной лекарственной форме, например, в ампулах или в емкостях со многими дозами, с добавленным консервантом. Композиции могут принимать такие формы, как суспензии, растворы или эмульсии в водных растворах, и могут содержать вспомогательные средства,такие как суспендирующие, стабилизирующие и/или диспергирующие вещества. Альтернативно активный ингредиент может находиться в порошке или лиофилизованной форме для объединения с подходящим растворителем, таким как стерильная апирогенная вода, перед использованием. В дополнение к композициям, описанным ранее, из соединений также может быть приготовлен депо-препарат. Такие длительно действующие композиции могут вводиться имплантацией (например, подкожно или внутримышечно) или внутримышечной инъекцией. Таким образом, например, из соединений может быть приготовлена лекарственная форма с подходящими полимерными или гидрофобными материалами (например, в виде эмульсии в приемлемом масле) или ионообменными смолами, или в виде труднорастворимых производных, например в виде труднорастворимой соли. Кроме того, соединения могут вводиться с использованием системы длительного высвобождения, такой как полупроницаемые матрицы из твердых гидрофобных полимеров, содержащих терапевтическое средство. Различные материалы длительного высвобождения были установлены и хорошо известны специалистам в данной области техники. Капсулы длительного высвобождения в зависимости от их химической природы могут высвобождать соединения в течение от нескольких недель до более чем 100 дней. Понятно, что вводимая доза будет зависеть от возраста, пола, здоровья и массы реципиента, вида сопутствующего лечения, если таковое имеется, частоты лечения и природы желаемого эффекта. Доза будет подбираться для отдельного субъекта, как это понимается и определяется специалистом в данной области. Общая доза, требуемая для каждого лечения, может вводиться в виде множества доз или одной дозы. Фармацевтическая композиция по настоящему изобретению может вводиться изолированно или в сочетании с другими терапевтическими средствами, направленными против состояния или направленными против других симптомов состояния. Обычно суточная доза активного ингредиента будет заключаться между 0,01 и 100 мг на килограмм массы тела или более. Обычно от 1 до 40 мг на килограмм в сутки, назначенные в разделенных дозах или в пролонгированной форме, эффективны для получения желаемых результатов. Второе или последующие введения могут быть выполнены в дозе, такой же,меньше или больше начальной или предыдущей дозы, введенной индивидууму. Эффективное количество относится к количеству активных ингредиентов, которое является достаточным, чтобы повлиять на течение и тяжесть болезни, приводя к ослаблению или ремиссии такой патологии. Эффективное количество будет зависеть от пути введения и состояния больного. Интервалы доз также можно определить, используя значение минимальной эффективной концентрации. Соединения должны применяться, используя режим, который поддерживает плазменные уровни выше минимальной эффективной концентрации в течение 10-90% времени, предпочтительно от 30 до 90% и наиболее предпочтительно от 50 до 90%. В случаях местного введения или селективного поглощения эффективная местная концентрация препарата может быть не связанной с плазменной концентрацией. Количество вводимой композиции будет, конечно, зависеть от субъекта, которого будут лечить, от массы субъекта, тяжести поражения, способа введения и мнения прописывающего врача. Доза, вводимая в виде единственной дозы или множественных доз индивидууму, будет меняться в зависимости от ряда факторов, включая фармакокинетические свойства, путь введения, состояние и особенности (пол, возраст, масса тела, здоровье, размер) больного, выраженность симптомов, сопутствующее лечение, частоту лечения и желаемый эффект. Вещества по изобретению могут вводиться ежедневно или через день, менее часто. Предпочтительно, чтобы одно или больше веществ по изобретению вводились один, два или три раза в неделю. Суточные дозы обычно даются в несколько приемов или в пролонгированной форме, эффективных для получения желаемых результатов. Второе или последующие введения могут быть выполнены в дозе, такой же, меньше или больше начальной или предыдущей дозы, введенной индивидууму. Второе или последующее введение может производиться в течение болезни или до ее начала. Согласно изобретению вещества по изобретению могут вводиться индивидууму профилактически или терапевтически до, одновременно или после других терапевтических режимов или средств (например, многокомпонентных медикаментозных режимов) в терапевтически эффективном количестве. Активные средства, которые вводятся одновременно с другими терапевтическими средствами, могут вводиться в той же или различных композициях. Для любого соединения, используемого в способе по изобретению, терапевтически эффективная- 16009389 доза может быть первоначально оценена по анализам клеточных культур. Например, доза может быть выработана на животных моделях, чтобы достигнуть диапазона концентрации в кровотоке, который включает или охватывает уровень или диапазон концентрации, для которого показано, что он уменьшает экспрессию цитокинов в системе in vitro. Такая информация может использоваться, чтобы более точно определить дозы, применимые для людей. Терапевтически эффективная доза относится к такому количеству соединения, которое приводит к ослаблению симптомов у больного. Токсичность и терапевтическую эффективность таких соединений можно определить стандартными фармацевтическими процедурами на культурах клеток или подопытных животных, например, для определения LD50 (дозы, смертельной для 50% исследуемой совокупности) и ED50 (дозы, терапевтически эффективной у 50% совокупности). Соотношение доз с токсическими и терапевтическими эффектами является терапевтическим индексом, и его можно выразить как отношение LD50 к ED50. Соединения, которые обнаруживают высокие терапевтические индексы, предпочтительны. Данные, полученные от данных анализов клеточных культур и исследований на животных, могут использоваться в определении диапазона доз для использования у людей. Доза таких соединений предпочтительно находится в пределах диапазона концентраций в кровотоке, которые включают ED50, с небольшой токсичностью или ее отсутствием. Доза может меняться в пределах данного диапазона в зависимости от используемой лекарственной формы и используемого пути введения. Точный состав, путь введения и доза могут быть выбраны отдельным врачом с учетом состояния больного. (См., например, Fingl et al., 1975, в The Pharmacological Basis of Therapeutics, Ch. 1). В настоящем изобретении также предлагаются новые скрининговые пробы и комплекты, включающие растворимые белки, содержащие последовательность, которая по меньшей мере на 85% гомологична зрелой форме внеклеточного домена человеческого CD164 (SEQ ID NO: 1), которые могут использоваться для идентификации и сравнения свойств соединений в качестве ингибиторов секреции и экспрессии цитокинов. Комплекты и пробы должны включать растворимые белки, содержащие последовательность, которая по меньшей мере на 85% гомологична зрелой форме внеклеточного домена человеческого CD164 (SEQ ID NO: 1), в конечном счете помеченную или иммобилизированную на твердой подложке. Следующие определения сформулированы, чтобы проиллюстрировать и определить значение и границы терминов, использованных, чтобы описать здесь изобретение. Как здесь попеременно используется, термины олигонуклеотиды и полинуклеотиды и нуклеиновая кислота включают РНК, ДНК или гибридные последовательности РНК/ДНК, большие чем один нуклеотид, либо в одноцепочечной, либо сдвоенной форме. Данные термины включают измененные нуклеотиды, которые содержат по меньшей мере одну модификацию, включая посредством примера и не ограничиваясь (а) альтернативной связующей группой, (b) формой, аналогичной пурину, (с) формой,аналогичной пиримидину или (d) аналогом сахара. Примеры аналогичных связующих групп, пуринов,пиримидинов и сахаров известны в известном уровне техники (WO 95/04064). Полинуклеотиды, кодирующие растворимые белки, могут быть получены любым известным способом, включая синтетический,рекомбинантный, образование ex vivo или их комбинацию, так же как используя любые способы очистки, известные в технике. Термины полинуклеотидная конструкция, рекомбинантный полинуклеотид и рекомбинантный полипептид используются здесь согласно их использованию в технике. Термины против хода транскрипции и по ходу транскрипции тоже используются здесь согласно их использованию в технике. Термины парные основания и парные основания Уотсона и Крика используются здесь попеременно и согласно их использованию в технике. Подобным образом, термины комплементарный, комплементарный им, комплемент, комплементарный полинуклеотид, комплементарная нуклеиновая кислота и комплементарная нуклеиновая последовательность используются здесь попеременно и согласно их использованию в технике. Подобным образом, термин очищенный используется здесь, чтобы описать растворимый белок,который был отделен от других соединений, включая, но не ограничиваясь нуклеиновыми кислотами,липидами, углеводами и другими белками. В некоторых предпочтительных вариантах осуществления полипептид, по существу, чистый, когда по меньшей мере приблизительно 50, 60, 75, 85, 90, 95, 96, 97,98, 99 или 99,5% молекул полипептида в образце имеют единую аминокислотную последовательность. В некоторых предпочтительных вариантах осуществления, по существу, чистый полипептид обычно включает приблизительно 50, 60, 70, 80, 90 95, 96, 97, 98, 99 или 99,5 мас./мас.% пробы белка. Чистоту или гомогенность полипептида показывает ряд способов, известных в технике, таких как электрофорез пробы в агарозе или полиакриламидном геле с последующей визуализацией одной полипептидной полосы путем окрашивания геля. Для определенных целей может быть достигнута большая разрешающая способность посредством использования ВЭЖХ или других способов, известных в технике. Кроме того, как используется здесь, термин очищенный не требует абсолютной чистоты; под ним понимается относительное определение. Очистка исходного материала или природного материала по меньшей мере на один порядок величины, предпочтительно на два или три порядка и более предпочтительно на четыре или пять порядков величины рассматривается специально. Альтернативно очистка мо- 17009389 жет быть выражена как наименьший процент чистоты, относящийся к гетерологичным полинуклеотидам (ДНК, РНК или обоим) или полипептидам. В качестве предпочтительного варианта осуществления полинуклеотиды или полипептиды CD164 имеют по меньшей мере 10, 20, 30, 40, 50, 60, 70, 80, 90, 95, 96,97, 98, 99, 99,5 или 100% чистоту относительно гетерологичных полинуклеотидов или полипептидов. В качестве дополнительного предпочтительного варианта осуществления полинуклеотиды или полипептиды имеют чистоту по меньшей мере в пределах от любого числа, до тысячного разряда, от 90 до 100%(например, по меньшей мере 99,995% чистоты) относительно гетерологичных полинуклеотидов или полипептидов. Кроме того, чистота полинуклеотидов или полипептидов может выражаться в процентах(как описано выше) относительно всех материалов и соединений, кроме раствора носителя. Каждое количество, до тысячного разряда, может быть заявлено как индивидуальная разновидность чистоты. Термин выделенный требует, чтобы материал был удален из первоначальной среды (например,природной среды, если он встречается в природе). Например, встречающийся в природе полинуклеотид или полипептид, находящийся в живом животном, не выделенный, но тот же самый полинуклеотид или ДНК, или полипептид, отделенные от некоторых или всех сосуществующих в природной системе материалов, выделенный. Такой полинуклеотид мог бы быть частью вектора, и/или такой полинуклеотид или полипептид мог бы быть частью композиции, и вс равно был бы выделенным в том, что данный вектор или композиция не являются частью его природного окружения. Термин праймер обозначает определенную олигонуклеотидную последовательность, которая комплементарна целевой нуклеотидной последовательности и используется для гибридизации с целевой нуклеотидной последовательностью. Праймер служит точкой инициации для полимеризации нуклеотидов, катализируемой ДНК полимеразой, РНК полимеразой или обратной транскриптазой. Термины белок или полипептид относятся к полимеру аминокислот безотносительно к длине полимера. Таким образом, пептиды, олигопептиды и белки включаются в определение полипептида. Данный термин также не конкретизирует и не исключает постэкспрессионных модификаций полипептидов. Например, полипептиды, которые включают ковалентное связывание гликозильных групп, ацетильных групп, фосфатных групп, липидных групп, миристоилированные группы и т.п., определенно охватываются термином полипептид. Также включены в определение фосфорилированные или дефосфорилированные полипептиды. Также включены в определение полипептиды, которые содержат один или более аналогов аминокислот (включая, например, не встречающиеся в природе аминокислоты, аминокислоты, которые в природе встречаются только в неродственной биологической системе, измененные аминокислоты из систем млекопитающих и т.д.), полипептиды с замещенными связями, так же как другими модификациями, известными в технике, как встречающимися в природе, так и не встречающимися в природе. Термины содержащий, состоящий из и по существу состоящий из определяются в соответствии со своими стандартными значениями. Определенное значение, изложенное в М.Р.Е.Р., контролирует определенное значение в технике, а определенное значение, изложенное в контролировании сферы федерального прецедентного права, контролирует значение, изложенное в М.Р.Е.Р. Имея это в виду, один термин может заменяться другим по всей заявке, рассматриваемой в данный момент, для того, чтобы связать определенное значение, связанное с каждым термином. Термин лечащее, как используется здесь, относится к введению соединения после появления клинических симптомов. Термин профилактическое, как используется здесь, относится к введению соединения до появления клинических симптомов. Термин профилактика в пределах контекста данного изобретения относится не только к полной профилактике болезни либо одного или более симптомов болезни, но также и к любой частичной или существенной профилактике, ослаблению, сокращению, снижению или уменьшению влияния до или в раннем начале болезни. Термин лечение в пределах контекста этого изобретения относится к любому благоприятному воздействию на прогрессирование болезни, включая ослабление, понижение, уменьшение или снижение патологического развития после начала болезни. Все ссылки, процитированные здесь, включая журнальные статьи или рефераты, опубликованные или неопубликованные американские или иностранные заявки на патент, выданные американские или иностранные патенты или любые другие ссылки, полностью включены сюда посредством ссылки, включая все данные, таблицы, числа и текст, представленный в процитированных ссылках. Кроме того, полное содержание ссылок, процитированных в пределах ссылок, процитированных здесь, также полностью включено посредством ссылки. Ссылка на известные этапы способа, традиционные этапы способов, известные способы или традиционные способы никоим образом не допускают того, что любой аспект, описание или вариант осуществления настоящего изобретения раскрывается, преподается или предлагается в релевантной технике. Изобретение будет теперь описано посредством следующих примеров, которые не должны рассматриваться как каким-либо образом ограничивающие настоящее изобретение. Примеры будут ссы- 18009389 латься на определенные фигуры. Предшествующее описание конкретных вариантов осуществления так полностью раскроет общую сущность изобретения, что другие могут, применяя знания в пределах компетентности в определенной области техники (включая содержание ссылок, процитированных здесь), легко изменить и/или переделать для различного применения такие определенные варианты осуществления без неуместного экспериментирования и не отступая от общего понятия настоящего изобретения. Поэтому предполагается, что такие переделки и модификации находятся в рамках эквивалентов описаных вариантов осуществления,основанных на обучении и руководстве, представленных здесь. Необходимо понять, что фразеология или терминология здесь находится с целью описания, а не ограничения, так что терминология или фразеология настоящей спецификации должны интерпретироваться квалифицированным рабочим в свете обучения и руководства, представленных здесь, в комбинации со знаниями среднего специалиста в данной области техники. Примеры Пример 1. Клонирование, высокопроизводительная экспрессия и очистка в клетках млекопитающихsf-CD164 с His-тагом. Последовательность кДНК, кодирующая полную внеклеточную область человеческого CD164 (остатки 1-163 из NCBI Асс. No. NP006007; SEQ ID NO: 3), была субклонирована для создания экспрессионной плазмиды, используя технологию клонирования Gateway (Invitrogen). Данная экспрессионная плазмида делает возможной экспрессию и секрецию зрелой формы внеклеточной области человеческогоCD164 (140 аминокислот) в виде растворимого составного белка, имеющего гексагистидиновый таг, слитый со своим С-концом (146 аминокислот; sf-CD164; SEQ ID NO: 2), затем использованного для аффинной очистки. Секреция управляется природной сигнальной последовательностью CD164 (остатки 1-23 изNCBI Асс. No. NP006007; SEQ ID NO: 3). Клетки млекопитающего, выбранные для высокопроизводительной экспрессии, представляли собой клетки почки зародыша человека 293, экспрессирующие ядерный антиген вируса Эпштейна-Барр(HEK293-EBNA, Invitrogen). Клетки сохранялись во взвешенном состоянии в бессывороточной питательной среде Ex-cell VPRO(семенной фонд, поддерживающая среда, JRH Biosciences). За время от 16 до 20 ч перед трансфекцией(день трансфекции -1), клетки были засеяны (плотность 2105 клеток/мл) в 2 колбы Т 225, каждая из которых содержала 50 мл DMEM (питательной среды Игла, модифицированной Дальбекко)/F12 (1:1) с 2% FBS (сыворотки коровьих эмбрионов) среды для посева (JRH Biosciences). На следующий день (день трансфекции 0) имела место трансфекция при использовании реагента JetPEI (2 мкл/мкг плазмида;PolyPlus-трансфекция). Для каждой колбы 113 мкг sf-CD164 экспрессионные плазмиды были одновременно трасфицированы вирусом с 2,3 мкг плазмиды, экспрессирующей зеленый флуоресцентный белок(GFP). Трансфекционную смесь затем добавляли к 2 Т 225 колбам и инкубировали при 37 С (5% СО 2) в течение 6 дней. Подтверждение положительной трансфекции производилось микроскопией (Axiovert 10Zeiss) в день 1 и день 6, чтобы качественно оценить флюоресценцию, обусловленную GFP. В день 6(день сбора) супернатанты (100 мл) из двух колб объединяли и центрифугировали (4 С, 400 g), и помещали в резервуар, несущий уникальный идентификатор. Процесс очистки выполняли, начиная с 100 и 500 мл проб питательной среды от клеток, экспрессирующих С-конец рекомбинантного белка, снабженный His-тагом. Пробы разбавляли одним объемом холодного буфера А (50 мМ NaH2PO4; 600 мМ NaCl; 8,7% (мас./об.) глицерина, pH 7,5) до конечных объемов 200 и 1000 мл соответственно. Пробы фильтровали через 0,22 мкм стерильный фильтр (Millipore,фильтрующая единица на 500 мл) и хранили при 4 С в стерильной прямоугольной бутыли для питательной среды (Nalgene). Очистку выполняли при 4 С на автоматизированном рабочем месте VISION (Applied Biosystems),соединенном с автоматическим загрузчиком проб (Labomatic). Процедура очистки состояла из двух последовательных этапов, металло-афинной хроматографии на колонке Poros 20 МС (Applied Biosystems),нагруженной ионами Ni (4,650 мм, 0,83 мл), с последующей гель-фильтрацией на колонке (1,010 см) со средой Sephadex G-25 (Amersham Pharmacia). Для первого этапа хроматографии металло-аффинную колонку (Ni-колонку) регенерировали 30 объемами колонки раствора ЭДТА (100 мМ ЭДТА; 1 М NaCl; pH 8,0), перезаряжали ионами Ni путем промывания 15 объемами колонки 100 мМ раствора NiSO4, промывали 10 объемами колонки буфера А,затем 7 объемами колонки буфера В (50 мМ NaH2PO4; 600 мМ NaCl; 8,7% (мас./об.) глицерина, 400 мМ; имидазола, рН 7,5) и в конце уравновешивали 15 объемами колонки буфера, содержащего 15 мМ имидазола. Пробу переносили загрузчиком проб Labomatic в 200 мл замкнутую систему для проб и затем загружали в Ni металло-аффинную колонку при скорости потока 10 мл/мин. Для 1000 мл пробы процедуру заполнения повторяли 5 раз. Ni-колонку промывали 12 объемами колонки буфера А, затем 28 объемами колонки буфера, содержащего 20 мМ имидазола. В течение данной промывки слабо связанные загрязняющие белки элюировались из колонки. Рекомбинантный белок, снабженный His-тагом, в конце элюировали из Ni-колонки 10 объемами колонки буфера В при скорости потока 2 мл/мин и элюируемый бе- 19009389 лок собирали во фракцию 1,6 мл. Для второго этапа хроматографии гель-фильтрации на Sephadex G-25, колонку регенерировали 2 мл буфера D (1,137 М NaCl; 2,7 мМ KCl; 15 мМ KH2PO4; 8 мМ Na2HPO4; pH 7,2), а затем уравновешивали 4 объемами колонки буфера С (137 мМ NaCl; 2,7 мМ KCl; 1,5 мМ KH2PO4; 8 мМ Na2HPO4; 20% (мас./об.) глицерина; рН 7,4). Пиковую фракцию, элюируемую из Ni-колонки, автоматически, посредством встроенного загрузчика проб загружали в колонку с Sephadex G-25, и белок элюировали буфером С при скорости потока 2 мл/мин. Обессоленный образец собирали фракциями 2,2 мл. Фракцию фильтровали через 0,22 мкм стерильный фильтр для центрифугирования (Millipore), отбирали аликвотные части, замораживали и хранили при -80 С. Аликвоту пробы анализировали на ДСН-ПААГ (4-12% гель NuPAGE; Novex) посредством окрашивания Кумасси и вестерн-блоттингом с антителами к His. Окрашивание Кумасси выполняли инкубированием геля NuPAGE в 0,1% окрашивающем растворе синего Кумасси R250 (30% метанола, 10% уксусной кислоты) при комнатной температуре в течение 1 ч. Затем гель обесцвечивали в 20%-м метаноле, 7,5%-й уксусной кислоте, пока фон не становился прозрачным, а белковые полосы - четко различимыми. Для вестерн-блоттинга белки переносили с NuPAGE геля на нитроцеллюлозную мембрану посредством электрического тока 290 мА в течение 1 ч при 4 С. Мембрану блокировали 5%-м сухим молоком в буфере Е (137 мМ NaCl; 2,7 мМ KCl; 1,5 мМ KH2PO4; 8 мМ NaH2PO4; 0,1% Твин-20, рН 7,4) в течение 1 ч при комнатной температуре, а затем инкубировали со смесью 2 кроличьих поликлональных антител кHis (G-18 и Н-15, 0,2 мкг/мл каждого; Santa Cruz) в 2,5% сухом молоке в буфере Е в течение ночи при 4 С. После дополнительного 1 ч инкубации при комнатной температуре мембрану промывали буфером Е(310 мин), а затем инкубировали со вторым HRP-конъюгированным кроличьим антителом (DAKO, HRP 0399), разбавленным 1/3000 в буфере Е, содержащим 2,5% сухого молока в течение 2 ч при комнатной температуре. После промывки буфером Е (310 мин), мембрана была проявлена комплектом ECL (Amersham Pharmacia) в течение 1 мин. Мембрану затем подвергали воздействию Hyperfilm (Amersham Pharmacia), пленку проявляли, и изображение вестерн-блоттинга визуально анализировали. Концентрацию белка в пробах определяли, используя комплект для анализа белков ВСА (Pierce) с бычьим сывороточным альбумином в качестве стандарта. Пример 2. Влияние sf-CD164 на выделение цитокинов, измеренное клеточными анализами. Следующие in vitro клеточные анализы, измеряющие влияния sf-CD164 на секрецию цитокинов,вызванную конканавалином A (Con А), которое измерялось cytokine bead array (CBA) анализом на IL-2,INF-, TNF-, IL-5, IL-4 и IL-10. Использовалось следующее оборудование и программное обеспечение: фотометр EX (Labsystem) для 96-луночных микротитровочных планшетовGraph Pad Software (Prism) программное обеспечение Excel (Microsoft) проточный цитометр (Becton-Dickinson) программное обеспечение СВА Analysis вытяжной шкаф для культур клеток термостат для культур клеток центрифуга пипетки. Использовались следующие материалы и реактивы: лейкоконцентратDMEM (GIBCO) человеческая сыворотка типа АВ (SIGMA)Ficoll (PHARMACIA) 96-клеточный микротитровочный планшет для культур клеток (COSTAR) конканавалин A (SIGMA) набор СВА для человеческих цитокинов Th1/Th2 (Becton-Dickinson) фосфатно-солевой буферный раствор (GIBCO) стерильные 50 мл пробирки Falcon (Becton-Dickinson) бычий сывороточный альбумин (BSA; SIGMA) глицерин (MERCK) диметилсульфоксид (ДМСО; SIGMA) 96-луночный микротитровочный планшет с коническим основанием (NUNC)autoMACS Separator и комплект для выделения клеток MACS (Miltenyl Biotec). Клетки выделялись для клеточных анализов следующим образом. Мононуклеарные клетки периферической крови человека (РВМС) были выделены из лейкоконцентрата, разбавленного DMEM. 25 мл разбавленной крови после этого медленно добавляли на слой 15 млFicoll в 50 мл пробирке Falcon и пробирки центрифугировались (2000 об./мин, 20 мин, при комнатной температуре без тормоза). Промежуточную фазу (кольцо) собирали и клетки промывали 25 мл DMEM, за чем следовал этап центрифугирования (1200 об./мин, 5 мин). Данную процедуру повторяли три раза. Лейкоконцентрат дал всего приблизительно 600106 клеток. Субпопуляции лейкоцитов (Т-лимфоцитов, В-лимфоцитов, моноцитов) были приготовлены из РВМС согласно инструкции изготовителя комплекта для выделения (MACS; Miltenyl Biotec). РВМС были выделены из лейкоконцентратов как описано выше. Заботились, чтобы создать суспензию отдельных клеток. Для приготовления CD4+ Т-лимфоцитов, CD4+ Т-лимфоцитов использовался Cell Isolation Kit II(номер в каталоге 130-091-155, Miltenyl Biotec). РВМС подсчитывали, центрифугировали в течение 10 мин и ресуспендировали в холодном фосфатно-солевом буфере (фосфатно-солевой буфер с рН 7,2 с добавлением 0,5% бычьего сывороточного альбумина и 2 мМ ЭДТА) при концентрации 2,5108 клеток в мл (40 мкл буфера на 107 клеток). Добавляли 10 мкл Biotin-Antibody Cocktail (поставленного с комплектом) на общее число 107 клеток. Суспензию хорошо перемешивали и инкубировали при 4-8 С в течение 10 мин. На 107 клеток добавляли 30 мкл буфера, затем - 20 мкл Anti-Biotin MicroBeads на 107 клеток. Суспензию хорошо перемешивали и инкубировали при 4-8 С в течение дополнительных 15 мин. Клетки отмывали буфером, добавляя отмеченный объем 10-20 и центрифугировали при 300g в течение 10 мин. Супернатант полностью удаляли и клетки ресуспендировали, до 108 клеток в 500 мкл буфера. Выполняли магнитное разделение с помощью сепаратора autoMACS. Сепаратор autoMACS подготавливали и заправляли согласно инструкциям производителя. Пробирку, содержащую магнитно помеченные клетки,помещали в сепаратор autoMACS и выбирали программу истощение. Собирали отрицательную фракцию (выпускной канал neg1). Данная фракция представляла обогащенные CD4+ Т-лимфоциты. Там, где требовалось, позднее собирали положительную фракцию (выпускной канал pos1). Данная фракция представляла магнитно помеченные клетки, не относящиеся к CD4+ Т-лимфоцитам. Условия, применяемые для клеточных анализов, были следующими: 100000 клеток/лунку в 96-луночных планшетах в конечных 100 мкл в 2%-м глицерине,5 нг/мл митогена конканаваллина А (ConA),48 ч для каждого анализа. Клетки были приготовлены в каждой лунке путем смешивания. 80 мкл 1,25106 клеток/мл разбавляли в DMEM+2,5% сыворотки человека+1% L-глутамина + 1% пенициллина-стрептомицина,10 мкл раствора, содержащего sf-CD164, который был разбавлен в фосфатно-солевом буфере + 20% глицерина (конечное разбавление белков составило 1/10),10 мкл ConA. После 48 ч супернатанты клеток собирали и измеряли человеческие цитокины с помощью HumanTh1/Th2 Cytokine CBA Kit (Becton-Dickinson). Смешанную суспензию Human Th1/Th2 Capture Beads готовили путем энергичного вихревого перемешивания в течение нескольких секунд перед смешиванием с пробами с микролуночного планшета. Для каждого анализированного исследования аликвоту в 10 мкл каждых микрочастиц захвата добавляли в единую пробирку с этикеткой смешанные микрочастицы захвата. Смесь микрочастиц подвергали тщательному вихревому перемешиванию. Супернатант разбавляли (1:4), используя Assay Diluent (20 мкл супернатантов + 60 мкл Assay Diluent). Разбавленные пробы затем перемешивали перед переносом проб на 96-луночный микротитровочный планшет с коническим основанием (Nunc).Human Th1/Th2 Cytokine CBA Assay CBA выполняли, добавляя 50 мкл разбавленных супернатантов в 96-луночный микротитровочный планшет с коническим основанием (Nunc). Добавляли 50 мкл смешанных микрочастиц захвата, затем добавляли 50 мкл Human Th1/Th2 PE Detection Reagent. Планшет затем инкубировали в течение 3 ч при комнатной температуре и защищали от прямого воздействия света,после чего следовало центрифугирование при 1500 об./мин в течение 5 мин. Затем супернатант тщательно удаляли. На следующем этапе 200 мкл промывочного буфера дважды добавляли к каждой лунке, центрифугировали при 1500 об./мин в течение 5 мин и супернатант тщательно удаляли. 130 мкл промывочного буфера после этого добавляли к каждой лунке, чтобы ресуспендировать осадок микрочастиц. Наконец, пробы анализировали на проточном цитометре. Данные анализировали, используя программное обеспечение СВА Application Software, Activity Base и Microsoft Excel. Влияние sf-CD164 на выделение цитокинов из человеческих клеток РВМС (смеси) и изолированных Т-лимфоцитов измерялось для шести цитокинов: TNF-, INF-, IL-2, IL-4, IL-5 и IL-10. sf-CD164 значительно и дозозависимо уменьшал выделение данных цитокинов в обоих клеточных анализах (IC50 суммированы в табл. I). Две примерные дозозависимые кривые показаны для IL-2 и TNF- как для человеческих РВМС, так и для изолированных CD4+ Т-лимфоцитов на фиг. 2 и 3 соответственно. Пример 3. Влияние введения sf-CD164 на выделение цитокинов, измеренное на животной модели индуцированного ЛПС выделения TNF-. Модель индуцированного липополисахаридом (ЛПС) выделения TNF- была приготовлена согласно патенту WO 98/38179. ЛПС (0111:В 4; SIGMA) инъецировали (0,3 мг/кг, в/б [внутрибрюшинно]) мы- 21009389 шам С 3 Н/HeN (Charles River, Франция). Через 90 мин брали пробы крови и определяли TNF- в плазме,используя комплект ELISA (RD). sf-CD164 и дексаметазон растворяли в фосфатно-солевом буфере и инъецировали (sf-CD164 по 0,03, 0,1 и 0,3 мг/кг, в/в [внутривенно]; или дексаметазон по 0,1 мг/кг, п/к[подкожно]) за 15 мин до введения ЛПС. Дексаметазон, противовоспалительное соединение, используемый в качестве положительного контроля, значимо (р 0,001) ингибировал индуцированное ЛПС выделение TNF- на 72%. sf-CD164, 0,3 мг/кг, значимо (р 0,01) ингибировал индуцированное ЛПС выделение TNF- на 38% (фиг. 4). Более низкие дозы 0,03 и 0,1 мг/кг были способны ингибировать TNF-, но статистически менее значимо. Пример 4. Влияние введения sf-CD164 на миграцию иммунных клеток, измеренную на двух животных моделях. Влияние введения sf-CD164 на миграцию иммунных клеток было сначала проверено с использованием миграции лейкоцитов в брюшную полость, вызванной тиогликолятом (фиг. 5). Мышам (линии С 3 Н, возраст 8 недель, n=6; Elevage Janvier, Франция) инъецировали sf-CD164 (0,03,0,1 и 0,3 мг/кг, в/в) или дексаметазон (1 мг/кг, п/к), растворенные в фосфатно-солевом буферном растворе, содержащим 0,02% бычьего сывороточного альбумина. Тиогликолят (1,5%, 40 мл/кг, в/б; SIGMA) инъецировали через 15 мин после введения исследуемых молекул. Второе введение исследуемых молекул производили 24 ч спустя. Через 48 ч после введения тиогликолята животных забивали и проводили промывание брюшной полости, используя 25 мл фосфатно-солевого буферного раствора - 1 мМ ЭДТА(+4 С). После центрифугирования (10 мин при 3000 об./мин) осадок ресуспендировали в 1 мл фосфатносолевого буферного раствора. Перитонеальные клетки подсчитывали, используя счетчик Beckman/Coulter. Дексаметазон значимо ингибировал (р 0,001) миграцию макрофагов на 69%. Это влияние было дозозависимым. sf-CD164 (0,03, 0,1 и 0,3 мг/кг) значимо ингибировал вызванную тиогликолятом миграцию макрофагов в брюшную полость на 5%, 26% (р 0,05) и 43% (р 0,001) соответственно, так же как миграцию в брюшную полость лимфоцитов (на 14, 18 и 34% соответственно) и нейтрофилов (на 3, 9 и 23% соответственно). Схожие результаты были получены при миграции в брюшную полость нейтрофилов и лимфоцитов,вызванной ЛПС (фиг. 5). Тот же самый протокол введения, описанный выше, использовался с ЛПС (0111:В 4, Sigma; 0,9 мг/кг, 40 мл/кг, в/б). sf-CD164 (0,03, 0,1 и 0,3 мг/кг) значимо ингибировал вызванную ЛПС миграцию в брюшную полость нейтрофилов на 9%, 35% (р 0,001) и 43% (р 0,001) соответственно. В тех же дозах он также значительно ингибировал миграцию активированных лимфоцитов на 8%, 26% (р 0,05) и 47%(р 0,001) соответственно. Дексаметазон (0,1 мг/кг) значительно (р 0,001) ингибировал миграцию активированных лимфоцитов. Пример 5. Влияние sf-CD164 в клеточном анализе на переработку и представление MBPспецифического антигена. Анализ была разработан, чтобы проверить влияние sf-CD164 на пролиферацию Т-лимфоцитов, специфичных к основному белку миелина (MBP), индуцированную пептидом Ас 1-11 основного белка миелина (MBP (Ас 1-11. Показано, что накожная иммунизация (ECi) с иммунодоминатным пептидом основного белка миелина (MBP), Ас 1-11, защищает мышей, трансгенных по рецептору Т-лимфоцитов, специфичному к Ас 1-11, от вызванной и спонтанной форм экспериментального аллергического энцефаломиелита (ЕАЕ). Селезенки B10.PL и MBP трансгенных мышей собирали и гомогенизировали, чтобы получить суспензии единичных клеток. После гемолиза раствором Gay спленоциты ресуспендировали в фосфатносолевом буферном растворе, промывали и подсчитывали. После процедур выделения жизнеспособность клеток превышала 90% по включению красителя трипанового синего. B10.PL антигенпредставляющие клетки (АРС) затем облучали 25 Гр гаммаизлучения (стимул), промывали и ресуспендировали в полной среде, 1,9106 клеток/мл. Популяцию клеток-респондеров приводили к 3,8106 клеток/мл в полной среде. 80 мкл каждой клеточной суспензии на лунку смешивали в 96-луночных планшетах. Антиген затем добавляли в объеме 20 мкл: 10 мкг/мл MBP мышиного или 1 мкг/мл Ас 1-11 пептида MBP на лунку (адекватными отрицательными контролями служили бычий сывороточный альбумин, MSA и не относящийся к делу пептид, полученный из MBP, соответственно). Белки или малые молекулы добавляли в объеме 20 мкл и затем инкубировали при 37 С в увлажненной атмосфере, содержащей 5% СО 2. Через 3 суток культивирования либо собирали супернатанты и замораживали при -80 С до исследования на образование цитокинов, либо добавляли 1 мкКи 3 Н тимидина и оценивали включение радиоактивной метки после 14-16 ч дополнительной инкубации.sf-CD164 (50 мкг/мл) значимо ингибировал пролиферацию специфичных к MBP Т-лимфоцитов, индуцированную Ас 1-11 (1 мкг/мл; фиг. 6). Таким образом, sf-CD164 или растворимый CD164 мог бы быть полезен в лечении рассеянного склероза. Пример 6. Влияние введения sf-CD164 на животную модель молниеносного гепатита печени. Показано, что белок sf-CD164 in vitro ингибирует секрецию определенных цитокинов мононукле- 22009389 арными клетками периферической крови человека (РВМС), стимулированными ConA. Поскольку цитокины играют ключевую роль в вызванном Т-лимфоцитами вызванном ConA гепатите печени (Seino et al. 2001, Annals of surgery 234, 681; Kusters S., Gastroenterology 111 (2):462-71, 1996; Toyonaga et al. 1994,PNAS 91, 614-618), мы оценили sf-CD164 на этой модели. Использовались самки мышей C57/BL6 (возраст 8 недель; IFFA CREDO). В целом, использовались 7 животных на экспериментальную группу. Мышей содержали в стандартных условиях при 12-часовом цикле чередования света и темноты, предоставляли облученную пищу и воду ad libitum. Конканаваллин А (ConA; Sigma ref. C7275) инъецировали по 18 мк/кг в/в и пробы крови забирали через 1,30 и 8 ч после инъекции. Sf-CD164 инъецировали за 30 мин до инъекции ConA. Положительной контрольной группе инъецировали дексаметазон (0,1 мг/кг), а отрицательной контрольной группе инъецировали фосфатно-солевой буферный раствор с бычьим сывороточным альбумином и 1,8% глицерина. Во время забоя кровь забирали из сердца. Уровни цитокинов IL-6 и INF- измеряли с помощью ТН 1/ТН 2 исследования СВА через 1,5 ч после инъекции ConA. Параметры трансаминаз крови определяли с использованием прибора COBAS (Hitachi). Эксперимент показывает, что sf-CD164 (1 мг/кг) защищает от повреждения печени на мышиной модели, имитирующей молниеносный гепатит после подкожного введения sf-CD164, так как он уменьшает релевантные параметры, такие как уровень трансаминазы (АлАТ), уровень цитокинов INF- и IL-6(фиг. 7). Уменьшение уровня АлАТ могло быть обусловлено сниженным уровнем и INF-, и IL-6. Различные цитокины вовлечены в повреждение печени после инъекции ConA. Например, антитела противTNF-альфа придают защиту против болезни (Seino et al. 2001, Annals of surgery 234, 681), и было показано, что ингибирование выработки IL-4 в NKT клетках является гепатопротективным при опосредованном Т-лимфоцитами гепатите у мышей (Ajuebor et al. 2003 J. Immunology 170, 5252-9). Таблица I ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение растворимого белка, содержащего последовательность, который по меньшей мере на 85% гомологичен зрелой форме внеклеточного домена человеческого CD164 (SEQ ID NO: 1), для получения препарата для лечения и/или профилактики воспалительных или/и аутоиммунных нарушений. 2. Применение по п.1, где указанный растворимый белок выбран изb) SEQ ID NO: 1, слитой с сигнальной последовательностью человеческого CD164. 3. Применение по п.1, где указанный растворимый белок является активным мутеином или изоформой SEQ ID NO: 1. 4. Применение по п.3, где указанный растворимый белок выбран изb) зрелой формы внеклеточного домена любой из следующих изоформ человеческого CD164:CD164-дельта 4 (SEQ ID NO: 4), CD164-дельта 5 (SEQ ID NO: 5). 5. Применение по любому из предыдущих пунктов, где упомянутый растворимый белок гликозилирован. 6. Применение по п.5, где упомянутый растворимый белок гликозилирован по любому положениюSEQ ID NO: 1. 7. Применение по любому из предыдущих пунктов, где упомянутый растворимый белок фосфорилирован. 8. Применение по п.7, где упомянутый растворимый белок фосфорилирован по любому положениюSEQ ID NO: 1. 9. Применение по любому из предыдущих пунктов, где упомянутый растворимый белок миристоилирован. 10. Применение по п.9, где упомянутый растворимый белок миристоилирован по любому положению SEQ ID NO: 1. 11. Применение по любому из предыдущих пунктов, где упомянутый растворимый белок является растворимым слитым белком. 12. Применение по п.11, где упомянутый растворимый слитый белок содержит сигнальную последовательность. 13. Применение по п.11 или 12, где указанный растворимый слитый белок содержит гистидиновый таг (гистидиновую метку). 14. Применение по п.13, где указанный растворимый слитый белок представляет собой SEQ ID NO: 2. 15. Применение по п.11 или 12, где указанный растворимый слитый белок содержит Fc-фрагмент иммуноглобулина. 16. Применение по любому из предыдущих пунктов, где указанный растворимый белок является активным производным, устойчивой к протеолизу модифицированной формой, конъюгатом, комплексом, фракцией, предшественником и/или солью. 17. Применение полинуклеотидной последовательности, кодирующей растворимый белок, содержащей последовательность, которая по меньшей мере на 85% гомологична зрелой форме внеклеточного домена человеческого CD164 (SEQ ID NO: 1), для получения лекарственного препарата для лечения и/или профилактики воспалительных или/и аутоиммунных нарушений. 18. Применение по любому из предыдущих пунктов, где указанное воспалительное и/или аутоиммунное заболевание выбрано из группы, включающей рассеянный склероз, системную красную волчанку, ревматоидный артрит, ювенильный идиопатический артрит, псориатический артрит, остеоартрит,спондилоартропатию, воспалительное заболевание кишечника, эндотоксинемию, болезнь Крона, болезнь Стилла, увеит, гранулематоз Вегенера, болезнь Бехчета, склеродермию, синдром Шегрена, саркоидоз,гангренозную пиодермию, полимиозит, дерматомиозит, миокардит, псориаз, системную склеродермию,гепатит С, аллергию, аллергическое воспаление, аллергическое воспаление дыхательных путей, хроническую обструктивную болезнь легких (ХОБЛ), инфаркт кишечника, инсульт, неспецифический язвенный колит, аллергическую астму, бронхиальную астму, фиброз, постишемическое воспаление мышцы, почек и сердца, воспаление кожи, гломерулонефрит, ювенильный сахарный диабет типа I, болезнь гиперчувствительности, вирусные или острые болезни печени, алкогольную печеночную недостаточность, туберкулез, септический шок, ВИЧ-инфекцию, реакцию трансплантат против хозяина (GVHD) и атеросклероз. 19. Способ ингибирования экспрессии одного или нескольких цитокинов у индивидуума, предусматривающий введение указанному индивидууму композиции, содержащей растворимый белок, содержащий последовательность, которая по меньшей мере на 85% гомологична зрелой форме внеклеточного домена человеческого CD164 (SEQ ID NO: 1). 20. Способ по п.19, где указанный цитокин является TNF-, INF-, IL-2, IL-4, IL-5 или IL-10. 21. Метод скрининга, включающий растворимый белок, содержащий последовательность, которая по меньшей мере на 85% гомологична зрелой форме внеклеточного домена человеческого CD164 (SEQID NO: 1), для идентификации и сравнения свойств соединений в качестве ингибиторов секреции и экспрессии цитокинов.
МПК / Метки
МПК: A61P 37/04, A61P 29/00, G01N 33/53, A61K 38/17
Метки: воспалительных, нарушениях, использование, аутоимунных, растворимого
Код ссылки
<a href="https://eas.patents.su/30-9389-ispolzovanie-rastvorimogo-cd-164-pri-vospalitelnyh-i-ili-autoimunnyh-narusheniyah.html" rel="bookmark" title="База патентов Евразийского Союза">Использование растворимого cd 164 при воспалительных и/или аутоимунных нарушениях</a>
Предыдущий патент: Векторы экспрессии и способы их применение
Следующий патент: Плазмида, кодирующая фактор роста фибробластов, для лечения ангиогенных дефектов, ассоциированных с гиперхолестеинемией или диабетом
Случайный патент: Способ извлечения сердечника кабеля из оболочки и смазывающий состав для его осуществления