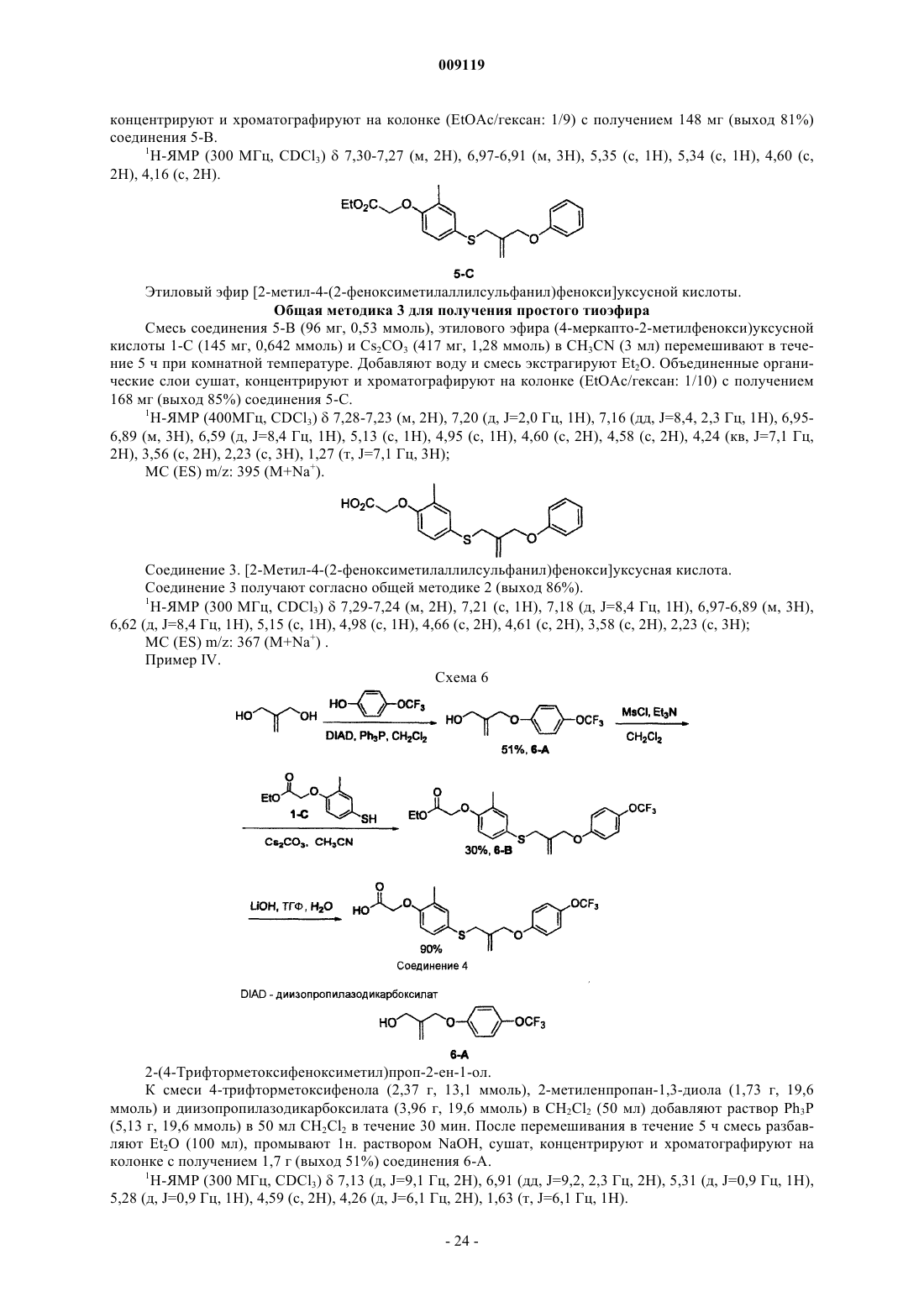
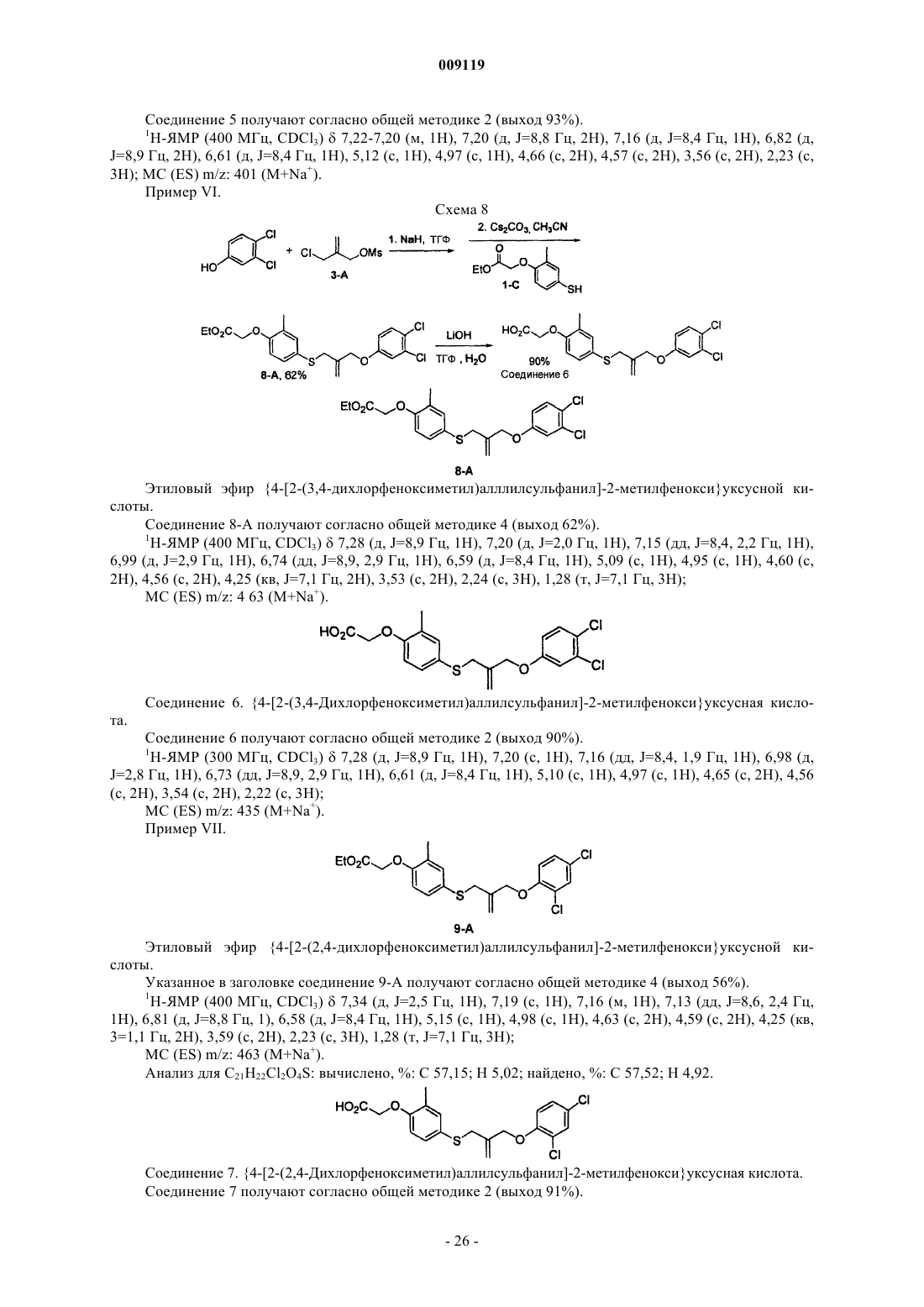
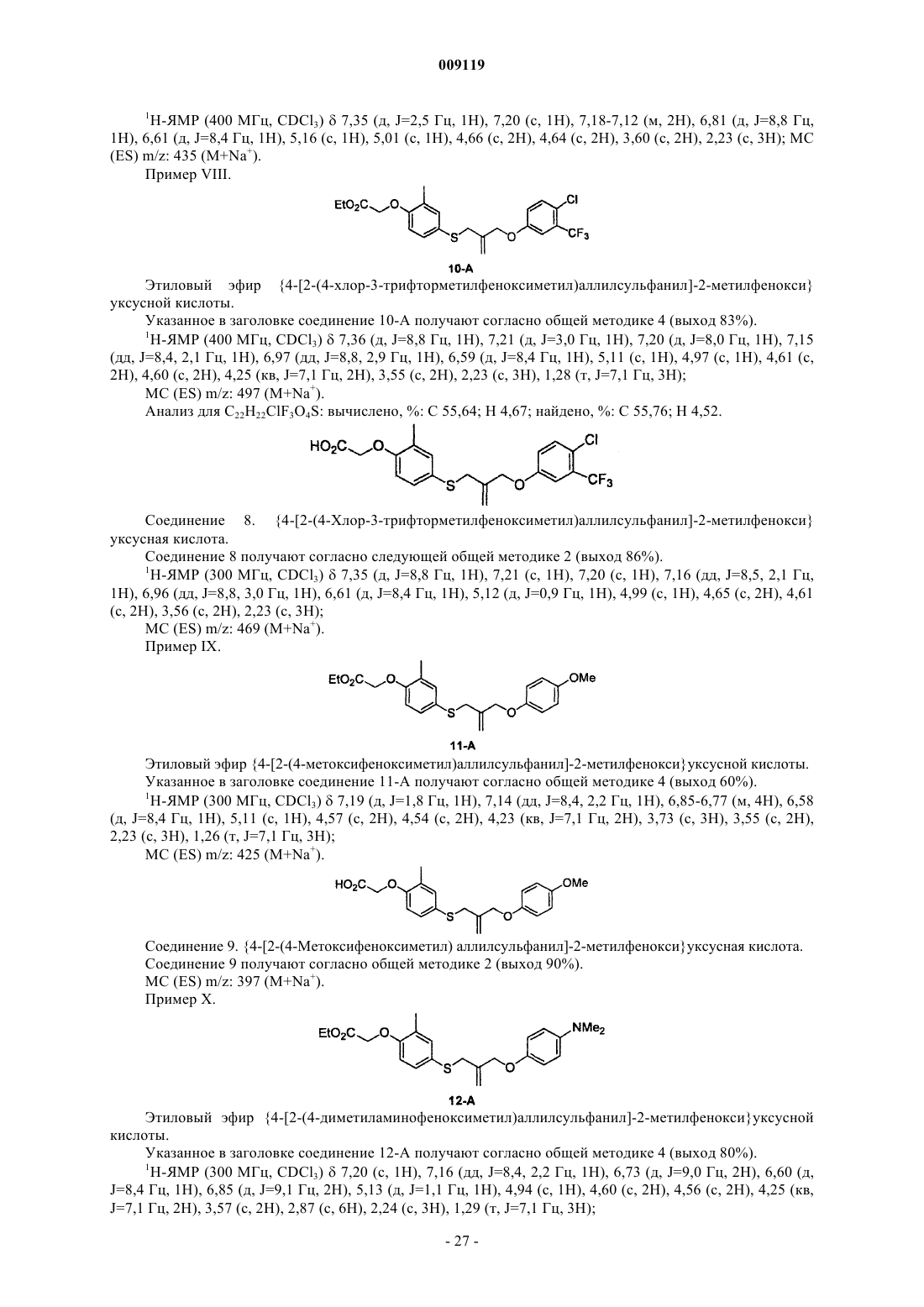
4- ((феноксиалкил)тио) феноксиуксусные кислоты и аналоги
Номер патента: 9119
Опубликовано: 26.10.2007
Авторы: Ванг Айхуа, Диэнджелис Алан Р., Куо Джи-Хонг, Чжан Жуй
Формула / Реферат
1. Соединение формулы (I)
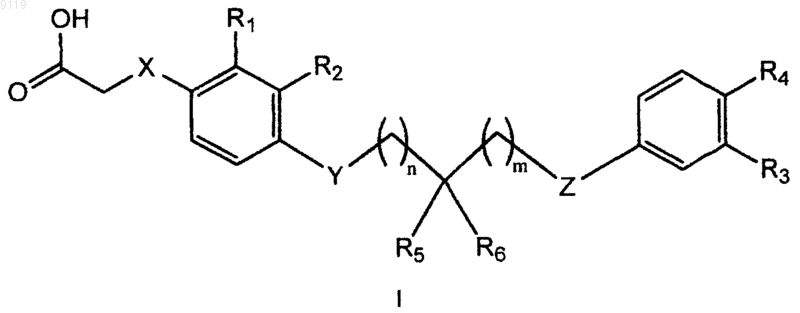
где X выбирают из ковалетной связи, S и О;
Y означает S или О;
Z означает О или CH2, при условии, что когда Y означает О, тогда Z означает О;
R1 и R2 независимо выбирают из Н, C1-3-алкила, C1-3-алкоксила, галогена и NRaRb, где Ra и Rb независимо означают Н или C1-3-алкил;
R3 и R4 независимо выбирают из Н, галогена, цианогруппы, C1-5-алкила, гидроксила, С2-4-ацила, C1-4-алкоксила и NRcRd, где Rc и Rd независимо означают Н или C1-3-алкил, при условии, что R3 и R4 оба не означают Н;
R5 и R6 независимо выбирают из галогена, фенила, C1-9-алкила, C1-8-алкоксила, С2-9-алкенила, С2-9-алкенилоксигруппы, C3-7-циклоалкила, C3-7-циклоалкоксила, C3-7-циклоалкил-С1-7-алкила, С3-7-циклоалкил-С1-7-алкоксила, С3-7-циклоалкилокси-С1-6-алкила и С3-7-циклоалкилокси-С1-7-алкоксила; или
R5 и R6 вместе образуют C1-9-алкилиденил или С3-9-алкенилиденил, или R5, R6 и атом углерода, с которым они связаны, вместе образуют С3-7-циклоалкил или 5- или 6-членный гетероциклил;
n означает 0, 1 или 2 и
m означает 0, 1 или 2;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где X означает S или О.
3. Соединение по п.2, где X означает О.
4. Соединение по п.1, где Y означает О.
5. Соединение по п.1, где Y означает S.
6. Соединение по п.1, где Z означает О.
7. Соединение по п.1, где Z означает СН или СН2.
8. Соединение по п.1, где m означает 1.
9. Соединение по п.1, где m означает 2.
10. Соединение по п.1, где n означает 1.
11. Соединение по п.1, где R1 и R2 независимо выбирают из Н, C1-3-алкила, C1-3-алкоксила, F, Cl и Br.
12. Соединение по п.11, где R1 и R2 независимо выбирают из Н, метила, метоксигруппы, F и Cl.
13. Соединение по п.1, где R3 и R4 независимо выбирают из Н, галогена, цианогруппы, ацетила, C1-2-алкила и C1-2-алкоксила.
14. Соединение по п.13, где R3 независимо выбирают из Н, F, Cl, гидроксила, метила и метоксигруппы.
15. Соединение по п.13, где R4 независимо выбирают из F, Cl, метила, метоксигруппы, трифторметила, трифторметоксигруппы, дифторметила, дифторметоксигруппы, фторметила, фторметоксигруппы, хлордифторметила, хлордифторметоксигруппы, дихлорфторметила и дихлорфторметоксигруппы.
16. Соединение по п.1, где R3 выбирают из метила, метоксигруппы, Н, Cl, Br, I, ОН, -CH(CF3)2, CF3, -OCF3, -N(CH3)2, -O-CH2COOH и -СОСН3 и R4 выбирают из Н, Cl и метила.
17. Соединение по п.1, где R5 и R6 вместе образуют C1-9-алкилиденил или С3-9-алкенилиденил или R5, R6 и атом углерода, с которым они связаны, вместе образуют С3-7-циклоалкил.
18. Соединение по п.1, где R5 и R6 независимо выбирают из галогена, фенила, C1-9-алкила, C1-8-алкоксила, С2-9-алкенила, С2-9-алкенилоксигруппы, C3-7-циклоалкила, С3-7-циклоалкоксила, С3-7-циклоалкил-С1-7-алкила, C3-7-циклоалкил-С1-7-алкоксила, С3-7-циклоалкилокси-С1-6-алкила и С3-7-циклоалкилокси-С1-7-алкоксила.
19. Соединение по п.1, где R3 выбирают из Н, F, Cl, метила и метоксигруппы, a R4 выбирают из F, Cl, ацетила, метила, метоксигруппы, трифторметила, трифторметоксигруппы, дифторметила, дифторметоксигруппы, фторметила, фторметоксигруппы, хлордифторметила, хлордифторметоксигруппы,
дихлорфторметила и дихлорфторметоксигруппы.
20. Соединение по п.1, где R1 выбирают из Н, CF3, метила, Cl и метоксигруппы, a R2 выбирают из Н, Cl и метила.
21. Соединение по п.1, где X означает О и Y означает О.
22. Соединение по п.1, где Z означает О и Y означает S.
23. Соединение по п.1, где X означает О и Y означает S.
24. Соединение по п.1, где X означает ковалентную связь и Y означает S.
25. Соединение по п.1, где R1 выбирают из Н, CF3, метила, Cl и метоксигруппы; R2 выбирают из Н, Cl и метила; R3 выбирают из Н, F, Cl, метила и метоксигруппы и R4 выбирают из F, Cl, метила и метоксигруппы.
26. Соединение по п.1, где X означает О; Y означает О; R3 выбирают из Н, F, Cl, метила и метоксигруппы и R4 выбирают из F, Cl, метила, метоксигруппы, трифторметила, трифторметоксигруппы, дифторметила, дифторметоксигруппы, фторметила и фторметоксигруппы.
27. Соединение по п.1, где X означает О; Y означает S; R3 выбирают из Н, F, Cl, метила и метоксигруппы и R4 выбирают из F, Cl, метила, метоксигруппы, трифторметила, трифторметоксигруппы, дифторметила, дифторметоксигруппы, фторметила и фторметоксигруппы.
28. Соединение по п.1, где Y означает О; Z означает О; R3 выбирают из Н, F, Cl, метила и метоксигруппы и R4 выбирают из F, Cl, метила, метоксигруппы, трифторметила, трифторметоксигруппы, дифторметила, дифторметоксигруппы, фторметила и фторметоксигруппы.
29. Соединение по п.1, где R1 выбирают из Н, CF3, метила, Cl и метоксигруппы; R2 выбирают из Н, Cl и метила; R3 выбирают из Н, F, Cl, метила и метоксигруппы; R4 выбирают из F, Cl, метила, метоксигруппы, трифторметила, трифторметоксигруппы, дифторметила, дифторметоксигруппы, фторметила и фторметоксигруппы и R5 и R6 вместе образуют C1-9-алкилиденил или С3-9-алкенилиденил или R5, R6 и атом углерода, с которым они связаны, вместе образуют С3-7-циклоалкил.
30. Соединение по п.25, где X означает О; Y означает О или S и Z означает О.
31. Соединение по п.25, где R5 и R6 вместе образуют C1-9-алкилиденил или С3-9-алкенилиденил или R5, R6 и атом углерода, с которым они связаны, вместе образуют С3-7-циклоалкил.
32. Соединение по п.25, где R5 и R6 независимо выбирают из галогена, фенила, C1-9-алкила, C1-8-алкоксила, С2-9-алкенила, С2-9-алкенилоксигруппы, С3-7-циклоалкила, C3-7-циклоалкоксила, С3-7-циклоалкил-С1-7-алкила, С3-7-циклоалкил-С1-7-алкоксила, С3-7-циклоалкилокси-С1-6-алкила и С3-7-циклоалкилокси-С1-7-алкоксила.
33. Соединение по п.25, где m означает 1 и n означает 1.
34. Соединение по п.25, где Y означает S.
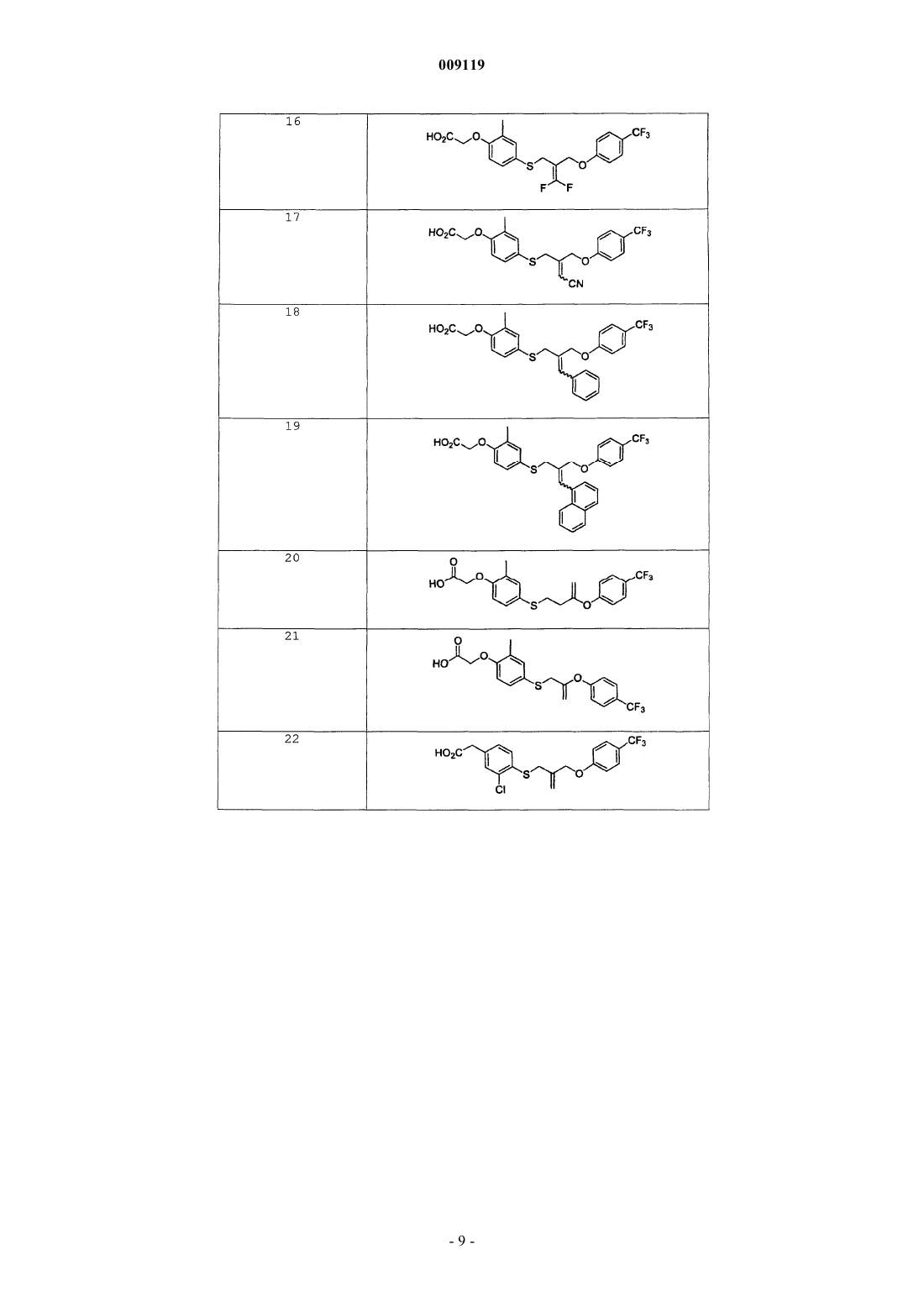
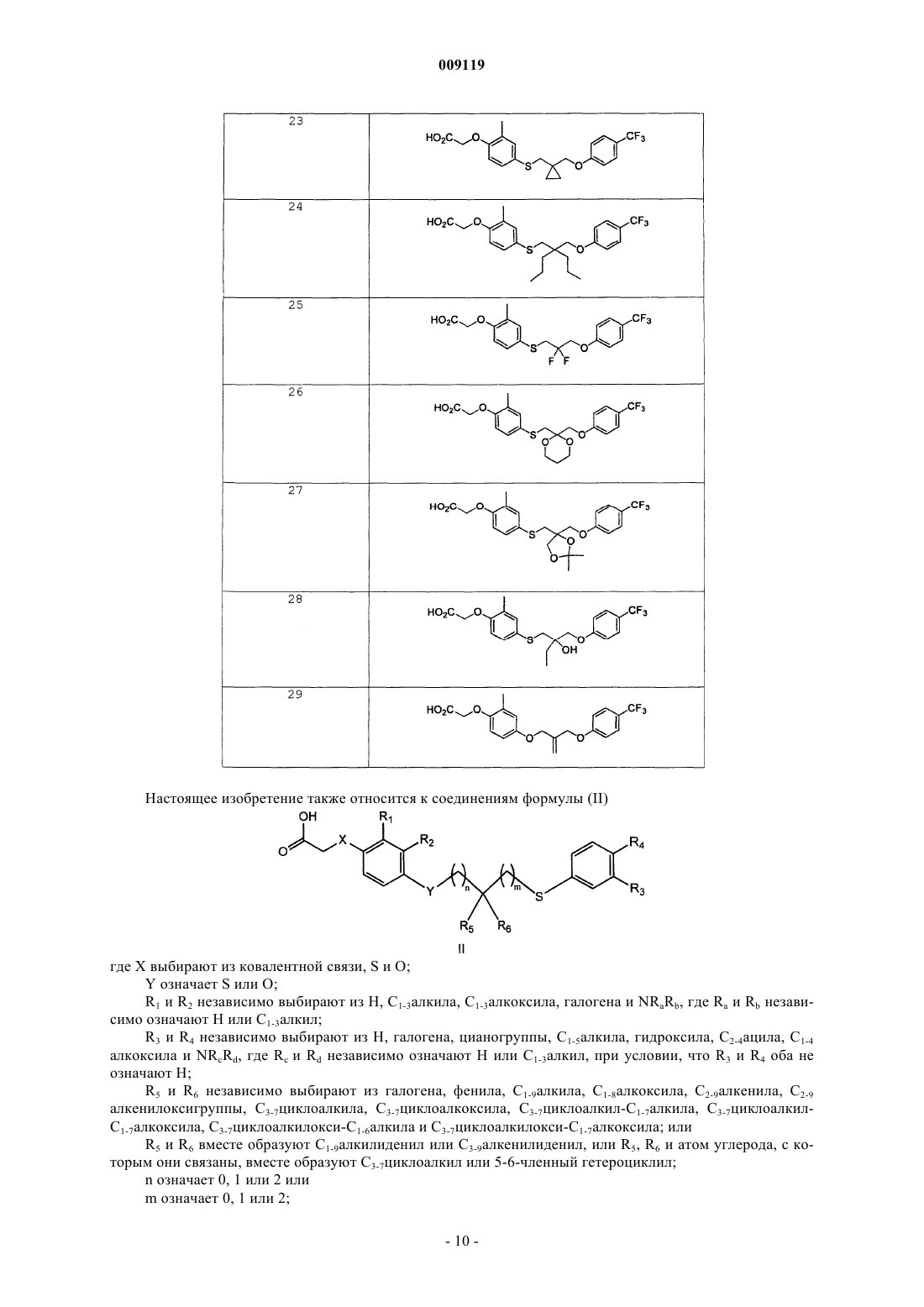
35. Соединение по п.1, выбираемое из группы, состоящей из
{2-метил-4-[2-(4-трифторметилфеноксиметил)аллилсульфанил]фенокси}уксусной кислоты;
(2-метил-4-{2-[2-(4-трифторметилфенил)этил]аллилсульфанил}фенокси)уксусной кислоты;
{2-метил-4-[2-(4-трифторметоксифеноксиметил)аллилсульфанил]фенокси}уксусной кислоты;
{2-хлор-4-[2-(4-трифторметилфеноксиметил)аллилсульфанил]фенокси}уксусной кислоты;
{2-метил-4-[3-метил-2-(4-трифторметилфеноксиметил)бут-2-енилсульфанил]фенокси}уксусной кислоты;
{4-[3,3-дифтор-2-(4-трифторметилфеноксиметил)аллилсульфанил]-2-метилфенокси}уксусной кислоты;
{3-хлор-4-[2-(4-трифторметилфеноксиметил)аллилсульфанил]фенил}уксусной кислоты;
{2-метил-4-[1-(4-трифторметилфеноксиметил)циклопропилметилсульфанил]фенокси}уксусной кислоты;
{2-метил-4-[2-пропил-2-(4-трифторметилфеноксиметил)пентилсульфанил]фенокси}уксусной кислоты;
{4-[2-(4-хлорфеноксиметил)аллилсульфанил]-2-метилфенокси}уксусной кислоты;
{4-[2-(3,4-дихлорфеноксиметил)аллилсульфанил]-2-метилфенокси}уксусной кислоты;
{4-[2-(2,4-дихлорфеноксиметил)аллилсульфанил]-2-метилфенокси}уксусной кислоты;
{4-[3-циано-2-(4-трифторметилфеноксиметил)аллилсульфанил]-2-метилфенокси}уксусной кислоты;
{2-метил-4-[3-фенил-2-(4-трифторметилфеноксиметил)аллилсульфанил]фенокси}уксусной кислоты;
{2-метил-4-[3-нафталин-1-ил-2-(4-трифторметилфеноксиметил)аллилсульфанил]фенокси}уксусной кислоты;
{4-[2,2-дифтор-3-(4-трифторметилфенокси)пропилсульфанил]-2-метилфенокси}уксусной кислоты;
{2-метил-4-[2-(4-трифторметилфеноксиметил)-[1,3]диоксан-2-илметилсульфанил]фенокси}уксусной кислоты;
{4-[2,2-диметил-4-(4-трифторметилфеноксиметил)-[1,3]диоксолан-4-илметилсульфанил]-2-метилфенокси}уксусной кислоты;
[2-метил-4-(2-феноксиметилаллилсульфанил)фенокси]уксусной кислоты;
{4-[2-(4-хлор-3-трифторметилфеноксиметил)аллилсульфанил]-2-метилфенокси}уксусной кислоты;
{4-[2-(4-метоксифеноксиметил) аллилсульфанил]-2-метилфенокси}уксусной кислоты;
{4-[2-(4-диметиламинофеноксиметил)аллилсульфанил]-2-метилфенокси}уксусной кислоты;
{2-трифторметил-4-[2-(4-трифторметилфеноксиметил)аллилсульфанил]фенокси}уксусной кислоты;
{3-хлор-4-[2-(4-трифторметилфеноксиметил)аллилсульфанил]фенокси}уксусной кислоты;
{2-метокси-4-[2-(4-трифторметилфеноксиметил)аллилсульфанил]фенокси}уксусной кислоты;
{2-метил-4-[3-(4-трифторметилфенокси)-бут-3-енилсульфанил]фенокси}уксусной кислоты;
{2-метил-4-[2-(4-трифторметилфенокси)аллилсульфанил]фенокси}уксусной кислоты;
{4-[2-гидрокси-2-(4-трифторметилфеноксиметил)бутилсульфанил]-2-метилфенокси}уксусной кислоты;
{4-[2-(4-трет-бутилфеноксиметил)аллилсульфанил]-2-метилфенокси}уксусной кислоты;
{4-[2-(4-изопропилфеноксиметил)аллилсульфанил]-2-метилфенокси}уксусной кислоты;
{2-хлор-4-[2-(3,4-дихлорфеноксиметил)аллилсульфанил]фенокси}уксусной кислоты;
{2-хлор-4-[2-(4-трифторметоксифеноксиметил)аллилсульфанил]фенокси}уксусной кислоты;
{4-[2,2-диметил-3-(4-трифторметилфенокси)пропилсульфанил]-2-метилфенокси}уксусной кислоты;
{2-хлор-4-[2,2-диметил-3-(4-трифторметилфенокси)пропилсульфанил]фенокси}уксусной кислоты;
{2-хлор-4-[1-(4-трифторметилфеноксиметил)циклопропилметилсульфанил]фенокси}уксусной кислоты;
{3-хлор-4-[2,2-диметил-3-(4-трифторметилфенокси)пропилсульфанил]фенил}уксусной кислоты;
{3-хлор-4-[2,2-диметил-3-(4-трифторметоксифенокси)пропилсульфанил]фенил}уксусной кислоты и
{3-хлор-4-[3-метил-2-(4-трифторметилфеноксиметил)-бут-2-енилсульфанил]фенил}уксусной кислоты.
36. Соединение по п.1, которым является [2-метил-4-[[2-[[4-(трифторметил)фенокси]метил]-2-пропенил]тио]фенокси]уксусная кислота.
37. Фармацевтическая композиция, включающая соединение по любому из пп.1, 16, 17, 19, 25, 26, 29, 35 и 36.
38. Способ лечения или ингибирования прогрессирования опосредуемого PPAR-дельта состояния, причем вышеуказанный способ включает введение пациенту, нуждающемуся в лечении, фармацевтически эффективного количества композиции по п.37.
39. Соединение по п.1, которым является {2-метил-4-[2-(4-трифторметилфеноксиметил)аллилсульфанил]фенокси}уксусная кислота.
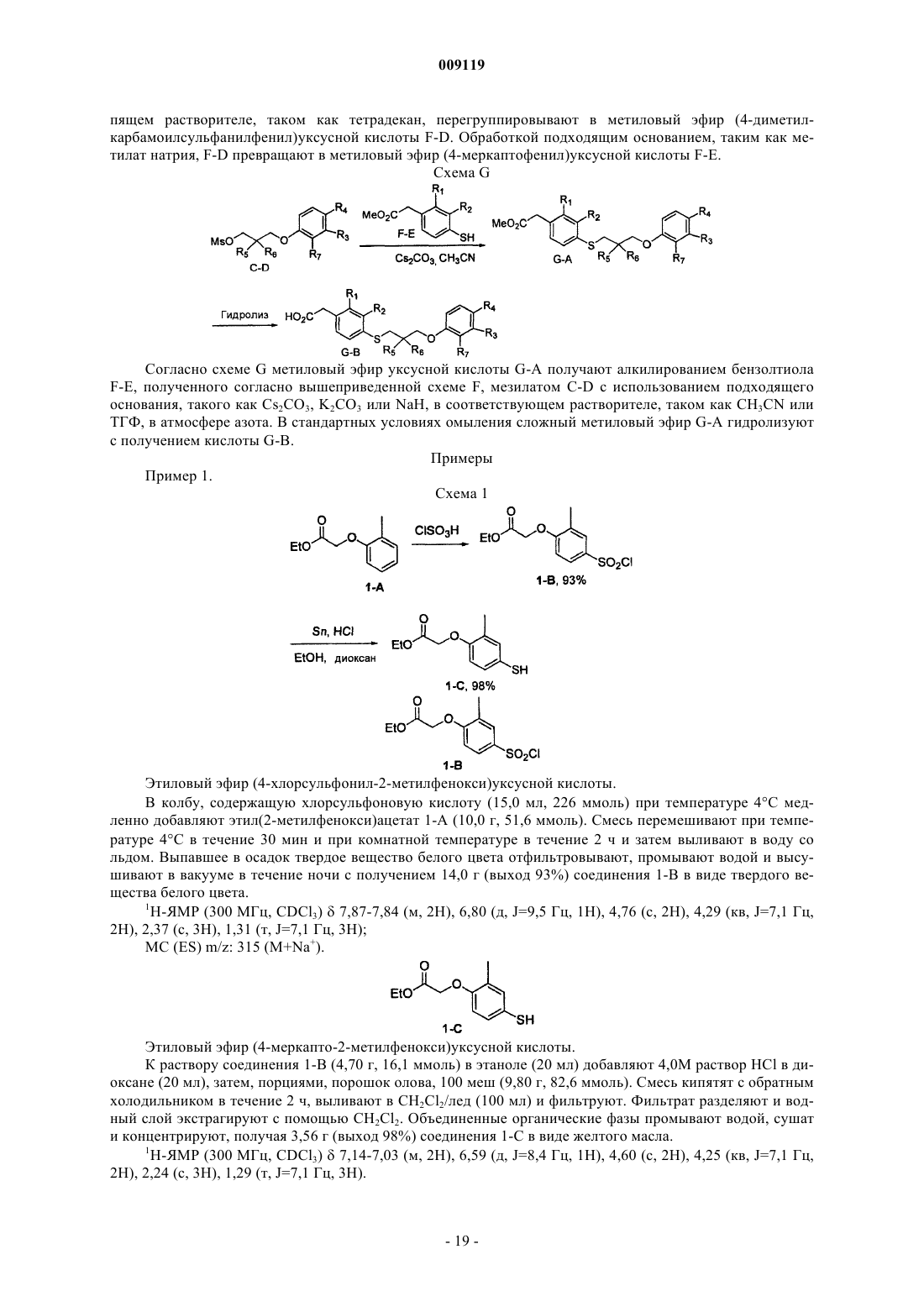
40. Соединение формулы (II)
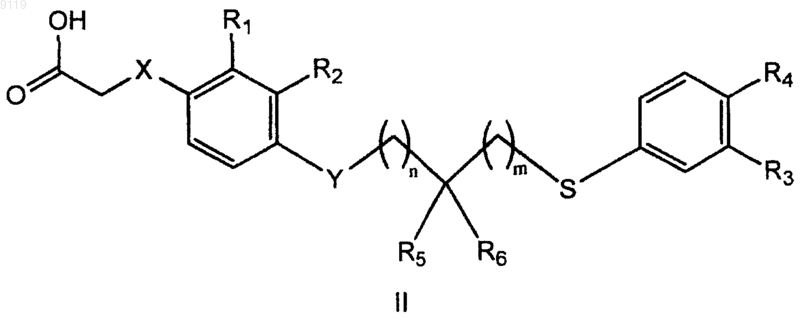
где X выбирают из ковалетной связи, S и О;
Y означает S или О;
R1 и R2 независимо выбирают из Н, C1-3-алкила, C1-3-алкоксила, галогена и NRaRb, где Ra и Rb независимо означают Н или C1-3-алкил;
R3 и R4 независимо выбирают из Н, галогена, цианогруппы, C1-5-алкила, гидроксила, С2-4-ацила, C1-4-алкоксила и NRcRd, где Rc и Rd независимо означают Н или C1-3-алкил, при условии, что R3 и R4 оба не означают Н;
R5 и R6 независимо выбирают из галогена, фенила, C1-9-алкила, C1-8-алкоксила, С2-9-алкенила, С2-9-алкенилоксигруппы, C3-7-циклоалкила, C3-7-циклоалкоксила, C3-7-циклоалкил-С1-7-алкила, C3-7-циклоалкил-С1-7-алкоксила, C3-7-циклоалкилокси-С1-6-алкила и C3-7-циклоалкилокси-С1-7-алкоксила; или
R5 и R6 вместе образуют Cl-9-алкилиденил или С3-9-алкенилиденил, или R5, R6 и атом углерода, с которым они связаны, вместе образуют С3-7-циклоалкил или 5-или 6-членный гетероциклил;
n означает 0, 1 или 2 и
m означает 0, 1 или 2;
или его фармацевтически приемлемая соль.
41. Соединение по п.40, где X означает S или О.
42. Соединение по п.41, где X означает О.
43. Соединение по п.40, где Y означает О.
44. Соединение по п.40, где Y означает S.
45. Соединение по п.40, где m означает 1.
46. Соединение по п.40, где m означает 2.
47. Соединение по п.40, где n означает 1.
48. Соединение по п.40, где R1 и R2 независимо выбирают из Н, C1-3-алкила, C1-3-алкоксила, F, Cl и Br.
49. Соединение по п.48, где R1 и R2 независимо выбирают из Н, метила, метоксигруппы, F и Cl.
50. Соединение по п.40, где R3 и R4 независимо выбирают из Н, галогена, цианогруппы, ацетила, C1-2-алкила и C1-2-алкоксила.
51. Соединение по п.50, где R3 независимо выбирают из Н, F, Cl, гидроксила, метила и метоксигруппы.
52. Соединение по п.50, где R4 независимо выбирают из F, Cl, метила, метоксигруппы, трифторметила, трифторметоксигруппы, дифторметила, дифторметоксигруппы, фторметила, фторметоксигруппы, хлордифторметила, хлордифторметоксигруппы, дихлорфторметила и дихлорфторметоксигруппы.
53. Соединение по п.40, где R3 выбирают из метила, метоксигруппы, Н, Cl, Br, I, ОН, -CH(CF3)2, CF3, -OCF3, -N(CH3)2, -O-СН2СООН и -СОСН3 и R4 выбирают из Н, Cl и метила.
54. Соединение по п.40, где R5 и R6 вместе образуют C1-9-алкилиденил или С3-9-алкенилиденил или R5, R6 и атом углерода, с которым они связаны, вместе образуют С3-7-циклоалкил.
55. Соединение по п.40, где R5 и R6 независимо выбирают из галогена, фенила, C1-9-алкила, C1-8-алкоксила, С2-9-алкенила, С2-9-алкенилоксигруппы, C3-7-циклоалкила, C3-7-циклоалкоксила, С3-7-циклоалкил-С1-7-алкила, C3-7-циклоалкил-С1-7-алкоксила, C3-7-циклоалкилокси-С1-6-алкила и С3-7-циклоалкилокси-С1-7-алкоксила.
56. Соединение по п.40, где R3 выбирают из Н, F, Cl, метила и метоксигруппы, и R4 выбирают из F, Cl, ацетила, метила, метоксигруппы, трифторметила, трифторметоксигруппы, дифторметила, дифторметоксигруппы, фторметила, фторметоксигруппы, хлордифторметила, хлордифторметоксигруппы, дихлорфторметила и дихлорфторметоксигруппы.
57. Соединение по п.40, где R1 выбирают из Н, CF3, метила, Cl и метоксигруппы и R2 выбирают из Н, Cl и метила.
58. Соединение по п.40, где X означает О и Y означает О.
59. Соединение по п.40, где X означает О и Y означает S.
60. Соединение по п.40, где X означрхт ковалентную связь и Y означает S.
61. Соединение по п.40, которым является [2-метил-4-[[2-[[[4-(трифторметил)фенил]тио]метил]-2-пропенил]тио]фенокси]уксусная кислота.
Текст
009119 Перекрестная ссыпка на родственные заявки По настоящей заявке испрашивается приоритет на основании предварительной заявки на патент США номер 60/504089, поданной 19 сентября 2003 г., которая во всей ее полноте включена в данное описание путем ссылки. Сообщение относительно финансирования Федеральным правительством научно-исследовательской работы и разработки Научно-исследовательская работа и разработка нижеописанного изобретения не финансировались Федеральным правительством. Предпосылки создания изобретения Сердечно-сосудистое заболевание (CVD) является широко распространенным в мире и часто ассоциируется с другими болезненными состояниями, такими как диабет и ожирение. Во многих исследованиях распространенности среди населения пытались идентифицировать факторы риска для CVD; из них среди наиболее важных нужно рассматривать высокие уровни в плазме холестерина липопротеинов низкой плотности (LDL-C), высокие уровни в плазме триглицеридов (200 мг/дл) и низкие уровни холестерина липопротеинов высокой плотности (HDL-C). В настоящее время существуют немногие виды терапии, нацеленные на низкие уровни холестерина липопротеинов высокой плотности и триглицериды. Рецепторы, активируемые стимулирующими рост пероксисом агентами, (PPARs) являются метаболическими сенсорами, регулирующими экспрессию генов, участвующих в глюкозном и липидном гомеостазе. Агонисты -подтипа PPAR (PPAR), такие как LOPID (гемфиброзил) и TRICOR (фенофибрат),и агонисты -подтипа PPAR (PPAR), такие как AVANDIA (розиглитазонмалеат), используют для лечения дислипидемии и диабета соответственно. Сообщалось, что другой член этого семейства нуклеарных рецепторов, дельта-рецептор, активируемый стимулирующими рост пероксисом агентами, (PPAR-дельта или PPAR) также представляет собой необходимый фактор транскрипции, вовлекаемый в регуляцию генов, участвующих в липидном метаболизме и расходе энергии. Показано, что PPAR-дельта действует как рецептор мембранного канала, модулирующий экспрессию других PPARs (Shi и др., Proc. Natl.Acad. Sci. USA, 99 (5), 2613-2618 (2002. Каждый подтип рецептора имеет определенное распределение в ткани: 1) PPAR обнаруживает самую высокую экспрессию в печени; 2) PPAR присутствует главным образом в жировой ткани и 3) PPAR имеет самое широкое распределение - повсеместно у взрослой крысы (Braissant и др., Endocrinology, 137 (1), 354-366 (1996 и во всех человеческих тканях, исследованных до настоящего времени, включая печень, почку, абдоминальную жировую ткань и скелетную мышцу (Auboeuf и др., Diabetes, 46 (8), 1319-1327 (1997. Недавно были опубликованы данные об эффективных лигандах PPAR, позволяющие лучше понимать его функцию в липидном метаболизме. Основным эффектом этих соединений в случае db/db мышей(Leibowitz и др., FEBS Lett., 473 (3), 333-336 (2000 и страдающих ожирением макак резус (Oliver и др.,Proc. Natl. Acad. Sci. USA, 98 (9), 5306-5311 (2001 является повышение содержания холестерина липопротеинов высокой плотности (HDL-C) и снижение уровня триглицеридов, с незначительным воздействием на глюкозу (хотя уровни инсулина в почках снижаются). HDL-C удаляет холестерин из периферических клеток вследствие процесса, называемого обратным транспортом холестерина. Первая и ограничивающая скорость стадия, перенос клеточного холестерина и фосфолипидов в аполипротеиновый А-1 компонент HDL, опосредуется АТФ-связывающим кассетным транспортером А 1 (АВСА 1) (Lawn и др., J.Clin. Investigation, 104 (8), R25-R31 (1999. Показано, что активация PPAR повышает уровень HDL-C вследствие транскрипционной регуляции АВСА 1 (Oliver и др., Proc. Natl. Acad. Sci. USA, 98 (9), 53065311 (2001. За счет индукции экспрессии АВСА 1 мРНК в макрофагах агонисты PPAR могут повышать уровни HDL-C у пациентов и удалять избыточный холестерин из нагруженных липидами макрофагов,ингибируя таким образом развитие атеросклеротических патологических изменений. Существующая терапия гиперхолестеринемии включает лекарственные средства на основе статина, которые снижают уровень LDL-C, но оказывают незначительное действие на HDL-C, и фибраты, агонисты PPAR, которые обладают низкой эффективностью и вызывают только умеренное повышение уровня HDL-C. Кроме того, подобно фибратам, агонисты PPAR также могут снижать уровень триглицеридов, дополнительный фактор риска для сердечно-сосудистого заболевания и диабета. Показано, что повышенный уровень жирных кислот способствует резистентности к инсулину и прогрессированию диабета (Boden G., PROCEEDINGS OF THE ASSOCIATION OF AMERICAN PHYSICIANS, 111 (3), 241-248 (май-июнь 1999. Примеры известных агонистов PPAR-дельта, разносторонне пригодных для гиперлипидемии, диабета или атеросклероза, включают L-165041 (Leibowitz и др., 2000) и GW501516 (Oliver и др., Proceedingsof the National Academy of Sciences of the United States of America, 98 (9), 5306-5311 (2001. Обработка дифференцированных ТНР-1-моноцитов с помощью GW501516 вызывает экспрессию АВСА 1 мРНК и усиливает отток холестерина из этих клеток. Краткое изложение сущности изобретения Изобретение относится к соединениям нижеуказанной формулы (I) где X выбирают из ковалетной связи, S и О;R1 и R2 независимо выбирают из Н, C1-3 алкила, C1-3 алкоксила, галогена и NRaRb, где Ra и Rb независимо означают Н или C1-3 алкил;R3 и R4 независимо выбирают из Н, галогена, цианогруппы, C1-5 алкила, гидроксила, С 2-4 ацила, C1-4 алкоксила и NRcRd, где Rc и Rd независимо означают Н или C1-3 алкил, при условии, что R3 и R4 оба не означают Н;R5 и R6 независимо выбирают из галогена, фенила, C1-9 алкила, C1-8 алкоксила, С 2-9 алкенила, С 2-9 алкенилоксигруппы, С 3-7 циклоалкила, С 3-7 циклоалкоксила, С 3-7 циклоалкил-С 1-7 алкила, С 3-7 циклоалкилС 1-7 алкоксила, С 3-7 циклоалкилокси-С 1-6 алкила и С 3-7 циклоалкилокси-С 1-7 алкоксила; илиm означает 0, 1 или 2; или их фармацевтически приемлемым солям. Изобретение также относится к композициям, которые включают одно или более соединений формулы (I) и фармацевтический носитель или эксципиент. Эти композиции и нижеуказанные способы, далее, могут включать дополнительные фармацевтически активные агенты, такие как снижающие уровень липидов агенты или снижающие кровяное давление агенты или и те, и другие. Следующий аспект изобретения включает способы применения раскрытых соединений или композиций в различных способах лечения, предотвращения или ингибирования прогрессировать состояния,прямо или косвенно опосредуемого PPAR-дельта. Вышеуказанное состояние включает, но не исчерпывающим образом, диабет, сердечно-сосудистые заболевания, метаболический синдром X, гиперхолестеринемию, гипо-HDL-холестеринемию, гипер-LDL-холестеринемию, дислипидемию, атеросклероз и ожирение. Одним вариантом осуществления настоящего изобретения является способ лечения опосредуемогоPPAR-дельта состояния, причем вышеуказанный способ включает введение пациенту, нуждающемуся в лечении, фармацевтически эффективного количества соединения или композиции, раскрытых в данном описании. Другим вариантом осуществления настоящего изобретения явлется способ ингибирования начала и/или ингибирования прогрессирования опосредуемого PPAR-дельта состояния, причем вышеуказанный способ включает введение пациенту, нуждающемуся в лечении, фармацевтически эффективного количества соединения или композиции, раскрытых в данном описании. Примеры состояний, которые можно лечить с помощью агониста PPAR-дельта, включают, но без ограничения указанным, диабет, сердечно-сосудистые заболевания, метаболический синдром X, гиперхолестеринемию, гипо-HDL-холестеринемию, гипер-LDL-холестеринемию, дислипидемию, атеросклероз и ожирение. Дислипидемия включает гипертриглицеридемию и смешанную гиперлипидемию. Например, дислипидемия (включая гиперлипидемию) может быть одним из следующих состояний: низкий уровень HDL (35 или 40 мг/дл), высокий уровень триглицеридов (200 мг/дл) и высокий уровень LDL(150 мг/дл). Дополнительные признаки и преимущества изобретения станут ясны из подробного описания, примеров и формулы изобретения, приводимых ниже. Подробное описание изобретения Изобретение относится к композициям, содержащим соединения формулы (I), согласно разделу Краткое изложение сущности изобретения и способам их применения. Предпочтительные соединения согласно изобретению являются сильными агонистами PPARдельта, которые обладают по меньшей мере одной и предпочтительно двумя или тремя из следующих характеристик, когда их вводят пациентам с гиперхолестеринемией, гипертриглицеридемией, низким уровнем HDL-C, ожирением, диабетом и/или метаболическим синдромом X: 1) повышение уровня HDLC; 2) снижение уровня триглицеридов; 3) снижение содержания свободных жирных кислот и 4) снижение уровня инсулина. Улучшение положения в отношении уровней HDL-C и триглицеридов является полезным для здоровья сердечно-сосудистой системы. Кроме того, сниженный уровень триглицеридов и-2 009119 свободных жирных кислот способствует уменьшению ожирения и уменьшает интенсивность или предотвращает диабет.PPAR-дельта, экспреесируемый повсеместно, может действовать как рецептор мембранного канала,который регулирует экспрессию/активность других нуклеарных рецепторов, таких как другие PPAR. Например, показано, что PPAR-дельта блокирует опосредуемый PPAR адипогенез и экспрессию ацилСоА-оксидазы; также показано, что он ассоциируется с сорепрессорами нуклеарного рецептора SMRT(молчащий медиатор рецепторов ретиноидных и тиреоидных гормонов), SHARP (белок-репрессор, ассоциирующийся с SMART и гистондезацетилазой) и HDAC (гистондезацетилаза). Таким образом, состояния, непосредственно опосредуемые этими нуклеарными рецепторами, такие как ожирение и диабет типа II, могут быть косвенно опосредованы PPAR-дельта (см., например, Shi и др., Proc. Natl. Acad. Sci.USA, 99 (5), 2613-2618 (2002. Некоторые аспекты изобретения относятся к лечению гипертриглицеридемии, повышению уровнейHDL, понижению уровней LDL и/или снижению общего холестерина. Предпочтительно способы лечения ассоциируются с улучшениями в отношении размера, продолжительности или степени побочных эффектов, таких как отек, обычно связанных с другими существующими видами терапии. Изобретение подробнее описывается ниже. Описание систематизировано следующим образом: А). Термины; В). Соединения; С). Синтез; D). Готовая лекарственная форма и введение; Е). Применение; F). Биологические примеры; G). Другие воплощения; и формула изобретения. А. Термины. Термин субъект, используемый в данном описании, относится к животному, предпочтительно млекопитающему, более предпочтительно человеку, который является объектом лечения, наблюдения или эксперимента. Термин терапевтически эффективное количество, используемый в данном описании, означает такое количество активного соединения или фармацевтического средства, которое вызывает биологический или лакарственный ответ в тканевой системе животного или человека, которого добивается исследователь, ветеринар, врач или другой клиницист, включающий облегчение, предохранение, лечение или задержку начала или прогрессирования симптомов заболевания или расстройства, которое лечат. Состояния, прямо или косвенно опосредуемые PPAR-дельта, включают, но не исчерпывающим образом, диабет, сердечно-сосудистые заболевания, метаболический синдром X, гиперхолестеринемию,гипо-HDL-холестеринемию, гипер-LDL-холестеринемию, дислипидемию, атеросклероз и ожирение. Для терапевтических целей термин совместно эффективное количество, используемый в данном описании, означает такое количество каждого активного соединения или фармацевтического средства,индивидуально или в комбинации, которое вызывает биологический или лекарственный ответ в тканевой системе животного или человека, которого добивается исследователь, ветеринар, врач или другой клиницист, включающий облегчение, предохранение, лечение или задержку начала или прогрессирования симптомов заболевания или расстройства, которое лечат. Для профилактических целей (т.е. ингибирование начала или прогрессирования расстройства), термин совместно эффективное количество относится к такому количеству каждого активного соединения или фармацевтического средства, индивидуально или в комбинации, которое способствует лечению или ингибированию у субъекта начала или прогрессирования расстройства, которого добивается исследователь, ветеринар, врач или другой клиницист. Таким образом, настоящее изобретение предусматривает комбинации из двух или более лекарственных средств,где, например, (а) каждое лекарственное средство вводят независимо в терапевтически или профилактически эффективном количестве; (b) по меньшей мере одно лекарственное средство в комбинации вводят в количестве, которое является ниже терапевтического или ниже профилактического количества, если его вводят индивидуально, но является терапевтическим или профилактическим количеством, когда его вводят в комбинации с другими или дополнительными лекарственными средствами согласно изобретению; или (с) оба (или более) лекарственных средства вводят в количестве, которое является ниже терапевтического или ниже профилактического количества, если их вводят индивидуально, но являются терапевтическими или профилактическими количествами, когда их вводят одновременно. Если не указано ничего другого, используемые в данном контексте самостоятельно или в качестве части замещающей группы термины алкил и алкоксил включают линейные и разветвленные цепи с 1-8 атомами углерода, такие как C1-6, C1-4, C3-8, С 2-5, или в любом другом диапазоне, и, если не указано ничего другого, оба представляют собой незамещенные и замещенные остатки. Например, C1-6 алкильные радикалы включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, третбутил, н-пентил, 3-(2-метил)бутил, 2-пентил, 2-метилбутил, неопентил, н-гексил, 2-гексил и 2 метилпентил. Алкоксильные радикалы образованы из вышеуказанных групп с линейной или разветвленной цепью. Термины алкил и алкоксил включают незамещенные или замещенные остатки с одним или более замещениями, такие как с 1-5, 1-3 или 2-4 заместителями. Заместители могут быть одинаковыми (дигидрокси, диметил), подобными (хлор, фтор) или разными (замещенный хлорбензилом или аминометилом). Примеры замещенного алкила включают галогеналкил (такой как фторметил, хлорметил,дифторметил, перхлорметил, 2-бромэтил, трифторметил и 3-иодциклопентил), гидроксиалкил (такой как гидроксиметил, гидроксиэтил, 2-гидроксипропил), аминоалкил (такой как аминометил, 2-аминоэтил, 3-3 009119 аминопропил и 2-аминопропил), алкоксиалкил, нитроалкил, алкилалкил, цианоалкил, фенилалкил, гетероарилалкил, гетероциклилалкил, феноксиалкил, гетероарилоксиалкил (такой как 2-пиридилоксиалкил),гетероциклилоксиалкил (такой как 2-тетрагидропираноксиалкил), тиоалкилалкил (такой как MeS-алкил),тиофенилалкил (такой как phS-алкил), карбоксиалкил и тому подобное. Ди-(C1-3 алкил)аминогруппа включает независимо выбираемые алкильные группы с образованием, например, метилпропиламиногруппы и изопропилметиламиногруппы, причем, кроме того, диалкиламиногруппы включают две одинаковые алкильные группы, такие как диметиламиногруппа или диэтиламиногруппа. Термин алкенил включает необязательно замещенные с линейной цепью или разветвленные углеводородные радикалы, указанные выше, по меньшей мере с одной углерод-углеродной двойной связью(sp2). Алкенилы включают этенил (или винил), проп-1-енил, проп-2-енил (или аллил), изопропенил (или 1-метилвинил), бут-1-енил, бут-2-енил, бутадиенилы, пентенилы, гекса-2,4-диенил и тому подобное. Углеводородные радикалы, включающие смесь двойных связей и тройных связей, такие как 2-пентен-4 инил, в данном описании классифицируются как алкинилы. Алкенил включает циклоалкенил. В рамки настоящего изобретения входят цис- и транс-формы или (Е)- и (Z)-формы. Алкенил может быть замещен одним или более заместителями, включая, но не исчерпывающим образом, цианоалкенил и тиоалкенил. Термин алкинил включает необязательно замещенные с линейной цепью и разветвленные углеводородные радикалы, указанные выше, по меньшей мере с одной углерод-углеродной тройной связью(sp). Алкинилы включают этинил, пропинилы, бутинилы и пентинилы. Углеводородные радикалы,включающие смесь двойных связей и тройных связей, такие как 2-пентен-4-инил, в данном описании классифицируют как алкинилы. Алкинил не представляет собой циклоалкинил. Термин Ас, как используемый в данном описании, который используют самостоятельно или в качестве части замещающей группы, означает ацетил (СН 3 СО-). Термин ацил, используемый в данном описании, относится к заместителю, который имеет карбонильную группу (С=O) и одну или более алкильных или алкиленовых групп. Например, С 2-4 ацил включает, не исчерпывающим образом, ацетил,СН 3 СН 2-(С=O)-СН 2- и СН 3 СН 2 СН 2(C=O)-. Термин галоген включает иод, бром, хлор и фтор. Термины арил или Ar, используемые в данном описании, относятся к незамещенной или замещенной ароматической углеводородной циклической системе, такой как фенил или нафтил. Когда Ar или арильная группа замещена, она может иметь от одного до трех заместителей, которые независимо выбирают из (C1-C8)алкила, (C1-C8)алкоксила, фторированного (C1-C8)алкила (например, трифторметил), фторированного (C1-C8)алкоксила (например, трифторметоксигруппа), галогена, цианогруппы, (C1-С 8) алкилкарбонила, такого как ацетил, карбоксила, гидроксила, аминогруппы, нитрогруппы, (C1-C4) алкиламиногруппы (т.е. -NH-(C1-C4)алкил), (C1-C4)диалкиламиногруппы (т.е. -N-[(C1-С 4)алкил]2, где алкильные группы могут быть одинаковыми или разными) или незамещенного, моно-, ди- или тризамещенного фенила, где заместители у фенила независимо выбирают из (C1-C8)алкила, (C1-C8)алкоксила,фторированного (C1-C8)алкила, фторированного (C1-C8)алкоксила, галогена, цианогруппы, ацетила, карбоксила, гидроксила, аминогруппы, нитрогруппы, алкиламиногруппы, диалкиламиногруппы или пятиили шестичленного гетероарила с 1-3 гетероатомами, выбираемыми из N, О и S. Термин гетероарил, используемый в данном описании, означает стабильную, незамещенную или замещенную пяти- или шестичленную моноциклическую или бициклическую ароматическую систему,которая состоит из атомов углерода и из от одного до трех гетероатомов, выбираемых из N, О и S. Гетероарильная группа может быть присоединена по любому гетероатому или атому углерода, что приводит к образованию стабильной структуры. Примеры гетероарильных групп включают, но не исчерпывающим образом, бензимидазолил, бензизоксазолил, бензофуранил, бензопиразолил, бензотиадиазолил, бензотиазолил, бензотиенил, бензотриазолил, бензоксазолил, фуранил, фуразанил, фурил, имидазолил, индазолил, индолизинил, индолинил, индолил, изобензофуранил, изоиндолил, изотиазолил, изоксазолил,оксазолил, пуринил, пиразинил, пиразолил, пиридазинил, пиридинил, пиримидинил, пирролил, хинолинил, хинолил, тиадиазолил, тиазолил, тиофенил или триазолил. Когда гетероарильная группа замещена,гетероарильная группа может иметь от одного до трех заместителей, включающих, но не исчерпывающим образом, (C1-C8)алкил, галоген и арил. Термин гетероциклил включает необязательно замещенные неароматические циклы, содержащие атомы углерода и по меньшей мере один гетероатом (О, S, N) или гетероатомную составляющую (SO2,CO, CONH, СОО) в цикле. Гетероциклил может быть насыщенным, частично насыщенным, неароматическим или конденсированным. Примеры гетероциклила включают циклогексиламиногруппу, имидазолидинил, имидазолинил, морфолинил, пиперазинил, пиперидил, пиридил, пиранил, пиразолидинил, пиразолинил, пирролидинил, пирролинил и тиенил. Если не указано ничего другого, гетероарил и гетероциклил могут иметь валентность, связывающую его с остальной частью молекулы через атом углерода, такой как 3-фурил или 2-имидазолил, или через гетероатом, такой как N-пиперидил или 1-пиразолил. Предпочтительно моноциклический гетероциклил имеет 5-7-атомов в цикле или 5-6 атомов в цикле; в цикле могут быть от 1 до 5 гетероатомов или гетероатомных составляющих и предпочтительно от 1 до 3 или от 1 до 2 гетероатомов или гетероатом-4 009119 ных составляющих. Гетероциклил и гетероарил также включают конденсированные циклы, например бициклы, такие как необязательно конденсированные с необязательно замещенным карбоциклическим или гетероциклическим пяти- или шестичленным ароматическим циклом. Например, гетероарил включает необязательно замещенный шестичленный гетероароматический цикл, содержащий 1, 2 или 3 атома азота, конденсированный с необязательно замещенным пяти- или шестичленным карбоциклическим или гетероциклическим ароматическим циклом. Вышеуказанный гетероциклический пяти- или шестичленный ароматический цикл, конденсированный с вышеуказанным пяти- или шестичленным ароматическим циклом, может содержать 1, 2 или 3 атома азота, в случае, где он является шестичленным циклом, или 1, 2 или 3 гетероатома, выбираемых из кислорода, азота и серы, в случае, где он является пятичленным циклом. Подразумевают, что определение любого заместителя или переменной в конкретном положении в молекуле не зависит от его определений где-нибудь в другом месте в этой молекуле. Подразумевают, что заместители и взаиморасположения заместителей в соединениях согласно настоящему изобретению могут быть выбраны специалистом в данной области для получения соединений, которые химически стабильны и которые могут быть легко синтезированы известными в данной области способами, а также способами, приводимыми далее в данном описании. В случае, где химические остатки являются комбинированными, такими как в этоксиметиле или фенилэтиле, термин описывается в направлении от периферии к месту связывания с остальной частью молекулы. Например, этоксиметил представляет собой СН 3 СН 2 ОСН 2-, а фенилэтил является фенильной группой, связанной через -СН 2 СН 2- с остальной частью молекулы (а не фенильная группа, связанная с молекулой, имеющая СН 3 СН 2-группу в качестве заместителя в фениле). В случае, где используют скобки, они указывают на периферическое замещение. Подразумевают, что термин композиция, используемый в данном описании, означает продукт,включающий указанные ингредиенты в указанных количествах, а также любой продукт, который получают, прямо или косвенно, из комбинаций указанных ингредиентов в указанных количествах. Соединения согласно изобретению описываются далее в ближайшем разделе. В. Соединения. Настоящее изобретение относится к композициям, содержащим соединения формулы (I), описанные выше, и способам их применения. Если не указано ничего другого, в формуле (I) каждый гидрокарбил (алкил, алкенил, алкинил, циклоалкил, циклоалкенил и т.д.) или гетерокарбил (гетероциклил, гетероарил, гетероатомная составляющая, такая как сульфонил, амино, амидо и т.д.) может быть замещенным или незамещенным, например, алкил включает замещенный и незамещенный алкил, а гетероциклил и арил и алкоксил, и тому подобное, также может быть замещенным или незамещенным. Например, в случае, где R4 означает метил или метокси, если не указано ничего другого, эти термины все вместе включают метил, метоксигруппу, трифторметил, трифторметоксигруппу, дифторметил, дифторметоксигруппу, фторметил, фторметоксигруппу, хлордифторметил, хлордифторметоксигруппу, дихлорфторметил и дихлорфторметоксигруппу и тому подобное. Примеры включают такие соединения, где: (а) X означает S или О; (b) X означает ковалентную связь; (с) X означает О; (d) Y означает О; (е) Y означает S; (f) Z означает О; (g) Z означает СН или СН 2;(h) m означает 1; (i) m означает 2; (k) n означает 1; (l) R1 и R2 независимо выбирают из Н, C1-3 алкила, C1-3 алкоксила, F, Cl и Br; (m) R1 и R2 независимо выбирают из Н, метила, метоксигруппы, F и Cl; (n) R3 и R4 независимо выбирают из Н, галогена, цианогруппы, ацетила, C1-2 алкила и C1-2 алкоксила; (о) R3 независимо выбирают из Н, F, Cl, метила и метоксигруппы; (р) R4 независимо выбирают из Н, галогена, цианогруппы, С 1-2 алкила и C1-2 алкоксила; (q) R3 независимо выбирают из Н, галогена, цианогруппы, C1-2 алкила и C1-2 алкоксила, и R4 независимо выбирают из F, Cl, метила и метоксигруппы; (r) R3 выбирают из метила, метоксигруппы, Н, Cl, Br, I, ОН, -CH(CF3)2, CF3, -OCF3, -N(CH3)2, -O-СН 2 СООН и -СОСН 3, и R4 выбирают из Н, Cl и метила; (s) R5 и R6 вместе образуют C1-9 алкилиденил или С 3-9 алкенилиденил, или R5,R6 и атом углерода, с которым они связаны, вместе образуют С 3-7 циклоалкил; (t) R5 и R6 независимо выбирают из галогена, фенила, C1-9 алкила, C1-8 алкоксила, С 2-9 алкенила, С 2-9 алкенилоксигруппы, С 3-7 циклоалкила, С 3-7 циклоалкоксила, С 3-7 циклоалкил-С 1-7 алкила, С 3-7 циклоалкил-С 1-7 алкоксила, С 3-7 циклоалкилокси-С 1-6 алкила и С 3-7 циклоалкилокси-С 1-7 алкоксила; (u) R3 выбирают из Н, F, Cl, метила и метоксигруппы, и R4 выбирают из F, Cl, ацетила, метила, метоксигруппы, трифторметила, трифторметоксигруппы,дифторметила, дифторметоксигруппы, фторметила, фторметоксигруппы; (v) R1 выбирают из Н, CF3, метила, Cl и метоксигруппы, и R2 выбирают из Н, Cl и метила; (w) X означает О и Y означает О; (х) Z означает О и Y означает О; (у) R1 выбирают из Н, CF3, метила, Cl и метоксигруппы, R2 выбирают из Н, Cl и метила, R3 выбирают из Н, F, Cl, метила и метоксигруппы, и R4 выбирают из F, Cl, метила и метоксигруппы; (z) X означает О, Y означает О, R3 выбирают из Н, F, Cl, метила и метоксигруппы, и R4 выбирают из F, Cl, метила и метоксигруппы; (z2) Z означает О, Y означает О, R3 выбирают из H, F, Cl, метила и метоксигруппы, и R4 выбирают из F, Cl, метила и метоксигруппы; (аа) R1 выбирают из Н, CF3, метила, Cl и метоксигруппы, R2 выбирают из Н, Cl и метила, R3 выбирают из Н, F, Cl, метила и метоксигруппы, R4 выбирают из F, Cl, метила и метоксигруппы, и R5 и R6 вместе образуют C1-9 алкилиденил или С 3-9 алкенил-5 009119 иденил или R5, R6 и атом углерода, с которым они связаны, вместе образуют С 3-7 циклоалкил; (bb) X означает О, Y означает О, Z означает О, R1 выбирают из Н, CF3, метила, Cl и метоксигруппы, R2 выбирают из Н, Cl и метила, R3 выбирают из Н, F, Cl, метила и метоксигруппы, R4 выбирают из F, Cl, метила и метоксигруппы, и R5 и R6 независимо выбирают из галогена, фенила, C1-9 алкила, С 1-8 алкоксила, С 2-9 алкенила, С 2-9 алкенилоксигруппы, С 3-7 циклоалкила, С 3-7 циклоалкоксила, С 3-7 циклоалкил-С 1-7 алкила, С 3-7 циклоалкил-С 1-7 алкоксила, С 3-7 циклоалкилокси-С 1-6 алкила и С 3-7 циклоалкилокси-С 1-7 алкоксила; (cc) X означает О, Y означает О, Z означает О, R1 выбирают из Н, CF3, метила, Cl и метоксигруппы, R2 выбирают из Н, Cl и метила, R3 выбирают из Н, F, Cl, метила и метоксигруппы, и R4 выбирают из F, Cl, метила и метоксигруппы; (dd) X означает О, Y означает О, Z означает О, R1 выбирают из Н, CF3, метила, Cl и метоксигруппы, R2 выбирают из Н, Cl и метила, R3 выбирают из Н, F, Cl, метила и метоксигруппы, R4 выбирают из F, Cl, метила и метоксигруппы, и R5 и R6 вместе образуют C1-9 алкилиденил или С 3-7 алкенилиденил или R5, R6 и атом углерода, с которым они связаны, вместе образуют С 3-7 циклоалкил; (ее)X означает О, Y означает О, Z означает О, R1 выбирают из Н, CF3, метила, Cl и метоксигруппы, R2 выбирают из Н, Cl и метила, R3 выбирают из Н, F, Cl, метила и метоксигруппы, R4 выбирают из F, Cl, метила и метоксигруппы, и R5 и R6 независимо выбирают из галогена, фенила, C1-9 алкила, C1-8 алкоксила, С 2-9 алкенила, С 2-9 алкенилоксигруппы, С 3-7 циклоалкила, С 3-7 циклоалкоксила, С 3-7 циклоалкил-С 1-7 алкила, С 3-7 циклоалкил-С 1-7 алкоксила, С 3-7 циклоалкилокси-С 1-6 алкила и С 3-7 циклоалкилокси-С 1-7 алкоксила; (ff) X означает О, Y означает О или S, Z означает О, R1 выбирают из Н, CF3, метила, Cl и метоксигруппы, R2 выбирают из Н, Cl и метила, R3 выбирают из Н, F, Cl, метила и метоксигруппы, R4 выбирают из F, Cl,метила и метоксигруппы, m означает 1 и n означает 1; (gg) X означает О, Y означает О или S, Z означает О, R1 выбирают из Н, CF3, метила, Cl и метоксигруппы, R2 выбирают из Н, Cl и метила, R3 выбирают из Н, F, Cl, метила и метоксигруппы, R4 выбирают из F, Cl, метила и метоксигруппы, m означает 1, n означает 1, и R5 и R6 независимо выбирают из галогена, фенила, C1-9 алкила, C1-8 алкоксила, С 2-9 алкенила, С 2-9 алкенилоксигруппы, С 3-7 циклоалкила, С 3-7 циклоалкоксила, С 3-7 циклоалкил-С 1-7 алкила, С 3-7 циклоалкилС 1-7 алкоксила, С 3-7 циклоалкилокси-С 1-6 алкила и С 3-7 циклоалкилокси-C1-7 алкоксила или комбинации вышеуказанных соединений. Соединения согласно настоящему изобретению далее могут быть выбраны из группы, состоящей из 2-метил-4-[2-(4-трифторметилфеноксиметил)аллилсульфанил]феноксиуксусной кислоты;-6 009119 4-[2-гидрокси-2-(4-трифторметилфеноксиметил)бутилсульфанил]-2-метилфеноксиуксусной кислоты; 4-[2-(4-трет-бутилфеноксиметил)аллилсульфанил]-2-метилфеноксиуксусной кислоты; 4-[2-(4-изопропилфеноксиметил)аллилсульфанил]-2-метилфеноксиуксусной кислоты; 2-хлор-4-[2-(3,4-дихлорфеноксиметил)аллилсульфанил]феноксиуксусной кислоты; 2-хлор-4-[2-(4-трифторметоксифеноксиметил)аллилсульфанил]феноксиуксусной кислоты; 4-[2,2-диметил-3-(4-трифторметилфенокси)пропилсульфанил]-2-метилфеноксиуксусной кислоты; 2-хлор-4-[2,2-диметил-3-(4-трифторметилфенокси)пропилсульфанил]феноксиуксусной кислоты; 2-хлор-4-[1-(4-трифторметилфеноксиметил)циклопропилметилсульфанил]феноксиуксусной кислоты; 3-хлор-4-[2,2-диметил-3-(4-трифторметилфенокси)пропилсульфанил]фенилуксусной кислоты; 2-метил-4-[2-(4-трифторметилфеноксиметил)аллилсульфанил]феноксиуксусной кислоты; 3-хлор-4-[2,2-диметил-3-(4-трифторметоксифенокси)пропилсульфанил]фенилуксусной кислоты и 3-хлор-4-[3-метил-2-(4-трифторметилфеноксиметил)-бут-2-енилсульфанил]фенилуксусной кислоты. Далее, следующим является соединение согласно настоящему изобретению[2-метил-4-2-4-(трифторметил)фенокси]метил]-2-пропенил]тио]фенокси]уксусная кислота. Настоящее изобретение также относится к композициям, содержащим соединения формулы (I), и способам их применения. В частности, согласно изобретению предусматриваются композиции, содержащие соединения формулы (I), приведенные выше в качестве примеров, и способы их применения. Примеры предпочтительных соединений включают таковые, описанные в табл. 1 ниже. Таблица 1 Настоящее изобретение также относится к соединениям формулы (II) где X выбирают из ковалентной связи, S и О;R1 и R2 независимо выбирают из Н, C1-3 алкила, C1-3 алкоксила, галогена и NRaRb, где Ra и Rb независимо означают Н или C1-3 алкил;R3 и R4 независимо выбирают из Н, галогена, цианогруппы, C1-5 алкила, гидроксила, С 2-4 ацила, C1-4 алкоксила и NRcRd, где Rc и Rd независимо означают Н или C1-3 алкил, при условии, что R3 и R4 оба не означают Н;R5 и R6 независимо выбирают из галогена, фенила, C1-9 алкила, C1-8 алкоксила, С 2-9 алкенила, С 2-9 алкенилоксигруппы, C3-7 циклоалкила, C3-7 циклоалкоксила, C3-7 циклоалкил-С 1-7 алкила, С 3-7 циклоалкилС 1-7 алкоксила, С 3-7 циклоалкилокси-С 1-6 алкила и C3-7 циклоалкилокси-С 1-7 алкоксила; или- 10009119 или их фармацевтически приемлемым солям. Конкретным примером таких соединений является [2-метил-4-2-4-(трифторметил)фенил] тио]метил]-2-пропенил]тио]фенокси]уксусная кислота(PPAR-дельта, ЕС 50: 80, 45, 38 нМ). В случае, где соединения согласно данному изобретению имеют по меньшей мере один хиральный центр, они могут, соответственно, существовать в виде энантиомеров. В случае, где соединения имеют два или более хиральных центра, они могут, кроме того, существовать в виде диастереомеров. Подразумевают, что все эти изомеры и их смеси входят в рамки настоящего изобретения. Более того, некоторые кристаллические формы соединений могут существовать в виде полиморфов, и подразумевают, что как таковые они входят в рамки настоящего изобретения. Кроме того, некоторые из соединений могут образовывать сольваты с водой (т.е. гидраты) или обычными органическими растворителями, и подразумевают, что такие сольваты также входят в рамки настоящего изобретения. Далее, представляют интерес следующие соединения:(PPTAR-дельта, ЕС 50: 500 нМ). Настоящее изобретение относится к раскрытым соединениям и родственным, фармацевтически приемлемым формам раскрытых соединений, таким как их соли, сложные эфиры, амиды, гидраты или сольваты; замаскированным или защищенным формам; и рацемическим смесям или энантиомерно или оптически чистым формам. Фармацевтически приемлемые соли, сложные эфиры и амиды включают соли карбоновых кислот(как, например, C1-8 алкил-, циклоалкил-, арил-, гетероарил- или неароматические гетероциклилкарбоновые кислоты), аддитивные соли аминокислот, сложные эфиры и амиды, которые обладают приемлемым соотношением польза/риск, фармакологически эффективны и пригодны для контакта с тканями пациентов без чрезмерной токсичности, раздражения или аллергической ответной реакции. Типичные соли включают гидробромид, гидрохлорид, сульфат, бисульфат, нитрат, ацетат, оксалат, валерат, олеат, пальмитат, стеарат, лаурат, борат, бензоат, лактат, фосфат, тозилат, цитрат, малеат, фумарат, сукцинат, тартрат, нафтилат, мезилат, глюкогептонат, лактиобионат и лаурилсульфонат. Они могут включать катионы щелочных и щелочно-земельных металлов, таких как натрий, калий, кальций и магний, а также нетоксичный аммоний, четвертичный аммоний и амино-катионы, такие как тетраметиламмоний, метиламин,триметиламин и этиламин. См., например, статью S.M. Berge и др., "Pharmaceutical Salts", J. Pharm. Sci.,1977, 66: 1-19, которая включена в данное описание путем ссылки. Типичные фармацевтически приемлемые амиды согласно изобретению включают таковые, происходящие от аммиака, первичных Cl-6 алкиламинов и вторичных ди(C1-6 алкил)аминов. Вторичные амины включают остатки 5- или 6-членного гетероцикла или гетероароматического цикла, содержащие по меньшей мере один атом азота и необязательно от 1 до 2 дополнительных гетероатомов. Предпочтительные амиды происходят от аммиака, первичных C1-3 алкиламинов и ди(С 1-2 алкил)аминов. Типичные фармацевтически приемлемые сложные эфиры согласно изобретению включают C1-7 алкиловые, С 5-7 циклоалкиловые, фениловые и фенил(C1-6) алкиловые сложные эфиры. Предпочтительные сложные эфиры включают сложные метиловые эфиры. Настоящее изобретение также включает раскрытые соединения, имеющие одну или более функциональных групп (как, например, аминогруппа или карбоксильная группа), замаскированных защитной группой. Некоторые из этих замаскированных или защищенных соединений являются фармацевтически приемлемыми; другие могут быть пригодны в качестве промежуточных продуктов. Синтетические промежуточные продукты и способы, раскрытые в данном описании, и их незначительные модификации также входят в рамки настоящего изобретения. Гидроксизащитные группы Защита гидроксильной группы включает простые метиловые эфиры, замещенные простые метиловые эфиры, замещенные простые этиловые эфиры, замещенные простые бензиловые эфиры и простые силиловые эфиры. Замещенные простые метиловые эфиры Примеры замещенных простых метиловых эфиров включают метилоксиметил, метилтиометил,трет-бутилтиометил, (фенилдиметилсилил)метоксиметил, бензилоксиметил, п-метоксибензилоксиметил,(4-метоксифенокси)метил, гваяколметил, трет-бутоксиметил, 4-пентенилоксиметил, силоксиметил, 2 метоксиэтоксиметил,2,2,2-трихлорэтоксиметил,бис(2-хлорэтокси)метил,2-(триметилсилил) этоксиметил, тетрагидропиранил, 3-бромтетрагидропиранил, тетрагидротиопиранил, 1-метоксициклогексил, 4-метокситетрагидропиранил, 4-метокситетрагидротиопиранил, S,S-диоксидо-4-метокси- 12009119 тетрагидротиопиранил, 1-[(2-хлор-4-метил)фенил]-4-метоксипиперидин-4-ил, 1,4-диоксан-2-ил, тетрагидрофуранил, тетрагидротиофуранил и 2,3,3 а,4,5,6,7,7 а-октагидро-7,8,8-триметил-4,7-метанобензофуран-2-ил. Замещенные простые этиловые эфиры Примеры замещенных простых этиловых эфиров включают 1-этоксиэтил, 1-(2-хлорэтокси)этил, 1 метил-1-метоксиэтил, 1-метил-1-бензилоксиэтил, 1-метил-1-бензилокси-2-фторэтил, 2,2,2-трихлорэтил,2-триметилсилилэтил, 2-(фенилселенил)этил, трет-бутил, аллил, п-хлорфенил, п-метоксифенил, 2,4 динитрофенил и бензил. Замещенные простые бензиловые эфиры Примеры замещенных простых бензиловых эфиров включают п-метоксибензил, 3,4-диметоксибензил, о-нитробензил, п-нитробензил, п-галогенбензил, 2,6-дихлорбензил, п-цианобензил, п-фенилбензил, 2- и 4-пиколил, N-оксидо-3-метил-2-пиколил, дифенилметил, п,п'-динитробензгидрил, 5-дибензосуберил, трифенилметил, -нафтилдифенилметил, п-метоксифенилдифенилметил, ди(п-метоксифенил) фенилметил, три(п-метоксифенил)метил, 4-(4'-бромфенацилокси)фенилдифенилметил, 4,4',4"-трис(4,5 дихлорфталимидофенил)метил, 4,4',4"-трис(левулиноилоксифенил)метил, 4,4',4"-трис(бензоилоксифенил)метил, 3-(имидазол-1-илметил)бис(4',4"-диметоксифенил)метил, 1,1-бис(4-метоксифенил)-1'-пиренилметил, 9-антрил, 9-(9-фенил)ксантенил, 9-(9-фенил-10-оксо)антрил, 1,3-бензодитиолан-2-ил и S,Sдиоксидобензизотиазолил. Простые силиловые эфиры Примеры силиловых эфиров включают триметилсилил, триэтилсилил, триизопропилсилил, диметилизопропилсилил, диэтилизопропилсилил, диметилтексилсилил, трет-бутилдиметилсилил, трет-бутилдифенилсилил, трибензилсилил, три-п-ксилилсилил, трифенилсилил, дифенилметилсилил и третбутилметоксифенилсилил. Сложные эфиры В дополнение к простым эфирам, гидроксильная группа может быть защищена в виде сложного эфира. Примеры сложных эфиров включают формиат, бензоилформиат, ацетат, хлорацетат, дихлорацетат, трихлорацетат, трифторацетат, метоксиацетат, трифенилметоксиацетат, феноксиацетат, пхлорфеноксиацетат, п-Р-фенилацетат, 3-фенилпропионат, 4-оксопентаноат (левулинат), 4,4-(этилендитио)пентаноат, пивалоат, адамантоат, кротонат, 4-метоксикротонат, бензоат, п-фенилбензоат, 2,4,6 триметилбензоат (мезитоат). Карбонаты Примеры карбонатов включают метил-, 9-флуоренилметил-, этил-, 2,2,2-трихлорэтил-, 2-(триметилсилил)этил-, 2-(фенилсульфонил)этил-, 2-(трифенилфосфонио)этил-, изобутил-, винил-, аллил-, п-нитрофенил-, бензил-, п-метоксибензил-, 3,4-диметоксибензил-, о-нитробензил-, п-нитробензил-, S-бензилтиокарбонат, 4-этокси-1-нафтил-и метилдитиокарбонат. Расщепляемые под действием реагента группы Примеры расщепляемых под действием реагента групп включают 2-иодбензоат, 4-азидобутират, 4 нитро-4-метилпентаноат, о-(дибромметил)бензоат, 2-формилбензолсульфонат, 2-(метилтиометокси) этилкарбонат, 4-(метилтиометокси)бутират и 2-(метилтиометоксиметил)бензоат. Разнообразные сложные эфиры Примеры разнообразных сложных эфиров включают 2,6-дихлор-4-метилфеноксиацетат, 2,6-дихлор 4-(1,1,3,3-тетраметилбутил)феноксиацетат, 2,4-бис(1,1-диметилпропил)феноксиацетат, хлордифенилацетат, изобутират, моносукциноат, (Е)-2-метил-2-бутеноат (тиглоат), о-(метоксикарбонил)бензоат, п-Рбензоат, -нафтоат, нитрат, алкил-N,N,N',N'-тетраметилфосфородиамидат, N-фенилкарбамат, борат, диметилфосфинотиоил и 2,4-динитрофенилсульфенат. Сульфонаты Примеры сульфонатов включают сульфат, метансульфонат (мезилат), бензилсульфонат и тозилат. Аминозащитные группы Защита для аминогруппы включает карбаматы, амиды и специальные-NH-защитные группы. Примеры карбаматов включают метил- и этилкарбаматы, замещенные этилкарбаматы, расщепляемые под действием реагента карбаматы, фотолитически расщепляемые карбаматы, производные типа мочевины и разнообразные карбаматы. Карбаматы Примеры метил- и этилкарбаматов включают метил- и этил-, 9-флуоренилметил-, 9-(2-сульфо) флуоренилметил-, 9-(2,7-дибром)флуоренилметил-, 2,7-ди-трет-бутил-[9-(10,10-диоксо-10,10,10,10-тетрагидротиоксантил)]метил- и 4-метоксифенацилкарбамат. Замещенные этилкарбаматы Примеры замещенных этилкарбаматов включают 2,2,2-трихлорэтил-, 2-триметилсилилэтил-, 2 фенилэтил-, 1-(1-адамантил)-1-метилэтил-, 1,1-диметил-2-галогенэтил-, 1,1-диметил-2,2-дибромэтил-,1,1-диметил-2,2,2-трихлорэтил-, 1-метил-1-(4-бифенилил)этил-, 1-(3,5-ди-трет-бутилфенил)-1-метилэтил-,2-(2'- и 4'-пиридил)этил-, 2-(N,N-дициклогексилкарбоксамидо)этил-, трет-бутил-, 1-адамантил-, винил-,- 13009119 аллил-, 1-изопропилаллил-, циннамил-, 4-нитроциннамил-, 8-хинолил-, N-гидроксипиперидинил-, алкилдитио-, бензил-, п-метоксибензил-, п-нитробензил-, п-бромбензил-, п-хлорбензил-, 2,4-дихлорбензил-, 4 метилсульфинилбензил-, 9-антрилметил- и дифенилметилэтилкарбамат. Расщепляемые под действием реагента группы Примеры расщепляемых под действием реагента групп включают 2-метилтиоэтил, 2-метилсульфонилэтил, 2-(п-толуолсульфонил)этил, [2-(1,3-дитианил)]метил, 4-метилтиофенил, 2,4-диметилтиофенил, 2-фосфониоэтил, 2-трифенилфосфониоизопропил, 1,1-диметил-2-цианоэтил, м-хлор-п-ацилоксибензил, п-(дигидроксиборил)бензил, 5-бензизоксазолилметил и 2-(трифторметил)-6-хромонилметил. Фотолитически расщепляемые группы Примеры фотолитически расщепляемых групп включают м-нитрофенил, 3,5-диметоксибензил, онитробензил, 3,4-диметокси-6-нитробензил и фенил(о-нитрофенил)метил. Производные типа мочевины Примеры производных типа мочевины включают фенотиазинил-(10)-карбонильное производное,N'-п-толуолсульфониламинокарбонил и N'-фениламинотиокарбонил. Разнообразные карбаматы Примеры разнообразных карбаматов включают трет-амилкарбамат, S-бензилтиокарбамат, пцианобензил-, циклобутил-, циклогексил-, циклопентил-, циклопропилметил-, п-децилоксибензил-, диизопропилметил-, 2,2-диметоксикарбонилвинил-, о-(N,N-диметилкарбоксамидо)бензил-, 1,1-диметил-3(N,N-диметилкарбоксамидо)пропил-, 1,1-диметилпропинил-, ди(2-пиридил)метил-, 2-фуранилметил-, 2 иодэтил-, изоборнил-, изобутил-, изоникотинил-, п-(п'-метоксифенилазо)бензил-, 1-метилциклобутил-, 1 метилциклогексил-, 1-метил-1-циклопропилметил-, 1-метил-1-(3,5-диметоксифенил)этил-, 1-метил-1-(пфенилазофенил)этил-, 1-метил-1-фенилэтил-, 1-метил-1-(4-пиридил)этил-, фенил-, п-(фенилазо)бензил-,2,4,6-три-трет-бутилфенил-, 4-(триметиламмоний)бензил- и 2,4,6-триметилбензилкарбамат. Примеры амидов включают АмидыN-Формил, N-ацетил, N-хлорацетил, N-трихлорацетил, N-трифторацетил, N-фенилацетил, N-3 фенилпропионил, N-пиколиноил, N-3-пиридилкарбоксамид, N-бензоилфенилаланил-производное, Nбензоил, N-п-фенилбензоил. Расщепляемые под действием реагента группыN-Фталимид, N-дитиасукциноил, N-2,3-дифенилмалеоил, N-2,5-диметилпирролил, N-1,1,4,4 тетраметилдисилилазациклопентановый аддукт, 5-замещенный 1,3-диметил-1,3,5-триазациклогексан-2 он, 5-замещенный 1,3-дибензил-1,3,5-триазациклогексан-2-он и 1-замещенный 3,5-динитро-4-пиридонил. Специальные-NH-защитные группы Примеры специальных NH-защитных групп включаютN-1,1-Диметилтиометилен, N-бензилиден, N-п-метоксибензилиден, N-дифенилметилен, N-[(2 пиридил)мезитил]метилен и N-(N',N'-диметиламинометилен). Защита для карбоксильной группы Сложные эфиры Примеры сложных эфиров включают формиат, бензоилформиат, ацетат, трихлорацетат, трифторацетат, метоксиацетат, феноксиацетат, п-хлорфеноксиацетат, бензоат. Замещенные сложные метиловые эфиры Примеры замещенных метиловых эфиров включают 9-флуоренилметил, метоксиметил, метилтиометил, тетрагидропиранил, тетрагидрофуранил, метоксиэтоксиметил, 2-(триметилсилил)этоксиметил,бензилоксиметил, фенацил, п-бромфенацил, -метилфенацил, п-метоксифенацил, карбоксамидометил иN-фталимидометил. 2-3 амещенные сложные этиловые эфиры Примеры 2-замещенных сложных этиловых эфиров включают 2,2,2-трихлорэтил, 2-галогенэтил, охлоралкил, 2-(триметилсилил)этил, 2-метилтиоэтил, 1,3-дитианил-2-метил, 2-(п-нитрофенилсульфенил) этил, 2-(п-толуолсульфонил)этил, 2-(2'-пиридил)этил, 2-(дифенилфосфино)этил, 1-метил-1-фенилэтил,трет-бутил, циклопентил, циклогексил, аллил, 3-бутен-1-ил, 4-(триметилсилил)-2-бутен-1-ил, циннамил,- 14009119-метилциннамил, фенил, п-(метилмеркапто)фенил и бензил. Замещенные сложные бензиловые эфиры Примеры замещенных сложных бензиловых эфиров включают трифенилметил, дифенилметил,бис(о-нитрофенил)метил, 9-антрилметил, 2-(9,10-диоксо)антрилметил, 5-дибензосуберил, 1-пиренилметил, 2-(трифторметил)-6-хромилметил, 2,4,6-триметилбензил, п-бромбензил, о-нитробензил, пнитробензил, п-метоксибензил, 2,6-диметоксибензил, 4-(метилсульфинил)бензил, 4-сульфобензил, пиперонил, 4-пиколил и п-Р-бензил. Сложные силиловые эфиры Примеры сложных силиловых эфиров включают триметилсилил, триэтилсилил, третбутилдиметилсилил, изопропилдиметилсилил, фенилдиметилсилил и ди-трет-бутилметилсилил. Активированные сложные эфиры Примеры активированных сложных эфиров включают тиолы. Разнообразные производные Примеры разнообразных производных включают оксазолы, 2-алкил-1,3-оксазолины, 4-алкил-5 оксо-1,3-оксазолидины, 5-алкил-4-оксо-1,3-диоксоланы, сложные орто-эфиры, фенильную группу и пентааминокобальтовый(III) комплекс. Станниловые сложные эфиры Примеры станниловых сложных эфиров включают триэтилстаннил и три-н-бутилстаннил. С. Синтез. Изобретение относится к способам получения раскрытых соединений согласно традиционным способам органического синтеза, а также способам матричного и комбинаторного органического синтеза. На схемах A-G описываются предлагаемые пути синтеза. Используя эти схемы, нижеприводимые указания и примеры соединений 1-28, специалист в данной области может разработать аналогичные или подобные способы для данного соединения, которые входят в рамки изобретения. Эти способы представлены на предпочтительных схемах синтеза, но не должны рассматриваться как ограничивающие объем охраны изобретения. Специалисту в данной области известно, что синтез соединений согласно настоящему изобретению может быть осуществлен за счет приобретения промежуточных или защищенных промежуточных соединений, указанных на любой из схем, раскрытых в данном описании. Специалисту в данной области,далее, известно, что во время любого из процессов получения соединений согласно настоящему изобретению может быть необходимо и/или желательно защищать чувствительные или реакционноспособные группы в любой из используемых молекул. Это может быть осуществлено с помощью обычных защитных групп, таких как группы, описанные в руководстве Protective Groups in Organic Synthesis, JohnWiley and Sons, 1991. Эти защитные группы могут быть удалены на подходящей стадии, используя способы, известные из уровня техники. В случае, где способы получения соединений согласно изобретению приводят к смеси стереоизомеров, эти изомеры могут быть разделены обычными способами, такими как препаративная хроматография. Соединения могут быть получены в рацемической форме, или индивидуальные энантиомеры могут быть получены либо путем энантиоспецифического синтеза, либо путем разделения. Соединения, например, могут быть разделены на составляющие их энантиомеры стандартными способами, такими как образование диастереоизомерных пар путем солеобразования. Соединения также могут быть разделены за счет образования диастереоизомерных сложных эфиров или амидов с последующим хроматографическим разделением и удалением хирального вспомогательного вещества. Альтернативно, соединения могут быть разделены при использовании хиральной колоночной высокоэффективной жидкостной хроматографии (ВЭЖХ). Примеры описанных путей синтеза включают примеры 1-7. Соединения, аналогичные целевым соединениям этих примеров, могут быть получены подобными путями. Раскрытые соединения пригодны при основной исследовательской работе и в качестве фармацевтических средств, как описывается в ближайшем разделе. Общее руководство Предпочтительный синтез соединений формулы (I) представлен на схемах A-G. Схема А. Синтез A-D- 15009119 В соответствии со схемой А, фенол А-А, множество из которых коммерчески доступно (такие как 3-метилфенол, 2-этилфенол, 2-пропилфенол, 2,3-диметилфенол, 2-хлорфенол, 2,3-дихлорфенол, 2 бромфенол и 2-аминофенол) алкилируют для получения этилового эфира феноксиуксусной кислоты А-В с помощью подходящего эфира галогенуксусной кислоты, такого как этиловый эфир бромуксусной кислоты, в присутствии соответствующего основания, такого как Cs2CO3, K2CO3 или NaH, в подходящем растворителе, таком как CH3CN или тетрагидрофуран (ТГФ). Сульфонирование этилового эфира феноксиуксусной кислоты А-В с помощью соответствующего сульфирующего агента, такого как хлорсульфоновая кислота, происходит селективно в пара-положении с образованием этилового эфира 4 хлорсульфонилфеноксиуксусной кислоты А-С. Превращение сульфонилхлорида А-С в бензолтиол A-D осуществляют с использованием металла в качестве восстановителя, такого как олово или цинк, в кислой среде, такой как этанол или диоксан. На схемах В, D и Е, R8 и R9 могут быть выбраны, например, из Н, C1-8 алкила, С 2-8 алкенила, фенила,галогена и цианогруппы. Схема В На схеме В, реакция Мацунобу 1,3-диола В-В с фенолом В-А приводит к спирту В-С с использованием триарилфосфина, такого как трифенилфосфин, и азодикарбонильного реагента, такого как диизопропилазодикарбоксилат, в подходящем растворителе, таком как ТГФ. Этиловый эфир феноксиуксусной кислоты B-D получают в две стадии: (1) превращение спирта В-С в мезилат в стандартных условиях с использованием метансульфонилхлорида и триэтиламина в соответствующем растворителе, таком какCH2Cl2, и (2) алкилирование бензолтиола B-D, полученного согласно вышеприведенной схеме А, промежуточным мезилатом с использованием подходящего основания, такого как Cs2CO3, K2CO3 или NaH, в соответствующем растворителе, таком как CH3CN или ТГФ, в атмосфере азота. В стандартных условиях омыления этиловый эфир феноксиуксусной кислоты B-D в атмосфере азота превращают в кислоту В-Е. Предпочтительные условия гидролиза включают использование NaOH в качестве основания в водноспиртовой системе растворителей, такой как вода-метанол, или использование LiOH в качестве основания в более мягкой системе вода-ТГФ. Схема С- 16009119 На схеме С замещенный радикалами R5 и R6 малонат С-А восстанавливают до пропан-1,3-диола СВ с использованием подходящего восстановителя, такого как литийалюминийгидрид или диизобутилалюминийгидрид. Затем пропан-1,3-диол С-В превращают в димезилат С-С, используя метансульфонилхлорид и триэтиламин в соответствующем растворителе, таком как CH2Cl2, димезилат С-С вводят в реакцию с фенолом В-А в присутствии подходящего основания, такого как Cs2CO3, K2CO3 или NaH, в соответствующем растворителе, таком как CH3CN или ТГФ, с получением мезилата C-D. Этиловый эфир феноксиуксусной кислоты С-Е получают алкилированием бензолтиола A-D, полученного согласно вышеприведенной схеме А, с помощью мезилата C-D, используя подходящее основание, такое как Cs2CO3,K2CO3 или NaH, в соответствующем растворителе, таком как CH3CN или ТГФ, в атмосфере азота. В стандартных условиях омыления этиловый эфир феноксиуксусной кислоты С-Е в атмосфере азота превращают в кислоту C-F. Предпочтительные условия гидролиза включают использование NaOH в качестве основания в водно-спиртовой системе растворителей, такой как вода-метанол, или использованиеLiOH в качестве основания в более мягкой системе вода-ТГФ. Схема D В соответствии со схемой D альдегид D-B может быть получен в две стадии метилированием кислоты D-A, используя (триметилсилил)диазометан в качестве метилирующего агента, с последующим восстановлением промежуточного сложного метилового эфира подходящим восстановителем, таким как диизобутилалюминийгидрид. Альдегид D-B превращают в эпоксид D-C взаимодействием с диметилсульфонийметилидом, который получают in situ в результате обработки триметилсульфонийиодида сильным основанием, таким как ДМСО-анион. Раскрытие эпоксидного цикла D-C с помощью бензолтиола A-D в присутствии каталитического количества тетрабутиламмонийфторида приводит к спирту DD, который окисляют до кетона D-E в мягких условиях окисления с использованием уксусного ангидрида и диметилсульфоксида. Некоторые типы олефинирования кетона D-E могут быть осуществлены с получением алкена D-F. Например, реакция Виттига и олефинирование D-E с помощью реактива Теббе все могут приводить к D-F. Наконец, омыление сложного этилового эфира D-F в стандартных условиях приводит к получению кислоты D-G. На схеме Е представлен другой путь получения кислоты Е-Е, указанной на схеме В. На схеме Е эпоксид Е-В получают обработкой фенола В-А соответствующим основанием, таким как карбонат цезия,затем алкилированием с помощью хлорметилоксирана Е-А. Раскрытие эпоксидного цикла Е-В с помощью бензолтиола A-D, полученного согласно вышеприведенной схеме А, в присутствии каталитического количества тетрабутиламмонийфторида приводит к спирту Е-С, который окисляют до кетона E-D в мягких условиях окисления с использованием уксусного ангидрида и диметилсульфоксида. Некоторые типы олефинирования кетона E-D могут быть осуществлены с получением алкена B-D. Например, реакция Виттига и олефинирование E-D с помощью реактива Теббе все могут приводить к B-D. Наконец, омыление сложного этилового эфира B-D в стандартных условиях приводит к получению кислоты В-Е. Схема F. Синтез F-E В соответствии со схемой F (4-гидроксифенил)уксусную кислоту F-A, различные представители которой коммерчески доступны (такие как 3-бром-4-гидроксифенилуксусная кислота, 3-хлор-4-гидроксифенилуксусная кислота, 3-фтор-4-гидроксифенилуксусная кислота, 4-гидрокси-3-метоксифенилуксусная кислота и 4-гидрокси-3-нитрофенилуксусная кислота), метилируют с получением метилового эфира (4 гидроксифенил)уксусной кислоты F-B в метаноле в присутствии каталитического количества подходящей кислоты, такой как серная кислота или соляная кислота. Фенол F-B превращают в метиловый эфир(4-диметилтиокарбамоилоксифенил)уксусной кислоты F-C реакцией с диметилтиокарбамоилхлоридом в присутствии некоторых подходящих оснований, таких как триэтиламин и 4-(диметиламино)пиридин. При высокой температуре в предпочтительном диапазоне от 250 до 300 С соединение F-C в высококи- 18009119 пящем растворителе, таком как тетрадекан, перегруппировывают в метиловый эфир (4-диметилкарбамоилсульфанилфенил)уксусной кислоты F-D. Обработкой подходящим основанием, таким как метилат натрия, F-D превращают в метиловый эфир (4-меркаптофенил)уксусной кислоты F-E. Схема G Согласно схеме G метиловый эфир уксусной кислоты G-A получают алкилированием бензолтиолаF-E, полученного согласно вышеприведенной схеме F, мезилатом C-D с использованием подходящего основания, такого как Cs2CO3, K2CO3 или NaH, в соответствующем растворителе, таком как CH3CN или ТГФ, в атмосфере азота. В стандартных условиях омыления сложный метиловый эфир G-A гидролизуют с получением кислоты G-B. Примеры Пример 1. Схема 1 Этиловый эфир (4-хлорсульфонил-2-метилфенокси)уксусной кислоты. В колбу, содержащую хлорсульфоновую кислоту (15,0 мл, 226 ммоль) при температуре 4 С медленно добавляют этил(2-метилфенокси)ацетат 1-А (10,0 г, 51,6 ммоль). Смесь перемешивают при температуре 4 С в течение 30 мин и при комнатной температуре в течение 2 ч и затем выливают в воду со льдом. Выпавшее в осадок твердое вещество белого цвета отфильтровывают, промывают водой и высушивают в вакууме в течение ночи с получением 14,0 г (выход 93%) соединения 1-В в виде твердого вещества белого цвета. 1 Н-ЯМР (300 МГц, CDCl3)7,87-7,84 (м, 2 Н), 6,80 (д, J=9,5 Гц, 1 Н), 4,76 (с, 2 Н), 4,29 (кв, J=7,1 Гц,2 Н), 2,37 (с, 3H), 1,31 (т, J=7,1 Гц, 3H); МС (ES) m/z: 315 (M+Na+). Этиловый эфир (4-меркапто-2-метилфенокси)уксусной кислоты. К раствору соединения 1-В (4,70 г, 16,1 ммоль) в этаноле (20 мл) добавляют 4,0 М раствор HCl в диоксане (20 мл), затем, порциями, порошок олова, 100 меш (9,80 г, 82,6 ммоль). Смесь кипятят с обратным холодильником в течение 2 ч, выливают в СН 2Cl2/лед (100 мл) и фильтруют. Фильтрат разделяют и водный слой экстрагируют с помощью СН 2Cl2. Объединенные органические фазы промывают водой, сушат и концентрируют, получая 3,56 г (выход 98%) соединения 1-С в виде желтого масла. 1 Н-ЯМР (300 МГц, CDCl3)7,14-7,03 (м, 2 Н), 6,59 (д, J=8,4 Гц, 1 Н), 4,60 (с, 2 Н), 4,25 (кв, J=7,1 Гц,2 Н), 2,24 (с, 3H), 1,29 (т, J=7,1 Гц, 3H). 2-(4-Трифторметилфеноксиметил)проп-2-ен-1-ол. К смеси 4-трифторметилфенола (49,0 г, 302 ммоль), 2-метилен-1,3-пропандиола (40,0 г, 454 ммоль) и диизопропилазодикарбоксилата (67,4 г, 333 ммоль) в CH2Cl2 (400 мл) при температуре 0 С по каплям добавляют раствор трифенилфосфина (87,2 г, 333 ммоль) в CH2Cl2 (400 мл). Затем смесь перемешивают при температуре 0 С и после этого оставляют нагреваться до комнатной температуры в течение ночи,CH2Cl2 выпаривают при пониженном давлении. К остатку добавляют диэтиловый эфир и гексан и смесь охлаждают до температуры 0 С. Выпавшее в осадок твердое вещество отфильтровывают и фильтрат концентрируют и подвергают колоночной хроматографии (этилацетат/гексан = 1:4), получая 35,2 г (выход 50%) соединения 2-А. 1 Н-ЯМР (300 МГц, CDCl3)7,55 (д, J=8, 6 Гц, 2 Н), 6,99 (д, J=8,6 Гц, 2 Н), 5,33 (д, J=0,9 Гц, 1 Н), 5,29 Этиловый эфир 2-метил-4-[2-(4-трифторметилфеноксиметил)аллилсульфанил]феноксиуксусной кислоты. Общая методика 1 для получения простого тиоэфира К раствору соединения 2-А (18,1 г, 78,2 ммоль) в CH2Cl2 (400 мл) при температуре 0 С добавляют триэтиламин (23,0 мл, 165 ммоль) и метансульфонилхлорид (13,4 г, 117 ммоль). Смесь перемешивают при температуре 0 С в течение 1 ч и при комнатной температуре в течение ночи и разбавляют насыщенным раствором NaHCO3 (100 мл). Органический слой отделяют, а водный слой экстрагируют 3 раза с помощью CH2Cl2. Объединенные органические фазы сушат и концентрируют, получая 24,2 г неочищенного продукта. Смесь полученного выше неочищенного продукта, этилового эфира (4-меркапто-2-метилфенокси)уксусной кислоты 1-С (21,2 г, 93,8 ммоль) и Cs2CO3 (76,2 г, 234 ммоль) в CH3CN (290 мл) перемешивают при комнатной температуре в течение 2 ч. Добавляют воду и смесь экстрагируют CH2Cl2. Объединенные органические слои сушат, концентрируют и подвергают колоночной хроматографии- 20009119 Соединение 1. 2-Метил-4-[2-(4-трифторметилфеноксиметил)аллилсульфанил]феноксиуксусная кислота. Общая методика 2 для гидролиза сложных этиловых и метиловых эфиров К раствору соединения 2-В (28,8 г, 65,5 ммоль) в ТГФ (576 мл) при температуре 0 С в атмосфере азота добавляют 1,0 М раствор LiOH (131 мл, 131 ммоль). После перемешивания в течение 45 мин при температуре 0 С и в течение 2,5 ч при комнатной температуре смесь охлаждают до температуры 0 С,подкисляют 1 М HCl и экстрагируют 3 раза этилацетатом. Экстракты сушат, концентрируют и очищают колоночной хроматографией, получая 26,7 г (выход 99%) соединения 1. 1 Н-ЯМР (300 МГц, CDCl3)7,52 (д, J=8,6 Гц, 2 Н), 7,21 (с, 1 Н), 7,17 (дд, J=8,4, 2,2 Гц, 1 Н), 6,95 (д,J=8,6 Гц, 2 Н), 6,62 (д, J-8,4 Гц, 1 Н), 5,14 (д, J=1,0 Гц, 1 Н), 4,99 (д, J=1,0 Гц, 1 Н), 4,65 (с, 4 Н), 3,57 (с, 2 Н),2,23 (с, 3H); МС (ES) m/z: 435 (M+Na+). Анализ для C20H19O4F3S0,1 Н 2O: вычислено, %: С 57,99; Н 4,67; S 7,74; F 13,76; найдено, %: С 58,06; Н 4,64; S 7,46; F 13,91. Пример II. Схема 4(МеОН) (10 мл) добавляют 1,0 М раствор (триметилсилил)диазометана (9,16 мл, 9,16 ммоль) в гексане. После перемешивания при комнатной температуре в течение 1 ч растворители удаляют при пониженном давлении. Остаток растворяют в Et2O, промывают насыщенным раствором NaHCO3 и солевым раствором, сушат и концентрируют с получением 1,04 г (выход 98%) соединения 4-В. 1- 21009119 диизобутилалюминийгидрида (4,74 мл, 4,74 ммоль). Смесь перемешивают при -78 С в течение 10 мин и гасят 10%-ным раствором HCl в МеОН (5 мл). После нагревания до комнатной температуры смесь отфильтровывают и фильтрат концентрируют и хроматографируют на колонке хроматографии с получением 796 мг (выход 83%) соединения 4-С. 1 2-[2-(4-Трифторметилфенил)этил]оксиран. Смесь NaH (52 мг, 1,3 ммоль; 60%-ная дисперсия в минеральном масле) в ДМСО (15 мл) нагревают при 70 С в течение 30 мин и оставляют охлаждаться до комнатной температуры. После разбавления ТГФ(10 мл) к смеси при 0 С медленно добавляют раствор триметилсульфонийиодида (306 мг, 1,50 ммоль) в ДМСО (10 мл). После перемешивания в течение 10 мин при 0 С добавляют раствор соединения 4-С (202 мг, 1,00 ммоль) в ТГФ (10 мл). Перемешивание продолжают в течение 1 ч при 0 С и смесь разбавляют водой и экстрагируют Et2O. Экстракты сушат, концентрируют и хроматографируют на колонке хроматографии (этилацетат (EtOAc)/гексан: 1/7) с получением 147 мг (выход 68%) соединения 4-D. 1 Этиловый эфир 4-[2-гидрокси-4-(4-трифторметилфенил)бутилсульфанил]-2-метилфеноксиуксусной кислоты. Смесь соединения 4-D (251 мг, 1,16 ммоль), этилового эфира (4-меркапто-2-метилфенокси)уксусной кислоты 1-С (394 мг, 1,74 ммоль) и тетрабутиламмонийфторида (0,12 мг, 0,12 ммоль; 1,0 М раствор в ТГФ) в ТГФ (5 мл) перемешивают при комнатной температуре в течение ночи и концентрируют. Остаток очищают с помощью колоночной хроматографии (EtOAc/гексан: 1/5) с получением 250 мг (выход 49%) соединения 4-Е. 1 Этиловый эфир 2-метил-4-[2-оксо-4-(4-трифторметилфенил)бутилсульфанил]феноксиуксусной кислоты. Смесь соединения 4-Е (370 мг, 0,837 ммоль) в уксусном ангидриде (Ас 2 О) (2,5 мл) и ДМСО (4 мл) перемешивают при комнатной температуре в течение 24 ч, разбавляют водой и экстрагируют Et2O. Экстракты сушат, концентрируют и очищают с помощью колоночной хроматографии с получением 278 мг- 22009119 кислоты. К раствору соединения 4-F (53 мг, 0,12 ммоль) в ТГФ (1 мл) при -78 С медленно добавляют 0,5 М раствор реактива Теббе (0,24 мл, 0,12 ммоль) в толуоле. Смесь постепенно нагревают до 0 С, перемешивают при той же температуре в течение 4,5 ч, разбавляют насыщенным раствором NaHCO3 и экстрагируют Et2O. Объединенные органические слои сушат, концентрируют и хроматографируют на колонке Соединение 2. (2-Метил-4-2-[2-(4-трифторметилфенил)этил]аллилсульфанилфенокси)уксусная кислота. Соединение 2 получают согласно общей методике 2 (выход 85%). 1 2-Хлорметилаллиловый эфир метансульфоновой кислоты. К раствору 2-метиленпропан-1,3-диола (257 мг, 2,92 ммоль) в CH2Cl2 (4 мл) и CH3CN (4 мл) при 0 С добавляют Et3N (1,76 мл, 12,6 ммоль) и метансульфонилхлорид (1,01 г, 8,79 ммоль). Потом смесь перемешивают при 0 С в течение 2 ч и затем оставляют нагреваться до комнатной температуры в течение ночи, добавляют насыщенный раствор NaHCO3. Органический слой отделяют и водный слой экстрагируют CH2Cl2. Объединенные органические фазы сушат, концентрируют и хроматографируют на колонке(2-Хлорметилаллилокси)бензол. К суспензии NaH (40 мг, 1,0 ммоль; 60%-ная дисперсия в минеральном масле) в ТГФ (2 мл) добавляют раствор фенола (94 мг, 1,0 ммоль) в ТГФ (1 мл). После перемешивания при комнатной температуре в течение 15 мин смесь добавляют к раствору 2-хлорметилаллилового эфира метансульфоновой кислоты 5-А (185 мг, 1,00 ммоль) в ТГФ (2 мл). Смесь перемешивают при комнатной температуре в течение 1 ч,затем нагревают при 40 С в течение ночи, разбавляют водой и экстрагируют EtOAc. Экстракты сушат,- 23009119 концентрируют и хроматографируют на колонке (EtOAc/гексан: 1/9) с получением 148 мг (выход 81%) соединения 5-В. 1 Этиловый эфир [2-метил-4-(2-феноксиметилаллилсульфанил)фенокси]уксусной кислоты. Общая методика 3 для получения простого тиоэфира Смесь соединения 5-В (96 мг, 0,53 ммоль), этилового эфира (4-меркапто-2-метилфенокси)уксусной кислоты 1-С (145 мг, 0,642 ммоль) и Cs2CO3 (417 мг, 1,28 ммоль) в CH3CN (3 мл) перемешивают в течение 5 ч при комнатной температуре. Добавляют воду и смесь экстрагируют Et2O. Объединенные органические слои сушат, концентрируют и хроматографируют на колонке (EtOAc/гексан: 1/10) с получением 168 мг (выход 85%) соединения 5-С. 1 Н-ЯМР (400 МГц, CDCl3)7,28-7,23 (м, 2 Н), 7,20 (д, J=2,0 Гц, 1 Н), 7,16 (дд, J=8,4, 2,3 Гц, 1 Н), 6,956,89 (м, 3H), 6,59 (д, J=8,4 Гц, 1 Н), 5,13 (с, 1 Н), 4,95 (с, 1 Н), 4,60 (с, 2 Н), 4,58 (с, 2 Н), 4,24 (кв, J=7,1 Гц,2 Н), 3,56 (с, 2 Н), 2,23 (с, 3 Н), 1,27 (т, J=7,1 Гц, 3 Н); МС (ES) m/z: 395 (M+Na+). Соединение 3. [2-Метил-4-(2-феноксиметилаллилсульфанил)фенокси]уксусная кислота. Соединение 3 получают согласно общей методике 2 (выход 86%). 1 Н-ЯМР (300 МГц, CDCl3)7,29-7,24 (м, 2 Н), 7,21 (с, 1 Н), 7,18 (д, J=8,4 Гц, 1 Н), 6,97-6,89 (м, 3 Н),6,62 (д, J=8,4 Гц, 1 Н), 5,15 (с, 1 Н), 4,98 (с, 1 Н), 4,66 (с, 2 Н), 4,61 (с, 2 Н), 3,58 (с, 2 Н), 2,23 (с, 3 Н); МС (ES) m/z: 367 (M+Na+) . Пример IV. Схема 6(5,13 г, 19,6 ммоль) в 50 мл CH2Cl2 в течение 30 мин. После перемешивания в течение 5 ч смесь разбавляют Et2O (100 мл), промывают 1 н. раствором NaOH, сушат, концентрируют и хроматографируют на колонке с получением 1,7 г (выход 51%) соединения 6-А. 1 Н-ЯМР (300 МГц, CDCl3)7,13 (д, J=9,1 Гц, 2 Н), 6,91 (дд, J=9,2, 2,3 Гц, 2 Н), 5,31 (д, J=0,9 Гц, 1 Н),5,28 (д, J=0,9 Гц, 1 Н), 4,59 (с, 2 Н), 4,26 (д, J=6,1 Гц, 2 Н), 1,63 (т, J=6,1 Гц, 1 Н). Этиловый эфир 2-метил-4-[2-(4-трифторметоксифеноксиметил)аллилсульфанил]фенокси уксусной кислоты. Соединение 6-В получают согласно общей методике 1. 1 Н-ЯМР (300 МГц, CDCl3)7,21-7,11 (м, 4 Н), 6,88 (дд, J=9,2, 2,3 Гц, 2 Н), 6,60 (д, J=8,4 Гц, 1 Н), 5,13 Соединение 4. [2-Метил-4-(2-п-толилоксиметилаллилсульфанил)фенокси]уксусная кислота. Соединение 4 получают согласно общей методике 2. 1 Н-ЯМР (300 МГц, CDCl3)7,19-7,10 (м, 4 Н), 6,88 (д, J-9,2 Гц, 2 Н), 6,62 (д, J=7,9 Гц, 1 Н), 5,13 (с,1 Н), 4,98 (с, 1 Н), 4,59 (с, 4 Н), 3,56 (с, 2 Н), 2,21 (с, 3H); МС (ES) m/z: 428 (М+Н+). Анализ для C20H19F3O5S0,2 Н 2O: вычислено, %: С 55,60; Н 4,53; найдено, %: С 55,61; Н 4,36. Пример V. Схема 7 Этиловый эфир 4-[2-(4-хлорфеноксиметил)аллилсульфанил]-2-метилфеноксиуксусной кислоты. Общая методика 4 для получения как простого эфира, так и тиоэфира К суспензии NaH (28 мг, 0,70 ммоль; 60%-ная дисперсия в минеральном масле) в ТГФ (1 мл) добавляют раствор 4-хлорфенола (89 мг, 0,69 ммоль) в ТГФ (1 мл). После перемешивания при комнатной температуре в течение 30 мин добавляют раствор 2-хлорметилаллилового эфира метансульфоновой кислоты 5-А (128 мг, 0,693 ммоль) в ТГФ (1 мл) и смесь нагревают при 50 С в течение ночи. К смеси последовательно добавляют этиловый эфир (4-меркапто-2-метилфенокси)уксусной кислоты 1-С (204 мг, 0,901 ммоль), Cs2CO3 (450 мг, 1,38 ммоль) и CH3CN (5 мл). После перемешивания при комнатной температуре в течение 1 ч реакционную смесь разбавляют водой и экстрагируют Et2O. Органическую фазу сушат,концентрируют и хроматографируют на колонке (EtOAc/гексан) с получением 180 мг (выход 64%) соединения 7-А. 1 Н-ЯМР (400 МГц, CDCl3)7,20 (д, J=8,9 Гц, 2 Н), 7,21-7,19 (м, 1 Н), 7,15 (дд, J=8,4, 2,2 Гц, 1 Н), 6,82- 25009119 Соединение 5 получают согласно общей методике 2 (выход 93%). Н-ЯМР (400 МГц, CDCl3)7,22-7,20 (м, 1 Н), 7,20 (д, J=8,8 Гц, 2 Н), 7,16 (д, J=8,4 Гц, 1 Н), 6,82 (д,J=8,9 Гц, 2 Н), 6,61 (д, J=8,4 Гц, 1 Н), 5,12 (с, 1 Н), 4,97 (с, 1 Н), 4,66 (с, 2 Н), 4,57 (с, 2 Н), 3,56 (с, 2 Н), 2,23 (с,3H); МС (ES) m/z: 401 (M+Na+). Пример VI. Схема 8 1 Этиловый эфир 4-[2-(3,4-дихлорфеноксиметил)алллилсульфанил]-2-метилфеноксиуксусной кислоты. Соединение 8-А получают согласно общей методике 4 (выход 62%). 1 Н-ЯМР (400 МГц, CDCl3)7,28 (д, J=8,9 Гц, 1 Н), 7,20 (д, J=2,0 Гц, 1 Н), 7,15 (дд, J=8,4, 2,2 Гц, 1 Н),6,99 (д, J=2,9 Гц, 1 Н), 6,74 (дд, J=8,9, 2,9 Гц, 1 Н), 6,59 (д, J=8,4 Гц, 1 Н), 5,09 (с, 1 Н), 4,95 (с, 1 Н), 4,60 (с,2 Н), 4,56 (с, 2 Н), 4,25 (кв, J=7,1 Гц, 2 Н), 3,53 (с, 2 Н), 2,24 (с, 3H), 1,28 (т, J=7,1 Гц, 3H); МС (ES) m/z: 4 63 (M+Na+). Соединение 6. 4-[2-(3,4-Дихлорфеноксиметил)аллилсульфанил]-2-метилфеноксиуксусная кислота. Соединение 6 получают согласно общей методике 2 (выход 90%). 1 Н-ЯМР (300 МГц, CDCl3)7,28 (д, J=8,9 Гц, 1 Н), 7,20 (с, 1 Н), 7,16 (дд, J=8,4, 1,9 Гц, 1 Н), 6,98 (д,J=2,8 Гц, 1 Н), 6,73 (дд, J=8,9, 2,9 Гц, 1 Н), 6,61 (д, J=8,4 Гц, 1 Н), 5,10 (с, 1 Н), 4,97 (с, 1 Н), 4,65 (с, 2 Н), 4,56 Этиловый эфир 4-[2-(2,4-дихлорфеноксиметил)аллилсульфанил]-2-метилфеноксиуксусной кислоты. Указанное в заголовке соединение 9-А получают согласно общей методике 4 (выход 56%). 1 Н-ЯМР (400 МГц, CDCl3)7,34 (д, J=2,5 Гц, 1 Н), 7,19 (с, 1 Н), 7,16 (м, 1 Н), 7,13 (дд, J=8,6, 2,4 Гц,1 Н), 6,81 (д, J=8,8 Гц, 1), 6,58 (д, J=8,4 Гц, 1 Н), 5,15 (с, 1 Н), 4,98 (с, 1 Н), 4,63 (с, 2 Н), 4,59 (с, 2 Н), 4,25 (кв,3=1,1 Гц, 2 Н), 3,59 (с, 2 Н), 2,23 (с, 3H), 1,28 (т, J=7,1 Гц, 3H); МС (ES) m/z: 463 (M+Na+). Анализ для C21H22Cl2O4S: вычислено, %: С 57,15; Н 5,02; найдено, %: С 57,52; Н 4,92. Соединение 7. 4-[2-(2,4-Дихлорфеноксиметил)аллилсульфанил]-2-метилфеноксиуксусная кислота. Соединение 7 получают согласно общей методике 2 (выход 91%). Этиловый эфир 4-[2-(4-хлор-3-трифторметилфеноксиметил)аллилсульфанил]-2-метилфенокси уксусной кислоты. Указанное в заголовке соединение 10-А получают согласно общей методике 4 (выход 83%). 1 Н-ЯМР (400 МГц, CDCl3)7,36 (д, J=8,8 Гц, 1 Н), 7,21 (д, J=3,0 Гц, 1 Н), 7,20 (д, J=8,0 Гц, 1 Н), 7,15 Соединение 8. 4-[2-(4-Хлор-3-трифторметилфеноксиметил)аллилсульфанил]-2-метилфенокси уксусная кислота. Соединение 8 получают согласно следующей общей методике 2 (выход 86%). 1 Н-ЯМР (300 МГц, CDCl3)7,35 (д, J=8,8 Гц, 1 Н), 7,21 (с, 1 Н), 7,20 (с, 1 Н), 7,16 (дд, J=8,5, 2,1 Гц,1 Н), 6,96 (дд, J=8,8, 3,0 Гц, 1 Н), 6,61 (д, J=8,4 Гц, 1 Н), 5,12 (д, J=0,9 Гц, 1 Н), 4,99 (с, 1 Н), 4,65 (с, 2 Н), 4,61 Этиловый эфир 4-[2-(4-метоксифеноксиметил)аллилсульфанил]-2-метилфеноксиуксусной кислоты. Указанное в заголовке соединение 11-А получают согласно общей методике 4 (выход 60%). 1 Н-ЯМР (300 МГц, CDCl3)7,19 (д, J=1,8 Гц, 1 Н), 7,14 (дд, J=8,4, 2,2 Гц, 1 Н), 6,85-6,77 (м, 4 Н), 6,58 Соединение 9. 4-[2-(4-Метоксифеноксиметил) аллилсульфанил]-2-метилфеноксиуксусная кислота. Соединение 9 получают согласно общей методике 2 (выход 90%). МС (ES) m/z: 397 (M+Na+). Пример X. Этиловый эфир 4-[2-(4-диметиламинофеноксиметил)аллилсульфанил]-2-метилфеноксиуксусной кислоты. Указанное в заголовке соединение 12-А получают согласно общей методике 4 (выход 80%). 1 Н-ЯМР (300 МГц, CDCl3)7,20 (с, 1 Н), 7,16 (дд, J=8,4, 2,2 Гц, 1 Н), 6,73 (д, J=9,0 Гц, 2 Н), 6,60 (д,J=8,4 Гц, 1 Н), 6,85 (д, J=9,1 Гц, 2 Н), 5,13 (д, J=1,1 Гц, 1 Н), 4,94 (с, 1 Н), 4,60 (с, 2 Н), 4,56 (с, 2 Н), 4,25 (кв,J=7,1 Гц, 2 Н), 3,57 (с, 2 Н), 2,87 (с, 6 Н), 2,24 (с, 3H), 1,29 (т, J=7,1 Гц, 3H); Соединение 10. 4-[2-(4-Диметиламинофеноксиметил)аллилсульфанил]-2-метилфеноксиуксусная кислота. Соединение 10 получают согласно общей методике 2 (выход 85%). 1 Н-ЯМР (400 МГц, MeOH-d4)7,17 (с, 1 Н), 7,15 (дд, J=8,5, 2,1 Гц, 1 Н), 6,92 (д, J=9,1 Гц, 2 Н), 6,82 1-(2-Хлорметилаллилокси)-4-трифторметилбензол. К суспензии NaH (60 мг, 1,5 ммоль; 60%-ная дисперсия в минеральном масле) в ТГФ (2 мл) добавляют раствор 4-трифторметилфенола (162 мг, 1,00 ммоль) в ТГФ (1 мл). После перемешивания при комнатной температуре в течение 15 мин смесь добавляют к раствору 2-хлорметилаллилового эфира метансульфоновой кислоты 5-А (185 мг, 1,00 ммоль) в ТГФ (3 мл) при 0 С. Смесь нагревают при 60-70 С в течение 3 ч и при 40-50 С в течение ночи, разбавляют водой и экстрагируют EtOAc. Экстракты сушат,концентрируют и хроматографируют на колонке (EtOAc/гексан: 1/10) с получением 221 мг (выход 88%) соединения 13-А. 1 Н-ЯМР (300 МГц, CDCl3)7,55 (д, J=8,6 Гц, 2 Н), 7,00 (д, J=8,6 Гц, 2 Н), 5,42 (с, 1 Н), 5,37 (с, 1 Н),4,68 (с, 2 Н), 4,19 (с, 2 Н). Этиловый эфир 2-хлор-4-[2-(4-трифторметилфеноксиметил)аллилсульфанил]феноксиуксусной кислоты. Соединение 13-С получают согласно общей методике 3 (выход 80%), заменяя этиловый эфир (4 меркапто-2-метилфенокси)уксусной кислоты 1-С на этиловый эфир (2-хлор-4-меркаптофенокси) уксусной кислоты 13-В. 1 Н-ЯМР (400 МГц, CDCl3)7,53 (д, J=8,8 Гц, 2 Н), 7,43 (д, J=2,3 Гц, 1 Н), 7,20 (дд, J=8,5, 2,3 Гц, 1 Н),6,96 (д, J=8,8 Гц, 2 Н), 6,73 (д, J=8,6 Гц, 1 Н), 5,17 (с, 1 Н), 5,01 (с, 1 Н), 4,66 (с, 2 Н), 4,65 (с, 2 Н), 4,26 (кв,J=7,1 Гц, 2 Н), 3,59 (с, 2 Н), 1,28 (т, J=7,1 Гц, 3H); МС (ES) m/z: 483 (M+Na+).- 28009119 кислота. Соединение 11 получают согласно следующей общей методике 2 (выход 95%). 1 Метиловый эфир (4-хлорсульфонил-2-трифторметилфенокси) уксусной кислоты. Смесь 2-трифторметилфенола (4,66 г, 28,8 ммоль), метилового эфира бромуксусной кислоты (4,01 г, 26,2 ммоль) и Cs2CO3 (18,8 г, 57,6 ммоль) в CH3CN (50 мл) перемешивают при комнатной температуре в течение ночи, отфильтровывают и промывают CH3CN. Фильтрат концентрируют, остаток растворяют вEt2O и промывают 1 н. раствором NaOH (3 раза) и Н 2O (2 раза). Органическую фазу сушат и концентрируют с получением 5,87 г (выход 87%) алкилированного продукта, метилового эфира (2-трифторметилфенокси)уксусной кислоты. В колбу, содержащую хлорсульфоновую кислоту (5,93 г, 50,9 ммоль), при 0 С медленно добавляют полученное выше соединение (2,65 г, 11,3 ммоль). Затем полученный раствор перемешивают при 0 С в течение 30 мин и при комнатной температуре в течение 2 ч, после чего выливают на лед при перемешивании. Выпавшее в осадок твердое вещество отфильтровывают, растворяют в CH2Cl2, промывают солевым раствором, сушат и концентрируют с получением 2,50 г (выход 66%) соединения 14-А. 1 Н-ЯМР (300 МГц, CDCl3)8,28 (д, J=2,3 Гц, 1 Н), 8,17 (дд, J=9,0, 2,4 Гц, 1 Н), 7,04 (д, J=9, 0 Гц, 1 Н),4,90 (с, 2 Н), 3,84 (с, 3H); МС (ES) m/z: 355 (M+Na+). Метиловый эфир (4-меркапто-2-трифторметилфенокси)уксусной кислоты. К раствору соединения 14-А (2,30 г, 6,91 ммоль) в МеОН (12 мл) добавляют 4 М раствор HCl в диоксане (12 мл, 4 8 ммоль) с последующим добавлением, порциями, порошка олова (4,10 г, 34,5 ммоль). Полученную смесь кипятят с обратным холодильником в течение 3 ч, затем выливают в смесь лед/CH2Cl2. Водный слой отделяют и экстрагируют CH2Cl2. Органические экстракты сушат и концентрируют с получением соединения 14-В. 1 Метиловый эфир 2-трифторметил-4-[2-(4-трифторметилфеноксиметил)аллилсульфанил]фенокси уксусной кислоты. Соединение 14-С получают согласно общей методике 3 (выход 85%), заменяя этиловый эфир (4 меркапто-2-метилфенокси)уксусной кислоты 1-С на метиловый эфир (4-меркапто-2-трифторметилфенокси)уксусной кислоты 14-В. 1 Соединение 12. 2-Трифторметил-4-[2-(4-трифторметилфеноксиметил)аллилсульфанил]фенокси уксусная кислота. Соединение 12 получают согласно общей методике 2 (выход 90%). 1 Метиловый эфир (3-хлор-4-хлорсульфонилфенокси)уксусной кислоты. Соединение 15-А получают по той же методике, как в случае получения соединения 14-А (выход 75%). 1 Метиловый эфир (3-хлор-4-меркаптофенокси)уксусной кислоты. Указанное в заголовке соединение 15-В получают по той же методике, как в случае соединения 14 В (выход 94%). 1 Н-ЯМР (300 МГц, CDCl3)7,27 (д, J=8,6 Гц, 1 Н), 6,97 (д, J=2,7 Гц, 1 Н), 6,74 (дд, J=8,7, 2,7 Гц, 1 Н),4,60 (с, 2 Н), 3,81 (с, 3H), 3,71 (д, J=5,6 Гц, 1 Н); МС (ES) m/z: 231 (M+Na+). Метиловый эфир 3-хлор-4-[2-(4-трифторметилфеноксиметил)аллилсульфанил]феноксиуксусной кислоты. Указанное в заголовке соединение 15-С получают согласно общей методике 3 (выход 88%), заменяя этиловый эфир (4-меркапто-2-метилфенокси)уксусной кислоты 1-С на метиловый эфир (3-хлор-4 меркаптофенокси)уксусной кислоты 15-В. 1 Н-ЯМР (300 МГц, CDCl3)7,53 (д, J=8,6 Гц, 2 Н), 7,35 (д, J=8,7 Гц, 1 Н), 6,98-6,95 (м, 3H), 6,73 (дд,J=8,7, 2,8 Гц, 1 Н), 5,14 (д, J=1,0 Гц, 1 Н), 5,00 (д, J=0,8 Гц, 1 Н), 4,66 (с, 2 Н), 4,59 (с, 2 Н), 3,81 (с, 3H), 3,62
МПК / Метки
МПК: A61P 3/10, C07C 323/20, A61K 31/357, C07C 59/70, C07D 319/20, C07D 317/22, A61K 31/192, A61K 31/277, A61K 31/196
Метки: феноксиалкил)тио, аналоги, феноксиуксусные, кислоты
Код ссылки
<a href="https://eas.patents.su/30-9119-4-fenoksialkiltio-fenoksiuksusnye-kisloty-i-analogi.html" rel="bookmark" title="База патентов Евразийского Союза">4- ((феноксиалкил)тио) феноксиуксусные кислоты и аналоги</a>
Предыдущий патент: Установка для розлива жидкостей
Следующий патент: Соединения 1,2,4-оксадиазол-бензойной кислоты и их применение
Случайный патент: Спирально намотанная мембрана для опреснения и фильтрации воды и способ её изготовления