Соединения 1,2,4-оксадиазол-бензойной кислоты и их применение
Номер патента: 9120
Опубликовано: 26.10.2007
Авторы: Чен Гуангминг, Альмстед Нил Грегори, Хванг Сеонгвоо, Мун Янг-Чун, Карп Гари Митчелл
Формула / Реферат
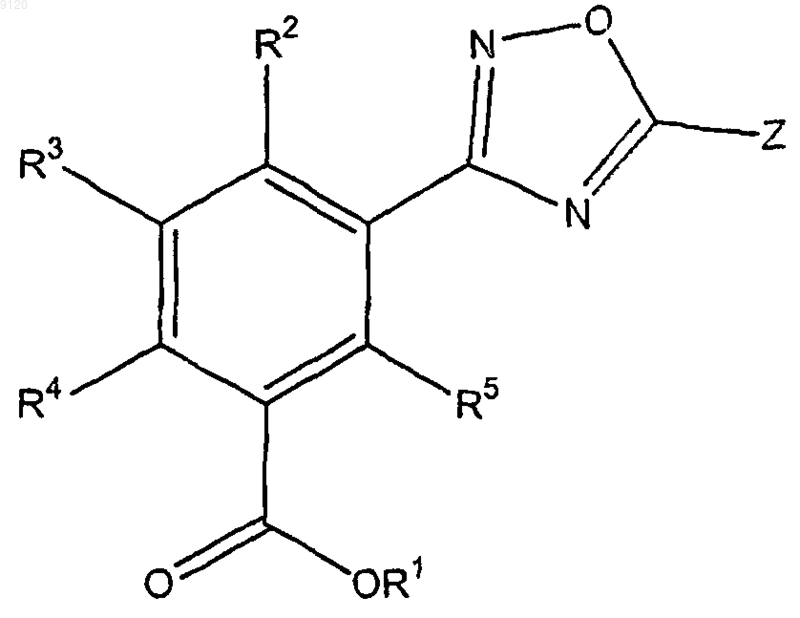
1. Соединение формулы

где Z представляет собой замещенный С5-14арил, замещенный или незамещенный 5-14-членный гетероарил, содержащий 1-3 гетероатома, выбранных азота, кислорода и серы, замещенный или незамещенный С3-7циклоалкил, замещенный или незамещенный C1-4алкил, замещенный или незамещенный С2-6алкенил, замещенный или незамещенный 5-14-членный гетероцикл, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, или замещенный или незамещенный С5-14арилС1-4алкил;
R1 представляет собой водород, замещенный или незамещенный С1-4алкил, замещенный или незамещенный С3-7циклоалкил, замещенный или незамещенный 5-14-членный гетероциклоалкил, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, замещенный или незамещенный С5-14арил, замещенный или незамещенный 5-14-членный гетероарил, содержащий 1-3 гетероатома, выбранных из азота кислорода и серы, -(СН2СН2O)nR6 или любую биогидролизуемую группу;
R2, R3, R4 и R5 независимо представляют собой водород, замещенный или незамещенный С1-4алкил, замещенный или незамещенный С2-6алкенил, замещенный или незамещенный С2-6алкинил, замещенный или незамещенный С3-7циклоалкил, замещенный или незамещенный 5-14-членный гетероциклоалкил, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, замещенный или незамещенный С5-14арил, замещенный или незамещенный 5-14-членный гетероарил, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, C1-6алкокси, С5-14арилокси, 5-14-членный гетероарилокси, содержащий 1-3 гетероатома, выбранных из азота кислорода и серы, галоген, СF3, ОСF3, OCHF2, CN, COOH, COOR7, SO2R7, NO2, NH2, или N(R7)2;
R6 представляет собой водород, замещенный или незамещенный С1-4алкил, замещенный или незамещенный С2-6алкенил, замещенный или незамещенный С2-6алкинил, замещенный или незамещенный С3-7циклоалкил, замещенный или незамещенный 5-14-членный гетероциклоалкил, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, замещенный или незамещенный С5-14арил, замещенный или незамещенный 5-14-членный гетероарил, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы;
в каждом случае R7 независимо представляет собой водород, замещенный или незамещенный С1-4алкил, замещенный или незамещенный С2-6алкенил, замещенный или незамещенный C2-6алкинил, замещенный или незамещенный С3-7циклоалкил, замещенный или незамещенный 5-14-членный гетероциклоалкил, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, замещенный или незамещенный С5-14арил, замещенный или незамещенный 5-14-членный гетероарил, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, C1-6алкокси, С5-14арилокси, 5-14-членный гетероарилокси, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, галоген или СF3;
n представляет собой целое число от 1 до 7;
при условии, что, когда R1, R2, R3, R4 и R5, каждый представляет собой водород, Z не является метилом, 2-карбоксиэтилом, 3-(4-пиридинил)пропилом, 4-цианофенилом или 2-(4-пиперидинил)этилом;
где группы, которые указаны как замещенные, являются замещенными 1-4 заместителями, выбранными из галогена, трифторметила, трифторметокси, гидрокси, C1-6алкокси, С3-7циклоалкилокси, С3-7циклоалкил, С5-14арил, С5-14арилС1-4алкила, циано, азидо или амино.
2. Соединение по п.1, имеющее формулу II
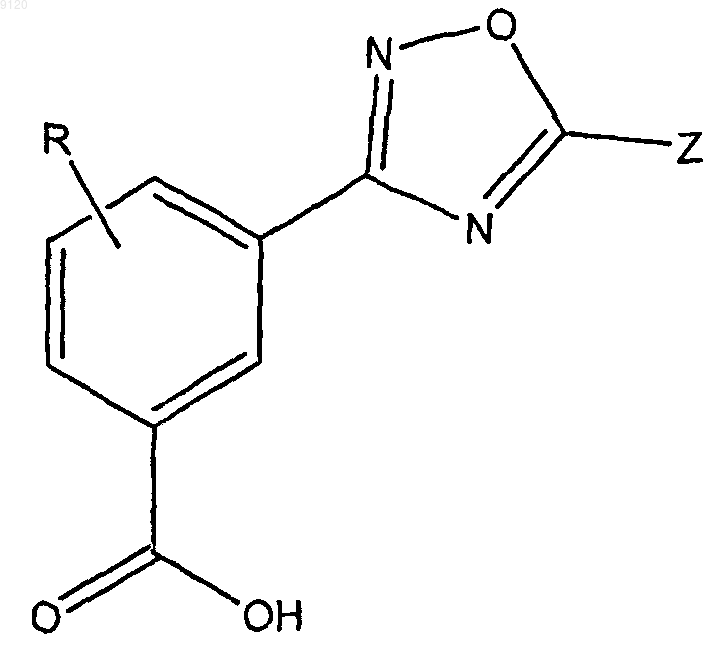
или фармацевтически приемлемые соли, гидраты, клатраты, или их стереоизомеры, где Z представляет собой замещенный C5-14арил, замещенный или незамещенный 5-14-членный гетероарил, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, замещенный или незамещенный С3-7циклоалкил, замещенный или незамещенный С1-4алкил, замещенный или незамещенный С2-6алкенил, замещенный или незамещенный 5-14-членный гетероцикл, содержащий 1-3 гетероатомов, выбранных из азота, кислорода и серы, замещенный или незамещенный С5-14арилС1-4алкил; и R представляет собой водород или галоген;
где группы, которые указаны как замещенные, являются замещенными 1-4 заместителями, выбранными из галогена, трифторметила, трифторметокси, гидрокси, C1-6алкокси, С3-7циклоалкилокси, С3-7циклоалкила, С5-14арила, С5-14арилС1-4алкила, циано, азидо или амино.
3. Соединение по п.1, где R1 представляет собой биогидролизуемый сложный эфир.
4. Соединение по п.1 или 2, где Z представляет собой п-толил; (4-хлорметилфенил); (2-хлорпиридин-3-ил); (2-фторфенил); (3,4-дифторфенил); (4-метоксифенил); бензо[1,3]диоксо-ил; (4-этилфенил); O-толил; (2-хлорфенил); (3-метилтиофен-2-ил); бензо[b]тиофен-2-ил; (3-фторфенил); (4-трет-бутилфенил); (2-метоксифенил); (2,5-дифторфенил); тиофен-2-ил; (2,4-дифторфенил); (3-хлорфенил); м-толил; (4-трифторметилфенил); (4-фторфенил); (3-метоксифенил); (2,6-дифторфенил); (2,5-диметилфуран-3-ил); (4-пиррол-1-ил-фенил); (3-диметиламинофенил); бифенил-4-ил; (4-диметиламинофенил); бензо[1,2,5]оксадиазол-ил; (2-трифторметилфенил); (6-хлорпиридин-3-ил); (3,5-бис-трифторметилфенил); фуран-2-ил; (4-нитрофенил); (3,4-диметоксифенил); (3-трифторметоксифенил); нафтален-1-ил; циклогексил; пиридин-3-ил; пиридин-4-ил; циклопентил; циклопропил; (4-пентилоксифенил); (3,4,5-триметоксифенил); (4-изобутилфенил); циклобутил; 5-(1-ацетилпиперидин-4-ил); 5-изоксазол-5-ил; [3-(2-хлор-6-фторфенил)-5-метилизоксазол-4-ил] или [3-(2-хлорфенил)-5-метилизоксазол-4-ил].
5. Соединение, выбранное из группы, состоящей из
3-(5-п-толил-[1,2,4]оксадиазол-3-ил)бензойной кислоты;
3-[5-(4-хлорметилфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-[5-(2-хлорпиридин-3-ил-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-[5-(3,4-дифторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-[5-(4-метоксифенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-(5-бензо-[1,3]диоксол-5-ил-[1,2,4]оксадиазол-3-ил)бензойной кислоты;
3-[5-(4-этилфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-(5-о-толил-[1,2,4]оксадиазол-3-ил)бензойной кислоты;
3-[5-(2-хлорфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-[5-(3-метилтиофен-2-ил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-(5-бензо[b]тиофен-2-ил-[1,2,4]оксадиазол-3-ил)бензойной кислоты;
3-[5-(3-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-[5-(4-трет-бутилфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-[5-(2-метоксифенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-[5-(2,5-дифторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-(5-тиофен-2-ил-[1,2,4]оксадиазол-3-ил)бензойной кислоты;
3-[5-(2,4-дифторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-[5-(3-хлорфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-(5-м-толил-[1,2,4]оксадиазол-3-ил)бензойной кислоты;
3-[5-(4-трифторметилфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-[5-(4-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-[5-(3-метоксифенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-[5-(2,6-дифторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-[5-(2,5-диметилфуран-3-ил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-[5-(4-пиррол-1-ил-фенил)-[1,2,4]оксадиазол-3-ил]бензойной кислюты;
3-[5-(3-диметиламинофенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-(бифенил-4-ил-[1,2,4]оксадиазол-3-ил)бензойной кислоты;
3-[5-(4-диметиламинофенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-(5-бензо[1,2,5]оксадиазол-5-ил-[1,2,4]оксадиазол-3-ил)бензойной кислоты;
3-(5-м-толил-[1,2,4]оксадиазол-3-ил)бензойной кислоты;
3-[5-(2-трифторметилфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-[5-(6-хлорпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-[5-(3,5-бис-трифторметилфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-(5-фуран-2-ил-[1,2,4]оксадиазол-3-ил)бензойной кислоты;
3-[5-(4-нитрофенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-[5-(3,4-диметоксифенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-[5-(3-трифторметоксифенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-(5-нафтален-1-ил-[1,2,4]оксадиазол-3-ил)бензойной кислоты;
3-(5-циклогексил-[1,2,4]оксадиазол-3-ил)бензойной кислоты;
3-(5-пиридин-3-ил-[1,2,4]оксадиазол-3-ил)бензойной кислоты;
3-(5-пиридин-4-ил-[1,2,4]оксадиазол-3-ил)бензойной кислоты;
3-(5-циклопентил-[1,2,4]оксадиазол-3-ил)бензойной кислоты;
3-(5-циклопропил-[1,2,4]оксадиазол-3-ил)бензойной кислоты;
3-[5-(4-пентилоксифенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-[5-(3,4,5-триметоксифенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-[5-(4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-(5-циклобутил-[1,2,4]оксадиазол-3-ил)бензойной кислоты;
3-[5-(1-ацетилпиперидин-4-ил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-(5-изоксазол-5-ил-[1,2,4]оксадиазол-3-ил)бензойной кислоты;
3-{5-[3-(2-хлор-6-фторфенил)метилизоксазол-4-ил]-[1,2,4]оксадиазол-3-ил}бензойной кислоты;
3-(5-изопропил-[1,2,4]оксадиазол-3-ил)бензойной кислоты;
3-(5-трет-бутил-[1,2,4]оксадиазол-3-ил)бензойной кислоты;
3-(5-бутил-[1,2,4]оксадиазол-3-ил)бензойной кислоты;
3-(5-пропенил-[1,2,4]оксадиазол-3-ил)бензойной кислоты;
3-[5-(4-хлорбензил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-[5-(4-хлорфеноксиметил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-(5-бензил-[1,2,4]оксадиазол-3-ил)бензойной кислоты;
3-(5-метоксиметил-[1,2,4]оксадиазол-3-ил)бензойной кислоты
3-[5-(1-фенилпропил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-[5-(4-фторбензил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-[5-(3-хлорфеноксиметил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-[5-(6-хлорпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-(5-циклопентилметил-[1,2,4]оксадиазол-3-ил)бензойной кислоты
3-[5-(4-метоксибензил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-[5-(2,3-дифторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-[5-(2-фтор-5-метилфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-[5-(2-метилсульфанилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-[5-(2,2-дифторбензо-[1,3]диоксол-5-ил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
4-фтор-3-[5-(4-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
2-фтор-5-[5-(4-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-[5-(4-хлор-2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-[5-(4-бром-2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-[5-(3-фторбифенил-4-ил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-{5-[3-(2-хлорфенил)-5-метилизоксазол-4-ил]-[1,2,4]оксадиазол-3-ил}бензойной кислоты;
натриевой соли 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
метилового эфира 3-[5-(4-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
5-[5-(4-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-[5-(3-фторбифенил-4-ил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-[5-(6-пирролидин-1-ил-пиридин-3-ил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-[5-(6-морфолин-4-ил-пиридин-3-ил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-[5-(3,4,5,6-тетрагидро-2Н-[1,2']бипиридинил-5'-ил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-[5-(2-фтор-6-гидроксифенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
метилового эфира 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
2-метоксиэтилового эфира 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
2-(2-метоксиэтокси)этилового эфира 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
2-[2-(2-метоксиэтокси)этокси]этилового эфира 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
2-{2-[2-(2-метоксиэтокси)этокси]этокси}этилового эфира 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
2-(2-{2-[2-(2-метоксиэтокси)этокси]этокси}этокси)этилового эфира 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
2-[2-(2-{2-[2-(2-гидроксиэтокси)этокси]этокси}этокси)этокси]этилового эфира 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-[5-(4-аминофенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-[5-(4-азидофенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты;
3-[5-(4-бензилоксифенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты
и фармацевтически приемлемых солей, гидратов, сольватов, клатратов и их стереоизомеров.
6. Фармацевтическая композиция, содержащая соединение по п.1 или 5 и фармацевтически приемлемый носитель.
7. Единичная дозированная форма, содержащая соединение по п.1 или 5 и фармацевтически приемлемый носитель.
8. Способ модулирования преждевременной терминации трансляции или нонсенс-обусловленного уменьшения мРНК, включающий контактирование клетки, в которой наблюдается преждевременная терминация трансляции или нонсенс-обусловленное уменьшение мРНК, с эффективным количеством соединения формулы
где Z представляет собой замещенный или незамещенный С5-14арил, замещенный или незамещенный 5-14-членный гетероарил, содержащий 1-3 гетероатома, выбранных азота, кислорода и серы, замещенный или незамещенный С3-7циклоалкил, замещенный или незамещенный C1-4алкил, замещенный или незамещенный С2-6алкенил, замещенный или незамещенный 5-14-членный гетероцикл, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, или замещенный или незамещенный С5-14арилС1-4алкил;
R1 представляет собой водород, замещенный или незамещенный С1-4алкил, замещенный или незамещенный С3-7циклоалкил, замещенный или незамещенный 5-14-членный гетероциклоалкил, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, замещенный или незамещенный С5-14арил, замещенный или незамещенный 5-14-членный гетероарил, содержащий 1-3 гетероатома, выбранных из азота кислорода и серы, -(СН2СН2O)nR6 или любую биогидролизуемую группу;
R2, R3, R4 и R5 независимо представляют собой водород, замещенный или незамещенный С1-4алкил, замещенный или незамещенный С2-6алкенил, замещенный или незамещенный С2-6алкинил, замещенный или незамещенный С3-7циклоалкил, замещенный или незамещенный 5-14-членный гетероциклоалкил, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, замещенный или незамещенный С5-14арил, замещенный или незамещенный 5-14-членный гетероарил, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, C1-6алкокси, С5-14арилокси, 5-14-членный гетероарилокси, содержащий 1-3 гетероатома, выбранных из азота кислорода и серы, галоген, СF3, ОСF3, OCHF2, CN, COOH, COOR7, SO2R7, NO2, NH2, или N(R7)2;
R6 представляет собой водород, замещенный или незамещенный С1-4алкил, замещенный или незамещенный С2-6алкенил, замещенный или незамещенный С2-6алкинил, замещенный или незамещенэыщ С3-7циклоалкил, замещенный или незамещенный 5-14-членный гетероциклоалкил, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, замещенный или незамещенный С5-14арил, замещенный или незамещенный 5-14-членный гетероарил, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы;
в каждом случае R7 независимо представляет собой водород, замещенный или незамещенный С1-4алкил, замещенный или незамещенный С2-6алкенил, замещенный или незамещенный С2-6алкинил, замещенный или незамещенный С3-7циклоалкил, замещенный или незамещенный 5-14-членный гетероциклоалкил, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, замещенный или незамещенный С5-14арил, замещенный или незамещенный 5-14-членный гетероарил, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, C1-6алкокси, С5-14арилокси, 5-14-членный гетероарилокси, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, галоген или СF3;
n представляет собой целое число от 1 до 7;
где группы, которые указаны как замещенные, являются замещенными 1-4 заместителями, выбранными из галогена, трифторметила, трифторметокси, гидрокси, C1-6алкокси, С3-7циклоалкилокси, С3-7циклоалкила, С5-14арила, С5-14арилС1-4алкила, циано, азидо или амино.
9. Способ по п.8, включающий контактирование клетки, в которой наблюдается преждевременная терминация трансляции или нонсенс-обусловленное уменьшение мРНК, с эффективным количеством соединения формулы II
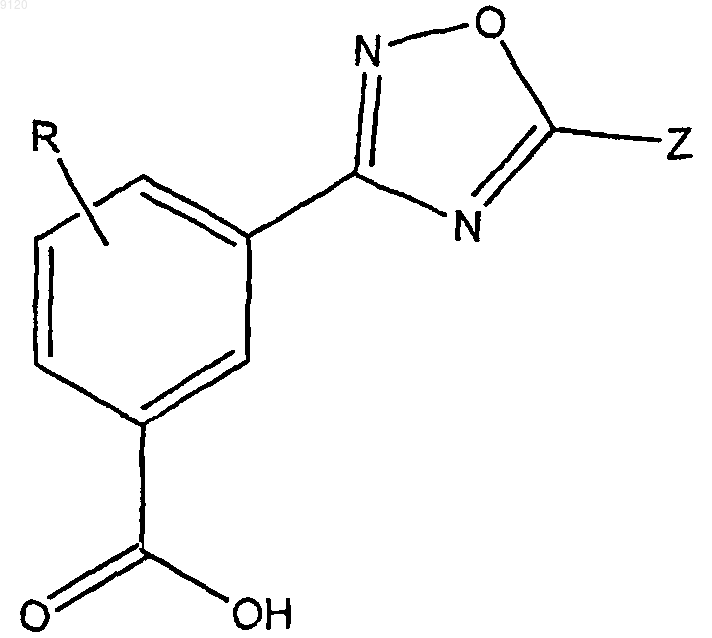
или фармацевтически приемлемыми солями, гидратами, клатратами или их стереоизомерами, где Z представляет собой замещенный или незамещенный С5-14арил, замещенный или незамещенный 5-14-членный гетероарил, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, замещенный или незамещенный С3-7циклоалкил, замещенный или незамещенный C1-4алкил, замещенный или незамещенный С2-6алкенил, замещенный или незамещенный 5-14-членный гетероцикл, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, замещенный или незамещенный С5-14арилС1-4алкил; и R представляет собой водород или галоген;
где группы, которые указаны как замещенные, являются замещенными 1-4 заместителями, выбранными из галогена, трифторметила, трифторметокси, гидрокси, C1-6алкокси, С3-7циклоалкилокси, С3-7циклоалкила, С5-14арила, С5-14арилС1-4алкила, циано, азидо или амино.
10. Способ по п.8 или 9, где модулирование преждевременной терминации трансляции или нонсенс-обусловленного уменьшения мРНК используется для лечения или предупреждения генетического заболевания.
11. Способ по п.10, где указанное генетическое заболевание является аутоиммунным заболеванием, заболеванием крови, заболеванием соединительной ткани, диабетом, воспалительным заболеванием или заболеванием центральной нервной системы.
12. Способ по п.11, где аутоиммунное заболевание представляет собой ревматоидный артрит или реакцию "трансплантант против хозяина".
13. Способ по п.11, где воспалительным заболеванием является артрит.
14. Способ по п.11, где заболеванием центральной нервной системы является рассеянный склероз, мышечная дистрофия, поздний младенческий нейрональный цероид-липофусциноз, мышечная дистрофия Дюшенне, болезнь Альцгеймера, болезнь Тея-Сакса, нейродегенеративное заболевание или болезнь Паркинсона.
15. Способ по п.11, где болезнью крови является гемофилия, болезнь Виллебранда, атаксия-телеангиоэктазия, b-талассемия или почечно-каменная болезнь.
16. Способ по п.11, где заболеванием соединительной ткани является несовершенный остеогенез или цирроз.
17. Способ по п.10, где генетическим заболеванием является семейная полицитемия, иммунодефицит, заболевание почек, фиброзно-кистозная дегенерация, семейная гиперхолистеринемия, пигментная дегенерация сетчатки, амилоидоз, атеросклероз, гигантизм, карликовость, гипотиреоз, гипертиреоз, старение, ожирение, болезнь Ниманна-Пика или синдром Марфана.
18. Способ лечения, профилактики или облегчения рака или одного или более симптомов, связанных с проявлениями рака, включающий введение пациенту, нуждающемуся в лечении, терапевтически или профилактически эффективного количества соединения формулы
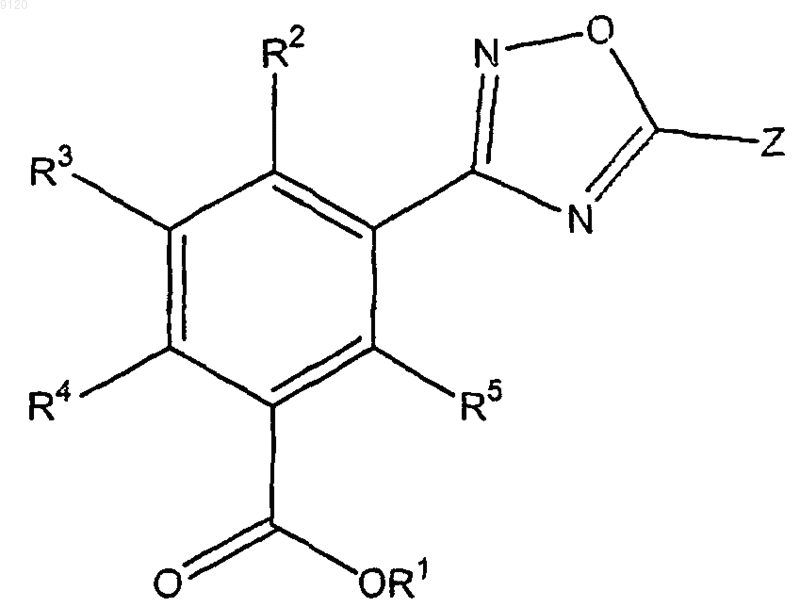
где Z представляет собой замещенный или незамещенный С5-14арил, замещенный или незамещенный 5-14-членный гетероарил, содержащий 1-3 гетероатома, выбранных азота, кислорода и серы, замещенный или незамещенный С3-7циклоалкил, замещенный или незамещенный C1-4алкил, замещенный или незамещенный С2-6алкенил, замещенный или незамещенный 5-14-членный гетероцикл, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, или замещенный или незамещенный С5-14арилС1-4алкил;
R1 представляет собой водород, замещенный или незамещенный С1-4алкил, замещенный или незамещенный С3-7циклоалкил, замещенный или незамещенный 5-14-членный гетероциклоалкил, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, замещенный или незамещенный С5-14арил, замещенный или незамещенный 5-14-членный гетероарил, содержащий 1-3 гетероатома, выбранных из азота кислорода и серы, -(СН2СН2O)nR6 или любую биогидролизуемую группу;
R2, R3, R4 и R5 независимо представляют собой водород, замещенный или незамещенный С1-4алкил, замещенный или незамещенный С2-6алкенил, замещенный или незамещенный С2-6алкинил, замещенный или незамещенный С3-7циклоалкил, замещенный или незамещенный 5-14-членный гетероциклоалкил, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, замещенный или незамещенный С5-14арил, замещенный или незамещенный 5-14-членный гетероарил, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, C1-6алкокси, С5-14арилокси, 5-14-членный гетероарилокси, содержащий 1-3 гетероатома, выбранных из азота кислорода и серы, галоген, CF3, ОСF3, OCHF2, CN, COOH, COOR7, SO2R7, NO2, NH2, или N(R7)2;
R6 представляет собой водород, замещенный или незамещенный С1-4алкил, замещенный или незамещенный С2-6алкенил, замещенный или незамещенный С2-6алкинил, замещенный или незамещенный С3-7циклоалкил, замещенный или незамещенный 5-14-членный гетероциклоалкил, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, замещенный или незамещенный С5-14арил, замещенный или незамещенный 5-14-членный гетероарил, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы;
в каждом случае R7 независимо представляет собой водород, замещенный или незамещенный С1-4алкил, замещенный или незамещенный С2-6алкенил, замещенный или незамещенный С2-6алкинил, замещенный или незамещенный С3-7циклоалкил, замещенный или незамещенный 5-14-членный гетероциклоалкил, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, замещенный или незамещенный С5-14арил, замещенный или незамещенный 5-14-членный гетероарил, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, C1-6алкокси, С5-14арилокси, 5-14-членный гетероарилокси, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, галоген или СF3;
n представляет собой целое число от 1 до 7;
где группы, которые указаны как замещенные, являются замещенными 1-4 заместителями, выбранными из галогеэр, трифторметила, трифторметокси, гидрокси, C1-6алкокси, С3-7циклоалкилокси, С3-7циклоалкила, С5-14арила, С5-14арилС1-4алкила, циано, азидо или амино.
19. Способ по п.18, включающий введение пациенту, нуждающемуся в лечении, терапевтически или профилактически эффективного количества соединения формулы II
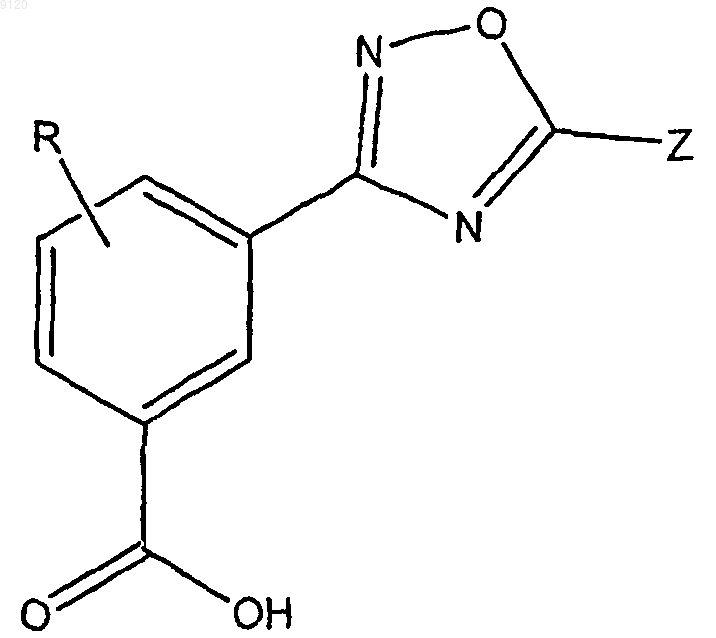
или фармацевтически приемлемых солей, гидратов, клатратов или их стереоизомеров, где Z представляет собой замещенный или незамещенный С5-14арил, замещенный или незамещенный 5-14-членный гетероарил, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, замещенный или незамещенный С3-7циклоалкил, замещенный или незамещенный С1-4алкил, замещенный или незамещенный С2-6алкенил, замещенный или незамещенный 5-14-членный гетероцикл, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, замещенный или незамещенный С5-14арилС1-4алкил; и R представляет собой водород или галоген;
где группы, которые указаны как замещенные, являются замещенными 1-4 заместителями, выбранными из галогена, трифторметила, трифторметокси, гидрокси, C1-6алкокси, С3-7циклоалкилокси, С3-7циклоалкила, С5-14арила, С5-14арилС1-4алкила, циано, азидо или амино.
20. Способ по п.18 или 19, где указанный рак является раком головы и шеи, глаза, кожи, рта, глотки, пищевода, грудной клетки, кости, легкого, толстой кишки, сигмовидной ободочной кишки, прямой кишки, желудка, простаты, груди, яичников, почек, печени, поджелудочной железы, мозга, кишечника, сердца, надпочечников, солидной опухолью, саркомой, карциномой, фибросаркомой, миксосаркомой, липосаркомой, хондросаркомой, остеогенной саркомой, хордомой, ангиосаркомсй, эндотелиосаркомой, лимфангиосаркомой, лимфангиоэндотелиосаркомой, синовиомой, мезотелиомой, опухолью Юинга, леймиосаркомой, рабдомиосаркомой, сквамозной клеточной карциномой, базальноклеточной карциномой, аденокарциномой, карциномой потовых желез, карциномой сальных желез, папиллярной карциномой, папиллярной аденокарциномой, цистаденокарциномой, медуллярной карциномой, бронхогенной карциномой, гипернефроидной карциномой, гепатомой, карциномой желчного протока, хориокарциномой, семиномой, эмбриональной карциномой, опухолью Вильмса, раком шейки матки, тестикулярной опухолью, легочной карциномой, мелкоклеточной карциномой легких, карциномой мочевого пузыря, эпителиальной карциномой, глиомой, астроцитомой, медуллобластомой, краниофарингомой, эпендимомой, саркомой Капоши, пинеаломой, гемангиобластомой, акустической невриномой, олигодендроглиомой, менангиомой, меланомой, нейробластомой, ретинобластомой, опухолью кровяного происхождения, острой лимфобластической лейкемией, острой лимфобластической лейкемией В-клеток, острой лимфобластической лейкемией Т-клеток, острой миелобластической лейкемией, острой промиелобластической лейкемией, острой монобластической лейкемией, острой эритролейкемической лейкемией, острой мегакариобластической лейкемией, острой миеломоноцитной лейкемией, острой нелимфоцитной лейкемией, острой недифференцированной лейкемией, хронической миелоцитной лейкемией, хронической лимфоцитной лейкемией, лейкозом ворсистых клеток, множественной миеломой или р53-обусловленным раком.
21. Способ по п.18 или 19, где пациент является млекопитающим.
22. Способ по п.18 или 19, где соединение вводят парентерально, трансдермально, мукозально, интраназально, буккально, сублингвально или перорально.
23. Способ по п.22, где соединение вводят перорально.
24. Способ по п.23, где соединение вводят перорально в таблетированной, жидкой или капсулярной форме.
25. Способ по п.18 или 19, где терапевтически или профилактически эффективное количество составляет примерно от 1 до примерно 2000 мг в день.
26. Способ по п.25, где терапевтически или профилактически эффективное количество составляет примерно от 5 до примерно 500 мг в день.
27. Способ по п.26, где терапевтически или профилактически эффективное количество составляет примерно от 10 до примерно 200 мг в день.
28. Соединение формулы
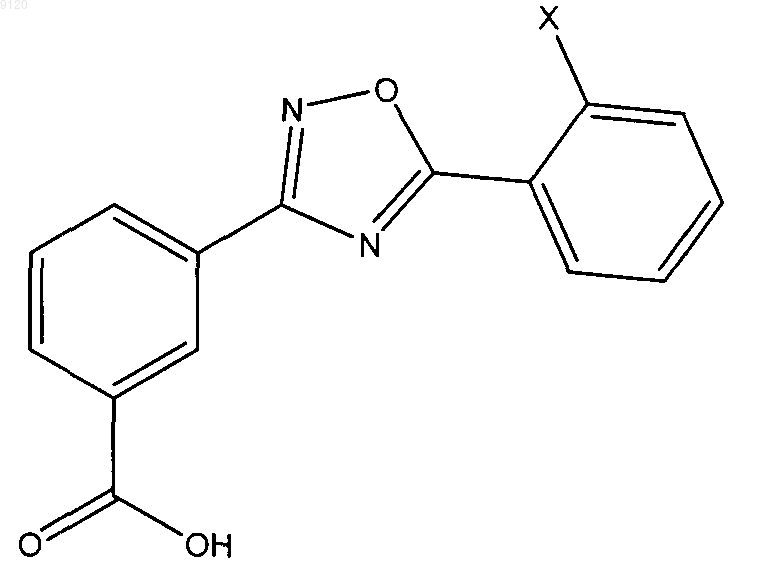
где Х представляет собой галоген, замещенный С1-4алкил или C1-6алкокси,
где С1-4алкил замещен 1-3 заместителями, выбранными из галогена, трифторметила, трифторметокси, гидрокси, C1-6алкокси, С3-7циклоалкилокси, С3-7циклоалкила, С5-14арила, С5-14арилС1-4алкила, циано, азидо или амино.
29. Соединение по п.4, где Z представляет собой (2-фторфенил); (3,4-дифторфенил); (2-хлорфенил); (3-фторфенил); (2,5-дифторфенил); (2,4-дифторфенил); (3-хлорфенил); (4-фторфенил) или (2,6-дифторфенил).
30. Фармацевтическая композиция по п.6, пригодная для перорального, парентерального, мукозального, трансдермального или местного введения.
31. Фармацевтическая композиция по п.30, пригодная для перорального введения.
32. Фармацевтическая композиция по п.31 в твердой форме.
33. Фармацевтическая композиция по п.32, где композиция представляет собой порошок.
34. Фармацевтическая композиция по п.32, где композиция представляет собой таблетку.
35. Фармацевтическая композиция по п.32, где композиция представляет собой капсулу.
36. Фармацевтическая композиция по п.31 в жидкой форме.
37. Фармацевтическая композиция по п.36, где композиция представляет собой суспензию.
38. Фармацевтическая композиция по п.37, где композиция является водной.
39. Применение соединения формулы
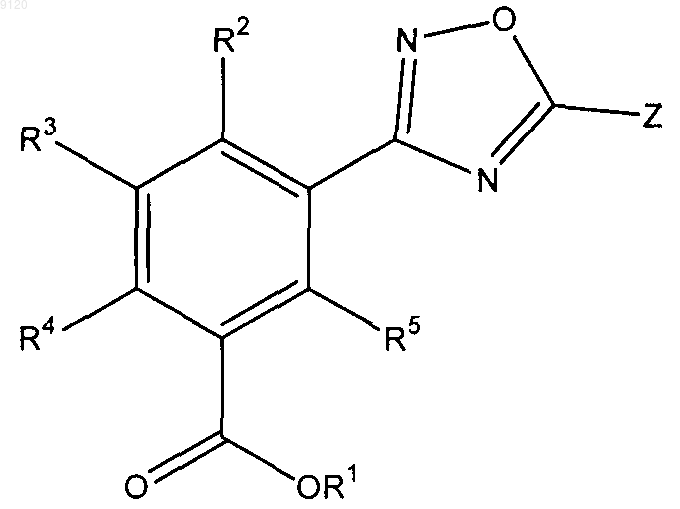
где Z представляет собой замещенный или незамещенный С5-14арил, замещенный или незамещенный 5-14-членный гетероарил, содержащий 1-3 гетероатома, выбранных азота, кислорода и серы, замещенный или незамещенный С3-7циклоалкил, замещенный или незамещенный C1-4алкил, замещенный или незамещенный С2-6алкенил, замещенный или незамещенный 5-14-членный гетероцикл, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, или замещенный или незамещенный С5-14арилС1-4алкил;
R1 представляет собой водород, замещенный или незамещенный С1-4алкил, замещенный или незамещенный С3-7циклоалкил, замещенный или незамещенный 5-14-членный гетероциклоалкил, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, замещенный или незамещенный С5-14арил, замещенный или незамещенный 5-14-членный гетероарил, содержащий 1-3 гетероатома, выбранных из азота кислорода и серы, -(CH2CH2O)nR6 или любую биогидролизуемую группу;
R2, R3, R4 и R5 независимо представляют собой водород, замещенный или незамещенный С1-4алкил, замещенный или незамещенный С2-6алкенил, замещенный или незамещенный С2-6алкинил, замещенный или незамещенный С3-7циклоалкил, замещенный или незамещенный 5-14-членный гетероциклоалкил, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, замещенный или незамещенный С5-14арил, замещенный или незамещенный 5-14-членный гетероарил, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, C1-6алкокси, С5-14арилокси, 5-14-членный гетероарилокси, содержащий 1-3 гетероатома, выбранных из азота кислорода и серы, галоген, СF3, ОСF3, OCHF2, CN, COOH, COOR7, SO2R7, NO2, NH2 или N(R7)2;
R6 представляет собой водород, замещенный или незамещенный С1-4алкил, замещенный или незамещенный С2-6алкенил, замещенный или незамещенный С2-6алкинил, замещенный или незамещенный С3-7циклоалкшы, замещенный или незамещенный 5-14-членный гетероциклоалкил, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, замещенный или незамещенный С5-14арил, замещенный или незамещенный 5-14-членный гетероарил, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы;
в каждом случае R7 независимо представляет собой водород, замещенный или незамещенный С1-4алкил, замещенный или незамещенный С2-6алкенил, замещенный или незамещенный С2-6алкинил, замещенный или незамещенный С3-7циклоалкил, замещенный или незамещенный 5-14-членный гетероциклоалкил, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, замещенный или незамещенный С5-14арил, замещенный или незамещенный 5-14-членный гетероарил, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, C1-6алкокси, С5-14арилокси, 5-14-членный гетероарилокси, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, галоген или СF3;
n представляет собой целое число от 1 до 7;
для производства лекарственного средства для лечения, профилактики или облегчения фиброзно-кистозной дегенерации или одного или нескольких симптомов, связанных с фиброзно-кистозной дегенерацией или проявлениями фиброзно-кистозной дегенерации;
где группы, которые указаны как замещенные, являются замещенными 1-4 заместителями, выбранными из галогена, трифторметила, трифторметокси, гидрокси, C1-6алкокси, С3-7циклоалкилокси, С3-7циклоалкила, С5-14арила, С5-14арилС1-4алкила, циано, азидо или амино.
40. Применение соединения формулы
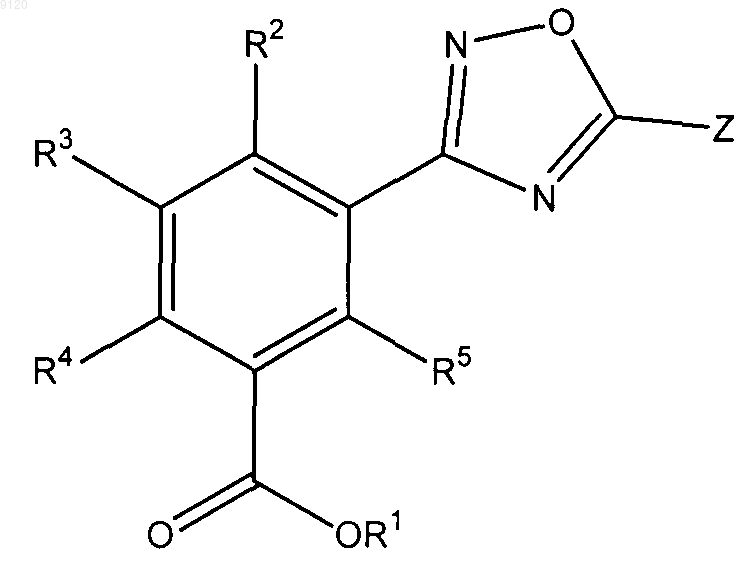
где Z представляет собой замещенный или незамещенный С5-14арил, замещенный или незамещенный 5-14-членный гетероарил, содержащий 1-3 гетероатома, выбранных азота, кислорода и серы, замещенный или незамещенный С3-7циклоалкил, замещенный или незамещенный C1-4алкил, замещенный или незамещенный С2-6алкенил, замещенный или незамещенный 5-14-членный гетероцикл, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, или замещенный или незамещенный С5-14арилС1-4алкил;
R1 представляет собой водород, замещенный или незамещенный С1-4алкил, замещенный или незамещенный С3-7циклоалкил, замещенный или незамещенный 5-14-членный гетероциклоалкил, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, замещенный или незамещенный С5-14арил, замещенный или незамещенный 5-14-членный гетероарил, содержащий 1-3 гетероатома, выбранных из азота кислорода и серы, -(СН2СН2O)nR6 или любую биогидролизуемую группу;
R2, R3, R4 и R5 независимо представляют собой водород, замещенный или незамещенный С1-4алкил, замещенный или незамещенный С2-6алкенил, замещенный или незамещенный С2-6алкинил, замещенный или незамещенный С3-7циклоалкил, замещенный или незамещенный 5-14-членный гетероциклоалкил, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, замещенный или незамещенный С5-14арил, замещенный или незамещенный 5-14-членный гетероарил, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, C1-6алкокси, С5-14арилокси, 5-14-членный гетероарилокси, содержащий 1-3 гетероатома, выбранных из азота кислорода и серы, галоген, СF3, ОСF3, OCHF2, CN, COOH, COOR7, SO2R7, NO2, NH2 или N(R7)2;
R6 представляет собой водород, замещенный или незамещенный С1-4алкил, замещенный или незамещенный С2-6алкенил, замещенный или незамещенный С2-6алкинил, замещенный или незамещенный С3-7циклоалкил, замещенный или незамещенный 5-14-членный гетероциклоалкил, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, замещенный или незамещенный С5-14арил, замещенный или незамещенный 5-14-членный гетероарил, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы;
в каждом случае R7 независимо представляет собой водород, замещенный или незамещенный С1-4алкил, замещенный или незамещенный С2-6алкенил, замещенный или незамещенный С2-6алкинил, замещенный или незамещенный С3-7циклоалкил, замещенный или незамещенный 5-14-членный гетероциклоалкил, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, замещенный или незамещенный С5-14арил, замещенный или незамещенный 5-14-членный гетероарил, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, C1-6алкокси, С5-14арилокси, 5-14-членный гетероарилокси, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, галоген или СF3;
n представляет собой целое число от 1 до 7;
для производства лекарственного средства для лечения, профилактики или облегчения мышечной дистрофии или одного или нескольких симптомов, связанных с мышечной дистрофией или проявлениями мышечной дистрофии;
где группы, которые указаны как замещенные, являются замещенными 1-4 заместителями, выбранными из галогена, трифторметила, трифторметокси, гидрокси, C1-6алкокси, С3-7циклоалкилокси, С3-7циклоалкила, С5-14арила, С5-14арилС1-4алкила, циано, азидо или амино.
Текст
009120 Область техники, к которой относится изобретение Данное изобретение касается соединений 1,2,4-оксадиазолбензойной кислоты, композиций, содержащих данные соединения, и способов лечения или профилактики заболеваний, связанных с нонсенсмутациями мРНК, введением данных соединений или композиций. Уровень техники данного изобретения Генная экспрессия в клетках зависит от последовательных процессов транскрипции и трансляции. Совместно данные процессы приводят к синтезу белка из нуклеотидной последовательности соответствующего гена. Транскрипция включает синтез мРНК с матрицы ДНК с помощью РНК-полимеразы. Транскрипция начинается с промоторного участка гена и продолжается до индукции терминации, например, за счет образования структуры "петли на стебле" в зарождающейся РНК или связывания с продуктом гена rho. Белок затем синтезируется с матрицы мРНК за счет процесса трансляции, проходящего на рибосоме с помощью тРНК, тРНК-синтетаз и различных других белков и видов РНК. Трансляция включает три стадии: инициации, элонгации и терминации. Трансляция инициируется образованием комплекса инициации, включающего белковые факторы, мРНК, тРНК, кофакторы и рибосомальные субъединицы, которые узнают сигналы на РНК, которые направляют механизм трансляции к началу трансляции на мРНК. Как только образован комплекс инициации, происходит рост полипептидной цепи за счет повторяющегося добавления аминокислот, как за счет активности пептидилтрансферазы на рибосоме, так и за счет тРНК и тРНК-синтетаз. Присутствие одного из трех кодонов терминации (UAA, UAG, UGA) в сайте А рибосомы подает сигнал факторам высвобождения (RF) полипептидной цепи связываться и узнавать терминационный сигнал. Следовательно, эфирная связь между 3'нуклеотидом тРНК, расположенной в Р сайте рибосомы, и растущей полипептидной цепью гидролизуется. Завершенная полипептидная цепь высвобождается, и рибосомные субъединицы используются для следующего цикла трансляции. Мутации последовательности ДНК, где изменено число оснований, подразделяются на вставки и делеции (мутации рамки считывания) и могут привести к большинству повреждений в геноме. Мутации ДНК, которые заменяют одно основание на другое, обозначаются как миссенс-мутация и подразделяются на классы транзиций (один пурин на другой пурин или один пиримидин на другой пиримидин) и трансверсий (пурин на пиримидин или пиримидин на пурин). Вставки, делеции, транзиции и трансверсии, все они могут привести к нонсенс-мутации, или мутации терминации цепи, в которой мутация основания или мутационные изменения рамки считывания изменяют кодон аминокислоты на один из трех стоп-кодонов. Данные преждевременные стоп-кодоны могут привести к синтезу аберрантных белков в клетках как результат преждевременной терминации трансляции. Нонсенс-мутация в важном гене может привести к летальному исходу и может также привести к ряду заболеваний, например разным видам рака, болезням лизосомного накопления, мышечным дистрофиям, фиброзно-кистозной дегенерации и гемофилии. В штаммах бактерий и эукариот с нонсенс-мутациями супрессия нонсенс-мутации может проявиться как результат мутации в одной из молекул тРНК, таким образом, что тРНК может узнавать нонсенскодон в результате мутаций белков, вовлеченных в процесс трансляции, как результат мутаций в рибосоме (или в рибосомальной РНК или в рибосомальных белках) или за счет добавления соединений, которые, как известно, изменяют процесс трансляции (например, циклогексимид или аминогликозидные антибиотики). Результат выражается в том, что аминокислота включается в полипептидную цепь в месте нонсенс-мутации и трансляция в нонсенс-кодоне преждевременно не терминируется. Включенная аминокислота может не обязательно быть идентичной оригинальной аминокислоте белка дикого типа; например, многие замены аминокислот не имеют огромного влияния на структуру и функцию белка. Таким образом, белок, получаемый с помощью супрессии нонсенс-мутации, будет, вероятно, обладать активностью, близкой к активности белка дикого типа. Эта схема обеспечивает возможность лечить заболевания,связанные с нонсенс-мутациями, за счет предотвращения преждевременной терминации трансляции посредством супрессии нонсенс-мутации. Способность аминогликозидных антибиотиков обеспечивать считывание эукариотических стоп-кодонов привлекла внимание к этим препаратам как потенциальным терапевтическим агентам в лечении заболеваний человека, обусловленных нонсенс-мутациями. Одним заболеванием, в отношении которого такая терапевтическая стратегия может быть осуществлена, является классический поздний младенческий нейрональный цероид-липофусциноз (LINCL), летальное детское нейродегенеративное заболевание, не имеющее на данный момент эффективного лечения. Мутации преждевременного стоп-кодона в гене CLN2, кодирующем лизосомальную трипептидилпептидазу 1 (TPP-I), связаны с заболеванием, примерно у половины детей с диагнозом LINCL. Была оценена способность аминогликозида гентамицина восстанавливать активность TPP-I в клеточных линиях LINCL. В одной клеточной линии пациента, состоявшей из гетерозигот для обычно наблюдаемой нонсенс-мутации (Arg208Stop) и отличающейся редкой нонсенс-мутацией, приблизительно 7% нормального уровня TPP-I были максимально сохранены за счет лечения гентамицином. Данные результаты позволяют предположить, что фармакологическая супрессия нонсенс-мутаций аминогликозидами или функционально схожими препаратами может иметь терапевтический потенциал в отношении LINCL (Sleat и др., Eur. J. Ped. Neurol. 5: Suppl. A 57-62 (2001.-1 009120 В культивированных клетках, имеющих преждевременные стоп-кодоны в гене регулятора трансмембранной проводимости фиброзно-кистозной нейродегенерации (CFTR), лечение аминогликозидами привело к продукции полного CFTR (Bedwell и др., Nat. Med. 3: 1280-1284 (1997); Howard и др. Nat. Med. 2: 467-469 (1996. В мышиной модели мышечной дистрофии Дюшенне, наблюдалась вызванная сульфатом гентамицина супрессия терминации трансляции в преждевременном стоп-кодоне, приводящая к синтезу полного дистрофина (Barton-Davis и др., J. Clin. Invest. 104: 375-381 (1999. Небольшое увеличение количества полного дистрофина обеспечило защиту от повреждения, индуцируемого сокращением у мышей mdx. В данных исследованиях не была определена аминокислота, включенная в сайт нонсенскодона. Терапия или профилактика небольшими молекулами, которые подавляют преждевременную терминацию трансляции, опосредуя несчитывание нонсенс-кодона, может быть полезной для лечения ряда заболеваний. Исследование препаратов небольших молекул, особенно биодоступных при пероральном применении, может привести к введению широкого спектра селективных терапевтических средств, которые могут быть использованы против заболевания, обусловленного нонсенс-мутацией. Сущность изобретения Данное изобретение охватывает новые соединения, новые фармацевтические композиции и новые способы лечения. Данные соединения, композиции и способы являются, частично, основанными на модулировании терминации преждевременной трансляции и/или уменьшения мРНК, обусловленного нонсенс-мутацией, которые играют роль в различных заболеваниях. Такие заболевания могут иметь место из-за сниженного количества активного белка, продуцируемого в качестве результата преждевременной терминации трансляции. Соединения данного изобретения позволяют осуществлять трансляцию мРНК после нонсенс-мутации, приводя к продуцированию полного белка. Таким образом, данное изобретение охватывает соединения, композиции и способы лечения и профилактики ряда заболеваний, особенно генетических заболеваний. Это изобретение охватывает соединения 1,2,4-оксадиазолбензойной кислоты формулы I или фармацевтически приемлемые соли, гидраты, клатраты, пролекарства, полиморфы, стереоизомеры,включая энантиомеры, диастереомеры, рацематы или смеси их стереоизомеров, гдеZ представляет собой замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный гетероцикл, замещенный или незамещенный арилалкил;R1 представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, -(CH2CH2)nOR6 или любую биогидролизуемую группу;R2, R3, R4, R5 и R6 независимо представляют собой водород, замещенный или незамещенный алкил,замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, алкокси, арилокси, гетероарилокси, галоген, СF3, ОСF3, OCHF2, CN, COOH, COOR7, SO2R7, NO2, NH2 или N(R7)2; в каждом случае R7 независимо представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, алкокси, арилокси, гетероарилокси,галоген или СF3;n представляет собой целое число от 1 до 7. В соответствующем воплощении данное изобретение охватывает соединения 1,2,4-оксадиазолбензойной кислоты формулы II-2 009120 или фармацевтически приемлемые соли, гидраты, клатраты или их стереоизомеры, где Z определяется формулой I и R представляет собой водород или галоген. В предпочтительном воплощении изобретения соединения формул I и II являются фармацевтически приемлемыми солями, гидратами, клатратами, пролекарствами, полиморфами, биогидролизуемыми сложными эфирами, рацематами или очищенными стереоизомерами, включающими, но не ограничивающимися оптически чистыми энантиомерами и диастереомерами. Данное изобретение дополнительно охватывает способы лечения или предотвращения заболевания улучшением модулирования терминации преждевременной трансляции или уменьшения мРНК, обусловленного нонсенс-мутацией, или улучшения одного или более симптомов, связанных с ним, включающие введение пациенту, нуждающемуся в лечении, терапевтически или профилактически эффективного количества соединения формулы I или II и их фармацевтически приемлемых солей, гидратов, сольватов, клатратов, пролекарств, полиморфов. В предпочтительном воплощении заболеванием является генетическое заболевание; заболевание ЦНС; воспалительное заболевание, в частности рак; сердечнососудистое заболевание или легочное заболевание; более предпочтительно данное заболевание включает, но не ограничиваясь, амилоидоз, LINCL, гемофилию, болезнь Альцгеймера, атеросклероз, гигантизм,карликовость, гипотиреоз, гипертиреоз, фиброзно-кистозную дегенерацию, старение, ожирение, болезнь Паркинсона, болезнь Ниманна-Пика, фиброзно-кистозную дегенерацию, семейную гиперхолистеринемию, пигментную дегенерацию сетчатки, мышечную дистрофию, мышечную дистрофию Дюшенне или синдром Марфана. Данное изобретение дополнительно охватывает способы лечения, или предотвращения, или облегчения генетического заболевания или одного или более симптомов, связанных с проявлениями генетического заболевания, включающие введение пациенту, нуждающемуся в лечении, терапевтически или профилактически эффективного количества соединения формулы I или II и их фармацевтически приемлемых солей, гидратов, сольватов, клатратов, пролекарств или полиморфов. В предпочтительном воплощении заболеванием является генетическое заболевание; заболевание ЦНС; воспалительное заболевание,нейродегенеративное заболевание; сердечно-сосудистое заболевание; аутоиммунное заболевание; рак; более предпочтительно генетическое заболевание включает, но не ограничиваясь, амилоидоз, LINCL,гемофилию, болезнь Альцгеймера, атеросклероз, гигантизм, карликовость, гипотиреоз, гипертиреоз,фиброзно-кистозную дегенерацию, старение, ожирение, болезнь Паркинсона, болезнь Ниманна-Пика,фиброзно-кистозную дегенерацию, семейную гиперхолистеринемию, пигментную дегенерацию сетчатки, мышечную дистрофию Дюшенне или синдром Марфана. Данное изобретение дополнительно охватывает способы лечения, предотвращения или облегчения рака или одного или более симптомов, связанных с проявлениями рака, включающие введение пациенту,нуждающемуся в лечении, терапевтически или профилактически эффективного количества соединения формулы I или II и их фармацевтически приемлемых солей, гидратов, сольватов, клатратов, пролекарств или полиморфов. В предпочтительном воплощении данного изобретения пациентом является млекопитающее, более предпочтительно человек, подверженный риску развития генетического заболевания. В альтернативном воплощении пациент прошел процесс скрининга для определения присутствия нонсенс-мутации, включающий стадии скрининга субъекта или клеток, получаемых от него, путем приемлемого скрининга нонсенс-мутации. В соответствующем воплощении терапия персонализирована так, что пациент подвергается скринингу на предмет нонсенс-мутации и лечится за счет введения одного или более соединений данного изобретения; особенно пациент может лечиться соединением, особенно подходящим для конкретных мутаций, например, в зависимости от типа болезни, клеточного типа и конкретного гена. В дополнительном воплощении пациентом является младенец или ребенок. Еще в другом воплощении данное изобретение охватывает лечение беременной женщины или непосредственно плода. Еще в предпочтительном воплощении данного изобретения соединение вводят парентерально,трансдермально, через слизистые оболочки, интраназально, буккально, сублингвально или перорально; более предпочтительно вводить соединение перорально, наиболее предпочтительно соединение вводить перорально в форме таблетки, капсулы или жидкости. Данное изобретение охватывает способы модулирования преждевременной терминации трансляции или нонсенс-обусловленного уменьшения мРНК. Данное изобретение дополнительно охватывает способ супрессии преждевременной терминации трансляции и/или нонсенс-обусловленного уменьшения мРНК в клетке, включающий контактирование клетки, в которой наблюдается преждевременная терминация трансляции и/или уменьшение мРНК, обусловленного нонсенс-мутацией, с эффективным количеством соединения формулы I или II. Данное изобретение дополнительно охватывает способ индуцирования нонсенс-супрессии в клетке, включающий контактирование клетки, в которой имеется нонсенс-мутация с эффективным количеством соединения формулы I или II. Нонсенс-кодон может присутствовать в ДНК или РНК любого типа клеток и может проявляться в обычных условиях или как результат мутагенеза. Соответственно, клетки, охватываемые настоящими способами, включают животные клетки, клетки млекопитающих, инфицированные вирусом. В одном воплощении нонсенс-кодон присутствует в ДНК предшественника. В другом воплощении нонсенс-кодон получается вследствие мутагенеза.-3 009120 Не ограничиваясь какой-либо частной теорией, способность соединений формул I или II обеспечивать считывание стоп-кодонов делает их применимыми в лечении или профилактике какого-либо заболевания, обусловленного полностью или частично нонсенс-мутацией. Такие заболевания могут иметь место из-за сниженного количества активного белка, синтезируемого в качестве результата преждевременной терминации трансляции. Не ограничиваясь какой-либо частной теорией, соединения формулы I или II позволяют трансляции мРНК продолжаться после нонсенс-мутации, приводя к синтезу полного белка. Значительным аспектом данного изобретения является то, что терапевтическая активность соединений формулы I или II не обязательно специфична относительно заболевания, наоборот, данные соединения эффективны в профилактике любого заболевания, связанного с нонсенс-мутацией. Более того,способы данного изобретения могут быть специфичны относительно пациента. То есть пациент может быть обследован для определения того, связано ли заболевание с нонсенс-мутацией. Если это так, то такого пациента можно лечить соединением данного изобретения. Соединения формулы I или II применимы для лечения или профилактики генетических заболеваний. Генетические заболевания, которые можно лечить или предупредить соединениями формулы I илиII, включают рак, аутоиммунное заболевание, болезнь крови, болезнь соединительной ткани, диабет, воспалительные заболевания или заболевание центральной нервной системы. Определения Используемый здесь термин "преждевременная терминация трансляции" касается результата мутации, которая заменяет кодон, соответствующий аминокислоте, на стоп-кодон. Используемый здесь термин "уменьшение мРНК, обусловленное нонсенс-мутацией" касается любого механизма, который опосредует уменьшение молекул мРНК, содержащих кодон преждевременной терминации трансляции. Используемый здесь термин "кодон преждевременной терминации" или "преждевременный стопкодон" касается появления стоп-кодона там, где должен быть кодон, соответствующий аминокислоте. Используемый здесь термин "нонсенс-мутация" является точечной мутацией, заменяющей кодон,соответствующий аминокислоте, на стоп-кодон. Используемый здесь термин "нонсенс-супрессия" касается ингибирования или супрессии преждевременной трансляции и/или уменьшения мРНК, обусловленного нонсенс-мутацией. Используемый здесь термин "модулирование преждевременной терминации трансляции и/или уменьшение мРНК, обусловленного нонсенс-мутацией" касается регуляции генной экспрессии изменением уровня нонсенс-супрессии. Например, если желательно увеличить продукцию неправильного белка, кодируемого геном с преждевременным стоп-кодоном, то есть разрешить считывание преждевременного стоп-кодона гена болезни таким образом, чтобы произошла трансляция, тогда модулирование терминации преждевременной трансляции и/или уменьшения мРНК, обусловленного нонсенс-мутацией,влечет за собой активацию нонсенс-супрессии. Напротив, если требуется обеспечить разрушение мРНК с преждевременным стоп-кодоном, тогда модулирование терминации преждевременной трансляции и/или уменьшения мРНК, обусловленного нонсенс-мутацией, влечет за собой ингибирование нонсенс-супрессии. Используемый здесь термин "пациент" подразумевает животное (например, корову, лошадь, овцу,свинью, курицу, индейку, перепела, кошку, собаку, мышь, крысу, кролика, морскую свинку и т.д.), предпочтительным является млекопитающее, например не примат и примат (например, обезьяна и человек),более предпочтительно человек. В конкретных воплощениях пациентом является младенец, ребенок,подросток или взрослый человек. В одном воплощении путем предварительного скрининга было определено, что пациент имеет нонсенс-мутацию. В другом воплощении путем предварительного скрининга было определено, какую нонсенс-мутацию имеет пациент (а именно, UAA, UGA, или UAG). В другом воплощении пациент инфицирован бактериальными клетками (например, Pseudomonas aeruginosa). В другом воплощении клетки пациента инфицированы вирусом. Используемый здесь термин, если иначе не определено, "замещенный" подразумевает группу, замещенную от одного до четырех или более заместителями, например гало, трифторметил, трифторметокси, гидрокси, алкокси, циклоалкокси, гетероциклоокси, оксо, алканоил, алкилкарбонил, циклоалкил,арил, арилокси, аралкил, алканоилокси, циано, азидо, амино, алкиламино, ариламино, аралкиламино,циклоалкиламино, гетероциклоамино, моно- и дизамещенный амино, где два заместителя в аминогруппе выбирают из алкила, арила, аралкила, алканоиламино, ароиламино, аралканоиламино, замещенного алканоиламино, замещенного ариламино, замещенного аралканоиламино, тиола, алкилтио, арилтио, аралкилтио, циклоалкилтио, гетероциклотио, алкилтионо, арилтионо, аралкилтионо, алкилсульфонила, арилсульфонила, аралкилсульфонила, сульфонамидо (например, SO2NH2), замещенного сульфонамидо, нитро, карбокси, карбамила (например, CONH2), замещенного карбамила (например, CONH алкила, CONH арила, CONH аралкила или примера, где есть два заместителя азота, выбранных из алкила, арила или аралкила), алкоксикарбонила, арила, замещенного арила, гуанидино и гетероцикло, например индолила,имидазолила, фурила, тиенила, тиазолила, пирролидила, пиридила, пиримидила и подобных. Где, как указано выше, сами заместители дополнительно замещены, такие дополнительные заместители выбирают из группы, состоящей из галогена, алкила, алкокси, арила и аралкила. В частном воплощении термин-4 009120 Используемый здесь термин "алкил", если иначе не определено, подразумевает неразветвленный или разветвленный нециклический углеводород, имеющий от 1 до 20 атомов углерода, предпочтительно 1-10 атомов углерода, наиболее предпочтительно 1-4 атомов углерода. Представители насыщенных неразветвленных алкилов включают -метил, -этил, -н-пропил, -н-бутил, -н-пентил, -н-гексил, -н-гептил, -ноктил, -н-нонил и -н-децил; при этом насыщенные разветвленные алкилы включают -изопропил, -секбутил, -изобутил, -трет-бутил, -изопентил, 2-метилбутил, 3-метилбутил, 2-метилпентил, 3-метилпентил,4-метилпентил, 2-метилгексил, 3-метилгексил, 4-метилгексил, 5-метилгексил, 2,3-диметилбутил, 2,3-диметилпентил, 2,4-диметилпентил, 2,3-диметилгексил, 2,4-диметилгексил, 2,5-диметилгексил, 2,2-диметилпентил, 2,2-диметилгексил, 3,3-диметилпентил, 3,3-диметилгексил, 4,4-диметилгексил, 2-этилпентил,3-этилпентил, 2-этилгексил, 3-этилгексил, 4-этилгексил, 2-метил-2-этилпентил, 2-метил-3-этилпентил, 2 метил-4-этилпентил, 2-метил-2-этилгексил, 2-метил-3-этилгексил, 2-метил-4-этилгексил, 2,2-диэтилпентил, 3,3-диэтилгексил, 2,2-диэтилгексил, 3,3-диэтилгексил и подобные. Алкильная группа может быть незамещена или замещена. Незамещенные алкильные группы включают алкенильные группы и алкинильные группы, которые обсуждаются ниже. Используемый здесь термин "алкенильная группа", если иначе не определено, подразумевает неразветвленный или разветвленный нециклический углеводород, имеющий от 2 до 20 атомов углерода, предпочтительно 2-10 атомов углерода, наиболее предпочтительно 2-6 атомов углерода и включает по меньшей мере одну углерод-углерод двойную связь. Представители насыщенных неразветвленных и разветвленных (С 2-С 10)алкенилов включают -винил, -аллил, -1-бутенил, -2-бутенил, -изобутенил, -1-пентенил,-2-пентенил, -3-метил-1-бутенил, -2-метил-2-бутенил, -2,3-диметил-2-бутенил, -1-гексенил, -2-гексенил,-3-гексенил, -1-гептенил, -2-гептенил, -3-гептенил, -1-октенил, -2-октенил, -3-октенил, -1-ноненил, -2 ноненил, -3-ноненил, -1-деценил, -2-деценил, -3-деценил и подобные. Двойная связь алкенильной группы может быть не соединена или соединена с другой ненасыщенной группой. Алкенильная группа может быть незамещена или замещена. Используемый здесь термин "алкинильная группа", если иначе не определено, подразумевает неразветвленный или разветвленный нециклический углеводород, имеющий от 2 до 20 атомов углерода,предпочтительно 2-10 атомов углерода, наиболее предпочтительно 2-6 атомов углерода и включает по меньшей мере одну тройную связь углерод-углерод. Представители неразветвленных и разветвленных(С 2-С 10)алкинилов включают -ацетиленил, -пропинил, -1-бутинил, -2-бутинил, -1-пентинил, -2-пентинил,-3-метил-1-бутинил, -4-пентинил, -1-гексинил, -2-гексинил, -5-гексинил, -1-гептинил, -2-гептинил, -6 гептинил, -1-октинил, -2-октинил, -7-октинил, -1-нонинил, -2-нонинил, -8-нонинил, -1-децинил, -2-децинил, -9-децинил и подобные. Тройная связь алкинильной группы может быть не соединена или соединена с другой ненасыщенной группой. Алкинильная группа может быть незамещенной или замещенной. Используемый здесь термин "галоген" или "гало", если иначе не определено, подразумевает фтор,хлор, бром или иод. Используемый здесь термин "алкилсульфонил", если иначе не определено, подразумевает -алкилSO3 Н или -SO3-алкил, где алкил является таким, как определено выше, включающий -SO2-СН 3, -SO2 СН 2 СН 3, -SO2-(СН 2)2 СН 3, -SO2-(СН 2)3 СН 3, -SO2-(СН 2)4 СН 3, -SO2-(CH2)5CH3 и подобные. Используемый здесь термин "карбоксил" и "карбокси", если иначе не определено, подразумевает-СООН. Используемый здесь термин "алкокси", если иначе не определено, подразумевает -О-(алкил), где алкил является таким, как определено выше, включающий -ОСН 3, -ОСН 2 СН 3, -O(СН 2)2 СН 3, -О-(СН 2)3 СН 3,-О-(СН 2)4 СН 3, -О-(СН 2)5 СН 3 и подобные. Используемый здесь термин "алкоксикарбонил", если иначе не определено, подразумевает-С(=O)О-(алкил), где алкил является таким, как определено выше, включающий -С(=O)O-СН 3, -С(=O)OСН 2 СН 3, -С(=O)O-(СН 2)2 СН 3, -С(=O)O-(СН 2)3 СН 3, -С(=O)О-(СН 2)4 СН 3, -С(=O)О-(СН 2)5 СН 3 и подобные. В предпочтительном воплощении сложные эфиры являются биогидролизуемыми (то есть эфир гидролизуется до карбоновой кислоты in vitro или in vivo). Используемый здесь термин "алкоксиалкил", если иначе не определено, подразумевает -(алкил)-О(алкил), где каждый "алкил" независимо является алкильной группой, определенной выше, включающий-СH2 ОСН 3, -СН 2 ОСH2 СН 3, -(СН 2)2OСН 2 СН 3, -(СН 2)2O(СН 2)2 СН 3 и подобные. Используемый здесь термин "арил", если иначе не определено, подразумевает карбоциклическое ароматическое кольцо, содержащее от 5 до 14 атомов в кольце. Все атомы в кольце карбоциклической арильной группы являются атомами углерода. Структуры арильного кольца включают соединения,имеющие одну или более кольцевых структур, например моно-, би-, или трициклические соединения, так же, как и связанные с бензольным кольцом карбоциклические фрагменты, например 5,6,7,8-тетрагидронафтил и подобные. Предпочтительно, если арильная группа является моноциклическим или бициклическим кольцом. Представители арильных групп включают фенил, толил, антраценил, фторенил, инденил,азуленил, фенантренил и нафтил. Карбоциклическая арильная группа может быть незамещенной или замещенной. Используемый здесь термин "гетероарил", если иначе не определено, подразумевает карбоциклическое ароматическое кольцо, содержащее от 5 до 14 атомов в кольце, и атомы кольца содержат по мень-5 009120 шей мере 1 гетероатом, предпочтительно от 1 до 3 гетероатомов, независимо выбранных из азота, кислорода или серы. Гетероарильные кольцевые структуры включают соединения, имеющие одну или более кольцевую структуру, например моно-, би-, или трициклические соединения, так же, как и связанные гетероциклические фрагменты. Представителями гетероарилов являются триазолил, тетразолил, оксадиазолил, пиридил, фурил, бензофуранил, тиофенил, бензотиофенил, бензоизоксазолил, бензоизотиазолил, хинолинил, пирролил, индолил, оксазолил, бензоксазолил, имидазолил, бензимидазолил, тиазолил,бензотиазолил, изоксазолил, пиразолил, изотиазолил, пиридазинил, пиримидинил, пиразинил, триазинил,циннолинил, фталазинил, хиназолинил, бензохиназолинил, акридинил, пиримидил и оксазолил. Группа может быть незамещенной или замещенной. Используемый здесь термин "арилокси", если иначе не определено, подразумевает -O-арильную группу, где арил является таким, как определено выше. Арилоксигруппа может быть незамещенной или замещенной. Используемый здесь термин "арилалкил", если иначе не определено, подразумевает -(алкил)-(арил),где алкил и арил являются такими, как определено выше, включают, но не ограничиваясь, -(СН 2)фенил,-(СН 2)2 фенил, -(CH2)3 фенил, -(СН)(фенил)2, -(СН)(фенил)3, -(СН 2)толил, -(СН 2)антраценил, -(СН 2)фторенил,-(СН 2)инденил, -(СН 2)азуленил, -(СН 2)нафтил и подобные. Используемый здесь термин "гетероарилалкил", если иначе не определено, подразумевает -(алкил)(гетероарил), где алкил и гетероарил являются такими, как определено выше, включающий, но не ограничиваясь, -(СН 2)пиридил, -(СН 2)2 пиридил, -(СН 2)3 пиридил, -СН(пиридил)2, -С(пиридил)3, -(СН 2)триазолил,-(СН 2)тетразолил, -(СН 2)оксадиазолил, -(СН 2)фурил, -(СН 2)бензофуранил, -(СН 2)тиофенил, -(СН 2)бензотиофенил и подобные. Используемый здесь термин "арилалкилокси", если иначе не определено, подразумевает -О-(алкил)(арил), где алкил и гетероарил являются такими, как определено выше, включающий, но не ограничиваясь,-О-(СН 2)2 фенил, -О-(СН 2)3 фенил, -O-СН(фенил)2, -O-СН(фенил)3, -О-(СН 2)толил, -О-(СН 2)антраценил, О(СН 2)фторенил, -О-(СН 2)инденил, -О-(СН 2)азуленил, -О-(СН 2)нафтил и подобные. Используемый здесь термин "циклоалкил", если иначе не определено, подразумевает моноциклическое или полициклическое насыщенное кольцо, содержащее атомы углерода и водорода и не имеющее множественных углерод-углерод связей. Циклоалкильная группа может быть незамещенной или замещенной. Примеры циклоалкильных групп включают, но не ограничиваясь, (С 3-С 7)циклоалкильные группы, включающие циклопропил, циклобутил, циклопентил, циклогексил и циклогептил, и насыщенные циклические и бициклические терпены. Циклоалкильная группа может быть ненасыщенной или насыщенной. Предпочтительно циклоалкильной группой является моноциклическое или бициклическое кольцо. Используемый здесь термин "гетероциклил", если иначе не определено, подразумевает моноциклическое или полициклическое кольцо, содержащее атомы углерода и водорода, не обязательно имеющее от 1 до 4 множественных связей, и атомы кольца содержат по меньшей мере 1 гетероатом, предпочтительно от 1 до 3 гетероатомов, независимо выбранных из азота, кислорода и серы. Гетероциклические кольцевые структуры включают соединения, имеющие одну или более кольцевых структур, например моно-, би-, или трициклические соединения. Предпочтительно гетероциклильная группа является моноциклическим или бициклическим кольцом. Представители гетероциклов включают, но не ограничиваются, морфолинилом, пирролидинонилом, пирролидинилом, пиперидинилом, гидантоинилом, валеролактамилом, оксиранилом, оксетанилом, тетрагидрофуранилом, тетрагидропиранилом, тетрагидропиридинилом, тетрагидропримидинилом, тетрагидротиофенилом, тетрагидротиопиранилом и подобными. Гетероциклильное кольцо может быть незамещенным или замещенным. Используемый здесь термин "циклоалкилокси", если иначе не определено, подразумевает -О-(циклоалкил), где циклоалкил определен выше. Используемый здесь термин "циклоалкилалкилокси", если другого не определено, подразумевает-О-(алкил)(циклоалкил), где циклоалкил и алкил являются такими, как определено выше, включающий,но не ограничивающийся -O-циклопропилом, -O-циклобутилом, -O-циклопентилом, -O-циклогексилом,-O-циклогептилом и подобными. Используемый здесь термин "аминоалкокси", если иначе не определено, подразумевает -О-(алкил)NH2, где алкил определен выше, включающий, но не ограничивающийся -O-CH2-NH2, -O-(СН 2)2-NH2, -O(CH2)3-NH2, -О-(CH2)4-NH2, -О-(СН 2)5-NH2 и подобными. Используемый здесь термин "алкиламино", если иначе не определено, подразумевает -NH(алкил) или-N(алкил)(алкил), где алкил определен выше, включающий, но не ограничивающийся NНСН 3, -NНСН 2 СН 3,-NH(СН 2)2 СН 3, -NН(СН 2)3 СН 3, -NH(CH2)4 СН 3, -NH(СH2)5 СН 3, -N(СН 3)2, -N(СН 2 СН 3)2, -NСН 2)2 СН 3)2,-N(СН 3)(СН 2 СН 3) и подобными. Используемый здесь термин "ариламино", если иначе не определено, подразумевает -NН(арил), где арил определен выше, включающий, но не ограничивающийся -NH(фенилом), -NН(толилом), -NH(антраценилом), -NH(фторенилом), -NH(инденилом), -NH(азуленилом), -NH(пиридинилом), -NH(нафтилом) и подобными.-6 009120 Используемый здесь термин "арилалкиламино", если иначе не определено, подразумевает -NH-(алкил)(арил), где алкил и арил определены выше, включающий -NH-CH2-(фенил), -NH-CH2-(толил), -NHCH2-(антраценил), -NH-CH2-(фторенил), -NH-CH2-(инденил), -NH-CH2-(азуленил), -NH-CH2-(пиридинил), -NH-СН 2-(нафтил), -NH-(CH2)2-(фенил) и подобные. Используемый здесь термин "циклоалкиламино", если иначе не определено, подразумевает -NH(циклоалкил), где циклоалкил определен выше, включающий -NH-циклопропил, -NH-циклобутил, -NHциклопентил, -NH-циклогексил, -NH-циклогептил и подобные. Используемый здесь термин "аминоалкил", если иначе не определено, подразумевает -(алкил)-NH2,где алкил определен выше, включающий -CH2-NH2, -(CH2)2-NH2, -(CH2)3-NH2, -(CH2)4-NH2, -(CH2)5-NH2 и подобные. Используемый здесь термин "алкиламиноалкил", если другого не определено, подразумевает -(алкил)NH(алкил) или -(алкил)-N(алкил)(алкил), где каждый "алкил" является независимо алкильной группой, определенной выше, включающей -CH2-NH-CH3, -CH2-NHCH2CH3, -CH2-NH(CH2)2CH3, -CH2-NH(CH2)3CH3,-CH2-NH(СН 2)4 СН 3, -CH2-NH(СН 2)5 СН 3, -(CH2)2-NH-CH3, -CH2-N(СН 3)2, -CH2-N(СН 2 СН 3)2, -СН 2-NСН 2)2 СН 3)2,-CH2-N(СН 3)(СН 2 СН 3), -(СН 2)2-N(СН 3)2 и подобные. Используемый здесь термин "терапевтически эффективное количество" относится к количеству соединения данного изобретения или другого активного ингредиента, достаточного для обеспечения терапевтической пользы в лечении или тактике лечения заболевания или для отсрочки или минимизации симптомов, связанных с заболеванием. Кроме того, терапевтически эффективное количество в отношении соединения данного изобретения подразумевает количество терапевтического агента самого по себе или в комбинации с другими терапиями, которое обеспечивает терапевтическую пользу в лечении и тактике лечения заболевания. Используемый в связи с количеством соединения данного изобретения, данный термин может охватывать количество, которое улучшает общую терапию, снижает или позволяет избежать симптомов или причин заболевания, или повышает терапевтическую эффективность, или действует совместно с другим терапевтическим агентом. Используемый здесь термин "профилактически эффективное количество" относится к количеству соединения данного изобретения или другого активного ингредиента, достаточного для предотвращения,исключения рецидива или развития заболевания. Профилактически эффективное количество может относиться к количеству, достаточному для предотвращения начала болезни, или рецидива, или развития заболевания у пациента, включающего, но не ограничивающегося теми, кто предрасположен к заболеванию. Профилактически эффективное количество может также относиться к количеству, которое обеспечивает терапевтическую пользу в предотвращении заболевания. Кроме того, профилактически эффективное количество в отношении соединения данного изобретения подразумевает количество терапевтического агента самого по себе или в комбинации с другими агентами, которое обеспечивает профилактическую пользу в предотвращении заболевания. Используемый в связи с количеством соединения данного изобретения, данный термин может охватывать количество, которое улучшает общую профилактику,или повышает профилактическую эффективность, или действует совместно с другим профилактическим агентом. Используемый здесь термин "терапевтический протокол" касается режима приема и дозирования одного или более терапевтическогих агентов. Используемый здесь термин "профилактический протокол" касается режима приема и дозирования одного или более профилактических агентов. Используемый здесь термин "протокол" включает расписание приема и режимы дозирования. Используемый здесь термин "в комбинации" относится к применению более чем одного профилактического и/или терапевтического агента. Используемые здесь термины "управлять", "управляя" и "управление" касаются полезных эффектов, которые субъект получает от профилактического или терапевтического агента, который не приводит к лечению заболевания. В конкретных воплощениях субъекту вводят один или более профилактических или терапевтических агентов, "управляющих" заболеванием так, чтобы предотвратить прогрессирование или ухудшение заболевания. Используемые здесь термины "предотвращать", "предотвращающее" и "предотвращение" относятся к предотвращению начала рецидива, распространения заболевания у субъекта, получаемого после введения профилактического или терапевтического агента. Используемые здесь термины "воздействовать", "воздействие" и "лечение" относится к устранению или улучшению заболевания или симптомов, связанных с заболеванием. В конкретных воплощениях такие термины относятся к минимизации распространения или ухудшения заболевания, получаемой после введения субъекту с таким заболеванием одного или более профилактических или терапевтических агентов. Используемый здесь термин "фармацевтически приемлемые соли" касается солей, получаемых из фармацевтически приемлемых нетоксичных кислот или оснований, включая неорганические кислоты и основания и органические кислоты и основания. Подходящие фармацевтически приемлемые аддитивные соли основания для соединения настоящего изобретения включают, но не ограничиваются солями ме-7 009120 таллов, состоящим из алюминия, кальция, лития, магния, калия, натрия и цинка или органических солей,образованными лизином, N,N'-дибензилэтилендиамином, хлорпрокаином, холином, диэтаноламином,этилендиамином, меглумином (N-метилглюкамином) и прокаином. Подходящие нетоксичные кислоты включают, но не ограничиваются неорганическими и органическими кислотами, такими как уксусная,альгиновая, антраниловая, бензолсульфоновая, бензойная, камфорсульфоновая, лимонная, этенсульфоновая, муравьиная, фумаровая, фуранкарбоновая, галактуроновая, глюконовая, глюкуроновая, глутаминовая, гликолевая, бромоводородная, хлороводородная, изэтиновая, молочная, малеиновая, яблочная,миндальная, метансульфоновая, слизистая, азотная, памоиновая, пантотеновая, фенилуксусная, фосфорная, пропионовая, салициловая, стеариновая, янтарная, сульфаниловая, серная, винно-каменная и п-толуолсульфоновая кислота. Конкретные нетоксичные кислоты включают хлороводородную, бромоводородную, фосфорную, серную, и метансульфоновую кислоты. Примеры конкретных солей, таким образом, включают соли, такие как гидрохлориды и мезилаты. Другие примеры солей хорошо известны в данной области, смотри, например, Remington's PharmaceuticalSciences, 18th ed., Mack Publishing, Easton PA (1990). Используемый здесь термин "пролекарство", если иначе не определено, подразумевает производное соединения, которое может гидролизоваться, окисляться или иначе взаимодействовать в биологических условиях (in vitro или in vivo) с обеспечением активного соединения, особенно соединения данного изобретения. Примеры пролекарств включают, но не ограничиваются производными или метаболитами соединения данного изобретения, которые включают биогидролизуемые фрагменты, такие как биогидролизуемые амиды, биогидролизуемые сложные эфиры, биогидролизуемые карбаматы, биогидролизуемые карбонаты, биогидролизуемые уреиды и биогидролизуемые аналоги фосфатов. Предпочтительно пролекарствами соединений с карбоксильными функциональными группами являются низшие алкильные сложные эфиры карбоновой кислоты. Карбоксилатные сложные эфиры удобно получать этерифицированием каких-либо фрагментов карбоновой кислоты, присутствующих в молекуле. Пролекарства обычно могут быть получены с использованием хорошо известных методов, например тех, что описаны в Burger'sof Prodrugs (H. Bundgaard ed., 1985, Harwood Academic Publishers Gmfh). Используемые здесь термины, если иначе не определено, "биогидролизуемый амид", "биогидролизуемый сложный эфир", "биогидролизуемый карбамат", "биогидролизуемый карбонат", "биогидролизуемый уреид", "биогидролизуемый фосфат" подразумевают амид, сложный эфир, карбамат, карбонат, уреид или фосфат, соответственно, соединения, которое или: 1) не пересекается в биологической активности с соединением, но может придавать этому соединению предпочтительные свойства in vivo, такие как захват, длительность действия, или начало действия; либо 2) является биологически не активным, но превращается in vivo в биологически активное соединение. Примеры биогидролизуемых эфиров включают, но не ограничиваются низшими алкильными сложными эфирами, алкоксиацилокси сложными эфирами, алкилациламиноалкильными сложными эфирами и холиновыми сложными эфирами. Примеры биогидролизуемых амидов включают, но не ограничиваются амидами низших алкилов, амидами -аминокислот, алкоксиациламидами и алкиламиноалкилкарбонильными амидами. Примеры биогидролизуемых карбаматов включают, но не ограничиваются низшими алкиламинами, замещенными этилендиаминами, аминокислотами, гидроксиалкиламинами, гетероциклическими и гетероароматическими аминами и полиэфирными аминами. Используемый здесь, если иначе не определено, термин "оптически чистый" или "стереомерно чистый" подразумевает стереоизомер соединения, в значительной степени свободный от других стереоизомеров этого соединения. Например, стереомерно чистое соединение, имеющее один хиральный центр, в значительной степени свободно от противоположного энантиомера соединения. Стереомерно чистое соединение, имеющее два хиральных центра, в значительной степени свободно от других диастереомеров соединения. Типичное стереомерно чистое соединение содержит более чем примерно 80 мас.% одного стереоизомера соединения и менее чем примерно 20 мас.% других стереоизомеров соединения, более предпочтительно более чем примерно 90 мас.% одного стереоизомера соединения и менее чем примерно 10 мас.% других стереоизомеров соединения, даже более предпочтительно более чем примерно 95 мас.% одного стереоизомера соединения и менее чем примерно 5 мас.% других стереоизомеров соединения и наиболее предпочтительно более чем примерно 97 мас.% одного стереоизомера соединения и менее чем примерно 3 мас.% других стереоизомеров соединения. Используемый здесь, если иначе не определено, термин "энантиомерно чистый" подразумевает стереомерно чистую композицию соединения, имеющего хиральный центр. Следует заметить, что, если существует различие между представленной структурой и наименованием,присвоенным структуре, представленная структура имеет большее значение. Кроме того, если стереохимия структуры или части структуры не отображена с помощью, например, жирных или пунктирных линий,структуру или часть структуры следует интерпретировать как охватываемую всеми ее стереоизомерами. Подробное описание изобретения Соединения данного изобретения Это изобретение охватывает соединения 1,2,4-оксадиазолбензойной кислоты формулы I или фармацевтически приемлемые соли, гидраты, клатраты, пролекарства, полиморфы, стереоизомеры,включая энантиомеры, диастереомеры, рацематы или смеси их стереоизомеров, гдеZ представляет собой замещенный или незамещенный арил, замещенный или незамещенный гетероарил,замещенный или незамещенный циклоалкил, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный гетероцикл, замещенный или незамещенный арилалкил;R1 представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, -(CH2CH2)nOR6 или любую биогидролизуемую группу;R2, R3, R4, R5 и R6 независимо представляют собой водород, замещенный или незамещенный алкил,замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, алкокси, арилокси, гетероарилокси, галоген, СF3, ОСF3, OCHF2, CN, СООН, COOR7, SO2R7, NO2, NH2 или N(R7)2;R7 в каждом случае независимо представляет собой водород, замещенный или незамещенный алкил,замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, алкокси, арилокси, гетероарилокси, галоген или СF3;n представляет собой целое число от 1 до 7. В альтернативном воплощении данное изобретение охватывает соединение формулы I, где R1, R2,3R , R4 и R5 представляют собой водород, Z не является метилом, 2-карбокси, этилом, 3-(4-пиридинил) пропилом или 2-(4-пиперидинил)этилом. В предпочтительном воплощении данное изобретение охватывает соединение формулы I, где R1 является Н. В предпочтительном воплощении данное изобретение охватывает соединение формулы I, где R1 является любой биогидролизуемой группой, отличной от Н. Во взаимосвязанном воплощении данное изобретение охватывает соединения 1,2,4-оксадиазолбензойной кислоты формулы II или фармацевтически приемлемые соли, гидраты, клатраты или их стереоизомеры, где Z представляет собой замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный гетероцикл, замещенный или незамещенный арилалкил и R представляет собой водород или галоген. В одном воплощении R является галогеном, фтором. В предпочтительном воплощении R является Н. В предпочтительном воплощении данное изобретение охватывает соединение формулы I или II, гдеZ представляет собой (4-фторфенил), еще более предпочтительно Z представляет собой (2-фторфенил). В конкретном воплощении данное изобретение охватывает соединение формулы I или II, где Z не является 4-цианофенилом. Предпочтительные соединения данного изобретения включают, но не ограничиваются- 10009120 3-[5-(3-хлорфеноксиметил)-[1,2,4]оксадиазол-3-ил]бензойной кислотой; 3-[5-(6-хлорпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]бензойной кислотой; 3-(5-циклопентилметил-[1,2,4]оксадиазол-3-ил)бензойной кислотой 3-[5-(4-метоксибензил)-[1,2,4]оксадиазол-3-ил]бензойной кислотой; 3-[5-(2,3-дифторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислотой; 3-[5-(2-фтор-5-метилфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислотой; 3-[5-(2-метилсульфанилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]бензойной кислотой; 3-[5-(2,2-дифторбензо[1,3]диоксол-5-ил)-[1,2,4]оксадиазол-3-ил]бензойной кислотой; 4-фтор-3-[5-(4-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислотой; 2-фтор-5-[5-(4-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислотой; 3-[5-(4-хлор-2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислотой; 3-[5-(4-бром-2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислотой; 3-[5-(3-фторбифенил-4-ил)-[1,2,4]оксадиазол-3-ил]бензойной кислотой; 3-5-[3-(2-хлорфенил)-5-метилизоксазол-4-ил]-[1,2,4]оксадиазол-3-илбензойной кислотой; 3-[5-(4-цианофенил)-[1,2,4]оксадиазол-3-ил]бензойной кислотой; натриевой солью 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты; метиловым эфиром 3-[5-(4-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты; 5-[5-(4-фторфенил)-[1,2,4]оксадиазол-3-ил]-2 метоксибензойной кислотой; 5-[5-(4-бром-2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислотой; 3-[5-(3-фторбифенил-4-ил)-[1,2,4]оксадиазол-3-ил]бензойной кислотой; 3-[5-(6-пирролидин-1-ил-пиридин-3-ил)-[1,2,4]оксадиазол-3-ил]бензойной кислотой; 3-[5-(6-морфолин-4-ил-пиридин-3-ил)-[1,2,4]оксадиазол-3-ил]бензойной кислотой; 3-[5-(3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-5'-ил)-[1,2,4]оксадиазол-3-ил]бензойной кислотой; 3-[5-(2-фтор-6-гидроксифенил)-[1,2,4]оксадиазол-3-ил]бензойной кислотой; метиловым эфиром 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты; 2-метоксиэтиловым эфиром 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты; 2-(2-метоксиэтокси)этиловым эфиром 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты; 2-[2-(2-метоксиэтокси)этокси]этиловым эфиром 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты; 2-2-[2-(2-метоксиэтокси)этокси]этоксиэтиловым эфиром 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3 ил]бензойной кислоты; 2-(2-2-[2-(2-метоксиэтокси)этокси]этоксиэтокси)этиловым эфиром 3-[5-(2-фторфенил)-[1,2,4]оксадиазол-3-ил]бензойной кислоты; 2-[2-(2-2-[2-(2-гидроксиэтокси)этокси]этоксиэтокси)этокси]этилового эфира 3-[5-(2-фторфенил)[1,2,4]оксадиазол-3-ил]бензойной кислотой; 3-[5-(4-аминофенил)-[1,2,4]оксадиазол-3-ил)бензойной кислотой; 3-[5-(4-азидофенил)-[1,2,4]оксадиазол-3-ил)бензойной кислотой; 3-[5-(4-бензилоксифенил)-[1,2,4]оксадиазол-3-ил)бензойной кислотой и фармацевтически приемлемыми солями, гидратами, сольватами, клатратами и их стереоизомерами. Соединения формул I и II, и приведенные выше, относятся здесь к "соединениям данного изобретения". Примеры соединения представлены в табл. 1 ниже. Таблица 1 Измерение активностей в табл. 1 было осуществлено с помощью клеточного анализа с репортером люциферазой (как описано в разделе "Биологические анализы и испытания на животных"), включающего конструкцию люциферазного репортера, содержащую кодон преждевременной терминации UGA, которой были стабильно трансфицированы клетки почек эмбриона человека 293 Т. В качестве внутреннего стандарта применялась небольшая молекула, 3-[3-(4-изопропилфенил)-2,5-диоксоимидазолидин-1-ил]бензойная кислота, которая, как известно, позволяет считывать кодоны преждевременной терминации. Измерения активности основаны на качественном отношении между минимальной концентрацией соединения,необходимого для продукции данного белка в клетке (активность), и максимального количества белка,производимого клеткой (эффективность). Значения активности и эффективности характеризуются как наивысшая, очень высокая или значительная. Комбинация этих значений используется для определения степени активности. Соединения, для которых была установлена наивысшая активность и наивысшая эффективность синтеза белка классифицируются как . Соединения, для которых была установлена наивысшая активность и высокая эффективность синтеза белка, классифицируются как . Соединения, для которых была установлена высокая активность и наивысшая эффективность синтеза белка,классифицируются как . Соединения, для которых была установлена высокая активность и высокая эффективность синтеза белка, классифицируются как . Соединения, для которых была установлена высокая активность и значительная эффективность синтеза белка, классифицируются как . Соединения, для которых была установлена значительная активность и высокая эффективность синтеза белка, классифицируются как . Аналогично, соединения, для которых была установлена значительная активность и значительная эффективность синтеза белка, классифицируются как (см. табл. внизу). Соединения, имеющие менее чем значительную активность или эффективность синтеза белка или оба показателя в клеточном анализе с репортером люциферазой, классифицировали без звездочек. Тем не менее, эти соединения, как полагают, имеют применение в in vivo методах данного изобретения. Настоящее изобретение охватывает применение соединения данного изобретения in vitro или invivo и включение соединения данного изобретения в фармацевтические композиции и отдельные единичные дозированные формы, применимые в лечении и профилактике ряда заболеваний и нарушений. Конкретные заболевания и нарушения включают те, что улучшены с помощью супрессии нонсенс-мутации в матричной РНК. Фармацевтические композиции, включающие дозированные формы данного изобретения, которые включают соединение данного изобретения или фармацевтически приемлемый полиморф, пролекарство,соль, клатрат, сольват или их гидрат, могут быть применены в способах данного изобретения. Не ограничиваясь теорией, предполагается, что соединение данного изобретения может модулировать терминацию преждевременной трансляции и/или уменьшение мРНК, обусловленное нонсенсмутацией. Следовательно, первое воплощение данного изобретения касается способа модулирования терминации преждевременной трансляции и/или уменьшения мРНК, обусловленного нонсенс-мутацией,включающего контактирование клетки, имеющей нонсенс-мутацию с эффективным количеством соединения данного изобретения, или фармацевтически приемлемого пролекарства, метаболита, полиморфа,соли, сольвата, гидрата или их клатрата. В частном воплощении данное изобретение касается способа индуцирования нонсенс-супрессии, включающаго контактирование клетки, имеющей нонсенс-мутацию с эффективным количеством соединения данного изобретения, или фармацевтически приемлемого пролекарства, метаболита, полиморфа, соли, сольвата, гидрата или их клатрата. Биологические анализы и испытания на животных Соединения, которые модулируют терминацию преждевременной трансляции и/или уменьшение мРНК, обусловленного нонсенс-мутацией, могут быть идентифицированы с помощью ряда методик. Например, способы скрининга соединений, которые модулируют посттранскрипционную экспрессию любого гена с преждевременным стоп-кодоном, описаны в международной патентной публикацииWO 01/44516 А 2 и включены в данный документ полностью в виде ссылки. В предпочтительном воплощении мРНК с преждевременным стоп-кодоном транслируется in vitro и используется для проверки библиотеки тест-соединений. В предпочтительном воплощении мРНК с кодоном преждевременной терминации является репортерным геном с кодоном преждевременной терминации. Для использования в высокопроизводительном отборе были разработаны два анализа для идентификации небольших молекул, которые обеспечивают нонсенс-супрессию. Каждый анализ использовал люциферазу, так как она является в анализе функциональным репортерным геном (свечение продуцируется, только если белок является функциональным), и этот анализ является чрезвычайно чувствительным(интенсивность свечения пропорциональна концентрации люциферазы в нМ диапазоне). Первый анализ является клеточным анализом с люциферазным репортером, и вторым является бихимический анализ,включающий лизат кроличьих лейкоцитов и мРНК люциферазного репортера, содержащего нонсенсмутацию. В клеточном анализе конструкцией люциферазного репортера, содержащей кодон преждевременной терминации UGA, стабильно трансфицировали клетки почек человеческих эмбрионов 293 Т. В биохимическом анализе мРНК, содержащую кодон преждевременной терминации UGA, использовали в качестве репортера в реакции трансляции in vitro, используя лизат кроличьих ретикулоцитов с добавлением тРНК, гемина, креатинкиназы, аминокислот, КОАс, Mg(ОАс)2 и креатинфосфата. Трансляция мРНК была инициирована в пределах лидерной последовательности вируса, которая значительно снижа- 19009120 ла стоимость анализа, так как кеппированная РНК не требовалась. Синтетическую мРНК получали invitro, используя Т 7-промотор и набор для транскрипции in vitro MegaScript (Ambion). В обоих, биохимическом и клеточном анализах, добавление небольшой молекулы, позволяющей, как известно, считывать кодоны преждевременной терминации, 3-[3-(4-изопропилфенил)-2, 5-диоксоимидазолидин-1-ил]бензойной кислоты, приводило к повышенной активности люциферазы и, следовательно, использовалось в качестве внутреннего стандарта. Системы животных моделей могут также использоваться для демонстрации безопасности и эффективности соединений формулы I или II. Соединения формулы I или II могут быть протестированы на предмет биологической активности с применением животных моделей интересующего заболевания, состояния или синдрома. Они включают животных, выведенных таким образом, чтобы они содержали необходимый элемент РНК, связанный с функциональной считывающей системой, например, трансгенных животных. Примеры животных моделей для фиброзно-кистозной дегенерации включают, но не ограничиваются мышами cftr(-/+) (см., например, Freedman и др., 2001, Gastroenterology 121(4): 950-7), мышамиUNC) (см., например, Stotland и др., 2000, Pediatr. Pulmonol. 30(5): 413-24). Примеры моделей мышечной дистрофии включают, но не ограничиваются мышью, хомяком, кошкой, собакой, и С. elegans. Примеры мышиных моделей включают, но не ограничиваются dy-/-мышью(см., например, Connolly и др., 2002, J. Neuroimmunol. 127(1-2): 80-7), мышиной мутацией мышечной дистрофии с миозитом (mdm) (см., например, Garvey и др., 2002, Genomics 79(2): 146-9), мышью mdx(Cv3) (см., например, Pillers и др., 1999, Laryngoscope 109(8): 1310-2) и мутантными мышами с миотонией ADR-MDX (см., например, Kramer и др., 1998, Neuromuscul. Disord. 8(8): 542-50). Примеры моделей мышечной дистрофии с хомяками включают, но не ограничиваются саркогликан-дефицитными хомяками (см., например, Nakamura и др., 2001, Am. J. Physiol. Cell. Physiol. 281(2): C690-9) и дистрофичными хомяками BIO 14.6 (см., например, SchlenkerBurbach, 1991, J. Appl. Physiol. 71(5): 1655-62). Пример модели мышечной дистрофии с кошками включает, но не ограничивается моделью гипертрофической кошачьей мышечной дистрофии (см., например, GaschenBurgunder, 2001, Acta Neuropathol. (Berl.) 101(6): 591-600). Собачьи модели мышечной дистрофии включают, но не ограничиваются мышечной дистрофией золотистого ретривера (см., например, Fletcher и др., 2001, Neuromuscul. Disord. 11(3): 23943) и собачьей Х-сцепленной мышечной дистрофией (см., например, Valentine и др., 1992, Am. J. Med.Genet. 42(3): 352-6). Примеры моделей мышечной дистрофии С. elegans описаны в ChamberlainBenian,2000, Curr. Biol. 10(21): R795-7 и CuletteSattelle, 2000, Hum. Mol. Genet. 9(6): 869-77. Примеры животных моделей семейной гиперхолистеринемии включают, но не ограничиваются мышами с отсутствием LDL рецепторных генов (см., например, Aji и др., 1997, Circulation 95(2): 430-7),крысами Yoshida (см., например, Fantappie и др., 1992, Life Sci. 50(24): 1913-24), крысами JCR:LA-cpJ. Pharmacol. 124(2): 227-82; и Tanaka и др., 1995, Atherosclerosis 114(1): 73-82). Пример животной модели рака человека, в основном, включает, но не ограничивается спонтанно возникающими опухолями домашних животных (см., например, VailMacEwen, 2000, Cancer Invest. 18(8): 781-92). Примеры животных моделей рака легкого включают, но не ограничиваются животными моделями рака легкого, описанными ZhangRoth (1994, In Vivo 8(5): 755-69) и трансгенной мышиной моделью с нарушенной функцией р 53 (см., например, Morris и др., 1998, J. La State Med. Soc. 150(4): 17985). Пример животной модели рака груди включает, но не ограничивается трансгенной мышью, у которой наблюдается избыточная экспрессия циклина D1 (см., например, Hosokawa и др., 2001, TransgenicRes 10(5): 471-8). Пример животной модели рака прямой кишки включает, но не ограничивается нокаутированными по TCR-бета и по р 53 мышами (см., например, Kado и др., 2001, Cancer Res. 61(6): 2395-8). Примеры животных моделей рака поджелудочной железы включают, но не ограничиваются метастатической моделью мышиной аденокарциномы поджелудочной железы Panc02 (см., например, Wang и др.,2001, Int. J. Pancreatol. 29(1): 37-46) и nu-nu мышами с генерированной подкожными опухолями поджелудочной железы (см., например, Ghaneh и др., 2001, Gene. Ther. 8(3): 199-208). Примеры животных моделей не Ходжкинской лимфомы включают, но не ограничиваются мышью с выраженным комбинированным иммунодефицитом ("SC1D") (см., например, Bryant и др., 2000, Lab. Invest. 80(4): 553-73) и трансгенными мышами IgHmu-HOX11 (см., например, Hough и др., 1998, Proc. Natl. Acad. Sci. USA 95(23): 13853-8). Пример животной модели рака пищевода включает, но не ограничивается трансгенной мышью для человеческого онкогенного папилломавируса типа 16 Е 7 (см., например, Herber и др., 1996, J.Virol. 70(3): 1873-81). Примеры животных моделей колоректальных карцином включают, но не ограничиваются мышиными моделями Арc (см., например, FoddeSmits, 2001, Trends Mol. Med. 7(8): 369-73 иKuraguchi и др., 2000, Oncogene 19(50): 5755-63). Пример животной модели нейрофиброматоза включает,но не ограничивается мутантными мышами NF1 (см., например, Cichowski и др., 1996, Semin. CancerBiol. 7(5): 291-8). Примеры животных моделей ретинобластомы включают, но не ограничиваются трансгенными мышами, которые экспрессируют 40 Т антиген птичьего вируса в сетчатке (см., например,Howes и др., 1994, Invest. Ophthalmol. Vis. Sci. 35(2): 342-51 и Windle и др., 1990, Nature 343(6259): 665-9) и инбредными крысами (см., например, Nishida и др., 1981, Curr. Eye Res. 1(1): 53-5 и Kobayashi и др.,1982, Acta Neuropathol. (Berl.) 57(2-3): 203-8). Примеры животных моделей опухоли Вильма включают,но не ограничиваются нокаутированными мышами WT1 (см., например, Scharnhorst и др., 1997, CellGrowth Differ. 8(2): 133-43), крысиной подлинией с высоким риском развития нефробластомы (см., например, MesfinBreech, 1996, Lab. Anim. Sci. 46(3): 321- 6), и крысой Wistar/Furth с опухолью Вильма(см., например, Murphy и др., 1987, Anticancer Res. 7(4 В): 717-9). Примеры животных моделей пигментной дегенерации сетчатки включают, но не ограничиваются крысой королевского колледжа хирургов ("RCS") (см., например, Vollrath и др., 2001, Proc. Natl. Acad.Wag/Rij (см., например, Lai и др., 1980, Am. J. Pathol. 98(1): 281-4). Примеры животных моделей цирроза включают, но не ограничиваются ССl4-восприимчивыми крысами (см., например, Kloehn и др., 2001, Horm. Metab. Res. 33(7): 394-401) и моделями грызунов, обработанных компонентами бактериальной клетки, или с колитом (см., например, Vierling, 2001, Best Pract.Res. Clin. Gastroenterol. 15(4): 591-610). Примеры животных моделей гемофилии включают, но не ограничиваются моделями грызунов с гемофилией А (см., например, Reipert. и др., 2000, Thromb. Haemost. 84(5): 826-32; Jarvis и др., 1996,Thromb. Haemost. 75(2): 318-25; и Bi и др., 1995, Nat. Genet. 10(1): 119-21), собачьими моделями гемофилии А (см., например, Gallo-Penn и др., 1999, Hum. Gene. Ther. 10(11): 1791-802 и Connelly и др., 1998,Blood 91(9); 3273-81), мышиными моделями гемофилии В (см., например, Snyder и др., 1999, Nat. Med. 5(1): 64-70; Wang и др., 1997, Proc. Natl. Acad. Sci. USA 94(21): 11563-6; и Fang и др., 1996, Gene Ther. 3(3): 217-22), собачьими моделями гемофилии В (см., например, Mount и др., 2002, Blood 99(8): 2670-6;Natl. Acad. Sci. USA 91(6): 2353-7) и моделью гемофилии В макаки-резус (см., например, Lozier и др.,1999, Blood 93(6): 1875-81). Примеры животных моделей болезни Виллебранда включают, но не ограничиваются мышиным инбредным штаммом RIIIS/J (см., например, Nichols и др., 1994, 83(11): 3225-31 и Sweeney и др., 1990,76(11): 2258-65), крысами, которым вводят ботроцетин (см., например, Sanders и др., 1988, Lab. Invest. 59(4): 443-52), и моделями болезни Виллебранда у свиней (см., например, Nichols и др., 1995, Proc. Natl.Acad. Sci. USA 92(7): 2455-9; JohnsonBowie, 1992, J. Lab. Clin. Med. 120(4): 553-8); и Brinkhous и др. 1991, Mayo Clin. Proc. 66(7): 733-42). Примеры животных моделей -талассемии включают, но не ограничиваются мышиными моделями с мутацией в генах глобина (см., например, Lewis и др., 1998, Blood 91(6): 2152-6; Raja и др., 1994, Br. J.Haematol. 86(1): 156-62; Рорр и др., 1985, 445: 432-44; и Skow и др., 1983, Cell 34(3): 1043-52). Примеры животных моделей почечно-каменной болезни включают, но не ограничиваются крысами с генетической гиперкальциурией (см., например, Bushinsky и др., 1999, Kidney Int. 55(1): 234-43 иBushinsky и др., 1995, Kidney Int. 48(6): 1705-13), химически обработанными крысами (см., например,Grases и др., 1998, Scand. J. Urol. Nephrol. 32(4): 261-5; Burgess и др., 1995, Urol. Res. 23(4): 239-42; Kumar и др., 1991, J. Urol. 146(5): 1384-9; Okada и др., 1985, Hinyokika Kiyo 31(4): 565-77; и Bluestone и др., 1975,Lab. Invest. 33(3): 273-9), крысами с гипероксалурией (см., например, Jones и др., 1991, J. Urol. 145(4): 868-74), свиньями с односторонней ретроградной гибкой нефроскопией (см., например, Seifinah и др.,2001, 57(4): 832-6) и кроликами с обструкцией верхних мочевыводящих путей (см., например, Itatani и др., 1979, Invest. Urol. 17(3): 234-40). Примеры животных моделей атаксии-телеангиоэктазии включают, но не ограничиваются мышиными моделями атаксии-телеангиоэктазии (см., например, Barlow и др., 1999, Proc. Natl. Acad. Sci. USA 96(17): 9915-9 и Inoue и др., 1986, Cancer Res. 46(8): 3979-82). Примеры животных моделей лизосомных болезней накопления включают, но не ограничиваются мышиными моделями мукополисахаридоза VII (см., например, Brooks и др., 2002, Proc. Natl. Acad. Sci.USA 99(9): 6216-21; Monroy и др., 2002 Bone 30(2): 352-9; Vogler и др., 2001, Pediatr. Dev. Pathol. 4(5): 421-33; Vogler и др., 2001, Pediatr. Res. 49(3): 342-8; и Wolfe и др., 2000, Mol. Ther. 2(6): 552-6), мышиной моделью метахромной лейкодистрофии (см., например, Matzner и др., 2002, Gene Ther. 9(1): 53-63), мышиной моделью болезни Сандхоффа (см., например, Sango и др., 2002, Neuropathol. Appl. Neurobiol. 28(1): 23-34), мышиными моделями мукополисахаридоза типа III А (см., например, Bhattacharyya и др.,2001, Glycobiology 11(1): 99-10 и Bhaumik и др., 1999, Glycobiology 9(12): 1389-96.), мышами с дефицитом арилсульфатазы A (ASA) (см., например, D'Hooge и др., 1999, Brain Res. 847(2): 352-6 и D'Hooge и- 21009120 др., 1999, Neurosci. Lett. 273(2): 93-6); мышами с аспартиглюкозаминурией, связанной с мутацией (см.,например, Jalanko и др., 1998, Hum. Mol. Genet. 7(2): 265-72); кошачьими моделями мукополисахаридоза типа VI (см., например, Crawley и др., 1998, J. Clin. Invest. 101(1): 109-19 и Norrdin и др., 1995, Bone 17(5): 485-9); кошачьей моделью болезни Ниманна-Пика типа С (см., например, March и др., 1997, ActaNeuropatliol. (Berl.) 94(2): 164-72); мышами с дефицитом кислой сфингомиелиназы (см., например, OtterbachStoffel, 1995, Cell 81(7): 1053-6) и бычьим маннозидозом (см., например, Jolly и др., 1975, Birth DefectsOrig. Arctic. Ser. 11(6): 273-8). Примеры животных моделей туберозного склероза ("TSC") включают, но не ограничиваются мышиной моделью TSC1 (см., например, Kwiatkowski и др., 2002, Hum. Mol. Genet. 11(5): 525-34), Tsc1USA 2001, Jul. 17; 98(15): 8762-7), крысиной моделью мутантного гена TSC2 (Eker) (см., например, Hino 2000, Nippon Rinsho 58(6): 1255-61; Mizuguchi и др., 2000, J. Neuropathol. Exp. Neurol. 59(3): 188-9; и Hino и др., 1999, Prog. Exp. Tumor Res. 35: 95-108); и (+/-)Tsc2 мышами (см., например, Onda и др., 1999, J.Clin. Invest. 104(6): 687-95). Синтез и получение Соединения данного изобретения могут быть получены с помощью стандартной, хорошо известной методологии синтеза, см., например, March, J. Advanced Organic Chemistry; Reactions Mechanisms, andStructure, 4th ed., 1992. Исходные материалы, применяемые при получении соединений данного изобретения и промежуточных соединений, являются коммерчески доступными или могут быть получены из коммерчески доступных материалов с использованием известных способов синтеза и реагентов. Соединения формулы I или II могут быть синтезированы с использованием синтеза, отображенного на схемах А и В, ниже. Соединения настоящего изобретения могут быть получены способами, обсуждаемыми в следующем разделе. Соединения формулы I могут быть получены с использованием методологии, представленной на схеме А. Схема А- 22009120 В этом изобретении может использоваться коммерчески доступная, кислотолабильная смола А 1,такая как трифенилметильная (тритильная) смола, смола 2-хлортритилхлорида, фенилацетамидометила(РАМ) и п-алкоксибензильного спирта. Связывание соединения бензойной кислоты А 2 и тритильной смолы (здесь Х=2-хлортритилхлорид) может быть осуществлено в подходящем растворителе, таком как дихлорметан, диметилформамид, толуол, в присутствии реагента третичного амина, такого как диизопропилэтиламин или триэтиламин. В альтернативном способе ацилированную смолу A3 удобно получать, используя стандартные условия образования эфирной связи с применением диизопропилкарбодиимида (для фенилацетамидометильной смолы и смолы п-алкоксибензильного спирта) или эквивалентов,таких как гексафторфосфат бензотриазол-1-ил-окси-трис-пирролидинофосфония (РуВОР), гексафторфосфат бром-трис-пирролидинофосфония (РуBrОР), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (EDC) без или с диизопропилэтиламином в диметилформамиде. Связанный со смолой цианобензойный эфир может быть обработан гидроксиламином в инертном растворителе, таком как этанол,тетрагидрофуран, диоксан и диметилформамид, или смеси с диизопропилэтиламином или без, с получением гидроксиамидинового соединения А 4. Гидроксиамидиновая смола А 4 может быть использована в качестве обычного сшивающего агента для синтеза 1,2,4-оксадиазольных соединений библиотеки с различием у большинства соединений в структуре I, как показано на схеме А. Гидроксиамидиновое соединение, связанное со смолой, ацилируется реагентом А 5, где группа Y представляет собой некоторые уходящие группы, такие как гало, имидазолил, п-нитрофенол и др., в присутствии основного реагента, такого как диизопропилэтиламин или триэтиламин, в инертном растворителе, таком как дихлорметан, тетрагидрофуран и диметилформамид или смеси. В альтернативном способе ацилирование удобно проводить с реагентом 5, где группа Y представляет собой гидрокси, используя диизопропилкарбодиимд или эквиваленты, такие как гексафторфосфат бензотриазол-1-ил-окси-трис-пирролидинофосфония, гексафторфосфат бром-трис-пирролидинофосфония, гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида с диизопропилэтиламином или без, в диметилформамиде. Ацилированное соединение А 6, связанное со смолой, расщепляется в кислой среде, такой как 2-молярная трифторуксуная кислота в дихлорметане,или 3-молярная уксусная кислота в дихлорметане, для получения требуемого соединения А 7. Реакция замыкания цикла на свободном кислом соединении А 7 может быть инициирована нагреванием с обратным холодильником в инертном растворителе, таком как толуол, тетрагидрофуран, диоксан и диметилформамид или смеси, с или без основного реагента, такого как диизопропилэтиламин, триэтиламин или тетрабутиламмонийфторид, для получения 1,2,4-оксадиазольного соединения I. Альтернативная реакция замыкания цикла может быть осуществлена дегидроциклизацией соединения А 6, связанного со смолой(схема А). Эта трансформация может быть выполнена с или без основного реагента, такого как триэтиламин, диизопропилэтиламин или тетрабутиламмонийфторид, в инертном растворителе, таком как толуол, тетрагидрофуран, диоксан и диметилформамид или смеси. Температуры данной реакции варьируют от температуры окружающей среды до температуры образования флегмы растворителя. Твердофазная химия, описанная выше, может быть применена к синтезу в растворе соединений структуры I. Это описано на схеме В ниже. Схема В Цианосоединение В 1 гидроксиамидинируется гидроксиламином. Эту реакцию часто осуществляют в присутствии основного реагента, такого как триэтиламин, карбонат калия или диизопропилэтиламин, в растворителе, таком как метанол, этанол, трет-бутанол, тетрагидрофуран или диметилформамид или смеси, и температуры варьируют от температуры окружающей среды до температуры флегмообразования выбранного растворителя. Гидроксиамидиновое соединение В 2 ацилируется реагентом В 3, где группа Y представляет собой некоторые уходящие группы, такие как гало, имидазоил, п-нитрофенол и др. Реак- 23009120 цию обычно проводят с основным реагентом, таким как триэтиламин или диизопропилэтиламин, в растворителе, таком как дихлорметан, тетрагидрофуран или диметилформамид. В альтернативном способе ацилирование удобно проводить в обычных реакциях образования эфирной связи, где группа Y представляет собой гидрокси, используя диизопропилкарбодиимид или эквиваленты, такие как гексафторфосфат бензотриазол-1-ил-окси-трис-пирролидинофосфония, гексафторфосфат бром-трис-пирролидинофосфония, гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида с или без диизопропилэтиламина. Замыкание цикла на соединении В 4 может быть проведено с или в отсутствие основного реагента,такого как триэтиламин или диизопропилэтиламин, в растворителе, таком как дихлорметан, тетрагидрофуран, толуол или диметилформамид и смеси, и температуры варьируют от температуры окружающей среды до температуры флегмообразования выбранного растворителя. Способы применения Данное изобретение охватывает способы лечения и профилактики заболеваний или нарушений путем улучшения супрессии терминации преждевременной трансляции и/или уменьшения мРНК, обусловленного нонсенс-мутацией у пациента, которые включают введение пациенту, нуждающемуся в таком лечении или такой профилактике, терапевтически эффективного количества соединения данного изобретения или фармацевтически приемлемого пролекарства, сольвата, метаболита, полиморфа, соли, сольвата, гидрата или их клатрата. В одном воплощении данное изобретение охватывает лечение или профилактику любого заболевания, которое связано с наблюдаемой генной терминацией преждевременной трансляции и/или уменьшения мРНК, обусловленного нонсенс-мутацией. В одном воплощении заболевание имеет место частично из-за отсутствия экспрессии гена, получаемого после преждевременного стоп-кодона. Конкретные примеры генов, которые могут проявлять терминацию преждевременной трансляции и/или уменьшение мРНК, обусловленное нонсенс-мутацией, и заболеваний, связанных с терминацией преждевременной трансляции и/или уменьшением мРНК, обусловленным нонсенс-мутацией, представлены в заявке на патент США 60/390,747, названной: Methods For Identifying Small Molecules That Modulate PrematureTranslation Termination And Nonsense Mediated mRNA Decay, поданной 21 июня 2002 года, которая полностью включена в данный документ в виде ссылки. Заболевания, течение которых улучшается за счет супрессии преждевременной терминации трансляции и/или нонсенс-обусловленного уменьшения мРНК, включают, но не ограничиваются генетическим заболеванием, раком, аутоиммунным заболеванием, заболеванием крови, заболеванием соединительной ткани, диабетом, нейродегенеративным заболеванием, пролиферативным заболеванием, сердечно-сосудистым заболеванием, легочным заболеванием, воспалительным заболеванием или заболеванием центральной нервной системы. Конкретные генетические заболевания в пределах объема способов данного изобретения включают,но не ограничиваются амилоидозом, гемофилией, болезнью Альцгеймера, болезнью Тея-Сакса, атеросклерозом, гигантизмом, карликовостью, гипотиреозом, гипертиреозом, старением, ожирением, болезнью Паркинсона, болезнью Ниманна-Пика, фиброзно-кистозной дегенерацией, мышечной дистрофией,сердечным заболеванием, почечно-каменной болезнью, атаксией-телеангиоэктазией, семейной гиперхолистеринемией, пигментной дегенерацией сетчатки, лизосомной болезнью накопления, туберозным склерозом, мышечной дистрофией Дюшенне и синдромом Марфана. Солидная опухоль и другие раковые заболевания включены в способы данного изобретения. В другом воплощении генетическим заболеванием является аутоиммунное заболевание. В предпочтительном воплощении аутоиммунное заболевание представляет собой ревматоидный артрит или реакцию "трансплантант против хозяина". В другом воплощении генетическим заболеванием является болезнь крови. В предпочтительном воплощении болезнью крови является гемофилия, болезнь Виллебранда, атаксия-телеангиоэктазия, -талассемия или почечно-каменная болезнь. В другом воплощении генетическим заболеванием является заболевание соединительной ткани. В воплощении заболеванием соединительной ткани является несовершенный остеогенез или цирроз. В другом воплощении генетическим заболеванием является диабет. В другом воплощении генетическим заболеванием является воспалительное заболевание. В предпочтительном воплощении воспалительным заболеванием является артрит. В другом воплощении генетическим заболеванием является заболевание центральной нервной системы. В одном воплощении заболеванием центральной нервной системы является нейродегенеративное заболевание. В предпочтительном воплощении заболеванием центральной нервной системы является рассеянный склероз, мышечная дистрофия, мышечная дистрофия Дюшенне, болезнь Альцгеймера, болезнь Тея-Сакса, поздний младенческий нейрональный цероид-липофусциноз или болезнь Паркинсона. В другом воплощении генетическим заболеванием является рак. В предпочтительном воплощении рак является раком головы и шеи, глаза, кожи, рта, глотки, пищевода, грудной клетки, кости, легкого,толстой кишки, сигмовидной ободочной кишки, прямой кишки, желудка, простаты, груди, яичников,почек, печени, поджелудочной железы, мозга, кишечника, сердца или надпочечников.- 24009120 В другом предпочтительном воплощении рак связан с генами супрессии опухоли (см., например,Garinis и др., 2002, Hum. Gen. 111: 115-117; Meyers и др. 1998, Proc. Natl. Acad. Sci. USA, 95: 1558715591; Kung и др., 2000, Nature Medicine 6(12): 1335-1340). Такие гены супрессии опухоли включают, но не ограничиваются АРС, АТМ, BRAC1, BRAC2, MSH1, pTEN, Rb и р 53. В особенно предпочтительном воплощении геном супрессии опухоли является ген р 53. В гене р 53 были идентифицированы нонсенс-мутации, которые участвуют в развитии рака. Были идентифицированы некоторые нонсенс-мутации в гене р 53 (см., например, Masuda и др., 2000, Tokai J. Exp. Clin. Med. 25(2): 69-77; Oh и др., 2000, Mol. Cells 10(3): 275-80; Li и др., 2000, Lab. Invest. 80(4): 493-9; Yang и др.,1999, Zhonghua Zhong Liu Za Zhi 21(2): 114-8; Finkelstein и др., 1998, Mol. Diagn. 3(1): 37-41; Kajiyama и др., 1998, Dis. Esophagus. 11(4): 279-83; Kawamura и др., 1999, Leuk Res. 23(2): 115-26; Radig и др., 1998,Hum. Pathol. 29(11): 1310-6; Schuyer и др., 1998, Int. J. Cancer 76(3): 299-303; Wang-Gohrke и др., 1998,Oncol Rep. 5(1): 65-8; Fulop и др., 1998, J. Reprod. Med. 43(2): 119-27; Ninomiya и др., 1997, J. Dermatol.Res. Commun. 177(3): 901-6; описания которых включены в данный документ полностью в виде ссылки). Любое заболевание, связанное с геном р 53, кодирующим преждевременный кодон трансляции, включая,но не ограничиваясь нонсенс-мутациями, описанными в ссылках, цитированных выше, можно лечить или предотвратить соединениями формулы I или II, не ограничиваясь теорией, эти соединения опосредуют терминацию преждевременной трансляции и/или уменьшение мРНК, обусловленное нонсенс-мутацией. В других воплощениях заболевания, которые следует лечить или возникновение которых следует предотвращать введением пациенту, нуждающемуся в этом, эффективного количества соединения формулы I, включают солидную опухоль, саркому, карциному, фибросаркому, миксосаркому, липосаркому,хондросаркому, остеогенную саркому, хордому, ангиосаркому, эндотелиосаркому, лимфангиосаркому,лимфангиоэндотелиосаркому, синовиому, мезотелиому, опухоль Юинга, леймиосаркому, рабдомиосаркому, плоскоклеточную карциному, базально-клеточную карциному, аденокарциному, карциному потовых желез, карциному сальных желез, папиллярную карциному, папиллярную аденокарциному, цистаденокарциному, медуллярную карциному, бронхогенную карциному, гипернефроидную карциному, гепатому, карциному желчного протока, хориокарциному, семиному, эмбриональную карциному, опухоль Вильмса, рак шейки матки, тестикулярную опухоль, легочную карциному, мелкоклеточную карциному легких, карциному мочевого пузыря, эпителиальную карциному, глиому, астроцитому, медуллобластому, краниофарингому, эпендимому, саркому Капоши, пинеалому, гемангиобластому, акустическую невриному, олигодендроглиому, менангиому, меланому, нейробластому, ретинобластому, опухоль кровяного происхождения, острую лимфобластическую лейкемию, острую лимфобластическую лейкемию В-клеток,острую лимфобластическую лейкемию Т-клеток, острую миелобластическую лейкемию, острую промиелобластическую лейкемию, острую монобластическую лейкемию, острую эритролейкемическую лейкемию, острую мегакариобластическую лейкемию, острую миеломоноцитную лейкемию, острую нелимфоцитную лейкемию, острую недифференцированную лейкемию, хроническую миелоцитную лейкемию,хроническую лимфоцитную лейкемию, лейкоз ворсистых клеток или множественную миелому. См., например, Harrisorn's Principles of Internal Medicine, Eugene Braunwald и др., eds., pp. 491-762 (15th ed. 2001). В предпочтительном воплощении данное изобретение охватывает способ лечения или профилактики заболевания, течение которого улучшается модулированием терминации преждевременной трансляции и/или уменьшения мРНК, обусловленного нонсенс-мутацией, или улучшения одного или более симптомов, связанных с данным заболеванием, включающий контактирование клетки с эффективным количеством соединения формулы I или II. Клетки, охватываемые настоящими способами, включают животные клетки, клетки млекопитающих, бактериальные клетки, растительные клетки и клетки, инфицированные вирусом. В одном воплощении нонсенс-кодон присутствовал в прогениторной ДНК. В другом воплощении нонсенс-кодон получался в результате мутагенеза. В конкретных воплощениях соединение формулы I или II или их фармацевтически приемлемую соль вводят пациенту, предпочтительно млекопитающему, более предпочтительно человеку в качестве превентивной меры против заболевания, связанного с преждевременной трансляцией и/или уменьшением мРНК, обусловленным нонсенс-мутацией. В предпочтительном воплощении сначала определяют, страдает ли пациент от заболевания, связанного с преждевременной трансляцией и/или уменьшением мРНК, обусловленным нонсенс-мутацией. В другом воплощении пациент прошел процесс скрининга для определения наличия нонсенс-мутации, который включал стадии скрининга субъекта или клеток, полученных из него, с помощью приемлемого скрининг-анализа нонсенс-мутации. В предпочтительном воплощении ДНК пациента может быть секвенирована или подвергнута блоттингу по Саузерну, полимеразной цепной реакции (PCR), применению короткого тандемного повтора (STR) или полиморфному анализу длины рестрикционных фрагментов(RFLP) для определения присутствия в ДНК пациента нонсенс-мутации. Альтернативно можно определить, экспрессируются ли у пациента измененные уровни белка с нонсенс-мутацией с помощью Вестернблоттинга или других иммуноанализов. В другом воплощении пациентом является нерожденный ребенок, который прошел скрининг in utero на присутствие нонсенс-мутации. Введение соединения формулыI или II можно осуществить или до либо после рождения. В связанном с этим воплощении терапия является персонализированной, так что пациент подвергается скринингу с помощью скринингового анализа нонсенс-мутации и его лечат введением одного или более соединений данного изобретения; особенно пациента можно лечить соединением особенно подходящим для конкретных мутаций; например, в зависимости от типа заболевания, типа клетки и конкретного гена. Такие способы хорошо известны специалисту в данной области. В другом воплощении клетки (например, животные клетки, клетки млекопитающих, бактериальные клетки, растительные клетки и клетки, инфицированные вирусом) подвергаются скринингу на предмет терминации преждевременной трансляции и/или уменьшения мРНК, обусловленного нонсенс-мутацией способом, который описан выше (то есть ДНК клетки может быть секвенирована или подвергнута блоттингу по Саузерну, полимеразной цепной реакции (PCR), применению короткого тандемного повтора(STR) или полиморфному анализу длины рестрикционных фрагментов (RFLP) для определения, присутствует ли нонсенс-мутация в ДНК клетки). Определенные способы данного изобретения дополнительно включают введение дополнительного терапевтического агента (то есть терапевтического агента, отличного от соединения данного изобретения). В конкретных воплощениях настоящего изобретения соединения данного изобретения могут быть применены в комбинации по крайней мере с одним отличным терапевтичным агентом. Терапевтические агенты включают, но не ограничиваются неопиодиными анальгетиками; нестероидными противовоспалительными средствами; противорвотными средствами; -адреноблокаторами; противосудорожными средствами; антидепрессантами; Са 2+-блокаторами; противораковым агентом и их смесями. В конкретных воплощениях соединения формулы I или II могут быть введены или представлены в комбинации с противораковыми агентами. Подходящие противораковые агенты включают, но не ограничиваются алкилирующими агентами; азотистым ипритом; антагонистами фолата; антагонистами пурина; антагонистами пиримидина; ядами клеточного веретена; ингибиторами топоизомеразы; агентами,индуцирующими апоптоз; ингибиторами ангиогенеза; подофиллотоксинами; нитрозомочевинами; цисплатином; карбоплотином; интерфероном; аспарагиназой; тамоксифеном; лейпролидом; флутамидом; мегестролом; митомицином; блеомицином; доксорубицином; иринотеканом и таксолом. В конкретных воплощениях соединения формулы I или II могут быть введены или формованы в комбинации с антибиотиками. В конкретных воплощениях антибиотиком является макролид (например,тобрамицин (Tobi, цефалоспорин (например, цефалексин(Keflex, цефрадин (Velosef), цефуроксим(Floxin), ципрофлоксацин (Cipro) или норфлоксацин (Noroxin. В предпочтительном воплощении антибиотик активен против Pseudomonas aeruginosa. Соединения данного изобретения и другие терапевтические агенты могут действовать аддитивно или, более предпочтительно, синергично. В предпочтительном воплощении композицию, содержащую соединение данного изобретения, вводят одновременно с введением другого терапевтического агента,который может быть частью этой же композиции или композиции, отличной от той, что содержит соединения данного изобретения. В другом воплощении соединение данного изобретения вводят до или после введения другого терапевтического агента. Значение профилактической или терапевтической дозы конкретного активного ингредиента данного изобретения при остром или хроническом течении заболевания или состояния варьирует, однако, в зависимости от природы и выраженности заболевания или состояния и пути введения активного ингредиента. Доза и, возможно, частота введения также варьируют из-за возраста, массы тела и реакции индивидуального пациента. Подходящие режимы дозирования могут быть легко выбраны квалифицированным специалистом в этой области при рассмотрении таких факторов. В основном, рекомендуемая дневная доза для описанных здесь состояний варьирует и лежит в пределах от примерно 0,1 до примерно 2000 мг в день, даваемая раз в день, предпочтительно в виде разделенной дозы в течение дня. В одном воплощении дневную дозу вводят в единичной дозе или в виде раделенных доз. Конкретно, значение дневной дозы должно быть от примерно 5 до примерно 500 мг в день, более конкретно между примерно 10 и примерно 200 мг в день. При наблюдении пациента терапию следует начинать с низшей дозы, возможно, примерно от 1 до примерно 25 мг, и повышать, если необходимо, от примерно 200 до примерно 2000 мг в день в виде или единичной дозы, либо в виде разделенных доз, в зависимости от общей реакции пациента. В некоторых случаях может быть необходимо использовать дозировки активного ингредиента, находящиеся за пределами значений, описанных здесь, как это будет очевидным для обычного специалиста в данной области. Более того, следует заметить, что врач или лечащий врач знает, как и когда прервать,изменить или отменить терапию в связи с индивидуальной реакцией пациента."терапевтически или профилактически эффективное количество", используемые здесь, включают описанные выше количества и расписания частоты приема. Различные терапевтически эффективные количества могут быть применимы для различных заболеваний и состояний, как это обычно может быть известно специалистам в данной области. Аналогично, количества, достаточные для лечения или профилактики таких заболеваний, но недостаточные для индуцирования, или достаточные для снижения побочных эффектов, связанных с традиционной терапией, также включены в описанные выше количества и расписания частоты приема. Фармацевтические композиции Фармацевтические композиции и монолитные лекарственные формы, содержащие соединение данного изобретения, или фармацевтически приемлемый полиморф, пролекарство, соль, сольват, гидрат, или их клатрат также охватываются данным изобретением. Индивидуальные дозированные формы данного изобретения могут быть подходящими для перорального, мукозального (включая сублингвальное, буккальное, ректальное, интраназальное или вагинальное), парентерального (включая подкожное, внутримышечное, в виде болюса, внутриартериальное или внутривенное), трансдермального или местного введения. Фармацевтические композиции и дозированные формы данного изобретения содержат соединение данного изобретения или фармацевтически приемлемое пролекарство, полиморф, соль, сольват или их клатрат. Фармацевтические композиции и дозированные формы данного изобретения обычно также содержат один или более фармацевтически приемлемых эксципиентов. Конкретная фармацевтическая композиция, охватываемая этим воплощением, содержит соединение данного изобретения или фармацевтически приемлемый полиморф, пролекарство, соль, сольват, гидрат или их клатрат и по крайней мере один дополнительный терапевтический агент. Примеры дополнительных терапевтических агентов включают, но не ограничиваются противораковыми препаратами и противовоспалительной терапией, включающей, но не ограничивающейся теми, что приведены выше в разделе"Синтез и получение". Монолитные лекарственные формы данного изобретения подходят для перорального, мукозального(например, подкожное, внутривенное, болюсное, внутримышечное или внутриартериальное), трансдермального введения пациенту. Примеры дозированных форм включают, но не ограничиваются таблетками, каплетами (таблетками в форме капсул); капсулами, такими как эластичные желатиновые капсулы,крахмальными облатками; пастилками; ромбовидными пастилками; дисперсиями; суппозиториями; мазями; припарками (примочками); пастами; порошками; повязками; кремами; пластырями; растворами; аппликациями; аэрозолями (например, назальными спреями или ингаляторами); гелями; жидкими дозированными формами, подходящими для перорального или мукозального введения пациенту, включающими суспензии (например, водные или неводные жидкие суспензии, эмульсии масло-в-воде или жидкие эмульсии вода-в-масле), растворы и эликсиры; жидкими дозированными формами, подходящими для парентерального введения пациенту; или стерильными порошками (например, кристаллическими или аморфными порошками), которые могут быть восстановлены с обеспечением жидких дозированных форм для парентерального введения пациенту. Состав, форма и тип дозированных форм данного изобретения обычно варьируют в зависимости от применения. Например, дозированная форма, используемая для срочного лечения воспаления или связанного с ним заболевания, может содержать большие количества одного или более активных ингредиентов, чем дозированная форма, используемая для лечения хронической формы этого же заболевания. Аналогично, парентеральная дозированная форма может содержать меньшие количества одного или более активных ингредиентов, чем дозированная форма для перорального применения для лечения этого же заболевания. Эти и другие пути, в которых конкретные дозированные формы включены в данное изобретение, отличающиеся друг от друга, очевидны для специалиста в данной области. См., например,Remington's Pharmaceutical Sciences, 18th ed., Mack Publishing, Easton PA (1990). Типичные фармацевтические композиции и дозированные формы включают один или более носителей, эксципиентов или разбавителей. Подходящие эксципиенты хорошо известны специалистам в данной области фармации, и в данном документе приведены неограниченные примеры подходящих эксципиентов. Является ли конкретный эксципиент подходящим для включения в состав фармацевтической композиции или дозированной формы, зависит от ряда факторов, хорошо известных в данной области,включая, но не ограничиваясь путем, которым дозированная форма будет введена пациенту. Например,пероральные дозированные формы, такие как таблетки, могут содержать эксципиенты, не подходящие для применения в парентеральных дозированных формах. Стабильность конкретного эксципиента может также зависеть от конкретных активных ингредиентов в дозированной форме. Данное изобретение дополнительно охватывает безводные фармацевтические композиции и дозированные формы, содержащие активные ингредиенты, так как вода может способствовать распаду некоторых соединений. Например, добавление воды (например, 5%) широко используется в области фармации в качестве средства моделирования длительного хранения для определения характеристик, таких как срок годности или стабильность препаратов во времени. См., например, Jens Т. Carstensen, Drug Stabiliy:PrinciplesPractice, 2d. Ed., Marcel Dekker, NY, NY, 1995, pp. 379-80. В сущности, вода и тепло ускоряют разложение некоторых соединений. Таким образом, влияние воды на препарат может иметь огромное значение, так как влага и/или влажность обычно имеет место при производстве, транспортировке, упаковке, хранении, поставке и применении препаратов. Безводные фармацевтические композиции и дозированные формы данного изобретения могут быть получены с использованием безводных ингредиентов или ингредиентов с низким содержанием влаги и условий с низким содержанием влаги или пониженной влажностью. Фармацевтические композиции и дозированные формы, которые содержат лактозу и по крайней мере один активный ингредиент, который содержит первичный или вторичный амин, являются предпочтительно безводными, если предполагается значимый контакт с влагой и/или влажностью при производстве, упаковке и/или хранении. Безводная фармацевтическая композиция должна быть приготовлена и храниться таким образом,чтобы ее безводное состояние сохранялось. Соответственно, безводную композицию предпочтительно упаковывать, используя материалы, которые, как известно, предотвращают воздействие воды, и так, чтобы они могли быть включены в подходящие наборы для композиций. Примеры подходящей упаковки включают, но не ограничиваются герметично запечатанной фольгой, пластиком, контейнерами для дозированных единиц (например, флаконами), блистерными упаковками и упаковками в виде полосок. Данное изобретение, кроме того, охватывает фармацевтические композиции и дозированные формы,которые содержат одно или более соединений, снижающих скорость разрушения активного ингредиента. Такие соединения, которые называются в данном документе как "стабилизаторы", включают, но не ограничиваются антиоксидантами, такими как аскорбиновая кислота, буферами рН или солевыми буферами. Подобно количествам и типам эксципиентов количества и конкретные типы активных ингредиентов в дозированной форме могут варьироваться в зависимости от факторов таких, как, но не ограничиваясь, путь введения ее пациентам. Однако типичные дозированные формы данного изобретения содержат соединение данного изобретения или фармацевтически приемлемую соль, сольват, клатрат, гидрат, полиморф или их пролекарство, лежащее в пределах от примерно 0,1 до примерно 2000 мг в день, даваемое в качестве единой дозы одноразово утром, но предпочтительно в виде разделенных доз в течение дня с пищей. Более конкретно дневная доза вводится дважды в день в равных разделенных дозах. Конкретно значение дневной дозы должно находиться от примерно 5 до примерно 500 мг в день, более конкретно между примерно 10 и примерно 200 мг в день. При наблюдении пациента терапию следует начинать с низкой дозы, вероятно, примерно от 1 до примерно 25 мг, и повышать, если необходимо, от примерно 200 до примерно 2000 мг в день или в виде единичной дозы, либо в виде разделенных доз, в зависимости от общей реакции пациента. Пероральные дозированные формы Фармацевтические композиции данного изобретения, которые подходят для перорального введения, могут быть представлены в виде отдельных дозированных форм, таких как, но не ограничиваясь,таблетки (например, жевательные таблетки), каплеты (таблетки в форме капсул), капсулы и жидкости(например, ароматизированные сиропы). Такие дозированные формы содержат заранее определенные количества активных ингредиентов и могут быть приготовлены способами фармации, хорошо известными специалистам в данной области. См., в основном, Remington's Pharmaceutical Sciences, 18th ed., MackPublishing, Easton PA (1990). Обычные пероральные дозированные формы готовят объединением активного ингредиента(ов) при тщательном смешивании по крайней мере с одним эксципиентом в соответствии с традиционными методиками фармацевтического производства. Эксципиенты могут принимать множество форм, в зависимости от формы препарата, который требуется ввести. Например, эксципиенты, подходящие для применения в пероральной жидкой или аэрозольной дозированной форме, включают, но не ограничиваются водой, гликолями, маслами, спиртами, ароматизирующими агентами, консервантами и красителями. Примеры эксципиентов, подходящих для применения в твердых дозированных формах (например, порошках,таблетках, капсулах и таблетках в форме капсул), включают, но не ограничиваются крахмалами, сахарами, микрокристаллической целлюлозой, разбавителями, агентами для грануляции, лубрикантами, связующими и дезинтегрантами. Жидкие препараты для перорального применения могут быть в форме, например, растворов, сиропов или суспензий, или они могут быть представлены в виде сухого продукта для разведения в воде или другом подходящем носителе до применения. Такие жидкие препараты могут быть приготовлены с помощью обычных средств с фармацевтически приемлемыми добавками, такими как суспендирующие агенты (например, сироп сорбитола, производные целлюлозы и гидрогенизированные пищевые жиры); эмульгирующие агенты (например, лецитин или акация); неводные носители (например, миндальное масло, жирные эфиры, этиловый спирт или фракционированные растительные масла); и консерванты(например, метил или пропил-п-гидроксибензоаты или сорбиновая кислота). Препараты могут, соответственно, также содержать буферные соли, ароматизирующие, окрашивающие агенты и подсластители. Ввиду их простого введения, таблетки и капсулы представляют собой предпочтительную единичную пероральную дозированную форму, в случае которой применяются твердые эксципиенты. Если требуется, таблетки могут быть покрыты с помощью стандартных водных и безводных методик. Такие до- 28009120 зированные формы могут быть приготовлены с помощью любого из способов фармации. В основном,фармацевтические композиции и дозированные формы готовят тщательным смешиванием до однородности активных ингредиентов с жидкими носителями, тонкоизмельченными твердыми носителями или обоими и затем формованием продукта до получения желаемого вида, если необходимо. Например, таблетка может быть приготовлена методом прессования или плавления. Прессованные таблетки могут быть получены прессованием в подходящем аппарате из активных ингредиентов в свободно текучем состоянии, таком как порошок или гранулы, необязательно смешанные с эксципиентом. Выплавленные таблетки могут быть приготовлены с помощью плавления смеси порошкового соединения в подходящем аппарате, увлажненного инертным жидким разбавителем. Примеры эксципиентов, которые могут быть использованы в пероральных дозированных формах данного изобретения, включают, но не ограничиваются связующими, наполнителями, разрыхлителями и лубрикантами. Связующие, подходящие для применения в фармацевтических композициях и дозированных формах, включают, но не ограничиваются кукурузным крахмалом, картофельным крахмалом или другими крахмалами, желатином, натуральными и синтетическими камедями, такими как акация, альгинат натрия, альгиновая кислота, другие альгинаты, порошковый трагакант, гуаровая камедь, целлюлозой и ее производными(например, этилцеллюлозой, ацетатом целлюлозы, кальцийкарбоксиметилцеллюлозой, натрийкарбоксиметилцеллюлозой) поливинилпирролидоном, метилцеллюлозой, прежелатинизированным крахмалом, гидроксипропилметилцеллюлозой (например, 2208, 2906, 2910), микрокристаллической целлюлозой и их смесями. Примеры наполнителей, подходящих для применения в фармацевтических композициях и дозированных формах, описанных в данном документе, включают, но не ограничиваются тальком, карбонатом кальция (например, гранулы или порошок), микрокристаллической целлюлозой, порошковой целлюлозой, декстратами, каолином, манитом, кремниевой кислотой, сорбитом, крахмалом, прежелатинизированным крахмалом и их смесями. Связующее или наполнитель в фармацевтических композициях данного изобретения обычно присутствует в количестве от примерно 50 до примерно 99 мас.% фармацевтической композиции или дозированной формы. Подходящие формы микрокристаллической целлюлозы включают, но не ограничиваются материалами, продаваемыми в виде AVICEL-РН-101, AVICEL-PH-103, AVICEL RC-581, AVICEL-PH-105 (получаемые от FMC Corporation, American Viscose Division, Avicel Sales, Marcus Hook, PA), и их смесями. Конкретным наполнителем является смесь микрокристаллической целлюлозы и натрийкарбоксиметилцеллюлозы, продаваемая в виде AVICEL RC-581. Подходящие безводные эксципиенты и эксципиенты с низким содержанием влаги или добавки включают AVICEL-PH-103 и Крахмал 1500 LM. Разрыхлители применяются в композициях данного изобретения для создания таблеток, которые разрушаются при попадании в водную среду. Таблетки, которые содержат слишком много разрыхлителя,могут разрушаться при хранении, при этом те, что содержат слишком мало разрыхлителя, могут не распадаться с необходимой скоростью или в требуемых условиях. Таким образом, следует использовать для создания твердых пероральных дозированных форм данного изобретения достаточное количество разрыхлителя, которое является ни большим, ни маленьким для ущербного изменения высвобождения активных ингредиентов. Количество используемого разрыхлителя варьирует в зависимости от типа препарата, и обычно оно очевидно для обычных специалистов в данной области. Обычные фармацевтические композиции содержат от примерно 0,5 до примерно 15 мас.% от массы разрыхлителя, конкретно от примерно 1 до примерно 5 мас.% массы разрыхлителя. Разрыхлители, которые могут быть использованы в фармацевтических композициях и дозированных формах данного изобретения, включают, но не ограничиваются агар-агаром, альгиновой кислотой,карбонатом кальция, микрокристаллической целлюлозой, натрийкроскармелозой, кросповидоном, полакрилином калия, натрийкрахмалгликолятом, картофельным или маниоковым крахмалом, прежелатинизированным крахмалом, другими крахмалами, глинами, другими альгинами, другими целлюлозами,камедями и их смесями. Лубриканты, которые могут быть использованы в фармацевтических композициях и дозированных формах данного изобретения, включают, но не ограничиваются стеаратом кальция, стеаратом магния,минеральным маслом, светлым минеральным маслом, глицерином, сорбитом, маннитом, полиэтиленгликолем, другими гликолями, стеариновой кислотой, натрийлаурилсульфатом, тальком, гидрогенизированным растительным маслом (например, арахисовым маслом, маслом семян хлопка, подсолнечным маслом, кунжутным маслом, оливковым маслом, кукурузным маслом и маслом соевых бобов), стеаратом цинка, этилолеатом, этиллауреатом, агаром и их смесями. Дополнительные смазывающие агенты включают, например, силоидный силикагель (AEROSIL 200, произведенный W.R. Grace Co. of Baltimore,MD), коагулированный аэрозоль синтетического кремния (продаваемый Degussa Co. of Plano, TX), CABO-SIL (продукт пирогенного диоксида кремния, продаваемого Cabot Co. of Boston, MA) и их смеси. При использовании во всех случаях лубриканты обычно используют в количестве меньшем, чем примерно 1 мас.% от массы фармацевтических композиций или дозированных форм, в которые они включены. Дозированные формы с отсроченным высвобождением Активные ингредиенты данного изобретения могут быть введены с помощью средств, контролирующих высвобождение, или с помощью средств доставки, которые хорошо известны обычным специа- 29009120 листам в данной области. Примеры включают, но не ограничиваются теми, что описаны в патентах США 3,845,770; 3,916,899; 3,536,809; 3,598,123; 4,008,719; 5,674,533; 5,059,595; 5,591,767; 5,120,548; 5,073,543; 5,639,476; 5,354,556 и 5,733,566, каждый из которых включен в данный документ в виде ссылки. Такие дозированные формы могут быть использованы для обеспечения медленного или контролируемого высвобождения одного или более активных ингредиентов с использованием, например, гидропропилметилцеллюлозы, других полимерных матриц, гелей, проницаемых мембран, систем осмоса, многослойных покрытий, микрочастиц, липосом, микросфер или их комбинации для обеспечения желаемого профиля высвобождения в различных пропорциях. Подходящие препараты с контролируемым высвобождением, известные обычным специалистам в данной области, включая те, что описаны в данном документе, могут быть легко выбраны для использования с активными ингредиентами данного изобретения. Данное изобретение охватывает, таким образом, монолитные лекарственные формы, подходящие для перорального введения, такие как, но не ограничиваясь, таблетки, капсулы, желатиновые капсулы и каплеты, адаптированные для контролируемого высвобождения. Все фармацевтические продукты с контролируемым высвобождением имеют общую цель, заключающуюся в улучшении лекарственной терапии сверх той, что достигается в случае средств с неконтролируемым высвобождением. Идеально, если применение оптимально разработанного препарата с контролируемым высвобождением в лечении характеризуется минимумом лекарственной субстанции, применяемой для лечения или контролирования состояния в минимальный период времени. Преимущества препаратов с контролируемым высвобождением включают продленную активность лекарства, сниженную частоту приема и повышенную восприимчивость пациента. Кроме того, препараты с контролируемым высвобождением могут быть использованы для воздействия на время начала действия или другие характеристики, такие как уровень лекарства в крови, и могут, таким образом, влиять на возникновение побочных (например, отрицательных) эффектов. Большинство препаратов с контролируемым высвобождением разработано таким образом, чтобы первоначально высвобождать количество лекарства (активного ингредиента), которое быстро создает желаемый терапевтический эффект, и постепенно и продолжительно высвобождать другие количества лекарства для сохранения этого уровня терапевтического или профилактического эффекта в течение продолжительного периода времени. Для того, чтобы сохранить этот постоянный уровень лекарства в организме, лекарство должно высвобождаться из дозированной формы со скоростью, которая восполняет количество лекарства, метаболизируемого и выделяемого организмом. Контролируемое высвобождение активного ингредиента может быть усилено различными условиями, включающими, но не ограничивающимися рН, температурой, ферментами, водой или другими физиологическими условиями или соединениями. Парентеральные дозированные формы Парентеральные дозированные формы могут быть введены пациентам различными путями, включая, но не ограничиваясь подкожным, внутривенным (включая болюсную инъекцию), внутримышечным и внутриартериальным. Ввиду того, что введение их обычно проходит через естественную защиту пациента от возбудителей, предпочтительны стерильные парентеральные дозированные формы или формы с возможностью стерилизации до введения пациенту. Примеры парентеральных дозированных форм включают, но не ограничиваясь, растворы, готовые для введения, сухие продукты, готовые к растворению или суспендированию в фармацевтически приемлемом носителе для инъекции, суспензии, готовые к введению, и эмульсии. Подходящие носители, которые могут быть использованы для получения парентеральных дозированных форм данного изобретения, хорошо известны специалистам в данной области. Примеры включают, но не ограничиваются водой для инъекций USP; водными носителями, такими как, но не ограничиваясь, натрия хлорид для инъекций, раствор Рингера для инъекций, раствор декстрозы для инъекций,раствор декстрозы и натрия хлорида для инъекций и лактат Рингера для инъекций; водорастворимыми носителями, такие как, но не ограничиваясь, этиловый спирт, полиэтиленгликоль и пропиленгликоль; и неводными носителями, такими как, но не ограничиваясь, кукурузное масло, масло семян хлопка, арахисовое масло, кунжутное масло, этилолеат, изопропилмиристат и бензилбензоат. Соединения, которые повышают растворимость одного или более активных ингредиентов, описанные в данном документе, могут также быть включены в состав парентеральных дозированных форм данного изобретения. Трансдермальные и поверхностные дозированные формы Трансдермальные и поверхностные формы данного изобретения включают, но не ограничиваясь,кремы, лосьоны, мази, гели, растворы, эмульсии, суспензии или другие формы, известные специалисту в данной области. См., например , Remington's Pharmaceutical Sciences, 18th eds., Mack Publishing, Easton PA(1990); и Introduction to Pharmaceutical Dosage Forms, 4th ed., LeaFebiger, Philadelphia (1985). Трансдермальные дозированные формы включают аппликации "резервуарного типа" или "матриксного типа", которые могут быть наложены на кожу и "надеты" в течение определенного периода времени для того,чтобы обеспечить проникновение желаемого количества активных ингредиентов. Подходящие эксципиенты (например, носители и разбавители) и другие материалы, которые могут быть использованы для создания трансдермальных и поверхностных дозированных форм, охваченные
МПК / Метки
МПК: C07D 271/06
Метки: применение, соединения, 1,2,4-оксадиазол-бензойной, кислоты
Код ссылки
<a href="https://eas.patents.su/30-9120-soedineniya-124-oksadiazol-benzojjnojj-kisloty-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения 1,2,4-оксадиазол-бензойной кислоты и их применение</a>
Предыдущий патент: 4- ((феноксиалкил)тио) феноксиуксусные кислоты и аналоги
Следующий патент: Бета – карболины, применяемые для лечения воспалительных заболеваний
Случайный патент: Способ подготовки семенного ложа












