Применение модулятора рецепторов глюкокортикоидов и агониста рецепторов глюкокортикоидов при получении лекарственного средства
Номер патента: 7483
Опубликовано: 27.10.2006
Авторы: Морган Брэдли Пол, Дау Роберт Ли, Свик Эндрю Гордон, Лиу Кевин Кун-Чин
Формула / Реферат
1. Применение соединения формулы II
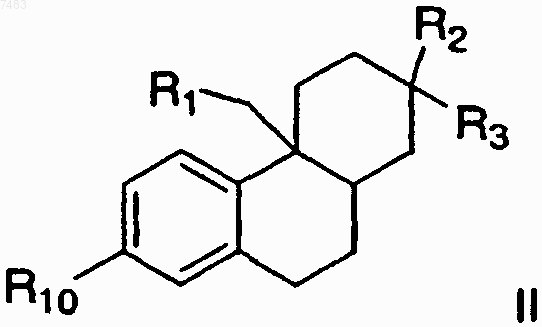
его изомера, пролекарства указанного соединения или изомера, или фармацевтически приемлемой соли указанного соединения, изомера или пролекарства;
где R1 представляет собой (C1-С6)алкил, (С2-С6)алкенил, (С2-С6)алкинил или фенил, незамещенный или замещенный одним из следующих заместителей: -ОН, -NR12R13, -NR12C(О)-(С1-С4)алкил, -CN, -(С0-С2)алкил-hеt, -О-(C1-C3)алкил-С(О)-NR12R13, -NR12-(C0-С2)алкил-С(О)-NR12R13, -(С0-С2)алкил-NR12-SO2-R13, -NR12-SO2-het, -O-С(О)-(С1-С4)алкил или -O-SO2-(C1-C4)алкил;
R2 представляет собой -ОН;
R3 представляет собой а) -(С1-С4)алкил, незамещенный или замещенный одним из следующих заместителей: -CF3, -CN, -(С3-С6)циклоалкил, фенил или -N3, b) -Су С-, замещенный одним из следующих заместителей: -(С1-С5)алкил, -Сl, -CF3, -(С3-С6)циклоалкил, фенил или бензил; с) -СН2ОН, d) -CH2O(C1-C5)алкил, где 1 атом углерода иной, чем связанный атом углерода, может необязательно быть заменен на 1 атом кислорода, е) -СН2O(С2-С5)алкенил, f) -CH2O(C2-C5)алкинил, где 1 атом углерода иной, чем связанный атом углерода, может необязательно быть заменен на 1 атом кислорода, g) -CH2ORy, h) -CN или i) -CF3;
где Ry представляет собой а) -(C1-С3)алкил-СF3, b) -(С3-С6)циклоалкил, с) фенил или d) бензил;
R10 представляет собой -С(О)-NH-Z-het;
het представляет собой 5-, 6- или 7-членное насыщенное, частично насыщенное или ненасыщенное кольцо, содержащее от одного (1) до трех (3) гетероатомов, независимо выбранных из группы, состоящей из азота, кислорода и серы, и замещенное 0-3 Rx;
Rx для каждого случая представляет собой независимо а) галоген, b) -ОН, с) -(C1-C8)алкил, d) -(С2-С6)алкенил, е) -(С2-С6)алкинил, f) -О(C1-C6)алкил, g) -О(С2-С6) алкенил, h) -O(С2-С6)алкинил, i) -(С0-С6)алкил-NR12R13, j) -С(О)-NR12R13, k) -Z-SO2R12, l) -(C0-C2)aлкил-SOR12, m) -(С0-С2)aлкил-SR12, n) -NR12-SO2R13, о) -NR12-C(O)-R13, p) -NR12-OR13, q) -SO2-NR12R13, r) -CN, s) -CF3, t) -С(O)(C1-C6)алкил, u) =O или v) -(С0-С2)алкил-SO2-фенил;
Z представляет -(С0-C6)алкил;
R12 и R13 независимо представляют собой а) -Н или b) -(C1-С6)алкил,
для получения лекарственного средства, предназначенного для лечения воспалительного заболевания у млекопитающего и для уменьшения нежелательных побочных эффектов при указанном лечении.
2. Применение по п.1, где воспалительное заболевание выбрано из группы, включающей артрит, астму, ринит и иммуномодуляцию.
3. Применение по п.1, дополнительно включающее агонист рецепторов глюкокортикоидов.
4. Применение по п.3, где агонист рецепторов глюкокортикоидов представляет собой соединение, выбранное из группы, состоящей из преднизона, преднилидена, преднизолона, кортизона, дексаметазона и гидрокортизона.
5. Применение по п.4, где соединение формулы II представляет собой соединение, выбранное из группы, включающей
2-фенантренкарбоксамид, 4b,5,6,7,8,8а,9,10-октагидро-7-гидрокси-4b-(фенилметил)-7-(1-пропинил)-N-(4-пиридинилметил)-, [4bS-(4ba ,7a ,8ab )]-;
2-фенантренкарбоксамид, 4b,5,6,7,8,8а,9,10-октагидро-7-гидрокси-4b-(фенилметил)-7-(1-пропинил)-N-(2-пиридинилметил)-, [4bS-(4ba ,7a ,8ab )]-;
2-фенантренкарбоксамид, 4b,5,6,7,8,8а,9,10-октагидро-7-гидрокси-4b-(фенилметил)-7-(1-пропинил)-N-(3-пиридинилметил)-, (4bS-(4ba ,7a ,8ab )]-;
2-фенантренкарбоксамид, 4b,5,6,7,8,8а,9,10-октагидро-7-гидрокси-4b-(фенилметил)-7-(1-пропинил)-N-пиразинил-, [4bS-(4ba ,7a ,8ab )]-;
2-фенантренкарбоксамид, 4b,5,6,7,8,8а,9,10-октагидро-7-гидрокси-N-[(2-метил-3-пиридинил)метил]-4b-(фенилметил)-7-(1-пропинил)-, [4bS-(4ba ,7a ,8аb )]-;
2-фенантренкарбоксамид, 4b,5,6,7,8,8а,9,10-октагидро-7-гидрокси-N-[(2-метил-3-пиридинил)метил]-4b-(фенилметил)-7-пропил-, [4bS-(4ba ,7a ,8аb )]-;
2-фенантренкарбоксамид, 4b,5,6,7,8,8а,9,10-октагидро-7-гидрокси-4Ь-(фенилметил)-7-пропил-N-(2-пиридинилметил)-, [4bS-(4ba ,7a ,8ab )]-;
2-фенантренкарбоксамид, 4b,5,6,7,8,8а,9,10-октагидро-7-гидрокси-N-[(2-метил-3-пиридинил)метил]-4b-(фенилметил)-7-(3,3,3-трифторпропил)-, (4bS,7S,8aR);
2-фенантренкарбоксамид, 4b,5,6,7,8,8а,9,10-октагидро-7-гидрокси-7-метил-N-[(2-метил-3-пиридинил)метил]-4b-(фенилметил)-, (4bS,7R,8aR)-;
2-фенантренкарбоксамид, 4b,5,6,7,8,8а,9,10-октагидро-7-гидрокси-7-метил-4b-(фенилметил)-N-3-пиридинил-, (4bS,7R,8aR)-; и
2-фенантренкарбоксамид, 4b,5,6,7,8,8а,9,10-октагидро-7-гидрокси-N-[(2-метил-3-пиридинил)метил]-4b-(фенилметил)-7-(трифторметил)-, (4bS,7R,8aR)-;
или его изомер, пролекарство указанного соединения или изомера, или фармацевтически приемлемую соль указанного соединения, изомера или пролекарства.
Текст
007483 Область изобретения Настоящее изобретение относится к применению нестероидных соединений, которые представляют собой селективные модуляторы (то есть, агонисты и антагонисты) стероидных рецепторов, в частности глюкокортикоидных рецепторов при получении лекарственного средства для лечения животных, нуждающихся в терапевтическом лечении с помощью агонистов и/или антагонистов глюкокортикоидных рецепторов, а также для уменьшения нежелательных побочных эффектов при указанном лечении. Модуляторы глюкокортикоидных рецепторов могут использоваться для лечения таких заболеваний, как ожирение, сахарный диабет, воспаление и другие, как описано ниже. Предпосылки изобретения Ядерные рецепторы классически определяются как семейство лигандзависимых факторов транскрипции, которые активируются в ответ на связывание лиганда (R.M. Evans, 240 Science, 889 (1988. Члены этого семейства включают следующие рецепторы: глюкокортикоидные, минералокортикоидные,андрогенные, прогестеронные и эстрогенные. Встречающиеся в природе лиганды для этих рецепторов представляют собой молекулы с низкой молекулярной массой, которые играют важную роль в функционировании здорового организма и при многих заболеваниях. Избытки или недостатки этих лигандов могут иметь выраженные физиологические последствия. В качестве примера, избыток глюкокортикоидов приводит к синдрому Кушинга, в то время как недостаток глюкокортикоидов приводит к болезни Аддисона. Глюкокортикоидные рецепторы (GR) присутствуют в чувствительных к глюкокортикоидам клетках, где они присутствуют в цитозоле в неактивном состоянии до тех пор, пока они не стимулируются агонистом. При стимуляции рецепторы глюкокортикоидов перемещаются в ядро клетки, где они специфически взаимодействуют с ДНК и/или белком (белками) и регулируют транскрипцию чувствительным к глюкокортикоидам способом. Два примера белков, которые взаимодействуют с глюкокортикоидными рецепторами, представляют собой факторы транскрипции, API и NF-B. Такие взаимодействия приводят к ингибированию транскрипции, опосредуемой API- и NF-B, и, как предполагается, являются ответственными за некоторую часть противовоспалительной активности вводимых эндогенно глюкокортикоидов. Кроме того, глюкокортикоиды могут также оказывать физиологические воздействия, независимые от ядерной транскрипции. Биологически значимые агонисты рецепторов глюкокортикоидов включают кортизол и кортикостерон. Существует множество синтетических агонистов рецепторов глюкокортикоидов, включая дексаметазон, преднизон и преднизилон. По определению, антагонисты рецепторов глюкокортикоидов связываются с рецепторами и предотвращают связывание агонистов рецепторов глюкокортикоидов и возникновение явлений, опосредуемых GR, включая транскрипцию. RU486 представляет собой пример неселективного антагониста рецепторов глюкокортикоидов. В патенте США 3683091 описаны соединения фенантрена, в частности некоторые производные ди-7-гидрокси или метил-2,3,4,4 а,9,10-гексагидрофенантрен-2-она и 4 а-алкила, гидрированные соединения, функциональные производные и их оптически активные изомеры, пригодные для использования в качестве специфических агентов против воспаления сальных желез. В японской патентной заявке, публикация 45014056, опубликованной 20 мая 1970 г., описано получение 1,2,3,4,9,10,11,12-октагидро-7-метокси-12-бутилфенантрен-2-ола и некоторых его производных, пригодных для использования в качестве противоандрогенных и противоанаболических лекарственных средств. В японской патентной заявке, публикация 6-263688, опубликованной 20 сентября 1994 г., описаны некоторые производные фенантрена, которые являются ингибиторами интерлейкина-1 (ИЛ-1). Описано также получение и некоторых промежуточных соединений. В публикации международной патентной заявкиWO 95/10266, опубликованной 20 апреля 1995 г., описано получение и препарат некоторых соединений фенантрена в качестве ингибиторов синтеза оксида азота (II). В японской патентной заявке, публикация 45-36500, опубликованной 20 ноября 1970 г., описан способ получения некоторых оптически активных производных фенантрена, которые могут использоваться в качестве противоандрогенных агентов. В европейской патентной заявке, публикация 0 188 396, опубликованной 23 июля 1986 г., описаны некоторые замещенные стероидные соединения, некоторые способы и промежуточные соединения для их получения, их применения и содержащие их фармацевтические композиции. Эти соединения, как описано, обладают противоглюкокортикоидной активностью, и некоторые из них имеют глюкокортикоидную активность.C.F. Bigge et al., J. Med. Chem. 1993, 36, 1977-1995, описывают синтез и фармакологическое исследование ряда октагидрофенантренаминов и некоторых их гетероциклических аналогов в качестве сильных неконкурентных антагонистов комплекса N-метил-D-аспартатного рецептора.P.R. Kanjilal et al., J. Org. Chem. 1985, 50, 857-863, описывают синтетические исследования, направленные на получение определенных сложных дитерпеноидов.G. Sinha et al., J. Chem. Soc., Perkin Trans. I (1983), (10), 2519-2528, описывают синтез изомерных мостиковых дикетонов, цис-3,4,4 а,9,10,10 а-гексагидро-1,4 а-этанофенантрен-2(1 Н),12-диона и транс 3,4,4 а,9,10,10 а-гексагидро-3,4 а-этанофенантрен-2(1 Н),12-диона, путем высокорегиоселективных внутри-1 007483 молекулярных альдольных конденсаций с помощью стереохимически определенных цис- и транс-2,2 этилендиокси-1,2,3,4,4 а,9,10,10 а-октагидрофенантрен-4 а-илацетальдегидов.U.R. Ghatak, M. Sarkar и S.K. Patra, Tetrahedron Letters No. 32, pp. 2929-2931, 1978, описывают простой стереоспецифический путь синтеза некоторых полициклических промежуточных соединений с мостиковыми кольцами, которые могут использоваться при получении некоторых сложных дитерпеноидов.P.N. Chakrabortty et al., Indian J. Chem. (1974), 12(9), 948-55, описывают синтез 1-метил-1,4 адикарбокси-1,2,3,4,4 а,9,10,10 а-октагидрофенантрена, промежуточного соединения в синтезе некоторых дитерпеноидов и дитерпеналкалоидов, и 1,4 а-дикарбокси-1,2,3, 4 , 4 а,9,10,10 а-октагидрофенантрена. Е. Fujita et al., J. Chem. Soc., Perkin Trans. I (1974), (1), 165-77, описывают получение энмеина из 5 метокси-2-тетралона с помощью энт-3-,2-эпокси-3-метокси-17-норкауран-6, 16-диола. Н. Sdassi et al., Synthetic Communications, 25(17), 2569-2573 (1995), описывают энантиоселективный синтез (R)-(+)-4a-цианометил-6-метокси-3,4,9,10-тетрагидрофенантрен-2-она, который является ключевым промежуточным соединением в синтезе морфинана. Т. Ibuka et al., Yakugaku Zasshi (1967), 87(8), 1014-17, описывают некоторые алкалоиды растенийmenispermaceous. В патенте Японии 09052899, поданном 25 февраля 1997 г., описаны некоторые производные дитерпенов или тритерпенов, которые представляют собой антагонисты лейкотриенов, полученные путем экстракции из Tripterygium wilfordii для терапевтического использования. В патенте США 5696127 описаны некоторые нестероидные соединения, такие как 5 Нхромено[3,4-f]хинолины, которые являются селективными модуляторами стероидных рецепторов. В патенте США 5767113 описаны некоторые синтетические стероидные соединения, которые могут использоваться для одновременного активирования глюкокортикоид-индуцированного ответа и уменьшения устойчивости ко многим лекарственным средствам. В европейский патентной заявке, публикация 0683172, опубликованной 11 ноября 1995 г., описаны некоторые производные 11,21-бисфенил-19-норпрегнана, обладающие противоглюкокортикоидной активностью, и которые могут быть использованы для лечения или предотвращения глюкокортикоидзависимых заболеваний.D. Bonnet-Delpon et al., Tetrahedron (1996), 52(1), 59-70, описывают некоторые СF3-замещенные алкены в качестве хороших реагентов для реакций Дильса-Альдера с диеном Данишевского и при 1,3 диполярных циклодобавлениях с некоторыми нитронами и нестабилизированными азометинилидами. В публикации международной патентной заявкиWO 98/26783, опубликованной 25 июня 1998 г.,описано применение некоторых стероидных соединений с противоглюкокортикоидной активностью, за исключением мифепристона, для получения лекарственных средств, предназначенных для профилактики или лечения психозов или пристрастий. В публикации международной патентной заявкиWO 98/27986, опубликованной 2 июля 1998 г.,описаны способы лечения инсулиннезависимого диабета (NIDDM), или диабета II типа, путем введения сочетания лекарственных средств, обладающих активностью агониста глюкокортикоидных рецепторов типа I и активностью антагониста глюкокортикоидных рецепторов типа II. Также описаны такие лекарственные средства, как некоторые стероидные соединения, обладающие как активностью агониста глюкокортикоидных рецепторов типа I, так и активностью антагониста глюкокортикоидных рецепторов типа II. В публикации международной патентной заявкиWO 98/31702, опубликованной 23 июля 1998 г.,описаны некоторые производные 16-гидрокси-11-(замещенный фенил)-эстра-4,9-диена, которые могут использоваться при лечении или профилактике глюкокортикоидзависимых заболеваний или симптомов. В публикации европейской патентной заявки 0 903 146, опубликованной 24 марта 1999 г., описано,что стероид 21-гидрокси-6,19-оксидопрогестерон (21 ОН-60 Р), как обнаружено, является селективным антиглюкокортикоидом и используется при лечении заболеваний, связанных с избытком глюкокортикоидов в организме, таких как синдром Кушинга или депрессия. Все цитируемые выше патенты и описания заявок на патенты включены здесь в качестве ссылок во всей их полноте.J.A. Findlay et al., Tetrahedron Letters No. 19, pp. 869-872, 1962, описывают некоторые промежуточные соединения в синтезе дитерпеналкалоидов. Хотя способы лечения глюкокортикоидных рецепторов и известны в данной области, продолжает существовать потребность в селективном терапевтическом лечении с помощью глюкокортикоидных рецепторов, и продолжается его поиск. Таким образом, идентификация нестероидных соединений, которые обладают специфичностью к одному или нескольким стероидным рецепторам, но которые имеют пониженную реакционную способность, или вообще ее не имеют, к другому стероиду или к внутриклеточным рецепторам, является очень важной в данной области. Краткое описание изобретения Настоящее изобретение относится к применению модулятора рецепторов глюкокортикоидов и агониста рецепторов глюкокортикоидов для получения лекарственного средства, предназначенного для лечения воспалительного заболевания у млекопитающего и для уменьшения нежелательных побочных эф-2 007483 фектов при указанном лечении. Указанное воспалителььное заболевание может быть выбрано из группы, включающей артрит, астму, ринит и иммуномодуляцию. В частности, модулятор рецепторов глюкокортикоидов представляет собой соединение формулы I его изомеры, пролекарство указанного соединения и его изомеров, и фармацевтически приемлемые соли указанного соединения, изомеров и пролекарств; где m равно 1 или 2;G, Н и I вместе с 2 атомами углерода А-кольца или 2 атомами углерода В-кольца образуют 5 членное гетероциклическое кольцо, содержащее один или несколько атомов N, О или S; при условии, что существует не более одного О и S на кольцо;J, K, L и М вместе с 2 атомами углерода В-кольца образуют 6-членное гетероциклическое кольцо,содержащее один или несколько атомов N;Z для каждого случая представляет собой независимо а) (С 0-С 6)алкил, b) -(С 2-С 6)алкенил или с) -(С 2-С 6)алкинил;R3 представляет собой а) -Н, b) - (C1-С 10)алкил, где 1 или 2 атома углерода иные, чем соединяющий атом углерода, могут необязательно быть заменены 1 или 2 гетероатомами, независимо выбранными изS, О и N, и где каждый атом углерода является замещенным 0, 1 или 2 Ry, с) -(С 2-С 10)алкенил, замещенный 0, 1 или 2 Ry, d) -(С 2-С 10)алкинил, где 1 атом углерода иной, чем соединяющий атом углерода, может необязательно быть заменен 1 атомом кислорода, и где каждый атом углерода является замещенным 0, 1 или 2 Ry, е) -СН=С=СН 2, f) -CN, g) -(С 3-С 6)циклоалкил, h) -Z-арил, i) -Z-het, j) -С(O)O(C1-C6)алкил, k) -O(С 1-С 6) алкил, 1) -Z-S-R12, m) -Z-S(O)-R12, n) -Z-S(O)2-R12, o) -CF3, p) -NR12O-(C1-C6)алкил или q) -CH2ORy,-3 007483 при условии, что один из R2 и R3 отсутствует, когда существует двойная связь между CR2R3 (7 положение) и F остатком (8 положение) С-кольца;Ry для каждого случая представляет собой независимо а) ОН, b) -галоген, с) -Z-CF3, d) -Z-CF(C1-C3 алкил)2, е) -CN, f) -NR12R13, g) -(С 3-С 6)циклоалкил, h) -(С 3-С 6) циклоалкенил, i) -(C0-С 3)алкил-арил, j) -het или k) -N3; или R2 и R3, взятые вместе, образуют a) =CHR11, b) =NOR11, с) =O, d) =N-NR12, e) =N-NR12-C(O)-R12,f) оксиранил или g) 1,3-диоксолан-4-ил;R4 и R5 для каждого случая представляют собой независимо а) -Н, b) -CN, с) -(C1-C6)алкил, замещенный 0-3 галогенами, d) -(С 2-С 6)алкенил, замещенный 0-3 галогенами, е) -(С 2-С 6)алкинил, замещенный 0-3 галогенами, f) -О-(C1-С 6)алкил, замещенный 0-3 галогенами, g) -О-(С 2-С 6)алкенил, замещенный 0-3 галогенами, h) -О-(С 2-С 6)алкинил, замещенный 0-3 галогенами, i) галоген, j) -ОН, k) (С 3 С 6)циклоалкил или l) (С 3-С 6)циклоалкенил; или R4 и R5, взятые вместе, образуют =O;R7 и R16 для каждого случая представляют независимо а) -Н, b) -галоген, с) -CN, d) -(C1-C6)алкил,замещенный 0-3 галогенами, е) -(С 2-С 6)алкенил, замещенный 0-3 галогенами или f) -(С 2-С 6)алкинил, замещенный 0-3 галогенами, при условии, что R7 является иным, чем -CN или -галоген, когда D представляет собой NR7; или R7 и R16, взятые вместе, образуют =O;R8, R9, R14 и R15 для каждого случая представляют собой независимо а) -Н, b) -галоген, с) (C1-C6)алкил, замещенный 0-3 галогенами, d) -(С 2-С 6)алкенил, замещенный 0-3 галогенами, е) -(С 2-С 6)алкинил, замещенный 0-3 галогенами, f) -CN, g) -(С 3-С 6)циклоалкил, h) -(С 3-С 6)циклоалкенил, i) -ОН, j) -О-(С 1-С 6) алкил, к) -О-(C1-C6)алкенил, l) -О-(C1-С 6)алкинил, m) -NR12R13, n) -C(O)OR12 или о) -C(O)NR12R13; или R8 и R9, взятые вместе на С-кольце, образуют =O; при условии, что, когда m равно 2, только одна пара R8 и R9 берется вместе для образования =O; или R14 и R15, взятые вместе, образуют =O; при условии, что, когда R14 и R15, взятые вместе, образуют =O, D является иным, чем CR7, и Е является иным, чем С;R10 представляет собой а) -(C1-С 10)алкил, замещенный 0-3 заместителями, независимо выбранными из -галогена, -ОН и -N3, b) -(С 2-С 10)алкенил, замещенный 0-3 заместителями, независимо выбранными из-галогена, -ОН и -N3, с) -(С 2-С 10)алкинил, замещенный 0-3 заместителями, независимо выбранными из галогена, -ОН и -N3, d) -галоген, е) -Z-CN, f) -ОН, g) -Z-het, h) -Z-NR12R13, i) -Z-C(O)-het, j) -Z-C(O)-(C1-C6) алкил, k) -Z-C(O)-NR12R13, l) -Z-C(O)-NR12-Z-CN, m) -Z-C(O)-NR12-Z-het, n) -Z-C(O)-NR12-Z-apил, o) -ZC(O)-NR12-Z-NR12R13, p) -Z-C(O)-NR12-Z-O(C1-C6)алкил, q) -(С 0-С 6)алкил-С(О)ОН, r) -Z-C(О)О(C1-C6)алкил, s) -Z-O-(С 0-С 6)алкил-het, t) -Z-O-(С 0-С 6)алкил-арил, u) -Z-O-(C1-С 6)алкил, замещенный 0-2 Rx, v) -ZO-(C1-С 6)алкил-СН(О), w) -Z-O-(С 1-С 6)aлкил-NRl2-het, х) -Z-O-Z-het-Z-het, у) -Z-O-Z-het-Z-NR12R13, z) -ZO-Z-het-C(O)-het, a1) -Z-O-Z-C(O)-het, b1) -Z-O-Z-C(O)-het-het, c1) -Z-O-Z-C(O)-(C1-C6)алкил, d1) -Z-O-ZC(S)-NR12R13, e1) -Z-O-Z-C(O)-NR12R13, f1) -Z-O-Z-(C1-C3)алкил-C(O)NR12R13, g1) -Z-O-Z-C(O)-O(C1-C6) алкил, h1) -Z-O-Z-C(O)-OH, i1) -Z-O-Z-C(O)-NR12-O(C1-C6)алкил, j1) -Z-O-Z-C(O)-NR12-OH, k1) -Z-O-ZC(O)-NR12-Z-NR12R13, l1) -Z-O-Z-C(O)-NR12-Z-het, m1) -Z-O-Z-C(O)-NR12-SO2-(C1-C6)алкил, n1) -Z-O-ZC(=NR12)(NR12R13), o1) -Z-O-Z-C(=NOR12)(NR12R13), p1) -Z-NR12-C(O)-O-Z-NR12R13, q1) -Z-S-C(O)NR12R13, r1) -Z-O-SO2-(C1-C6)алкил, s1) -Z-O-SO2-арил, t1) -Z-O-SO2-NR12R13, u1) -Z-O-SO2-CF3, v1) -ZNR12C(O)OR13 или w1) -Z-NR12C(O)R13; или R9 и R10, взятые вместе на группе формулы А-5, образуют а) =О или b) =NOR12;R12 и R13 для каждого случая представляют, каждый независимо, а) -Н, b) -(C1-C6)алкил, где 1 или 2 атома углерода иные, чем соединяющий атом углерода, могут необязательно быть заменены 1 или 2 гетероатомами, независимо выбранными из S, О и N, и где каждый атом углерода является замещенным 06 галогенами, с) -(С 2-С 6)алкенил, замещенный 0-6 галогенами, или d) -(C1-С 6)алкинил, где 1 атом углерода иной, чем соединяющий атом углерода, может необязательно быть заменен 1 атомом кислорода, и где каждый атом углерода является замещенным 0-6 галогенами; или R12 и R13, взятые вместе с N, образуют het; или R6 и R14 или R15, взятые вместе, образуют 1,3-диоксоланил; арил представляет собой а) фенил, замещенный 0-3 Rx, b) нафтил, замещенный 0-3 Rx или с) бифенил, замещенный 0-3 Rx;het представляет собой 5-, 6- или 7-членное насыщенное, частично насыщенное или ненасыщенное кольцо, содержащее от одного (1) до трех (3) гетероатомов, независимо выбранных из группы, состоящей из азота, кислорода и серы; и включающее любую бициклическую группу, в которой любое из гетероциклических колец, указанных выше, конденсировано с бензольным кольцом или другим гетероциклом; и азот может быть в окисленном состоянии, давая N-оксидную форму; и замещенный 0-3 Rx;Rx для каждого случая представляет собой независимо а) -галоген, b) -ОН, с) -(C1-C6)алкил, d) (C2-C6) алкенил, е) -(С 2-С 6)алкинил, f) -О(C1-C6)алкил, g) -О(С 2-С 6)алкенил, h) -O(С 2-С 6)алкинил, i) -(С 0-С 6)алкил-4 007483net' представляет собой 5-, 6- или 7-членное насыщенное, частично насыщенное или ненасыщенное кольцо, содержащее от одного (1) до трех (3) гетероатомов, независимо выбранных из группы, состоящей из азота, кислорода и серы; и включающее любую бициклическую группу, в которой любое из указанных выше гетероциклических колец конденсировано с бензольным кольцом или другим гетероциклом; при условии, что: 1) X-R1 является иным, чем водород или метил; 2) когда R9 и R10 являются заместителями на А-кольце, они являются иными, чем моно- или диметокси; 3) когда R2 и R3, взятые вместе, образуют =CHR11 или =O, R11 представляет собой -O(C1-C6)алкил,-X-R1 является иным, чем (C1-С 4)алкил; 4) когда R2 и R3, взятые вместе, образуют =O, и R9 представляет собой водород на А-кольце; или,когда R2 представляет собой гидрокси, R3 представляет собой водород, и R9 представляет собой водород на А-кольце, R10 является иным, чем -O-(C1-C6)алкил или -O-СН 2-фенил в 2-положении А-кольца; 5) когда X-R1 представляет собой (С 1-С 4)алкил, (С 2-С 4)алкенил или (C2-C4)алкинил, R9 и R10 являются иными, чем моногидрокси или =O, включая его диольную форму, когда берутся вместе; и 6) когда X отсутствует, R1 является иным, чем группа, содержащая гетероатом, выбранный из N, О или S, непосредственно присоединенный к связке между В-кольцом и С-кольцом. В частности, соединения формулы I являются такими, где А-кольцо выбрано из группы, включающейX представляет собой -СН 2-. Более конкретно, соединения формулы I являются такими, где D представляет собой СН 2; Е представляет собой СН; F представляет собой СН 2; R8 представляет собой -Н; R9 представляет собой -Н на Скольце; m равно 2; R14 представляет собой -Н; R15 представляет собой -Н; и А-кольцо представляет собой группу формулы А-1 а. Предпочтительно, модулятор рецепторов глюкокортикоидов представляет собой соединение, выбранное из группы, включающей 2-фенантренкарбоксамид, 4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-4b-(фенилметил)-7-(1-пропинил)N-(4-пиридинилметил)-, [4bS-(4b,7,8a)]-; 2-фенантренкарбоксамид, 4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-4b-(фенилметил)-7-(1-пропинил)N-(2-пиридинилметил)-, [4bS-(4b,7,8a)]-; 2-фенантренкарбоксамид, 4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-4b-(фенилметил)-7-(1-пропинил)N-(3-пиридинилметил)-, (4bS-(4b,7,8a)]-; карбаминовая кислота, [2-(диметиламино)этил]-, 4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-4b-(фенилметил)-7-(1-пропинил)-2-фенантрениловый эфир, [4bS-(4b,7,8 а)]-; 2-фенантренкарбоксамид, 4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-4b-(фенилметил)-7-(1-пропинил)N-пиразинил-, [4bS-(4b,7,8a)]-; 2-фенантренол, 1,2,3,4,4 а,9,10,10 а-октагидро-4 а-(фенилметил)-2-(1-пропинил)-7-(4-пиридинилметокси)-,[2R-(2,4 а,10 а)]; 2-фенантренол, 1,2,3,4,4 а,9,10,10 а-октагидро-4 а-(фенилметил)-2-(1-пропинил)-7-(2-пиридинилметокси)-,[2R-(2, 4 а, 10 а)]; 2-фенантренкарбонитрил, 4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-4b-(фенилметил)-7-(1-пропинил)-,[4bS-(4b,7,8 а)]-; 2-фенантренкарбоксамид, 4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-N-[(2-метил-3-пиридинил)метил]4b-(фенилметил)-7-(1-пропинил)-, [4bS-(4b,7,8 а)]-;-5 007483 2-фенантренкарбоксамид, 4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-N-[(2-метил-3-пиридинил)метил]4b-(фенилметил)-7-пропил-, [4bS-(4b,7,8 а)]-; 2-фенантренкарбоксамид, 4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-4b-(фенилметил)-7-пропил-N-(2 пиридинилметил)-, [4bS-(4b,7,8a)]-; 2-фенантренол, 1,2,3,4,4 а,9,10,10 а-октагидро-4 а-(фенилметил)-7-(3-пиридинилметокси)-2-(3,3,3-трифторпропил)-, [2S-(2,4a,10 а)]-; 2-фенантренол, 1,2,3,4,4 а,9,10,10 а-октагидро-7-[(2-метил-3-пиридинил)метокси]-4 а-(фенилметил)-2(3,3,3-трифторпропил)-, [2S-(2,4a,10a)]-; 2-фенантренкарбоксамид, 4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-N-[(2-метил-3-пиридинил)метил]4b-(фенилметил)-7-(3,3,3-трифторпропил)-, (4bS,7S,8aR); 2-фенантренкарбоксамид, 4b,5,6,7,8,8 а,9,10-октагидро-7-гидpoкcи-7-мeтил-N-[(2-метил-3-пиридинил) метил]-4b-(фенилметил)-, (4bS,7R,8aR)-; 2-фенантренкарбоксамид,4b,5,6,7,8,8a,9,10-октагидро-7-гидрокси-7-метил-4b-(фенилметил)-N-3 пиридинил-, (4bS,7R,8aR)-; 2-фенантренол, 1,2,3,4,4a,9,10,10 а-октагидро-7-[(2-метил-3-пиридинил)метокси]-4 а-(фенилметил)-2(трифторметил)-, (2R,4aS, 10aR)-; и 2-фенантренкарбоксамид, 4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-N-[(2-метил-3-пиридинил)метил]4b-(фенилметил)-7-(трифторметил)-, (4bS,7R,8aR)-; или его изомер, пролекарство указанного соединения или изомера, или фармацевтически приемлемую соль указанного соединения, изомера или пролекарства. Как указано выше, настоящее изобретение относится к применению модулятора рецепторов глюкокортикоидов и агониста рецепторов глюкокортикоидов для получения лекарственного средства, предназначенного для лечения воспалительного заболевания у млекопитающего и для уменьшения нежелательных побочных эффектов при указанном лечении. В частности, указанное воспалительное заболевание выбрано из группы, включающей артрит, астму, ринит и иммуномодуляцию. Одним из аспектов настоящего изобретения является применение агониста рецепторов глюкокортикоидов, где агонист рецепторов глюкокортикоидов представляет собой соединение, выбранное из группы, состоящей из преднизона, преднилидена, преднизолона, кортизона, дексаметазона и гидрокортизона. Фармацевтические композиции для лечения воспалительного заболевания включают излечивающее воспаление количество соединения формулы I, его изомера, пролекарства указанного соединения или изомера, или фармацевтически приемлемой соли указанного соединения, изомера или пролекарства; и фармацевтически приемлемый носитель. Лечение воспалительного заболевания у млекопитающего включает введение указанному млекопитающему терапевтически эффективных количеств модулятора рецепторов глюкокортикоидов и агониста рецепторов глюкокортикоидов. Такое лечение может дополнительно включать уменьшение нежелательных побочных эффектов указанного лечения. Воспалительное заболевание, например, может быть выбрано из группы, включающей артрит, астму, ринит и иммуномодуляцию. Более конкретно, модулятор рецепторов глюкокортикоидов представляет собой соединение формулы I, его изомер, пролекарство указанного соединения или изомера, или фармацевтически приемлемую соль указанного соединения, изомера или пролекарства. Также, более конкретно, агонист рецепторов глюкокортикоидов представляет собой соединение, выбранное из группы, включающей преднизон,преднилиден, преднизолон, кортизон, дексаметазон и гидрокортизон. Подробное описание изобретения При описании соединений формулы I по настоящему изобретению они именуются согласно системе номенклатуры IUPAC или CAS. В одном способе обозначения соединений по настоящему изобретению атомы углерода в кольце могут быть пронумерованы так, как показано на следующей далее упрощенной структуре: Альтернативно, в другом способе обозначений соединений по настоящему изобретению атомы углерода в кольце могут быть пронумерованы так, как показано на следующей далее упрощенной структуре: Содержание атомов углерода в различных остатках, содержащих углеводороды, обозначается с помощью приставки, обозначающей минимальное и максимальное количество атомов углерода в остатке,то есть, приставка Ci-Cj указывает на остаток, содержащий от целого числа "i" до целого числа "j" атомов углерода. Так, например, C1-C3 алкил относится к алкилу из одного-трех атомов углерода включительно,или к метилу, этилу, пропилу и изопропилу, и ко всем их изомерным формам и формам с прямой и разветвленной цепью. Примеры алкила, содержащего от 1 до 9 атомов углерода, представляют собой метил, этил, пропил,бутил, пентил, гексил, гептил, октил, и нонил, и все их изомерные формы, как прямые, так и разветвленные. Примеры алкенила, содержащего от 2 до 5 атомов углерода, представляют собой этенил, пропенил,бутенил, пентенил и все их изомерные формы, как прямые, так и разветвленные. Примеры алкинила, содержащего от 2 до 5 атомов углерода, представляют собой этинил, пропинил,бутинил, пентинил и все их изомерные формы, как прямые, так и разветвленные. Термины "циклоалкил", "циклоалкенил" и "циклоалкинил" относятся к циклическим формам алкила, алкенила и алкинила, соответственно. Например, (С 3-С 8)циклоалкильные группы представляют собой циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил. Термин "галоген" включает хлор, бром, йод и фтор. Термин "арил" относится к необязательно замещенному шестичленному ароматическому кольцу,включая полиароматические кольца. Примеры арила включают фенил, нафтил и бифенил. Термин "net" относится к необязательно замещенному 5-, 6-или 7-членному насыщенному, частично насыщенному или ненасыщенному гетероциклическому кольцу, содержащему от 1 до 3 гетероатомов,выбранному из группы, состоящей из азота, кислорода и серы; и включающему любую бициклическую группу, в которой любое из выше указанных гетероциклических колец сливается с бензольным кольцом или другим гетероциклическим кольцом; и атом азота может быть в окисленном состоянии с получениемN-оксидной формы; и замещенному 0-3 независимыми заместителями. Следующие разделы описывают примеры кольца (колец) для общих описаний колец, содержащихся здесь. Примеры пятичленных колец представляют собой фурил, тиенил, 2 Н-пирролил, 3 Н-пирролил, пирролил, 2-пирролинил, 3-пирролинил, пирролидинил, 1,3-диоксоланил, оксазолил, тиазолил, имидазолил,2 Н-имидазолил, 2-имидазолинил, имидазолидинил, пиразолил, 2-пиразолинил, пиразолидинил, изоксазолил, изотиазолил, 1,2-дитиолил, 1,3-дитиолил, 3 Н-1,2-оксатиолил, 1,2,3-оксадиазолил, 1,2,4 оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, 1,2, 3-триазолил, 1,2,4-триазолил, 1,3,4 тиадиазолил, 1,2,3,4-оксатриазолил, 1,2,3,5-оксатриазолил, 3 Н-1,2,3-диоксазолил, 1,2,4-диоксазолил,1,3,2-диоксазолил, 1,3,4-диоксазолил, 5 Н-1,2,5-оксатиазолил и 1,3-оксатиолил. Примеры шестичленных колец представляют собой 2 Н-пиранил, 4 Н-пиранил, пиридинил, пиперидинил, 1,2-диоксинил, 1,3-диоксинил, 1,4-диоксанил, морфолинил, 1,4-дитианил, тиоморфолинил, пиридазинил, пиримидинил, пиразинил, пиперазинил, 1,3,5-триазинил, 1,2,4-триазинил, 1,2,3-триазинил,1,3,5-тритианил, 4 Н-1,2-оксазинил, 2 Н-1,3-оксазинил, 6 Н-1,3-оксазинил, 6 Н-1,2-оксазинил, 1,4 оксазинил, 2 Н-1,2-оксазинил, 4 Н-1,4-оксазинил, 1,2,5-оксатиазинил, 1,4-оксазинил, о-изоксазинил, п-изоксазинил, 1,2,5-оксатиазинил, 1,2,6-оксатиазинил, 1,4,2-оксадиазинил и 1,3, 5, 2-оксадиазинил. Примеры семичленных колец представляют собой азепинил, оксепинил, тиепинил и 1,2,4-диазепинил. Примеры восьмичленных колец представляют собой циклооктил, циклооктенил и циклооктадиенил. Примеры бициклических колец, состоящих из сочетания из двух слитых частично насыщенных,полностью насыщенных или полностью ненасыщенных пяти- или шестичленных колец, взятых независимо, необязательно имеющих от 1 до 4 гетероатомов, выбранных независимо из азота, серы и кислорода, представляют собой индолизинил, индолил, изоиндолил, 3 Н-индолил, 1H-изоиндолил, индолинил,циклопента(b)пиридинил, пирано(3,4-b)пирролил, бензофурил, изобензофурил, бензо(b)тиенил, бензо(с)тиенил, 1 Н-индазолил, индоксазинил, бензоксазолил, антранилил, бензимидазолил, бензтиазолил, пуринил, 4 Н-хинолизинил, хинолинил, изохинолинил, циннолинил, фталазинил, хиназолинил, хиноксалинил, 1,8-нафтиридинил, птеридинил, инденил, изоинденил, нафтил, тетралинил, декалинил, 2 Н-1-бензопиранил, пиридо(3,4-b)пиридинил, пиридо(3,2-b)пиридинил, пиридо(4,3-b)пиридинил, 2 Н-1,3-бензоксазинил, 2 Н-1,4-бензоксазинил, 1 Н-2,3-бензоксазинил, 4 Н-3,1-бензоксазинил, 2 Н-1,2-бензоксазинил и 4 Н 1,4-бензоксазинил. Как он используется здесь термин "млекопитающие", как подразумевается, относится ко всем млекопитающим, включая, например, приматов, таких как люди и обезьяны. Примерами других млекопитающих, включенных сюда, являются кролики, собаки, коты, крупный рогатый скот, козы, овцы и лошади.-7 007483 Термин "лечение", "лечить" или "излечение", как он используется здесь, включает превентативное(например, профилактику) и паллиативное лечение. Как "фармацевтически приемлемый", подразумевается носитель, наполнитель, разбавитель, наполнитель и/или соль, которые должны быть совместимы с другими ингредиентами препарата, и не наносить вреда тому, кто их принимает. Выражение "пролекарство" относится к соединениям, которые являются предшественниками лекарственных средств, которые после введения высвобождают лекарственное средство in vivo посредством некоторого химического или физиологического процесса (например, пролекарство, когда оно доводится до физиологического значения рН или под действием фермента, преобразуется в желаемую лекарственную форму). Например, пролекарства при расщеплении высвобождают соответствующую свободную кислоту, и такие гидролизуемые, формирующие сложные эфиры остатки соединений формулы I включают, но не ограничиваются ими, те, которые имеют карбоксильный остаток, где свободный водород заменен (C1-C4)алкилом, (С 2-С 7)алканоилоксиметилом, 1-(алканоилокси)этилом, имеющим от 4 до 9 атомов углерода, 1-метил-1-(алканоилокси)этилом, имеющим от 5 до 10 атомов углерода, алкоксикарбонилоксиметилом, имеющим от 3 до 6 атомов углерода, 1-(алкоксикарбонилокси)этилом, имеющим от 4 до 7 атомов углерода, 1-метил-1-(алкоксикарбонилокси)-этилом, имеющим от 5 до 8 атомов углерода, N(алкоксикарбонил)аминометилом, имеющим от 3 до 9 атомов углерода, 1-(N-(алкоксикарбонил)амино) этилом, имеющим от 4 до 10 атомов углерода, 3-фталидилом, 4-кротонолактонилом, гамма-бутиролактон-4-илом, ди-N,N-(C1-C2)алкиламино(С 2-С 3)алкилом (таким как -диметиламиноэтил), карбамоил(C1C2)алкилом, N,N-ди(С 1-С 2)алкилкарбамоил(С 1-С 2)алкилом и пиперидино-, пирролидино- или морфолино(С 2-С 3)алкилом. Соединения формулы I по настоящему изобретения получают так, как описано ниже в примерах,или получают с помощью способов, аналогичным им, которые хорошо известны и доступны специалисту в данной области в свете настоящего описания. В каждой из схем, группы R (например, R1, R2, и тому подобное) соответствуют тем, которые обозначены выше в кратком описании. Кроме того, переменная n определяется как 0-6. Однако, как понятно специалисту в данной области, и другие функциональные группы, описанные здесь в указанных положениях соединений формулы I, также представляют собой потенциальные заместители для аналогичных положений на структурах в схемах. Любое из соединений и веществ-предшественников, указанных в настоящем изобретении, может быть синтезировано в виде фармацевтически приемлемых солей для включения в различные фармацевтические композиции. Фармацевтически приемлемые соли включают, но не ограничиваются ими, соли,образованные со следующими кислотами, соединениями или ионами: хлористо-водородная, бромистоводородная, йодисто-водородная, фтористо-водородная, серная, сульфоновая, лимонная, камфорная, малеиновая, уксусная, молочная, никотиновая, азотная, янтарная, фосфорная, малоновая, яблочная, салициловая, фенилуксусная, стеариновая, пальмитиновая, пиридин, аммоний, пиперазин, диэтиламин, никотинамид, муравьиная, фумаровая, мочевина, натрий, калий, кальций, магний, цинк, литий, коричная, метиламино, метансульфоновая, пикриновая, п-толуолсульфоновая, нафталинсульфоновая, винная, триэтиламино, диметиламино, и трис(гидроксиметил)аминометан. Дополнительные фармацевтически приемлемые соли являются очевидными для специалиста в данной области. Когда существует более чем один основной остаток, выражение включает кратные соли (например, ди-соль). Некоторые из соединений по настоящему изобретению являются кислотными, и они образуют соль с фармацевтически приемлемым катионом. Некоторые из соединений по настоящему изобретению являются основными, и они образуют соль с фармацевтически приемлемым анионом. Все такие соли,включая ди-соли, находятся в рамках настоящего изобретения, и они могут быть получены с помощью удобных способов. Они могут быть получены просто путем приведения в контакт кислотных и основных веществ либо в водной, либо в неводной, либо в частично водной среде. Например, мезилатную соль получают путем взаимодействия формы свободного основания соединения формулы I с метансульфоновой кислотой в стандартных условиях. Подобным же образом гидрохлоридную соль получают путем взаимодействия формы свободного основания соединения формулы I с хлористо-водородной кислотой в стандартных условиях. Соли извлекаются либо путем фильтрования, либо путем осаждения с помощью плохого растворителя с последующим фильтрованием, либо путем выпаривания растворителя, либо, в случае водных растворов, путем лиофилизации, по потребности. Кроме того, когда соединения и пролекарства по настоящему изобретению образуют гидраты или сольваты, они также находятся в рамках настоящего изобретения. Соединения и пролекарства по настоящему изобретению также включают рацематы, стереоизомеры и смеси этих соединений, включая изотопно-меченные и радиоактивно-меченные соединения. Такие изомеры могут быть выделены с помощью стандартных методик разделения, включая фракционную кристаллизацию и хроматографию на колонках с хиральной фазой. Например, соединения по настоящему изобретению имеют асимметричные атомы углерода и они,следовательно, являются энантиомерами или диастереомерами. Диастереомерные смеси могут разделяться на их индивидуальные диастереомеры на основе их физических/химических различий с помощью способов, известных в данной области, например, с помощью хроматографии и/или фракционной кри-8 007483 сталлизации. Энантиомеры могут быть разделены путем преобразования энантиомерной смеси в диастереомерную смесь путем взаимодействия с соответствующим оптически активным соединением (например, спиртом), разделения диастереомеров и преобразования (например, гидролиза) индивидуальных диастереомеров в соответствующие чистые энантиомеры. Все такие изомеры, включая диастереомеры,энантиомеры и их смеси, рассматриваются как часть настоящего изобретения. Следующие конфигурации соединений по настоящему изобретению (как представлено с помощью упрощенных структур) являются предпочтительными, при этом первая конфигурация является более предпочтительной Также, соединения и пролекарства по настоящему изобретению могут существовать в нескольких таутомерных формах, включая энольную форму, кето-форму и их смеси. Все такие таутомерные формы включаются в рамки настоящего изобретения. Агонисты, частичные агонисты и антагонисты GR по настоящему изобретению могут быть использованы для воздействия на основные системы жизнеобеспечения организма, включая метаболизм углеводов, белков и липидов, электролитный и водный баланс, и функции сердечно-сосудистой, почечной,центральной нервной, иммунной, скелетно-мышечной и других систем, органов и тканей. В этой связи модуляторы GR используются для лечения заболеваний, связанных с избытком или недостатком глюкокортикоидов в организме. В таком качестве они могут быть использованы для лечения следующих заболеваний: ожирения, диабета, сердечно-сосудистого заболевания, гипертонии, синдрома X, депрессии,беспричинного страха, глаукомы, вируса иммунодефицита человека (ВИЧ) или синдрома приобретенного иммунодефицита (СПИД), нейродегенерации (например, болезни Альцгеймера и Паркинсона), усиления познавательной способности, синдрома Кушинга, болезни Аддисона, остеопороза, хрупкости костей,воспалительных заболеваний (таких как остеоартрит, ревматоидный артрит, астма и ринит), для исследований функции почек, вирусной инфекции, иммунодефицита, иммуномодуляции, аутоимунных заболеваний, аллергий, заживления ран, навязчивых состояний, устойчивости ко множеству лекарственных средств, наркомании, психоза, анорексии, кахексии, синдрома посттравматического стресса, переломов костей после хирургического вмешательства, медицинского катаболизма и предотвращения мышечной слабости. Специалисту в данной области должно быть понятно, что несмотря на то, что соединения, их изомеры, пролекарства и их фармацевтически приемлемые соли по настоящему изобретению, как правило,будут использоваться в качестве селективных агонистов, частичных агонистов или антагонистов, могут существовать случаи, где предпочтительным является соединение со смешанными свойствами относительно рецепторов стероидов. Далее, специалисту в данной области должно быть понятно, что соединения, изомеры, пролекарства и их фармацевтически приемлемые соли по настоящему изобретению, включая фармацевтические композиции и препараты, содержащие эти соединения, изомеры, пролекарства и соли, могут быть использованы в широком наборе комбинированной терапии для лечения состояний и заболеваний, описанных выше. Таким образом, соединения, изомеры, пролекарства и их фармацевтически приемлемые соли по настоящему изобретению могут быть использованы в сочетании с другими фармацевтическими агентами для лечения заболеваний/состояний, описанных здесь. Например, они могут быть использованы в сочетании с фармацевтическими агентами, которые излечивают ожирение, диабет, воспалительное заболевание, иммунодефицит, гипертонию, сердечно-сосудистое заболевание, вирусную инфекцию, ВИЧ,болезнь Альцгеймера, болезнь Паркинсона, беспричинный страх, депрессию или психоз. При комбинированном терапевтическом лечении как соединения, изомеры, пролекарства и их фармацевтически приемлемые соли по настоящему изобретению, так и другие терапевтические лекарственные средства, вводятся млекопитающим (например, людям женского и мужского пола) с помощью обычных способов. Например, агонисты рецепторов глюкокортикоидов являются эффективными агентами для лечения различных воспалительных заболеваний; однако лечение часто сопровождается нежелательными побочными эффектами. Эти побочные эффекты включают, но не ограничиваются ими, следующие примеры: воздействие на метаболизм, увеличение веса, истощение мышц, декальцинирование скелета, остеопороз,утоньшение кожи и утоньшение скелета. Однако, в соответствии с настоящим изобретением модуляторы рецепторов глюкокортикоидов могут использоваться в сочетании с агонистами рецепторов глюкокортикоидов для блокировки некоторых из этих побочных эффектов без ингибирования эффективности лечения. Таким образом, любой агонист рецепторов глюкокортикоидов может быть использован в качестве второго вещества в аспекте сочетания настоящего изобретения. Это сочетание включает лечение различ-9 007483 ных воспалительных заболеваний, таких как артрит (остеоидный и ревматоидный), астма, ринит, или иммуномодуляция. Примеры модуляторов рецепторов глюкокортикоидов включают те, которые известны в данной области (многие из которых описаны выше), а также новые соединения формулы I по настоящему изобретению. Болееконкретно, примеры модуляторов рецепторов глюкокортикоидов, известных в данной области, включают, но не ограничиваются ими, определенные нестероидные соединения,такие как 5 Н-хромено[3,4-f]хинолины, которые являются селективными модуляторами рецепторов стероидов, как описано в патенте США 5696127; и определенные стероидные соединения, замещенные в положении 10, которые обладают противоглюкокортикоидной активностью, и некоторые из которых имеют глюкокортикоидную активность, как описывается в описании заявки на eвропейский патент 0188396, опубликованный 23 июля 1986 г. Примеры агонистов рецепторов глюкокортикоидов включают те, которые известны в данной области, такие как преднизон(17,21-дигидроксипрегнан-1,4-диен-3,11,20 трион), преднилиден 11)-11,17,21-тригидрокси-16-метиленпрегна-1,4-диен-3,20-дион), преднизолон 11)11,17,21-тригидроксипрегна-1,4-диен-3,20-дион), кортизон(17,21-дигидрокси-4-прегнен-3,11,20-трион),дексаметазон 11,16)-9-фтор-11,17,21-тригидрокси-16-метилпрегна-1,4-диен-3,20-дион) и гидрокортизон(11,17,21-тригидроксипрегн-4-ен-3,20-дион). Эти соединения, которые являются агонистами рецепторов глюкокортикоидов, как правило, вводятся в виде стандартной дозированной формы с терапевтически эффективным количеством каждого соединения. Например, преднизон или эквивалентное лекарственное средство могут вводиться в количестве от около 5 до около 80 мг, в зависимости от состояния; гидрокортизон может вводиться в количестве от около 100 до около 400 мг, в зависимости от состояния; и дексаметазон может вводиться в количестве от около 4 до около 16 мг, в зависимости от состояния. Эти дозы, как правило, вводятся один или два раза в день, а для целей поддержания, иногда через день. Как отмечено выше, соединения, изомеры, пролекарства и фармацевтически приемлемые соли по настоящему изобретению могут быть объединены в смеси с фармацевтически приемлемым носителем,связующим веществом или разбавителем для создания фармацевтических композиций, пригодных для использования при лечении биологических состояний или расстройств, отмеченных здесь, у пациентов млекопитающих, а более предпочтительно у людей. Конкретный носитель, наполнитель или разбавитель,используемый в этих фармацевтических композициях, может принимать большое множество форм, в зависимости от желаемого типа введения, например внутривенного, перорального, местного, в суппозиториях или парентерального. Кроме того, соединения, изомеры, пролекарства и их соли по настоящему изобретению могут вводиться индивидуально или совместно в любой удобной дозированной форме, такой как пероральная, парентеральная, ректальная или трансдермальная дозированная форма. Для перорального введения фармацевтическая композиция может принимать форму раствора, суспензии, таблеток, пилюль, капсул, порошков и тому подобное. Таблетки, содержащие различные наполнители, такие как цитрат натрия, карбонат кальция и фосфат кальция, используются вместе с различными разрыхлителями, такими как крахмал, предпочтительно крахмал из картофеля или тапиоки, и определенные комплексные силикаты, вместе со связующими агентами, такими как поливинилпирролидон,сахароза, желатин и смола акации. Кроме того, смазывающие агенты, такие как стеарат магния, натрий лаурилсульфат и тальк, очень часто используются для целей таблетирования. Твердые композиции подобного типа также используются в качестве наполнителей в желатиновых капсулах с мягким и твердым наполнением; предпочтительные материалы в этом отношении также включают лактозу или молочный сахар, а также высокомолекулярные полиэтиленгликоли. Когда водные суспензии и/или эликсиры являются желательными для перорального введения, соединения, пролекарства и их фармацевтически приемлемые соли по настоящему изобретению могут объединяться с различными подслащающими агентами, ароматизирующими агентами, подкрашивающими агентами, эмульгирующими агентами и/или суспендирующими агентами, а также с такими разбавителями как вода, этанол, пропиленгликоль, глицерин и различные подобные их комбинации. Благодаря простоте их введения таблетки и капсулы представляют собой наиболее предпочтительную форму пероральной дозировки для фармацевтических композиций по настоящему изобретению. Для целей парентерального введения могут быть использованы растворы в кунжутном или арахисовом масле или в водном растворе пропиленгликоля, а также стерильные водные растворы соответствующих водорастворимых солей. Такие водные растворы могут быть дополнены соответствующим буфером, если это необходимо, и жидкий разбавитель может сначала быть сделан изотоническим с помощью достаточного количества солевого раствора или глюкозы. Эти водные растворы являются особенно пригодными для целей внутривенных, внутримышечных, подкожных или внутрибрюшинных инъекций. В этой связи используемые стерильные водные среды могут легко быть получены с помощью стандартных методик, хорошо известных в данной области. Для целей трансдермального (например, местного) введения приготавливаются разбавленные, стерильные, водные или частично водные растворы (как правило, при концентрации от около 0,1 до 5%), в другом случае, растворы, подобные указанным выше парентеральным растворам. Для местного введения соединения по настоящему изобретению могут быть приготовлены с ис- 10007483 пользованием мягких, увлажняющих основ, таких как мази и кремы. Примерами соответствующих основ в виде мазей являются вазелин, вазелин плюс летучие силиконы, ланолин и эмульсии типа вода в масле. Способы получения различных фармацевтических композиций с определенным количеством активного ингредиента являются известными или станут ясны специалистам в данной области в свете настоящего описания. Примеры способов получения фармацевтических композиций, смотри Remington'sPharmaceutical Sciences. Mack Publishing Company, Easter, Pa., 15th Edition (1975). Фармацевтические композиции и соединения, изомеры, пролекарства и их фармацевтически приемлемые соли по настоящему изобретению могут вводиться в виде стандартной дозированной формы(например, таблетки, капсулы, и тому подобное) при терапевтически эффективном количестве такого соединения, пролекарства или его соли от около 0,1 мкг/кг массы тела до около 500 мг/кг массы тела,более конкретно от около 1 мкг/кг до около 250 мг/кг, а наиболее конкретно от около 2 мкг/кг до около 100 мг/кг. Более предпочтительно, соединение по настоящему изобретению будет вводиться в количестве от около 0,1 до около 500 мг/кг массы тела и наиболее предпочтительно от около 0,1 до около 50 мг/кг массы тела. Как ясно специалисту в данной области, конкретное количество фармацевтической композиции по настоящему изобретению, вводимое пациенту, будет зависеть от ряда факторов, включая без ограничения, желаемую биологическую активность, состояние пациента и толерантность к лекарству. Следующие разделы описывают примерные препараты, дозировки и тому подобное, которые пригодны для использования для животных, не являющихся людьми. Введение соединений по настоящему изобретению может производиться перорально или не перорально, например путем инъекции. Количество соединения формулы I, изомера, пролекарства или их фармацевтически приемлемой соли, вводится таким образом, что получается терапевтически эффективная доза, как правило, дневная доза, которая,когда она принимается животным перорально, обычно находится в пределах между 0,01 и 500 мг/кг массы тела, предпочтительно между 0,1 и 50 мг/кг массы тела. Удобно, чтобы лекарственное средство находилось в питьевой воде, с тем, чтобы терапевтическая доза агента принималась с дневным потреблением воды. Агент может быть непосредственно отмерен в питьевую воду, предпочтительно в форме жидкого водорастворимого концентрата (такого как водный раствор водорастворимой соли). Удобно, чтобы активный ингредиент также добавлялся непосредственно в корм, как есть или в форме добавок в корм для животных, также упоминаемых как примесь или концентрат. Примесь или концентрат терапевтического агента в носителе более широко используется для введения агента в корм. Соответствующие носители являются жидкими или твердыми, такие как вода, различные виды муки, такие как мука люцерны, мука соевых бобов, корм на основе хлопкового масла, корм на основе льняного масла, измельченные кукурузные початки и кукурузная мука, меласса, мочевина, костная мука, и минеральные смеси, такие как те,которые используются в кормах для птицы. Особенно эффективным носителем является сам соответствующий корм для животных; то есть небольшая часть этого корма. Этот носитель облегчает однородное распределение активных материалов в готовом корме, с которым смешивается примесь. Является важным, чтобы соединение тщательно смешивалось с примесью, а в последствии с кормом. В этом отношении агент может быть диспергирован или растворен в соответствующем масляном носителе, таком как соевое масло, кукурузное масло, хлопковое масло и тому подобное, или в летучем органическом растворителе, а затем смешано с носителем. Ясно, что пропорции активного материала в концентрате можно изменять в широких пределах, поскольку количество агента в готовом корме может быть подобрано путем соответствующей пропорции примеси в корме для получения желаемого уровня терапевтического агента. Сильнодействующие концентраты могут смешиваться производителем кормов с белковым носителем, таким как корм на основе соевого масла, и другими видами кормов, как описано выше, для получения концентрированных добавок, которые являются пригодными для непосредственного кормления животных. В таких случаях животным дают возможность потреблять их обычные корма. Альтернативно,такие концентрированные добавки могут добавляться непосредственно в корм для производства сбалансированного по питательным веществам готового корма, содержащего терапевтически эффективный уровень соединения по настоящему изобретению. Смеси тщательно смешиваются с помощью стандартных процедур, например, в двухкорпусном блендере для обеспечения гомогенности. Активность соединений по настоящему изобретению демонстрируют с помощью одного или нескольких из исследований, описанных ниже. Далее следует описание исследования для идентификации антагонистов/агонистов рецепторов глюкокортикоидов: клетки HeLa, содержащие эндогенные рецепторы глюкокортикоидов человека, трансфицируются с помощью плазмиды 3 хGRЕ-люциферазы, генерируемой с помощью стандартных процедур, и плазмиды, придающей устойчивость к неомицину. Новые линии чувствительных к глюкокортикоидам клеток генерируются и характеризуются. Одна такая линия клеток, обозначаемая Hela-GRE9, используется для определения активности соединений по отношению к рецепторам глюкокортикоидов. Клетки выдерживаются в снятой на активированном угле сыворотке и переносятся в 96-луночные планшеты для микротитрования за один день до обработки различными концентрациями (10-12-10-5) исследуемых соединений в отсутствие и в присутствии известных агонистов рецепторов глюкокортикоидов (то есть дексаметазона, гидрокортизона) в течение вплоть до 24 ч. Обработки производятся троекратно. Приготавли- 11007483 вают лизаты клеток, и активность люциферазы определяется с помощью люминометра. Активность агонистов оценивается путем сравнения активности люциферазы от клеток, обработанных исследуемым соединением, с клетками, обработанными агонистом дексаметазона. Активность антагониста оценивается путем сравнения активности люциферазы при концентрации дексаметазона ЕС 50 в отсутствие и в присутствии исследуемого соединения. Значение ЕС 50 (концентрация, которая дает 50% максимальной реакции) для дексаметазона вычисляется из кривых дозовой зависимости. Далее следует описание исследования для определения конкурентного ингибирующего связывания рецепторов глюкокортикоидов человека типа II, экспрессированных в клетки Sf9. Протокол связывания. Соединения исследуются в исследовании вытеснения связыванием с использованием рецепторов глюкокортикоидов человека, экспрессированных в клетки Sf9, с 3 Н-дексаметазоном в качестве лиганда. Рецепторы глюкокортикоидов человека экспрессируются в клетки Sf9, как описано в Mol. Endocrinology 4:209, 1990. Шарики, содержащие клетки Sf9 с экспрессированным рецептором GR человека, из 1 л емкостей лизируются с помощью от 40 мкл до 20 мМ бульона AEBSF (Calbiochem, LaJolla, CA), содержащего 50 мг/мл лейпептина, и добавляют 40 мл гомогенизирующего буфера. Исследование проводят на 96-луночных полипропиленовых планшетах при конечном объеме 130 мкл, содержащем 200 мкг белка лизата Sf9, 6,9 нМ 3 Н-дексаметазона (Amersham, Arlington Heights, IL), в присутствии исследуемых соединений, носителя исследуемого соединения (для общего числа отсчетов) или избытка дексаметазона (7 мкМ, нерадиоактивный, для определения неспецифического связывания), в соответствующем объеме буфера для анализа. Все соединения исследуются при 6 концентрациях по 2 раза (диапазон концентраций 0,1-30 нМ или 3-1000 нМ). Исследуемые соединения разбавляют от 25 мМ бульона в 100% ДМСО с 70% EtOH, их добавляют в объеме 2 мкл. Как только все добавления сделаны, планшеты встряхивают,запечатывают с помощью ленты и инкубируют при 4 С в течение ночи. После инкубирования в течение ночи несвязанные отсчеты удаляют с помощью активированного угля, покрытого декстраном, следующим образом: добавляют 75 мкл активированного угля, покрытого декстраном (5,0 г активированного угля, 0,5 г декстрана доводят до объема 100 мл с помощью буфера для анализа), планшеты встряхивают и инкубируют в течение пяти минут при 4 С. Пластины затем центрифугируют в охлаждаемой лабораторной планшетной центрифуге при максимальной скорости в течение 15 мин, 100 мкл супернатанта из каждой лунки помещают в 96-луночный планшет из ПЭТФ с 200 мкл сцинцилляционного коктейля и считают на бета-счетчике (1450 MicroBetaTrilux, от Wallac, Turku,Finland). Анализ данных. После вычитания неспецифического связывания, связанные отсчеты выражают как процент от общего количества отсчетов. Концентрационная реакция на исследуемое соединение подгоняется с помощью S-образной кривой для определения IC50 (концентрация соединения, которая вытесняет 50% связанных отсчетов). Реагенты. Буфер для анализа: 2,0 мл 1 М Трис, 0,2 мл 0,5 мМ EDTA, 77,1 мг DTT, 0,243 г молибдата натрия в объеме 100 мл воды; гомогенизирующий буфер: 2,0 мл 0,5 М K2 НРО 4 (рН 7,6), 20 мкл 0,5 М EDTA (рН 8,0), 77,1 мг DTT, 0,486 г молибдата натрия в объеме 100 мл воды. Следующее является описанием исследования для определения селективности рецепторов: клеткиT47D из АТСС, содержащие эндогенный прогестерон человека и рецепторы минералакортикоидов, временно трансфицируются 3 хGRЕ-люциферазой с использованием Lipofectamine Plus (GIBCO-DRL,Gaithersburg, MD). 24 ч после трансфицирования клетки поддерживаются в сыворотке, снятой на активированном угле, и переносятся в 96-луночные планшеты для микротитрования. На следующий день клетки обрабатывают различными концентрациями (от 10-12 до 10-5) исследуемых соединений в отсутствие и в присутствии известных агонистов рецепторов прогестерона (прогестерон) и известного агониста рецепторов минералокортикоидов (альдостерон) в течение вплоть до 24 ч. Обработки проводятся три раза. Приготавливают лизаты клеток, и активность люциферазы определяется с использованием люминометра. Активность агониста оценивается путем сравнения активности люциферазы от клеток, обработанных одним только соединением, и клеток, обработанных агонистом либо прогестерона, либо альдостерона. Активность антагониста оценивается путем сравнения активности люциферазы концентрации ЕС 50 прогестерона или альдостерона в отсутствие и в присутствии соединения. Значение ЕС 50 (концентрация, которая дает 50% максимальной реакции) для прогестерона и альдостерона вычисляется из кривых дозовой зависимости. Следующее является описанием исследования для определения способности соединения ингибировать индукцию агонистов глюкокортикоидов в связи с активностью тирозинаминотрансферазы (ТАТ) печени у находящихся в сознании крыс. Животные. Используются самцы крыс линии Sprague Dawley (от Charles River, Wilimington MA) (интактные или с надпочечниками, удаленными, по меньшей мере, за неделю перед исследованием), масса тела 90 г. Перед использованием в исследованиях крыс содержат при стандартных условиях в течение 7-10 дней.- 12007483 Экспериментальный протокол. Крысам (как правило, по 3 в лечебной группе) вводят дозы исследуемого соединения, носителя или положительного контроля (Ru486), либо внутрибрюшинно, перорально, подкожно, либо внутривенно(хвостовая вена). Носителем доз для исследуемых соединений, как правило, является один из следующих растворов: 100% PEG 400, 0,25% метилцеллюлозы в воде, 70% этанола или 0,1 н НСl, и соединения исследуются при дозах, находящихся в пределах от 10 до 125 мг/кг. Соединения дозируются в объеме 1,0 мл/100 г массы тела (для перорального) или 0,1 мл/100 г массы тела для других способов введения. Через 10 мин после введения исследуемого соединения крысам делают инъекцию дексаметазона (0,03 мг/кг,внутрибрюшинно, в объеме 0,1 мл/100 г) или носителя. Для приготовления дозы раствора дексаметазона,дексаметазон (от Sigma, St. Louis, МО) растворяют в 100% этанола и разбавляют водой (конечный: 10% этанола:90% воды, объем:объем). Группы, пролеченные носителем-носителем, носителемдексаметазоном и Ru486-дексаметазоном, включают в каждое исследование. Соединения исследуются в зависимости только от дексаметазона. Через 3 ч после инъекции дексаметазона крыс умерщвляют путем декапитации. Образец печени (0,3 г) вырезают, помещают в 2,7 мл охлаждаемого льдом буфера и гомогенизируют с помощью политрона. Для получения цитозоля гомогенат печени центрифугируют при 105000 g в течение 60 мин и супернатант хранят при -80 С до анализов. ТАТ оценивается на 100 мкл супернатанта от 105000g при разбавлении 1:20 с использованием метода Граннера и Томкинса (Methods inEnzymology 17A: 633-637,1970), и время реакции составляет 8-10 мин. Активность ТАТ выражается как микромоль продукта/мин/г печени. Интерпретация. Данные лечения анализируются с использованием анализа разброса (ANOVA) с post-hoc анализом с сохранением наименьшей значимой разницы (PLSD). Соединения рассматриваются как активные в настоящем исследовании, если активность ТАТ в группе, предварительно пролеченной соединением перед введением дексаметазона, является значимо уменьшенной (Р 0,05) по отношению к активности ТАТ у группы, пролеченной носителем-дексаметазоном. Следующее является описанием исследования для определения воздействия соединения на два типичных гена, которые регулируются во время воспалительной реакции. Это исследование, ингибирование глюкокортикоидами индуцированной IL-1 (интерлейкином-1) продукции ММР-1 (матриксной металлопротеиназы-1) и IL-8 (интерлейкина-8) у клеток хондросаркомы человека, осуществляется следующим образом: клетки хондросаркомы человека SW1353 (получают от АТСС), от пересева 12 до пересева 19, используют при анализе в 96-луночном формате. Клетки размещают конфлюентно в 96-луночных планшетах, в DMEM (среда Игла, модифицированная Дульбекко) с 10% фетальной бычьей сыворотки и инкубируют при 37 С, 5% СО 2. Через 24 ч среда, содержащая сыворотку, удаляется и заменяется 200 мкл/лунка DMEM, содержащей 1 мг/л инсулина, 2 г/л гидрозилата лактальбумина, и 0,5 мг/л аскорбиновой кислоты, и планшеты возвращаются на инкубирование при 37 С, 5% СО 2. На следующее утро не содержащие сыворотки среды удаляют и заменяют 150 мкл/лунка свежих сред, не содержащих сыворотки, которые содержат +/- 20 нг/мл IL-1 бета, +/- 5 нМ дексаметазона, +/- соединение. Все условия выполняют по три раза, используя только внутренние 60 лунок 96-луночного планшета. Наружные окружающие лунки на планшете содержат по 200 мкл не содержащей сыворотки DMEM. Планшеты инкубируют при 37 С, 5% СO2. Через 24 ч после добавления IL-1 по 25 мкл образца из каждой лунки удаляют при асептических условиях для анализа продуцирования IL-8. Образцы хранятся при -20 С до момента анализа. Продуцирование IL-8 оценивается с использованием набора Quantikine ELISA для IL-8 человека отRD Systems (D8050) на образцах, разбавленных 60-кратно, в устройстве RD5P Calibrator Diluent, следуя протоколу производителей. Процент усредненного контроля IL-1 определяется по среднему для каждого из трех образцов после вычитания среднего сигнала от необработанных клеток. Значения IC50 определяются из полулогарифмических графиков процента контроля в зависимости от концентрации ингибитора. Через 72 ч после добавления IL-1 оставшиеся среды удаляются и хранятся при -20 С до момента анализа продуцирования ММР-1. Продуцирование ММР-1 оценивается с помощью набора Bio-Trak ELISA для ММР-1 от Amersham (RPN2610) на 100 мкл неразбавленного образца, следуя протоколу производителей. Процент среднего контроля IL-1 определяется по среднему из трех образцов после вычитания среднего сигнала от необработанных клеток. Значение IС 50 определяют из полулогарифмических графиков процента контроля в зависимости от концентрации ингибитора. Доказано, что дексаметазон является хорошим ингибитором для экспрессии как IL-8, так и ММР 1 (IC50=5 нМ), с положительным контролем. Примеры Пример 1. 2(3 Н)-Фенантренон, 4,4 а,9,10-тетрагидро-7-метокси-4 а-(фенилметил)-, (S)-. Раствор 48 г (143 ммоль) указанного в заголовке продукта приготовления 2 и 71 мл 1 М метоксида натрия в 100 мл метанола перемешивают при комнатной температуре в течение 15 мин, затем нагревают до 75 С в течение 3 ч. Раствор охлаждают до 0 С, добавляют по каплям 8,2 мл уксусной кислоты и раствор концентрируют до масла. Масло растворяют в EtOAc, промывают насыщенным NaHCO3 и насыщенным солевым раствором, сушат над Na2SO4, фильтруют, и выпаривают досуха. Сырой продукт очищают с помощью хроматографии на SiO2 с использованием от 15 до 35% EtOAc в гексане в качестве градиента элюента, с получением 44 г 2 (3 Н)-фенантренона, 4,4 а,9,10-тетрагидро-7-метокси-4 а- 13007483(фенилметил)-, (S)- в виде не совсем белого порошка (60% от 1-бензил-6-метокси-3,4-дигидро-1 Н-нафталин-2-он). Пекристаллизация из EtOAc/гексан дает 35 г указанного в заголовке продукта этого примера в виде белого кристаллического твердого продукта, т.пл. 101-102 С; ИК (чистый) 1667, 1500 см-1; 1 Н ЯМР(CDCl3) 1,83-1,90 (м, 1 Н), 2,02 (дт, 1 Н, J=5,5, 14), 2,27 (дт, 1 Н, J=4,3, 14) 2,44-2,51 (м, 2 Н), 2,64-2,79 (м,3 Н), 3,14 (д, 1 Н, J=13), 3,21 (д, 1 Н, J=13), 3,78 (с 3 Н), 5,96 (с, 1 Н), 6,54 (д, 1 Н, J=2,6), 6,71 (д, 2 Н, J=7,1),6,77 (дд, 1 Н, J=2,6, 8,7), 7,06-7,23 (м, 4 Н); 13 С ЯМР (100 МГц, CDCl3)30,71, 32,10, 34,62, 36,09, 43,62,46,36, 55,20, 112,78, 112,84, 125,53, 126,68, 127,96, 128,12, 130,08, 133,01, 137,24, 137,28, 157,75, 169,16,198,81; МС m/z 319(M+H)+. Анал. вычислено для С 22 Н 22 О 2: С, 82,99; Н, 6,96; N, 0. Найдено: С, 83,21; Н,7,08; N, 0,10. Пример 2. 2(3 Н)-Фенантренон, 4,4 а,9,10-тетрагидро-7-метокси-4 а-(фенилметил)-, (R)-. Указанный в заголовке продукт этого приготовления получают с использованием способа, аналогичного способу примера 1. Начиная с 3,53 г указанного в заголовке продукта приготовления 3, производят 2,78 г указанного в заголовке продукта этого примера в виде не совсем белого порошка (51% из 1 бензил-6-метокси-3,4-дигидро-1 Н-нафталин-2-он. Перекристаллизация из EtOAc/гексана дает 2,15 г указанного в заголовке продукта этого примера в виде белого кристаллического твердого продукта. Все физические постоянные являются такими же, как приведено для указанного в заголовке продукта примера 1. Аналитич. вычислено для С 22 Н 22 О 2: С, 82,99; Н, 6,96; N, 0. Найдено: С, 83,17; Н, 7,13; N, 0,10. Пример 3. 2(3 Н)-Фенантренон, 4,4 а,9,10-тетрагидро-7-гидрокси-4 а-(фенилметил)-, (S)-. К перемешиваемому раствору 40 г (0,12 6 моль) указанного в заголовке продукта примера 1 (который получают путем процедур, описанных в примере 1) и 46,5 г (0,126 моль) тетрабутиламмоний йодида в 630 мл дихлорметана при -78 С в атмосфере N2 добавляют 300 мл 1 М трихлорида бора в метиленхлориде. Полученному раствору дают возможность нагреться до комнатной температуры в течение 1,5 ч,затем выливают на избыток льда и быстро перемешивают в течение ночи. Смесь экстрагируют дихлорметаном, сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью флэшхроматографии на SiO2 с использованием от 20 до 60% EtOAc в гексане в качестве градиента элюента дает 33,3 г указанного в заголовке продукта этого примера в виде не совсем белого порошка (87%). 1 Н ЯМР (400 МГц, CD3OD)1,81-2,00 (м, 2 Н), 2,26 (дт, 1 Н, J=4,2, 13), 2,40 (дд, 1 Н, J=4,5, 18), 2,53 (ддд, 1 Н,J=l,7, 5,6, 14), 2,58-2,80 (м, 3 Н), 3,20 (д, 1 Н, J=13), 3,26 (д, 1 Н, J=13), 5,92 (с, 1 Н), 6,45 (д, 1 Н, J=2,5), 6,67(дд, 1 Н, J=2,5, 8,5), 6,76 (д, 2 Н, J=6,6), 7,05-7,14 (м, 4 Н); 13 С ЯМР (100 МГц, CD3OD)30,22, 32,03, 34,08,36,04, 43,73, 45,97, 113,76, 113,91, 124,50, 126,25, 127,49, 127,94, 129,84, 131,86, 137,0, 137,71, 155,34,171,73, 200,33; МС m/z 305(М+Н)+. Пример 4. 2(3 Н)-Фенантренон, 4,4 а,9,10-тетрагидро-7-гидрокси-4 а-(фенилметил)-, (R)-. Указанный в заголовке продукт этого примера получают с использованием способа, аналогичного способу примера 3. Исходя из 1,8 г указанного в заголовке продукта примера 2 получают 1,3 г указанного в заголовке продукта этого примера в виде белого твердого продукта (75%). Все физические постоянные являются такими же, как приведено для указанного в заголовке продукта примера 3. Пример 5. 2,7-Фенантрендиол, 2,3,4,4 а,9,10-гексагидро-4 а-(фенилметил)-2-(1-пропинил)-, (2R-цис)и 2,7-фенантрендиол, 2,3,4,4 а,9,10-гексагидро-4 а-(фенилметил)-2-(1-пропинил)-, (2S-транс)-. К перемешиваемому раствору 5 мл ТГФ, насыщенному газообразным пропином, при 0 С добавляют 4 мл 0,5 М литий диизопропиламида в ТГФ и полученную смесь перемешивают в атмосфере азота в течение 20 мин. Раствор 50 мг (0,16 ммоль) указанного в заголовке продукта примера 3 в 2 мл ТГФ добавляют по каплям и реакционную смесь нагревают до комнатной температуры и перемешивают в течение 16 ч. Добавляют насыщенный водный раствор аммоний хлорида и смесь экстрагируют EtOAc, сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью флэш-хроматографии на SiO2, с использованием от 2% ацетона в дихлорметане до 4% ацетона в дихлорметане, с 0,5% триэтиламина, в качестве градиента элюента, дает 25 мг (45%) перечисленного первым указанного в заголовке продукта этого примера (более высокий Rf) и 5 мг (9%) перечисленного вторым указанного в заголовке продукта этого примера. Физические свойства перечисленного первым указанного в заголовке продукта этого примера являются следующими: 1 Н ЯМР (400 МГц, d6 ацетон)1,67 (с, 3 Н), 1,67-1,80 (м, 2 Н), 2,00-2,22 (м, 2 Н + d6 ацетон), 2,26 (ддд, 1 Н, J=2,9, 4,2, 7,0), 2,60-2,78 (м, 3 Н), 3,01, (д, 1 Н, J=13), 3,05 (д, 1 Н, J =13), 4,30 (с, 1 Н),5,52 (с, 1 Н), 6,49 (д, 1 Н, J=2,6), 6,55 (дд, 1 Н, J=2,6, 8,5), 6,67 (д, 1 Н, J=8,5), 6,76-6,80 (м, 2 Н), 7,08-7,13 (м,3 Н), 8,06, (с, 1 Н); 13 С ЯМР (100 МГц, d6 ацетон)2,5, 31,4, 33,3, 35,6, 41,8, 46,8, 54,8, 65,8, 77,8, 83,9,113,1, 114,4, 126,0, 127,4, 127,7, 128,4, 130,6, 134,0, 137,2, 138,7, 141,1, 155,1; МС m/z 327 (М-ОН)+. Физические свойства перечисленного вторым указанного в заголовке продукта этого примера являются следующими: 1 Н ЯМР (400 МГц, d6 ацетон)1,77 (с, 3 Н), 1,77-2,30 (м, 5 Н + d6 ацетон), 2,58-2,78- 14007483 Пример 6. 2(1 Н)-Фенантренон, 3,4,4 а,9,10,10 а-гексагидро-7-гидрокси-4 а-(фенилметил)-, (4 аSтранс)-. Аммиак (1,5 л) конденсируют в круглодонной колбе при -78 С, снабженной обратным холодильником с сухим льдом, и механически перемешивают. В эту колбу добавляют 0,7 г (99 ммоль) литиевой проволоки, и раствор становится синим. Раствор 10 г (32,8 ммоль) указанного в заголовке продукта примера 3 в 400 мл 1:1 диоксана:простого эфира медленно добавляют к смеси в порядке поддержания синего цвета реакционной смеси. Когда синий цвет исчезает, к смеси добавляют небольшое количество литиевой проволоки для восстановления синего цвета. Общее количество лития, добавленного к реакционной смеси, не превышает 3,5 г (495 ммоль). После завершения добавления 10 г указанного в заголовке продукта примера 3 реакционную смесь перемешивают дополнительные 30 мин, затем добавляют 14 г твердого продукта аммоний хлорида, и наблюдается немедленное исчезновение синего цвета. К смеси добавляют Н 2O и ее экстрагируют EtOAc, сушат над Na2SO4, фильтруют и концентрируют досуха. Сырой продукт очищают с помощью флэш-хроматографии на SiO2 с использованием от 15 до 20% EtOAc в гексане в качестве градиента элюента с получением 8,16 г указанного в заголовке продукта этого примера в виде белого твердого продукта (81%). 1 Н ЯМР (400 МГц, CD3OD)1,52 (дт, 1 Н, J=4,5, 13), 1,64-1,71 (м, 1 Н),1,90-2,15 (м, 2 Н), 2,27 (ддд, 1 Н, J=2,5, 3,7, 15), 2,39 (дм, 1 Н, J=15), 2,48 (ддд, 1H, J=2,0, 6,5, 13), 2,72 (т,1H, J=14), 2,84 (д, 1H, J=13), 2,89-3,01 (м, 3 Н), 3,22 (д, 1 Н, J=13), 6,17 (д, 1 Н, J=8,5), 6,24 (дд, 1 Н, J=2,5,8,5), 6,53 (д, 1 Н, J=2,5), 6,65-6,68 (м, 1H), 7,04-7,13, (м, 3 Н); 13 С ЯМР (100 МГц, CD3OD)27,9, 33,7, 34,8,36,0, 37,6, 39,4, 43,6, 44,0, 111,3, 114,6, 125,7, 127,0, 127,9, 130,5, 133,4, 136,8, 138,0, 155,1, 212,7; MC m/z 307 (M+H)+. Пример 7. 2(1H)-Фенантренон, 3,4,4a,9,10,10 а-гексагидро-7-гидрокси-4 а-(фенилметил)-, (4 аS-цис)-. К раствору 1 г (3,6 ммоль) указанного в заголовке продукта примера 3 в 75 мл этанола и 0,27 мл 2 МKОН добавляют 0,15 г 10% Pd/C. Реакционную смесь встряхивают при давлении газообразного Н 2 45 фунт/кв.дюйм (что составляет около 3 атм) в течение 4 ч. Добавляют уксусную кислоту (0,035 мл), затем смесь фильтруют через целит, промывают целит этанолом, а затем этанол удаляют при пониженном давлении. Полученный остаток распределяют между EtOAc и насыщ. NaHCO3, экстрагируют EtOAc, сушат над Na2SO4, фильтруют и концентрируют досуха. Сырой продукт очищают с помощью флэшхроматографии на SiO2 с использованием 25% EtOAc в гексане в качестве элюента, с получением 947 мг указанного в заголовке продукта этого примера в виде белого твердого продукта (86%). 1 Н ЯМР (400 МГц, CD3OD)1,52-1,60 (м, 1 Н), 1,87 (ддд, 1 Н, J=4,8, 11, 14), 2,00-2,35 (м, 6 Н), 2,39 (дт, 1 Н, J=5,2, 14),2,69-2,92 (м, 2 Н), 2,96 (д, 1 Н, J=13), 3,00 (д, 1 Н, J=13), 6,56-6,58 (м, 2 Н), 6,88-6,92 (м, 3 Н), 7,13-7,15, (м,3 Н); 13 С ЯМР (100 МГц, CD3OD)23,7, 25,3, 34,7, 37,2, 39,6, 40,3, 42,8, 47,7, 113,1, 115,1, 127,3, 128,0,130,5, 137,2, 137,8, 155,2, 213,9; MC m/z 307 (М+Н)+. Пример 8. 2,7-Фенантрендиол, 2-(хлорэтинил)-1,2,3,4,4 а,9,10,10 а-октагидро-4 а-(фенилметил)-, [2R(2,4 а,10 а)]- и 2,7-фенантрендиол, 2-(хлорэтинил)-1,2,3,4,4 а,9,10,10 а-октагидро-4 а-(фенилметил)-, [2S(2,4 а,10 а)]-. К перемешиваемому раствору 95 мг цис-дихлорэтилена (0,98 мМ) в 5 мл ТГФ при 0 С добавляют 2,5 мл 0,5 М литийдиизопропиламида в ТГФ и полученной смеси дают возможность нагреться до комнатной температуры в течение 30 мин в атмосфере азота. Раствор 30 мг (0,098 ммоль) указанного в заголовке продукта примера 6 в 0,65 мл ТГФ добавляют по каплям и реакционную смесь перемешивают дополнительные 2 ч. Добавляют насыщенный водный раствор аммоний хлорида и смесь экстрагируютEtOAc, сушат над Na2SO4, фильтруют и концентрируют досуха. Первоначальная очистка с помощью флэш-хроматографии на SiO2 с использованием 20% EtOAc в гексане в качестве элюента дает 30 мг светло-коричневого твердого продукта. Дополнительная очистка с помощью флэш-хроматографии наSiO2 с использованием от 2 до 4% ацетона в дихлорметане в качестве градиента элюента дает 20 мг(56%) перечисленного первым указанного продукта этого примера (более высокий Rf) и 7,0 мг (19%) перечисленного вторым указанного продукта этого примера (более низкий Rf) в виде белого твердого продукта. Физические характеристики перечисленного первым указанного продукта этого примера являются следующими: т.пл. 230-232 С (разл.); 1 Н ЯМР (300 МГц, CD3OD)1,40 (мт, 1 Н, J=14), 1,64-1,70(М-ОН)+. Физические характеристики перечисленного вторым указанного продукта этого примера являются следующими: т.пл. 216-219 С (разл.) 1 Н ЯМР (400 МГц, CD3OD)1,47 (мт, 1 Н, J=14), 1,56-1,62 (м, 1 Н),1,80-2,00 (м, 5 Н), 2,08 (мт, 1 Н, J=13), 2,23 (дт, 1 Н, J=3,8, 14), 2,59 (д, 1 Н, J=13), 2,82-2,93 (м) и 2,95 (д, 1 Н,J=13), 6,08 (д, 1H, J=8,6), 6,20 (дд, 1 Н, J=2,2, 8,6), 6,50 (д, 1 Н, J=2,2), 6,54-6,56 (м, 2 Н), 7,03-7,06 (м, 3 Н); 13 С ЯМР (75 МГц, CD3OD)25,4, 28,8, 28,9, 36,0, 36,7, 40,4, 42,5, 65,1, 67,3, 75,9, 112,3, 116,1, 126,8,128,2, 128,8, 132,2, 136,3, 138,3, 139,7, 156,2; MC m/z 366 (М+Н)+, 349 (М-ОН)+.- 15007483 Пример 9. 2,7-Фенантрендиол, 1,2,3,4,4 а,9,10,10 а-октагидро-4 а-(фенилметил)-2-(1-пропинил)-, [2R(2,4 а,10 а)]- и 2,7-фенантрендиол, 1,2,3,4,4 а,9,10,10 а-октагидро-4 а-(фенилметил)-2-(1-пропинил)-,[2S-(2,4 а,10 а)]-. К перемешиваемому раствору 183 мл ТГФ, насыщенного газообразным пропином при 0 С, добавляют 143 мл 1 М литийдиизопропиламида в ТГФ, и полученную смесь перемешивают в атмосфере азота в течение 20 мин. Добавляют по каплям раствор 7,3 г (23,8 ммоль) указанного в заголовке продукта примера 6 в 250 мл ТГФ и реакционную смесь нагревают до комнатной температуры и перемешивают в течение ночи. Добавляют насыщенный водный раствор аммоний хлорида и смесь экстрагируют EtOAc,сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью флэш-хроматографии наSiO2 с использованием от 2% ацетона в дихлорметане до 4% ацетона в качестве элюента дает 4,0 г (49%) перечисленного первым указанного продукта этого примера (более высокий Rf) и 2,4 г (29%) перечисленного вторым указанного продукта этого примера в виде твердых белых продуктов. Физические характеристики перечисленного первым указанного продукта этого примера являются следующими: т.пл. 227-229 С (разл.), 1H ЯМР (400 МГц, CD3OD)1,42 (мт, 1 Н, J=14), 1,61 (ддд, 1 Н,J=3,4, 4,1, 8,8), 1,72 (с, 3 Н), 1,73-1,82 (м, 2 Н), 1,84-2,10 (м, 5 Н), 2,55 (д, 1 Н, J=13), 2,83-2,93 (м) и 2,94 (д,3 Н, J=13), 6,10 (д, 1 Н, J=8,3), 6,23 (дд, 1 Н, J=2,5, 8,4), 6,52-6,55 (м, 3 Н), 7,00-7,05 (м, 3 Н); 13 С ЯМР (62 МГц, CD3OD)2,5, 24,1, 27,3, 30,5, 35,8, 36,1, 39,1, 40,2, 42,4, 68,9, 79,5, 82,3, 110,9, 114,7, 125,4, 126,8,127,5, 130,7, 135,1, 136,9, 138,3, 154,8; MC m/z 346 (М+Н)+, 329 (М-ОН)+. Физические характеристики перечисленного вторым указанного продукта этого примера являются следующими: т.пл. 222-223 С (разл.); 1 Н ЯМР (400 МГц, CD3OD)1,46 (мт, 1 Н, J=14), 1,54-1,60 (м, 1 Н),1,83 (с) перекрывается с 1,75-1,94 (м, 8 Н), 2,08 (мт, 1 Н, J=13), 2,20 (дт, 1 Н, J=4, 14), 2,57 (д, 1 Н, J=13),2,88 (т, 2 Н, J=8,7), 2,94 (д, 1 Н, J=13), 6,08 (д, 1 Н, J=8,3), 6,20 (дд, 1 Н, J=2,4, 8,3), 6,50 (д, 1 Н, J=2,4), 6,536,56 (м, 2 Н), 7,01-7,06 (м, 3 Н); 13 С ЯМР (62 МГц, CD3OD)1,7, 24,1, 27,4, 27,6, 35,0, 35,2, 36,4, 39,0, 41,6,65,5, 76,9, 84,5, 110,8, 114,6, 125,3, 126,8, 127,4, 130,7, 135,0, 136,9, 138,4, 154,7; МС m/z 346 (М+Н)+, 329(М-ОН)+. Пример 10. 2,7-Фенантрендиол, 1,2,3,4,4 а,9,10,10 а-октагидро-4 а-(фенилметил)-2-пропил-[2R-(2,4 а,10 а)]-. Смесь 975 мг перечисленного первым указанного продукта примера 9, 195 мг 10% Pd/C и 100 мгK2 СО 3 в МеОН встряхивают при давлении Н 2 gas 40 фунт/кв.дюйм (что составляет около 2,6 атм) в течение 16 ч. Смесь фильтруют через целит и концентрируют с получением 945 мг указанного в заголовке продукта этого примера в виде белого твердого продукта. МС: 368 (М+18)+. Пример 11. Фентанал, 5-4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-4b-(фенилметил)-7-пропил-2-фенантренил]окси]-, [4bS-(4b,7,8 а)]-. К перемешиваемому раствору 157 мг указанного в заголовке соединения примера 314, ниже, в 4,8 мл диоксана и 1,2 мл Н 2O, добавляют 72 мг 4-метилморфолин-N-оксида, 0,003 мл пиридина и 0,18 мл 2,5 мас.% OsO4 в трет-бутаноле, и реакционную смесь перемешивают в течение 4 ч. К этой смеси добавляют 776 мг NaIO4 и полученную смесь перемешивают в течение ночи. Реакционную смесь выливают в Н 2O и экстрагируют EtOAc. Органический слой сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью флэш-хроматографии на SiO2 с использованием от 25 до 10% EtOAc в гексане в качестве градиента элюента дает 141 мг указанного в заголовке продукта этого примера в виде бесцветного масла. МС: 417 (М-17)+. Пример 12. 2-Фенантренол, 1,2,3,4,4 а,9,10,10 а-октагидро-7-5-(4-морфолинил)пентил]окси]-4 а-(фенилметил)-2-пропил-, [2R-(2,4a,10a)]-. К перемешиваемому раствору 34,6 мг указанного в заголовке продукта примера 11 в 1 мл АсОН добавляют 0,014 мл морфолина и 109 мг Na2SO4 и полученную смесь перемешивают в течение 15 мин. К этой смеси добавляют 24 мг NaHB(OAc)3 и полученную смесь перемешивают в течение 1,5 ч. Смесь охлаждают до 0 С и добавляют насыщ. Na2CO3 до тех пор, пока рН смеси не составит приблизительно 8-9. Реакционную смесь экстрагируют EtOAc, сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью флэш-хроматографии на SiO2 с использованием от 5% МеОН в дихлорметане до чистого МеОН в качестве элюента дает 26,6 мг указанного в заголовке продукта этого примера в виде белого твердого продукта. МС: 506 (М+1)+. Пример 13. Метансульфоновая кислота, трифтор, 4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-4b(фенилметил)-7-(1-пропинил)-2-фенантрениловый эфир, [4bS-(4b,7,8 а)]-. К перемешиваемому раствору 4,14 г перечисленного первым указанного в заголовке соединения примера 9 (которое получают с помощью процедур, описанных в примере 9), 1,95 мл 2,6-лутидина и 292 мг 4-диметиламинопиридина в 150 мл дихлорметана при -40 С в атмосфере азота добавляют 2,6 мл трифторметилсульфонового ангидрида. Полученную смесь перемешивают в течение 0,5 ч при -40 С 0,5 ч при 0 С, затем 1,5 ч при комнатной температуре. Реакционную смесь выливают в 1 н НСl и экстрагируют дихлорметаном. Органический слой промывают водой, насыщ. NаНСО 3 и насыщенным солевым раствором, сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью флэш-хроматографии на SiO2 с использованием от 15 до 20% EtOAc в гексане в качестве градиента элюента дает 4,4 г (77%) указанного в заголовке продукта этого примера в виде белого твердого продукта. 1 Н ЯМР (400 МГц,- 16007483C6D6)6,07 (д, 1 Н, J=8,4), 6,63 (д, 1 Н, J=2,5). Пример 14. 2-Фенантренкарбоновая кислота, 4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-4b-(фенилметил)-7-(1-пропинил)-, метиловый эфир, [4bS-(4b,7,8a)]-. Смесь 1,18 г указанного в заголовке продукта примера 13, 0,27 г 1,3-бис(дифенилфосфино)пропанола, 2,54 мл триэтиламина и 0,1 г палладий ацетата в 40 мл 1:1 ДМФ/МеОН встряхивают при давлении моноокиси углерода 60 фунт/кв.дюйм (что составляет около 4 атм) при 70 С в течение 4 ч. Реакционную смесь концентрируют с удалением МеОН. Смесь выливают в 1:1 гексан/EtOAc, промывают 50% насыщенным солевым раствором, сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью флэш-хроматографии на SiO2 с использованием от 23 до 28% EtOAc в гексане в качестве градиента элюента дает 0,79 г (82 %) указанного в заголовке продукта этого примера в виде белого твердого продукта. МС: 371 (М-17)+. Пример 15. 2-Фенантренкарбонитрил, 4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-4b-(фенилметил)-7(1-пропинил)-, [4bS-(4b,7,8 а)]-. Перемешиваемую смесь 1,0 г указанного в заголовке продукта примера 13, 0,4 г тетракис(трифенилфосфин)палладия(0) и 0,17 г цинк(II)цианида в 9,5 мл 1-метил-2-пирролидинона (NMP) нагревают в атмосфере азота до 90 С в течение 4 ч. Реакционную смесь выливают в насыщ. NaHCO3, фильтруют через целит и экстрагируют EtOAc. Органический слой сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью флэш-хроматографии на SiO2 с использованием от 20 до 30 % EtOAc в гексане в качестве градиента элюента дает 0,64 г (86 %) указанного в заголовке продукта этого примера в виде белого твердого продукта. МС: 338 (М-17)+. Пример 16. 2-Фенантренол, 1,2,3,4,4 а,9,10,10 а-октагидро-4 а-(фенилметил)-2-(1-пропинил)-7-(2-пиридинил)-, [2R-(2,4 а,10 а)]-. Газообразный азот барботируют через раствор 300 мг указанного в заголовке продукта примера 13,70 мг 1,1'-бис(дифенилфосфино)ферроцена и 28 мг палладий ацетата в ТГФ в течение 5 мин. В атмосфере азота раствор охлаждают до -78 С и добавляют 3,78 мл 0,5 М бром-2-пиридил цинка в ТГФ. Раствор нагревают до комнатной температуры, затем нагревают до 70 С в течение ночи. После охлаждения до комнатной температуры добавляют насыщ. NH4Cl и полученную смесь экстрагируют EtOAc, сушат надNa2SO4, фильтруют и концентрируют досуха. Очистка с помощью флэш-хроматографии на SiO2 с использованием 20% EtOAc в гексане в качестве элюента дает 173 мг (67%) указанного в заголовке продукта этого примера в виде белого твердого продукта. МС: 408 (М+1)+. Пример 17. 2-Фенантренкарбоновая кислота, 4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-4b-(фенилметил)-7-(1-пропинил)-, [4bS-(4b,7,8 а)]-. К перемешиваемому раствору 170 мг указанного в заголовке продукта примера 14 в 4 мл ТГФ добавляют 0,26 мл 2 н KОН, и полученный раствор кипятят с обратным холодильником в течение 3 дней. Добавляют дополнительные 0,75 мл 2 н KОН и смесь кипятят с обратным холодильником в течение ночи. Реакционную смесь охлаждают до комнатной температуры, разбавляют небольшим количеством воды и промывают простым диэтиловым эфиром. Водный слой подкисляют 2 н НСl и экстрагируют EtOAc. Органический слой сушат над Na2SO4, фильтруют и концентрируют досуха с получением 155 мг указанного в заголовке продукта этого примера в виде не совсем белого твердого продукта. МС: 357 (М-17)+. Пример 18. 2-Фенантренкарбоксамид, 4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-N-[3-(1 Н-имидазол 1-ил)пропил]-4b-(фенилметил)-7-(1-пропинил)-, [4bS-(4b,7,8 а)]-. К перемешиваемому раствору 1-(3-аминопропил)имидазола в 1 мл дихлорметана, при 0 С, в атмосфере N2 добавляют 0,1 мл 2,0 М триметилалюминия в гексане. Смесь перемешивают при 0 С в течение 20 мин, затем при комнатной температуре в течение 1 ч. К этой смеси добавляют 20 мг указанного в заголовке соединения примера 14 в 1 мл дихлорметана. Смесь кипятят с обратным холодильником в течение 6 ч, затем удаляют из нагревающего устройства и перемешивают при комнатной температуре в течение 3 дней. К реакционной смеси добавляют по каплям 1 н НСl до тех пор, пока рН водного слоя не станет равным приблизительно 4. Полученную смесь экстрагируют EtOAc, сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью флэш-хроматографии на SiO2 с использованием от 5% МеОН в дихлорметане до 10% МеОН в дихлорметане в качестве градиента элюента дает 22 мг (88%) указанного в заголовке продукта этого примера в виде белого твердого продукта. МС: 483 (М+1)+. Пример 19. 2-Фенантренметанол, 4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-,-диметил-4b-(фенилметил)-7-(1-пропинил)-, [4bS-(4b,7,8a)]-. К перемешиваемому раствору 100 мг указанного в заголовке соединения примера 14 в 2 мл ТГФ при 0 С в атмосфере N2 добавляют 0,77 мл 1 М метилмагний бромида в простом бутиловом эфире. Смесь перемешивают при 0 С в течение 2 ч, нагревают до комнатной температуры и перемешивают дополнительно 1 ч. К реакционной смеси добавляют 1,2 мл 1 М метилмагний бромида в простом бутиловом эфире, и полученную смесь перемешивают при комнатной температуре в течение 1 ч. Добавляют насыщ.NH4Cl, и полученную смесь экстрагируют EtOAc, сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью флэш-хроматографии на SiO2 с использованием от 20 до 30% EtOAc в гексане в качестве градиента элюента дает 80,5 мг указанного в заголовке продукта этого примера в виде белого- 17007483 твердого продукта. МС: 371 (М-17)+. Пример 20. 2-Фенантренметанол, 4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-4b-(фенилметил)-7-(1 пропинил)-, [4bS-(4b,7,8 а)]-. К перемешиваемому раствору 50 мг указанного в заголовке соединения примера 14 в 2 мл дихлорметана при -78 С в атмосфере N2 добавляют 0,39 мл 1 М диизобутилалюминий гидрида в гексане, и полученную смесь перемешивают в течение 35 мин. К реакционной смеси добавляют по каплям метанол(10 капель), а затем 2 мл насыщ. соли Rochelle. Смесь экстрагируют дихлорметаном. Органический слой промывают Н 2O и насыщенным солевым раствором, сушат над Na2SO4, фильтруют и концентрируют досуха. Полученный твердый продукт промывают небольшим количеством EtOAc с получением 18 мг указанного в заголовке продукта этого примера в виде белого твердого продукта. МС: 343 (М-17)+. Пример 21. 2-Фенантренметанол, 4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-4b-(фенилметил)-7-(1 пропинил)-, -метансульфонат, [4bS-(4b,7,8a)]-. К перемешиваемому раствору 20 мг указанного в заголовке продукта примера 20 (который получают с помощью процедур, описанных в примере 20) в 0,5 мл ТГФ при 0 С в атмосфере N2 добавляют 0,017 мл метансульфонилхлорида и 0,02 мл диизопропилэтиламина. Через 3 ч реакционную смесь разбавляют EtOAc, промывают Н 2 О и насыщенным солевым раствором, сушат над Na2SO4, фильтруют и концентрируют с получением 18 мг указанного в заголовке продукта этого примера в виде желтого твердого продукта. 1 Н ЯМР (400 МГц, C6D6)4,79 (с, 2 Н). Пример 22. 2-Фенантренол, 7-(азидометил)-1,2,3,4,4 а,9,10,10 а-октагидро-4 а-(фенилметил)-2-(1-пропинил)-, [2R-(2,4 а,10 а)]-. Указанный в заголовке продукт примера 21 (18 мг) и 20 мг натрий азида в 0,5 мл ДМФ нагревают до 100 С в атмосфере N2 в течение 3 ч. Реакционную смесь охлаждают до комнатной температуры, разбавляют EtOAc, промывают Н 2O и насыщенным солевым раствором, сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью флэш-хроматографии на SiO2 с использованием 20% EtOAc в гексане в качестве элюента дает 18 мг указанного в заголовке продукта этого примера в виде белого твердого продукта. ИК (чистый) 2098 см-1; 1H ЯМР (400 МГц, C6D6)4,24 (с, 2 Н). Пример 23. 2-Фенантренол, 7-(аминометил)-1,2,3,4,4 а,9,10,10 а-октагидро-4 а-(фенилметил)-2-(1 пропинил)-, [2R-(2,4 а,10 а)]-. К перемешиваемому раствору 18 мг указанного в заголовке продукта примера 22 в 1 мл 2:1:1 ТГФ:МеОН:Н 2O добавляют 25 мг трифенилфосфина и полученную смесь перемешивают при комнатной температуре в течение 1,5 ч. Реакционную смесь концентрируют до получения белого остатка. К этому остатку добавляют простой дизтиловый эфир, и полученную смесь экстрагируют 1 н НСl. Водный слой доводят до значения рН, большего чем 10, с помощью добавления 15% NaOH, экстрагируют EtOAc, сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью флэш-хроматографии на SiO2 с использованием от 5 до 50% МеОН в дихлорметане с 1% триэтиламина в качестве градиента элюента дает 10 мг указанного в заголовке продукта этого примера в виде белого твердого продукта. МС: 360(М+1)+. Пример 24. 2-Фенантренол, 1,2,3,4,4 а,9,10,10 а-октагидро-4 а-(фенилметил)-2-(1-пропинил)-7-(1 Нтетразол-5-ил)-, [2R-(2,4 а,10 а)]-. К перемешиваемому раствору 42 мг указанного в заголовке соединения примера 15 в 1 мл толуола в атмосфере N2 добавляют 4,7 г дибутилолово оксида и 0,032 мл триметилсилил азида. Полученную смесь перемешивают при 90 С в течение 7 дней, затем при комнатной температуре в течение 7 дополнительных дней. Реакционную смесь концентрируют в вакууме, растворяют в МеОН, и концентрируют в вакууме. Остаток растворяют в EtOAc, промывают насыщ. NаНСО 3, сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью флэш-хроматографии на SiO2 с использованием 10% МеОН в дихлорметане в качестве элюента дает 4 мг указанного в заголовке продукта этого примера в виде белого твердого продукта. МС: 399 (М+1)+. Пример 25. 2-Фенантренкарбоксамид, 4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-N-метокси-N-метил 4b-(фенилметил)-7-(1-пропинил)-, [4bS-(4b,7,8a)]-. К перемешиваемому раствору 168 мг указанного в заголовке соединения примера 17 (который получают с помощью процедур, описанных в примере 17) в дихлорметане добавляют последовательно 53 мгN,O-диметилгидроксиламин гидрохлорида, 172 мг 1-(3-диметиламинопропил)-3-этилкарбодиимидгидрохлорида, 121 мг гидроксибензотриазол гидрата и 110 мг 4-диметиламинопиридина при комнатной температуре в атмосфере N2. Полученную смесь перемешивают при комнатной температуре в течение ночи,выливают в 2 н НСl и экстрагируют EtOAc. Органический слой промывают последовательно 2 н НСl,Н 2O и насыщ. NaHCO3, сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью флэш-хроматографии на SiO2 с использованием 3% МеОН в дихлорметане в качестве элюента дает 134 мг (71%) указанного в заголовке продукта этого примера в виде бесцветного масла. МС: 418 (М+1)+. Пример 26. 1-Пропанон, 1-[4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-4b-(фенилметил)-7-(1-пропинил)-2-фенантренил]-, [4bS-(4b,7,8a)]-. К перемешиваемому раствору 119 мг указанного в заголовке продукта примера 25 в 1,5 мл ТГФ при-78 С в атмосфере N2 добавляют 0,8 6 мл 1 М этилмагний бромида в ТГФ. Реакционную смесь перемешивают при -78 С в течение 1 ч при 0 С в течение 2 ч, затем при комнатной температуре в течение 2 ч. Реакционную смесь выливают в 5% НСl в EtOH и перемешивают в течение 5 мин. Полученную смесь выливают в насыщенный солевой раствор и экстрагируют EtOAc. Органический слой сушат над Na2SO4,фильтруют и концентрируют досуха. Очистка с помощью флэш-хроматографии на SiO2 с использованием от 15 до 20% EtOAc в гексане в качестве градиента элюента дает 49,5 мг (48%) указанного в заголовке продукта этого примера в виде белого твердого продукта. МС: 387 (М+1)+. Пример 27. 2-Фенантренметанол, -этил-4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-4b-(фенилметил)7-(1-пропинил)-, [4bS-(4b,7,8 а)]-. К перемешиваемому раствору 32,3 мг указанного в заголовке продукта примера 26 в 0,8 мл МеОН добавляют 3,2 мг NаВH4 и полученную смесь перемешивают при комнатной температуре в течение 2 дней. Дополнительно добавляют 2 мг NaBH4 и реакционную смесь кипятят с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры добавляют Н 2O, и смесь концентрируют в вакууме с удалением МеОН. Полученную смесь экстрагируют EtOAc, сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью флэш-хроматографии на SiO2 с использованием 15% EtOAc в гексане в качестве элюента дает 24 мг указанного в заголовке продукта этого примера в виде бесцветного масла. МС: 371 (М-17)+. Пример 28. Карбаминовая кислота, [4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-4b-(фенилметил)-7-(1 пропинил)-2-фенантренил]-, 1,1-диметилэтиловый эфир, (4bS-(4b,7,8a)]-. Раствор 124 мг указанного в заголовке соединения примера 17, 91 мг дифенилфосфорилазида и 0,046 мл тризтиламина в 1 мл трет-бутанола кипятят с обратным холодильником в течение 16 ч. Раствор концентрируют в вакууме и полученный остаток растворяют в EtOAc. Раствор EtOAc промывают 5% лимонной кислотой, Н 2 О, насыщ. NаНСО 3 и насыщенным солевым раствором, сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью флэш-хроматографии на SiO2 с использованием от 30 до 50% EtOAc в гексане в качестве градиента элюента дает 34,1 мг указанного в заголовке продукта этого примера в виде белого твердого продукта. МС: 328 (М-17)+. Пример 29. 2-Фенантренол, 7-амино-1,2,3,4,4 а,9,10,10 а-октагидро-4 а-(фенилметил)-2-(1-пропинил)-,[2R-(2,4 а,10 а]-. К перемешиваемому раствору 20 мг указанного в заголовке продукта примера 28 в 0,5 мл дихлорметана добавляют 0,07 мл трифторуксусной кислоты. Раствор перемешивают при комнатной температуре в течение приблизительно 1,5 ч. К раствору добавляют насыщ. NаНСО 3. Полученную смесь экстрагируют EtOAc, промывают насыщенным солевым раствором, сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью флэш-хроматографии на SiO2 с использованием 20% EtOAc в гексане в качестве элюента дает 7,5 мг указанного в заголовке продукта этого примера в виде белого твердого продукта. МС: 328 (М+1)+. Пример 30. 2-Фенантренкарбоксамид, 4b-(2,3-дигидроксипропил)-4b,5,6,7,8,8 а,9,10-октагидро-7 гидрокси-7-(1-пропинил)-, [4bS-(4b,7,8a)]-. К перемешиваемой суспензии 303 мг 2-фенантренкарбоксамида, 4b,5,6,7,8,8 а,9,10-октагидро-7 гидрокси-4b-(2-пропенил)-7-(1-пропинил)-, [4bS-(4b,7,8 а)] в 13,5 мл диоксана и 3,3 мл Н 2O добавляют 186 мг 4-метилморфолин-N-оксида, 0,008 мл пиридина, и 0,47 мл 2,5 мас.% OsO4 в трет-бутаноле, и смесь перемешивают при комнатной температуре в течение ночи. К этой смеси добавляют 1:1 насыщ.NaHCO3 и насыщ. NaHSO3. Полученную смесь экстрагируют EtOAc, сушат над Na2SO4, фильтруют и концентрируют с получением 292 мг указанного в заголовке продукта этого примера в виде белого твердого продукта. МС: 358 (М+1)+. Пример 31. 2-Фенантренкарбоксамид, 4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-4b-[(2-оксо-1,3-диоксолан-4-ил)метил]-7-(1-пропинил)-, [4bS-(4b,7,8 а)]-. К перемешиваемому раствору 90 мг указанного в заголовке продукта примера 30 в дихлорметане при 0 С в атмосфере N2 добавляют 45 мг карбонилдиимидазола. Реакционную смесь нагревают до комнатной температуры и перемешивают в течение 3 ч. Смесь концентрируют досуха и очищают с помощью флэш-хроматографии на SiO2 с использованием от 3 до 5%МеОН в дихлорметане в качестве градиента элюента с получением 46 мг указанного в заголовке продукта этого примера в виде белого твердого продукта. МС: 384 (М+1)+. Пример 32. 4 а(2 Н)-Фенантренацетальдегид, 2-(хлорэтинил)-1,3,4,9,10,10 а-гексагидро-2,7-дигидрокси-, [2R-(2,4 а,10 а)]-. К перемешиваемому раствору 1,77 г указанного в заголовке соединения примера 172, ниже, в 100 мл диоксана и 25 мл Н 2O добавляют 1,11 г 4-метилморфолин-N-оксида, 0,04 5 мл пиридина и 2,8 мл 2,5 мас.% OsO4 в трет-бутаноле, и реакционную смесь перемешивают в течение 6 ч. К этой смеси добавляют 12 г NaIO4, и полученную смесь перемешивают в течение ночи. Реакционную смесь выливают в Н 2O и экстрагируют EtOAc. Органический слой сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью флэш-хроматографии на SiO2 с использованием 30% EtOAc в гексане в качестве элюента дает 1,04 г указанного в заголовке продукта этого примера в виде белого твердого продукта. 1 Н ЯМР(400 МГц, D6-ацетон)4,8 (с, 2 Н). Пример 33. 2,7-Фенантрендиол, 2-(хлорэтинил)-1,2,3,4,4 а,9,10,10 а-октагидро-4 а-[2-(1-пиперидинил) этил]-, [2R-(2,4 а,10 а)]-. К перемешиваемому раствору 100 мг указанного в заголовке продукта примера 32 в 1,5 мл АсОН добавляют 0,062 мл пиперидина и 44 6 мг Na2SO4 и полученную смесь перемешивают в течение 15 мин. К этой смеси добавляют 100 мг NaHB(OAc)3 двумя частями и полученную смесь перемешивают в течение 1,5 ч. Смесь охлаждают до 0 С и добавляют насыщ. Na2CO3 до тех пор, пока рН смеси станет приблизительно 8-9. Реакционную смесь экстрагируют EtOAc, сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью флэш-хроматографии на SiO2 с использованием от 5% МеОН в дихлорметане до чистого МеОН в качестве градиента элюента дает 95 мг указанного в заголовке продукта этого примера в виде белого твердого продукта. МС: 388 (М+1)+. Пример 34. 4 а(2 Н)-Фенантренацетальдегид, 2-(хлорэтинил)-1,3,4,9,10,10 а-гексагидро-2,7-дигидрокси-, оксим, [2R-[2,4a,10 а-. К перемешиваемому раствору 150 мг указанного в заголовке продукта примера 32 в 6 мл МеОН добавляют 147 мг KНСО 3 и 141 мг гидроксиламин гидрохлорида. Реакционную смесь кипятят с обратным холодильником в течение 3 ч, затем охлаждают до комнатной температуры и концентрируют досуха. Очистка с помощью флэш-хроматографии на SiO2 с использованием от 5 до 8% МеОН в дихлорметане в качестве градиента элюента дает 64 мг указанного в заголовке продукта этого примера в виде белого твердого продукта. МС: 316 (М-17)+. Пример 35. 2,7-Фенантрендиол, 2-(хлорэтинил)-1,2,3,4,4 а,9,10,10 а-октагидро-4 а-(3-фенил-2-пропенил)-, [2R-[2,4 а(Е),10 а-. К перемешиваемому раствору 410 мг диэтилбензилфосфоната в 5 мл ТГФ при -78 С в атмосфере N2 добавляют 0,65 мл 2,5 М бутиллития в гексане. Реакционную смесь нагревают до 0 С и перемешивают в течение 1 ч. К реакционной смеси добавляют 104 мг указанного в заголовке продукта примера 32 в 2 мл ТГФ, и смесь перемешивают дополнительно в течение 3,5 ч. Реакционную смесь выливают в насыщ.NH4Cl, экстрагируют EtOAc, сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью флэш-хроматографии на SiO2 с использованием от 10 до 20% EtOAc в гексане в качестве градиента элюента дает 60 мг указанного в заголовке продукта этого примера в виде белого твердого продукта. МС: 375 (М-17)+. Пример 36. 2-Бутеновая кислота, 4-[2-(хлорэтинил)-1,3,4,9,10,10 а-гексагидро-2,7-дигидрокси 4 а(2 Н)-фенантренил]-, [2R-[2,4a(E),10 а-. К перемешиваемому раствору 2,2 г указанного в заголовке соединения примера 183, ниже, в 40 мл ТГФ добавляют 11 мл 2 н KОН, и полученный раствор кипятят с обратным холодильником в течение 4 ч. Реакционную смесь охлаждают до комнатной температуры, разбавляют малым количеством воды и промывают простым диэтиловым эфиром. Водный слой подкисляют 2 н НСl и экстрагируют EtOAc, сушат над Na2SO4, фильтруют и концентрируют досуха с получением 1,55 г указанного в заголовке продукта этого примера в виде не совсем белого твердого продукта. 1 Н ЯМР (400 МГц, CD3OD)5,66 (д, 1 Н,J=15), 6,67-6,80 (м, 1 Н). Пример 37. Пирролидин, 1-[4-[2-(хлорэтинил)-1,3,4,9,10,10 а-гексагидро-2,7-дигидрокси-4 а(2 Н)-фенантренил]-1-оксо-2-бутенил]-, [2R-[2,4a(E),10 а-.N, являются пирролидинилом), обращаясь к схеме F. К перемешиваемому раствору 168 мг указанного в заголовке продукта примера 36 в дихлорметане добавляют последовательно 0,67 мл пирролидина, 140 мг дициклогексилкарбодиимида, 91 мг гидроксибензотриазол гидрата и 10 мг 4-диметиламинопиридина при комнатной температуре в атмосфере N2. Полученную смесь перемешивают при комнатной температуре в течение ночи. Смесь разбавляют МеОН,фильтруют через целит и концентрируют досуха. Очистка с помощью флэш-хроматографии на SiO2 с использованием 90% ацетонитрила и 10% дихлорметана с содержанием от 0,5 до 1% Н 2O в качестве градиента элюента дает 90 мг указанного в заголовке продукта этого примера в виде белого твердого продукта. МС: 414 (М+1)+. Пример 38. 4 Н-Бензо[а]хинолизин-4-он, 1,2,3,6,7,11b-гексагидро-9-гидрокси-11b-(фенилметил)-. Раствор 973 мг 2-(3-гидроксифенил)этиламин гидробромида и 920 мг 5-оксо-6-фенилгексановой кислоты в 3 мл изопропанола нагревают до 210 С открытым на воздухе в течение 5 ч. Полученный остаток очищают с помощью флэш-хроматографии на SiO2 с использованием от 5% МеОН в дихлорметане до 20% МеОН в дихлорметане в качестве градиента элюента, с получением 774 мг (56%) указанного в заголовке продукта этого примера в виде не совсем белого твердого продукта. МС: 307 (М+1)+. Пример 39. 4 Н-Бензо[а]хинолизин-4-он, 1,2,3,6,7,11b-гексагидро-9-(фенилметокси)-11b-(фенилметил)-. К перемешиваемому раствору 770 мг указанного в заголовке продукта примера 38 в ДМФ добавляют сначала 3 мл 1 М трет-бутоксида калия в трет-бутаноле, а затем 0,35 мл бензилбромида. Реакционную смесь нагревают до 60 С в течение 2 ч. Смесь охлаждают до комнатной температуры и добавляют 1 н- 20007483 НСl. Полученную смесь экстрагируют EtOAc, сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью флэш-хроматографии на SiO2 с использованием от 60% EtOAc в гексане до 100%EtOAc в качестве градиента элюента дает 797 мг (80%) указанного в заголовке продукта этого примера в виде не совсем белого твердого продукта. МС: 398 (М+1)+. Пример 40. 2 Н-Бензо[а]хинолизин-3-карбоновая кислота, 1,3,4,6,7,11b-гексагидро-4-оксо-9(фенилметокси)-11b-(фенилметил)-3-пропил-, метиловый эфир, (3-цис)-. К перемешиваемому раствору 0,61 мл диизопропиламина в 9 мл ТГФ при 0 С в атмосфере N2 добавляют 1,7 5 мл 2,5 М н-бутиллития в гексане. Полученный раствор перемешивают в течение 10 мин при 0 С, затем охлаждают до -78 С. К этому раствору по каплям добавляют 790 мг указанного в заголовке продукта примера 39 в 10 мл ТГФ в течение 30 мин. Полученный раствор перемешивают при -78 С в течение 30 мин, нагревают до 0 С в течение 2 ч, затем охлаждают до -78 С. К этому раствору добавляют 0,17 мл метилхлорформиата. Полученную смесь перемешивают в течение 30 мин при -78 С, затем нагревают до комнатной температуры и перемешивают в течение 1 ч. К реакционной смеси добавляют 0,42 мл пропилйодида, и полученную смесь перемешивают при 0 С в течение 1 ч, затем нагревают до комнатной температуры в течение 14 ч. К реакционной смеси добавляют дополнительно 0,5 мл пропилйодида, и полученную смесь нагревают до 55 С в течение 4 ч. Смесь выливают в EtOAc и промывают 1 н НСl,Н 2O, насыщ. NаНСО 3 и насыщенным солевым раствором. Органический раствор сушат над Na2SO4,фильтруют и концентрируют досуха. Очистка с помощью флэш-хроматографии на SiO2 с использованием 40% EtOAc в гексане в качестве элюента дает 768 мг (78%) указанного в заголовке продукта этого примера в виде не совсем белого твердого продукта. МС: 498 (М+1)+. Пример 41. 2 Н-Бензо[а]хинолизин-3-метанол, 1,3,4,6,7,11b-гексагидро-9-(фенилметокси)-11b-(фенилметил)-3-пропил-, (3-цис)-. К перемешиваемому раствору 50 мг указанного в заголовке продукта примера 40 в 1 мл ТГФ добавляют 3 мл 1,0 М литийалюминий гидрида в ТГФ. Реакционную смесь кипятят с обратным холодильником в атмосфере N2 в течение ночи. Смесь охлаждают до 0 С и медленно и постепенно добавляют к реакционной смеси с перемешиванием 0,12 мл Н 2O, 0,12 мл 15% NaOH и 0,36 мл Н 2O. Через 5 мин быстро перемешивают, смесь фильтруют через целит и концентрируют досуха. Очистка с помощью флэшхроматографии на SiO2 с использованием от 3% МеОН в дихлорметане до 10% МеОН в дихлорметане в качестве градиента элюента дает 36 мг (79%) указанного в заголовке продукта этого примера в виде белого твердого продукта. МС: 456 (М+1)+. Пример 42. 2 Н-Бензо[а]хинолизин-3-метанол, 1,3,4,6,7,11b-гексагидро-9-гидрокси-11b-(фенилметил)3-пропил-, (3-цис)-. К перемешиваемому раствору 31 мг указанного в заголовке продукта примера 41 в дихлорметане при -78 С в атмосфере N2 добавляют 0,05 мл ВВr3, и реакционной смеси дают возможность нагреться до комнатной температуры. Реакционную смесь охлаждают до -78 С и по каплям добавляют МеОН для гашения реакции. Смесь концентрируют досуха, растворяют в МеОН и концентрируют досуха. Очистка с помощью флэш-хроматографии на SiO2 с использованием от 5% МеОН в дихлорметане с содержанием от 0,1% триэтиламина до 10% МеОН в дихлорметане с 0,1% триэтиламина в качестве градиента элюента дает белый твердый продукт. Этот твердый продукт распределяют между EtOAc и насыщ. NаНСО 3. СлойEtOAc сушат над Na2SO4, фильтруют и концентрируют с получением 10 мг указанного в заголовке продукта этого примера в виде белого твердого продукта. 1 Н ЯМР (400 МГц, CD3OD)2,45 (д, 1 Н, J=12),2,66 (д, 1 Н, J=12). Пример 43. 2 Н-Бензо[а]хинолизин-3-карбоновая кислота, 1,3,4,6,7,11b-гексагидро-9-гидрокси-4 оксо-11b-(фенилметил)-3-пропил-, метиловый эфир, (3-цис)-. Смесь 50 мг указанного в заголовке продукта примера 40, 63 мг аммоний формиата и 20 мг 20% палладий гидроксида на угле в 5 мл МеОН кипятят с обратным холодильником в течение 3 ч. Смесь охлаждают до комнатной температуры, фильтруют через целит и концентрируют досуха. Очистка с помощью флэш-хроматографии на SiO2 с использованием 50% EtOAc в гексане в качестве элюента дает 41 мг указанного в заголовке продукта этого примера в виде белого твердого продукта. МС: 408 (М+1)+. Пример 44. 4 Н-Бензо[а]хинолизин-4-он, 1,2,3,6,7,11b-гексагидро-3-(гидроксиметил)-9-(фенилметокси)-11b-(фенилметил)-3-пропил-, (3-цис)-. К перемешиваемому раствору 50 мг указанного в заголовке продукта примера 40 в 5 мл ТГФ в атмосфере N2 добавляют 10 мг боргидрида лития. Полученную смесь перемешивают в течение 2 ч при комнатной температуре, затем нагревают до 40 С и перемешивают дополнительные 2 ч. После охлаждения до комнатной температуры добавляют насыщ. аммоний хлорид и смесь экстрагируют EtOAc. Раствор EtOAc сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью флэшхроматографии на SiO2 с использованием от 40 до 80% EtOAc в гексане в качестве градиента элюента дает 17 мг указанного в заголовке продукта этого примера в виде белого твердого продукта. МС: 470(М+1)+. Пример 45. 2(1 Н)-Фенантренон, 7-(ацетилокси)-3,4,4 а,9,10,10 а-гексагидро-4 а-(фенилметил)-, (4 аS-транс)-. К перемешиваемому раствору 54 мг указанного в заголовке соединения примера 6 в 2 мл дихлорметана добавляют 0,037 мл триэтиламина и 0,015 мл ацетилхлорида и полученную смесь перемешивают в- 21007483 течение ночи. Смесь выливают в 1 н НСl и экстрагируют дихлорметаном. Раствор дихлорметана сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью флэш-хроматографии на SiO2 с использованием 20% EtOAc в гексане в качестве элюента дает 55 мг указанного в заголовке продукта этого примера. 1 Н ЯМР (400 МГц, CDCl3)2,27 (с, 3 Н). Пример 46. 1 Н-Бенз[е]инден-2-карбоновая кислота, 7-(ацетилокси)-2,3,3 а,4,5,9b-гексагидро-9b(фенилметил)-, [2R-(2,3 а,9b)]-. К перемешиваемому раствору 50 мг указанного в заголовке продукта примера 45 в 1 мл дихлорметана добавляют 75 мг тринитрата таллия 3 Н 2O в атмосфере N2, и смесь перемешивают в течение ночи. К реакционной смеси добавляют дополнительные 75 мг тринитрата таллия 3 Н 2 О, и смесь снова перемешивают в течение ночи. Смесь фильтруют через целит и концентрируют с получением указанного в заголовке продукта этого примера в виде не совсем белого твердого продукта. МС: 363 (М-1)+. Пример 47. 1 Н-Бенз[е]инден-2-карбоновая кислота, 2,3,3 а,4,5,9b-гексагидро-7-гидрокси-9b-(фенилметил)-, метиловый эфир, [2R-(2,3a,9b)]-. Продолжая процедуру, начатую в примере 46, раствор указанного в заголовке продукта примера 46 в метаноле и каталитического количества серной кислоты кипятят с обратным холодильником, снабженным аппаратом Сосклета для экстракторной реакции, заполненным молекулярными ситами размером 3 ангстрема, в течение 4 ч. После охлаждения до комнатной температуры к раствору добавляют небольшое количество твердого продукта NaHCO3 и его концентрируют досуха. Очистка с помощью флэшхроматографии на SiO2 с использованием 20% EtOAc в гексане в качестве элюента дает 28 мг указанного в заголовке продукта этого примера. МС: 335 (М-1)+. Пример 48. 2,7-Фенантрендиол, 1,2,3,4,4 а,9,10,10 а-октагидро-4 а-(фенилметил)-2-(1 Н-1,2,4-триазол 1-илметил)-, [2R-(2,4 а,10 а)]-. Раствор 50 мг указанного в заголовке соединения примера 79, ниже, (который получают с помощью процедур, описанных в примере 79), 54 мг 1,2,4-триазола и 108 мг карбоната калия в 4 мл ДМФ нагревают до 90 С в течение 2 ч. После охлаждения до комнатной температуры добавляют насыщ. аммонийхлорид и полученную смесь экстрагируют EtOAc. Раствор EtOAc сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью флэш-хроматографии на SiO2 с использованием 5% МеОН в дихлорметане в качестве элюента дает 50 мг указанного в заголовке продукта этого примера в виде белого твердого продукта. МС: 391 (М+1)+. Пример 49. 2(1 Н)-Фенантренон, 4 а-(2-бутенил)-3,4,4 а,5,8,9,10,10 а-октагидро-7-метокси-, [4aS-[4 а(Е),10 а-. Аммиак (200 мл) конденсируют в круглодонной колбе при -78 С, снабженной обратным холодильником с сухим льдом, и механически перемешивают. В эту колбу добавляют 80 мл трет-бутанола, а затем литиевую проволоку, до тех пор, пока раствор не станет синим. Раствор 5 г 2(3 Н)-фенантренона, 4 а-(2 бутенил)-4,4 а,9,10-тетрагидро-7-метокси-, [S-(E)]- в 80 мл ТГФ медленно добавляют к смеси в порядке поддержания синего цвета реакционной смеси. Когда синий цвет исчезает, к смеси добавляют небольшое количество литиевой проволоки для восстановления синего цвета. Общее количество добавленного лития к реакционной смеси не превышает 4 г. После завершения добавления исходного соединения реакционную смесь перемешивают дополнительные 40 мин, затем добавляют 100 мл насыщ. аммоний хлорида, и наблюдается немедленное исчезновение синего цвета. К смеси добавляют Н 2O и ее экстрагируютEtOAc, сушат над Na2SO4, фильтруют и концентрируют досуха. Сырой продукт очищают с помощью флэш-хроматографии на SiO2 с использованием от 10 до 25% EtOAc в гексане в качестве градиента элюента с получением 2,0 г указанного в заголовке продукта этого примера в виде белого твердого продукта. МС: 287 (М+1)+. Пример 50. 2-Фенантренол, 4 а-(2-бутенил)-1,2,3,4,4 а,5,8,9,10,10 а-декагидро-7-метокси-2-(1-пропинил)-, [2R-[2,4 а(Е), 10 а-. К перемешиваемому раствору 200 мл ТГФ, насыщенного газообразным пропином, при 0 С добавляют 16,4 мл 2,5 М н-бутиллития в гексане, и полученную смесь перемешивают в атмосфере азота в течение 20 мин. По каплям добавляют раствор 1,96 г указанного в заголовке продукта примера 49 в 50 мл ТГФ и реакционную смесь нагревают до комнатной температуры и перемешивают в течение 40 мин. Добавляют насыщенный водный раствор аммоний хлорида и смесь экстрагируют EtOAc, сушат над Na2SO4,фильтруют и концентрируют досуха. Очистка с помощью флэш-хроматографии на SiO2 с использованием от 10 до 15% EtOAc в гексане в качестве элюента дает 879 мг указанного в заголовке продукта этого примера в виде белого твердого продукта. МС: 327 (М+1)+. Пример 51. 2(3 Н)-Фенантренон, 4b-(2-бутенил)-4,4 а,4b,5,6,7,8,8 а,9,10-декагидро-7-гидрокси-7-(1 пропинил)-, 4aR-4a,4b(Е),7,8 а- и 2(1 Н)-фенантренон, 4b-(2-бутенил)-3,4,4b,5,6,7,8,8 а,9,10 декагидро-7-гидрокси-7-(1-пропинил)-, [4bS-[4b(E),7,8 а-. Продолжая процедуры, начатые в примере 50, к перемешиваемому раствору указанного в заголовке продукта примера 50 в 20 мл ТГФ добавляют 1 мл 2 н НСl. Через 3 ч при комнатной температуре добавляют насыщ. NаНСО 3 и смесь экстрагируют EtOAc. Органический слой сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью флэш-хроматографии на SiO2 с использованием от 20 до 35% EtOAc в гексане в качестве градиента элюента дает 154 мг перечисленного вторым указанного про- 22007483 дукта этого примера в виде белого твердого продукта. МС: 313 (М+1)+. Дополнительная очистка материала с более низким Rf с помощью флэш-хроматографии на SiO2 с использованием от 3% ацетона в дихлорметане до 4% ацетона в дихлорметане в качестве градиента элюента дает 215 мг перечисленного первым указанного продукта этого примера в виде белого твердого продукта. МС: 313 (М+1)+. Пример 52. 2,7-Фенантрендиол, 1,2,3,4,4 а,9,10,10 а-октагидро-4 а-4-[(метилсульфонил)окси]фенил] метил]-2-пропил-, 7-метансульфонат, (4aS,10aS)-; и 2,7-фенантрендиол, 1,2,3,4,4 а,9,10,10 а-октагидро-4 а 4-[(метилсульфонил)окси]фенил]метил]-2-пропил-, (4aS, 10aS)-. К перемешиваемому раствору 50 мг 2,7-фенантрендиола, 1,2,3,4,4 а,9,10,10 а-октагидро-4 а-[(4-гидроксифенил)метил]-2-пропил-, (4aS,10aS)- в 0,039 мл триэтиламина и 3 мл безводного ТГФ добавляют медленно 0,011 мл MeSO2Cl при 0 С в атмосфере N2. Реакционной смеси дают возможность нагреться до комнатной температуры в течение 2 ч, затем гасят водой. Смесь экстрагируют EtOAc (х 3), промывают насыщенным солевым раствором, сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью флэш-хроматографии на SiO2 с использованием от 25 до 45% EtOAc в гексане в качестве градиента элюента дает 18 мг перечисленного вторым указанного в заголовке продукта этого примера и 35 мг перечисленного первым указанного в заголовке продукта этого примера в виде белого порошка. МСm/z 540 (М+ NH4)+. Пример 53. 1-Пиперазинкарбоксамид, N-[4-1,3,4,9,10,10 а-гексагидро-2,7-дигидрокси-2-(1-пропинил)-4 а(2 Н)-фенантренил]метил]фенил]-4-метил-, (4aS,10aR)-. К перемешиваемому раствору 97 мг карбаминовой кислоты, [4-1,3,4,9,10,10 а-гексагидро-2,7 дигидрокси-2-(1-пропинил)-4 а(2 Н)-фенантренил]метил]фенил]-, сложного 1,1-диметилэтилового эфира,[2R-(2,4 а,10 а)]- в 0,078 мл 1-метилпиперазина и 5 мл безводного ТГФ в атмосфере N2 добавляют 0,56 мл 2,5 М n-BuLi, и смесь нагревают до 65 С. Через 2 ч реакцию гасят NH4Cl (нас.), экстрагируют EtOAc(х 3), промывают насыщенным солевым раствором, сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью флэш-хроматографии на SiO2 с использованием 5% МеОН в СН 2 Сl2 в качестве элюента дает 40 мг (40%) указанного в заголовке продукта этого примера в виде белого пушистого порошка. МС m/z 472 (М-Ме)+. Пример 54. Уксусная кислота, [4-1,3,4,9,10,10 а-гексагидро-2-гидрокси-7-(2-метокси-2-оксоэтокси)2-(1-пропинил)-4 а(2 Н)-фенантренил]метил]фенокси]-, сложный метиловый эфир, [2R-(2,4 а,10 а)]-. Раствор 50 мг 2, 7-фенантрендиола, 1,2,3,4,4 а,9,10,10 а-октагидро-4 а-[(4-гидроксифенил)метил]-2-(1 пропинил)-, [2R-(2 а, 4aa,10ab)]- в 5 мл безводного CH3CN, 109,5 мг Cs2CO3 и 0,067 мл метилбромацетата перемешивают при комнатной температуре в атмосфере N2 в течение ночи. Реакцию гасят NH4Cl (нас.),экстрагируют EtOAc (х 3), промывают насыщенным солевым раствором, сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью препаративной ТСХ на SiO2 с использованием 45% EtOAc в гексане в качестве элюента дает 20 мг (28%) указанного в заголовке продукта этого примера в виде белого пушистого порошка. МС m/z 489 (М-17)+. Пример 55. Ацетамид, 2-[4-7-(2-амино-2-оксоэтокси)-1,3,4,9,10,10 а-гексагидро-2-гидрокси-2-(1 пропинил)-4 а(2 Н)-фенантренил]-метил]фенокси]-, [2R-(2,4a, 10 а)]-. Раствор 17 мг указанного в заголовке продукта примера 54 в 2 мл NH4OH (водн.), 0,5 мл толуола и 10 капель МеОН нагревают при 60 С в течение ночи. Реакцию гасят NH4Cl (нас.), экстрагируют EtOAc(х 3), промывают насыщенным солевым раствором, сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью флэш-хроматографии на SiO2 с использованием от 2% МеОН в СН 2 Сl2 до 4% МеОН в СН 2 Сl2 в качестве элюента дает 5 мг (30%) указанного в заголовке продукта этого примера в виде белого пушистого порошка. МС m/z 478 (М+Н)+. Пример 56. 2(1 Н)-Фенантренон, 4 а-3-(диметиламино)фенил]метил]-3,4,4 а,9,10,10 а-гексагидро-7 гидрокси-, (4 аS-цис)-. См. также приготовление 5, выше. Пример 57. 2,7-Фенантрендиол, 1,2,3,4,4 а,9,10,10 а-октагидро-2-(1-пропинил)-4 а-4-(4 Н-1,2,4-триазол-4-ил)фенил]метил]-, [2R-(2,4a,10 а)]-. Раствор 50 мг указанного в заголовке продукта примера 776, ниже, 20 мг диметилформамидазина и 3 мг п-толуолсульфоновой кислоты в 5 мл толуола кипятят с обратным холодильником в течение ночи. Реакцию гасят NаНСО 3 (нас.), экстрагируют EtOAc (х 3), промывают насыщенным солевым раствором,сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью флэш-хроматографии наSiO2 с использованием от 1 до 5% МеОН в CH2Cl2 в качестве элюента дает 18 мг (31%) указанного в заголовке продукта этого примера в виде белого пушистого порошка. МС m/z 398 (М-Ме)+. Пример 58. 4-Морфолинкарбоновая кислота, сложный 7-(хлорэтинил)-4b,5,6,7,8,8 а,9,10-октагидро 7-гидрокси-4b-(фенилметил)-2-фенантрениловый эфир, (4bS,8aR)-. К раствору 50 мг 2,7-фенантрендиола, 2-(хлорэтинил)-1,2,3,4,4 а,9,10,10 а-октагидро-4 а-фенилметил)-, [2S-(2,4 а,10 а)]- в 3 мл безводного ТГФ добавляют 0,019 мл триэтиламина, 1,7 мг DMAP, а затем медленно добавляют 0,020 мл 4-морфолинкарбонилхлорида при 0 С в атмосфере N2. Реакционную смесь нагревают до комнатной температуры в течение 4 ч, а затем гасят NH4Cl (нас.), экстрагируютEtOAc (х 3), промывают насыщенным солевым раствором, сушат над Na2SO4, фильтруют и концентри- 23007483 руют досуха. Очистка с помощью флэш-хроматографии на SiO2 с использованием от 2% EtOAc в гексане до 30% EtOAc в гексане в качестве градиента элюента дает 57 мг (85%) указанного в заголовке продукта этого примера в виде белого пушистого порошка. МС m/z 480 (М)+. Пример 59. Карбаминовая кислота, [2-(диметиламино)этил]-, сложный 4b-3-(диметиламино)фенил] метил]-4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-7-(1-пропинил)-2-фенантрениловый эфир, [4bS-(4b,7,8a)]-. Раствор 68 мг 2,7-фенантрендиола, 4 а-3-(диметиламино)фенил]метил]-1,2,3,4,4 а,9,10,10 аоктагидро-2-(1-пропинил)-, (4aS,10aR)- в 64 мг трифосгена, 0,03 мл триэтиламина и 2 мл безводного дихлорметана перемешивают при комнатной температуре в течение 1,5 ч в атмосфере N2. К смеси добавляют по каплям 0,099 мл N,N-диметилэтилендиамина и перемешивают в течение ночи в атмосфере N2. Реакцию гасят NH4Cl (нас.), экстрагируют EtOAc (х 3), промывают насыщенным солевым раствором, сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью флэш-хроматографии на SiO2 с использованием от 100% СНСl3 и 0,1% триэтиламина до 2% EtOH в СНСl3 и 0,1% триэтиламина в качестве градиента элюента дает 20 мг (23%) указанного в заголовке продукта этого примера в виде белого пушистого порошка. МС m/z 504 (М+Н)+. Пример 60. 2-Фенантренол, 4 а-3-(диметиламино)фенил]метил]-1,2,3,4,4 а,9,10,10 а-октагидро-7-(2 гидроксиэтокси)-2-(1-пропинил)-, [2R-(2,4 а,10 а)]-. К раствору 76 мг 2,7-фенантрендиола, 4 а-3-(диметиламино)фенил]метил]-1,2,3,4,4 а,9,10,10 а-октагидро-2-(1-пропинил)-, (4aS,10a)- в 3 мл безводного ДМФ добавляют 1,4 мг TBAI и 17 мг этиленкарбоната, и смесь нагревают до 100 С в течение 2 ч. Реакцию гасят водой, экстрагируют EtOAc (х 3), промывают насыщенным солевым раствором, сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью флэш-хроматографии на SiO2 с использованием от 5% EtOAc в гексане и 0,1% триэтиламина до 40% EtOAc в гексане и 0,1% триэтиламина в качестве градиента элюента дает 30 мг (36%) указанного в заголовке продукта этого примера в виде белого пушистого порошка. МС m/z 435 (М+Н)+. Пример 61. 2-Фенантренол, 1,2,3,4,4 а,9,10,10 а-октагидро-4 а-(фенилметил)-2-(1-пропинил)-7-[(3-пиразинил-1,2,4-оксадиазол-5-ил)метокси]-, [2R-(2,4 а,10 а)]-. К раствору 29 мг уксусной кислоты, 4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-4b-(фенилметил)-7(1-пропинил)-2-фенантренил]окси]-, сложного метилового эфира, [4bS-(4b,7,8 а)]- и 19,5 мг пиразин 2-карбоксамидоксима в 3 мл безводного ТГФ добавляют 24 мг NaH (60%) и кипятят с обратным холодильником в течение ночи. Реакционную смесь охлаждают до комнатной температуры, фильтруют и концентрируют досуха. Очистка с помощью препаративной ТСХ на SiO2 с использованием 5% МеОН в дихлорметане в качестве элюента дает 7 мг (20%) указанного в заголовке продукта этого примера. МСm/z 507 (М+Н)+. Пример 62. 2-Фенантренол, 7-[(5-амино-1 Н-1,2,4-триазол-3-ил)метокси]-1,2,3,4,4 а,9,10,10 а-октагидро-4 а-(фенилметил)-2-(1-пропинил)-, (4aS,10aR)-. К охлажденному (0 С) раствору NaOMe, приготовленному из 7 мг натрия и 1 мл безводного МеОН,добавляют 40 мг аминогуанидин нитрата. Затем 30 мг уксусной кислоты, 4b,5,6,7,8,8 а,9,10-октагидро-7 гидрокси-4b-(фенилметил)-7-(1-пропинил)-2-фенантренил]окси]-, сложный метилового эфира, [4bS(4b,7,8 а)]- в 1 мл безводного МеОН добавляют по каплям к полученной смеси и кипятят с обратным холодильником в атмосфере N2 в течение ночи. Смесь концентрируют досуха и очищают препаративной ТСХ использованием 10% МеОН в дихлорметане в качестве элюента с получением 11 мг указанного в заголовке продукта этого примера (33%) в виде белого пушистого порошка. МС m/z 443 (М+Н)+. Пример 63. Уксусная кислота, 4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-4b-(фенилметил)-7-(1-пропинил)-2-фенантренил]окси]-, [4bS-(4b,7,8a)]-. Раствор 20 мг уксусной кислоты, 4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-4b-(фенилметил)-7-(1 пропинил)-2-фенантренил]окси]-, сложного метилового эфира, [4bS-(4b,7,8 а)]- и 5,36 мг KОН в 3 мл МеОН и 0,5 мл Н 2O нагревают при 80 С в течение 4 ч. Реакционную смесь охлаждают до комнатной температуры, экстрагируют EtOAc (х 3), промывают насыщенным солевым раствором, сушат над Nа 2SO4,фильтруют и концентрируют досуха. Очистка с помощью слоя SiO2 с использованием 5% МеОН вCH2Cl2 в качестве элюента дает 18 мг (93%) указанного в заголовке продукта этого примера в виде белого пушистого порошка. МС m/z 387 (М-17)+. Пример 64. Ацетонитрил, 4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-4b-(фенилметил)-7-(1-пропинил)-2-фенантренил]окси]-, [4bS-(4b,7,8a)]-. К раствору 54 мг перечисленного первым указанного в заголовке продукта примера 8 (который получают с помощью процедур, аналогичных тем, которые описаны в примере 8) и 8 мг 60% NaH в 5 мл безводного CH3CN добавляют 0,056 мл бромацетонитрила в атмосфере N2. Реакционную смесь нагревают до 85 С в течение ночи. Реакцию гасят NH4Cl (нас.), экстрагируют EtOAc (х 3), промывают насыщенным солевым раствором, сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью флэш-хроматографии на SiO2 с использованием от 0,5% ацетона в CH2Cl2 до 1% ацетона в CH2Cl2 в качестве градиента элюента дает 46 мг (76%) указанного в заголовке продукта этого примера в виде белого пушистого порошка. МС m/z (M-17)+. Пример 65. 2-Фенантренол, 7-(2-бромэтокси)-1,2,3,4,4 а,9,10,10 а-октагидро-4 а-(фенилметил)-2-(1- 24007483 пропинил)-, [2R-(2,4a,10a)]-. К раствору 5 мг перечисленного первым указанного в заголовке продукта примера 8 и 7 мг 60%NaH в 5 мл безводного CH3CN, добавляют 0,125 мл 1,2-дибромэтана в атмосфере N2. Реакционную смесь нагревают до 85 С в течение ночи. Реакцию гасят NH4Cl (нас.), экстрагируют EtOAc (х 3), промывают насыщенным солевым раствором, сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью флэш-хроматографии на SiO2 с использованием от 2 до 20% EtOAc в гексане в качестве градиента элюента дает 29 мг (44%) указанного в заголовке продукта этого примера в виде белого пушистого порошка. МС m/z 453 (М+Н)+. Пример 66. 2-Фенантренол, 1,2,3,4,4 а,9,10,10 а-октагидро-4 а-(фенилметил)-2-(1-пропинил)-7-(1 Нтетразол-5-илметокси)-, [2R-(2, 4 а,10 а)]-.(Обращаясь к схеме В: В-7 В-10.) Раствор 0,019 мл TMSN3 и 0,067 мл Ме 3 Аl в 5 мл безводного толуола перемешивают при 0 С в атмосфере N2. К полученному раствору добавляют 43 мг указанного в заголовке продукта примера 64 в 1 мл толуола, медленно, для поддержания температуры ниже 5 С. Реакционной смеси затем дают возможность подогреться до комнатной температуры, и нагревают до 80 С в течение ночи. Реакционную смесь охлаждают до 0 С и гасят 5 мл 10% НСl и 5 мл EtOAc. Водную фазу подкисляют 1 н НСl до рН приблизительно 3 и экстрагируют EtOAc (х 3), сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью флэш-хроматографии на SiO2 с использованием от 1% МеОН в CH2Cl2 и пары капель АсОН до 10% МеОН в СН 2 Сl2 и пары капель АсОН в качестве градиента элюента дает 17 мг (36%) указанного в заголовке продукта этого примера в виде белого пушистого порошка. МС m/z 427 (М-Н)+. Пример 67. 2-Фенантренол, 1,2,3,4,4 а,9,10,10 а-октагидро-7-[2-(4-метил-1-пиперазинил)этокси]-4 а(фенилметил)-2-(1-пропинил)-, [2R-(2 а,4 а,10 а)]-. К раствору 30 мг указанного в заголовке продукта примера 65 (который получают с помощью процедур, описанных в примере 65), 8 мг безводного Na2CO3 и 12 мг NaI в 2 мл безводного ДМФ добавляют 0,015 мл 1-метилпиперазина в атмосфере N2. Реакционную смесь нагревают до 60 С в течение ночи. Реакцию гасят NaHCO3 (нас.), экстрагируют EtOAc (х 3), промывают насыщенным солевым раствором, сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью препаративной ТСХ на SiO2 с использованием 5% МеОН в метиленхлориде в качестве элюента дает 19 мг (60%) указанного в заголовке продукта этого примера в виде белого пушистого порошка. МС m/z 473 (М+Н)+. Пример 68. Этанимидамид, N-гидрокси-2-4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-4b-(фенилметил)7-(1-пропинил)-2-фенантренил]окси]-, [4bS-(4b,7,8a)]-. К раствору 30 мг указанного в заголовке продукта примера 64 и 22 мг K2 СO3 в 2 мл безводногоEtOH добавляют 8 мг NH2OHHCl и нагревают до температуры дефлегмации в течение 6 ч. Реакционную смесь затем концентрируют досуха и очищают с помощью препаративной ТСХ с использованием 5% МеОН в CH2Cl2 в качестве элюента с получением 11 мг указанного в заголовке продукта этого примера в виде белого порошка (34%). МС m/z 419 (М+Н)+. Пример 69. 2-Фенантренол, 7-5-[(диметиламино)метил]-1,2,4-оксадиазол-3-ил]метокси]-1,2,3,4,4 а,9,10,10 а-октагидро-4 а-(фенилметил)-2-(1-пропинил)-, [2R-(2,4 а,10 а)]-. Раствор 30 мг указанного в заголовке продукта примера 68 (который получают с помощью процедур, описанных в примере 68) и 3 мг 60% NaH в 3 мл безводного ТГФ нагревают до 60 С в течение 20 мин. Раствор охлаждают до комнатной температуры и добавляют к раствору 0,02 мл этил-N,Nдиметилглицина. Полученную смесь кипятят с обратным холодильником в течение 1 ч, затем охлаждают до комнатной температуры, фильтруют и концентрируют досуха. Очистка с помощью препаративной ТСХ с использованием 10% ацетона в СН 2 Сl2 и 0,05% NH4OH в качестве элюента дает 4 мг указанного в заголовке продукта этого пример (11 %). МС m/z 486 (М+Н)+. Пример 70. 1,2,4-Oксадиазол-5(2 Н)-он, 3-4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-4b-(фенилметил)7-(1-пропинил)-2-фенантренил]окси]метил]-, [4bS-(4b,7,8a)]-. К раствору 30 мг указанного в заголовке продукта примера 68 (который получают с помощью процедур, описанных в примере 68), 0,006 мл пиридина и 1 мл безводного ДМФ в 2 мл ксилола медленно добавляют 0,014 мл 2-этилгексил хлорформиата при 0 С в атмосфере N2. Затем реакционную смесь перемешивают в течение 30 мин, ее разбавляют водой, экстрагируют EtOAc (х 3), промывают насыщенным солевым раствором, сушат над Na2SO4, фильтруют и концентрируют досуха. Остаток растворяют в ксилоле и кипятят с обратным холодильником в течение 2 дней. Затем смесь концентрируют досуха и очищают с помощью препаративной ТСХ на SiO2 с использованием 5% МеОН в метиленхлориде в качестве элюента, с получением 6 мг (19%) указанного в заголовке продукта этого примера. МС m/z 443 (М-Н)+. Пример 71. 1,2,4-Oксадиазол-5(2 Н)-тион, 3-4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-4b-(фенилметил)7-(1-пропинил)-2-фенантренил]окси]метил]-, [4bS-(4b,7,8 а)]-. К раствору 20 мг указанного в заголовке продукта примера 68 (который получают с помощью процедур, описанных в примере 68) и 0,029 мл DBU в 2 мл безводного CH3CN добавляют 14 мг 1,1-тиокарбонилдиимидазола при комнатной температуре и перемешивают в течение 1,5 ч. Раствор разбавляют водой, доводят до рН приблизительно 4 с помощью 10% НСl, экстрагируют EtOAc (х 3), промывают на- 25007483 сыщенным солевым раствором, сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью препаративной ТСХ на SiO2 с использованием 5% МеОН в метиленхлориде в качестве элюента дает 12 мг (54%) указанного в заголовке продукта этого примера в виде белого пушистого порошка. МСm/z 459 (М-Н)+. Пример 72. 2-Фенантренол, 1,2,3,4,4 а,9,10,10 а-октагидро-7-5-[2-(4-морфолинил)этил]-1,2,4-оксадиазол-3-ил]метокси]-4 а-(фенилметил)-2-(1-пропинил)-, [2R-(2,4 а,10 а)]-. К раствору 30 мг указанного в заголовке продукта примера 68 (который получают с помощью процедур, описанных в примере 68) и 3 мг 60% NaH в 3 мл безводного ТГФ добавляют 0,023 мл метил 4 морфолинпропионата и нагревают до температуры дефлегмации в течение 2 ч. Раствор охлаждают,фильтруют, концентрируют досуха и очищают с помощью препаративной ТСХ с использованием 20% ацетона в СН 2 Сl2 и нескольких капель NH4OH в качестве элюента с получением 14 мг указанного в заголовке продукта этого пример (36%) в виде белого пушистого порошка. МС m/z 542 (М+Н)+. Пример 73. Карбамотиоевая кислота, диметил-, сложный S-[4b,5,6,7,8,8a,9,10-октагидро-7-гидрокси-4b-(фенилметил)-7-(1-пропинил)-2-фенантренил]эфир, [4bS-(4b,7,8 а)]-. Раствор 55 мг карбамотиовой кислоты, О-[4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-4b-(фенилметил)-7(1-пропинил)-2-фенантренил] сложного эфира, [4b,7,8 а)]- в 2 мл простого фенолового эфира кипятят с обратным холодильником в течение ночи в атмосфере N2. Раствор концентрируют досуха и очищают с помощью препаративной ТСХ с использованием 2% МеОН в CH2Cl2 в качестве элюента с получением 5 мг указанного в заголовке продукта этого примера. МС m/z 434 (М+Н)+. Пример 74. 2-Фенантренол, 1,2,3,4,4 а,9,10,10 а-октагидро-4 а-(фенилметил)-2-(1-пропинил)-7-(пиразинилокси)-, [2R-(2,4 а,10 а)]-. К раствору 30 мг перечисленного первым указанного в заголовке продукта примера 8 (который получают с помощью процедур, описанных в примере 8) и 4 мг 60% NaH в 2 мл безводного ДМФ добавляют 0,01 мл хлорпиразина при 0 С в атмосфере N2. Реакционную смесь затем нагревают до 60 С в течение 2 ч. Реакцию гасят NH4Cl (нас.), экстрагируют EtOAc (х 3), промывают насыщенным солевым раствором,сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью флэш-хроматографии на SiO2 с использованием от 2% EtOAc в гексане до 25% EtOAc в гексане в качестве градиента элюента дает 20 мг (54%) указанного в заголовке продукта этого примера в виде белого пушистого порошка. МС m/z 426 (М+2)+. Пример 75. 2-Фенантренол, 1,2,3,4,4 а,9,10,10 а-октагидро-7-2-(4-морфолинил)-4-пиримидинил]окси]-4 а-(фенилметил)-2-(1-пропинил)-, [2R-(2,4a,10 а)]-. Раствор 12 мг 2-фенантренола, 7-[(4-хлор-2-пиримидинил)окси]-1,2,3,4,4 а,9,10,10 а-октагидро-4 а(фенилметил)-2-(1-пропинил)-, [2R-(2,4 а,10 а)]- и 0,011 мл морфолина в 2 мл безводного ТГФ нагревают при 65 С в течение ночи в атмосфере N2. Реакцию гасят NH4Cl (нас.), экстрагируют EtOAc (х 3),промывают насыщенным солевым раствором, сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью препаративной ТСХ на SiO2 с использованием 50% EtOAc в гексане в качестве элюента дает 10 мг (75%) указанного в заголовке продукта этого примера в виде белого пушистого порошка. МС m/z 510 (М+Н)+. Пример 76. 2-Фенантренол, 1,2,3,4,4 а,9,10,10 а-октагидро-4 а-(фенилметил)-2-(1-пропинил)-7-(3-пиридинилметокси)-, [2R-(2,4 а,10 а)]-. К раствору 30 мг перечисленного первым указанного продукта примера 8 (который получают с помощью процедур, описанных в примере 8) и 8 мг 60% NaH в 2 мл безводного ДМФ добавляют 18 мг 3 пиколилхлорид гидрохлорида при комнатной температуре в атмосфере N2 в течение ночи. Реакцию гасятNH4 Сl (нас.), экстрагируют EtOAc (х 3), промывают насыщенным солевым раствором, сушат над Na2SO4,фильтруют и концентрируют досуха. Очистка с помощью препаративной ТСХ на SiO2 с использованием 4% МеОН в СН 2 Сl2 в качестве элюента дает 32 мг (80%) указанного в заголовке продукта этого примера в виде белого пушистого порошка. МС m/z 438 (М+Н)+. Пример 77. 2(1 Н)-Фенантренон, 3,4,4 а,9,10,10 а-гексагидро-7-гидрокси-4 а-(фенилметил)-, О-этилоксим. К раствору 150 мг перечисленного первым указанного в заголовке продукта примера 8 (который получают с помощью процедур, описанных в примере 8) и 80 мг ацетата натрия в 5 мл EtOH добавляют 96 мг О-этилгидроксиламин гидрохлорида и нагревают до 70 С в течение 30 мин. Раствор концентрируют досуха и очищают с помощью флэш-хроматографии на SiO2 с использованием от 5% EtOAc в гексане с 0,1% Et3N до 7% EtOAc в гексане, с 0,1% Et3N, в качестве градиента элюента дает 148 мг (86%) указанного в заголовке продукта этого примера в виде белого пушистого порошка. МС m/z 350 (М+Н)+. Пример 78. 2-Фенантренол, 4b,5,6,7,8,8 а,9,10-октагидро-4b-[(4-гидроксифенил)метил]-7-пропилиден-,[4bS-(4b,7Z, 8 а)]-. К раствору 170 мг пропилтрифенилфосфоний бромида в 3 мл безводного ДМСО добавляют по каплям 0,44 мл 1 М натрий бис(триметилсилан)амида в простом эфире при комнатной температуре в атмосфере N2 в течение 10 мин. К полученному раствору по каплям добавляют 35 мг указанного в заголовке продукта приготовления 17 в 1,5 мл ДМСО и смесь нагревают при 70 С в течение ночи. Реакцию гасятNH4Cl (нас.), экстрагируют EtOAc (х 3), промывают насыщенным солевым раствором, сушат над Na2SO4,- 26007483 фильтруют и концентрируют досуха. Очистка с помощью флэш-хроматографии на SiO2 с использованием от 10% EtOAc в гексане до 25% EtOAc в гексане в качестве градиента элюента дает 34 мг (89%) указанного в заголовке продукта этого примера в виде белого пушистого порошка. МС m/z 349 (М+Н)+. Пример 79. Спиро[оксиран-2,2'(1'Н)фенантрен]-7'-ол, 3',4',4'а,9',10',10'а-гексагидро-4'а-(фенилметил)-,[2'R-(2',4'a,10'a)]-. К раствору 91 мг триметил сульфониййодида в 1 мл безводного ДМФ добавляют 55 мг трет-BuOK при 0 С в атмосфере N2 и смесь перемешивают в течение 5 мин. К полученному раствору медленно добавляют 20 мг указанного в заголовке продукта примера 6 в 1 мл ДМФ и перемешивают в течение следующего 1 ч при 0 С. Реакцию гасят NH4Cl (нас.), экстрагируют EtOAc (х 3), промывают насыщенным солевым раствором, сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью флэшхроматографии на SiO2 с использованием от 100% СН 2 Сl2 до 2% ацетона в СН 2 Сl2 в качестве градиента элюента дает 13 мг (70%) указанного в заголовке продукта этого примера в виде белого пушистого порошка. МС m/z 303 (М-17)+. Пример 80. 2-Фенантренацетонитрил, 1,2,3,4,4 а,9,10,10 а-октагидро-2,7-дигидрокси-4 а-(фенилметил)-, (4aS,10aR)-, -2R-. Раствор 9 мг указанного в заголовке продукта примера 79 и 22 мг цианида калия в 1 мл этиленгликоля нагревают при 100 С в течение 2 ч. Реакционную смесь охлаждают и разбавляют водой, экстрагируют EtOAc (х 3), промывают насыщенным солевым раствором, сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью препаративной ТСХ на SiO2 с использованием 35% EtOAc в гексане в качестве элюента дает 5 мг (51%) указанного в заголовке продукта этого примера в виде белого пушистого порошка. МС m/z 330 (М-17)+. Пример 81. 2,7-Фенантрендиол, 1,2,3,4,4 а,9,10,10 а-октагидро-2-(метоксиметил)-4 а-(фенилметил)-,[2R-(2,4 а,10 а)]-. Раствор 20 мг указанного в заголовке продукта примера 79 (который получают с помощью процедур, описанных в примере 79) и 0,071 мл 25% (мас./мас.) натрий метоксида в 5 мл безводного МеОН кипятят с обратным холодильником в течение 3 ч. Реакционную смесь охлаждают и гасят NH4Cl (нас.), экстрагируют EtOAc (х 3), промывают насыщенным солевым раствором, сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью препаративной ТСХ на SiO2 с использованием 30% EtOAc в гексане в качестве элюента дает 15 мг (69%) указанного в заголовке продукта этого примера в виде белого пушистого порошка. МС m/z 335 (М-17)+. Пример 82. 2,7-Фенантрендиол, 2-(азидометил)-1,2,3,4,4 а,9,10,10 а-октагидро-4 а-(фенилметил)-, [2R(2,4 а,10 а)]-. Раствор 20 мг указанного в заголовке продукта примера 79 (который получают с помощью процедур, описанных в примере 79), 20 мг натрий азида и 17 мг NH4Cl в 0,8 мл МеОН и 0,1 мл воды кипятят с обратным холодильником в течение 3 ч. Реакционную смесь охлаждают и разбавляют NH4Cl (нас.), экстрагируют EtOAc (х 3), промывают насыщенным солевым раствором, сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью препаративной ТСХ на SiO2 с использованием 27% EtOAc в гексане в качестве элюента дает 15 мг (66%) указанного в заголовке продукта этого примера в виде белого пушистого порошка. МС m/z 348 (М-17)+. Пример 83. 2,7-Фенантрендиол, 1,2,3,4,4 а,9,10,10 а-октагидро-2-(4-морфолинилметил)-4 а-(фенилметил)-,[2R-(2,4 а,10 а)]-. Раствор 20 мг указанного в заголовке продукта примера 79 (который получают с помощью процедур, описанных в примере 79) и 0,055 мл морфилина в 1 мл безводного МеОН кипятят с обратным холодильником в течение 2 чс. Реакционную смесь охлаждают и разбавляют с NH4Cl (нас.), экстрагируютEtOAc (х 3), промывают насыщенным солевым раствором, сушат над Na2SO4, фильтруют и концентрируют досуха. Очистка с помощью препаративной ТСХ на SiO2 с использованием 5% МеОН в метиленхлориде в качестве элюента дает 14 мг (55%) указанного в заголовке продукта этого примера в виде белого пушистого порошка. МС m/z 408 (М+Н)+. Следующие соединения получают с помощью использования способов, аналогичных тем, которые описаны выше в примере 8. Пример 84. Пиперидин, 4-2-(хлорэтинил)-1,3,4,9,10,10 а-гексагидро-2,7-дигидрокси-4 а(2 Н)-фенантренил]метил]-1-(метилсульфонил)-, [2R-(2,4 а,10 а)]-, т.пл.=124-127 С. Пример 85. Пиперидин, 4-2-(хлорэтинил)-1,3,4,9,10,10 а-гексагидро-2,7-дигидрокси-4 а(2 Н)-фенантренил]метил]-1-(этилсульфонил)-, [2R-(2,4 а,10 а)]-, т.пл.=174-176 С. Пример 86. Пиперидин, 4-2-(хлорэтинил)-1,3,4,9,10,10 а-гексагидро-2,7-дигидрокси-4 а(2 Н)-фенантренил]метил]-1-(2-тиенилсульфонил)-, [2R-(2,4 а,10 а)]-, т.пл.=145-148 С. Примеры 87-90. Следующие соединения получают с помощью использования способов, аналогичных тем, которые описаны выше в примере 35.(разлаг). Пример 88. Бензойная кислота, 3-[3-[2-(хлорэтинил)-1,3,4,9,10,10 а-гексагидро-2,7-дигидрокси 4 а(2 Н)-фенантренил]-1-пропенил]-, сложный метиловый эфир, [2R-[2,4 а(Е),10 а-, т.пл.=93-95 С. Пример 89. 4-Тиазолкарбоновая кислота, 2-[3-[2-(хлорэтинил)-1,3,4,9,10,10 а-гексагидро-2,7-дигидрокси-4 а(2 Н)-фенантренил]-1-пропенил]-, сложный этиловый эфир, [2R-[2,4a(E),10 а-, МС: 472. Пример 90. 2,7-Фенантрендиол, 2-(хлорэтинил)-1,2,3,4,4 а,9,10,10 а-октагидро-4 а-[3-[4-(гидроксиметил)фенил]-2-пропенил]-, [2R-[2,4a(E),10 а-, МС: 405 (М-18)+. Пример 91. Бензойная кислота, 4-[3-[2-(хлорэтинил)-1,3,4,9,10,10 а-гексагидро-2,7-дигидрокси 4 а(2 Н)-фенантренил]-1-пропенил]-, [2R-[2,4a(E),10 а-. К перемешиваемому раствору указанного в заголовке соединения примера 87 в метаноле (9 мл) добавляют раствор гидроксида калия (250 мг) в воде (0,6 мл), и полученный раствор кипятят с обратным холодильником в течение 3 ч. Реакционной смеси дают возможность охладиться до комнатной температуры, добавляют насыщенный водный раствор аммоний хлорида и смесь экстрагируют этилацетатом(3 х). Объединенные органические слои сушат над сульфатом магния и концентрируют в вакууме с получением указанного соединения этого примера в виде не совсем белого твердого продукта, 381 мг. т.пл. 145-146 С (разлаг). Пример 92. Морфолин, 4-[4-[3-[2-(хлорэтинил)-1,3,4,9,10,10 а-гексагидро-2,7-дигидрокси-4 а(2 Н)фенантренил]-1-пропенил]бензоил]-, [2R-(2,4 а(Е), 10 а-. К перемешиваемому раствору указанного в заголовке продукта примера 91 (100 мг) и Nгидроксисукцинимида (26 мг) в диоксане (2,3 мл) при 0 С добавляют 1,3-дициклогексилкарбодиимид (47 мг) , и полученному раствору дают возможность нагреться до комнатной температуры, и перемешивают в течение 3 ч. Добавляют ацетонитрил (10 мл) и полученную суспензию фильтруют через целит. Концентрирование фильтрата дает масло (170 мг), которое медленно кристаллизуется, когда его оставляют в покое. Остаток твердого продукта и морфолин (0,08 мл) суспендируют в ацетонитриле (3,5 мл) и нагревают при 50 С в течение 3 ч. Добавляют насыщенный водный раствор аммоний хлорида, экстрагируют этилацетатом (3 х), органические слои объединяют, сушат над сульфатом натрия и концентрируют в вакууме с получением пены. Флэш-хроматография на силикагеле (1:1-3:1 этилацетат:гексан) дает указанное в заголовке соединение этого примера в виде не совсем белой пены, 60 мг. т.пл.=129-136 С, МС: 506. Примеры 93-100. Следующие стириламидные соединения получают с использованием процедур, аналогичных тем,которые описаны выше в примеры 91 и 92. Пример 93. Пиперазин, 1-[4-[3-[2-(хлорэтинил)-1,3,4,9,10,10 а-гексагидро-2,7-дигидрокси-4 а(2 Н)-фенантренил]-1-пропенил]бензоил]-4-метил-, [2R-[2,4a(E),10 а-, МС: 519. Пример 94. 4-Пиперидинол, 1-[4-[3-[2-(хлорэтинил)-1,3,4,9,10,10 а-гексагидро-2,7-дигидрокси-4 а(2 Н)фенантренил]-1-пропенил] бензоил]-, [2R-[2,4 а(Е),10 а-, МС: 520. Пример 95. Бензамид, 4-[3-[2-(хлорэтинил)-1,3,4,9,10,10 а-гексагидро-2,7-дигидрокси-4 а(2 Н)-фенантренил]-1-пропенил]-, [2R-[2,4a(Е),10 а-, МС: 436. Пример 96. Бензойная кислота, 3-[3-[2-(хлорэтинил)-1,3,4,9,10,10 а-гексагидро-2,7-дигидрокси-4 а(2 Н)фенантренил]-1-пропенил]-, [2R-[2,4a(Е),10 а-, т.пл.=101-105 С. Пример 97. Морфолин, 4-[3-[3-[2-(хлорэтинил)-1,3,4,9,10,10 а-гексагидро-2,7-дигидрокси-4 а(2 Н)-фенантренил]-1-пропенил]бензоил]-, [2R-[2,4a(E),10a-, т.пл.=135-141C. Пример 98. Пиперазин, 1-[3-[3-[2-(хлорэтинил)-1,3,4,9,10,10 а-гексагидро-2,7-дигидрокси-4 а(2 Н)фенантренил]-1-пропенил]бензоил]-4-метил-, [2R-[2,4a(E),10 а-, МС: 519. Пример 99. 4-Пиперидинол, 1-[3-[3-[2-(хлорэтинил)-1,3,4,9,10,10 а-гексагидро-2,7-дигидрокси-4 а(2 Н)фенантренил]-1-пропенил]бензоил]-, [2R-[2,4 а(Е),10 а-, МС: 520. Пример 100. Морфолин, 4-2-[3-[2-(хлорэтинил)-1,3,4,9,10,10 а-гексагидро-2,7-дигидрокси-4 а(2 Н)фенантренил]-1-пропенил]-4-тиазолил] карбонил]-, [2R-[2,4 а(Е),10 а-, МС: 513. Пример 101. 2,7-Фенантрендиол, 2-(хлорэтинил)-1,2,3,4,4 а,9,10,10 а-октагидро-4 а-[3-[4-(гидроксиметил)фенил]-2-пропенил]-, 7-ацетат, [2R-[2,4a(Е),10 а-. К перемешиваемому раствору 2,7-фенантрендиола, 2-(хлорэтинил)-1,2,3,4,4 а,9,10,10 а-октагидро-4 а[3-[4-(трет-бутилдиметилсилоксиметил)фенил]-2-пропенил]-, [2R-[2,4 а(Е),10 а- (322 мг), тетрабутиламмоний гидроксида (0,7 мг) и гидроксида натрия (60 мг) в диоксане (1 мл) при 5 С добавляют по каплям раствор ацетилхлорида (57 мг) в диоксане (1 мл). Реакционной смеси дают возможность нагреться до комнатной температуры и перемешивают в течение 2 ч. Добавляют дополнительные части ацетилхлорида (57 мг) и продолжают перемешивание дополнительные 2 ч. Реакцию гасят водным раствором аммоний хлорида, экстрагируют этилацетатом, органическую фазу сушат над сульфатом натрия и фильтрат концентрируют в вакууме. Флэш-хроматография на силикагеле (10-20% этилацетат/гексан) дает масло,91 мг. К охлажденному (0 С) перемешиваемому раствору этого масла в тетрагидрофуране (1,6 мл) добавляют 1 М раствор тетрабутиламмоний фторида в тетрагидрофуране (0,23 мл). Через 2 ч реакцию гасят- 28007483 насыщенным водным раствором аммоний хлорида, экстрагируют этилацетатом, органический слой сушат над сульфатом натрия, концентрируют, и флэш-хроматография на силикагеле (10-50% этилацетат/гексан) дает указанное соединение этого примера, 22 мг. т.пл. 73-77 С. Пример 102. 2,7-Фенантрендиол, 2-(хлорэтинил)-1,2,3,4,4 а,9,10,10 а-октагидро-4 а-[3-[4-(4-морфолинилметил)фенил]-2-пропенил]-, 7-ацетат, [2R-[2,4a(Е),10 а-. К охлажденному (0 С) перемешиваемому раствору указанного в заголовке продукта примера 101(40 мг) (который получают с помощью процедур, описанных в примере 101) в тетрагидрофуране (0,9 мл) добавляют последовательно метансульфонил хлорид (39 мг) и диизопропилэтиламин (33 мг). Через 2 ч реакционную смесь охлаждают до -78 С, добавляют морфолин (0,12 мл), и реакционному раствору дают возможность нагреться до 0 С. Через 4 ч реакцию гасят водным раствором аммоний хлорида, экстрагируют простым этиловым эфиром, сушат над сульфатом натрия и концентрируют в вакууме с получением смолы. Флэш-хроматография на силикагеле (40-75% этилацетат/гексан) дает указанное в заголовке соединение этого примера в виде бесцветной смолы, 35 мг: МС: 534. Пример 103. 2,7-Фенантрендиол, 2-(хлорэтинил)-1,2,3,4,4 а,9,10,10 а-октагидро-4 а-[3-[4-(4-морфолинилметил)фенил]-2-пропенил]-, [2R-[2,4a(Е),10 а-. К суспензии указанного в заголовке продукта примера 102 (25 мг) в метаноле (0,5 мл) и воды (0,25 мл) добавляют насыщенный водный раствор бикарбоната натрия (0,25 мл), и реакционной смеси дают возможность перемешиваться при комнатной температуре в течение 2 ч. Реакцию гасят насыщенным водным раствором аммоний хлорида, экстрагируют этилацетатом, органическую фазу сушат над сульфатом натрия и концентрируют в вакууме с получением бесцветного твердого продукта. Флэшхроматография на силикагеле (50-100% этилацетат/гексан) дает указанное в заголовке соединение этого примера в виде бесцветного твердого продукта, 15 мг: МС: 492. Примеры 104-106. Следующие аминометилзамещенные стириловые соединения получают с использованием процедур, аналогичных тем, которые описаны выше в примерах 101-103. Пример 104. 2,7-Фенантрендиол, 2-(хлорэтинил)-1,2,3,4,4 а,9,10,10 а-октагидро-4 а-[3-[4-[(4-гидрокси-1 пиперидинил)метил]фенил]-2-пропенил]-, 7-ацетат, [2R-[2,4a(E),10a-, MC: 548. Пример 105. 2,7-Фенантрендиол, 2-(хлорэтинил)-1,2,3,4,4 а,9,10,10 а-октагидро-4 а-[3-[4-[(4-гидрокси-1 пиперидинил)метил]фенил]-2-пропенил]-, [2R-[2,4a(E),10 а-, МС: 506. Пример 106. 2,7-Фенантрендиол, 2-(хлорэтинил)-4 а-[3-[4-[(диметиламино)метил]фенил]-2-пропенил]-1,2,3,4,4 а,9,10,10 а-октагидро-, [2R-[2,4a(E),10 а-, МС: 450. Пример 107. Карбаминовая кислота, диметил-, сложный 4b-[2-(4-формилфенокси)этил]-4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-7-(1-пропинил)-2-фенантрениловый эфир, [4bS-(4b,7,8 а)]-. К перемешиваемому раствору указанного в заголовке продукта приготовления 10 (1,9 г) в пиридине(50 мл) добавляют п-толуолсульфонил хлорид (2,0 г). Через 18 ч при комнатной температуре реакционный раствор распределяют между простым этиловым эфиром и 0,5 н водным раствором гидросульфата натрия, водную фазу экстрагируют дополнительным простым этиловым эфиром (2 х), объединенные органические слои сушат над сульфатом натрия, концентрируют в вакууме, и флэш-хроматография на силикагеле (50-60% этилацетат/гексан) дает бесцветную пену, 1,5 г. К раствору этого масла в диметилформамиде (9 мл) добавляют раствор п-гидроксибензальдегида (0,44 г) и калий трет-бутоксида (1M в тетрагидрофуране, 3,3 мл) в диметилформамиде (5 мл, перемешивают при температуре окружающей среды в течение 0,5 чс), и полученный раствор нагревают при 80 С в течение 4 ч. Реакционную смесь охлаждают, разбавляют простым этиловым эфиром, промывают водой, насыщенным солевым раствором, сушат над сульфатом натрия и концентрируют в вакууме. Полученное масло подвергают флэш-хроматографии с получением указанного соединения этого примера в виде бесцветной пены, 1,3 г. МС: 476 (М+1)+. Пример 108. Карбаминовая кислота, диметил-, сложный 4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-4b[2-[4-(4-орфолинилметил)фенокси]этил]-7-(1-пропинил)-2-фенантрениловый эфир, [4bS-(4b,7,8a)]-,НСl соль. Раствор указанного в заголовке продукта примера 107 (50 мг), уксусной кислоты (7 мг), морфолина(18 мг) и натрий триацетоксиборгидрида (33 мг) в 1,2-дихлорэтане (2 мл) перемешивают при комнатной температуре в течение 3 ч. Реакцию гасят насыщенным водным раствором бикарбоната натрия, экстрагируют дихлорметаном, органическую фазу сушат над сульфатом натрия и концентрируют в вакууме с получением масла. Флэш-хроматография на силикагеле (этилацетат) дает указанное в заголовке соединение этого примера в виде бесцветной пены, 50 мг. МС: 547. Примеры 109-129. Следующие примеры приготавливают с использованием процедур, аналогичных тем, которые описаны выше в примерах 107 и 108. Пример 109. Карбаминовая кислота, диметил-, сложный 4b-[2-[4-[(диметиламино)метил]фенокси] этил]-4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-7-(1-пропинил)-2-фенантрениловый эфир, [4bS-(4b,7,8a)]-,НСl соль, МС: 505.- 29007483 Пример 110. Карбаминовая кислота, диметил-, сложный 4b-[2-[4-[(этиламино)метил]фенокси]этил]4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-7-(1-пропинил)-2-фенантрениловый эфир, [4bS-(4b,7,8a)]-,НСl соль, МС: 505. Пример 111. Карбаминовая кислота, диметил-, сложный 4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-4b[2-[4-(метиламино)метил]фенокси]этил]-7-(1-пропинил)-2-фенантрениловый эфир, [4bS-(4b,7,8 а)]-,НСl соль, МС: 491. Пример 112. Карбаминовая кислота, диметил-, сложный 4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-4b[2-[4-метил(метилсульфонил)амино]метил]фенокси]этил]-7-(1-пропинил)-2-фенантрениловый эфир,[4bS-(4b,7,8a)]-, т.пл. 82-85 С. Пример 113. Карбаминовая кислота, диметил-, сложный 4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-7(1-пропинил)-4b-[2-[4-(1-пирролидинилметил)фенокси]этил]-2-фенантрениловый эфир, [4bS-(4b,7,8a)]-,НСl соль, МС: 531. Пример 114. Карбаминовая кислота, диметил-, сложный 4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-4b[2-[4-[(4-метил-1-пиперазинил)метил]фенокси]этил]-7-(1-пропинил)-2-фенантрениловый эфир, [4bS(4b,7,8a)]-, НСl соль, МС: 560. Пример 115. Карбаминовая кислота, диметил-, сложный 4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-4b[2-[4-метил(1-метил-4-пиперидинил)амино]метил]фенокси]этил]-7-(1-пропинил)-2-фенантрениловый эфир, [4bS-(4b,7,8 а)]-, НСl соль, МС: 588. Пример 116. Карбаминовая кислота, диметил-, сложный 4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-4b[2-[4-(2-метоксиэтил)амино]метил]фенокси]этил]-7-(1-пропинил)-2-фенантрениловый эфир,[4bS(4b,7,8a]-, HCl соль, МС: 535. Пример 117. Карбаминовая кислота, диметил-, сложный 4b-[2-[4-2-(диметиламино)этил]амино] метил]фенокси]этил]-4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-7-(1-пропинил)-2-фенантрениловый эфир,[4bS-(4b,7,8a)]-, НСl соль, МС: 548. Пример 118. Карбаминовая кислота, диметил-, сложный 4b-[2-[4-2-(диметиламино)этил]метиламино]метил]фенокси]этил]-4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-7-(1-пропинил)-2-фенантрениловый эфир, [4bS-(4b,7,8 а)]-, НСl соль, МС: 562. Пример 119. Карбаминовая кислота, диметил-, сложный 4b-[2-[4-[(диэтиламино)метил]фенокси] этил]-4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-7-(1-пропинил)-2-фенантрениловый эфир, [4bS-(4ba,7a,8ap)]-,НСl соль, МС: 533. Пример 120. Карбаминовая кислота, диметил-, сложный 4b-[2-[4-[(циклопропиламино]метил] фенокси]этил]-4b,5,6,7,8,8 а,8,10-октагидро-7-гидрокси-7-(1-пропинил)-2-фенантрениловый эфир, [4bS(4b,7,8 а)]-, НСl соль, МС: 517. Пример 121. Карбаминовая кислота, диметил-, сложный 4b-[2-[4-бис(2-метоксиэтил)амино]метил] фенокси]этил]-4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-7-(1-пропинил)-2-фенантрениловый эфир, [4bS(4b,7,8a)]-, НСl соль, МС: 593. Пример 122. 2,7-Фенантрендиол, 2-(хлорэтинил)-1,2,3,4,4 а,9,10,10 а-октагидро-4 а-[2-[4-(4-морфолинилметил)фенокси]этил]-, [2R-(2,4a,10a)]-, МС: 496. Пример 123. Карбаминовая кислота, диметил-, сложный 7-(хлорэтинил)-4b,5,6,7,8,8 а,9,10-октагидро 7-гидрокси-4b-[2-[4-(4-морфолинилметил)фенокси]этил]-2-фенантрениловый эфир, [4bS-(4b,7,8 а)]-,НСl соль, МС: 567. Пример 124. 2,7-Фенантрендиол, 2-(хлорэтинил)-4 а-[2-[4-[(диметиламино)метил]фенокси]этил]-1,2,3,4,4 а,9,10,10 а-октагидро-, [2R-(2,4 а,10 а)]-, МС: 454. Пример 125. Карбаминовая кислота, диметил-, сложный 7-(хлорэтинил)-4b-[2[4-[(диметиламино) метил]фенокси]этил]-4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-2-фенантрениловый эфир, [4bS-(4b,7,8a)]-, НСl соль, МС: 525. Пример 126. Сульфаминовая кислота, диметил-, сложный 7-(хлорэтинил)-4b-[2-[4-[(диметиламино] метил]феноксиэтил]-4b,5,6,7,8,8 а,9,10-октагидро-7-гидрокси-2-фенантрениловый эфир, [4bS-(4b,7,8a)]-,НСl соль, МС: 561. Пример 127. 2,7-Фенантрендиол, 2-(хлорэтинил)-1,2,3,4,4 а,9,10,10 а-октагидро-4 а-[2-[4-(гидроксиметил)фенокси]этил]-, [2R-(2,4 а,10 а)]-, т.пл.=179-186 С. Пример 128. Бензальдегид, 4-[2-[2-(хлорэтинил)-1,3,4,9,10,10 а-гексагидро-2,7-дигидрокси-4 а(2 Н)фенантренил]этокси]-, [2R-(2,4 а,10 а)]-, МС: 407 (М-18)+. Пример 129. 2,7-Фенантрендиол, 2-(хлорэтинил)-1,2,3,4,4 а,9,10,10 а-октагидро-4 а-(2-феноксиэтил)-,[2R-(2,4 а,10 а)]-, МС: 379. Пример 130. Нафто[1,2-d]тиазол-7-ол, 2-амино-7-(хлорэтинил)-4,5,5 а,6,7,8,9,9 а-октагидро-9 а-(фенилметил)-, [5aR,S-(5a,7,9 а)]-. Раствор указанного в заголовке продукта приготовления 14 (46 мг) и тиомочевины (22 мг) в ацетонитриле (2 мл) нагревают при температуре дефлегмации в течение 8 ч. Реакционную смесь концентрируют в вакууме, распределяют между насыщ. водным раствором бикарбоната натрия и хлороформом,- 30
МПК / Метки
МПК: A61K 31/325, C07C 271/44, A61K 31/05, C07D 213/30, C07C 35/42, A61K 31/122, A61K 31/4409, A61K 31/4402, C07C 49/675, A61K 31/4406, C07D 213/40
Метки: лекарственного, применение, получении, агониста, рецепторов, модулятора, глюкокортикоидов, средства
Код ссылки
<a href="https://eas.patents.su/30-7483-primenenie-modulyatora-receptorov-glyukokortikoidov-i-agonista-receptorov-glyukokortikoidov-pri-poluchenii-lekarstvennogo-sredstva.html" rel="bookmark" title="База патентов Евразийского Союза">Применение модулятора рецепторов глюкокортикоидов и агониста рецепторов глюкокортикоидов при получении лекарственного средства</a>
Предыдущий патент: Способ реализации виртуальных локальных вычислительных сетей в системах связи по электрической сети
Следующий патент: Соединения и способы лечения или предупреждения инфекций flavivirus
Случайный патент: Кристалл диуридин тетрафосфата или его соли и способ его получения и способ получения указанного соединения


































