Противоопухолевые соединения, активируемые протеином активации фибробластов (fap)
Номер патента: 5204
Опубликовано: 30.12.2004
Авторы: Гарин-Чеса Пилар, Реттиг Вольфганг Й., Петерс Штефан, Лайперт Дитмар, Лентер Мартин, Парк Джон Эдуард, Макк Юрген, Файрстоун Раймонд Арманд, Телан Лейла А.
Формула / Реферат
1. Соединение формулы (I)
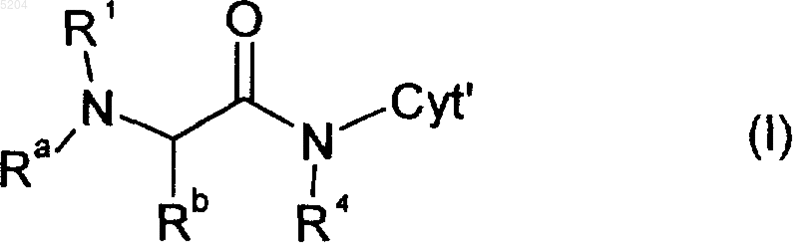
или его фармацевтически приемлемая соль,
где R1 обозначает фрагмент формулы Cg-A, Cg-B-A или Cg-(D)m-B-A, где
Cg обозначает блокирующую группу, выбранную из ряда, включающего R5-CO, R5-O-CO-, R5-NH-CO-, R5-SO2- или R5-, где R5 обозначает необязательно замещенную C3-C8циклоалкильную, арильную, аралкильную или гетероарильную группу;
A представляет собой фрагмент, являющийся производным аминокарбоновой кислоты, выбранной из ряда, включающего L-пролин, глицин, L-норлейцин, L-циклогексилглицин, L-5-гидроксинорлейцин, L-6-гидроксинорлейцин, L-5-гидроксилизин, L-аргинин или L-лизин; и
B и D, каждый независимо друг от друга, обозначает фрагменты, являющиеся производными аминокарбоновых кислот формулы -[NR6-(X)P-CO]-, где X обозначает CR7R8 и где R6, R7 и R8, каждый независимо друг от друга, обозначает атом водорода, необязательно замещенную C1-C6алкильную, C3-C8циклоалкильную, арильную или гетероарильную группу, и
p обозначает 1, 2, 3, 4, 5; или
B и D, каждый независимо друг от друга, обозначает фрагменты, являющиеся производными циклических аминокарбоновых кислот формулы
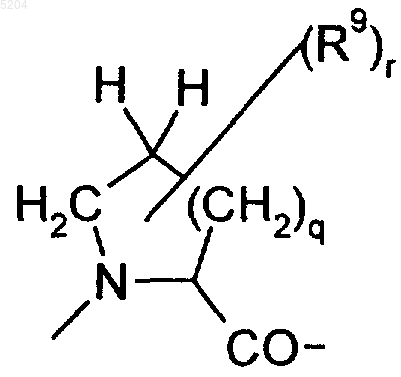
где R9 обозначает C1-C6алкил, OH или NH2,
m обозначает целое число от 1 до 10;
q обозначает 0, 1 или 2 и
r обозначает 0, 1 или 2;
Ra и Rb вместе с промежуточной N-C-группой образуют необязательно замещенное, необязательно сконденсированное с бензо- или циклогексаногруппой 3-7-членное насыщенное или ненасыщенное гетероциклическое кольцо, в котором одна или две CH2-группы также могут быть замещены NH, O или S,
R4 обозначает H и
Cyt' обозначает фрагмент цитотоксического или цитостатического соединения.
2. Соединение формулы I по п.1, где гетероциклическое кольцо, образованное Ra, Rb и промежуточной N-C-группой, замещено R2 и R3, при этом R2 и R3, каждый независимо друг от друга, обозначает атом водорода или атом галогена или C1-C6алкил, C1-C6алкиламино, диC1-C6алкиламино, C1-C6алкокси, тиол, C1-C6алкилтио, оксо, имино, формил, C1-C6алкоксикарбонил, аминокарбонил, C3-C8циклоалкил, арил или гетероарил.
3. Соединение формулы IA
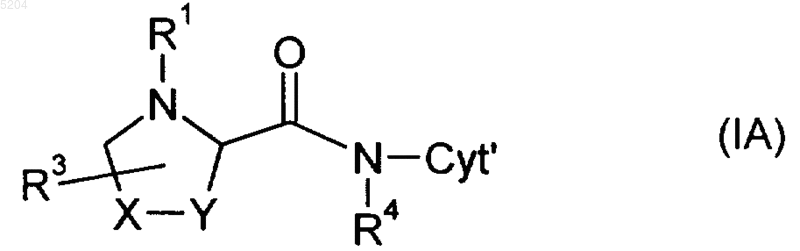
где R1, R4 и Cyt' имеют значения, указанные в любом из предыдущих пунктов, R2 и R3 имеют значения, определенные в п.2, и X-Y обозначает CHR2-CH2, CR2=CH, NH-CH2, CH2-NH, -CR2-, CH2-CHR2-CH2.
4. Соединение формулы IA1

где R1 и Cyt' имеют значения, указанные в п.1.
5. Соединение формулы I
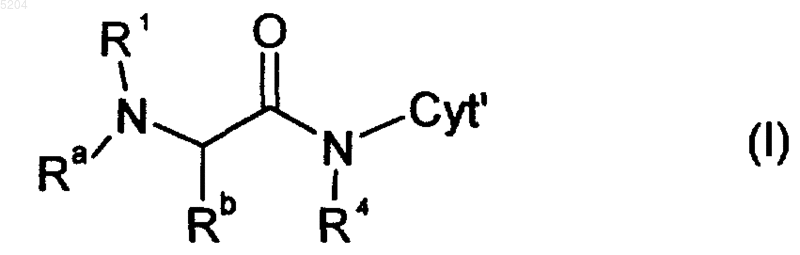
где R1 и Cyt' имеют значения, указанные в п.1,
R4 означает H,
выбранное из соединений формул IA2, IA3, IA4 и IA5
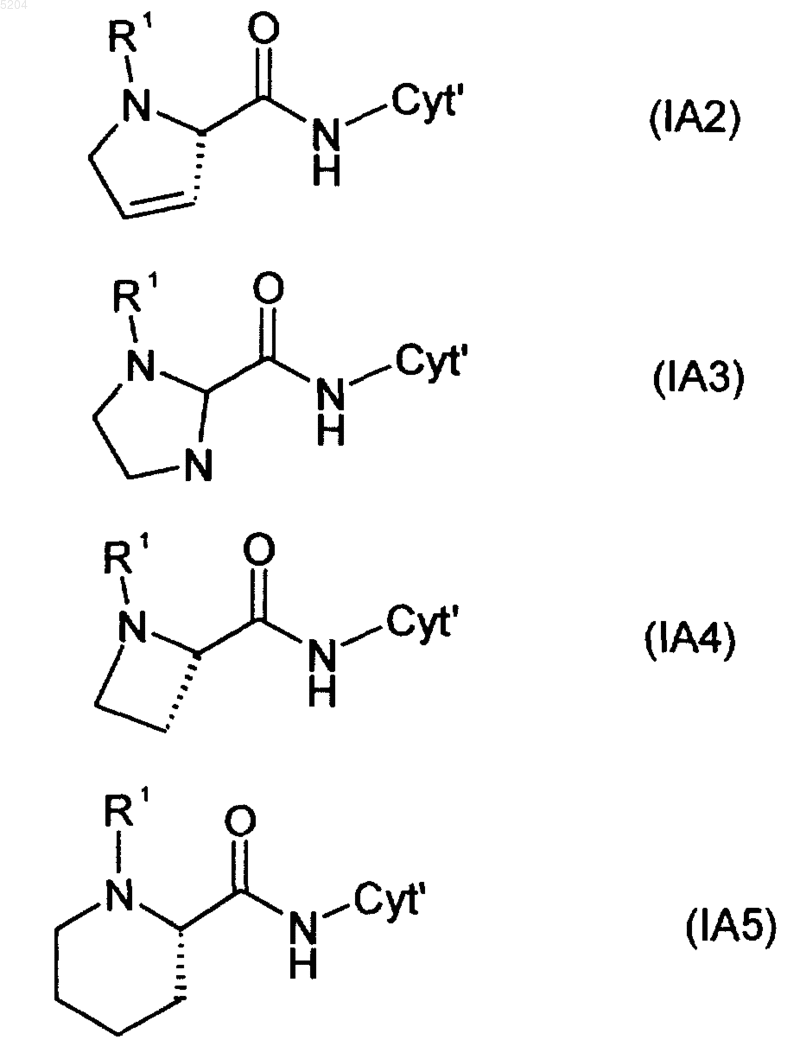
6. Соединение по любому из предыдущих пунктов, где R1 обозначает группу, выбранную из формул (21), (22) и (34)
Cg-Gly (21)
Cg-Nle (22)
Cg-(Xaa)m-Xaa-Gly (34),
где Cg обозначает атом водорода или блокирующую группу, выбранную из ряда, включающего бензоилоксикарбонил, фенилацетил, фенилметилсульфонил и бензиламинокарбонил;
Xaa обозначает фрагмент, полученный из аминокарбоновой кислоты, и
m обозначает целое число от 1 до 6.
7. Соединение по п.6, где фрагменты аминоалкановой кислоты находятся в (L)-конфигурации.
8. Соединение по п.1, где -HN-Cyt' обозначает антрациклиновое производное.
9. Соединение по п.8, выбранное из соединений формул (IIIA), (IIIB), (IIIE) и (IIIF)


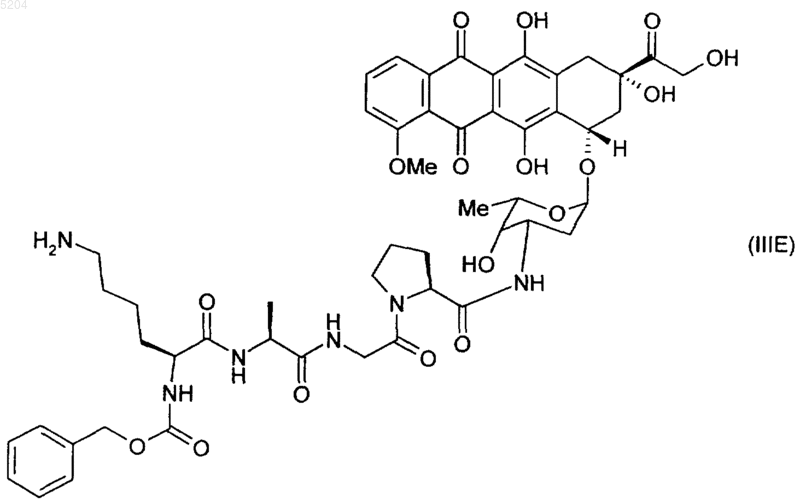
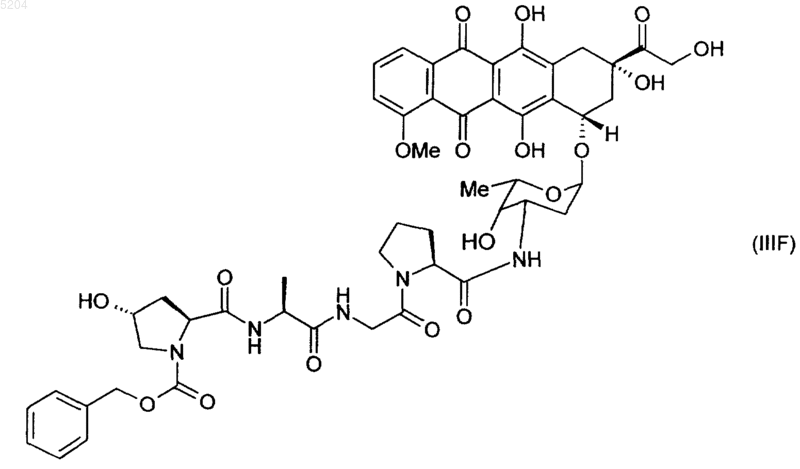
10. Применение соединения по любому из предыдущих пунктов в качестве терапевтического агента.
11. Фармацевтическая композиция, включающая соединение по любому из пп.1-9 и необязательно один или несколько фармацевтически приемлемых эксципиентов.
12. Применение соединения по любому из пп.1-9 для приготовления фармацевтической композиции, предназначенной для лечения рака.
13. Способ получения соединения формулы I по п.1, отличающийся тем, что соединение формулы (V)
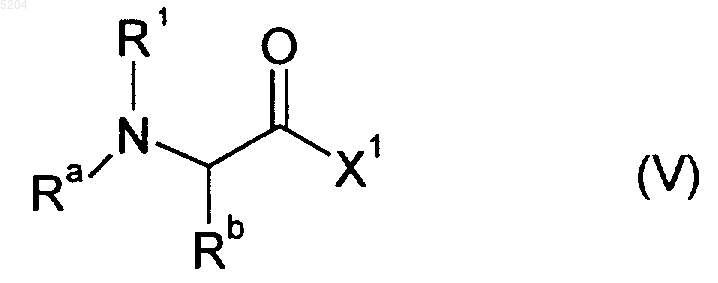
где R1, Ra и Rb имеют значения, указанные в п.1, X1 обозначает OH или уходящую группу, которая может быть замещена аминогруппой,
подвергают взаимодействию с соединением формулы HN(R4)-Cyt', где Cyt' обозначает фрагмент цитотоксического или цитостатического соединения и R4 имеет значения, указанные в п.1, с последующим выделением целевого продукта.
14. Способ лечения рака, предусматривающий введение пациенту, нуждающемуся в таком лечении, фармацевтической композиции по п.11 в течение времени и при условиях, эффективных для ингибирования пролиферации клеток опухоли.
15. Способ лечения рака, предусматривающий введение пациенту, нуждающемуся в таком лечении, соединения по п.1 в количестве, эффективном для ингибирования пролиферации клеток опухоли, в течение времени и при условиях, эффективных для ингибирования пролиферации клеток опухоли.
16. Способ лечения заболевания, выбранного из ряда, содержащего
эпителиальные карциномы, включая карциномы молочной железы, легкого, колоректальную карциному, карциному головы и шеи, поджелудочной железы, яичника, мочевого пузыря, желудка, кожи, эндометрия, яичек, пищевода, предстательной железы и почек;
саркомы костной ткани и мягких тканей, включая остеосаркомы, хондросаркомы; фибросаркому, злокачественную фиброзную гистиоцитому (MFH) и лейомиосаркому;
гематопоэтические злокачественные опухоли, включая лимфому Ходжкина и неходжкинскую лимфому;
нейроэктодермальные опухоли, включая опухоли периферической нервной системы, астроцитомы и меланомы; и
мезотелиомы, предусматривающий введение пациенту, нуждающемуся в таком лечении, соединения по п.1 в количестве, эффективном для ингибирования пролиферации клеток опухоли.
Текст
1 Область техники изобретения Настоящее изобретение относится к лечению опухолей путем введения пролекарства,которое превращается в лекарство при попадании в опухоль. В частности, изобретение относится к пролекарствам, которые могут быть превращены в лекарства в результате каталитического действия FAP, к их получению и применению в фармацевтике. Предпосылки создания изобретения Протеин активации фибробластов человека (FAP) представляет собой молекулу, расположенную на поверхности клетки, с молекулярной массой Мr 95000, которая первоначально была идентифицирована с помощью моноклонального антитела (МАт) F19 (Rettig и др. Proc.FAP кодирует интегральный мембранный протеин типа II, имеющий большой внеклеточный домен, трансмембранный сегмент и короткий цитоплазматический концевой сегмент (Scanlan и др. Proc. Natl. Acad. Sci. USA 91, 5657-5661(1994); WO 97/34927). Аминокислотная последовательность FAP на 48% идентична аминокислотной последовательности антигена CD26 Т-клеточной активации, также известного как дипептидилпептидаза IV (DPPIV; КФ 3.4.14.5),представляющего собой связанный с мембраной протеин, обладающий дипептидилпептидазной активностью (Scanlan и др., в указанном месте).FAP обладает ферментативной активностью и является представителем семейства серинпротеаз, для ферментативной активности которых решающее значение имеет наличие серина в положении 624 (WO 97/34927). Исследование,включающее анализ внешней поверхности мембраны, позволило установить, что димеры FAP обладают способностью расщеплять дипептиды Аlа-Рrо-7-амино-4-трифторметилкумарин, G1 уРrо-7-амино-4-трифторметилкумарин и Lys-Рrо 7-амино-4-трифторметилкумаринFAP избирательно экспрессируется в реактивных стромальных фибробластах многих гистологических типов эпителиального рака человека, грануляционной ткани заживляющихся ран и злокачественных клетках определенных типов сарком костной ткани и мягких тканей. В нормальных тканях взрослого человека обычно отсутствуют обнаруживаемые количестваFAP, однако, в некоторых эмбриональных мезенхимных тканях происходит кратковременная экспрессия этой молекулы. В противоположность этому большинство распространенных типов эпителиального рака, в том числе 90% типов рака молочной железы, немелкоклеточного рака легкого и колоректальных карцином содержат FAP-реактивные стромальные фибробласты (Scanlan и др., в указанном месте). ЭтиFAP+-фибробласты возникают при формиро 005204 2 вании новых кровеносных сосудов опухоли,образуя отдельный клеточный компартмент,расположенный между эндотелием капилляров опухоли и базальной частью кластеров злокачественных эпителиальных клеток (Welt и др. J.Clin. Oncol. 12(6), 1193-1203 (1994. В то время как FAP+-стромальные фибробласты присутствуют как в первичных, так и в метастатических карциномах, исследования позволили установить, что в доброкачественных и предраковых повреждениях эпителия (Welt и др., в указанном месте), таких как фиброаденомы молочной железы и колоректальные аденомы, FAP+стромальные клетки присутствуют очень редко. На основе данных, свидетельствующих об ограниченном характере распределения FAP в нормальных тканях и его постоянной экспрессии в поддерживающей строме многих злокачественных опухолей были начаты клинические испытания на пациентах, страдающих метастатическими карциномами ободочной кишки, с использованием Мат F19, меченного с помощью 131I (Welt и др., в указанном месте). Для новых противораковых терапий, основанных на применении цитотоксических или цитостатических лекарств, основной целью является увеличение терапевтического индекса за счет повышения эффективности уничтожения канцерогенной ткани и/или уменьшения токсичности цитотоксических или цитостатических агентов в отношении нормальной ткани. Для того, чтобы повысить специфичность действия в отношении уничтожения опухолевой ткани и уменьшить токсичность в отношении нормальных тканей, могут быть созданы пусковые механизмы, сущность которых состоит в том, что токсичные агенты, синтезированные в виде их пролекарств или в неактивных формах, становятся активными только тогда и в том месте, где это требуется, прежде всего в канцерогенных тканях (Panchal, Biochem. Pharmacol. 55, 247-252(1998. Пусковые механизмы могут включать как экзогенные факторы, такие как свет или химические вещества, так и эндогенные клеточные факторы, такие как ферменты, экспрессия которых происходит только в раковых тканях. Другая разработанная концепция называется терапия, основанная на применении пролекарств, с использованием фермента, направляемого антителом (ADEPT) или катализ, направляемый антителом (ADC) (Huennekens, Trends Biotechnol. 12, 234-239 (1994); Bagshawe, Clin. Pharmacokinet. 27, 368-376 (1994); Wang и др., CancerADEPT для направленного переноса определенного фермента в область опухоли используют антитело к связанному с опухолью антигену. Присутствующий в опухоли фермент превращает введенное после этого пролекарство в активный цитотоксический агент. Конъюгат антите 3 ло-фермент (АЕС) связывается с антигеноммишенью на клеточных мембранах или со свободным антигеном во внеклеточной жидкости(ECF). Промежуток времени между введением АЕС и пролекарства является достаточным для выведения АЕС из нормальных тканей, так что пролекарство не активируется в нормальных тканях или крови. Однако у ADEPT имеются некоторые недостатки, связанные со свойствами АЕС (Bagshawe, в указанном месте). Например,в организме людей лишь небольшая часть введенной дозы направляемого АЕС связывается с опухолевой тканью, тогда как остальная часть распределяется в общей воде организма, из которой она выводится с большой задержкой по времени. Даже в небольших концентрациях несвязанный фермент может катализировать достаточно большое для проявления токсических действий количество пролекарства, поскольку объемы плазмы и нормальной ECF намного больше, чем объемы ECF опухоли. АЕС может также оказаться иммуногенным, что во многих случаях препятствует его повторному введению. В Международных заявках на патент WO 97/12624 и WO 97/14416 описаны олигопептиды, включая следующие пента- и гексапептиды(SEQ.ID.NO: 151 и SEQ.ID.NO: 177: hArg-TyrGln-Ser-Ser-Pro; hArg-Tyr-Gln-Ser-Pro), имеющие аминокислотные последовательности, которые распознаются и протеолитически расщепляются свободным простатическим антигеном(PSA), и терапевтические агенты, которые включают конъюгаты таких олигопептидов и известных терапевтических или цитотоксических агентов. Такие олигопептидные конъюгаты, которые содержат по крайней мере один глутамин-сериновый фрагмент, могут применяться только для лечения рака предстательной железы. Задачей настоящего изобретения является разработка методов и средств улучшения переносимости нормальными тканями цитотоксических или цитостатических агентов, обладающих известной эффективностью в отношении широкого спектра опухолевых тканей. Описание изобретения Настоящее изобретение относится к противоопухолевым соединениям, активируемым ферментами. В изобретении предложены пролекарства, обладающие способностью превращаться в лекарства в результате каталитического действия эндогенного протеина альфа активации фибробласта (FAP), который, как было установлено, присутствует в раковых тканях человека. Предпочтительно пролекарство по настоящему изобретению обладает способностью превращаться в лекарство в результате каталитического действия FAP, при этом пролекарство имеет сайт расщепления, распознаваемый FAP, и лекарство обладает цитотоксическим или цитостатическим действием в отно 005204 4 шении раковых клеток в физиологических условиях. В контексте настоящего изобретения понятие лекарство обозначает химическое соединение, которое может вводиться людям или животным с целью лечения болезни. В частности,лекарство представляет собой агент, обладающий фармакологической активностью. Понятие цитотоксическое соединение обозначает химическое соединение, которое является токсичным в отношении живых клеток, в частности лекарство, которое разрушает или убивает клетки. Понятие цитостатическое соединение обозначает соединение, которое подавляет рост клеток и размножение и таким образом ингибирует пролиферацию клеток. Примерами цитотоксических или цитостатических соединений, которые могут применяться согласно настоящему изобретению, являются антрациклиновые производные, такие как доксорубицин, аналоги метотрексата, такие как метотрексат, притрексим, триметрексат илиDDMP, мелфалан, аналоги цисплатина, такие как цисплатин, JM216, JM335, бис(платина) или карбоплатин, аналоги пуринов и пиримидинов,такие как цитарбин, гемцитабин, азацитидин, 6 тиогуанин, флурдарабин или 2-дезоксикоформицин, и аналоги других химиотерапевтических агентов, такие как 9-аминокамптотецин, D,Lаминоглутетимид, триметоприм, пириметамин,митомицин С, митоксантрон, циклофосфанамид, 5-фторурацил, экстрамустин, подофиллотоксин, блеомицин или таксол. Понятие пролекарство обозначает соединение, которое после введения должно подвергнуться химическому превращению в результате процессов метаболизма прежде, чем оно станет фармакологически активным. В частности, пролекарство является предшественником лекарства. В контексте настоящего изобретения пролекарство обладает существенно меньшей цитотоксической или цитостатической активностью, чем лекарство, в которое оно превращается в результате каталитического действия FAP. Специалисту известны методы определения цитотоксичности соединения, см., например, пример 6 настоящего описания или уMosmann, J. Immun. Meth. 65, 55-63 (1983). Предпочтительно пролекарство при анализе invitro должно обладать по крайней мере в три раза меньшим цитотоксическим действием по сравнению с лекарством. Лекарство, которое обладает цитостатическим или цитотоксическим действием в физиологических условиях обозначает химическое соединение, которое обладает цитостатическим или цитотоксическим действием в организме живого человека или животного, в частности, соединение, которое убивает клетки или ингибирует пролиферацию клеток в организме живого человека или животного. 5 Пролекарство, которое имеет сайт расщепления, распознаваемый FAP, обозначает пролекарство, которое может выступать в качестве субстрата для ферментативной активностиFAP может катализировать в физиологических условиях расщепление ковалентной связи, присутствующей в пролекарстве. В результате расщепления этой ковалентной связи пролекарство непосредственно или косвенным образом превращается в лекарство. Косвенная активация может иметь место в том случае, если продукт расщепления, образующийся на стадии, катализируемой FAP, сам по себе не обладает фармакологической активностью, но приобретает активность после прохождения следующей стадии реакции, например гидролиза. Более предпочтительно сайт расщепления пролекарства специфически распознается FAP, но не другими протеолитическими ферментами, присутствующими в организме человека или животного. Также предпочтительно, чтобы сайт расщепления специфически распознавался FAP, но не протеолитическими ферментами, присутствующими в общей воде организма человека или животного, прежде всего в плазме. В наиболее предпочтительном варианте осуществления пролекарство является стабильным в плазме,других составляющих общей воды организма или тканях, в которых отсутствует или не может быть обнаружен обладающий биологической активностью FAP. По данным анализа in vitro,который осуществляют согласно методу, изложенному в примере 7 настоящего описания, после выдерживания в течение 8 ч при 37 С в растворе, содержащем 10 об.% человеческой плазмы, предпочтительно еще присутствует более чем 50%, более предпочтительно более чем 80%, еще более предпочтительно более чем 90% пролекарства. Наиболее предпочтительно сайт расщепления должен обладать специфичностью в отношении FAP. В предпочтительном варианте осуществления сайт расщепления содержит остаток L-пролина, связанный с цитотоксическим или цитостатическим лекарством с помощью амидной связи. Примером соединения,относящегося к этому классу, является конъюгат доксорубицин-пептид. FAP может катализировать расщепление пептидной связи между остатком С-концевой аминокислоты пептида,предпочтительно представляющей собой Lпролин, и цитотоксическим или цитостатическим соединением. Для предпочтительных соединений степень превращения в свободное лекарство составляет по меньшей мере 10% в указанных ниже стандартных условиях. Для более предпочтительных соединений степень превращения в свободное лекарство в стандартных условиях составляет по меньшей мере 20%. Для еще более предпочтительных соединений степень пре 005204 6 вращения в свободное лекарство в стандартных условиях составляет по меньшей мере 50%. В контексте настоящего описания стандартные условия определяются следующим образом: каждое соединение растворяют в 50 мМ Hepesбуфера, 150 мМ NaCl, pH 7,2, в конечной концентрации 5 мкМ и инкубируют с 100 нгCD8FAP (см. пример 4) в течение 24 ч при 37 С. Высвобождение свободного лекарства под действием CD8FAP определяют согласно методу, описанному в примере 5. Предпочтительно настоящее изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли, гдеR1 обозначает аминоалканоил, олигопептидоил, прежде всего ди- или трипептидоильную группу, N-концевая аминофункция которой может быть присоединена к блокирующей группе;Ra и Rb вместе с промежуточной N-Cгруппой образуют необязательное замещенное,необязательно сконденсированное с бензо- или циклогексаногруппой 3-7-членное насыщенное или ненасыщенное гетероциклическое кольцо, в котором одна или две СН 2-группы также могут быть замещены NH, О или S,R4 обозначает Н, C1-С 6 алкил, С 3-С 8 циклоалкил, арил или гетероарил; иCyt' обозначает фрагмент цитотоксического или цитостатического соединения,при условии, что исключаютсяN2-ацетил-L-гомоаргинил-L-тирозил-Lглутаминил-L-серил-L-серил-N-[2,3,6-тридезокси-1-O-[(1S,3S)-1,2,3,4,6,11 -гексагидро-3,5,12 тригидрокси-3-(гидроксиацетил)-10-метокси 6,11-диоксо-1-нафтаценил]L-ликсогексопираноз-3-ил]-L-пролинамид. Особенно предпочтительными являются соединения формулы I, в которых R1 обозначает фрагмент формулы Cg-A, Cg-B-A или Cg-(D)mB-А, гдеCg обозначает атом водорода или блокирующую группу, выбранную из ряда, включающего R5-CO, R5-O-CO-, R5-NH-CO, R5-SO2 или R5 -, где R5 обозначает необязательно замещенную C1-С 6 алкильную, С 3-С 8 циклоалкильную, арильную, аралкильную или гетероарильную группу; предпочтительно Cg обозначает ацетил,бензоил, D-аланил, (R)-H2NCH(CH3)- или 7 Н 2 НСОСН 2 СН 2-заместитель или другую блокирующую группу для защиты N-концевой аминофункции; А, В и D, каждый независимо друг от друга, обозначает фрагменты, являющиеся производными аминокарбоновых кислот формулыR6, R7 и R8, каждый независимо друг от друга,обозначает атом водорода, необязательно замещенный C1-С 6 алкильной, С 3-С 8 циклоалкильной, арильной или гетероарильной группой, и р обозначает 1, 2, 3, 4, 5; или А, В и D, каждый независимо друг от друга, обозначает фрагменты, являющиеся производными циклических аминокарбоновых кислот формулы где R9 обозначает C1-С 6 алкил, ОН или NH2,m обозначает целое число от 1 до 10;r обозначает 0, 1 или 2. Кроме того, предпочтительными являются соединения формулы I, в которых R6, R7 и R8,каждый независимо друг от друга, обозначает атом водорода или СН 3-, СН 3 СН 2-, СН 3 СН 2 СН 2-,(СН 3)2 СН-,СН 3 СН 2 СН 2 СН 2-,(СН 3)2 СНСН 2-,СН 3 СН 2 СН(СН 3)-, (СН 3)3 С-, НОСН 2-, СН 3 СН(ОН)-,СН 3 СН(ОН)СН 2 СН 2-,НОСН 2 СН 2 СН 2 СН 2-,H2NCH2CH2CH2-, H2NCH2CH2CH2CH2-, H2NCH2CH(OH)CH2CH2-,H2NC(=NH)NHCH2CH2CH2-,HSCH2-, CH3SCH2CH2-, HOOCCH2-, HOOCCH2CH2-,H2NC(=O)CH2-, H2NC(=O)CH2CH2-, бензил, парагидроксибензил, циклогексил, фенил,p обозначает 1, и где конфигурация CR7R8 может представлять собой R- или S-конфигурацию; причем,если R7 не обозначает Н, то R8 предпочтительно обозначает Н; R6 предпочтительно обозначает Н; если р больше 1, R7 и R8 предпочтительно обозначают Н. Другим предпочтительным вариантом осуществления изобретения являются соединения формулы I, где гетероциклическое кольцо,образованное Ra, Rb и промежуточной N-Cгруппой, замещено R2 и R3, где R2 и R3, каждый независимо друг от друга, обозначает атом водорода или атом галогена или C1-С 6 алкил, C1-С 6 алкиламино, диС 1-С 6 алкиламино, C1-С 6 алкокси,тиол, С 1-С 6 алкилтио, оксо, имино, формил, C1 С 6 алкоксикарбонил, аминокарбонил, С 3-С 8 циклоалкил, арил или гетероарил. 8 Если не указано иное, отдельные стереоизомеры, а также смеси или рацематы стереоизомеров подпадают под объем изобретения.C1-С 6 алкил обычно представляет собой углеводородный радикал с прямой или разветвленной цепью, содержащий 1-6 атомов углерода. Понятие необязательно замещенный,употребляемое выше и ниже в настоящем описании по отношению к группе или фрагменту,обозначает группу или фрагмент, которые могут быть необязательно замещены одним или несколькими атомами галогена, гидроксилом,амино-, C1-С 6 алкиламино-, диС 1-С 6 алкиламино-,С 1-С 6 алкилоксигруппой, тиолом, С 1-С 6 алкилтиогруппой, =О, =NH, -CHO, -COOH, -CONH2,-NHC(=NH)NH2, С 3-С 8 циклоалкилом, арилом или гетероарилом, при этом указанные заместители могут быть одинаковыми или различными. В качестве примеров могут служить следующие радикалы: метил, этил, пропил, 1 метилэтил (изопропил), бутил, 1-метилпропил,2-метилпропил, 1,1-диметилэтил, н-пентил, 1 метилбутил, 2-метилбутил, 3-метилбутил, 1,1 диметилпропил, 1,2-диметилпропил, 2,2-диметилпропил, 1-этилпропил, гексил, 1-метилпентил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 1,1-диметилбутил, 1,2-диметилбутил,1,3-диметилбутил, 2,2-диметилбутил, 2,3-диметилбутил, 3,3-диметилбутил, 1-этилбутил, 2 этилбутил, 1,1,2-триметипропил, 1,2,2-триметилпропил, 1-этил-1-метилпропил и 1-этил-2 метилпропил,НОСН 2-,СН 3 СН(ОН)-,СН 3 СН(ОН)СН 2 СН 2-,НОСН 2 СН 2 СН 2 СН 2-,H2NCH2CH2CH2-, H2NCH2CH2CH2CH2-, H2NCH2CH2CH2-, бензил, парагидроксибензил, Если C1-С 6 алкильная группа является замещенной, то заместителями предпочтительно являются гидроксил, амино, диметиламино, диэтиламино, тиол, метилтиол, метокси, этокси,=О,=NH,-СНО,-СООН,-СООСН 3,-СООСН 2 СН 3, -CONH2, -NHC(=NH)NH2, циклогексил, фенил, бензил, парагидроксибензил, Если C1-С 6 алкил замещен арилом или гетероарилом, то C1-С 6 алкил предпочтительно представляет собой С 1, более предпочтительно метиленовую группу. Понятия аминоалканоил или олигопептидоил, включая ди- или трипептидоил, ис 9 пользуемое выше и ниже в настоящем описании по отношению к радикалу R1, обозначают радикал, в котором аминокислота или олигомер, содержащий до 12, предпочтительно 2 или 3 аминокислотных фрагмента, присоединен с помощью амидной связи С-концом к атому азота гетероциклического кольца. Специалисту в области химии аминокислот и олигопептидов должно быть очевидно, что определенные аминокислоты могут быть заменены другими гомологичными, изостерическими и/или изоэлектронными аминокислотами,при этом биологическая активность исходной аминокислоты или олигопептида сохраняется после такой модификации. Для замены соответствующих аминокислот, встречающихся в естественных условиях, могут применяться определенные не встречающиеся в естественных условиях и модифицированные встречающиеся в естественных условиях аминокислоты. Так, например, тирозин может быть заменен 3 йодтирозином, 2- или 3-метилтирозином, 3 фтортирозином. Понятие блокирующая группа, используемое выше или ниже в настоящем описании применительно к группе, присоединенной к Nконцевому атому азота аминоалканоильной или олигопептидоильной группы радикала R1, обозначает группу или фрагмент, который уменьшает или устраняет ферментативное расщепление соединений по настоящему изобретению под действием аминопептидаз, присутствующих в плазме крови теплокровных животных. Пригодные блокирующие группы включают C1 С 10 алканоил, С 6-С 18 арил-С 1-С 10 алканоил, С 6-С 18 арил-С 1-С 10 алкилсульфонил. Такие блокирующие группы также включают гидрофильные блокирующие группы, которые выбирают при наличии гидрофильных функциональных групп. Такие блокирующие группы увеличивают гидрофильность соединений по настоящему изобретению и таким образом повышают их растворимость в водных средах. Такие повышающие гидрофильность блокирующие группы предпочтительно выбирают из ряда, включающего гидроксилированный алканол, полигидроксилированный алканоил, гидроксилированный ароил, гидроксилированный арил-алканоил,полигидроксилированный ароил, полигидроксилированный арилалканоил, полиэтиленгликоль, гликозилаты, сахара и простые краунэфиры. С 3-С 8 циклоалкил обычно представляет собой циклический углеводородный радикал,содержащий 3-8 атомов углерода, который необязательно может быть замещен одним или несколькими заместителями, выбранными из ряда, включающего гидроксил, амино, С 1 С 6 алкиламино, диС 1-С 6 алкиламино, C1-С 6 алкил,C1-С 6 алкокси, тиол, С 1-С 6 алкилтио, =О, =NH,-СНО, -СООН, -СООСН 3, -СООСН 2 СН 3,-CONH2, -NHC(=NH)NH2 или галоген, при этом 10 указанные заместители могут быть одинаковыми или различными. Понятие гетероциклическое кольцо, используемое выше и ниже в настоящем описании применительно к группе, образованной Ra и Rb в сочетании с промежуточной N-C-группой,обычно обозначает 3-7-членную, предпочтительно 4-, 5- или 6-членную неароматическую гетероциклическую кольцевую систему, содержащую один атом азота и необязательно 1 или 2 дополнительных гетероатома, выбранных из группы, включающей азот, кислород и серу,которая может быть замещена одним или несколькими атомами галогена или C1-С 6 алкилом,C1-С 6 алкиламино-, диС 1-С 6 алкиламино-, C1-С 6 алкоксигруппой, тиолом, C1-С 6 алкилтио-, оксо-,иминогруппой, формилом, C1-С 6 алкоксикарбонилом, аминокарбонилом, С 3-С 8 циклоалкилом, арилом или гетероарилом, при этом указанные заместители могут быть одинаковыми или различными, и которая необязательно может быть сконденсирована с бензо- или циклогексаногруппой. Такие гетероциклические кольца предпочтительно представляют собой азетидин или производные полностью или частично гидрогенизированного пиррола, пиридина, тиазола, изоксазола, пиразола, имидазола,индола, бензимидазола, индазола, пиридазина,пиримидина, пиразина. Наиболее предпочтительными являются азетидин, пирролидин, 3,4 дегидропирролидин, пиперидин, гексагидро-1 Назепин, октагидроиндол, имидазолидин, тиазолидин. Если такое гетероциклическое кольцо является замещенным, то заместители предпочтительно представляют собой метил, этил, пропил,1-метилэтил (изопропил), бутил, 1-метилпропил, 2-метилпропил, 1,1-диметилэтил, гидроксил, амино, диметиламино, диэтиламино,тиол, метилтиол, метокси, этокси, -СНО,-СООН, -СООСН 3, -СООСН 2 СН 3 или -CONH2. Арил обычно представляет собой ароматическую кольцевую систему, содержащую 610, предпочтительно 6 атомов углерода, которая необязательно может быть замещена одним или несколькими заместителями, выбранными из ряда, включающего гидроксил, амино, C1-С 6 алкиламино, диС 1-С 6 алкиламино, C1-С 6 алкил, C1 С 6 алкокси, тиол, С 1-С 6 алкилтио, -СНО, -СООН,-СООСН 3, -СООСН 2 СН 3, -CONH2 или галоген,при этом указанные заместители могут быть одинаковыми или различными, и которая необязательно может быть сконденсирована с бензогруппой. Заместители для арила предпочтительно могут быть выбраны из производных бензола, предпочтительными примерами являются фенил, 2-гидроксифенил, 3-гидроксифенил, 4 гидроксифенил, 4-аминофенил, 2-аминофенил,3-аминофенил. Если арил является замещенным, то заместителями предпочтительно являются метил,этил, пропил, 1-метилэтил (изопропил), бутил, 11 1-метилпропил, 2-метилпропил, 1,1-диметилэтил, гидроксил, амино, диметиламино, диэтиламино, тиол, метилтиол, метокси, этокси,-СНО, -СООН, -СООСН 3, -СООСН 2 СН 3 или-CONH2. Гетероарил обычно представляет собой 5-10-членную ароматическую гетероциклическую кольцевую систему, содержащую 1-5 гетероатомов, выбранных из азота, кислорода или серы, которая необязательно может быть замещена одним или несколькими заместителями,выбранными из группы, включающей гидроксил, амино, C1-С 6 алкиламино, диС 1-С 6 алкиламино, C1-С 6 алкил, C1-С 6 алкилокси, тиол,C1-С 6 алкилтио, -СНО, -СООН, -СООСН 3,-СООСН 2 СН 3, -CONH2 или галоген, при этом указанные заместители могут быть одинаковыми или различными, и которая необязательно может быть сконденсирована с бензогруппой. Заместители для гетероарила предпочтительно могут являться производными фурана, пиррола,тиофена, пиридина, тиазола, изоксазола, пиразола, имидазола, бензофурана, тианафтена, индола, бензимидазола, индазола, хинолина, пиридазина, пиримидина, пиразина, хиназолина, пирана, пурина, аденина, гуанина, тимина, цитозина, урацила. Если гетероарил является замещенным, то заместители предпочтительно представляют собой метил, этил, пропил, 1-метилэтил (изопропил), бутил, 1-метилпропил, 2-метилпропил,1,1-диметилэтил, гидроксил, амино, диметиламино, диэтиламино, тиол, метилтиол, метокси,этокси, -СНО, -СООН, -СООСН 3, -СООСН 2 СН 3 или -CONH2. Фрагмент цитотоксического или цитостатического соединения обозначает, что соединение H2N-Cyt', которое высвобождается после расщепления амидной связи, присутствующей в формуле (I), либо само является цитотоксическим или цитостатическим, либо может быть превращено в цитотоксическое или цитостатическое соединение на следующей стадии. В последнем случае -Cyt' может представлять собой фрагмент формулы -L-Cyt", где L обозначает связующий фрагмент, полученный из бифункциональной молекулы, например диамина H2N-L'-NH2, аминоспирта Н 2N-L'-ОН,например парааминобензилового спирта (РАВОН), аминокарбоната, например или не встречающейся в естественных условиях аминокарбоновой кислоты. Если -Cyt' является фрагментом формулы -L-Cyt", то соединение H2N-L'-Cyt" получают путем ферментативного расщепления амидной связи, присутствующей в формуле (I). Соединение H2N-L'Cyt" может быть цитотоксическим или цитостатическим само по себе или связующий фрагмент 12 отщепляют от Cyt на следующей стадии, высвобождая цитотоксический или цитостатический агент. Например, соединение H2N-L'-Cyt" может быть гидролизовано в физиологических условиях с получением соединения H2N-L'-OH и цитотоксического или цитостатического соединения H-Cyt", представляющего собой агент,обладающий терапевтической активностью (в дальнейшем для простоты как для Cyt', так и дляCyt" используется только одно обозначение Cyt,и только одно обозначение L используется как для L, так и для L'). Фармацевтически приемлемые соли соединений по настоящему изобретению включают обычные нетоксичные соли, образованные с нетоксичными неорганическими или органическими кислотами. Например, такие обычные нетоксичные соли включают соли неорганических кислот, таких как соляная, бромистоводородная, серная, сульфаминовая, фосфорная,азотная кислота и т.п.; и соли, полученные из органических кислот, таких как уксусная, пропионовая, янтарная, гликолевая, стеариновая,молочная, яблочная, винная, лимонная, аскорбиновая, малеиновая, фенилуксусная, глутаминовая, бензойная, салициловая, сульфаниловая,щавелевая, трифторуксусная кислота и т.п. Предпочтительными соединениями формулы I являются соединения формулы IA где R2, R3, R4, Cyt' имеют указанные выше значения, R1 обозначает аминоалканоильную или олигопептидоильную группу и X-Y обозначаетX-Y обозначает группу СН 2-СН 2, то R1 обозначает аминоалканоильную, ди- или трипептидоильную группу или R1 обозначает олигопептидоил, имеющий более трех аминокислотных фрагментов, которые не содержат аминокислотную последовательность Gln-Ser. Предпочтительно атом углерода в положении циклического фрагмента аминокислоты является рацемическим, т.е. находится в(R/S)-конфигурации, наиболее предпочтительно в (S)-конфигурации; в наиболее предпочтительном варианте осуществления атом углерода в положении находится в (S)-конфигурации и R2 обозначает Н. В том случае, когда R обозначает ОН, он предпочтительно находится в трансориентации.R2, R3 предпочтительно обозначают атом водорода или метил, этил, пропил, изопропил,фенил, метокси-, этокси- или гидроксигруппу,наиболее предпочтительно атом водорода. R4 предпочтительно обозначает атом водорода или метил, этил, пропил, изопропил или фенил, наиболее предпочтительно атом водорода. Наиболее предпочтительными являются соединения формулы IA, выбранные из соединений формул IA1, IA2, IA3, IA4 и IA5H2N-Cyt' предпочтительно обозначает антрациклиновое производное формулы IIRd обозначает водород, гидрокси или C1-С 6 алкокси, в частности метокси; один из радикалов Re и Rf обозначает атом водорода, а другой обозначает атом водорода или гидрокси- или тетрагидропиран-2-илокси(ОТНР)- группу. Наиболее предпочтительными являются следующие соединения формулы II: 14 Наиболее предпочтительным является доксорубицин (Dox). Другие цитотоксические или цитостатические фрагменты Cyt' могут быть получены, например, на основе метотрексата,триметрексата, пиритрексима, 5,10-дидеазатетрагидрофолатпириметамина, триметоприма,10-пропаргил-5,8-дидеазафолат-2,4-диамино-5(3',4'-дихлорофенил)-6-метилпиримидина, аминоглутетимида, горесерелина, мелфалана, хлорамбуцила, аналогов других химиотерапевтических агентов, таких как 9-аминокамтотецин (см.,например, Burris H. A, r. d. и S. M. Fields, "Topoisomerase Iinhibitors. An overview of the camptothecin analogs [обзор]," Hematol. Oncol Clin.[обзор] [ 137 ссылок]," Cancer Chemother. Pharmacol. 42 приложение: S31-S43 (1998. В формуле (I), Cyt' может также обозначать биологическую эффекторную молекулу,которая прямо или косвенно оказывает разрушающее воздействие на опухолевые клетки типа, например, TNF. Предпочтительными примерами аминокарбоновых кислот, на основе которых могут быть получены фрагменты А, В и D, являются глицин (Gly), или D- или более предпочтительно L-формы аланина (Аlа), валин (Val), лейцин(Cha), метионин-S-оксид (Met), -циклопропилаланин (Сра), трет-лейцин (Tle) или гомосерин (Hse). Предпочтительными соединениями являются соединения общей формулы (I), где фрагмент А получен на основе аланина, валина (Val),лейцина (Leu), изолейцина (Ilе), фенилаланина Наиболее предпочтительными являются соединения формулы (I), где R1 представляет собой группу, выбранную из формул (1) - (34):(17) Cg-(Xaa)m-Xaa-Gly (34) где Cg обозначает атом водорода или блокирующую группу, выбранную из бензоилоксикарбонила, фенилацетила, фенилметилсульфонила и бензиламинокарбонила; Хаа обозначает фрагмент, полученный из аминокарбоновой кислоты, предпочтительно выбранной из группы встречающихся в естественных условиях аминокислот, прежде всего из группы, включающей Ala, Pro, Туr, Phe, His, Ser, Thr, Hyp иLys; и m обозначает целое число от 1 до 6. Предпочтительными блокирующими группами Cg являются ацетил (Ас), сукцинимидилZ) или макромолекулы, такие как полиэтиленгликоль. Предпочтительными антрациклиновыми пролекарствами являются соединения формулы где Ra, Rb, Rc, Rd, Re, Rf и R1 имеют указанные выше значения. Наиболее предпочтительными соединениями по изобретению являются производные доксорубицина формул (IIIА) - (IIIF): Если фрагмент Cg-B-A или Cg-(D)m-B-A формулы (I) включает два или более атомов серы, то соединение по изобретению может содержать одну или более дисульфидных связей. 17 Один из классов цитотоксических или цитостатических соединений, которые могут применяться согласно настоящему изобретению,содержит первичную аминофункцию, которая может образовывать амидную связь, показанную на структурной формуле (I), например доксорубицин. В этом случае наличие связующей молекулы L не является обязательным. Если цитотостатическое или цитотоксическое соединение не содержит такую аминофункцию, то такая функция может быть введена в это соединение посредством химической модификации,например, путем введения или преобразования функциональной группы или присоединения к соединению связующей молекулы. Связующая молекула может быть также встроена между олигомерным фрагментом (т.е. фрагментом,содержащим остатки аминокарбоновых кислот) и цитостатическим или цитотоксическим фрагментом соединения по изобретению для того,чтобы обеспечить или оптимизировать расщепление амидной связи между олигомерным фрагментом и цитотоксическим или цитостатическим фрагментом. Если присутствует связующая молекула, например, в соединениях,включающих структуру L-Cyt', то связь между L и Cyt' предпочтительно представляет собой амидную или сложноэфирную связь. В предпочтительном варианте осуществления в физиологических условиях после ферментативного расщепления такая связующая молекула подвергается гидролизу с отщеплением цитостатического или цитотоксического соединения, в результате чего образуется цитостатическое или цитотоксическое соединение. В любом случае соединение по изобретению должно обладать способностью расщепляться в условиях каталитического действия FAP и в результате непосредственного или косвенного воздействия такого расщепления высвобождать в физиологических условиях цитостатическое или цитотоксическое соединение. Еще одним объектом настоящего изобретения является пролекарство,которое может превращаться в лекарство в результате каталитического действия FAP, при этом пролекарство имеет сайт расщепления,распознаваемый FAP, и пролекарство является цитотоксическим или цитостатическим в физиологических условиях. Такое пролекарство предпочтительно содержит олигомерный фрагмент, включающий два или более аминокарбоновых остатков и цитотоксический или цитостатический фрагмент, где С-концевой аминокарбоновый остаток олигомерного фрагмента представляет собой встречающуюся в естественных условиях или синтетическую 3-7-членную циклическую аминокислоту, предпочтительно Dили L-пролин или D- или L-гидроксипролин, а С-концевая карбоксифункция связана с цитотоксическим или цитостатическим фрагментом посредством амидной связи, которая может 18 быть расщеплена в результате каталитического действия FAP. Олигомерный фрагмент предпочтительно представляет собой пептид. Предпочтительно олигомерный фрагмент содержит два, три, четыре, пять, шесть, семь, восемь, девять, десять, одиннадцать или двенадцать остатков аминокарбоновой кислоты, более предпочтительно два, три или четыре остатка аминокарбоновой кислоты. ПредпочтительноNконцевую аминофункцию защищают с помощью блокирующей группы. Соединения по изобретению могут быть синтезированы методами, известными в данной области (см. у Е. Wunsch, Synthese von Peptiden,в "Methoden der organischen Chemie", HoubenWeyl (под редакцией Е. Muller, O. Bayer), томXV, части 1 и 2, издательство Georg Thieme,Штуттгарт, 1974). Например, соединения могут быть синтезированы методом блочного синтеза путем конденсации концевой карбоксифункции олигомерного фрагмента, где X может обозначать ОН или активирующую уходящую группу,с аминогруппой цитотоксической или цитостатической молекулы H2N-Cyt', приводя к образованию амида. Если между олигомерным фрагментом и цитотоксическим или цитостатическим агентом должен присутствовать связующий фрагмент(L), то блочный синтез может быть осуществлен таким же образом. Если цитотоксический или цитостатический фрагмент содержит карбоксифункцию,необходимую для присоединения к олигомерному фрагменту, то связующая молекула может представлять собой имин или аминоспирт и блочный синтез таких соединений может быть осуществлен аналогичным образом путем взаимодействия активированного фрагмента XOCCyt' либо с гидрокси-, либо с аминогруппой. Если цитотоксический или цитостатический реагент содержит гидроксильную функцию, которая может применяться для сочетания с олигомерным фрагментом, то связующий остаток может представлять собой аминокарбоновую кислоту и блочный синтез может быть проведен аналогичным образом. При необходимости с помощью соответствующих защитных групп в радикалах Cyt', L, 19 гидроксипролин, А, В и D могут быть защищены другие функциональные группы, которые не должны вступать в реакцию в процессе образования молекул-мишеней. Пригодные защитные группы широко известны в данной области(P.G.M. Wuts, "Protective groups in organic synthesis", John Wiley and Sons Inc., New York,1991). Эти защитные группы удаляют после завершения синтеза. С целью иллюстрации можно отметить,что пригодные аминозащитные группы могут включать, например, C1-С 10 алканоильные группы, такие как формил, ацетилдихлорацетил,пропионил, 3,3-диэтилгексаноил и т.п., C1-С 10 алкоксикарбонил и С 6-С 17 аралкилоксикарбонил,например трет-бутоксикарбонил, бензилоксикарбонил (ВОС), флуоренилметоксикарбонил и т.п. Наиболее предпочтительным является флуоренилметоксикарбонил (FMOC). Пригодные карбоксизащитные группы могут включать, например, C1-С 10 алкильные группы, такие как метил, трет-бутил, децил; С 6 С 17 аралкил, такой как бензил, 4-метоксибензил,дифенилметил, трифенилметил, флуоренил; три(С 1-С 10 алкил)силил или (C1-С 10 алкил)диарилсилил, такой как триметилсилил, диметилтрет-бутилсилил, дифенил-трет-бутилсилил и родственные группы. Для образования такого сложного эфира или амида может оказаться необходимым активировать карбонильную группу карбоновой кислоты для нуклеофильного взаимодействия с амином или спиртом, т.е. X должен представлять собой активирующую группу или уходящую группу, которая может быть замещена аминогруппой. Такая активация может быть осуществлена путем превращения карбоновой кислоты в хлорангидрид или фторангидрид или путем превращения карбоновой кислоты в активированный эфир,например,Nгидроксисукцинимидиловый эфир или пентафторфениловый эфир. Другой метод активации представляет собой трансформацию в симметричный или несимметричный ангидрид. В альтернативном варианте образование амидных или эфирных связей может быть достигнуто путем использования in situ реагентов для реакции сочетания, таких как гексафторфосфат бензотриазол-1-илокситриспирролидинфосфонияBlankenmeyer-Menge и др., THL, 31, 1701-1704,1990). В качестве альтернативы методу блочного синтеза создание молекул общей формулы (I) может быть осуществлено постадийно в направлении справа налево путем последовательных 20 реакций конденсации соответствующих мономеров Cyt', L, циклической аминогруппы, образованной Ra, Rb и промежуточной N-C-группой,прежде всего пролина или гидроксипролина, А,В и D. Для осуществления реакции конденсации могут быть использованы те же методы сочетания, которые указаны выше. Поскольку элементы L, пролин/гидроксипролин, А, В и D представляют собой по меньшей мере бифункциональные молекулы, содержащие амино- и (по меньшей мере фрагменты А, В, D и циклическая аминогруппа, образованная Ra, Rb промежуточнойN-C-группой,прежде всего пролин/гидроксипролин) карбоксигруппу, то аминогруппа должна быть блокирована защитной группой (PG) перед активацией карбоксильной функции. Для защиты аминогрупп могут использоваться группа ВОС или предпочтительно группа FMOC. После осуществления реакции сочетания аминозащитная группа должна быть удалена и может быть осуществлено сочетание со следующим фрагментом, защищенным группой Fmoc- или Воc. При необходимости с помощью пригодных защитных групп могут быть защищены другие функциональные группы,присутствующие в фрагментах Cyt', L, циклической аминокислотной группе, образованной Ra,Rb и промежуточной N-C-группой, прежде всего в гидроксипролине, А, В и D, которые не должны вступать в реакцию в процессе синтеза молекул-мишеней. Эти защитные группы должны быть удалены после окончания синтеза. Блокирующие группы, как они определены для формулы (I), могут также служить в качестве защитных групп, прежде всего при добавлении последнего (N-концевого) остатка аминокарбоновой кислоты. В этом последнем случае защитную группу не удаляют, поскольку она является частью молекулы-мишени. В альтернативном варианте блокирующая группа может быть присоединена после проведения сочетания с последним остатком аминокарбоновой кислоты и затем удалена. Постадийный синтез описан на приведенных ниже схемах. На второй схеме показан пример того, что связующий фрагмент, а также фрагмент Cyt' могут содержать другие функциональные группы, показанные на этой схеме Таким образом, следующим объектом изобретения является способ получения соединения формулы (I), отличающийся тем, что соединение общей формулы (V) где R1, Ra и Rb имеют указанные выше значения, X1 обозначает ОН или уходящую группу,которая может быть замещена аминогруппой,подвергают взаимодействию с соединениемHN(R4)-Cyt', где Cyt' обозначает фрагмент цитотоксического или цитостатического соединения и R4 имеет указанные выше значения. Предпочтительно X1 в формуле (V) обозначает уходящую группу, например -Сl, -F, Nгидроксисукцинимидил, пентафторфенил или карбоксилат. В альтернативном варианте X1 может обозначать ОН и конденсация может быть осуществлена с использованием in situ реагента для реакции сочетания, например, гексафторфосфата бензотриазол-1-илокситриспирролидинфосфония (РуВОР), 1,1'-карбонилдиимидазол(TBTU) или 1-(мезитилен-2-сульфонил)-3 нитро-1 Н-1,2,4-триазола (MSNT). Следующим объектом изобретения является способ получения соединения формулы (I),отличающийся тем, что соединение общей формулы (VI) где R1, Ra и Rb имеют значения, указанные в п.1 формулы изобретения, Y1 обозначает L-COX2,где L обозначает связующий фрагмент и X2 обозначает ОН или уходящую группу, которая может быть замещена аминогруппой или гидроксигруппой, подвергают взаимодействию с соединением H2N-Cyt' или с соединением HO-Cyt', 005204 22 где Cyt' обозначает фрагмент цитотоксического или цитостатического соединения. Предпочтительно X2 в формуле (VI) обозначает уходящую группу, например, -Cl, -F, Nгидроксисукцинимидил, пентафторфенил или карбоксилат. В альтернативном варианте X1 может обозначать ОН и конденсация может быть осуществлена с использованием in situ реагента для реакции сочетания, например гексафторфосфата бензотриазол-1-илокситриспирролидинфосфония (РуВОР), 1,1-карбонилдиимидазол (CDI),тетрафторбората 2-(1 Н-бензотриазол-1-ил)1,1,3,3-тетраметилурония (TBTU) или 1(мезитилен-2-сульфонил)-3-нитро-1 Н-1,2,4 триазола (MSNT). Еще одним объектом изобретения является способ получения соединения формулы (I), отличающийся тем, что соединение общей формулы (VII) где R1, Ra и Rb имеют указанные выше значения,Y2 обозначает L-OH или L-NH2, где L обозначает связующий фрагмент, подвергают взаимодействию с соединением X3OC-Cyt', где X может обозначать ОН или уходящую группу, которая может быть замещена аминогруппой или гидроксигруппой и где Cyt' обозначает фрагмент цитотоксического или цитостатического соединения. Предпочтительно X3 в соединении X3OCCyt' обозначает уходящую группу, например-Cl, -F, N-гидроксисукцинимидил, пентафторфенил или карбоксилат. В альтернативном варианте X может обозначать ОН, а конденсацию осуществляют с использованием in situ реагента для реакции сочетания, например, гексафторфосфата бензотриазол-1-илокситриспирролидинфосфония (РуВОР), тетрафторбората 1,1'карбонилдиимидазола (CDI), тетрафторбората 2-(1 Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония (TBTU) или 1-(мезитилен-2-сульфонил)3-нитро-1 Н-1,2,4-триазола (MSNT). Следующим объектом изобретения является способ получения соединения формулы (I),отличающийся тем, что соединение формулыH2N-Cyt' подвергают постадийной конденсации с фрагментами, образующими соединение формулы (I). Перед каждой стадией сочетания может оказаться необходимым удалить защитную группу PG, если она присутствует. Таким образом, еще одним объектом изобретения является способ получения соединения формулы (I), отличающийся тем, что соединение общей формулы (VIII) где PG1 обозначает защитную группу, а другие заместители имеют указанные выше значения,подвергают взаимодействию с соединениемHN(R4)-Cyt', где Cyt' обозначает фрагмент цитотоксического или цитостатического соединения; затем удаляют защитную группу PG1, после чего образовавшееся соединение (VIIIA)X5OC-Cyt', где Cyt' обозначает фрагмент цитотоксического или цитостатического соединения и X5 обозначает ОН или приемлемую уходящую группу; затем удаляют защитную группу PG5 и образовавшееся соединение HN(R4)-L-Y5-COCyt' подвергают взаимодействию с соединением формулы (VIII) после чего удаляют защитную группу и образовавшееся соединение подвергают взаимодействию с соединениемPG2-A-X4, где PG2 обозначает защитную группу и X4 обозначает ОН или уходящую группу, которая может быть замещена аминогруппой; и затем при необходимости осуществляют дополнительные стадии сочетания до получения конечного соединения. Группы PG1 и PG2 могут представлять собой, например, ВОС или предпочтительноFMOC. Таким образом, еще одним объектом изобретения является способ получения соединения формулы (I), отличающийся тем, что соединение формулы PG3-N(R4)-L-COX3, где PG3 обозначает защитную группу, а другие заместители имеют указанные выше значения, подвергают взаимодействию с соединением формулы Y4Cyt', где Cyt' обозначает фрагмент цитотоксического или цитостатического соединения; и Y4 обозначает H2N или НО; затем удаляют защитную группу PG3 и образовавшееся соединение после чего удаляют защитную группу PG1 и образовавшееся соединение формулы подвергают взаимодействию с соединением PG4-A-X4, где PG4 обозначает защитную группу и X4 может обозначать ОН или уходящую группу, которая может быть замещена аминогруппой; и затем при необходимости осуществляют дополнительные стадии сочетания до получения конечного соединения. Следующим объектом изобретения является способ получения соединения формулы (I),отличающийся тем, что соединение формулыPG5-N(R4)-L-Y5, где PG5 обозначает защитную группу, Y5 обозначает ОН или NH2 и заместители имеют указанные выше значения, подверга подвергают взаимодействию с соединениемPG2-A-X4, где PG2 обозначает защитную группу и X4 обозначает ОН или уходящую группу, которая может быть замещена аминогруппой. И затем при необходимости осуществляют дополнительные стадии сочетания до получения конечного соединения. Еще одним объектом изобретения являются новые промежуточные соединения формулы где Ra, Rb, R4 и Cyt' имеют указанные выше значения. Соединения по изобретению предназначены для применения в медицине. В частности,эти соединения могут применяться для лечения опухолей, связанных со стромальными фибробластами, экспрессирующими FAP, лечение которых с помощью существующих цитотоксических и/или цитостатических агентов не является оптимальным. Опухолями такого типа являются, например, различные виды эпителиальных карцином, такие как карциномы легкого,молочной железы и ободочной кишки. С помощью этих соединений можно лечить также такие опухоли как саркомы костной ткани и мягких тканей, которые экспрессируют FAP. Таким образом, еще одним объектом настоящего изобретения являются фармацевтические композиции, содержащие соединение по настоящему изобретению и необязательно один или несколько пригодных и фармацевтически приемлемых эксципиентов, примеры которых приведены в Remington: the science and practiceof pharmacy, 19-e изд. Easton: Mack Publ, 1995. Фармацевтические композиции могут быть приготовлены в виде твердых продуктов или растворов. Твердые композиции могут использоваться для получения растворов для инъекций. Предпочтительно фармацевтические композиции представляют собой растворы для инъек 25 ций. Они могут вводиться системно, например путем внутривенной инъекции, или местно, например путем инъекции непосредственно в область опухоли. Доза должна быть выбрана с учетом таких факторов, как вес тела и состояние здоровья пациента, природа подлежащей лечению болезни, спектр терапевтической активности применяемого соединения, растворимость и т.п. Соответствующая регулировка дозы находится в компетенции специалиста в данной области. Например, для конъюгатов доксорубицина доза предпочтительно должна составлять от 10 до 1350 мг/м 2, однако, могут применяться также более высокие и более низкие дозы. Таким образом, еще одним объектом настоящего изобретения является применение соединения по изобретению для приготовления фармацевтической композиции, предназначенной для лечения рака. Кроме того, объектом изобретения является способ лечения рака, предусматривающий введение пациенту эффективного количества фармацевтической композиции по изобретению. Композиции могут применяться для лечения различных типов рака, а именно: 1) эпителиальных карцином, включая карциномы молочной железы, легкого, колоректальную карциному, карциному головы и шеи,поджелудочной железы, яичника, мочевого пузыря, желудка, кожи, эндометрия, яичек, пищевода, предстательной железы и почек; 2) карцином костной ткани и мягких тканей: остеосаркомы, хондросаркомы, фибросаркомы, злокачественной фиброзной гистиоцитомы (MFH), лейомиосаркомы; 3) гематопоэтических злокачественных опухолей: лимфомы Ходжкина и неходжкинской лимфомы; 4) нейроэктодермальных опухолей: опухолей периферической нервной системы, астроцитом, меланом; 5) мезотелиом. Композиции могут также применяться для лечения хронических воспалительных состояний, таких как ревматоидный артрит, остеоартрит, цирроз печени, фиброз легкого, артериосклероз и аномальное заживление раны. Еще одним объектом изобретения является способ лечения рака, предусматривающий введение пациенту пролекарства, где пролекарство может быть превращено в цитотоксическое или цитостатическое лекарство в результате ферментативной активности, при этом ферментативная активность обусловливается продуктом,который экспрессируется клетками, связанными с опухолевой тканью. Предпочтительно ферментативная активность представляет собой протеолитическую активность FAP. Одним из методов введения соединений является внутривенная инфузия. Другие возможные пути введения включают внутрибрюшинную (посредством болюса или инфузии),внутримышечную или внутриопухолевую инъ 005204 26 екцию. При необходимости также можно использовать непосредственное введение (например, в случае фиброза легкого). Описание чертежей Фиг. 1 - расщепление конъюгатов доксорубицин-пептид с помощью FAP. Приведены хроматограммы(Z-Gly-(L)-Proдоксорубицин) после инкубации с очищенным слитым протеином FAPmCD8 (А) или с буфером (Б) (см. пример 5). Фиг. 2 - уменьшение цитотоксичности доксорубицина в результате конъюгации доксорубицина с пептидами, которые могут быть расщеплены с помощью FAP (см. пример 6). Фиг. 3 - демонстрация цитотоксического действия доксорубицина, высвобожденного из конъюгатов доксорубицин-пептид, которые могут расщепляться с помощью FAP, в результате экспрессии FAP клетками клона НТ 1080 33 по сравнению с родительскими клетками линии НТ 1080 (см. пример 8). Фиг. 4 - стабильность N-Сbz-Сlу-(L)-Ргодоксорубицина и N-Cbz-(L)-Рrо-(L)-Аlа-Glу-(L)Рrо-доксорубицина в плазме мыши и человека(см. пример 9). Фиг. 5 - демонстрация ферментативной активности FAP и определение его средней молекулярной массы в образцах опухолевых тканей человека (см. пример 12). Специалисту в данной области должно быть очевидно, что несмотря на то, что в приведенных ниже примерах описаны конкретные реагенты и условия реакций, могут использоваться их модификации, которые следует рассматривать как подпадающие под объем изобретения. Таким образом, приведенные ниже примеры предназначены для более подробного пояснения изобретения, но не направлены на ограничение его объема. Примеры Пример 1. Процессы синтеза конъюгатов доксорубицина.N-Cbz-Gly-Pro-доксорубицин: взвешивали N-Cbz-Gly-Pro (116,1 мг, 0,37 ммоля) и Nгидроксисукцинимид (44 мг, 0,37 ммоля) и вносили в двугорлую круглодонную колбу в атмосфере N2. Добавляли безводный N,Nдиметилформамид (20 мл) и колбу охлаждали до 0 С в ледяной бане. Добавляли дициклогексилкарбодиимид (78 мг, 0,37 ммоля) в виде раствора в N,N-диметилформамиде объемом 1 мл. Раствор перемешивали в течение 40 мин при 0 С. Взвешивали доксорубицинНСl (100 мг,ммоля), вносили в сосуд, снабженный небольшой мешалкой и помещали в атмосферу N2. В сосуд добавляли при перемешивании N,Nдиметилформамид (3 мл) и N,N-диизопропилэтиламин (33,1 мкл, 0,19 ммоля). Раствор доксорубицина с помощью шприца добавляли к раствору пептида и сосуд дополнительно про 27 мывали 2 мл N,N-диметилформамида. Ледяную баню удаляли и реакционную смесь перемешивали в течение приблизительно 48 ч при комнатной температуре. Реакционный раствор экстрагировали этилацетатом (500 мл). Этилацетатный слой промывали последовательно 10%-ным раствором лимонной кислоты (250 мл), насыщенным водным раствором бикарбоната натрия (250 мл) и соляным раствором (250 мл). Органический экстракт сушили над безводным MgSO4 и растворитель удаляли с помощью роторного испарителя. Продукт, содержащий большое количество примеси в виде ДМФ, подвергали экспресс-хроматографии с обращеной фазой на колонке типа С-18, используя в качестве элюента смесь метанол:вода (8:2). Выделяли одно пятно оранжевого цвета, время удерживания (rf) которого составляло 0,3, флуоресцировавшее при освещении длинноволновым УФ-светом. Метанол удаляли с помощью роторного испарителя, а последние следовые количества растворителя удаляли в течение ночи с помощью высоковакуумного насоса.N-Cbz-Pro-Ala-Gly-Pro: N-Cbz-Pro-Ala (5 г,15 ммолей) и карбонилдиимидазол (2,43 г, 15 ммолей) вносили в атмосфере аргона в трехгорлую круглодонную колбу объемом 250 мл. Добавляли безводный тетрагидрофуран (50 мл) и раствор перемешивали при комнатной температуре в течение приблизительно 45 мин. При этом происходило интенсивное выделение газа(СО 2). Взвешивали Gly-Pro-OCH3HCl (2,9 г, 15 ммолей) и вносили отдельную колбу. Добавляли тетрагидрофуран (5 мл) и N,N-диизопропилэтиламин (5,23 мл, 30 ммолей) и раствор перемешивали в течение нескольких минут. Растворенный продукт добавляли с помощью шприца к активированному пептиду, оставшийся продукт растворяли в минимальном количестве СН 2 Сl2 и также добавляли с помощью шприца к активированному пептиду. Реакционный раствор перемешивали в течение ночи при комнатной температуре (15 ч) и к утру образовывалось значительное количество осадка белого цвета. Реакционную смесь промывали 10%-ным водным раствором лимонной кислоты (300 мл) и экстрагировали этилацетатом (500 мл). Этилацетатный экстракт промывали насыщенным водным раствором бикарбоната натрия (300 мл) и сушили в присутствии соляного раствора (300 мл) и безводного MgSO4. Этилацетат удаляли с помощью роторного испарителя, получая 5 г бесцветного масла, обладавшего удовлетворительными характеристиками. Неочищенное масло, представляющее собой N-Cbz-Pro-Ala-Gly-Рrо-ОСН 3 (5 г, 12 ммолей), растворяли в метаноле (20 мл) в круглодонной колбе. Колбу помещали в водяную баню при температуре окружающей среды. Осторож 005204 28 но добавляли 1 н. раствор гидроксида натрия (12 мл). Раствор перемешивали в течение 3,5 ч, после чего добавляли 1 н. раствор НСl (12 мл). Раствор концентрировали на роторном испарителе и добавляли еще несколько капель 1 н. раствора НСl до достижения значения рН приблизительно 1,5, которое определяли с помощью лакмусовой бумаги. Воду удаляли с помощью вакуумного насоса, получая продукт в виде масла, который медленно перекристаллизовывали из этанола.(15 мл). 1-Гидроксибензотриазол (51,3 мг, 38 ммолей) и дициклогексилкарбодиимид (78 мг,38 ммолей) каждый растворяли в 1 мл N,Nдиметилформамида и добавляли в виде растворов к пептиду. Реакционную смесь перемешивали при комнатной температуре в течение 45 мин. Взвешивали доксорубицин НСl (116 мг, 20 ммолей), вносили в отдельный сосуд и растворяли в N,N-диметилформамиде (3 мл). В сосуд,содержащий доксорубицин, вносили с помощью шприца N,N-диизопропилэтиламин (34,8 мкл,20 ммолей) и содержимое перемешивали в течение нескольких минут для обеспечения полного растворения. Раствор доксорубицина добавляли с помощью шприца к активированному пептиду. Раствор перемешивали в течение 48 ч при комнатной температуре. Продукт экстрагировали этилацетатом (2 л) и промывали 10%-ным водным раствором лимонной кислоты (500 мл). Этилацетатный слой отделяли, сушили над MgSO4 и концентрировали на роторном испарителе, получая продукт в виде масла. Масло подвергали хроматографии с обращенной фазой на колонке типа С-18 на силикагеле, получая пятно оранжевого цвета rf = 0,25, которое флуоресцировало при освещении длинноволновым УФ-светом. Конечный продукт обладал удовлетворительными характеристиками. Пример 2. Получение линий клеток, экспрессирующих FAP. Получали линии клеток млекопитающих,экспрессирующие рекомбинантный FAP. Хорошо известные клетки фибросаркомы НТ 1080,которые могут быть получены от DSMZ (Немецкая коллекция микроорганизмов и клеточных культур, Брауншвейг, Германия) под регистрационным номером DSMZ ACC 315, поддерживали в смеси DMEM/F12 (50:50), включающей 10% фетальной бычьей сыворотки, в атмосфере, содержащей 95% воздуха и 5% СO2. Клетки линии НТ 1080 трансфектировали вектором FAP.38 (WO 97/34927, Scanlan и др., в указанном месте) с помощью метода с использованием липофектина согласно инструкциям производителя (фирма Gibco/BRL). Подвергнутые 29 трансфекции клетки отбирали по признаку устойчивости к антибиотикам (200 мкг/мл генетрицина) и затем поддерживали в среде, содержащей генетрицин. Отбирали отдельные колонии устойчивых клеток, выращивали до конфлуенции на чашках Петри для культур тканей диаметром 10 см и анализировали в отношении экспрессии FAP с помощью иммунофлуоресцентного анализа с использованием FAPспецифического моноклонального антитела F19 согласно описанному в литературе методу(Garin-Chesa и др. Proc. Natl. Acad. Sci. USA 87(18), 7235-7239 (1990. С помощью иммунофлуоресцентного анализа для родительской линии клеток НТ 1080 не было обнаружено заметной экспрессии FAP, тогда как один клон,обозначенный далее как клон НТ 1080 33, оказался позитивным в отношении экспрессииFAP. Аналогично этому клетки почки эмбриона человека линии 293, которые являются хорошо известными и могут быть получены от Американской коллекции тканевых культур (Роквилл,штат Мэриленд), выращивали в среде DMEM,дополненной 10% фетальной бычьей сыворотки,в атмосфере, содержащей 95% воздуха и 5% СO2. Клетки трансфектировали вектором, экспрессирующим FAP, т.е. pFAP.38, путем трансфекции с использованием фосфата кальция согласно описанному в литературе методу (Park(1994. Отбор и анализ трансфектантов осуществляли согласно методу, описанному выше применительно к экспрессии FAP. Для родительской линии клеток 293 не было обнаружено заметной экспрессии FAP. Один клон, обозначаемый далее как 293-I/2, оказался позитивным в отношении FAP. Пример 3. Исследование экспрессии FAP в трансфектированных линиях клеток. Экспрессию FAP исследовали в клетках линии НТ 1080 и клона НТ 1080 33. Метаболическое мечение, иммунопреципитацию и флуорографию осуществляли в основном следуя описанному в литературе методу (Park и др., Somatic Cell Mol. Genet. 17(2), 137-150 (1991. Клетки линии НТ 1080 и клона 33 линии НТ 1080 метаболически метили с помощью 35Sметионина. Экстракты, полученные с помощью детергентов, подвергали иммунопреципитации с помощью моноклонального антитела F19 или мышиного антитела IgGl в качестве отрицательного контроля. Осадки кипятили в буфере для образцов и разделяли с помощью гельэлектрофореза с использованием додецилсульфата натрия (согласно методу, описанному у 30 Флуорографический анализ полученного геля показал, что клетки клона 33 линии НТ 1080 продуцируют протеин FAP. Ни в экстрактах родительских клеток линии НТ 1080, ни в образцах, подвергнутых иммунопреципитации, полученных с помощью мышиного IgGl, протеинFAP. Растворимую рекомбинантную форму протеина FAP получали следующим образом. кДНК, кодирующую внеклеточный доменCD8, лигировали с кДНК, кодирующей внеклеточный домен FAP (аминокислоты 27-760),получая конструкцию слитого протеина, а именно, FAPmCD8, аналогичную по структуре лиганду слитого протеина CD8a-CD40, согласно описанному ранее методу (Lane и др. J. Exp.Med. 177(4), 1209-1213 (1993. кДНК проверяли путем секвенирования и встраивали в векторpVL1393. Трансфекцию клеток линии Sf9 и амплификацию полученного рекомбинантного бакуловируса осуществляли согласно описанному в литературе методу (O'Reilly, BaculovirusUniversity Press, New York (1994. Супернатант культуры High Five-клеток, зараженных рекомбинантным бакуловирусом FAPmCD8 и выращенных в течение 4 дней, собирали и очищали путем ультрацентрифугирования. Слитый протеин FAPmCD8 очищали из этих супернатантов с использованием моноклонального антитела кFAP, иммобилизованного на активированных агарозных шариках (фирма Pierce Chemical, Индианополис, штат Индиана, США). Супернатант культуры пропускали через колонку с высокой аффинностью к антителу и элюировали с помощью сдвига значения рН с использованием 0,1 М цитратного буфера, рН 3. Образцы сразу же нейтрализовали с помощью насыщенного раствора Трис (фирма Sigma Chemicals, Сент-Луис,штат Миссури) и объединяли содержащие протеин фракции. Пример 5. Оценка расщепления конъюгатов доксорубицин-пептид. Образцы разделяли с помощью метода жидкостной хроматографии высокого разрешения (ЖХВР) с обращенной фазой, адаптированного для измерения расщепления конъюгатов доксорубицин-пептид. ЖХВР-система включала автоматический аппликатор образцов типа Waters 717, снабженный 100-микролитровой (мкл) петлей, и два насоса типа Waters модель 510 для введения растворителей. Разделения осуществляли в изократических условиях при скорости потока 0,7 мл/мин на колонке типа Nucleosil С 18, длиной 100 мм, внутренним диаметром 4 мм, с размером частиц носителя 5 мкм (фирма 31 фаза представляла собой смесь метанол:вода(70:30, об./об.), содержащую 0,2 М ацетат аммония, значение рН которой доводили до 3,2. Свободный доксорубицин и конъюгаты доксорубицин-пептид обнаруживали с помощью флуоресценции (длина волны возбуждения 475 нм; длина волны испускания 585 нм) с использованием флуоресцентного детектора типа Waters 474. Инъекцию, введение растворителя, сбор данных и анализ данных осуществляли с использованием программного обеспечения для хроматографии типа Millennium 2010 (фирма Waters Corp.,Милфорд, штат Миннесота, США). Вещества,подлежащие тестированию, сначала растворяли в диметилсульфоксиде до получения концентрации 5 мМ, а затем разводили в водном растворе перед внесением в колонку для ЖХВР. Исследовали способность растворимого рекомбинантного фермента FAP высвобождать свободный доксорубицин из конъюгатов доксорубицин-пептид. Маточные растворы конъюгатов доксорубицин-пептид (5 мМ) разбавляли забуференным Hepes физиологическим раствором, рН 7,4, до получения конечной концентрации 50-100 мкМ. 20 мкл образовавшегося раствора смешивали с 50 мкл описанного выше очищенного слитого протеина FAPmCD8 (приблизительно 20 нг) и 30 мкл забуференногоHepes физиологического раствора, рН 7,4. Смесь инкубировали при 37 С в течение 1 дня и высвобождение свободного доксорубицина оценивали путем указанного выше анализа с помощью ЖХВР. Площади под каждым пиком оценивали количественно с помощью указанного выше программного обеспечения, при этом исходное значение принимали за 100%. Скорость высвобождения свободного доксорубицина оценивали по появлению пика с таким же временем удерживания, что и у свободного доксорубицина в рассматриваемых условиях для ЖХВР. Величины площадей под каждым пиком использовали для вычисления отношений количества свободного доксорубицина к количеству конъюгата доксорубицин-пептид. Интегрирование площадей пиков для определения процента расщепления осуществляли с помощью указанного выше программного обеспечения для хроматографии типа Millennium 2010. Как видно на хроматограммах для ZGP-Dox (N-Cbz-Gly-Proдоксорубицин), представленных на фиг. 1,конъюгат доксорубицин-пептид может быть превращен в свободный доксорубицин после инкубации с очищенным слитым протеиномFAPmCD8, но время удерживания конъюгата не изменялось в результате инкубации с буфером. Пример 6. Уменьшение цитотоксичности доксорубицина путем конъюгации с пептидами,которые могут расщепляться с помощью FAP. Определяли способность пептидов, которые могут расщепляться с помощью FAP, блокировать цитотоксическое действие доксоруби 005204K562, которые могут быть получены от Американской коллекции типовых культур, Роквилл,штат Мэриленд, США (АТСС-номер: CCL-243),высевали в 96-луночные планшеты (фирмаGreiner Scientific) с плотностью 1000 клеток/лунку. К клеткам добавляли бессывороточную среду для культуры клеток, содержащую различные концентрации свободного доксорубицина или эквивалентные молярные концентрации конъюгатов доксорубицин-пептид. Через 4 дня определяли количество клеток с использованием автоматического счетчика клеток типа CASY (фирма Scharfe SystemGmbH, Реутлинген, Германия). Результаты представлены на фиг. 2. Пример 7. Высвобождение свободного доксорубицина с помощью связанного с клетками FAP. Исследовали способность связанного с клетками фермента FAP высвобождать свободный доксорубицин из конъюгатов доксорубицин-пептид. Каждый конъюгат растворяли в бессывороточной среде для культуры клеток до конечной концентрации 1 мкМ. 10 мл этого раствора добавляли к конфлуэнтным монослоям клеток линии НТ 1080 или клона 33 линии НТ 1080, находящимся в планшетах для культуры ткани диаметром 10 см, и выдерживали в течение 19 ч при 37 С. Среду удаляли и высвобождение доксорубицина оценивали согласно методу, описанному в примере 5. Линия клеток,экспрессирующих FAP, т.е. клон НТ 1080 33,превращала в свободный доксорубицин 81% и 43% конъюгатов ZGP-Dox (N-Cbz-Gly-Proдоксорубицин) и ZPAGP-Dox (N-Cbz-Pro-AlaGly-Рrо-доксорубицин) соответственно. Родительская линия клеток НТ 1080 в таких же условиях превращала в свободный доксорубицин только 9% ZGP-Dox. В этих же условиях родительская линия НТ 1080 превращала в свободный доксорубицин лишь незначительное количество ZPAGP-Dox или это количество не могло быть обнаружено. Пример 8. Уничтожение чувствительных клеток высвобождаемым с помощью FAP доксорубицином. Оценивали способность FAP образовывать свободный доксорубицин, обладающий способностью уничтожать чувствительные к доксорубицину клетки. Клетки линии K562,которые могут быть получены от Американской коллекции типовых культур, Роквилл, штат Мэриленд, США (АТСС-номер: CCL-243), высевали на 96-луночные планшеты (фирма GreinerScientific) с плотностью 1000 клеток/лунку. Бессывороточную среду, содержащую 1 мкМ конъюгата доксорубицин-пептид добавляли к клеткам линии НТ 1080 или клона 33 линии НТ 1080,находящимся в планшетах для культуры ткани 33 диаметром 10 см, и выдерживали в течение 19 ч при 37 С. Среду удаляли и высвобождение доксорубицина оценивали согласно методу, описанному в примере 5. Затем 66 мкл этой среды добавляли в каждую лунку к клеткам линииK562. Через 4 дня определяли количество клеток с использованием автоматического счетчика клеток типа CASY. Результаты представлены на фиг. 3. Пример 9. Стабильность конъюгатов доксорубицин-пептид в плазме. Стабильность конъюгатов доксорубицинпептид в плазме оценивали с помощью методов,описанных в примере 5. Образцы, содержащие конъюгаты доксорубицин-пептид (в концентрации 1 мкМ) инкубировали в присутствии 10 об.% мышиной или человеческой плазмы при 37 С в течение указанных периодов времени. Результаты для ZGP-Dox и ZPAGP-Dox после инкубации в мышиной или человеческой плазме представлены на фиг. 4. Пример 10. Катализируемое FАР расщепление определенных конъюгатов 4-метокси-нафтиламид-пептид. Для выявления предпочтительных дляFAP пептидных субстратов синтезировали олигомеры, состоящие из встречающихся в естественных условиях и/или не встречающихся в естественных условиях аминокарбоновых кислот и подвергали их сочетанию с пролин-4 метоксинафталинамином (Pro-MNA) с использованием методов, известных в данной области (Е. Wunsch, Synthese von Peptiden, в(ред-ры E. Muller, O. Bayer), том XV, части 1 и 2, изд-во Georg Thieme, Штутгарт, 1974). Синтез Pro-Pro-4-метоксинафтиламида. Воc-Pro (32 мг, 0,15 ммоля), тетрафторборат 2-(1 Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония (53 мг, 0,15 ммоля) и гидрохлорид Рrо-4-метоксинафтиламида (46 мг, 0,15 ммоля) растворяли в смеси безводный N,Nдиметилформамид/тетрагидрофуран 1:1 (4 мл). Добавляли N-этилдиизопропиламин (0,26 мл,0,44 ммоля), растворенный в N-метилпирролидоне (1,7 мол.) и смесь перемешивали в течение ночи при комнатной температуре. Растворитель удаляли с помощью роторного испарителя и остаток растворяли в этилацетате (10 мл) и трижды экстрагировали водой. Органический слой сушили над безводнымNa2SO4 и растворитель удаляли с помощью роторного испарителя. Остаток растворяли в смеси трифторуксусная кислота/дихлорметан (1:4,25 мл) и давали прореагировать в течение 1 ч. Растворитель удаляли с помощью роторного испарителя и полученное масло сушили в потоке азота. Неочищенный продукт очищали с помощью препаративной ЖХВР с обращенной фазой с использованием градиента ацетонитрила/воды. Продукт имел удовлетворительные 34 аналитические характеристики (ЯМР и массспектры). Затем с помощью флуориметра типа Cytofluor (фирма PerSeptive Biosystems, Inc.) оценивали высвобождение свободного MNA из пептидов, используя набор фильтров для длины волны возбуждения 355 нм/длины волны испускания 405 нм. Кинетические параметры фермента (значения константы Михаэлиса-Ментен Кm и(1977, для фермента FAP, выделенного из экстрактов мембран трансфектированных 293i/2-клеток, описанных в примере 2. Таблица 1. Значения Km и kcat для катализируемого FAP расщепления определенных конъюгатов 4-метоксинафтиламид (MNА)пептид.MNAсвязанных пептидов в отношении FAP в сравнении с DPP-IV. Среди известных представителей семейства серинолигопептидаз, обладающих специфичностью в отношении пролила, наиболее близким к FAP ферментом является DPP-IV. Поскольку активный DPP-IV обнаружен в плазме и во многих различных типах клеток, то необходима оптимизация относительной (необязательно) избирательности пептидных пролекарств дляFAP по сравнению с DPP-IV для того, чтобы уменьшить нежелательное превращение пролекарства в областях, отличных от опухоли (например, в плазме). Для выявления пептидов,обладающих специфичностью в отношенииFAP, способность FAP расщеплять MNAсвязанные пептиды сравнивали со способностью DPP-IV расщеплять те же самые пептид 35 ные конъюгаты. Высобождение свободногоMNA оценивали согласно методу, описанному в примере 9. Результаты представлены в табл. 2. Таблица 2. Сравнение избирательной способности FAP и DPP-IV в отношении расщепления конъюгатов MNA-пептид. Специфичность расщепления+ обозначает фермент, обладающий способностью расщеплять субстрат;- обозначает отсутствие расщепления. Пример 12. Активность FAP в образцах опухоли. Ферментативную активность FAP измеряли в образцах опухоли человека. 96-луночные планшеты для ELISA (твердофазный иммуноферментный анализ) (фирма Costar, Корнинг,штат Нью-Джерси) сенсибилизировали в течение ночи при 4 С с использованием 1 мкг/мл антитела F19 или контрольного антитела в забуференном фосфатом физиологическом растворе (ЗФР), рН 7,4. Затем лунки промывали буфером для отмывки (ЗФР, 0,1% Tween 20, рН 7,4) и избыток сайтов связывания блокировали в течение 1 ч при комнатной температуре блокирующим буфером (5% бычий сывороточный альбумин в ЗФР, рН 7,4). Измеряли активностьFAP в опухолевой ткани (закрашенные символы) или в соответствующей нормальной контрольной ткани (соответствующие незакрашенные символы) из экстрактов мембран, обогащенных конкавалином А (фиг. 5 а). Образцы опухолей включали рак молочной железы (Н,9),ободочной кишки , метастазы опухоли ободочной кишки в печеньи рак легкого (,). Экстракты вносили на сенсибилизированные с помощью F19 планшеты и инкубировали в течение 1 ч при комнатной температуре. Несвязанный продукт удаляли, лунки трижды промывали буфером для отмывки и ферментативную активность FAP анализировали в течение 1 ч при 37 С с использованием 100 мкл Ala-ProAFC согласно методу, описанному в WO 97/34927. Для каждого экстракта оценивали первые две конкавалин А-фракции и результаты каждого измерения по отдельности наносили на график. Из каждого значения вычитали фоновую флуоресценцию (измеренную для планшетов, сенсибилизированных с помощью контрольного антитела). Независимое биохимические данные о ферментативной активности FAP и его средней молекулярной массе в экстрактах опухолевых тканей получали путем мечения вышеуказанных экстрактов ткани с использованием 14 Сдиизопропилфторфосфата (DPP; фирма NENDuPont, Cologne, Германия). Известно, что DPP 36 ковалентно и необратимо связывается с активными сайтами серина многих серинпротеаз,препятствуя тем самым дальнейшему катализуC-DFP FAP, выделенного с помощью иммунопреципитации из опухоли (Т), соответствующей образцу опухоли ободочной кишки, обозначенному символомна фиг. 5. Анализ с помощью электрофореза в полиакриламидном геле в присутствии додецилсульфата натрияSomatic Cell Mol. Genet. 17(2), 137-150 (1991 этих образцов позволил выявить присутствие меченого протеина с молекулярной массой 95 кДа в образце раковой ткани ободочной кишки. Ни для соответствующего контрольного образца, полученного иммунопреципитацией (N), ни для контрольного антитела не было выявлено полос, несущих радиоактивную метку. Величина средней молекулярной массы меченного с помощью 14 С протеина, полученного путем иммунопреципитации, которая представлена на фиг. 5, согласуется с опубликованными ранее данными для FAP (Rettig W. J., Su S. L., Fortunato S. R., Scanlan M. J., Mohan Raj B. K., GarinChesa P., Healey J. H. и Old L. J., Fibroblast activation protein: Purification, epitope mapping andinduction by growth factors. Int. J. Cancer 58(3),385-392 (1994); WO 97/34927). Пример 13. Получение защищенных олигопептидов. Защищенные олигопептиды получали либо в растворе согласно протоколам, известным из существующего уровня техники (см., например,у М. Bodanszky и A. Bodanszky, The practice ofPeptide Synthesis, 2-е изд., изд-во Springer,Нью-Йорк, 1994), либо с помощью твердофазного синтеза с использованием автоматического синтезатора пептидов типа Applied Biosystems модель 430 А. Удаление защитных групп и отделение олигопептида от смоляной подложки осуществляли путем обработки смесями трифторуксусной кислоты и широко используемых акцепторных добавок. Очистку осуществляли с помощью жидкостной хроматографии высокого давления с обращенной фазой на колонках типа С 18 на силикагеле с использованием градиента 37 0,1%-ного водного раствора трифторуксусной кислоты/ацетонитрила. Идентичность и гомогенность пептидов подтверждали с помощью жидкостной хроматографии высокого давления и масс-спектрометрического анализа. Олигопептиды, полученные таким методом, представлены в табл. 3. Таблица 3. Олигопептиды.Fmoc-Pro-Ala-Gly-Pro-OH (44 мг, 0,078 ммоля) растворяли в безводном N,N-диметилформамиде (10 мл) и значение рН доводили до 7,5 с помощью N,N-диизопропилэтиламина. Добавляли N-гидроксисукцинимид (1M В ТГФ,78 мкл, 0,078 ммоля) и смесь охлаждали в ледяной бане. Добавляли при перемешивании дициклогексилкарбодиимид (1M в ДМФ, 87 мкл,0,087 ммоля) и раствор перемешивали в течение 1 ч при 0 С. 38 ДоксорубицинНСl (25 мг, 0,043 ммоля) растворяли в 20 мл безводного ДМФ и добавляли N,N-диизопропилэтиламин (8,2 мкл, 0,048 ммоля). Эту смесь с помощью шприца добавляли к активированному пептиду. Реакционной смеси давали нагреться до комнатной температуры и ее перемешивали в течение 48 ч. Затем растворитель удаляли и продукт очищали с помощью препаративной ОФ-ЖХВР на колонках типа С 18, используя градиент воды/ацетонитрила с добавлением 0,1%-ной трифторуксусной кислоты. Выход по данным аналитической ЖХВР 90%; ES-MC 1110,5 ([M+Na]+); 674,4. Пример 15. Получение H-Pro-Ala-Gly-ProDox.Fmoc-PAGP-Dox (полученный в примере 14, 44 мг, 0,040 ммоля) растворяли в смеси ТГФ/диэтиламин (2:1, 20 мл) при 0 С и перемешивали в течение 2 ч. Растворитель удаляли и продукт очищали с помощью препаративной ОФ-ЖХВР на колонках типа С 18, используя градиент воды/ацетонитрила с добавлением 0,1%-ной трифторуксусной кислоты. Выход по данным аналитической ЖХВР 90%; ES-MC 866,6 [М+Н]+, 452,4. Пример 16. Получение H-Chg-Pro-Dox.Fmoc-Chg-Pro-OH (46 мг, 0,096 ммоля) растворяли в безводном N,N-диметилформамиде (10 мл) и значение рН доводили до 7,5 с помощью N,N-диизопропилэтиламина. Добавляли N-гидроксисукцинимид (1M в ДМФ, 96 мкл, 0,096 ммоля) и смесь охлаждали в ледяной бане. Добавляли при перемешивании дициклогексилкарбодиимид (1M B ДМФ, 107 мкл, 0,107 ммоля) и раствор перемешивали в течение 1 ч при 0 С. ДоксорубицинНСl (31 мг, 0,053 ммоля) растворяли в 20 мл безводного ДМФ и добавляли N,N-диизопропилэтиламин (10 мкл, 0,059 ммоля). Эту смесь с помощью шприца добавляли к активированному пептиду. Реакционной смеси давали нагреться до комнатной температуры и ее перемешивали в течение 48 ч. Затем растворитель удаляли и продукт очищали с помощью препаративной ОФ-ЖХВР на колонках типа С 18, используя градиент вода/ацетонитрила с добавлением 0,1%-ной трифторуксусной кислоты. Лиофилизированный продукт растворяли в смеси ТГФ/диэтиламин (2:1, 20 мл) при 0 С и перемешивали в течение 2 ч. Растворитель удаляли и продукт очищали с помощью препаративной ОФ-ЖХВР на колонках типа С 18, используя градиент воды/ацетонитрила с добавлением 0,1%-ной трифторуксусной кислоты. Выход по данным аналитической ЖХВР 90%; ES-MC 780,2 ([М+Н]+); 366,4. В приведенной ниже табл. 4 указаны конъюгаты пептид-доксорубицин, которые получали аналогичным методом, а также данные о расщеплении с помощью FAP (через 20 ч). 40 Выход по данным аналитической ЖХВР 90%; ES-MC 593,0 ([М+Н]+). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I)N-Cbz-Gly-Pro-OH (22 мг, 0,072 ммоля) растворяли в безводном N,N-диметилформамиде (8 мл) и значение рН доводили до 7,5 с помощью N,N-диизопропилэтиламина. Добавляли N-гидроксисукцинимид (1M B ДМФ, 72 мкл, 0,072 ммоля) и смесь охлаждали в ледяной бане. Добавляли при перемешивании дициклогексилкарбодиимид (1M B ДМФ, 67 мкл, 0,67 ммоля) и раствор перемешивали при 0 С в течение 2 ч. Мелфалан (14,7 мг, 0,048 ммоля) растворяли в 30 мл безводного ДМФ и добавляли N,Nдиизопропилэтиламин (12,3 мкл, 0,072 ммоля). Эту смесь с помощью шприца добавляли к активированному пептиду. Реакционной смеси давали нагреться до комнатной температуры и ее перемешивали в течение 24 ч. Растворитель удаляли и продукт очищали с помощью препаративной ОФ-ЖХВР на колонках типа С 18, используя градиент воды/ацетонитрила с добавлением 0,1%-ной трифторуксусной кислоты. или его фармацевтически приемлемая соль,где R1 обозначает фрагмент формулы CgA, Cg-B-A или Cg-(D)m-B-A, гдеCg обозначает блокирующую группу, выбранную из ряда, включающего R5-CO, R5-OСО-, R5-NH-CO-, R5-SO2- или R5-, где R5 обозначает необязательно замещенную С 3 С 8 циклоалкильную, арильную, аралкильную или гетероарильную группу; А представляет собой фрагмент, являющийся производным аминокарбоновой кислоты,выбранной из ряда, включающего L-пролин,глицин, L-норлейцин, L-циклогексилглицин, L5-гидроксинорлейцин, L-6-гидроксинорлейцин,L-5-гидроксилизин, L-аргинин или L-лизин; и В и D, каждый независимо друг от друга,обозначает фрагменты, являющиеся производными аминокарбоновых кислот формулы -[NR6(X)P-CO]-, где X обозначает CR7R8 и где R6, R7 иR8, каждый независимо друг от друга, обозначает атом водорода, необязательно замещеннуюC1-С 6 алкильную, С 3-С 8 циклоалкильную, арильную или гетероарильную группу, и р обозначает 1, 2, 3, 4, 5; или В и D, каждый независимо друг от друга,обозначает фрагменты, являющиеся производными циклических аминокарбоновых кислот формулы где R9 обозначает С 1-С 6 алкил, ОН или NH2,m обозначает целое число от 1 до 10;Ra и Rb вместе с промежуточной N-Cгруппой образуют необязательно замещенное,необязательно сконденсированное с бензо- или циклогексаногруппой 3-7-членное насыщенное или ненасыщенное гетероциклическое кольцо, в котором одна или две СН 2-группы также могут быть замещены NH, О или S,R4 обозначает Н иCyt' обозначает фрагмент цитотоксического или цитостатического соединения. 2. Соединение формулы I по п.1, где гетероциклическое кольцо, образованное Ra, Rb и промежуточной N-C-группой, замещено R2 и R3,при этом R2 и R3, каждый независимо друг от друга, обозначает атом водорода или атом гало 41 гена или С 1-С 6 алкил, C1-С 6 алкиламино, диС 1 С 6 алкиламино, C1-С 6 алкокси, тиол, С 1-С 6 алкилтио, оксо, имино, формил, С 1-С 6 алкоксикарбонил, аминокарбонил, С 3-С 8 циклоалкил, арил или гетероарил. 3. Соединение формулы IA 42 8. Соединение по п.1, где -HN-Cyt' обозначает антрациклиновое производное. 9. Соединение по п.8, выбранное из соединений формул (IIIА), (IIIВ), (IIIЕ) и (IIIF) где R1, R4 и Cyt' имеют значения, указанные в любом из предыдущих пунктов, R2 и R3 имеют значения, определенные в п.2, и X-Y обозначает где R1 и Cyt' имеют значения, указанные в п.1,R4 означает Н,выбранное из соединений формул IA2,IА 3, IA4 и IA5 6. Соединение по любому из предыдущих пунктов, где R1 обозначает группу, выбранную из формул (21), (22) и (34)(34),где Cg обозначает атом водорода или блокирующую группу, выбранную из ряда, включающего бензоилоксикарбонил, фенилацетил,фенилметилсульфонил и бензиламинокарбонил; Хаа обозначает фрагмент, полученный из аминокарбоновой кислоты, иm обозначает целое число от 1 до 6. 7. Соединение по п.6, где фрагменты аминоалкановой кислоты находятся в (L)конфигурации. 10. Применение соединения по любому из предыдущих пунктов в качестве терапевтического агента. 11. Фармацевтическая композиция, включающая соединение по любому из пп.1-9 и необязательно один или несколько фармацевтически приемлемых эксципиентов. 12. Применение соединения по любому из пп.1-9 для приготовления фармацевтической композиции, предназначенной для лечения рака. 13. Способ получения соединения формулы I по п.1, отличающийся тем, что соединение формулы (V) где R1, Ra и Rb имеют значения, указанные в п.1,X1 обозначает ОН или уходящую группу, которая может быть замещена аминогруппой,подвергают взаимодействию с соединением формулы HN(R4)-Cyt', где Cyt' обозначает фрагмент цитотоксического или цитостатического соединения и R4 имеет значения, указанные в п.1, с последующим выделением целевого продукта. 14. Способ лечения рака, предусматривающий введение пациенту, нуждающемуся в таком лечении, фармацевтической композиции по п.11 в течение времени и при условиях, эффективных для ингибирования пролиферации клеток опухоли. 15. Способ лечения рака, предусматривающий введение пациенту, нуждающемуся в таком лечении, соединения по п.1 в количестве,эффективном для ингибирования пролиферации клеток опухоли, в течение времени и при усло 005204 44 виях, эффективных для ингибирования пролиферации клеток опухоли. 16. Способ лечения заболевания, выбранного из ряда, содержащего эпителиальные карциномы, включая карциномы молочной железы, легкого, колоректальную карциному, карциному головы и шеи,поджелудочной железы, яичника, мочевого пузыря, желудка, кожи, эндометрия, яичек, пищевода, предстательной железы и почек; саркомы костной ткани и мягких тканей,включая остеосаркомы, хондросаркомы; фибросаркому, злокачественную фиброзную гистиоцитому (MFH) и лейомиосаркому; гематопоэтические злокачественные опухоли, включая лимфому Ходжкина и неходжкинскую лимфому; нейроэктодермальные опухоли, включая опухоли периферической нервной системы, астроцитомы и меланомы; и мезотелиомы, предусматривающий введение пациенту, нуждающемуся в таком лечении,соединения по п.1 в количестве, эффективном для ингибирования пролиферации клеток опухоли.
МПК / Метки
МПК: C07K 1/107, A61P 35/00, A61K 38/04
Метки: фибробластов, fap, соединения, активируемые, протеином, активации, противоопухолевые
Код ссылки
<a href="https://eas.patents.su/24-5204-protivoopuholevye-soedineniya-aktiviruemye-proteinom-aktivacii-fibroblastov-fap.html" rel="bookmark" title="База патентов Евразийского Союза">Противоопухолевые соединения, активируемые протеином активации фибробластов (fap)</a>
Предыдущий патент: Спирогетероциклические нитрилы, пригодные для применения в качестве обратимо действующих ингибиторов цистеиновых протеаз
Следующий патент: Замещенные пиразолы как ингибиторы р38 киназы
Случайный патент: Шестизвенный механизм переменной структуры












