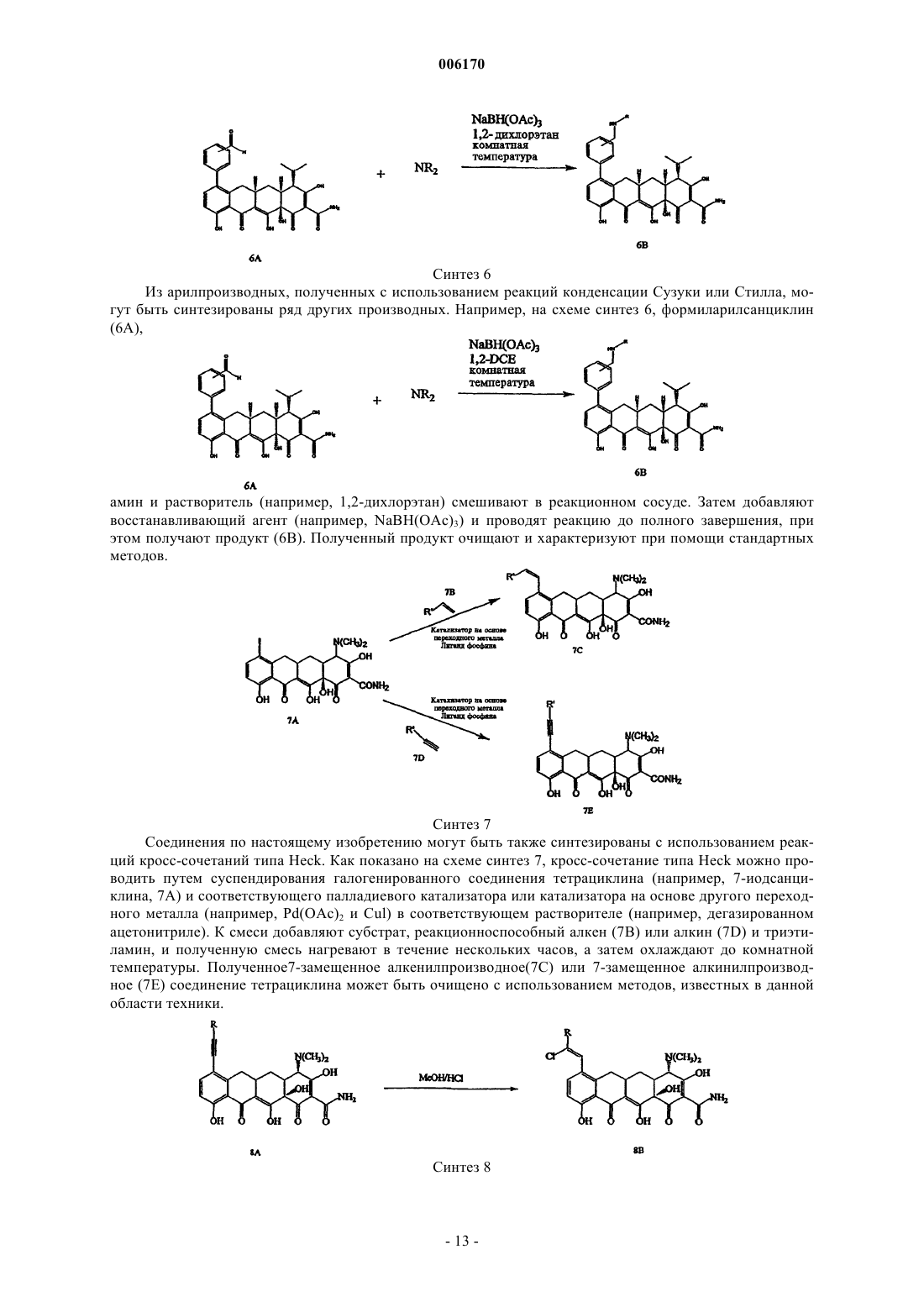
Замещенные соединения тетрациклина (варианты), фармацевтическая композиция и способ лечения чувствительного к тетрациклину состояния субъекта
Номер патента: 6170
Опубликовано: 27.10.2005
Авторы: Виски Питер, Ренни Глен, Коуза Дэррелл, Уорчол Тэд, Верма Атул, Бхатиа Бина, Фречетт Роджер, Мессершмит Дэвид, Макинтайр Лора, Нельсон Марк Л., Хокинс Пол, Измаил Мохамед, Шихэн Пол, Баузер Тодд, Банадарадж Юпул
Формула / Реферат
1. Замещенные соединения тетрациклина общей формулы I

где X означает CHC(R13Y'Y), CR6'R6, C=CR6'R6, S, NR6 или O;
R2, R2', R4' и R4'', каждый независимо, означает водород, C1-C4алкил, C2-C6алкенил, C2-C6алкинил, C1-C4алкокси, C1-C4алкилтио, C1-C4алкилсульфинил, C1-C4алкилсульфонил, C1-C4алкиламино, C5-C10 арилC1-C4алкил, C5-C10арил, гетероциклический остаток, содержащий 3-5 атомов углерода и 1-2 атома N, гетероароматический остаток, включающий 1-3 атома N;
R4 означает NR4'R4'', C1-C4алкил, C2-C6алкенил, C2-C6алкинил, C5-C10арил, гидроксил, галоген;
R2', R3, R10, R11 и R12 каждый означает водород или остаток пролекарства;
R5 означает гидроксил, водород, радикал тио, алканоил, ароил, алкароил, C5-C10арил, гетероароматический остаток, C1-C4алкил, C2-C6алкенил, C2-C6алкинил, C1-C4алкокси, C1-C4алкилтио, C1-C4алкилсульфинил, C1-C4алкилсульфонил, C1-C4алкиламино, C5-C10арилC1-C4алкил, C1-C4алкилкарбонилокси или C5-C10арилкарбонилокси;
R6 и R6' оба одновременно означают водород, образуют группу метилен, каждый независимо, означает водород, гидроксил, галоген, радикал тио, C1-C4алкил, C2-C6алкенил, C2-C6алкинил, C5-C10арил, C1-C4алкокси, C1-C4алкилтио, C1-C4алкилсульфинил, C1-C4алкилсульфонил, C1-C4алкиламино или C5-C10арилC1-C4алкил;
R7 означает нитро, C1-C10алкил (кроме метила), C2-C6алкенил, C2-C6алкинил, C5-C10арил, C1-C4алкокси, C1-C4алкилтио, C1-C4алкилсульфинил, C1-C4алкилсульфонил, C5-C10арилC1-C4алкил, амино, амидо, C5-C10арилC2-C6алкенил, C5-C10арилC2-C6алкинил или -(CH2)0-3NR7cC(=W')WR7a;
R9 означает водород, нитро, C1-C4алкил, алкенил, C2-C6алкинил, C5-C10арил, C1-C4алкокси, C1-C4алкилтио, C1-C4алкилсульфинил, C1-C4алкилсульфонил, C5-C10арилC1-C4алкил, амино, амидо, C5-C10арил C2-C6алкенил, C5-C10арилC2-C4алкинил, тионитрозо (например, -N=S), или -(CH2)0-3NR9cC(=Z')ZR9a;
Z означает CR9dR9e, S, NR9b или O;
Z' означает O, S или NR9f;
W означает CR7dR7e, S, NR7b или O;
W' означает O, NR7f, S;
R7a, R7b, R7c, R7d, R7e, R9a, R9b, R9c, R9d и R9e, каждый независимо, означает водород, C1-C6ацил, C1-C4 алкил, C2-C6алкенил, C2-C6алкинил, C1-C4алкокси, C1-C4алкилтио, C1-C4алкилсульфинил, C1-C4алкилсульфонил, C1-C4алкиламино,C5-C10арилC1-C4алкил, C5-C10арил, гетероциклический остаток, содержащий 3-5 атомов углерода и 1-2 атома N, гетероароматический остаток, включающий 1-2 атома N;
R8 означает водород, гидроксил, галоген, радикал тио, C1-C4алкил, C2-C6алкенил, C2-C6алкинил, C5-C10арил, C1-C4алкокси, C1-C4алкилтио, C1-C4алкилсульфинил, C1-C4алкилсульфонил, C1-C4алкиламино или C5-C10арилC1-C4алкил;
R13 означает водород, гидрокси, C1-C4алкил, C2-C6алкенил, C2-C6алкинил, C1-C4алкокси, C1-C4алкилтио, C1-C4алкилсульфинил, C1-C4алкилсульфонил, C1-C4алкиламино или C5-C10арилC1-C4алкил; и
Y' и Y, каждый независимо, означает водород, галоген, гидроксил, циано, сульфгидрил, амино, C1-C4алкил, C2-C6алкенил, C2-C6алкинил, C1-C4алкокси, C1-C4алкилтио, C1-C4алкилсульфинил, C1-C4алкилсульфонил, C1-C4алкиламино или C5-C10арилC1-C4алкил, и их фармацевтически приемлемые соли.
2. Соединение тетрациклина по п.1, отличающееся тем, что R4 означает NR4'R4", X означает CR6R6', а R2, R2', R6, R6', R8, R9, R10, R11 и R12 каждый означает водород, R4' и R4'' означают C1-C4алкил, а R5 означает гидрокси или водород.
3. Соединение тетрациклина по п.2, отличающееся тем, что R4' и R4'' каждый означает метил, а R5 означает водород.
4. Соединение тетрациклина по любому из пп.1-3, отличающееся тем, что R7 означает C5-C10арил.
5. Соединение тетрациклина по п.4, отличающееся тем, что R7 означает замещенный или незамещенный фенил.
6. Соединение тетрациклина по п.5, отличающееся тем, что указанный фенил замещен заместителем, выбранным из группы, содержащей C1-C4алкил, C2-C6алкенил, галоген, гидроксил, C1-C4алкокси, C1-C4алкилкарбонилокси, C1-C4алкилоксикарбонил,C5-C10арилкарбонилокси, C1-C4алкоксикарбониламино, C1-C4алкоксикарбонилокси, C5-C10арилоксикарбонилокси, карбоксилат, C1-C4алкилкарбонил, C1-C4алкиламинокарбонил, C5-C10арилC1-C4алкиламинокарбонил, C2-C6алкениламинокарбонил, C5-C10арилкарбонил, аминоC1-C4алкил, C5-C10арилC1-C4алкилкарбонил, C2-C6алкенилкарбонил, C1-C4алкоксикарбонил, силил, аминокарбонил, C1-C4алкилтиокарбонил, фосфат, арC1-C4алкил, фосфонато, фосфинато, циано, амиэю, C1-C6ациламино, амидо, имино, сульфгидрил, C1-C4алкилтио, сульфат, C5-C10арилтио, тиокарбоксилат, C1-C4алкилсульфинил, сульфонато, сульфамоил, сульфонамидо, нитро, азидо, гетероциклил, содержащий 3-5 атомов углерода и 1-2 атома N, C1-C4алкилC5-C10арил, C5-C10арил и гетероарил, содержащий 3-7 атомов углерода и 1-2 гетероатома, выбранных из N и O.
7. Соединение тетрациклина по п.6, отличающееся тем, что указанным заместителем является замещенный или незамещенный C1-C4алкил.
8. Соединение тетрациклина по п.5, отличающееся тем, что указанный C1-C4алкил замещен гетероциклом, содержащим 3-5 атомов углерода и 1-2 атома N.
9. Соединение тетрациклина по п.8, отличающееся тем, что указанным гетероциклом является морфолин, пиперидин или пирролидин.
10. Соединение тетрациклина по п.5, отличающееся тем, что указанный фенил замещен аминогруппой.
11. Соединение тетрациклина по п.10, отличающееся тем, что указанная аминогруппа замещена по меньшей мере одним заместителем, выбранным из группы, содержащей C1-C4алкил, C2-C6алкенил, C2-C6 алкинил, карбонил, C1-C4алкокси и C5-C10арил.
12. Соединение тетрациклина по п.11, отличающееся тем, что указанная аминогруппа замещена C1-C4алкоксигруппой.
13. Соединение тетрациклина по п.11, отличающееся тем, что указанная аминогруппа замещена замещенным или незамещенным фенилом.
14. Соединение тетрациклина по п.13, отличающееся тем, что указанный фенил замещен галогеном.
15. Соединение тетрациклина по п.13, отличающееся тем, что указанная аминогруппа, замещенная фенилом, содержит в качестве заместителя вторую замещенную аминогруппу.
16. Соединение тетрациклина по п.15, отличающееся тем, что указанной второй замещенной аминогруппой является замещенный или незамещенный C5-C10арил.
17. Соединение тетрациклина по п.16, отличающееся тем, что указанной второй замещенной аминогруппой является второй замещенный фенил.
18. Соединение тетрациклина по п.5, отличающееся тем, что указанная фенильная группа замещена C1-C4алкоксигруппой.
19. Соединение тетрациклина по п.5, отличающееся тем, что указанная фенильная группа замещена C1-C4алкоксикарбониламиногруппой.
20. Соединение тетрациклина по п.4, отличающееся тем, что указанной арильной группой является замещенный или незамещенный нафтил.
21. Соединение тетрациклина по п.20, отличающееся тем, что указанная нафтильная группа замещена по меньшей мере одним заместителем, выбранным из группы, содержащей C1-C4алкил, C2-C6алкенил, галоген, гидроксил, C1-C4алкокси, C1-C4алкилкарбонилокси, C1-C4алкилоксикарбонил, карбокси, C5-C10арилкарбонилокси, C1-C4алкоксикарбониламино, C1-C4алкоксикарбонилокси, C5-C10арилоксикарбонилокси, карбоксилат, C1-C4алкилкарбонил, C1-C4алкиламинокарбонил, C5-C10арилC1-C4алкиламинокарбонил, C2-C6алкениламинокарбонил, C5-C10арилкарбонил, аминоалкил, C5-C10арилC1-C4алкилкарбонил, C2-C6алкенилкарбонил, C1-C4алкоксикарбонил, силил, аминокарбонил, C1-C4алкилтиокарбонил, фосфат, арC1-C4алкил, фосфонато, фосфинато, циано, амино, C1-C6ациламино, амидо, имино, сульфгидрил, C1-C4алкилтио, сульфат, C5-C10арилтио, тиокарбоксилат, C1-C4алкилсульфинил, сульфонато, сульфамоил, сульфонамидо, нитро, азидо, гетероциклил, содержащий 3-5 атомов углерода и 1-2 атома N, C1-C4алкилC5-C10арил, C5-C10арил и гетероарил, содержащий 3-5 атомов углерода и 1-2 гетероатома, выбранных из N и O.
22. Соединение тетрациклина по п.21, отличающееся тем, что указанным заместителем является амино или формил.
23. Соединение тетрациклина по п.4, отличающееся тем, что R7 означает гетероарил, содержащий 3-10 атомов углерода и 1-2 гетероатома, выбранных из N, S и O.
24. Соединение тетрациклина по п.23, отличающееся тем, что указанный гетероарил выбран из группы, включающей в себя фуранил, имидазолил, бензотиофенил, бензофуранил, хинолинил, изохинолинил, пиридинил, пиразолил, бензодиоксазолил, бензоксазолил, бензотиазолил, бензоимидазолил, метилендиоксифенил, индолил, тиенил, пиримидил, пиразинил, пуринил, оксазолил, изооксазолил, нафтиридинил, тиазолил, изотиазолил и деазапуринил.
25. Соединение тетрациклина по п.24, отличающееся тем, что указанным гетероарилом является тиазолил, тиофенил или фуранил.
26. Соединение тетрациклина по любому из пп.1-3, отличающееся тем, что R7 означает замещенный или незамещенный C1-C8алкил.
27. Соединение тетрациклина по п.26, отличающееся тем, что указанным C1-C6алкилом является линейная или разветвленная цепь.
28. Соединение тетрациклина по п.27, отличающееся тем, что указанным C1-C6алкилом является метил, этил, изопропил, н-пропил, н-бутил, изобутил, трет-бутил, пентил или гексил.
29. Соединение тетрациклина по п.26, отличающееся тем, что указанный C1-C8алкил включает в себя циклоC3-C7алкил.
30. Соединение тетрациклина по п.29, отличающееся тем, что указанным циклоC3-C7алкилом является циклопентил, циклогексил, циклопропил или циклобутил.
31. Соединение тетрациклина по п.26, отличающееся тем, что указанный C1-C8алкил замещен по меньшей мере одним заместителем, выбранным из группы, содержащей C2-C6алкенил, галоген, гидроксил, C1-C4алкокси, C1-C4алкилкарбонилокси, C1-C4алкилоксикарбонил, карбокси, C5-C10арилкарбонилокси, C1-C4алкоксикарбониламино, C1-C4алкоксикарбонилокси, C5-C10арилоксикарбонилокси, карбоксилат, C1-C4алкилкарбонил, C1-C4алкиламинокарбонил, C5-C10арилC1-C4алкиламинокарбонил, C2-C6 алкениламинокарбонил, C5-C10арилкарбонил, аминоC1-C4алкил, C5-C10арилC1-C4алкилкарбонил, C2-C6 алкенилкарбонил, C1-C4алкоксикарбонил, силил, аминокарбонил, C1-C4алкилтиокарбонил, фосфат, арC1-C4алкил, фосфонато, фосфинато, циано, амино, C1-C6ациламино, амидо, имино, сульфгидрил, C1-C4алкилтио, сульфат, C5-C10арилтио, тиокарбоксилат, C1-C4алкилсульфинил, сульфонато, сульфамоил, сульфонамидо, нитро, азидо, гетероциклил, содержащий 3-5 атомов углерода и 1-2 атома N, C1-C4алкилC5-C10арил, C5-C10арил и гетероарил, содержащий 4-10 атомов углерода и 1-2 гетероатома, выбранных из N, S и O.
32. Соединение тетрациклина по п.31, отличающееся тем, что указанный C1-C4алкил замещен остатками, выбранными из группы, содержащей амино, гидрокси, карбокси, карбонил или C5-C10арил.
33. Соединение тетрациклина по п.32, отличающееся тем, что указанной арильной группой является гетероароматическая групяр, содержащая 5-10 атомов углерода и 1-2 гетероатома, выбранных из N, S и O.
34. Соединение тетрациклина по п.33, отличающееся тем, что указанной гетероароматической группой является фуранил, имидазолил, бензотиофенил, бензофуранил, хинолинил, изохинолинил, бензодиоксазолил, бензоксазолил, бензотиазолил, бензоимидазолил, метилендиоксифенил, индолил, тиенил, пиридинил, пиразолил, пиримидил, пиразинил, пуринил, оксазолил, изооксазолил, нафтиридинил, тиазолил, изотиазолил или деазапуринил.
35. Соединение тетрациклина по п.34, отличающееся тем, что указанной гетероароматической группой является пиридинил.
36. Соединение тетрациклина по п.32, отличающееся тем, что указанной арильной группой является замещенный или незамещенный фенил.
37. Соединение тетрациклина по п.36, отличающееся тем, что указанная фенильная группа замещена сульфонамидогруппой или C1-C4алкилом.
38. Соединение тетрациклина по п.32, отличающееся тем, что указанной карбонильной группой является морфолинилкарбонил.
39. Соединение тетрациклина по любому из пп.1-3, отличающееся тем, что R7 означает замещенный или незамещенный C2-C6алкенил.
40. Соединение тетрациклина по п.39, отличающееся тем, что указанная C2-C6алкенильная группа замещена по меньшей мере одним заместителем, выбранным из группы, содержащей C1-C4алкил, галоген, гидроксил, C1-C4алкокси, C1-C4алкилкарбонилокси, C1-C4алкилоксикарбонил, карбокси, C5-C10арилкарбонилокси, C1-C4алкоксикарбониламино, C1-C4алкоксикарбонилокси, C5-C10арилоксикарбонилокси, карбоксилат, C1-C4алкилкарбонил, C1-C4алкиламинокарбонил, C5-C10арилC1-C4алкиламинокарбонил, C2-C4алкениламинокарбонил, C5-C10арилкарбонил, аминоC1-C4алкил, C5-C10арилC1-C4алкилкарбонил, C2-C6 алкенилкарбонил, C1-C4алкоксикарбонил, силил, аминокарбонил, C1-C4алкилтиокарбонил, фосфат, арC1-C4алкил, фосфонато, фосфинато, циано, амино, C1-C6ациламино, амидо, имино, сульфгидрил, C1-C4алкилтио, сульфат, C5-C10арилтио, тиокарбоксилат, C1-C4алкилсульфинил, сульфонато, сульфамоил, сульфонамидо, нитро, азидо, гетероциклил, содержащий 3-5 атомов углерода и 1-2 атома N, C1-C4алкилC5-C10арил, C5-C10арил и гетероарил, содержащий 5-10 атомов углерода и 1-2 атома N.
41. Соединение тетрациклина по п.40, отличающееся тем, что указанная C2-C6алкенильная группа замещена аминокарбонильной или C1-C4алкоксикарбонильной группой.
42. Соединение тетрациклина по п.41, отличающееся тем, что указанным аминокарбонилом является диC1-C4алкиламинокарбонил.
43. Соединение тетрациклина по п.40, отличающееся тем, что указанная C2-C6алкенильная группа замещена по меньшей мере одним атомом галогена.
44. Соединение тетрациклина по п.40, отличающееся тем, что указанная C2-C6алкенильная группа замещена по меньшей мере одной гидроксигруппой.
45. Соединение тетрациклина по п.40, отличающееся тем, что указанная C2-C6алкенильная группа замещена гетероарилом, содержащим 5-10 атомов углерода и 1-2 гетероатома, выбранных из N, S и O.
46. Соединение тетрациклина по п.45, отличающееся тем, что указанная гетероарильная группа выбрана из группы, содержащей фуранил, имидазолил, бензотиофенил, бензофуранил, хинолинил, изохинолинил, бензодиоксазолил, бензоксазолил, бензотиазолил, бензоимидазолил, метилендиоксифенил, индолил, тиенил, пиридинил, пиразолил, пиримидил, пиразинил, пуринил, оксазолил, изооксазолил, нафтиридинил, тиазолил, изотиазолил и деазапуринил.
47. Соединение тетрациклина по п.46, отличающееся тем, что указанным гетероарилом является тиазолил.
48. Соединение тетрациклина по п.40, отличающееся тем, что указанным C5-C10арильным заместителем является замещенный или незамещенный фенил.
49. Соединение тетрациклина по п.48, отличающееся тем, что указанный замещенный фенил замещен по меньшей мере одной группой, выбранной из галогенов, C1-C4алкокси, гидрокси или C1-C4алкильной группы.
50. Соединение тетрациклина по п.49, отличающееся тем, что указанный замещенный фенил замещен по меньшей мере одним атомом фтора.
51. Соединение тетрациклина по любому из пп.1-3, отличающееся тем, что R7 означает замещенный или незамещенный C2-C6алкинил.
52. Соединение тетрациклина по п.51, отличающееся тем, что указанный замещенный C2-C6алкинил замещен C5-C10арильной группой.
53. Соединение тетрациклина по п.52, отличающееся тем, что указанный замещенный C2-C6алкинил замещен замещенным или незамещенным фенилом.
54. Соединение тетрациклина по п.53, отличающееся тем, что указанный замещенный фенил замещен по меньшей мере одним заместителем, выбранных из группы, содержащей C1-C4алкил, галоген, гидроксил, C1-C4алкокси, C1-C4алкилкарбонилокси, C1-C4алкилоксикарбонил, карбокси, C1-C4алкилкарбониламино, C5-C10арилкарбонилокси, C1-C4алкоксикарбониламино, C1-C4алкоксикарбонилокси, C5-C10арилоксикарбонилокси, карбоксилат, C1-C4алкилкарбонил, C1-C4алкиламинокарбонил, C5-C10арилC1-C4алкиламинокарбонил, C2-C6алкениламинокарбонил, C5-C10арилкарбонил, аминоC1-C4алкил, C5-C10арилC1-C4алкилкарбонил, C2-C6алкенилкарбонил, C1-C4алкоксикарбонил, силил, аминокарбонил, C1-C4алкилтиокарбонил, фосфат, арC1-C6алкил, фосфонато, фосфинато, циано, амино, C1-C6ациламино, амидо, имино, сульфгидрил, C1-C4алкилтио, сульфат, C5-C10арилтио, тиокарбоксилат, C1-C4алкилсульфинил, сульфонато, сульфамоил, сульфонамидо, нитро, азидо, гетероциклил, содержащий 3-5 атомов углерода и 1-2 атома N, C1-C4алкилC5-C10арил, C5-C10арил и гетероарил, содержащий 5-10 атомов углерода и 1-2 гетероатома, выбранных из N, S и O.
55. Соединение тетрациклина по п.54, отличающееся тем, что указанный фенил замещен C1-C4алкилкарбониламино или сульфонамидогруппой.
56. Соединение тетрациклина по п.51, отличающееся тем, что указанный замещенный C2-C6алкинил замещен остатком тетрациклина.
57. Соединение тетрациклина по любому из пп.1-3, отличающееся тем, что R7 означает C1-C4алкилкарбониламино.
58. Соединение тетрациклина по любому из пп.1-3, отличающееся тем, что R7 означает карбонил.
59. Соединение тетрациклина по п.58, отличающееся тем, что R7 означает замещенный или незамещенный C1-C4алкилкарбонил.
60. Соединение тетрациклина по п.59, отличающееся тем, что указанный замещенный C1-C4алкилкарбонил замещен C5-C10арильной группой.
61. Соединение тетрациклина по п.60, отличающееся тем, что указанным C5-C10арильным заместитеыхь является гетероарил, содержащий 3-5 атомов углерода и 1-2 атома N.
62. Соединение тетрациклина по п.61, отличающееся тем, что указанным гетероарильным заместителем является пиридинил.
63. Соединение тетрациклина по любому из пп.1-3, отличающееся тем, что R7 означает замещенную или незамещенную иминогруппу.
64. Соединение тетрациклина по любому из пп.1-3, отличающееся тем, что указанная замещенная иминогруппа замещена группами гидрокси или C1-C4алкокси.
65. Соединение тетрациклина по любому из пп.1-3, отличающееся тем, что R7 означает NR7c(C=W')WR7a.
66. Соединение тетрациклина по п.55, отличающееся тем, что R7c означает водород, W' означает кислород и W означает кислород.
67. Соединение тетрациклина по п.65 или п.66, отличающееся тем, что R7a означает замещенный или незамещенный фенил.
68. Соединение тетрациклина по п.67, отличающееся тем, что указанный замещенный фенил замещен по меньшей мере одним заместителем, выбранным из группы, содержащей C1-C4алкил, галоген, гидроксил, C1-C4алкокси, C1-C4алкилкарбонилокси, C1-C4алкилоксикарбонил, карбокси, C1-C4алкилкарбониламино, C5-C10арилкарбонилокси, C1-C4алкоксикарбониламино, C1-C4алкоксикарбонилокси, C5-C10арилоксикарбонилокси, карбоксилат, C1-C4алкилкарбонил, C1-C4алкиламинокарбонил, C5-C10арилC1-C4алкиламинокарбонил, C2-C6алкениламинокарбонил, C5-C10арилкарбонил, аминоC1-C4алкил, C5-C10арилC1-C4алкилкарбонил, C2-C6алкенилкарбонил, C1-C4алкоксикарбонил, силил, аминокарбонил, C1-C4алкилтиокарбонил, фосфат, арC1-C6алкил, фосфонато, фосфинато, циано, амино, C1-C6ациламино, амидо, имино, сульфгидрил, C1-C4алкилтио, сульфат, C5-C10арилтио, тиокарбоксилат, C1-C4алкилсульфинил, сульфонато, сульфамоил, сульфонамидо, нитро, азидо, гетероциклил, содержащий 3-5 атомов углерода и 1-2 атома N, C1-C4алкилC5-C10арил, C5-C10арил и гетероарил, содержащий 5-10 атомов углерода и 1-2 гетероатома, выбранных из N, S и O.
69. Соединение тетрациклина по п.65 или п.66, отличающееся тем, что R7a означает C1-C4алкил.
70. Соединение тетрациклина по любому из пп.1-3, отличающееся тем, что R7 означает сульфонамидо.
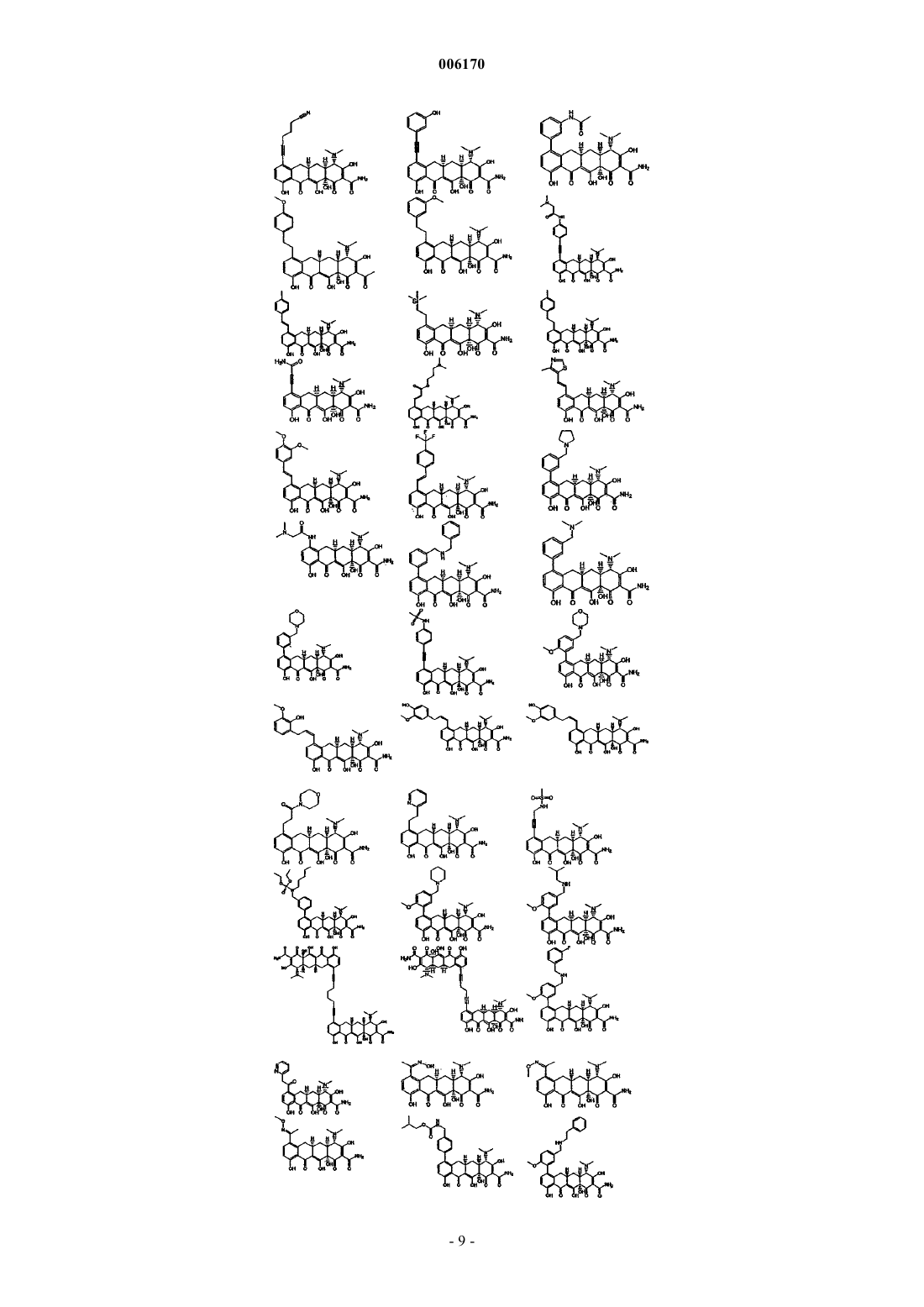
71. Соединение тетрациклина, выбранное из группы, включающей в себя следующие соединения
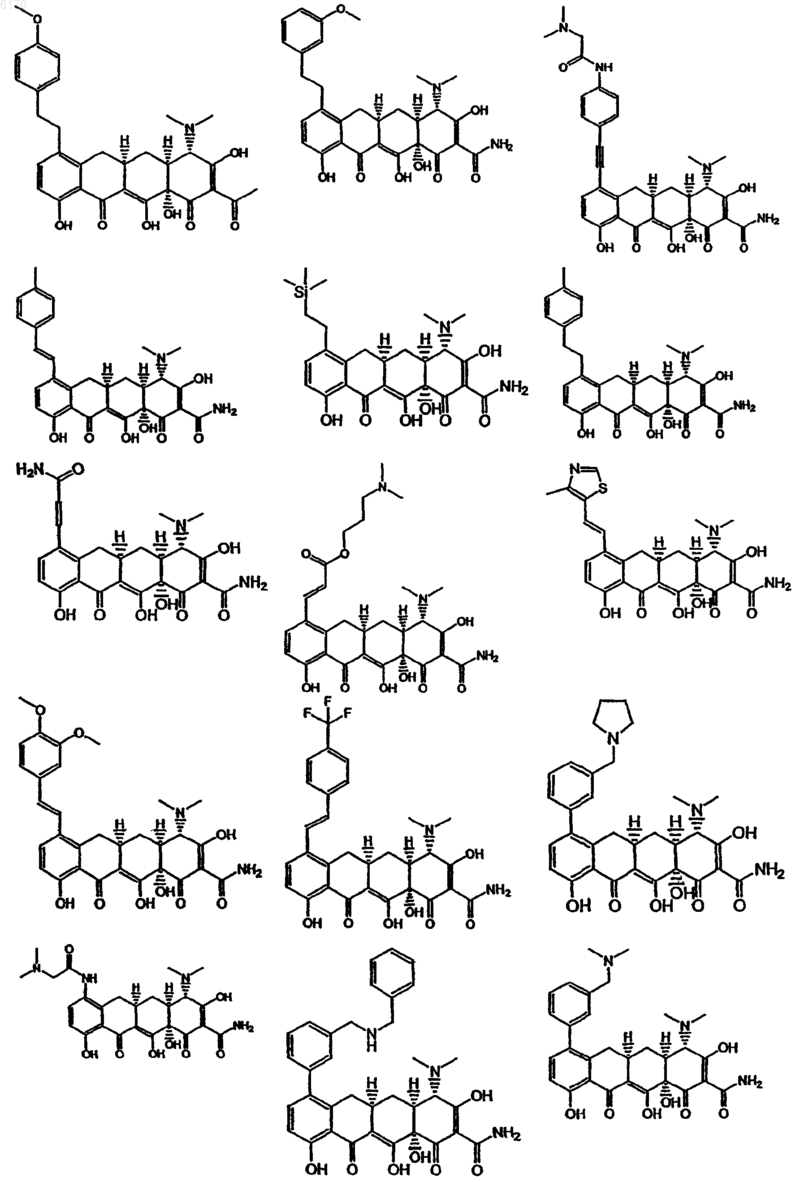
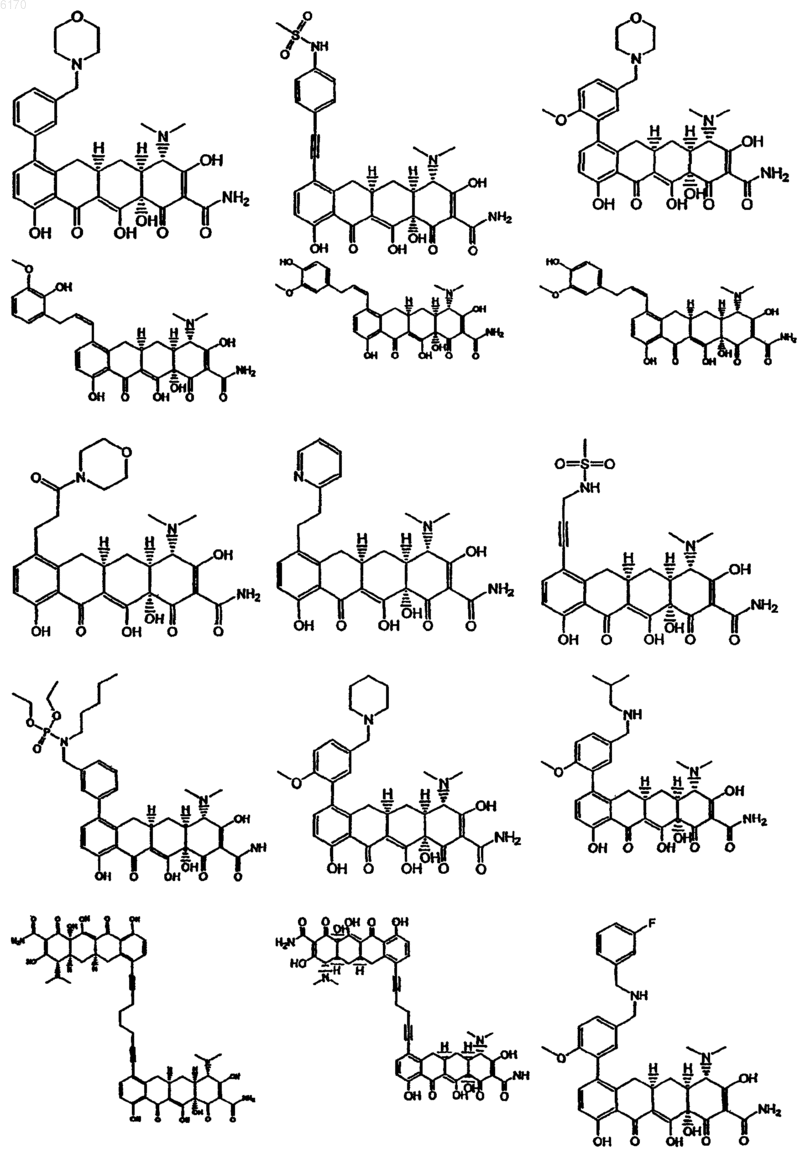
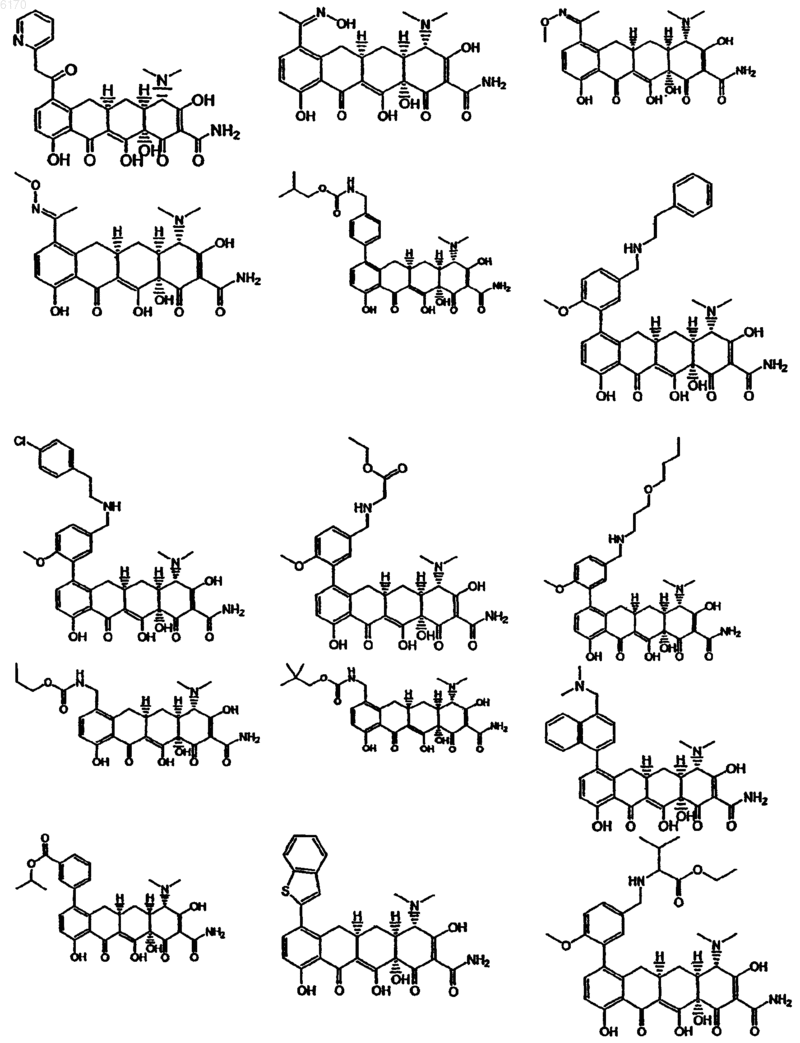
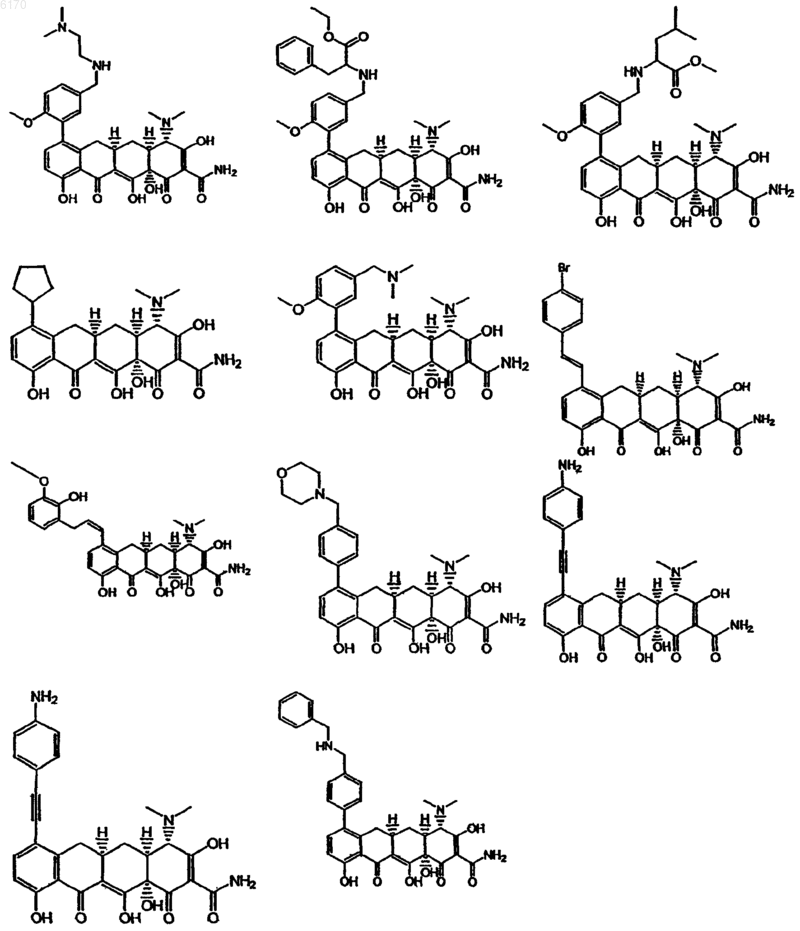
и их фармацевтически приемлемые соли, пролекарства и сложные эфиры.
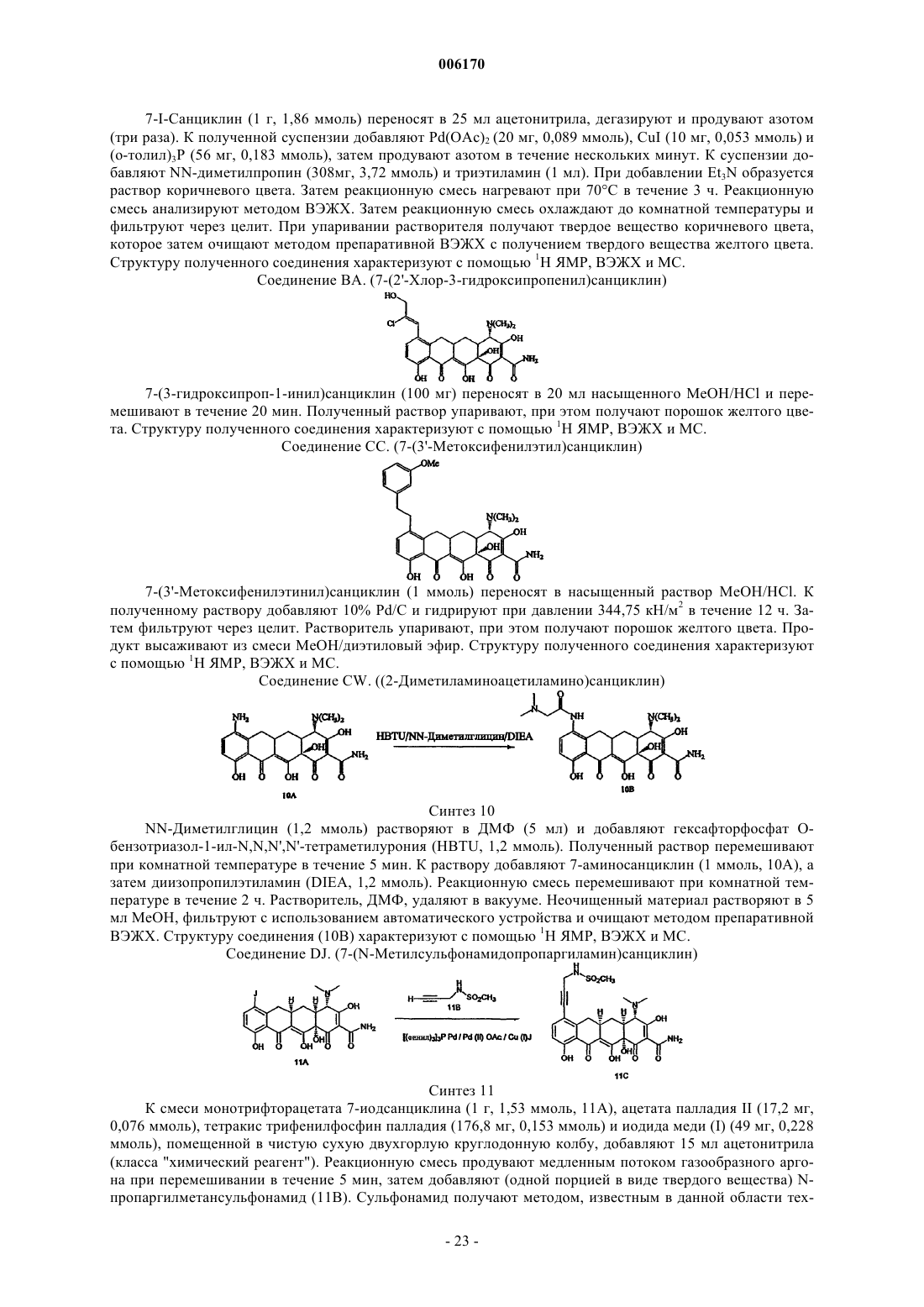
72. 7-Замещенное соединение санциклина формулы
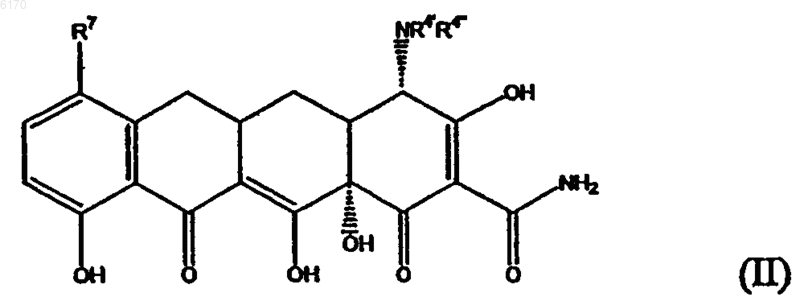
где
R4' и R4'' каждый означает C1-C4алкил;
R7 означает конденсированный циклический остаток формулы 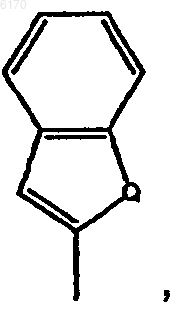
где Q означает C или гетероатом, остаток, выбранный из группы, содержащей C1-C6ацилфуранил, три-, тетра- или пентагалогензамещенный фенил, аминометилфенил, C1-C6ациламинометил, C1-C4алкилэфирфенил, C1-C6ацилфенил, C1-C6ацилC2-C6алкинил, C1-C6ацилC1-C4алкоксифенил, метилфенил, диметилфенил, карбоксифенил, карбоксиC2-C6алкинил, тиофен, галогентиофен, C1-C4алкоксикарбонилфенил, C1-C4алкоксифенил, C1-C4алкоксифенилC2-C6алкинил, C1-C4алкоксипиридил, C2-C4алкиленпиридил, циклопентил или циклопентенил, циклогексилC2-C6алкинил, циклогексенилC2-C6алкинил, циклогексенилгалогенC2-C6алкенил, гидроксициклогексилC2-C6алкинил, фенилC2-C6алкинил, фенилC2-C6алкенил, аминоC2-C6алкинил, циклобутилC2-C6алкенил, пиридилC2-C6алкинил, пиридилC2-C6алкенил, нитрофенилC2-C6алкинил, нитрофенилC2-C6алкенил, цианоC2-C6алкинил, C2-C6алкинил, цианоC2-C6алкенил, цианофенил, диC1-C4алкиламидоC2-C6алкенил, диC1-C4алкиламидофенил, аминофенилэтил, аминофенилэтинил, галогенэтенил, галогенфенилC2-C6алкинил или пентенил, замещенный C1-C4алкиловым эфиром; и их фармацевтически приемлемые соли.
73. Соединение по п.72, отличающееся тем, что оно представлено следующими соединениями:
7-(2-бензофуран)санциклин,
7-(3-формилфуранил)санциклин,
7-(2,3,4,5,6-пентафторфенил)санциклин,
7-(4-аминометилфенил)санциклин,
7-(4-формиламинометилфенил)санциклин,
7-(4-карбоксифенилметилэфир)санциклин,
7-(2-карбоксифенилэтилэфир)санциклин,
7-(4-толил)санциклин,
7-(3-формилфенил)санциклин,
7-(4-формилфенил)санциклин,
7-(3-ацетилфенил)санциклин,
7-(2-ацетилфенил)санциклин,
7-(3-ацетилфенил)санциклин,
7-(4-ацетилфенил)санциклин,
7-(3-формил-6-метоксифенил)санциклин,
7-(4-метилфенил)санциклин,
7-(3,5-диметилфенил)санциклин,
7-(3-карбоксифенил)санциклин,
7-(карбоксиэтинил)санциклин,
7-(3-тиофен)санциклин,
7-(3-метил-2-тиофен)санциклин,
7-(3-метил-5-тиофен)санциклин,
7-(3-хлор-2-тиофен)санциклин,
7-(4-хлор-2-тиофен)санциклин,
7-(2-этоксикарбонилфенил)санциклин,
7-(2-этоксифенил)санциклин,
7-(3-этоксифенил)санциклин,
7-(4-метоксифенил)санциклин,
7-(2,5-диметоксифенил)санциклин,
7-(4-метоксифенилэтинил)санциклин,
7-(4-метокси-5-пиридил)санциклин,
7-(циклопентенил)санциклин,
7-(циклогексилэтинил)санциклин,
7-(1-этинил-1-циклогексил)санциклин,
7-(1-хлорвинил-1-циклогексил)санциклин,
7-(1-этинил-1-гидроксициклогексил)санциклин,
7-(фенилэтинил)санциклин,
7-(толилэтинил)санциклин,
7-(4-метоксифенилэтинил)санциклин,
7-(2-винилпиридил)санциклин,
7-(винилфенил)санциклин,
7-(диметиламиноэтинил)санциклин,
7-(циклобутилметенил)санциклин,
7-(2-пиридилэтинил)санциклин,
7-(3-пиридилэтинил)санциклин,
7-(4-пиридилэтенил)санциклин,
7-(циано-1-пентинил)санциклин,
7-(цианогексенил)санциклин,
7-(3-цианофенил)санциклин,
7-(4-цианофенил)санциклин,
7-(3-гидроксифенилэтинил)санциклин,
7-(N,N-диметилакриламид)санциклин,
7-(диметиламидоэтенил)санциклин,
7-(4-нитрофенилэтинил)санциклин,
7-(4-нитростирил)санциклин,
7-(этинил)санциклин,
7-(3-диметиламидофенил)санциклин,
7-(4-метоксифенил)санциклин,
7-(4-аминофенилэтил)санциклин,
7-(2-хлорэтенил)санциклин,
7-(2-фторфенилэтенил)санциклин,
7-(1-иод-1,3-дикарбоэтокси-1,3-бутадиен)санциклин или
7-(4-аминофенилвинил)санциклин.
74. Соединение по п.1 или 71, отличающееся тем, что по крайней мере 75% указанного соединения свободно от изомеров положения.
75. Соединение по п.74, отличающееся тем, что по крайней мере 80% указанного соединения свободно от изомеров положения.
76. Соединение по п.75, отличающееся тем, что по крайней мере 85% указанного соединения свободно от изомеров положения.
77. Соединение по п.76, отличающееся тем, что по крайней мере 90% указанного соединения свободно от изомеров положения.
78. Соединение по п.77, отличающееся тем, что по крайней мере 95% указанного соединения свободно от изомеров положения.
79. Способ лечения чувствительного к тетрациклину состояния субъекта, отличающийся тем, что указанному субъекту вводят соединение тетрациклина по одному из пп.1, 71 или 72 и осуществляют лечение указанного субъекта.
80. Способ по п.79, отличающийся тем, что указанным чувствительным к тетрациклину состоянием является бактериальная инфекция.
81. Способ по п.80, отличающийся тем, что указанная бактериальная инфекция связана с E. coli.
82. Способ по п.80, отличающийся тем, что указанная бактериальная инфекция связана с S. aureus.
83. Способ по п.80, отличающийся тем, что указанная бактериальная инфекция связана с E. faecalis.
84. Способ по п.80, отличающийся тем, что указанная бактериальная инфекция устойчива к другим тетрациклиновым антибиотикам.
85. Способ по п.79, отличающийся тем, что указанным субъектом является человек.
86. Способ по п.79, отличающийся тем, что указанное соединение тетрациклина вводят в смеси с фармацевтически приемлемым носителем.
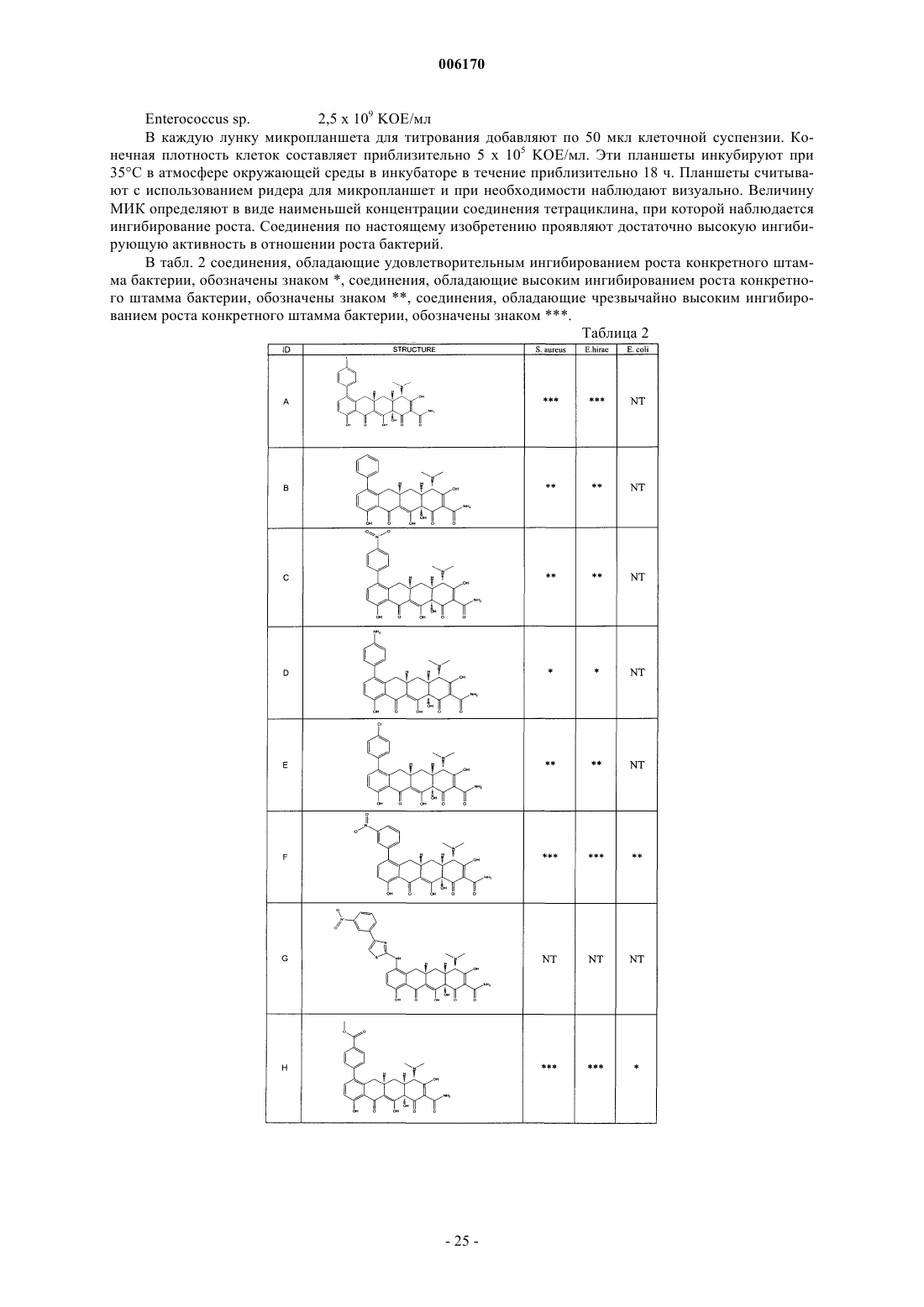
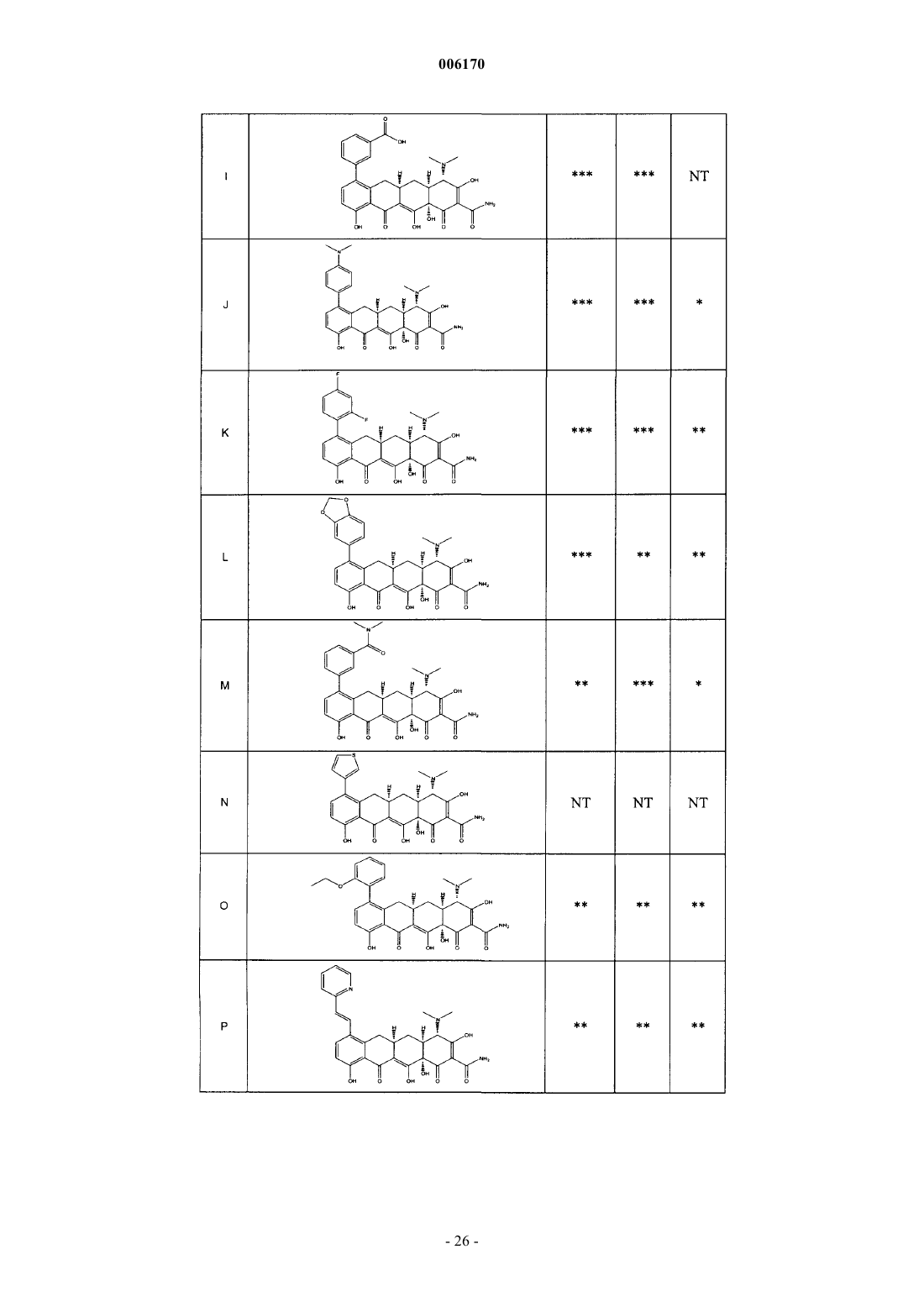
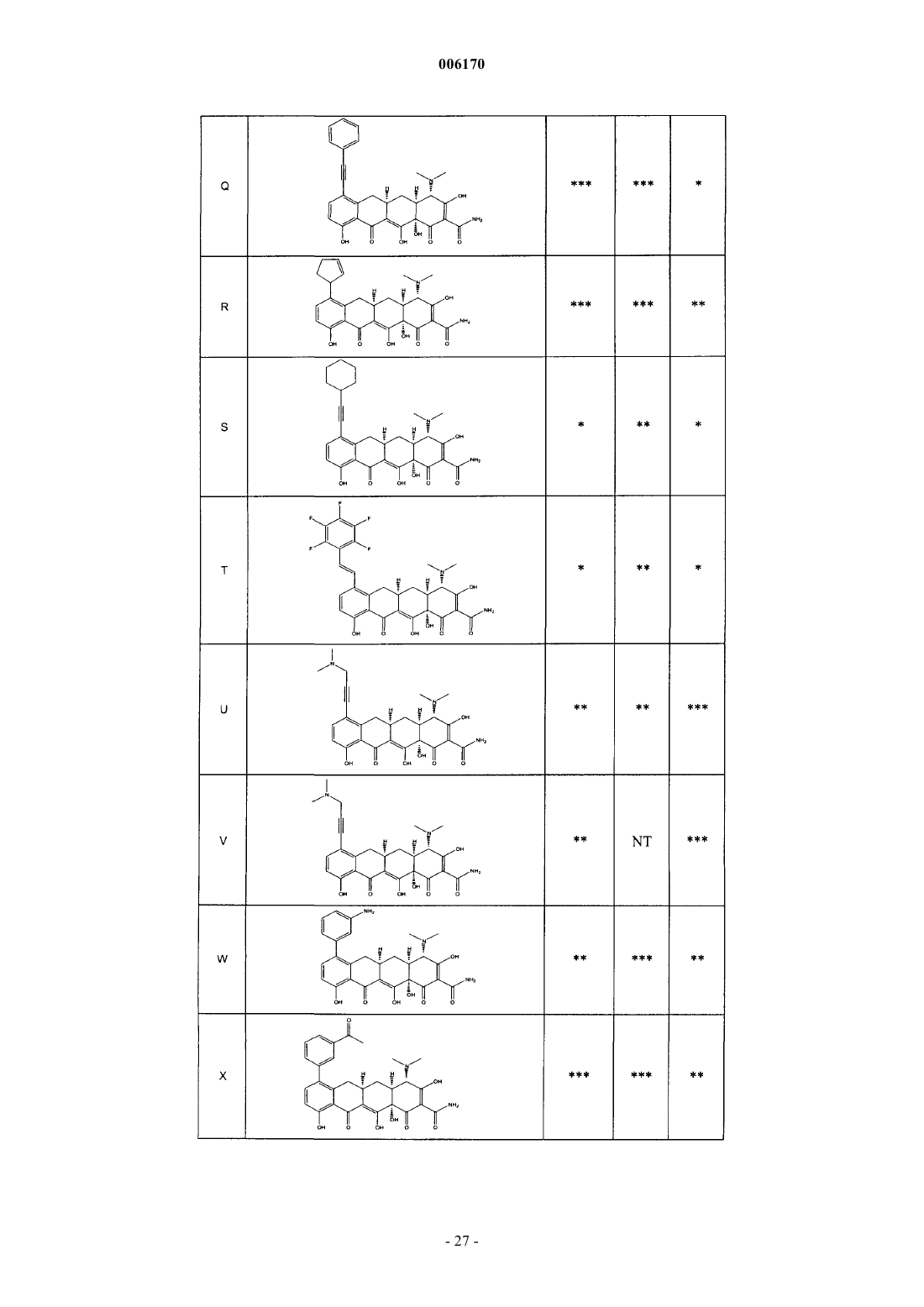
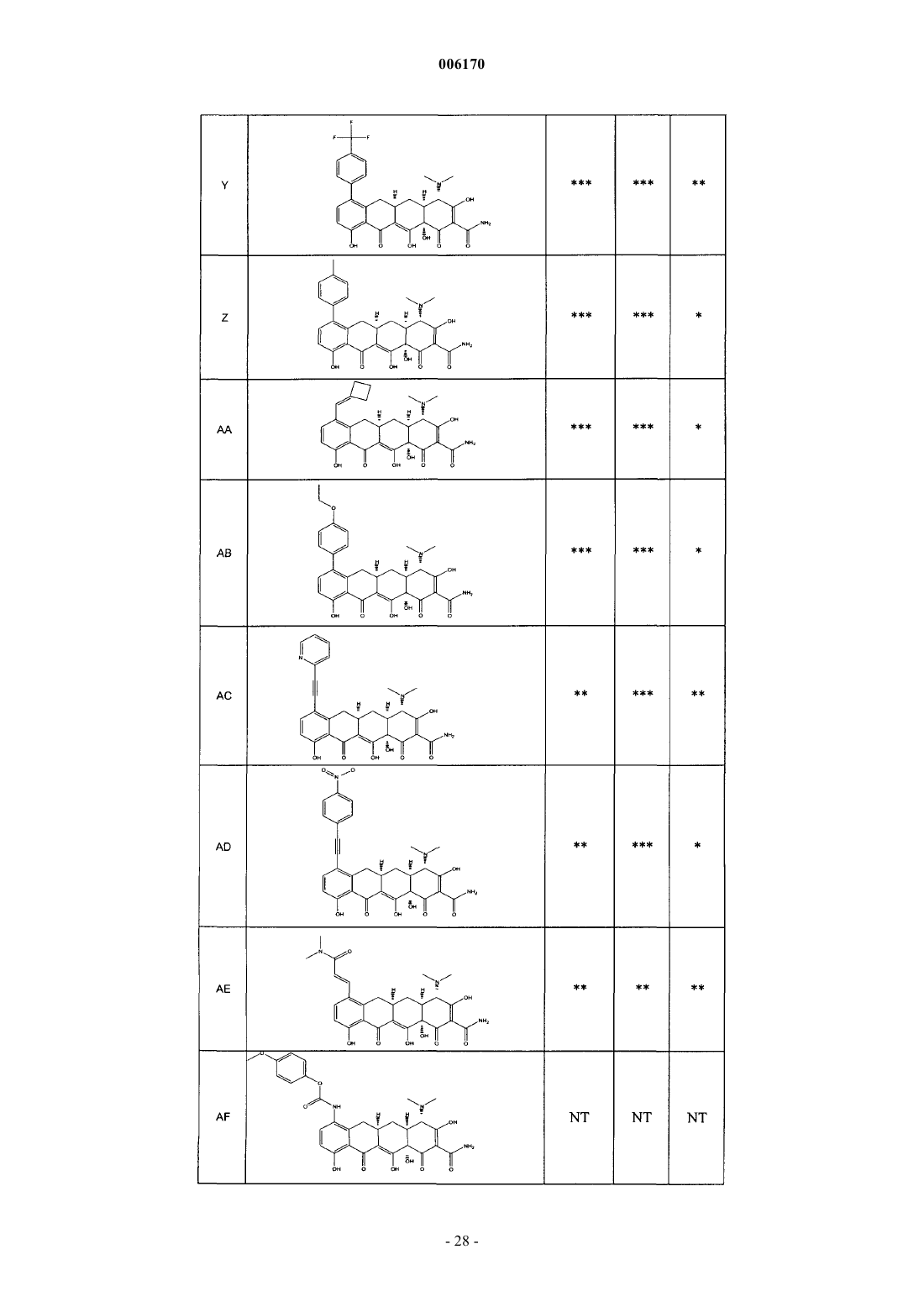
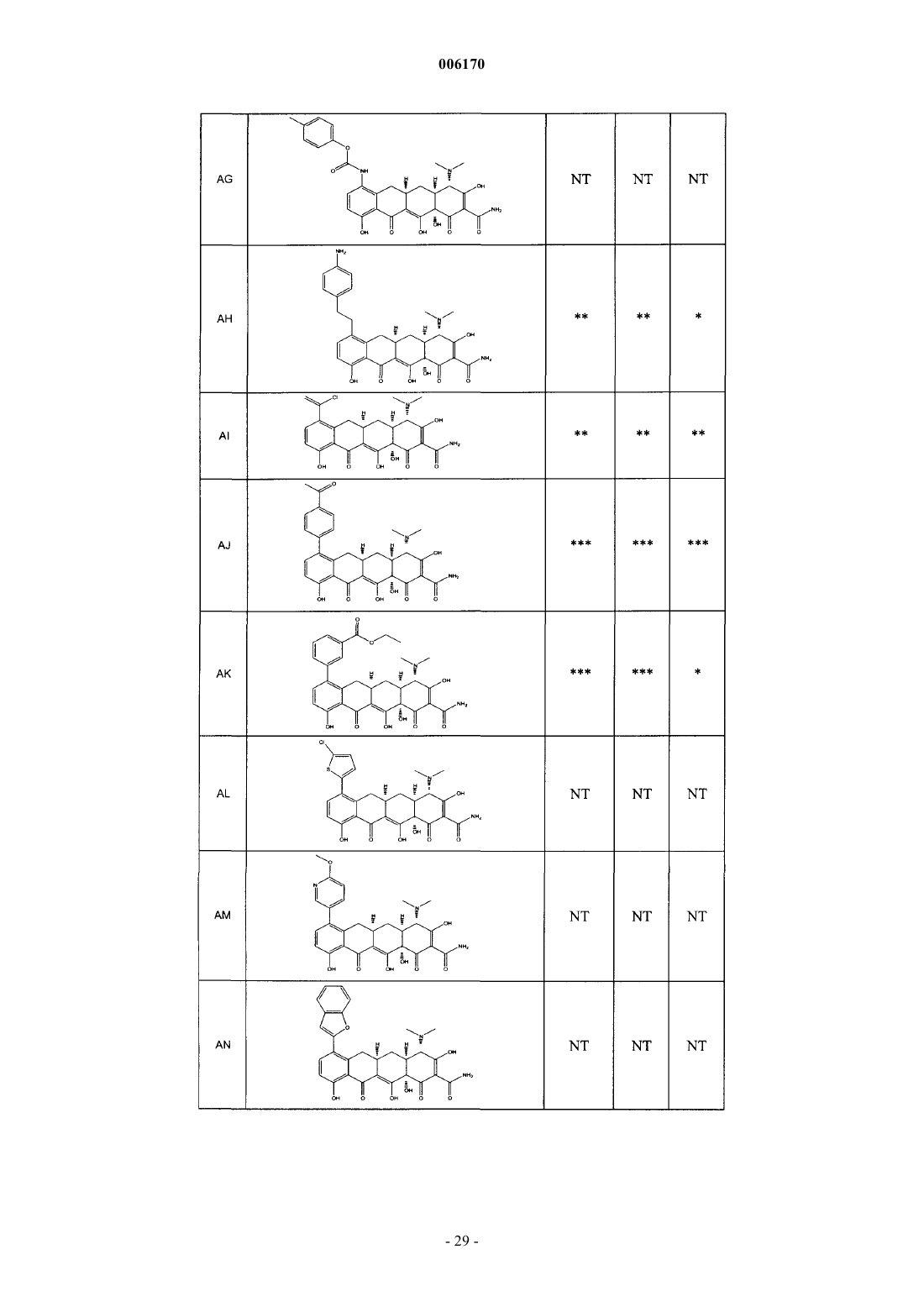
87. Замещенное соединение тетрациклина, выбранное из группы соединений, приведенных в табл. 2.
88. Фармацевтическая композиция, отличающаяся тем, что она содержит терапевтически эффективное количество соединения тетрациклина по одному из пп.1, 71, 72 или 87 и фармацевтически приемлемый носитель.
Текст
006170 Область техники, к которой относится изобретение Изобретение относится к области медицинской химии, более конкретно, к химии антибиотиков, и, в частности, касается новых 7-замещенных соединений тетрациклина и их использования для лечения состояний субъекта, чувствительных к действию тетрациклина. Уровень техники Разработка тетрациклиновых антибиотиков является прямым результатом систематического анализа бактериального состава образцов почв, собранных в различных частях земного шара, с целью обнаружения микроорганизмов, способных продуцировать бактерицидные и/или бактериостатические композиции. Первым из таких новых соединений в 1948 г. был обнаружен антибиотик под названием хлортетрациклин. Двумя годами позже, был обнаружен окситетрациклин. Изучение химической структуры таких соединений подтвердило сходство их свойств и в 1952 г. явилось аналитической основой для получения третьего представителя этой группы - тетрациклина. Новое семейство соединений тетрациклина,не содержащих присоединенной к кольцу метильной группы, которая присутствовала в предыдущих препаратах тетрациклина, было получено в 1957 г. и получило широкое распространение в 1967 г., а миноциклин используется с 1972 г. Позднее, исследования были сфокусированы на разработке новых композиций на основе тетрациклиновых антибиотиков, эффективных при лечении различных состояний с использованием различных способов введения. Были исследованы также новые аналоги тетрациклина с равным или более эффективным действием по сравнению с первыми соединениями тетрациклина. Примеры включают в себя патенты США 2980584, 2990331, 3062717, 3165531, 3454697, 3557280, 3674859, 3957980, 4018889,4024272 и 4126680. В этих патентах представлен широкий спектр фармацевтически активных композиций на основе тетрациклина и аналогов тетрациклина. Позднее, сразу же после их открытия и внедрения было показано, что тетрациклины обладают чрезвычайно высокой фармакологической эффективностью в отношении риккетсий, ряда грамположительных и грамотрицательных бактерий и агентов, вызывающих венерическую лимфогранулему, конъюктивиты с включениями и пситтакоз. В связи с этим, тетрациклины стали известны как антибиотики"широкого спектра". В связи с последующим исследованием их антимикробной активности in vitro, эффективности по отношению к экспериментальным инфекциям и фармакологических свойств класс тетрациклинов быстро получил широкое распространение в терапии. Однако указанное широко распространенное использование тетрациклинов как для лечения серьезных, так и неопасных заболеваний и расстройств привело к развитию устойчивости к этим антибиотикам даже среди высокочувствительных бактериальных штаммов, как симбиотических, так и патогенных (например, Pneumococci и Salmonella). Появление устойчивых к тетрациклину организмов привело к общему отказу от использования композиций на основе тетрациклина и аналогов тетрациклина. Сущность изобретения Изобретение включает в себя, по крайней мере частично, 7-замещенные соединения тетрациклина общей формулы (I)R2, R2', R4' и R4", каждый независимо, означает водород, алкил, алкенил, алкинил, алкокси, алкилтио, алкилсульфинил, алкилсульфонил, алкиламино, арилалкил, арил, гетероциклический, гетероароматический остаток или остаток пролекарства;R21, R3, R10, R11 и R12 каждый означает водород или остаток пролекарства;R7a, R7b, R7c, R7d, R7e, R9a, R9b, R9c, R9d и R9e, каждый независимо, означает водород, ацил, алкил, алкенил, алкинил, алкокси, алкилтио, алкилсульфинил, алкилсульфонил, алкиламино, арилалкил, арил,гетероциклический, гетероароматический остаток или остаток пролекарства;Y' и Y, каждый независимо, означает водород, галоген, гидроксил, циано, сульфгидрил, амино,амидо, алкил, алкенил, алкинил, алкокси, алкилтио, алкилсульфинил, алкилсульфонил, алкиламино или арилалкил, и их фармацевтически приемлемые соли. Изобретение относится также к 7-замещенным соединениям общей формулыR7 означает конденсированный циклический остаток формулы, где Q означает C или гетероатом, остаток, выбранный из группы, содержащей ацилфуранил, три-, тетра- или пентагалогензамещенный фенил, аминометилфенил, ациламинометил, алкилэфирфенил, ацилфенил, ацилалкинил, ацилалкоксифенил, метилфенил, диметилфенил, карбоксифенил, карбоксиалкинил, тиофен, галогентиофен, алкоксикарбонилфенил, алкоксифенил, алкоксифенилалкинил, алкоксипиридил, алкиленпиридил, циклопентил или циклопентенил, циклогексилалкинил, циклогексенилалкинил, циклогексенилгалогеналкенил,гидроксициклогексилалкинил, фенилалкинил, фенилалкенил, аминоалкинил, циклобутилалкенил, пиридилалкинил, пиридилалкенил, нитрофенилалкинил, нитрофенилалкенил, цианоалкинил, алкинил; цианоалкенил; цианофенил, диалкиламидоалкенил, диалкиламидофенил, аминофенилэтил, аминофенилэтинил,галогенэтенил, галогенфенилалкинил или пентенил, замещенный алкиловым эфиром, и к их фармацевтически приемлемым солям. Изобретение относится также к способу лечения чувствительного к тетрациклину состояния субъекта посредством введения субъекту 7-замещенного соединения тетрациклина по настоящему изобретению (например, формулы I или II), таким образом, что чувствительное к тетрациклину состояние излечивается. Изобретение включает в себя также фармацевтические композиции, содержащие эффективное количество 7-замещенного соединения тетрациклина по настоящему изобретению и необязательно фармацевтически приемлемый носитель. Сведения, подтверждающие возможность осуществления изобретения Настоящее изобретение относится, по крайней мере частично, к новым 7-замещенным соединениям тетерациклина. Эти соединения могут быть использованы для лечения многочисленных чувствительных к тетрациклину состояний, таких как бактериальные инфекции и новообразования, наряду с другими известными областями применений соединений миноциклина и тетрациклина, например, в качестве блокаторов оттока тетрациклина и модуляции экспрессии генов. Термин "соединение тетрациклина" включает в себя множество соединений с кольцевой структурой, сходной со структурой тетрациклина. Примеры соединений тетрациклина включают в себя: тетрациклин, хлортетрациклин, окситетрациклин, демеклоциклин, метациклин, санциклин, доксициклин и миноциклин. Примеры включают также другие производные и аналоги, содержащие аналогичную четырехкольцевую структуру. В табл. 1 представлены тетрациклины и несколько известных тетрациклиновых производных. Таблица 1-2 006170 Термин "7-замещенные соединения тетрациклина" включает в себя соединения тетрациклина, содержащие заместители в положении 7. В одном из вариантов воплощения настоящего изобретения заместители в положении 7 увеличиваютспособность соединения тетрациклина выполнять его основную предназначенную функцию, например, способность лечения чувствительных к тетрациклину состояний. В варианте воплощения настоящего изобретения 7-замещенное соединение тетрациклина означает 7 замещенный тетрациклин (например, в котором R4 означает NR4'R4", a R4' и R4" означают метил, R5 означает водород, и Х означает CR6R6', где R6 означает метил и R6' означает гидрокси); 7-замещенный доксициклин (например, в котором R4 означает NR4'R4", а R4' и R4" означают метил, R5 означает гидроксил и Х означает CR6R6', где R6 означает метил и R6' означает водород); 7-замещенное соединение тетрациклина,в котором Х означает CR6R6', a R4, R5, R6' и R6 означают водород или 7-замещенный санциклин (в котором R4 означает NR4'R4", а R4' и R4" означают метил, R5 означает водород и Х означает CR6R6', где R6 и R6' означают атомы водорода). Изобретение включает в себя, по крайней мере частично, 7-замещенные соединения тетрациклина общей формулы (I)R2, R2', R4' и R4 каждый независимо означает водород, алкил, алкенил, алкинил, алкокси, алкилтио,алкилсульфинил, алкилсульфонил, алкиламино, арилалкил, арил, гетероциклический, гетероароматический остаток или остаток пролекарства;R21, R3, R10, R11 и R12 каждый означает водород или остаток пролекарства;R6 и R6', каждый независимо, означает водород, метилен, отсутствие заместителя, гидроксил, галоген, тиол, алкил, алкенил, алкинил, арил, алкокси, алкилтио, алкилсульфинил, алкилсульфонил, алкиламино, арилалкил или они могут быть объединены;R7a, R7b, R7c, R7d, R7e, R9a, R9b, R9c, R9d и R9e, каждый независимо, означает водород, ацил, алкил, алкенил, алкинил, алкокси, алкилтио, алкилсульфинил, алкилсульфонил, алкиламино, арилалкил, арил,гетероциклический, гетероароматический остаток или остаток пролекарства;Y' и Y, каждый независимо, означает водород, галоген, гидроксил, циано, сульфгидрил, амино,амидо, алкил, алкенил, алкинил, алкокси, алкилтио, алкилсульфинил, алкилсульфонил, алкиламино или арилалкил, и их фармацевтически приемлемые соли. В варианте воплощения настоящего изобретения R7 отлично от нитро или амино. В другом воплощении настоящего изобретения Х означает CR6R6'; a R2, R2', R6, R6', R8, R9, R10, R11 и 12R каждый означает водород, R4 означает NR4'R4"; а R4' и R4 означают низший алкил (например, метил); и R5 означает гидрокси или водород. В одном из вариантов воплощения настоящего изобретения R7 означает арил. Примеры арильных групп R7 включают в себя замещенный или незамещенный фенил. Фенильная группа R7 может быть замещена любым заместителем, который обеспечивает выполнение соединением тетрациклина его предназначенной основной функции. Примеры заместителей включают в себя, без ограничения перечисленным,алкил, алкенил, галоген, гидроксил, алкокси, алкилкарбонилокси, алкилоксикарбонил, арилкарбонилокси, алкоксикарбониламино, алкоксикарбонилокси, арилоксикарбонилокси, карбоксилат, алкилкарбонил,-3 006170 алкиламинокарбонил, арилалкиламинокарбонил, алкениламинокарбонил, арилкарбонил, аминоалкил,арилалкилкарбонил, алкенилкарбонил, алкоксикарбонил, силил, аминокарбонил, алкилтиокарбонил,фосфат, аралкил, фосфонато, фосфинато, циано, амино, ациламино, амидо, имино, сульфгидрил, алкилтио, сульфат, арилтио, тиокарбоксилат, алкилсульфинил, сульфонато, сульфамоил, сульфонамидо, нитро,азидо, гетероциклил, алкиларил, арил и гетероарил. В другом варианте воплощения настоящего изобретения фенильная группа R7 замещена замещенным или незамещенным алкилом. Примеры заместителей алкила включают в себя гетероциклы, такие как морфолин, пиперидин и пирролидин. В другом варианте воплощения настоящего изобретения фенильная группа R7 замещена аминогруппой. Аминогруппа может также быть замещена, например, следующими группами: алкил, алкенил, алкинил, карбонил, алкокси или арил (например, замещенный или незамещенный гетероарил, фенил и т.п.). Заместитель фениламино может быть замещен любым заместителем или комбинацией заместителей, которые обеспечивают выполнение соединением его основной функции. Примеры таких заместителей включают в себя галогены (например, фтор, хлор, бром, иод),амино (например, который может быть, в свою очередь, замещен следующими группами: алкил, карбонил, алкенил, алкинил или арил) и ариламино (например, фениламино). Фенильная группа R7 может быть также замещена алкоксильными группами. Примеры алкоксильных групп включают в себя, без ограничения перечисленным, метокси, этокси, пропокси, бутокси, перфторметокси, перхлорметокси, метилендиокси и т.п Фенильная группа может быть также замещена амидной группой, такой как остаток карбамата (например, группой алкоксикарбониламино). Арильная группа R7 может означать также замещенный или незамещенный биарил, например, нафтил, флуоренил и т.п Биарильная группа R7 может быть также замещена любым заместителем, который способствует выполнению соединением его основных функций. Примеры заместителей включают в себя,без ограничения перечисленным, алкил, алкенил, галоген, гидроксил, алкокси, алкилкарбонилокси, алкилоксикарбонил, карбокси, арилкарбонилокси, алкоксикарбониламино, алкоксикарбонилокси, арилоксикарбонилокси, карбоксилат, алкилкарбонил, алкиламинокарбонил, арилалкиламинокарбонил, алкениламинокарбонил, арилкарбонил, аминоалкил, арилалкилкарбонил, алкенилкарбонил, алкоксикарбонил,силил, аминокарбонил, алкилтиокарбонил, фосфат, аралкил, фосфонато, фосфинато, циано, амино, ациламино, амидо, имино, сульфгидрил, алкилтио, сульфат, арилтио, тиокарбоксилат, алкилсульфинил,сульфонато, сульфамоил, сульфонамидо, нитро, азидо, гетероциклил, алкиларил, арил и гетероарил. В варианте воплощения настоящего изобретения заместитель означает амино или формил. Арильная группа R7 может также означать гетероарил. Примеры гетероарильных остатков R7 включают в себя, без ограничения перечисленным, фуранил, имидазолил, бензотиофенил, бензофуранил, хинолинил, изохинолинил, пиридинил, пиразолил, бензодиоксазолил, бензоксазолил, бензотиазолил, бензоимидазолил, метилендиоксифенил, индолил, тиенил, пиримидил, пиразинил, пуринил, оксазолил, изооксазолил, нафтиридинил, тиазолил, изотиазолил и деазапуринил. В определенных вариантах воплощения настоящего изобретения гетероарильная группа R7 означает тиазолил, тиофенил или фуранил.R7 может также означать замещенный или незамещенный алкил. Алкильная группа может быть линейной или разветвленной, например, метил, этил, изопропил, н-пропил, н-бутил, изобутил, трет-бутил,пентил, гексил и т.п. Алкильная группа может также содержать кольцо, например, циклоалкил (например, циклопентил, циклогексил, циклопропил или циклобутил). Алкильная группа R7 может быть также замещена любым заместителем или комбинацией заместителей, которые способствуют выполнению соединением его основной функции. Примеры заместителей включают в себя, без ограничения перечисленным, алкенил, галоген, гидроксил, алкокси, алкилкарбонилокси, алкилоксикарбонил, карбокси, арилкарбонилокси, алкоксикарбониламино, алкоксикарбонилокси, арилоксикарбонилокси, карбоксилат, алкилкарбонил, алкиламинокарбонил, арилалкиламинокарбонил, алкениламинокарбонил, арилкарбонил,аминоалкил, арилалкилкарбонил, алкенилкарбонил, алкоксикарбонил, силил, аминокарбонил, алкилтиокарбонил, фосфат, аралкил, фосфонато, фосфинато, циано, амино, ациламино, амидо, имино, сульфгидрил, алкилтио, сульфат, арилтио, тиокарбоксилат, алкилсульфинил, сульфонато, сульфамоил, сульфонамидо, нитро, азидо, гетероциклил, алкиларил, арил и гетероарил. В определенных вариантах воплощения настоящего изобретения алкильная группа замещена следующими группами: амино, гидрокси, карбокси, карбонил (например, замещенный карбонил, например,морфолинилкарбонил), гетероциклическая или арильная группы. Примеры гетероциклических групп включают в себя, например, фуранил, имидазолил, бензотиофенил, бензофуранил, хинолинил, изохинолинил, бензодиоксазолил, бензоксазолил, бензотиазолил, бензоимидазолил, метилендиоксифенил, индолил, тиенил, пиридинил, пиразолил, пиримидил, пиразинил, пуринил, оксазолил, изооксазолил, нафтиридинил, тиазолил, изотиазолил и деазапуринил. В другом варианте воплощения настоящего изобретения арильная группа означает пиридинил. В другом варианте воплощения настоящего изобретения аралкильная группа R7 включает в себя замещенный или незамещенный фенил. Данная фенильная группа может быть также замещена любым заместителем, который способствует выполнению соединением его основной функции. Примеры заместителей включают в себя, без ограничения перечисленным, сульфонамидо, алкил и другие заместители,перечисленные выше для алкильной группы R7.R7 может быть также замещена замещенным или незамещенным алкенилом. Примеры заместителей включают в себя такие заместители, которые способствуют выполнению соединением его основной функции. Примеры заместителей включают в себя, без ограничения перечисленным, алкил, галоген, гидроксил, алкокси, алкилкарбонилокси, алкилоксикарбонил, карбокси, арилкарбонилокси, алкоксикарбониламино, алкоксикарбонилокси, арилоксикарбонилокси, карбоксилат, алкилкарбонил, алкиламинокарбонил, арилалкиламинокарбонил, алкениламинокарбонил, арилкарбонил, аминоалкил, арилалкилкарбонил, алкенилкарбонил, алкоксикарбонил, силил, аминокарбонил, алкилтиокарбонил, фосфат, аралкил,фосфонато, фосфинато, циано, амино, ациламино, амидо, имино, сульфгидрил, алкилтио, сульфат, арилтио, тиокарбоксилат, алкилсульфинил, сульфонато, сульфамоил, сульфонамидо, нитро, азидо, гетероциклил, алкиларил, арил и гетероарил. В другом варианте воплощения настоящего изобретения алкенильная группа R7 замещена аминокарбонильной группой (например, алкиламинокарбонил, диалкиламинокарбонил, диметиламинокарбонил) или алкоксикарбонильной группой. Алкенильная группа R7 может быть также замещена по меньшей мере одним атомом галогена (таким, как фтор, хлор, бром, иод), гидроксигруппами, гетероарильными группами (например, фуранил, имидазолил, бензотиофенил, бензофуранил, хинолинил, изохинолинил, бензодиоксазолил, бензоксазолил, бензотиазолил, бензоимидазолил, метилендиоксифенил, индолил,тиенил, пиридинил, пиразолил, пиримидил, пиразинил, пуринил, оксазолил, изооксазолил, нафтиридинил, тиазолил, изотиазолил и деазапуринил и т.п.). В другом варианте воплощения настоящего изобретения гетероарильный заместитель означает тиазолил. В другом варианте воплощения настоящего изобретения алкенильная группа R7 замещена замещенным или незамещенным фенилом. Фенил может быть замещен любым заместителем, способствующим выполнению соединением его основной функции. Примеры заместителей включают в себя перечисленные выше группы для других фенильных остатков. Другие примеры заместителей включают в себя, без ограничения перечисленным, галогены (например, фтор, хлор, бром, иод), алкокси (например, метокси,этокси, пропокси, и т.п.), перфторметил, перхлорметил, гидрокси или алкил (например, метил, этил, пропил, бутил, пентил, гексил и т.п.). Другой пример R7 включает в себя замещенные или незамещенные алкинилы. Алкинильные остатки могут быть замещены заместителем или комбинацией заместителей, которые способствуют выполнению соединением тетрациклина по настоящему изобретению его основной функции. Примеры заместителей включают в себя, без ограничения перечисленным, алкил, галоген, гидроксил, алкокси, алкилкарбонилокси, алкилоксикарбонил, карбокси, арилкарбонилокси, алкоксикарбониламино, алкоксикарбонилокси, арилоксикарбонилокси, карбоксилат, алкилкарбонил, алкиламинокарбонил, арилалкиламинокарбонил, алкениламинокарбонил, арилкарбонил, аминоалкил, арилалкилкарбонил, алкенилкарбонил, алкоксикарбонил, силил, аминокарбонил, алкилтиокарбонил, фосфат, аралкил, фосфонато, фосфинато,циано, амино, ациламино, амидо, имино, сульфгидрил, алкилтио, сульфат, арилтио, тиокарбоксилат, алкилсульфинил, сульфонато, сульфамоил, сульфонамидо, нитро, азидо, гетероциклил, алкиларил, арил и гетероарил. В другом варианте воплощения настоящего изобретения алкинильный остаток R7 замещен арилом,например, замещенным или незамещенным гетероарилом, фенилом и т.п Этот арильный остаток может быть замещен любым заместителем или комбинацией заместителей, перечисленных выше, для алкинильных остатков R7. Примеры предпочтительных заместителей включают в себя, без ограничения перечисленным, карбониламино (например, алкилкарбониламино, диалкилкарбониламино, арилкарбониламино и т.п.) и сульфонамидо. В другом варианте воплощения настоящего изобретения алкинильная группа R7 замещена остатком тетрациклина. Термин "остаток тетрациклина" включает в себя четырехкольцевую тетрациклиновую систему, как описано выше. Этот остаток может быть связан с алкинильной группой R7 с помощью звена, содержащего 1-20 атомов. Это звено может быть присоединено к остатку тетрациклина в любом положении в кольце, которое способствует выполнению соединением его основной функции. В варианте воплощения настоящего изобретения остаток тетрациклина присоединен к такому звену в положении 7. Другие примеры остатков R7 включают в себя замещенные и незамещенные остатки следующего ряда: алкилкарбониламино, сульфонамидо, имино и карбонил. Остатки карбонила могут быть замещены замещенной или незамещенной алкильной группой. Примеры возможных заместителей алкильной группы включают в себя, без ограничения перечисленным, арильные остатки, такие как фенил и гетероарилы(например, пиридинил и т.п.). Примеры заместителей иминогруппы включают в себя, без ограничения перечисленным, гидрокси и алкоксигруппы. В другом варианте воплощения настоящего изобретения R7 означает NR7c(C=W')WR7a. Примеры соединений тетрациклина по настоящему изобретению включают в себя соединения, в которых R7c означает водород, W означает кислород и W означает кислород. В определенных вариантах воплощения настоящего изобретения R7a означает замещенный или незамещенный фенил. Примеры заместителей включают в себя, без ограничения перечисленным, алкил, галоген, гидроксил, алкокси, алкилкарбонилокси, алкилоксикарбонил, карбокси, алкилкарбониламино, арилкарбонилокси, алкоксикарбониламино,алкоксикарбонилокси, арилоксикарбонилокси, карбоксилат, алкилкарбонил, алкиламинокарбонил, ари-5 006170 лалкиламинокарбонил, алкениламинокарбонил, арилкарбонил, аминоалкил, арилалкилкарбонил, алкенилкарбонил, алкоксикарбонил, силил, аминокарбонил, алкилтиокарбонил, фосфат, аралкил, фосфонато,фосфинато, циано, амино, ациламино, амидо, имино, сульфгидрил, алкилтио, сульфат, арилтио, тиокарбоксилат, алкилсульфинил, сульфонато, сульфамоил, сульфонамидо, нитро, азидо, гетероциклил, алкиларил, арил и гетероарил. В другом варианте воплощения настоящего изобретения R7a означает замещенный или незамещенный алкил. Изобретение относится также к 7-замещенным соединениям санциклина общей формулыR7 означает конденсированный циклический остаток формулы где Q означает C или гетероатом, остаток, выбранный из группы, содержащей ацилфуранил, три-,тетра- или пентагалогензамещенный фенил, аминометилфенил, ациламинометил, алкилэфирфенил,ацилфенил, ацилалкинил, ацилалкоксифенил, метилфенил, диметилфенил, карбоксифенил, карбоксиалкинил, тиофен, галогентиофен, алкоксикарбонилфенил, алкоксифенил, алкоксифенилалкинил, алкоксипиридил, алкиленпиридил, циклопентил или циклопентенил, циклогексилалкинил, циклогексенилалкинил, циклогексенилгалогеналкенил, гидроксициклогексилалкинил, фенилалкинил, фенилалкенил, аминоалкенил, циклобутилалкенил, пиридилалкинил, пиридилалкенил, нитрофенилалкинил, нитрофенилалкенил, цианоалкинил, алкинил, цианоалкенил, цианофенил, диалкиламидоалкенил, диалкиламидофенил,аминофенилэтил, аминофенилэтинил, галогенэтенил, галогенфенилалкинил или пентенил, замещенный алкиловым эфиром; и к их фармацевтически приемлемым солям. Термин "7-замещенные соединения санциклина" включает в себя соединения санциклина, содержащие заместитель в положении 7, как представлено в формуле I. В другом варианте воплощения настоящего изобретения оба заместителя R4' и R4 каждый означает метил. Согласно другому варианту воплощения настоящего изобретения R7 означает конденсированный циклический остаток формулы где Q означает С или гетероатом. Примеры соединений санциклина, содержащих указанный заместитель R7, включают в себя 7-(2-бензофуран)санциклин. Согласно другому варианту изобретения R7 означает ацилфуранильную группу. Примеры соединений санциклина, содержащих указанный заместитель R7, включают в себя 7-(3-формилфуранил)санциклин. Согласно другому варианту воплощения настоящего изобретения R7 означает три-, тетра- или пентагалогензамещенную фенильную группу. Примеры соединений санциклина, содержащих указанный заместитель R7, включают в себя 7(2,3,4,5,6-пентафторфенил)санциклин. Согласно другому варианту изобретения R7 означает аминометилфенил. Примеры соединений санциклина, содержащих указанный заместитель R7, включают в себя 7-(4-аминометилфенил)санциклин. Согласно другому варианту изобретения R7 означает ациламинометил. Примеры соединений санциклина, содержащих указанный заместитель R7, включают в себя 7-(4-формиламинометилфенил)санциклин. Согласно другому варианту воплощения настоящего изобретения R7 означает алкилэфирфенил. Примеры соединений санциклина, содержащих указанный заместитель R7, включают в себя 7-(4-карбоксифенилметилэфир)санциклин и 7-(2-карбоксифенилэтилэфир)санциклин. Согласно другому варианту воплощения настоящего изобретения R7 означает алкилфенил. Примеры соединений санциклина, содержащих указанный заместитель R7, включают в себя 7-(4-толил)санциклин. Согласно другому варианту воплощения настоящего изобретения R7 означает ацилфенил. Примеры соединений санциклина, содержащих указанный заместитель R7, включают в себя 7-(3-формилфенил) санциклин, 7-(4-формилфенил)санциклин, 7-(3-ацетилфенил)санциклин, 7-(2-ацетилфенил)санциклин, 7(3-ацетилфенил)санциклин и 7-(4-ацетилфенил)санциклин.-6 006170 Согласно другому варианту воплощения настоящего изобретения R7 означает ацилалкоксифенил. Примеры соединений санциклина, содержащих указанный заместитель R7, включают в себя 7-(3-формил-6-метоксифенил)санциклин. Согласно другому варианту воплощения настоящего изобретения R7 означает метилфенил. Примеры соединений санциклина, содержащих указанный заместитель R7, включают в себя 7-(4-метилфенил) санциклин. Согласно другому варианту воплощения настоящего изобретения R7 означает диметилфенил. Примеры соединений санциклина, содержащих указанный заместитель R7, включают в себя 7-(3,5 диметилфенил)санциклин. Согласно другому варианту воплощения настоящего изобретения R7 означает карбоксифенил. Примеры соединений санциклина, содержащих указанный заместитель R7, включают в себя 7-(3 карбоксифенил)санциклин. Согласно другому варианту воплощения настоящего изобретения R7 означает карбоксиалкинил. Примеры соединений санциклина, содержащих указанный заместитель R7, включают в себя 7-(карбоксиэтинил)санциклин. Согласно другому варианту воплощения настоящего изобретения R7 означает тиофен. Примеры соединений санциклина, содержащих указанный заместитель R7, включают в себя 7-(3-тиофен)санциклин,7-(3-метил-2-тиофен)санциклин, 7-(3-метил-5-тиофен)санциклин. Согласно другому варианту воплощения настоящего изобретения R7 означает галогентиофен. Примеры соединений санциклина, содержащих указанный заместитель R7, включают в себя 7-(3-хлор-2 тиофен)санциклин, 7-(4-хлор-2-тиофен)санциклин. Согласно другому варианту воплощения настоящего изобретения R7 означает алкоксикарбонилфенил. Примеры соединений санциклина, содержащих указанный заместитель R7, включают в себя 7-(2 этоксикарбонилфенил)санциклин. Согласно другому варианту воплощения настоящего изобретения R7 означает алкоксифенил. Примеры соединений санциклина, содержащих указанный заместитель R7, включают в себя 7-(2-этоксифенил)санциклин, 7-(3-этоксифенил)санциклин, 7-(4-метоксифенил)санциклин, 7-(2,5-диметоксифенил) санциклин. Согласно другому варианту воплощения настоящего изобретения R7 означает алкоксифенилалкинил. Примеры соединений санциклина, содержащих указанный заместитель R7, включают в себя 7-(4 метоксифенилэтинил)санциклин. Согласно другому варианту воплощения настоящего изобретения R7 означает алкоксипиридил. Примеры соединений санциклина, содержащих указанный заместитель R7, включают в себя 7-(4 метокси-5-пиридил)санциклин. Согласно другому варианту воплощения настоящего изобретения R7 означает циклопентил или циклопентенил. Примеры соединений санциклина, содержащих указанный заместитель R7, включают в себя 7-(циклопентенил)санциклин. Согласно другому варианту воплощения настоящего изобретения R7 означает циклогексилалкинил. Примеры соединений санциклина, содержащих указанный заместитель R7, включают в себя 7(циклогексилэтинил)санциклин. Согласно другому варианту воплощения настоящего изобретения R7 означает циклогексенилалкинил. Примеры соединений санциклина, содержащих указанный заместитель R7, включают в себя 7-(1 этинил-1-циклогексил)санциклин. Согласно другому варианту воплощения настоящего изобретения R7 означает циклогексинилгалогеналкенил. Примеры соединений санциклина, содержащих указанный заместитель R7, включают в себя 7-( 1-хлорвинил-1-циклогексил)санциклин. Согласно другому варианту воплощения настоящего изобретения R7 означает гидроксициклогексилалкинил. Примеры соединений санциклина, содержащих указанный заместитель R7, включают в себя 7(1-этинил-1-гидроксициклогексил)санциклин. Согласно другому варианту воплощения настоящего изобретения R7 означает фенилалкинил. Примеры соединений санциклина, содержащих указанный заместитель R7, включают в себя 7(фенилэтинил)санциклин, 7-(толилэтинил)санциклин и 7-(4-метоксифенилэтинил)санциклин. Согласно другому варианту воплощения настоящего изобретения R7 означает фенилалкенил. Примеры соединений санциклина, содержащих указанный заместитель R7, включают в себя 7-(2 винилпиридил)санциклин и 7-(винилфенил)санциклин. Согласно другому варианту воплощения настоящего изобретения R7 означает аминоалкинил. Примеры соединений санциклина, содержащих указанный заместитель R7, включают в себя 7(диметиламиноэтинил)санциклин. Согласно другому варианту воплощения настоящего изобретения R7 означает циклобутилалкенил. Примеры соединений санциклина, содержащих указанный заместитель R7, включают в себя 7(циклобутилметенил)санциклин.-7 006170 Согласно другому варианту воплощения настоящего изобретения R7 означает пиридилалкинил. Примеры соединений санциклина, содержащих указанный заместитель R7, включают в себя 7-(2 пиридилэтинил)санциклин и 7-(3-пиридилэтинил)санциклин. Согласно другому варианту воплощения настоящего изобретения R7 означает пиридилалкенил. Примеры соединений санциклина, содержащих указанный заместитель R7, включают в себя 7-(4 пиридилэтенил)санциклин. Согласно другому варианту воплощения настоящего изобретения R7 означает нитрофенилалкинил. Примеры соединений санциклина, содержащих указанный заместитель R7, включают в себя 7-(4 нитрофенилэтинил)-санциклин. Согласно другому варианту воплощения настоящего изобретения R7 означает нитрофенилалкенил. Примеры соединений санциклина, содержащих заместитель указанный R7, включают в себя 7-(4 нитростирил)санциклин. Согласно другому варианту воплощения настоящего изобретения R7 означает алкинил. Примеры соединений санциклина, содержащих у казанный заместитель R7, включают в себя 7-(этинил)санциклин. Согласно другому варианту воплощения настоящего изобретения R7 означает цианоалкинил. Примеры соединений санциклина, содержащих указанный заместитель R7, включают в себя 7-(циано-1 пентинил)санциклин. Согласно другому варианту воплощения настоящего изобретения R7 означает цианоалкенил. Примеры соединений санциклина, содержащих указанный заместитель R7, включают в себя 7(цианогексенил)санциклин. Согласно другому варианту воплощения настоящего изобретения R7 означает цианофенил. Примеры соединений санциклина, содержащих указанный заместитель R7, включают в себя 7-(3 цианофенил)санциклин и 7-(4-цианофенил)санциклин. Согласно другому варианту воплощения настоящего изобретения R7 означает гидроксифенилэтинил. Примеры соединений санциклина, содержащих указанный заместитель R7, включают в себя 7-(3 гидроксифенилэтинил)санциклин. Согласно другому варианту воплощения настоящего изобретения R7 означает диалкиламидоалкенил. Примеры соединений санциклина, содержащих указанный заместитель R7, включают в себя 7-(N,Nдиметилакриламид)санциклин и 7-(диметиламидоэтенил)санциклин. Согласно другому варианту воплощения настоящего изобретения R7 означает диалкиламидофенил. Примеры соединений санциклина, содержащих указанный заместитель R7, включают в себя 7-(3 диметиламидофенил)санциклин. Согласно другому варианту воплощения настоящего изобретения R7 означает аминофенилэтил. Примеры соединений санциклина, содержащих указанный заместитель R7, включают в себя 7-(4 аминофенилэтил)санциклин. Согласно другому варианту воплощения настоящего изобретения R7 означает аминофенилэтинил. Примеры соединений санциклина, содержащих указанный заместитель R7, включают в себя 7-(4 аминофенилэтинил)-санциклин. Согласно другому варианту воплощения настоящего изобретения R7 означает галогенэтенил. Примеры соединений санциклина, содержащих указанный заместитель R7, включают в себя 7-(2 хлорэтенил)санциклин. Согласно другому варианту воплощения настоящего изобретения R7 означает галогенфенилалкинил. Примеры соединений санциклина, содержащих указанный заместитель R7, включают в себя 7-(2 фторфенилэтенил)санциклин. Согласно другому варианту воплощения настоящего изобретения R7 означает пентенил, замещенный алкиловым эфиром. Примеры соединений санциклина, содержащих указанный заместитель R7,включают в себя 7-(1-иод-1,3-дикарбоэтокси-1,3-бутадиен)санциклин. Согласно другому варианту воплощения настоящего изобретения R7 означает аминофенилалкинил. Примеры соединений санциклина, содержащих указанный заместитель R7, включают в себя 7-(4 аминофенилвинил)санциклин. Настоящее изобретение относится также к соединениям тетрациклина, приведенным ниже: В изобретение включены также соли, сложные эфиры и пролекарства указанных выше соединений. В другом варианте воплощения настоящего изобретения представлены 7-замещенные соединения тетрациклина следующих формул:- 10006170 Изобретение также относится к каждому из 7-замещенных соединений тетрациклина, перечисленных в табл. 2, а также к их фармацевтически приемлемым солям, сложным эфирам и пролекарствам. Соединения тетрациклина по настоящему изобретению могут быть синтезированы с использованием описанных на схемах синтеза 1-8 методик. Некоторые 7-замещенные соединения тетрациклина могут быть синтезированы способом, представленным на схеме синтез 1. Несмотря на то, что в каждой схеме в качестве соединения тетрациклина используют санциклин, специалисту в данной области техники представляется очевидным, что данную методологию можно использовать также для других соединений тетрациклина, таких как тетрациклин и доксициклин. Синтез 1 В основном, 7-замещенные соединения тетрациклина могут быть синтезированы, как показано на схеме синтез 1 для получения санциклина. Санциклин (1 А) обрабатывают серной кислотой и нитратом натрия. Полученный продукт представляет собой 7-нитросанциклин (1 В) (в смеси с изомерами по атому углерода в 9-положении). Затем соединение нитросанциклина обрабатывают газообразным водородом в присутствии платинового катализатора, при этом получают соединение 7-аминосанциклина, 1 С. Чтобы синтезировать 7-производные, соединение 7-аминосанциклин обрабатывают HONO, при этом получают соль диазония(1D). Полученную соль можно потом обрабатывать множеством соединений, содержащих алкеновую функциональную группу или функциональную группу с -связью, таких как алкены, арилы и алкинилы (например, R7Br), с получением 7-замещенного соединения санциклина (1 Е). Синтез 2 Как показано на схеме синтез 2, соединения тетрациклина по настоящему изобретению, в которыхR7 означает карбамат или производное мочевины, могут быть синтезированы по следующей методике. Санциклин (2 А) обрабатывают NaNO2 в кислотных условиях, при этом образуется 7-нитросанциклин(2 В) в смеси с изомерами положения. Затем 7-нитросанциклин (2 В) обрабатывают газообразным водородом в присутствии платинового катализатора, при этом получают производное 7-аминосанциклина, 2 С. Для получения производного мочевины (2 Е) проводят реакцию изоцианата (2D) с производным 7 аминосанциклина (2 С). Для получения карбамата (2G) проводят реакцию соответствующего эфира хлоругольной кислоты (2F) с производным 2 С. Синтез 3 Как показано на схеме синтез 3, соединения тетрациклина по настоящему изобретению, в которыхR7 означает аминогруппу, замещенную гетероциклом (т.е. тиазолом), могут быть синтезированы по следующей методике. Для получения защищенного производного тиомочевины (3 С) проводят реакцию 7 аминосанциклина (3 А) с Fmoc-изотиоцианатом (3 В). Затем защитную группу тиомочевины (3 С) удаляют, при этом получают активное производное санциклинтиомочевины (3D). После этого проводят реакцию санциклинтиомочевины (3D) с -галогенкетоном (3 Е) с получением 7-аминотиазолсанциклина (3F).(4 В), можно гидрировать с образованием 7-алкилзамещенных соединений тетрациклина (например, 7 алкилсанциклин, 4 С). На схеме синтез 4 показано избирательное гидрирование двойных или тройных связей в положении 7 под давлением в насыщенном растворе метанола и соляной кислоты в присутствии палладия на угле в качестве катализатора с образованием требуемого продукта. Синтез 5 На схеме синтез 5 приведена основная схема синтеза арилпроизводных в положении 7. Проводят реакцию Сузуки, включающую конденсацию арилбороновой кислоты с иодсанциклином. Соединение иодсанциклина (5 В) соответствующей бороновой кислотой (5 С). В качестве катализатора используют палладиевое соединение (например, Рd(ОАс)2). Продукт (5D) может быть очищен методами, известными в данной области техники (такими, как ВЭЖХ). Другие 7-арил- и алкинилзамещенные соединения тетрациклина могут быть синтезированы с использованием аналогичных методик. 7-Замещенные соединения тетрациклина по настоящему изобретению могут быть также синтезированы с использованием реакции кросс-сочетания Стилла. Реакцию кросс-сочетания Стилла можно проводить с использованием соответствующего реагента, содержащего олово (например, R-SnBu3) и галогенированного соединения тетрациклина (например, 7-иодсанциклина). Реагент, содержащий олово, и соединение иодсанциклина могут быть обработаны в присутствии катализатора на основе палладия (например, Рd(РРh3)2 Сl2 или Рd(АsPh3)2 Сl2) и, по выбору, в присутствии дополнительной соли меди, например, CuI. Полученное соединение может быть очищено методами, известными в данной области техники. Синтез 6 Из арилпроизводных, полученных с использованием реакций конденсации Сузуки или Стилла, могут быть синтезированы ряд других производных. Например, на схеме синтез 6, формиларилсанциклин(6 А), амин и растворитель (например, 1,2-дихлорэтан) смешивают в реакционном сосуде. Затем добавляют восстанавливающий агент (например, NаВН(ОАс)3) и проводят реакцию до полного завершения, при этом получают продукт (6 В). Полученный продукт очищают и характеризуют при помощи стандартных методов. Синтез 7 Соединения по настоящему изобретению могут быть также синтезированы с использованием реакций кросс-сочетаний типа Heck. Как показано на схеме синтез 7, кросс-сочетание типа Heck можно проводить путем суспендирования галогенированного соединения тетрациклина (например, 7-иодсанциклина, 7 А) и соответствующего палладиевого катализатора или катализатора на основе другого переходного металла (например, Pd(OAc)2 и Cul) в соответствующем растворителе (например, дегазированном ацетонитриле). К смеси добавляют субстрат, реакционноспособный алкен (7 В) или алкин (7D) и триэтиламин, и полученную смесь нагревают в течение нескольких часов, а затем охлаждают до комнатной температуры. Полученное 7-замещенное алкенилпроизводное(7 С) или 7-замещенное алкинилпроизводное (7 Е) соединение тетрациклина может быть очищено с использованием методов, известных в данной области техники.- 13006170 Для получения соединений 7-(2'-хлоралкенил)тетрациклина может быть использована следующая методика. 7-(Алкинил)санциклин (8 А) растворяют в метаноле, насыщенном соляной кислотой, и перемешивают. Затем растворитель удаляют и получают продукт (8 В). Термин "алкил" включает в себя насыщенные алифатические группы, включая линейные алкильные группы (например, метил, этил, пропил, бутил, пентил, гексил, гептил, октил, нонил, децил и т.п.), разветвленные алкильные группы (изопропил, трет-бутил, изобутил и т.п.), циклоалкильные (алициклические) группы (циклопропил, циклопентил, циклогексил, циклогептил, циклооктил), алкилзамещенные циклоалкильные группы и циклоалкилзамещенные алкильные группы. Термин алкил включает, кроме того, алкильные группы, которые могут содержать атомы кислорода, азота, серы или фосфора, замещающие по меньшей мере один атом в углеводородной цепи. В одном из вариантов воплощения настоящего изобретения линейный или разветвленный алкил включает в себя 6 или менее атомов углерода в цепи (например, C1-C6 для линейной цепи, С 3-C6 для разветвленной цепи), и более предпочтительно 4 или менее. Аналогичным образом, предпочтительные циклоалкилы содержат 3-8 атомов углерода в кольце, и более предпочтительно 5 или 6 атомов углерода в кольце. Термин C1-C6 включает в себя алкильные группы, содержащие от 1 до 6 атомов углерода. Более того, термин "алкил" включает в себя оба понятия "незамещенные алкилы" и "замещенные алкилы", последний из которых относится к алкильным группам, содержащим заместители, замещающие водород у по меньшей мере одного атома углерода в углеводородной цепи. Такие заместители могут включать в себя, например, алкил, алкенил, алкинил, галоген, гидроксил, алкилкарбонилокси, арилкарбонилокси, алкоксикарбонилокси, арилоксикарбонилокси, карбоксилат, алкилкарбонил, арилкарбонил,алкоксикарбонил, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил, алкилтиокарбонил,алкоксил, фосфат, фосфонато, фосфинато, циано, амино (включая алкиламино, диалкиламино, ариламино, диариламино и алкилариламино), ациламино (включая алкилкарбониламино, арилкарбониламино,карбамоил и уреидо), амидино, имино, сульфгидрил, алкилтио, арилтио, тиокарбоксилат, сульфаты, алкилсульфинил, сульфонато, сульфамоил, сульфонамидо, нитро, трифторметил, азидо, гетероциклил, алкиларил или ароматический или гетероароматический остаток. Циклоалкилы могут быть также замещены, например, заместителями, описанными выше. Остаток "алкиларил" или "аралкил" означает алкил,замещенный арилом (например, фенилметил (бензил. Термин алкил включает в себя также боковые цепи природных и неприродных аминокислот. Термин "арил" включает в себя группы, содержащие 5- и 6- членные моноциклические ароматические группы, которые могут включать от нуля до четырех гетероатомов, например, бензол, фенил, пиррол, фуран, тиофен, тиазол, изотиазол, имидазол, триазол, тетразол, пиразол, оксазол, изооксазол, пиридин, пиразин, пиридазин, пиримидин и т.п. Более того, арильные группы включают также полициклические арильные группы, например, трициклические, бициклические, такие как нафталин, бензоксазол,бензодиоксазол, бензотиазол, бензоимидазол, бензотиофен, метилендиоксифенол, хинолин, изохинолин,нафтиридин, индол, бензофуран, пурин, деазапурин или индолизин. Такие арильные группы, содержащие в кольце гетероатомы, могут также называться "арилгетероциклами", "гетероарилами" или "гетероароматическими соединениями". Ароматическое кольцо может быть замещено в по меньшей мере одном положении кольца заместителями, описанными выше, такими, как например, галоген, гидроксил, алкокси, алкилкарбонилокси, арилкарбонилокси, алкоксикарбонилокси, арилоксикарбонилокси, карбоксилат,алкилкарбонил, алкиламинокарбонил, аралкиламинокарбонил, алкениламинокарбонил, арилкарбонил,аралкилкарбонил, алкенилкарбонил, алкоксикарбонил, аминокарбонил, алкилтиокарбонил, фосфат, фосфонато, фосфинато, циано, амино (включая алкиламино, диалкиламино, ариламино, диариламино и алкилариламино), ациламино (включая алкилкарбониламино, арилкарбониламино, карбамоил и уреидо),амидино, имино, сульфгидрил, алкилтио, арилтио, тиокарбоксилат, сульфаты, алкилсульфинил, сульфонато, сульфамоил, сульфонамидо, нитро, трифторметил, азидо, гетероциклил, алкиларил или ароматический или гетероароматический остаток. Арильные группы могут быть также конденсированными или соединены мостиковыми группами с ал и циклически ми или гетероциклическими кольцами, которые не являются ароматическими, с образованием полициклической системы (например, тетралин). Термин "алкенил" включает в себя ненасыщенные алифатические группы, по длине и положениям возможного замещения аналогичные описанным выше алкилам, но содержащие по крайней мере одну двойную связь. Термин "алкенил" включает в себя, например, линейные алкенильные группы, (например, этенил,пропенил, бутенил, пентенил, гексенил, гептенил, октенил, ноненил, деценил и т.п.), разветвленные алкенильные группы, циклоалкенильные (алициклические) группы (циклопропенил, циклопентенил, циклогексенил, циклогептенил, циклооктенил), алкил- или алкенилзамещенные циклоалкенильные группы и циклоалкил- или циклоалкенилзамещенные алкенильные группы. Термин алкенил, кроме того, включает в себя алкенильные группы, содержащие атомы кислорода, азота, серы или фосфора, замещающие по меньшей мере один атом углерода в углеводородной цепи. В одном из вариантов воплощения настоящего изобретения линейный или разветвленный алкенил включает в себя 6 или менее атомов углерода в цепи (например, С 2-С 6 для линейной цепи, С 3-С 6 для разветвленной цепи). Аналогичным образом, циклоалкенильные группы содержат 3-8 атомов углерода в кольце, и более предпочтительно 5 или 6 атомов- 14006170 углерода в кольце. Термин C2-C6 включает в себя алкенильные группы, содержащие от 2 до 6 атомов углерода. Более того, термин алкенил включает в себя оба понятия "незамещенные алкенилы" и "замещенные алкенилы", последний из которых относится к алкенильным группам, содержащим заместители, замещающие водороду по меньшей мере одного атома углерода в углеводородной цепи. Такие заместители могут включать, например, алкил, алкинил, галоген, гидроксил, алкилкарбонилокси, арилкарбонилокси,алкоксикарбонилокси, арилоксикарбонилокси, карбоксилат, алкилкарбонил, арилкарбонил, алкоксикарбонил, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил, алкилтиокарбонил, алкоксил,фосфат, фосфонато, фосфинато, циано, амино (включая алкиламино, диалкиламино, ариламино, диариламино и алкилариламино), ациламино (включая алкилкарбониламино, арилкарбониламино, карбамоил и уреидо), амидино, имино, сульфгидрил, алкилтио, арилтио, тиокарбоксилат, сульфаты, алкилсульфинил,сульфонато, сульфамоил, сульфонамидо, нитро, трифторметил, азидо, гетероциклил, алкиларил или ароматический или гетероароматический остаток. Термин "алкинил" включает в себя ненасыщенные алифатические группы, по длине и положениям возможного замещения аналогичные описанным выше алкилам, но содержащие по крайней мере одну тройную связь. Например, термин "алкинил" включает в себя линейные алкинильные группы, (например, этинил,пропинил, бутинил, пентинил, гексинил, гептинил, октинил, нонинил, децинил и т.п.), разветвленные алкинильные группы и циклоалкил- или циклоалкенилзамещенные алкинильные группы. Термин алкенил включает в себя также алкинильные группы, которые включают атомы кислорода, азота, серы или фосфора, замещающие по меньшей мере один атом углерода в углеводородной цепи. В одном из вариантов воплощения настоящего изобретения линейный или разветвленный алкинил включает в себя 6 или менее атомов углерода в цепи (например, C2-C6 для линейной цепи, С 3-С 6 для разветвленной цепи). Термин C2-C6 включает в себя алкинильные группы, содержащие от 2 до 6 атомов углерода. Более того, термин алкинил включает в себя оба понятия "незамещенные алкинилы" и "замещенные алкинилы", последний из которых относится к алкинильным группам, содержащим заместители, замещающие водород у по меньшей мере одного атома углерода в углеводородной цепи. Такие заместители могут включать, например, алкил, алкинил, галоген, гидроксил, алкилкарбонилокси, арилкарбонилокси,алкоксикарбонилокси, арилоксикарбонилокси, карбоксилат, алкилкарбонил, арилкарбонил, алкоксикарбонил, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил, алкилтиокарбонил, алкоксил,фосфат, фосфонато, фосфинато, циано, амино (включая алкиламино, диалкиламино, ариламино, диариламино и алкилариламино), ациламино (включая алкилкарбониламино, арилкарбониламино, карбамоил и уреидо), амидино, имино, сульфгидрил, алкилтио, арилтио, тиокарбоксилат, сульфаты, алкилсульфинил,сульфонато, сульфамоил, сульфонамидо, нитро, трифторметил, азидо, гетероциклил, алкиларил или ароматический или гетероароматический остаток. Если количество атомов углерода особо не указано, термин "низший алкил", используемый в настоящем описании, означает алкильную группу, определенную выше, но содержащую в основной цепи от одного до пяти атомов углерода. Аналогично, "низший алкенил" и "низший алкинил" имеют аналогичную длину цепи, например, содержащую от 2 до 5 атомов углерода. Термин "ацил" включает в себя соединения и остатки, содержащие ацильный радикал (СН 3 СО-) или карбонильную группу. Термин "замещенный ацил" включает в себя ацильные группы, в которых по меньшей мере один атом водорода замещен и содержит, например, такие заместители, как алкил, алкинил, галоген, гидроксил, алкилкарбонилокси, арилкарбонилокси, алкоксикарбонилокси, арилоксикарбонилокси, карбоксилат, алкилкарбонил, арилкарбонил, алкоксикарбонил, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил, алкилтиокарбонил, алкоксил, фосфат, фосфонато, фосфинато, циано,амино (включая алкиламино, диалкиламино, ариламино, диариламино и алкилариламино), ациламино(включая алкилкарбониламино, арилкарбониламино, карбамоил и уреидо), амидино, имино, сульфгидрил, алкилтио, арилтио, тиокарбоксилат, сульфаты, алкилсульфинил, сульфонато, сульфамоил, сульфонамидо, нитро, трифторметил, азидо, гетероциклил, алкиларил или ароматический или гетероароматический остаток. Термин "ациламино" включает в себя остатки, в которых ацильный остаток присоединен к амино группе. Например, термин включает в себя следующие группы: алкилкарбониламино, арилкарбониламино, карбамоил и уреидо. Термин "ароил" включает в себя соединения и остатки, в которых арильный или гетероароматический остаток присоединен к карбонильной группе. Примеры ароильных групп включают фенилкарбокси,нафтилкарбокси и т.п. Термины "алкоксиалкил", "алкиламиноалкил" и "тиоалкоксиалкил" включают в себя алкильные группы, описанные выше, но содержащие атомы кислорода, азота или серы, замещающие по меньшей мере один атом углерода в углеводородной цепи, например, атомы кислорода, азота или серы. Термин "алкокси" включает в себя замещенные или незамещенные алкильные, алкенильные и алкинильные группы, ковалентно связанные с атомом кислорода. Примеры алкоксигрупп включают метокси, этокси, изопропокси, пропокси, бутокси и пентокси. Примеры замещенных алкокси групп включают- 15006170 галогенированные алкокси группы. Алкокси группы могут быть замещены следующими группами: алкенил, алкинил, галоген, гидроксил, алкилкарбонилокси, арилкарбонилокси, алкоксикарбонилокси, арилоксикарбонилокси, карбоксилат, алкилкарбонил, арилкарбонил, алкоксикарбонил, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил, алкилтиокарбонил, алкоксил, фосфат, фосфонато, фосфинато, циано, амино (включая алкиламино, диалкиламино, ариламино, диариламино и алкилариламино),ациламино (включая алкилкарбониламино, арилкарбониламино, карбамоил и уреидо), амидино, имино,сульфгидрил, алкилтио, арилтио, тиокарбоксилат, сульфаты, алкилсульфинил, сульфонато, сульфамоил,сульфонамидо, нитро, трифторметил, азидо, гетероциклил, алкиларил или ароматический или гетероароматический остаток. Примеры галогенированных алкокси групп включают, без ограничения перечисленным, фторметокси, дифторметокси, трифторметокси, хлорметокси, дихлорметокси, трихлорметокси и т.п. Термин "амин" или "амино" включает в себя соединения, в которых атом азота ковалентно связан по крайней мере с одним атомом углерода или гетероатомом. Термин "алкиламино" включает в себя группы и соединения, в которых атом азота связан по крайней мере с одной дополнительной алкильной группой. Термин "диалкиламино" включает в себя группы, в которых атом азота связан по крайней мере с двумя дополнительными алкильными группами. Термин "ариламино" и "диариламино" включает в себя группы, в которых атом азота связан по крайней мере с одной или двумя арильными группами, соответственно. Термин "алкилариламино", "алкиламиноарил" или "ариламиноалкил" означает аминогруппу,которая связана по крайней мере с одной алкильной группой и по крайней мере с одной арильной группой. Термин "алкаминоалкил" означает алкильную, алкенильную или алкинильную группу, связанную с атомом азота, который связан также с алкильной группой. Термин "амид", "амидо" или "аминокарбонил" включает в себя соединения или остатки, которые содержат атом азота, связанный с атомом углерода карбонильной или тиокарбонильной группы. Термин включает в себя "алкаминокарбонил" или "алкиламинокарбонил", которые содержат следующие группы: алкил, алкенил, арил или алкинил, связанные с аминогруппой, которая связана с карбонильной группой. Указанные группы включают в себя ариламинокарбонильные группы, которые включают остатки арил или гетероарил, связанные с аминогруппой, связанной с углеродом карбонильной или тиокарбонильной группы. Термины "алкиламинокарбонил", "алкениламинокарбонил", "алкиниламинокарбонил", "ариламинокарбонил", "алкилкарбониламино", "алкенилкарбониламино", "алкинилкарбониламино" и "арилкарбониламино" включают в себя термин "амид". Амиды также включают группы мочевины (аминокарбониламино) и карбаматы (оксикарбониламино). Термин "карбонил" или "карбокси" включает в себя соединения или остатки, которые содержат атом углерода, связанный двойной связью с атомом кислорода. Карбонил, кроме того, может быть замещен любым остатком, который обеспечивает выполнение соединением по изобретению его предназначенную функцию. Например, остатки карбонила могут содержать следующие заместители: алкилы, алкенилы, алкинилы, арилы, алкокси, амино и т.п Примеры остатков, содержащих карбонильную группу,включают в себя альдегиды, кетоны, карбоновые кислоты, амиды, сложные эфиры, ангидриды и т.п. Термин "тиокарбонил" или "тиокарбокси" включает в себя соединения и остатки, которые содержат атом углерода, присоединенный двойной связью к атому серы. Термин "простой эфир" включает в себя соединения или остатки, которые содержат атом кислорода, присоединенный к двум различным атомам углерода или гетероатомам. Например, термин включает в себя "алкоксиалкил", который означает алкильную, алкенильную или алкинильную группу, ковалентно связанную с атомом кислорода, который ковалентно связан с другой алкильной группой. Термин "сложный эфир" включает в себя соединения или остатки, которые содержат атом углерода или гетероатом, присоединенный к атому кислорода, который соединен с атомом углерода карбонильной группы. Термин "сложный эфир" включает в себя алкоксикарбокси группы, такие как метоксикарбонил,этоксикарбонил, пропоксикарбонил, бутоксикарбонил, пентоксикарбонил и т.п. Алкильные, алкенильные или алкинильные группы имеют значения, определенные выше. Термин "тиоэфир" включает в себя соединения или остатки, которые содержат атом серы, присоединенный к двум различным атомам углерода или гетероатомам. Примеры тиоэфиров включают, без ограничения перечисленным, алктиоалкилы, алктиоалкенилы и алктиоалкинилы. Термин "алктиоалкилы" включает в себя соединения, которые содержат алкильную, алкенильную или алкинильную группу,связанную с атомом серы, соединенным с алкильной группой. Аналогичным способом термины "алктиоалкенилы" и "алктиоалкинилы" означают соединения или остатки, которые содержат алкильную, алкенильную или алкинильную группу, связанную с атомом серы, ковалентно соединенным с алкильной группой. Термин "гидрокси" или "гидроксил" включает в себя группы, содержащие -ОН или -О-". Термин "галоген" включает в себя фтор, бром, хлор, иод. Термин "пергалогенированный" в основном означает остаток, в котором все атомы водорода заменены на атомы галогена. Термины "полициклический" или "полициклический радикал" означают два или более циклических кольца (например, циклоалкилов, циклоалкенилов, циклоалкинилов, арилов и/или гетероциклилов), в которых два или более атомов углерода одновременно принадлежат двум соседним кольцам, например,- 16006170 кольца являются "конденсированными". Кольца, соединенные не через соседние атомы, называются"мостиковыми" кольцами. Каждое из колец полицикла может быть замещено заместителями, такими, как описано выше, например, галоген, гидроксил, алкилкарбонилокси, арилкарбонилокси, алкоксикарбонилокси, арилоксикарбонилокси, карбоксилат, алкилкарбонил, алкоксикарбонил, алкиламинокарбонил,арилакиламинокарбонил, алкениламинокарбонил, арилкарбонил, арилалкилкарбонил, алкенилкарбонил,аминокарбонил, алкилтиокарбонил, алкоксил, фосфат, фосфонато, фосфинато, циано, амино (включая алкиламино, диалкиламино, ариламино, диариламино и алкилариламино), ациламино (включая алкилкарбониламино, арилкарбониламино, карбамоил и уреидо), амидино, имино, сульфгидрил, алкилтио,арилтио, тиокарбоксилат, сульфаты, алкилсульфинил, сульфонато, сульфамоил, сульфонамидо, нитро,трифторметил, азидо, гетероциклил, алкил, алкиларил или ароматический или гетероароматический остаток. Термин "гетероатом" включает в себя любой элемент, отличный от атомов углерода или водорода. Предпочтительными гетероатомами являются азот, кислород, сера и фосфор. Термин "остаток пролекарства" включает в себя остатки, которые могут метаболизироваться in vivo с образованием гидроксильной группы, или остатки, которые предпочтительно могут оставаться этерифицированными in vivo. Остатки пролекарств предпочтительно могут метаболизироваться in vivo эстеразами или по другому механизму до гидроксильных групп или других требуемых групп. Примеры пролекарств и их использования хорошо известны в данной области техники (см., например, в статье Berge и соавт. (1997) "Pharmaceutical salts" ("Фармацевтические соли"), J. Pharm. Sci., т. 66, стр. 1-19). Некоторые пролекарства могут быть получены in situ в процессе конечного выделения и очистки соединений или отдельным взаимодействием очищенного соединения в форме свободной кислоты или гидроксила с подходящим этерифицирующим агентом. Гидроксильные группы, например, могут быть превращены в сложные эфиры путем обработки карбоновой кислотой. Примеры остатков пролекарства включают замещенные и незамещенные, разветвленные или неразветвленные низшие алкильные сложноэфирные остатки (например, сложные эфиры пропионовой кислоты), сложные эфиры низших алкенилов, сложные эфиры ди(низш.)алкиламинонизших алкилов (например, диметиламиноэтиловый сложный эфир), ациламинонизшие алкильные эфиры (например, ацетилоксиметиловый эфир), ацилокси(низш.)алкильные сложные эфиры (например, пивалоилоксиметиловый эфир), арильные сложные эфиры (фенильный сложный эфир), арил(низш.)алкиловые сложные эфиры (например, бензиловый эфир), замещенные (например, группами метил, галоген или метокси) арильные и арил(низш.)алкильные сложные эфиры, амиды, (низш.)алкиламиды, ди(низш.)алкиламиды и гидроксиамиды. Предпочтительными остатками пролекарства являются сложные эфиры пропионовой кислоты и ацильные сложные эфиры. Следует отметить, что структуры некоторых соединений тетрациклина по настоящему изобретению включают в себя ассиметрические атомы углерода. Соответственно следует понимать, что изомеры, образующиеся в связи с такой асимметрией (например, все энантиомеры и диастереомеры), включены в объем настоящего изобретения, если не указано иное. Такие изомеры могут быть получены в практически полностью очищенной форме с использованием классических методов выделения и методов стереохимического синтеза. Кроме того, структуры и другие соединения и остатки, описанные в настоящем описании, также включают в себя все их таутомеры. Изобретение относится также к способу лечения чувствительных к тетрациклину состояний у субъектов посредством введения субъекту эффективного количества 7-замещенного соединения тетрациклина по настоящему изобретению (например, соединения формулы (I) или представленного в табл. 1), способного вылечить указанное чувствительное к тетрациклину состояние. Термин "чувствительное к соединению тетрациклина состояние" включает в себя состояние, которое можно вылечить, провести его профилактику или уменьшить интенсивность его симптомов путем введения соединения тетрациклина по настоящему изобретению. Чувствительные к соединению тетрациклина состояния включают в себя бактериальные инфекции (включая состояния, устойчивые к другим соединениям тетрациклина), онкологические заболевания, диабет и другие состояния, для которых показано, что в этом случае соединения тетрациклина действенны (см., например, патенты США NN 5789395,5834450 и 5532227). Соединения по настоящему изобретению могут быть использованы для профилактики или борьбы с наиболее распространенными заболеваниями млекопитающих и животных, такими как диарея, инфекции мочевых путей, инфекции кожи и структуры кожи, инфекции уха, горла и носа,инфекции в ранах, маститы и т.п. Кроме того, в изобретение включены способы лечения новообразований с использованием соединений тетрациклина по настоящему изобретению (см. статью van der Bozert и соавт., Cancer Res., 48:6686-6690 (1988. Бактериальные инфекции могут быть вызваны широким спектром грамположительных и грамотрицательных бактерий. Соединения по настоящему изобретению используют в качестве антибиотиков против организмов, устойчивых к другим соединениям тетрациклина. Антибиотическую активность соединений тетрациклина по настоящему изобретению можно определить с использованием способа, который описан в примере 2, или с использованием стандартного способа разведения питательной среды in vitro,который описан в документе Waitz J.A., National Commission for Clinical Laboratory Standarts (Стандарты- 17006170 национальной комиссии по клиническим лабораторным методам), Document M7-A2, т. 10, No 8, стр. 1320, 2-издание, Villanova, PA (1990). Соединения тетрациклина могут быть также использованы для лечения инфекций, которые обычно лечат соединениями тетрациклина, таких как риккетсии, ряд грамположительных и грамотрицательных бактерий, а также агенты, вызывающие венерическую лимфогранулему, конъюктивиты с включениями,пситтакоз. Соединения тетрациклина могут быть использованы для лечения инфекций, например, таких как К. pneumoniae, Salmonella, E. hirae, A. baumanii, В. catarrhalis, H. influenzae, P. aeruginosa, E. faecium,E. соli, S. aureus или E. faecalis. Согласно варианту воплощения настоящего изобретения соединение тетрациклина используют для лечения бактериальной инфекции, устойчивой к другим тетрациклиновым антибиотикам. Соединение тетрациклина по настоящему изобретению можно вводить в смеси с фармацевтически приемлемым носителем. Термин "эффективное количество" соединения означает количество, необходимое или достаточное для лечения или профилактики состояния, чувствительного к соединению тетрациклина. Эффективное количество может варьировать в зависимости от факторов, таких как размер и масса субъекта, тип заболевания или конкретное соединение тетрациклина. Например, выбор соединения тетрациклина может влиять на величину "эффективного количества". Специалист в данной области техники способен оценить вышеупомянутые факторы и сделать выводы относительно эффективного количества соединения миноциклина без дополнительных экспериментов. Изобретение относится также к способу лечения инфекций, вызванных микроорганизмами, и связанных с ними заболеваний. Способы включают в себя введение субъекту эффективного количества по меньшей мере одного соединения тетрациклина. Субъектом может являться растение или предпочтительно животное, например, млекопитающее, например, человек. Согласно терапевтическим способам по настоящему изобретению, по меньшей мере одно соединение тетрациклина по настоящему изобретению может быть введено субъекту отдельно или, в более типичном случае, соединение по настоящему изобретению вводят в виде компонента в составе фармацевтической композиции в смеси со стандартным наполнителем, то есть с фармацевтически приемлемыми органическими или неорганическими веществами-носителями, подходящими для парентерального, перорального или другого требуемого способа введения и которые не оказывают отрицательного действия посредством взаимодействия с активными соединениями, а также не оказывают отрицательного действия на реципиента. Изобретение относится также к фармацевтическим композициям, содержащим терапевтически эффективное количество соединения тетрациклина (например, соединение формулы I, табл. 2 или другого соединения, описанного в данном контексте) и необязательно фармацевтически приемлемый носитель. Термин "фармацевтически приемлемый носитель" включает в себя вещества, которые могут быть введены совместно с соединением (соединениями) тетрациклина и которые обеспечивают осуществление функций соединений, то есть лечение или профилактику состояния, чувствительного к тетрациклину. Подходящие фармацевтически приемлемые носители включают в себя, без ограничения перечисленным, воду, солевые растворы, спирт, растительные масла, полиэтиленгликоли, желатин, лактозу, амилозу, стеарат магния, тальк, кремниевую кислоту, вязкий парафин, ароматическое масло, моноглицериды жирных кислот и диглицериды, петролейные эфиры жирных кислот, гидроксиметилцеллюлозу, поливинилпирролидон и т.п. Фармацевтические препараты могут быть стерилизованы и при необходимости,смешаны со вспомогательными агентами, например, такими как замасливатели, консерванты, стабилизаторы, увлажнители, эмульгаторы, соли для регулировки осмотического давления, буферные вещества,красители, вкусовые добавки и/или ароматические вещества и т.п., которые не оказывают отрицательного воздействия посредством взаимодействия с активными соединениями по настоящему изобретению. Соединения тетрациклина по настоящему изобретению по своей природе являются основаниями и могут образовывать множество солей с различными неорганическими и органическими кислотами. К кислотам, которые могут быть использованы для получения фармацевтически приемлемых кислотноаддитивных солей с основными по природе соединениями тетрациклина по настоящему изобретению,относятся кислоты, которые образуют нетоксичные кислотно-аддитивные соли, то есть соли, содержащие фармацевтически приемлемые анионы, такие как гидрохлорид, гидробромид, гидроиодид, нитрат,сульфат, бисульфат, фосфат, кислый фосфат, изоникотинат, ацетат, лактат, салицилат, цитрат, кислый цитрат, тартрат, пантотенат, битартрат, аскорбат, сукцинат, малеат, гентизинат, фумарат, глюконат, глюкаронат, сахарат, формиат, бензоат, глутамат, метансульфонат, этансульфонат, бензолсульфонат, птолуолсульфонат и пальмоат (то есть 1,1'-метилен-бис-(2-гидрокси-3-нафтоат. Несмотря на то, что такие соли должны быть фармацевтически приемлемыми для введения субъекту, например, млекопитающему, на практике часто требуется выделять соединение тетрациклина по настоящему изобретению из реакционной смеси в виде фармацевтически неприемлемой соли, а затем просто превращать последнюю в свободное основание путем обработки щелочным реагентом с последующим превращением упомянутого свободного основания в фармацевтически приемлемую кислотно-аддитивную соль. Кислотноаддитивные соли основных соединений по настоящему изобретению легко получить путем обработки основного соединения эквивалентным количеством выбранной неорганической или органической кисло- 18006170 ты в среде водного растворителя или в подходящем органическом растворителе, таком как метанол или этанол. После осторожного упаривания растворителя, легко получить требуемую твердую соль. Получение других соединений тетрациклина по настоящему изобретению, которое подробно не описано выше в экспериментальной части, можно осуществить с использованием комбинации реакций,описанных выше и известных для специалиста в данной области техники. Соединения тетрациклина по настоящему изобретению, которые имеют кислотную природу, могут образовывать множество солей с основаниями. К химическим основаниям, которые могут быть использованы в качестве реагентов для получения фармацевтически приемлемых основных солей таких соединений тетрациклина по изобретению, которые имеют кислотную природу, относятся основания, которые образуют нетоксические основные соли таких соединений. Такие нетоксические основные соли включают в себя, без ограничения перечисленным, соли, содержащие фармацевтически приемлемые катионы,такие как катионы щелочных металлов (например, калия и натрия) и щелочно-земельных металлов (например, кальция и магния), аммония или воднорастворимые амино-аддитивные соли, такие как Nметилглюкамин-(меглюмин), а также низший алканоламмоний и другие основные соли фармацевтически приемлемых органических аминов. Фармацевтически приемлемые основно-аддитивные соли соединений тетрациклина по изобретению, которые имеют кислотную природу, могут быть получены с фармацевтически приемлемыми катионами с использованием стандартных способов. Таким образом, эти соли могут быть легко получены путем обработки соединения тетрациклина по изобретению водным раствором требуемого фармацевтически приемлемого катиона и упаривания полученного раствора досуха, предпочтительно при пониженном давлении. В другом варианте, раствор замещенного соединения тетрациклина по изобретению в низшем алкиловом спирте может быть смешан с алкоксидом требуемого металла и затем раствор упаривают досуха. Соединения тетрациклина по изобретению и их фармацевтически приемлемые соли могут быть введены с помощью перорального, парентерального или местного способов. В основном, наиболее предпочтительно вводить эти соединения в эффективных дозах в зависимости от массы и состояния субъекта,подлежащего лечению, от конкретного выбранного способа введения. Возможны варианты в зависимости от вида субъекта, подлежащего лечению, и от его индивидуальной чувствительности к упомянутому лекарственному средству, а также от типа выбранного фармацевтического состава, от периода времени и интервала, через который осуществляют введение. Фармацевтические композиции по настоящему изобретению могут быть введены отдельно или в комбинации с другими известными композициями для лечения чувствительных к тетрациклину состояний у млекопитающих. Предпочтительные млекопитающие включают в себя домашних животных (например, кошки, собаки, хорьки и т.п.), сельскохозяйственный скот (крупный рогатый скот, овцы, свиньи,лошади, козы и т.п.), лабораторных животных (крысы, мыши, обезьяны и т.п.) и приматов (шимпанзе,человекообразные, гориллы). Термин "в комбинации с" известной композицией включает в себя одновременное введение композиции по изобретению и известной композиции, введение сначала композиции по изобретению с последующим введением известной композиции и введение сначала известной композиции с последующим введением композиции по изобретению. Согласно способам по настоящему изобретению может быть использована любая терапевтическая композиция, известная в данной области техники для лечения чувствительных к тетрациклину состояний. Соединения тетрациклина по настоящему изобретению могут быть введены отдельно или в комбинации с фармацевтически приемлемыми носителями или разбавителями любым из ранее упомянутых способов, и введение осуществляют в виде однократной или многократной дозы. Например, новые терапевтические агенты по настоящему изобретению могут быть эффективно введены в виде широкого спектра различных лекарственных форм, то есть они могут быть смешаны с различными фармацевтически приемлемыми инертными носителями в форме таблеток, капсул, лепешек, пастилок, твердых капсул,порошков, спреев, кремов, бальзамов, суппозиториев, желе, гелей, паст, лосьонов, мазей, водных суспензий, растворов для инъекций, эликсиров, сиропов и т.п. Такие носители включают в себя твердые разбавители или наполнители, стерильные водные среды и различные нетоксичные органические растворители и т.п. Более того, в пероральные фармацевтические композиции могут быть добавлены подходящие подсластители и/или ароматизаторы. В основном, в таких формах терапевтически эффективные соединения по настоящему изобретению содержатся при концентрации в диапазоне от приблизительно 5,0 мас.% до приблизительно 70 мас.%. Для перорального введения могут быть использованы таблетки, содержащие различные носители,такие как микрокристаллическая целлюлоза, цитрат натрия, карбонат кальция, кислый фосфат кальция и глицин, наряду с различными дезинтегрирующими агентами, такими как крахмал (предпочтительно, кукурузный, картофельный крахмал или крахмал из тапиоки), альгиновая кислота и определенные комплексные силикаты в смеси со связующими гранул, такими как поливинилпирролидон, сахароза, желатин и аравийская камедь. Кроме того, для формирования таблеток в большинстве случаев используют замасливатели, такие как стеарат магния, лаурилсульфат натрия и тальк. В качестве наполнителей в желатиновых капсулах используют также твердые композиции аналогичного типа, причем предпочтительные материалы в этом случае включают также лактозу или молочный сахар, а также высокомолекуляр- 19006170 ные полиэтиленгликоли. Если требуются водные суспензии и/или эликсиры для перорального введения,активный компонент может быть смешан с различными подсластителями или ароматизаторами, красителями или пигментами, и при необходимости с эмульгаторами и/или суспендирующими агентами наряду с разбавителями, такими как вода, этанол, пропиленгликоль, глицерин и другие их аналогичные комбинации. Для парентерального введения (включая внутрибрюшинное, подкожное, внутривенное, чрескожное или внутримышечное введение), могут быть использованы растворы терапевтического соединения по изобретению в кунжутном или арахисовом масле или в водном пропиленгликоле. В водных растворах при необходимости следует использовать буферные вещества (предпочтительно при рН выше 8) и жидкий разбавитель, который в первую очередь придает изотонические свойства. Такие водные растворы подходят для внутривенной инъекции. Масляные растворы подходят для внутрисуставной, внутримышечной и подкожной инъекции. Получение всех таких растворов в стерильных условиях с использованием стандартных фармацевтических методов известны специалистам в данной области техники. Примеры подходящих препаратов для парентерального применения включают в себя растворы, предпочтительно масляные или водные, а также суспензии, эмульсии или имплантаты, включая суппозитории. Терапевтические соединения могут быть переработаны в стерильную форму, содержащую многократную или однократную дозу, например, в виде дисперсии в жидком носителе, таком как стерильный физиологический солевой раствор или 5%-ный солевой раствор декстрозы, которые обычно используют в составах для инъекции. Кроме того, возможно также введение соединений по настоящему изобретению местным способом при лечении воспалительных процессов на коже. Примеры способов местного введения включают чрескожный, буккальный или подъязычный. Для местного введения подходящим способом может быть смешивание терапевтических соединений в фармацевтически инертном носителе для местного введения,таком как гель, мазь, лосьон или крем. Такие носители для местного введения включают в себя воду,глицерин, спирт, пропиленгликоль, жирные спирты, триглицериды, сложные эфиры жирных кислот или минеральные масла. Другими возможными носителями для местного введения являются жидкий вазелин, изопропилпальмитат, полиэтиленгликоль, 95%-ный этанол, 5%-ный монолаурат полиоксиэтилена в воде, 5%-ный лаурилсульфат натрия в воде и т.п. Кроме того, при необходимости могут быть добавлены материалы, такие как антиоксиданты, увлажнители, стабилизаторы вязкости и т.п. Для энтерального введения, подходящими являются, прежде всего, таблетки, драже или капсулы,содержащие тальк и/или углеводный связующий носитель или аналогичный материал, причем в качестве носителя предпочтительно используют лактозу и/или кукурузный крахмал, и/или картофельный крахмал. Могут быть также использованы сироп, эликсир и т.п., в которые добавляют подсластитель в качестве носителя. Могут быть получены композиции пролонгированного действия, в которых активный компонент защищен дифференциально разрушаемыми покрытиями, например, с помощью микроинкапсуляции, многокомпонентных покрытий и т.д. Кроме лечения человека, терапевтические способы лечения по настоящему изобретению имеют большое значение в ветеринарной практике, например, при лечении сельскохозяйственного скота, такого как крупный рогатый скот, овцы, козы, коровы, свиньи и т.п., домашней птицы, такой как куры, утки,гуси, индейки и т.п., лошади и домашние животные, такие как собаки и кошки. Соединения по изобретению могут быть также использованы для лечения объектов неживотного мира, таких как растения. Следует понимать, что действительные предпочтительные количества активных соединений, используемых для данного лечения, могут различаться в зависимости от конкретного используемого соединения, от конкретных полученных композиций, способа применения, специфического участка введения и т.д. Оптимальная частота введения для данной схемы введения может быть легко определена специалистами в данной области техники с использованием обычного тестирования для определения дозировки, которое осуществляют в соответствии с вышеупомянутыми рекомендациями. В основном, соединения по настоящему изобретению, предназначенные для лечения, могут быть введены субъекту в дозировках, которые использовали в предшествующей практике лечения тетрациклином. См., например, издание "Physicians' Desk Reference" (Настольные рекомендации для терапевтов). Например, подходящая эффективная доза по меньшей мере одного соединения по настоящему изобретению изменяется в диапазоне от 0,01 до 100 мг/кг массы тела реципиента в сутки, предпочтительно в диапазоне от 0,1 до 50 мг/кг массы тела реципиента в сутки, более предпочтительно, в диапазоне от 1 до 20 мг/кг массы тела реципиента в сутки. Требуемую дозу вводят один раз в сутки или в виде нескольких разделенных доз, например, от 2 до 5 разделенных доз, причем введение осуществляют через определенные интервалы в течение суток или по другой соответствующей схеме введения. Следует также понимать, что, с целью обеспечения эффективности введенных соединений в нормальных условиях применения, следует принимать стандартные известные меры предосторожности при введении тетрациклинов. Прежде всего, при использовании для терапевтического лечения человека и животных in vivo, практикующий врач должен принимать все разумные меры предосторожности, чтобы исключить известные обычные отрицательные действия и токсичные эффекты. Таким образом, следует надлежащим образом учитывать определяемые обычным способом неблагоприятные реакции с учетом- 20006170 заболеваний желудочно-кишечного тракта и воспалительных процессов, нефротоксичности, гиперчувствительности, изменений состава крови и ухудшения всасываемости, связанного с ионами алюминия,кальция и магния. Кроме того, настоящее изобретение относится также к использованию соединения тетрациклина формулы 1 для получения лекарственных средств. Лекарственное средство может содержать фармацевтически приемлемый носитель и соединение тетрациклина в эффективном количестве, например, эффективном для лечения чувствительного к тетрациклину состояния. ПРИМЕРЫ Соединения по настоящему изобретению могут быть получены, как описано ниже, причем возможны модификации описанных ниже методик, которые очевидны для специалистов в данной области техники. Пример 1. Синтез 7-замещенных санциклинов. 7-Иодсанциклин. 1 г санциклина растворяют в 25 мл ТФУ (трифторуксусная кислота) и охлаждают до 0 С (на льду). К реакционной смеси добавляют 1,2 экв. N-иодсукцинимида (NIS) и проводят реакцию в течение 40 мин. Затем ледяную баню удаляют, и реакцию проводят при комнатной температуре в течение еще 5 ч. Полученную смесь анализируют с использованием методов ВЭЖХ и ТСХ и проводят реакцию до завершения,добавляя порциями NIS. После завершения реакции ТФУ удаляют в вакууме и добавляют 3 мл МеОН для растворения остатка. К интенсивно перемешиваемому раствору диэтилового эфира медленно добавляют полученный раствор метанола до образования зеленовато-коричневого осадка. 7-Иодизомерсанциклина очищают обработкой 7-иодпродукта с использованием активированного угля, фильтрования через целит и затем удаления растворителя в вакууме, при этом получают 7-изомер в виде чистого твердого вещества желтого цвета, выход составляет 75%. МС (М+Н) (растворитель муравьиная кислота) 541,3. Rt: колонка Hypersil C18 BDS, 11.73 мин. 1H ЯМР (метанол d4-300 МГц)7,87-7,90 (d, 1 Н), 6,666,69 (d, 1H), 4,06 (s, 1 Н), 2,98 (s, 6 Н), 2,42 (m, 1H), 2,19 (m, 1H), 1,62 (m, 4H), 0,99 (m, 2H). Соединение В. (7-Фенилсанциклин). В сосуд, снабженный перемешивающим стержнем, добавляют 7-иодсанциклин (150 мг, 0,28 ммоль), Pd(OAc)2 и 10 мл МеОН, систему трижды дегазируют аргоном. К смеси добавляют с помощью шприца Nа 2 СО 3 (87 мг, 0,8 ммоль), растворенный в воде и дегазированный аргоном, фенилбороновую кислоту (68 мг, 0,55 ммоль) в МеОН, также дегазированную аргоном. Реакцию проводят в течение 2 ч,при этом реакционную смесь анализируют ВЭЖХ, и охлаждают до комнатной температуры. Раствор фильтруют и высушивают, при этом получают неочищенную смесь. Твердое вещество растворяют в диметилформамиде и наносят на колонку препаративной системы ВЭЖХ с обращенной фазой с использованием силикагеля С 18. Фракции с временем удерживания 36-38 мин отделяют и растворитель удаляют в вакууме, при этом получают смесь продукта и соли. Соли удаляют экстракцией смесью вода/бутанол/этилацетат, 50:25:25, и высушивают в вакууме. Полученное твердое вещество растворяют в МеОН и пропусканием газообразного HCl через смесь получают гидрохлорид. Растворитель удаляют,при этом получают продукт в виде твердого вещества желтого цвета, выход составляет 42%. Rt 21,6 мин,МС (М+Н, растворитель муравьиная кислота) 491,3. 1H ЯМР (метанол d4-300 МГц)7,87 (d, J=8,86 Гц,1 Н), 7,38 (m, 5H), 6,64 (d, J=8,87 Гц, 1 Н), 4,00 (s, 1H), 3,84 (s, 2 Н), 3,01 (s, 6H), 2,46 (m, 2H), 1,63 (m, 4 Н),0,95 (m, 2H). Соединение Е. (7-(4'-Хлорфенил)санциклин). В сосуд, снабженный перемешивающим стержнем, добавляют 7-иодсанциклин (500 мг, 0,91 ммоль), Pd(OAc)2 (21 мг) и 20 мл МеОН, систему трижды дегазируют аргоном. Nа 2 СО 3 (293 мг, 2,8 ммоль) растворяют в воде, дегазируют аргоном и с помощью шприца добавляют 4-Сl-фенилбороновую кислоту (289 мг, 1,85 ммоль) в МеОН, которую также дегазируют аргоном. Реакцию проводят в течение 45 мин, при этом реакционную смесь анализируют с помощью ВЭЖХ, и охлаждают до комнатной температуры. Раствор фильтруют и высушивают, при этом получают неочищенную смесь. Твердое вещество растворяют в диметилформамиде и наносят на колонку препаративной системы ВЭЖХ с обращенной фазой с использованием силикагеля С 18. Фракции с временем удерживания 39 мин отделяют и растворитель удаляют в вакууме, при этом получают продукт и соли. Соли удаляют экстракцией смесью вода/бутанол/этилацетат, 50:25:25, и высушивают в вакууме. Полученное твердое вещество растворяют в МеОН и пропусканием газообразного HCl через смесь получают гидрохлорид. Растворитель удаляют,при этом получают продукт в виде твердого вещества желтого цвета, выход составляет 57%. Rt 20,3 мин,МС (М+Н, растворитель муравьиная кислота) 525,7. 1H ЯМР (метанол d4-300 МГц)7,49-7,52 (d, J=8,54 Гц, 1 Н), 6,99-7,01 (d, J=8,61 Гц, 1 Н), 4,12 (s, 1H), 3,67 (m, 1H), 3,06 (s, 6H), 2,58 (m, 2H), 1,62 (m, 4 Н), 1,01(m, 2H). Соединение А. (7-(4'-Фторфенил)санциклин). В сосуд, снабженный перемешивающим стержнем, добавляют 7-иодсанциклин (200 мг, 0,3 ммоль),Pd(OAc)2 (8,3 мг) и 10 мл МеОН, систему трижды дегазируют аргоном. Nа 2 СО 3 (104 мг, 1,1 ммоль) растворяют в воде, дегазируют аргоном и с помощью шприца добавляют 4-F-фенилбороновую кислоту (104 мг, 0,7 ммоль) в МеОН, которую также дегазируют аргоном. Реакцию проводят в течение 20 мин, при- 21006170 этом реакционную смесь анализируют ВЭЖХ, и охлаждают до комнатной температуры. Раствор фильтруют и высушивают, при этом получают неочищенную смесь. Твердое вещество растворяют в диметилформамиде и наносят на колонку препаративной системы ВЭЖХ с обращенной фазой с использованием силикагеля С 18. Фракции с временем удерживания 19-20 мин отделяют и растворитель удаляют в вакууме, при этом получают продукт и соли. Соли удаляют экстракцией в смеси вода/бутанол/этилацетат,50:25:25, и высушивают в вакууме. Полученное твердое вещество растворяют в МеОН и пропусканием газообразного HCl через смесь получают гидрохлорид. Растворитель удаляют, при этом получают продукт в виде твердого вещества желтого цвета, выход составляет 47%.(три раза). К полученной суспензии добавляют Pd(OAc)2 (20 мг, 0,089 ммоль), CuI (10 мг, 0,053 ммоль) и(о-толил)3 Р (56 мг, 0,183 ммоль), а затем продувают азотом. Затем к суспензии добавляют этилпропиолят(1 мл) и 1 мл триэтиламина (TEA). При добавлении Еt3N образуется раствор коричневого цвета. Затем реакционную смесь нагревают при 70 С в течение 2 ч. Реакционную смесь анализируют с помощью ВЭЖХ. Затем реакционную смесь охлаждают до комнатной температуры и фильтруют через целит. При упаривании растворителя получают твердое вещество коричневого цвета, которое затем очищают методом препаративной ВЭЖХ и при этом получают твердое вещество желтого цвета. Соединение АI. (7-(2'-Хлорэтенил)санциклин). К раствору/суспензии 0,65 г (1 ммоль) 7-иодсанциклина при комнатной температуре добавляют 0,05 г тетракис-трифенилфосфинатопалладата, 0,012 г ацетата палладия, 0,05 г иодида меди (I) в 10 мл ацетонитрила, 2 мл триэтиламина и 0,5 г триметилсилилацетилена. Реакцию проводят в течение 2 ч, затем фильтруют через слой целита и концентрируют. Неочищенный продукт очищают методом препаративной ВЭЖХ. Собранные фракции концентрируют и остаток переносят в приблизительно 1 мл метанола и 2 мл насыщенного HCl метанола. Продукт высаживают эфиром. Твердое вещество отфильтровывают и высушивают при пониженном давлении. Данные спектроскопии ЯМР и МС-ЖХ свидетельствуют о том, что полученное вещество является 7-(2-хлорэтенил)санциклином. Соединение D. (7-(4'-Аминофенил)санциклин). К раствору 200 мг 7-(4-нитрофенил)санциклина в 50 мл метанола добавляют в качестве катализатора 10 мг 10% палладия на угле. Реакционную смесь встряхивают при давлении 275,8 кН/м 2 в атмосфере водорода в течение 2 ч, а затем фильтруют и концентрируют. Остаток очищают препаративной ВЭЖХ,получают 35 мг продукта в виде гидрохлорида, данные ЯМР, МС-ЖХ свидетельствуют о том, что полученное вещество является 7-(4-аминофенил)санциклином. Соединение EF. (1,8-ди-7-Санциклинил-1,7-октадиин) Синтез 9 В реакционный сосуд загружают 7-иодсанциклин (3,0 г, 4,57 ммоль, 9 А), Pd(OAc)2 (0,102 г, 0,46 ммоль), CuI (0,044 г, 0,23 ммоль) и Р(о-ТоI)3 (0,278 г, 0,91 ммоль), затем смесь суспендируют в безводном ацетонитриле. Полученную смесь продувают азотом при 60 С (температура бани) и добавляют 1,7 октадиин (0,305 мл, 2,29 ммоль, 9 В), а затем триэтиламин. Раствор темного цвета перемешивают при 60 С в течение 3 ч, фильтруют через слой целита и высушивают. Раствор продукта (9 С) в смеси метанол/ДМФ/ТФУ (90:8:2) очищают на препаративной колонке ВЭЖХ. Конечный продукт (9 С) характеризуют с помощью ВЭЖХ, МС и 1H ЯМР спектроскопии. Соединение U. (7-(NN-Диметилпропинил)санциклин)(три раза). К полученной суспензии добавляют Рd(ОАс)2 (20 мг, 0,089 ммоль), CuI (10 мг, 0,053 ммоль) и(о-толил)3 Р (56 мг, 0,183 ммоль), затем продувают азотом в течение нескольких минут. К суспензии добавляют NN-диметилпропин (308 мг, 3,72 ммоль) и триэтиламин (1 мл). При добавлении Et3N образуется раствор коричневого цвета. Затем реакционную смесь нагревают при 70 С в течение 3 ч. Реакционную смесь анализируют методом ВЭЖХ. Затем реакционную смесь охлаждают до комнатной температуры и фильтруют через целит. При упаривании растворителя получают твердое вещество коричневого цвета,которое затем очищают методом препаративной ВЭЖХ с получением твердого вещества желтого цвета. Структуру полученного соединения характеризуют с помощью 1H ЯМР, ВЭЖХ и МС. Соединение ВА. (7-(2'-Хлор-3-гидроксипропенил)санциклин) 7-(3-гидроксипроп-1-инил)санциклин (100 мг) переносят в 20 мл насыщенного МеОН/НСl и перемешивают в течение 20 мин. Полученный раствор упаривают, при этом получают порошок желтого цвета. Структуру полученного соединения характеризуют с помощью 1H ЯМР, ВЭЖХ и МС. Соединение СС. (7-(3'-Метоксифенилэтил)санциклин) 7-(3'-Метоксифенилэтинил)санциклин (1 ммоль) переносят в насыщенный раствор MeOH/HCl. К полученному раствору добавляют 10% Pd/C и гидрируют при давлении 344,75 кН/м 2 в течение 12 ч. Затем фильтруют через целит. Растворитель упаривают, при этом получают порошок желтого цвета. Продукт высаживают из смеси МеОН/диэтиловый эфир. Структуру полученного соединения характеризуют с помощью 1H ЯМР, ВЭЖХ и МС. Соединение CW. 2-Диметиламиноацетиламино)санциклин)NN-Диметилглицин (1,2 ммоль) растворяют в ДМФ (5 мл) и добавляют гексафторфосфат Обензотриазол-1-ил-N,N,N',N'-тетраметилурония (HBTU, 1,2 ммоль). Полученный раствор перемешивают при комнатной температуре в течение 5 мин. К раствору добавляют 7-аминосанциклин (1 ммоль, 10 А), а затем диизопропилэтиламин (DIEA, 1,2 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 2 ч. Растворитель, ДМФ, удаляют в вакууме. Неочищенный материал растворяют в 5 мл МеОН, фильтруют с использованием автоматического устройства и очищают методом препаративной ВЭЖХ. Структуру соединения (10 В) характеризуют с помощью 1H ЯМР, ВЭЖХ и МС. Соединение DJ. (7-(N-Метилсульфонамидопропаргиламин)санциклин) Синтез 11 К смеси монотрифторацетата 7-иодсанциклина (1 г, 1,53 ммоль, 11 А), ацетата палладия II (17,2 мг,0,076 ммоль), тетракис трифенилфосфин палладия (176,8 мг, 0,153 ммоль) и иодида меди (I) (49 мг, 0,228 ммоль), помещенной в чистую сухую двухгорлую круглодонную колбу, добавляют 15 мл ацетонитрила(класса "химический реагент"). Реакционную смесь продувают медленным потоком газообразного аргона при перемешивании в течение 5 мин, затем добавляют (одной порцией в виде твердого вещества) Nпропаргилметансульфонамид (11 В). Сульфонамид получают методом, известным в данной области тех- 23006170 ники (J. Med. Chem., (1988), т. 31(3), стр. 577-82). Затем добавляют 1 мл триэтиламина (1 мл, 0,726 мг,7,175 ммоль) и реакционную смесь перемешивают в атмосфере аргона при температуре окружающей среды в течение приблизительно 1,0 ч. Реакционную смесь фильтруют в вакууме через слой диатомовой земли и промывают ацетонитрилом. Фильтрат высушивают в вакууме досуха и остаток обрабатывают разбавленным раствором трифторуксусной кислоты в ацетонитриле, доводя величину рН до приблизительно 2. Остаток обрабатывают еще более разбавленным раствором трифторуксусной кислоты в ацетонитриле, в результате образуется осадок, который удаляют фильтрованием в вакууме. Неочищенные фильтраты очищают посредством ВЭЖХ с обращенной фазой с использованием дивинилбензольного сорбента в качестве твердой фазы, а в качестве элюента - градиента смеси метанол/ацетонитрил, 1:1, содержащей 1% трифторуксусной кислоты, и 1% трифторуксусной кислоты в воде. Соответствующие фракции высушивают досуха при пониженном давлении и собирают твердое вещество. Соединение Синтез 12 В двухгорлой круглодонной колбе объемом 250 мл, снабженной холодильником и подключенной к баллону с аргоном, смешивают 7-иодсанциклин (12 А, 1 г, 1,53 ммоль), Рd(ОАс)2 (34 мг, 0,153 ммоль) и МеОН (50 мл). Затем раствор продувают аргоном (15 мин) при нагревании на масляной бане при приблизительно 70 С. Карбонат натрия (482 мг, 4,58 ммоль) растворяют в воде (3-5 мл) и добавляют в реакционный сосуд. Затем сосуд продувают аргоном в течение еще 5 мин. 2-Метокси-5-формилфенилбороновую кислоту (12 В, 333 мг, 1,83 ммоль) растворяют в МеОН (5 мл) и добавляют в реакционный сосуд. Затем сосуд продувают аргоном в течение еще 10 мин. Реакционную смесь анализируют до завершения реакции в течение 3 ч. Содержимое сосуда фильтруют через бумажный фильтр и остатки растворителя удаляют. Для получения гидрохлорида остаток растворяют в МеОН, насыщенном HCl, затем раствор фильтруют и растворитель удаляют. Продукт (12 С) характеризуют с помощью 1H ЯМР, МС-ЖХ. Соединение FD. (7-(2'-Метокси-5'-N,N'-диметиламинометилфенил)санциклин) Синтез 13 Альдегид (12 А, 1 г, 1,82 ммоль), гидрохлорид диметиламина (13 В, 297 мг, 3,64 ммоль), триэтиламин (506 мкл, 3,64 ммоль) и 1,2-DCE (7 мл) смешивают в колбе объемом 40 мл. Содержимое колбы растворяют в течение нескольких минут при встряхивании или перемешивании. Затем добавляют триацетоксиборгидрид натрия (772 мг, 3,64 ммоль) в виде твердого вещества. Реакционную смесь анализируют с помощью ВЭЖХ и МС-ЖХ и реакцию проводят до завершения в течение 3 ч. Реакцию останавливают добавлением МеОН (20 мл) и растворитель удаляют. Остаток повторно растворяют в 3 мл ДМФ и разделяют на колонке С-18. Фракции, полученные при элюции препаративной колонки, высушивают в вакууме и получают гидрохлорид растворением содержимого в метаноле, насыщенном HCl, растворитель удаляют и получают порошок желтого цвета (13 С). Продукт характеризуют с помощью 1H ЯМР, МС-ЖХ,ВЭЖХ. Пример 2. Определение минимальной ингибирующей концентрации (МИК) in vitro. Следующий анализ используют для определения эффективности соединений тетрациклина по отношению к распространенным бактериям. 2 мг каждого соединения растворяют в 100 мкл ДМСО. Затем раствор добавляют в питательную среду Mueller Hinton, сбалансированную по катионам (САМНВ), до конечной концентрации соединения 200 мкг/мл. Растворы соединений тетрациклина разбавляют до 50 мкл, при этом концентрация исследуемого соединения составляет 0,098 мкг/мл. Оптическую плотность(ОД) определяют относительно свежеприготовленных культур в логарифмической фазе роста исследуемых штаммов. Готовят разбавления, в которых конечная плотность клеток составляет приблизительно 1 х 106 КОЕ (колониеобразующих единиц)/мл. Если ОД=1, то плотность клеток для различных видов бактерий приблизительно составляет: Е. соli 1 х 109 KОЕ/млEnterococcus sp. 2,5 х 109 KОЕ/мл В каждую лунку микропланшета для титрования добавляют по 50 мкл клеточной суспензии. Конечная плотность клеток составляет приблизительно 5 х 105 KОЕ/мл. Эти планшеты инкубируют при 35 С в атмосфере окружающей среды в инкубаторе в течение приблизительно 18 ч. Планшеты считывают с использованием ридера для микропланшет и при необходимости наблюдают визуально. Величину МИК определяют в виде наименьшей концентрации соединения тетрациклина, при которой наблюдается ингибирование роста. Соединения по настоящему изобретению проявляют достаточно высокую ингибирующую активность в отношении роста бактерий. В табл. 2 соединения, обладающие удовлетворительным ингибированием роста конкретного штамма бактерии, обозначены знаком , соединения, обладающие высоким ингибированием роста конкретного штамма бактерии, обозначены знаком , соединения, обладающие чрезвычайно высоким ингибированием роста конкретного штамма бактерии, обозначены знаком . Таблица 2
МПК / Метки
МПК: C07C 237/26, A61K 31/65
Метки: соединения, композиция, лечения, способ, тетрациклина, фармацевтическая, тетрациклину, варианты, чувствительного, замещенные, состояния, субъекта
Код ссылки
<a href="https://eas.patents.su/30-6170-zameshhennye-soedineniya-tetraciklina-varianty-farmacevticheskaya-kompoziciya-i-sposob-lecheniya-chuvstvitelnogo-k-tetraciklinu-sostoyaniya-subekta.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные соединения тетрациклина (варианты), фармацевтическая композиция и способ лечения чувствительного к тетрациклину состояния субъекта</a>
Предыдущий патент: Композиция, содержащая паракват и/или дикват, альгинат и рвотное средство и/или слабительное средство
Следующий патент: Переработка масличных семян
Случайный патент: Устройство регулирования мощности транспортной системы