Изомерные конденсированные пирролокарбазолы и изоиндолоны
Формула / Реферат
1. Соединение формулы I

I
или его стереоизомер или фармацевтически приемлемая соль, где
кольцо D выбрано из фенила и циклогексена с двойной связью a-b;
кольцо B и кольцо F, независимо и каждое вместе с атомами углерода, к которым они присоединены, выбраны из фенила, пиридила и тиенила;
G-X-W представляет -CH2NHC (=O)-, -C (=O) NHCH2- или -C(=O)NHC(=O)-;
R2 и R4, каждый независимо, выбран из
a) H, -CN, CF3, -NO2, -OH, -OR7, Br, F, Cl, -O(CH2)2OR8, -NR9R10, -NHS(=O)2R7,
-NHC(=O)R7 или
-NHC(=S)R7;
c)-NHC(=O)NR9R10, -NHC(=S)NR9R10, -CO2R12, -C(=O)R12, -C(=O)NR9R10 или
-C(=S)NR9R10, и
e) метила, этила, пропила или винила, где
1) каждая группа метил, этил, пропил или винил является незамещенной, или
2) каждая группа метил, этил, пропил или винил является замещенной фенилом, пиридилом, бензилокси, гидроксиC1-C8алкокси, C1-C8алкилоксиC1-C8алкокси, F, Cl, Br, -CN, -NO2, -OH, -OR7, -NR9R10, -NHCO2R7, -NHC(=O)NR9R10, -NHC(=S)NR9R10, -NHC(=O)R7, -NHC(=S)R7, -NHS(=O)2R7, -S(O)2R7, -CO2R12, -C(=O) NR9R10, -C(=S)NR9R10, -C(=O)R12, -CH2OR8 или -S (=O) 2NR12R12A;
R3 и R5 представляют H;
Q представляет -NR6;
R6 выбран из H, SO2R7A, -CO2R7A, -C(=O)R7A, -C(=O)NR9R10 и алкила из 1-3 атомов углерода, и либо
1) алкил из 1-3 атомов углерода является незамещенным, либо
2) алкил из 1-3 атомов углерода является замещенным группой, выбранной из фенила, пиридила, бензилокси, гидроксиC1-C8алкокси, C1-C8алкилоксиC1-C8алкокси, F, Cl, Br, -CN, -NO2, -OH, -OR7, -OC(=O)R7A, -OC (=O)NHR12, -NR9R10, -NHCO2R7A, -NHC(=O)NR9R10, -NHC(=S)NR9R10, -NHC(=NH)NH2, -NHC(=O)R7A, -NHC(=S)R7A, -NHS(=O)2R7A, -S(O)2R7A, -CO2R12, -C(=O)NR9R10, -C (=S) NR9R10, -C(=O)R12 и -S(=O)2NR12R12A;
R7 представляет алкил из 1-4 атомов углерода;
R7A выбран из алкила из 1-4 атомов углерода; фенила, замещенного одним или двумя группами хлора; пирролила; N-бутоксикарбонилпирролила и N-метансульфонилпир-ролила;
R8 выбран из H и алкила из 1-4 атомов углерода;
R9 и R10, каждый независимо, выбран из H, алкила из 1-4 атомов углерода, алкила из 1-4 атомов углерода, замещенного OH, и фенила;
R12 выбран из H и алкила из 1-4 атомов углерода;
R12A имеет значения, указанные для R12;
Y выбран из -CH2-, -CH2CH2-, -CH(R13)-, -CH=CH-, -O-, -S-, -S(=O)-, -S(=O)2-, -C(=O)- и -CH2O-;
R13 выбран из -CH2OH, -CH2OCH3, -CH2OCH2CH2OCH3, -CHOH(пиридил), -CHOH(CH3) и -тиенила.
2. Соединение по п.1, где кольца B и F независимо представляют собой замещенный или незамещенный фенил.
3. Соединение по п.1, где Q представляет -NR6, и R6 представляет H или замещенный или незамещенный алкил из 1-3 атомов углерода.
4. Соединение по п.1, где Y представляет -CH2-, -CH2CH2-, -C(=O)-, -CH2O-, -S-, -O- или
-CH=CH-.
5. Соединение по п.1, где кольцо D представляет фенил.
6. Соединение по п.5, где кольца B представляет фенил, замещенный R2, и кольцо F представляют собой фенил, замещенный R4.
7. Соединение по п.6, где R6 представляет H или замещенный или незамещенный алкил из 1-3 атомов углерода.
8. Соединение по п.6, где Y представляет -CH2-, -CH2CH2-, -C(=O)-, -CH2O-, -S-, -O- или
-CH=CH-.
9. Соединение по п.1, имеющее формулу
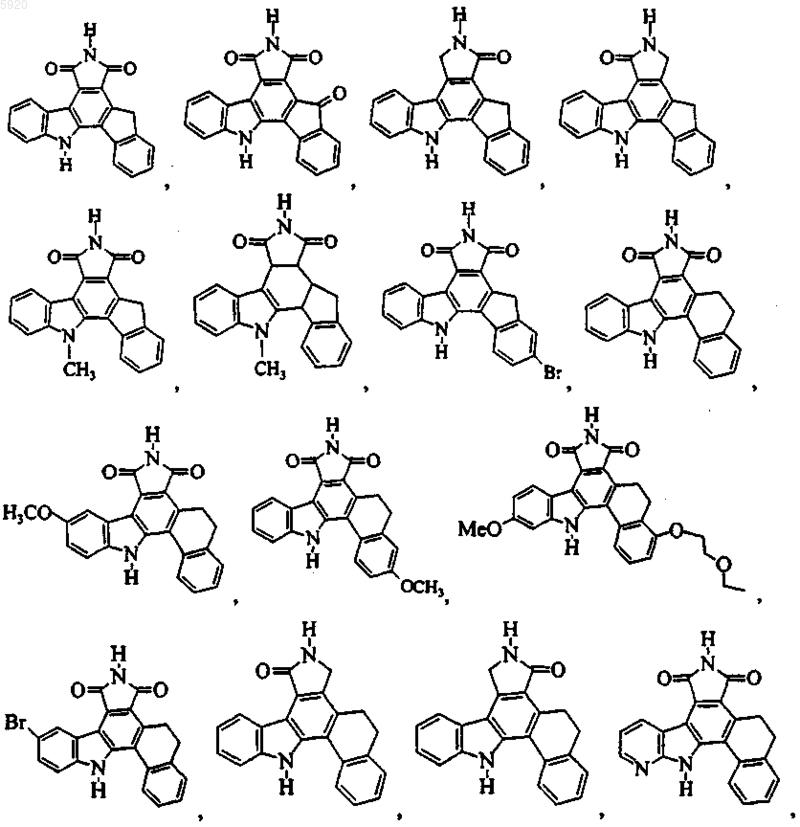
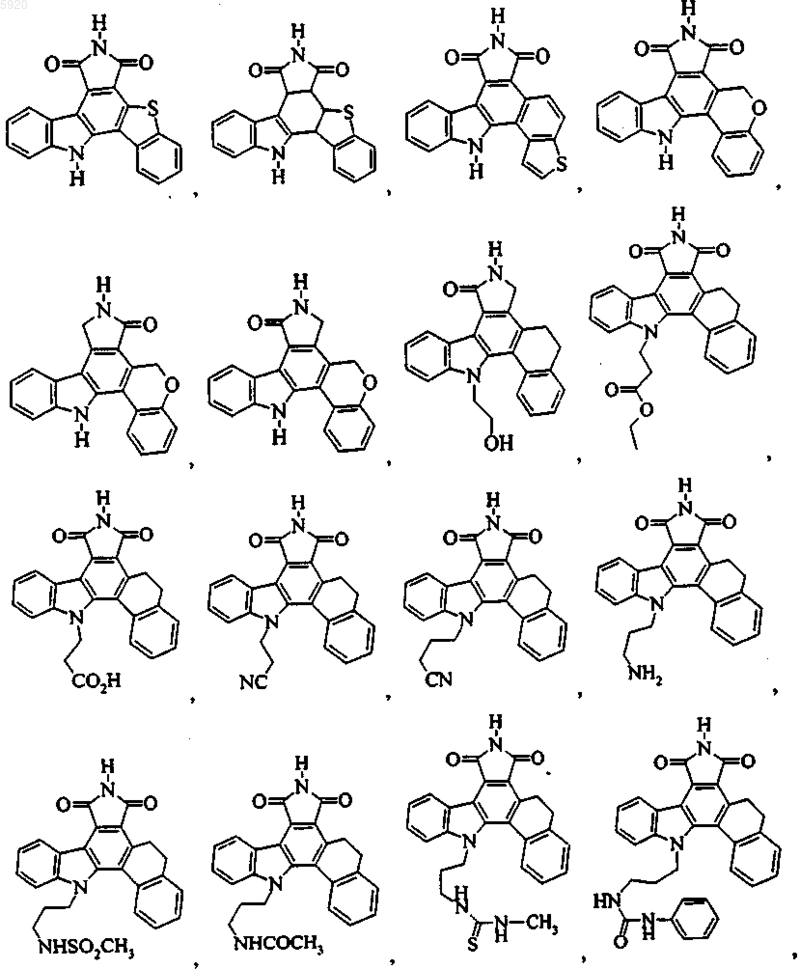
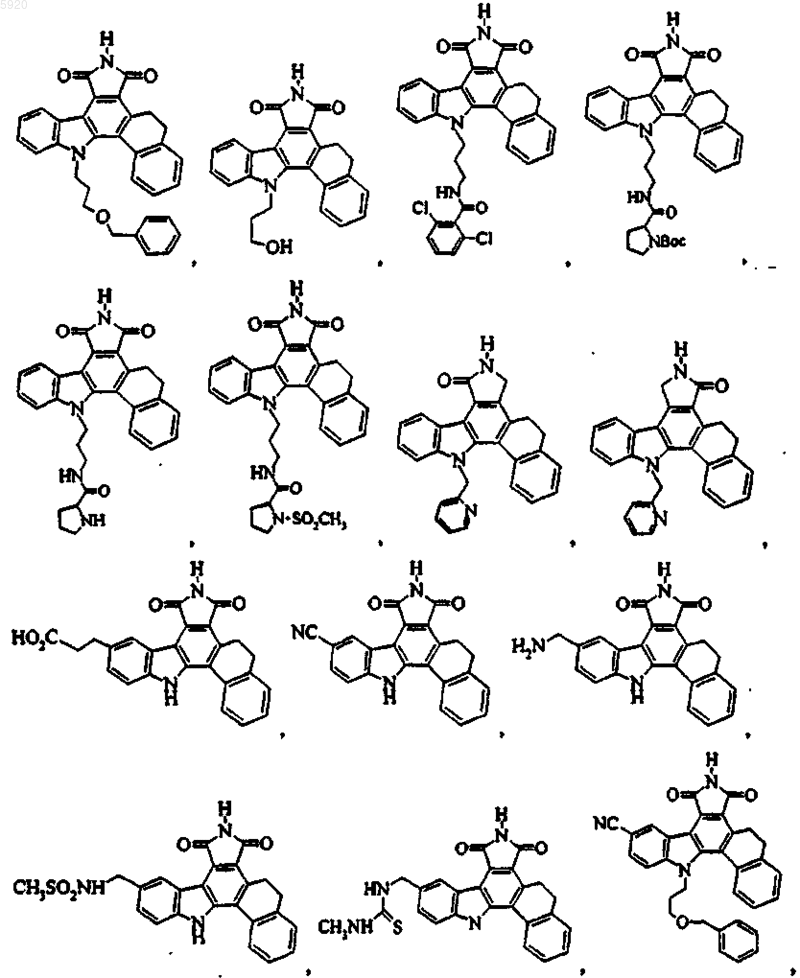
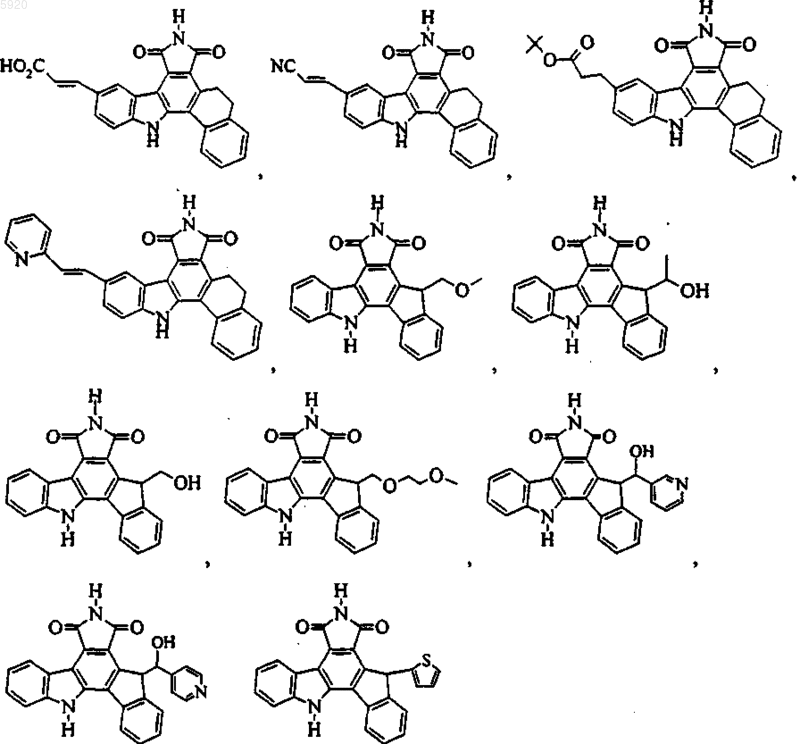
или его фармацевтичеки приемлемая соль.
10. Фармацевтическая композиция, содержащая соединение по п.1 и фармацевтически приемлемый носитель.
11. Фармацевтическая композиция, содержащая соединение по п.9 и фармацевтически приемлемый носитель.
Текст
005920 Область изобретения Настоящее изобретение относится в общем к изомерным конденсированным пирролокарбазолам и изоиндолонам, включая содержащие их фармацевтические композиции, диагностические наборы, стандартные анализы и реагенты, и к способам их применения в качестве лекарственных средств. Изобретение также относится к промежуточным соединениям и способам получения таких новых соединений. Предпосылки изобретения Полученное из микробов вещество, называемое как К-252 а, представляет собой уникальное соединение, привлекающее в течение последних нескольких лет значительное внимание благодаря разнообразной функциональной активности, которой оно обладает. К-252 а представляет собой индолокарбозольный алкалоид, который первоначально был выделен из культуры Nocardiosis sp. (Kase H. et al., 39 JAntibiotics, 1059, 1986). K252a является ингибитором нескольких ферментов, включая протеинкиназу С(РКС), играющую ключевую роль в регулировании клеточных функций, и trk тирозинкиназу. Функциональная активность К 252 а и его производных, о которой сообщалось, является многочисленной и разнообразной: ингибирование опухолей (см. патенты США 4877776, 4923986 и 5063330; публикацию европейского патента 238011 на имя Nomato); антиинсектицидная активность (см. патент США 4735939); ингибирование воспаления (см. патент США 4816450); лечение заболеваний, связанных с нейронными клетками (см. патенты США 5461146, 5621100, 5621101 и WIPO публикацию WO94/02488, опубликованную 3 февраля 1994 на имя Cephalon Inc., и Kyowa Hakko Kogyo Co., Ltd) и лечение заболеваний простаты (см. патенты США 5516771 и 5654427). Также сообщалось, что К 252 а ингибирует продуцированиеIL-2 (см. Grove et al., Experimental Cell Research 193: 175-182, 1991). Индолокарбазолы, о которых сообщалось, обладают несколькими общими признаками. В частности, каждое включает три пятичленных кольца, все из которых включают азотный фрагмент; стауроспорин (полученный из Streptomyces sp.) и К 252 а, каждый дополнительно включает фрагмент сахара, присоединенный через две N-гликозидных связи. Как К 252 а, так и стауроспорин, интенсивно исследовали в отношении их применения в качестве терапевтических агентов. Индолокарбазолы обычно являются липофильными, что дает возможность для достаточно легкого перехода их через биологические мембраны и в отличие от белковоподобных веществ они обладают более продолжительным периодом полураспада in vivo. Хотя К 252 а обычно получают из культуральной среды путем ферментативного процесса, был осуществлен общий синтез природного (+) изомера и неприродного (-) изомера, в которых три хиральных атома углерода сахара имеют противоположные конфигурации (см. Wood et al., J.Am.Chem.Soc.,117:10413, 1995 и WIPO публикацию WO97/07081). Однако данный синтез не применим для практического коммерческого использования. В дополнение к индолокарбазольным алкалоидам, представленным К 252 а и стауроспорином, получены синтетические небольшие органические молекулы, которые являются биологически активными и известны как конденсированные пирролокарбазолы (см. патенты США 5475110, 5591855, 5594009,5705511 и 5616724). Также известны конденсированные изоиндолоны, которые являются индол-несодержащими молекулами, которые могут быть химически синтезированы новым образом (см. патент США 5808060 иWIPO публикацию WO97/21677). Также сообщалось о некоторых бис-индолилмалеимидных макроциклических производных (см., например, патенты США 5710145, 5672618, 5552396 и 5545636). Также сообщалось о производных cахаров индолопирролокарбазолов (см. WIPO публикацию WO98/07433). Сохраняется необходимость в новых производных пирролокарбазола и изоиндолона, которые обладают полезными свойствами. К ним относится данное изобретение, а также и к другим важным моментам. Краткое изложение сущности изобретения Соответственно, одной из целей настоящего изобретения является создание новых соединений,представляющих собой ингибиторы киназы. В частности, соединения настоящего изобретения являются ингибиторами trk киназы, киназы рецептора фактора роста, полученного из тромбоцитов (PDGFR), киназы рецептора сосудистого эндотелиального фактора роста (VEGFR) или NGF-стимулированной trk фосфорилирования. Другой целью изобретения является разработка новых соединений, которые усиливают индуцированную трофическим фактором активность отвечающих на трофический фактор клеток. Другой целью настоящего изобретения является разработка фармацевтических композиций, обладающих активностью в отношении trk киназы, киназы рецептора фактора роста, полученного из тромбоцитов (PDGFR), киназы рецептора сосудистого эндотелиального фактора роста (VEGFR), NGFстимулированной trk фосфорилирования или отвечающих на трофический фактор клеток, где композиция включает фармацевтически приемлемый носитель и терапевтически эффективное количество по крайней мере одного из соединений настоящего изобретения или его фармацевтически приемлемой солевой формы. Настоящее изобретение предназначено для разработки способа лечения или профилактики заболеваний, связанных с аномальной активностью trk киназы, киназы рецептора фактора роста, полученного из тромбоцитов (PDGFR), киназы рецептора сосудистого эндотелиального фактора роста (VEGFR), NGFстимулированной trk фосфорилирования или отвечающих на трофический фактор клеток. Настоящее изобретение предназначено также для разработки способа ингибирования trk киназы,-1 005920 киназы рецептора фактора роста, полученного из тромбоцитов (PDGFR), киназы рецептора сосудистого эндотелиального фактора роста (VEGFR), NGF-стимулированной trk фосфорилирования или усиления активности отвечающих на трофический фактор клеток в образце жидкости тела. Эти и другие цели, которые станут очевидными из следующего далее подробного описания, были достигнуты при открытии авторами изобретения того факта, что соединения формулы I стереоизомерные формы, смеси стереоизомерных форм или их фармацевтически приемлемые солевые формы, где А, В, С, D, Е, F, G, Q, X, W, Y, R2, R3, R4 и R5 определены ниже, являются эффективными ингибиторами киназы. Подробное описание вариантов осуществления Таким образом, в первом варианте осуществления изобретение относится к новому соединению формулы I или его стереоизомеру или фармацевтически приемлемой соли, где кольцо D выбрано из фенила и циклогексена с двойной связью а-b; кольцо В и кольцо F независимо и каждое вместе с атомами углерода, к которым они присоединены, выбраны из фенила, пиридила и тиенила;e) метила, этила, пропила или винила, где 1) каждая группа метил, этил, пропил или винил является незамещенной, или 2) каждая группа метил, этил, пропил или винил является замещенной фенилом, пиридилом, бензилокси,гидроксиС 1-С 8 алкокси, С 1-С 8 алкилоксиС 1-С 8 алкокси, F, Cl, Br, -CN, -NO2, -ОН, -OR7, -NR9R10, -NHCO2R7,-NHC(=O)NR9R10, -NHC(=S)NR9R10, -NHC(=O)R7, -NHC(=S)R7, -NHS(=O)2R7, -S(O)2R7, -CO2R12, -C (=O)R6 выбран из H, SO2R7A, -CO2R7A, -C(=O)R7A, -C(=O)NR9R10 и алкила из 1-3 атомов углерода, и либо 1) алкил из 1-3 атомов углерода является незамещенным, либо 2) алкил из 1-3 атомов углерода является замещенным группой, выбранной из фенила, пиридила,бензилокси, гидроксиС 1-С 8 алкокси, С 1-С 8 алкилоксиС 1-С 8 алкокси, F, Cl, Br, -CN, -NO2, -ОН, -OR7, OC(=O)R7A, -ОС (=O) NHR12, -NR9R10, -NHCO2R7A, -NHC(=O)NR9R10, -NHC (=S)NR9R10, -NHC (=NH)R7 представляет алкил из 1-4 атомов углерода;R7A выбран из алкила из 1-4 атомов углерода; фенила, замещенного одним или двумя группами хлора; пирролила; N-бутоксикарбонилпирролила и N-метансульфонилпирролила;R9 и R10 каждый независимо выбран из Н, алкила из 1-4 атомов углерода, алкила из 1-4 атомов углерода, замещенного ОН, и фенила;R13 выбран из -СН 2 ОН, -СН 2 ОСН 3, -СН 2 ОСН 2 СН 2 ОСН 3, -СНОН(пиридил), -СНОН(СН 3) и -тиенила. В некоторых предпочтительных вариантах осуществления кольца В и F независимо представляют замещенный или незамещенный фенил или пиридил. В других предпочтительных вариантах осуществления Q представляет -NR6, где указанными значениями для R6 являются Н или замещенный или незамещенный низший алкил, содержащий 1-3 атома углерода. В некоторых предпочтительных вариантах осуществления Y представляет незамещенный алкилен из 1-3 атомов углерода, -С(=O)-, -СН 2 О-, -S-, -Оили -СН=СН-. В других предпочтительных вариантах осуществления кольцо D представляет фенил. В других предпочтительных вариантах осуществления кольцо В представляет фенил, замещенныйR2, и кольцо F представляют собой фенил, замещенный R4. В еще одном предпочтительном варианте осуществления R6 представляет Н или замещенный или незамещенный алкил из 1-3 атомов углерода. В других предпочтительных вариантах осуществления Y представляет -СН 2-, -СН 2 СН 2-, -С(=O)-, СН 2 О-, -S-, -О- или -СН=СН-. Еще дальнейшими предпочтительными вариантами осуществления являются соединения, указанные в табл. 1-4. В других вариантах осуществления настоящее изобретение относится к фармацевтическим композициям, содержащим соединение формулы I и фармацевтически приемлемый носитель. В предпочтительной композиции соединение формулы I представляет собой одно из соединений, указанных в табл. 1,2, 3 или 4. В некоторых предпочтительных фармацевтических композициях композиция предназначена для ингибирования одной или нескольких из активности trk киназы, активности VEGFR киназы или активности RDGFR, где композиция содержит соединение формулы I и фармацевтически приемлемый носитель. В других предпочтительных фармацевтических композициях композиция предназначена для усиления трофического фактора или ChAT активности спинного мозга, где композиция содержит соединение формулы I и фармацевтически приемлемый носитель. Согласно настоящему изобретению фармацевтические композиции могут быть предназначены для лечения или профилактики заболеваний простаты, таких как рак простаты или доброкачественная гиперплазия простаты, или для лечения или профилактики ангиогенных заболеваний, таких как рак солидных опухолей, эндометриоз, диабетическая ретинопатия, псориаз, гемангиобластома, глазные заболевания или дегенерация желтого пятна, или могут разрабатываться далее для лечения или профилактики неоплазии, ревматоидного артрита, фиброза легких, миелофиброза аномального заживления раны, атеросклероза или рестеноза, а также для лечения или профилактики болезни Альцгеймера, бокового амиотрофического склероза, болезни Паркинсона, удара, ишемии, болезни Хантингтона, слабоумия при СПИД, эпилепсии, рассеянного склероза, периферической невропатии или повреждений мозга или спинного мозга. Настоящее изобретение может разрабатываться далее для использования в способе ингибирования активности trk киназы, включающем обеспечение соединением формулы I в количестве, достаточном для эффективного ингибирования. В предпочтительном варианте соединение формулы I может быть предназначено для лечения воспаления. Еще в одном предпочтительном варианте рецептор trk киназы может представлять собой trk A. Далее настоящее изобретение может найти применение в способе лечения или профилактики заболеваний простаты, включающем введение хозяину, нуждающемуся в таком лечении или профилактике,терапевтически эффективного количества соединения формулы I. В предпочтительном варианте заболевание простаты может представлять собой рак простаты или доброкачественную гиперплазию простаты. Кроме того, соединения настоящего изобретения могут найти применение в способе лечения или профилактики ангиогенных заболеваний, где активность VEGFR киназы вносит вклад в патологические состояния, причем способ включает обеспечение соединением формулы I в количестве, достаточном для контактирования рецептора сосудистого зндотелиального фактора роста с эффективным ингибирующим количеством соединения. В другом варианте соединения настоящего изобретения могут найти применение также при лечении или профилактике ангиогенных заболеваний, включающим введение хозяину,нуждающемуся в таком лечении или профилактике, терапевтически эффективного количества соединения формулы I. В предпочтительном варианте ангиогенное заболевание может представлять собой рак солидных опухолей, глазные заболевания, дегенерацию желтого пятна, эндометриоз, диабетическую ретинопатию, псориаз или гемангиобластому. Соединения настоящего изобретения также могут найти применение при лечении или профилактике заболеваний, при которых PDGFR активность вносит вклад в патологические состояния, причем лечение включает обеспечение соединением формулы I в количестве, достаточном для контактирования рецептора фактора роста, полученного из тромбоцитов, с эффективным ингибирующим количеством соединения. В другом варианте соединения настоящего изобретения могут быть использованы в способе лечения или профилактики патологических нарушений, включающем введение хозяину, нуждающемуся в таком лечении или профилактике, терапевтически эффективного количества соединения формулы I. В-3 005920 предпочтительном варианте патологическое нарушение может представлять собой неоплазию, ревматоидный артрит, фиброз легких, миелофиброз, аномальное заживление раны, атеросклероз или рестеноз. Дополнительно соединения настоящего изобретения вследствие своей активности могут найти применение в способе лечения заболеваний, отличающихся аномальной активностью отвечающих на трофический фактор клеток, который включает обеспечение соединением формулы I в количестве, достаточном для контактирования рецептора отвечающих на трофический фактор клеток с индуцирующим эффективную активность количеством соединения. В предпочтительных вариантах активность отвечающих за трофический фактор клеток может представлять собой СhАТ активность. Соединения настоящего изобртения также могут найти применение в способе лечения или профилактики болезни Альцгеймера, бокового амиотрофического склероза, болезни Паркинсона, удара, ишемии, болезни Хантингтона, слабоумия при СПИД, эпилепсии, рассеянного склероза, периферической невропатии или повреждений головного или спинного мозга, который включает введение хозяину, нуждающемуся в таком лечении или профилактике, терапевтически эффективного количества соединения формулы I. Соединения, представленные формулой I, также могут называться как соединение I, и то же самое применяется для соединений с другими номерами формул. Определения Следующие термины и выражения имеют указанные значения. Как использовано в данном описании, подразумевается, что стабильное соединение или стабильная структура означает соединение,которое является достаточно стойким, чтобы выдержать выделение из реакционной смеси до нужной степени чистоты, и предпочтительно допустимо введение его в состав эффективного терапевтического агента. Настоящее изобретение относится только к стабильным соединениям. Как использовано в данном описании, предполагается, что замещенный указывает на то, что один или более атомов водорода у указанного атома заменены выбранными группами, называемыми в данном описании как заместитель,при условии, что валентность у замещаемого атома не превышена, и замещение приводит к стабильному соединению. Как использовано в данном описании, термин алкил означает прямую, циклическую или разветвленную алкильную группу, содержащую 1-8 атомов углерода, такую как метил, этил, пропил, изопропил,бутил, изобутил, втор-бутил, трет-бутил, пентил, изоамил, неопентил, 1-этилпропил, гексил, октил, циклопропил ициклопентил. Алкильный фрагмент алкил-содержащих групп, таких как алкокси, алкоксикарбонильная и алкиламинокарбонильная группы, имеет такое же значение, что и определенный выше алкил. Низшие алкильные группы, которые являются предпочтительными, представляют собой алкильные группы, как определено выше, которые содержат 1-4 атома углерода. Алкильные группы и алкильные фрагменты, содержащиеся в группах заместителей, таких как аралкильная, алкокси, арилалкокси, гидроксиалкокси, алкоксиалкокси, гидрокси-алкилтио, алкоксиалкилтио,алкилкарбонилокси, гидроксиалкильная и ацилоксигруппы, могут быть замещенными или незамещенными. Замещенная алкильная группа содержит 1-3 независимо выбранных заместителя, предпочтительно таких, как гидрокси, низший алкокси, низший алкоксиалкокси, замещенный или незамещенный арилалкокси-низший алкокси, замещенный или незамещенный гетероарилалкокси-низший алкокси, замещенный или незамещенный арилалкокси, замещенный или незамещенный гетероциклоалкокси, галоген, карбоксил, низший алкоксикарбонил, нитро, амино, моно или ди-низший алкиламино, диоксолан, диоксан,дитиолан, дитион, фуран, лактон или лактам. Как использовано в данном описании, подразумевается, что термин алкенил включает прямые,циклические и разветвленные углеводородные цепи, имеющие по крайней мере одну углеродуглеродную двойную связь. Примеры алкенильных групп включают группы этенила, пропенила, 3 метилбутенила и циклогексенила. Как использовано в данном описании, подразумевается, что термин алкинил включает прямые, циклические и разветвленные углеводородные цепи, имеющие по крайней мере одну углерод-углеродную тройную связь. Примеры алкинильных групп включают группы этинила,пропинила, 3-метилбутинила и циклогексинила. Как использовано в данном описании, подразумевается, что ацильный фрагмент ацилсодержащих групп, таких как ацилоксигруппы включает прямую, разветвленную или циклическую алканоильную группу, имеющую 1-6 атомов углерода, такую как формил, ацетил, пропаноил, бутирил, валерил, пивалоил или гексаноил. Как использовано в данном описании, термин карбоциклический относится к циклическим группам, в которых кольцевой фрагмент составлен исключительно из атомов углерода. Они включают, но не ограничиваются ими, циклопропил, циклобутил, цклопентил, циклогексил, циклогептил, циклооктил. Термин гетероцикло и гетероциклический относится к циклическим группам, в которых кольцевой фрагмент включает по крайней мере один гетероатом, такой как О, N или S. Гетероциклические группы включают гетероарильные и гетероалкильные группы. Как использовано в данном описании, термин арил означает ароматическое кольцо, содержащее 6-12 атомов углерода, такое как фенил, бифенил и нафтил. Предпочтительные арильные группы включают незамещенные или замещенные фенильные и нафтильные группы. Термин гетероарил, как он использован в данном описании, означает арильную группу, в которой один или более кольцевых атомов-4 005920 углерода заменены на гетеро (т.е. неуглеродный) атом, такой как О, N или S. Предпочтительные гетероарильные группы включают пиридильную, пиримидильную, пирролильную, фурильную, тиенильную,имидазолильную, триазолильную, тетразолильную, хинолильную, изохинолильную, бензоимидазолильную, тиазолильную, пиразолильную и бензотиазолильную группы. Термин гетероалкил означает циклоалкильную группу, в которой один или более атомов углерода заменены гетероатомами, такими как О,N или S. Как использовано в данном описании, подразумевается, что термин аралкил (или арилалкил) означает группу, имеющую от 7 до 15 атомов углерода, состоящую из алкильной группы, к которой присоединена арильная группа. Примеры аралкильных групп включают, но не ограничиваются ими, бензильную, фенетильную, бензгидрильную и нафтилметильную группу. Замещенная арильная, замещенная гетероциклическая и замещенная аралкильная группы, каждая, имеют 1-3 независимо выбранных заместителя, которые предпочтительно представляют собой низший алкил, гидрокси, низший алкокси, карбокси, низший алкоксикарбонил, нитро, амино, моно- или ди-низший алкиламино и галоген. Предпочтительные гетероциклические группы, образованные с атомом азота, включают группы пирролидинила, пиперидинила, пиперидино, морфолинила, морфолино, тиоморфолино, Nметилпиперазинила, индолила, изоиндолила, имидазола, имидазолина, оксазолина, оксазола, триазола,тиазолина, тиазола, изотиазола, тиадиазолов, триазинов, изоксазола, оксииндола, индоксила, пиразола,пиразолона, пиримидина, пиразина, хинолина, изохинолина и тетразола. Предпочтительные гетероциклические группы, образованные с атомом кислорода включают группы фурана, тетрагидрофурана, пирана, бензофуранов, изобензофуранов и тетрагидропирана. Предпочтительные гетероциклические группы, образованные с атомом серы, включают тиофен,тианафталин, тетрагидротиофен, тетрагидротиапиран и бензотиофены. Как использовано в данном описании, гидроксиалкильные группы представляют собой алкильные группы, содержащие присоединенную гидроксильную группу. Как использовано в данном описании, гидроксиалкокси группы представляют собой алкоксигруппы, которые содержат присоединенную гидроксильную группу. Как использовано в данном описании, галоген относится к фтору, хлору, брому и йоду. Как использовано в данном описании, термин гетероарилалкил означает арилалкильную группу,которая содержит гетероатом в арильном фрагменте. Термин окси означает присутствие атома кислорода. Таким образом, алкокси группы представляют собой алкильные группы, которые присоединены через атом кислорода, и карбонилокси группы представляют собой карбонильные группы, которые присоединены через атом кислорода. Как использовано в данном описании, термин гетероциклоалкил и гетероциклоалкокси означают алкильную или алкоксигруппу, которая содержит присоединенную к алкильному фрагменту гетероциклическую группу, и термин арилалкокси означает алкоксигруппу, которая содержит присоединенную к алкильному фрагменту арильную группу. Как использовано в данном описании, термин алкилкарбонилокси означает группу формулы -O-С(=O)-алкил. Как использовано в данном описании, термин алкокси-алкокси означает алкоксигруппу, которая содержит алкилоксизаместитель, присоединенный к ее алкильному фрагменту. Термин алкоксиалкилтио означает алкилтиогруппу (т.е. группу формулы -S-алкил), которая содержит алкоксизаместитель,присоединенный к ее алкильному фрагменту. Термин гидрокси-алкилтио означает алкилтиогруппу(т.е. группу формулы -S-алкил), которая содержит гидроксизаместитель, присоединенный к ее алкильному фрагменту. Как использовано в данном описании, термин моносахарид имеет общепринятое значение как простой сахар. Как использовано в данном описании, термин аминокислота означает молекулу, содержащую как аминогруппу, так и карбонильную группу. Варианты осуществления аминокислот включают-аминокислоты, т.е. карбоновые кислоты общей формулы НООС-СН(NH2) - (боковая цепь). Боковые цепи аминокислот включают природные и неприродные фрагменты. Боковые цепи неприродных (т.е. искусственных) аминокислот представляют собой фрагменты, которые используются вместо боковых цепей природных кислот в случае, например, аналогов аминокислот. См., например, Lehninger, Biochemistry, Second Edition, Worth Publishers, Inc., 1975, pages 73-75, включенную в данное описание в качестве ссылки. В определенных вариантах осуществления группы заместителей для соединений формул I, II иIII включают остаток аминокислоты после удаления гидроксильного фрагмента из ее карбоксильной группы, т.е. группы формулы -С(=O)-СН(NH2) - (боковая цепь). Функциональные группы, присутствующие в соединениях формулы I, также могут содержать защитные группы. Предпочтительные защитные группы включают бензилоксикарбонильную (Cbz; Z) группу и трет-бутоксикарбонильную (Воc) группу. Другие предпочтительные защитные группы можно найти в монографии Greene T.W. and Wuts P.G.M., Protective Groups in Organic Synthesis 2d Ed., WileySons, 1991, содержание которой включено в данное описание в качестве ссылки. Как использовано в данном описании, предполагается, что термины, обычно применяемые для описания действия терапевтических агентов в биологических системах, анализах и тому подобном, имеют свое общепринятое в данной области значение. Как использовано в данном описании, термин действие-5 005920 при использовании для модификации терминов функционирование и выживаемость означает положительное или отрицательное изменение или перемену. Действие, которое является положительным,может упоминаться в качестве улучшения или усиления, и действие, которое является отрицательным, может называться как ингибирование или подавление. Как использовано в данном описании, термины усиление или улучшение при использовании для модификации терминов функционирование или выживание означают, что присутствие соединения изомерного конденсированного пирролокарбазола или изоиндолона обладает положительным действием на функционирование и/или выживание отвечающей на трофический фактор клетки по сравнению с клеткой в отсутствие соединения. Например, и без ограничения, в отношении выживания, например,холинергического нейрона, соединение было бы очевидным улучшением выживания популяции холинергических нейронов при риске гибели (гибель вследствие, например, повреждения, болезненного состояния, дегенеративного состояния или природного развития) при сравнении с популяцией холинергических нейронов, где не присутствует такое соединение, если обработанная популяция имеет сравнительно больший период функционирования, чем необработанная популяция. Как использовано в данном описании, ингибировать и ингибирование означает, что специфический ответ обозначенного вещества (например, ферментативная активность) сравнительно понижается в присутствии соединения изомерного конденсированного пирролокарбазола или изоиндолона. Как использовано в данном описании, термин trk относится к высоко аффинным нейротрофиновым рецепторам, в настоящий момент включающим trkA, trkB и trkC, и к другим мембранноассоциированным белкам, с которыми может связываться нейротрофин. Как использовано в данном описании, термин рак и раковый относится к любой злокачественной пролиферации клеток у млекопитающего. Примеры включают рак простаты, доброкачественную гиперплазию простаты, рак яичника, молочной железы, головного мозга, легкого, поджелудочной железы, толстой кишки, кишечника, желудка, солидные опухоли, рак головы и шеи, нейробластому, почечную клеточную карциному, лимфому, лейкемию, другие распознаваемые злокачественные заболевания гемопоэтической системы и другие виды рака. Как использовано в данном описании, термин нейрон, клетка нейронной линии и нейронная клетка включает, но не ограничивается ими, гетерогенную популяцию нейронных типов, имеющую единственный или множество трансмиттеров и/или единственную или множество функций; предпочтительно, они представляют собой холинергические и сенсорные нейроны. Как использовано в данном описании, фраза холинергический нейрон означает нейроны центральной нервной системы (ЦНС) и периферической нервной системы (ПНС), чьим нейротрансмиттером является ацетилхолин; примерами являются нейроны базального переднего отдела головного мозга, стриарные и нейроны спинного мозга. Как использовано в данном описании, фраза сенсорный нейрон включает нейроны, ответственные за отклики на окружающую среду (например, температуру, движение), например, от кожи, мышц и суставов; примером является нейрон корешка спинномозгового ганглия. Как использовано в данном описании, термин отвечающая на трофический фактор клетка относится к клетке, которая включает рецептор, с которым трофический фактор может специфически связываться; примеры включают нейроны (например, холинергические и сенсорные нейроны) и не являющиеся нейронами клетки (например, моноциты и клетки, относящиеся к новообразованиям). Как использовано в данном описании, термин терапевтически эффективное количество относится к количеству соединения по настоящему изобретению, эффективному для предотвращения или лечения симптомов конкретного заболевания. Такие заболевания включают, но не ограничиваются ими, такие патологические и неврологические заболевания, связанные с отличающейся от нормы активностью описанных здесь рецепторов, где лечение или профилактика включают ингибирование, индуцирование или усиление их активности путем контактирования рецептора с соединением формулы I. Как использовано в данном описании, термин фармацевтически приемлемый относится к тем соединениям, веществам, композициям и/или лекарственным препаративным формам, которые являются, в пределах смысла медицинского суждения, подходящими для контакта с тканями человека и животных без чрезмерной токсичности, раздражения, аллергической реакции или других осложнений, соразмерных с резонным соотношением польза/риск. Как использовано в данном описании, термин фармацевтически приемлемые соли относится к производным описанных соединений, где исходное соединение модифицируют, получая его кислотные или основные соли. Примеры фармацевтически приемлемых солей включают, но не ограничиваются ими, соли минеральных или органических кислот основных остатков, таких как амины; щелочные или органические соли кислотных остатков, таких как карбоновые кислоты и тому подобное. Фармацевтически приемлемые соли включают обычные нетоксичные соли или соли четвертичных аммониевых оснований образованного исходного соединения, например, с нетоксичными неорганическими или органическими кислотами. Например, такие обычные нетоксичные соли включают соли, полученные из неорганических кислот, таких как хлористо-водородная, бромисто-водородная, серная, сульфаминовая, фосфорная, азотная и тому подобные; и соли, полученные из органических кислот, таких как уксусная, пропионовая, янтарная, гликолевая, стеариновая, молочная, яблочная, винная, лимонная, аскорбиновая, па-6 005920 мовая, малеиновая, гидроксималеиновая, фенилуксусная, глутаминовая, бензойная, салициловая, сульфаниловая, 2-ацетоксибензойная, фумаровая, толуолсульфоновая, метансульфоновая, этандисульфоновая, щавелевая, изетионовая и тому подобные. Фармацевтически приемлемые соли по настоящему изобретению могут быть синтезированы из исходных соединений, которые содержат основный или кислотный фрагмент, обычными химическими способами. Обычно такие соли могут быть получены взаимодействием формы свободной кислоты или оснований данных соединений со стехиометрическим количеством подходящего основания или кислоты в воде или в органическом растворителе, или в их смеси. Обычно неводные среды, такие как простой эфир, этилацетат, этанол, изопропанол или ацетонитрил являются предпочтительными. Список подходящих солей приведен в Remington's Pharmaceutical Sciences, 17th ed., Mark Publishing Company, EastonPA, 1985, стр.1418, содержание которого включено в данное описание в качестве ссылки. Как использовано в данном описании, подразумевается, что пролекарство включает любые ковалентно связанные носители, которые высвобождают активное исходное лекарство согласно формуле (I) или другим формулам соединений настоящего изобретения in vivo при введении такого пролекарства млекопитающему. Поскольку известно, что пролекарства усиливают многочисленные желательные качества фармацевтических препаратов (например, растворимость, биодоступность, производство и т.д.),соединения настоящего изобретения могут доставляться в форме пролекарства. Таким образом, настоящее изобретение рассматривает пролекарства заявляемых соединений, содержащие их композиции и способы их доставки. Пролекарства соединений по настоящему изобретению, например, формулы I могут быть получены путем модификации функциональных групп, присутствующих в соединении, таким образом, что модифицированные группы расщепляются или при обычной обработке, или in vivo, давая исходное соединение. Соответственно, пролекарства включают, например, соединения настоящего изобретения, где гидрокси, амино или карбоксильная группа связаны с любой группой, которая, когда пролекарство вводят млекопитающему, расщепляется с образованием свободного гидроксила, свободного амина или карбоновой кислоты, соответственно. Примеры включают, но не ограничиваются ими, ацетатные, формиатные и бензоатные производные спиртовых и аминных функциональных групп; и алкиловые, карбоциклические, ариловые и алкилариловые сложные эфиры, такие как метиловый, этиловый,пропиловый, изопропиловый, бутиловый, изобутиловый, втор-бутиловый, трет-бутиловый, циклопропиловый, фениловый, бензиловый и фенетиловый сложные эфиры и тому подобное. Синтез Соединения настоящего изобретения могут быть получены рядом способов, хорошо известных специалистам в данной области. Соединения могут быть синтезированы, например, описанными ниже способами, или их вариациями, что понятно квалифицированному специалисту. Все способы, раскрываемые в связи с настоящим изобретением, рассматриваются как практически осуществимые в любом масштабе,включая миллиграммы, граммы, мультиграммы, килограммы, мультикилограммы или коммерческий промышленный масштаб. Понятно, что соединения настоящего изобретения могут содержать один или несколько асимметрически замещенных атомов углерода и могут быть выделены в оптически активной или рацемической формах. Таким образом, подразумеваются все хиральные, диастереомерные, рацемические формы и все геометрические изомерные формы структуры, если специально не указана конкретная стереохимическая или изомерная форма. Хорошо известно в данной области, каким образом получают и выделяют такие оптически активные формы. Например, смеси стереоизомеров могут быть разделены стандартными способами, включая, но не ограничиваясь ими, разделение рацемических форм, обычную, обращеннофазовую и хиральную хроматографию, избирательное солеобразование, перекристаллизацию и тому подобное или путем хирального синтеза либо из хиральных исходных веществ, или путем преднамеренного синтеза целевых хиральных центров. Как легко понятно, функциональные группы, присутствующие в соединениях формулы I, в процессе синтеза могут содержать защитные группы. Например, заместители аминокислотных боковых цепей соединений формулы I могут быть замещены защитными группами, такими как бензилоксикарбонильная или трет-бутоксикарбонильная группы. Защитные группы известны сами по себе в качестве химических функциональных групп, которые могут быть селективно присоединены и удалены от функциональных групп, таких как гидроксильные группы и карбоксильные группы. Подобные группы присутствуют в химическом соединении для придания такой функции инертности к условиям химической реакции, которой подвергают соединение. В настоящем изобретении можно использовать любую из множества защитных групп. Предпочтительные защитные группы включают бензилоксикарбонильную (Cbz; Z) группу и трет-бутоксикарбонильную (Воc) группу. Другие предпочтительные группы согласно изобретению можно найти в Greene T.W. and Wuts, P.G.M., Protective Groups in Organic Synthesis, 2d, Ed., WileySons,1991. Соединения настоящего изобретения могут быть получены, как показано в общих чертах на следующих схемах. Обычно имидные соединения могут быть получены, как показано на схеме 1. Реакция циклоприсоединения малеимида и циклического-2-винильного производного (II) дает соединения тетрагидрокарбазола общей структуры (III), которые могут быть дегидрированы способами,хорошо известными в данной области (схема 1). Реакцию циклоприсоединения можно осуществлять в отсутствие растворителя при температурах от примерно 150 до примерно 200 С или в растворителе, таком как толуол, ксилол или хлорбензол, при повышенных температурах с добавлением или без добавления кислоты Льюиса в качестве катализатора. Диены общей структуры (II) могут быть получены добавлением 2-литийиндольных производных, замещенных или незамещенных, к циклическому гетеро(арил) 1-кетону, например, 1-инданону, 1-тетралону, 4-хроманону, 4-кето-4,5,6,7-тетрагидротианафталину, замещенному или незамещенному, как описано, например, в Tetrahedron Lett., 1985, 26, 5935, описание которого включено в настоящее описание в качестве ссылки. На схеме 2 показан в общих чертах общий подход получения изомеров лактама, т.е. соединений,где G-X-W представляет собой -C(=O)-N(R1)-C(B1B2) или -C(A1A2)-N(R1)-C(=O)-. Схема 2 Реакция циклоприсоединения диенов общей структуры III к этил цисцианоакрилату в условиях,описанных для имидов на схеме 1, дает региоизомеры циано-сложноэфирного тетрагидрокарбазола общей структуры V и VI. Стандартные способы, такие как перекристаллизация или хроматография, можно использовать для разделения полученных региоизомеров V и VI. Циано-сложные эфиры тетрагидрокарбазола легко могут быть дегидрированы в соответствии с обычными методами, например с помощью 2,3 дихлор-4,5-дициано-1,4-бензохинона, давая ароматизироанные карбазолы общей структуры VII и VIII(Схема 2). Лактамы общей структуры IX и X могут быть получены по отдельности или в виде смеси восстановительной циклизацией нитрило-сложных эфиров с использованием восстановителей, например никеля Ренея/Н 2, РdO и Pd или на активированном углероде. Имидное производное IV легко может быть восстановлено до изомеров лактама IX и X обычными способами, как например, с использованием амальгамы цинка-HCl, Zn в уксусной кислоте или обработкой гидридными восстанавливающими агентами, такими как литийалюминийгидрид. Полученные региоизомеры лактама могут быть разделены стандартными способами, такими как перекристаллизация или хроматография.-8 005920 Соединения, в которых G-X-W представляет -СН (R1A)-С (=O) -N(R1)- или -N(R1)-C(=O)-CH(R1A), а также те, в которых G-X-W представляет лактам или имид, могут быть получены способами, указанными, например, в патентах США 5616724 и 5801190, описание которых включено в настоящее описание в качестве ссылки во всей своей полноте. Схема 3 Соединения, содержащие гетероарильные группы в кольцах В или F, могут быть получены с использованием описанных способов, как показано на схемах 3 и 4. Фенильное кольцо индола может представлять собой гетероцикл, например, но не ограничиваясь этим, 7-азаиндол. Схема 4 Хотя полученное производное спирта общей структуры (I-i), показанное на схеме 1, может быть дегидрировано до соединений общей структуры (II) с использованием условий, известных в данной области, как, например, НСl в ацетоне или п-толуолсульфоновая кислота в бензоле, диены общей структуры(II) также могут быть получены с использованием метода кросс-сочетания, катализируемого палладием. Например, сочетание подходящего бром, йод или трифторметансульфонатного производного с 2 станнил- или 2-бороновая кислота- производным индола, как показано на схеме 5. Схема 5-9 005920 Тетрагидрокарбазольные аддукты циклоприсоединения III легко могут быть дегидрированы в соответствии с обычными способами с помощью, например, 2,3-дихлор-4,5-дигиано-1,4-бензохинона, давая ароматические карбазолы общей структуры IV (схема 1). Схема 6 На схеме 6 показан в общем виде альтернативный способ получения изомера лактама общей структуры X. Диен общей структуры II, замещенный или незамещенный, взаимодействует с оксалилхлоридом и спиртом, давая кетоэфиры общей структуры XIX. Реакции олефинизации, известные специалистам в области органического синтеза, например взаимодействие кетона XIX с диэтилцианометилфосфонатом,легко дают цианоэфир XX. Замыкание ароматического кольца в катализируемых палладием или окислительных условиях дает циано-эфир-карбазол общей структуры XXI (схема 6) или VIII (схема 2). Восстановительная циклизация дает лактам общей структуры X (схемы 2, 6). Соединения настоящего изобретения, где соединения общих структур IV, IX или X содержатY=CH2, дополнительно могут быть замещены, как показано на схеме 7. Схема 7 Обычно соединения, в которых R6 представляет собой водород, могут быть алкилированы в присутствии основания (например, гидридов, алкоксидов, гидроксидов щелочных или щелочноземельных металлов, или литийорганических соединений) обработкой R6L, где L представляет собой уходящую группу, такую как галоген. Полученный пирролокарбазол может иметь алкильную группу, замещенную или незамещенную, связанную с азотом индола, например, IV-20, 41. Соединения общей формулы IV, IX или X, в которой R6 представляет N-водород, могут быть подвергнуты реакции Михаэля с использовани- 10005920 ем основания, такого как ДБУ, и акцептора Михаэля, такого как производное акриловой кислоты или акрилонитрил, давая соединения IV-20-22. Реакции данного типа в дальнейшем могут быть понятны со ссылкой на схему 8. Схема 8 Галогенпроизводные, такие как бромзамещенное соединение IV-9, можно использовать для дополнительной модификации индольного кольца, как показано на схемах 9 и 10. Схема 9 Катализируемая палладием реакция Хека с использованием IV-9 и партнера сочетания, такого как виниларильное или гетероарильное производное, производное акриловой кислоты или акрилонитрил,дает винильные производные IV-37, 37, 39, 43. Винильное производное может быть восстановлено в алкановые производные, такие как IV-38, 40, с использованием условий восстановления, таких как палладий-на-углероде в атмосфере водорода. Другие отличительные особенности изобретения будут понятны в ходе следующего описания примеров осуществления. Данные примеры приведены для иллюстрации изобретения и не предназначены для его ограничения. Примеры Некоторые сокращения, использованные в данном описании, определены следующим образом: ТГФ для тетрагидрофурана, BuLi для бутиллития, NMP для N-метилпирролидинона, ДМСО для диметилсульфоксида, СDС 13 для дейтерированного хлороформа, RaNi для никеля Ренея, ТСХ для тонкослойной хроматографии, EtOAc для этилацетата, TBAF для фторида тетрабутиламмония, са для приблизительного значения, кт для комнатной температуры, фунт/кв.дюйм для фунтов на квадратный дюйм, мм для миллиметров ртутного столба (Нg), С для градусов Цельсия, д для дублета,дд для дублета дублетов, т для триплета. м для мультиплета, экв. для эквивалентов, г для грамма или граммов, мг для миллиграмма или миллиграммов, мл для миллилитра или миллилитров,Н для водорода или водородов, час или ч для часа или часов, м для мультиплета, М для молярности, мин или м для минуты или минут, МГц для мегагерц, т.пл. для температуры плавления, Масс-спектр для масс-спектроскопии, ямр или ЯМР для спектроскопии ядерного магнитного резонанса. Пример 1. Соединение IV-1 Стадия 1: Промежуточное соединение I-ia (Y=СН 2, R2=R4=H, R6=H (2-(1-Гидрокси)инданил)индол К раствору индола (4,0 г, 34,1 ммоль) в ТГФ (200 мл) при -78 С в атмосфере азота добавляли по каплям BuLi (34,1 ммоль, 13,7 мл 2,5 М раствора в гексанах) в течение 15 мин. После 3-минутного перемешивания СО 2 (г) пропускали через раствор в течение 10 мин, после чего прозрачный раствор оставляли нагреваться до температуры окружающей среды, затем концентрировали до половины объема при пониженном давлении. Объем ТГФ доводили до примерно 200 мл и охлаждали до -78 С. Медленно добавляли трет-BuLi (34,1 ммоль, 20 мл 1,7 М раствора в гексанах) при поддержании температуры ниже -68 С с последующим перемешиванием в течение 2 ч при -78 С. Добавляли 1-инданон (5,0 г, 37,4 ммоль) в ТГФ (25 мл), смесь перемешивали в течение 1 ч, гасили добавлением воды (5 мл), затем выливали в насыщенный раствор NH4Cl (250 мл). Смесь экстрагировали простым эфиром (1x200 мл), промывали 100 мл насыщенного раствора NH4Cl, сушили (MgSO4) и концентрировали при пониженном давлении, получая масло. Перекристаллизация из смеси Et2O-гeкcaн давала 5,1 г (63%) I-i-a, т.пл. 123-124 С. 1 Н ЯМР (CDCl3):2,3-2,5 (м, 1 Н), 2,55-2,7 (м, 2 Н), 2,9-3,05 (м, 1 Н), 3,1-3,2 (м, 1 Н), 6,15 (с, 1 Н), 7,05-7,4 (м, 7 Н), 7,5 (д, 1 Н),8,5 (с, 1 Н). Стадия 2: Промежуточное соединение IIа (Y=СН 2, R2=R4=H, R6=H (2-(1-Инденил)индол К перемешиваемому раствору Iа (4,0 г, 16,1 ммоль) в ацетоне (50 мл) добавляли 2 н НСl (5 мл). После перемешивания в течение 15 мин при комнатной температуре добавляли воду и твердое вещество собирали фильтрованием, хорошо промывали водой и сушили, получая 3,7 г (100%) промежуточного соединения IIa в виде белого твердого вещества. 1 Н ЯМР (CDCl3):3,6 (с, 2 Н), 6,75 (с, 1 Н), 6,95 (С, 1 Н) 7,1-7,5 (м, 5 Н), 7,6 (д, 1 Н), 7,7 (д, 1 Н), 7,9 (д, 1 Н), 8,35 (ушир.с, 1 Н). Масс-спектр (ES+) m/e 254 (М + 23). Стадия 3: Промежуточное соединение IIIa, (Y = СН 2, R2=R4=H, R6=H) Смесь промежуточного соединения IIа (660 мг, 2,9 ммоль) и малеимида (550 мг, 5,7 ммоль) в 10 см запаянной реакционной ампуле нагревали при перемешивании при 180-190 С в течение 30 мин. После охлаждения до примерно 50-60 С добавляли МеОН (3 мл) и продукт собирали после растирания, полу- 12005920 чая 880 мг (92%) IIIа в виде белого твердого вещества; т.пл. 210-214 С. 1 Н ЯМР (ДМСО-d6, 300 МГц):3,1-3,4 (м, 2 Н) , 3,8 (м, 2 Н) , 3,95 (т, 1 Н), 4,35 (д, 1 Н), 6,9-7,4 (м, 7 Н), 7,75 (д, 1 Н) , 11,05 (с, 1 Н), 11,25 (с,1 Н). Масс-спектр (ES-) : m/e 327 (m - 1). Стадия 4: Соединение IV-1 К суспензии промежуточного соединения IIIа (500 мг, 1,52 ммоль) в толуоле (60 мл) добавляли твердый 2,3-дихлор-5,6-дициано-1,4-бензохинон (865 мг, 3,81 ммоль) в виде одной порции. Раствор выдерживали при 60-65 С в течение 6 ч. После охлаждения на ледяной бане твердые вещества собирали фильтрованием, суспендировали в МеОН (20 мл) и продукт собирали фильтрованием. Перекристаллизация из ацетона давала 350 мг (71%) соединения IV-1 в виде желтого твердого вещества, т.пл.300 С. 1 Н ЯМР (ДМСО-d6, 300 МГц):4,38 (с, 2 Н) , 7,38 (т, 1 Н), 7,45-7,5 (м, 1 Н), 7,6-77 (м, 2 Н), 7,8 (м, 2 Н), 8,6 (д,1 Н), 8,95 (д, 1 Н), 11,15 (с, 1 Н), 12,15 (с, 1 Н). Масс-спектр (FAB): m/e 324 (m+) . Элементный анализ, вычислено для C21H12N2O20,7 Н 2 О: С, 74,86; Н, 4,01; N, 8,31. Найдено: С, 74,85; Н, 3,62; N, 8,52. Пример 2. Соединение IV-2 К перемешиваемому раствору соединения IV-1 в NMP (2 мл) добавляли NaH (10 мг 95%-ного) при комнатной температуре. Реакционную смесь меняла цвет из оранжевого на зеленый. Через 0,5 ч добавляли воду и полученное красное твердое вещество собирали, промывали водой и сушили. 1 Н ЯМР (ДМСОd6, 300 МГц):7,34 (т, 1 Н), 7,45 (т, 1 Н), 7,6-7,75 (м, 4 Н), 8,35 (д, 1 Н), 8,95 (д, 1 Н). Масс-спектр (ES-): m/е 337 (m-1). Пример 3. Соединение IX-1 Стадия 1: Промежуточное соединение Va (Y=СН 2, R2=R4=H, R6=H) Промежуточное соединение IIa (2,0 г, 8,7 ммоль) и этил цисцианоакрилат (3,3 г, 26,0 ммоль) нагревали в круглодонной колбе в токе азота при 190 С при перемешивании в течение 1 ч. По мере охлаждения до комнатной температуры добавляли МеОН (10 мл) и перемешивание продолжали в течение 0,5 ч. Раствор оставляли на ночь в холодильнике и отделившееся твердое вещество собирали, получая 880 мг(28%) промежуточного соединения Va в виде белого твердого вещества. 2 Н ЯМР (ДМСО-d6, 300 МГц):1,28 (т, J=6,9 Гц, 3 Н) , 3,00-3,08 (м, 1 Н), 3,30 (м, 1 Н), 3,47-3,51 (м, 1 Н), 3,62 (м, 1 Н), 4,26 (кв, J=7,0 Гц,2 Н), 4,54 (м, 1 Н), 4,72 (м, 1 Н), 6,97-7,09 (м, 2 Н), 7,16-7,24 (м, 3 Н), 7,31 (д, J=7,8 Гц, 1 Н), 7,50 (д, J=7,5 Гц,1 Н), 7,82 (д, J=7,0 Гц, 1 Н) , 11,04 (с, 1 Н) . Масс-спектр (ES+) m/e 357, 379 (М + 1, М + 23). Стадия 1b. Слой метанола со стадии 1 а концентрировали при пониженном давлении до масла и избыток цианоакрилата удаляли отгонкой Kugelrohr (температура печи 80 С, 1 мм). Остаток растирали с простым эфиром, получая желтое твердое вещество, которое собирали. 1 Н ЯМР показал смесь 2:1 изомеров Va и Via (Y =CH2); Масс-спектр (ES+) m/e 357, 379 (M + 1, M+23). Стадия 2: Промежуточное соединение VIIa (Y=CH2, R2=R4=H, R6=H) К суспензии промежуточного соединения VIa со стадии 1 а (650 мг, 1,8 ммоль) в толуоле (60 мл) добавляли твердый 2,3-дихлор-5,6-дициано-1,4-бензохинон (1,05 г, 4,6 ммоль) в виде одной порции. Раствор помещали на масляную баню при 65 С в течение 6 ч. После охлаждения при температуре морозильной камеры твердые вещества собирали фильтрованием, суспендировали в МеОН (20 мл) и продукт собирали фильтрованием, получая 620 мг (98%) желтого твердого вещества. 1 Н ЯМР (ДMCO-d6, 300 МГц):1,44 (т, J=7,0 Гц, 3 Н), 4,36 (с, 2 Н), 4,45 (q, J = 7,18 Гц, 2 Н), 7,38 (т, 1 Н), 7,44 (т, 1 Н), 7,54-7,63 (м,2 Н), 7,71-7,78 (м, 2 Н), 8,55 (д, J=7,5 Гц, 1 Н), 8,63 (д, J=8,0 Гц, 1 Н), 12,22 (с, 1 Н). Масс-спектр (ES+) m/e 353, 375 (М + 1, М + 23). Стадия 3: Соединение IX-1 Продукт со стадии 2 (промежуточное соединение VIIa) (500 мг, 1,4 ммоль) в ДМФ (40 мл) и катализатор RaNi (1 небольшой шпатель) гидрировали при давлении 60 фунтов/кв.дюйм в аппарате Парра в течение 24 ч или до тех пор, пока данные ТСХ (2:1, EtOAc:Гексаны) не показали завершение реакции. Растворитель фильтровали через целит для удаления катализатора, затем концентрировали при пониженном давлении. Твердое вещество растирали с МеОН, собирали и сушили, получая 325 мг (71%) соединения IX-1 в виде белого твердого вещества, т.пл.300 С. 1H ЯМР (ДМСО-d6, 300 МГц):4,30 (с,2 Н), 4,93 (с, 2 Н), 7,32-7,42 (м, 2 Н), 7,52-7,56 (м, 2 Н), 7,72-7,76 (м,2 Н), 8,05 (д, 1 Н), 8,51-8,54 (м, 2 Н), 11,92(с, 1 Н). Масс-cпeктp(FAB): m/e 311 (m+) . Пример 4. Соединение Х-1 Стадия 1: Промежуточное соединение VIIIa (Y=СН 2, R2=R4=H, R6=H) К суспензии циано-сложноэфирных изомеров Va и VIa из примера 3 стадия Ib (880 мг, 2,3 ммоль),суспендированных в толуоле (50 мл), добавляли твердый 2,3-дихлор-5,6-дициано-1,4-бензохинон (1,3 г,5,6 ммоль) в виде одной порции. Раствор помещали на масляную баню при 65 С в течение 6 ч. После охлаждения при температуре морозильной камеры твердые вещества собирали фильтрованием, суспендировали в МеОН (20 мл) и продукт собирали фильтрованием, получая 700 мг (88%) продукта в виде смеси двух изомеров циано-сложноэфирного карбазола в соотношении приблизительно 2:1 (VIIIa:VIIa)- 13005920 согласно 1 Н ЯМР. Масс-спектр (ES+) m/e 353 (М + 1). Смесь непосредственно использовали на следующей стадии. Стадия 2: Соединение Х-1 Смесь циано-сложноэфирных изомеров VIIIa и VIIa со стадии 1 (700 мг, 2,0 ммоль) и катализаторRaNi (один полный шпатель) в ДМФ (40 мл) гидрировали при давлении 60 фунтов/кв. дюйм в аппарате Парра в течение 24 ч или до тех пор, пока данные ТСХ(2:1, ЕtОАс:Гексаны) не показали завершение реакции. Растворитель фильтровали через целит для удаления катализатора, затем концентрировали при пониженном давлении. Продукт растирали с МеОН, собирали и сушили, получая 550 мг (89%) белого твердого вещества. По данным 1 Н ЯМР (ДМСО-d6, 300 МГц) показано, что продукт представлял собой смесь 2:1 соединений Х-1: IX-1. Соединение Х-1 выделяли колоночной хроматографией (силикагель) и элюировали смесью толуол:ТГФ, увеличивая содержание ТГФ от 30 до 50%. Фракции, содержащие чистый продукт, объединяли и концентрировали при пониженном давлении. Продукт собирали после растирания с МеОН, т.пл.300 С. 1 Н ЯМР (ДМСО-d6, 300 МГц):4,08 (с, 2 Н), 4,59 (с, 2 Н), 7,20 (т, J=7,5 Гц,1 Н), 7,37-7,46 (м, 2 Н), 7,54 (т, J=7,5 Гц, 1 Н), 7,64-7,71 (м, 2 Н), 8,53-8,56 (с, 2 Н), 9,18 (д, J=7,8 Гц, 1 Н),11,71 (с, 1 Н) . Масс-спектр (ES+) : m/e 311 (М + 1). Пример 5. Соединение III-1 Стадия 1: Промежуточное соединение I-ib (Y=СН 2, R2=R4=H, R6=H) (1-Метил-2-[(1 гидрокси)инданил)]индол(20 мл). Раствор перемешивали при кипении с обратным холодильником в течение 4 ч, охлаждали до комнатной температуры с последующим добавлением 1-инданона в 10 мл простого эфира. После перемешивания при комнатной температуре в течение 2 ч раствор выливали в насыщенный раствор NH4Cl(30 мл). Эфирный слой промывали водой (2 х 20 мл), раствором NaCl (2 х 20 мл) и сушили (MgSO4). Растирание со смесью простой эфир-гексан (2:1) давало 3,7 г (62%) Ib. 1H ЯМР (ДМСО-d6, 300 МГц):2,52,6 (м, 1 Н), 2,7-2,8 (м, 1 Н), 2,9-3, (м, 1 Н), 3,1-3,2 (м, 1 Н), 3,95 (с, 3 Н), 6,0 (с, 1 Н), 7,05-7,30 (м, 2 Н), 7,457,5 (м, 7 Н) . Стадия 2: 1-Метил-2-(1-инденил)индол (Промежуточное соединение IIb) К перемешиваемому раствору промежуточного соединения I-ib (500 мг, 1,9 ммоль) в ацетоне добавляли медленно при комнатной температуре 2 н НCl. Через 2 ч добавляли воду и осадок собирали фильтрованием, хорошо промывали водой и сушили, получая 445 мг (96%) промежуточного соединенияIIb в виде белого твердого вещества т.пл.250 С. 1 Н ЯМР (CDCl3):3,66 (С, 2 Н), 3,8 (с, 3 Н), 6,65 (с,1 Н), 6,70 (с, 1 Н), 7,15-7,4 (м, 7,5-7,6 (м, 2 Н), 7,75 (д, 1 Н). Масс-спектр (ES+) m/e 245 (М -1). Стадия-3. Соединение III-1 (Промежуточное соединение IIIb, Y = СН 2, R2=R4=H, R6=H) Смесь IIb (380 мг, 1,6 ммоль) и малеимида (190 мг, 1,9 ммоль) в 10 см запаянной реакционной ампуле нагревали при 180 С в течение 30 мин. Дав смеси возможность охладиться ниже 60 С, добавляли МеОН (3 мл) и продукт собирали после растирания, получая 450 мг (82%) белого твердого вещества,т.пл. 205-210 С. 1 Н ЯМР (ДМСО-d6, 300 МГц):2,9-2,95 (м, 1 Н), 3,05-3,15 (м, 2 Н), 3,5 (м, 1 Н), 3,9 (с,3 Н), 7,0-7,3 (м, 5 Н), 7,45 (д, 1 Н), 7,55 (м, 1 Н), 7,85 (д, 1 Н), 11,05 (с 1 Н). Масс-спектр (ES-) m/e 341 (М-1). Пример 6. Соединение IV-3 К суспензии соединения III-1 из примера 5 (330 мг, 1,0 ммоль) в толуоле (50 мл) добавляли твердый 2,3-дихлор-5,6-дициано-1,4-бензохинон (550 мг, 2,5 ммоль) в виде одной порции. Раствор выдерживали при кипении с обратным холодильником в течение 4 ч. После охлаждения на ледяной бане твердые вещества собирали фильтрованием, суспендировали в МеОН (20 мл) и продукт собирали фильтрованием,получая 280 мг (86%) желтого твердого вещества, т.пл.262-265 С. 1 Н ЯМР (ДМСО-d6, 300 МГц):3,4m/e 337 (М-1). Пример 7. Соединение IV-4 Стадия 1: Промежуточное соединение IIc (Y = СН 2, R2=H, R4=5-Br, R6=H) Данное вещество получали с помощью аналогичной общей методики примеров Ia-IIa, с использованием индола (10,0 г, 85,3 ммоль) и 5-бром-1-инданона (19,0 г, 90 ммоль), получая неочищенное спиртовое промежуточное соединение Iс. Полученный сырой спирт в виде темного маслянистого остатка растворяли в ацетоне (250 мл) с последующим добавлением 2 н НCl (25 мл) и воды (50 мл). После перемешивания в течение 2 ч при комнатной температуре смесь выливали в воду и экстрагировали EtOAc.EtOAc промывали водой и насыщенным раствором соли, сушили над MgSO4, затем концентрировали при пониженном давлении. Продукт растирали с Et2O и собирали, получая 8,7 г промежуточного соединения IIс. 1H ЯМР (CDCl3):3,56 (с, 2 Н), 6,68 (с, 1 Н), 6,90 (с, 1 Н), 7,12-7,25 (м, 3 Н), 7,40 (д, 1 Н), 7,52 (д,1 Н), 7,66-7,74 (м, 3 Н), 8,26 (с, 1 Н). Масс-спектр (ES+): m/e 311 (м + 1).- 14005920 Стадия 2: Промежуточное соединение IIIc (Y=CH2, R2=H, R4=5-Br, R6=H) Данное вещество получали с помощью аналогичной общей методики примера Iс с использованиемIIс (300 мг, 0,97 ммоль) и малеимида (300 мг, 3,1 ммоль), получая 210 мг (57%) промежуточного соединения IIIс в виде белого твердого вещества. 1 Н ЯМР (ДМСО-d6):3,72-2,80 (м, 1 Н), 3,17-3,26 (м, 2 Н),3,53 (м, 1 Н), 4,4 (м, 2 Н), 6,95-7,206 (м, 2 Н), 7,27 (д, 1 Н), 7,41-7,46 (м, 2 Н), 7,66-7,75 (м, 2 Н), 10,69 (с, 1 Н),11,33 (с, 1 Н). Масс-спектр (ES+): m/e 407 (m+). Стадия 3. Соединение IV-4 Данное вещество получали с помощью аналогичной общей методики для соединения IV-1 с использованием IIIс (160 мг, 0,4 ммоль) и 2,3-дихлор-5,6-дициано-1,4-бензохинона (228 мг, 1,0 ммоль), получая 158 мг (100%) соединения IV-4 в виде желтого твердого вещества. 1 Н ЯМР (ДМСО-d6):4,34 (с,2 Н), 7,36 (т, 1 Н), 7,62 (т, 1 Н), 7,73-7,82 (м, 2 Н), 7,98 (с, 1 Н), 8,52 (д, 1 Н), 8,93 (д, 1 Н) , 11,18 (с, 1 Н), 12,18(с, 1 Н). Масс-спектр (ES-): m/e 402 (m - 1). Пример 8. Соединение IV-5 Стадия 1: Промежуточное соединение I-id (Y=СН 2 СН 2, R2=R4=H, R6=H (2-(1-Гидрокси-1,2,3,4 тетрагидронафтил)индол Данное соединение получали с помощью аналогичной общей методики для соединения I-ia, с использованием индола (15 г, 132 ммоль) и 1-тетралона (20 г, 139 ммоль), получая 18 г (46%) промежуточного соединения Id в виде белого твердого вещества. 1 Н ЯМР (CDCl3):1,84-1,93 (м, 1 Н) , 1,97-2,03 (м, 1 Н), 2,17-2,35 (м, 2 Н), 2,36 (с, 1 Н), 2,88-2,92 (,2 Н), 6,10 (с, 1 Н), 7,07 (т, 1 Н), 7,13-7,19 (м, 3 Н), 7,23-7,28 (м, 1 Н), 7,33-7,36 (м, 2 Н), 7,51 (д, 1 Н), 8,42 (с,1 Н). Стадия 2: Промежуточное соединение IId (Y=СН 2 СН 2, R2=R4=H, R6=H (2-[l-(3,4 дигидронафтил)]индол К раствору спирта I-id (15 г, 57 ммоль) в ацетоне (150 мл) добавляли 2 н НС 1 (3 мл). После перемешивания при комнатной температуре в течение 1 ч добавляли воду для инициирования осаждения твердого вещества. Продукт собирали фильтрованием и сушили, получая 14 г (100%) промежуточного соединения IId в виде белого твердого вещества. 1 Н ЯМР (CDCl3):2,39-2,46 (м 2 Н), 2,82-2,87 (м, 2 Н), 6,38(т, 1 Н), 6,59 (с, 1 Н), 7,09-7,25 (м, 5 Н), 7,34-7,40 (м, 2 Н), 7,61 (д, 1 Н), 8,11 (с, 1 Н). Масс-спектр (ES+) m/e 246 (М + 1). Стадия 3: Промежуточное соединение IIId (Y=СН 2 СН 2, R2=R4=H, R6=H) Перемешиваемую смесь диена IId (330 мг, 1,4 ммоль) и малеимида нагревали при 190 С в течение 1 ч. Смесь охлаждали, растворяли в этилацетате (50 мл) и промывали несколько раз горячей водой для удаления избыточного малеимида. EtOAc слой сушили (MgSO4), концентрировали и полученное твердое вещество сушили в вакууме при 80 С, получая 425 мг (89%) IIId. Масс-спектр (ES-) m/e 341 (М - 1). Стадия 4: Соединение IV-5 К имидному промежуточному соединению IIId, суспендированному в толуоле (10 мл) добавляли 2,3-дихлор-5,6-дициано-1,4-бензохинон (160 мг, 0,7 ммоль) в виде одной порции с последующим нагреванием при 60-65 С в течение 16 ч. Суспензию концентрировали и продукт очищали колоночной хроматографией (силикагель, EtOAc:гексан; 1:1), получая 90 мг желтого твердого вещества. 1 Н ЯМР 2,81 (м,2 Н), 3,16 (м, 2 Н), 7,27 (т, 1 Н), 7,40-7,54 (м, 4 Н), 7,67 (м, 1 Н), 8,12 (д, 1 Н), 8,88 (д, 1 Н), 11,10 (с, 1 Н), 11,85(с, 1 Н) . Масс-спектр (ES-) m/e 337 (М - 1). Пример 9. Соединение IV-6 Стадия 1: Промежуточное соединение I-ie. (Y=СН 2 СН 2, R2=5-ОСН 3, R4=H, R6=H (2-(1-Гидрокси 1,2,3,4-тетрагидронафтил)-5-метоксииндол Промежуточное соединение I-ie получали с помощью аналогичной общей методики для соединения(62%) промежуточного соединения I-ie в виде белого твердого вещества. 1 Н ЯМР (CDCl3):1,84-1,90 (м,1 Н), 1,96-2,03 (м, 1 Н) , 10 2,16-2,33 (м, 2 Н), 2,36 (с, 1 Н), 2,90 (м, 2 Н), 3,80 (с, 3 Н), 6,03 (с, 1 Н), 6,82 (м,1 Н), 6,97 (с, 1 Н), 7,13-7,25 (м, 4 Н), 7,32 (д, 1 Н), 8,31 (с, 1 Н). Стадия 2: Промежуточное соединение IIe (Y=СН 2 СН 2, R2=5-ОСН 3, R4=H, R6=H (2-[1-(3,4 Дигидронафтил)]-5-метоксииндол К раствору спирта I-ie (300 мг, 1,0 ммоль) в ацетоне (10 мл) добавляли 2 н НСl (1 мл). После перемешивания при комнатной температуре в течение 1 ч добавляли воду для осаждения продукта, который собирали фильтрованием и сушили, получая 200 мг (73%) Не в виде красного твердого вещества. 1 Н ЯМР (CDCl3):2,41-2,45 (м, 2 Н), 2,81-2,86 (м, 2 Н), 3,86 (с, 3 Н), 6,35 (м, 1 Н), 6,52 (с, 1 Н), 6,83 (м, 1 Н),7,08 (с, 1 Н), 7,12-7,25 (м, 4 Н), 7,39 (м, 1 Н), 8,01 (с, 1 Н). Масс-спектр (ES+) m/e 276 (М + 1). Стадия 3: Промежуточное соединение IIIe. (Y = СН 2 СН 2, R2=5-ОСН 3, R4=H, R6=H) Данное вещество получали с помощью аналогичной общей методики для соединения IIIа с использованием IIе (150 мг, 0,54 ммоль) и малеимид (105 мг, 1,1 ммоль), получая 100 мг (50%) IIIе в виде бело- 15005920 го твердого вещества. Масс-спектр (ES+) m/e 373 (М + 1). Стадия 4: Соединение IV-6 Данное вещество получали с помощью аналогичной общей методики для соединения IV-1 с использованием имида IIIе со стадии 3 (80 мг, 0,22 ммоль) и 2,3-дихлор-5,6-дициано-1,4-бензохинона (103 мг, 0,45 ммоль) в диоксане (3 мл), получая 75 мг (95%). 1 Н ЯМР (ДМСО-d6):2,82 (м, 2 Н), 3,2 (м, 2 Н),3,84 (с, 3 Н), 7,15 (м, 1 Н), 7,36-7,59 (м, 3 Н), 7,57 (д, 1 Н), 8,11 (д, 1 Н), 8,46 (с, 1 Н), 11,09 (с, 1 Н), 11,69 (с,1 Н). Масс-спектр (ES-) m/e 367 (M-1). Пример 10. Соединение IV-7 Стадия 1: Промежуточное соединение I-if (Y=CH2CH2, R2=H, R4=6-OCH3, R6=H (2-(1-Гидрокси 1,2,3,4-(6-метокси)тетрагидронафтил)-2-индол Получали с помощью аналогичной общей методики для промежуточного соединения I-ia с использованием индола (7,0 г, 59,8 ммоль) и 6-метокси-1-тетралона (11,6 г, 65,8 ммоль), получая 12,7 г (73%) промежуточного соединения I-if в виде белого твердого вещества. 1 Н ЯМР (CDCl3):1,83-2,01 (м, 2 Н),2,16-2,25 (м, 2 Н), 2,86 (м, 2 Н), 3,80 (с, 3 Н), 6,12 (с, 1 Н), 6,67-6,73 (м, 2 Н), 7,04-7,17 (м, 2 Н), 7,23 (м, 1 Н),7,34 (д, 1 Н), 7,50 (д, 1 Н), 8,40 (ушир.с, 1 Н). Стадия 2: Промежуточное соединение IIf (Y=CH2CH2, R2=H, R4=6-OCH3, R6=H (2-(6-Метокси-(3,4 дигидронафтил-2-индол Данное вещество получали с помощью аналогичной общей методики для соединения На, с использованием промежуточного соединения I-if (300 мг, 1,03 ммоль) и 3 мл 2 н НСl, получая 280 мг (100%) IIf в виде белой пены. 1 Н ЯМР (CDCl3):2,37-2,43 (м, 2 Н), 2,78-2,85 (м, 2 Н), 3,82 (с, 3 Н), 6,12 (с, 1 Н), 6,25(ушир.с, 1 Н). Масс-спектр (ES+) m/e 276 (М + 1). Стадия 3: Промежуточное соединение IIIf (Y=CH2CH2, R2=H, R4=6-OCH3, R6=H) Данное вещество получали с помощью аналогичной общей методики для соединения IIIа, с использованием промежуточного соединения IIf (250 мг, 0,91 ммоль) и малеимида (265 мг, 2,7 ммоль), получая 225 мг (67%) IIIf в виде белой пены. 1 Н ЯМР (CDCl3):1,60-1,72 (м, 2 Н), 2,70-2,9 (м, 3 Н), 3,62 (м, 1 Н),3,80 (с, 3 Н), 4,20 (м, 1 Н), 4,30 (м, 1 Н), 6,7 (с, 1 Н), 6,9 (м, 1 Н), 7,1-7,35 (м, 4 Н), 6,60 (с, 1 Н), 6,80 (с, 1 Н), 8,0(д, 1 Н). Масс-спектр (ES ) m/e 371 (M -). Стадия 4: Соединение IV-6 Данное вещество получали с помощью аналогичной общей методики для соединения IV-1, с использованием имида IIIf со стадии 3 (35 мг, 0,094 ммоль) и 2,3-дихлор-5,6-дициано-1,4-бензохинона (54 мг, 0,237 ммоль), получая 31 мг (85%) соединения IV-6 в виде желтого твердого вещества. 1 Н ЯМР(д, 1 Н), 8,87 (д, 1 Н), 11,05 (с, 1 Н), 11,76 (с, 1 Н). Масс-спектр (ES+) m/e 369 (М + 1), 391 (М + 23). Пример 11. Соединение IV-8 Стадия 1: Промежуточное соединение I-ig (Y = СН 2 СН 2, R2=6-ОСН 3, R4=5-(2-этокси)этокси, R6=H) Получали с помощью аналогичной общей методики для промежуточного соединения I-ia, с использованием 6-метоксииндола (1,5 г, 9,8 ммоль) и 5-[(2-этокси)этокси]-1-тетралона (2,35 г, 10,0 ммоль), получая 1,8 г (47%) промежуточного соединения I-ig в виде белого твердого вещества. 1 Н ЯМР (CDCl3):1,23 (т, 3 Н), 1,83 (м, 1 Н), 1,94 (м, 1 Н), 2,10-2,32 (м, 4 Н), 2,74-2,83 (м, 2 Н), 3,64 (кв, 2 Н), 3,83 (с, 3 Н), 4,15(м, 2 Н), 6,02 (м, 1 Н), 6,72-6,80 (м, 3 Н), 7,00 (д, 1 Н), 7,12 (д, 1 Н), 7,25 (с, 1 Н), 7,36 (д, 1 Н), 8,41 (ушир.с,1 Н). Стадия 2: Промежуточное соединение IIg (Y = СН 2 СН 2, R2=6-ОСН 3, R4=5-(2-этокси)этокси, R6=H) Данное вещество получали с помощью аналогичной общей методики для соединения IIа, с использованием промежуточного соединения Ig (200 мг, 0,52 ммоль) и 2 мл 2 н НСl, получая 175 мг (95%) промежуточного соединения IIg в виде белого порошка. 1 Н ЯМР (CDCl3):1,25 (т, 3 Н), 2,32-2,40 (м, 2 Н),2,85 (м, 2 Н), 3,65 (кв, 2 Н), 3,81-3,85 (м, 2 Н), 3,82 (с, 3 Н), 4,15 (м, 2 Н), 6,33 (м, 1 Н), 6,49 (с, 1 Н), 6,76-6,86(м, 3 Н), 7,02-7,15 (м, 2 Н), 7,45 (м, 1 Н) , 7,97 (ушир.с, 1 Н) . Масс-спектр (ES+) m/e 364 (М + 1). Стадия 3: Промежуточное соединение IIIg. (Y = СН 2 СН 2, R2=6-ОСН 3, R4=5-(2-этокси)этокси, R6=H) Данное вещество получали с помощью аналогичной общей методики для промежуточного соединения IIIа, с использованием продукта примера IIg (100 мг, 0,29 ммоль) и малеимида (55 мг, 0,58 ммоль),получая 55 мг (41%) IIIg в виде белой пены. 1 Масс-спектр (ES-) m/e 459 (М -1). Стадия 4: Соединение IV-8 Данное вещество получали с помощью аналогичной общей методики для соединения IV-1, с использованием имида IIIg со стадии 3 (50 мг, 0,11 ммоль) и 2,3-дихлор-5,6-дициано-1,4-бензохинона (54 мг, 0,24 ммоль), получая 45 мг (90%) соединения IV-8. 1 Н ЯМР (ДМСО-d6):1,13 (т, 3 Н), 2,77 (м, 2 Н),3,2 (м, 2 Н), 3,51 (кв, 2 Н), 3,74 (м, 2 Н), 3,84 (с, 3 Н), 4,17 (м, 2 Н), 6,88 (м, 1 Н), 7,10-7,16 (м, 2 Н), 7,42 (м,1 Н), 7,72 (м, 1 Н), 8,7 (д, 1 Н), 1,04 (с, 1 Н), 11,65 (с, 1 Н). Масс-спектр (ES-) m/e 455 (М - 1).- 16005920 Пример 12. Соединение IV-9 К соединению IV-4 (50 мг, 0,15 ммоль) в ДМФ (2 мл) добавляли NBS (31 мг, 0,18 ммоль) с последующим перемешиванием при комнатной температуре в течение 2 ч. Раствор концентрировали при пониженном давлении. Остаток растирали с МеОН (3 мл) и твердое вещество собирали и промывали МеОН, получая 55 мг (89%) соединения IV-9 в виде желтого твердого вещества, т.пл.300C; 1 Н ЯМР(ДМСО-d6, 300 МГц):2,82 (м, 2 Н), 3,12 (м, 2 Н), 7,43-7,53 (м, 4 Н), 7,68 (с, 1 Н), 8,14 (д, 1 Н), 9,06 (с,1 Н),11,24 (с, 1 Н), 12,05 (с, 1 Н) . Масс-спектр (ES-) m/e 416 (М - 1). Пример 13. Соединение Х-2 Стадия 1: Смесь промежуточного соединения II-d (2-[l-(3,4-дигидронафтил)]индол) (1,0 г, 4,1 ммоль) и этил цисцианоакрилата (2,0 г, 16,0 ммоль) нагревали при 190 С при перемешивании в течение 1 ч. По мере охлаждения до комнатной температуры добавляли МеОН (10 мл) и перемешивание продолжали в течение 0,5 ч. Отделившееся твердое вещество собирали, получая 1,2 г (79%) белого твердого вещества. Твердое вещество представляло собой смесь 1:1 2-х изомеров и имело т.пл.300 С. Масс-спектр (ES+) m/e 371 (М + 1). Данное промежуточное соединение непосредственно использовали на следующей стадии. Стадия 2: К смеси изомеров со стадии 1 (500 мг, 1,35 ммоль) в толуоле (50 мл) добавляли твердый 2,3-дихлор-5,6-дициано-1,4-бензохинон (678 мг, 3,0 ммоль) в виде одной порции. Смесь нагревали при 60-65 С в течение 18 ч. Реакционную смесь концентрировали при пониженном давлении. Полученное вещество растворяли в EtOAc (75 мл), промывали 2 н NaOH (2x 50 мл), водой (2 х 50 мл), насыщенным раствором NaCl (2x50 мл), сушили (MgSO4) и концентрировали, получая 480 мг (97%) продукта в виде смеси 1:1 3-циано и 4-циано-изомеров. Данное промежуточное соединение непосредственно использовали на следующей стадии. Стадия 3: Смесь изомеров в соотношении 1:1 (450 мг, 1,2 ммоль) со стадии 3 в смеси ДМФ:МеОН(1:1, 10 мл) и 1 полный шпатель RaNi гидрировали при давлении 55 фунтов/кв.дюйм в течение 18 ч. Катализатор удаляли фильтрованием и растворитель удаляли при пониженном давлении. Твердое вещество растирали с простым эфиром, получая 350 мг (90%) смеси изомеров лактама IX-2: Х-2 в соотношении 1:1. Стадия 4: Соединение Х-2 К изомерам лактама со стадии 3 (300 мг, 0,93 ммоль) в ДМФ (10 мл) добавляли триэтиламин (190 мг, 0,25 мл) и трет-бутилдиметилсилилхлорид (285 мг, 1,9 ммоль). Раствор перемешивали 1 ч при комнатной температуре, по данным ТСХ (силикагель, простой эфир:гексан; 1:1) за данное время реакция прошла примерно на 50%. ДМФ удаляли при пониженном давлении и остаток растворяли в EtOAc, промывали водой и раствором NaCl и сушили (MgSO4). Растворитель удаляли и полученное твердое вещество растирали с простым эфиром. Соединение Х-2 собирали и сушили; т.пл.300 С. 1 Н ЯМР (ДMCO-d6,300 МГц):2,8 (ушир., 4 Н), 4,5 (с, 2 Н), 7,21 (т, 1 Н), 7,37-7,51 (м, 4 Н), 7,65 (д, J = 8 Гц, 1 Н), 8,23 (д, J = 7,6 Гц, 1 Н), 8,63 (с, 1 Н), 9,14 (д, J=7,7 Гц), 11,48 (с, 1 Н). Масс-спектр (ES-) m/e 371 (М + 1). Пример 14. Соединение IX-2 Эфирный раствор из примера 13 стадия 4 концентрировали и добавляли ТГФ, а затем TBAF (2 мл, 1 М в ТГФ). Раствор перемешивали при комнатной температуре в течение 4 ч, после чего растворитель удаляли и полученное твердое вещество растирали с водой, собирали. Продукт промывали простым эфиром и сушили (60 С,1 мм), получая соединение IX-2 в виде белого твердого вещества, т.пл.300 С. 1 Н ЯМР (ДMCO-d6, 300 МГц):2,77-2,81 (м, 2 Н), 3,49-3,52 (м, 2 Н), 4,83 (с, 2 Н), 7,23-7,36 (м, 2 Н), 7,42-7,51 (м,3 Н), 7,70 (д, 1 Н), 7,78 (д, 1 Н), 8,15(д, 1 Н), 8,46 (с, 1 Н), 11,61 (с, 1 Н). Масс-спектр (ES-) m/e 371 (М + 1). Пример 15. Соединение XIII Стадия 1: Промежуточное соединение XI (R2=R4=R6=H) К раствору 7-азаиндола (5,2 г, 4 4 ммоль) в сухом ТГФ (120 мл), охлажденному до -78 С, в атмосфере азота медленно добавляли BuLi (46,2 ммоль, 18,5 мл 2,5 М раствора в гексанах). После перемешивания в течение 30 мин через раствор пропускали СО 2(г) в течение 10 мин, после чего прозрачный раствор концентрировали до примерно двух третей первоначального объема при пониженном давлении. Объем ТГФ доводили до примерно 125 мл и охлаждали до -78 С. Медленно добавляли трет-BuLi (44 ммоль, 26 мл 1,7 М раствора в гексанах), поддерживая температуру ниже -68 С, с последующим перемешиванием в течение 2 ч при -78 С. К оранжевому раствору добавляли по каплям 1-тетралон (6,8 г, 46,2 ммоль) в ТГФ (10 мл). Смесь перемешивали в течение 1,5 ч, затем выливали в 2 н НСl (150 мл), экстрагировали EtOAc (1x150 мл) и НСl слой перемешивали в течение 18 ч. НСl-раствор подщелачивали 2 нNaOH и образовавшийся при этом осадок собирали, получая 6,7 г (63%) промежуточного соединения- 17005920 Стадия 2: Промежуточное соединение XII (R2=R4=R6=H) Смесь промежуточного соединения XI (100 мг, 0,41 ммоль) и малеимида (79 мг, 0,81 ммоль) в ксилолах (8 мл) выдерживали при кипении с обратным холодильником в течение 14 ч. Реакционную смесь охлаждали до комнатной температуры и отделившееся твердое вещество собирали, промывали простым эфиром и сушили, получая 90 мг (64%) соединения XII в виде желто-коричневого твердого вещества. Масс-спектр (ES-) m/e 341 (М-1). Стадия 3: Соединение XIII К суспензии XII (35 мг, 0,1 ммоль) в диоксане (3,5 мл) добавляли твердый DDQ (45 мг, 0,2 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 12 ч. Добавляли метанол (5 мл) и смесь охлаждали в морозильной камере. Светло-золотистый осадок собирали и сушили, получая 20 мг(д, 1 Н), 9,14 (д, 1 Н), 11,25 (с, 1 Н), 12,48 (с, 1 Н). Масс-спектр (ES-): m/e 338 (m - 1). Пример 16. Соединение III-2 Стадия 1: Промежуточное соединение IIg (Y = S, R2=R4=R6=H (2-(3-Бензотиено)индол К раствору 1-карбокси-2-трибутилстаннилиндола (9,5 г, 21,0 ммоль) и 3-бромбензотиофена (3,0 г,14,1 ммоль) в EtOH (75 мл) добавляли дихлорбис(бистрифенилфосфин)палладий(II) (771 мг, 1,1 ммоль). Смесь перемешивали при кипении с обратным холодильником в атмосфере азота в течение 16 ч, охлаждали до комнатной температуры и концентрировали при пониженном давлении. Полученное темное масло споласкивали раствором простой эфир-гексан (1:1) и декантировали (2 х), получая коричневое твердое вещество. Твердое вещество перекристаллизовывали из горячего МеОН, получая 3,2 г (65%) золотистокоричневого твердого вещества. 1 Н ЯМР (ДМСО-d6):6,94 (с, 1 Н), 7,04 (т, 1 Н), 7,15 (т, 1 Н), 7,43-7,62 (м,4 Н), 8,04 (с, 1 Н), 8,09 (д, 1 Н), 8,29 (д, 1 Н), 11,55 (с, 1 Н). Масс-спектр (ES+): m/e 250 (m + 1). Стадия 2: Соединение III-2 2-(3-Бензотиено)индол (IIg, стадия 1) (100 мг, 0,4 ммоль), малеимид (77 мг, 0,8 ммоль) и трифторуксусную кислоту (примерно 10 капель) в толуоле (10 мл) выдерживали при кипении с обратным холодильником в течение 12 ч. Реакционную смесь охлаждали до комнатной температуры и твердое вещество собирали, промывали толуолом и простым эфиром, получая 75 мг (54%) соединения III-2 в виде золотисто-коричневого твердого вещества. 1 Н ЯМР (ДМСО-d6):3,73 (м, 1 Н), 4,47 (м, 1 Н), 4,90 (м, 1 Н), 4,96(60 мг, 0,26 ммоль). После нагревания при 65 С в течение 12 ч смесь концентрировали, продукт растирали с метанолом, собирали и сушили, получая 24 мг (78%) IV-10. 1 Н ЯМР (ДМСО-d6):7,38 (т, 1 Н), 7,567,82 (м, 4 Н), 8,23 (д, 1 Н), 8,92 (д, 1 Н), 9,00 (д, 1 Н), 11,32 (с, 1 Н), 12,37 (с, 1 Н). Масс-спектр (ES-): m/e 341(m - 1). Пример 18. Соединение XVII Стадия 1: Промежуточное соединение XIV (R2=H) Данное вещество получали с помощью аналогичной общей методики для промежуточного соединения I-ia, исходя из индола (3,5 г, 29,9 ммоль) и 4-кето-4,5,6,7-тетрагидротианафталина (5,0 г, 32,9 ммоль), получая 6,5 г (81%) XIV в виде белого твердого вещества. 1 Н ЯМР (CDCl3):1,93-2,09 (м, 2 Н),2,16-2,24 (м, 2 Н), 2,33 (с, 1 Н), 2,86-2,93 (м, 2 Н), 6,16 (с, 1 Н), 6,87 (д, 1 Н), 7,05-7,18 (м, 3 Н), 7,35 (д, 1 Н),7,52 (д, 1 Н), 8,44 (с, 1 Н). Стадия 2. Промежуточное соединение XV (R2=H) Данное вещество получали с помощью аналогичной общей методики для соединения IIа, с использованием XIV (200 мг, 0,74 ммоль), получая диен XV в виде белого нестабильного стеклообразного вещества. 1 Н ЯМР (CDCl3):2,52-2,59 (м, 2 Н), 2,89-2,95 (м, 2 Н), 6,13 (м, 1 Н), 6,61 (с, 1 Н), 7,08-7,22 (м, 4 Н),7,35 (д, 1 Н), 7,60 (д, 1 Н), 8,14 (с, 1 Н). Масс-спектр (ES+) m/e 252 (М + 1). Стадия 3: Соединение XVI (R2=H) Данное вещество получали с помощью аналогичной общей методики для соединения IIIа с использованием диена XV (250 мг, 1,0 ммоль) и малеимида (194 мг, 2,0 ммоль), получая 225 мг (66%) из смеси МеОН-простой эфир. Масс-спектр (ES+) m/e 347 (М - 1). Стадия 4: Соединение XVII Смесь XVI (70 мг, 0,2 ммоль) и DDQ (136 мг, 0,6 ммоль) нагревали при 65 С в течение 40 ч. Смесь концентрировали и продукт (Rf 0,4) выделяли колоночной хроматографией (силикагель, EtOA:гексан; 2:1) в виде желтого твердого вещества. 1H ЯМР (ДМСО-d6, 300 МГц):7,43 (т, 1 Н), 7,63 (т, 1 Н), 7,96 (д,1 Н), 8,33 (д, 1 Н), 8,43 (д, 1 Н), 8,96 (д, 1 Н), 9,07 (д, 1 Н), 9,13 (д, 1 Н), 11,25 (с, 1 Н), 12,21 (с, 1 Н). Массспектр (ES+) m/e 341 (М - 1).- 18005920 Пример 19. Соединение IV-11 Стадия 1: Промежуточное соединение I-ih (Y=CH2O, R2=R4=R6=H) Данное вещество получали с помощью аналогичной общей методики для соединения I-ia с использованием индола (7,0 г, 35 ммоль) и 4-хроманона (9,74 г, 65,8 ммоль), получая 12,5 г (79%) неочищенного масла. Образец перекристаллизовывали из смеси простой эфир-гексан. 1 Н ЯМР (CDCl3):2,30-2,49 (м, с,3 Н), 4,26-4,43 (м, 2 Н), 6,25 (с, 1 Н), 6,86-6,93 (м, 2 Н), 7,07-7,27 (м, 3 Н), 7,35 (д, 1 Н), 7,54 (д, 1 Н), 8,39(с,1 Н). Стадия 2: Промежуточное соединение IIh (Y=СН 2 О, R2=R4=R6=H) Масло со стадии 1 растворяли в ацетоне (125 мл) и добавляли 2 н НСl (20 мл) с последующим перемешиванием в течение 1 ч при комнатной температуре. Осадок собирали, промывали водой и сушили,получая 11 г (7 6% 2 стадии) вещества. 1 Н ЯМР (CDCl3):4,82 (д, 2 Н), 6,06 (м, 1 Н), 6,64 (с, 1 Н), 6,93-6,97(м, 2 Н), 7,11-7,25 (м, 3 Н), 7,36-7,43 (м, 2 Н), 7,62 (д, 1 Н) , 8,13 (с, 1 Н). Масс-спектр (ES+) m/e 248 (m + ). Стадия 3: Промежуточное соединение IIIh (Y=CH2O, R2=R4=R6=H) Данное вещество получали с помощью аналогичной общей методики для соединения IIIа, используя диен IIh (300 мг, 1,2 ммоль) и малеимид (235 мг, 2,4 ммоль). После охлаждения до комнатной температуры остаток растворяли в EtOAc (50 мл) и промывали горячей водой (3 х 50 мл), сушили (MgSO4) и концентрировали, получая желтое твердое вещество. Масс-спектр (ES+) m/e 343 (М - 1). Стадия 4. Соединение IV-11 К продукту стадии 3 (IIH) в толуоле (10 мл) добавляли DDQ (684 мг, 3,0 ммоль) и нагревали при 65 С в течение 16 ч. Смесь охлаждали до комнатной температуры и выпавшее в осадок твердое вещество собирали, промывали МеОН и сушили, получая 290 мг (71% 2 стадии) неочищенного твердого вещества. Продукт очищали колоночной хроматографией (силикагель, толуол:ТГФ; 10-30% ТГФ). 1 Н ЯМР(ДМСО-d6, 300 МГц):7,24 (м, 1 Н), 7,33-7-38 (м, 2 Н), 7,59 (м, 1 Н), 7,62 (м, 2 Н), 7,80 (м, 1 Н), 8,38 (д, 1 Н),8,98 (д, 1 Н), 11,30 (с, 1 Н), 12,08 (с, 1 Н). Масс-спектр (ES+) m/e 339 (М-1). Пример 20. Соединение IX-3 Стадия 1: Смесь диена IIH (880 мг, 3,6 ммоль) и этил цис-Р-цианоакрилата (1,8 г, 14,4 ммоль) нагревали при 190 С при перемешивании в течение 1 ч. Пока смесь оставалась горячей, добавляли метанол(15 мл) с последующим перемешиванием при комнатной температуре в течение 3 ч. Выделившееся твердое вещество собирали и сушили в вакууме, получая 550 мг (41%) 4-CN изомера (промежуточное соединение V, Y = СН 2 О, R2=R4=H) в виде желтого твердого вещества. 1 Н ЯМР (ДМСО-d6, 300 МГц):1,33 (т,3 Н), 3,11-3,17(м, 1 Н), 3,81-3,84 (м, 1 Н), 4,00-4,08 (м, 1 Н), 4,31-4,41 (м, 4 Н), 4,77 (д, 1 Н), 6,87 (д, 1 Н), 7,047,15 (м, 3 Н), 7,23 (т, 1 Н), 7,42 (д, 1 Н), 7,57 (д, 1 Н), 7,64 (д, 1 Н), 10,69 (с, 1 Н). Масс-спектр (ES+) m/e 373(М + 1). МеОН слой упаривали при пониженном давлении до половины объема и добавляли простой эфир для инициирования осаждения. После охлаждения при температуре морозильной камеры в течение ночи выделяли 325 мг твердого вещества в виде смеси изомеров V в соотношении 1:1 (Y = СН 2 О,R2=R4=H) и VI (Y = СН 2 О, R2=R4=H) по данным 1 Н ЯМР. Стадия 2: 4-CN изомер со стадии 1 (500 мг, 1,3 ммоль) и DDQ (740 мг, 3,3 ммоль) в толуоле нагревали в течение 18 ч при 60 С. Раствор концентрировали и остаток растворяли в EtOAc, промывали 2 нNaOH (2 х), водой, насыщенным раствором соли и сушили (MgSO4). После концентрирования растворителя продукт растирали с МеОН, получая 320 мг (67%). 1 Н ЯМР (ДМСО-d6, 300 МГц):1,43 (т, 3 Н),4,48 (кв, 2 Н), 5,37 (с, 2 Н), 7,20 (д, 1 Н), 7,36-7,49 (м, 3 Н), 7,65 (т, 1 Н), 7,81 (д, 1 Н), 8,25 (д, 1 Н), 8,58 (д,1 Н), 12,12 (с, 1 Н). Масс-спектр (ES+) m/e 369 (М + 1). Стадия 3: Соединение IХ-3 К циано-сложноэфирному продукту со стадии 2 (300 мг, 0,82 ммоль) в смеси ДМФ:МеОН (20 мл,1:1) добавляли полный шпатель RaNi и гидрировали под давлением 55 фунтов/кв.дюйм в аппарате Парра в течение 14 ч. Раствор фильтровали через целит и концентрировали. Продукт перекристаллизовывали из МеОН, получая 200 мг (75%) в виде белого твердого вещества. 1 Н ЯМР (ДМСО-d6, 300 МГц):4,90 (с,2 Н), 5,75 (с, 2 Н), 7,15 (д, 1 Н), 7,29-7,38 (м, 3 Н), 7,52 (т, 1 Н), 7,75 (д, 1 Н), 8,02 (д, 1 Н), 8,22 (д, 1 Н), 8,62 (с,1 Н) , 11,73 (с, 1 Н) . Масс-спектр (ES+) m/e 326 (М+). Пример 21. Соединение Х-3 Смесь изомеров со стадии 1 примера 20 (330 мг, 0,9 ммоль) окисляли с использованием DDQ (607 мг, 2,7 ммоль), применяя аналогичную общую методику примера 20, стадии 3-15, получая 300 мг (90%) продукта. Изомеры растворяли в смеси (1:1, 30 мл) и гидрировали с помощью аналогичной общей методики примера 20 стадия 4, получая 175 мг. Соединение Х-3 получали из МеОН. 1 Н ЯМР (ДМСО-d6, 300 МГц):4,58 (с, 2 Н), 5,25 (с, 2 Н), 7,15-7,50 (м, 6 Н), 7,70 (д, 1 Н), 8,30 (д, 1 Н), 8,60 (с, 1 Н), 9,20 (д, 1 Н),11,60 (с, 1 Н). Масс-спектр (ES+) m/e 326 (М+).NaH (325 мг, 8,2 ммоль, 60% дисперсия в масле) добавляли к раствору диена IId (1,0 г, 4,1 ммоль) в сухом ДМФ (40 мл). После перемешивания при комнатной температуре в течение 1 ч добавляли мезил 2 бензилоксиэтанол (1,9 г, 8,2 ммоль). Реакционную смесь нагревали до 70 С на масляной бане в течение 18 ч,охлаждали до комнатной температуры и выливали в воду (100 мл). Продукт экстрагировали EtOAc (2 х 100 мл),с последующим промыванием водой (2 х 100 мл), раствором хлорида натрия (2x100 мл) и сушили (MgSO4) . Раствор концентрировали при пониженном давлении и полученный продукт растирали с раствором простой эфир:гексан (1:1), получая 1,4 5 г (95%) рыжевато-коричневого твердого вещества. 1 Н ЯМР (CDCl3):2,38 (м,2 Н), 2,86 (т, 2 Н), 3,59 (т, 2 Н), 4,12 (т, 2 Н), 4,31 (с, 2 Н), 6,20 (т, 1 Н), 6,47 (с, 1 Н), 6,74 (д, 1 Н), 7,02 (т, 1 Н), 7,10-7,25(м, 9 Н), 7,38 (д, 1 Н), 7,62 (д, 1 Н). Масс-спектр (ES+) m/e 380 (m + 1). Стадия 2: Промежуточное соединение XIXb (R2=R4=H) К продукту стадии 1 (650 мг, 1,7 ммоль) в СН 2 С 12 (25 мл) медленно добавляли оксалилхлорид (0,15 мл, 1,7 ммоль) при температуре ледяной бани. Раствор перемешивали в течение 0,5 ч, затем добавляли безводный МеОН (2 мл) с последующим перемешиванием при комнатной температуре в течение 0,5 ч. Раствор концентрировали, растворяли в EtOAc и промывали 2 н NaOH (2x), водой (2 х), раствором хлорида натрия (2 х) сушили (MgSO4 и концентрировали до темного масла. Очистка колоночной хроматографией (силикагель, EtOAc:гексан; 1:1) давала 0,5 гNa2 СО 3 (43 мг, 0,41 ммоль) в сухом ТГФ (25 мл) перемешивали при кипении с обратным холодильником в течение 4 ч. Реакционную смесь охлаждали до комнатной температуры и концентрировали. Остаток растворяли в EtOAc (50 мл), промывали 2 х 2 н NaOH, водой, насыщенным раствором соли, сушили(м, 2 Н), 2,80-2,87 (м, 2 Н), 3,20 (с, 3 Н), 3,5-3,65 (м, 2 Н), 2,95-4,05 (м, 1 Н), 4,15-4,25 (м, 1 Н), 4,3 (с, 2 Н),5,95 (с, 1 Н), 6,05 (м, 1 Н), 6,65 (д, 1 Н), 7,05-7,1 (м, 2 Н), 7,18 (м, 2 Н), 7,2-7,4 (м, 6 Н), 7,45 (м, 1 Н), 7,7 (м,1 Н). ИК см-1 2240 (CN). Масс-спектр (ES+) m/e 489 (м + 1). Стадия 4: Промежуточное соединение XXI (R2=R4=H) Промежуточное соединение XX (500 мг, 1,1 ммоль), хлоронил (270 мг, 1,2 ммоль) и ацетат палладия (240 мг, 1,1 ммоль) в дихлорбензоле (40 мл) перемешивали при кипении с обратным холодильником в атмосфере азота 24 ч. Раствор концентрировали, остаток растворяли в EtOAc и экстрагировали 2 М раствором Na2CO3 (3 х) и сушили (MgSO4). Продукт очищали колоночной хроматографией (Rf 0,5, силикагель, EtOAc: гексан; 1:1). Масс-спектр (ES+) m/e 487 (m + 1), 509 (m + 23). Стадия 5: Соединение Х-4 К продукту со стадии 4 в смеси ДМФ-МеОН (10 мл + 5 мл) добавляли полный шпатель RaNi и гидрировали в аппарате Парра в течение 14 ч. Раствор фильтровали для удаления катализатора, затем концентрировали при пониженном давлении. Остаток растворяли в смеси DMF-MeOH (1:1,15 мл), добавляли Pd(OH)2 (50 мг, 20%/С) и гидрировали в аппарате Парра в течение 12 ч. Раствор фильтровали и концентрировали при пониженном давлении. Продукт растирали со смесью Et2O-гексан и собирали, получаяIX-4. 1 Н ЯМР (CDC13,):2,95-3,0 (м, 4 Н), 4,20 (м, 1 Н), 4,4-4,5 (ушир., 6 Н), 7,21 (м, 1 Н), 7,28-7,46 (м, 4 Н),7,57 (д, 1 Н), 7,66 (д, 1 Н), 8,60 (с, 1 Н), 9,18 (д, 1 Н). Масс-спектр (ES+) m/e 369 (m + 1), 391 (m+ 23). Дополнительные соединения IV-12 - IV-44, IX-4, IX-5, X-5 и X-6 получали по методикам, совпадающим с примерами 1-22. Такие соединения, а также те, которые представлены в указанных выше примерах, могут дополнительно подразумеваться со ссылкой на табл. 1-4, присутствующим в иллюстративных целях, где каждая запись соответствует сопровождающей структуре. Применение. Изомерные конденсированные пирролокарбазолы и изоиндолоны по настоящему изобретению могут использоваться, помимо прочего, в качестве терапевтических агентов. В частности, соединения можно использовать для ингибирования киназы. Показано, что изомерные конденсированные пирролокарбазолы и изоиндолоны ингибируют, например, одну или несколько trk киназ, киназу рецептора фактора роста, полученного из тромбоцитов (PDGFR), киназы рецептора сосудистого эндотелиального фактора роста (VEGFR) или NGF-стимулированной trk фосфорилирования. Свойства соединений настоящего изобретения являются полезными для терапевтического регулирования. Активность конденсированных пирролокарбазолов и изоиндолонов по отношению к некоторым ферментам можно использовать для борьбы с вредными последствиями данных ферментов. В частности,ингибирование рецептора сосудистого эндотелиального фактора роста (VEGFR) предполагает примене- 23005920 ние, например, при заболеваниях, в которых важную роль играет ангиогенез, таких как рак солидных опухолей, эндометриоз, диабетическая ретинопатия, псориаз, гемангиобластома, а также при других глазных заболеваниях и видах рака. Ингибирование trk предполагает применение, например, при заболеваниях простаты, таких как рак простаты и доброкачественная гиперплазия простаты, и для лечения боли при воспалении. Ингибирование рецептора фактора роста, полученного из тромбоцитов (PDGFR), предполагает применение, например, при различных формах неоплазии, ревматоидном артрите, фиброзе легких, миелофиброзе, аномальном заживлении раны, заболеваниях, приводящих к сердечно-сосудистой недостаточности, таких как атеросклероз, рестеноз, рестеноз после ангиопластики и тому подобное. Показано также, что активность изомерных конденсированных пирролокарбазолов и изоиндолонов также обладает положительным действием на функционирование и выживание отвечающих на трофический фактор клеток за счет промотирования выживания нейронов. В отношении выживания холинергического нейрона, например, соединение может сохранять выживаемость холинергической нейронной популяции при риске гибели (например, гибель вследствие повреждения, болезненного состояния, дегенеративного состояния или природного развития) по сравнению с холинергической нейронной популяцией, где не присутствует такое соединение, в том случае, когда обработанная популяция имеет сравнительно больший период функционирования, чем необработанная популяция. Множество неврологических заболеваний характеризуется нейронными клетками, находящимися в состоянии гибели, повреждения, функционально подвергающимися риску, претерпевающими дегенерацию аксонов при риске гибели и т.д. Данные заболевания включают, но не ограничиваются ими, болезнь Альцгеймера, моторные нейронные заболевания (например, боковой амиотрофический склероз), болезнь Паркинсона, церебрососудистые заболевания (например, удар, ишемия), болезнь Хантингтона, слабоумие при СПИД, эпилепсию, рассеянный склероз, периферические заболевания нервной системы (например, повреждающие DRG нейроны при связанной с химиотерапией периферической невропатии),включая диабетическую невропатию, заболевания, индуцированные возбуждающими аминокислотами и заболевания, связанные с сотрясением или с проникающими повреждениями головного мозга или спинного мозга. Соединения не только полезны для усиления индуцированной трофическим фактором активности отвечающих на трофический фактор клеток, например холинергических нейронов, но также могут действовать как агенты, промотирующие выживание других типов нейронных клеток, например допаминергических или глутаматергических. Фактор роста может регулировать выживание нейронов при прямой последовательности сигнальных каскадов небольших ГТФ связанных белков ras, rас и cdc42 (DenhardtD.T., Biochem. J., 1996, 318, 729). Конкретно, активация ras приводит к фосфорилированию и активации межклеточной рецептор-активированной киназы (ERK), которая связана с биологическим ростом и процессами дифференцировки. Стимулирование rac/cdc42 приводит к увеличению активации JNK и р 38, ответным реакциям, которые связаны со стрессом, апоптозом и воспалением. Хотя ответные реакции фактора роста в первую очередь протекают путем ERK, воздействие на данные более поздние процессы может привести к альтернативному механизму выживания нейронов, который может имитировать свойства усиления выживания фактора роста (Xia et al., Science, 1995, 270, 1326). Соединения также могут функционировать как промотирующие выживание агенты для нейронных и ненейронных клеток за счет механизма, относящегося к,но также и отличающегося от него, опосредованного фактором роста выживания, например, ингибирование JNK и р 38 МАРК путей, которые могут вести к выживанию путем ингибирования процессов гибели клеток за счет апоптоза. Настоящие соединения также полезны при лечении заболеваний, связанных с пониженной ChAT активностью или смертью, повреждением моторных нейронов спинного мозга, и также могут применяться, например, при заболеваниях, связанных с апоптозной смертью клеток центральной и периферической нервной системы, иммунной системы и при воспалительных заболеваниях. ChAT катализирует синтез нейротрансмиттерного ацетилхолина и рассматривается в качестве ферментативного маркера для функциональных холинергических нейронов. Функциональный нейрон также способен к выживанию. Выживание нейронов анализируют путем количественной оценки специфического поглощения и ферментативного превращения красителя (например, кальцеина AM) живыми нейронами. Описанные здесь соединения также могут найти применение при лечении болезненных состояний, включающих пролиферацию злокачественных клеток, таких как многие виды рака. Вследствие их разнообразных полезных свойств отличительные особенности изомерных конденсированных пирролокарбазолов и изоиндолов можно применять в других видах деятельности, таких как научные исследования. Например, соединения можно применять для разработки моделей выживания,функционирования, идентификации нейронных клеток in vitro или для скрининга других синтетических соединений, обладающих активностью, подобной активности изомерных конденсированных пирролокарбазоловых и изоиндолоновых соединений. Таким образом, соединения, разработанные в данном изобретении, можно применять в качестве стандартных или ссылочных соединений для использования в тестах или анализах для определения активности агента при фармацевтических научноисследовательских программах.- 24005920 Соединения также можно применять для исследования, определения и установления молекулярных объектов (целей), связанных с функциональными ответными реакциями. Например, если изомерное конденсированное соединение пирролокарбазола или изоиндола, меченное радиоизотопной меткой, связанное с конкретной клеточной функцией (например, митогенезом), то целевой объект, с которым связывается производное, может быть идентифицирован, выделен и очищен для того, чтобы его охарактеризовать. В качестве дополнительной иллюстрации соединения можно применять для разработки анализов и моделей для дальнейшего расширения понимания роли, которую играет ингибирование серин/треонин или тирозинпротеинкиназы (например, РКС, trk тирозинкиназы) в механистических аспектах связанных заболеваний и болезненных состояний. Таким образом, соединения настоящего изобретения могут быть полезны в качестве диагностических реагентов в диагностических анализах, таких как анализы, приведенные в данном описании. Ингибирование ферментативной активности с помощью изомерных конденсированных соединений пирролокарбазола и изоиндолона по настоящему изобретению может быть определено с использованием, например, следующих анализов: 1. Анализ ингибирования киназы сосудистого эндотелиального фактора роста (VEGFR) 2. Анализ ингибирования активности trkA тирозинкиназы 3. Анализ ингибирования активности РКС и 4. Анализ ингибирования рецептора фактора роста, полученного из тромбоцитов. Далее следуют описания данных анализов, но полученные здесь результаты не рассматриваются,как ограничивающие объем раскрытия существа изобретения. Для удобства, для представления результатов использованы некоторые сокращения, которые определены в основном тексте. Другие сокращения определены следующим образом: мкг для микрограмма, мг для миллиграмма, г для грамма, мкл для микролитра, мл для миллилитра, л для литра, нМ для наномолярной концентрации, мкМ для микромолярной, мМ для миллимолярной, М для молярной и нм для нанометра, БСК для бензолсульфоновой кислоты, АТФ для аденозинтрифосфата и ЭДТК для 1,2-ди(2-аминоэтокси)этанN,N,N'N'-тетрауксусной кислоты. Ингибирование активности trkA тирозинкиназы Выбранные изомерные конденсированные соединения пирролокарбазола и изоиндолона исследовали на способность ингибировать активность киназы trkA цитоплазматического домена человека, экспрессированного бакуловирусом, с использованием анализа, основанного на ELISA, как описано ранее(Angeles et al., Anal.Biochem. 236: 49-55, 1996). Кратко, 96-луночный микротитровочный планшет покрывали раствором субстрата (белок слияния рекомбинантная фосфолипаза человека C-l/глутатион Sтрансфераза (Rotin et al., EMBO J. , 11:559-567, 1992). Исследования ингибирования проводили в 100 мкл смесях для анализа, содержащих 50 мМ Hepes, рН 7,4, 40 мкМ АТФ, 10 мМ МnС 12, 0,1% БСК, 2% ДМСО и различные концентрации ингибитора. Реакцию инициировали добавлением trkA киназы и оставляли протекать в течение 15 мин при 37 С. Затем добавляли антитело к фосфотирозину (UBI) с последующим добавлением вторичного фермент-конъюгированного антитела, щелочная фосфатаза-меченый козий анти-мышиный IgG (Bio-Rad). Активность связанного фермента измеряли посредством амплифицированной детекторной системы (Gibco-BRL). Данные ингибирования анализировали с использованием сигмоидального уравнения доза-ответ (переменный угол наклона) в GraphPad Prism. Концентрация, которая приводила к 50%-ному ингибированию активности киназы, указывается как "IC50". Результаты суммированы в табл. 5.- 25005920 Таблица 5 Ингибирующее действие изомерных конденсированных пирролокарбазолов и изоиндолонов на активность trkA киназы Ингибирование активности киназы рецептора сосудистого эндотелиального фактора роста Изомерные конденсированные соединения пирролокарбазола и изоиндолона исследовали на ингибирующее действие в отношении активности киназы экспрессированного бакуловирусом домена VEGF рецепторной киназы (flk-1 человека, KDR, VEGFR2) с использованием способа, описанного ELISA анализа для trkA киназы, раскрытого выше. Реакционную смесь киназы, состоящую из 50 мМ Hepes, pH 7,4,40 мкМ АТФ, 10 мМ МnСl2, 0,1% БСК, 2% ДМСО и различных концентраций ингибитора, переносили на PLC-/GST покрытые планшеты. Добавляли VEGFR киназу и реакцию оставляли протекать в течение 15 мин при 37 С. Обнаружение фосфорилированного продукта осуществляли путем добавления антифосфотирозинового антитела (UBI). Вторичное фермент-конъюгированное антитело добавляли для за хвата комплекса антитело-фосфорилированный PLC-/GST. Активность связанного фермента измеряли с помощью амплифицированной детекторной системы (Gibco-BRL). Данные ингибирования анализировали с использованием сигмоидального уравнения доза-ответ (переменный угол наклона) в GraphPad Prism. Результаты суммированы в табл. 6.- 26005920 Таблица 6 Ингибирующее действие изомерных конденсированных пирролокарбазолов и изоиндолонов на активность киназы VEGF рецептора Ингибирование активности киназы рецептора фактора роста, полученного из тромбоцитов Изомерные конденсированные соединения пирролокарбазола и изоиндолона исследовали на их ингибирующее действие в отношении активности киназы экспрессированного бакуловирусом PDGF рецепторного киназного домена с использованием ELISA анализа для trkA киназы, описанного выше. Анализы проводили на покрытых субстратом PLC-/GST 96-луночных микротитровочных планшетах. Каждая 100 мкл реакционная смесь содержала 50 мМ Hepes, рН 7,4, 20 мкМ АТФ, 10 мМ МnСl2, 0,1% БСК,2% ДМСО и различные концентрации ингибитора. Реакцию инициировали добавлением предварительно фосфорилированного рекомбинантного фермента человека (10 нг/мл PDGFR) и оставляли протекать в течение 15 мин при 37 С. Предварительно фосфорилированный фермент получали перед применением путем инкубирования киназы в буфере, содержащем 20 мкМ АТФ и 10 мМ МnСl2 в течение 1 ч при 4 С. Обнаружение фосфорилированного продукта проводили, добавляя конъюгированное с пероксидазой хрена (HRP) антифосфотирозиновое антитело (UBI). Позднее добавляли раствор HRP субстрата, содержащий 3,3'-5,5'-тетраметилбензидин и перекись водорода, и планшеты инкубировали в течение 10 мин при комнатной температуре. Реакцию гасили кислотой и полученное поглощение считывали при 450 нм с использованием микропланшетного ридера Bio-kinetics (Bio-Tek Instrument EL 312e). Данные ингибирования анализировали с использованием сигмоидального уравнения доза-ответ (переменный угол наклона) в GraphPad Prism. Результаты суммированы в табл. 7.PDGFR ингибирующее действие изомерных конденсированных пирролокарбазолов и изоиндолонов Дозировка и состав Для терапевтических целей соединения по настоящему изобретению можно вводить любым способом, который приводит к контакту активного агента с местом действия агента в организме млекопитающего. Соединения можно вводить с помощью любых общепринятых средств, доступных для применения совместно с фармацевтическими препаратами, либо в качестве индивидуальных терапевтических агентов, либо в виде комбинации терапевтических агентов. Предпочтительно их вводят в виде единственного активного агента в фармацевтической композиции, но альтернативно их можно использовать в комбинации с другими активными ингредиентами, например другими факторами роста, которые облегчают выживание нейронов или регенерацию аксонов при заболеваниях или нарушениях. Соединения предпочтительно объединяют с фармацевтическим носителем на основе выбранного пути введения и обычной фармацевтической практикой. Соединения могут быть введены в состав фармацевтических композиций, например, путем смешивания с фармацевтически приемлемыми нетоксичными эксципиентами и носителями. Такие композиции могут быть получены для применения путем парентерального введения, в частности, в форме жидких растворов или суспензий, или перорального введения, в частности, в форме таблеток или капсул, или внутриназально, в частности, в форме порошков, капель для носа или аэрозолей, или через кожу посредством, например, чрескожных пластырей. Композицию можно удобным образом вводить в виде единичной дозировочной формы и ее можно получать любыми способами, хорошо известными в области фармацевтики, например, как описано вRemington's Pharmaceutical Sciences (MarkPub.Co., Easton, PA, 1980). Составы для парентерального введения могут содержать в качестве обычных эксципиентов стерильную воду или физиологический раствор, полиалкиленгликоли, такие как полиэтиленгликоль, масла и масла растительного присхождения,гидрированные нафталины и тому подобное. В частности, биосовместимый, биоразрушаемый лактидный полимер, лактид/ гликолидный сополимер или сополимеры полиоксиэтилена и полиоксипропилена могут представлять собой полезные эксципиенты для контроля высвобождения активных соединений. Другие потенциально полезные парентеральные системы доставки для данных активных соединений включают частицы сополимера этилена и винилацетата, осмотические насосы, имплантируемые инфузионные системы и липосомы. Составы для ингаляционного введения содержат в качестве эксципиентов, например, лактозу или могут представлять собой водные растворы, содержащие, например, полиоксиэтилен-9-лауриловый простой эфир, гликохолат и деоксихолат, или масляные растворы для введения в виде капель для носа или в виде геля для внутриназального нанесения. Составы для парентерального введения могут также включать гликохолат для буккального введения, салицилат для ректального введения или лимонную кислоту для вагинального введения. Составы для чрескожных пластырей предпочтительно представляют собой липофильные эмульсии. Соединения формулы I и их фармацевтически приемлемые соли можно вводить перорально или неперорально, например в виде мази или инъекции. Концентрации соединений данного изобретения в те- 29005920 рапевтической композиции могут изменяться. Концентрация будет зависеть от факторов, таких как общая доза лекарственного средства, которая должна быть введена, химические характеристики (например,гидрофобности) используемого соединения, пути введения, возраст, вес тела и симптомы пациента и т.д. Соединения данного изобретения можно получать в виде водного физиологического буферного раствора, содержащего примерно от 0,1 до 10% вес.об. соединения для парентерального введения. Типичные интервалы дозировки колеблются от примерно 1 мг/кг до примерно 1 мкг/кг веса тела в день, предпочтительный диапазон дозировки составляет от примерно 0,01 до 100 мг/кг веса тела в день и предпочтительно примерно от 0,1 до 20 мг/кг от одного до четырех раз в день. Предпочтительная дозировка лекарственного средства для введения подходящим образом зависит от таких переменных, как тип и степень развития заболевания или нарушения, общее состояние здоровья конкретного пациента, относительная биологическая эффективность выбранного соединения, состав эксципиентов и путь введения. Фармацевтические композиции согласно настоящему изобретению могут быть получены однородным смешиванием эффективного количества соединения формулы I или его фармацевтически приемлемой соли в качестве активного ингредиента с фармацевтически приемлемым носителем. Носитель может принимать широкий диапазон форм в соответствии с формами композиции, подходящими для введения. Желательно, чтобы такие фармацевтически композиции получали в виде единичной дозировочной формы, подходящей для перорального или неперорального введения. Формы для неперорального введения включают мазь и инъекцию. Таблетки могут быть получены с использованием эксципиентов, таких как лактоза, глюкоза, сахароза, маннит и метилцеллюлоза, дезинтегрирующих агентов, таких как крахмал, альгинат натрия, карбоксиметилцеллюлоза кальция и кристаллическая целлюлоза, смазочных веществ, таких как стеарат магния и тальк, связующих веществ, таких как желатин, поливиниловый спирт, поливинилпирролидон,гидроксипропил-целлюлоза и метилцеллюлоза, поверхностно-активных веществ, таких как сложные эфиры сахарозы и жирных кислот и сложные эфиры сорбита и жирных кислот, и тому подобное обычным образом. Предпочтительно, чтобы каждая таблетка содержала 15-300 мг активного ингредиента. Гранулы могут быть получены с использованием эксципиентов, таких как лактоза и сахароза, дезинтегрирующих агентов, таких как крахмал, связующих веществ, таких как желатин, и тому подобное обычным образом. Порошки могут быть получены с использованием эксципиентов, таких как лактоза и маннит и тому подобное обычным образом. Капсулы могут быть получены с использованием желатина,воды, сахарозы, аравийской камеди, сорбита, глицерина, кристаллической целлюлозы, стеарата магния,талька и тому подобное обычным образом. Предпочтительно, чтобы каждая капсула содержала 15-300 мг активного ингредиента. Составы сиропов можно получать с использованием сахаров, таких как сахароза, воды, этанола и тому подобное обычным образом. Мазь может быть получена с использованием основы для мазей, такой как вазелин, жидкий парафин, ланолин и макроголь, эмульгаторов, таких как лауриллактат натрия, хлорид бензалькония, моносорбитановые сложные эфиры жирных кислот, натрийкарбоксиметилцеллюлоза и аравийская камедь, и тому подобное обычным образом. Препараты для инъекций могут быть получены с использованием растворителей, таких как вода,физиологический раствор, растительные масла (например, оливковое масло и арахисовое масло), этилолеат и пропиленгликоль, солюбилизирующих агентов, таких как бензоат натрия, салицилат натрия и уретан, изотонических агентов, таких как хлорид натрия и глюкоза, консервантов, таких как фенол, крезол,п-гидроксибензойный сложный эфир и хлорбутанол, антиоксидантов, таких как аскорбиновая кислота и пиросульфит натрия, и тому подобное обычным образом. Специалистам в данной области будет очевидно, что возможны многочисленные модификации и вариации настоящего изобретения в свете указанного выше. Таким образом, следует понимать, что в объеме прилагаемой формулы изобретения данное изобретение может быть практически осуществлено иначе, чем конкретно изложено в данном описании, и предполагается, что объем изобретения охватывает все такие вариации. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы II или его стереоизомер или фармацевтически приемлемая соль, где
МПК / Метки
МПК: C07D 487/04, A61K 31/407, A61P 13/08, C07D 471/14, C07D 491/14, C07D 495/14
Метки: конденсированные, изомерные, изоиндолоны, пирролокарбазолы
Код ссылки
<a href="https://eas.patents.su/30-5920-izomernye-kondensirovannye-pirrolokarbazoly-i-izoindolony.html" rel="bookmark" title="База патентов Евразийского Союза">Изомерные конденсированные пирролокарбазолы и изоиндолоны</a>
Предыдущий патент: Способ антивич/спид экспресс-терапии и устройство для его осуществления (“марс-3″)
Следующий патент: Ген и белок, ассоциированные с шизофренией
Случайный патент: Способ получения металлургического кокса












