Птеридиноны в качестве ингибиторов киназ
Номер патента: 5287
Опубликовано: 30.12.2004
Авторы: Добрусин Эллен Майра, Денни Уильям Эликзэндер, Крамер Джеймс Бернард, Шоуолтер Хауард Дэниэл Холлис, Рукасл Гордон Уильям, Тугуд Питер Лоренс, Мак Намара Деннис Джозеф
Формула / Реферат
1. Соединение формулы
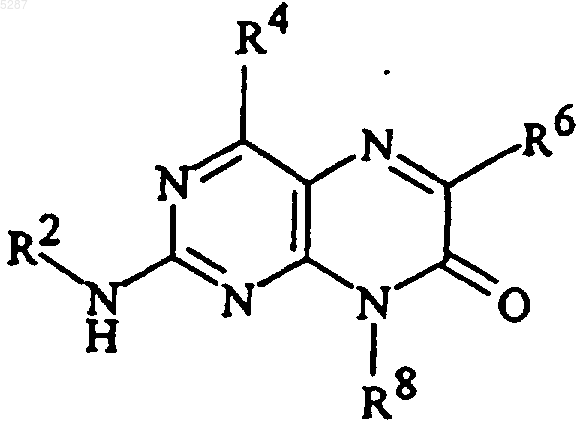
и его фармацевтически приемлемые соли, эфиры, амиды и пролекарства, где
R2 представляет собой (CH2)nарил и (CH2)nгетероарил, где каждая из вышеупомянутых арильных и гетероарильных групп может быть не замещена или замещена 1-5 группами-заместителями, выбранными из
(а) галогена;
(б) амино, алкиламино и диалкиламино;
(в) C1-C10алкокси, аминоалкокси, алкиламиноалкокси и диалкиламиноалкокси;
(г) гидрокси;
(д) алканоила, аминоалканоила, алкиламиноалканоила и диалкиламиноалканоила;
(е) аминокарбонила, алкиламинокарбонила и диалкиламинокарбонила;
(ж) амино-C3-C7циклоалкилкарбонила, алкиламино-C3-C7циклоалкилкарбонила и диалкиламино-C3-C7циклоалкилкарбонила;
(з) COZ, CO2Z, SOZ, SO2Z и PO3Z, где Z представляет собой водород, гидрокси, C1-C10алкокси, C1-C10алкил, амино, алкиламино, диалкиламино, пиперидинил, морфолинил, пиперазинил;
(и) карбоциклической группы, содержащей от 3 до 7 кольцевых членов, один или два из которых могут представлять собой гетероатом, выбранный из O или N, и причем эта карбоциклическая группа может быть замещена 1, 2 или 3 группами-заместителями, выбранными из
(1) галогена,
(2) гидрокси,
(3) C1-C10алкила, аминоалкила, алкил- и диалкиламиноалкила,
(4) C1-C10алкокси,
(5) амино, алкиламино, диалкиламино, алканоиламино,
(6) COZ, CO2Z, SOZ, SO2Z или PO3Z,
(7) (CH2)nморфолино,
(8) (CH2)nпиперазинила,
(9) (CH2)nпиперидинила;
R4 и R6 являются
(а) одинаковыми или разными и независимо представляют собой водород, C1-C10алкил, C1-C10алкокси, амино, аминоалкокси, гидрокси, моно- или диалкиламино, моно- или диалкиламиноалкокси;
(б) одинаковыми или разными и независимо представляют собой (CH2)nарил или (CH2)nгетероарил, где каждый арил и гетероарил не замещен или замещен группами в количестве вплоть до 5, выбранными из галогена, гидрокси, C1-C10алкила, C1-C10алкокси, амино, моно- или диалкиламино;
R8 представляет собой C1-C10алкил или (CH2)nкарбоциклическую группу, содержащую от 3 до 7 членов;
n представляет собой 0;
и где алкильная составляющая в указанных радикалах содержит от 1 до 10 углеродных атомов;
арил означает ароматическую карбоциклическую группу, имеющую единственное кольцо, множественные кольца или множественные конденсированные кольца, из которых по меньшей мере одно является ароматическим;
гетероарил означает одну или более чем одну ароматическую кольцевую систему из 5, 6 или 7 членов, содержащую по меньшей мере 1 и вплоть до 4 гетероатомов, выбранных из азота, кислорода или серы;
карбоциклическая группа означает неароматическое циклическое кольцо или конденсированные кольца, имеющие от 3 до 7 кольцевых углеродных членов.
2. Соединение формулы
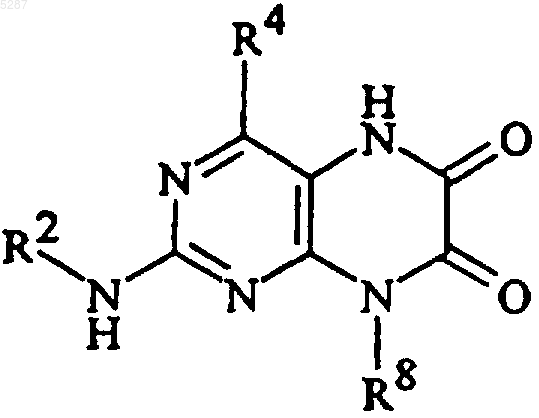
и его фармацевтически приемлемые соли, эфиры, амиды и пролекарства, где
R2 представляет собой (CH2)nарил и (CH2)nгетероарил, где каждая из вышеупомянутых арильных и гетероарильных групп может быть не замещена или замещена 1-5 группами-заместителями, выбранными из
(а) галогена;
(б) амино, алкиламино и диалкиламино;
(в) C1-C10алкокси, аминоалкокси, алкиламиноалкокси и диалкиламиноалкокси;
(г) гидрокси;
(д) алканоила, аминоалканоила, алкиламиноалканоила и диалкиламиноалканоила;
(е) аминокарбонила, алкиламинокарбонила и диалкиламинокарбонила;
(ж) амино-C3-C7циклоалкилкарбонила, алкиламино-C3-C7циклоалкилкарбонила и диалкиламино-C3-C7циклоалкилкарбонила;
(з) COZ, CO2Z, SOZ, SO2Z и PO3Z, где Z представляет собой водород, гидрокси, C1-C10алкокси, C1-C10алкил, амино, алкиламино, диалкиламино, пиперидинил, морфолинил, пиперазинил;
(и) карбоциклической группы, содержащей от 3 до 7 кольцевых членов, один или два из которых могут представлять собой гетероатом, выбранный из O или N, и причем эта карбоциклическая группа может быть замещена 1, 2 или 3 группами-заместителями, выбранными из
(1) галогена,
(2) гидрокси,
(3) C1-C10алкила, аминоалкила, алкил- и диалкиламиноалкила,
(4) C1-C10алкокси,
(5) амино, алкиламино, диалкиламино, алканоиламино,
(6) COZ, CO2Z, SOZ, SO2Z или PO3Z,
(7) (CH2)nморфолино,
(8) (CH2)nпиперазинила,
(9) (CH2)nпиперидинила;
R4 представляет собой
(а) водород, C1-C10алкил, C1-C10алкокси, амино, аминоалкокси, гидрокси, моно- или диалкиламино, моно- или диалкиламиноалкокси;
(б) (CH2)nарил или (CH2)nгетероарил, где каждый арил и гетероарил не замещен или замещен группами в количестве вплоть до 5, выбранными из галогена, гидрокси, C1-C10алкила, C1-C10алкокси, амино, моно- или диалкиламино;
R8 представляет собой C1-C10алкил или (CH2)nкарбоциклическую группу, содержащую от 3 до 7 членов,
n представляет собой 0;
и где алкильная составляющая во всех указанных радикалах содержит от 1 до 10 углеродных атомов;
арил означает ароматическую карбоциклическую группу, имеющую единственное кольцо, множественные кольца или множественные конденсированные кольца, из которых по меньшей мере одно является ароматическим;
гетероарил означает одну или более чем одну ароматическую кольцевую систему из 5, 6 или 7 членов, содержащую по меньшей мере 1 и вплоть до 4 гетероатомов, выбранных из азота, кислорода или серы;
карбоциклическая группа означает неароматическое циклическое кольцо или конденсированные кольца, имеющие от 3 до 7 кольцевых углеродных членов.
3. Соединение формулы
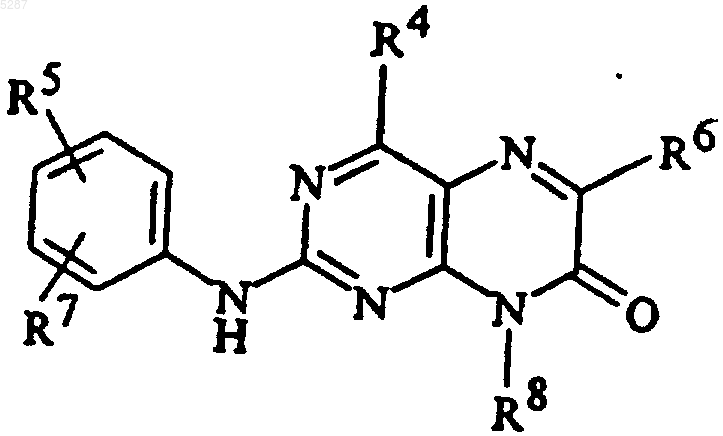
и его фармацевтически приемлемые соли, эфиры, амиды и пролекарства, где R5 и R7 являются одинаковыми или разными и выбраны из
(а) водорода, галогена, амино, аминоалкокси, C1-C10алкокси, гидрокси, моно- или диалкиламино, моно- или диалкиламиноалкокси, аминокарбонила, амино-C3-C7циклоалкилкарбонила и N-моно- или N,N-диалкиламинокарбонила;
(б) CO2Z, COZ, SOZ, SO2Z или PO3Z, где Z представляет собой H, C1-C10алкил, гидрокси, C1-C10алкокси, амино, моно- или диалкиламино, пиперидинил, морфолинил или пиперазинил;
(в) карбоциклической группы, содержащей от 3 до 7 членов, из которых до двух членов представляют собой гетероатомы, выбранные из кислорода и азота, причем эта карбоциклическая группа не замещена или замещена 1, 2 или 3 группами, независимо выбранными из группы, состоящей из галогена, гидрокси, C1-C10алкила, C1-C10алкокси, амино, моно- или диалкиламино, карбоновой кислоты, карбоксамида, эфира карбоновой кислоты, морфолино, пиперазинила, пиперидинила, аминоалкила и алканоиламино;
R4 и R6 являются
(а) одинаковыьш или разными и независимо представляют собой водород, C1-C10алкил, C1-C10алкокси, амино, аминоалкокси, гидрокси, моно- или диалкиламино, моно- или диалкиламиноалкокси;
(б) одинаковыми или разными и независимо представляют собой (CH2)nарил или (CH2)nгетероарил, где каждый арил и гетероарил не замещен или замещен группами в количестве вплоть до 5, выбранными из галогена, гидрокси, C1-C10алкила, C1-C10алкокси, амино, моно- или диалкиламино;
R8 представляет собой C1-C10алкил или (CH2)nкарбоциклическую группу, содержащую от 3 до 7 членов;
n представляет собой 0;
и где алкильная составляющая во всех указанных радикалах содержит от 1 до 10 углеродных атомов;
арил означает ароматическую карбоциклическую группу, имеющую единственное кольцо, множественные кольца или множественные конденсированные кольца, из которых по меньшей мере одно является ароматическим;
гетероарил означает одну или более чем одну ароматическую кольцевую систему из 5, 6 или 7 членов, содержащую по меньшей мере 1 и вплоть до 4 гетероатомов, выбранных из азота, кислорода или серы;
карбоциклическая группа означает неароматическое циклическое кольцо или конденсированные кольца, имеющие от 3 до 7 кольцевых углеродных членов.
4. Соединение формулы
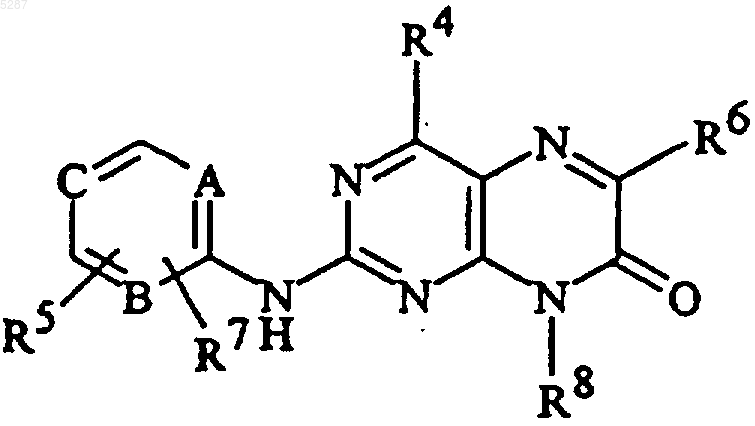
и его фармацевтически приемлемые соли, эфиры, амиды и пролекарства, где A, B и C являются одинаковыми или разными и представляют собой N или CH при условии, что по меньшей мере один из A, B или C представляет собой CH;
R5 и R7 являются являются одинаковыми или разными и выбраны из
(а) водорода, галогена, амино, аминоалкокси, C1-C10алкокси, гидрокси, моно- или диалкиламино, моно- или диалкиламиноалкокси, карбамоила, амино-C3-C7циклоалкилкарбонила и N-моно- или N,N-диалкилкарбамоила;
(б) CO2Z, COZ, SOZ, SO2Z или PO3Z, где Z представляет собой H, C1-C10алкил, гидрокси, C1-C10алкокси, амино, моно- или диалкиламино, пиперидинил, морфолинил или пиперазинил;
(в) карбоциклической группы, содержащей от 3 до 7 членов, из которых до двух членов представляют собой гетероатомы, выбранные из кислорода и азота, причем эта карбоциклическая группа не замещена или замещена 1, 2 или 3 группами, независимо выбранными из группы, состоящей из галогена, гидрокси, C1-C10алкила, C1-C10алкокси, амино, моно- или диалкиламино, морфолино, пиперазинила, пиперидинила и аминоалкила;
R4 и R6 являются
(а) одинаковыми или разными и независимо представляют собой водород, C1-C10алкил, C1-C10алкокси, амино, аминоалкокси, гидрокси, моно- или диалкиламино, моно- или диалкиламиноалкокси;
(б) одинаковыми или разными и независимо представляют собой (CH2)nарил или (CH2)nгетероарил, где каждый арил и гетероарил не замещен или замещен группами, в количестве вплоть до 5, выбранными из галогена, гидрокси, C1-C10алкила, C1-C10алкокси, амино, моно- или диалкиламино;
R8 представляет собой C1-C10алкил или (CH2)nкарбоциклическую группу, содержащую от 3 до 7 членов;
n представляет собой 0;
и где алкильная составляющая во всех указанных радикалах содержит от 1 до 10 углеродных атомов;
арил означает ароматическую карбоциклическую группу, имеющую единственное кольцо, множественные кольца или множественные конденсированные кольца, из которых по меньшей мере одно является ароматическим;
гетероарил означает одну или более чем одну ароматическую кольцевую систему из 5, 6 или 7 членов, содержащую по меньшей мере 1 и вплоть до 4 гетероатомов, выбранных из азота, кислорода или серы;
карбоциклическая группа означает неароматическое циклическое кольцо или конденсированные кольца, имеющие от 3 до 7 кольцевых углеродных членов.
5. Соединение формулы
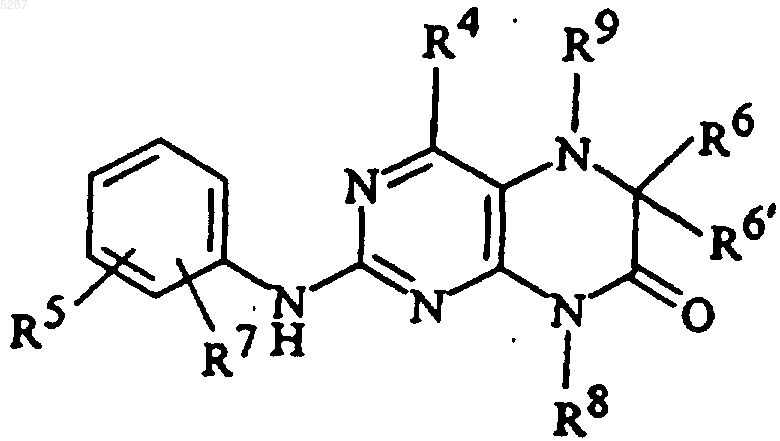
и его фармацевтически приемлемые соли, эфиры, амиды и пролекарства, где R5 и R7 являются одинаковыми или разными и выбраны из
(а) водорода, галогена, амино, аминоалкокси, C1-C10алкокси, гидрокси, моно- или диалкиламино, моно- или диалкиламиноалкокси, карбамоила, амино-C3-C7циклоалкилкарбонила и N-моно- или N,N-диалкилкарбамоила;
(б) CO2Z, COZ, SOZ, SO2Z или PO3Z, где Z представляет собой водород, C1-C10алкил, гидрокси, C1-C10алкокси, амино, моно- или диалкиламино, пиперидинил, морфолинил или пиперазинил;
(в) карбоциклической группы, содержащей от 3 до 7 членов, из которых до двух членов представляют собой гетероатомы, выбранные из кислорода и азота, причем эта карбоциклическая группа не замещена или замещена 1, 2 или 3 группами, независимо выбранными из группы, состоящей из галогена, гидрокси, C1-C10алкила, C1-C10алкокси, амино, моно- или диалкиламино, морфолино, пиперазинила, пиперидинила, аминоалкила и алканоиламино;
R4, R6, R6' и R9 являются
(а) одинаковыми или разными и независимо представляют собой водород, C1-C10алкил, C1-C10алкокси, амино, аминоалкокси, гидрокси, моно- или диалкиламино, моно- или диалкиламиноалкокси;
(б) одинаковыми или разными и независимо представляют собой (CH2)nарил или (CH2)nгетероарил, где каждый арил и гетероарил не замещен или замещен группами, в количестве вплоть до 5, выбранными из галогена, гидрокси, C1-C10алкила, C1-C10алкокси, амино, моно- или диалкиламино;
R8 представляет собой C1-C10алкил или (CH2)nкарбоциклическую группу, содержащую от 3 до 7 членов;
n представляет собой 0;
и где алкильная составляющая во всех указанных радикалах содержит от 1 до 10 углеродных атомов;
арил означает ароматическую карбоциклическую группу, имеющую единственное кольцо, множественные кольца или множественные конденсированные кольца, из которых по меньшей мере одно является ароматическим;
гетероарил означает одну или более чем одну ароматическую кольцевую систему из 5, 6 или 7 членов, содержащую по меньшей мере 1 и вплоть до 4 гетероатомов, выбранных из азота, кислорода или серы;
карбоциклическая группа означает неароматическое циклическое кольцо или конденсированные кольца, имеющие от 3 до 7 кольцевых углеродных членов.
6. Соединение формулы
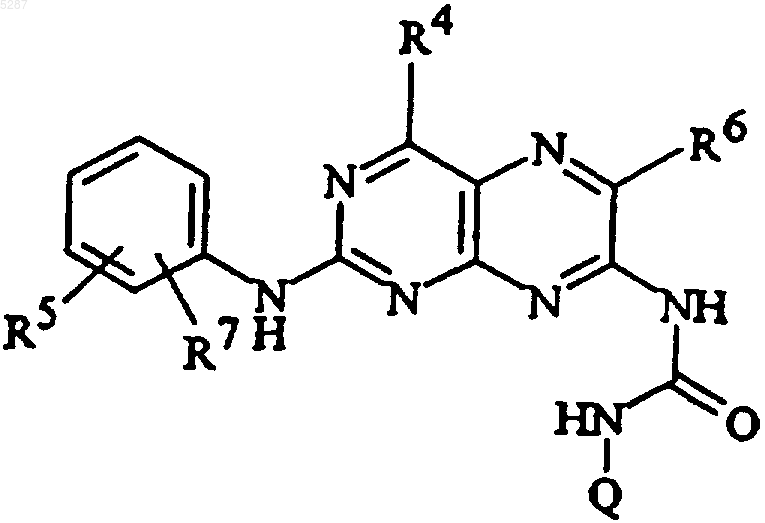
и его фармацевтически приемлемые соли, эфиры, амиды и пролекарства, где R5 и R7 являются одинаковыми или разными и выбраны из
(а) водорода, галогена, амино, аминоалкокси, C1-C10алкокси, гидрокси, моно- или диалкиламино, моно- или диалкиламиноалкокси, карбамоила, амино-C3-C7циклоалкилкарбонила и N-моно- или N,N-диалкилкарбамоила;
(б) CO2Z, COZ, SOZ, SO2Z или PO3Z, где Z представляет собой водород, C1-C10алкил, амино, моно- или диалкиламино, пиперидинил, морфолинил или пиперазинил;
(в) карбоциклической группы, содержащей от 3 до 7 членов, из которых до двух членов представляют собой гетероатомы, выбранные из кислорода и азота, причем эта карбоциклическая группа не замещена или замещена 1, 2 или 3 группами, независимо выбранными из группы, состоящей из галогена, гидрокёш, C1-C10алкила, C1-C10алкокси, амино, моно- или диалкиламино, морфолино, пиперазинила, пиперидинила, аминоалкила и алканоиламино;
R4 и R6 являются
(а) одинаковыми или разными и независимо представляют собой водород, C1-C10алкил, C1-C10алкокси, амино, аминоалкокси, гидрокси, моно- или диалкиламино, моно- или диалкиламиноалкокси;
(б) одинаковыми или разными и независимо представляют собой (CH2)nарил или (CH2)nгетероарил, где каждый арил и гетероарил не замещен или замещен группами, в количестве вплоть до 5, выбранными из галогена, гидрокси, C1-C10алкила, C1-C10алкокси, амино, моно- или диалкиламино;
Q представляет собой водород, C1-C10алкил;
n представляет собой 0;
и где алкильная составляющая во всех указанных радикалах содержит от 1 до 10 углеродных атомов;
арил означает ароматическую карбоциклическую группу, имеющую единственное кольцо, множественные кольца или множественные конденсированные кольца, из которых по меньшей мере одно является ароматическим;
гетероарил означает одну или более чем одну ароматическую кольцевую систему из 5, 6 или 7 членов, содержащую по меньшей мере 1 и вплоть до 4 гетероатомов, выбранных из азота, кислорода или серы;
карбоциклическая группа означает неароматическое циклическое кольцо или конденсированные кольца, имеющие от 3 до 7 кольцевых углеродных членов.
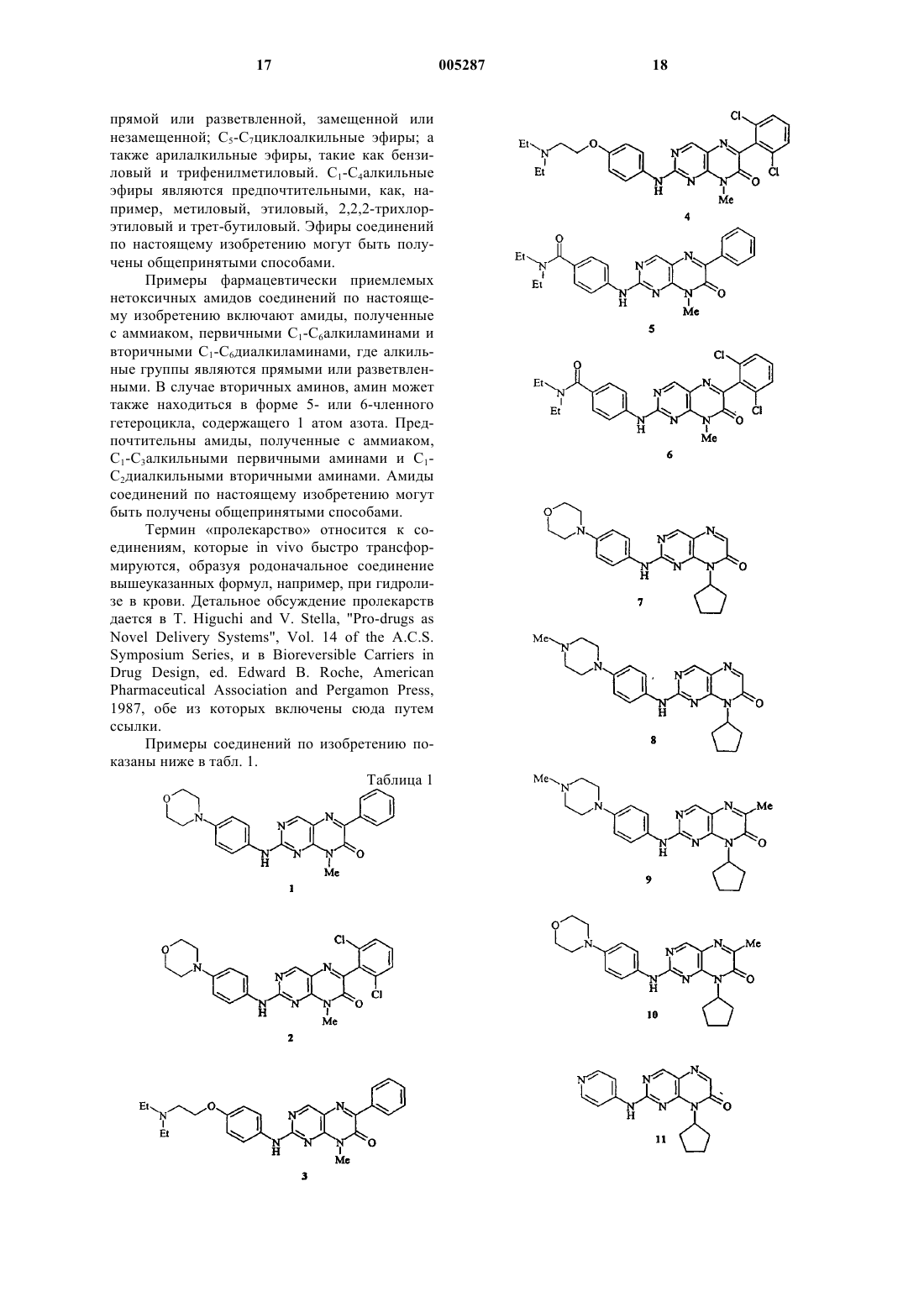
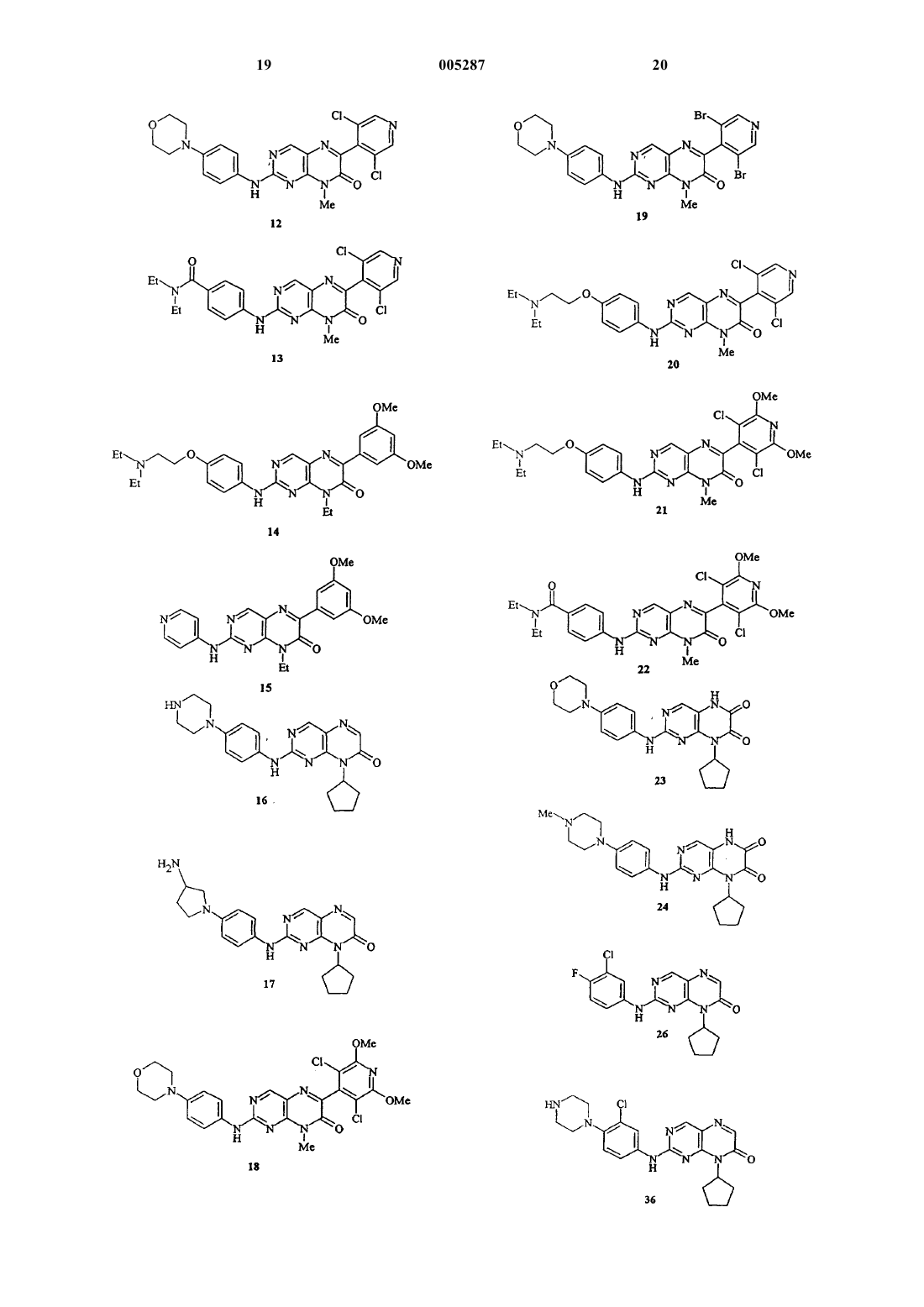
7. Соединение, которое выбрано из
8-метил-2-[[4-(морфолин-4-ил)фенил]амино]-6-фенил-8H-птеридин-7-она;
6-(2,6-дихлорфенил)-8-метил-2-[[4-(морфолин-4-ил)фенил]амино]-8H-птеридин-7-она;
6-(3,5-дихлорпиридин-4-ил)-8-метил-2-[[4-(морфолин-4-ил)фенил]амино]-8H-птеридин-7-она;
6-(3,5-дихлор-2,6-диметоксипиридин-4-ил)-8-метил-2-[[4-(морфолин-4-ил)фенил]амино]-8H-птеридин-7-она;
6-(3,5-дибромпиридин-4-ил)-8-метил-2-[[4-(морфолин-4-ил)фенил]амино]-8H-птеридин-7-она;
2-[[4-[2-(диэтиламино)этокси]фенил]амино]-8-метил-6-фенил-8H-птеридин-7-она;
6-(2,6-дихлорфенил)-2-[[4-[2-(диэтиламино)этокси]фенил]амино]-8-метил-8H-птеридин-7-она;
6-(3,5-дихлорпиридин-4-ил)-8-метил-2-[[4-[2-(диэтиламино)этокси]фенил]амино]-8H-птеридин-7-она;
6-(3,5-дихлор-2,6-диметоксипиридин-4-ил)-8-метил-2-[[4-[2-(диэтиламино)этокси]фенил]амино]-8H-птеридин-7-она;
2-[[4-(диэтиламинокарбонил)фенил]амино]-8-метил-6-фенил-8H-птеридин-7-она;
6-(2,6-дихлорфенил)-2-[[4-(диэтиламинокарбонил)фенил]амино]-8-метил-8H-птеридин-7-она;
6-(3,5-дихлорпиридин-4-ил)-2-[[4-(диэтиламинокарбонил)фенил]амино]-8-метил-8H-птеридин-7-она;
6-(3,5-дихлор-2,6-диметоксипиридин-4-ил)-2-[[4-(диэтиламинокарбонил)фенил]амино]-8-метил-8H-птеридин-7-она;
8-циклопентил-2-[[4-(морфолин-4-ил)фенил]амино]-8H-птеридин-7-она;
8-циклопентил-6-метил-2-[[4-(морфолин-4-ил)фенил]амино]-8H-птеридин-7-она;
8-циклопентил-2-[[4-(4-метилпиперазин-1-ил)фенил]амино]-8H-птеридин-7-она;
8-циклопентил-6-метил-2-[[4-(4-метилпиперазин-1-ил)фенил]амино]-8H-птеридин-7-она;
8-циклопентил-2-[(пиридин-4-ил)амино]-8H-птеридин-7-она;
2-[[4-(3-аминопирролидин-1-ил)фенил]амино]-8-циклопентил-8H-птеридин-7-она;
8-циклопентил-2-[[4-(пиперазин-1-ил)фенил]амино]-8H-птеридин-7-она;
6-(3,5-диметоксифенил)-8-этил-2-[(пиридин-4-ил)амино]-8H-птеридин-7-она;
6-(3,5-диметоксифенил)-8-этил-2-[[4-[2-(диэтиламино)этокси]фенил]амино]-8H-птеридин-7-она;
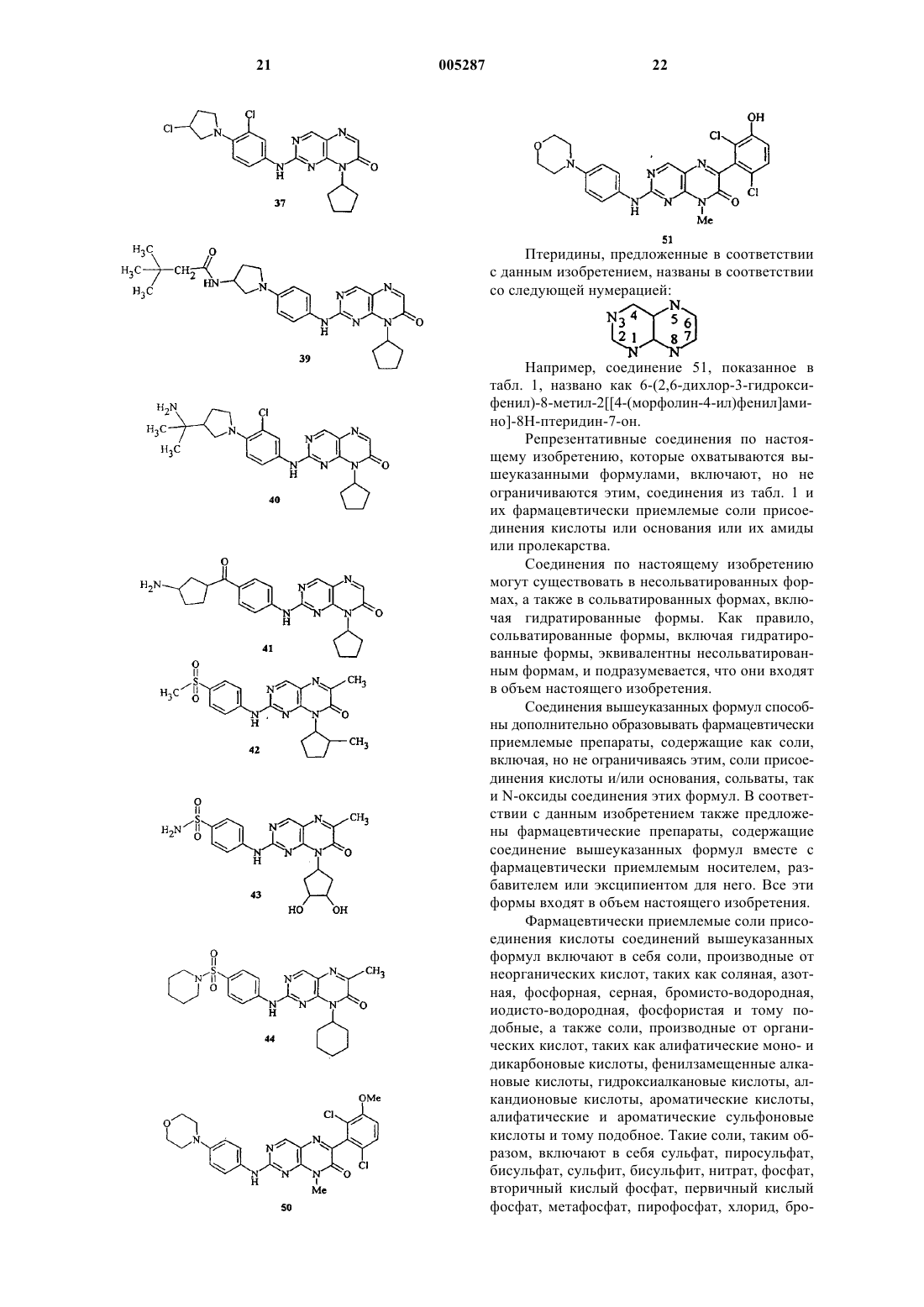
2-[[4-[4-(трет-бутоксикарбонил)пиперазин-1-ил]фенил]амино]-8-циклопентил-8H-птеридин-7-она;
2-[[4-[3-(трет-бутоксикарбониламино)пирролидин-1-ил]фенил]амино]-8-циклопентил-8H-птеридин-7-она;
8-циклопентил-2-(4-фтор-3-метилфениламино)-8H-птеридин-7-она;
2-(3-хлор-4-фторфениламино)-8-циклопентил-8H-птеридин-7-она;
8-циклогексил-2-(4-фтор-3-метилфениламино)-8H-птеридин-7-она.
8. Соединение, которое выбрано из
8-циклопентил-2-[[4-(морфолин-4-ил)фенил]амино]-5H,8H-птеридин-6,7-диона;
8-циклопентил-2-[[4-(4-метилпиперазин-1-ил)фенил]амино]-5H,8H-птеридин-6,7-диона.
9. Фармацевтический препарат, содержащий соединение по п.1 в комбинации с фармацевтически приемлемым носителем, разбавителем или эксципиентом.
10. Применение соединения по любому из пп.1-8 для изготовления лекарственного средства для регуляции пролиферативных расстройств у млекопитающего, выбранных из группы, состоящей из рака, псориаза, пролиферации гладкомышечных клеток сосудов, связанной с расстройством, выбранным из группы, состоящей из атеросклероза, послеоперационного стеноза сосудов и рестеноза.
11. Применение соединения по любому из пп.1-8 для изготовления лекарственного средства для ингибирования циклинзависимой киназы.
12. Применение соединения по любому из пп.1-8 для изготовления лекарственного средства для ингибирования фактора роста опосредуемой тирозинкиназы.
13. Применение соединения по любому из пп.1-8 для изготовления лекарственного средства для лечения субъекта, страдающего заболеваниями, вызванными пролиферацией гладкомышечных клеток сосудов.
14. Применение соединения по любому из пп.1-8 для изготовления лекарственного средства для лечения субъекта, страдающего раком.
15. Применение соединения по любому из пп.1-8 для изготовления лекарственного средства для лечения млекопитающего, страдающего сердечно-сосудистыми заболеваниями, включая атеросклероз и рестеноз; раком; ангиогенезом; вирусными инфекциями, включая ДНК-вирусы, такие как вирус герпеса, и РНК-вирусы, такие как ВИЧ; грибковыми инфекциями; диабетом типа I и диабетической невропатией и ретинопатией; рассеянным склерозом; гломерулонефритом; нейродегенеративными заболеваниями, включая болезнь Альцгеймера; аутоиммунными заболеваниями, такими как псориаз, ревматоидный артрит, волчанка; отторжением органного трансплантата и болезнью "трансплантат против хозяина"; подагрой; болезнью поликистоз почек; и воспалением, включая воспалительное заболевание кишечника.
Текст
1 Предпосылки изобретения Область изобретения Данное изобретение относится к 8 Нптеридин-7-онам, тетрагидроптеридин-7-онам,5 Н,8 Н-птеридин-6,7-дионам и птеридин-7-мочевинам, которые ингибируют циклинзависимую серин/треонинкиназу, Wee1 тирозинкиназу и опосредуемые фактором роста ферментытирозинкиназы и которые как таковые полезны для лечения клеточных пролиферативных заболеваний и расстройств. Эти заболевания и расстройства включают в себя сердечно-сосудистые заболевания, включая атеросклероз и рестеноз; рак; ангиогенез; вирусные инфекции,в которые вовлечены ДНК-вирусы, например вирус герпеса, и РНК-вирусы, например ВИЧ; грибковые инфекции; диабет типа I и диабетическую невропатию и ретинопатию; рассеянный склероз; гломерулонефрит; нейродегенеративные заболевания, включая болезнь Альцгеймера; аутоиммунные заболевания, такие как псориаз, ревматоидный артрит, волчанка; отторжение органного трансплантата и болезнь трансплантат против хозяина; подагра; болезнь поликистоз почек; и воспаление, включая воспалительное заболевание кишечника. Уровень техники Киназы клеточного цикла представляют собой встречающиеся в природе ферменты, вовлеченные в регуляцию клеточного цикла (MeijerL., "Chemical Inhibitors of Cyclin-Dependent Kinases", Progress in Cell Cycle Research, 1995; 1:351-363). К типичным ферментам относятся серин/треонинкиназы, такие как циклинзависимые киназы (cdk) cdk1, cdk2, cdk4, cdk5, cdk6, а также тирозинкиназы, вовлеченные в регуляцию клеточного цикла, такие как Wee1 киназа. Было показано, что повышенная активность или временно аномальная активация или регуляция этих киназ приводит к развитию опухолей и других пролиферативных расстройств у человека. Соединения, которые ингибируют cdk, либо путем блокирования взаимодействия между циклином и его киназным партнером, либо путем связывания и инактивирования киназы вызывают ингибирование клеточной пролиферации и, таким образом, являются полезными для лечения опухолей или других аномально пролиферирующих клеток. Некоторые соединения, которые ингибируют cdk, демонстрировали преклиническую противоопухолевую активность. Например,флавопиридол представляет собой флавоноид,который, как было показано, является сильнодействующим ингибитором нескольких типов клеток рака молочной железы и легкого (Kaur,et al., J. Natl. Cancer Inst., 1992; 84: 1736-1740;Int. J. Oncol., 1996; 9:1143-1168). Было показано,что это соединение ингибирует cdk2 и cdk4. Оломоуцин (oloumicine) [2-(гидроксиэтиламино)-6-бензиламин-9-метилпурин] является сильным ингибитором cdk2 и cdk5 (Vesely, et al., 005287Eur. J. Biochem., 1994; 224:771-786), и было показано, что он ингибирует пролиферацию приблизительно 60 различных линий опухолевых клеток человека, используемых Национальным Онкологическим Институтом (НИР) для скрининга новых способов терапии рака (Abraham, etal., Biology of the Cell, 1995; 83: 105-120). Позднее появился пурваланольный (purvalanol) класс ингибиторов cdk как более сильнодействующих производных оломоуцинового класса соединений(Gray, M.S., et al., Science, 1998; 281: 533-538). Кроме того, тирозинкиназы представляют собой класс ферментов, которые катализируют перенос концевого фосфата аденозинтрифосфата(АТФ) на тирозиновые остатки белковых субстратов. Тирозинкиназы важны для распространения передачи сигнала фактора роста, приводящего к прохождению клеточного цикла, клеточной пролиферации, дифференцировке и миграции. Тирозинкиназы включают в себя тирозинкиназы рецепторов факторов роста на клеточной поверхности, таких как рецептор фактора роста фибробластов (FGFr) и рецептор тромбоцитарного фактора роста (PDGFr); a также нерецепторные тирозинкиназы, в том числе c-src и Ick. Было продемонстрировано, что ингибирование этих ферментов вызывает противоопухолевую и противоангиогенезную активность (Наmbу, etal., Pharmacol. Ther., 1999; 82 (2-3): 169-193). Несмотря на достигнутый прогресс, продолжается поиск низкомолекулярных соединений, которые были бы перорально биодоступны и полезны для лечения широкого круга человеческих опухолей и других пролиферативных расстройств, включая рестеноз, ангиогенез, диабетическую ретинопатию, псориаз, хирургические спайки, дегенерацию желтого пятна и атеросклероз. Краткое изложение сущности изобретения В соответствии с настоящим изобретением предложено соединение формулы и его фармацевтически приемлемые соли,эфиры, амиды и пролекарства, где(СН 2)nарил и (СН 2)nгетероарил, где каждая из вышеупомянутых арильных и гетероарильных групп может быть не замещена или замещена 15 группами-заместителями, выбранными из(и) карбоциклической группы, содержащей от 3 до 7 кольцевых членов, один или два из которых могут представлять собой гетероатом,выбранный из О или N, и причем эта карбоциклическая группа может быть замещена 1, 2 или 3 группами-заместителями, выбранными из(а) одинаковыми или разными и независимо представляют собой водород, C1-С 10 алкил,C1-С 10 алкокси, амино, аминоалкокси, гидрокси,моно- или диалкиламино, моно- или диалкиламиноалкокси;(б) одинаковыми или разными и независимо представляют собой (CH2)nарил или(СН 2)nгетероарил, где каждый арил и гетероарил не замещен или замещен группами, в количестве вплоть до 5, выбранными из галогена, гидрокси, C1-С 10 алкила, C1-С 10 алкокси, амино, моноили диалкиламино;n представляет собой 0; и где алкильная составляющая в указанных радикалах содержит от 1 до 10 углеродных атомов; арил означает ароматическую карбоциклическую группу, имеющую единственное кольцо,множественные кольца или множественные конденсированные кольца, из которых по меньшей мере одно является ароматическим; гетероарил означает одну или более чем одну ароматическую кольцевую систему из 5, 6 или 7 членов, содержащую по меньшей мере 1 и вплоть до 4 гетероатомов, выбранных из азота,кислорода или серы; карбоциклическая группа означает неароматическое циклическое кольцо или конденсированные кольца, имеющие от 3 до 7 кольцевых углеродных членов. 4 Согласно изобретению предложено также соединение формулы и его фармацевтически приемлемые соли,эфиры, амиды и пролекарства, где(СН 2)nарил и (СН 2)nгетероарил, где каждая из вышеупомянутых арильных и гетероарильных групп может быть не замещена или замещена 15 группами-заместителями, выбранными из(и) карбоциклической группы, содержащей от 3 до 7 кольцевых членов, один или два из которых могут представлять собой гетероатом,выбранный из О или N, и причем эта карбоциклическая группа может быть замещена 1, 2 или 3 группами-заместителями, выбранными из(б) (СН 2)nарил или (СН 2)nгетероарил, где каждый арил и гетероарил не замещен или замещен группами, в количестве вплоть до 5, выбранными из галогена, гидрокси, C1-С 10 алкила,C1-С 10 алкокси, амино, моно- или диалкиламино; 5 и где алкильная составляющая во всех указанных радикалах содержит от 1 до 10 углеродных атомов; арил означает ароматическую карбоциклическую группу, имеющую единственное кольцо,множественные кольца или множественные конденсированные кольца, из которых по меньшей мере одно является ароматическим; гетероарил означает одну или более чем одну ароматическую кольцевую систему из 5, 6 или 7 членов, содержащую по меньшей мере 1 и вплоть до 4 гетероатомов, выбранных из азота,кислорода или серы; карбоциклическая группа означает неароматическое циклическое кольцо или конденсированные кольца, имеющие от 3 до 7 кольцевых углеродных членов. Согласно изобретению предложено далее соединение формулы и его фармацевтически приемлемые соли,эфиры, амиды и пролекарства, гдеR5 и R7 являются одинаковыми или разными и выбраны из(в) карбоциклической группы, содержащей от 3 до 7 членов, из которых до двух членов представляют собой гетероатомы, выбранные из кислорода и азота, причем эта карбоциклическая группа не замещена или замещена 1, 2 или 3 группами, независимо выбранными из группы,состоящей из галогена, гидрокси, C1-С 10 алкила,C1-С 10 алкокси, амино, моно- или диалкиламино,карбоновой кислоты, карбоксамида, эфира карбоновой кислоты, морфолино, пиперазинила,пиперидинила, аминоалкила и алканоиламино;(а) одинаковыми или разными и независимо представляют собой водород, C1-С 10 алкил,C1-С 10 алкокси, амино, аминоалкокси, гидрокси,моно- или диалкиламино, моно- или диалкил аминоалкокси;(б) одинаковыми или разными и независимо представляют собой (СН 2)nарил или (СН 2)n гетероарил, где каждый арил и гетероарил не замещен или замещен группами, в количестве вплоть до 5, выбранными из галогена, гидрокси, 005287n представляет собой 0; и где алкильная составляющая во всех указанных радикалах содержит от 1 до 10 углеродных атомов; арил означает ароматическую карбоцикпическую группу, имеющую единственное кольцо, множественные кольца или множественные конденсированные кольца, из которых по меньшей мере одно является ароматическим; гетероарил означает одну или более чем одну ароматическую кольцевую систему из 5, 6 или 7 членов, содержащую по меньшей мере 1 и вплоть до 4 гетероатомов, выбранных из азота,кислорода или серы; карбоциклическая группа означает неароматическое циклическое кольцо или конденсированные кольца, имеющие от 3 до 7 кольцевых углеродных членов. Далее согласно изобретению предложено соединение формулы и его фармацевтически приемлемые соли,эфиры, амиды и пролекарства, где А, В и С являются одинаковыми или разными и представляют собой N или СН при условии, что по меньшей мере один из А, В или С представляет собой СН;R5 и R7 являются являются одинаковыми или разными и выбраны из(в) карбоциклической группы, содержащей от 3 до 7 членов, из которых до двух членов представляют собой гетероатомы, выбранные из кислорода и азота, причем эта карбоциклическая группа не замещена или замещена 1, 2 или 3 группами, независимо выбранными из группы,состоящей из галогена, гидрокси, C1-С 10 алкила,C1-С 10 алкокси, амино, моно- или диалкиламино,морфолино, пиперазинила, пиперидинила и аминоалкила;(а) одинаковыми или разными и независимо представляют собой водород, C1-С 10 алкил, 7(б) одинаковыми или разными и независимо представляют собой (СН 2)nарил или (СН 2)n гетероарил, где каждый арил и гетероарил не замещен или замещен группами, в количестве вплоть до 5, выбранными из галогена, гидрокси,C1-С 10 алкила, C1-С 10 алкокси, амино, моно- или диалкиламино;n представляет собой 0; и где алкильная составляющая во всех указанных радикалах содержит от 1 до 10 углеродных атомов; арил означает ароматическую карбоциклическую группу, имеющую единственное кольцо,множественные кольца или множественные конденсированные кольца, из которых по меньшей мере одно является ароматическим; гетероарил означает одну или более чем одну ароматическую кольцевую систему из 5, 6 или 7 членов, содержащую по меньшей мере 1 и вплоть до 4 гетероатомов, выбранных из азота,кислорода или серы; карбоциклическая группа означает неароматическое циклическое кольцо или конденсированные кольца, имеющие от 3 до 7 кольцевых углеродных членов. Согласно изобретению предложено также соединение формулы и его фармацевтически приемлемые соли,эфиры, амиды и пролекарства, гдеR5 и R7 являются одинаковыми или разными и выбраны из(в) карбоциклической группы, содержащей от 3 до 7 членов, из которых до двух членов представляют собой гетероатомы, выбранные из кислорода и азота, причем эта карбоциклическая группа не замещена или замещена 1, 2 или 3 группами, независимо выбранными из группы,состоящей из галогена, гидрокси, C1-С 10 алкила, 005287(а) одинаковыми или разными и независимо представляют собой водород, C1-С 10 алкил,C1-С 10 алкокси, амино, аминоалкокси, гидрокси,моно- или диалкиламино, моно- или диалкиламиноалкокси;(б) одинаковыми или разными и независимо представляют собой (СН 2)nарил или (СН 2)n гетероарил, где каждый арил и гетероарил не замещен или замещен группами, в количестве вплоть до 5, выбранными из галогена, гидрокси,C1-С 10 алкила, C1-С 10 алкокси, амино, моно- или диалкиламино;n представляет собой 0; и где алкильная составляющая во всех указанных радикалах содержит от 1 до 10 углеродных атомов; арил означает ароматическую карбоциклическую группу, имеющую единственное кольцо,множественные кольца или множественные конденсированные кольца, из которых по меньшей мере одно является ароматическим; гетероарил означает одну или более чем одну ароматическую кольцевую систему из 5, 6 или 7 членов, содержащую по меньшей мере 1 и вплоть до 4 гетероатомов, выбранных из азота,кислорода или серы; карбоциклическая группа означает неароматическое циклическое кольцо или конденсированные кольца, имеющие от 3 до 7 кольцевых углеродных членов. Кроме того, в соответствии с изобретением предложено соединение формулы и его фармацевтически приемлемые соли,эфиры, амиды и пролекарства, гдеR5 и R7 являются одинаковыми или разными и выбраны из(в) карбоциклической группы, содержащей от 3 до 7 членов, из которых до двух членов представляют собой гетероатомы, выбранные из кислорода и азота, причем эта карбоциклическая группа не замещена или замещена 1, 2 или 3 группами, независимо выбранными из группы,состоящей из галогена, гидрокси, C1-С 10 алкила,C1-С 10 алкокси, амино, моно- или диалкиламино,морфолино, пиперазинила, пиперидинила, аминоалкила и алканоиламино;(а) одинаковыми или разными и независимо представляют собой водород, C1-С 10 алкил,C1-С 10 алкокси, амино, аминоалкокси, гидрокси,моно- или диалкиламино, моно- или диалкиламиноалкокси;(б) одинаковыми или разными и независимо представляют собой (CH2)nарил или (СН 2)n гетероарил, где каждый арил и гетероарил не замещен или замещен группами, в количестве вплоть до 5, выбранными из галогена, гидрокси,C1-С 10 алкила, C1-С 10 алкокси, амино, моно- или диалкиламино;n представляет собой 0; и где алкильная составляющая во всех указанных радикалах содержит от 1 до 10 углеродных атомов; арил означает ароматическую карбоциклическую группу, имеющую единственное кольцо,множественные кольца или множественные конденсированные кольца, из которых по меньшей мере одно является ароматическим; гетероарил означает одну или более чем одну ароматическую кольцевую систему из 5, 6 или 7 членов, содержащую по меньшей мере 1 и вплоть до 4 гетероатомов, выбранных из азота,кислорода или серы; карбоциклическая группа означает неароматическое циклическое кольцо или конденсированные кольца, имеющие от 3 до 7 кольцевых углеродных членов. Наиболее предпочтительными соединениями по изобретению являются соединения,выбранные из 8-метил-2-4-(морфолин-4-ил)фенил)]амино]-6-фенил-8 Н-птеридин-7-она; 6-(2,6-дихлорфенил)-8-метил-2-4-(морфолин-4-ил)фенил]амино]-8H-птеридин-7-она; 6-(3,5-дихлорпиридин-4-ил)-8-метил-2-4(морфолин-4-ил)фенил]амино]-8H-птеридин-7 она; 6-(3,5-дихлор-2,6-диметоксипиридин-4-ил)8-метил-2-4-(морфолин-4-ил)фенил]амино]8 Н-птеридин-7-она; 6-(3,5-дибромпиридин-4-ил)-8-метил-2-4(морфолин-4-ил)фенил]амино]-8 Н-птеридин-7 она; 2-4-[2-(диэтиламино)этокси]фенил]амино]-8-метил-6-фенил-8H-птеридин-7-она; 10 6-(2,6-дихлорфенил)-2-4-[2-(диэтиламино) этокси]фенил]амино]-8-метил-8 Н-птеридин-7-она; 6-(3,5-дихлорпиридин-4-ил)-8-метил-2-4[2-(диэтиламино)этокси]фенил]амино]-8H-птеридин-7-она; 6-(3,5-дихлор-2,6-диметоксипиридин-4-ил)8-метил-2-4-[2-(диэтиламино)этокси]фенил] амино]-8 Н-птеридин-7-она; 2-4-(диэтиламинокарбонил)фенил]амино]8-метил-6-фенил-8H-птеридин-7-она; 6-(2,6-дихлорфенил)-2-4-(диэтиламинокарбонил)фенил]амино]-8-метил-8H-птеридин 7-она; 6-(3,5-дихлорпиридин-4-ил)-2-4-(диэтиламинокарбонил)фенил]амино]-8-метил-8 Н-птеридин-7-она; 6-(3,5-дихлор-2,6-диметоксипиридин-4-ил)2-4-(диэтиламинокарбонил)фенил]амино]-8 метил-8H-птеридин-7-она; 8-циклопентил-2-4-(морфолин-4-ил)фенил] амино]-8 Н-птеридин-7-она; 8-циклопентил-6-метил-2-4-(морфолин-4 ил)фенил]амино]-8 Н-птеридин-7-она; 8-циклопентил-2-4-(4-метилпиперазин-1 ил)фенил]амино]-8 Н-птеридин-7-она; 8-циклопентил-6-метил-2-4-(4-метилпиперазин-1-ил)фенил]амино]-8H-птеридин-7-она; 8-циклопентил-2-[(пиридин-4-ил)амино]8 Н-птеридин-7-она; 2-4-(3-аминопирролидин-1-ил)фенил] амино]-8-циклопентил-8H-птеридин-7-она; 8-циклопентил-2-4-(пиперазин-1-ил)фенил]амино]-8H-птеридин-7-она; 6-(3,5-диметоксифенил)-8-этил-2-[(пиридин-4-ил)амино]-8 Н-птеридин-7-она; 6-(3,5-диметоксифенил)-8-этил-2-4-[2(диэтиламино)этокси]фенил]амино]-8H-птеридин-7-она; 2-4-[4-(трет-бутоксикарбонил)пиперазин 1-ил]фенил]амино]-8-циклопентил-8H-птеридин 7-она; 2-4-[3-(трет-бутоксикарбониламино)пирролидин-1-ил]фенил]амино]-8-циклопентил-8 Нптеридин-7-она; 8-циклопентил-2-(4-фтор-3-метилфениламино)-8H-птеридин-7-она; 2-(3-хлор-4-фторфениламино)-8-циклопентил-8H-птеридин-7-она; 8-циклогексил-2-(4-фтор-3-метилфениламино)-8 Н-птеридин-7-она. Также к числу наиболее предпочтительных соединений относится соединение, которое выбрано из 8-циклопентил-2-4-(морфолин-4-ил)фенил]амино]-5 Н,8 Н-птеридин-6,7-диона; 8-циклопентил-2-4-(4-метилпиперазин-1 ил)фенил]амино]-5H,8 Н-птеридин-6,7-диона. Согласно настоящему изобретению предложен фармацевтический препарат, содержащий соединение по изобретению в комбинации с фармацевтически приемлемым носителем,разбавителем или эксципиентом. 11 Согласно изобретению предложено также применение соединения, как оно определено выше, для изготовления лекарственного средства для регуляции пролиферативных расстройств у млекопитающего, выбранных из группы, состоящей из рака, псориаза, пролиферации гладкомышечных клеток сосудов, связанной с расстройством, выбранным из группы, состоящей из атеросклероза, послеоперационного стеноза сосудов и рестеноза. Также предложено применение соединения, как оно определено выше, для изготовления лекарственного средства для ингибирования циклинзависимой киназы. Также предложено применение соединения, как оно определено выше, для изготовления лекарственного средства для ингибирования фактор роста-опосредуемой тирозинкиназы. Согласно изобретению дополнительно предложено применение соединения, как оно определено выше, для изготовления лекарственного средства для лечения субъекта, страдающего заболеваниями, вызванными пролиферацией гладкомышечных клеток сосудов. Далее согласно изобретению предложено применение соединения по изобретению, как оно определено выше, для изготовления лекарственного средства для лечения субъекта, страдающего раком. И, наконец, согласно изобретению предложено применение соединения по изобретению, как оно определено выше, для изготовления лекарственного средства для лечения млекопитающего, страдающего сердечно-сосудистыми заболеваниями, включая атеросклероз и рестеноз; раком; ангиогенезом; вирусными инфекциями, включая ДНК-вирусы, такие как вирус герпеса, и РНК-вирусы, такие как ВИЧ; грибковыми инфекциями; диабетом типа I и диабетической невропатией и ретинопатией; рассеянным склерозом; гломерулонефритом; нейродегенеративными заболеваниями, включая болезнь Альцгеймера; аутоиммунными заболеваниями, такими как псориаз, ревматоидный артрит, волчанка; отторжением органного трансплантата и болезнью трансплантат против хозяина; подагрой; болезнью поликистоз почек; и воспалением, включая воспалительное заболевание кишечника. Подробное описание изобретения Предпочтительными из соединений вышеуказанных формул являются соединения формулы II(б) R6 представляет собой водород, C1-С 10 алкил, арил или гетероарил, причем такой арил или гетероарил не замещен или замещен 1-5 группами, выбранными из гидрокси, амино,галогена, C1-С 10 алкила или C1-С 10 алкокси;(в) R8 представляет собой C1-С 10 алкил или карбоциклическую группу, содержащую от 3 до 7 членов;(г) R7 представляет собой водород или галоген; и(д) R5 находится в положении 4 (т.е. пара) и выбран из галогена, моно- или диалкиламиноалкокси, N-моно- или N,N-диалкиламинокарбонила, карбоновой кислоты, эфира или амида карбоновой кислоты, SO2Z, PO3Z или карбоциклической группы, содержащей от 3 до 7 членов,из которых до двух членов представляют собой гетероатомы, выбранные из кислорода и азота,причем эта карбоциклическая группа не замещена или замещена С 1-С 10 алкилом, ацилом,морфолино, пиперазинилом, пиперидинилом,аминоалкилом и алканоиламино. Более предпочтительными соединениями формулы II являются такие, где(г) R5 находится в положении 4 и выбран из моно- или диалкиламиноалкокси, N-моноили N,N-диалкиламинокарбонила или карбоциклической группы, содержащей от 3 до 7 членов, из которых до двух членов представляют собой гетероатомы, выбранные из кислорода и азота, причем эта карбоциклическая группа не замещена или замещена C1-С 10 алкилом, ацилом,морфолино, пиперазинилом, пиперидинилом,аминоалкилом и алканоиламино; и(д) R6 представляет собой водород или метил, фенил или 4-пиридил, причем фенильная и пиридильная группы не замещены или замещены группами, в количестве вплоть до 5, выбранными из группы, состоящей из хлора, фтора,гидрокси, метила, амино и метокси. Кроме того, предпочтительными из числа соединений вышеуказанных формул являются соединения формулы III где только один из А, В и С представляет собойN; R5 и R7 представляют собой водород; R8 представляет собой C1-С 10 алкил или карбоциклическую группу, содержащую от 3 до 7 членов;R4 представляет собой водород, а R6 представляет собой водород, арил или пиридил, незамещенный или замещенный группами, в количест 13 ве вплоть до 5, выбранными из гидрокси, амино,галогена, C1-С 10 алкила или C1-С 10 алкокси. Более предпочтительными соединениями формулы III являются такие, где С представляет собой N; А и В представляют собой CH; R4 представляет собой водород; R6 представляет собой водород, арил или пиридил, незамещенный или замещенный группами, в количестве вплоть до 4, выбранными из галогена, гидрокси,C1-С 10 алкила и C1-С 10 алкокси; а R8 представляет собой метил, этил или циклопентил. Кроме того, предпочтительными также являются соединения формул IVa и IVb где R4, R8, R5 и R7 такие как определено выше;R9 представляет собой Н, ОН, NH2, C1-С 10 алкил; когда R6 и R6' взяты вместе как С=O, и R9 является Н (IVc), или каждый представляет собой Н для IVd. Предпочтительными соединениями формулы IVc являются такие, где R4 представляет собой водород; R8 представляет собой C1-С 10 алкил или карбоциклическую группу, содержащую от 3 до 7 членов; R7 представляет собой водород, а R5 находится в положении 4 и представляет собой карбоциклическую группу, содержащую от 3 до 7 членов, из которых до двух членов представляют собой гетероатомы, выбранные из кислорода и азота, причем эта карбоциклическая группа не замещена или замещена C1-С 10 алкилом. Более предпочтительными соединениями формулы IVc являются такие, где R8 представляет собой циклопентил, а R5 находится в положении 4 и представляет собой морфолин-4-ил,4-пиперазин-1-ил. Кроме того, из числа соединений по изобретению предпочтительны соединения формулы V 14 представляет собой галоген или водород; а R7 представляет собой C1-С 10 алкил или карбоциклическую группу, содержащую от 3 до 7 членов,из которых до двух членов представляют собой гетероатомы, выбранные из кислорода и азота,причем эта карбоциклическая группа не замещена или замещена C1-С 10 алкилом, амино или моно- или диалкиламино. Более предпочтительными соединениями формулы V являются такие, где R7 представляет собой C1-С 10 алкил или морфолин, пиперидин,или пиперазин. Под алкилом и C1-С 10 алкилом в настоящем изобретении подразумевают алкильные группы с прямой или разветвленной цепью,имеющие от 1 до 10 углеродных атомов, как,например, предпочтительно C1-С 6, метил, этил,н-пропил, изопропил, н-бутил, втop-бутил, третбутил, пентил, 2-пентил, изопентил, неопентил,гексил, 2-гексил, 3-гексил, децил, октил и 3 метилпентил. Эти группы могут быть замещены, например, галогено, амино, алкилом и диалкиламино, гидрокси и тому подобным. Примеры включают хлорметил, 2-аминоэтил и 3-диметиламинопропил. Под алкокси и C1-С 10 алкокси в настоящем изобретении понимают алкоксигруппы с прямой или разветвленной цепью, имеющие от 1 до 10 углеродных атомов, предпочтительно 1-6 углеродных атомов, присоединенные через атом кислорода, такие как, например, метокси,этокси, н-пропокси, изопропокси, н-бутокси,втор-бутокси, трет-бутокси, пентокси, 2-пентилокси, изопентокси, неопентокси, гексокси, 2 гексокси, 3-гексокси и 3-метилпентокси. Эти алкоксигруппы могут быть замещены, например,амино-, алкиламино- и диалкиламиногруппами. Примеры включают в себя аминометокси, 2-(метиламино)этокси и 4-(диметиламино)бутокси. Термин алканоил обозначает алкильную группу, присоединенную через карбонильную группировку. Примеры включают ацетил и пентаноил. Аминоалканоил обозначает, что алкильная группа замещена аминогруппой. Примеры включают аминоацетил и 3-аминогексаноил. Алкиламиноалканоил обозначает аминоалканоильную группу, в которой амин замещен C1-С 10 алкильной группой, и включает метиламиноацетил и 4-(изобутиламино)октаноил. Диалкиламиноалканоил обозначает N,N-дизамещенную аминоалканоильную группу, такую как диизопропиламиноацетил. Термин аминокарбонил обозначает аминогруппу, присоединенную через карбонильную группу, например аминоформил. Алкиламинокарбонил включает группы, такие как метиламиноформил, а диалкиламинокарбонил включает такие группы, как диэтиламиноформил. Под термином галоген в настоящем изобретении понимают фтор, бром, хлор и иод. Под арилом понимают ароматическую карбоциклическую группу, имеющую единст 15 венное кольцо (например, фенил), множественные кольца (например, бифенил) или множественные конденсированные кольца, из которых по меньшей мере одно является ароматическим(например, 1,2,3,4-тетрагидронафтил, нафтил,антрил или фенантрил), которые могут быть моно-, ди-, тризамещенными или тетразамещенными, например, галогеном, С 1-С 10 алкилом,C1-С 10 алкокси, C1-С 10 ацилокси, амино и гидрокси. Предпочтительный арил представляет собой фенил и замещенный фенил, включая 2,6 дихлорфенил, 3-метоксифенил, 2-хлор-6-бромфенил, 3,5-диэтоксифенил, 2,6-диметилфенил,2,6-дихлор-3-гидроксифенил, 2,6-дихлор-4-гидроксифенил, 3-аминофенил, 4-аминофенил, 2 хлор-6-метоксифенил, 2-хлор-6-гидроксифенил,2,6-дихлор-4-аминофенил и 2,6-дихлор-3-аминофенил. Под гетероарилом понимают одну или более чем одну ароматическую кольцевую систему из 5, 6 или 7 членов, содержащую по меньшей мере 1 и вплоть до 4 гетероатомов,выбранных из азота, кислорода или серы. Такие гетероарильные группы включают, например,тиенил, фуранил, тиазолил, имидазолил, (из)оксазолил, тетразолил, пиридил, пиридонил, пиримидинил, пиразол, (изо)хинолинил, нафтиридинил, фталимидил, бензимидазолил, бензоксазолил. Предпочтительными гетероарилами по настоящему изобретению являются пиридил,фталимидил и тетразолил. Гетероарильная группа может быть замещена 1, 2, 3 или 4 из групп, указанных выше для арила, как, например, 2,3,4,6-тетрахлорпиридил. Карбоциклическая группа обозначает неароматическое циклическое кольцо или конденсированные кольца, имеющие от 3 до 7 кольцевых углеродных членов. Примеры включают в себя циклопропил, циклобутил и циклогептил. Эти кольца могут быть замещены одной или более чем одной из замещающих групп,указанных для арила, например галогено, амино, гидрокси и алкокси. Типичные замещенные карбоциклические группы включают 2-хлорциклопропил, 2,3-диэтоксициклопентил и 2,2,4,4 тетрафторциклогексил. Карбоциклическая группа может содержать 1 или 2 гетероатома, выбранных из кислорода, серы и азота, и такие кольцевые системы называют гетероциклилильными. Примеры включают пиранил, тетрагидрофуранил и диоксанил. Эти гетероциклицильные группы могут быть замещены группами-заместителями в количестве вплоть до 4,указанными для арила, с образованием групп,таких как 3-хлор-2-диоксанил и 3,5-дигидроксиморфолино. Термин рак включает в себя, но не ограничен этим, следующие виды рака: рак молочной железы, яичника, шейки, простаты, яичка,пищевода, глиобластому, нейробластому, рак желудка, кожи, кератоакантому, рак легкого,плоскоклеточную карциному, крупноклеточную 16 карциному, аденокарциному, рак кости, ободочной кишки, аденокарциному, аденому, рак поджелудочной железы, аденокарциному, рак щитовидной железы, фолликулярную карциному, недифферинцированную карциному, папиллярную карциному, семиному, меланому, саркому, карциному мочевого пузыря, карциному печени и рак желчных протоков, карциному почки, миелоидные нарушения, лимфоидные нарушения, болезнь Ходжкина, волосатые клетки, рак щечного кармана и рак ротоглотки,губы, языка, ротовой полости, глотки, тонкого кишечника, ободочной-прямой кишки, толстого кишечника, прямой кишки, головного мозга и центральной нервной системы, а также лейкемию. Термин фармацевтически приемлемые соли, эфиры, амиды и пролекарства, как он используется здесь, относится к тем солямкарбоксилатам, солям присоединения аминокислот, эфирам, амидам и пролекарствам соединений по настоящему изобретению, которые, по здравому медицинскому суждению,подходят для применения в контакте с тканями пациентов, не обладая чрезмерной токсичностью, не вызывая раздражения, аллергической реакции и тому подобного, соразмерны с разумным соотношением польза/риск и эффективны в отношении их предполагаемого применения, а также, когда это возможно, к цвиттерионным формам соединений по изобретению. Термин соли относится к относительно нетоксичным неорганическим и органическим солям присоединения кислоты соединений по настоящему изобретению. Эти соли могут быть получены insitu в ходе конечного выделения и очистки данных соединений или путем отдельного взаимодействия очищенного соединения в форме его свободного основания с подходящей органической или неорганической кислотой и выделения образовавшейся таким образом соли. Характерные соли включают соли гидробромид, гидрохлорид, сульфат, бисульфат, нитрат, ацетат, оксалат, валерат, олеат, пальмиат, стеарат, лаурат,борат, бензоат, лактат, фосфат, тозилат, цитрат,малеат, фумарат, сукцинат, тартрат, нафтилат,мезилат, глюкогептонат, лактобионат и лаурилсульфонат и тому подобное. Они могут включать в себя катионы на основе щелочных и щелочно-земельных металлов, таких как натрий,литий, калий, кальций, магний и тому подобное,а также нетоксичные аммониевые, четвертичные аммониевые и аминные катионы, включая,но не ограничиваясь этим, аммоний, тетраметиламмоний, тетраэтиламмоний, метиламин, диметиламин, триметиламин, триэтиламин, этиламин и тому подобное (cм., например, Веrgе S.M. etal., "Pharmaceutical Salts", J. Pharm. Sci., 1977; 66: 1-19, включенную сюда путем ссылки). Примеры фармацевтически приемлемых нетоксичных эфиров соединений по настоящему изобретению включают в себя C1-С 6 алкильные эфиры, причем алкильная группа является 17 прямой или разветвленной, замещенной или незамещенной; C5-С 7 циклоалкильные эфиры; а также арилалкильные эфиры, такие как бензиловый и трифенилметиловый. C1-С 4 алкильные эфиры являются предпочтительными, как, например, метиловый, этиловый, 2,2,2-трихлорэтиловый и тpeт-бутиловый. Эфиры соединений по настоящему изобретению могут быть получены общепринятыми способами. Примеры фармацевтически приемлемых нетоксичных амидов соединений по настоящему изобретению включают амиды, полученные с аммиаком, первичными C1-С 6 алкиламинами и вторичными C1-С 6 диалкиламинами, где алкильные группы являются прямыми или разветвленными. В случае вторичных аминов, амин может также находиться в форме 5- или 6-членного гетероцикла, содержащего 1 атом азота. Предпочтительны амиды, полученные с аммиаком,C1-С 3 алкильными первичными аминами и C1 С 2 диалкильными вторичными аминами. Амиды соединений по настоящему изобретению могут быть получены общепринятыми способами. Термин пролекарство относится к соединениям, которые in vivo быстро трансформируются, образуя родоначальное соединение вышеуказанных формул, например, при гидролизе в крови. Детальное обсуждение пролекарств дается в Т. Higuchi and V. Stella, "Pro-drugs asPharmaceutical Association and Pergamon Press,1987, обе из которых включены сюда путем ссылки. Примеры соединений по изобретению показаны ниже в табл. 1. Таблица 1 Птеридины, предложенные в соответствии с данным изобретением, названы в соответствии со следующей нумерацией: Например, соединение 51, показанное в табл. 1, названо как 6-(2,6-дихлор-3-гидроксифенил)-8-метил-24-(морфолин-4-ил)фенил]амино]-8 Н-птеридин-7-он. Репрезентативные соединения по настоящему изобретению, которые охватываются вышеуказанными формулами, включают, но не ограничиваются этим, соединения из табл. 1 и их фармацевтически приемлемые соли присоединения кислоты или основания или их амиды или пролекарства. Соединения по настоящему изобретению могут существовать в несольватированных формах, а также в сольватированных формах, включая гидратированные формы. Как правило,сольватированные формы, включая гидратированные формы, эквивалентны несольватированным формам, и подразумевается, что они входят в объем настоящего изобретения. Соединения вышеуказанных формул способны дополнительно образовывать фармацевтически приемлемые препараты, содержащие как соли,включая, но не ограничиваясь этим, соли присоединения кислоты и/или основания, сольваты, так и N-оксиды соединения этих формул. В соответствии с данным изобретением также предложены фармацевтические препараты, содержащие соединение вышеуказанных формул вместе с фармацевтически приемлемым носителем, разбавителем или эксципиентом для него. Все эти формы входят в объем настоящего изобретения. Фармацевтически приемлемые соли присоединения кислоты соединений вышеуказанных формул включают в себя соли, производные от неорганических кислот, таких как соляная, азотная, фосфорная, серная, бромисто-водородная,иодисто-водородная, фосфористая и тому подобные, а также соли, производные от органических кислот, таких как алифатические моно- и дикарбоновые кислоты, фенилзамещенные алкановые кислоты, гидроксиалкановые кислоты, алкандионовые кислоты, ароматические кислоты,алифатические и ароматические сульфоновые кислоты и тому подобное. Такие соли, таким образом, включают в себя сульфат, пиросульфат,бисульфат, сульфит, бисульфит, нитрат, фосфат,вторичный кислый фосфат, первичный кислый фосфат, метафосфат, пирофосфат, хлорид, бро 23 мид, иодид, ацетат, пропионат, каприлат, изобутират, оксалат, малонат, сукцинат, суберат, себацинат, фумарат, малеат, манделат, бензоат,хлорбензоат, метилбензоат, динитробензоат,фталат, бензолсульфонат, толуолсульфонат,фенилацетат, цитрат, лактат, малеат, тартрат,метансульфонат и тому подобное. Также предусмотрены соли аминокислот, такие как аргинат,глюконат, галактуронат и тому подобное; см.,например, Berge, et al., "Pharmaceutical Salts", J.of Pharmaceutical Science, 1977; 66: 1-19. Соли присоединения кислоты основных соединений получают путем приведения в контакт формы свободного основания с достаточным количеством желаемой кислоты с получением соли традиционным способом. Форма свободного основания может быть регенерирована путем приведения в контакт солевой формы и основания и выделения свободного основания традиционным способом. Формы свободного основания в некоторой степени отличаются от своих соответствующих солевых форм по некоторым физическим свойствам, таким как растворимость в полярных растворителях, но в остальном эти соли эквивалентны соответствующим им свободным основаниям для целей настоящего изобретения. Фармацевтически приемлемые соли присоединения основания образованы с металлами или аминами, как, например, с гидроксидами щелочных и щелочно-земельных металлов или органическими аминами. Примерами металлов,используемых в качестве катионов, являются натрий, калий, магний, кальций и тому подобное. Примерами подходящих аминов являютсяN,N'-дибензилэтилендиамин, хлорпрокаин, холин,диэтаноламин, этилендиамин, N-метилглюкамин и прокаин; см., например, Веrgе, et al., выше. Соли присоединения основания кислотных соединений получают путем приведения в контакт формы свободной кислоты и достаточного количества желаемого основания с получением соли традиционным способом. Форма свободной кислоты может быть регенерирована путем приведения в контакт солевой формы и кислоты и выделения свободной кислоты традиционным способом. Формы свободной кислоты в некоторой степени отличаются от своих соответствующих солевых форм по некоторым физическим свойствам, таким как растворимость в полярных растворителях, но в остальном эти соли эквивалентны соответствующим им свободным кислотам для целей настоящего изобретения. Соединения по настоящему изобретению полезны для лечения рака (например, лейкемии и рака легкого, молочной железы, простаты и кожи, как, например, меланомы) и других пролиферативных заболеваний, включая, но не ограничиваясь этим, псориаз, вирус простого герпеса (HSV), ВИЧ, рестеноз и атеросклероз. Для применения соединения по настоящему изобретению для лечения рака пациенту, имеющему рак, вводят терапевтически эффективное коли 005287 24 чество фармацевтически приемлемой композиции, содержащей соединение по изобретению. Еще одним воплощением настоящего изобретения является способ лечения субъектов,страдающих заболеваниями, вызванными пролиферацией гладкомышечных клеток сосудов. Соединения, входящие в объем настоящего изобретения, эффективно ингибируют пролиферацию и миграцию гладкомышечных клеток сосудов. Данный способ влечет за собой ингибирование пролиферации и/или миграции гладкомышечных клеток сосудов посредством введения эффективного количества соединения вышеуказанных формул субъекту, нуждающемуся в лечении. Соединения по настоящему изобретению могут быть приготовлены и введены в большом разнообразии пероральных и парентеральных лекарственных форм, включая чреcкожное и ректальное введение. Специалистам в данной области следует понимать, что следующие лекарственные формы могут содержать в качестве активного компонента либо соединение по изобретению, либо соответствующую фармацевтически приемлемую соль или сольват соединения по изобретению. Дополнительным воплощением настоящего изобретения является фармацевтический препарат, содержащий соединение по изобретению вместе с фармацевтически приемлемым носителем, разбавителем или эксципиентом для него. Для приготовления фармацевтических композиций с соединениями по настоящему изобретению фармацевтически приемлемые носители могут быть либо твердыми, либо жидкими. Препараты в твердой форме включают в себя порошки, таблетки, пилюли, капсулы, крахмальные облатки,суппозитории и дозируемые гранулы. Твердым носителем может быть одно или более чем одно вещество, которое может также служить в качестве разбавителей, корригентов, связующих веществ, консервантов, разрыхляющих агентов для таблеток или инкапсулирующего материала. В порошках носитель представляет собой тонкоизмельченное твердое вещество, такое как тальк или крахмал, которое находится в смеси с тонкоизмельченным активным компонентом. В таблетках активный компонент смешан с носителем, имеющим необходимые свойства связывания, в подходящих пропорциях, и спрессован в желаемой форме с желаемым размером. Препараты по настоящему изобретению предпочтительно содержат от примерно 5 до примерно 70% или более активного соединения. Подходящие носители включают карбонат магния, стеарат магния, тальк, сахар, лактозу, пектин, декстрин, крахмал, желатин, трагакант,метилцеллюлозу, натрийкарбоксиметилцеллюлозу, воск с низкой температурой плавления,масло какао и тому подобное. Предпочтительной формой для перорального применения являются капсулы, которые включают в себя препарат активного соединения с инкапсулирующим материалом в качестве носителя, образую 25 щего капсулу, в которой активный компонент с другими носителями или без них окружен носителем, который, таким образом, находится в ассоциации с ним. Подобным образом включены крахмальные облатки и лепешки. Таблетки,порошки, капсулы, пилюли, крахмальные облатки и лепешки могут быть использованы в качестве твердых лекарственных форм, подходящих для перорального введения. Для получения суппозиториев воск с низкой температурой плавления, как, например, смесь глицеридов жирных кислот или масло какао,сначала расплавляют и активный компонент гомогенно диспергируют в нем, например, путем перемешивания. Расплавленную гомогенную смесь затем выливают в формы удобного размера, дают остыть и, таким образом, затвердеть. Препараты в жидкой форме включают растворы, суспензии и эмульсии, как, например,водные или водно-пропиленгликолевые растворы. Для парентеральной инъекции жидкие препараты могут быть приготовлены в виде раствора в водном растворе полиэтиленгликоля, изотоническом растворе, 5% водном растворе глюкозы и тому подобном. Водные растворы, подходящие для перорального применения, можно приготовить путем растворения активного компонента в воде и добавления подходящих красящих веществ, корригентов, стабилизирующих и загущающих агентов, как требуется. Водные суспензии, подходящие для перорального применения, можно приготовить путем диспергирования тонкоизмельченного активного компонента в воде и смешивания с материалом, увеличивающим вязкость, таким как природные и синтетические камеди, смолы, метилцеллюлоза,натрийкарбоксиметилцеллюлоза или другие хорошо известные суспендирующие агенты. Также включены препараты в твердой форме, которые, как подразумевается, должны быть превращены незадолго до применения в препараты в жидкой форме для перорального введения. Такие жидкие формы включают в себя растворы, суспензии и эмульсии. Эти препараты могут содержать, в дополнение к активному компоненту, красящие вещества, корригенты, стабилизаторы, буферы, искусственные и природные подслащивающие вещества, диспергирующие вещества, загустители, солюбилизирующие агенты и тому подобное. Воски, полимеры, микрочастицы и тому подобное можно использовать для приготовления лекарственных форм с пролонгированным высвобождением. Также могут быть использованы осмотические насосы для равномерной доставки активного соединения в течение пролонгированного периода времени. Фармацевтические препараты по изобретению предпочтительно представлены в стандартной лекарственной форме. В такой форме препарат подразделен на стандартные дозы, содержащие соответствующие количества актив 005287 26 ного компонента. Стандартная лекарственная форма может представлять собой упакованный препарат, причем упаковка содержит дискретные количества препарата, как, например, упакованные таблетки, капсулы, а также порошки во флаконах или ампулах. Также стандартная лекарственная форма может представлять собой саму по себе капсулу, таблетку, крахмальную облатку или лепешку, либо она может представлять собой соответствующее число любого из перечисленного в упакованной форме. Терапевтически эффективная доза соединения по изобретению должна обычно составлять от примерно 1 мг до примерно 100 мг/кг массы тела в сутки. Типичные дозы для взрослых должны составлять от примерно 50 до примерно 800 мг в сутки. Количество активного компонента в препарате стандартной дозы может варьировать или может быть отрегулировано от примерно 0,1 до примерно 500 мг, предпочтительно от примерно 0,5 до 100 мг, в соответствии с конкретным употреблением и эффективностью активного компонента. Данная композиция может также, по желанию, содержать другие совместимые терапевтические агенты. Субъекту, нуждающемуся в лечении соединением по изобретению, вводят дозировку от примерно 1 до примерно 500 мг в сутки, либо однократно, либо в виде множественных доз в течение 24-часового периода. Соединения по настоящему изобретению способны связываться с такими протеинкиназами и ингибировать активность таких протеинкиназ, как протеинкиназы cdk, Wee1, PDGFr,FGFr, c-src и FGFr-FL (Full-length - полноразмерная). Протеинкиназы cdk образуют комплексы с циклинами, и эти комплексы фосфорилируют ключевые белки, которые регулируют прохождение клетками клеточного цикла (Meijer L.,Progress in Cell Cycle Research, 1995; 1: 351-363). Соединения по изобретению ингибируют это фосфорилирование и, таким образом, могут быть использованы в качестве антипролиферативных агентов для лечения рака и/или рестеноза и других пролиферативных заболеваний. Благодаря их активности ингибирования cdk и других киназ соединения по настоящему изобретению также представляют собой полезный исследовательский инструмент для изучения механизма действия этих киназ как in vitro, так и in vivo. Птеридины по настоящему изобретению могут быть получены любым из нескольких стандартных способов синтеза, обычно используемых специалистами по органической химии. Пример обычного получения соединений по настоящему изобретению показан на cхеме I. Хотя на этих схемах часто показаны конкретные структуры, специалист в данной области поймет, что эти способы широко применимы к аналогичным птеридинам и их промежуточным соединениям, с уделением соответствующего внимания защите и снятию защиты с реакционно 27 способных функциональных групп с помощью стандартных способов органической химии. Например, гидроксигруппы, для того чтобы предупредить нежелательные побочные реакции, как правило, необходимо превратить в простые эфиры или сложные эфиры во время химических реакций по другим местам в молекулах. Защитную группу гидроксила легко удаляют для получения свободной гидроксигруппы. Подобным же образом получают производные аминогрупп и карбоксильных кислотных групп, чтобы защитить их от нежелательных побочных реакций. Обычные защитные группы и способы их присоединения и отщепления полностью описаны Greene и Wuts в Protective Groups in Organic Специалисты в данной области должны понимать, что исходные материалы можно варьировать и дополнительные стадии, используемые для получения соединений, охватываются настоящим изобретением, как показано с помощью следующих подробных примеров. Как показано на cхеме I, 2,4-дихлор-5 нитропиримидин взаимодействует с соответствующим амином при повышенной температуре,давая соответствующий 4-аминопиримидин. 2 Хлор-5-нитро-4-замещенный аминопиримидин взаимодействует с другим амином (R2NH2) при температуре окружающей среды с образованием 5-нитро-2,4-диаминопиримидина. Нитрогруппу последовательно восстанавливают путем гидрирования с получением 2,4,5-триаминопиримидина, который затем циклизуют до желаемого птеридин-7-она или -6,7-диона путем осуществления взаимодействия с соответствующим пируватом или оксалатом при повышенной температуре, составляющей от примерно 50 до примерно 150 С. Обозначение R1 на схеме I представляет собой эфиробразующую группу оксалата или пирувата, обычно C1-С 6 алкильную,такую как этильная. Альтернативно, соединения формулы IVd могут быть приготовлены в соответствии со 28 схемой II. 2,4,5-Тригалогенопиримидин последовательно подвергают взаимодействию с соответствующим образом замещенными аминами с получением 5,6-диаминопиримидина. Циклизацию с получением 2-галогеноптеридина выполняют путем взаимодействия с бромацетилхлоридом. К предпочтительным соединениям по изобретению относятся те, которые получены посредством взаимодействия 2-галогеноптеридина с соответствующим образом замещенным ариламином, таким как анилин. Схема II Соединения вышеуказанных формул могут быть получены из соответствующих промежуточных соединений, содержащих S, SO или SO2 вместо NH. Например, на схеме III показано,что 2-алкилтио-4,5-дигалогенопиримидин может являться исходным материалом для аминирования, как показано на схеме II. После обычной циклизации с образованием птеридинового кольца 2-алкилтиогруппа может быть окислена,например путем взаимодействия с метахлорпербензойной кислотой с получением сульфоксида (n=1) или сульфона (n=2). Сульфоксид или сульфон легко замещают путем осуществления взаимодействия с амином, таким как ариламин(арилNН 2). Типичные соединения имеют структуры, показанные в табл. 1, при этом 2-ариламиногруппа замещена на алкилS(O)n-. Схема III 29 Птеридинмочевины вышеуказанной формулы могут быть удобным образом получены путем ацилирования 7-аминоптеридина, который, в свою очередь, легко получить, используя 4,5-диаминопиримидино. Это проиллюстрировано на схеме IV ниже. Схема IV На вышеприведенной схеме IV 2,4-дихлор 5-нитропиримидин подвергают взаимодействию с аммиаком с получением 4-амино-2-хлор-5-нитропиримидина. Восстановление нитрогруппы,например путем осуществления взаимодействия с водородом в присутствии катализатора, такого как палладий на углероде, дает 2-хлор-4,5-диаминопиримидин, подобный тому, что показан на схеме III. Циклизацию до птеридина осуществляют путем взаимодействия 4,5-диаминопиримидина с таким агентом, как кетонитрил(R6COCN) с получением соответствующего 2 хлор-7-аминоптеридина. Группу 2-хлор легко замещают путем взаимодействия с амином, например с ариламином, с получением соответствующего 2-замещенного-7-аминоптеридина. Это промежуточное соединение важно тем, что оно легко ацилируется, например, путем взаимодействия с ацилгалогенидом или, предпочтительно,с изоцианатом, с получением мочевины по изобретению. Мочевина может быть выделена и очищена стандартными способами, такими как хроматография, кристаллизация и тому подобное. Изложение всех статей и ссылок в данной заявке, включая патенты, включено сюда путем ссылки. Далее данное изобретение проиллюстрировано следующими подробными примерами,которые не следует понимать как ограничивающие изобретение объемом или сущностью описанных в них конкретных процедур и соединений. Исходные материалы и различные промежуточные соединения можно приобрести в продаже, получить из имеющихся в продаже органических соединений или получить с использованием хорошо известных способов синтеза. В каждом примере предложена общая процедура получения нескольких конкретных со 005287 30 единений, каждое из которых имеет свой номер в виде подраздела каждого широкого примера. Пример 1. Синтез 2-галоген-4-(замещенный амино)-5-нитропиримидинов. 1. 2-Хлор-4-(метиламино)-5-нитропиримидин.(ТГФ) охлаждали до -78 С и раствор 4,66 г (60 ммоль) 40% водного метиламина в 20 мл 2-пропанола добавляли по каплям в течение 5 мин. После пребывания еще 10 мин при -78 С данной смеси давали нагреться до комнатной температуры и растворитель удаляли в вакууме. Остаток затем экстрагировали в этилацетат (EtOAc),промывали водой и сушили сульфатом натрия(Nа 2SO4). Удаление растворителя и хроматография на диоксиде кремния с элюированием смесью гексан/ЕtOАс (92:8) дало 4,87 г (86%) соединения, указанного в заголовке: т.пл. (гексан) 86-87 С (литер. т.пл. 90-91 С; G.B. Barlin, J.(d, C-6), 156,10 (s, C-4), 126,80 (s, C-5), 28,28 (q,СН 3). Дальнейшее элюирование растворителем дало 0,48 г (8,5%) 4-хлор-2-(метиламино)-5 нитропиримидина: т.пл. (гексан) 167-169 С (литер. т.пл. 172-173 С; G.B. Barlin, J. Chem. Soc. К раствору 5,82 г (30 ммоль) 2,4-дихлор-5 нитропиримидина (N. Whittaker, J. Chem. Soc.,1951; 1565-1570) в 100 мл ТГФ при -78 С добавляли по каплям в течение 5 мин раствор 5,11 г(60 ммоль) циклопентиламина в 20 мл ТГФ. После пребывания еще 10 мин при -78 С данной смеси давали нагреться до комнатной температуры и растворитель удаляли в вакууме. Остаток затем экстрагировали в ЕtOАс, промывали водой и сушили с помощью Na2SO4. Удаление растворителя и хроматография на SiO2 с элюированием смесью гексан/ЕtOАс (95:5) дало 6,20 г(d, C-6), 154,96 (s, C-4), 126,43 (s, C-5), 53,23 (d,CH), 32,99 (t, CH2), 23,69 (t, CH2). Анализ: рассчитано для C9H11ClN4O2: С, 44,55; Н, 4,57; N, 23,09. Обнаружено: С, 44,80; Н, 4,54; N, 22,90. Дополнительное элюирование растворителем дало 0,54 г (7,4%) 4-хлор-2-(циклопентиламино)-5-нитропиримидина: т.пл. (гексан) 149-153 С. 1 К раствору 5,82 г (30 ммоль) 2,4-дихлор-5 нитропиримидина (N. Whittaker, J. Chem. Soc.,1951; 1565-1570) в 100 мл ТГФ при -78 С добавляли по каплям в течение 5 мин раствор 3,87 г(60 ммоль) 70% водного этиламина в 20 мл 2 пропанола. После перемешивания при -78 С в течение 15 мин реакционной смеси давали нагреться до комнатной температуры и растворитель удаляли в вакууме. Остаток затем обрабатывали ЕtOАс и хроматографировали на диоксиде кремния, элюируя смесью гексан/ЕtOАс(d, C-6), 155,40 (s, C-4), 126,50 (s, C-5), 36,58 (t,CH2), 14,20 (q, СН 3). Анализ: рассчитано для C6H7CIN4O2: С, 35,57; Н, 3,48; N, 27,65. Обнаружено: С, 35,52; Н, 3,22; N, 27,57. Дальнейшее элюирование смесью гексан/ ЕtOАс (9:1) дало 0,43 г (7%) 4-хлор-2-(этиламино)5-нитропиримидина: т.пл. (изо-Рr2O) 122-123 С. К раствору 0,943 г (5 ммоль) 2-хлор-4(метиламино)-5-нитропиримидина в 25 мл ТГФ,имеющему комнатную температуру, добавляют раствор 1,96 г (11 ммоль) 4-(4-аминофенил)морфолина в 100 мл 2-пропанола и полученную смесь нагревают и перемешивают при 50 С в течение 30 мин. Данную смесь затем разбавляют водой, твердый осадок собирают, промывают водой и сушат, с получением 1,62 г (98%) соединения, указанного в заголовке: т.пл. К раствору 1,89 г (10 ммоль) 2-хлор-4-(метиламино)-5-нитропиримидина в 100 мл ТГФ при -78 С добавляют раствор 2,48 г (12 ммоль) 4-[2-(диэтиламино)этокси]анилина в 100 мл 2 пропанола и полученной смеси дают медленно нагреться до комнатной температуры. Осадок собирают, промывают 2-пропанолом и растворяют в воде. После фильтрования через целит водный раствор подщелачивают водным аммиаком и полученный осадок собирают, промывают водой и сушат с получением 2,88 г (80%) соединения,указанного в заголовке: т.пл. (ЕtOН) 163-164 С. К раствору 0,943 г (5 ммоль) 2-хлор-4-(метиламино)-5-нитропиримидина в 25 мл ТГФ,имеющему комнатную температуру, добавляют раствор 2,11 г (11 ммоль) 4-амино-N,N-диэтилбензамида в 100 мл 2-пропанола и полученную смесь нагревают с обратным холодильником с перемешиванием в течение 1 ч. Данную смесь затем разбавляют водой, твердый осадок собирают, промывают водой и сушат, с получением 1,50 г (87%) соединения, указанного в заголовке: т.пл. (ЕtOН) 213-215 С. 1 К раствору 1,21 г (5 ммоль) 2-хлор-4-(циклопентиламино)-5-нитропиримидина в 50 мл ТГФ, имеющему комнатную температуру, добавляют раствор 1,96 г (11 ммоль) 4-(4-аминофенил)морфолина в 100 мл 2-пропанола и полученную смесь нагревают с обратным холодильником в течение 30 мин. Данную смесь затем разбавляют водой, твердый осадок собирают,промывают водой и сушат, с получением 1,77 г К раствору 0,97 г (4 ммоль) 2-хлор-4-(циклопентиламино)-5-нитропиримидина в 50 мл ТГФ при -78 С добавляют раствор 0,91 г (4,8 ммоль) 1-(4-аминофенил)-4-метилпиперазина в 50 мл 2 пропанола и полученной смеси дают медленно нагреться до комнатной температуры. После подкисления уксусной кислотой растворители удаляют в вакууме и остаток растворяют в воде. После промывания ЕtOАс водный раствор подщелачивают водным аммиаком и продукт экстрагируют ЕtOАс и сушат, с получением 1,15 г(br t, J=4,8 Гц, 4 Н, CH2N), 2,44 (br t, J=4,9 Гц,4 Н, CH2N), 2,22 (s, 3 Н, СН 3), 2,09-2,00 (m, 2 Н,циклопентил), 1,78-1,56 (m, 6H, циклопентил). Анализ: рассчитано для C20H27N7O2: С, 60,44; Н, 6,85; N, 24,67. Обнаружено: С, 60,36; Н, 6,82; N, 24,58. Выпаривание растворителя из промывки ЕtOАс дало твердое вещество, которое идентифицировано как 4-[(циклопентил)амино]-2-4[4-[4-(циклопентиламино)-5-нитропиримидин 2-ил]пиперазин-1-ил]фенил]амино]-5-нитропиримидин: т.пл. (ЕtOАс) 244-246,5 С. 1 Смесь 0,64 г (3 ммоль) 2-хлор-4-(циклопентиламино)-5-нитропиримидина и 0,62 г (6,6 ммоль) 4-аминопиридина в 5 мл ДМСО (диметилсульфоксид) перемешивали при комнатной температуре в течение 15 мин. Раствор разбавляли водой и подщелачивали водным аммиаком с получением 0,41 г (44%) соединения, указанного в заголовке: т.пл. (ЕtOН) 219-221 С. 1 К раствору 1,013 г (5 ммоль) 2-хлор-4(этиламино)-5-нитропиримидина в 50 мл ТГФ при -78 С добавляют раствор 2,48 г (12 ммоль) 4-[2-(диэтиламино)этокси]анилина в 50 мл 2 пропанола и полученной смеси дают медленно нагреться до комнатной температуры. После удаления растворителя остаток растворяют в водной уксусной кислоте и фильтруют через целит. Водный раствор затем подщелачивают водным аммиаком и полученный осадок собирают, промывают водой и сушат, с получением 1,65 г (95%) соединения, указанного в заголовке: т.пл. (МеОН) 134-136 С. 1 К раствору 1,013 г (5 ммоль) 2-хлор-4(этиламино)-5-нитропиримидина в 25 мл ДМСО при комнатной температуре добавляют 1,04 г(11 ммоль) 4-аминопиридина и полученный раствор перемешивают при комнатной температуре в течение ночи. Разбавление водой и затем нейтрализация водным K2 СО 3 дали 0,72 г (55%) соединения, указанного в заголовке: т.пл. (МеОН) 235-236 С. 1 К раствору 0,73 г (3 ммоль) 2-хлор-4-(циклопентиламино)-5-нитропиримидина и 0,49 г (4 ммоль) N,N-диметиланилина в 10 мл ТГФ добавляют раствор 0,94 г (3,4 ммоль) 1-(трет-бутоксикарбонил)-4-(4-аминофенил)пиперазина в 20 мл 2-пропанола и полученную смесь нагревают с обратным холодильником в течение 2 ч. После охлаждения и подкисления уксусной кислотой данную смесь разбавляют водой с получением 1,37 г (94%) соединения, указанного в заголовке: т.пл. (МеОН) 194-196 С. 1(2 ммоль) N,N-диметиланилина в 10 мл ТГФ добавляют раствор 0,47 г (1,69 ммоль) 3-(трет 37 бутоксикарбониламино)-1-(4-аминофенил)пирролидина в 10 мл 2-пропанола и полученную смесь нагревают с обратным холодильником в течение 2 ч. После охлаждения и подкисления уксусной кислотой данную смесь разбавляют водой, с получением 0,82 г (100%) соединения,указанного в заголовке: т.пл. (МеОН) 186189 С. 1 Гидрирование 4-(метиламино)-2-[(4-морфолинофенил)амино]-5-нитропиримидина (из примера 2(1) выше) над палладием на угле Раствор 4,44 г (30 ммоль) 3,5-дихлорпиридина в 40 мл ТГФ добавляли по каплям в течение 30 мин к перемешанному раствору 23 мл(35 ммоль) 1,5 М ЛДА (лаурилдиэтаноламид) в 30 мл ТГФ при -78 С. Еще через 15 мин при-78 С добавляли раствор 6,13 г (42 ммоль) диэтилоксалата в 15 мл ТГФ и температуре медленно давали подняться до -20 С. Реакционную смесь затем гасили водным хлоридом аммония,растворитель удаляли и остаток обрабатывали в ЕtOАс. Хроматография на диоксиде кремния с элюированием смесью гексан/ЕtOАс (9:1) дала 2,4 г (32%) соединения, указанного в заголовке,в виде масла. 1 Раствор 5,20 г (25 ммоль) 3,5-дихлор-2,6 диметоксипиридина (J. Bratt, H. Suschitzky,J.C.S. Perkin I, 1983: 1689-1693) в 40 мл ТГФ добавляли по каплям в течение 30 мин к раствору 20 мл (30 ммоль) 1,5 М ЛДА (лития диизопропиламид) в 20 мл ТГФ при -78 С. Полученный раствор перемешивают при -78 С в течение 1 ч и затем добавляют 4,5 мл (33 ммоль) диэтилоксалата. Температуре медленно давали подняться до комнатной температуры, добавляли водный раствор хлорида аммония и растворитель удаляли в вакууме. Остаток экстрагировали в ЕtOАс и хроматографировали на SiO2, элюируя смесью гексан-ЕtOАс (9:1), с получением 5,97 г (78%) соединения, указанного в заголовке: т.пл. (гексан) 195-196 С. 1 Литификация 4,74 г (20 ммоль) 3,5-дибромпиридина ЛДА в соответствии с методикой,описанной в литературе (Y.G. Gu, Е.K. Bayburt,Tetrahedron Lett., 1996; 37:2565-2568), с последующим гашением диэтилоксалатом и хроматографией на диоксиде кремния с элюированием смесью гексан/ЕtOАс (5:1) дали 4,53 г (67%) соединения, указанного в заголовке. 1Liebigs Ann. Chem., 1955; 597: 153-157) в 100 мл ТГФ при -78 С добавляли 12,3 мл (21 ммоль) 1,7 М тpeт-BuLi в пентане и еще через 5 мин добавляли 4,4 г (30 ммоль) диэтилоксалата. После того, как данной смеси дали нагреться до-20 С, ее гасили водным NH4Cl и ТГФ удаляли в вакууме. Обработка ЕtOАс с последующей хроматографией на диоксиде кремния с элюированием смесью гексан/ЕtOАс (9:1) дали 3,38 гLeanna, Synthesis, 1988: 803-805) и 0,3 мл НОАс в 25 мл 2-метоксиэтанола нагревали с обратным холодильником в течение 16 ч, до того как растворитель удаляли в вакууме. Остаток экстрагировали в ЕtOАс и, после промывания водой,раствор сушили над Na2SO4. Удаление растворителя и хроматография на диоксиде кремния с элюированием смесью гексан/ЕtOАс в соотношении 3:2 дали 0,36 г (37%) соединения, указанного в заголовке (cоединение 2 в табл. 1 и 2): т.пл. (ЕtOН) 292-293 С. 1(br, 2 Н, Н-2',6'), 7,62 (br d, J=8,0 Гц, 2 Н, Н-3",5"),7,55 (dd, J=9,1; 6,9 Гц, 1H, Н-4"), 6,98 (d, J=9,0 Гц, 2 Н, Н-3',5'), 3,75 (br t, J=4,6 Гц, 4 Н, СН 2O),3,63 (s, 3 Н, CH3N), 3,09 (br t, J=4,7 Гц, 4 Н, СН 2N). Анализ: рассчитано для С 23 Н 20 Сl2N6O2: С, 57,15; Н, 4,17; N, 17,39. Обнаружено: С, 57,17; Н, 3,91; N, 17,37. 3. 6-(3,5-Дихлорпиридин-4-ил)-8-метил-24-(морфолин-4-ил)фенил]амино]-8 Н-птеридин 7-он. Смесь 0,30 г (1 ммоль) 5-амино-4-(метиламино)-2-4-(морфолин-4-ил)фенил]амино]пиримидина, 0,37 г (1,5 ммоль) этил-2-(3,5-дихлорпиридин-4-ил)-2-оксоацетата и 0,3 мл НОАс в 15 мл 2-метоксиэтанола нагревали с обратным холодильником в течение 16 ч и обрабатывали,как описано выше в подразделе 2. Хроматография на оксиде алюминия с элюированием смесью CH2Cl2/EtOAc (4:1) дала 85 мг (18%) соединения, указанного в заголовке (cоединение 12 в табл. 1 и 2): т.пл. (МеОН) 243-245 С. 1 44 Анализ: рассчитано для C22H19Cl2N7O20,25H2O: С, 54,05; Н, 4,02; N, 20,06. Обнаружено: С, 54,07; Н, 3,63; N, 19,93. 4. 6-(3,5-Дихлор-2,6-диметоксипиридин-4 ил)-8-метил-2-4-(морфолин-4-ил)фенил]амино]8 Н-птеридин-7-он. Смесь 0,60 г (2 ммоль) 5-амино-4-(метиламино)-2-4-(морфолин-4-ил)фенил]амино]пиримидина, 1,23 г (4 ммоль) этил-2-(3,5-дихлор 2,6-диметоксипиридин-4-ил)-2-оксоацетата и 1 мл НОАс в 20 мл 2-метоксиэтанола нагревали с обратным холодильником в течение 16 ч. Обработка ЕtOАс, с поcледующей хроматографией на кремнеземе с элюированием смесью гексанЕtOАс (3:2) дали 0,55 г (51%) соединения, указанного в заголовке (cоединение 18): т.пл.(br, 2 Н, Н-2',6'), 6,98 (d, J=8,9 Гц, 2 Н, Н-3',5'),4,07 (s, 6H, СН 3 О), 3,75 (br t, J=4,8 Гц, 4 Н,СН 2O), 3,62 (s, 3 Н, СН 3N), 3,09 (br t, J=4,7 Гц,4 Н, CH2N). Анализ: рассчитано для C24H23Cl2N7O4: С, 52,95; Н, 4,26; N, 18,01. Обнаружено: С, 52,78; Н, 4,13; N, 17,84. 5. 6-(3,5-Дибромпиридин-4-ил)-8-метил-24-(морфолин-4-ил)фенил]амино]-8 Н-птеридин 7-он. Смесь 0,30 г (1 ммоль) 5-амино-4-(метиламино)-2-4-(морфолин-4-ил)фенил]амино]пиримидина, 0,67 г (2 ммоль) этил-2-(3,5-дибромпиридин-4-ил)-2-оксоацетата (из получения 17) и 0,5 мл НОАс в 15 мл 2-метоксиэтанола нагревали с обратным холодильником в течение 18 ч. Обработка ЕtOАс с последующей хроматографией на диоксиде кремния с элюированием смесью CH2Cl2/EtOAc (4:1) дали 0,15 г (26%) соединения, указанного в заголовке (cоединение 19): т.пл. (ЕtOН) 204-206 С. 1H-ЯМР [(СD3)2SO]:10,40 (br, 1H, обмениваемый на D2 О, NH), 8,94 (s, 1 Н, Н-4), 8.92 (s,2 Н, Н-2",6"), 7,70 (br, 2 Н, Н-2',6'), 6,98 (d, J=8,7 Гц, 2 Н, Н-3',5'), 3,75 (br t, J=4,7 Гц, 4 Н, СН 2O),3,64 (s, 3 Н, СН 3N), 3,09 (br t, J=4,6 Гц, 4 Н,CH2N). Анализ: рассчитано для С 22 Н 19 Вr2N7O2: С, 46,10; Н, 3,34; N, 17,10. Обнаружено: С, 46,14; Н, 3,12; N, 17,09. 6. 2-4-[2-(Диэтиламино)этокси]фенил]амино]-8-метил-6-фенил-8 Н-птеридин-7-он. Смесь 0,165 г (0,5 ммоль) 5-амино-2-4-[2(диэтиламино)этокси]фенил]амино]-4-(метиламино)пиримидина, 0,1 г (0,6 ммоль) метилбензоилформиата и 0,2 мл НОАс в 10 мл ЕtOН нагревали с обратным холодильником в течение 20 ч. После удаления растворителя остаток обрабатывали водным раствором аммиака и экстраги 45 ровали ЕtOАс. Хроматография на оксиде алюминия с элюированием ЕtOАс дала 90 мг (40%) соединения, указанного в заголовке (cоединение 3): т.пл. (МеОН) 162-165 С. 1M.R. Leanna, Synthesis, 1988: 803-805) и 0,3 мл НОАс в 10 мл 2-метоксиэтанола нагревали с обратным холодильником в течение 18 ч. Реакционную смесь обрабатывали, как описано выше в подразделе 6, с получением 85 мг (33%) соединения, указанного в заголовке (cоединение 4): т.пл. (МеОН) 156-161 С. 1(br, 2 Н, Н-2',6'), 7,63 (br d, J=7,9 Гц, 2 Н, Н-3",5"),7,55 (dd, J=9,1; 7,0 Гц, 1H, Н-4"), 6,96 (d, J=8,9 Гц,2 Н, Н-3',5'), 4,01 (t, J=6,2 Гц, 2 Н, СН 2O), 3,63 (s,3 Н, СН 3N), 2,77 (t, J=6,2 Гц, 2 Н, CH2N), 2,55 (q,J=7,1 Гц, 4 Н, CH2N), 0,98 (t, J=7,0 Гц, 6 Н, СН 3). Анализ: рассчитано для С 25 Н 26 Сl2N6O2: С, 58,48; Н, 5,10; N, 16,37. Обнаружено: С, 58,67; Н, 5,04; N, 16,25. 8. 6-(3,5-Дихлорпиридин-4-ил)-8-метил-24-[2-(диэтиламино)этокси]фенил]амино]-8 Нптеридин-7-он. Смесь 0,465 г (1,4 ммоль) 5-амино-2-4-[2(диэтиламино)этокси]фенил]амино]-4-(метиламино)пиримидина, 0,69 г (2,8 ммоль) этил-2(3,5-дихлорпиридин-4-ил)-2-оксоацетата и 0,5 мл НОАс в 15 мл 2-метоксиэтанола нагревали с обратным холодильником в течение 18 ч и реакционную смесь обрабатывали, как описано выше в подразделе 6, с получением 0,11 г (15%) соединения, указанного в заголовке (cоединение 20): т.пл. (МеОН) 179-180,5 С. 1M.R. Leanna, Synthesis, 1988: 803-805) и 0,4 мл НОАс в 15 мл 2-метоксиэтанола нагревали с обратным холодильником в течение 16 ч. После удаления растворителя остаток обрабатывалиEtOAc и хроматографировали на диоксиде кремния, элюируя смесью CH2Cl2/EtOAc (4:1), с получением 0,25 г (50%) соединения, указанного в заголовке (cоединение 6): т.пл. (МеОН) 239-241 С.H-ЯМР [(CD3)2SO]:10,63 (br, 1H, обмениваемый на D2O, NH), 9,01 (s, 1 Н, Н-4), 7,91 (d,J=8,5 Гц, 2 Н, Н-2',6'), 7,64 (br d, J=8,0 Гц, 2 Н, Н 3",5"), 7,56 (dd, J=9,2; 6,9 Гц, 1H, Н-4"), 7,39 (d,J=8,6 Гц, 2 Н, Н-3',5'), 3,68 (s, 3 Н, СН 3N), 3,32 (m,4H, СН 2), 1,12 (br t, J=6,4 Гц, 6 Н, СН 3). Анализ: рассчитано для С 24 Н 22 Сl2N6O2: С, 57,96; Н, 4,46; N, 16,90. Обнаружено: С, 58,25; Н, 4,36; N, 16,97. 12. 6-(3,5-Дихлорпиридин-4-ил)-2-4-(диэтиламинокарбонил)фенил]амино]-8-метил-8 Нптеридин-7-он. Смесь 0,50 г (1,6 ммоль) 5-амино-2-4-(диэтиламинокарбонил)фенил]амино]-4-(метиламино)пиримидина, 0,8 г (3,2 ммоль) этил-2-(3,5-дихлорпиридин-4-ил)-2-оксоацетата и 0,5 мл НОАс в 20 мл 2-метоксиэтанола нагревали с обратным холодильником в течение 16 ч. Обработка ЕtOАс с последующей хроматографией на диоксиде кремния с элюированием смесью ЕtOАс/ гексан (3:2) дала 0,22 г (28%) соединения, указанного в заголовке (cоединение 13): т.пл. (изоРr2 О) 230-231 С. 1(m, 4H, СН 2), 1,12 (br t, J=6,1 Гц, 6 Н, СН 3). Анализ: рассчитано для C23H21Cl2N7O2: С, 55,43; Н, 4,25; N, 19,67. Обнаружено: С, 55,12; Н, 4,05; N, 19,44. 13. 6-(3,5-Дихлор-2,6-диметоксипиридин 4-ил)-2-4-(диэтиламинокарбонил)фенил]амино]8-метил-8 Н-птеридин-7-он. Смесь 0,47 г (1,5 ммоль) 5-амино-2-4-(диэтиламинокарбонил)фенил]амино]-4-(метиламино)пиримидина, 0,62 г (2 ммоль) этил-2-(3,5-дихлор-2,6-диметоксипиридин-4-ил)-2-оксоацетата и 1,0 мл НОАс в 20 мл 2-метоксиэтанола нагревали с обратным холодильником в течение 16 ч. Обработка EtOAc с последующей хроматографией на диоксиде кремния с элюированием смесью гексан/ЕtOАс (1:1) дали 0,42 г (56%) соединения, указанного в заголовке (cоединение 22): т.пл. (EtOH) 274-276C. 1 48 лата (F.J. Wolf, J. Weijlard, Org. Synth. Coll.,1963; 4: 124-125) и 0,5 мл НОАс в 10 мл EtOH нагревали с обратным холодильником в течение 12 ч. Удаление растворителя и разбавление водой дали неочищенный продукт, который хроматографировали на оксиде алюминия, элюируя смесью CH2Cl2/EtOAc (4:1), с получением 90 мгWeijlard, Org. Synth. Coll., 1963; 4: 124-125) и 0,5 мл НОАс в 15 мл ЕtOН нагревали с обратным холодильником в течение 14 ч и растворитель удаляли в вакууме. Остаток разбавляли водным раствором аммиака и экстрагировали в EtOAc. Хроматография на оксиде алюминия с элюированием смесью CH2Cl2/EtOAc (4:1) дала 0,26 гt, J=4,9 Гц, 4 Н, CH2N), 2,27-2,18 (m, 2H, циклопентил), 2,22 (s, 3H, СН 3), 1,94-1,74 (m, 4H, циклопентил), 1,64-1,52 (m, 2H, циклопентил). Анализ: рассчитано для C22H27N7O: С, 65,16; Н, 6,71; N, 24,18. Обнаружено: С, 65,02; Н. 6,96; N, 24,47. 18. 8-Циклопентил-6-метил-2-4-(4-метилпиперазин-1-ил)фенил]амино]-8 Н-птеридин-7-он. Смесь 0,367 г (1 ммоль) 5-амино-4-(циклопентиламино)-2-4-(4-метилпиперазин-1-ил)фенил]амино]пиримидина, 0,17 г (1,5 ммоль) 90% метилпирувата и 0,3 мл НОАс в 10 мл ЕtOН нагревали с обратным холодильником в течение 14 ч и растворитель удаляли в вакууме. Обработка остатка водным раствором аммиака дала твердое вещество, которое собирали и сушили с получением 0,39 г (93%) соединения, указанного в заголовке (cоединение 9): т.пл. (МеОН) 210-211 С. 1(F.J. Wolf, J. Weijlard, Оrg. Synth. Coll., 1963; 4: 124-125) и 0,5 мл НОАс в 15 мл ЕtOН нагревали с обратным холодильником в течение 14 ч. После удаления растворителя подщелоченный остаток обрабатывали ЕtOАс и хроматографировали на оксиде алюминия, элюируя ЕtOАс, с получением 90 мг (24%) соединения, указанного в заголовке (cоединение 11): т.пл. (МеОН) 236238 С. 1d, J=6,0 Гц, 2 Н, Н-3',5'), 5,73 (квинтет, J=8,8 Гц,1H, циклопентил СН), 2,31-2,21 (m, 2H, циклопентил), 2,04-1,93 (m, 2H, циклопентил), 1,931,81 (m, 2H, циклопентил), 1,71-1,59 (m, 2H,циклопентил). Анализ: рассчитано для C16H16N6O: С, 62,33; Н, 5,23; N, 27,27. Обнаружено: С, 62,38; Н, 5,21; N, 27,49. 21. 6-(3,5-Диметоксифенил)-8-этил-2-4-[2(диэтиламино)этокси]фенил]амино]-8H-птеридин 7-он. Смесь 0,96 г (2,8 ммоль) 5-амино-2-4-[2(диэтиламино)этокси]фенил]амино]-4-(этиламино)пиримидина, 0,83 г (35 ммоль) этил-2-(3,5 диметоксифенил)-2-оксоацетата (из примера 4(2 и 1 мл уксусной кислоты в 25 мл ЕtOН нагревали с обратным холодильником в течение 14 ч и растворитель удаляли в вакууме. Остаток затем растворяли в воде и промывали ЕtOАс. Водный слой делали щелочным с помощью водного аммиака, а неочищенный продукт экст 51 рагировали в свежий ЕtOАс. Хроматография на оксиде алюминия с элюированием смесью гексана и ЕtOАс (1:1) дала затем 0,81 г (56%) соединения, указанного в заголовке (cоединение 14): т.пл. (МеОН) 154-155 С. 1d, J=8,6 Гц, 2H, Н-2',6'), 7,42 (d, J=2,3 Гц, 2H, Н 2",6"), 6,94 (d, J=9,1 Гц, 2H, Н-3',5'), 6,63 (t, J=2,3 Гц,1H, Н-4"), 4,32 (q, J=7,0 Гц, 2H, CH2N), 4,00 (t,J=6,2 Гц, 2H, CH2O), 3,80 (s, 6H, СН 3 О), 2,76 (t,J=6,2 Гц, 2H, CH2N), 2,55 (q, J=7,1 Гц, 4 Н, СН 2N),1,30 (t, J=7,0 Гц, 3 Н, СН 3), 0,98 (t, J=7,0 Гц, 6H,СН 3). Анализ: рассчитано для С 28 Н 34 СlN6O4: С, 64,85; Н, 6,61; N, 16,21. Обнаружено: С, 64,78; Н, 6,63; N, 16,39. 22. 6-(3,5-Диметоксифенил)-8-этил-2-[(пиридин-4-ил)амино]-8 Н-птеридин-7-он. Смесь 0,46 г (2 ммоль) 5-амино-4-(этиламино)-2-[(пиридин-4-ил)амино]пиримидина,0,71 г (3 ммоль) этил-2-(3,5-диметоксифенил)-2 оксоацетата и 1 мл уксусной кислоты нагревали с обратным холодильником в течение 16 ч и охлаждали. Полученный осадок собирали, промывали МеОН и сушили с получением 0,38 г Смесь 0,82 г (1,8 ммоль) 5-амино-2-4-[4(трет-бутоксикарбонил)пиперазин-1-ил]фенил] амино]-4-(циклопентиламино)пиримидина (из получения 14 А), 0,52 г (4 ммоль) бутилглиоксилата (F.J. Wolf, J. Weijlard, Org. Synth. Coll.,1963; 4: 124-125) и 0,5 мл НОАс в 15 мл EtOH нагревали с обратным холодильником в течение 14 ч и растворитель удаляли в вакууме. Остаток разбавляли водным раствором аммиака и экстрагировали в ЕtOАс. Хроматография на диокси 005287t, J=5,0 Гц, 4 Н, CH2N), 2,28-2,18 (m, 2H, циклопентил), 1,94-1,74 (m, 4H, циклопентил), 1,641,53 (m, 2H, циклопентил), 1,42 (s, 9H, СН 3). Анализ: рассчитано для С 26 Н 33N7O3: С, 63,53; Н, 6,77; N, 19,94. Обнаружено: С, 63,55; Н, 6,90; N, 19,82. б) Раствор 0,15 г (0,3 ммоль) 2-4-[4-(третбутоксикарбонил)пиперазин-1-ил]фенил]амино]8-циклопентил-8H-птеридин-7-она в 10 мл СН 2 Сl2 обрабатывали 1 мл трифторуксусной кислоты и данную смесь перемешивали при комнатной температуре в течение 3 ч. После удаления растворителя в вакууме остаток растирали с водным аммиаком с получением 0,112 г Смесь 0,70 г (1,5 ммоль) 5-амино-2-4-[3(трет-бутоксикарбониламино)пирролидин-1-ил] фенил]амино]-4-(циклопентиламино)пиримидина, 0,52 г (4 ммоль) бутилглиоксилата (F.J. Wolf,J. Weijlard, Org. Synth. Coll., 1963; 4: 124-125) и 0,5 мл НОАс в 15 мл EtOH нагревали с обратным холодильником в течение 14 ч и растворитель удаляли в вакууме. Остаток разбавляли водным раствором аммиака и экстрагировали вEtOAc. Хроматография на диоксиде кремния с элюированием смесью гексан/ЕtOАс (3:2) дала 0,21 г (28%) соединения, указанного в заголовке(s, 1H, Н-6), 7,44 (dd, J=8,8; 3,4 Гц, 2 Н, Н-2',6'),7,17 (br d, J=6,5 Гц, 1H, обмениваемый на D2O,3 Н), 6,51 (d, J=8,9 Гц, 2 Н, Н-3',5'), 5,63 (m, 1H,циклопентил, CHN), 4,13 (m, 1H, пирролидинил,CHN), 3,45 (m, 1H, пирролидинил), 3,34 (m, 1H,пирролидинил), 3,22 (m, 1H, пирролидинил),3,03 (m, 1H, пирролидинил), 2,28-2,19 (m, 2H,циклопентил), 2,16 (m, 1H, пирролидинил), 1,931,73 (m, 5H, (m, 1H, пирролидинил и циклопентил), 1,63-1,52 (m, 2H, циклопентил), 1,40 (s, 9H,СН 3). Анализ: рассчитано для C26H33N7O3: С, 63,53; Н, 6,77; N, 19,94. Обнаружено: С, 63,54; Н, 6,74; N, 19,82. б) Раствор 0,14 г (0,28 ммоль) 2-4-[3(тpeт-бутоксикарбониламино)пирролидин-1-ил] фенил]амино]-8-циклопентил-8H-птеридин-7 она (из примера 23) в 10 мл CH2Cl2 обрабатывали 1 мл трифторуксусной кислоты и полученную смесь перемешивали при комнатной температуре в течение 3 ч. После удаления растворителя остаток растирали с водным аммиаком с получением 0,11 г (100%) соединения, указанного в заголовке (cоединение 17): т.пл. (МеОН(m, 2H, циклопентил), 2,07 (m, 1H, пирролидинил), 1,98-1,66 (m, 7H, NH2, пирролидинил и циклопентил), 1,63-1,52 (m, 2H, циклопентил). Анализ: рассчитано для C21H25N7O0,66H2O: С, 62,51; Н, 6,58; N, 24,30. Обнаружено: С, 62,41; Н, 6,55; N, 24,33. Дополнительное соединение, полученное аналогичным образом, представляет собой следующее: 6-(2,6-дихлор-3-гидроксифенил)-8-метил 2-(4-морфолин-4-ил-фениламино)-8 Н-птеридин 7-он (соединение 62). Пример 6. Фармацевтическая полезность птеридинов по данному изобретению установлена с помощью следующих анализов ингибирования киназ. 1. Анализ Wee1 OY. Данные киназные анализы осуществляли в 96-луночных фильтровальных планшетах (Millipore,Cat. MADPN0B50) в 50 мкл буфера для киназ 005287 54 ного анализа (50 мМ Трис, рН 8,0,10 мМ NaCl,10 мМ MgCl2,10 мкМ АТФ с 0,25 мкКи) [r32 Р]АТФ, 1 мМ ДТТ (дитиотреитол с 0,1 мкг очищенной усеченной с N-конца Wee1 и 6 мкг поли(Orn, Туr) 4:1 (Sigma, P4534). Анализ начинали с добавления АТФ и инкубации при комнатной температуре в течение 20 мин при интенсивном перемешивани. Реакции останавливали путем добавления 50 мкл охлажденной на льду 20% ТХУ (трихлоруксусная кислота) с 0,1 М пирофосфатом натрия и интенсивного перемешивания полученной смеси в течение 1 мин. Планшет затем инкубировали при 4 С в течение 1 ч, чтобы дать белку выпасть в осадок. Эти планшеты затем 5 раз промывали, на промывку использовали 200 мкл охлажденной на льду 10% ТХУ и 0,1 М пирофосфатa натрия. Затем в каждую лунку добавляли 25 мкл сцинтилляционной жидкости и производили подсчет на планшете в счетчике Wallac's MicroBeta 1450. Результаты для нескольких птеридинов по изобретению показаны в табл. 2. 2. Анализ циклинзависимой киназы 4(CDK4). Ферментные анализы для определения ИК 50 (табл. 1) и оценку кинетики осуществляли в 96-луночных фильтровальных планшетах(трис[гидроксиметил]аминометан) в конечной концентрации 20 мМ, при рН 7,4, 50 мМ NaCl,1 мМ дитиотреитола, 10 мМ MgCl2, 25 мкМ АТФ, содержащего 0,25 мкКи [32 Р]AТФ, 20 нг комплекса сdk4/циклинD1, 1 мкг ретинобластомы и соответствующие разведения соединения по настоящему изобретению. Все компоненты,за исключением АТФ, добавляли в лунки и планшет помещали на мешалку для планшетов на 2 мин. Реакцию начинали с добавления[32 Р]АТФ и планшет инкубировали при 25 С в течение 15 мин. Реакцию останавливали добавлением 0,1 мл 20% ТХУ. Планшет выдерживали при 4 С в течение по меньшей мере 1 ч, чтобы дать субстрату выпасть в осадок. Лунки затем 5 раз промывали 0,2 мл 10% ТХУ и определяли включение 32P с помощью бета-счетчика для планшетов (Wallac Inc., Gaithersburg, Maryland). 3. Анализы тирозинкиназ рецепторовPDGF и FGF. Полноразмерные кДНК для тирозинкиназ рецепторов мышиного PDGF- и человеческогоFGF-1 (flg) были получены от J. Escobedo и приготовлены, как описано в J. Biol. Chem., 1991; 262: 1482-1487. Были сконструированы праймеры для ПЦР, чтобы амплифицировать фрагмент ДНК, который кодирует внутриклеточный тирозинкиназный домен. Этот фрагмент инсерцировали в бакуловирусный вектор, трансфицировали совместно AcMNPV ДНК и рекомбинантный вирус выделили. Клетки насекомых SF9 были инфицированы этим вирусом для сверхэкспрессии белка, и клеточный лизат использовали для 55 анализа. Анализы осуществляли в 96-луночных планшетах (100 мкл/инкубация/лунка) и условия оптимизировали для измерения включения 32P из 32 Р-АТФ в глутаматтирозинсополимерный субстрат. Кратко, в каждую лунку добавляли 82,5 мкл инкубационного буфера, содержащего 25 мМ Hepes (рН 7,0), 150 мМ NaCl, 0,1% Тритон Х-100, 0,2 мМ ФМСФ (фенилметилсульфонилфторид), 0,2 мМ Nа 3VO4, 10 мМ МnСl2 и 750 мкг/мл поли(4:1)глутаматтирозина, за чем следовало 2,5 мкл ингибитора и 5 мкл ферментного лизата (7,5 мкг/мкл FGF-TK или 6,0 мкг/мклPDGF-TK) для инициации реакции. После 10 мин инкубации при 25 С в каждую лунку добавляли 10 мл 32 Р-АТФ (0,4 мкКи плюс 50 мкМ АТФ) и образцы инкубировали в течение дополнительных 10 мин при 25 С. Реакцию останавливали добавлением 100 мкл 30% ТХУ, содержащей 20 мМ пирофосфата натрия, и осаждением материала на поверхность из стекловолокна (Wallac). Фильтры 3 раза промывали 15% ТХУ, содержащей 100 мМ пирофосфата натрия, и радиоактивность, удержанную на фильтрах, считали в ридере Wallac 1250 Betaplate. Неспецифическую активность определяли как радиоактивность,удержанную на фильтрах после инкубации образцов с одним буфером (без фермента). Специфическую ферментативную активность (фермент плюс буфер) определяли как общую активность за вычетом неспецифической активности. Концентрацию соединения, которая ингибировала специфическую активность на 50%,(ИК 50) определяли, основываясь на кривой ингибирования. 4. Анализы с-src киназы.C-src киназу очищали от лизатов клеток насекомых, инфицированных бакуловирусом, с использованием антипептидного моноклонального антитела, направленного против N-концевых аминокислот (аминокислоты 2-17) c-src. Антитело, ковалентно связанное с 0,65 мкм латексными шариками, добавляли к суспензии буфера для лизиса клеток насекомых, содержащего 150 мМ NaCl, 50 мМ Tris pH 7,5, 1 мМ ДТТ,1% NP-40, 2 мМ ЭГТК (этиленгликольтетрауксусная кислота), 1 мМ ванадата натрия, 1 мМ ФМСФ, 1 мкг/мл каждого из леупептина, пепстатина и апротинина. Лизат клеток насекомых,содержащий белок c-src, инкубировали с этими шариками в течение 3-4 ч при 4 С при вращении. В конце инкубации лизата шарики промывали 3 раза буфером для лизиса, ресуспендировали в буфере для лизиса, содержащем 10% глицерина, и замораживали. Эти латексные шарики размораживали, промывали 3 раза в буфере для анализа (40 мМ Tris, pH 7,5, 5 мМ MgCl2) и суспендировали в этом же буфере. В 96 луночный планшет Millipore с дном из 0,65 мкм поливинилидиновой мембраны добавляли компоненты реакции: 10 мкл C-src - шариков, 10 мкл 2,5 мг/мл поли-GluТуr-субстрата, 5 мкМ 56 АТФ, содержащего 0,2 мкКи меченого 32 Р-АТФ,5 мкл ДМСО, содержащего ингибиторы, или в качестве контрольного растворителя и буфер для доведения конечного объема до 125 мкл. Реакцию начинали при комнатной температуре добавлением АТФ и гасили через 10 мин добавлением 125 мкл 30% ТХУ с 0,1 М пирофосфата натрия в течение 5 мин на льду. Планшет затем фильтровали и лунки промывали двумя аликвотами по 250 мл 15% ТХУ с 0,1 М пирофосфата. Фильтры затем выталкивали, делали подсчет в жидкостном сцинтилляционном счетчике и данные изучали на предмет ингибирующей активности по сравнению с известным ингибитором, таким как эрбстатин. Этот способ также описан в J. Med. Chem., 1994; 37: 598-609. 5. Анализы циклинзависимых киназ(сdk2/циклинЕ, сdk2/циклинА, сdc2/циклин В). Ферментные анализы для определения ИК 50 и оценки кинетики осуществляли в 96 луночных фильтровальных планшетах (MilliporeMADVN6550) в общем объеме 0,1 мл, содержащем 20 мМ TRIS, pH 7,4, 50 мМ NaCl, 1 мМ дитиотрейтола, 10 мМ МgСl2, 12 мкМ АТФ,содержащего 0,25 мкКи [32 Р]-АТФ, 20 нг фермента (либо сdk2/циклин Е, сdk2/циклин А, либо сdс 2/циклин В), 1 мкг ретинобластомы и соответствующие разведения определенного соединения по настоящему изобретению. Все компоненты, за исключением АТФ, добавляли в лунки и планшет на 2 мин помещали на мешалку для планшетов. Реакцию начинали добавлением [32 Р]AТФ и планшет инкубировали при 25 С в течение 15 мин. Реакцию останавливали добавлением 0,1 мл 20% ТХУ. Планшет выдерживали при 4 С в течение по меньшей мере 1 ч,чтобы дать субстрату выпасть в осадок. Лунки затем 5 раз промывали 0,2 мл 10% ТХУ и включение 32 Р определяли с помощью бета-счетчика для планшетов (Wallac Inc., Gaithersburg, Maryland). Некоторые из соединений по изобретению проявляли хорошую ингибирующую активность при оценке в вышеупомянутых анализах, что проиллюстрировано данными в табл. 2. В таблице столбцы имеют следующие значения:FGF обозначает полноразмерную киназу рецептора фактора роста фибробластов;PDGF обозначает киназу тромбоцитарного фактора роста;CDK4D обозначает комплекс циклинзависимая киназа 4/циклин D1;CDK2A обозначает комплекс циклинзависимая киназа 2/циклин А;CDK1 В обозначает комплекс циклинзависимая киназа 1/циклин В;CDK2E обозначает комплекс циклинзависимая киназа 2/циклин Е; ИК 50 обозначает концентрацию тестируемого соединения, в микромолях, которая ингибирует активность указанной киназы на 50%. Следующие примеры далее иллюстрируют типовые фармацевтические препараты, предложенные в соответствии с данным изобретении. Пример 7. Приготовление фармацевтических композиций. 1. Фармацевтический препарат в форме твердых желатиновых капсул для перорального введения готовят, используя следующие ингредиенты. Активное соединение Порошок крахмала Стеарат магния Всего Вышеуказанные ингредиенты смешивают и загружают в твердые желатиновые капсулы в количестве по 460 мг. Обычный активный ингредиент представляет собой 6-(3,4-диэтоксифенил)-2-[4-(2-диэтиламиноэтокси)фениламино]8-н-бутил-8 Н-птеридин-7-он. Композицию вводят от 2 до 4 раз в сутки для лечения послеоперационного рестеноза. 2. Препарат в виде пероральной суспензии. Ингредиент Кол-во 8-втор-Бутил-2-фениламино 8 Н-6-(2,3-дифторфенил)-7-он 500 мг Раствор сорбита (70% N.F.) 40 мл Бензоат натрия 150 мг Сахарин 10 мг Вишневый корригент 50 мг Дистиллированная вода 58 Раствор сорбита добавляют к 40 мл дистиллированной воды и в нем суспендируют нафтиридин. Сахарин, бензоат натрия и корригент добавляют и растворяют. Объем доводят до 100 мл дистиллированной водой. Каждый миллилитр сиропа содержит 5 мг активного ингредиента. Суспензия хорошо подходит для перорального лечения и предупреждения атеросклероза. 3. Таблетки, содержащие 60 мг активного ингредиента каждая. Кол-во, мг Активный ингредиент 60 Крахмал 45 Микрокристаллическая целлюлоза 35 Поливинилпирролидон(в виде 10% раствора в воде) 4 Натрийкарбоксиметилкрахмал 4,5 Стеарат магния 0,5 Тальк 1,0 Всего 150 Активные ингредиенты, крахмал и целлюлозу, пропускают через сито 45 меш (США) и тщательно перемешивают. Раствор поливинилпирролидона смешивают с полученным порошковым продуктом и затем пропускают через сито 14 меш (США). Гранулы высушивают при 50-60 С и пропускают через сито 18 меш(США). Натрийкарбоксиметилкрахмал, стеарат магния и тальк, предварительно пропущенные через сито 60 меш (США), затем добавляют к гранулам и все это после перемешивания прессуют на таблеточной машине с получением таблеток, каждая из которых весит 150 мг. Обычным активным ингредиентом, используемым в вышеуказанном препарате, является соединение примера 6(7). Препарат хорошо подходит для предупреждения и лечения псориаза. 4. Парентеральную композицию, подходящую для введения путем инъекции, готовят путем растворения 100 мг 6-пиридин-2-ил-8-(1-этилпропил)-2-[4-(4-метилпиперазин-1-ил)фениламино]-8 Н-птеридин-7-она в 250 мл 0,9% водного раствора хлорида натрия и доведения рН раствора до примерно 7. Данный препарат хорошо подходит для лечения рака, например рака молочной железы, лейкемии, рака простаты, карцином мочевого пузыря, рака ободочной и прямой кишки и мелкоклеточной карциномы легкого. 5. Препарат в виде суппозиториев. Смесь 500 мг гидрохлорида 2-(3-метил-4 фторфенил)амино-8-циклогексил-8 Н-птеридин 7-она и 1500 мг какао-масла смешивают до однородности при 60 С. Смесь охлаждают до 24 С в конических формах. Каждый суппозиторий должен весить примерно 2 г, и его можно вводить от 1 до 2 раз каждые сутки для лечения воспалительного заболевания кишечника. 59 6. Препарат для местного применения. Ингредиент Кол-во, мг 8-Метил-2-(4-метоксифенилами 20 но)-6-фенил-8 Н-птеридин-7-он Пропиленгликоль 100 Белый петролатум 500 Цетеариловый спирт 50 Глицерилстеарат 100 Стеарат ПЭГ 100 100 Цетеф-20 50 Одноосновный фосфат натрия 80 Всего 1000 Вышеуказанные ингредиенты смешивают до однородности, получая крем, и применяют местно для лечения меланомы. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы и его фармацевтически приемлемые соли,эфиры, амиды и пролекарства, где(СН 2)nарил и (СН 2)nгетероарил, где каждая из вышеупомянутых арильных и гетероарильных групп может быть не замещена или замещена 1-5 группами-заместителями, выбранными из(и) карбоциклической группы, содержащей от 3 до 7 кольцевых членов, один или два из которых могут представлять собой гетероатом,выбранный из О или N, и причем эта карбоциклическая группа может быть замещена 1, 2 или 3 группами-заместителями, выбранными из(а) одинаковыми или разными и независимо представляют собой водород, C1-С 10 алкил,C1-С 10 алкокси, амино, аминоалкокси, гидрокси,моно- или диалкиламино, моно- или диалкиламиноалкокси;(б) одинаковыми или разными и независимо представляют собой (СН 2)nарил или (СH2)n гетероарил, где каждый арил и гетероарил не замещен или замещен группами в количестве вплоть до 5, выбранными из галогена, гидрокси,C1-С 10 алкила, C1-С 10 алкокси, амино, моно- или диалкиламино;n представляет собой 0; и где алкильная составляющая в указанных радикалах содержит от 1 до 10 углеродных атомов; арил означает ароматическую карбоциклическую группу, имеющую единственное кольцо,множественные кольца или множественные конденсированные кольца, из которых по меньшей мере одно является ароматическим; гетероарил означает одну или более чем одну ароматическую кольцевую систему из 5, 6 или 7 членов, содержащую по меньшей мере 1 и вплоть до 4 гетероатомов, выбранных из азота,кислорода или серы; карбоциклическая группа означает неароматическое циклическое кольцо или конденсированные кольца, имеющие от 3 до 7 кольцевых углеродных членов. 2. Соединение формулы и его фармацевтически приемлемые соли,эфиры, амиды и пролекарства, где(СН 2)nарил и (СН 2)nгетероарил, где каждая из вышеупомянутых арильных и гетероарильных групп может быть не замещена или замещена 1-5 группами-заместителями, выбранными из
МПК / Метки
МПК: C07D 475/00, A61P 35/00, A61K 31/505
Метки: качестве, птеридиноны, ингибиторов, киназ
Код ссылки
<a href="https://eas.patents.su/30-5287-pteridinony-v-kachestve-ingibitorov-kinaz.html" rel="bookmark" title="База патентов Евразийского Союза">Птеридиноны в качестве ингибиторов киназ</a>
Предыдущий патент: Способ работы компьютерной системы для осуществления дискретного субструктурного анализа
Следующий патент: Производные диазепинкарбоксамида, способ их получения, их применение в качестве лекарственных средств, фармацевтические композиции и их применение
Случайный патент: Пиперидин - 2, 6 - дионовые памоатные соли и их использование для лечения связанных со стрессом аффективных расстройств