Производные алкинилсодержащих гидроксамовых кислот и их применение в качестве ингибиторов tace
Номер патента: 4883
Опубликовано: 26.08.2004
Авторы: Коул Дерек Сесил, Левин Джереми Ян, Чен Джеймс Минг, Гросу Джордж Теодор, Дэвис Джэми Мэри, Венкатесан Аранапакам Мудумбаи
Формула / Реферат
1. Соединение формулы I
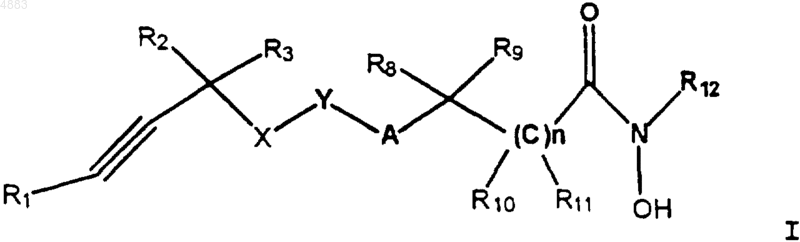
где R1 означает алкил с 1-6 атомами углерода;
каждый из R2 и R3 означает водород;
R8 означает водород; алкил с 1-10 атомами углерода, который может быть замещен циано; арил(низший)алкил, который может быть замещен пиперидинил(низшим)алкокси; гетероарил(низший)алкил; циклоалкил с 3-6 атомами углерода; арил; 5-7-членный гетероциклил, содержащий гетероатомы, выбранные из NH, NR7, O, S, SO или SO2, где R7 означает водород, низший ацил, низший ацилокси, (низший)алкоксифенил или бензоил; или радикал формулы
R4-(CH2)k-C(O)NH-(CH2)l-
или
R4-(CH2)k-C(O)NH-CH2-C(O)NH-(CH2)l-,
где R4 означает фенил, необязательно замещенный галогеном или фенетилом; дифенилметил; фталоиламидо; гетероарил или ксантенил;
k равно 0-3, и
l равно 0-6,
R9 означает водород или галогензамещенный фенил;
A означает O, S, SO, SO2 или CH2;
X означает O;
Y означает фенил;
при условии, что A и X не присоединены к соседним атомам Y и
n равно 0-2;
каждый из R10, R11 и R12 означает водород;
где низший алкил представляет собой прямой или разветвленный алкил с 1-6 атомами углерода;
арил означает фенильные или нафтильные кольца, которые могут быть необязательно моно- или дизамещены низшим алкокси, галогеном или тиенилом;
гетероарил представляет собой 5-10-членное моно или бициклическое кольцо, содержащее от 1 до 3 гетероатомов, выбранных из N, O или S;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, выбранное из группы, включающей
2-[4-(бут-2-инилокси)фенилсульфонил]-N-гидрокси-2-метил-3-пиридин-3-илпропионамид;
2-[4-(бут-2-инилокси)фенилтио]-N-гидроксипропионамид;
2-[4-(бут-2-инилокси)фенилсульфонил]-N-гидрокси-2-метил-3-[4-(2-пиперидин-1-илэтокси)фенил]пропионамид;
3-бифенил-4-ил-2-[4-(бут-2-инилокси)фенилсульфонил]-N-гидрокси-2-метилпропионамид;
гидроксамид 2-[4-(бут-2-инилокси)фенилтио]октановой кислоты;
гидроксамид 2-[4-(бут-2-инилокси)фенилсульфонил]октановой кислоты;
(S)-2-(R)-[4-(бут-2-инилокси)фенилсульфинил]-N-гидроксиоктанамид;
(S)-2-(S)-[4-(бут-2-инилокси)фенилсульфинил]-N-гидроксиоктанамид;
3-[4-(бут-2-инилокси)фенокси]-N-гидроксипропионамид;
4-[4-(бут-2-инилокси)фенокси]-N-гидроксибутирамид;
2-[4-(бут-2-инилокси)фенокси]-N-гидроксиацетамид;
4-[4-(бут-2-инилокси)фенил]-N-гидроксибутирамид;
[5-[4-(бут-2-инилокси)фенилтио]-5-гидроксикарбамоилпентил]амид хинолин-2-карбоновой кислоты;
гидроксиамид 2-[4-(бут-2-инилокси)фенилтио]-6-[2-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)ацетиламино]гексановой кислоты;
N-[5-[4-(бут-2-инилокси)фенилтио]-5-гидроксикарбамоилпентил]-2-фенетилбензамид;
гидроксиамид 2-[4-(бут-2-инилокси)фенилтио]-6-[2-(3,4-дихлорфенил)ацетиламино]гексановой кислоты;
[5-[4-(бут-2-инилокси)фенилтио]-5-гидроксикарбамоилпентил]амид хинолин-3-карбоновой кислоты;
гидроксиамид 2-[4-(бут-2-инилокси)фенилтио]-6-(4-тиофен-2-илбутириламино)гексановой кислоты;
[5-[4-(бут-2-инилокси)фенилтио]-5-гидроксикарбамоилпентил]амид 9H-ксантен-9-карбоновой кислоты;
гидроксиамид 2-[4-(бут-2-инилокси)фенилтио]-6-дифенилацетиламиногексановой кислоты;
[5-[4-(бут-2-инилокси)фенилтио]-5-гидроксикарбамоилпентил]амид изохинолин-1-карбоновой кислоты;
гидроксиамид 6-(2-бензо[b]тиофен-3-илацетиламино)-2-[4-(бут-2-инилокси)фенилтио]гексановой кислоты;
[5-[4-(бут-2-инилокси)фенилсульфинил]-5-гидроксикарбамоилпентил]амид хинолин-2-карбоновой кислоты;
гидроксиамид 2-[4-(бут-2-инилокси)фенилсульфинил]-6-[2-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)ацетиламино]гексановой кислоты;
N-[5-[4-(бут-2-инилокси)фенилсульфинил]-5-гидроксикарбамоилпентил]-2-фенетилбензамид;
гидроксиамид 2-[4-(бут-2-инилокси)фенилсульфинил]-6-[2-(3,4-дихлорфенил)ацетиламино]гексановой кислоты;
[5-[4-(бут-2-инилокси)фенилсульфинил]-5-гидроксикарбамоилпентил]амид хинолин-3-карбоновой кислоты;
гидроксиамид 2-[4-(бут-2-инилокси)фенилсульфинил]-6-(4-тиофен-2-илбутириламино)гексановой кислоты;
[5-[4-(бут-2-инилокси)фенилсульфинил]-5-гидроксикарбамоилпентил]амид 9H-ксантен-9-карбоновой кислоты;
гидроксиамид 2-[4-(бут-2-инилокси)фенилсульфинил]-6-дифенилацетиламиногексановой кислоты;
[5-[4-(бут-2-инилокси)фенилсульфинил]-5-гидроксикарбамоилпентил]амид изохинолин-1-карбоновой кислоты;
гидроксиамид 6-(2-бензо[b]тиофен-3-илацетиламино)-2-[4-(бут-2-инилокси)фенилсульфинил]гексановой кислоты;
гидроксиамид 2-[4-(бут-2-инилокси)фенилсульфинил]-6-(2-1H-индол-3-илацетиламино)гексановой кислоты;
[5-[4-(бут-2-инилокси)фенилсульфонил]-5-гидроксикарбамоилпентил]амид хинолин-2-карбоновой кислоты;
гидроксиамид 2-[4-(бут-2-инилокси)фенилсульфонил]-6-[2-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)ацетиламино]гексановой кислоты;
N-[5-[4-(бут-2-инилокси)фенилсульфонил]-5-гидроксикарбамоилпентил]-2-фенетилбензамид;
гидроксиамид 2-[4-(бут-2-инилокси)фенилсульфонил]-6-[2-(3,4-дихлорфенил)ацетиламино]гексановой кислоты;
[5-[4-(бут-2-инилокси)фенилсульфонил]-5-гидроксикарбамоилпентил]амид хинолин-3-карбоновой кислоты;
[5-[4-(бут-2-инилокси)фенилсульфонил]-5-гидроксикарбамоилпентил]амид 9H-ксантен-9-карбоновой кислоты;
гидроксиамид 2-[4-(бут-2-инилокси)фенилсульфонил]-6-дифенилацетиламиногексановой кислоты;
[5-[4-(бут-2-инилокси)фенилсульфонил]-5-гидроксикарбамоилпентил]амид изохинолин-1-карбоновой кислоты;
гидроксиамид 6-(2-бензо[b]тиофен-3-илацетиламино)-2-[4-(бут-2-инилокси)фенилсульфонил]гексановой кислоты;
{[5-[4-(бут-2-инилокси)фенилтио]-5-гидроксикарбамоилпентилкарбамоил]метил}амид хинолин-2-карбоновой кислоты;
гидроксиамид 2-[4-(бут-2-инилокси)фенилтио]-6-{2-[2-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)ацетиламино]ацетиламино}гексановой кислоты;
N-{[5-[4-(бут-2-инилокси)фенилтио]-5-гидроксикарбамоилпентилкарбамоил]метил}-2-фенетилбензамид;
гидроксиамид 2-[4-(бут-2-инилокси)фенилтио]-6-{2-[2-(3,4-дихлорфенил)ацетиламино]ацетиламино}гексановой кислоты;
{[5-[4-(бут-2-инилокси)фенилтио]-5-гидроксикарбамоилпентилкарбамоил]метил}амид хинолин-3-карбоновой кислоты;
{[5-[4-(бут-2-инилокси)фенилтио]-5-гидроксикарбамоилпентилкарбамоил]метил}амид 9H-ксантен-9-карбоновой кислоты;
гидроксиамид 2-[4-(бут-2-инилокси)фенилтио]-6-(2-дифенилацетиламиноацетиламино)гексановой кислоты;
{[5-[4-(бут-2-инилокси)фенилтио]-5-гидроксикарбамоилпентилкарбамоил]метил}амид изохинолин-1-карбоновой кислоты;
{[5-[4-(бут-2-инилокси)фенилтио]-5-гидроксикарбамоилпентилкарбамоил]метил}амид 1-метил-1H-пиррол-2-карбоновой кислоты;
гидроксиамид 6-[2-(2-бензо[b]тиофен-3-илацетиламино)ацетиламино]-2-[4-(бут-2-инилокси)фенилтио]гексановой кислоты;
{[5-[4-(бут-2-инилокси)фенилсульфинил]-5-гидроксикарбамоилпентилкарбамоил]метил}амид хинолин-2-карбоновой кислоты;
гидроксиамид 2-[4-(бут-2-инилокси)фенилсульфинил]-6-{2-[2-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)ацетиламино]ацетиламино}гексановой кислоты;
N-{[5-[4-(бут-2-инилокси)фенилсульфинил]-5-гидроксикарбамоилпентилкарбамоил]метил}-2-фенетилбензамид;
гидроксиамид 2-[4-(бут-2-инилокси)фенилсульфинил]-6-{2-[2-(3,4-дихлорфенил)ацетиламино]ацетиламино}гексановой кислоты;
{[5-[4-(бут-2-инилокси)фенилсульфинил]-5-гидроксикарбамоилпентилкарбамоил]метил}амид хинолин-3-карбоновой кислоты;
гидроксиамид 2-[4-(бут-2-инилокси)фенилсульфинил]-6-[2-(4-тиофен-2-илбутириламино)ацетиламино]гексановой кислоты;
{[5-[4-(бут-2-инилокси)фенилсульфинил]-5-гидроксикарбамоилпентилкарбамоил]метил}амид 9H-ксантен-9-карбоновой кислоты;
гидроксиаьшф 2-[4-(бут-2-инилокси)фенилсульфинил]-6-(2-дифенилацетиламиноацетиламино)гексановой кислоты;
{[5-[4-(бут-2-инилокси)фенилсульфинил]-5-гидроксикарбамоилпентилкарбамоил]метил}амид 1-метил-1H-пиррол-2-карбоновой кислоты;
гидроксиамид 2-[4-(бут-2-инилокси)фенилсульфонил]-6-{2-[2-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)ацетиламино]ацетиламино}гексановой кислоты;
N-{[5-[4-(бут-2-инилокси)фенилсульфонил]-5-гидроксикарбамоилпентилкарбамоил]метил}-2-фенетилбензамид;
гидроксиамид 2-[4-(бут-2-инилокси)фенилсульфонил]-6-{2-[2-(3,4-дихлорфенил)ацетиламино]ацетиламино}гексановой кислоты;
{[5-[4-(бут-2-инилокси)фенилсульфонил]-5-гидроксикарбамоилпентилкарбамоил]метил}амид хинолин-3-карбоновой кислоты;
{[5-[4-(бут-2-инилокси)фенилсульфонил]-5-гидроксикарбамоилпентилкарбамоил]метил}амид 9H-ксантен-9-карбоновой кислоты;
гидроксиамид 2-[4-(бут-2-инилокси)фенилсульфонил]-6-(2-дифенилацетиламиноацетиламино)гексановой кислоты;
{[5-[4-(бут-2-инилокси)фенилсульфонил]-5-гидроксикарбамоилпентилкарбамоил]метил}амид изохинолин-1-карбоновой кислоты;
гидроксиамид 6-[2-(2-бензо[b]тиофен-3-илацетиламино)ацетиламино]-2-[4-(бут-2-инилокси)фенилсульфонил]гексановой кислоты;
гидроксиамид 2-[4-(бут-2-инилокси)фенилсульфонил]-6-[2-(2-1H-индол-3-илацетиламино)ацетиламино]гексановой кислоты;
2-{[4-(бут-2-инилокси)фенил]сульфонил}-N-гидрокси-4-{4-[2-(1-пиперидинил)этокси]нил}бутанамид;
2-{[4-(бут-2-инилокси)фенил]сульфонил}-7-циано-N-гидроксигептанамид;
2-{[4-(бут-2-инилокси)фенил]тио}-2-циклогексил-N-гидроксиацетамид;
2-{[4-(бут-2-инилокси)фенил]сульфинил}-2-циклогексил-N-гидроксиацетамид;
2-{[4-(бут-2-инилокси)фенил]сульфонил}-2-циклогексил-N-гидроксиацетамид;
2-{[4-(бут-2-инилокси)фенил]тио}-N-гидрокси-2-(4-метоксифенил)ацетамид;
(2R)-2-{[4-(бут-2-инилокси)фенил]сульфинил}-N-гидрокси-2-(4-метоксифенил)этанамид;
(2S)-2-{[4-(бут-2-инилокси)фенил]сульфинил}-N-гидрокси-2-(4-метоксифенил)этанамид;
2-{[4-(бут-2-инилокси)фенил]сульфонил}-N-гидрокси-2-(4-метоксифенил)ацетамид;
2-{[4-(бут-2-инилокси)фенил]тио}-2-(4-хлорфенил)-N-гидроксиацетамид;
2-{[4-(бут-2-инилокси)фенил]сульфинил}-2-(4-хлорфенил)-N-гидроксиацетамид;
2-{[4-(бут-2-инилокси)фенил]сульфонил}-2-(4-хлорфенил)-N-гидроксиацетамид;
2-{[4-(бут-2-инилокси)фенил]тио}-2-(3-хлорфенил)-N-гидроксиацетамид;
2-{[4-(бут-2-инилокси)фенил]сульфонил}-2-(3-хлорфенил)-N-гидроксиацетамид;
2-(4-бромфенил)-2-{[4-(бут-2-инилокси)фенил]тио}-N-гидроксиацетамид;
(2S)-2-(4-бромфенил)-2-{[4-(бут-2-инилокси)фенил]сульфинил}-N-гидроксиацетамид;
(2R)-2-(4-бромфенил)-2-{[4-(бут-2-инилокси)фенил]сульфинил}-N-гидроксиацетамид;
2-(4-бромфенил)-2-{[4-(бут-2-инилокси)фенил]сульфонил}-N-гидроксиацетамид;
2-{[4-(бут-2-инилокси)фенил]тио}-N-гидрокси-2-[4-(2-тиенил)фенил]ацетамид;
(2R)-2-{[4-(бут-2-инилокси)фенил]сульфинил}-N-гидрокси-2-[4-(2-тиенил)фенил]этанамид;
2-{[4-(бут-2-инилокси)фенил]сульфонил}-N-гидрокси-2-[4-(2-тиенил)фенил]ацетамид;
2-{[4-(бут-2-инилокси)фенил]тио}-N-гидрокси-2-(1-нафтил)ацетамид;
2-{[4-(бут-2-инилокси)фенил]сульфинил}-N-гидрокси-2-(1-нафтил)ацетамид;
2-{[4-(бут-2-инилокси)фенил]сульфонил}-N-гидрокси-2-(1-нафтил)ацетамид;
2-{[4-(бут-2-инилокси)фенил]тио}-2-(4-фторфенил)-N-гидрокси-2-(1-нафтил)ацетамид;
2-{[4-(бут-2-инилокси)фенил]сульфинил}-2-(4-фторфенил)-N-гидроксиацетамид;
2-{[4-(бут-2-инилокси)фенил]сульфонил}-2-(4-фторфенил)-N-гидроксиацетамид;
2-(2-метоксифенил)-2-{[4-(бут-2-инилокси)фенил]тио}-N-гидроксиацетамид;
2-(2-метоксифенил)-2-{[4-(бут-2-инилокси)фенил]сульфинил}-N-гидроксиацетамид;
2-{[4-(бут-2-инилокси)фенил]тио}-N-гидрокси-2-(4-этоксифенил)ацетамид;
2-{[4-(бут-2-инилокси)фенил]сульфинил}-N-гидрокси-2-(4-этоксифенил)ацетамид;
2-{[4-(бут-2-инилокси)фенил]сульфонил}-2-(4-хлорфенил)-N-гидроксиацетамид;
2-([4-(бут-2-инилокси)фенил]тио}-N-гидрокси-2-(3-бромфенил)ацетамид;
(2R)-2-{[4-(бут-2-инилокси)фенил]сульфинил}-N-гидрокси-2-(3-бромфенил)ацетамид;
(2S)-2-{[4-(бут-2-инилокси)фенил]сульфинил}-N-гидрокси-2-(3-бромфенил)ацетамид;
2-{[4-(бут-2-инилокси)фенил]сульфонил}-2-(3-бромфенил)-N-гидроксиацетамид;
2-{[4-(бут-2-инилокси)фенил]тио}-2-изопропил-N-гидроксиацетамид;
R-2-{[4-(бут-2-инилокси)фенил]сульфинил}-2-изопропил-N-гидроксиацетамид;
S-2-{[4-(бут-2-инилокси)фенил]сульфинил}-2-изопропил-N-гидроксиацетамид;
2-{[4-(бут-2-инилокси)фенил]сульфонил}-2-изопропил-N-гидроксиацетамид;
2-{[4-(бут-2-инилокси)фенил]тио}-2-фенил-N-гидроксиацетамид;
R-2-{[4-(бут-2-инилокси)фенил]сульфинил}-2-фенил-N-гидроксиацетамид;
S-2-{[4-(бут-2-инилокси)фенил]сульфинил}-2-фенил-N-гидроксиацетамид;
2-{[4-(бут-2-инилокси)фенил]тио}-2-(2-нафтил)-N-гидроксиацетамид;
2-{[4-(бут-2-инилокси)фенил]сульфинил}-2-(2-нафтил)-N-гидроксиацетамид;
2-{[4-(бут-2-инилокси)фенил]сульфенил}-2-(2-нафтил)-N-гидроксиацетамид;
трет-бутил-4-[1-{[4-(бут-2-инилокси)фенил]сульфонил}-2-(гидроксиамино)-2-оксоэтил]-1-пиперидинкарбоксилат;
2-{[4-(бут-2-инилокси)фенил]сульфонил}-N-гидрокси-2-(4-пиперидинил)ацетамид;
2-{[4-(бут-2-инилокси)фенил]сульфонил}-N-гидрокси-2-[1-(4-метоксибензил)-4-пиперидинил]ацетамид;
2-(1-бензоил-4-пиперидинил)-2-{[4-(бут-2-инилокси)фенил]сульфонил}-N-гидроксиацетамид;
2-(1-ацетил-4-пиперидинил)-2-{[4-(бут-2-инилокси)фенил]сульфонил}-N-гидроксиацетамид;
2-{[4-(бут-2-инилокси)фенил]сульфонил}-N-гидрокси-2-тетрагидро-2H-пиран-4-илацетамид;
2-{[4-(бут-2-инилокси)фенил]сульфонил}-N-гидрокси-2-тетрагидро-2H-тиопиран-4-илацетамид;
2-{[4-(бут-2-инилокси)фенил]сульфонил}-N-гидрокси-2-(1-оксидотетрагидро-2H-тиопиран-4-ил)ацетамид;
2-{[4-(бут-2-инилокси)фенил]сульфонил}-N-гидрокси-2-(1,1-диоксидотетрагидро-2H-тиопиран-4-ил)ацетамид.
3. Способ ингибирования патологических изменений, опосредованных ФНО-a-конвертирующим ферментом (TACE), у млекопитающего, при необходимости этого, который включает введение указанному млекопитающему терапевтически эффективного количества соединения в соответствии с п.1 или его фармацевтически приемлемой соли.
4. Способ по п.3, в котором подлежащее лечению заболевание представляет собой ревматоидный артрит, отторжение трансплантата, кахексию, воспаление, лихорадку, инсулиннезависимый сахарный диабет, септический шок, хроническую сердечную недостаточность, воспалительное заболевание центральной нервной системы, воспалительное заболевание кишечника или ВИЧ-инфицирование.
5. Фармацевтическая композиция, содержащая в качестве активного ингредиента соединение по п.1. формулы
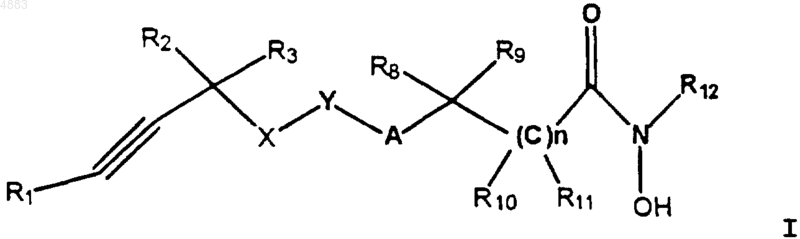
где R1 означает алкил с 1-6 атомами углерода;
каждый из R2 и R3 означает водород;
R8 означает водород; алкил с 1-10 атомами углерода, который может быть замещен циано; арил(низший)алкил, который может быть замещен пиперидинил(низшим)алкокси; гетероарил(низший)алкил; циклоалкил с 3-6 атомами углерода; арил; 5-7-членный гетероциклил, содержащий гетероатомы, выбранные из NH, NR7, O, S, SO или SO2, где R7 означает водород, низший ацил, низший ацилокси, (низший)алкоксифенил или бензоил; или радикал формулы
R4-(CH2)k-C(O)NH-(CH2)l-
или
R4-(CH2)k-C(O)NH-CH2-C(O)NH-(CH2)l-,
где R4 означает фенил, необязательно замещенный галогеном или фенетилом; дифенилметил; фталоиламидо; гетероарил или ксантенил;
k равно 0-3 и
l равно 0-6,
R9 означает водород или галогензамещенный фенил;
A означает O, S, SO, SO2 или CH2;
X означает O;
Y означает фенил;
при условии, что A и X не присоединены к соседэшь атомам Y, и
n равно 0-2;
каждый из R10, R11 и R12 означает водород;
где низший алкил представляет собой прямой или разветвленный алкил с 1-6 атомами углерода;
арил означает фенильные или нафтильные кольца, которые могут быть необязательно моно- или дизамещены низшим алкокси, галогеном или тиенилом;
гетероарил представляет собой 5-10-членное моно- или бициклическое кольцо, содержащее от 1 до 3 гетероатомов, выбранных из N, O или S;
или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
6. Способ получения соединения формулы I по п.1, заключающийся в том, что осуществляют взаимодействие между соединением формулы
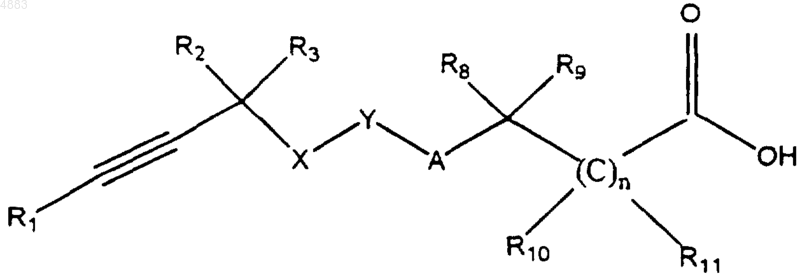
где n, X, Y, A, R1, R2, R3, R8, R9, R10 и R11 имеют значения, указанные в п.1, или его реакционноспособным производным и соединением формулы
R12NHOH,
где R12 имеет значения, указанные в п.1, с получением соединения формулы I, которое выделяют, или осуществляют
разделение смеси (например, рацемата) оптически активных изомеров соединения формулы I для отделения одного энантиомера или диастереомера от другого энантиомера или диастереомера
или
подкисление основного соединения формулы I фармацевтически приемлемой кислотой с получением фармацевтически приемлемой соли.
7. Способ получения соединения формулы I по п.1, заключающийся в том, что осуществляют удаление защитных групп у соединения формулы
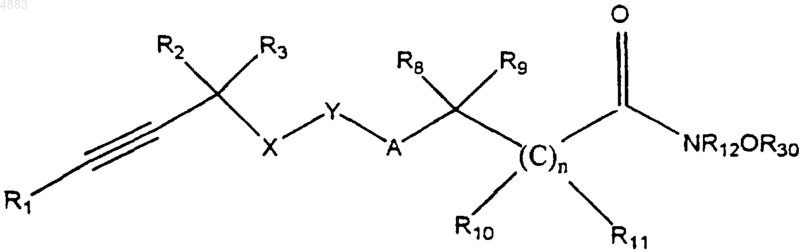
где n, X, Y, A, R1, R2, R3, R8, R9, R10, R11 и R12 имеют значения, указанные в п.1, и R30 означает приемлемую защитную группу, такую как трет-бутил, бензил и триалкилсилил, с получением соответствующего соединения формулы I, которое выделяют, или осуществляют
разделение смеси (например, рацемата) оптически активных изомеров соединения формулы I для отделения одного энантиомера или диастереомера от другого энантиомера или диастереомера
или
подкисление основного соединения формулы I фармацевтически приемлемой кислотой с получением фармацевтически приемлемой соли.
8. Способ получения соединения формулы I по п.1, заключающийся в том, что осуществляют отщепление от полимерного носителя производного гидроксамата, содержащего группу
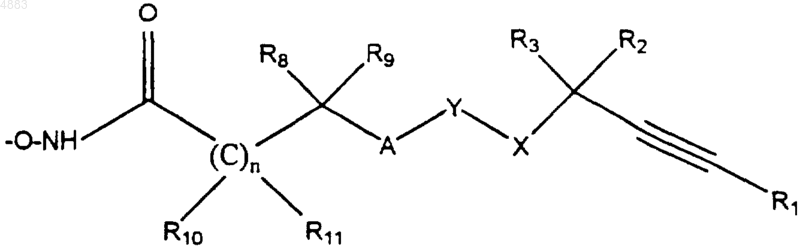
где n, X, Y, A, R1, R2, R3, R8, R9, R10 и R11 имеют значения, указанные в п.1, с получением соединения формулы I, в котором R12 означает водород, которое выделяют, или осуществляют
или разделение смеси (например, рацемата) оптически активных изомеров соединения формулы I для отделения одного энантиомера или диастереомера от другого энантиомера или диастереомера
или подкисление основного соединения формулы I фармацевтически приемлемой кислотой с получением фармацевтически приемлемой соли.
Текст
1 Область техники Данное изобретение относится к ацетиленовым гидроксамовым кислотам, которые являются ингибиторами ФНОконвертирующего фермента (ТАСЕ). Соединения по настоящему изобретению могут использоваться для лечения заболеваний, опосредованных ФНО-,таких как ревматоидный артрит, остеоартрит,сепсис, СПИД, неспецифический язвенный колит, рассеянный склероз, болезнь Крона и дегенеративное разрежение хряща. Предпосылки изобретения Матриксные металлопротеиназы (ММР) образуют группу ферментов, которые участвуют в патологическом разрушении соединительной ткани и базальных мембран. Указанные цинксодержащие эндопептидазы включают несколько подклассов ферментов, в том числе коллагеназы, стромелизины и желатиназы. Установлено,что из указанных классов ферментов желатиназы, являющиеся ММР, имеют непосредственное отношение к росту и распространению опухолей. Известно, что желатиназа в большей степени экспрессирована в злокачественных опухолях, при этом она способна разрушать базальные мембраны, что ведет к образованию метастазов опухоли. Недавно было установлено, что желатиназа является одним из компонентов ангиогенеза, необходимого для роста твердых опухолей. Кроме того, существуют данные,подтверждающие, что желатиназа участвует в разрушении бляшек в случае атеросклероза. Другими заболеваниями, опосредованными ММР,являются рестеноз,ММРопосредованные нарушения остеогенеза, воспалительные заболевания центральной нервной системы, старение кожи, рост опухоли, остеоартрит, ревматоидный артрит, септический артрит, изъязвление роговицы, патологические раны, заболевание костей, протеинурия, аневризма аорты, дегенеративное разрежение хряща вследствие травматического поражения сустава,демиелинизирующие заболевания нервной системы, цирроз печени, гломерулярное заболевание почки, преждевременное разрушение оболочки плода, воспалительное заболевание кишечника, периодонтит, возрастная дегенерация пятна роговицы, диабетическая ретинопатия,пролиферативная витреоретинопатия, юношеская ретинопатия, воспаление глаза, кератоконус, синдром Шегрена, миопия, опухоли глаза,ангиогенез/неоваскуляризация глаза и отторжение роговичного трансплантата. Для ознакомления с недавно опубликованными материалами см.Opin. Ther. Patents (1998) 8(3): 281-259. ФНОконвертирующий фермент (ТАСЕ) катализирует образование ФНО- из мембраносвязанного белка предшественника ФНО-. ФНО- является провоспалительным цитокином, который, как известно, имеет непосредственное отношение к возникновению таких заболеваний, как ревматоидный артрит [Shire, M.G.;Moldawer, L.L. Arch. Surg. 1998, 133, 558], застойная сердечная недостаточность [Packer, M.Bachetti, Т.; et al. Circulation, 1995, 92(6), 1479],постишемическая повторная перфузия, воспалительное заболевание центральной нервной системы, воспалительное заболевание кишечника,инсулиннезависимый сахарный диабет [Hotamisligil, G.S.; Sgargill, N.S.; Spiegelman, B.M.;Lopez-Soriano, F.J. Argiles, J.M. Med. Res. Reviews,1995, 15(6), 533, помимо того, что он обладает хорошо известными противоопухолевыми свойствами [Old, L. Science, 1985, 230, 630]. Например, исследования с использованием антител против-ФНО- и трансгенных животных позволили установить, что блокирование образования ФНО- подавляет развитие артрита [Rankin,E.C.; Choy, E.H.; Kassimos, D.; Kingsley, G.H.;Pheumatol. 1995, 34, 334; Pharmaprojects, 1996,Therapeutic Updates 17 (Oct.), au197-M2Z]. Аналогичные данные были недавно получены в исследованиях с участием человека, как это описано в статье "ФНО- in Human Diseases", Current Pharmaceutical Design, 1996, 2, 662. Предполагается, что низкомолекулярные ингибиторы ТАСЕ должны быть пригодны для лечения разных заболеваний. Хотя известен целый ряд ингибиторов ТАСЕ, многие такие молекулы имеют пептидную и пептидоподобную структуру, для которой характерны проблемы,связанные с биологической доступностью и фармакокинетикой. Кроме того, многие из указанных молекул не обладают избирательным действием, являясь сильнодействующими ингибиторами матриксных металлопротеиназ, и в частности ММР-1. Как известно, ингибирование ММР-1 (коллагеназа 1) вызывает боли в суста 3 вах во время клинических испытаний ингибиторов ММР [Scrip, 1998, 2349, 20]. Поэтому для лечения вышеуказанных заболеваний желательно иметь длительно действующие, избирательные, обладающие биологической доступностью при пероральном введении, непептидные ингибиторы ТАСЕ. Описаны ингибиторы ММР на основе сульфонгидроксамовых кислот общей формулы I[Burgess, L.E.; Rizzi, J.P.; Rawson, D.J., заявка на европейский патент 818442. Groneberg, R.D.;Neuenschwander, K.W.; Djuric, S.W.; McGeehan,G.M.; Burns, C.J.; Condon, S.M.; Morrissette,M.M.; Salvino, J.M.; Scotese, А.С.; Ullrich, J.W.,международная заявка на патент РСТ WO 97/24117. Bender, S.L.; Broka, С.A.; Campbell,J.A.; Castelhano, A.L.; Fisher, L.E.; Hendricks,R.T.; Sarma, К., заявка на европейский патент 780386. Venkatesan, A.M.; Grosu, G.T.; Davis,J.M.; Нu, В.; O'Dell, M.J., международная заявка на патент РСТ WO 98/38163]. Примером ингибитора ММР данного класса является нижеследующее соединение RS-130830. В классе ингибиторов ММР на основе сульфонгидроксамовых кислот линкер, связывающий сульфон и гидроксамовую кислоту,увеличен до трех атомов углерода (I, n=2) без существенного ухудшения эффективностиGetman, D.P.; McDonald, J.J., международная заявка на патент РСТ WO 98/39316. McDonald,J.J.; Barta, Т.Е.; Becker, D.P.; Bedell, L.J.; Rao,S.N.; Freskos, J.N.; Mischke, B.V., международная заявка на патент РСТ WO 98/38859. Описаны пиперидинсульфонгидроксамовые кислоты, II (n=1) [Becker, D.P.; Villamil, C.I.;Boehm, T.L.; Getman, D.P.; McDonald, J.J.; DeCrescenzo, G.A., международная заявка на патент РСТ WO 98/39315]. Описаны подобные пиперидиновые производные, в которых отсутствует метилен, связывающий пиперидиновое кольцо с сульфоном (II, n=0) [Venkatesan, A.M.;Grosu, G.T.; Davis, J.M.; Baker, J.L., международная заявка на патент РСТ WO 98/37877].III, в которых гидроксильная группа находится в альфа-положении относительно гидроксамовой кислоты [Freskos, J.N.; Boehm, T.L.; Mischke,B.V.; Heintz, R.M.; McDonald, J.J.; DeCrescenzo,G.A.; Howard, S.C., международная заявка на патент РСТ WO 98/39326. Robinson, R.P., международная заявка на патент РСТ WO 98/34915]. Описаны ингибиторы ММР на основе сульфона общей формулы IV, в которых использован тиол в качестве цинкового хелатообразователя [Frescos, J.N.; Abbas, Z.S.; DeCrescenzo, G.A.; Getman, D.P.; Heintz, R.M.; Mischke,B.V.; McDonald, J.J., международная заявка на патент РСТ WO 98/03164]. Описаны ингибиторы стромелизина общей формулы V [Shuker, S.B.; Hajduk, P.J.; Meadows,R.P.; Fesik, S.W. Science 1996, 274, 1531-1534,Hajduk, P.J.; Sheppard, G.; Nettesheim, D.G.;Holms, J.H., международная заявка на патент РСТ WO 97/18188].Salah et al., Liebigs Ann. Chem. 195, (1973) описывают некоторые производные арилзамещенных, тио- и арилзамещенных сульфонилацетогидроксамовых кислот общей формулы 1. Указанные соединения получают по реакции Манниха. Полученные соединения испытаны на фунгицидную активность. Некоторые сульфонкарбоновые кислоты описаны в патенте США 4933367. Установлено, что указанные соединения обладают гипогликемической активностью. Подробное описание изобретения Настоящее изобретение относится к новым низкомолекулярным непептидным ингибиторам матриксных металлопротеиназ (ММР) и ФНО-конвертирующего фермента (ТАСЕ), предназначенным для лечения артрита, опухолевых метастазов, изъязвления тканей, патологических ран, периодонтита, заболевания костей, сахарного диабета (инсулиннезависимого) и ВИЧ-инфицирования. Данное изобретение относится к соединениям общей формулы I где R1 означает водород, арил, гетероарил, алкил с 1-6 атомами углерода, алкенил с 2-6 атомами углерода, алкинил с 2-6 атомами углерода,циклоалкил с 3-6 атомами углерода или С 5-С 8 циклогетероалкил, содержащий 1-2 гетероатома,выбранных из N, NR7, S и О;R7 означает водород, арил, аралкил, алкил с 1-6 атомами углерода или циклоалкил с 3-6 атомами углерода, окси, C1-C8-алканоил,COOR5, COR5, -SО 2-С 1-С 8-алкил, -SО 2-арил,-SО 2-гетероарил, -CO-NHR1;Y означает арил или гетероарил, при условии,что А и Х не присоединены к смежным атомам Y; иn равно 0-2; или к их фармацевтически приемлемой соли. В некоторых предпочтительных вариантах осуществления настоящего изобретения Y означает фенил, пиридил, тиенил, фуранил, имидазолил, триазолил и тиадиазолил. Более предпочтительными соединениями по настоящему изобретению являются соединения формулы I, в которой R2 и R3, каждый независимо,означают водород или алкил с 1-6 атомами углерода; R12 означает водород и Y означает фенил. Наиболее предпочтительными соединениями, ингибирующими матриксную металлопротеиназу и ТАСЕ, по данному изобретению являются 2-[4-(бут-2-инилокси)фенилсульфонил]-Nгидрокси-2-метил-3-пиридин-3-илпропионамид; 2-[4-(бут-2-инилокси)фенилтио]-N-гидроксипропионамид; 2-[4-(бут-2-инилокси)фенилсульфонил]-Nгидрокси-2-метил-3-[4-(2-пиперидин-1-илэтокси)фенил]пропионамид; 3-бифенил-4-ил-2-[4-(бут-2-инилокси)фенилсульфонил]-N-гидрокси-2-метилпропионамид; гидроксамид 2-[4-(бут-2-инилокси)фенилтио]октановой кислоты; гидроксамид 2-(бут-2-инилоксибензолсульфонил)октановой кислоты; 2-(R)-[4-(бут-2-инилокси)фенилсульфинил]N-гидроксиоктанамид; 2-(S)-[4-(бут-2-инилокси)фенилсульфинил]N-гидроксиоктанамид; 3-[4-(бут-2-инилокси)фенокси]-N-гидроксипропионамид; 4-[4-(бут-2-инилокси)фенокси]-N-гидроксибутирамид; 2-[4-(бут-2-инилокси)фенокси]-N-гидроксиацетамид; 4-[4-(бут-2-инилокси)фенил]-N-гидроксибутирамид; 11 2-[4-(бут-2-инилокси)фенил]тио-2-(2 нафтил)-N-гидроксиацетамид; 2-[4-(бут-2-инилокси)фенил]сульфинил 2-(2-нафтил)-N-гидроксиацетамид; 2-[4-(бут-2-инилокси)фенил]сульфонил 2-(2-нафтил)-N-гидроксиацетамид; трет-бутил-4-[1-[4-(бут-2-инилокси)фенил] сульфонил-2-(гидроксиамино)-2-оксоэтил]-1 пиперидинкарбоксилат; 2-[4-(бут-2-инилокси)фенил]сульфонилN-гидрокси-2-(4-пиперидинил)ацетамид; 2-[4-(бут-2-инилокси)фенил]сульфонилN-гидрокси-2-[1-(4-метоксибензил)-4-пиперидинил]ацетамид; 2-(1-бензоил-4-пиперидинил)-2-[4-(бут-2 инилокси)фенил]сульфонил-N-гидроксиацетамид; 2-(1-ацетил-4-пиперидинил)-2-[4-(бут-2 инилокси)фенил]сульфонил-N-гидроксиацетамид; 2-[4-(бут-2-инилокси)фенил]сульфонил-Nгидрокси-2-тетрагидро-2 Н-пиран-4-илацетамид; 2-[4-(бут-2-инилокси)фенил]сульфонил-Nгидрокси-2-тетрагидро-2 Н-тиопиран-4-илацетамид; 2-[4-(бут-2-инилокси)фенил]сульфонилN-гидрокси-2-(1-оксидотетрагидро-2 Н-тиопиран 4-ил)ацетамид; и 2-[4-(бут-2-инилокси)фенил]сульфонилN-гидрокси-2-(1,1-диоксидотетрагидро-2 Н-тиопиран-4-ил)ацетамид. Гетероарил в используемом здесь значении означает 5-10-членное моно- или бициклическое кольцо, имеющее 1-3 гетероатома, выбранных из N, NR7, S и О. Гетероарил предпочтительно имеет нижеследующие структуры: где K означает О, S или -NR7 и R7 имеют указанные выше значения. Предпочтительными гетероарильными кольцами являются пиррол,фуран, тиофен, пиридин, пиримидин, пиридазин, пиразин, триазол, пиразол, имидазол, изотиазол, тиазол, изоксазол, оксазол, индол, изоиндол, бензофуран, бензотиофен, хинолин, изохинолин, хиноксалин, хиназолин, бензотриазол,индазол, бензимидазол, бензотиазол, бензизоксазол и бензоксазол. Гетероарильные группы по настоящему изобретению могут быть моно- или дизамещенными. где K означает О, S или -NR7 и R7 имеют указанные выше значения. Предпочтительными гетероциклоалкильными кольцами являются пиперидин, пиперазин, морфолин, тетрагидропиран, тетрагидрофуран или пирролидин. Гетероциклоалкильные группы по настоящему изобретению могут быть необязательно моно- или дизамещены. Арил в используемом здесь значении означает фенильные или нафтильные ароматические кольца, которые могут быть необязательно моно- или дизамещены. Алкил, алкенил, алкинил и перфторалкил могут иметь прямую и разветвленную цепь. Алкильные, алкенильные, алкинильные и циклоалкильные группы могут быть незамещены (атомы углерода присоединены к водороду или другим атомам углерода в цепи или кольце) или могут быть моно- или полизамещены. Низший алкил является C1-C6-алкилом. Аралкил в используемом здесь значении означает замещенную алкильную группу, алкиларил, где алкил является низшим алкилом предпочтительно с 1-3 атомами углерода и арил имеет вышеуказанные значения. Гетероаралкил в используемом здесь значении означает замещенную алкильную группу,алкилгетероарил, где алкил является низшим алкилом предпочтительно с 1-3 атомами углерода и гетероарил имеет вышеуказанные значения. Галоген означает бром, хлор, фтор и иод. Приемлемыми заместителями арила, аралкила, гетероарила, гетероаралкила, алкила, алкенила, алкинила, циклоалкила являются, но не ограничиваются ими, галоген, алкил с 1-6 атомами углерода; алкенил с 2-6 атомами углерода; алкинил с 2-6 атомами углерода, циклоалкил с 3-6 атомами углерода, -OR5, -CN, -COR5, перфторалкил с 1-4 атомами углерода, -O-перфторалкил с 1-4 атомами углерода, -CONR5R6,-S(O)nR5, -OPO(OR5)OR6, -PO(OR5)R6, -ОС(О)OR5,-OR5NR5R6, -OC(O)NR5R6, -С(O)NR5OR6, -COOR5,-SО 3 Н, -NR5R6, -N[(CH2)2]2NR5, NR5COR6,-NR5COOR6, -SO2NR5R6, -NО 2, -N(R5)SO2R6,-NR5CONR5R6, -NR5C(=NR6)NR5R6, -NR5C(=NR6)N(SO2)R5R6, -NR5C(=NR6)N(C=OR5)R6, -тетразол 5-ил, -SO2NHCN, -SO2NHCONR5R6, фенил, гетероарил или -С 5-С 8-циклогетероалкил; где -NR5R6 может образовывать пирролидиновое, пиперидиновое, морфолиновое, тиоморфо 13 линовое, оксазолидиновое, тиазолидиновое,пиразолидиновое, пиперазиновое или азетидиновое кольцо;R7 означает водород, арил, гетероарил, алкил с 1-6 атомами углерода или циклоалкил с 36 атомами углерода; и n равно 0-2. Когда любая часть содержит несколько заместителей с одинаковым значением, все заместители могут быть одинаковыми или разными. Фармацевтически приемлемые соли можно получить из органических и неорганических кислот, таких как, например, уксусная, пропионовая, молочная, лимонная, винная, янтарная,фумаровая, малеиновая, малоновая, миндальная,яблочная, фталевая, хлористо-водородная, бромисто-водородная, фосфорная, азотная, серная,метансульфоновая, нафталинсульфоновая, бензолсульфоновая, толуолсульфоновая, камфорсульфоновая и подобные известные приемлемые кислоты, когда соединение по данному изобретению содержит основную часть. Соли можно также получить из органических и неорганических оснований, предпочтительно соли щелочных металлов, например, натрия, лития или калия, когда соединение по данному изобретению содержит кислотную часть. Соединения по настоящему изобретению могут содержать асимметричный атом углерода,и некоторые соединения по данному изобретению могут иметь один или несколько асимметричных центров, благодаря чему можно получить оптические изомеры и диастереомеры. Хотя настоящее изобретение описано без обращения к стереохимии, в его объем входят такие оптические изомеры и диастереомеры, а также рацемические и разделенные, энантиомерно чистые R- и S-стереоизомеры, другие смеси R- иS-стереоизомеров и их фармацевтически приемлемые соли. Известно, что один оптический изомер, включая диастереомер и энантиомер,или стереоизомер может обладать более полезными свойствами по сравнению с другим. Таким образом, при рассмотрении данного изобретения в описании изобретения и формуле изобретения, когда описана одна рацемическая смесь, понятно, что в объем изобретения входят как другие оптические изомеры, включая диастереомеры и энантиомеры, так и, по существу,индивидуальные стереоизомеры. Установлено, что соединения по данному изобретению ингибируют ферменты ММР-1,ММР-9, ММР-13 и ФНОконвертирующий фермент (ТАСЕ), и поэтому их можно использовать для лечения артрита, опухолевых метастазов, изъязвления тканей, патологических ран,периодонтита, отторжения трансплантата, инсулинрезистентного диабета, заболевания костей и ВИЧ-инфицирования. В частности, соединения 14 по данному изобретению характеризуются более высокой степенью ингибирования активности ТАСЕ in vitro и в клеточном анализе и/или лучшей избирательностью в отношении ММР-1,благодаря чему их можно особенно эффективно использовать для лечения заболеваний, опосредованных ФНО. Настоящее изобретение относится также к способам получения соединений по настоящему изобретению, которые включают осуществление одного из нижеследующих способов. а) Осуществление взаимодействия соединения формулы где n, X, Y, A, R1, R2, R3, R8,R9, R10 и R11 имеют указанные выше значения, или его реакционноспособного производного с соединением формулыR12NHOH где R12 имеет указанные выше значения, с получением соединения формулы I; илиb) удаление защитных групп у соединения формулы где n, X, Y, A, R1, R2, R3, R8, R9, R10, R11 и R12 имеют указанные выше значения и R30 означает подходящую защитную группу, такую как третбутил, бензил и триалкилсилил, с получением соответствующего соединения формулы I; или с) отщепление от полимерного носителя производного гидроксамата, содержащего группу где n, X, Y, A, R1, R2, R3, R8, R9, R10 и R11 имеют указанные выше значения, с получением соединения формулы I; илиd) разделение смеси (например, рацемата) оптически активных изомеров соединения формулы I для отделения одного энантиомера или диастереомера от другого энантиомера или диастереомера; илиe) подкисление основного соединения формулы I фармацевтически приемлемой кислотой,что дает фармацевтически приемлемую соль; илиf) преобразование соединения формулы I,имеющего реакционноспособную замещающую группу или центр замещения, в соединение формулы I, имеющее другую замещающую группу или центр замещения. Что касается способа а), то взаимодействие можно осуществлять способами, известными в данной области, например, подвергая взаимодействию хлорангидрид кислоты или реакционноспособное производное смешанного ангидрида с соединением формулы R12NHOH. Удаление защитных групп, как показано в способе b), можно осуществлять способами,известными в данной области для получения гидроксамовой кислоты. Способ с) можно осуществлять, как это описано со ссылкой на схему 11, например, используя сильную кислоту, такую как ТФУ, для отщепления гидроксамата от смолы. При осуществлении способа d) можно использовать стандартные методы разделения,применяемые для отделения конкретных энантиомерных или диастереомерных форм. Например, рацемическую смесь можно преобразовать в смесь оптически активных диастереоизомеров,осуществляя взаимодействие с одним энантиомером "разделяющего агента" (например, путем образования диастереомерной соли или ковалентной связи). Полученную смесь оптически активных диастереоизомеров можно разделить стандартными методами (например, кристаллизацией или хроматографией), после чего отдельные оптически активные диастереоизомеры обрабатывают для удаления "разделяющего агента", получая при этом отдельный энантиомер соединения по данному изобретению. Для прямого разделения энантиомерных смесей можно также использовать хиральную хроматографию (применяя хиральный носитель, элюент или агент для получения ионных пар). Соединения формулы I можно выделить в виде соли фармацевтически приемлемой кислоты, например органической или неорганической кислоты, производя обработку кислотой, как это описано выше. Что касается способа е), то соединения формулы I, имеющие реакционноспособную замещающую группу, такую как гидрокси или амино, или центр замещения, такой как -S-,можно преобразовать в другие соединения формулы I известными способами, например спирт в сложный или простой эфир. Реакционноспособные центры, такие как атом серы, можно окислить в SO или SO2 (например, как показано на нижеследующих схемах 2 и 8). При необходимости реакционноспособные замещающие группы можно защитить в процессе синтеза соединений формулы I и удалить на последней стадии. Соединения по настоящему изобретению,в которых n=0, Х=О, S или NHR7 и А=S, SO илиSO2, можно легко получить одним из общих способов, рассмотренных ниже. 16 Как показано на схеме 1, замещенное соответствующим образом производное меркаптана алкилируют, вводя сложный эфир замещенной или незамещенной-бромуксусной кислоты в хлороформ, при кипячении с обратным холодильником, и используя N,N-диизопропилэтиламин в качестве основания. Полученный таким образом сульфид подвергают взаимодействию замещенным соответствующим образом пропаргилбромидом в ацетоне, при кипячении с обратным холодильником, используя K2 СО 3 в качестве основания. В том случае, когда Х=-N-R7,N-алкилирование можно осуществлять в ДМФ/NaH при комнатной температуре. Полученный таким образом сульфид окисляют, используя мхлорпербензойную кислоту в СН 2 Сl2 или оксон в смеси метанол/вода. Сульфон, полученный в результате осуществления вышеуказанного способа, можно далее алкилировать, используя разные алкилгалогениды, что дает дизамещенное производное, или гидролизовать, используяNaOH/MeOH, при комнатной температуре. Однако в присутствии третичного бутилового эфира вместо этилового эфира гидролиз можно осуществлять в ТФУ/СН 2 Сl2 при комнатной температуре. После чего полученную карбоновую кислоту преобразуют в производное гидроксамовой кислоты, осуществляя взаимодействие между оксалилхлоридом/ДМФ (каталитическое количество) и гидроксиламином/триэтиламином. Схема 1NН 2OННСl/Еt3N. Как показано на схеме 1, сульфид можно гидролизовать с образованием карбоновой кислоты, используя NaOH/MeOH, при комнатной температуре и затем преобразовать в производное гидроксамовой кислоты, как указано на схеме 1. Производные монозамещенного сульфида можно далее алкилировать, используя бис(триметилсилил)амид калия и соответствующим образом замещенные алкилгалогениды,с образованием производных дизамещенного сульфида. Указанные соединения можно далее гидролизовать и преобразовать в производное 17 гидроксамовой кислоты, как показано на схеме 1. Сульфинильные производные получают, окисляя сульфидные производные гидроксамовой кислоты 30% Н 2O2 в метаноле при комнатной температуре. Схема 2b: (СОСl)2/NH2OHHCl/Et3N; с: Н 2 О 2/МеОН/комнатная температура; d: KN[Si(СН 3)3]/ТГФ/R9Br. Тиолы, используемые в качестве промежуточных веществ в процессе синтеза соединений по данному изобретению, можно получить в соответствии со схемой 3. Так, соли 1 сульфоновой кислоты, в которых XR50 означает гидрокси, тиол или замещенную аминогруппу, можно алкилировать ацетиленами 2, где J означает приемлемую удаляемую группу, такую как галоген мезилат, тозилат или трифлат, получая при этом соединение 3. Ацетилены 2 являются коммерчески доступными или известными соединениями, либо их можно синтезировать методами, известными специалистам в данной области. Соли 3 сульфоновой кислоты можно преобразовать в соответствующий сульфонилхлорид или другой сульфонилирующий агент 4 известными методами, такими как осуществление взаимодействия с оксалилхлоридом, оксихлоридом фосфора или другим реагентом, совместимым с заместителями R1, R2 и R3, и ацетиленом. Сульфонилхлорид 4 можно восстановить в соответствующий тиол 5, используя трифенилфосфин в смеси приемлемых растворителей, таких как дихлорметан/ДМФ, при температуре от -20 до 30 С. Дисульфид 6 можно альтернативно преобразовать в диацетилен 7, осуществляя взаимодействие с соединениями 2, с последующим восстановлением дисульфидной связи, что дает требуемые тиолы 5. бис-Ацетилены 7 можно также преобразовать в тиолы 5, используя сульфонилхлориды 4. Алкилирование фенола, тиофенола, анилина или защищенного анилина 8 соединением 2 позволяет получить соединение 9, которое затем подвергают взаимодействию с хлорсульфоновой кислотой, получая при этом сульфоновые кислоты 10, которые можно легко преобразовать в соединение 4 при помощи оксалилхлорида или подобных реагентов и последующего восстановления в тиолы 5. Тиофенолы 11 являются также предшественниками соединения 5, получаемого путем защиты тиола трифенилметильной или другой приемлемой защитной группой, алкилирования ХН, где Х означает О, N или S, и снятия защиты с серы. Соединения по данному изобретению, в которых Х означает N, О, S, SO или SО 2, можно синтезировать в соответствии со схемами 4 и 5. Алкилирование парадизамещенного арила 14 или его защищенного эквивалента ацетиленом 2 в присутствии основания, такого как карбонат калия, в полярном апротонном растворителе,таком как ацетон или ДМФ, при температуре от 20 до 120 С позволяет получить монопропаргиловый эфир 15. Специалистам в данной области должно быть известно, что могут потребоваться защитные группы во избежание нежелательных побочных реакций и увеличения выхода продукта реакции. Необходимость применения и соответствующий выбор защитной группы для конкретной реакции относится к компетенции специалистов в данной области. Осуществление взаимодействия указанного соединения с -пропиолактоном или производным замещенного пропиолактона (в котором заместители не показаны на схеме для ясности) в присутствии основания, такого как трет-бутоксид калия, в полярном растворителе или смеси растворителей, таких как ТГФ или ДМФ, позволяет получить карбоновую кислоту 16. Преобразование карбоновой кислоты 16 в соответствующую гидроксамовую кислоту 17 осуществляют путем получения производного активированного сложного эфира, такого как хлорангидрид или ангидрид кислоты, с последующим осуществлением взаимодействия с гидроксиламином. Специалистам в данной области должно быть понятно, что когда А означает серу на схеме 4 и на всех последующих родственных схемах, серу можно окислить в соответствующий сульфоксид или сульфон на любой стадии после получения тиоэфира, используя подходящий окислитель, такой как оксон, воздух, м-хлорпербензойная кислота или перекись водорода. 19 Соединения 17 можно также получить,присоединяя при помощи реакции Михаэля соединение 15 к эфиру акриловой кислоты или эфиру замещенной акриловой кислоты (заместители не показаны на схеме для ясности), с получением соединения 18, в котором R30 означает водород или приемлемую защитную группу карбоновой кислоты. Удаление защитных групп с части сложного эфира позволяет получить карбоновую кислоту 16, которую можно преобразовать в аналогичную гидроксамовую кислоту 17. Аналогичным образом, осуществляя реакцию присоединения Михаэля монозащищенного 1,4-дизамещенного арила 19, где ZR25 означает гидрокси или защищенный гидрокси,тиол или амин, получают соединение 20. Удаление защитной группы дает тиол, анилин или фенол 21, который можно алкилировать пропаргиловым производным 2 с получением соединения 18. Монозащищенное соединение 19 можно также подвергнуть взаимодействию с b-пропиолактоном с получением соединения 22. Этерификация соединения 22 дает соединение 20, которое затем можно преобразовать в соединения 17 по данному изобретению. Альтернативно у соединения 22 можно удалить защитную группу с последующим алкилированием, получив при этом соединение 16 или 18. Схема 4 Соединения по данному изобретению, в которых Х означает N, О, S, SO или SO2 и линкер между смежным гетероатомом и гидроксамовой кислотой имеет цепь из 1 или 3 атомов углерода, можно синтезировать в соответствии со схемой 5. Соединение 19, в котором XR25 означает гидрокси или защищенный гидрокси,тиол или амин, можно подвергнуть взаимодействию со сложным эфиром 24 или лактоном 24 а,в котором R30 означает водород или приемлемую защитную группу карбоновой кислоты, с должным образом замещенной удаляемой груп 004883 20 пой, такой галоген, тозилат, мезилат или трифлат, получив при этом соединение 25. Удаление защитных групп с гетероатома Х соединения 25 позволяет получить соединение 26, которое затем можно алкилировать пропаргиловым производным 2, что дает ацетиленовый эфир 27. Сложный эфир 27 можно преобразовать в соответствующую гидроксамовую кислоту 28, преобразуя указанный эфир в карбоновую кислоту при помощи кислотного или основного гидролиза с последующим преобразованием в гидроксамовую кислоту, как показано на схеме 4. Альтернативно соединение 15, полученное в соответствии со схемой 2, можно подвергнуть прямому алкилированию сложным эфиром 24 или лактоном 24 а с получением соединения 27 и затем соединения 28. Несмотря на то, что заместители атома углерода в альфа-положении относительно гидроксамовой кислоты не показаны на схеме для ясности, их можно присоединить путем депротонирования и гашения соединений 25 или 27 приемлемым электрофилом. Схема 5 Соединения по данному изобретению, в которых А означает метиленовую или замещенную метиленовую группу и Х означает кислород, можно получить в соответствии со схемой 6. Сложные эфиры или карбоновые кислоты 29,коммерчески доступные или известные из научной литературы, можно преобразовать в соответствующие фенолы 30. Алкилирование фенола ацетиленом 2 дает пропаргиловые эфиры 31,которые можно преобразовать в соответствующие карбоновые кислоты и затем в гидроксамовые кислоты 33, как показано на схеме 4. Несмотря на то, что заместители атома углерода,занимающего альфа-положение относительно гидроксамовой кислоты, не показаны на схеме для ясности, их можно присоединить путем депротонирования и гашения соединений 29 или 31 приемлемым электрофилом. Соединения по данному изобретению, в которых А означает -SO2- и R8 и R9 не являются водородом, получают, используя в качестве исходного вещества 4-фторбензолтиол 34, как показано на схеме 7. Депротонирование тиола,последующее осуществление взаимодействия с-пропиолактоном, эфиром акриловой кислоты или производным сложного эфира 24 и окисление полученного тиоэфира позволяют получить сульфоновую кислоту 35. Замещение 4-фторзаместителя соединения 35 или его соответствующего сложного эфира пропаргиловым производным 36, в котором Х означает N, О или S,позволяет получить сульфон 16. Соединение 16 можно преобразовать в соединения по данному изобретению в соответствии со схемой 4. Фторарил 35 можно также подвергнуть взаимодействию с защищенным гидроксилом, тиолом или аминогруппой (HXR40, где R40 означает приемлемую защитную группу) в присутствии основания, такого как гидрид натрия, в полярном апротонном растворителе, таком как ДМФ, получив при этом соединение 36. Удаление защитных групп с соединения 36 и последующее алкилирование ацетиленовым производным 2 позволяют получить соединение 16. Схема 7 Соединения по данному изобретению, в которых Х означает NH, можно получить, используя в качестве исходного вещества производимое коммерческим путем приемлемое нитроарильное соединение 38. Таким образом, анион соединения 38 можно использовать для алкилирования -пропиолактона, замещенного производного или сложного эфира акриловой кислоты, с получением соединения 39. Восстановление нитрогруппы с последующим алкилированием полученного анилина дает соединение 16. Соединение 38 можно также алкилировать производным сложного эфира 24, чтобы получить нитроэфир 40, из которого при последую 004883 22 щем восстановлении получают соответствующий анилин, аналогичный соединению 26 на схеме 5. Схема 8 Соединения по данному изобретению, в которых R11, занимающий альфа-положение относительно гидроксамовой кислоты, является гидроксильной группой, можно получить, используя эпоксиды 41, как показано на схеме 9. Указанные эпоксиды получают, окисляя соответствующие эфиры акриловой кислоты или выполняя реакцию Дарзана, в соответствии с которой альфа-галогензамещенный эфир подвергают взаимодействию с альдегидом или кетоном. Осуществляя взаимодействие эпоксида с тиолом, фенолом или анилином 19 в присутствии основания, получают альфа-гидроксиловый эфир 42. Удаление защитных групп с соединения 42 и последующее алкилирование пропаргиловым производным 2 позволяют получить соединение 44. Преобразование сложного эфира 44 в аналогичную гидроксамовую кислоту, как показано на схеме 4, дает соединение 45. Соединения 45, в которых А означает серу, можно преобразовать в аналогичные сульфоксиды или сульфоны, производя окисление перекисью водорода, воздухом, оксоном или другим приемлемым реагентом на данной стадии. Аналогичным образом тиол, фенол или анилин 15 можно подвергнуть взаимодействию с соединением 41 и получить соединение 44. Гидроксильную группу соединения 43 можно также преобразовать в приемлемую удаляемую группу, такую как галогенид или эфир сульфоновой кислоты, с последующим замещением разными нуклеофилами,включая амины, с получением соединения 44. Схема 9 23 Другой способ получения альфагидроксигидроксамовых кислот по данному изобретению показан на схеме 10. Соединение 15 можно алкилировать спиртом 46 с получением соединения 47. Окисление спирта с одновременным окислением или без окисления тиоэфира (для А=S) дает альдегид 48. Осуществляя взаимодействие альдегида 48 с триметилсилилцианидом или другим приемлемым реагентом,получают цианогидрин 49. Гидролиз нитрила 49 с получением соответствующей карбоновой кислоты и последующее преобразование в гидроксамовую кислоту, как показано на схеме 4,дает соединение 50. Схема 10 На схеме 11 показаны альтернативные способы получения соединений гидроксамовой кислоты при использовании твердофазного носителя. Схема 11(гидроксиламиносмола) можно связать с 2 бром-6-фталоилкапроновой кислотой, получив при этом гидроксиамидную смолу. Реакцию связывания можно осуществлять в присутствии карбодиимида, такого как DIC, в инертном растворителе, таком как ДМФ, при комнатной температуре. Бромидная группа может быть замещена гидроксибензолтиолом в присутствии основания, такого как DBU, в инертном растворителе, таком как ТГФ, при комнатной температуре. Сульфид можно окислить в сульфоксид, 004883 24 осуществляя взаимодействие с окислителем,таким как трет-бутилгидропероксид, в присутствии кислотного катализатора, такого как бензолсульфоновая кислота, в инертном растворителе, таком как DCM, при комнатной температуре. Альтернативно сульфид можно окислить в сульфон, осуществляя взаимодействие с окислителем, таким как мета-хлорпероксибензойная кислота, в инертном растворителе, таком какDCM, при комнатной температуре. Фталоильную защитную группу можно удалить, осуществляя взаимодействие с гидразином в растворителе, таком как этанол или ТГФ. Свободный амин можно удлинить глициновым спейсером,осуществляя взаимодействие с N-фталоилглицином в присутствии карбодиимида, такого какDIC, в инертном растворителе, таком как ДМФ,при комнатной температуре. Фталоильную защитную группу можно также удалить, осуществляя взаимодействие с гидразином в растворителе, таком как этанол или ТГФ. Свободный амин можно ацилировать, осуществляя взаимодействие с кислотой в присутствии карбодиимида, такого как DIC, в инертном растворителе,таком как ДМФ, при комнатной температуре. Сульфид, сульфоксид или сульфон можно обработать кислотой, такой как трифторуксусная кислота, в инертном растворителе, таком какDCM, для высвобождения свободной гидроксамовой кислоты. Схема 12 На схеме 12 показан альтернативный способ получения производных альфа-замещенной(где А=SO2 и n=0) гидроксамовой кислоты. Осуществляя взаимодействие соединения 51 с замещенными сульфонилфторидами, можно получить -сульфонильные производные сложного эфира 52, которые затем преобразуют в соответствующие производные гидроксамовой кислоты. Нижеследующие примеры служат только для иллюстрации настоящего изобретения и не ограничивают его объем. Пример 1. Получение 2-[4-(бут-2-инилокси)фенилсульфонил]-N-гидрокси-2-метил-3-[4(2-пиперидин-1-илэтокси)фенил]пропионамида. Стадия 1. К перемешиваемому раствору 4-меркаптофенола (12,6 г, 100 ммоль) и диизопропилэтиламина (13,0 г, 101 ммоль) в хлороформе(200 мл) медленно добавляют раствор этил-2 бромпропионата (18,2 г, 100 ммоль) в хлороформе (50 мл). Реакционную смесь осторожно кипятят с обратным холодильником в процессе добавления. Закончив добавление этил 2 бромпропионата, реакционную смесь кипятят с обратным холодильником в течение 2 ч и охла 25 ждают до комнатной температуры. Реакционную смесь промывают водой и экстрагируют хлороформом. Затем смесь сушат над Na2SO4,фильтруют и концентрируют. Продукт, этиловый эфир 2-(4-гидроксифенилтио)пропионовой кислоты, используют на следующей стадии без очистки. Бесцветное масло. Выход 22,0 г (97%); МС: 227 (М+Н)+. Стадия 2. Смесь этилового эфира 2-(4-гидроксифенилтио)пропионовой кислоты (22,6 г, 100 ммоль),1-бром-2-бутина (13,2 г, 100 ммоль) и безводного K2 СО 3 (50 г, избыток) кипятят с обратным холодильником в ацетоне (300 мл) в течение 8 ч. После окончания реакции реакционную смесь охлаждают до комнатной температуры и фильтруют. Ацетоновый слой удаляют перегонкой,остаток экстрагируют хлороформом, тщательно промывают водой, сушат и концентрируют. Этиловый эфир 2-[4-(бут-2-инил-окси)фенилтио]пропионовой кислоты выделяют в виде бесцветного масла. Выход 26,0 г (93%); МС: 279(М+Н)+. Стадия 3. К перемешиваемому раствору этилового эфира 2-[4-(бут-2-инилокси)фенилтио]пропионовой кислоты (2,78 г, 10 ммоль) в метаноле: ТГФ (3:1) (100 мл) добавляют оксон (10 г, избыток) в воде (25 мл) при комнатной температуре. Реакционную смесь перемешивают при комнатной температуре в течение 8 ч и фильтруют. Органический слой удаляют при пониженном давлении и выделяют этиловый эфир 2-[4-(бут 2-инилокси)фенилсульфонил]пропионовой кислоты в виде бесцветного масла. Выход 3,0 г(96%); МС: 311 (М+Н)+. Стадия 4. Смесь этилового эфира 2-[4-(бут-2-инилокси)фенилсульфонил]пропионовой кислоты (3,1 г,10 ммоль), гидрохлорида 4-(2-пиперидин-1-илэтокси)бензилхлорида (2,9 г, 10 ммоль), 18 краун-6 (500 мг), бромида тетрабутиламмония(500 мг) и К 2 СО 3 (10 г, избыток) кипятят с обратным холодильником в ацетоне (200 мл) в течение 8 ч. После окончания реакции реакционную смесь охлаждают до комнатной температуры, фильтруют и концентрируют. Остаток экстрагируют хлороформом, тщательно промывают водой, сушат и концентрируют. Сырой продукт очищают хроматографией на колонке,элюируя смесью 70% этилацетат:гексан. Этиловый эфир 2-[4-(бут-2-инилокси)фенилсульфонил]-2-метил-3-[4-(2-пиперидин-1-илэтокси)фенил]пропионовой кислоты выделяют в виде красного масла. Выход 3,2 г (60%); МС: 528(М+Н)+. Стадия 5. К перемешиваемому раствору этилового эфира 2-[4-(бут-2-инилокси)фенилсульфонил]2-метил-3-[4-(2-пиперидин-1-илэтокси)фенил] пропионовой кислоты (3,0 г, 5,4 ммоль) в ТГФ:МеОН (1:1) (100 мл) добавляют 10 н рас 004883 26 твор NaOH (10 мл) при комнатной температуре. Реакционную смесь нагревают до 60 С в течение 24 ч. Затем реакционную смесь концентрируют, осторожно нейтрализуют 5 н раствором НСl и экстрагируют хлороформом. Полученный продукт тщательно промывают водой, сушат над безводным Nа 2SO4 и концентрируют. 2-[4(бут-2-Инилокси)фенилсульфонил]-2-метил-3-[4(2-пиперидин-1-илэтокси)фенил]пропионовую кислоту выделяют в виде желтого твердого вещества; т.п. 84 С. Выход 2,0 г (74%); МС: 500(M+H). Стадия 6. К перемешиваемому раствору 2-[4-(бут-2 инилокси)фенилсульфонил]-2-метил-3-[4-(2-пиперидин-1-илэтокси)фенил]пропионовой кислоты (4,99 г, 10 ммоль) и ДМФ (4 мл) в метиленхлориде (100 мл) медленно добавляют раствор оксалилхлорида (6,3 г, 50 ммоль) в метиленхлориде при 0 С. Закончив добавление, реакционную смесь перемешивают при комнатной температуре в течение 1 ч. В отдельной колбеNH2OHHCl (3,5 г, 50 ммоль) растворяют в ДМФ (20 мл) и добавляют Et3N (10 г, 100 ммоль). Реакционную смесь разбавляют ацетонитрилом (25 мл) и охлаждают до 0 С. Хлорангидрид кислоты, полученный в отдельной колбе, концентрируют, чтобы удалить избыток оксалилхлорида, и вновь растворяют в 100 мл метиленхлориде, который медленно добавляют кNH2OH. Реакционную смесь перемешивают при комнатной температуре в течение 24 ч и концентрируют при пониженном давлении. Полученный остаток экстрагируют хлороформом,тщательно промывают водой, сушат над безводным Na2SO4. Слой хлороформа фильтруют и концентрируют. Полученный продукт очищают хроматографией на колонке с силикагелем,элюируя смесью 10% метанол:хлороформ. Выделенный таким образом 2-[4-(бут-2 инилокси)фенилсульфонил]-N-гидрокси-2-метил-3-[4-(2-пиперидин 1-илэтокси)фенил]пропионамид преобразуют в его хлористо-водородную соль, осуществляя взаимодействие с раствором хлороводорода в метаноле. Бесцветное твердое вещество, т.п. 114-116 С. Выход 4,5 (87%); МС: 515 (М+Н). Пример 2. 3-Бифенил-4-ил-2-[4-(бут-2-инилокси)фенилсульфонил]-N-гидрокси-2-метилпропионамид. Этиловый эфир 3-бифенил-4-ил-2-[4-(бут-2 инилокси)фенилсульфонил]-2-метилпропионовой кислоты получают способом по примеру 1(стадия 4). Используя в качестве исходных веществ этиловый эфир 2-[4-(бут-2-инилокси)фенилсульфонил]пропионовой кислоты (3,1 г, 10 ммоль) и 4-фенилбензилхлорид (20,2 г, 10 ммоль), получают 4,2 г продукта в виде желтого масла. Выход (88%); МС: 477 (М+Н)+. 3-Бифенил-4-ил-2-[4-(бут-2-инилокси)фенилсульфонил]-2-метилпропионовую кислоту получают, используя в качестве исходных ве 27 ществ этиловый эфир 3-бифенил-4-ил-2-[4-(бут 2-инилокси)фенилсульфонил]-2-метилпропионовой кислоты (4,0 г, 8,4 ммоль), растворенный в МеОН (100 мл), и 10 н. раствор NaOH (20 мл). Полученную реакционную смесь обрабатывают аналогично примеру 1 (стадия 5). Выход 3,2 г(85%); МС: 449 (М+Н)+. Используя в качестве исходного вещества 3-бифенил-4-ил-2-[4-(бут-2-инилокси)фенилсульфонил]-2-метилпропионовую кислоту (3,0 г, 6,7 ммоль) и выполняя способ по примеру 1 (стадия 6), выделяют 2,8 г 3-бифенил-4-ил-2-[4-(бут-2 инилокси)фенилсульфонил]-N-гидрокси-2-метилпропионамид в виде бесцветного твердого вещества; т.п. 92-94 С. Выход 90%; МС: 464 (М+Н)+. Пример 3. 2-[4-(бут-2-Инилокси)фенилсульфонил]-N-гидрокси-2-метил-3-пиридин-3 илпропионамид. Этиловый эфир 2-[4-(бут-2-инилокси)фенилсульфонил]-2-метил-3-пиридин-3-илпропионовой кислоты получают способом по примеру 1 (стадия 4). Используя в качестве исходных веществ этиловый эфир 2-[4-(бут-2-инилокси) фенилсульфонил]пропионовой кислоты (7,0 г,22,5 ммоль) и гидрохлорид 3-пиколилхлорида(М+Н)+. 2-[4-(бут-2-Инилокси)фенилсульфонил]-2 метил-3-пиридин-3-илпропионовую кислоту получают, используя в качестве исходных веществ этиловый эфир 2-[4-(бут-2-инилокси)фенилсульфонил]-2-метил-3-пиридин-3-илпропионовой кислоты (8,0 г, 19,9 ммоль), растворенный в МеОН (100 мл), и 10 н раствор NaOH (20 мл). Полученную реакционную смесь обрабатывают аналогично примеру 1 (стадия 5). Выход 5,1 г(69%); МС: 374 (М+Н)+. Используя в качестве исходного вещества 2-[4-(бут-2-инилокси)фенилсульфонил]-2-метил 3-пиридин-3-илпропионовую кислоту (6,0 г, 16 ммоль) и выполняя способ по примеру 1 (стадия 6), выделяют 4,8 г 2-[4-(бут-2-инилокси)фенилсульфонил]-N-гидрокси-2-метил-3-пиридин-3 илпропионамида в виде бесцветного твердого вещества. Хлористо-водородную соль получают аналогично примеру 1; т.п. 154-156 С. Выход 89%; МС: 389 (М+Н)+. Пример 4. 2-[4-(бут-2-Инилокси)фенилтио]N-гидроксипропионамид. 2-[4-(бут-2-Инилокси)фенилтио]пропионовую кислоту получают, используя в качестве исходных веществ этиловый эфир 2-[4-(бут-2 инилокси)фенилтио]пропионовой кислоты (5,56 г,20 ммоль), растворенный в МеОН (100 мл), и 10 н раствор NaOH. Полученную реакционную смесь обрабатывают аналогично примеру 1 (стадия 5). Выход 4,8 г (96%); МС: 249 (М-Н)-. Используя в качестве исходного вещества 2-[4-(бут-2-инилокси)фенилтио]пропионовую кислоту (6,0 г, 24 ммоль) и выполняя способ по примеру 1 (стадия 6), выделяют 500 мг 2-[4 004883(бут-2-инилокси)фенилтио]-N-гидроксипропионамида в виде бесцветного твердого вещества; т.п. 102-104 С. Выход 8%; МС: 266 (М+Н)+. Пример 5. Гидроксамид 2-[4-(бут-2-инилокси)фенилсульфонил]октановой кислоты. Этиловый эфир 2-(4-гидроксифенилтио) октановой кислоты получают общим способом по примеру 1 (стадия 1). Используя в качестве исходных веществ 4-меркаптофенол (12,6 г, 100 ммоль) и этил 2-бромоктаноат (25,2 г, 100 ммоль), получают 25 г этилового эфира 2-(4-гидроксифенилтио)октановой кислоты в виде бесцветной жидкости. Выход 84%; МС: 297 (М+Н)+. Этиловый эфир 2-[4-(бут-2-инилокси)фенилтио]октановой кислоты получают общим способом по примеру 1 (стадия 2), используя в качестве исходных веществ этиловый эфир 2-(4 гидроксифенилтио)октановой кислоты (13,6 г,46 ммоль) и 1-бром-2-бутин (6,23 г, 47 ммоль). Выход 13,78 г (86%); янтарное масло; МС: 349,0(M+H)+. 2-[4-(бут-2-Инилокси)фенилтио]октановую кислоту получают общим способом по примеру 1 (стадия 5). Используя в качестве исходного вещества этиловый эфир 2-[4-(бут-2-инилокси) фенилтио]октановой кислоты (4,77 г, 13,7 ммоль),выделяют 4,16 г продукта. Выход 96%; МС: 321,0 (М+Н)+. Этиловый эфир 2-[4-(бут-2-инилокси) фенилсульфонил]октановой кислоты получают общим способом по примеру 1 (стадия 3). Используя в качестве исходного вещества этиловый эфир 2-[4-(бут-2-инилокси)фенилтио]октановой кислоты (7,26 г, 21 ммоль), выделяют 6,78 г продукта. Выход (85%); желтое масло; МС: 381,2 (М+Н)+. 2-[4-(бут-2-Инилокси)фенилсульфонил]октановую кислоту получают, используя в качестве исходных веществ этиловый эфир 2-[4-(бут 2-инилокси)фенилсульфонил]октановой кислоты (6,52 г, 17 ммоль), растворенный в ТГФ:метаноле (100:50 мл), и 10 н. раствор NaOH (10 мл). Полученную реакционную смесь обрабатывают аналогично примеру 1 (стадия 5). Выход 2,42 г(42%); бесцветная смола; МС: 352,9 (М+Н)+. Используя в качестве исходного вещества 2-[4-(бут-2-инилокси)фенилсульфонил]октановую кислоту (2,21 г, 6 ммоль) и выполняя способ по примеру 1 (стадия 6), выделяют 270 мг гидроксамида 2-[4-(бут-2-инилокси)фенилсульфонил]октановой кислоты в виде янтарной смолы. Выход 42%; МС: 369,7 (М+Н)+. 1H-ЯMP(300 МГц, ДМСО-d6):0,826 (м, 3 Н), 1,33 (м,9 Н), 1,77 (с, 3 Н), 1,89 (д, J=2,2, 1 Н), 3,03 (д, J=4 Гц, 1 Н), 4,73 (м, 2 Н), 5,78 (с, 1 Н), 6,56 (с, 1 Н),7,1 (д, 2 Н), 7,92 (м, 2 Н). Пример 6. Гидроксамид 2-[4-(бут-2 инилокси)фенилтио]октановой кислоты. 2-[4-(бут-2-Инилокси)фенилтио]октановую кислоту получают общим способом по примеру 1 (стадия 5). Используя в качестве исходного вещества этиловый эфир 2-[4-(бут-2-инилокси) 29 фенилтио]октановой кислоты (4,77 г, 13,7 ммоль),выделяют 4,16 г продукта. Выход 96%; МС: 321,0 (М+Н)+. Используя в качестве исходного вещества 2-[4-(бут-2-инилокси)фенилтио]октановую кислоту (4,12 г, 12,9 ммоль) и выполняя способ по примеру 1 (стадия 6), выделяют гидроксамид 2[4-(бут-2-инилокси)фенилтио]октановой кислоты в виде белого твердого вещества, т.п. 125 С. Выход 73%; МС: 335,9 (М+Н)+. 1H-ЯМР (300 МГц, ДМСО-d6):0,856 (м, 3 Н), 1,24 (м, 6 Н),1,57 (м, 2 Н), 1,71 (м, 2 Н), 1,83 (т, 3 Н), 2,55 (м,2 Н), 4,78 (д, 2 Н), 6,95 (д, 2 Н), 7,36 (д, 2 Н), 8,96(1,78 г, 5 ммоль) растворяют в метаноле (50 мл) и добавляют Н 2 О 2 (30%, 10 мл). Реакционную смесь перемешивают при комнатной температуре в течение 96 ч и гасят охлаждаемым льдом раствором NaHSO3. Затем реакционную смесь концентрируют при пониженном давлении и остаток экстрагируют хлороформом. Исследование реакционной смеси указывает на образование двух диастереоизомеров, которые разделяют хроматографией на колонке с силикагелем, производя элюирование смесью 50% этилацетат:гексан. Выделяют 0,411 г гидроксамида(S)-2-[(R)-[4-(бут-2-инилокси)фенилсульфинил] октановой кислоты в виде белого твердого вещества, т.п. 132,3 С. Выход 24%; МС: 352,0(д, J=2,8, 2 Н), 7,36 (д, J=2,3, 2 Н), 9,00 (с, 1 Н),10,56 (с, 1 Н). Используя в качестве исходного вещества гидроксамид 2-[4-(бут-2-инилокси)фенилтио] октановой кислоты (1,78 г, 5,0 ммоль) и выполняя способ по примеру 7, получают 0,411 г гидроксамида (S)-2-[(S)-4-(бут-2-инилоксифенил) сульфинил]октановой кислоты в виде белого твердого вещества, т.п. 112,2 С. Выход 12%; МС: 352,0 (М+Н)+. 1H-ЯМР (300 МГц, ДМСОd6):0,804 (м, 3 Н), 1,01 (м, 9 Н), 1,59 (м, 1 Н),1,84 (т, 3 Н), 3,33 (с, 3 Н), 4,84 (д, 2 Н), 7,16 (д,J=2,5, 2 Н), 7,61 (д, J=2,7, 2 Н), 9,21 (с, 1 Н), 10,82(с, 1 Н). Пример 9. 3-[4-(бут-2-Инилокси)фенокси]N-гидроксипропионамид. Стадия 1. 4-(бут-2-Инилокси)фенол. К раствору 4,13 г (0,038 моль) гидрохинона в 80 мл ацетона добавляют 5,19 г (0,375 моль) карбоната калия и 5,0 г (0,038 моль) 1-бром-2 бутина. Полученную смесь нагревают при 5560 С в течение 8 ч и затем перемешивают в течение ночи при комнатной температуре. Реак 004883 30 ционную смесь выливают на лед и экстрагируют простым эфиром. Объединенные органические экстракты промывают 1 н раствором гидроксида натрия. Объединенные водные слои подкисляют 1 н. раствором НСl и экстрагируют дихлорметаном. Слои дихлорметана промывают водой и насыщенным солевым раствором, сушат над Na2SO4, фильтруют через Magnesol и концентрируют в вакууме, получая при этом 2,0 г фенола в виде коричневого масла . Стадия 2. 3-[4-(бут-2-Инилокси)фенокси] пропионовая кислота. К находящемуся при 0 С раствору 1,015 г(8,60 ммоль) трет-бутоксида калия, суспендированного в 10 мл сухого ТГФ, добавляют раствор 1,40 г (8,60 ммоль) 4-(бут-2-инилокси)фенола,растворенного в 30 мл ТГФ/ДМФ (5:1). Реакционную смесь перемешивают при комнатной температуре в течение 10 мин, вновь охлаждают до 0 С и добавляют 0,66 мл (9,46 ммоль) чистого -пропиолактона. Полученную смесь перемешивают в течение ночи при комнатной температуре и концентрируют в вакууме. Остаток разбавляют этилацетатом и экстрагируют насыщенным раствором бикарбоната натрия. Щелочные водные экстракты подкисляют до рН 2 концентрированным раствором НСl, выпавшее в осадок твердое вещество собирают фильтрованием, промывают водой и сушат в вакууме, получая при этом 0,089 г карбоновой кислоты в виде черного твердого вещества; т.п. 88-92 С. Электрораспылительная масс-спектрометрия: 232,9 (М-Н)-. Стадия 3. 3-[4-(бут-2-Инилокси)фенокси]N-гидроксипропионамид. К находящемуся при 0 С раствору 0,089 г(0,758 ммоль) 2 М раствора оксалилхлорида. Реакционную смесь нагревают до комнатной температуры, перемешивают в течение 2 ч и вновь охлаждают до 0 С. К реакционной смеси добавляют смесь 0,139 мл (2,27 ммоль) 50% раствора гидроксиламина, 0,73 мл ТГФ и 0,21 мл триэтиламина. Реакционную смесь перемешивают при комнатной температуре в течение 12 ч и концентрируют в вакууме. Остаток экстрагируют дихлорметаном, объединенные органические экстракты промывают водой, 2 н раствором лимонной кислоты и насыщенным солевым раствором , сушат над Na2SO4, фильтруют и концентрируют в вакууме. Остаток растирают с этилацетатом/гексаном, получая при этом гидроксамовую кислоту в виде белого твердого вещества; т.п. 116-118 С. Электрораспылительная масс-спектрометрия: 249,9 (М+Н)+. Пример 10. 4-[4-(бут-2-Инилокси)фенокси]-N-гидроксибутирамид. Стадия 1. Этиловый эфир 4-(4-бензилоксифенокси)масляной кислоты. 31 К суспензии 1,2 г (0,030 моль) 60% гидрида натрия в 100 мл толуола добавляют 6,12 г(0,030 моль) 4-(бензилокси)фенола, реакционную смесь перемешивают при комнатной температуре в течение 30 мин и добавляют 5,85 г(0,030 моль) этил 3-бромбутирата. Полученную смесь нагревают до температуры кипячения с обратным холодильником в течение ночи и фильтруют. Фильтрат промывают 0,5 н. раствором гидроксида натрия, 3% раствором карбоната натрия, водой и насыщенным солевым раствором, сушат над Na2SO4, фильтруют и концентрируют в вакууме, получая при этом 5,45 г бис-эфира в виде белого твердого вещества. Электрораспылительная масс-спектрометрия: 314,8 (М+Н)+. Стадия 2. Этиловый эфир 4-(4-гидроксифенокси)масляной кислоты. К раствору 3,58 г (0,011 моль) этилового эфира 4-(4-бензилоксифенокси)масляной кислоты в 200 мл этанола добавляют 0,81 г 5% палладия на угле и полученную смесь встряхивают под давлением водорода 2,45 атм (35 фунтов/кв.дюйм) в течение 4 ч. Полученную смесь фильтруют через Magnesol и концентрируют в вакууме, получая при этом 1,97 г фенола в виде серого твердого вещества. Электрораспылительная масс-спектрометрия: 225 (М+Н)+. Стадия 3. Этиловый эфир 4-[4-(бут-2 инилокси)фенокси]масляной кислоты. К раствору 524 мг (2 ммоль) трифенилфосфина, растворенного в 20 мл бензола и 50 мл ТГФ, добавляют 0,175 мл (2,3 ммоль) 2-бутин-1 ола. Через 5 мин к реакционной смеси добавляют 0,39 г (21,28 ммоль) этилового эфира 4-(4 гидроксифенокси)масляной кислоты, растворенной в 10 мл ТГФ, и 0,369 мл (2,34 ммоль) диэтилазодикарбоксилата. Полученную реакционную смесь перемешивают в течение 18 ч при комнатной температуре и концентрируют в вакууме. Остаток хроматографируют на силикагеле, производя элюирование смесью этилацетат/гексан (1:10), и получают 0,28 г (58%) требуемого этилового эфира 4-[4-(бут-2-инилокси) фенокси]масляной кислоты в виде светлой жидкости. Масс-спектрометрия с электронной ионизацией (EI): 276,9 М+. Стадия 4. 4-[4-(бут-2-Инилокси)фенокси] масляная кислота. К раствору 0,37 г (1/34 ммоль) этилового эфира 4-[4-(бут-2-инилокси)фенокси]масляной кислоты в 6 мл ТГФ/метанола (5:1) добавляют 1,6 мл 1 н. раствора гидроксида натрия и полученную смесь перемешивают в течение 1,5 ч при 70 С. Затем реакционную смесь концентрируют в вакууме, растирают с простым эфиром,фильтруют и сушат в вакууме, получая при этом 0,36 г соли карбоксилата в виде белого твердого вещества. Электрораспылительная массспектрометрия: 247 (М-Н)-. Стадия 5. 4-[4-(бут-2-Инилокси)фенокси]N-гидроксибутирамид. 32 Аналогично способу по примеру 9 (стадия 3), используя 0,36 г (1,33 ммоль) 4-[4-(бут-2 инилокси)фенокси]масляной кислоты, получают 0,237 г (68%) гидроксамовой кислоты в виде белого твердого вещества; т.п. 123-125 С. Электрораспылительная масс-спектрометрия: 263,9(М-Н)-. Пример 11. 2-[4-(бут-2-Инилокси)фенокси]-N-гидроксиацетамид. Этиловый эфир [4-(бут-2-инилокси)фенокси]уксусной кислоты. К суспензии 600 мг (0,015 моль) 60% гидрида натрия в 100 мл толуола добавляют 3,0 г(0,015 моль) 4-(бензилокси)фенола, реакционную смесь перемешивают при комнатной температуре в течение 30 мин и добавляют 1,61 мл(0,015 моль) этилхлорацетата. Полученную смесь нагревают до температуры кипячения с обратным холодильником в течение ночи и фильтруют. Фильтрат промывают 0,5 н раствором гидроксида натрия, 3% раствором карбоната натрия, водой и насыщенным солевым раствором, сушат над Na2SO4, фильтруют и концентрируют в вакууме, получая при этом 2,62 г бис-эфира в виде белого твердого вещества; т.п. 65-67 С. К раствору 2,58 г (8,74 ммоль) вышеуказанного продукта в 200 мл этанола добавляют 0,81 г 5% палладия на угле и полученную смесь встряхивают под давлением водорода 2,45 атм(35 фунтов/кв.дюйм) в течение 4 ч. Полученную смесь фильтруют через Magnesol и концентрируют в вакууме, получая при этом 1,7 г фенола в виде серого твердого вещества; т.п. 100-105 С. Аналогично способу по примеру 10 (стадия 3), используя 1,65 г (8,41 ммоль) фенола и 0,63 мл 2-бутин-1-ола, получают 1,2 г (60%) бутинилового эфира в виде желтого масла. Электрораспылительная масс-спектрометрия: 248,8 (М+Н)+.[4-(бут-2-Инилокси)фенокси]уксусная кислота. Аналогично способу по примеру 10 (стадия 4), используя 1,0 г (4,00 ммоль) этилового эфира [4-(бут-2-инилокси)фенокси]уксусной кислоты, получают 0,47 г карбоновой кислоты в виде белого твердого вещества; т.п. 114-116 С. Электрораспылительная масс-спектрометрия: 218,9 (М-Н)-. 2-[4-(бут-2-Инилокси)фенокси]-N-гидроксиацетамид. Аналогично способу по примеру 9 (стадия 3),используя 0,40 г (1,82 ммоль) [4-(бут-2-инилокси)фенокси]уксусной кислоты, получают 0,20 г гидроксамовой кислоты в виде белого твердого вещества; т.п. 130-132 С. Электрораспылительная масс-спектрометрия: 235,9 (М+Н)+. Пример 12. 4-[4-(бут-2-Инилокси)фенил]N-гидроксибутирамид. 4-[4-(бут-2-Инилокси)фенил]масляная кислота. 33 К раствору 1,00 г (5,15 ммоль) 4-(4-метоксифенил)масляной кислоты в 100 мл дихлорметана при 0 С добавляют 15,5 мл (15,5 ммоль) трибромида бора, реакционную смесь оставляют нагреваться до комнатной температуры и перемешивают в течение 2 ч. Затем реакционную смесь выливают в 200 мл насыщенного раствора бикарбоната натрия и отделяют органический слой. Водный слой подкисляют концентрированным раствором НСl и экстрагируют дихлорметаном. Объединенные органические экстракты сушат над МgSO4, фильтруют и концентрируют в вакууме, получая при этом 0,696 г неочищенной 4-(4-гидроксифенил)масляной кислоты. К раствору 0,69 г 4-(4-гидроксифенил)масляной кислоты в 10 мл ДМФ добавляют 0,956 г бикарбоната натрия и 0,36 мл иодметана, после чего полученную смесь перемешивают при комнатной температуре в течение 5 ч. Затем реакционную смесь разбавляют водой, экстрагируют простым эфиром, сушат над MgSO4,фильтруют и концентрируют в вакууме, получая при этом 0,553 г метил 4-(4-гидроксифенил) бутирата. Аналогично способу по примеру 10 (стадия 3), используя 0,553 г (2,851 ммоль) метил 4(4-гидроксифенил)бутирана и 0,256 мл 2-бутин 1-ола, получают 0,294 г простого бутинилового эфира-сложного метилового эфира, для чего продукт хроматографируют на силикагеле,элюируя смесью этилацетат/гексан (1:10). К раствору 0,294 г (1,195 ммоль) простого бутинилового эфира-сложного метилового эфира в 12 мл ТГФ/метанола (1:1) добавляют 6,0 мл 1 н. раствора гидроксида натрия и полученную смесь перемешивают при комнатной температуре в течение 6 ч. Реакционную смесь подкисляют 5% раствором НСl, экстрагируют этилацетатом, сушат над MgSO4 и концентрируют в вакууме, получая при этом 0,223 г карбоновой кислоты в виде желтовато-коричневого твердого вещества. Электрораспылительная массспектрометрия: 231 (М-Н)-. 4-[4-(бут-2-Инилокси)фенил]-N-гидроксибутирамид. К раствору 0,189 г (0,815 ммоль) 4-[4-(бут 2-инилокси)фенил]масляной кислоты в 4,3 мл ДМФ добавляют 0,132 г (0,978 ммоль) 1-гидроксибензотриазола и 0,208 г (1,083 ммоль) гидрохлорида 1-[3-(диметиламино)пропил]-3-этилкарбодиимида и полученную смесь перемешивают при комнатной температуре в течение 1 ч. К реакционной смеси добавляют 0,23 мл 50% водного раствора гидроксиламина и перемешивают в течение ночи при комнатной температуре. Затем реакционную смесь разбавляют водой и экстрагируют этилацетатом. Объединенные органические экстракты промывают водой и насыщенным раствором бикарбоната натрия, сушат над Na2SO4, фильтруют и концентрируют в вакууме, получая при этом 0,156 г гидроксамовой кислоты в виде желтовато-коричневого 34 твердого вещества. Электрораспылительная масс-спектрометрия: 248,0 (М+Н)+. Пример 13. Гидроксиамид 2-[4-(бут-2-инилокси)фенилтио]-6-[2-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)ацетиламино]гексановой кислоты. Стадия А. Связывание 2-бром-6-фталоилкапроновой кислоты с гидроксидаминовой смолой. 4-O-Метилгидроксиаминофеноксиметилсополи(стирол-1%-дивинилбензольную)смолу 1 (20 г,1,1 мэкв./г) помещают в сосуд для синтеза пептидов (Chemglass Inc. Part Number CG-1866) и суспендируют в ДМФ (60 мл). Затем добавляют 2-бром-N-фталоилкапроновую кислоту (15 г, 2,0 экв.), гидрат 1-гидроксибензотриазола (HOBt,18 г, 6,0 экв.) и 1,3-диизопропилкарбодиимид(DIC, 14 мл, 4,0 экв.). Реакционную смесь встряхивают на ротационном шейкере при комнатной температуре в течение 2-16 ч. Затем реакционную смесь фильтруют и промывают ДМФ (3 х 50 мл). Отбирают образец смолы и анализируют его методом Кайзера. Если результаты анализа указывают на наличие свободного амина (смола синеет), повторяют вышеописанное связывание, в противном случае смолу промывают DCM (3 х 50 мл), МеОН (2 х 50 мл) иDCM (2 х 50 мл). (Промывка включает добавление растворителя и перемешивание при барботировании азота или встряхивание на ротационном шейкере в течение 1-5 мин и последующую фильтрацию в вакууме.) Смолу сушат в вакууме при комнатной температуре. Стадия В. Замещение бромида 4-гидроксибензолтиолом. Смолу, содержащую гидроксиамид 2-бром 6-фталоилгексановой кислоты, полученную на стадии А (20 г, 1,1 мэкв./г), суспендируют в ТГФ (50 мл). Добавляют 4-гидроксибензолтиол(12 г, 5,0 экв.), иодид натрия (13 г, 5,0 экв.) и 1,8-диазабицикло[5,4,0]ундец-7-ен (DBU, 8,9 мл,3,0 экв.). Реакционную смесь встряхивают при комнатной температуре в течение 12-16 ч. Затем реакционную смесь фильтруют и промывают ДМФ (2 х 20 мл), смесью ДМФ: вода (9:1) (2 х 20 мл),ДМФ (20 мл), МеОН (2 х 20 мл) и DCM (2 х 20 мл). Смолу сушат в вакууме при комнатной температуре. Стадия С. Алкилирование 2-бромбутином. Смолу, содержащую гидроксиамид 2-(4 гидроксифенилтио)-6-фталоилгексановой кислоты, полученную на стадии В (20 г, 1,1 мэкв./г) ,суспендируют в ТГФ (50 мл) и охлаждают до 0 С. Добавляют 2-бромбутин (8,0 мл, 2,0 экв.) и гидрид натрия (2,4 г, 3,0 экв.) и смесь встряхивают при комнатной температуре в течение ночи. Реакционную смесь фильтруют и промывают ДМФ (2 х 20 мл), МеОН (2 х 20 мл) и DCM(2 х 20 мл). Смолу сушат в вакууме при комнатной температуре. Стадия D. Удаление фталоильной группы. Смолу, содержащую гидроксиамид 2-[4(бут-2-инилокси)фенилтио]-6-фталоилгексановой кислоты, полученную на стадии С (3,4 г, 1,1 35 мэкв./г), суспендируют в ТГФ (150 мл) и добавляют этанол (150 мл) и гидразин (30 мл). Реакционную смесь встряхивают на ротационном шейкере при комнатной температуре в течение 12-24 ч. Затем реакционную смесь фильтруют и промывают DCM (2 х 50 мл), ДМФ (2 х 50 мл),МеОН (2 х 50 мл) и DCM (2 х 50 мл). Смолу сушат в вакууме при комнатной температуре. Стадия Е. Ацилирование первичного амина. Смолу, содержащую гидроксиамид 6 амино-2-[4-(бут-2-инилокси)фенилтио]гексановой кислоты, полученную на стадии D (0,33 г,1,1 мэкв./г), суспендируют в ДМФ (60 мл). Добавляют N-фталоилглицин (1,5 г, 4,0 экв.), гидрат 1-гидроксибензотриазола (HOBt, 1,43 г, 6,0 экв.) и 1,3-диизопропилкарбодиимид (DIC, 0,18 мл,4,0 экв.). Реакционную смесь встряхивают на ротационном шейкере при комнатной температуре в течение 2-16 ч. Затем реакционную смесь фильтруют и промывают ДМФ (3 х 5 мл). Отбирают образец смолы и анализируют методом Кайзера. Если результаты анализа указывают на наличие свободного амина (смола синеет), повторяют вышеописанное связывание, в противном случае смолу промывают DCM (3 х 5 мл),МеОН (2 х 5 мл) и DCM (2 х 5 мл). Смолу сушат в вакууме при комнатной температуре. Стадия F. Отщепление гидроксиамида 2[4-(бут-2-инилокси)фенилтио]-6-[2-(1,3-диоксо 1,3-дигидроизоиндол-2-ил)ацетиламино]гексановой кислоты от смолы. Смолу, содержащую гидроксиамид 2-[4(бут-2-инилокси)фенилтио]-6-[2-(1,3-диоксо 1,3-дигидроизоиндол-2-ил)ацетиламино]гексановой кислоты, полученную на стадии Е (0,33 г,1,1 мэкв./г) суспендируют в DCM (1,0 мл) и добавляют ТФУ (1,0 мл). Реакционную смесь встряхивают в течение 1 ч при комнатной температуре. Затем реакционную смесь фильтруют и смолу промывают DCM (2 х 1 мл). Фильтрат и промывные воды объединяют и концентрируют досуха в аппарате Savant SpeedVac Plus. Добавляют метанол (1 мл) и смесь концентрируют. Сырой продукт очищают ВЭЖХ с обращенной фазой в нижеследующих условиях. Колонка: ODS-AM, 20 мм х 50 мм, размер частиц 5 мкм (YMC, Inc. Wilmington, NorthCarolina) Градиент Время Вода Ацетонитрил растворителя 0,0 95 5 16 мин 5 95 Скорость потока: 22,5 мл/мин Пример 13. Гидроксиамид 2-[4-(бут-2-инилокси)фенилтио]-6-[2-(1,3-диоксо-1,3-дигидроизоиндол-2-ил) ацетиламино]гексановой кислоты характеризуется временем 2 удерживания ВЭЖХ 4,5 мин и МС 3 510 (М+Н). Нижеследующие соединения гидроксамовой кислоты синтезируют, выполняя стадии по Пример 23. [5-[4-(бут-2-Инилокси)фенилсульфинил]-5-гидроксикарбамоилпентил]амид хинолин-2-карбоновой кислоты. Стадия А. Окисление сульфида в сульфоксид. Смолу, содержащую гидроксиамид 2-[4(бут-2-инилокси)фенилтио]-6-фталоилгексановой кислоты, полученную по примеру 13, стадия С (6,7 г, 1,1 мэкв./г), суспендируют в DCM (200 мл) и добавляют 70% трет-бутилгидропероксид (45 мл) и бензолсульфоновую кислоту(2 г). Реакционную смесь встряхивают на ротационном шейкере при комнатной температуре в течение 12-24 ч. Затем реакционную смесь фильтруют и промывают DCM (2 х 50 мл), ДМФ(2 х 50 мл), МеОН (2 х 50 мл) и DCM (2 х 50 мл). Смолу сушат в вакууме при комнатной температуре. Стадия В. Удаление фталоильной группы. Из смолы, содержащей гидроксиамид 2-[4(бут-2-инилокси)фенилсульфинил]-6-фталоилгексановой кислоты, полученную на стадии А,удаляют защитную группу способом по примеру 13, стадия D, получая при этом смолу, содержащую гидроксиамид 6-амино-2-[4-(бут-2 инилокси)фенилсульфинил]гексановой кислоты. Стадия С. Ацилирование первичного амина. Смолу, содержащую гидроксиамид 6 амино-2-[4-(бут-2-инилокси)фенилсульфинил] гексановой кислоты (0,33 г, 1,1 мэкв./г), полученную на стадии В, ацилируют хинальдиновой кислотой (1,2 г, 4,0 экв.) способом по примеру 13, стадия Е, получая при этом смолу, содержащую [5-[4-(бут-2-инилокси)фенилсульфинил]5 37 гидроксикарбамоилпентил]амид хинолин-2-карбоновой кислоты. Стадия D. Отщепление [5-[4-(бут-2-инилокси) фенилсульфинил]-5-гидроксикарбамоилпентил] амида хинолин-2-карбоновой кислоты от смолы. Смолу, содержащую [5-[4-(бут-2-инилокси)фенилсульфинил]-5-гидроксикарбамоилпентил]амид хинолин-2-карбоновой кислоты, полученную на стадии С (0,33 г, 1,1 мэкв./г), расщепляют способом по примеру 13, стадия F, получая при этом продукт по примеру 23: [5-[4-(бут 2-инилокси)фенилсульфинил]-5-гидроксикарбамоилпентил]амид хинолин-2-карбоновой кислоты в виде смеси диастереомеров, которые характеризуются временем 2 удерживания ВЭЖХ 4,35/4,5 мин и МС 3 494 (М+Н). Нижеследующие соединения гидроксамовых кислот синтезируют, выполняя стадии по примеру 23 и используя N-фталоилглицин, 2 дибензилкарбоновую кислоту, 3,4-дихлорфенилуксусную кислоту, 3-хинолинкарбоновую кислоту, 4-(2-тиенил)масляную кислоту, ксантен-9-карбоновую кислоту, дифенилуксусную кислоту, 1-изохинолинкарбоновую кислоту, Nметилпиррол-2-карбоновую кислоту, тианафталин-3-уксусную кислоту или индол-3-уксусную кислоту.(6,7 г, 1,1 мэкв./г), суспендируют в DCM (200 мл) и добавляют mСРВА (8 г). Реакционную смесь встряхивают на ротационном шейкере при комнатной температуре в течение 12-24 ч. Затем 38 реакционную смесь фильтруют и промываютDCM (2 х 50 мл), ДМФ (2 х 50 мл), МеОН (2 х 50 мл) и DCM (2 х 50 мл). Смолу сушат в вакууме при комнатной температуре. Стадия В. Удаление фталоильной группы. Из смолы, содержащей гидроксиамид 2-[4(бут-2-инилокси)фенилсульфонил]-6-фталоилгексановой кислоты, полученной на стадии А,удаляют защитную группу способом по примеру 13, стадия D, получая при этом смолу, содержащую гидроксиамид 6-амино-2-[4-(бут-2 инилокси)фенилсульфинил]гексановой кислоты. Стадия С. Ацилирование первичного амина. Смолу, содержащую гидроксиамид 6 амино-2-[4-(бут-2-инилокси)фенилсульфонил] гексановой кислоты (0,33 г, 1,1 мэкв./г), полученную на стадии В, ацилируют 2-дибензилкарбоновой кислотой (1,6 г, 4,0 экв.) способом по примеру 13, стадия Е, получая при этом смолу, содержащую N-[5-[4-(бут-2-инилокси)фенилсульфонил]-5-гидроксикарбамоилпентил]-2 фенетилбензамид. Стадия D. Отщепление N-[5-[4-(бут-2 инилокси)фенилсульфонил]-5-гидроксикарбамоилпентил]-2-фенетилбензамид от смолы. Смолу, содержащую N-[5-[4-(бут-2-инилокси)фенилсульфонил]-5-гидроксикарбамоилпентил]-2-фенетилбензамид, полученную на стадии С (0,33 г, 1,1 мэкв./г), расщепляют способом по примеру 13, стадия F, получая при этом продукт по примеру 34: N-[5-[4-(бут-2-инилокси)фенилсульфонил]-5-гидроксикарбамоилпентил]-2-фенетилбензамид, который характеризуется временем 2 удерживания ВЭЖХ 5,0 мин и МС 3 541(М+Н). Нижеследующие соединения гидроксамовых кислот синтезируют, выполняя стадии по примеру 34 и используя хинальдиновую кислоту, N-фталоилглицин, 3,4-дихлорфенилуксусную кислоту, 3-хинолинкарбоновую кислоту,ксантен-9-карбоновую кислоту, дифенилуксусную кислоту, 1-изохинолинкарбоновую кислоту или тианафталин-3-уксусную кислоту. Пример 43. Гидроксиамид 2-[4-(бут-2 инилокси)фенилтио]-6-2-[2-(3,4-дихлорфенил) ацетиламино]ацетиламиногексановой кислоты. Стадия А. Удаление фталоильной группы. Из смолы, содержащей гидроксиамид 2-[4(бут-2-инилокси)фенилтио]-6-[2-(1,3-диоксо-1,3 дигидроизоиндол-2-ил)ацетиламино]гексановой кислоты, полученной в примере 13, стадия Е,удаляют защитную группу способом по примеру 13, стадия D, получая при этом смолу, содержащую гидроксиамид 6-(аминоацетиламино)-2-[4-(бут-2-инилокси)фенилсульфинил]гексановой кислоты. Стадия В. Ацилирование первичного амина. Смолу, содержащую гидроксиамид 6-(аминоацетиламино)-2-[4-(бут-2-инилокси)фенилсульфинил]гексановой кислоты (0,33 г, 1,1 мэкв./г),полученную на стадии А, ацилируют 3,4 дихлорфенилуксусной кислотой (1,5 г, 4,0 экв.) способом по примеру 13, стадия Е, получая при этом смолу, содержащую гидроксиамид 2-[4(бут-2-инилокси)фенилтио]-6-2-[2-(3,4-дихлорфенил)ацетиламино]ацетиламиногексановой кислоты. Стадия C. Отщепление гидроксиамида 2[4-(бут-2-инилокси)фенилтио]-6-2-[2-(3,4-дихлорфенил)ацетиламино]ацетиламиногексановой кислоты от смолы. Смолу, содержащую гидроксиамид 2-[4(бут-2-инилокси)фенилтио]-6-2-[2-(3,4-дихлорфенил)ацетиламино]ацетиламиногексановой кислоты, полученную на стадии В (0,33 г, 1,1 мэкв./г), расщепляют способом по примеру 13,стадия F, получая при этом продукт по примеру 43: гидроксиамид 2-[4-(бут-2-инилокси)фенилтио]6-2-[2-(3,4-дихлорфенил)ацетиламино]ацетиламиногексановой кислоты, который характеризуется временем 2 удерживания ВЭЖХ 4,94 мин и МС 3 567 (М+Н). Нижеследующие соединения гидроксамовых кислот синтезируют, выполняя стадии по примеру 43 и используя хинальдиновую кислоту, N-фталоилглицин, 2-дибензилкарбоновую кислоту, 3-хинолинкарбоновую кислоту, ксантен-9-карбоновую кислоту, дифенилуксусную кислоту, 1-изохинолинкарбоновую кислоту, Nметилпиррол-2-карбоновую кислоту или тианафталин-3-уксусную кислоту. Пример 53. [5-[4-(бут-2-Инилокси)фенилсульфинил]-5-гидроксикарбамоилпентил]амид хинолин-3-карбоновой кислоты. Стадия А. Окисление сульфида в сульфоксид. Смолу, содержащую гидроксиамид 2-[4(бут-2-инилокси)фенилтио]-6-[2-(1,3-диоксо-1,3 дигидроизоиндол-2-ил)ацетиламино]гексановой кислоты, полученную в примере 13, стадия Е,окисляют способом по примеру 23, стадия А,получая при этом смолу, содержащую гидроксиамид 2-[4-(бут-2-инилокси)фенилсульфинил]-6[2-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)ацетиламино]гексановой кислоты. Стадия В. Удаление фталоильной группы. Из смолы, содержащей гидроксиамид 2-[4(бут-2-инилокси)фенилсульфинил]-6-[2-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)ацетиламино] гексановой кислоты, полученной на стадии А,удаляют защитную группу способом по примеру 13, стадия D, получая при этом смолу, содержащую гидроксиамид 6-(аминоацетиламино)-2-[4-(бут-2-инилокси)фенилсульфинил]гексановой кислоты. Стадия С. Ацилирование первичного амина. Смолу, содержащую гидроксиамид 6-(аминоацетиламино)-2-[4-(бут-2-инилокси)фенилсульфинил]гексановой кислоты (0,33 г, 1,1 мэкв./г),полученную на стадии В, ацилируют 3-хинолинкарбоновой кислотой (1,2 г, 4,0 экв.) способом по примеру 13, стадия Е, получая при этом смолу, содержащую [5-[4-(бут-2-инилокси)фенилсульфинил]-5-гидроксикарбамоилпентил] амид хинолин-3-карбоновой кислоты. Стадия D. Отщепление [5-[4-(бут-2-инилокси) фенилсульфинил]-5-гидроксикарбамоилпентил] амида хинолин-3-карбоновой кислоты от смолы. 41 Смолу, содержащую [5-[4-(бут-2-инилокси)фенилсульфинил]-5-гидроксикарбамоилпентил]амид хинолин-3-карбоновой кислоты, полученную на стадии С (0,33 г, 1,1 мэкв./г), расщепляют способом по примеру 13, стадия F, получая при этом продукт по примеру 53: [5-[4-(бут 2-инилокси)фенилсульфинил]-5-гидроксикарбамоилпентил]амид хинолин-3-карбоновой кислоты в виде смеси диастереомеров, которые характеризуются временем 2 удерживания ВЭЖХ 3,49 мин и МС 3 551 (М+Н). Нижеследующие соединения гидроксамовых кислот синтезируют, выполняя стадии по примеру 53 и используя хинальдиновую кислоту, N-фталоилглицин, 2-дибензилкарбоновую кислоту, 3,4-дихлорфенилуксусную кислоту, 4(2-тиенил)масляную кислоту, ксантен-9-карбоновую кислоту, дифенилуксусную кислоту и Nметилпиррол-2-карбоновую кислоту. Пример 62. Гидроксиамид 2-[4-(бут-2 инилокси)фенилсульфонил]-6-(2-дифенилацетиламиноацетиламино)гексановой кислоты. Стадия А. Окисление сульфида в сульфон. Смолу, содержащую гидроксиамид 2-[4(бут-2-инилокси)фенилтио]-6-[2-(1,3-диоксо-1,3 дигидроизоиндол-2-ил)ацетиламино]гексановой кислоты, полученную в примере 13, стадия Е,окисляют способом по примеру 34, стадия А,получая при этом смолу, содержащую гидроксиамид 2-[4-(бут-2-инилокси)фенилсульфонил]-6[2-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)ацетиламино]гексановой кислоты. Стадия В. Удаление фталоильной группы. Из смолы, содержащей гидроксиамид 2-[4(бут-2-инилокси)фенилсульфонил]-6-[2-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)ацетиламино] гексановой кислоты, полученной на стадии А,удаляют защитную группу способом по примеру 13, стадия D, получая при этом смолу, содержащую гидроксиамид 6-(аминоацетилами 004883 42 но)-2-[4-(бут-2-инилокси)фенилсульфинил]гексановой кислоты. Стадия С. Ацилирование первичного амина. Смолу, содержащую гидроксиамид 6-(аминоацетиламино)-2-[4-(бут-2-инилокси)фенилсульфонил]гексановой кислоты (0,33 г, 1,1 мэкв./г),полученную на стадии В, ацилируют дифенилуксусной кислотой (1,5 г, 4,0 экв.) способом по примеру 13, стадия Е, получая при этом смолу,содержащую гидроксиамид 2-[4-(бут-2-инилокси)фенилсульфонил]-6-(2-дифенилацетиламиноацетиламино)гексановой кислоты. Стадия D. Отщепление гидроксиамида 2[4-(бут-2-инилокси)фенилсульфонил]-6-(2-дифенилацетиламиноацетиламино)гексановой кислоты от смолы. Смолу, содержащую гидроксиамид 2-[4-(бут 2-инилокси)фенилсульфонил]-6-(2-дифенилацетиламиноацетиламино)гексановой кислоты, полученную на стадии С (0,33 г, 1,1 мэкв./г), расщепляют способом по примеру 13, стадия F,получая при этом продукт по примеру 62: гидроксиамид 2-[4-(бут-2-инилокси)фенилсульфонил]6-(2-дифенилацетиламиноацетиламино)гексановой кислоты, который характеризуется временем 2 удерживания ВЭЖХ 4,90 мин и МС 3 606(М+Н). Нижеследующие соединения гидроксамовых кислот синтезируют, выполняя стадии по примеру 62 и используя N-фталоилглицин, 2 дибензилкарбоновую кислоту, 3,4-дихлорфенилуксусную кислоту, 3-хинолинкарбоновую кислоту, ксантен-9-карбоновую кислоту, 1-изохинолинкарбоновую кислоту, тианафтен-3-уксусную кислоту или индол-3-уксусную кислоту.Letters, 1997, 38, 321-322. 2. Условия выполнения жидкостной хроматографии: устройство Hewlett Packard 1100;(7,36 г, 39,96 ммоль) в 30 мл ДМФ добавляют 5 гK2 СО 3. Реакционную смесь перемешивают при 80 С в течение ночи. Смесь охлаждают, гасят водой и экстрагируют СНСl3. Органический слой отделяют, сушат над Na2SO4, фильтруют и концентрируют. Выделяют 2-[4-(2-пиперидин-1 илэтокси)фенил]этанол (4,58 г, 18,4 ммоль) в виде коричневого масла. Выход 51%; МС: 250,3(4,23 г, 16,98 ммоль) растворяют в 200 мл ТГФ. Газообразный НСl барботируют через раствор при 0 С в течение 5 мин. При 0 С по каплям добавляют тионилхлорид (2,48 мл, 33,9 ммоль). Реакционную смесь кипятят с обратным холодильником в течение 2 ч и концентрируют. Выделяют 1-2-[4-(хлорэтил)фенокси]этилпиперидин (4,74 г, 15,6 ммоль) в виде коричневого полутвердого вещества. Выход 92%; МС: 268,3(М+Н)+. Стадия 3. Этил-2-[4-(бут-2-инилокси)фенил]сульфонил-4-4-[2-(1-пиперидинил)этоксифенилбутаноат получают общим способом по примеру 1(стадия 4), используя в качестве исходных веществ 1-2-[4-(хлорэтил)фенокси]этилпиперидин (4,74 г, 15,64 ммоль) и этиловый эфир [4(бут-2-инилокси)фенилсульфонил]уксусной кислоты (3,56 г, 12 ммоль); 1,21 г сырого продукта. Выход 19%; коричневое масло; МС: 528,1 (М+Н)+. Стадия 4. 2-[4-(бут-2-Инилокси)фенил]сульфонил 4-4-[2-(1-пиперидинил)этокси]фенилбутановую кислоту получают общим способом по примеру 1 (стадия 5). Используя в качестве исходного вещества этил-2-[4-(бут-2-инилокси) фенил]сульфонил-4-4-[2-(1-пиперидинил)этоксифенилбутаноат (1,21 г, 2,29 ммоль), выделяют 750 мг не совсем белого твердого вещества. Выход 65%; МС: 500,3 (М+Н)+. Стадия 5. Используя в качестве исходного вещества 2-[4-(бут-2-инилокси)фенил]сульфонил-4-4 004883[2-(1-пиперидинил)этокси]фенилбутановую кислоту (660 мг, 1,32 ммоль) и выполняя способ по примеру 1 (стадия 6), выделяют 50 мг 2-[4-(бут 2-инилокси)фенил]сульфонил-N-гидрокси-44-[2-(1-пиперидинил)этоксифенилбутанамида в виде бледно-желтого твердого вещества; т.п. 68 С. Выход 7%; МС: 515,2 (М+Н)+. 1H-ЯМР(с, 1 Н), 9,88 (с, 1 Н). Пример 72. 2-[4-(бут-2-Инилокси)фенил] сульфонил-7-циано-N-гидроксигептанамид. Этил-2-[4-(бут-2-инилокси)фенил]сульфонил-7-цианогептаноат получают общим способом по примеру 1 (стадия 4), используя в качестве исходных веществ этиловый эфир [4-(бут 2-инилокси)фенилсульфонил]уксусной кислоты(10 г, 33,8 ммоль) и 6-бромгексаннитрил (4,48 мл, 33,8 ммоль); 7,9 г белого твердого вещества; т.п. 63 С. Выход 60%; МС (EI): 391,4 (М+Н)+. 2-[4-(бут-2-Инилокси)фенил]сульфонил 7-цианогептановую кислоту получают общим способом по примеру 1 (стадия 5), используя в качестве исходного вещества этил-2-[4-(бут-2 инилокси)фенил]сульфонил-7-цианогептаноат(300 мг, 0,77 ммоль); 230 мг желтого геля. Выход 82%; МС: 362,4 (М-Н)-. Используя в качестве исходного вещества 2-[4-(бут-2-инилокси)фенил]сульфонил-7-цианогептановую кислоту (3,78 г, 10,4 ммоль) и выполняя способ по примеру 1 (стадия 6), выделяют 1,11 г 2-[4-(бут-2-инилокси)фенил]сульфонил-7-циано-N-гидроксигептанамида в виде белого порошка; т.п. 120 С. Выход 28%; МС: 379,3 (М+Н)+. 1H-ЯMP (300 МГц, ДМСО-d6):1,16-1,31 (полоса, 4 Н), 1,44 (м, 2 Н), 1,69 (м, 2 Н),1,85 (с, 3 Н), 2,42 (т, J=7 Гц, 2 Н), 3,71 (т, J=7,3 Гц,1 Н), 4,89 (д, 2,19 Гц, 2 Н), 7,18 (д, J=8,9 Гц, 2 Н),7,72 (д, J=8,9 Гц, 2 Н), 9,24 (с, 1 Н), 10,88 (с, 1 Н). Пример 73. 2-[4-(бут-2-Инилокси)фенил] тио-2-циклогексил-N-гидроксиацетамид. Стадия 1. 2-Бромциклогексилуксусная кислота. К раствору циклогексилуксусной кислоты(10 г, 70 ммоль) в 100 мл ССl4 добавляют красный фосфор (6,32 г, 204 ммоль). Смесь нагревают до температуры кипения с обратным холодильником и в течение 3 ч по каплям добавляют бром (70,7 мл, 1,38 ммоль) через конденсатор с капельной воронкой. Реакционную смесь кипятят с обратным холодильником в течение 5 ч,медленно гасят водой и промывают 10%Na2SO4, водой и затем в NaHCO3. Раствор бикарбоната натрия доводят до кислого значения рН, используя 1 н раствор НСl. Твердое вещество собирают и водный фильтрат экстрагируют СНСl3, промывают насыщенным растворомNa2HSO4 и водой. Органический слой сушат надNa2SO4, фильтруют, концентрируют и объединяют с ранее собранным твердым веществом,получая при этом 3,22 г 2-бромциклогексилуксусной кислоты в виде белого твердого вещества. Выход 21%; МС: 219,1 (М-Н)-. Стадия 2. Этилциклогексил-[4-(гидроксифенил)тио] уксусную кислоту получают общим способом по примеру 1 (стадия 1), используя в качестве исходных веществ 2-бромциклогексилуксусную кислоту (3,08 г, 13,9 ммоль) и 4-меркаптофенол(2 г, 14,2 ммоль); 3,10 г желтого масла. Полученный продукт является достаточно чистым и пригоден для использования в дальнейшем синтезе. Выход 84%; МС: 265 (М+Н)+. Стадия 3. Этилциклогексил-[4-(гидроксифенил)тио]ацетат. К раствору этилциклогексил-[4-(гидроксифенил)тио]уксусной кислоты (3,1 г, 11,65 ммоль) в 100 мл этанола добавляют 1 мл серной кислоты. Смесь кипятят с обратным холодильником в течение ночи, концентрируют, экстрагируют в метиленхлориде, промывают сначала насыщенным раствором NаНСО 3 и затем водой. Органический слой сушат над Na2SO4, фильтруют через магнезол и концентрируют, получая при этом 1,22 г этилциклогексил[4-(гидроксифенил)тио]ацетата в виде желтого масла. Выход 35%; МС: 295,4 (М+Н)+. Стадия 4. Этил[4-(бут-2-инилокси)фенил]тио(циклогексил)ацетат получают общим способом по примеру 1 (стадия 2), используя в качестве исходных веществ этилциклогексил[4-(гидроксифенил)тио]ацетат (1 г, 3,4 ммоль) и 4-бром-2 бутин (0,32 мл, 3,7 ммоль); 1,25 г желтого масла. Выход 100%; МС (EI): 346,1 (М+Н)+. Стадия 5.[4-(бут-2-Инилокси)фенил]тио(циклогексил)уксусную кислоту получают общим способом по примеру 1 (стадия 5), используя в качестве исходного вещества этил[4-(бут-2-инилокси)фенил]тио(циклогексил)ацетат (1,2 г, 3,47 ммоль); 1,19 г желтого масла. Выход 100%; МС: 317,4 (М-Н)-. Стадия 6. Используя в качестве исходного вещества[4-(бут-2-инилокси)фенил]тио(циклогексил) уксусную кислоту и выполняя способ по примеру 1 (стадия 6), выделяют 672 мг 2-[4-(бут-2 инилокси)фенил]тио-2-циклогексил-N-гидроксиацетамида в виде белого порошка; т.п. 163 С. Выход 75%; МС: 334,1 (М+Н)+. 1H-ЯMP (300 МГц, ДМСО-d6):0,86-1,12 (полоса, 5 Н), 1,62(м, 5 Н), 1,83 (т, J=2,25 Гц, 3 Н), 2,05 (д, J=11,9 Гц, 1 Н), 3,12 (д, J=9,1 Гц, 1 Н), 4,73 (д, J=2,34 Гц,2 Н), 6,92 (д, J=8,7 Гц, 2 Н), 7,36 (д, J=8,7 Гц, 2 Н),8,92 (с, 1 Н), 10,5 (с, 1 Н). Пример 74. 2-[4-(бут-2-Инилокси)фенил] сульфинил-2-циклогексил-N-гидроксиацетамид. Используя в качестве исходного вещества 2-[4-(бут-2-инилокси)фенил]тио-2-циклогексил 004883N-гидроксиацетамид (580 мг, 1,74 ммоль) и выполняя способ по примеру 7, выделяют 230 мг 2-[4-(бут-2-инилокси)фенил]сульфинил-2-циклогексил-N-гидроксиацетамида в виде белого твердого вещества; т.п. 188 С. Выход 38%; МС: 350,2 (М+Н)+. 1H-ЯМР (300 МГц, ДМСО-d6):1,05 (м, 3 Н), 1,24 (м, 2 Н), 1,41-1,72 (полоса, 5 Н),1,84 (т, J=2,22 Гц, 3 Н), 2,5 (м, 1 Н), 3,14 (д,J=7,23 Гц, 1 Н), 4,89 (м, 2 Н), 7,16 (д, J=9 Гц, 2 Н),7,61 (д, J=8,7 Гц, 2 Н), 9,0 (д, 1 Н), 10,4 (д, 1 Н). Пример 75. 2-[4-(бут-2-Инилокси)фенил] сульфонил-2-циклогексил-N-гидроксиацетамид. К перемешиваемому раствору 2-[4-(бут-2 инилокси)фенил]сульфинил-2-циклогексил-Nгидроксиацетамида (180 мг, 0,52 ммоль) в МеОН/ ТГФ при комнатной температуре добавляют оксон (5,0 г, избыток) в воде (20 мл). Реакционную смесь перемешивают при комнатной температуре в течение 6 ч и фильтруют. Слой метанола-ТГФ концентрируют и экстрагируют хлороформом. Органический слой тщательно промывают водой, сушат, фильтруют и концентрируют. Продукт очищают хроматографией на колонке с силикагелем, элюируя смесью этилацетат:гексан (4:1), и выделяют 2-[4-(бут-2 инилокси)фенил]сульфонил-2-циклогексил-Nгидроксиацетамид в виде белого твердого вещества; т.п. 191 С. Выход 45 мг (24%); МС: 366,3(д, J=2,34 Гц, 2 Н), 7,16 (д, J=9 Гц, 2 Н), 7,76 (д,J=9 Гц, 2 Н), 9,01 (с, 1 Н), 10,7 (с, 1 Н). Пример 76. 2-[4-(бут-2-Инилокси)фенил] тио-N-гидрокси-2-(4-метоксифенил)ацетамид. Стадия 1. Этил[(4-гидроксифенил)тио](4 метоксифенил)ацетат. Этилбром(4-метоксифенил)ацетат (16,5 г,60,4 ммоль) добавляют к перемешиваемому раствору триэтиламина (10 мл) и 4-меркаптофенола(7,63 г, 60,4 ммоль) в хлороформе (200 мл). Смесь кипятят с обратным холодильником в течение ночи и концентрируют, остаток экстрагируют в этилацетате и промывают водой. Органический слой сушат над Na2SO4, фильтруют и концентрируют. Соединение выделяют при помощи хроматографии на колонке с силикагелем, элюируя раствором 20% этилацетат:гексан. Этил[(4-гидроксифенил)тио](4-метоксифенил) ацетат выделяют в виде желтого масла (15,82 г). Выход 82%; МС: 317,2 (М-Н)-. Этил[4-(бут-2-инилокси)фенил]тио(4 метоксифенил)ацетат получают общим способом по примеру 1 (стадия 1), используя в качестве исходных веществ этил[(4-гидроксифенил) тио](4-метоксифенил)ацетат (15,82 г, 49,7 ммоль) и 4-бром-2-бутин (4,79 мл, 54,7 ммоль); 17,66 г желтого масла. Выход 96%; МС (EI): 370,1 47 способом по примеру 1 (стадия 5) (гидролиз осуществляют при комнатной температуре в течение 24 ч), используя в качестве исходного вещества этил[4-(бут-2-инилокси)фенил]тио[4-(бут-2-инилокси)фенил]тио(4-метоксифенил) уксусную кислоту (5,59 г, 16,3 ммоль) и выполняя способ по примеру 1 (стадия 6), выделяют 450 мг 2-[4-(бут-2-инилокси)фенил]тио-Nгидрокси-2-(4-метоксифенил)ацетамида в виде белого твердого вещества; т.п. 156 С. Выход 8%; МС: 358,3 (М+Н)+. 1H-ЯМР (300 МГц, ДМСОd6):1,82 (т, J=2,25 Гц, 3 Н) , 3,72 (с, 3 Н), 4,65(д, 2 Н), 7,53 (д, 2 Н), 9,0 (с, 1 Н), 10,8 (с, 1 Н). Пример 77. (2R)-2-[4-(бут-2-Инилокси) фенил]сульфинил-N-гидрокси-2-(4-метоксифенил)этанамид. Пример 78. (2S)-2-[4-(бут-2-Инилокси) фенил]сульфинил-N-гидрокси-2-(4-метоксифенил)этанамид. Используя в качестве исходного вещества 2-[4-(бут-2-инилокси)фенил]тио-N-гидрокси 2-(4-метоксифенил)ацетамид (полученный в примере 76) (340 мг, 0,95 ммоль) и выполняя способ по примеру 7, получают смесь двух диастереоизомеров. Полученные диастереоизомеры разделяют хроматографией на колонке с силикагелем, элюируя смесью 50% этилацетат:гексан. Более подвижный изомер, а именно (2R)-2[4-(бут-2-инилокси)фенил]сульфинил-N-гидрокси-2-(4-метоксифенил)этанамид, выделяют в виде белого порошка; т.п. 157 С. Выход 49,0 мг(с, 1 Н). Пример 79. 2-[4-(бут-2-Инилокси)фенил] сульфонил-N-гидрокси-2-(4-метоксифенил) ацетамид. Используя в качестве исходного вещества 2-[4-(бут-2-инилокси)фенил]тио-N-гидрокси 2-(4-метоксифенил)ацетамид (290 мг, 0,8 ммоль) и выполняя способ по примеру 75, выделяют 120 мг 2-[4-(бут-2-инилокси)фенил]сульфонилN-гидрокси-2-(4-метоксифенил)ацетамида в виде белого порошка; т.п. 190 С. Выход 39%; МС: 390,2 (М+Н)+. 1H-ЯМР (300 МГц, ДМСО-d6):1,85 (т, J=2,22 Гц, 3 Н), 3,74 (с, 3 Н), 4,85 (д, 004883(д, J=9 Гц, 2 Н), 9,24 (д, J=1,5 Гц, 1 Н), 10,9 (с, 1 Н). Пример 80. 2-[4-(бут-2-Инилокси)фенил] тио-2-(4-хлорфенил)-N-гидроксиацетамид. Этил(4-хлорфенил)[(4-гидроксифенил)тио] ацетат получают общим способом по примеру 1(стадия 1), используя в качестве исходных веществ этилбром(4-хлорфенил)ацетат (16,5 г, 59,6 ммоль) и 4-меркаптофенол (7,5 г, 59,6 ммоль); 18,8 г белого твердого вещества; т.п. 63 С. Выход 97%; МС: 321,3 (М-Н)-. Этил[4-(бут-2-инилокси)фенил]тио(4-хлорфенил)ацетат получают общим способом по примеру 1 (стадия 2), используя в качестве исходных веществ этил(4-хлорфенил)[(4-гидроксифенил)тио]ацетат (15,37 г, 47,7 ммоль) и 4 бром-2-бутин (4,26 мл, 48,7 ммоль); 12,57 г желтого масла. Выход 69%; МС (EI): 374 (М+Н)+.[4-(бут-2-Инилокси)фенил]тио(4-хлорфенил)уксусную кислоту получают общим способом по примеру 1 (стадия 5), используя в качестве исходного вещества этил[4-(бут-2-инилокси)фенил]тио(4-хлорфенил)ацетат (3,91 г,10,5 ммоль); 2,63 г желтого масла. Выход 72%; МС: 345,2 (М-Н)-. Используя в качестве исходного вещества[4-(бут-2-инилокси)фенил]тио(4-хлорфенил) уксусную кислоту (2,43 г, 7,02 ммоль) и выполняя способ по примеру 1 (стадия 6), получают 65 мг 2-[4-(бут-2-инилокси)фенил]тио-2-(4 хлорфенил)-N-гидроксиацетамида в виде белого порошка; т.п. 152 С. Выход 3%; МС: 362,2(М+Н)+. 1H-ЯМР (300 МГц, ДMCO-d6):1,82 (т,J=2,31 Гц, 3 Н), 4,72 (м, 3 Н), 6,89 (д, 2 Н), 7,26 (д,2 Н), 7,4 (м, 4 Н), 9,1 (с, 1 Н), 10,9 (с, 1 Н). Пример 81. 2-[4-(бут-2-Инилокси)фенил] сульфинил-2-(4-хлорфенил)-N-гидроксиацетамид. Используя в качестве исходного вещества 2-[4-(бут-2-инилокси)фенил]тио-2-(4-хлорфенил)-N-гидроксиацетамид (полученный в примере 80) (1,35 г, 3,74 ммоль) и выполняя способ по примеру 7, выделяют 70 мг 2-[4-(бут-2 инилокси)фенил]сульфинил-2-(4-хлорфенил)N-гидроксиацетамида в виде белого порошка. Полученное соединение испытывают в виде смеси диастереоизомеров; т.п. 92 С. Выход 5%; МС: 378 (М+Н)+. 1H-ЯMP (300 МГц, ДМСО-d6):1,83 (т, J=2,25 Гц, 3 Н), 4,43 (с, 1 Н), 4,77 (д,J=2,37 Гц, 2 Н), 6,98 (д, 2 Н), 7,09 (д, 2 Н), 7,19 (д,2 Н), 7,34 (д, 2 Н), 9,32 (с, 1 Н), 11 (с, 1 Н). Пример 82. 2-[4-(бут-2-Инилокси)фенил] сульфонил-2-(4-хлорфенил)-N-гидроксиацетамид. Используя в качестве исходного вещества смесь 2-[4-(бут-2-инилокси)фенил]тио-2-(4 хлорфенил)-N-гидроксиацетамида (по примеру 80) и 2-[4-(бут-2-инилокси)фенил]сульфинил 2-(4-хлорфенил)-N-гидроксиацетамида (750 мг,1,99 ммоль) и выполняя способ по примеру 75,выделяют 228 мг 2-[4-(бут-2-инилокси)фенил] сульфонил-2-(4-хлорфенил)-N-гидроксиацета 49 мида в виде белого твердого вещества; т.п. 140 С. Выход 29%; МС: 394,2 (M+Н)+. 1H-ЯМР(300 МГц, ДМСО-d6):1,85 (т, J=2,19 Гц, 3 Н),4,86 (д, J=2,28 Гц, 2 Н), 5,05 (с, 1 Н), 7,1 (д, 2 Н),7,4 (м, 4 Н), 7,5 (д, 2 Н), 9,33 (с, 1 Н), 10,8 (с, 1 Н). Пример 83. 2-[4-(бут-2-Инилокси)фенил] тио-2-(3-хлорфенил)-N-гидроксиацетамид. Стадия 1. Этил(3-хлорфенил)[(4-гидроксифенил)тио] ацетат получают общим способом по примеру 1(стадия 1), используя в качестве исходных веществ этилбром(3-хлорфенил)ацетат (6,16 г, 16,5 ммоль) и 4-меркаптофенол (2,08 г, 16,5 ммоль); 4,36 г светлого масла. Выход 82%; МС: 321 (М-Н)-. Стадия 2. Этил[4-(бут-2-инилокси)фенил] тио(3-хлорфенил)ацетат. Этил(3-хлорфенил)[(4-гидроксифенил)тио] ацетат (4,2 г, 13 ммоль) перемешивают с ТГФ(100 мл) в сухой двугорлой колбе в инертных условиях. 2-Бутин-1-ол (0,97 мл, 13 ммоль), 1,1'(азодикарбонил)дипиперидин (3,94 г, 15,6 ммоль). Трибутилфосфин (3,90 мл, 15,6 ммоль) добавляют по каплям при 0 С. Реакционную смесь перемешивают при комнатной температуре в атмосфере азота в течение 2 ч и концентрируют. Остаток растирают с простым эфиром и фильтрат концентрируют. Этил[4-(бут-2-инилокси) фенил]тио(3-хлорфенил)ацетат выделяют в виде желтого масла (4,08 г) после выполнения хроматографии на колонке с силикагелем, используя метиленхлорид в качестве подвижной фазы. Выход 84%; МС (EI): 375 (М+Н)+.[4-(бут-2-Инилокси)фенил]тио(3-хлорфенил)уксусную кислоту получают общим способом по примеру 1 (стадия 5), используя в качестве исходного вещества этил[4-(бут-2-инилокси)фенил]тио(3-хлорфенил)ацетат (4,08 г,10,9 ммоль); 2,04 г не совсем белого порошка; т.п. 64 С. Выход 54%; МС: 691,4 (2 М-Н)-. Используя в качестве исходного вещества[4-(бут-2-инилокси)фенил]тио(3-хлорфенил) уксусную кислоту (1,86 г, 5,37 ммоль) и выполняя способ по примеру 1 (стадия 6), выделяют 130 мг 2-[4-(бут-2-инилокси)фенил]тио-2-(3 хлорфенил)-N-гидроксиацетамида в виде белого порошка; т.п. 127 С. Выход 7%; МС: 362,1 (М+Н)+. 1(м, 3 Н), 7,48 (с, 1 Н), 9,1 (с, 1 Н), 10,9 (с, 1 Н). Пример 84. 2-[4-(бут-2-Инилокси)фенил] сульфонил-2-(3-хлорфенил)-N-гидроксиацетамид. Используя в качестве исходного вещества смесь 2-[4-(бут-2-инилокси)фенил]тио-2-(3 хлорфенил)-N-гидроксиацетамида и 2-[4-(бут 2-инилокси)фенил]сульфинил-2-(3-хлорфенил)N-гидроксиацетамида (210 мг, 0,56 ммоль) и выполняя способ по примеру 75, получают 60 мг 2-[4-(бут-2-инилокси)фенил]сульфонил-2-(3 хлорфенил)-N-гидроксиацетамида в виде белого порошка; т.п. 50 С. Выход 27%; МС: 394,1J=2,22 Гц, 3 Н), 4,86 (д, J=2,31 Гц, 2 Н), 5,06 (с, 1 Н),7,12 (д, J=8,97 Гц, 2 Н), 7,19-7,39 (полоса, 2 Н),7,48 (м, 4 Н), 9,33 (д, J=1,2 Гц, 1 Н), 10,9 (с, 1 Н). Пример 85. 2-(4-Бромфенил)-2-[4-(бут-2 инилокси)фенил]тио-N-гидроксиацетамид. Этил(4-бромфенил)[(4-гидроксифенил)тио] ацетат получают общим способом по примеру 1(стадия 1), используя в качестве исходных веществ этилбром(4-бромфенил)ацетат (15 г, 45,6 ммоль) и 4-меркаптофенол (5,75 г, 45,6 ммоль); 15,39 г белого твердого вещества; т.п. 55,6 С. Выход 92%; МС: 365,1 (М-Н)-. Этил(4-бромфенил)[4-(бут-2-инилокси) фенил]тиоацетат получают общим способом по примеру 83 (стадия 2), используя в качестве исходных веществ этил(4-бромфенил)[(4-гидроксифенил)тио]ацетат (13,57 г, 36,9 ммоль) и 2-бутин-1-ол (2,77 мл, 36,9 ммоль); 9,05 г светлого масла. Выход 59%; МС (EI): 420,8 (М+Н)+.(4-Бромфенил)[4-(бут-2-инилокси)фенил] тиоуксусную кислоту получают общим способом по примеру 1 (стадия 5), используя в качестве исходного вещества этил(4-бромфенил)[4(бут-2-инилокси)фенил]тиоацетат (1,2 г, 2,86 ммоль); 860 мг коричневого масла. Выход 77%; МС: 389,2 (М-Н)-. Используя в качестве исходного вещества(4-бромфенил)[4-(бут-2-инилокси)фенил]тио уксусную кислоту (790 мг, 2,02 ммоль) и выполняя способ по примеру 1 (стадия 6), выделяют 61 мг 2-(4-бромфенил)-2-[4-(бут-2-инилокси)фенил]тио-N-гидроксиацетамида в виде белого твердого вещества; т.п. 153 С. Выход 24%; МС: 408 (М+Н)+. 1H-ЯМР (300 МГц,ДМСО-d6):1,82 (т, J=2,28 Гц, 3 Н), 4,68 (с, 1 Н),4,71 (кв, 2 Н), 6,89 (д, 2 Н), 7,25 (д, 2 Н), 7,36 (д,2 Н), 7,51 (д, 2 Н), 9,07 (с, 1 Н), 10,8 (с, 1 Н). Пример 86. (2S)-2-(4-Бромфенил)-2-[4(бут-2-инилокси)фенил]сульфинил-N-гидроксиацетамид. Пример 87. (2R)-2-(4-Бромфенил)-2-[4(бут-2-инилокси)фенил]сульфинил-N-гидроксиацетамид. Используя в качестве исходного вещества 2-(4-бромфенил)-2-[4-(бут-2-инилокси)фенил] тио-N-гидроксиацетамид (по примеру 85) (1,54 г,3,7 ммоль) и выполняя способ по примеру 7,выделяют два диастереоизомера. Полученные диастереоизомеры разделяют хроматографией на колонке с силикагелем, элюируя смесью 50% этилацетат:гексан. Более подвижный изомер, а именно (2S)-2-(4-бромфенил)-2-[4-(бут-2-инилокси)фенил]сульфинил-2-N-гидроксиацетамид,выделяют в виде белого твердого вещества; т.п. 167 С. Выход 170 мг (11%); МС: 424 (М+Н)+. 1 51 сульфинил-2-N-гидроксиацетамид, выделяют в виде не совсем белого твердого вещества; т.п. 93 С. Выход 20 мг (1,3%); МС: 423,9 (М+Н)+. 1H-ЯМР (300 МГц, ДМСО-d6):1,83 (т, J=2,13 Гц,3 Н), 4,42 (с, 1 Н), 4,77 (д, J=2,28 Гц, 2 Н), 7,0 (м, 4 Н),7,2 (д, 2 Н), 7,5 (д, 2 Н), 9,33 (с, 1 Н), 10,9 (с, 1 Н). Пример 88. 2-(4-Бромфенил)-2-[4-(бут-2 инилокси)фенил]сульфонил-N-гидроксиацетамид. Используя в качестве исходного вещества смесь 2-(4-бромфенил)-2-[4-(бут-2-инилокси) фенил]тио-N-гидроксиацетамида и 2-(4-бромфенил)-2-[4-(бут-2-инилокси)фенил]сульфинил 2-N-гидроксиацетамида (1,42 г, 3,4 ммоль) и выполняя способ по примеру 75, выделяют 610 мг 2-(4-бромфенил)-2-[4-(бут-2-инилокси)фенил] сульфонил-N-гидроксиацетамида в виде белого твердого вещества; т.п. 187 С. Выход 41%; МС: 440 (М+Н)+. 1 Н-ЯМР (300 МГц, ДМСО-d6):1,85 (т, J=2,22 Гц, 3 Н), 4,86 (д, J=2,31 Гц, 2 Н),5,03 (с, 1 Н), 7,11 (д, 2 Н), 7,31 (д, 2 Н), 7,47 (д,2 Н), 7,55 (д, 2 Н), 9,32 (с, 1 Н), 10,9 (с, 1 Н). Пример 89. 2-[4-(бут-2-Инилокси)фенил] тио-N-гидрокси-2-[4-(2-тиенил)фенил]ацетамид. Стадия 1. Этил[4-(2-тиенил)фенил]ацетат. Азот барботируют через смесь 2-трибутилстаннилтиофена (15,68 мл, 49,4 ммоль) и этил(4 бромфенил)ацетата (6 г, 24,7 ммоль) в толуоле(250 мл) и добавляют 0,5 г тетракис(трифенилфосфин)палладия(0). Смесь кипятят с обратным холодильником в атмосфере азота в течение 4 ч,фильтруют через магнезол и концентрируют. Остаток очищают хроматографией на колонке с силикагелем, элюируя раствором 20% этилацетат/гексан. Этил[4-(2-тиенил)фенил]ацетат получают в виде желтого масла (4,15 г). Выход 68%; МС: 247,5 (М+Н)+. Стадия 2. Этилбром[4-(2-тиенил)фенил] ацетат. К раствору этил[4-(2-тиенил)фенил]ацетата(4,1 г, 16,6 ммоль) в тетрахлорметане (150 мл) добавляют бензоилпероксид (0,5 г) и N-бромсукцинимид (3,26 г, 18,3 ммоль). Смесь кипятят с обратным холодильником в атмосфере азота в течение 3 ч, фильтруют и концентрируют. Остаток экстрагируют хлороформом и промывают водой. Органический слой сушат над Na2SO4,фильтруют и концентрируют. Остаток очищают хроматографией на колонке с силикагелем, производя элюирование раствором 15% этилацетат:гексан. Этилбром[4-(2-тиенил)фенил]ацетат выделяют в виде низкоплавкого белого твердого вещества (2,19 г). Выход 40%; МС (EI): 325,2(М+Н)+. Этил[(4-гидроксифенил)тио][4-(2-тиенил) фенил]ацетат получают общим способом по примеру 1 (стадия 1), используя в качестве исходных веществ этилбром[4-(2-тиенил)фенил] ацетат (2 г, 6,15 ммоль) и 4-меркаптофенол (0,82 г,6,5 ммоль); 1,68 г белого твердого вещества; т.п. 103 С. Выход 73%; МС: 369,1 (М-Н)-. 52 Этил[4-(бут-2-инилокси)фенил]тио[4-(2 тиенил)фенил]ацетат получают общим способом по примеру 83 (стадия 2), используя в качестве исходных веществ этил[(4-гидроксифенил) тио][4-(2-тиенил)фенил]ацетат (1,6 г, 4,3 ммоль) и 2-бутин-1-ол (0,33 мл, 4,32 ммоль); 1,34 г желтого масла. Выход 74%; МС (EI): 421,71 (М+Н)+.[4-(бут-2-Инилокси)фенил]тио[4-(2-тиенил)фенил]уксусную кислоту получают общим способом по примеру 1 (стадия 5), используя в качестве исходного вещества этил[4-(бут-2 инилокси)фенил]тио[4-(2-тиенил)фенил]ацетат[4-(бут-2-инилокси)фенил]тио[4-(2-тиенил) фенил]уксусную кислоту (840 мг, 2,13 ммоль) и выполняя способ по примеру 1 (стадия 6), выделяют 1,052 г 2-[4-(бут-2-инилокси)фенил]тиоN-гидрокси-2-[4-(2-тиенил)фенил]ацетамида в виде белого твердого вещества; т.п. 182 С. Выход 99%; МС: 410 (М+Н)+. 1H-ЯМР (300 МГц,ДМСО-d6):1,81 (т, J=2,31 Гц, 3 Н), 4,71 (м, 3 Н),6,9 (д, 2 Н), 7,13 (м, 1 Н), 7,28 (д, 2 Н), 7,44-7,62(полоса, 6 Н), 9,07 (с, 1 Н), 10,8 (с, 1 Н). Пример 90. (2R)-2-[4-(бут-2-Инилокси) фенил]сульфинил-N-гидрокси-2-[4-(2-тиенил) фенил]этанамид. Используя в качестве исходного вещества 2-[4-(бут-2-инилокси)фенил]тио-N-гидрокси 2-[4-(2-тиенил)фенил]ацетамид (1 г, 2,13 ммоль) и выполняя способ по примеру 7, выделяют 160 мг(2R)-2-[4-(бут-2-инилокси)фенил]сульфинилN-гидрокси-2-[4-(2-тиенил)фенил]этанамид в виде не совсем белого твердого вещества; т.п. 158 С. Выход 18%; МС: 425,9 (М+Н)+. 1H-ЯМР(300 МГц, ДМСО-d6):1,79 (т, J=2,1 Гц, 3 Н),4,43 (с, 1 Н), 4,75 (д, J=2,31 Гц, 2 Н), 6,98 (д,J=8,85 Гц, 2 Н), 7,12 (м, 3 Н), 7,22 (д, J=8,79 Гц,2 Н), 7,54 (м, 4 Н), 9,31 (д, 1 Н), 11 (с, 1 Н). Пример 91. 2-[4-(-2-Бутинилокси)фенил] сульфонил-N-гидрокси-2-[4-(2-тиенил)фенил] ацетамид. Используя в качестве исходного вещества смесь 2-[4-(бут-2-инилокси)фенил]тио-N-гидрокси-2-[4-(2-тиенил)фенил]ацетамида и 2-[4(бут-2-инилокси)фенил]сульфинил-N-гидрокси 2-[4-(2-тиенил)фенил]этанамида (410 мг, 0,96 ммоль) и выполняя способ по примеру 75, выделяют 110 мг 2-[4-(бут-2-инилокси)фенил] сульфонил-N-гидрокси-2-[4-(2-тиенил)фенил] ацетамида в виде серого твердого вещества; т.п. 175 С. Выход 26%; МС: 442,2 (М+Н)+. 1H-ЯМР(300 МГц, ДМСО-d6):1,83 (т, 3 Н), 4,85 (д,J=2,01 Гц, 2 Н), 5,04 (с, 1 Н), 7,11 (м, 4 Н), 7,39 (д,2 Н), 7,49-7,63 (полоса, 5 Н), 9,30 (с, 1 Н), 10,9 (с, 1 Н). Пример 92. 2-[4-(бут-2-Инилокси)фенил] тио-N-гидрокси-2-(1-нафтил)ацетамид. Этил[(4-гидроксифенил)тио](1-нафтил)ацетат получают общим способом по примеру 1[4-(бут-2-Инилокси)фенил]тио(1-нафтил) ацетат получают общим способом по примеру 1(стадия 2). Используя в качестве исходных веществ этил(4-гидроксифенил)тио](1-нафтил)ацетат (7,74 г, 23 ммоль) и 1-бром-2-бутин (3,4 г, 25 ммоль), выделяют 7,64 г продукта. Выход 85%; янтарное масло; МС: 390,5 (М+Н)+.[4-(бут-2-Инилокси)фенил]тио(1-нафтил) уксусную кислоту получают общим способом по примеру 1 (стадия 5). Используя в качестве исходного вещества [4-(бут-2-инилокси)фенил] тио(1-нафтил)ацетат (7,64 г, 19,6 ммоль), выделяют 4,92 г продукта. Выход 69%; белое твердое вещество; т.п. 98,7 С; МС: 722,8 (2 М-Н)-. Используя в качестве исходного вещества[4-(бут-2-инилокси)фенил]тио(1-нафтил)уксусную кислоту (4,69 г, 12,95 ммоль) и выполняя способ по примеру 1 (стадия 6), выделяют 2,95 г 2-[4-(бут-2-инилокси)фенил]тио-N-гидрокси-2-(1-нафтил)ацетамида в виде белого твердого вещества; т.п. 139,6 С. МС: 378,1(М+Н)+. 1H-ЯМР (300 МГц, ДМСО-d6):1,87 (т,3 Н), 4,62 (м, 2 Н), (с, 1 Н), 6,87 (д, J=10 Гц, 2 Н),7,37 (д, J=8 Гц, 2 Н), 7,46 (шм, 4 Н), 7,80 (д, J=3 Гц, 1 Н), (д, J=4 Гц), 8,03 (д, J=8 Гц, 2 Н), 9,2 (с,1 Н). Пример 93. 2-[4-(бут-2-Инилокси)фенил] сульфинил-N-гидрокси-2-(1-нафтил)ацетамид. Используя в качестве исходного вещества 2-[4-(бут-2-инилокси)фенил]тио-N-гидрокси 2-(1-нафтил)ацетамид (1,95 г, 5,2 ммоль) и выполняя способ по примеру 7, выделяют 0,19 г 2[4-(бут-2-инилокси)фенил]сульфинил-N-гидрокси-2-(1-нафтил)ацетамида в виде белого твердого вещества; т.п. 159,4 С. МС: 394,1(М+Н)+. 1H-ЯМР (300 МГц, ДМСО-d6):1,55 (т,3 Н), 4,60 (м, 2 Н), 5,51 (с, 1 Н), 6,72 (д, J=11,7 Гц,2 Н), 7,24 (2 Н), 7,37 (м, 3 Н), 7,77 (м, 3 Н), 8,19 (с,1 Н), 10,68 (с, 1 Н). Пример 94. 2-[4-(бут-2-Инилокси)фенил] сульфонил-N-гидрокси-2-(1-нафтил)ацетамид. Используя в качестве исходного вещества 2-[4-(бут-2-инилокси)фенил]тио-N-гидрокси 2-(1-нафтил)ацетамид (0,6 г, 15,9 ммоль) и выполняя способ по примеру 75, выделяют 0,162 г 2-[4-(бут-2-инилокси)фенил]сульфонил-N-гидрокси-2-(1-нафтил)ацетамида в виде белого твердого вещества; т.п. 213,3 С. МС: 410,0 54 Этил[(4-фторфенил)[4-гидроксифенил)тио] ацетат получают общим способом по примеру 1(стадия 1). Используя в качестве исходных веществ этилбром(4-фторфенил)ацетат (7,2 г, 28 ммоль) и 4-меркаптофенол (3,8 г, 30 ммоль),выделяют 7,08 г продукта. Выход 82,6%; янтарное масло; МС: 305,3 (М-Н)-. Этил[4-(бут-2-инилокси)фенил]тио(4 фторфенил)ацетат получают общим способом по примеру 1 (стадия 2). Используя в качестве исходных веществ этил[(4-фторфенил[(4-гидроксифенил)тио]ацетат (7,05 г, 23 ммоль) и 1 бром-2-бутин (4,02 г, 30 ммоль), выделяют 6,82 г продукта. Выход 83%; янтарное масло; МС: 358,0 (М-Н)-. Этил[4-(бут-2-инилокси)фенил]тио(4 фторфенил)уксусную кислоту получают общим способом по примеру 1 (стадия 5). Используя в качестве исходного вещества этил[(4-фторфенил)[(4-гидроксифенил)тио]ацетат (4,73 г, 13 ммоль), выделяют 3,26 г продукта. Выход 75%; янтарная смола; МС: 329,3 (М-Н)-. Используя в качестве исходного вещества этил[4-(бут-2-инилокси)фенил]тио(4-фторфенил)уксусную кислоту (3,0 г, 9,1 ммоль) и выполняя способ по примеру 1 (стадия 6), из реакционной смеси выделяют 0,295 г 2-[4-(бут-2 инилокси)фенил]тио-2-(4-фторфенил)-N-гидроксиацетамида в виде белого твердого вещества; т.п. 105,7 С. МС: 346,1 (М+Н)+. 1 Н-ЯМР (300 МГц, ДМСО-d6):1,82 (т, 3 Н), 4,70-4,72 (м,3 Н), 6,00 (с, 1 Н), 6,19-6,91 (д, J=6,9 Гц, 2 Н),7,15-7,21 (д, J=17 Гц, 2 Н), 7,24-7,27 (д, J=8,7 Гц,2 Н), 7,4 (м, 2 Н), 9,08 (с, 1 Н), 10,78 (с, 1 Н). Используя в качестве исходного вещества 2-[4-(бут-2-инилокси)фенил]тио-2-(4-фторфенил)-N-гидроксиацетамид (1,29 г, 3,3 ммоль) и выполняя способ по примеру 7, выделяют 0,086 г продукта в виде белого твердого вещества; т.п. 91,1 С. Выделяют основной диастереоизомер. МС: 362,3 (М+Н)+. 1H-ЯMP (300 МГц, ДМСОd6):1,83 (т, 3 Н), 4,41 (с, 1 Н), 4,76-4,77 (д, J=3 Гц, 2 Н), 6,97-7,01 (д, J=9,9 Гц, 2 Н), 7,07-7,10 (дд,J=8,9 Гц, 4 Н), 7,16-7,19 (д, J=8,8 Гц, 2 Н), 9,3 (с,1 Н), 10,98 (с, 1 Н). Пример 97. Получение 2-[4-(бут-2-инилокси)фенил]сульфонил-2-(4-фторфенил)-N-гидроксиацетамида. Используя в качестве исходного вещества 2-[4-(бут-2-инилокси)фенил]тио-2-(4-фторфенил)-N-гидроксиацетамид (1,29 г, 3,3 ммоль) и выполняя способ по примеру 75, выделяют 0,106 г белого твердого вещества; т.п. 160,1 С. МС: 378,2 (М+Н)+. 1H-ЯМР (300 МГц, ДМСО-d6):1,84 (т, 3 Н), 4,85-4,86 (д, J=2,4 Гц, 2 Н), 5,04 (с,1 Н), 7,08-7,11 (д, J=9,0 Гц, 2 Н), 7,16-7,19 (т,J=9,0 Гц, 2 Н), 7,38-7,40 (д, J=5,4 Гц, 2 Н), 7,457,47 (д, J=6,9 Гц, 2 Н), 9,3 (с, 1 Н), 10,90 (с, 1 Н). Пример 98. 2-(2-Метоксифенил)-2-[4-(бут 2-инилокси)фенил]тио-N-гидроксиацетамид. 55 Этил(2-метоксифенил)[(4-гидроксифенил) тио]ацетат получают общим способом по примеру 1 (стадия 1), используя в качестве исходных веществ этилбром(2-метоксифенил)ацетат(24 г, 87,5 ммоль) и 4-меркаптофенол (11,0 г,87,5 ммоль); 24,9 г янтарного масла. Выход 89%; МС: 320 (М+Н)+. Этил(2-метоксифенил)[4-(бут-2-инилокси) фенил]тиоацетат получают общим способом по примеру 1 (стадия 2), используя в качестве исходных веществ этил(2-метоксифенил)[(4 гидроксифенил)тио]ацетат (3,2 г, 10 ммоль) и 1 бром-2-бутин (1,5 г, 11,2 ммоль); 3,2 г светлого масла. Выход 87%; МС (EI): 371 (М+Н)+.(2-Метоксифенил)[4-(бут-2-инилокси)фенил]тиоуксусную кислоту получают общим способом по примеру 1 (стадия 5), используя в качестве исходного вещества этил(2-метоксифенил)-[4-(бут-2-инилокси)фенил]тиоацетат(2-метоксифенил)-[4-(бут-2-инилокси)фенил] тиоуксусную кислоту (2,6 г, 7,6 ммоль) и выполняя способ по примеру 1 (стадия 6), выделяют 2,6 г 2-(2-метоксифенил)-2-[4-(бут-2 инилокси)фенил]тио-N-гидроксиацетамида в виде белого твердого вещества; т.п. 172-173 С. Выход 97%; МС: 358,4 (М+Н)+. 1H-ЯМР (300 МГц, ДМСО-d6):1,85 (с, 3 Н), 3,80 (с, 3 Н), 4,72(с, 2 Н), 5,12 (с, 1 Н), 6,62 (м, 4 Н), 7,3-7,5 (м, 4 Н),9,3 (шс, 1 Н). Пример 99. 2-(2-Метоксифенил)-2-[4-(бут 2-инилокси)фенил]сульфинил-N-гидроксиацетамид. Используя в качестве исходного вещества 2-[4-(бут-2-инилокси)фенил]тио-2-(2-метоксифенил)-N-гидроксиацетамид (3,0 г, 8,37 ммоль) и выполняя способ по примеру 7, выделяют 2,75 г 2-(2-метоксифенил)-2-[4-(бут-2-инилокси)фенил]сульфинил-N-гидроксиацетамида в виде белого твердого вещества; т.п. 167,8 С (выделен только основной диастереоизомер). МС: 374(М+Н)+. 1H-ЯМР (300 МГц, ДМСО-d6):1,83 (с,3 Н), 3,32 (с, 3 Н), 4,41 (с, 2 Н), 5,2 (с, 1 Н), 6,31 (д,1 Н), 6,44 (м, 3 Н), 7,22-7,40 (м, 3 Н), 7,81 (д, 1 Н),8,62 (с, 1 Н), 10,41 (с, 1 Н). Пример 100. 2-[4-(бут-2-Инилокси)фенил] тио-N-гидрокси-2-(4-этоксифенил)ацетамид. Метил [(4-гидроксифенил)тио]-4-этоксифенилацетат. Метилбром(4-этоксифенил)ацетат (7,6 г,27,8 ммоль) добавляют к перемешиваемому раствору триэтиламина (30 мл), сульфита натрия(3,0 г, 23,8 ммоль) и 4-меркаптофенола (3,5 г,27,8 ммоль) в метаноле (200 мл). Смесь перемешивают в течение ночи и концентрируют,остаток экстрагируют этилацетатом и промывают водой. Органический слой сушат надNa2SO4, фильтруют и концентрируют. Соединение выделяют хроматографией на колонке с 56 силикагелем, элюируя раствором 20% этилацетат/гексан. Метил[(4-гидроксифенил)тио](4-этоксифенил)ацетат выделяют в виде сырого продукта (7,76 г, 24,4 ммоль). Выход 88%; МС: 317,1 (М-Н)-. Метил[4-(бут-2-инилокси)фенил]тио(4 этоксифенил)ацетат получают общим способом по примеру 1 (стадия 2). Используя в качестве исходных веществ этил[(4-гидроксифенил)тио][4-(бут-2-Инилокси)фенил]тио(4-этоксифенил)уксусную кислоту получают общим способом по примеру 1 (стадия 5), используя в качестве исходного вещества этил[4-(бут-2-инилокси)фенил]тио(4-этоксифенил)ацетат (8,55 г,23 ммоль); 7,86 г. Выход 96%; МС: 355,1 (М-Н)-. Используя в качестве исходного вещества[4-(бут-2-инилокси)фенил]тио(4-этоксифенил) уксусную кислоту (7,61 г, 20,6 ммоль) и выполняя способ по примеру 1 (стадия 6), выделяют 2,904 г 2-[4-(бут-2-инилокси)фенил]тио-N-гидрокси-2-(4-этоксифенил)ацетамида. Выход 38%; МС: 372,2 (М+Н)+. 1 Н-ЯМР (300 МГц, ДМСО-d6):1,25 (т, J=2,22 Гц, 3 Н), 1,80 (с, 3 Н), 4,00 (кв,J=2,22 Гц, 3 Н), 4,60 (с, 1 Н), 4,65 (с, 2 Н), 6,80 (д,J=9 Гц, 2 Н), 6,90 (д, J=9 Гц, 2 Н), 7,20 (д, J=9 Гц,2 Н), 7,35 (д, J=9 Гц, 2 Н), 9,00 (с, 1 Н), 10,8 (с, 1 Н). Пример 101. 2-[4-(бут-2-Инилокси)фенил] сульфинил-N-гидрокси-2-(4-этоксифенил)ацетамид. Используя в качестве исходного вещества 2-[4-(бут-2-инилокси)фенил]тио-N-гидрокси 2-(4-этоксифенил)ацетамид (808 мг, 2,27 ммоль) и выполняя способ по примеру 7, получают 640 мг 2-[4-(бут-2-инилокси)фенил]сульфинил-N-гидрокси-2-(4-этоксифенил)ацетамида в виде коричневого порошка. Выход 73%; МС: 388,2(M+H)+; т.п. 192-193 С. Пример 102. 2-[4-(бут-2-Инилокси)фенил] сульфонил-2-(4-хлорфенил)-N-гидроксиацетамид. 2-[4-(бут-2-Инилокси)фенил]сульфонил 2-(4-хлорфенил)-N-гидроксиацетамид получают,используя в качестве исходного вещества 2-[4(бут-2-инилокси)фенил]тио-N-гидрокси-2-(4 этоксифенил)ацетамид (808 мг, 2,27 ммоль) и выполняя способ по примеру 75, в результате чего выделяют 1,1 г 2-[4-(бут-2-инилокси)фенил]сульфонил-2-(4-хлорфенил)-N-гидроксиацетамида в виде белого твердого вещества. МС: 404,2 (M+H)+; т.п. 138-140. Пример 103. 2-[4-(бут-2-Инилокси)фенил] тио-N-гидрокcи-2-(3-бромфенил)ацетамид. Метил[(4-гидроксифенил)тио](3-бромфенил)ацетат. Метилбром(3-бромфенил)ацетат (7,2 г, 23,3 ммоль) добавляют к перемешиваемому раствору триэтиламина (30 мл), сульфита натрия (3,0 г,23,8 ммоль) и 4-меркаптофенола (2,94 г, 23,3 57 ммоль) в метаноле (200 мл). Смесь перемешивают в течение ночи и концентрируют, остаток экстрагируют этилацетатом и промывают водой. Органический слой сушат над Na2SO4, фильтруют и концентрируют. Соединение выделяют хроматографией на колонке с силикагелем,элюируя раствором 20% этилацетат:гексан. Метил[(4-гидроксифенил)тио](3-бромфенил) ацетат выделяют в виде сырого продукта (8,64 г). МС: 353,0 (М-Н)-. Используя в качестве исходных веществ этил[(4-гидроксифенил)тио](4-метоксифенил) ацетат (8,0 г, сырой продукт, 22,7 ммоль) и 1 бром-2-бутин (3,04 г, 22,7 ммоль) и выполняя способ по примеру 1 (стадия 2), выделяют 4,91 г метил[4-(бут-2-инилокси)фенил]тио(3-бромфенил)ацетата в виде желтого масла. Выход 52%; МС: 405,6 (М+Н)+. Используя в качестве исходного вещества[4-(бут-2-инилокси)фенил]тио(3-бромфенил) ацетат (4,04 г, 10 ммоль) и выполняя способ по примеру 1 (стадия 5), выделяют 3,83 г [4-(бут 2-инилокси)фенил]тио-(3-бромфенил)уксусной кислоты в виде полутвердого вещества. Выход 98%; МС: 389,0 (М-Н)-. Используя в качестве исходного вещества[4-(бут-2-инилокси)фенил]тио(3-бромфенил) уксусную кислоту (3,83 г, 9,8 ммоль) и выполняя способ по примеру 1 (стадия 6), выделяют 1,675 г 2-[4-(бут-2-инилокси)фенил]тио-Nгидрокси-2-(3-бромфенил)ацетамида. Выход 42%; МС: 408,0 (М+Н)+. 1 Н-ЯМР (300 МГц, ДМСОd6):1,60 (м, 3 Н), 2,26 (с, 3 Н), 4,45 (с, 1 Н), 4,47(м, 2 Н), 6,66 (д, J=9 Гц, 2 Н), 7,03 (д, J=9 Гц, 2 Н),7,06-7,38 (м, 5 Н), 8,87 (с, 1 Н), 10,41 (с, 1 Н). Пример 104. (2R)-2-[4-(бут-2-Инилокси) фенил]сульфинил-N-гидрокси-2-(3-бромфенил) ацетамид. Пример 105. (2S)-2-[4-(бут-2-Инилокси) фенил]сульфинил-N-гидрокси-2-(3-бромфенил) ацетамид. Используя в качестве исходного вещества 2-[4-(бут-2-инилокси)фенил]тио-N-гидрокси 2-(3-бромфенил)ацетамид (470 мг, 1,2 ммоль) и выполняя способ по примеру 7, сульфид окисляют в сульфоксид. Смесь двух диастереоизомеров разделяют хроматографией на колонке с силикагелем, элюируя смесью 50% этилацетат:гексан. Более подвижный изомер, а именно(20%); МС: 423,9 (М+Н)+. Пример 106. 2-[4-(бут-2-Инилокси)фенил] сульфонил-2-(3-бромфенил)-N-гидроксиацетамид. Используя в качестве исходного вещества 2-[4-(бут-2-инилокси)фенил]тио-N-гидрокси 004883 58 2-(3-бромфенил)ацетамид (480 мг, 1,2 ммоль) и выполняя способ по примеру 75, выделяют 270 мг 2-[4-(бут-2-инилокси)фенил]сульфонил-2-(4 хлорфенил)-N-гидроксиацетамида в виде коричневого порошка. Выход 52%; МС: 440,1 (М+Н)+. 1H-ЯMP (300 МГц, ДМСО-d6):1,60 (м, 3 Н),2,26 (с, 3 Н), 4,45 (с, 1 Н), 4,47 (м, 2 Н), 6,66 (д,J=9 Гц, 2 Н), 7,03 (д, J=9 Гц, 2 Н), 7,06-7,38 (м,5 Н), 8,87 (с, 1 Н), 10,41 (с, 1 Н). Пример 107. 2-[4-(бут-2-Инилокси)фенил] тио-2-изопропил-N-гидроксиацетамид. Стадия 1. Этилизопропил[4-(гидроксифенил)тио] ацетат получают общим способом по примеру 1(стадия 1), используя в качестве исходных веществ этил-2-бромизовалерат (2,09 г, 10 ммоль) и 4-меркаптофенол (1,26 г, 10,0 ммоль); 2,5 г желтого масла. Полученный продукт является достаточно чистым и пригоден для использования в дальнейшем синтезе. Выход 99%; МС: 255(М+Н)+. Стадия 2. Этил[4-(бут-2-инилокси)фенил]тио(изопропил)ацетат получают общим способом по примеру 1 (стадия 2), используя в качестве исходных веществ этилизопропил[4-(гидроксифенил)тио]ацетат (2,54 г, 10 ммоль) и 4-бром-2 бутин (1,34 г, 10 ммоль); 3,0 г желтого масла. Выход 99%; МС (EI): 307 (М+Н)+. Стадия 3.[4-(бут-2-Инилокси)фенил]тио(изопропил) уксусную кислоту получают общим способом по примеру 1 (стадия 5), используя в качестве исходного вещества этил[4-(бут-2-инилокси) фенил]тио(изопропил)ацетат (3,06 г, 10 ммоль); 2,7 г желтого масла. Выход 99%; МС: 277 (М-Н)-. Используя в качестве исходного вещества[4-(бут-2-инилокси)фенил]тио(изопропил)уксусную кислоту (1,39 г, 5 ммоль) и выполняя способ по примеру 1 (стадия 6), выделяют 800 мг 2-[4-(бут-2-инилокси)фенил]тио-2-изопропилN-гидроксиацетамида в виде белого порошка; т.п. 128 С. Выход 54%; МС: 294,1 (М+Н)+. 1HЯМР (300 МГц, ДМСО-d6):0,9 (д, 3 Н), 1,02 (д,3 Н), 1,89 (с, 3 Н), 1,98 (м, 1 Н), 3,0 (д, 1 Н), 3,2(с,1 Н), 4,8 (с, 2 Н), 6,8 (д, J=9 Гц, 2 Н), 7,4 (д, J=9 Гц, 2 Н), 9,0 (с, 1 Н), 10,81 (с, 1 Н). Пример 108. R-2-[4-(бут-2-Инилокси)фенил] сульфинил-2-изопропил-N-гидроксиацетамид. Пример 109. S-2-[4-(бут-2-Инилокси)фенил] сульфинил-2-изопропил-N-гидроксиацетамид. Используя в качестве исходного вещества 2-[4-(бут-2-инилокси)фенил]тио-2-изопропилN-гидроксиацетамид (1,45 г, 5 ммоль) и выполняя способ по примеру 7, выделяют 123 мг R-2[4-(бут-2-инилокси)фенил]сульфинил-2-изопропил-N-гидроксиацетамида в виде белого твердого вещества. Два диастереоизомера разделяют хроматографией на колонке с силикагелем, элюируя смесью 50% этилацетат:гексан; т.п. 68 С. Выход 15%; МС: 310 (М+Н)+. 59 Менее подвижный изомер, а именно S-2[4-(бут-2-инилокси)фенил]сульфинил-2-изопропил-N-гидроксиацетамид, выделяют в виде белого твердого вещества; т.п. 148 С. Выход 135 мг (17%); МС: 310 (М+Н)+. Пример 110. 2-[4-(бут-2-Инилокси)фенил] сульфонил-2-изопропил-N-гидроксиацетамид. Используя в качестве исходного вещества 2-4-(бут-2-инилокси)фенил]тио-N-гидрокси 2-изопропилацетамид (1,4 г, 5 ммоль) и выполняя способ по примеру 75, выделяют 800 мг 2[4-(бут-2-инилокси)фенил]сульфонил-2-изопропил-N-гидроксиацетамида в виде белого порошка. Выход 49%; МС: 326,1 (М+Н)+. 1HЯМР (300 МГц, ДМСО-d6):0,8 (д, 3 Н), 1,0 (д,3 Н), 2,0 (с, 3 Н), 2,1 (м, 1H), 3,51 (д, 1H), 3,2 (с,1 Н), 5,01 (с, 2 Н), 7,0 (д, J=9 Гц, 2 Н), 756 (д, J=9 Гц, 2 Н), 9,5 (с, 1H), 11,41 (с, 1H). Пример 111. 2-[4-(бут-2-Инилокси)фенил] тио-2-фенил-N-гидроксиацетамид. Стадия 1. Этилфенил[4-(гидроксифенил)тио]ацетат получают общим способом по примеру 1 (стадия 1), используя в качестве исходных веществ этил-2-бромфенилацетат (2,42 г, 10 ммоль) и 4 меркаптофенол (1,26 г, 10,0 ммоль); 2,7 г желтого масла. Полученный продукт является достаточно чистым и пригоден для использования в дальнейшем синтезе. Выход 93%; МС: 289(М+Н)+. Стадия 2. Этил[4-(бут-2-инилокси)фенил]тиофенилацетат получают общим способом по примеру 1(стадия 2), используя в качестве исходных веществ этилфенил[4-(гидроксифенил)тио]ацетат[4-(бут-2-Инилокси)фенил]тиофенилуксусную кислоту получают общим способом по примеру 1 (стадия 5), используя в качестве исходного вещества этил[4-(бут-2-инилокси)фенил]тиофенилацетат (3,4 г, 10 ммоль); 3,0 г желтого масла. Выход 88%; МС: 311 (М-Н)-. Используя в качестве исходного вещества[4-(бут-2-инилокси)фенил]тио(фенил)уксусную кислоту (3,12 г, 10 ммоль) и выполняя способ по примеру 1 (стадия 6), выделяют 3,0 г 2-[4-(бут 2-инилокси)фенил]тио-2-фенил-N-гидроксиацетамида в виде белого порошка; т.п. 151 С. Выход 91%; МС: 328 (М+Н)+. 1H-ЯМР (300 МГц,ДМСО-d6):1,8 (с, 3 Н), 4,8 (с, 2 Н), 4,9 (с, 1H),6,8-7,6 (м, 9 Н), 9,2 (шс, 1H), 11 (шс, 1H). Пример 112. R-2-[4-(бут-2-Инилокси)фенил]сульфинил-2-фенил-N-гидроксиацетамид. Пример 113. S-2-[4-(бут-2-Инилокси)фенил]сульфинил-2-фенил-N-гидроксиацетамид. Используя в качестве исходного вещества 2-[4-(бут-2-инилокси)фенил]тио-2-фенил-Nгидроксиацетамид (1,5 г, 4,5 ммоль) и выполняя 60 способ по примеру 7, выделяют 400 мг R-2-[4(бут-2-инилокси)фенил]сульфинил-2-фeнил-Nгидpoкcиaцeтaмидa в виде белого твердого вещества. Два диастереоизомера разделяют хроматографией на колонке с силикагелем, элюируя смесью 50% этилацетат:гексан; т.п. 153 С. Выход 51%; МС: 344 (М+Н)+. 1H-ЯМР (300 МГц,ДМСО-d6):1,8 (с, 3 Н), 4,5 (с, 1 Н), 4,9 (с, 2 Н),6,9-7,6 (м, 9 Н), 9,0 (шс, 1 Н), 10,8 (шс, 1 Н). Менее подвижный изомер, а именно S-2[4-(бут-2-инилокси)фенил]сульфинил-2-фенилN-гидроксиацетамид, выделяют в виде белого твердого вещества; т.п. 55 С. Выход 300 мг(38%); МС: 344 (М+Н)+. 1 Н-ЯМР (300 МГц,ДМСО-d6):1,7 (с, 3 Н), 4,4 (с, 1 Н), 4,7 (с, 2 Н),7,0-7,6 (м, 9 Н), 9,3 (с, 1 Н), 11,0 (с, 1 Н). Пример 114. 2-[4-(бут-2-Инилокси)фенил] тио-2-(2-нафтил)-N-гидроксиацетамид. Стадия 1. Этил(2-нафтил)-2-[4-(гидроксифенил)тио] ацетат получают общим способом по примеру 1(стадия 1), используя в качестве исходных веществ этиловый эфир -бром-2-нафтилуксусной кислоты (2,93 г, 10 ммоль) и 4-меркаптофенол(1,26 г, 10,0 ммоль); 3,3 г желтого масла. Полученный продукт является достаточно чистым и пригоден для использования в дальнейшем синтезе. Выход 99%; МС: 339 (М+Н)+. Стадия 2. Этил[4-(бут-2-инилокси)фенил]тио-2-(2 нафтил)ацетат получают общим способом по примеру 1 (стадия 2), используя в качестве исходных веществ этил(2-нафтил)-2-[4-(гидроксифенил)тио]ацетат (2,54 г, 10 ммоль) и 4-бром-2 бутин (1,34 г, 10 ммоль); 3,7 г желтого масла. Выход 99%; МС (EI): 377 (М+Н)+. Стадия 3.[4-(бут-2-Инилокси)фенил]тио-2-(2-нафтил)уксусную кислоту получают общим способом по примеру 1 (стадия 5), используя в качестве исходного вещества этил[4-(бут-2-инилокси)фенил]тио-2-(2-нафтил)ацетат (3,76 г, 10 ммоль); 3,5 г желтого масла. Выход 96%; МС: 361 (М-Н)-. Используя в качестве исходного вещества[4-(бут-2-инилокси)фенил]тио-2-(2-нафтил) уксусную кислоту (3,6 г, 10 ммоль) и выполняя способ по примеру 1 (стадия 6), выделяют 3,2 г 2-[4-(бут-2-инилокси)фенил]тио-2-(2-нафтил)N-гидроксиацетамида в виде белого порошка; т.п. 148 С. Выход 84%; МС: 378 (М+Н)+. 1H-ЯМР(300 МГц, ДМСО-d6):1,8 (с, 3 Н), 4,7 (с, 2 Н),4,95 (с, 1 Н), 6,8-8,0 (с, 11 Н), 9,0 (шс, 1 Н), 11 (шс,1 Н). Пример 115. 2-[4-(бут-2-Инилокси)фенил] сульфинил-2-(2-нафтил)-N-гидроксиацетамид. Используя в качестве исходного вещества 2-[4-(бут-2-инилокси)фенил]тио-2-(2-нафтил)N-гидроксиацетамид (1,88 г, 5 ммоль) и выполняя способ по примеру 7, выделяют 900 мг 2[4-(бут-2-инилокси)фенил]сульфинил-2-(2-наф
МПК / Метки
МПК: C07C 317/44, A61K 31/16, A61P 19/02, C07F 9/53, C07D 213/56
Метки: качестве, гидроксамовых, ингибиторов, производные, алкинилсодержащих, кислот, применение
Код ссылки
<a href="https://eas.patents.su/30-4883-proizvodnye-alkinilsoderzhashhih-gidroksamovyh-kislot-i-ih-primenenie-v-kachestve-ingibitorov-tace.html" rel="bookmark" title="База патентов Евразийского Союза">Производные алкинилсодержащих гидроксамовых кислот и их применение в качестве ингибиторов tace</a>
Предыдущий патент: Ингибитор натрий-водородного обмена типа 1(nhe-1)
Случайный патент: Устройство для измерения температуры при твердофазной поликонденсации


































