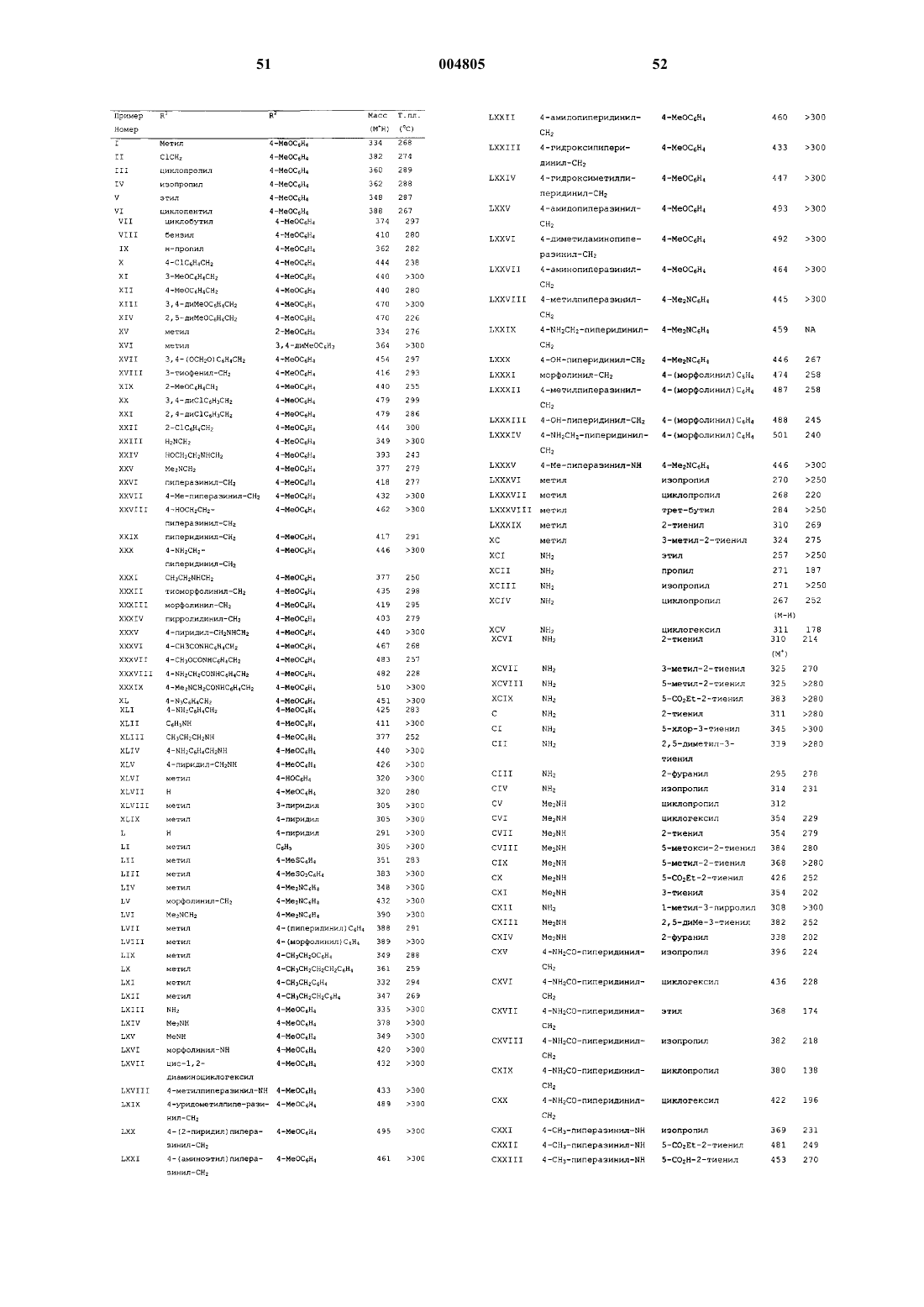
5-аминоиндено [1, 2-с]пиразол-4-оны в качестве противораковых и антипролиферативных агентов
Номер патента: 4805
Опубликовано: 26.08.2004
Авторы: Ньюджел Дэвид Э., Димео Сьюзн В., Карини Дэвид Дж., Юэ Эдди В.
Формула / Реферат
1. Соединение формулы I
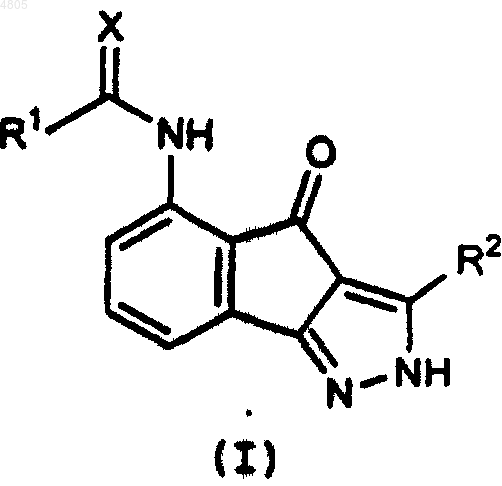
или его стереоизомер, или его фармацевтически приемлемая соль,
где X выбирают из группы: O, S и NR;
R обозначает H, C1-C4алкил и NR5R5a;
R1 обозначает H, C1-C10алкил, замещенный 0-3 группами Rc, C2-C10алкенил, замещенный 0-3 группами Rc, C2-C10алкинил, замещенный 0-3 группами Rc, NHR4, C3-C10карбоцикл, замещенный 0-5 группами Ra и 3-10-членный гетероцикл, содержащий 1-4 гетероатома, выбранных из группы, включающей O, N и S, замещенный 0-5 группами Rb;
Ra в каждом случае независимо обозначает галоген, -CN, N3, NO2, C1-C4алкил, галоген-C1-C4алкил, NR3R3a, =O, OR3, COR3, CO2R3, CONR3R3a, NHC(O)NR3R3a, NHC (S) NR3R3a, NR3C(O)OR3, NR3C(O)R3, SO2NR3R3a, SO2R3b и 5-10-членный гетероцикл, содержащий 1-4 гетероатома, выбранных из O, N и S;
альтернативно, когда две группы Ra находятся у соседних атомов углерода, они могут вместе образовывать -OCH2O- или -OCH2CH2O-;
Rb в каждом случае независимо обозначает галоген, -CN, NO2, C1-C4алкил, галоген-C1-C4алкил, NR3R3a, NR3C(O)OR3, NR3C(O)R3, OR3, COR3, CO2R3, CONR3R3a, NHC(O)NR3R3a, NHC (S)NR3R3a, SO2NR3R3a и SO2R3b;
Rc в каждом случае независимо обозначает галоген, -CN, NO2, C1-C4алкил, галоген-C1-C4алкил, NR3R3a, NR5NR5R5a, NR3C(O)OR3, NR3C(O)R3, =O, OR3, COR3, CO2R3, CONR3R3a, NHC(O)NR3R3a, NHC(S)NR3R3a, SO2NR3R3a, SO2R3b, C3-C10карбоцикл, замещенный 0-5 группами Ra, и 5-10-членный гетероцикл, содержащий 1-4 гетероатома, выбранных из группы, включающей O, N и S, замещенный 0-3 группами R3;
R2 обозначает H, C1-C10алкил, замещенный 0-3 группами Rc, C2-C10алкенил, замещенный 0-3 группами Rc, C2-C10алкинил, замещенный 0-3 группами Rc, -(CF2)mCF3, C3-C10карбоцикл, замещенный 0-5 группами Ra, или 3-10-членный гетероцикл, содержащий 1-4 гетероатома, выбранных из группы, включающей O, N и S, замещенный 0-5 группами Rb;
R3 обозначает H, галоген, -CN, NO2, галоген-C1-C4алкил, NR5R5a, NR5NR5R5a, NR5C(O)OR5, NR5C(O)R5, =O, OR5, COR5, CO2R5, CONR5R5a, NHC(O)NR5R5a, NHC(S)NR5R5a, SO2NR5R5a, SO2R5b, C1-C4алкил, фенил и бензил;
R3a обозначает H, C1-C4-алкил, фенил и бензил;
альтернативно, R3 и R3a могут также вместе с атомом азота, к которому они присоединены, образовывать 4-8-членный гетероцикл, который может дополнительно включать 0-1 атом азота, серы или кислорода, замещенный 0-3 группами R3c;
R3b обозначает H, C1-C4алкил, фенил и бензил;
R3c в каждом случае независимо обозначает галоген, -CN, N3, NO2, C1-C4алкил, галоген-C1-C4алкил, NR3R3b, =O, OR3, COR3, CO2R3, CONR3R3b, NHC(O)NR3R3b, NHC (S) NR3R3b, NR3C(O)OR3, NR3C(O)R3, SO2NR3R3b, SO2R3b и 5-10-членный гетероцикл, содержащий 1-4 гетероатома, выбранных из O, N и S;
R4 в каждом случае независимо обозначает H, -CN, C1-C4алкил, галоген-C1-C4алкил, NR3R3e, NR3C(O)OR3, NR3C(O)R3, OR3, COR3, CO2R3, CONR3R3a, NHC(O)NR3R3a, NHC (S) NR3R3a, SO2NR3R3a, SO2R3b, C3-C10карбоцикл, замещенный 0-5 группами Ra, и 5-10-членный гетероцикл, содержащий 1-4 гетероатома, выбранных из O, N и S, замещенный 0-3 группами R3;
R5 независимо выбирают из группы: H, C1-C4алкил, фенил и бензил;
R5a независимо выбирают из группы: H, C1-C4алкил, фенил и бензил;
R5b независимо выбирают из группы: H, C1-C4-алкил, фенил и бензил, и
m равно 0, 1, 2 и 3;
при условии, что если R2 обозначает незамещенный разветвленный C1-C4алкил, то R1 не является CH3; или
если R1 обозначает NHR4 и R4 обозначает NR3R3a, то R3 и R3a не могут оба обозначать фенил.
2. Соединение по п.1, в котором
X выбирают из O или S;
R1 обозначает H, C1-C10алкил, замещенный 0-3 группами Rc, NHR4, C3-C10карбоцикл, замещенный 0-5 группами Ra или 3-10-членный гетероцикл, содержащий 1-4 гетероатома, выбранных из группы, включающей O, N и S, и замещенный 0-5 группами Rb;
Rc независимо обозначает галоген, C3-C10карбоцикл, замещенный 0-5 группами Ra, и 5-10-членный гетероцикл, содержащий 1-4 гетероатома, выбранных из группы, включающей O, N и S, замещенный 0-3 группами R3, NR3R3a;
R3 и R3a независимо обозначают H, C1-C4алкил, фенил и бензил или вместе с атомами, к которым они присоединены, образуют 4-8-членное гетероциклическое кольцо, содержащее дополнительно 0-1 атом N, S или O и замещенное 0-3 группами R3c;
R4 обозначает H, C1-C4алкил, NR3R3a, C3-C10карбоцикл, замещенный 0-5 группами Ra, или 5-10-членный гетероцикл, содержащий 1-4 гетероатома, выбранных из O, N и S, замещенный 0-3 группами R3;
R2 обозначает C3-C10карбоцикл, замещенный 0-5 группами Ra, и 3-10-членный гетероцикл, содержащий 1-4 гетероатома, выбранных из группы, включающей O, N и S, и замещенный 0-5 группами Rb, и C1-C10алкил, замещенный 0-3 группами Rc;
3. Соединение по п.1, в котором
X обозначает O или S;
R1 обозначает C1-C4алкил, замещенный 0-3 группами Rc, где Rc независимо выбран из группы, включающхщ C3-C6карбоцикл, замещенный 0-5 группами Ra, 5-6-членный гетероцикл, замещенный 0-3 группами R3, NR3R3a и OR3; C3-C6карбоцикл, замещенный 0-5 группами Ra, где Ra независимо выбран из группы, включающей OR3, галоген, C1-C4-алкил, NR3C(O)R3, COR3, CO2R3, N3, NR3C(O)OR3, NR3R3a, CONR3R3a и 5-6-членный гетероцикл;
или, когда два Ra находятся у соседних атомов углерода, они могут вместе образовывать -OCH2O- или -OCH2CH2O-;
или 5-6-членный гетероцикл и замещенный 0-5 группами Rb, где Rb независимо выбирают из группы, включающей OR3, галоген, COR3, C1-C4-алкил, CO2R3, NR3C(O)R3, NR3C(O)OR3, NR3R3a и CONR3R3a;
R2 обозначает C3-C6карбоцикл, замещенный 0-5 группами Ra, где Ra независимо выбран из группы, включающей OR3, галоген, C1-C4алкил, NR3C(O)R3, COR3, CO2R3, N3, NR3C(O)OR3, NR3R3a, CONR3R3a и 5-6-членный гетероцикл;
или, когда два Ra находятся у соседних атомов углерода, они могут вместе образовывать -OCH2O- или -OCH2CH2O-;
3-6-членный гетероцикл, содержащий 1-4 гетероатома, выбранных из группы, включающей O, N и S, и замещенный 0-5 группами Rb, где Rb независимо выбирают из группы, включающей OR3, галоген, COR3, C1-C4алкил, CO2R3, NR3C(O)R3, NR3C(O)OR3, NR3R3a и CONR3R3a;
или C1-C10алкил, замещенный 0-3 группами Rc, где Rc независимо выбран из группы, включающей C3-C6карбоцикл, замещенный 0-5 группами Ra, 5-6-членный гетероцикл, замещенный 0-3 группами R3, NR3R3a и OR3.
4. Соединение по п.1, в котором
X обозначает O или S;
R1 обозначает H, NHR4, C1-C4алкил, замещенный 0-3 группами Rc, C3-C6карбоцикл, замещенный 0-5 группами Ra, или 5-6-членный гетероцикл, замещенный 0-5 группами Rb;
R2 обозначает C3-C6карбоцикл, замещенный 0-5 группами Ra, 3-10-членный гетероцикл, содержащий 1-4 гетероатома, выбранных из группы, включающей O, N и S, и замещенный 0-5 группами Rb, и C1-C10алкил, замещенный 0-3 группами Rc, C2-C10алкенил, замещенный 0-3 группами Rc;
R4 независимо обозначает H, C1-C4-алкил, NR3R3a, C3-C6карбоцикл, замещенный 0-5 группами Ra, и 5-6-членный гетероцикл, замещенный 0-3 группами R3;
R3 обозначает H, галоген, COR5, CO2R5, CONR5R5a, NR5C(O)OR5, NR5C(O)R5, C1-C4алкил, фенил и бензил;
R3a независимо обозначает H, C1-C4алкил, фенил и бензил;
или R3 и R3a вместе с атомами, к которым они присоединены, образуют 5-6-членный гетероцикл, который может дополнительно включать 0-1 атом N, S или O и замещенный 1-3 группами R3c;
Rc независимо обозначает C1-C6карбоцикл, замещенный 0-5 группами Ra, и 5-6-членный гетероцикл, замещенный 0-3 группами R3, NR3R3a и OR3;
Ra независимо обозначает OR3, галоген, C1-C4-алкил, NR3C(O)R3, COR3, CO2R3, N3, NR3C(O)OR3, NR3R3a, CONR3R3a, 5-6-членный гетероцикл;
или, когда два Ra находятся у соседних атомов углерода, они вместе образуют -OCH2O- или -OCH2CH2O-;
Rb независимо обозначает OR3, галоген, COR3, C1-C4алкил, NR3C(O)R3, NR3C(O)OR3, NR3R3a, CO2R3, CONR3R3a;
R3c независимо обозначает OR3, галоген, COR3, CO2R3, N3, NR3R3b, C1-C4алкил, NR3C(O)R3, NR3C(O)OR3, CONR3R3b и 5-6-членный гетероцикл;
m независимо равно 1, 2, 3 и 4.
5. Соединение по п.1, в котором R1 выбран из группы: -NHR4 и C1-C2алкил, замещенный одной группой Rc.
6. Соединение по п.1, в котором
X представляет собой O или S и
R1 выбран из группы: H, C1-C4алкил, замещенный 0-3 группами Rc, C2-C4алкенил, замещенный 0-3 группами Rc, C2-C4алкинил, замещенный 0-3 группами Rc, -NHR4, C3-C6карбоцикл, замещенный 0-5 группами Rc, и 3-6-членный гетероцикл, содержащий 1-4 гетероатома, выбранных из O, N, и S, и замещенный 0-5 группами Rb.
7. Соединение по п.1, в котором X представляет собой O или S и
R1 выбран из группы: H, C1-C4алкил, замещенный 0-3 группами Rc, C2-C4алкенил, замещенный 0-3 группами Rc, C2-C4алкинил, замещенный 0-3 группами Rc, -NHR4, C3-C6карбоцикл, замещенный 0-5 группами Ra, и 3-6-членный гетероцикл, содержащий 1-4 гетероатома, выбранных из O, N, и S, и замещенный 0-5 группами Rb;
Ra независимо в каждом случав выбран из группы: -CH2N(CH3)2, -CH2NH2, -SH, -SCH3, -NR3C(O)R3, -N3, галоген, C1-C4алкил, NR3R3a и OR3;
или, когда два Ra находятся на соседних атомах углерода, они соединяются с образованием -OCH2O- или -OCH2CH2O-;
Rb независимо в каждом случае выбран из группы: галоген, C1-C4алкил, NR3R3a, OR3, COR3 и CO2R3;
Rc независимо в каждом случае выбран из группы: галоген, C1-C4алкил, NR3R3a, C3-6карбоцикл, замещенный 0-5 группами Ra, и 5-7-членный гетероцикл, содержащий 1-4 гетероатома, выбранных из O, N, и S, замещенный 0-3 группами R3;
R3a представляет собой H или C1-C4алкил и
R3 выбран из группы: H, -CH2CH2OH, -C(O)CH2NH2, C(O)CH2N(CH3)2, -NR5R5a, -C1-C4алкил-NR5R5a, C1-C4алкил, фенил и бензил.
8. Соединение по п.1, в котором X представляет собой O или S;
R1 выбран из группы: H, C1-C4алкил, замещенэыщ 0-3 группами Rc, -NHR4, C3-C6карбоцикл, замещенный 0-5 группами Ra, и 3-6-членный гетероцикл, содержащий 1-4 гетероатома, выбранных из O, N, и S, и замещенный 0-5 группами Rb;
Ra независимо в каждом случае выбран из группы: -CH2N(CH3)2, -CH2NH2, -SH, -SCH3, галоген, C1-C4алкил, NR3R3a и OR3;
или, когда два Ra находятся на соседних атомах углерода, они соединяются с образованием -OCH2O- или -OCH2CH2O-;
Rb независимо в каждом случае выбран из группы: галоген, C1-C4алкил, NR3R3a, OR3, COR3 и CO2R3;
Rc независимо в каждом случае выбран из группы: -OH, хлор, C1-C4алкил, -NH2, -NHCH3, -NHCH2CH3, -NHCH2CH2CH3, -NHCH2CH2OH, -N(CH3)2, фенил, замещенный 0-5 группами Ra, и 5-7-членный гетероцикл, содержащий 1-4 гетероатома, выбранных из O, N, и S, замещенный 0-3 группами R3.
9. Соединение по п.1, в котором
R1 выбран из группы: H, C1-C10алкил, замещенный 0-3 группами Rc, C2-C10алкенил, замещенный 0-3 группами Rc, C2-C10алкинил, замещенный 0-3 группами Rc;
R2 выбран из группы: H, -(CF2)mCF3, C3-C10карбоцикл, замещенный 0-5 группами Ra, и 3-10-членный гетероцикл, содержащий 1-4 гетероатома, выбранных из O, N, и S, и замещенный 0-5 группами Rb; и
Rc независимо в каждом случае выбран из группы: фенил, замещенный 0-5 группами Ra, и тиофенил или пиридил, замещенный 0-3 группами R3.
10. Соединение по п.1, в котором
R1 выбран из группы: H, C1-C10алкил, замещенный 0-3 группами Rc, C2-C10алкенил, замещенный 0-3 группами Rc, C2-C10 алкинил, замещенный 0-3 группами Rc;
R2 выбран из группы: H, -(CF2)mCF3, C3-C10карбоцикл, замещенный 0-5 группами Ra, и 3-10 членный гетероцикл, содержащий 1-4 гетероатома, выбранных из O, N, и S, и замещенный 0-5 группами Rb; и
Rc независимо в каждом случае выбран из группы: тиофенил, пиперазинил, пиперидинил, тиоморфолинил, морфолинил, пирролидинил и пиридил, замещенный 0-3 заместителями, независимо выбранными из группы, состоящей из CH3, CH2CH2OH, CH2CH2NH2, -C(=O)NH2, -OCH3, CH2NH2, NHCH2CH3,OH, NH2, галогена, -CH2N(CH3)2, -OCH2CH2O-, -OCH2O-, -N(CH3)2, уридометила и пиридила.
11. Соединение по п.1, в котором
R1 выбран из группы: H, C1-C10алкил, замещенный 0-3 группами Rc, C2-C10алкенил, замещенный 0-3 группами Rc, C2-C10алкинил, замещенный 0-3 группами Rc;
R2 выбран из группы: H, -(CF2)mCF3, C3-C10карбоцикл, замещенный 0-5 группами Ra, и 3-10-членный гетероцикл, содержащий 1-4 гетероатома, выбранных из O, N, и S, и замещенный 0-5 группами Rb; и
Rc представляет собой фенил, замещенный 0-5 заместителями, независимо выбранными из группы, состоящей из CH3, CH2CH2OH, CH2CH2NH2, -C(=O)NH2, -OCH3, CH2NH2, NHCH2CH3, OH, NH2, галогена, -CH2N(CH3)2, -OCH2CH2O-, -OCH2O-, -N(CH3)2, уридометила и пиридила.
12. Соединение по п.1, в котором X представляет собой O или S;
R1 представляет собой -NHR4 или метилен, замещенный 0-3 группами Rc;
Rc представляет собой NR3R3a;
R4 выбран из группы, состоящей из H, C1-C4алкила и NR3R3a; и
R3 и R3a независимо представляют собой водород или C1-C4алкил
или R3 и R3a вместе с атомом азота, с которым они связаны, образуют 4-8-членный гетероцикл, содержащий дополнительно 0-1 атом N, S или O и замещенный 0-3 группами R3c.
13. Соединение по п.1, в котором
X представляет собой O или S;
R1 представляет собой -NHR4 или метилен, замещенный 0-3 группами Rc;
Rc представляет собой NR3R3a;
R4 выбран из группы, состоящей из H, C1-C4алкила и NR3R3a; и
R3 и R3a независимо представляют собой водород или C1-C4алкил,
или R3 и R3a вместе с атомом азота, с которым они связаны, образуют 4-8-членный гетероцикл, содержащий дополнительно 0-1 атом N, S, или O и замещенный 0-3 заместителями, независимо выбранными из группы, состоящей из метила, -CH2OCH3, -C(CH3)2OCH3, -CH2CH2OH, -CH2OH, -CH2OCH2фенил, -CH2CH2NH2, -CH2NH2, -C(=NH)CH3 и NH2.
14. Соединение по п.1, в котором X представляет собой O или S и
R1 выбран из группы: метилен, замещенный заместителем, выбранным из группы, состоящей из галогена, NR3R3a, C3-C6карбоцикла, замещенного 0-5 группами Ra, и 5-7 членного гетероцикла, содержащего 1-4 гетероатома, выбранных из O, N и S, замещенного 0-3 группами R3.
15. Соединение по п.1, в котором
X представляет собой O или S;
R1 выбран из группы: метилен, замещенный NR3R3a; и
R3 и R3a вместе с атомом азота, с которым они связаны, образуют пирролил, пирролинил, пирролидинил, имидазолил, имидазолинил, имидазолидинил, пиразолил, пиразолинил, пиразолидинил, тиоморфолинил, пираморфолинил, пиперидинил, пиперазинил или пиперадинил, замещенные 0-3 группами R3c.
16. Соединение по п.1, в котором
R1 представляет собой -NHR4;
R4 представляет собой NR3R3a и
R3 и R3a вместе с атомом азота, с которым они связаны, образуют пирролил, пирролинил, пирролидинил, имидазолил, имидазолинил, имидазолидинил, пиразолил, пиразолинил, пиразолидинил, тиоморфолинил, пираморфолинил, пиперидинил, пиперазинил или пиперадинил, замещенные 0-3 группами R3c.
17. Соединение по п.1, в котором
R1 представляет собой -NHR4;
R4 представляет собой NR3R3a и
R3 и R3a вместе с атомом азота, с которым они связаны, образуют пирролил, пирролинил, пирролидинил, имидазолил, имидазолинил, имидазолидинил, пиразолил, пиразолинил, пиразолидинил, тиоморфолинил, пираморфолинил, пиперидинил, пиперазинил или пиперадинил, замещенный 0-3 заместителями, независимо выбранными из группы, состоящей из метила, -CH2OCH3, -C(CH3)2OCH3, -CH2CH2OH, -CH2OH, -CH2OCH2фенила, -CH2CH2NH2, -CH2NH2, -C(=NH)CH3 и NH2.
18. Соединение по п.1, в котором R2 выбран из группы: 5-7-членное моноциклическое насыщенное или частично насыщенное гетероциклическое кольцо, замещенное 0-5 группами Rb.
19. Соединение по п.1, в котором R2 выбран из группы: 5-7-членное моноциклическое ароматическое гетероциклическое кольцо, замещенное 0-5 группами Rb.
20. Соединение по п.1, в котором R2 выбран из группы: C1-C10алкил, замещенный 0-3 группами Rc, C3-C10карбоцикл, замещенный 0-5 группами Ra, и 3-10-членный гетероцикл, содержащий 1-4 гетероатома, выбранных из O, N и S, и замещенный 0-5 группами Rb.
21. Соединение по п.1, в котором R2 выбран из группы: C1-C6алкил, замещенный 0-3 группами Rc, C3-C6карбоцикл, замещенный 0-5 группами Ra, и 3-7-членный гетероцикл, содержащий 1-4 гетероатома, выбранных из O, N и S, и замещенный 0-5 группами Rb.
22. Соединение по п.1, в котором R2 выбран из группы: C1-C6алкил, замещенный C3-C10карбоциклом, замещенным 0-5 группами Ra, и C1-C6алкил, замещенный 5-10-членным гетероциклом, содержащим 1-4 гетероатома, выбранных из O, N и S.
23. Соединение по п.1, в котором
R2 выбран из группы: фенил, замещенный 0-5 группами Ra, и циклопропил или циклогексил, замещенные 0-2 группами Ra; и
Ra независимо в каждом случае выбран из группы: -CH2N(CH3)2, -CH2NH2, -SR3 галоген, -CN, N3, NO2, C1-C4алкил, C1-C4галогеналкил, NR3R3a, =O, OR3, COR3, CO2R3, CONR3R3a, NHC(O)NR3R3a, NHC(S)NR3R3a, NR3C(O)OR3, NR3C(O)R3, SO2NR3R3a, SO2R3b и 5-10-членный гетероцикл, содержащий 1-4 гетероатома, выбранных из O, N и S.
24. Соединение по п.1, в котором
R2 выбран из группы: фенил замещенный 0-5 группами Ra, и циклопропил или циклогексил, замещенный 0-2 группами Ra; и
Ra независимо в каждом случае выбран из группы: C1-C4 алкил, COR3, CO2R3 и CONR3R3a;
R3a представляет собой H или C1-C4алкил.
25. Соединение по п.1, в котором
R2 выбран из группы: фенил, замещенный 0-5 группами Ra, и циклопропил или циклогексил, замещенный 0-2 группами Ra;
Ra независимо в каждом случае выбран из группы: C1-C4алкил, COR3, CO2R3 и CONR3R3a;
R3a представляет собой H или C1-C4алкил;
R3 представляет собой C1-C4алкил, C1-C4алкил-NR5R5а и
R5 и R5a вместе с атомами, с которым они связаны, образуют гетероцикл, содержащий 4-8 атома в кольце и дополнительно содержащий 0-1 атом N, S или O.
26. Соединение по п.1, в котором
R2 выбран из группы: фенил, замещенный 0-5 группами Ra, и циклопропил или циклогексил, замещенные 0-2 группами Ra;
Ra независимо в каждом случае выбран из группы: C1-C4алкил, COR3, CO2R3 и CONR3R3a; и
R3a представляет собой H или C1-C4алкил.
27. Соединение по п.1, в котором R2 представляет собой фенил, замещенный NR3R3a, где R3 и R3a вместе с атомом азота, с которым они связаны, образуют 4-8-членный гетероцикл, содержащий дополнительно 0-1 атом N, S или O и замещенный 0-3 группами R3c.
28. Соединение по п.25, в котором
R2 представляет собой фенил, замещенный NR3R3a; и
R3 и R3a вместе с атомом азота, с которым они связаны, образуют пирролинил, пирролидинил, имидазолинил, пиразолидинил, пиразолинил, пиперидинил, морфолинил, тиоморфолинил, гомопиперазинил или пиперазинил, замещенные 0-3 группами R3c.
29. Соединение по п.25, в котором R2 представляет собой фенил, замещенный NR3R3a, где R3 и R3a вместе с атомом азота, с которым они связаны, образуют пиперидинил, гомопиперазинил или пиперазинил группу, замещенные 0-3 группами R3c.
30. Соединение по п.25, в котором
R2 представляет собой фенил, замещенный NR3R3a; и
R3 и R3a вместе с атомом азота, с которым они связаны, образуют пиперидинил, гомопиперазинил или пиперазинил, замещенные 0-3 заместителями, независимо выбранными из группы, состоящей из -C(=NH)CH3, пирролинила, пирролидинила, имидазолинила, пиразолидинила, пиразолинила, пиперидинила, морфолинила, тиоморфолинила, гомопиперазинила или пиперазинила, пиридила, C1-C4алкила, -NR3R3b.
31. Соединение по п.1, которое выбрано из
3-(4-метоксифенил)-5-(ацетамидо)индено[1,2-c]пиразол-4-она;
3-фенил-5-(ацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метилтиофенил)-5-(ацетамидо)индено[1,2-c] пиразол-4-она;
3-(4-метансульфонилфенил)-5-(ацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-(N,N-диметиламино)фенил)-5-(ацетамидо)индено[1,2-c]пиразол-4-она;
3-(3-пиридил)-5-(ацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(формамидо)индено[1,2-c]пиразол-4-она;
3-(4-гидроксифенил)-5-(ацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-пиперидинофенил)-5-(ацетамидо)индено[1,2-c]-пиразол-4-она;
3-(4-морфолинофенил)-5-(ацетамидо)индено[1,2-c]-пиразол-4-она;
3-(4-этоксифенил)-5-(ацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-бутилфенил)-5-(ацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-этилфенил)-5-(ацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-н-пропилфенил)-5-(ацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-((4-аминофенил)ацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-пиридил)-5-(формамидо)индено[1,2-c]пиразол-4-она;
3-(4-пиридил)-5-(ацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-((4-аминофенил)ацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-((4-азидофенил)ацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-((4-(метоксикарбониламино)фенил)ацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-((4-(аминометилкарбониламино)фенил)ацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-((4-((N,N-диметиламино)метилкарбониламино)фенил)ацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-((4-ацетамидофенил)ацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(пирролидиноацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(морфолиноацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(тиоморфолиноацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(этиламиноацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(пиперидиноацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(4-(аминометил)пиперидиноацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(пиперазиноацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(4-метилпиперазиноацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(4-(2-гидроксиэтил)пиперазиноацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(N,N-диметиламиноацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-((2-гидроксиэтил)аминоацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(аминоацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-((2-хлорфенил)ацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-((2,4-дихлорфенил)ацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-((3',4-дихлорфенил)ацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-((2-метоксифенил)ацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(3-тиенилацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-((3,4-метилендиоксифенил)ацетамидо)индено[1,2-c]пиразол-4-она;
3-(3,4-диметоксифенил)-5-(ацетамидо)индено[1,2-c]пиразол-4-она;
3-(2-метоксифенил)-5-(ацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-((2,5-диметоксифенил)ацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-((3,4-диметоксифенил)ацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-((4-метоксифенил)ацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-((3-метоксифенил)ацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-((4-хлорфенил)ацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-((бутилкарбамоил)амино)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-((4-аминобензилкарбамоил)амино)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-((4-пиридилкарбамоил)амино)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-((фенилкарбамоил)амино)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(циклобутанкарбоксамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(циклопентанкарбоксамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(бутанамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(пропанамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(фенилацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(2-метилпропанамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(циклопропанкарбоксамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(хлорацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(4-(аминометил)пиперидиноацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-(N,N-диметиламино)фенил)-5-(морфолиноацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-(N,N-диметиламино)фенил)-5-(N,N-диметиламиноацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-(трифторметил)фенил)-5-(ацетамидо)индено[1,2-c]-пиразол-4-она;
3-(4-(N,N-диметиламино)фенил)-5-(4-метилпиперазиноацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-(N,N-диметиламино)фенил)-5-(4-(аминометил)пиперидиноацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-(N,N-диметиламино)фенил)-5-(4-гидроксипиперидиноацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-морфолинофенил)-5-(морфолиноацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-морфолинофенил)-5-(4-метилпиперазиноацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-морфолинофенил)-5-(4-гидроксипиперидиноацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-морфолинофенил)-5-(4-(аминометил)пиперидиноацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-пиперазинофенил)-5-(морфолиноацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-пиперазинофенил)-5-((N,N-диметиламино)ацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-пиперазинофенил)-5-(4-метилпиперазиноацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-пиперазинофенил)-5-(4-(аминометил)пиперидиноацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-пиперазинофенил)-5-(карбамоиламино)индено[1,2-c]пиразол-4-она;
3-(4-пиперазинофенил)-5-(аминокарбамоилаимино)индено[1,2-c]пиразол-4-она;
3-(4-пиперазинофенил)-5-(морфолинокарбамоиламино)индено[1,2-c]пиразол-4-она;
3-(4-(4-метилпиперазино)фенил)-5-(морфолинокарбамоиламино)индено[1,2-c]пиразол-4-она;
3-(4-(4-этилпиперазино)фенил)-5-(морфолинокарбамоиламино)индено[1,2-c]пиразол-4-она;
3-(4-(4-изопропилпиперазино)фенил)-5-(морфолинокарбамоиламино)индено[1,2-c]пиразол-4-она;
3-(4-(4-трет-бутоксикарбонилпиперазино)фенил)-5-(морфолинокарбамоиламино)индено[1,2-c]пиразол-4-она;
3-(4-(N,N-диметиламино)фенил)-5-((4-метилпиперазино)карбамоиламино)индено[1,2-c]пиразол-4-она;
3-(циклопропил)-5-(ацетамидо)индено[1,2-c]пиразол-4-она;
3-(2-тиенил)-5-(ацетамидо)индено[1,2-c]пиразол-4-она;
3-(3-метил-2-тиенил)-5-(ацетамидо)индено[1,2-c]пиразол-4-она;
3-(этил)-5-(карбамоиламино)индено[1,2-c]пиразол-4-она;
3-(н-пропил)-5-(карбамоиламино)аминоиндено[1,2-c]пиразол-4-она;
3-(изопропил)-5-(карбамоиламино)индено[1,2-c]пиразол-4-она;
3-(циклопропил)-5-(карбамоиламино)индено[1,2-c]пиразол-4-она;
3-(циклогексил)-5-(карбамоиламино)индено[1,2-c]пиразол-4-она;
3-(2-тиенил)-5-(карбамоиламино)индено[1,2-c]пиразол-4-она;
3-(3-метил-2-тиенил)-5-(карбамоиламино)индено[1,2-c]-пиразол-4-она;
3-(5-метил-2-тиенил)-5-(карбамоиламино)индено[1,2-c]пиразол-4-она;
3-(5-карбоэтокси-2-тиенил)-5-(карбамоиламино)индено[1,2-c]пиразол-4-она;
3-(3-тиенил)-5-(карбамоиламино)индено[1,2-c]пиразол-4-она;
3-(1-метил-3-пирролил)-5-(карбамоиламино)индено[1,2-c]пиразол-4-она;
3-(2,5-диметил-3-тиенил)-5-(карбамоиламино)индено[1,2-c]пиразол-4-она;
3-(2-фуранил)-5-(карбамоиламино)индено[1,2-c]пиразол-4-она;
3-(изопропил)-5-((N,N-диметиламинокарбамоил)амино)индено[1,2-c]пиразол-4-она;
3-(циклопропил)-5-((N,N-диметиламинокарбамоил)амино)индено[1,2-c]пиразол-4-она;
3-(циклогексил)-5-((N,N-диметиламинокарбамоил)амино)индено[1,2-c]пиразол-4-она;
3-(2-тиенил)-5-((N,N-диметиламинокарбамоил)амино)индено[1,2-c]пиразол-4-она;
3-(5-метокси-2-тиенил)-5-((N,N-диметиламинокарбамоил)амино)индено[1,2-c]пиразол-4-она;
3-(5-метил-2-тиенил)-5-((N,N-диметиламинокарбамоил)амино)индено[1,2-c]пиразол-4-она;
3-(5-карбоэтокси-2-тиенил)-5-((N,N-диметиламинокарбамоил)амино)индено[1,2-c]пиразол-4-она;
3-(3-тиенил)-5-((N,N-диметиламинокарбамоил)амино)индено[1,2-c]пиразол-4-она;
3-(5-хлор-3-тиенил)-5-((N,N-диметиламинокарбамоил)амино)индено[1,2-c]пиразол-4-она;
3-(2,5-диметил-3-тиенил)-5-((N,N-диметиламинокарбамоил)амино)индено[1,2-c]пиразол-4-она;
3-(2-фуранил)-5-((N,N-диметиламинокарбамоил)амино)индено[1,2-c]пиразол-4-она;
3-(изопропил)-5-((4-карбамоилпиперидино)ацетамидо)индено[1,2-c]пиразол-4-она;
3-(циклогексил)-5-((4-карбамоилпиперидино)ацетамидо)индено[1,2-c]пиразол-4-она;
3-(этил)-5-(4-(аминометил)пиперидиноацетамидо)индено[1,2-c]пиразол-4-она;
3-(изопропил)-5-(4-(аминометил)пиперидиноацетамидо)индено[1,2-c]пиразол-4-она;
3-(циклопропил)-5-(4-(аминометил)пиперидиноацетамидо)индено[1,2-c]пиразол-4-она;
3-(циклогексил)-5-(4-(аминометил)пиперидиноацетамидо)индено[1,2-c]пиразол-4-она;
3-(изопропил)-5-((4-метилпиперазино)карбамоиламино)индено[1,2-c]пиразол-4-она;
3-(5-карбоэтокси-2-тиенил)-5-((4-метилпиперазино)карбамоиламино)индено[1,2-c]пиразол-4-она;
3-(5-карбоксил-2-тиенил)-5-((4-метилпиперазино)карбамоиламино)индено[1,2-c]пиразол-4-она;
3-(2,5-диметил-3-тиенил)-5-((4-метилпиперазино)карбамоиламино)индено[1,2-c]пиразол-4-она;
3-(изопропил)-5-(морфолинокарбамоиламино)индено[1,2-c]-пиразол-4-она;
3-(1-метоксикарбонил-4-пиперидинил)-5-(морфолинокарбамоиламино)индено[1,2-c]пиразол-4-она;
3-(5-метил-2-тиенил)-5-(морфолинокарбамоиламино)индено[1,2-c]пиразол-4-она;
3-(5-хлор-3-тиенил)-5-(морфолинокарбамоиламино)индено[1,2-c]пиразол-4-она;
3-(2,5-диметил-3-тиенил)-5-(морфолинокарбамоиламино)индено[1,2-c]пиразол-4-она;
3-(5-карбоэтокси-2-тиенил)-5-(морфолинилкарбамоиламино)индено[1,2-c]пиразол-4-она;
3-(5-карбоксил-2-тиенил)-5-(морфолинилкарбамоиламино)индено[1,2-c]пиразол-4-она;
3-(5-(бензиламинокарбонил)-2-тиенил)-5-(морфолинокарбамоиламино)индено[1,2-c]пиразол-4-она;
3-(5-((4-метилпиперазино)карбонил)-2-тиенил)-5-(морфолинокарбамоиламино)индено[1,2-c]пиразол-4-юэр;
3-(5-((2-(1-метил-2-пирролидинил)этил)аминокарбонил)-2-тиенил)-5-(морфолинокарбамоиламино)индено[1,2-c]пиразол-4-она;
3-(5-((N,N-диметиламино)аминокарбонил)-2-тиенил-5-(морфолинокарбамоиламино)индено[1,2-c]пиразол-4-она;
3-(5-(2-(N,N-диметиламино)этил)аминокарбонил)-2-тиенил-5-(морфолинокарбамоиламино)индено[1,2-c]пиразол-4-она;
3-(5-(2-пирролидиноэтил)аминокарбонил)-2-тиенил-5-(морфолинокарбамоиламино)индено[1,2-c]пиразол-4-она;
3-(5-(2-морфолиноэтил)аминокарбонил)-2-тиенил-5-(морфолинокарбамоиламино)индено[1,2-c]пиразол-4-она;
3-(5-(морфолинокарбонил)-2-тиенил)-5-(морфолинокарбамоиламино)индено[1,2-c]пиразол-4-она;
3-(5-(3-(2-пирролидон-1-ил)пропил)аминокарбонил)-2-тиенил-5-(морфолинокарбамоиламино)индено[1,2-c]-пиразол-4-она;
3-(5-((2-(3-пиридил)этил)аминокарбонил)-2-тиенил)-5-(морфолинокарбамоиламино)индено[1,2-c]пиразол-4-она;
3-(5-((3-(1-имидазолил)пропил)аминокарбонил)-2-тиенил)-5-(морфолинокарбамоиламино)индено[1,2-c]пиразол-4-она;
3-(5-((2-(2-пиридил)этил)аминокарбонил)-2-тиенил)-5-(морфолинокарбамоиламино)индено[1,2-c]пиразол-4-она;
3-((5-((2-пиридил)метил)аминокарбонил)-2-тиенил)-5-(морфолинокарбамоиламино)индено[1,2-c]пиразол-4-она;
3-(5-((2-пиперидиноэтил)аминокарбонил)-2-тиенил)-5-(морфолинокарбамоиламино)индено[1,2-c]пиразол-4-она;
3-(4-пиперазинофенил)-5-((N,N-диметиламино)карбамоиламино)индено[1,2-c]пиразол-4-она;
3-(4-(4-метилпиперазино)фенил)-5-((N,N-диметиламино)карбамоиламино)индено[1,2-c]пиразол-4-она;
3-(4-пиперазинофенил)-5-((4-метилпиперазино)карбамоиламино)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(изопропиламидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(этиламидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(н-пропиламидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-((3-тиофен)ацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-((2-гидроксиэтил)аминоацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(N,N-диметиламиноацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(пиперазинилацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(4-пиридиниламинометилацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(фенилкарбамоил)аминоиндено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(диметиламинокарбамоил)аминоиндено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(метилкарбамоил)аминоиндено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(морфолинокарбамоил)аминоиндено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(цис-2-аминоциклогексилкарбамоил)аминоиндено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(4-метилпиперазинилкарбамоил)аминоиндено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(4-уридометилпиперидинилацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(4-(2-пиридил)пиперазинилацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(4-(аминоэтил)пиперазинилацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(4-амидопиперидинилацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(4-гидроксипиперидинилацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(4-гидроксиметилпиперидинилацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(4-амидопиперазинилацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(4-диметиламинопиперидинилацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-метоксифенил)-5-(4-аминопиперидинилацетамидо)индено[1,2-c]пиразол-4-она;
3-(изопропил)-5-(ацетамидо)индено[1,2-c]пиразол-4-она;
3-(трет-бутил)-5-(ацетамидо)индено[1,2-c]пиразол-4-она;
3-(5-хлор-3-тиенил)-5-(карбамоил)аминоиндено[1,2-c]пиразол-4-она;
3-(этил)-5-(4-аминометилпиперидинилацетамидо)индено[1,2-c]пиразол-4-она;
3-(изопропил)-5-(4-аминометилпиперидинилацетамидо)индено[1,2-c]пиразол-4-она;
3-(циклопропил)-5-(4-аминометилпиперидинилацетамидо)индено[1,2-c]пиразол-4-она;
3-(циклогексил)-5-(4-аминометилпиперидинилацетамидо)индено[1,2-c]пиразол-4-она;
3-(4-(1-пиперазинил)фенил)-5-((аминокарбонил)амино)индено[1,2-c]пиразол-4-она;
или их фармацевтически приемлемых солей.
32. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и терапевтически эффективное количество соединения по п.1.
33. Способ лечения рака и пролиферативных заболеваний, включающий введение нуждающемуся в таком лечении субъекту терапевтически эффективного количества соединения по п.1, или его фармацевтически приемлемой соли, или пролекарственной формы этого соединения.
Текст
1 Область изобретения Настоящее изобретение относится к новым 5-замещенным индено[1,2-с]пиразол-4-онам,которые используются в качестве ингибиторов циклинзависимых киназ (ЦЗК), содержащим их фармацевтическим композициям, методам их применения с целью лечения пролиферативных заболеваний, а также к промежуточным продуктам и способам их получения. Одним из наиболее важных и наиболее фундаментальных процессов в биологии является деление клеток в процессе клеточного цикла. Этот процесс обеспечивает контролируемое продуцирование последующих поколений клеток, имеющих определенную биологическую функцию, и является в высокой степени регулируемым феноменом, отвечающим за ряд разнообразных клеточных сигналов, как внутри клетки, так и от внешних источников. Ключевыми компонентами этих клеточных сигнальных процессов является сложная система способствующих опухолевому росту и тормозящих его генных продуктов. Сверхэкспрессия способствующих опухолевому росту компонентов и последующее уменьшение количества продуктов,тормозящих опухолевый рост, приводят к неконтролируемой клеточной пролиферации и возникновению опухолей (Pardee, Science, 246,603-608, 1989). Циклинзависимые киназы (ЦЗК) играют ключевую роль в регулировании механизма клеточного цикла. Эти комплексы состоят из двух компонентов: каталитической субъединицы (киназы) и регуляторной субъединицы (циклина). К настоящему времени были идентифицированы шесть киназных субъединиц (ЦЗК 17) наряду с несколькими регуляторными субъединицами (циклины А-Н). Каждая киназа связывается со специфическим регуляторным партнером и образует вместе с ним активную каталитическую группу. Каждый переход клеточного цикла регулируется специальным ЦЗКкомплексом: G1/S посредством ЦЗК 2/циклин Е,ЦЗК 4/циклин D1 и ЦЗК 6/циклин D2; S/G2 посредством ЦЗК 2/циклин А и ЦЗК 1/циклин A;G2/M посредством ЦЗК 1/В. Координируемая активность этих киназ проводит индивидуальные клетки через репликационный процесс и обеспечивает жизнеспособность каждого последующего поколения (Sherr, Cell, 73, 1059-1065,1993; Draetta, Trends Biochem. Sci., 15, 378-382,1990). Возрастающий объем данных показал связь между развитием опухоли и дисфункциями, обусловленными ЦЗК. Установлена взаимосвязь между сверхэкспрессией циклинрегуляторных белков и последующей гиперактивностью киназы и нескольких типов рака(Jiang, Proc. Natl. Acad. Sci. USA, 90, 9026-9030,1993; Wang, Nature, 343, 555-557, 1990). Недавно было обнаружено, что эндогенные высокоспецифичные белковые ингибиторы ЦЗК оказы 004805 2 вают существенное влияние на клеточную пролиферацию (Kamb et al., Science, 264, 436-440,1994; Beach, Nature, 336, 701-704, 1993) . Эти ингибиторы включают pl6INK4 (ингибитор ЦЗК 4/D1), p21CIP1 (общий ингибитор для ЦЗК) иp21CIP1 (специфический ингибитор для ЦЗК 2/Е) . Недавно установленная структура р 27, связанного с ЦЗК 2/А, дала представление о том, каким образом эти белки эффективно ингибируют активность киназы в результате множественных взаимодействий с комплексом ЦЗК (Pavletich,Nature, 382, 325-331, 1996). Эти белки позволяют регулировать клеточный цикл путем специфических взаимодействий с соответствующими им комплексами ЦЗК. Клетки с дефицитом этих ингибиторов обладают склонностью к нерегулируемому росту и образованию опухоли. Полученные данные привели к интенсивному поиску ингибиторов семейства ЦЗК,имеющих маленькую молекулу, в качестве составляющих хемотерапию рака. Известны примеры молекул, имеющих отношение к настоящему изобретению, которые представляют собой 5-замещенные индено[1,2-c]пиразолы, являющиеся ингибиторами ЦЗК. В одной из публикаций описаны индено[1,2-c]пиразолы, которые проявляли противораковую активность. Известны также две публикации, в которых описаны индено[1,2-c]пиразолы, обладающие полезными свойствами и структурой, не имеющими отношения к настоящему изобретению. Ряд обладающих противораковой активностью индено[1,2-c]-пиразолов описан в JP 60130521 и JP 62099361. Эти соединения имеют следующую общую формулу Данные соединения не имеют никаких заместителей в инденофенильной части молекулы и не указано, что они могут быть ингибиторами УЗК. Кроме того, в настоящем изобретении обнаружено, что наличие замещения в 5 положении является критическим для ингибирующей УЗК активности. Ряд индено[1,2-c]пиразолов, обладающих гербицидной активностью, описаны в GB 2223946 и имеют следующую общую формулу Названные выше соединения отличаются от соединений настоящего изобретения характером заместителя Хn, который представляет галоген, алкил, галогеналкил или галогеналкокси при n, равным 0-2, кроме того, R1 обозначает ацил, a R2 алкил или циклоалкил. Ряд 1-(6'-замещенный-4'-метилхинол-2'ил)-3-метилиндено[1,2-c]пиразолов, проявляющих активность в отношении центральной нервной системы, описаны Quraishi, Farmaco, 3 44, 753-758, 1989 и имеют следующую общую формулу: Соединения этого ряда не рассматриваются как часть настоящего изобретения. Краткое описание изобретения Настоящее изобретение относится к новому классу индено[1,2-с]пиразол-4-онов или их фармацевтически приемлемых солям, которые являются мощными ингибиторами класса ферментов, известных как циклинзависимые киназы, которые относятся к каталитическим субъединицам ЦЗК 1-7 и их регуляторным субъединицам, известным как циклины А-Н. Другим предметом настоящего изобретения является новый способ лечения рака или других пролиферативных заболеваний, включающий введение терапевтически эффективного количества одного из названных выше соединений или их фармацевтически приемлемой соли. Еще одним предметом настоящего изобретения является новый способ лечения рака или других пролиферативных заболеваний, включающий введение терапевтически эффективной комбинации одного из соединений настоящего изобретения и одного или более других известных противораковых или антипролиферативных агентов. Эти или другие цели были достигнуты обнаружением того факта, что соединения формулы I где R1, R2 и X определены ниже, или их фармацевтически приемлемые соли являются ингибиторами циклинзависимой киназы. Детальное описание предпочтительных вариантов изобретения Изобретение относится к новым ингибиторам циклин-зависиых киназ (ЦЗК) и преимущественно, но не исключительно, к ингибиторам комплексов ЦЗК-циклин. Ингибиторами настоящего изобретения являются аналоги индено[1,2-c]пиразол-4-она. Некоторые аналоги оказались селективными в своей активности в отношении ЦЗК и их комплексов с циклинами,проявляя более низкую активность по отношению к другим известным серин-треониновым киназам, таким как протеинкиназа А (ПКА) и протеинкиназа С (ПКС). Наряду с этим ингибиторы оказались менее активными в отношении тирозинкиназ, таких как с-Аbl. Как указано выше, ингибиторы настоящего изобретения способны ингибировать механизм 4 клеточного цикла и благодаря этому могли бы быть полезными для модулирования протекания клеточного цикла, который в конечном итоге регулирует рост и дифференциацию клеток. Такие соединения могли бы оказаться полезными для лечения лиц с расстройствами, обусловленными избыточной клеточной пролиферацией, в частности лечения рака, псориаза, иммунологических расстройств, сопровождающихся нежелательной пролиферацией лейкоцитов, при лечении рестиноза и других клеточных заболеваний клеток гладких мышц, и т.п. Настоящее изобретение в первом варианте относится к новому соединению формулы I или его стереоизомер или его фармацевтически приемлемую соль, гдеRa в каждом случае независимо обозначает галоген, -CN, N3, NO2, С 1-С 4-алкил, галоген-С 1 С 4-алкил, NR3R3a, =O, OR3, COR3, CO2R3,CONR3R3a, NHC(O)NR3R3a, NHC(S)NR3R3a,NR3C(O)OR3, NR3C(O)R3, SO2NR3R3a, SO2R3b и 5-10-членный гетероцикл, содержащий 1-4 гетероатома, выбранный из О, N и S; альтернативно, когда два Ra находятся у соседних атомов углерода, они могут вместе образовывать -ОСН 2 О- или -ОСН 2 СН 2 О-;Rb в каждом случае независимо обозначает галоген, -CN, NO2, С 1-С 4-алкил, галоген-С 1-С 4 алкил, NR3R3a, NR3C(O)OR3, NR3C(O)R3, OR3,COR3, CO2R3, CONR3R3a, NHC(O)NR3R3a,NHC(S)NR3R3a, SO2NR3R3a и SO2R3b;Rc в каждом случае независимо обозначает галоген, -CN, NO2, С 1-С 4-алкил, галоген-С 1-С 4 алкил, NR3R3a, NR5NR5R5a, NR3C(O)OR3,NR3C(O)R3, =O, OR3, COR3, CO2R3, CONR3R3a,NHC(O)NR3R3a, NHC(S)NR3R3a, SO2NR3R3a,SO2R3b, С 3-С 10-карбоцикл, замещенный 0-5 группами Ra и 5-10-членный гетероцикл, содержащий 1-4 гетероатома, выбранные из группы,включающей O, N и S, и замещенный 0-3 группами R3;R3a обозначает Н, С 1-С 4-алкил, фенил и бензил; альтернативно, R3 и R3a могут также вместе с атомом азота, к которому они присоединены, образовывать 4-8-членный гетероцикл, который может дополнительно включать 0-1 атом азота, серы или кислорода и быть замещенным 1-3 группами R3c;R3c в каждом случае независимо обозначает галоген, -CN, N3, NO2, С 1-С 4-алкил, галогенС 1-С 4-алкил, NR3R3b, =O, OR3, COR3, CO2R3,CONR3R3b, NHC(O)NR3R3b, NHC(S)NR3R3b,NR3C(O)OR3, NR3C(O)R3, SO2NR3R3b, SO2R3b и 5-10-членный гетероцикл, содержащий 1-4 гетероатома, выбранные из: О, N или S;R4 в каждом случае независимо обозначает Н, -CN, C1-C4-алкил, галоген-С 1-С 4-алкил,NR3R3a, NR3C(O)OR3, NR3C(O)R3, OR3, COR3,CO2R3, CONR3R3a, NHC(O)NR3R3a, NHC(S)R5 независимо выбирают из группы Н, С 1 С 4-алкил, фенил и бензил;R5a независимо выбирают из группы Н, С 1 С 4-алкил, фенил и бензил;R5b независимо выбирают из группы Н, С 1 С 4-алкил, фенил и бензил; иm равно 0, 1, 2 и 3. В предпочтительном варианте настоящее изобретение относится к новому соединению формулы I, гдеRa в каждом случае независимо обозначает галоген, -CN, N3, NO2, С 1-С 4-алкил, галоген-С 1 С 4-алкил, NR3R3a, NR3C(O)OR3, NR3C(O)R3, =O,OR3, COR3, CO2R3, CONR3R3a, NHC(O)NR3R3a,NHC(S)NR3R3a, SO2NR3R3a, SO2R3b и 5-10 членный гетероцикл, содержащий 1-4 гетероатома, выбранные из О, N или S; 6 альтернативно, когда два Ra находятся у соседних атомов углерода, они могут вместе образовывать -ОСН 2 О- или -ОСН 2 СН 2 О-;Rb в каждом случае независимо обозначает галоген, -CN, NO2, С 1-С 4-алкил, галоген-С 1-С 4 алкил, NR3R3a, NR3C(O)OR3, NR3C(O)R3, OR3,COR3, CO2R3, CONR3R3a, NHC(O)NR3R3a, NHCRc в каждом случае независимо обозначает галоген, -CN, NO2, С 1-С 4-алкил, галоген-С 1-С 4 алкил, NR3R3a, NR3C(O)OR3, NR3C(O)R3,NR5NR5R5a, =O, OR3, COR3, CO2R3, CONR3R3a,NHC(O)NR3R3a, NHC(S)NR3R3a, SO2NR3R3a,SO2R3b, С 3-С 10-карбоцикл, замещенный 0-5 группами Ra, и 5-10-членный гетероцикл, содержащий 1-4 гетероатома, выбранные из группы, включающей О, N и S, и замещенный 0-3 группами R3;R3a обозначает Н, С 1-С 4-алкил, фенил и бензил; Альтернативно, R3 и R3a могут также вместе с атомом азота, к которому они присоединены, образовывать 4-8-членный гетероцикл, который может дополнительно включать 0-1 атом азота, серы или кислорода и быть замещенным 1-3 группами R3c;R3c в каждом случае независимо обозначает галоген, -CN, N3, NO2, С 1-С 4-алкил, галогенС 1-С 4-алкил, NR3R3b, =O, OR3, COR3, CO2R3,CONR3R3b, NHC(O)NR3R3b, NHC(S)NR3R3b,NR3C(O)OR3, NR3C(O)R3, SO2NR3R3b, SO2R3b и 5-10-членный гетероцикл, содержащий 1-4 гетероатома, выбранные из О, N или S;R4 в каждом случае независимо обозначает Н, -CN, С 1-С 4-алкил, галоген-С 1-С 4-алкил,NR3R3a, NR3C(O)OR3, NR3C(O)R3, OR3, COR3,CO2R3, CONR3R3a, NHC(O)NR3R3a, NHC(S)R5 независимо выбирают из группы Н, С 1 С 4-алкил, фенил и бензил;R5a независимо выбирают из группы Н, С 1 С 4-алкил, фенил и бензил;R5b независимо выбирают из группы Н, С 1 С 4-алкил, фенил и бензил; иm равно 0, 1, 2 и 3; при условии, что если R2 обозначает незамещенный разветвленный С 1-С 4 алкил, то R1 не является СН 3; или если R1 обозначает NHR4, и R4 обозначает 3 3aNR R , то R3 и R3a не могут оба обозначать фенил. В более предпочтительном варианте настоящее изобретение относится к новому соединению формулы I, гдеX выбирают из группы О и S;Ra в каждом случае независимо обозначает галоген, -CN, N3, C1-С 4-алкил, галоген-С 1-С 4 алкил, NR3R3a, NR3C(O)OR3, NR3C(O)R3, OR3,COR3, CO2R3, CONR3R3a, NHC(O)NR3R3a,SO2NR3R3a, SO2R3b или 5-6-членный гетероцикл,содержащий 1-4 гетероатома, выбранные из О,N или S; Альтернативно, в том случае, когда два Ra находятся у соседних атомов углерода, они могут вместе образовывать -ОСН 2 О- илиRb в каждом случае независимо обозначает галоген, -CN, C1-C4-алкил, галоген-С 1-С 4-алкил,NR3R3a, NR3C(O)OR3, NR3C(O)R3, OR3, COR3,CO2R3, CONR3R3a, NHC(O)NR3R3a, SO2NR3R3a иRc в каждом случае независимо обозначает галоген, -CN, C1-C4-алкил, галоген-С 1-С 4-алкил,NR3R3a, NR5NR5R5a, NR3C(O)OR3, NR3C(O)R3,=O, OR3, COR3, CO2R3, CONR3R3a, NHCR3a обозначает Н, С 1-С 4-алкил, фенил и бензил; Альтернативно, R3 и R3a могут также вместе с атомом азота, к которому они присоедине 004805 8 ны, образовывать 5-6-членный гетероцикл, который может дополнительно включать 0-1 атом азота, серы или кислорода и быть замещенным 1-3 группами R3c;R3c в каждом случае независимо обозначает галоген, -CN, N3, NO2, С 1-С 4-алкил, галогенС 1-С 4-алкил, NR3R3b, =O, OR3, COR3, CO2R3,CONR3R3b, NHC(O)NR3R3b, NHC(S)NR3R3b,NR3C(O)OR3, NR3C(O)R3, SO2NR3R3b, SO2R3b или 5-10-членный гетероцикл, содержащий 1-4 гетероатома, выбранные из О, N и S;R4 в каждом случае независимо обозначает Н, -CN, С 1-С 4-алкил, галоген-С 1-С 4-алкил,NR3R3a, NR3C(O)OR3, NR3C(O)R3, OR3, COR3,CO2R3, CONR3R3a, NHC(O)NR3R3a, NHC(S)R5 независимо выбирают из группы Н, С 1 С 4-алкил, фенил и бензил;R5a независимо выбирают из группы Н, С 1 С 4-алкил, фенил и бензил;R5b независимо выбирают из группы Н, С 1 С 4-алкил, фенил и бензил; иm равно 0, 1, 2 и 3. В еще более предпочтительном варианте настоящее изобретение относится к новому соединению формулы I, гдеX выбирают из группы О и S;Ra в каждом случае независимо обозначает галоген, -CN, N3, С 1-С 4-алкил, галоген-С 1-С 4 алкил, NR3R3a, NR3C(O)OR3, NR3C(O)R3, OR3,COR3, CO2R3, CONR3R3a, NHC(O)NR3R3a,SO2NR3R3a, SO2R3b или 5-10-членный гетероцикл, содержащий 1-4 гетероатома, выбранные из О, N или S; альтернативно, когда два Ra находятся у соседних атомов углерода, они могут вместе образовывать -ОСН 2 О- или -ОСН 2 СН 2 О-;Rb в каждом случае независимо обозначает галоген,C1-C4-алкил,галоген-С 1-С 4-алкил,NR3R3a, NR3C(O)OR3, NR3C(O)R3, OR3, COR3,CO2R3, CONR3R3a, NHC(O)NR3R3a, SO2NR3R3a или SO2R3b;Rc в каждом случае независимо обозначает галоген, -CN, C1-C4-алкил, галоген-С 1-С 4-алкил,NR3R3a, NR5NR5R5a, NR3C(O)OR3, NR3C(O)R3,OR3, COR3, CO2R3, CONR3R3a, NHC(O)NR3R3a,SO2NR3R3a, SO2R3b, С 3-С 10-карбоцикл, замещенный 0-5 группами Ra, и 5-10-членный гетероцикл, содержащий 1-4 гетероатома, выбранныеR3a обозначает Н, С 1-С 4-алкил, фенил и бензил; Альтернативно, R3 и R3a могут также вместе с атомом азота, к которому они присоединены, образовывать 5-6-членный гетероцикл, который может дополнительно включать 0-1 атом азота, серы или кислорода и быть замещенным 1-3 группами R3c;R3c в каждом случае независимо обозначает галоген, N3, NO2, С 1-С 4-алкил, галоген-С 1-С 4 алкил, NR3R3b, =O, OR3, COR3, CO2R3,CONR3R3b, NHC(O)NR3R3b, NHC(S)NR3R3b,NR3C(O)OR3, NR3C(O)R3, SO2NR3R3b, SO2R3b или 5-10-членный гетероцикл, содержащий 1-4 гетероатома, выбранные из О, N и S;R4 в каждом случае независимо обозначает Н, -CN, С 1-С 4-алкил, галоген-С 1-С 4-алкил,NR3R3a, NR3C(O)OR3, NR3C(O)R3, OR3, COR3,CO2R3,CONR3R3a,NHC(O)NR3R3a,3 3a 3 3aR5 независимо выбирают из группы Н иR5a независимо выбирают из группы Н, С 1 С 4-алкил, фенил и бензил;R5b независимо выбирают из группы Н и С 1-С 4-алкил, иm равно 0, 1, 2 и 3. В наиболее предпочтительном варианте соединения формулы I выбирают из следующих соединений: 3-(4-метоксифенил)-5-(ацетамидо)индено[1,2-c]пиразол-4-он; 3-(5-(2-пиперидил)этил)карбоксамидо-2 тиенил)-5-(морфолинилкарбамоил)аминоиндено[1,2-c]пиразол-4-он; или их фармацевтически приемлемые соли. Другим объектом изобретения является фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и терапевтически эффективное количество соединения формулы I. Еще одним объектом изобретения является способ лечения рака и пролиферативных заболеваний, включающий введение нуждающемуся в таком лечении субъекту терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли. Определения Используемые в настоящем изобретении следующие термины и выражения имеют указанные значения. Соединения настоящего изобретения могут содержать асимметрически замещенный атом углерода и могут быть выделены в оптически активной или рацемической формах. Способы получения оптически активных форм хорошо известны -это могут быть способы разделения рацемических форм или синтез из оптически активных исходных материалов. В объем изобретения входят все хиральные, диастереоизомерные и рацемические формы, а также геоетрические изомерные формы молекул, если специфическая стереохимия или изомерная форма не оговорены особо. Термин алкил относится к насыщенным алифатическим углеводородным группам как с разветвленной, так и с нормальной цепью,имеющим определенное количество атомов углерода. Примеры алкилов включают, но не ограничены ими, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил, н-пентил и втор-пентил. Термин алкил так же относится как к незамещенным, так и замещенные алкильным группам, к последним из которых относятся алкильные группы, у которых один или более атомов водорода замещены галогеном,гидроксилом, карбонилом, алкоксигруппой,сложно-эфирной группой, группой простого эфира, группами циано, фосфорильной, амино,амидной, сульфгидрильной, алкилтио, сложной тио-эфирной, сульфонильной, нитро, гетероциклической, арильной, гетероарильной или другими группами. Специалистам понятно, что сами замещенные при необходимости могут, в свою очередь, иметь заместители. Используемый термин галоген относится к фтору, хлору, брому и йоду. Термин арил относится к ароматической группе, содержащей определенное число атомов углерода, такой,например, как фенил, инданил или нафтил. Термины циклоалкил и бициклоалкил относит 004805 16 ся к любой стабильной циклической системе,которая может быть насыщенной или частично ненасыщенной. Не ограничивающими примерами такой системы являются циклопропил, циклопентил, циклогексил, норборнил, бицикло[2.2.2]нонан, адамантил и тетра-гидронафтил(тетралин). Используемый термин карбоцикл, или карбоциклический остаток, относится к любой стабильной 3-7-членной моноциклической или 7-13-членной бициклической или трициклической системе, каждая из которых может быть насыщенной, частично ненасыщенной или ароматической. Не ограничивающими примерами таких карбоциклов являются циклопропил,циклобутил, циклопентил, циклогексил, циклогептил, адамантил, циклооктил, [3.3.0]бициклооктан, [4.3.0]бициклононан, [4.4.0]бициклодекан (декалин), [2.2.2]бициклооктан, флуоренил, фенил, нафтил, инданил, адамантил и тетрагидронафтил (тетралин). Используемый термин гетероцикл, или гетероциклическая система относится к стабильной 5-7-членной моноциклической или бициклической или 7-10-членной бициклической гетероциклической системе, которая может быть насыщенной, частично ненасыщенной или ненасыщенной (ароматической) и которая состоит из атомов углерода и 1-4 гетероатомов,выбранных из группы, состоящей из N, О и S,включающей также любую бициклическую группу, в которой какое-либо из определенных выше гетероциклических колец конденсировано с бензольным кольцом. Гетероатомы азота и серы могут необязательно находиться в окисленной форме. Гетероциклическое кольцо может быть соединено с ответвляющейся от него группой через любой гетероатом или атом углерода с образованием устойчивой структуры. Описанные здесь гетероциклические кольца могут быть замещены по атому углерода или азота, если образующееся при этом соединение является устойчивым. Если оговорено особо,азот в ге-тероцикле может быть в кватернизованной форме. Когда общее число атомов S и О в гетероцикле превышает 1, предпочтительно,чтобы эти атомы не находились в соседних положениях. Используемый термин ароматическая гетероциклическая система относится к устойчивому 5-7-членному моноциклическому или бициклическому или 7-10-членному бициклическому гетероциклическому ароматическому кольцу, которое состоит из атомов углерода и 14 гетероатомов, независимо выбранных из группы, состоящей из N, О и S. Предпочтительно, чтобы общее число атомов S и О в гетероцикле было не более одного. Примеры гетероциклов включают, но не ограничены, 1 Н-индазол, 2-пирролидонил, 2 Н,6 Н-1,5,2-дитиазинил, 2 Н-пирролил, 3 Н-индолил, 4-пиперидонил, 4 аН-карбазол, 4 Н-хинолизинил, 6 Н-1,2,5-тиадиазинил, акридинил, азоци 17 нил, бензимидазолил, бензофуранил, бензотиофуранил, бензотиофенил, бензоксазолил,бензтиазолил, бензтриазолил, бензтетразолил,бензизоксазолил, бензизотиазолил, бензимидазалонил, карбазолил, 4 аН-карбазолил, b-карболинил, хроманил, хроменил, циннолинил, декагидрохинолинил, 2 Н, 6 Н-1,5,2-дитиазинил, дигидрофуро[2,3-b]тетрагидрофуран,фуранил,фуразанил, имидазолидинил, имидазолинил,имидазолил, 1 Н-индазолил, индоленил, индолинил, индолизинил, индолил, изобензофуранил,изохроманил, изоиндазолил, изоиндолинил,изоиндолил, изохинолинил, изотиазолил, изоксазолил, морфолинил, нафтиридинил, октагидроизохинолинил, оксадиазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил,1,3,4-оксадиазолил, оксазолидинил, оксазолил,оксазолидинилперимидинил, фенантридинил,фенантролинил, фенарсазинил, феназинил, фенотиазинил, феноксатиинил, феноксазинил,фталазинил, пиперазинил, пиперидинил, птеридинил, пиперидонил, 4-пиперидонил, птеридинил, пуринил, пиранил, пиразинил, пиразолидинил, пиразолинил, пиразолил, пиридазинил, пиридооксазол, пиридоимидазол, пиридотиазол,пиридинил, пиридил, пиримидинил, пирролидинил, пирролинил, пирролил, хиназолинил, хинолинил, 4 Н-хинолизинил, хиноксалинил, хинуклидинил, карболинил, тетрагидрофуранил,тетрагидроизохинолинил,тетрагидрохинолинил, 6 Н-1,2,5-тиадиазинил, 1,2,3-тиадиазолил,1,2,4-тиадиазолил, 1,2,5-тиадиазолил, 1,3,4-тиадиазолил, тиантренил, тиазолил, тиенил, тиенотиазолил, тиенооксазолил, тиеноимидазолил,тиофенил, триазинил, 1,2,3-триазолил, 1,2,4 триазолил, 1,2,5-триазолил, 1,3,4-триазолил,ксантенил. Примерами предпочтительных гетероциклов являются пиридинил, фуранил, тиенил, пирролил, пиразолил, имидазолил, индолил, бензимидазолил, 1 Н-индазолил, оксазолидинил, бензотриазолил, бензизоксазолил, оксиндолил, бензоксазолинил и изатиноил. Сюда же входят соединения с конденсированными кольцами и спиросоединения, содержащие, например, перечисленные выше соединения. Используемый термин фармацевтически приемлемые соли относится к производным соединений настоящего изобретения, в которых исходное соединение модифицировано превращением в соль с кислотой или основанием. Не ограничивающими примерами фармацевтически приемлемых солей являются соли с минеральными или органическими кислотами, образованные с основными остатками, такими как аминогруппы; соли щелочей или органических оснований, образованные по кислотным остаткам таким как карбоксильные группы; и т.п. Фармацевтически приемлемые соли включают обычные нетоксичные соли или соли четвертичного аммония исходного соединения, образованные, например, с нетоксичными неорганическими или органическими кислотами. К числу 18 такого рода обычных нетоксичных солей относятся соли, полученные с неорганическими кислотами такими как хлористо-водородная, бромисто водородная, серная, сульфаминовая, фосфорная, азотная кислота и т.п., и соли, полученные с органическими кислотами, такими как уксусная, пропионовая, янтарная, гликолевая,стеариновая, молочная, яблочная, винная, лимонная, аскорбиновая, памоевая (4,4'-метиленбис(3-гидрокси-2-нафтойная, малеиновая, гидроксималеиновая, фенилуксусная, глутаминовая, бензойная, салициловая, сульфаниловая, 2 ацетоксибензойная, фумаровая, толуолсульфоновая, метансульфоновая, этандисульфоновая,щавелевая, изетионовая (2-гидроксиэтансульфоновая) кислота и т.п. Фармацевтически приемлемые соли настоящего изобретения могут быть синтезированы из исходного соединения, содержащего основную или кислотную группу, с использованием традиционных химических методов. Обычно такие соли могут быть получены реакцией исходных соединений в форме свободной кислоты или в основной форме со стехиометрическим количеством соответствующего основания или кислоты в воде или в органическом растворителе или в их смеси. Из неводных сред обычно предпочтительны этиловый эфир, этилацетат,этанол, изопропиловый спирт и ацетонитрил. Перечень подходящих солей можно найти вRemington's Pharmaceutical Sciences, 18-ое изд.,Mack Publishing Company, Easton, PA, 1990,p.1445, который включен сюда в качестве ссылки. Выражение фармацевтически приемлемый используется в отношении соединений,материалов, композиций и/или дозируемых форм, которые, с точки зрения медицины, пригодны для применения, в контакте с тканями человека и животных, без чрезмерного токсического действия, раздражения, аллергической реакции или других проблем или осложнений,оцениваемых с учетом оптимального соотношения польза/риск. Используемый термин пролекарства включает любые ковалентно связанные носители, выделяющие исходные активные лекарственные соединения настоящего изобретения invivo, когда такое пролекарство вводят млекопитающему. Поскольку известно, что пролекарства усиливают многие желательные качества фармацевтических препаратов (например, растворимость, биодоступность, изготовление и т.д.), соединения настоящего изобретения могут быть переведены в форму пролекарства. Таким образом, настоящее изобретение охватывает пролекарственные формы заявленных здесь соединений, способы их доставки и содержащие их композиции. Пролекарства настоящего изобретения приготовляют модифицированием содержащихся в соединении функциональных групп таким образом, чтобы модифицированные 19 группы расщеплялись либо в процессе обычной обработки, либо in vivo, с выделением исходного соединения. Пролекарства включают соединения настоящего изобретения, в которых гидроксильная, амино- или сульфгидрильная группа связана с любой группой, которая при введении пролекарства настоящего изобретения млекопитающему отщепляется с образованием свободного гидроксила, свободной аминогруппы или свободной сульфгидрильной группы, соответственно. Примеры пролекарств включают, но не ограничены ими, ацетатные, формиатные и бензоатные производные спиртовой или аминной функциональных групп соединений настоящего изобретения. Термин замещенный применяется для указания того, что один или более атомов водорода у атома, обозначенного как замещенный,заменены указанной группой или группами при условии, что нормальная валентность указанного атома при этом не превышается и что замещение приводит к образованию стабильного соединения. Когда заместителем является кетогруппа (=СO), у атома замещаются два атома водорода. Используемый термин противораковый или антипролиферативный агент включает, но не ограничен ими, альтретамин, бусульфан,хлорамбуцил, циклофосфамид, ифосфамид, мехлорэтамин, мелфалан, тиотепа, кладрибин,фторурацил, флоксуридин, гемцитабин, тиогуанин, пертостатин, метотрексат, 6-меркаптопурин, цитарабин, кармустин, ломустин, стрептозотоцин, карбоплатин, цисплатин, оксалиплатин, ипроплатин, тетраплатин, добаплатин,JM216, JM335, флударабин, аминоглутетимид,флутамид, госерелин, леупролид, диэтилстильбестрон, преднизалон, блеомицин, дактиномицин, даунорубицин, доксирубицин, идарубицин,митоксантрон, лозоксантрон, митомицин-с,пликамицин, паклитаксел, доцетаксел, топотекан, иринотекан, 9-аминокамптотекан, 9 нитрокамптотекан, GS-211, этопозид, тенипозид, винбластин, винкристин, винорелбин, прокарбазин, аспарагиназу, пегаспаргазу, октреотид, эстрамустин, гидроксимочевину. Синтез Соединения настоящего изобретения могут быть синтезированы с использованием описанных ниже методов в сочетании с синтетическими методами, известными в области синтетической органической химии, или их вариаций по усмотрению специалистов-синтетиков. Предпочтительные методы, но включают не ограниченые ими методы, которые описаны ниже. Каждая из приведенных ниже ссылок включена в данное описание в качестве ссылки. Последовательность реакций получения индено[1,2-c]пиразол-4-она представлена на Схеме 1 и может быть использована для получения соединений настоящего изобретения. Нитрогруппу диметил-3-нитрофталата восстанавливают в аминогруппу методом каталитического гидрирования. Анилин ацетилируют с использованием уксусного ангидрида и пиридина в качестве основания. Смесь образующегося ацетамида 2 с ацетофеноном обработывают сильным основанием в подходящем растворителе при повышенной температуре с образованием желаемого трикетона 3. Известен другой способ получения трикетонов, описанный в Kilgore et al., Industrial and Engyneering Chemistry,34, 494-497, 1946, которая включена в описание в качестве ссылки. Трикетон обрабатывают гидразином при повышенной температуре в подходящем растворителе с образованием кольцевой системы индено[1,2-c]пиразол-4-она. Известен другой способ получения индено[1,2-c]пиразол 4-онов, описанный в Lemke et al., J. Heterocyclicand Svangova, Collect. Czech. Chem. Commun.,59, 2734-2740, 1994, которая включена в описание в качестве ссылки. Амид деацилируют нагреванием с сильной кислотой в подходящем растворителе с образованием анилина 4. Этот анилин ацилируют в стандартных условиях с использованием хлорангидрида кислоты в подходящем растворителе с образованием желаемого продукта 5. Схема 2 На схеме 2 представлен альтернативный способ получения соединений настоящего изобретения. Промежуточный трикетон 3 может быть деацилирован сильной кислотой и повторно ацилирован соответствующим хлорангидридом в соответствии с известными методами. Далее трикетон 6 может быть превращен в кольцевую систему индено[1,2-c]пиразол-4-она в тех же условиях, которые были описаны для схемы 1. Другой способ получения трикетонов 6 схемы 3 состоит в конденсации 1,3-дикетона 6 а с ангидридом нитрофталевой кислоты, как описано в Rotberg and Oshkaya, Zh. Organ. Khim., 8,84-87, 1972; Zh. Organ. Khim., 9, 2548-1550,1973, которая включена в описание в качестве ссылки. Коммерчески недоступные 1,3 дикетоны могут быть легко получены ацетилированием или трифторацетилирова-нием соответствующего метилкетона R1 СОСН 3. Восстановление нитропроизводного 6b в анилин 6 с может быть осуществлено различными путями,включая каталитическое гидрирование, обработку цинком или железом в кислотных условиях или обработку другими восстановителями,такими как дитионит натрия или хлорид олова(II). Анилин 6 с может быть затем превращен в индено[1,2-c]пиразол-4-оны настоящего изобретения ацилированием, с последующей обработкой гидразином, как это изображено на схеме 2. Схема 4 На схеме 4 представлен еще один способ получения кольцевой системы индено[1,2 с]пиразол-4-она. Диметилгидразин вводят в реакцию с 3-ацетилпиридином в отсутствие растворителя, в результате чего получают гидразон 7. Последний обрабатывают так, как описано для схемы 1, с образованием желаемого промежуточного соединения 8. Известны другие способы получения аналогичных промежуточных соединений, описанные в Pappoport, J. Org. 22 ное соединение вводят в последовательность реакций, аналогичную описанной для схемы 1. Другие отличительные признаки изобретения станут очевидными из следующих примеров вариантов изобретения, которые приведены как иллюстративный материал и не ограничивают объема изобретения. Примеры Приведенные в примерах сокращения определяются следующим образом: С означает градусы Цельсия, ХИМС означает хемоионизационная масс-спектроскопия, ЭИМС означает элетронноионизационная масс-спектроскопия, экв означает эквивалент или эквиваленты, г - грамм или граммы, ч - час или часы,мг - миллиграмм или миллиграммы, мл миллилитр или миллилитры, ммоль означает миллимолярный, М - молярный, мин - минута или минуты,п-TsOH птолуолсульфокислота, ДМФ - диметилформамид и ТФА - трифторуксусная кислота. Пример I. Получение 3-(4-метоксифенил)5-(ацетамидо)индено[1,2-c]пиразол-4-она.Pd/C (2,5 г) и гидрируют в течение 2 ч в аппарате Парра при давлении 0,345 МПа. Раствор фильтруют на целите, собирают фильтрат и удаляют растворитель при пониженном давлении. Остаток растворяют в уксусном ангидриде(20 мл), добавляют пиридин (0,05 мл) и нагревают до 80 С в течение 1 мин. Реакционную смесь охлаждают и перемешивают 2 ч при 25 С. Растворитель удаляют при пониженном давлении и остаток перекристаллизовывают из этанола, получая продукт в виде белого твердого вещества (21 г, 79%) с т.пл. 104-105 С; ХИМС(2 мл) добавляют в один прием гидрид натрия(0,15 г, 60%-ная суспензия в масле, 0,5 ммоль). Через 1 ч добавляют в один прием 4 метоксиацетофенон (0,6 г, 4,0 ммоль) и нагревают реакционную смесь до 90 С. Добавляют вторую порцию гидрида натрия (0,15 г, 60%-ная суспензия в масле, 0,4 ммоль), после чего смесь в результате экзотермической реакции стано 23 вится темно-красной. Через 20 мин реакционную смесь охлаждают до 25 С, разбавляют водой (20 мл) , экстрагируют этилацетатом (10 мл) и отделяют водную фазу. Последнюю подкисляют 2 н. HCl до рН 2 и собирают неочищенный продукт. Перекристаллизация из этанола дает целевой продукт в виде желтого твердого вещества (0,4 г, 30%) с т.пл. 174-175 С; ХИМС m/е: рассчитано для C19H16NO5 338,1028, найдено 338,1028; Элементный анализ: рассчитано для(5 мл) добавляют гидразингидрат (0,1 мл, 1,8 ммоль) и п-TsOH (3 мг) . Реакционную смесь кипятят с обратным холодильником, перемешивают в течение 2 ч, охлаждают до 25 С и собирают продукт в виде желтого твердого вещества Стадия 1. Получение 13 из 12. К суспензии 12 (1,0 г, 3,0 ммоль) в метаноле (10 мл) добавляют конц. НСl (1 мл) и кипятят с обратным холодильником. Через 2 ч реакционную смесь охлаждают и собирают продукт в виде зеленоватого твердого вещества (0,7 г,81%) с т.пл. 273 С; ХИМС m/e: рассчитано дляN 14,14. Стадия 2. Синтез 14 из 13. К суспензии 13 (20 мг, 0,07 ммоль) в диоксане (2 мл) добавляют насыщенный водный раствор NаНСО 3 (1 мл) и хлорацетилхлорид (30 мл,0,21 ммоль). Реакционную смесь нагревают до 50 С, перемешивают в течение 2 ч, охлаждают,вливают в воду (2 мл) и экстрагируют этилацетатом (10 мл). Органический слой отделяют,сушат над MgSO4 и удаляют растворитель при пониженном давлении. Твердый остаток перекристаллизовывают из этанола, получая продукт в виде желтого твердого вещества (9 мг, 35%) с т.пл. 274 С; ХИМС m/e: рассчитано для 24 Продукт получают так, как описано в примере II, используя в качестве исходного материала циклопропилацетилхлорид; т.пл. 298 С; ХИМС m/e: рассчитано для C21H18N3O3 360,1348, найдено 360,1330. Пример IV. Получение 3-(4-метоксифенил)-5-(изопропиламидо)индено[1,2-с]пиразол 4-она. Продукт получают так, как описано в примере II, используя в качестве исходного материала изопропилацетилхлорид; т.пл. 288 С; ХИМС m/e: рассчитано для C21H20N3O3 362,1505, найдено 362,1535. Пример V. Получение 3-(4-метоксифенил)5-(этиламидо)индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере II, используя в качестве исходного материала пропионилхлорид; т.пл. 287 С; ХИМСm/e: рассчитано для C20H18N3O3 348,1348, найдено 348,1313. Пример VI. Получение 3-(4-метоксифенил)-5-(циклопентиламидо)индено[1,2-с]пиразол-4-она. Продукт получают так, как описано в примере II, используя в качестве исходного материала циклопентилацетилхлорид; т.пл. 267 С; ХИМС m/e: рассчитано для C23H22N3O3 366,1661, найдено 388,1626. Пример VII. Получение 3-(4-метоксифенил)-5-(циклобутиламидо)индено[1,2-с]пиразол-4-она. Продукт получают так, как описано в примере II, используя в качестве исходного материала циклобутилацетилхлорид; т.пл. 297 С; ХИМС m/e: рассчитано для C22H20N3O3 374,1505, найдено 374,1530. Пример VIII. Получение 3-(4-метоксифенил)-5-(фенилацетамидо)индено[1,2-с]пиразол-4-она. Продукт получают так, как описано в примере II, используя в качестве исходного материала фенилацетилхлорид; т.пл. 280 С; ХИМСm/e: рассчитано для C25H20N3O3 410,1505, найдено 410,1533. Пример XI. Получение 3-(4-метоксифенил)-5-(бутиламидо)индено[1,2-с]пиразол-4-она. Продукт получают так, как описано в примере II, используя в качестве исходного материала бутирилхлорид; т.пл. 282 С; ХИМС m/e: рассчитано для C21H20N3O3 362,1505, найдено 362,1500. Пример X. Получение 3-(4-метоксифенил)5-4-хлорфенил)ацетамидо)индено[1,2-с]пиразол-4-она. Продукт получают так, как описано в примере II, используя в качестве исходного материала 4-хлорфенилацетилилхлорид; т.пл. 238 С; ХИМС m/e: рассчитано для C25H19N3O3Cl 444,1115, найдено 444,1110. Пример XI. Получение 3-(4-метоксифенил)-5-3-метоксифенил)ацетамидо)индено[1,2c]пиразол-4-она. 25 Продукт получают так, как описано в примере II, используя в качестве исходного материала 3-метоксифенилацетилилхлорид; т.пл.300 С; ХИМС m/e: рассчитано для C26H22N3O3 440,1610, найдено 440,1620. Пример XII. Получение 3-(4-метоксифенил)-5-4-метоксифенил)ацетамидо)индено[1,2c]пиразол-4-она. Продукт получают так, как описано в примере II, используя в качестве исходного материала 4-метоксифенилацетилилхлорид; т.пл. 280 С; ХИМС m/e: рассчитано для C26H22N3O3 440,1610, найдено 440,1630. Пример XIII. Получение 3-(4-метоксифенил)-5-3,4-диметоксифенил)ацетамидо)индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере II, используя в качестве исходного материала 3,4-диметоксифенилацетилилхлорид; т.пл. 300 С; ХИМС m/e: рассчитано для[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере II, используя в качестве исходного материала 2,5-диметоксифенилацетилилхлорид; т.пл. 226 С; ХИМС m/e: рассчитано дляC27H24N3O3 470,1716, найдено 470,1739. Пример XV. Получение 3-(2-метоксифенил)-5-(ацетамидо)индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере I, используя в качестве исходного материала 2-метоксиацетофенон; т.пл. 276 С; ХИМСm/e: рассчитано для C19H16N3O3 334,1192, найдено 334,1169. Пример XVI. Получение 3-(3,4-диметоксифенил)-5-(ацетамидо)индено[1,2-с]пиразол-4 она. Продукт получают так, как описано в примере I, используя в качестве исходного материала 3,4-диметоксиацетофенон; т.пл. 300 С; ХИМС m/e: рассчитано для C20H18N3O4 364,1297, найдено 364,1288. Пример XVII. Получение 3-(4-метоксифенил)-5-3,4-этилендиоксифенил)ацетамидо) индено[1,2-c]пиразол-4-она. Стадия 1. Синтез 15 из 11. К суспензии 11 (5 г, 14,18 ммоль) в метаноле (50 мл) добавляют конц. HCl (1 мл) и кипятят с обратным холодильником. После перемешивания в течение 2 ч реакционную смесь охлаждают до 0 С и собирают продукт в виде желтого твердого вещества (4,2 г, 96%) сC17H14NO4 296,0923, найдено 296,0901. Стадия 2. Синтез 16 из 15. К суспензии 15 (20 мг, 0,07 ммоль) в ацетоне (2 мл) добавляют NаНСО 3 (10 мг) и неочищенный хлорангидрид (3,4-метилендиоксифенил)уксусной кислоты (полученный нагреванием кислоты в смеси бензолтионилхлорид (4:1) при 50 С в течение 2 ч с последующим удалением летучих компонентов при пониженном давлении). Реакционную смесь нагревают до 50 С и перемешивают в течение 2 ч, после чего охлаждают, вливают в воду (4 мл), экстрагируют этилацетатом (10 мл), сушат над MgSO4,фильтруют и упаривают. Неочищенный трикетон суспендируют в этаноле (2 мл), добавляют гидразингидрат (0,05 мл) и п-TsOH (1 мл) и кипятят с обратным холодильником в течение 2 ч. Реакционную смесь после этого охлаждают до 0 С и отфильтровывают продукт в виде желтого твердого вещества (6,5 мг, 20%) с т.пл. 297 С. ХИМС m/e: рассчитано для C26H20N3O5 454,1403, найдено 454,1398. Пример XVIII. Получение 3-(4-диметоксифенил)-5-3-тиофен)ацетамидо)индено[1,2-c] пиразол-4-она. Продукт получают так, как описано в примере XVII, используя в качестве исходного материала хлорангидрид 3-тиофенуксусной кислоты; т.пл. 293 С; ХИМС m/e: рассчитано для[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере XVII, используя в качестве исходного материала хлорангидрид 2-метоксифенилуксусной кислоты; т.пл. 255 С; ХИМС m/e: рассчитано для C26H22N3O4 440,1610, найдено 440,1622. Пример XX. Получение 3-(4-метоксифенил)-5-3,4-дихлорфенил)ацетамидо)индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере XVII, используя в качестве исходного материала хлорангидрид 3,4-дихлорфенил уксусной кислоты; т.пл. 299 С; ХИМС m/e: рассчитано для C25H18N3O3Cl2 478,0725, найдено 478,0744. Пример XXI. Получение 3-(4-метоксифенил)-5-2,4-дихлорфенил)ацетамидо)индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере XVII, используя в качестве исходного материала хлорангидрид 2,4-дихлорфенилуксусной кислоты; т.пл. 286 С; ХИМС m/e: рассчитано для C25H18N3O3Cl2 478,0725, найдено 478,0734. Пример XXII. Получение 3-(4-метоксифенил)-5-2-хлорфенил)ацетамидо)индено[1,2c]пиразол-4-она. Продукт получают так, как описано в примере XVII, используя в качестве исходного ма 27 териала хлорангидрид 2-хлорфенилуксусной кислоты; т.пл. 300 С; ХИМС m/e; рассчитано для C25H19N3O3Cl 444,1115, найдено 444,1111. Пример XXIII. Получение 3-(4-метоксифенил)-5-(аминоацетамидо)индено[1,2-с]пиразол-4-она. К суспензии 14 (15 мг, 0,04 ммоль) в этаноле (1 мл) добавляют конц. NH4OH (1 мл), помещают в запаянную трубку и нагревают 3 ч при 80 С, после чего реакционную смесь охлаждают и удаляют растворитель при пониженном давлении. Остаток перекристаллизовы-вают из этанола, получая продукт в виде желтого твердого вещества (9 мг, 62%) с т.пл. 300 С; ХИМС m/e: рассчитано для C20H19N4O3 363,1457, найдено 363,1431. Пример XXIV. Получение 3-(4-метоксифенил)-5-2-гидроксиэтил)аминоацетамидо)индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере XXIII, используя в качестве исходного материала гидроксиламин; т.пл. 243 С; ХИМС[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере XXIII, используя в качестве исходного материала диметиламин; т.пл. 279 С; ХИМСm/e: рассчитано для C21H21N4O3 377,1614, найдено 377,1640. Пример XXVI. Получение 3-(4-метоксифенил)-5-(пиперазинилацетамидо)индено [1,2-c] пиразол-4-она. Продукт получают так, как описано в примере XXIII, используя в качестве исходного материала пиперазин; т.пл. 277 С; ХИМС m/e: рассчитано для C23H24N5O3 418,1879, найдено 418,1899. Пример XXVII. Получение 3-(4-метоксифенил)-5-(4-метилпиперазинилацетамидо)индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере XXIII, используя в качестве исходного материала 4-метилпиперазин; т.пл. 300 С; ХИМС m/e: рассчитано для C24H26N5O3 432,2036, найдено 432,2030. Пример XXVIII. Получение 3-(4-метоксифенил)-5-(4-(2-гидроксиэтил)пиперазинилацетамидо)индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере XXIII, используя в качестве исходного материала 4-гидроксиэтилпиперазин; т.пл. 300 С; ХИМС m/e: рассчитано для C25H28N5O4 462,2141, найдено 462,2128. 28 Пример XXIX. Получение 3-(4-метоксифенил)-5-(пиперидинилацетамидо)индено[1,2-c] пиразол-4-она. Продукт получают так, как описано в примере XXIII, используя в качестве исходного материала пиперидин; т.пл. 298 С; ХИМС m/e: рассчитано для C24H25N4O3 417,1927, найдено 417,1955. Пример XXX. Получение 3-(4-метоксифенил)-5-(4-аминометилпиперидинилацетамидо)индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере XXIII, используя в качестве исходного материала 4-аминометилпиперидин; т.пл. 300 С; ХИМС m/e: рассчитано для C25H28N5O3 446,2192, найдено 446,2166. Пример XXXI. Получение 3-(4-метоксифенил)-5-(этиламиноацетамидо)индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере XXIII, используя в качестве исходного материала этиламин; т.пл. 250 С; ХИМС m/e: рассчитано для C21H21N4O3 377,1614, найдено 377,1644. Пример XXXII. Получение 3-(4-метоксифенил)-5-(тиоморфоленилацетамидо)индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере XXIII, используя в качестве исходного материала тиоморфолин; т.пл. 298 С; ХИМСm/e: рассчитано для C23H23N4O3S 435,1491, найдено 435,1477. Пример XXXIII. Получение 3-(4-метоксифенил)-5-(морфоленилацетамидо)индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере XXIII, используя в качестве исходного материала морфолин; т.пл. 295 С; ХИМС m/e: рассчитано для C23H23N4O4 419,1719, найдено 419,1719. Пример XXXIV. Получение 3-(4-метоксифенил)-5-(пирролидинилацетамидо)индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере XXIII, используя в качестве исходного материала пирролидин; т.пл. 279 С; ХИМС m/e: рассчитано для C23H23N4O3 403,1770, найдено 403,1761. Пример XXXV. Получение 3-(4-метоксифенил)-5-(4-пиридиниламинометилацетамидо) индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере XXIII, используя в качестве исходного материала 4-аминометилпиридин; т.пл. 300 С; ХИМС m/e: рассчитано для C25H22N5O3 440,1723, найдено 440,1762. Пример XXXVI. Получение 3-(4-метоксифенил)-5-4-ацетамидофенил)ацетамидо)индено[1,2-c]пиразол-4-она. К суспензии 18 (10 мг, 0,02 ммоль) в диоксане (1 мл) добавляют насыщенный водный раствор NаНСО 3 (0,5 мл) и ацетилхлорид (0,01 мл). Реакционную смесь нагревают 1 ч при 50 С,охлаждают, вливают в воду (5 мл) и экстрагируют этилацетатом. Органический слой отделяют, сушат над MgSO4 и удаляют растворитель при пониженном давлении. Остаток перекристаллизовывают из этанола, получая продукт в виде желтого твердого вещества (5,6 мг, 61%) с т.пл. 268 С; ХИМС m/e: рассчитано дляC27H23N4O3 467,1719, найдено 467,1730. Пример XXXVII. Получение 3-(4-метоксифенил)-5-4-метоксикарбониламинофенил) ацетамидо)индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере XXXII, используя в качестве исходного материала метилхлорформиат; т.пл. 257 С; ХИМС m/е: рассчитано для C27H23N4O5 403,1770, найдено 483,1633. Пример XXXVIII. Получение 3-(4-метоксифенил)-5-4-аминометилкарбониламинофенил)ацетамидо)индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере XXIII и XXXII, используя в качестве исходного материала хлорацетилхлорид и конц.C27H24N5O4 482,1828, найдено 482,1844. Пример XXXIX. Получение 3-(4-метоксифенил)-5-4-N,N-диметиламинометилкарбониламинофенил)ацетамидо)индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере XXIII и XXXII, используя в качестве исходного материала хлорацетилхлорид и диметиламин; т.пл. 300 С; ХИМС m/e: рассчитано для C29H28N5O4 510,2141, найдено 510,2121. Пример XL. Получение 3-(4-метоксифенил)-5-4-азидофенил)ацетамидо)индено[1,2-c] пиразол-4-она. К раствору из примера XXXVI (20 мг, 0,04 ммоль) в ДМФ (2 мл) добавляют 5%-ный палладий на угле (5 мг) и гидрируют при атмосферном давлении с использованием водородного баллона. Через 2 ч раствор фильтруют на целите и удаляют растворитель при пониженном давлении. Остаток перекристаллизовывают из этанола, получая продукт в виде желтого твердого вещества (15 мг, 78%) с т.пл. 300 С; ХИМСm/e: рассчитано для C25H19N6O3 451,1519, найдено 451,1544. Пример XLI. Получение 3-(4-метоксифенил)-5-4-аминофенил)ацетамидо)индено[1,2-c] пиразол-4-она. Продукт получают так, как описано в примере XXVII, используя в качестве исходного материала 4-азидофенилуксусную кислоту; т.пл.(10 мл) добавляют NаНСО 3 (0,5 г) и фенилхлорформиат. Реакционную смесь нагревают 2 ч при 50 С, охлаждают, вливают в воду (20 мл) и экстрагируют этилацетатом (40 мл). Органический слой отделяют, сушат над MgSO4 и удаляют растворитель при пониженном давлении. Остаток суспендируют в этаноле (10 мл) и добавляют гидразингидрат (0,16 мл, 5,1 ммоль) и nTsOH (10 мг). Смесь кипятят 3 ч при перемешивании, охлаждают до 0 С и собирают продукт в виде желтого твердого вещества (0,25 г, 36%) с т.пл. 195 С; ХИМС m/e: рассчитано дляC24H18N3O4 412,1297, найдено 412,1308. Стадия 2. Синтез 21 из 20. К раствору 20 (20 мг, 0,05 ммоль) в диметилсульфоксиде (2 мл) добавляют анилин (20 мл) и диметиламинопиридин (1 мг). Реакционную смесь нагревают 2 ч при 80 С, охлаждают,вливают в воду (4 мл) и экстрагируют этилацетатом (15 мл). Органический слой отделяют,сушат над MgSO4 и удаляют растворитель при пониженном давлении. Остаток перекристаллизовывают из этанола, получая продукт в виде желтого твердого вещества (9 мг, 44%) с т.пл. 300 С; ХИМС m/e: рассчитано для C24H19N4O3 411,14 57, найдено 411,1432. Пример XLIII. Получение 3-(4-метоксифенил)-5-(бутилкарбамоил)аминоиндено-[1,2-c] пиразол-4-она. Продукт получают так, как описано в примере XLII, используя в качестве исходного материала бутиламин; т.пл. 252 С; ХИМС m/e: рассчитано для C21H21N4O3 377,1614, найдено 377,1633. Пример XLIV. Получение 3-(4-метоксифенил)-5-(4-аминобензилкарбамоил)аминоиндено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере XLII, используя в качестве исходного материала 4-аминобензиламин; т.пл. 300 С; ХИМС m/e: рассчитано для C25H22N5O3 440,1723, найдено 440,1700. Пример XXV. Получение 3-(4-метоксифенил)-5-(4-пиридилкарбамоил)аминоиндено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере XLII, используя в качестве исходного ма 31 териала 4-аминометилпиперидин; т.пл. 300 С; ХИМС m/e: рассчитано для C24H20N5O3 426,1566, найдено 426,1533. Пример XLVI. Получение 3-(4-гидроксифенил)-5-(ацетамидо)индено[1,2-c]пиразол 4-она. К суспензии 12 (20 мг, 0,07 ммоль) в дихлорметане (2 мл) добавляют избыток ВВr3 (1/0 мл, 1,0 М в дихлорметане) и перемешивают в течение 12 ч. Реакционную смесь медленно приливают к насыщенному водному раствору(10 мл). Экстракт сушат над MgSO4 и упаривают. Остаток перекристаллизовывают из этанола,получая желаемый продукт в виде желтого твердого вещества (7,5 мг, 33%) с т.пл. 300 С; ХИМС m/e: рассчитано для C18H14N3O3 320,1035, найдено 320,1050. Пример XLVII. Получение 3-(4-метоксифенил)-5-(формамидо)индено[1,2-c]пиразол-4 она. Суспензию 13 (20 мг, 0,06 ммоль) в муравьиной кислоте (2 мл) нагревают 2 ч при 100 С. Реакционную смесь охлаждают и удаляют растворитель при пониженном давлении. Остаток перекристаллизовывают из этанола,получая целевой продукт в виде желтого твердого вещества (12 мг, 63%) с т.пл. 280 С; ХИМС(5 мг). Реакционную смесь нагревают до 85 С и перемешивают в течение 3 ч, после чего охлаждают и удаляют растворитель при пониженном давлении. К образовавшемуся гидразону в течение 5 мин добавляют 1,0 М NaN(TMS) в ТГФ(16,6 мл, 16,6 ммоль) при 25 С. Через 30 мин добавляют в один прием диметил-3-ацетамидофталат (2,1 г, 8,3 ммоль) и кипятят реакционную смесь с обратным холодильником. Перемешивают смесь в течение 6 ч, после чего охлаждают и останавливают реакцию медленным 32 добавлением трифторуксусной кислоты. Растворитель удаляют при пониженном давлении и остаток хроматографируют (силикагель, 2,5-5% метанол/дихлорметан), получая продукт в виде желтого твердого вещества (0,35 г, 14%) с т.пл. 265 С; ХИМС m/e: рассчитано для C17H13N2O4 309,0875, найдено 309,0888. Стадия 2. Синтез 25 из 24. К суспензии 24 (30 мг, 0,09 ммоль) в этаноле (2 мл) добавляют гидразингидрат (0,05 мл) и п-TsOH (1 мг) и кипятят с обратным холодильником. После перемешивания в течение 2 ч реакционную смесь охлаждают и отфильтровывают продукт в виде желтого твердого вещества(12 мг, 44%) с т.пл. 300 С; ХИМС m/e: рассчитано для C17H13N4O2 305,1039, найдено 305,1048. Пример XLIX. Получение 3-(4-пиридил)-5(ацетамидо)индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере XLVIII, используя в качестве исходного материала 4-ацетилпиридин; т.пл. 300 С; ХИМС m/e: рассчитано для C17H13N4O2 305,1039, найдено 305,1046. Пример L. Получение 3-(4-пиридил)-5(формамидо)индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере XLVII, используя в качестве исходного материала 4-ацетилпиридин; т.пл. 300 С; ХИМС m/e: рассчитано для C16H11N4O2 291,0882, найдено 291,0882. Пример LI. Получение 3-фенил-5-(ацетамидо)индено[1,2-с]пиразол-4-она. Продукт получают так, как описано в примере I, используя в качестве исходного материала ацетофенон; т.пл. 300 С; ХИМС m/e: рассчитано для C16H11N3O2 304,1065, найдено 304,1086. Пример LII. Получение 3-(4-метилтиофенил)-5-(ацетамидо)индено[1,2-c]пиразол-4 она. Продукт получают так, как описано в примере I, используя в качестве исходного материала 4'-метилтиоацетофенон; т.пл. 283 С; ХИМС m/e: рассчитано для C19H15N3O2S 350,0956, найдено 350,0963. Пример LIII. Получение 3-(4-метилсульфонилфенил)-5-(ацетамидо)индено[1,2-с]пиразол-4-она. Продукт получают окислением продукта примера LII; т.пл. 300 С; ХИМС m/е: рассчитано для C19H15N3O4S 382,0860, найдено 382,0862. Пример LIV. Получение 3-(N,N-диметиламинофенил)-5-(ацетамидо)индено [1,2-с]пиразол-4-она. Продукт получают так, как описано в примере I, используя в качестве исходного материала 4'-N,N-диметиламиноацетофенон; т.пл. 300 С; ХИМС m/e: рассчитано для C20H18N4O2 347,1496, найдено 347,1508.[1,2-c]пиразол-4-она. Продукт получают так, как описано в примерах II и XXIII, используя в качестве исходных материалов продукт примера LIV и морфолин; т.пл. 300 С; ХИМС m/e: рассчитано дляC24H26N5O3 432,2036, найдено 432,2020. Пример LVI. Получение 3-(N,N-диметиламинофенил)-5-(диметиламиноацетамидо)индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примерах II и XXIII, используя в качестве исходных материалов продукт примера LIV и диметиламин; т.пл. 300 С; ХИМС m/e: рассчитано для C22H24N5O2 390,1930, найдено 390,1948. Пример LVII. Получение 3-(4-(1-пиперидинцл)фенил)-5-(ацетамидо)индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере I, используя в качестве исходного материала 4'-(1-пиперидинил)ацетофенон; т.пл. 291 С; ХИМС m/e: рассчитано для C23H22N4O2 387,1801, найдено 387,1821. Пример LVIII. Получение 3-(4-морфолинил)фенил)-5-(ацетамидо)индено[1,2-с]пиразол 4-она. Продукт получают так, как описано в примере I, используя в качестве исходного материала 4'-морфолинилацетофенон; т.пл. 300 С; ХИМС m/e: рассчитано для C22H20N4O3 388,1528, найдено 388,1535. Пример LIX. Получение 3-(4-этоксифенил)-5-(ацетамидо)индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере I, используя в качестве исходного материала 4'-этоксиацетофенон; т.пл. 288 С; ХИМСm/e: рассчитано для C20H17N3O3 348,1325, найдено 348,1348. Пример LX. Получение 3-(4-бутилфенил)5-(ацетамидо)индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере I, используя в качестве исходного материала 4'-бутилацетофенон; т.пл. 259 С; ХИМСm/e: рассчитано для C22H21N3O2 360,1701, найдено 360,1712. Пример LXI. Получение 3-(4-этилфенил)5-(ацетамидо)индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере I, используя в качестве исходного материала 4'-этилацетофенон; т.пл. 294 С; ХИМСm/e: рассчитано для C20H17N3O2 331,1310, найдено 331,1321. Пример LXII. Получение 3-(4-н-пропилфенил)-5-(ацетамидо)индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере I, используя в качестве исходного материала 4'-н-пропилацетофенон; т.пл. 269 С; ХИМС m/e: рассчитано для C21H19N3O2 346,1555, найдено 346,1554. 34 Пример LXIII. Получение 3-(4-метоксифенил)-5-карбамоиламиноиндено[1,2-c]пиразол 4-она. Продукт получают так, как описано в примере XLII, используя в качестве исходного материала концентрированный гидроксид аммония; т.пл. 300 С; ХИМС m/e: рассчитано дляC18H15N4O3 335,114 4, найдено 335,1113. Пример LXIV. Получение 3-(4-метоксифенил)-5-(диметиламинокарбамоил)аминоиндено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере XLII, используя в качестве исходного материала диметиламиногидразина; т.пл. 300 С; ХИМС m/e: рассчитано для C20H20N5O3 378,1566, найдено 378,1555. Пример LXV. Получение 3-(4-метоксифенил)-5-(метилкарбамоил)аминоиндено[1,2-c] пиразол-4-она. Продукт получают так, как описано в примере XLII, используя в качестве исходного материала метиламин; т.пл. 300 С; ХИМС m/e: рассчитано для C19H17N4O3 349,1300, найдено 349,1311. Пример LXVI. Получение 3-(4-метоксифенил)-5-(морфолинилкарбамоил)аминоиндено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере XLII, используя в качестве исходного материала N-аминоморфолин; т.пл. 300 С; ХИМС m/e: рассчитано для C22H22N5O4 420,1671, найдено 420,1655. Пример LXVII. Получение 3-(4-метоксифенил)-5-(цис-2-аминоциклогексилкарбамоил) аминоиндено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере XLII, используя в качестве исходного материала цис-1,2-диаминоциклогексан; т.пл. 300 С; ХИМС m/e: рассчитано для C24H26N5O3 432,2035, найдено 432,2020. Пример LXVIII. Получение 3-(4-метоксифенил)-5-(4-метилпиперазинилкарбамоил)аминоиндено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере XLII, используя в качестве исходного материала цис-1,2-диаминоциклогексан; т.пл. 300 С; ХИМС m/e: рассчитано для C23H25N6O3 433,1987, найдено 433,1999. Пример LXIX. Получение 3-(4-метоксифенил)-5-(4-уридометилпиперидинилацетамидо) индено[1,2-с]пиразол-4-она. Продукт получают так, как описано в примере XXIII, используя в качестве исходного материала соединение из примера XXX; т.пл. 300 С; ХИМС m/e: рассчитано для C26H29N6O4 489,2250, найдено 489,2209. Пример LXX. Получение 3-(4-метоксифенил)-5-(4-(2-пиридил)пиперазинилацетамидо) индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере XXIII, используя в качестве исходного материала 4-(2-пиридид)пиперазин; т.пл. 35 300 С; ХИМС m/e: рассчитано для C28H27N6O3 495,2144, найдено 495,2111. Пример LXXI. Получение 3-(4-метоксифенил)-5-(4-(аминоэтил)пиперазинилацетамидо) индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере XXIII, используя в качестве исходного материала 4-(аминоэтил)пиперазин; т.пл. 300 С; ХИМС m/e: рассчитано для C25H29N6O3 461,2300, найдено 461,2333. Пример LXXII. Получение 3-(4-метоксифенил)-5-(4-амидопиперидинилацетамидо)индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере XXIII, используя в качестве исходного материала амид гексагидроизоникотиновой кислоты; т.пл. 300 С; ХИМС m/e: рассчитано дляLXXIII. Получение 3-(4 метоксифенил)-5-(4-гидроксипиперидинилацетамидо)индено[1,2-с]пиразол-4-она. Продукт получают так, как описано в примере XXIII, используя в качестве исходного материала 4-гидроксипиперидин кислоты; т.пл. 300 С; ХИМС m/e: рассчитано для C24H25N4O4 433,1875, найдено 433,1844. Пример LXXIV. Получение 3-(4-метоксифенил)-5-(4-гидроксиметилпиперидинилацетамидо)индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере XXIII, используя в качестве исходного материала 4-гидроксиметилпиперидин; т.пл. 300 С; ХИМС m/e: рассчитано для C25H27N4O4 447,2032, найдено 447,2002. Пример LXXV. Получение 3-(4-метоксифенил)-5-(4-амидопиперазинилацетамидо)индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере XXIII, используя в качестве исходного материала 4-амидопиперазин; т.пл. 300 С; ХИМС m/e: рассчитано для C24H25N6O6 493,1835, найдено 493,1802. Пример LXXVI. Получение 3-(4-метоксифенил)-5-(4-диметиламинопиперидинилацетамидо)индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере XXIII, используя в качестве исходного материала 4-диметиламинопиперидин; т.пл. 300 С; ХИМС m/e: рассчитано для C26H30N5O5 4 92,2246, найдено 492,2220. Пример LXXVII. Получение 3-(4-метоксифенил)-5-(4-аминопиперидинилацетамидо) индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере XXIII, используя в качестве исходного материала 4-аминопиперидин; т.пл. 300 С; ХИМС m/e: рассчитано для С 24H26N5O5 464,1933, найдено 464,1975. Пример LXXVIII. Получение 3-(4-(диметиламино)фенил)-5-(4-метил-1-пиперазинилацетамидо)индено[1,2-c]пиразол-4-она. 36 Продукт получают так, как описано в примерах II и XXIII, используя в качестве исходных материалов продукт примера LIV и 1 метилпиперазин; т.пл. 300 С; ЭИМС m/e: рассчитано для C25H29N6O2 445,2352, найдено 445,2359. Пример LXXIX. Получение 3-(4-(диметиламино)фенил)-5-4-аминометил-1-пиперидинил)ацетамидо)индено[1,2-с]пиразол-4-она. Продукт получают так, как описано в примерах II и XXIII, используя в качестве исходных материалов продукт примера LIV и 4(аминометил) пиперидин; ЭИМС m/e: рассчитано для C25H29N6O2 445,2352, найдено 445,2359. Пример LXXX. Получение 3-(4-(диметиламино)фенил)-5-4-гидрокси-1-пиперидинил) ацетамидо)индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примерах II и XXIII, используя в качестве исходных материалов продукт примера LIV и 4 гидроксипиперидин; т.пл. 267 С; ЭИМС m/e: рассчитано для C25H28N5O3 446,2192, найдено 446,2206. Пример LXXXI. Получение 3-(4-(4-морфолинил)фенил)-5-(4-морфолинил)ацетамидо)индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примерах II и XXIII, используя в качестве исходных материалов продукт примера LVIII и морфолин; т.пл. 258 С; ЭИМС m/e: рассчитано дляC26H28N5O4 474,2141, найдено 474,2151. Пример LXXXII. Получение 3-(4-(4-морфолинил)фенил)-5-(4-метил-1-пиперазинил) ацетамидо)индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примерах II и XXIII, используя в качестве исходных материалов продукт примера LVIII и 1 метилпиперазин; т.пл. 258 С; ЭИМС m/e: рассчитано для C27H31N6O3 487,2457, найдено 487,2447. Пример LXXXIII. Получение 3-(4-(4-морфолинил)фенил)-5-(4-гидрокси-1-пиперидинил) ацетамидо)индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примерах II и XXIII, используя в качестве исходных материалов продукт примера LVIII и 4 гидроксипиперидин; т.пл. 245 С; ЭИМС m/e: рассчитано для C27H30N5O4 488,2298, найдено 488,2290. Пример LXXXIV. Получение 3-(4-(4-морфолинил)фенил)-5-4-аминометил-1-пиперидинил)ацетамидо)индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примерах II и XXIII, используя в качестве исходных материалов продукт примера LVIII и 4(аминометил)пиперидин; т.пл. 240 С; ЭИМС 37 Продукт получают так, как описано в примерах I, XXVII и XLII, используя в качестве исходных материалов 4-(диметиламино ) ацетофенон и 1-амино-4-метилпиперазин; т.пл. 300 С; ЭИМС m/e: рассчитано для C24H28N7O2 446,2304, найдено 446,2310. Пример LXXXVI. Получение 3-изопропил 5-(ацетамидо)индено[1,2-c]пиразол-4-она.(9,7 г, 50 ммоль) и 1,1,1-трифтор-5-метил-2,4 гександиона (9,1 г, 50 ммоль) в уксусном ангидриде (28,3 мл, 300 ммоль) добавляют триэтиламин (13,95 мл, 100 ммоль) и перемешивают 4 ч при 25 С. Раствор разбавляют 1 н. HCl (200 мл),отделяют остаток, промывают его водой (200 мл) и гексаном (400 мл), получая продукт в виде желтого твердого вещества (11,1 г, 85%) с т.пл. 127-129 С;. ХИМС (М+Н) : рассчитано для(90 г, 1,4 моль) и хлорид кальция (3 г, 27 ммоль) и кипятят реакционную смесь с обратным холодильником в течение 16 ч, после чего фильтруют на целите. Фильтрат упаривают при пониженном давлении с образованием водного остатка, который экстрагируют этилацетатом (100 мл). Органический слой отделяют, промывают насыщенным раствором ЭДТА (100 мл) и солевым раствором (100 мл), высушивают надMgSO4, фильтруют и упаривают при пониженном давлении, получая желтое твердое вещество. Растирание с гексаном дает продукт в виде желтого твердого вещества (7,1 г, 73%) с т.пл. 241-243 С; ХИМС (М+Н): рассчитано дляC13H14NO3 232,0974, найдено 232,0962. Стадия 3. Синтез 28 из 27. К раствору 27 (500 мг, 2,16 ммоль) в дихлорметане (5 мл) добавляют триэтиламин (0,35 мл, 2,59 ммоль) и перемешивают 15 мин при 25 С, после чего добавляют ацетилхлорид (0,18 мл, 2,38 ммоль), перемешивают при 25 С еще 1 ч, останавливают реакцию добавлением 1 н. HClMgSO4, фильтруют и упаривают при пониженном давлении, получая бурый остаток. Растирание с гексаном дает продукт в виде желтоватобурого твердого вещества (484 г, 82%) с т.пл. 241-243 С; ХИМС (М+Н): рассчитано для 38 К раствору 28 (240 мг, 0,88 ммоль) в бутаноле (5 мл) добавляют гидразингидрат (0,055 мл, 1,76 ммоль) и п-TsOH (8,4 мг, 0,044 ммоль). Реакционную смесь кипятят с обратным холодильником в течение 4 ч при перемешивании,охлаждают до 25 С и удаляют растворитель при пониженном давлении. Перекристаллизация из изопропилового спирта дает слегка грязноватого цвета продукт (173 г, 73%) с т.пл. 250 С; ЭИМС (М+Н): рассчитано для C15H16N3O2 270,1242, найдено 270,1258. Пример LXXXVII. Получение 3-циклопропил-5-(ацетамидо)индено[1,2-c]пиразол-4 она. Продукт получают так, как описано в примере LXXXVI, используя в качестве исходного материала циклопропиловый аналог 26; т.пл. 220-221 С; ХИМС (М+Н): рассчитано дляC15H14N3O2 268,1086, найдено 268,1078. Пример LXXXVIII. Получение 3-(третбутил)-5-(ацетамидо)индено[1,2-c]пиразол-4 она. Продукт получают так, как описано в примере LXXXVI, используя в качестве исходного материала трет-бутиловый аналог 26; т.пл. 250 С; ХИМС (М+Н): рассчитано дляC16H18N3O2 284,1399, найдено 284,1395. Пример LXXXIX. Получение 3-(2-тиенил)5-(ацетамидо)индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере LXXXVI, используя в качестве исходного материала 2-тиениловый аналог 26; т.пл. 269 С; ХИМС (М+Н): рассчитано для C16H12N3O2S 310,0650, найдено 310,0635. Пример ХС. Получение 3-(3-метил-2 тиенил)-5-(ацетамидо)индено[1,2-c]пиразол-4 она. Продукт получают так, как описано в примере LXXXVI, используя в качестве исходного материала 3-метил-2-тиениловый аналог 26; т.пл. 275 С; ЭИМС (М+Н): рассчитано дляC17H14N3O2S 324,0811, найдено 324,0807. Пример XCI. Получение 3-(этил)-5-(карбамоил)аминоиндено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере LXXXVI, используя в качестве исходных материалов аммиак и этиловый аналог 15; т.пл. 250 С; ХИМС (М+Н): рассчитано дляC13H13N4O2 257,1039, найдено 257,1033. Пример XCII. Получение 3-(н-пропил)-5(карбамоил)аминоиндено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере LXXXVI, используя в качестве исходных материалов аммиак и н-пропиловый аналог 15; т.пл. 187-189 С; ХИМС (М+Н) : рассчитано дляC14H15N4O2 271,1195, найдено 271,1187. Пример ХСIII. Получение 3-(изопропил)-5(карбамоил)аминоиндено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере LXXXVI, используя в качестве исходных материалов аммиак и изопропиловый аналог 15; 39 т.пл. 250 С; ХИМС (М+Н): рассчитано для С 14 Н 15N4 О 2 271,1195, найдено 271,1196. Пример XCIV. Получение 3-циклопропил 5-(карбамоил)аминоиндено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере LXXXVI, используя в качестве исходных материалов аммиак и циклопропиловый аналог 15; т.пл. 252-253 С; ЭИМС (М-Н): рассчитано для С 14 Н 11N4 О 2 267,0861, найдено 267,0884. Пример XCV. Получение 3-(с-гексил)-5(карбамоил)аминоиндено[1,2-с]пиразол-4-она. Продукт получают так, как описано в примере LXXXVI, используя в качестве исходных материалов аммиак и с-гексиловый аналог 15; т.пл. 178-179 С; ЭИМС (М+Н): рассчитано дляC17H19N4O2 311,1507, найдено 311,1500. Пример XCVI. Получение 3-(2-тиенил)-5(карбамоил)аминоиндено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере LXXXVI, используя в качестве исходных материалов аммиак и 2-тиениловый аналог 15; т.пл. 214 С; ХИМС m+: рассчитано дляC15H10N4O2S 310,0517, найдено 310,0524. Пример XCVII. Получение 3-(3-метил-2 тиенил)-5-(карбамоил)аминоиндено[1,2-с]пиразол-4-она. Продукт получают так, как описано в примере LXXXVI, используя в качестве исходных материалов аммиак и 3-метил-2-тиениловый аналог 15; т.пл. 270 С; ЭИМС (М+Н): рассчитано для C16H13N4O2S 325,0759, найдено 325,0744. Пример XCVIII. Получение 3-(5-метил-2 тиенил)-5-(карбамоил)аминоиндено[1,2-с]пиразол-4-она. Продукт получают так, как описано в примере LXXXVI, используя в качестве исходных материалов аммиак и 5-метил-2-тиениловый аналог 15; т.пл. 280 С; ЭИМС (М+Н): рассчитано для C16H13N4O2S 325,0759, найдено 325,0761. Пример XCIX. Получение 3-(5-этилкарбоксил-2-тиенил)-5-(карбамоил)аминоиндено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере LXXXVI, используя в качестве исходных материалов аммиак и 5-этилкарбоксил-2 тиениловый аналог 15; т.пл. 280 С; ЭИМС(М+Н): рассчитано для C18H15N4O6S 383,0813,найдено 383,0788. Пример С. Получение 3-(3-тиенил)-5(карбамоил)аминоиндено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере LXXXVI, используя в качестве исходных материалов аммиак и 3-тиениловый аналог 15; т.пл. 280 С; ЭИМС (М+Н): рассчитано дляC15H11N4O2S 311,0603, найдено 383,0594. Пример CI. Получение 3-(5-хлор-3-тиенил)-5-(карбамоил)аминоиндено[1,2-с]пиразол 4-она. Продукт получают так, как описано в примере LXXXVI, используя в качестве исходных материалов аммиак и 5-хлор-3-тиениловый ана 004805 40 лог 15; т.пл. 300 С; ЭИМС (М+Н): рассчитано для C15H10N4O2SCl 345,0209, найдено 345,0213. Пример СII. Получение 3-(2,5-диметил-3-тиенил)-5(карбамоил)аминоиндено [1,2-c]пиразол-4-она. Продукт получают так, как описано в примере LXXXVI, используя в качестве исходных материалов аммиак и 2,5-диметил-3-тиениловый аналог 15; т.пл. 280 С; ЭИМС (М+Н): рассчитано для C17H15N4O2S 339,0916, найдено 339,0905. Пример CIII. Получение 3-(2-фуранил)-5(карбамоил)аминоиндено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере LXXXVI, используя в качестве исходных материалов аммиак и 2-фураниловый аналог 15; т.пл. 278 С; ЭИМС (М+Н): рассчитано для[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере LXXXVI, используя в качестве исходных материалов 1,1-диметилгидразин и изопропиловый аналог 15; т.пл. 231-233 С; ЭИМС[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере LXXXVI, используя в качестве исходных материалов 1,1-диметилгидразин и циклопропиловый аналог 15; ЭИМС (М+Н): рассчитано для C16H18N5O2 312,1460, найдено 312,1487. Пример CVI. Получение 3-циклогексил-5(N,N-диметиламинокарбамоил)аминоиндено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере LXXXVI, используя в качестве исходных материалов 1,1-диметилгидразин и циклогексиловый аналог 15; т.пл. 229-231 С; ЭИМС[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере LXXXVI, используя в качестве исходных материалов 1,1-диметилгидразин и 2-тиениловый аналог 15; т.пл. 279 С; ЭИМС (М+Н): рассчитано для C17H16N5O2S 354,1024, найдено 354,1025. Пример CVIII. Получение 3-(5-метокси-2 тиенил)-5-(N,N-диметиламинокарбамоил)аминоиндено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере LXXXVI, используя в качестве исходных материалов 1,1-диметилгидразин и 5-метокси-2 тиениловый аналог 15; т.пл. 280 С; ЭИМС(М+Н): рассчитано для C18H18N5O3S 384,1130,найдено 384,1119. Пример СIX. Получение 3-(5-метил-2 тиенил)-5-(N,N-диметиламинокарбамоил)аминоиндено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере LXXXVI, используя в качестве исходных материалов 1,1-диметилгидразин и 5-метил-2 тиениловый аналог 15; т.пл. 280 С; ЭИМС(М+Н): рассчитано для C18H18N5O3S 368,1181,найдено 368,1171. Пример СХ. Получение 3-(5-этилкарбоксил-2-тиенил)-5-(N,N-диметиламинокарбамоил)аминоиндено[1,2-с]пиразол-4-она. Продукт получают так, как описано в примере LXXXVI, используя в качестве исходных материалов 1,1-диметилгидразин и 5-этилкарбоксил-2-тиениловый аналог 15; т.пл. 252 С; ЭИМС (М+Н): рассчитано для C20H20N5O4S 426,1236, найдено 426,1236. Пример CXI. Получение 3-(3-тиенил)-5(N,N-диметиламинокарбамоил)аминоиндено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере LXXXVI, используя в качестве исходных материалов 1,1-диметилгидразин и 3-тиениловый аналог 15; т.пл. 202 С; ЭИМС (М+Н): рассчитано для C17H16N5O2S 354,1025, найдено 354,1031. Пример CXII. Получение 3-(1-метил-3 пирролил)-5-(карбамоил)аминоиндено[1,2-c] пиразол-4-она. Продукт получают так, как описано в примере LXXXVI, используя в качестве исходных материалов аммиака и 1-метил-3-пирролиловый аналог 15; т.пл. 300 С; ЭИМС (М+Н): рассчитано для C16H14N5O2 308,1147, найдено 308,1166. Пример CXIII. Получение 3-(2,5-диметил 3-фиенил)-5-(N,N-диметиламинокарбамоил) аминоиндено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере LXXXVI, используя в качестве исходных материалов 1,1-диметилгидразина и 2,5 диметил-3-тиениловый аналог 15; т.пл. 252 С; ЭИМС (М+Н): рассчитано для C19H20N5O2S 382,1338, найдено 382,1357. Пример CXIV. Получение 3-(2-фуранил)-5(N,N-диметиламинокарбамоил)аминоиндено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере LXXXVI, используя в качестве исходных материалов 1,1-диметилгидразина и 2-фураниловый аналог 15; т.пл. 202 С; ЭИМС (М+Н): рассчитано для C17H16N5O3 338,1253, найдено 338,1248. Пример CXV. Получение 3-изопропил-5(4-карбамоилпиперидинилацетамидо)индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере XXIII, используя в качестве исходных материалов амид гексагидроизоникотиновой ки 004805[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере XXIII, используя в качестве исходных материалов амид гексагидроизоникотиновой кислоты и циклогексиловый аналог 14; т.пл. 224225 С; ЭИМС (М+Н): рассчитано для[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере XXIII, используя в качестве исходных материалов 4-(аминометил)пиперидин и этиловый аналог 14; т.пл. 174-176 С; ЭИМС (М+Н): рассчитано для C20H26N5O2 368,2086, найдено 368,2078. Пример CXVIII. Получение 3-изопропил 5-(4-аминометилпиперидинилацетамидо)индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере XXIII, используя в качестве исходных материалов 4-(аминометил)пиперидин и изопропиловый аналог 14; т.пл. 218-220 С; ЭИМС[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере XXIII, используя в качестве исходных материалов 4-(аминометил)пиперидин и циклопропиловый аналог 14; т.пл. 138-140 С; ЭИМС[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере XXIII, используя в качестве исходных материалов 4-(аминометил)пиперидин и циклогексиловый аналог 14; т.пл. 196-198 С; ЭИМС[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере LXXXVI, используя в качестве исходных материалов 1-амино-4-метилпиперазин и изопропиловый аналог 15; т.пл. 231-233 С; ЭИМСC23H25N6O4S 481,1657, найдено 481,1642. Пример CXXIII. Получение 3-(5-карбокси 2-тиенил)-5-(4-метилпиперазинилкарбамоил) аминоиндено[1,2-c]пиразол-4-она. К раствору CXXII (30 мг, 0,05 ммоль) в смеси ТГФ/вода (3:1, 2 мл) добавляют LiOH (23 мг, 0,5 ммоль) и перемешивают реакционную смесь 12 ч при 25 С, после чего смесь кипятят с обратным холодильником в течение 1 ч. Органический растворитель удаляют при пониженном давлении, а остаток распределяют между этилацетатом (5 мл) и водой (5 мл). Органический слой отделяют, рН водой фазы доводят до 2 добавлением 1 М HCl и повторно экстрагируют водную фазу этилацетатом (5 мл). Объединенную органическую фазу сушат над Na2SO4,фильтруют и упаривают при пониженном давлении, получая неочищенный продукт. Очистка высокоэффективной жидкостной хроматографией с обращенной фазой дает желтый продукт(10,4 мг, 46%) с т.пл. 270 С; ЭИМС (М+Н): рассчитано для C21H21N6O4S 453,1344, найдено 453,1353. Пример CXXIV. Получение 3-(2,5-диметил-2-тиенил)-5-(4-метилпиперазинилкарбамоил)аминоиндено[1,2-с]пиразол-4-она. Продукт получают так, как описано в примере LXXXVI, используя в качестве исходных материалов 1-амино-4-метилпиперазин и 2,5 диметил-2-тиениловый аналог 15; т.пл. 250 С; ЭИМС (М+Н): рассчитано для C22H25N6O2S 437,1760, найдено 437,1771. Пример CXXV. Получение 3-изопропил-5(морфолинилкарбамоил)аминоиндено[1,2-c] пиразол-4-она. Продукт получают так, как описано в примере LXXXVI, используя в качестве исходных материалов 4-аминоморфолин и изопропиловый аналог 15; т.пл. 256-258 С; ЭИМС (М+Н): рассчитано для С 18 Н 20N5 О 3 354,1566, найдено 354,1543. Пример CXXVI. Получение 3-(N-метилкарбамоил-4-пиперидинил)-5-(морфолинилкарбамоил)аминоиндено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере LXXXVI, используя в качестве исходных материалов 4-аминоморфолин и N-метилкарбамоил-4-пиперидиниловый аналог 15; т.пл. 216218 С; ЭИМС (М+Н): рассчитано для[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере LXXXVI, используя в качестве исходных материалов 4-аминоморфолин и 5-метил-2 тиениловый аналог 15; т.пл. 261 С; ЭИМС[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере LXXXVI, используя в качестве исходных материалов 4-аминоморфолин и 5-хлор-3 тиениловый аналог 15; т.пл. 259 С; ЭИМС(М+Н): рассчитано для C19H17N5O3SCl 430,0741,найдено 430,0757. Пример CXXIX. Получение 3-(2,5-диметил-3-тиенил)-5-(морфолинилкарбамоил)аминоиндено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере LXXXVI, используя в качестве исходных материалов 4-аминоморфолин и 2,5-диметил-3 тиениловый аналог 15; т.пл. 280 С; ЭИМС(М+Н): рассчитано для C21H22N5O3S 424,1443,найдено 424,1431. Пример СХХХ. Получение 3-(5-этилкарбоксил-2-тиенил)-5-(морфолинилкарбамоил) аминоиндено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере LXXXVI, используя в качестве исходных материалов 4-аминоморфолин и 5-этилкарбоксил-2-тиениловый аналог 15; т.пл. 258 С; ЭИМС (М+Н): рассчитано для C22H22N5O5S 468,1341, найдено 468,1331. Пример CXXXI. Получение 3-(5-карбокси 2-тиенил)-5-(морфолинилкарбамоил)аминоиндено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере LXXXVI (гидролиз ранее полученного сложного эфира); т.пл. 273 С; ЭИМС (М+Н): рассчитано для C20H18N5O5S 440,1028, найдено 440,1026. Пример CXXXII. Получение 3-(5-бензилкарбоксамидо-2-тиенил)-5-(морфолинилкарбамоил)аминоиндено[1,2-c]пиразол-4-она. К раствору бензиламина (0,01 мл, 0,09 ммоль) в ДМФ (1 мл) добавляют кислотуCXXXI (40 мг, 0,09 ммоль), перемешивают при 25 С, добавляют тетрабутилтиомочевину и перемешивают при 25 С еще 30 мин. После этого добавляют триэтиламин (0,01 мл, 0,09 ммоль),перемешивают смесь при 25 С 12 ч., вновь добавляют тетрабутилтиомочевину (15 мг, 0,045 ммоль) и триэтиламин (0,01 мл, 0,09 ммоль),перемешивают реакционную смесь при 25 С еще 4 ч и разбавляют этилацетатом (10 мл) и водой (10 мл). Водный слой экстрагируют этилацетатом (5 х 10 мл). Объединенную органическую фазу сушат над Nа 2SO4, фильтруют и удаляют растворитель при пониженном давлении. Очистку остатка производят высокоэффективной жидкостной хроматографией с обращенной фазой, получая продукт в виде желтого твердого вещества (21 мг, 42%) с т.пл. 275 С; ЭИМС(морфолинилкарбамоил)аминоиндено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере CXXXII, используя в качестве исходного материала 1-амино-4-метилпиперазин; т.пл. 190 С; ЭИМС (М+Н): рассчитано для[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере CXXXII, используя в качестве исходного материала 2-(2-аминоэтил)-1-метилпирролидин; т.пл. 235 С; ЭИМС (М+Н): рассчитано дляC27H32N7O4S 550,2236, найдено 550,2229. Пример CXXXV. Получение 3-(5-(N,Nдиметиламино)карбоксамидо-2-тиенил)-5-(морфолинилкарбамоил)аминоиндено[1,2-c]пиразол 4-она. Продукт получают так, как описано в примере CXXXII, используя в качестве исходного материала 1,1-диметилгидразин; т.пл. 201 С; ЭИМС (М+Н): рассчитано для C22H24N7O4S 482,1610, найдено 482,1588. Пример CXXXVI. Получение 3-(5-(2-(N,Nдиметиламино)этил)карбоксамидо-2-тие-нил)-5(морфолинилкарбамоил)аминоиндено[1,2c]пиразол-4-она. Продукт получают так, как описано в примере CXXXII, используя в качестве исходного материала N,N-диметилэтилендиамин; т.пл. 190 С; ЭИМС (М+Н): рассчитано дляC24H28N7O4S 510,1923, найдено 510,1922. Пример CXXXVII. Получение 3-(5-(2(пирролидинил)этил)карбоксамидо-2-тиенил)-5(морфолинилкарбамоил)аминоиндено[1,2-c] пиразол-4-она. Продукт получают так, как описано в примере CXXXII, используя в качестве исходного материала 1-(2-аминоэтил)пирролидин; т.пл. 224 С; ЭИМС (М+Н): рассчитано дляC26H30N7O4S 536,2080, найдено 536,2091. Пример CXXXVIII. Получение 3-(5-(2(морфолинил)этил)карбоксамидо-2-тиенил)-5(морфолинилкарбамоил)аминоиндено[1,2-c] пиразол-4-она. Продукт получают так, как описано в примере CXXXII, используя в качестве исходного материала 4-(2-аминоэтил)морфолин; т.пл. 241 С; ЭИМС (М+Н): рассчитано дляC26H30N7O5S 552,2029, найдено 552,2043. Пример CXXXIX. Получение 3-(5-морфолинилкарбоксамидо-2-тиенил)-5-(морфолинилкарбамоил)аминоиндено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере CXXXII, используя в качестве исходного материала 4-аминоморфолин; т.пл. 271 С; ЭИМС (М+Н): рассчитано для C24H26N7O5S 524,1716, найдено 524,1719. Пример CXL. Получение 3-(5-(3-(пирролидонил)пропил)карбоксамидо-2-тиенил)-5 004805(морфолинилкарбамоил)аминоиндено[1,2-c] пиразол-4-она. Продукт получают так, как описано в примере CXXXII, используя в качестве исходного материала 1-(3-аминопропил)-2-пирролидинон; т.пл. 260 С; ЭИМС (М+Н): рассчитано дляC27H30N7O5S 564,2029, найдено 564,2031. Пример CXLI. Получение 3-(5-(2-(3(пиридил)этил)карбоксамидо-2-тиенил)-5-(морфолинилкарбамоил)аминоиндено[1,2-c]пиразол 4-она. Продукт получают так, как описано в примере CXXXII, используя в качестве исходного материала 3-(2-аминоэтил)пиридин; т.пл. 203 С; ЭИМС (М+Н): рассчитано для C27H26N7O4S 544,1766, найдено 544,1760. Пример CXLII. Получение 3-(5-(3-(имидазолил)пропил)карбоксамидо-2-тиенил)-5-(морфолинилкарбамоил)аминоиндено[1,2-c]пиразол 4-она. Продукт получают так, как описано в примере CXXXII, используя в качестве исходного материала 1-(3-аминопропил)имидазол; т.пл. 263 С; ЭИМС (М+Н): рассчитано дляC26H27N8O4S 547,1875, найдено 547,1872. Пример CXLIII. Получение 3-(5-(2-(2 пиридил)этил)карбоксамидо-2-тиенил)-5-(морфолинилкарбамоил)аминоиндено[1,2-c]пиразол 4-она. Продукт получают так, как опийано в примере CXXXII, используя в качестве исходного материала 2-(2-аминоэтил)пиридин; т.пл. 280 С; ЭИМС (М+Н): рассчитано длиC27H26N7O4S 544,1767, найдено 544,1778. Пример CXLIV. Получение 3-(5-2-пиридил)метил)карбоксамидо-2-тиенил)-5-(морфолинилкарбамоил)аминоиндено[1,2-c]пиразол-4 она. Продукт получают так, как описано в примере CXXXII, используя в качестве исходного материала 2-(аминометил)пиридин; т.пл. 239 С; ЭИМС (М+Н): рассчитано для C26H24N7O4S 530,1610, найдено 530,1603. Пример CXLV. Получение 3-(5-(2-(пиперидинил)этил)карбоксамидо-2-тиенил)-5-(морфолинилкарбамоил)аминоиндено[1,2-с]пиразол 4-она. Продукт получают так, как описано в примере CXXXII, используя в качестве исходного материала 1-(2-аминоэтил)пиперидин; т.пл. 228 С; ЭИМС (М+Н): рассчитано дляC27H32N7O4S 550,2236, найдено 550,2236. Пример CXLVI. Получение 3-(4-(трифторметил)фенил)-5-(ацетамидо)индено[1,2-с]пиразол-4-она. Продукт получают так, как опиcано в примере LXXXVI, используя в качестве исходного материала 1-(4-(трифторметил)фенил-4,4,4 трифтор-1,3-бутандион; т.пл. 300 С; ЭИМС Стадия 1. Синтез 30. К раствору 4-пиперазиноацетофенона (24,8 г, 121 ммоль) и ди-трет-бутилдикарбонат (27,8 г,128 ммоль) в 480 мл тетрагидрофурана кипятят с обратным холодильником в течение 16 ч, охлаждают до комнатной температуры и упаривают в вакууме. Образовавшееся твердое вещество промывают гексаном и сушат в вакууме, получая 29,4 г (80%) грязноватого цвета твердого вещества. ЯМР (CDCl3)7,89 (д, 2 Н, J = 9 Гц),6,87 (д, 2 Н, J = 9 Гц), 3,59 (м, 4 Н), 3,33 (м, 4 Н),2,53 (с, 3 Н), 1,49 (с, 9 Н). Стадия 2. Синтез 31 из 30. К раствору 30 (11,35 г, 37 ммоль) и этилтрифторацетата (5,40 мл, 45 ммоль) в 50 мл тетрагидрофурана при 25 С в течение 15 мин добавляют по каплям 21%-ный этоксид натрия в этаноле (16,8 мл, 45 ммоль) и образовавшийся раствор перемешивают при 25 С в течение 14 ч. Реакционную смесь разбавляют водой, доводят рН до 5 добавлением концентрированной соляной кислоты и экстрагируют этилацетатом. Объединенные экстракты промывают водой и солевым раствором, сушат над безводным сульфатом натрия, фильтруют и упаривают в вакууме. Образовавшееся твердое вещество промывают диэтиловым эфиром и сушат, получая 12,1 г (81%) продукта в виде оранжевого твердого вещества. ЯМР (CDCl3)7,87 (д, 2 Н, J = 9 Гц) ,6,87 (д, 2 Н, J = 9 Гц), 6,45 (с, 1 Н) , 3,60 (м, 4 Н) ,3,41 (м, 4 Н), 1,48 (с, 9 Н) . Стадия 3. Синтез CXLVII из 31. Продукт получают так, как описано в примерах LXXVI и XLII, используя в качестве исходных материалов 31 и 4-аминоморфолин; т.пл. 242 С; ЭИМС m/e: рассчитано дляC30H36N7O5 574,2778, найдено 574,2762. Пример CXLVIII. Получение 3-(4-(1-пиперазинил)фенил)-5-4-морфолиниламино)карбонил)амино)индено[1,2-c]пиразол-4-она. Раствор CXLVII (0,58 г, 1,0 ммоль) в 20 мл трифторуксусной кислоты перемешивают 2 ч при 25 С, после чего реакционную смесь упаривают в вакууме. Остаток перекристаллизовывают из этанола, получая 0,54 г (89%) желтого продукта в виде его соли с ТФК; т.пл. 263 С; ЭИМС m/e: рассчитано для C25H28N7O3 474,2254, найдено 474,2280. 48 Пример CXLIX. Получение 3-(4-(1 пиперазинил)фенил)-5-аминокарбонил)амино) индено[1, 2-c]пиразол-4-она. Продукт получают так, как описано в примерах XLII и CXLVIII, используя в качестве исходных материалов полученный в примереC21H21N6O2 389,1726, найдено 389,1724. Пример CL. Получение 3-(4-(1-пиперазинил)фенил)-5-гидразинокарбонил)амино) индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примерах XLII и CXLVIII, используя в качестве исходных материалов полученный в примереC21H22N7O2 404,1835, найдено 404,1834. Пример CLI. Получение 3-(4-(1-пиперазинил)фенил)-5-диметиламино)ацетамидо)индено[1,2-с]пиразол-4-она. Продукт получают, используя в качестве исходного материала полученный в примереCXLVII 2-(4-(4-трет-бутоксикарбонил-1-пиперазинил)бензоил)-4-амино-1,3-индандион, после чего проводят хлорацетилирование и реакцию с диметиламином, как описано в примерах II иXXIII, и затем обрабатывают гидразином и удаляют трет-бутоксикарбонильную группу, как описано в примерах I и CXLVIII; т.пл. 243 С; ЭИМС m/e: рассчитано для C24H27N6O2 431,2196, найдено 431,2198. Пример CLII. Получение 3-(4-(1-пиперазинил)фенил)-5-4-морфолинил)ацетамидо) индено[1,2-c]пиразол-4-она. Продукт получают, используя в качестве исходного материала полученный в примереCXLVII 2-(4-(4-трет-бутоксикарбонил-1-пиперазинил)бензоил)-4-амино-1,3-индандион, после чего проводят хлорацетилирование и реакцию с морфолином, как описано в примерах II и XXIII,и затем обрабатывают гидразином и удаляют трет-бутоксикарбонильную группу, как описано в примерах I и CXLVIII; т.пл. 259 С; ЭИМСm/e: рассчитано для С 26 Н 29N6 О 3 473,2301, найдено 473,2302. Пример CLIII. Получение 3-(4-(1-пиперазинил)фенил)-5-4-метил-1-пиперазинил)ацетамидо)индено[1,2-c]пиразол-4-она. Продукт получают, используя в качестве исходного материала полученный в примереCXLVII 2-(4-(4-трет-бутоксикарбонил-1-пиперазинил)бензоил)-4-амино-1,3-индандион, после чего проводят хлорацетилирование и реакцию с 1-метилпиперазином, как описано в примерах II и XXIII, и затем обрабатывают гидразином и удаляют трет-бутоксикарбонильную группу, как описано в примерах I и CXLVIII; ЭИМС m/e: рассчитано для C27H32N7O2 486,2618, найдено 486,2608. 49 Пример CLIV. Получение 3-(4-(1-пиперазинил)фенил)-5-4-аминометил-1-пиперидинил)ацетамидо)индено[1,2-c]пиразол-4-она. Продукт получают, используя в качестве исходного материала полученный в примереCXLVII 2-(4-(4-трет-бутоксикарбонил-1-пиперазинил)бензоил)-4-амино-1,3-индандион, после чего проводят хлорацетилирование и реакцию с 4-(аминометил)пиперидином, как описано в примерах II и XXIII, и затем обрабатывают гидразином и удаляют трет-бутоксикарбонильную группу, как описано в примерах I и CXLVIII; т.пл. 239 С; ЭИМС m/e: рассчитано для К раствору CXLVIII (0,17 г, 0,29 ммоль) в 10 мл метанола и 2 мл воды при 25 С добавляют последовательно 37%-ный водный раствор формальдегида (0,45 г, 5,8 ммоль), цианоборогидрид натрия (0,18 г, 2,9 ммоль) и 4 капли уксусной кислоты. Образовавшийся раствор перемешивают 16 ч при 25 С, разбавляют водой,подкисляют до рН 1 концентрированной соляной кислотой и перемешивают в течение 10 мин. После этого реакционную смесь подщелачивают до рН 13 50%-ным водным гидроксидом натрия и затем доводят рН до 10 с помощью 1 н. соляной кислоты. Полученную реакционную смесь экстрагируют смесью хлороформ/изопропиловый спирт (4:1). Объединенные экстракты промывают водой и солевым раствором, сушат над безводным сульфатом натрия и фильтруют. К фильтрату добавляют избыток трифторуксусной кислоты и полученный раствор упаривают в вакууме. Остаток перекристаллизовывают из изопропилового спирта, получая 0,16 г (92%) желтого продукта в виде его соли с ТФК; т.пл. 245 С; ЭИМС m/e: рассчитано для C26H30N7O3 488,2410, найдено 488,2420. Пример CLVI. Получение 3-(4-(4-этил-1 пиперазинил)фенил)-5-4-морфолиниламино) карбонил)амино)индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере XLV, используя в качестве исходных материалов CXLVIII и ацетальдегид; т.пл. 245 С; ЭИМС m/e: рассчитано для C27H32N7O3 502,2567, найдено 502,2555. Пример CLVII. Получение 3-(4-(4-изопропил-1-пиперазинил)фенил)-5-4-морфолиниламино)карбонил)амино)индено[1,2-c]пиразол-4-она. Продукт получают так, как описано в примере XLV, используя в качестве исходных материалов CXLVIII и ацетон; т.пл. 253 С; ЭИМС 50 Применение Ингибирование ферментной активности комплекса киназа/циклин Несколько соединений, описанных в настоящем изобретении, были испытаны на ингибиторную активность в отношении комплексов Ц 3K4/D1 и ЦЗК 2/Е-киназа. В кратком изложении, в испытаниях in vitro использованы клеточные лизаты из клеток насекомых, экспрессирующих каждую из киназ и связанные с ними соответствующие регуляторные единицы. Комплекс ЦЗК 2/циклин Е очищают от клеток насекомых, экспрессирующих обладающие гистидиновым маркером ЦЗК 2 и циклин Е. ЦЗК/циклиновый лизат смешивают в планшете для микротитрования с совместимым с киназой буфером, 32 Р-меченой АТФ с концентрацией 50 мМ, белком слияния GST-Rb и тестируемым соединением в разных концентрациях. Проводят взаимодействие киназы с радиомеченой АТФ и эффективно останавливают реакцию добавлением большого избытка ЭДТА и немеченой АТФ. Меченый белок GST-Rb связывают с помощью суспензии гранул GSH-сефарозы, промывают,повторно суспендируют в сцинтиллянте и определяют активность фосфора 32 Р на сцинтилляционном счетчике. Для каждого соединения рассчитывают концентрацию, ингибирующую 50% киназной активности. Соединение считается активным, еcли значение этой концентрации(IC50) ниже 1 мкМ. Ингибирование пролиферации раковых клеток НСТ 116 Для тестирования клеточной активности нескольких из предложенных в настоящем изобретении соединений исследовали влияние этих соединений на культивированные клетки НСТ 116 и определили их влияние на протекание клеточного цикла с помощью колориметрического теста на цитотоксичность, используя сульфородамин В (Skehan et al., J. Natl. CancerInst., 82, 1107-1112, 1990). В кратком изложении, клетки НСТ 116 культивируют в присутствии испытуемых соединений при повышенной концентрации. В определенные моменты времени группы клеток фиксируют трихлоруксусной кислотой и окрашивают сульфородамином В(СРВ). Свободный краситель удаляют промыванием, а краситель, связанный с белком, экстрагируют для определения оптической плотности. Соединение считается активным, если значение
МПК / Метки
МПК: C07D 231/54, A61P 35/00, A61K 31/416
Метки: качестве, антипролиферативных, противораковых, агентов, 5-аминоиндено, 2-с]пиразол-4-оны
Код ссылки
<a href="https://eas.patents.su/30-4805-5-aminoindeno-1-2-spirazol-4-ony-v-kachestve-protivorakovyh-i-antiproliferativnyh-agentov.html" rel="bookmark" title="База патентов Евразийского Союза">5-аминоиндено [1, 2-с]пиразол-4-оны в качестве противораковых и антипролиферативных агентов</a>
Предыдущий патент: Применение доцетаксела для лечения печеночно-клеточного рака
Следующий патент: Производные 6-азаурацила, ингибирующие il-5
Случайный патент: Электрическая цепь электролизера и способ уменьшения электромагнитных полей поблизости от электролизера