Производные пиразол-4-илбензоила и их применение в качестве гербицидов
Номер патента: 1228
Опубликовано: 25.12.2000
Авторы: Оттен Мартина, Плат Петер, Фоссен Маркус, Кениг Хартманн, Вестфален Карл-Отто, Кардорфф Увэ, Фон Дайн Вольфганг, Мисслитц Ульф, Вальтер Хельмут, Хилл Регина Луизе, Харреус Альбрехт, Ранг Харальд, Энгель Штефан
Формула / Реферат
1. Производные пиразол-4-илбензоила формулы I
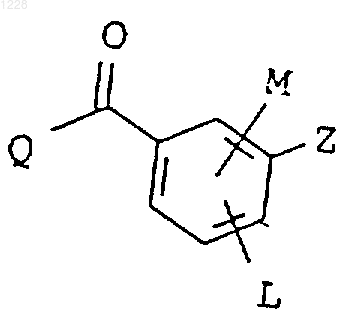
в которой заместители имеют следующие значения:
L обозначает водород, галоген, нитрогруппу, С1-С4алкилсульфонил;
М обозначает водород, С1-С4алкил, галоген, С1-С4алкилтиогруппу;
Z обозначает 5-членный гетероциклический остаток, содержащий от одного до двух гетероатомов, выбранных из группы, включающей кислород, серу или азот, который необязательно замещен С1-С4алкилом;
Q обозначает присоединенное в положении 4 пиразольное кольцо формулы II
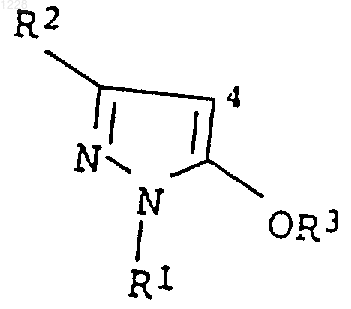
в которой R1 обозначает С1-С4алкил;
R2 обозначает водород, С1-С4алкил или галоС1-С4алкил и
R3 обозначает водород, С1-С4алкилсульфонил, фенилсульфонил; а также
пригодные для применения в сельском хозяйстве соли соединений формулы I.
2. Производные пиразол-4-илбензоила по п.1 формулы Iа
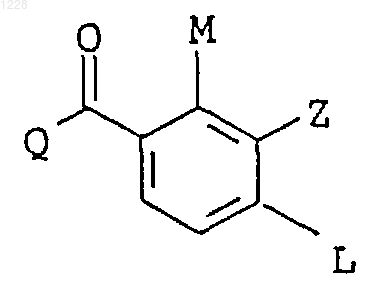
в которой L обозначает С1-С4алкилсульфонил, галоген, нитро;
М обозначает водород, С1-С4алкил, С1-С4алкилтио, галоген; а Q и Z имеют значения, указанные в п.1.
3. Производные пиразол-4-илбензоила по п.1 формулы Ib
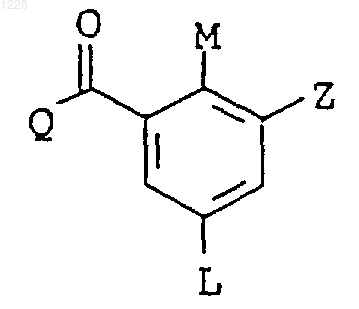
в которой L обозначает С1-С4алкилсульфонил, галоген, нитро;
М обозначает С1-С4алкил, С1-С4алкилтио, галоген, а Q и Z имеют значения, указанные в п.1.
4. Производные пиразол-4-илбензоила формулы I по п.1, в которой радикал L обозначает водород, метилсульфонил, хлор, нитрогруппу;
М обозначает водород, метил, метилтио, хлор.
5. Гербицидный препарат, содержащий, по крайней мере, одно производное пиразол-4-илбензоила формулы I по п.1 и обычные инертные добавки.
Текст
1 Настоящее изобретение относится к новым производным пиразолилбензоила, обладающим гербицидным действием, к способу получения производных пиразолилбензоила, к содержащим их средствам, а также к применению этих производных или содержащих их средств для борьбы с сорной растительностью. Из литературы известны обладающие гербицидным действием производные пиразолилбензоила, например, из европейской заявки ЕР 352543. Однако гербицидные свойства известных соединений, равно как и их совместимость с культурными растениями можно признать лишь как условно удовлетворительные. Исходя из вышеизложенного, в основу изобретения была положена задача получить новые производные пиразолилбензоила с более совершенными свойствами. В соответствии с этой задачей был разработан состав новых производных пиразол -4 илбензоила формулы I в которой заместители имеют следующие значения:Z обозначает 5-членный гетероциклический остаток, содержащий от одного до двух гетероатомов, выбранных из группы, включающей кислород, серу или азот, который необязательно замещен С 1-С 4 алкилом;Q обозначает присоединенное в положении 4 пиразольное кольцо формулы IIR2 обозначает водород, С 1-С 4 алкил или галоС 1-С 4 алкил иR3 обозначает водород, С 1-С 4 алкилсульфонил, фенилсульфонил; а также пригодные для применения в сельском хозяйстве соли соединений формулы I. Предпочтительными являются производные пиразол-4-илбензоила формулы Iа 2 М обозначает водород, С 1-С 4 алкил, С 1-С 4 алкилтио, галоген; а Q и Z имеют вышеуказанные значения. Предпочтительными являются также производные пиразол-4-илбензоила формулы IbL обозначает С 1-С 4 алкилсульфонил, галоген, нитро; М обозначает С 1-С 4 алкил, С 1-С 4 алкилтио,галоген, а Q и Z имеют вышеуказанные значения. Причем предпочтительными являются производные пиразол-4-илбензоила формулы I,в которой радикал L обозначает водород, метилсульфонил, хлор, нитрогруппу; а М обозначает водород, метил, метилтио, хлор. Другим объектом изобретения является гербицидный препарат, содержащий, по крайней мере, одно производное пиразол-4 илбензоила формулы I и обычные инертные добавки. Соединения формулы I получают благодаря тому, что 5-гидроксипиразолы формулы IIа ацилируют производным бензоила формулы III(Т обозначает Cl) и образующийся сложный пиразоловый эфир перегруппировывают, получая соединения формулы Iс В вышеприведенных формулах Т обозначает галоген, a L, М и Z имеют значения, указанные выше. Первую стадию проведения реакции, ацилирование, осуществляют по общеизвестной методике, например, добавлением производного бензоила формулы III (Т обозначает хлор) к раствору или к суспензии 5-гидроксипиразола IIа в присутствии вспомогательного основания. Реагенты и вспомогательное основание целесообразно применять при этом практически в эквимолярных количествах. Небольшой избыток вспомогательного основания порядка 1,2-1,5 мол. эквивалента в пересчете на соединение II при определенных условиях также может оказаться целесообразным. В качестве вспомогательного основания пригодны, например, третичные алкиламины,пиридин или карбонаты щелочных металлов, а в качестве растворителей могут использоваться метиленхлорид, диэтиловый эфир, толуол или 3 этиловый эфир уксусной кислоты. В процессе добавления хлорангидрида кислоты реакционную смесь предпочтительно охлаждают до 010 С, после чего при более высокой температуре, например, в диапазоне 25-50 С, смесь перемешивают до завершения обменной реакции. Дальнейшую переработку осуществляют по обычной методике, например, реакционную смесь сливают в воду и экстрагируют метиленхлоридом. После сушки органической фазы и удаления растворителя сырой 5-гидроксипиразоловый эфир без последующей очистки может использоваться для проведения перегруппировки. Примеры получения бензойнокислотных эфиров 5-гидроксипиразолов можно найти,в частности, в европейской заявке ЕР-А 282944 и в патенте США 4643757. Перегруппировку 5-гидроксипиразоловых эфиров с получением в результате соединений формулы 1 с осуществляют предпочтительно при температурах в интервале от 20 до 40 С в растворителе и в присутствии вспомогательного основания, а также с помощью цианосоединения в качестве катализатора. В качестве растворителей могут применяться среди прочих ацетонитрил, метиленхлорид, 1,2-дихлорэтан, этиловый эфир уксусной кислоты либо толуол. Предпочтительным растворителем является ацетонитрил. В качестве вспомогательного основания приемлемы третичные алкиламины,пиридин или карбонаты щелочных металлов,которые применяют в эквимолярном количестве или в избытке до четырехкратного. Предпочтительным вспомогательным основанием является триэтиламин в двойном количестве. В качестве катализатора пригодны цианидовые соединения,такие, как цианид калия или ацетонциангидрин,которые применяют, например, в количестве от 1 до 50, прежде всего от 5 до 20 мол.% по отношению к 5-гидроксипиразоловому эфиру. Предпочтительно используют ацетонциангидрин,например, в количестве 10 мол.%. Примеры перегруппировки бензойнокислотных эфиров 5-гидроксипиразолов можно найти, в частности, в указанных выше публикациях ЕР-А 282944 или US 4643757, однако в качестве катализатора в этих публикациях применяют только карбонат натрия или карбонат калия в диоксане. Применение цианида калия или ацeтонциангидрина хотя и известно в связи с проведением аналогичной перегруппировки енольных эфиров циклогексан-1,3-дионов (патент США US 4695673), однако, в литературе отсутствуют примеры, подтверждающие особую пригодность цианидовых соединений для осуществления перегруппировки Фриса Oацильных производных 5-гидроксипиразола. Последующую переработку осуществляют по обычной методике, например, реакционную смесь подкисляют разбавленными минеральными кислотами, такими, как 5%-ная соляная кислота или серная кислота, и экстрагируют, на 001228 4 пример, метиленхлоридом или этиловым эфиром уксусной кислоты. Для очистки экстракт экстрагируют холодным 5-10%-ным раствором карбоната щелочного металла, причем конечный продукт переходит в водную фазу. Подкислением водного раствора продукт формулы Iс осаждают или повторно экстрагируют метиленхлоридом, сушат и затем из него удаляют растворитель. Используемые в качестве исходного материала 5-гидроксипиразолы формулы II известны и могут быть получены по известным способамPrakt. Chem. 315. 382 (1973. 1,3-диметил-5 гидроксипиразол является коммерчески доступным соединением. Производные бензойной кислоты формулыIII можно получить следующим путем. Бензоилгалогениды как, например, бензоилхлориды формулы III (Т обозначает хлор),получают по известной методике взаимодействием бензойных кислот формулы III (Т обозначает ОН) с тионилхлоридом. Бензойные кислоты формулы III (Т обозначает ОН) могут быть получены по известной методике из соответствующих сложных эфиров формулы III (Т обозначает С 1-С 4 алкокси) путем кислотного либо основного гидролиза. Промежуточные продукты формулы III можно получить по описанному ниже механизму, представленному на схемах 2 и 3. Схема 2 Т обозначает С 1-С 4 алкокси,Х обозначает Cl, Br, J, -OS(O)2CF3,-ОS(O)2F,А 1 обозначает Sn(С 1-С 4 алкил)3, В(ОН)2,ZnHal, где Hal представляет собой Cl или Br, L,М и Z имеют значения, указанные выше. Согласно этой схеме арилгалоидные соединения или арилсульфонаты формулы IV подвергают взаимодействию по известной методике с гетероарилстаннатами (реакции сочетания Штилле), боргетероарильными соединениями (реакции сочетания Сузуки) или цинкгетероарильными соединениями (реакция Негиши) формулы V (ср., например, Synthesis 1987,51-53, Synthesis 1992, 413) в присутствии катализатора на основе переходного металла, такого, как палладиевый или никелевый катализатор, и необязательно в присутствии основания с получением в результате новых соединений общей формулы III. Производные бензойной кислоты формулыIII можно получить также благодаря тому, что соответствующие бром- или иодзамещенные соединения формулы VIZ1 обозначает Z или CN, Т обозначает ОН, С 1-С 4 алкокси, в которой L и М имеют указанные выше значения, в присутствии катализатора на основе переходного металла, такого, как палладиевый, никелевый, кобальтовый или родиевый катализатор, и в присутствии основания подвергают взаимодействию с оксидом углерода и водой при повышенном давлении. Предпочтительными в рамках настоящего изобретения являются производные бензоила формулы IIIaZ имеет значения, указанные выше. К предпочтительным относятся также производные бензоила формулы IIIbZ имеет значения, указанные выше. Никелевые, кобальтовые, родиевые и прежде всего палладиевые катализаторы могут быть представлены в металлической форме либо в виде обычных солей, в частности в виде галоидных соединений, как, например, PdCl2,RhCl3H2O, ацетатов, как, например, Рd(OAc)2,цианидов и т.д. с известными степенями валентности. Далее могут быть представлены металлические комплексы с третичными фосфинами, алкилкарбонилы металлов, карбонилы металлов, например, CO2(CO)8, Ni(CO)4, металлкарбонильные комплексы с третичными фос 001228 6 финами, например, (РРh3)2Ni(СО)2, комплексные соединения, образованные солями переходных металлов с третичными фосфинами. Последний из названных вариантов выполнения,прежде всего в случае палладиевого катализатора, является предпочтительным. При этом тип фосфиновых лигандов может варьироваться в широких пределах. Их можно представить, например, следующими формулами:R11-R14 представляют собой низкомолекулярный алкил, например, С 1-С 6 алкил, арил, С 1-С 4 алкиларил, например, бензил, фенетил или арилокси. Арил представляет собой, например, нафтил,антрил и предпочтительно необязательно замещенный фенил, причем касательно заместителей следует учитывать лишь их инертность по отношению к реакции карбоксилирования, в остальном их можно варьировать в широких пределах, и они включают все инертные Сорганические радикалы, такие, как С 1-С 6 алкильные радикалы, например, метил, карбоксильные радикалы, такие, как СООН, СООМ (М представляет собой, например, щелочной либо щелочно-земельный металл или аммониевую соль), или С-органические радикалы, связанные через кислород, такие, как С 1-С 6 алкоксильные радикалы. Получение фосфиновых комплексов может осуществляться по известной методике, в частности так, как это описано в вышеуказанных публикациях. Так, например, исходят из обычных, коммерчески доступных солей металлов,таких, как PdCl2 или Рd(ОСОСН 3)2, и добавляют фосфин, например, Р(С 6 Н 5)3, Р(н-С 4 Н 9)3,РСН 3(C6 Н 5)2,1,2-бис(дифенилфосфино)этан. Количество фосфина по отношению к переходному металлу составляет обычно 0-20, прежде всего, 0,1-10 мол.эквивалентов, особенно предпочтительно 1-5 мол.эквивалентов. Количество переходного металла решающего значения не имеет. Очевидно, что по соображениям экономичности целесообразнее применять малое количество, например, в пределах от 0,1 до 10 мол.%, прежде всего 1-5 мол.% в пересчете на исходное вещество формулы VI. Для получения бензойных кислот формулыIII (Т обозначает ОН) осуществляют взаимодействие с оксидом углерода и, по крайней мере, с эквимолярным количеством воды в пересчете на исходные вещества формулы VI. Вода в качестве сокомпонента может служить одновременно растворителем, иными словами, ее максимальное количество решающего значения не имеет. 7 Однако в зависимости от типа исходных материалов и применяемых катализаторов может оказаться целесообразным вместо указанного сокомпонента использовать в качестве растворителя другой инертный растворитель или же используемое для карбоксилирования основание. В качестве инертных растворителей для реакций карбоксилирования могут рассматриваться обычные растворители, такие, как углеводороды, например, толуол, ксилол, гексан,пентан, циклогексан, простые эфиры, например,метил-трет-бутиловый эфир, тетрагидрофуран,диоксан, диметоксиэтан, замещенные амиды,такие, как диметилформамид, перзамещенные мочевины, такие, как тетра-С 1-С 4 алкилмочевины, или нитрилы, такие, как бензонитрил либо ацетонитрил. В предпочтительном варианте осуществления предлагаемого способа один из сокомпонентов, прежде всего основание, применяют в избытке, что исключает необходимость в использовании дополнительного растворителя. Пригодными для применения в способе согласно изобретению основаниями являются все инертные основания, обладающие способностью связывать высвобождающийся в ходе реакции иодистый водород, соответственно бромистый водород. В качестве примеров можно назвать в этой связи третичные амины, такие,как трет-алкиламины, например, триалкиламины, в частности, триэтиламин, циклические амины, такие, как N-метилпиперидин или N,N'диметилпиперазин, пиридин, карбонаты либо гидрокарбонаты щелочных металлов или тетраалкилзамещенные производные мочевины, такие, как тетра-С 1-С 4 алкилмочевина, например,тетраметилмочевина. Количество основания решающего значения не имеет, и обычно применяют 1-10, прежде всего 1-5 молей. При одновременном использовании основания в качестве растворителя его количество, как правило,выбирают таким образом, чтобы компоненты реакции могли растворяться, причем по соображениям практичности и экономичности избегают без необходимости больших избытков, что,помимо прочего, дает возможность использовать небольшие реакционные сосуды и обеспечивать тем самым максимальный контакт реагентов друг с другом. Во время реакции давление оксида углерода регулируют таким образом, чтобы обеспечить постоянный избыток СО по отношению к соединениям VI. Предпочтительно давление оксида углерода при комнатной температуре составляет 1-250 бар, прежде всего 5-150 бар СО. Карбонилирование осуществляют, как правило, в диапазоне температур от 20 до 250 С, прежде всего, от 30 до 150 С, в непрерывном либо периодическом режиме. При работе в периодическом режиме для поддержания 8 постоянного давления целесообразно подавать оксид углерода на реакционную смесь непрерывно. Используемые в качестве исходных веществ арилгалоидные соединения формулы VI известны либо могут быть легко получены путем соответствующего сочетания известных методов синтеза. Так, например, галоидные соединения формулы VI можно получить по реакции Зандмейера из соответствующих анилинов,которые, в свою очередь, синтезируют восстановлением соответствующих нитросоединений(ср., например, для соединений VI с Z1, обозначающим CN: Liebigs Ann. Chem. 1980, 768-778). Арилбромиды VI могут быть получены, кроме того, непосредственным бромированием соответствующих исходных соединений [ср., например, ежемесячное издание "MonatsheftR15 обозначает водород, С 1-С 4 алкил, С 1 С 4 галогеналкил, С 3-С 8 циклоалкил, необязательно замещенный фенил или триметилсилил;R16 обозначает водород, С 1-С 4 галогеналкил, С 3-С 8 циклоалкил или необязательно замещенный фенил. Исходя из арилгалоидных соединений или арилсульфонатов формулы IV, в присутствии катализатора на основе переходного металла, в частности палладиевого либо никелевого катализатора, и необязательно в присутствии основания по известным из литературы методам можно получить арилметилкетоны формулыIVa, а именно, взаимодействием с простыми винилалкиловыми эфирами и последующим гидролизом [ср., например, Tetrahedron Lett. 32,1753-1756 (1991)]. Этинилированные ароматические углеводороды формулы IVb могут быть получены по известной методике взаимодействием арилгалоидных соединений или арилсульфонатов формулы IV с замещенными ацетиленами в присутствии палладиевого либо никелевого катализатора [ср., например, Heterocycles, 24, 31-32(1986)]. Производные IVb с R15, обозначающим Н, получают предпочтительно из силильных соединений формулы IVb, где R15 обозначает Si(СН 3)3 [см. Journ. Org. Chem. 46, 2280-2286(1981)]. По реакции Хека взаимодействием арилгалоидных соединений или арилсульфонатов формулы IV с олефинами в присутствии палладиевого катализатора получают арилалкены формулы IVc (ср., например, Heck, PalladiumPress, Лондон, 1985, соответственно Synthesis 1993, 735-762). Используемые в качестве исходных соединений производные бензоила формулы IV известны [ср., например, Coll. Czech. Chem.Commn. 40, 3009-3019 (1975)] либо могут быть легко получены путем соответствующего сочетания известных методов синтеза. Например, сульфонаты формулы IV (X представляет собой -OS(O)2CF3, -OS(O)2F) можно получить из соответствующих фенолов, которые, в свою очередь, также известны (ср., например, европейскую заявку ЕР 195247) либо могут быть получены с помощью известных методов (ср., например, Synthesis 1993, 735-762). Галоидные соединения формулы IV (X обозначает хлор, бром или иод) можно получить в частности по реакции Зандмейера из соответствующих анилинов. Схема 5 А обозначает S, NH или NOH; Т представляет собой С 1-С 4 алкокси и L и М имеют значения, указанные выше. Производные изофталевой кислоты формулы IVf могут быть получены из альдегидов формулы IVe по известным методам [см. Journ.March Advanced Organic Chemistry, 3-е издание,стр.629 и далее, изд-во Wiley-Interscience Publication (1985)]. Оксимы формулы IVg получают предпочтительно осуществляемым по известной методике взаимодействием альдегидов IVe с гидроксиламином [см. Journ. March Advanced OrganicWiley-Interscience Piblication (1985)]. Преобразование оксимов формулы IVg в нитрилы формулы IVh также можно осуществ 001228 10 лять с помощью известных методов [см. Journ.(1985)]. Используемые в качестве исходных соединений альдегиды формулы IVe известны либо могут быть получены по известным методам. Так, в частности, их можно синтезировать согласно схеме 6 из метильных соединений формулы VII. Схема 6 Радикалы Т, М и L имеют значение, указанное для схемы 5. Из метильных соединений формулы VII по общеизвестным методам, например, взаимодействием с N-бромсукцинимидом или с 1,3-дибром-5,5-диметилгидантоином, могут быть получены бензилбромиды формулы VIII. Превращение бензилбромидов в бензальдегиды формулы IVe также известно из литературы [ср. Synth. Commun. 22,1967-1971 (1992)]. Промежуточные продукты (форпродукты) формул IVa-IVh пригодны для построения гетероциклических промежуточных продуктов формулы III. Так, например, из ацетофеноновIVa через галогенированную промежуточную стадию IVd можно получить производные 5 оксазолила [ср., например, Journ. HeterocyclicIVc пригодны для построения производных 4 изоксазолила, 5-изоксазолила, 4,5-дигидроизоксазол-4-ила, 4,5-дигидроизоксазол-5-ила [ср.,например, Houben-Weyl, Methoden der organischen Chemie, 4-е издание, том Х/3, стр.843 и далее (1965)]. Из бензойных кислот IVf, соответственно из получаемых из этих кислот с помощью обычных методов хлорангидридов IVi можно получить, например, по известным из литературы способам производные 2-оксазолила, 1,2,4 оксадиазол-5-ила, 1,3,4-оксадиазол-2-ила [ср.,например, Journ. Heterocyclic Chem., 28, 17-28(1991)] или производные 2-пирролила [ср., например, Heterocycles 26, 3141-3151 (1987)]. Производные 1,2,4-триазол-3-ила могут быть получены из бензонитрилов IVh по известным методам [ср., например, Journ. Chem.Soc. 3461-3464 (1954). Бензонитрилы IVh через промежуточную стадию тиоамидов, амидоксимов или амидиновIVm могут быть превращены в производные 1,2,4-оксадиазол-3-ила [ср., например, Journ.Heterocyclic Chem., 28, 17-28 (1991)], 2 тиазолила, 4,5-дигидротиазол-2-ила или 5,6 11 дигидро-4-Н-1,3-тиазин-2-ила [ср., например,Houben-Weyl, Methoden der organischen Chemie,4-е издание, том Е 5, стр. 1268 и далее (1985)]. Из тиоамидов IVm (А обозначает S) по известным из литературы методам можно получить также производные 1,2,4-тиадиазол-5-ила [ср.,например, Journ. Org. Chem. 45, 3750-3753Trans. I 1987-1991 (1982)]. Преобразование оксимов IVg в производные 3-изоксазолила может осуществляться по известной методике через промежуточную стадию хлорангидридов гидроксамовой кислотыorganischen Chemie, 4-е издание, том Х/3, стр. 843 и далее (1965)]. С учетом целевого применения производных бензоила общей формулы I в качестве заместителей могут рассматриваться следующие радикалы: 12 С 2-С 6 алкинил, такой, как пропаргил, 2 бутинил, 3-бутинил, 2-пентинил, 3-пентинил, 4 пентинил,1-метил-3-бутинил,2-метил-3 бутинил, 1-метил-2-бутинил, 1,1-диметил-2 пропинил, 1-этил-2-пропинил, 2-гексинил, 3 гексинил, 4-гексинил, 5-гексинил, 1-метил-2 пентинил,1-метил-3-пентинил,1-метил-4 пентинил,3-метил-4-пентинил,4-метил-2 пентинил, 1,1-диметил-2-бутинил, 1,1-диметил 3-бутинил, 1,2-диметил-3-бутинил, 2,2-диметил 3-бутинил, 1-этил-2-бутинил, 1-этил-3-бутинил,2-этил-3-бутинил и 1-этил-1-метил-2-пропинил; С 1-С 4 алкокси, такой как метокси, этокси,н-пропокси, 1-метилэтокси, н-бутокси, 1 метилпропокси,2-метилпропокси и 1,1 диметилэтокси, прежде всего С 1-С 3 алкокси, такой как метокси, этокси, изопропокси, причем эти группы необязательно могут быть замещены одним-пятью атомами галогена, такими, как фтор, хлор, бром и иод, предпочтительно фтор и хлор, или С 1-С 4 алкоксигруппой, расшифровка которой указана выше. Указанная выше группа -(Y)n-S(O)mR7 представляет собой, например, С 1-С 4 алкилтио,такой, как метилтио, этилтио, н-пропилтио, 1 метилэтилтио, н-бутилтио, 1-метилпропилтио,2-метилпропилтио и 1,1-диметилэтилтио, прежде всего, метилтио; С 1-С 4 алкилсульфинил, такой как метилсульфинил,этилсульфинил,н-пропилсульфинил, 1-метилэтилсульфинил, н-бутилсульфинил, 1-метилпропил-сульфинил, 2-метилпропилсульфинил и 1,1-диметилэтилсульфинил,прежде всего, метилсульфинил; С 1-С 4 алкилсульфонил, такой как метилсульфонил, этилсульфонил, н-пропилсульфонил, 1-метилэтилсульфонил, н-бутилсульфонил,1-метилпропилсульфонил, 2-метилпропилсульфонил и 1,1-диметилэтилсульфонил, прежде всего, метилсульфонил; С 1-С 4 алкоксисульфонил, такой как метоксисульфонил, этоксисульфонил, н-пропоксисульфонил,1-метилэтоксисульфонил,нбутоксисульфонил, 1-метилпропоксисульфонил,2-метилпропоксисульфонил и 1,1-диметилэтоксисульфонил, прежде всего метоксисульфонил;N-С 1-С 4aлкилcyльфoнил-N-этилaминo, такой как N-метилсульфонил-N-этиламино, Nэтилсульфонил-N-этиламино, N-н-пропилсульфонил-N-этиламино, N-1-метилэтилсульфонилN-этиламино, N-н-бутилсульфонил-N-этиламино, N-1-метилпропилсульфонил-N-этиламино,N-2-метилпропилсульфонил-N-этиламино и N1,1-диметилэтилсульфонил-N-этиламино, прежде всего, N-метилсульфонил-N-этиламино; С 1-С 4 галогеналкилтио, такой как хлорметилтио, дихлорметилтио, трихлорметилтио,фторметилтио, дифторметилтио, трифторметилтио, хлорфторметилтио, хлордифторметилтио,1-фторэтилтио, 2-фторэтилтио, 2,2-дифторэтилтио, 2,2,2-трифторэтилтио, 2-хлор-2,2-дифторэтилтио,2,2-дихлор-2-фторэтилтио,2,2,2,трихлорэтилтио и пентафторэтилтио, прежде всего, трифторметилтио. Указанная выше группа -(Y)n-СО-R8 представляет собой, например,С 1-С 4 алкилкарбонил, такой как метилкарбонил, этилкарбонил, н-пропилкарбонил, 1 метилэтилкарбонил,н-бутилкарбонил,1 метилпропилкарбонил, 2-метилпропилкарбонил и 1,1-диметилэтилкарбонил, прежде всего, метилкарбонил; С 1-С 4 алкоксикарбонил, такой как метоксикарбонил, этоксикарбонил, н-пропоксикарбонил, 1-метилэтоксикарбонил, н-бутоксикарбонил, 1-метилпропоксикарбонил, 2-метилпропоксикарбонил и 1,1-диметилэтоксикарбонил, прежде всего, метоксикарбонил;Z представляет собой, например, 5- либо 6 членный гетероциклический, насыщенный либо ненасыщенный радикал, содержащий от одного до трех гетероатомов, выбранных из группы,включающей кислород, серу или азот, например, пятичленные гетероароматические углеводороды, такие, как: 2-фурил, 3-фурил, 2-тиенил,3-тиенил, 2-пирролил, 3-пирролил, 3-изоксазолил,4-изоксазолил,5-изоксазолил,3 изотиазолил, 4-изотиазолил, 5-изотиазолил, 3 пиразолил, 4-пиразолил, 5-пиразолил, 2 оксазолил,4-оксазолил,5-оксазолил,2 тиазолил, 4-тиазолил, 5-тиазолил, 2-имидазолил,4-имидазолил, 1,2,4-оксадиазол-3-ил, 1,2,4 оксадиазол-5-ил, 1,3,4-оксадиазол-2-ил, 1,2,3 оксадиазол-4-ил, 1,2,3-оксадиазол-5-ил, 1,2,5 оксадиазол-3-ил, 1,2,4-тиадиазол-3-ил, 1,2,4 тиадиазол-5-ил, 1,3,4-тиадиазол-2-ил, 1,2,3 тиадиазол-4-ил, 1,2,3-тиадиазол-5-ил, 1,2,5 тиадиазол-3-ил,1,2,4-триазол-3-ил,1,3,4 триазол-2-ил, 1,2,3-триазол-4-ил, 1,2,3-триазол 5-ил, 1,2,4-триазол-5-ил, тетразол-5-ил, прежде всего, 2-тиазолил и 3-изоксазолил; шестичленные гетероароматические углеводороды, такие,как 2-пиридинил, 3-пиридинил, 4-пиридинил, 3 пиридазинил, 4-пиридазинил, 2-пиримидинил,4-пиримидинил, 5-пиримидинил, 2-пиразинил,1,3,5-триазин-2-ил, 1,2,4-триазин-5-ил и 1,2,4 триазин-3-ил,1,2,4-триазин-6-ил,1,2,4,5 тетразин-3-ил; 5-6-членные, насыщенные либо частично ненасыщенные гетероциклы, содержащие от одного до трех атомов азота и/или один либо два атома кислорода или серы, такие,как 2-тетрагидрофуранил, 3-тетрагидрофуранил,2-тетрагидротиенил, 3-тетрагидротиенил, тетрагидротиопиран-2-ил, тетрагидротиопиран-3-ил,тетрагидротиопиран-4-ил,1,3-дитиолан-2-ил,1,3-дитиолан-4-ил, 1,3-дитиан-2-ил, 1,3-дитиан 4-ил,5,6-дигидро-4 Н-1,3-тиазин-2-ил,1,3 оксатиолан-2-ил, 1,3-оксатиан-2-ил, 1-пирролидинил, 2-пирролидинил, 3-пирролидинил, 3 001228 16 изоксазолидинил, 4-изоксазолидинил, 5-изоксазолидинил, 3-изотиазолидинил, 4-изотиазолидинил, 5-изотиазолидинил, 3-пиразолидинил,4-пиразолидинил, 5-пиразолидинил, 2-оксазолидинил, 4-оксазолидинил, 5-оксазолидинил, 2 тиазолидинил, 4-тиазолидинил, 5-тиазолидинил,2-имидазолидинил, 4-имидазолидинил, 1,2,4 оксадиазолидин-3-ил, 1,2,4-оксадиазолидин-5 ил, 1,2,4-тиадиазолидин-3-ил, 1,2,4-тиадиазолидин-5-ил, 1,3,4-оксадиазолидин-2-ил, 1,3,4 тиадиазолидин-2-ил,1,3,4-триазолидин-2-ил,2,3-дигидрофур-2-ил, 2,3-дигидрофур-3-ил, 2,4 дигидрофур-2-ил, 2,4-дигидрофур-3-ил, 2,3 дигидротиен-2-ил, 2,3-дигидротиен-3-ил, 2,4 дигидротиен-2-ил, 2,4-дигидротиен-3-ил, 2,3 пирролин-2-ил,2,3-пирролин-3-ил,2,4 пирролин-2-ил,2,4-пирролин-3-ил,2,3 изоксазолин-3-ил, 3,4-изоксазолин-3-ил, 4,5 изоксазолин-3-ил, 2,3-изоксазолин-4-ил, 3,4 изоксазолин-4-ил, 4,5-изоксазолин-4-ил, 2,3 изоксазолин-5-ил, 3,4-изоксазолин-5-ил, 4,5 изоксазолин-5-ил, 2,3-изотиазолин-3-ил, 3,4 изотиазолин-3-ил, 4,5-изотиазолин-3-ил, 2,3 изотиазолин-4-ил, 3,4-изотиазолин-4-ил, 4,5 изотиазолин-4-ил, 2,3-изотиазолин-5-ил, 3,4 изотиазолин-5-ил, 4,5-изотиазолин-5-ил, 2,3 дигидропиразол-1-ил, 2,3-дигидропиразол-2-ил,2,3-дигидропиразол-3-ил, 2,3-дигидропиразол-4 ил, 2,3-дигидропиразол-5-ил, 3,4-дигидропиразол-1-ил, 3,4-дигидрогпаразол-3-ил, 3,4-дигидропиразол-4-ил, 3,4-дигидропиразол-5-ил, 4,5 дигидропиразол-1-ил, 4,5-дигидропиразол-3-ил,4,5-дигидропиразол-4-ил, 4,5-дигидропиразол-5 ил,2,3-дигидрооксазол-2-ил,2,3-дигидрооксазол-3-ил, 2,3-дигидрооксазол-4-ил, 2,3 дигидрооксазол-5-ил, 4,5-дигидрооксазол-2-ил,4,5-дигидрооксазол-4-ил, 4,5-дигидрооксазол-5 ил, 1,3-диоксолан-2-ил, 1,3-диоксолан-4-ил, 1,3 диоксан-5-ил, 1,4-диоксан-2-ил, 2-пиперидинил,3-пиперидинил, 4-пиперидинил, 3-тетрагидропиридазинил, 4-тетрагидропиридазинил, 2 тетрагидропиримидинил,4-тетрагидропиримидинил,5-тетрагидропиримидинил,2 тетрагидропиразинил, 1,3,5-тетрагидротриазин 2-ил и 1,2,4-тетрагидротриазин-3-ил, прежде всего, 2-тетрагидрофуранил, 1,3-диоксолан-2-ил и 1,3-диоксан-2-ил, который (заместитель Z) необязательно замещен галогеном, указанным выше, прежде всего фтором или хлором, циано-,нитрогруппой, группой -CO-R8, например алкилкарбонилом, указанным выше, алкоксикарбонилом, указанным выше, N-алкилкарбамоилом, указанным выше, диалкилкарбамоилом, указанным выше; С 1-С 4 алкилом, указанным выше; С 1-С 4 галогеналкилом, таким, например,как хлорметил, дифторметил, дихлорметил,трифторметил, трихлорметил, хлордифторметил, 1-фторэтил, 2-фторэтил, 2,2-дифторэтил,1,1,2,2-тетрафторэтил, 2,2,2-трифторэтил, 2 хлор-1,1,2-трифторэтил, пентафторэтил, декафторбутил, 1,1-бис-трифторметил-2,2,2-трифтор 17 этил, прежде всего, дифторметил, трифторметил, трихлорметил и хлордифторметил; С 3-С 8 циклоалкилом, таким, например, как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, прежде всего,циклопропил и циклогексил; С 1-С 4 алкоксигруппой, указанной выше; С 1-С 4 галогеналкоксигруппой, такой, например, как хлорметокси, дихлорметокси, трихлорметокси, фторметокси, дифторметокси,трифторметокси, хлордифторметокси, дихлорфторметокси, 1-фторэтокси, 2-фторэтокси, 2,2 дифторэтокси, 1,1,2,2-тетрафторэтокси, 2,2,2 трифторэтокси, 2-хлор-1,1,2-трифторэтокси и пентафторэтокси, прежде всего С 1-С 3 галогеналкоксигруппой, такой, как 2,2,2-трифторэтокси и 2-хлор-2,2-дифторэтокси; С 1-С 4 алкилтиогруппой, указанной выше; С 1-С 4 галогеналкилтиогруппой, указанной выше; ди-С 1-С 4 алкиламиногруппой, такой, например, как диметиламино, диэтиламино, дипропиламино,дибутиламино,N-метил-Nэтиламино, N-метил-N-пропиламино, N-метилN-1-метилэтиламино, N-метил-N-1,1-диметилэтиламино, ди-1-метилэтиламино, N-этил-N-1 метилэтиламино иN-этил-N-1,1-диметилэтиламино; необязательно замещенным фенилом или оксогруппой, которая необязательно может быть представлена также в таутомерной форме в качестве гидроксильной группы, например,тиазолин-4,5-дион-2-ил,3-оксо-3 Н-1,2,4 дитиазолил или 2-оксо-2 Н-1,3,4-дитиазолил. Сконденсированные с бензольным ядром 5- либо 6-членные гетероароматические углеводороды представляют собой, например, бензофуранил, бензотиенил, индолил, бензоксазолил,бензизоксазолил, бензтиазолил, бензизотиазолил,бензпиразолил,индазолил,1,2,3 бензотиадиазолил, 2,1,3-бензотиадиазолил, бензотриазолил, бензофуроксанил, хинолинил, изохинолинил, циннолинил, хиназолинил, хиноксалинил или фталазинил. Примеры особенно предпочтительных соединений общей формулы 18 Таблица 1. Соединения со структурой Id Соединения формулы I и их пригодные для использования в сельском хозяйстве соли - как в виде смесей изомеров, так и в виде чистых изомеров - могут применяться в качестве гербицидов. Гербицидные препараты, содержащие соединения формулы I, дают очень хороший эффект при борьбе с растительностью на площадях, на которых не возделываются культурные растения, прежде всего при высоких нормах расхода. В посевах таких культур, как пшеница,рис, кукуруза, соя и хлопчатник, эти препараты эффективны против сорняков и вредоносных растений, практически не нанося вреда культурным растениям. Этот эффект достигают прежде всего при низких нормах расхода. С учетом разнообразия методов обработки соединения формулы I, соответственно содержащие эти соединения гербицидные препараты могут применяться для уничтожения нежелательной растительности также в целом ряде других культурных растений. Среди таковых можно назвать, например, следующие культуры:aestivum, Triticum durum, Vicia faba, Vitis vinifera и Zea mays. Кроме того, соединения формулы I могут применяться также в культурах, которые благодаря методам селекции и/или генной инженерии приобрели значительную устойчивость к действию гербицидов. Действующие вещества формулы I, соответственно, гербицидные препараты могут применяться в методах как предвсходовой, так и послевсходовой обработки. Если действующие вещества обладают недостаточной совместимостью с некоторыми культурными растениями,то рекомендуется применять такую технологию обработки, при которой гербицидные препараты следует распылять с помощью соответствующих опрыскивателей так, чтобы они по возможности не попадали на листья чувствительных культур, а были направлены на листья растущих среди них нежелательных растений или на открытые участки почвы (способ направленного опрыскивания, способ ленточного опрыскивания). Соединения формулы I, соответственно содержащие их гербицидные препараты могут применяться, например, в виде предназначенных для непосредственного опрыскивания водных растворов, порошков, суспензий, в том числе высококонцентрированных водных, масляных или каких-либо других суспензий, или дисперсий, эмульсий, масляных дисперсий, паст,препаратов для опыливания, препаратов для опудривания или гранулятов, которые используют для обработки самыми разными методами,такими, как опрыскивание, обработка в виде туманов, опыливание, опудривание или полив. Технология обработки и используемые формы зависят от целей применения, но во всех случаях должно быть обеспечено максимально тонкое 23 и равномерное распределение действующих веществ по изобретению. В качестве инертных вспомогательных веществ могут рассматриваться в основном следующие: фракции нефтяного топлива с температурой кипения от средней до высокой, такие,как керосин и дизельное топливо, далее каменноугольные масла, а также масла растительного или животного происхождения, алифатические,циклические и ароматические углеводороды,например, парафины, тетрагидронафталин, алкилированные нафталины либо их производные,алкилированные бензолы либо их производные,спирты, такие, как метанол, этанол, пропанол,бутанол, циклогексанол, циклогексанон, или сильно полярные растворители, такие, как Nметилпирролидон, или вода. Водные формы применения могут приготавливаться из эмульсионных концентратов,суспензий, паст, смачивающихся порошков или диспергируемых в воде гранулятов добавлением воды. Для приготовления эмульсий, паст или масляных дисперсий субстраты как таковые либо после их растворения в масле или растворителе можно с помощью смачивателей, адгезивов, диспергаторов или эмульгаторов гомогенизировать в воде. Возможно также из действующего вещества, смачивателей, адгезивов, диспергаторов или эмульгаторов и необязательно растворителей или масла получать концентраты,пригодные для разбавления водой. В качестве поверхностно-активных веществ (адъювантов) могут использоваться соли щелочных и щелочно-земельных металлов и аммониевые соли ароматических сульфокислот,например, лигнин-, фенол-, нафталин- и дибутилнафталинсульфокислоты, а также соли жирных кислот, алкил- и алкиларилсульфонаты,алкилсульфаты, сульфаты лаурилового эфира и жирных спиртов и соли сульфатированных гекса-, гепта- и октадеканолов, а также гликолевых эфиров жирных спиртов, продукты конденсации сульфированного нафталина и его производных с формальдегидом, продукты конденсации нафталина, соответственно нафталинсульфокислот с фенолом и формальдегидом, полиоксиэтиленоктилфеноловый эфир, этоксилированный изооктил-, октил- или нонилфенол, полигликолевые эфиры алкилфенила и трибутилфенила, алкилариловые полиэфиры спиртов, изотридециловый спирт, конденсаты этиленоксида и жирных спиртов, этоксилированное касторовое масло, полиоксиэтилен- или полиоксипропиленалкиловые эфиры, ацетат эфира лаурилового спирта и полигликоля, сложные эфиры сорбита,отработанный лигнинсульфитный щелок или метилцеллюлоза. Порошковые препараты, препараты для опыливания и опудривания могут приготавливаться путем смешения или совместного измельчения действующих веществ с каким-либо твердым наполнителем. 24 Грануляты, например, грануляты в оболочке, импрегнированные грануляты и гомогенные грануляты могут быть получены за счет связывания действующих веществ с твердыми наполнителями. В качестве таких твердых наполнителей могут служить минеральные земли,в частности кремниевые кислоты, силикагели,силикаты, тальк, каолин, известняк, известь,мел, болюс, лесс, глина, доломит, диатомовая земля, сульфат кальция и магния, оксид магния,измельченные синтетические материалы, удобрения, такие, как сульфат аммония, фосфат аммония, нитрат аммония, мочевины и растительные продукты, такие, как мука зерновых, мука из коры деревьев, древесная мука и мука из ореховой скорлупы, целлюлозные порошки или какие-либо другие твердые наполнители. Концентрация действующих веществ I в готовых для применения композициях может варьироваться в широких пределах. Как правило, композиции содержат действующее вещество в количестве от 0,001 до 98 мас.%, предпочтительно от 0,01 до 95 мас.%. Действующие вещества применяют при этом со степенью чистоты от 90 до 100%, предпочтительно от 95 до 100% (согласно ЯМР-спектру). Ниже представлены примеры, поясняющие технологию приготовления таких композиций из соединений I по изобретению и их состав.I. 20 мас.ч. соединения 1.28 растворяют в смеси, состоящей из 80 мас.ч. алкилированного бензола, 10 мас.ч. продукта присоединения 810 молей этиленоксида к 1 молю N-моноэтаноламида олеиновой кислоты, 5 мас.ч. кальциевой соли додецилбензолсульфокислоты и 5 мас.ч. продукта присоединения 40 молей этиленоксида к 1 молю касторового масла. После декантирования и тонкого равномерного распределения раствора в 100000 мас.ч. воды получают водную дисперсию, содержащую 0,02 мас.% действующего вещества.II. 20 мас.ч. соединения 1.28 растворяют в смеси, состоящей из 40 мас.частей циклогексанона, 30 мас.ч. изобутанола, 20 мас.ч. продукта присоединения 7 молей этиленоксида к 1 молю изооктилфенола и 10 мас.ч. продукта присоединения 40 молей этиленоксида к 1 молю касторового масла. После декантирования и тонкого равномерного распределения раствора в 100000 мас.ч. воды получают водную дисперсию, содержащую 0,02 мас.% действующего вещества.III. 20 мас.ч. действующего вещества 1.28 растворяют в смеси, состоящей из 25 мас.ч. циклогексанона, 65 мас.ч. получаемой при перегонке нефти фракции нефтяного топлива с температурой кипения 210-280 С и 10 мас.ч. продукта присоединения 40 молей этиленоксида к 1 молю касторового масла. После декантирования и тонкого равномерного распределения раствора в 100000 мас.частях воды получают воднуюIV. 20 мас.ч. действующего вещества 1.28 тщательно перемешивают с 3 мас.ч. натриевой соли диизобутилнафталинсульфокислоты, 17 мас.ч. натриевой соли лигнинсульфокислоты из отработанного сульфитного щелока и 60 мас.ч. порошкообразного геля кремниевой кислоты, после чего тщательно измельчают в молотковой мельнице. После тонкого и равномерного распределения смеси в 20000 мас.ч. воды получают раствор для опрыскивания, содержащий 0,1 мас.% действующего вещества.V. 3 мас.ч. действующего вещества 1.28 смешивают с 97 мас.ч. тонкодисперсного каолина. Таким путем получают препарат для опыливания, содержащий 3 мас.% действующего вещества.VI. 20 мас.ч. действующего вещества 1.28 тщательно смешивают с 2 мас.ч. кальциевой соли додецилбензолсульфокислоты, 8 мас.ч. полигликолевого эфира жирного спирта, 2 мас.ч. натриевой соли конденсата фенолмочевины и формальдегида и 68 мас.ч. парафинового минерального масла. Таким путем получают стабильную масляную дисперсию.VII. 1 маc.ч. соединения 1.28 растворяют в смеси, состоящей из 70 мас.ч. циклогексанона, 20 мас.ч. этоксилированного изооктилфенола и 10 мас.частей этоксилированного касторового масла. Таким путем получают стабильный эмульсионный концентрат.VIII. 1 маc.ч. соединения 1.28 растворяют в смеси, состоящей из 80 мас.ч. циклогексанона и 20 мас.ч. Emulphor EL (этоксилированное касторовое масло). Таким путем получают стабильный эмульсионный концентрат. Для расширения спектра действия и достижения синергического эффекта производные пиразолилбензоила формулы I можно смешивать с многочисленными представителями других групп действующих веществ, обладающих гербицидными или регулирующими рост свойствами, и использовать их таким образом для совместной обработки. В качестве таких сокомпонентов в смесях для совместной обработки могут служить, например, диазины, 4 Н-3,1 бензоксазинпроизводные, бензотиадиазиноны,2,6-динитроанилины, N-фенилкарбаматы, тиолкарбаматы, галогенкарбоновые кислоты, триазины, амиды, мочевины, дифениловый эфир,триазиноны, урацилы, производные бензофурана, производные циклогексан-1,3-диона, несущие в положении 2, например, карбоксильную или карбиминогруппу, производные хинолинкарбоновой кислоты, имидазолиноны, сульфонамиды, сульфонилмочевины, арилокси-, гетероарилоксифеноксипропионовые кислоты, а также их соли, эфиры и амиды, и другие. Кроме того, может оказаться полезным и целесообразным соединения формулы I инди 001228 26 видуально либо в сочетании с другими гербицидами применять также в смесях с целым рядом других средств защиты растений для совместной обработки, например, со средствами борьбы против вредителей или фитопатогенных грибов,соответственно бактерий. Интерес представляет далее возможность смешения с растворами минеральных солей, предназначенных для компенсации недостатка питательных веществ и микроэлементов. Можно также вводить добавки нефитотоксичных масел и масляных концентратов. Нормы расхода действующих веществ формулы I в зависимости от цели обработки,времени года, обрабатываемых растений и стадии роста составляют от 0,001 до 3,0, предпочтительно от 0,01 до 1,0 кг/га активной субстанции (а.с.). Примеры по применению Гербицидное действие производных пиразолилбензоила формулы I было подтверждено в ходе проведения следующих опытов в теплице. В качестве вегетационных сосудов служили пластиковые цветочные горшки с супесью с содержанием приблизительно 3% гумуса в качестве субстрата. Семена опытных растений высевали раздельно по видам. Предвсходовую обработку суспендированными или эмульгированными в воде действующими веществами проводили непосредственно после высевания с помощью соответствующих сопел, обеспечивающих мелкокапельное опрыскивание. Сосуды подвергали легкому дождеванию с тем, чтобы способствовать прорастанию и росту, после чего сосуды накрывали прозрачными пластиковыми крышками, пока растения не пошли в рост. Такие крышки обеспечивают равномерную всхожесть опытных растений, пока еще не испытывающих воздействия активных субстанций. Для послевсходовой обработки опытные растения в зависимости от экстерьера выращивали сначала до достижения ими высоты от 3 до 15 см и лишь после этого обрабатывали суспендированными или эмульгированными в воде действующими веществами. С этой целью опытные растения либо непосредственно высевали и выращивали в тех же самых сосудах, либо их выращивали сначала отдельно как зародышевые растения, а за несколько дней до обработки пересаживали в сосуды для экспериментов. Растения по видам выдерживали при температурах 10-25 С, соответственно 20-35 С. Опыты проводились в течение 2-4 недель. В течение этого периода времени за растениями вели тщательный уход, определяя при этом их реакцию на каждую из проводимых обработок. Оценку производили по шкале с градацией от 0 до 100. При этом показатель 100 означал,что растения не взошли, соответственно, что имеет место полная гибель, по крайней мере, их надземных частей, а показатель 0 означал, что растения не повреждены или наблюдается их нормальный рост. Таблица 2. Гербицидная активность при послевсходовой обработке в теплице Таблица 3. Гербицидная активность при послевсходовой обработке в теплице. Примеры по получению А) Получение исходных веществ 1. Метиловый эфир 2-хлор-3-формил-4 метилсульфонилбензойной кислоты. а. К суспензии из 286 г (2,14 моля) трихлорида алюминия в 420 мл 1,2-дихлорэтана по каплям добавляли при 15-20 С раствор из 157 г(2 моля) ацетилхлорида в 420 мл 1,2 дихлорэтана. Затем добавляли по каплям раствор из 346 г (2 моля) 2-хлор-6-метилтиотолуола в 1 л 1,2-дихлорэтана. После перемешивания в течение 12 ч реакционную смесь сливали в смесь из 3 л льда и 1 л концентрированного НСl. Затем экстрагировали метиленхлоридом, органическую фазу промывали водой, сушили с помощью сульфата натрия и концентрировали. Остаток перегоняли под вакуумом. Таким путем получили 256 г (60% от теории) 2-хлор-3-метил-4-метилтиоацетофенона, tпл 46 С. б. 163 г (0,76 моля) 2-хлор-3-метил-4 метилтиоацетофенона растворяли в 1,5 л уксусного эфира, смешивали с 18,6 г вольфрамата натрия и при охлаждении добавляли по каплям 173,3 г 30%-ного раствора перекиси водорода. Далее продолжали перемешивание в течение 2 дней, после чего разбавляли водой. Выпавшее твердое вещество отфильтровывали, промывали 28 водой и сушили. Таким путем получили 164 г(88% от теории) 2-хлор-3-метил-4-метилсульфонилацетофенона, tпл 110-111 С. в. 82 г (0,33 моля) 2-хлор-3-метил-4 метилсульфонилацетофенона растворяли в 700 мл диоксана и при комнатной температуре смешивали с 1 л 12,5%-ного раствора гипохлорита натрия. Затем перемешивали в течение 1 ч при 80 С. После охлаждения образовались две фазы,нижнюю из которых разбавляли водой и слегка подкисляли. Выпавшее твердое вещество промывали водой и сушили. Таким путем получили 60 г (73% от теории) 2-хлор-3-метил-4 метилсульфонилбензойной кислоты, tпл 230231 С. г. 100 г (0,4 моля) 2-хлор-3-метил-4 метилсульфонилбензойной кислоты растворяли в 1 л метанола и при температуре дефлегмации в течение 5 ч в раствор подавали газ НСl, после чего концентрировали. Таким путем получили 88,5 г (84% от теории) метилового эфира 2 хлор-3-метил-4-метил-сульфонилбензойной кислоты, tпл 107-108 С. д. 82 г (0,31 моля) метилового эфира 2 хлор-3-метил-4-метил-сульфонилбензойной кислоты растворяли в 2 л тетрахлорметана и при облучении светом порциями смешивали с 56 г(0,31 моля) N-бромсукцинимида. Затем реакционную смесь фильтровали, фильтрат концентрировали и остаток растворяли в 200 мл метилтрет-бутилового эфира. Раствор смешивали с петролейным эфиром, выпавшее твердое вещество отфильтровывали и сушили. Таким путем получили 74,5 г (70% от теории) метилового эфира 3-бромметил-2-хлор-4-метилсульфонилбензойной кислоты, tпл 74-75 С. е. Раствор из 41 г (0,12 моля) метилового эфира 3-бромметил-2-хлор-4-метилсульфонилбензойной кислоты в 250 мл ацетонитрила смешивали с 42,1 г (0,36 моля) N-метилморфолинN-оксида. Смесь в течение 12 ч перемешивали при комнатной температуре, после чего концентрировали и остаток растворяли в уксусном эфире. Раствор экстрагировали водой, сушили с помощью сульфата натрия и концентрировали. Таким путем получили 31,2 г (94% от теории) метилового эфира 2-хлор-3-формил-4-метилсульфонилбензойной кислоты, tпл 98-105 С. 2. Метиловый эфир 2-хлор-4-метилсульфонил-3-(трифторметилсульфонил) оксибензойной кислоты. а. 101 г (0,41 моля) 2-хлор-3-гидрокси-4 метилсульфонилбензойной кислоты растворяли в 1,3 л метанола и при температуре дефлегмации в раствор в течение 4 ч подавали газ НСl. Затем раствор концентрировали, остаток растворяли в дихлорметане и экстрагировали раствором К 2 СО 3. Водную фазу с помощью разбавленной соляной кислоты устанавливали на рН 7 и промывали дихлорметаном. Затем подкисляли до рН 1 и продукт экстрагировали дихлорметаном. Таким путем получили 76,2 г (71% от 29 теории) метилового эфира 2-хлор-3-гидрокси-4 метилсульфонилбензойной кислоты. б. Раствор из 76 г (0,29 моля) метилового эфира 2-хлор-3-гидрокси-4-метилсульфонилбензойной кислоты и 68 г пиридина в 700 мл дихлорметана смешивали при -20 С с 89 г (0,32 моля) ангидрида трифторметансульфоновой кислоты. Раствор продолжали перемешивать в течение 12 ч при комнатной температуре, затем разбавляли дихлорметаном и экстрагировали водой. Органическую фазу сушили над сульфатом магния и концентрировали. Таким путем получили 94 г (82% от теории) метилового эфира 2-хлор-4-метилсульфонил-3-(трифторметилсульфонил) оксибензойной кислоты, tпл 69 С. Б) Получение промежуточных продуктов 1. Метиловый эфир 3-(3-изопропилизоксазол-5-ил)-4-метилсульфонилбензойной кислоты. а. 30 г (102 ммоля) метилового эфира 3 бром-4-метилсульфонилбензойной кислоты, 90 мг дихлорида палладия и 240 мг трифенилфосфина в 200 мл диэтиламина и 60 мл диметилформамида смешивали с 10 г (102 ммоля) (триметилсилил) ацетилена и 180 мг иодида меди(I) и перемешивали в течение 4,5 ч при 40 С. Затем перемешивание продолжали еще в течение 12 ч при комнатной температуре. Далее реакционную смесь фильтровали, фильтрат концентрировали и остаток хроматографировали на силикагеле с использованием толуола в качестве элюента. Таким путем получили 17,3 г (55% от теории) метилового эфира 4-метилсульфонил-3(триметилсилил)этинилбензойной кислоты в виде масла. б. 25 г метилового эфира 4-метилсульфонил-3-(триметилсилил)этинилбензойной кислоты перемешивали со 100 мл метанола и 0,9 г карбоната калия в течение 18 ч при комнатной температуре. Затем отфильтровывали от твердого вещества, концентрировали и экстрагировали смесью уксусный эфир-вода. Органическую фазу сушили над сульфатом натрия и концентрировали. Таким путем получили 15 г (79% от теории) метилового эфира 4-метилсульфонил-3 этинилбензойной кислоты, tпл 95-98 С. в. 13,5 г (57 ммолей) метилового эфира 4 метилсульфонил-3-этинилбензойной кислоты растворяли в 50 мл дихлорметана, смешивали с 5,2 г (60 ммолей) изобутиральдегидоксима и по каплям добавляли 41 г 12,5%-ного раствора гипохлорита натрия. Затем продолжали перемешивание в течение 24 ч при комнатной температуре. Далее реакционную смесь экстрагировали дихлорметаном-водой, органическую фазу концентрировали и остаток хроматографировали на силикагеле с помощью толуола-уксусного эфира в качестве элюентов. Таким путем получили 8,8 г (48% от теории) метилового эфира 3-(3 изопропилизоксазол-5-ил)-4-метилсульфонилбензойной кислоты, tпл 102-104 С. 30 2. Метиловый эфир 2-хлор-3-(изоксазол-3 ил)-4-метилсульфонилбензойной кислоты. а. 15 г (54 ммоля) метилового эфира 2 хлор-3-формил-4-метилсульфонилбензойной кислоты (пример A.I.) и 4,2 г (60 ммолей) гидроксиламингидрохлорида перемешивают с 300 мл метанола и по каплям добавляют раствор из 3,18 г (30 ммолей) карбоната натрия в 80 мл воды. Реакционную смесь перемешивают в течение ночи при комнатной температуре, после чего метанол отгоняют и смесь экстрагируют простым эфиром-водой. Эфирную фазу сушат над сульфатом натрия и концентрируют. Таким путем получают 14,4 г (91% от теории) метилового эфира 2-хлор-3-гидроксииминометил-4 метилсульфонил-бензойной кислоты, tпл 126128 С. б. 5,3 г (18 ммолей) метилового эфира 2 хлор-3-гидроксииминометил-4-метилсульфонилбензойной кислоты растворяют в 50 мл дихлорметана и при 0-5 С в течение 30 мин в раствор подают ацетилен. Затем смешивают с ацетатом натрия, добавляемым на кончике шпателя, и продолжая подачу ацетилена, по каплям добавляют при 10 С 15 мл 10%-ного раствора гипохлорита натрия. После введения этой добавки продолжают подачу ацетилена еще в течение 15 мин при 10 С и затем в течение 12 ч продолжают перемешивание. Далее фазы разделяют, органическую фазу промывают водой,сушат с помощью сульфата натрия и концентрируют. Таким путем получают 4,8 г (84% от теории) метилового эфира 2-хлор-3-(изоксазол 3-ил)-4-метилсульфонилбензойной кислоты, tпл 145-147 С. 3. Метиловый эфир 2-хлор-3-(тиазол-2-ил)4-метилсульфонилбензойной кислоты. 33 г (88 ммолей) 2-(трибутилстаннил) тиазола, 17,5 г (44 ммоля) метилового эфира 2 хлор-4-метилсульфонил-3-(трифторметилсульфонил)оксибензойной кислоты (пример А.2.),5,8 г хлорида лития, 1 г тетракис-(трифенилфосфин) палладия (0), щепотку (на кончике шпателя) 2,6-ди-трет-бутил-4-метилфенола и 200 мл 1,4-диоксана перемешивают в автоклаве в течение 3 ч при 140 С при собственном давлении. После охлаждения реакционную смесь отфильтровывают через слой силикагеля, промывают метил-трет-бутиловым эфиром и концентрируют. Остаток хроматографируют на силикагеле с помощью толуола-уксусного эфира в качестве элюентов. Таким путем получают 9,1 г(62,6% от теории) метилового эфира 2-хлор-3(тиазол-2-ил)-4-метилсульфонилбензойной кислоты, tпл 135-138 С. 4. Метиловый эфир 2-хлор-3-(оксазол-5 ил)-4-метилсульфонилбензойной кислоты. 25 г (0,09 моля) метилового эфира 2-хлор 3-формил-4-метилсульфонил-бензойной кислоты (пример A.1.), 17,6 г (0,09 моля) тозилметиленизоцианида и 6,2 г (0,045 моля) тонкоизмельченного порошкообразного карбоната ка 31 лия перемешивают с 450 мл метанола в течение 5 ч при температуре дефлегмации. Затем удаляют растворитель, остаток растворяют в уксусном эфире и экстрагируют водой. Уксусноэфирную фазу сушат с помощью сульфата натрия и концентрируют. Таким путем получают 24,7 г (87% от теории) метилового эфира 2 хлор-3-(оксазол-5-ил)-4-метилсульфонилбензойной кислоты, 1 Н-ЯМР (CDCl3) : 8,24 (d, 1H),8,15 (s, 1H), 8,01 (d, 1H), 7,40 (s, 1H), 4,0 (s, 3H),2,96 (s, 3H). Аналогичным путем получают промежуточные продукты, представленные в нижеследующей таблице. Таблица 4 32 а. 1,22 г (10,9 ммоля) 1,3-диметил-5 гидроксипиразола и 1,1 г (10,9 ммолей) триэтиламина растворяют в 75 мл ацетонитрила и при 0 С смешивают с 3,5 г (10,9 ммолей) 2-хлор-4 метилсульфонил-3-(оксазол-5-ил)бензоилхлорида в 50 мл ацетонитрила. Затем продолжают перемешивание в течение 1 ч при 0 С, после чего при комнатной температуре добавляют по каплям 4,45 г (44 ммоля) триэтиламина и 0,61 г(7,2 ммолей) ацетоциангидрина. Раствор перемешивают в течение 12 ч при комнатной температуре. Для дальнейшей переработки сначала смешивают с разбавленной соляной кислотой и экстрагируют метил-трет-бутиловым эфиром. Затем эфирную фазу экстрагируют 5%-ным раствором карбоната калия. Из водной фазы после подкисления соляной кислотой продукт экстрагируют уксусным эфиром. Уксусно-эфирную фазу сушат с помощью сульфата натрия и концентрируют. Таким путем получают 1,2 г сырого продукта, который очищают посредством хроматографии на колонке. В результате получают 0,4 г (27% от теории) 1,3-диметил-4-[2 хлор-4-метилсульфонил-3-(оксазол-5-ил)бензоил]-5-гидроксипиразола, tпл 236-241 С. Аналогичным путем получают соединения,представленные в нижеследующей таблице. Таблица 5 В) Получение конечных продуктов 1. 1,3-диметил-4-[2-хлор-4-метилсульфонил-3-(оксазол-5-ил)бензоил]-5-гидроксипиразол (пример 1.28). в которой заместители имеют следующие значения:Z обозначает 5-членный гетероциклический остаток, содержащий от одного до двух гетероатомов, выбранных из группы, включающей кислород, серу или азот, который необязательно замещен С 1-С 4 алкилом;Q обозначает присоединенное в положении 4 пиразольное кольцо формулы IIR2 обозначает водород, С 1-С 4 алкил или галоС 1-С 4 алкил иR3 обозначает водород, С 1-С 4 алкилсульфонил, фенилсульфонил; а также пригодные для применения в сельском хозяйстве соли соединений формулы I. 2. Производные пиразол-4-илбензоила по п.1 формулы Iа в которой L обозначает С 1-С 4 алкилсульфонил,галоген, нитро; М обозначает С 1-С 4 алкил, С 1-С 4 алкилтио,галоген, а Q и Z имеют значения, указанные в п.1. 4. Производные пиразол-4-илбензоила формулы I по п.1, в которой радикал L обозначает водород, метилсульфонил, хлор, нитрогруппу; М обозначает водород, метил, метилтио, хлор. 5. Гербицидный препарат, содержащий, по крайней мере, одно производное пиразол-4 илбензоила формулы I по п.1 и обычные инертные добавки. Евразийский патент действует на территории всех Договаривающихся государств кроме АМ,МD.
МПК / Метки
МПК: A01N 43/56, C07D 409/10
Метки: качестве, пиразол-4-илбензоила, гербицидов, производные, применение
Код ссылки
<a href="https://eas.patents.su/18-1228-proizvodnye-pirazol-4-ilbenzoila-i-ih-primenenie-v-kachestve-gerbicidov.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пиразол-4-илбензоила и их применение в качестве гербицидов</a>
Предыдущий патент: Дисперсии арамидных волокон и арамидное бумажное полотно
Следующий патент: Дозирующий аэрозольный клапан.
Случайный патент: Оборудование и способ приема вызова в системе cdma












