Пептидные ингибиторы вируса гепатита с
Номер патента: 4765
Опубликовано: 26.08.2004
Авторы: Гудреу Натали, Пупар Марк-Андре, Камерон Даль, Тсантризо Иула С., Гиро Элиза, Ранкур Жан, Байли Мюррей Д., Ллина-Брюне Монсе
Формула / Реферат
1. Рацематы, диастериоизомеры и оптические изомеры соединения формулы (I)
 ,
,
в которой a равно 0 или 1,
b обозначает 0 или 1,
Y обозначает H или C1-C6алкил,
B обозначает H, ацильное производное формулы R7-C(O)- или сульфонил формулы R7-SO2, где
R7 обозначает C1-C10алкил, необязательно замещенный карбоксилом, C1-C6аланоилокси- или C1-C6алкоксигруппой, C6- или C10арил или C7-C16аралкил, необязательно замещенный C1-C6алкилом, гидрокси- или аминогруппой, необязательно замещенной C1-C6алкилом или Het, необязательно замещенный C1-C6алкилом, гидрокси- или аминогруппой, необязательно замещенной C1-C6алкилом, или амидиногруппой, необязательно замещенной C1-C6алкилом,
R6 при его наличии обозначает C1-C6алкил, замещенный карбоксилом,
R5 при его наличии обозначает C1-C6алкил, необязательно замещенный карбоксилом,
R4 обозначает C1-C10алкил, C3-C7циклоалкил или C4-C10(алкилциклоалкил),
R3 обозначает C1-C10алкил, C3-C7циклоалкил или C4-C10(алкилциклоалкил),
R2 обозначает CH2-R20 или O-R20, где
R20 обозначает насыщенный или ненасыщенный C3-C7циклоалкил или C4-C10(алкилциклоалкил), необязательно моно-, ди- или тризамещенный радикалом R21 или
R20 обозначает C6- или C10арил или C7-C16аралкил, необязательно моно-, ди- или тризамещенный радикалом R21, или
R20 обозначает Het или (низш.)алкил-Het, необязательно моно-, ди- или тризамещенный радикалом R21, где
R21, в каждом случае независимо, обозначает C1-C6алкил, C1-C6алкокси-, галоген, галоалкил, амидогруппу, необязательно монозамещенную C1-C6алкилом, C6- или C10арилом, C7-C16аралкилом, Het или (низш.)алкил-Het, C6- или C10арил или Het, где арил или Het необязательно замещены радикалом R22, где
R22 обозначает C1-C6алкил,
R1 обозначает C1-C6алкил или C2-C6алкенил, необязательно замещенный галогеном, и
W обозначает гидрокси или N-замещенную аминогруппу,
и его фармацевтически приемлемая соль или сложный эфир;
причем Het обозначает 6- или 10-членный содержащий азот гетероцикл.
2. Соединение по п.1, в котором B обозначает H или ацильное производное формулы R7-C(O)-, где R7 обозначает C1-C6алкил, C1-C6алкокси, амидиногруппу, необязательно замещенную C1-C6алкилом или Het, C6- или C10арил, C7-C16аралкил или Het, все необязательно замещенные C1-C6алкилом или гидроксигруппой.
3. Соединение по п.2, в котором R7 обозначает C1-C6алкил или Het.
4. Соединение по п.3, в котором Het выбирают из группы, включающей
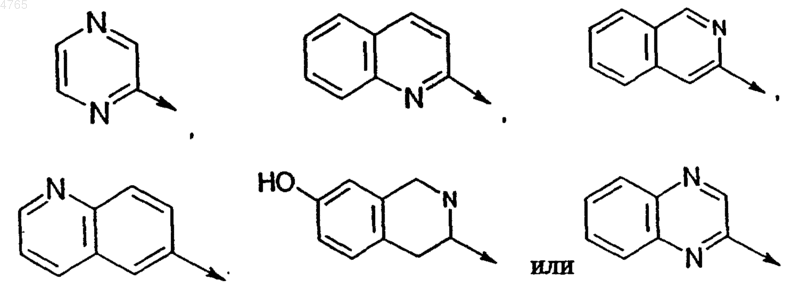 .
.
5. Соединение по п.2, в котором B выбирают из группы, включающей H, ацетил,
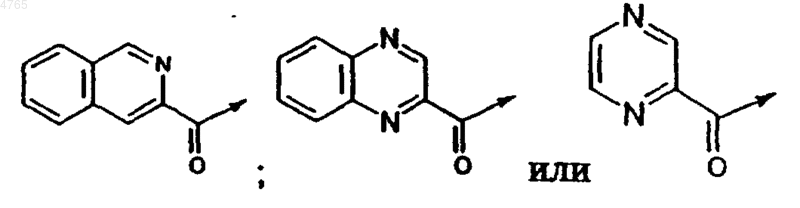 .
.
6. Соединение по п.5, в котором B обозначает ацетил.
7. Соединение по п.1, в котором B обозначает R7-SO2, а R7 обозначает C6- или C10арил, C7-C16аралкил или Het, все необязательно замещенные C1-C6алкилом.
8. Соединение по п.1, в котором R6, если он присутствует, обозначает боковую цепь Asp или Glu.
9. Соединение по п.8, в котором R6, если он присутствует, обозначает боковую цепь Asp.
10. Соединение по п.1, в котором a равно 0, и в этом случае R6 отсутствует.
11. Соединение по п.1, в котором R5, если он присутствует, обозначает боковую цепь аминокислоты, выбранной из группы, включающей D-Asp, L-Asp, D-Glu, L-Glu, D-Val, L-Val, D-трет-бутилглицин (Tbg) и L-Tbg.
12. Соединение по п.11, в котором R5, если он присутствует, обозначает боковую цепь D-Asp, D-Val или D-Glu.
13. Соединение по п.12, в котором R5, если он присутствует, обозначает боковую цепь D-Glu.
14. Соединение по п.1, в котором a равно 0, b равно 0, и в этом случае R6 и R5 отсутствуют.
15. Соединение по п.1, в котором R4 обозначает боковую цепь аминокислоты, выбранной из группы, включающей Val, циклогексилглицин (Chg), Tbg, Ile или Leu.
16. Соединение по п.15, в котором R4 обозначает боковую цепь Chg или Ile.
17. Соединение по п.16, в котором R4 обозначает боковую цепь Chg.
18. Соединение по п.1, в котором Y обозначает H или Me.
19. Соединение по п.18, в котором Y обозначает H.
20. Соединение по п.1, в котором R3 обозначает боковую цепь аминокислоты, выбранной из группы, включающей Ile, Chg, Val и Tbg.
21. Соединение по п.20, в котором R3 обозначает боковую цепь Val, Chg или Tbg.
22. Соединение по п.21, в котором R3 обозначает боковую цепь Val или Tbg.
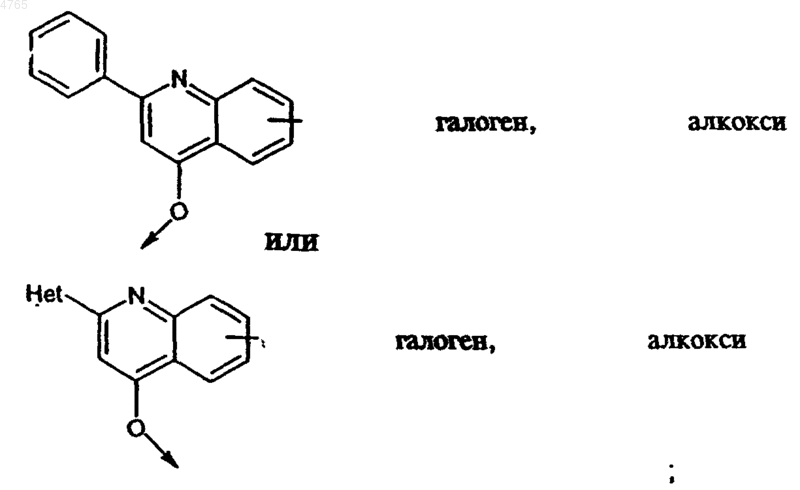
23. Соединение по п.1, в котором R2 обозначает O-R20, где R20 обозначает C6- или C10арил, C7-C16аралкил, Het или -CH2-Het, все необязательно моно-, ди- или тризамещенные радикалом R21, где R21 обозначает C1-C6алкил, C1-C6алкокси-, амидогруппу, необязательно монозамещенную C1-C6алкилом, C6- или C10арилом C7-C16аралкилом, Het или (низш.)алкил-Het, или означает галоген, трифторметил, C6- или C10арил или Het, где арил, аралкил или Het необязательно замещены радикалом R22, где R22 обозначает C1-C6алкил.
24. Соединение по п.23, в котором R21 обозначает C1-C6алкил, C1-C6алкокси-, (низш.)алкиламид, C6- или C10арил или Het.
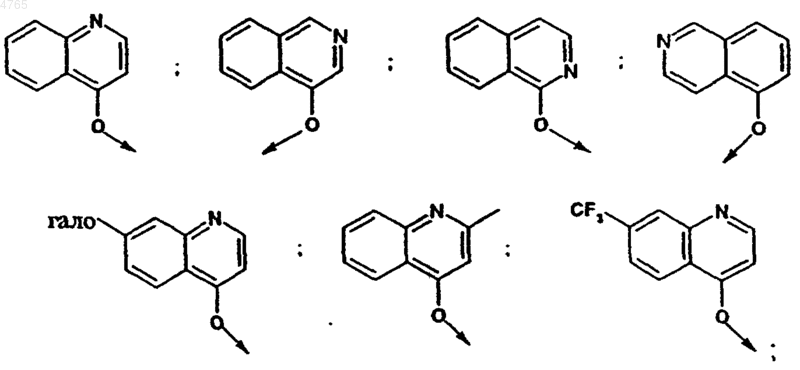
25. Соединение по п.23, в котором R2 обозначает 1-нафтилметокси-, 2-нафтилметокси-, бензилокси-, 1-нафтилокси-, 2-нафтилокси- или хинолиноксигруппу, незамещенную, моно- или дизамещенную радикалом R21, где R21 имеет значения, указанные в п.23.
26. Соединение по п.23, в котором R2 обозначает 1-нафтилметокси- или хинолиноксигруппу, незамещенную, моно- или дизамещенную радикалом R21, где R21 имеет значения, указанные в п.23.
27. Соединение по п.26, в котором R2 обозначает
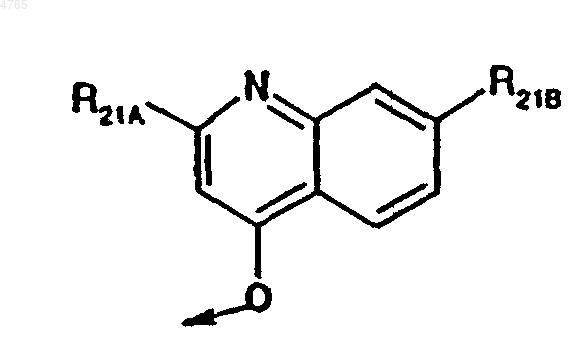 ,
,
где R21A обозначает амидогруппу, необязательно замещенную C1-C6алкилом, C6- или C10арилом, C7-C16аралкилом или Het, C6- или C10арил или Het, R21B обозначает C1-C6алкил, C1-C6алкокси-, (низш.)алкиламид, галоген или трифторметил.
28. Соединение по п.27, в котором R21A обозначает C6- или C10арил или Het.
29. Соединение по п.27, в котором R21B обозначает C1-C6алкокси.
30. Соединение по п.29, в котором R21B обозначает метокси.
31. Соединение по п.1, в котором асимметричный атом углерода в положении 1 имеет R-конфигурацию, представленную следующими абсолютными конфигурациями:
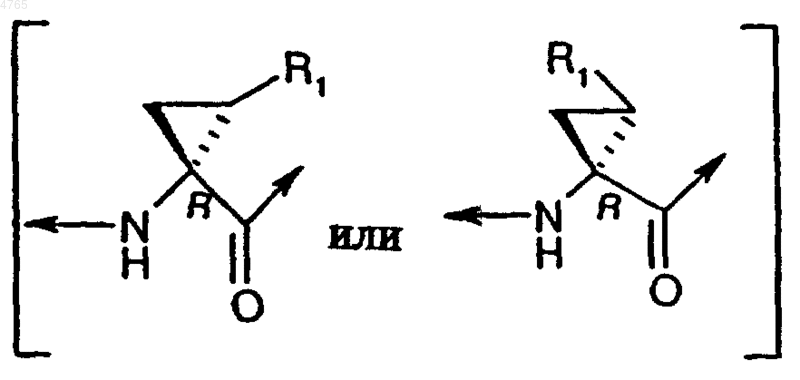 ,
,
где R1 имеет значения, указанные в п.1.
32. Соединение по п.31, в котором заместитель R1 в положении 1 (P1) находится в син-ориентации относительно карбонильной группы, как это представлено следующей абсолютной конфигурацией:
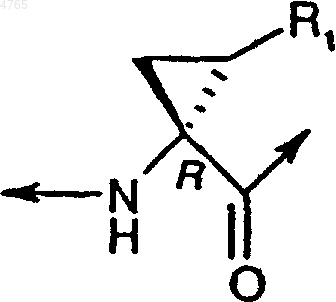 ,
,
где R1 обозначает метил, этил, пропил, винил, все необязательно замещенные галогеном.
33. Соединение по п.32, в котором R1 обозначает этил, винил или бромвинил.
34. Соединение по п.33, в котором R1 обозначает винил.
35. Соединение по п.1, в котором W обозначает гидроксигруппу или (низш.)алкиламино-, ди(низш.)алкиламино- или аралкиламиногруппу, или его фармацевтически приемлемая соль или сложный эфир.
36. Соединение по п.33, в котором W обозначает гидроксигруппу или N(R13a)R13b, где R13a и R13b независимо друг от друга обозначают H, арил или C1-C6алкил, необязательно замещенный гидроксигруппой или фенилом, или его фармацевтически приемлемая соль.
37. Соединение по п.36, в котором W обозначает -OH, -NH-бензил или -NH-CH(Me)Ph.
38. Соединение по п.37, в котором W обозначает -OH, -NH-(S)CH(Me)-фенил.
39. Соединение по п.38, в котором W обозначает сложный эфир, причем этот сложный эфир выбирают из группы, включающей C1-C6алкокси, фенокси или арил(C1-C6алкокси).
40. Соединение по п.39, в котором сложный эфир представляет собой метокси, этокси, фенокси, бензилокси или PhCH(Me)-O-.
41. Соединение формулы I по п.1, в котором
B обозначает H, (низш.)алкил-C(O)- или Het-C(O)-,
R6 при его наличии обозначает боковую цепь Asp или Glu,
R5 при его наличии обозначает боковую цепь D- или L-Asp, -Glu, -Val или -Tbg,
Y обозначает H или метил,
R4 обозначает боковую цепь Val, Chg, Tbg, Ile или Leu,
R3 обозначает водород или боковую цепь Ile, Chg, Val или Tbg,
R2 обозначает 1-нафтилметокси, 2-нафтилметокси, O-Bn,
P1 обозначает циклопропильную кольцевую систему формулы
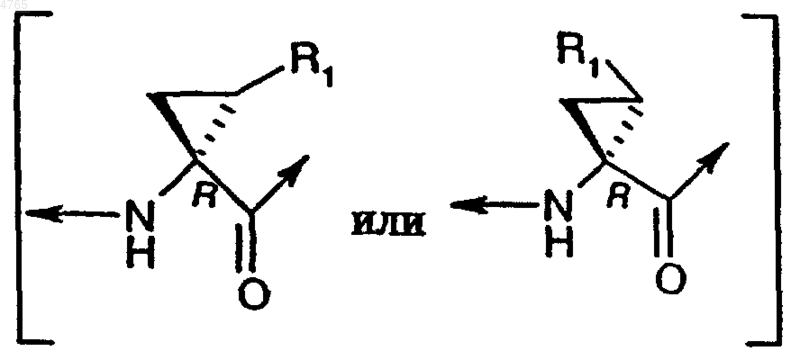 ,
,
где R1 обозначает этил, винил или бромвинил и
W обозначает гидроксигруппу или N(R13a)R13b, где R13a и R13b независимо друг от друга обозначают H, арил или C1-C6алкил, необязательно замещенный гидроксигруппой или фенилом,
или его фармацевтически приемлемая соль или сложный эфир.
42. Соединение формулы I по п.1, в котором B обозначает H, ацетил или Het-C(O)-, R6, если он присутствует, обозначает боковую цепь Asp, R5, если он присутствует, обозначает боковую цепь D-Asp, D-Glu или D-Val, Y обозначает H, R4 обозначает боковую цепь Chg или Ile, R3 обозначает боковую цепь Val, Chg или Tbg, R2 обозначает 1-нафтилметокси-, бензилокси-, 4-хинолинокси- или
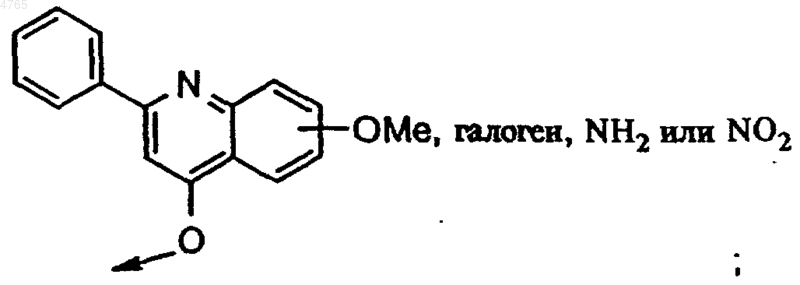
P1 обозначает циклопропильную кольцевую систему формулы
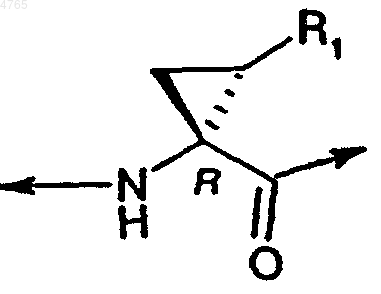
где R1 обозначает Et или CH=CH2 или CH=CHBr, и W обозначает гидроксигруппу или -NH-(S)CH(Me)Ph,
или его фармацевтически приемлемая соль.
43. Соединение формулы I по п.1, в котором B обозначает ацетил, R6, если он присутствует, обозначает боковую цепь Asp, R5, если он присутствует, обозначает боковую цепь D-Glu, Y обозначает H, R4 обозначает боковую цепь Chg, R3 обозначает боковую цепь Val или Tbg, R2 обозначает
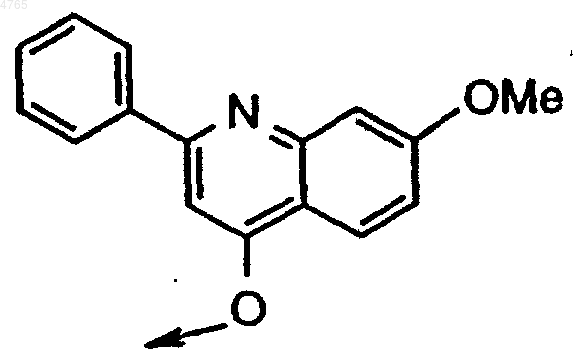
P1 обозначает
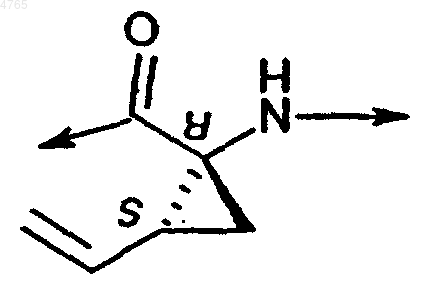
W обозначает гидроксигруппу, или его фармацевтически приемлемая соль.
44. Соединение по п.41, представленное формулой
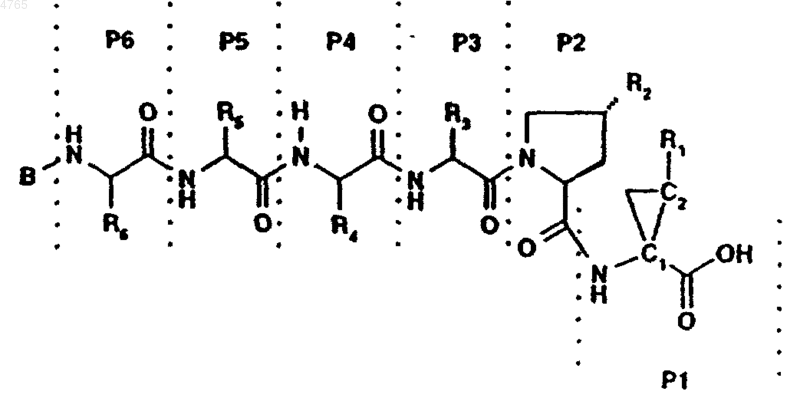 ,
,
где B, P6, P5, P4, P3, R2 и R1 имеют значения, указанные в следующей таблице:
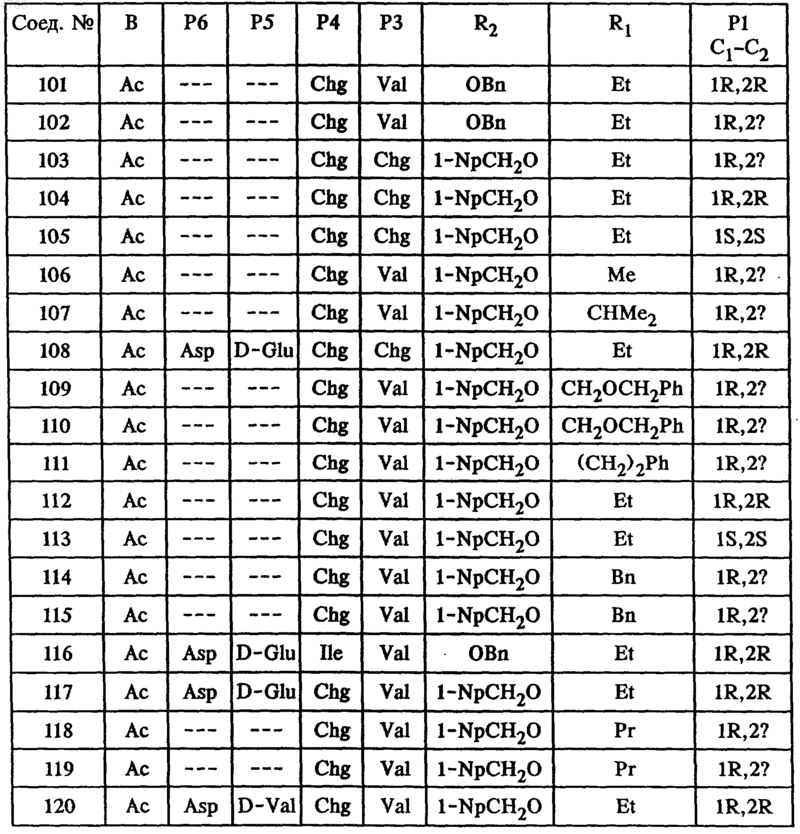
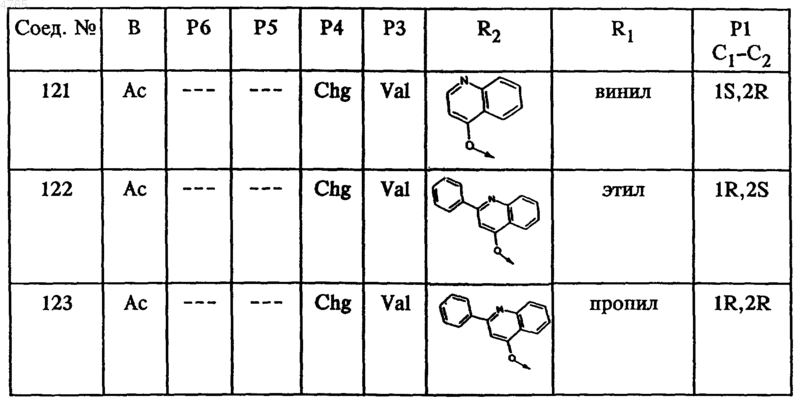
45. Соединение по п.41, представленное формулой
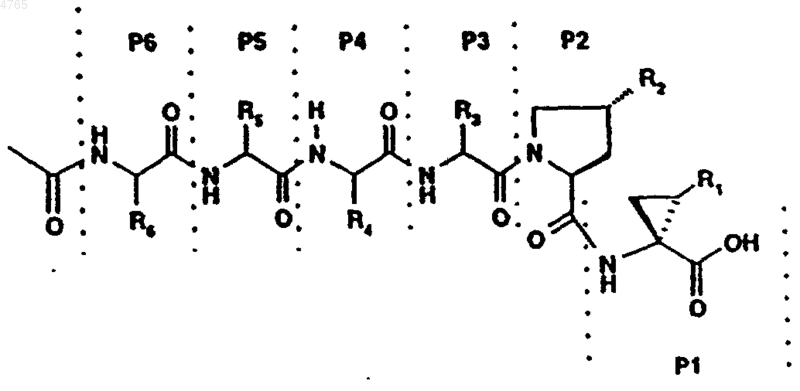 ,
,
где P6, P5, P4, P3, R2 и R1 имеют значения, указанные в следующей таблице:
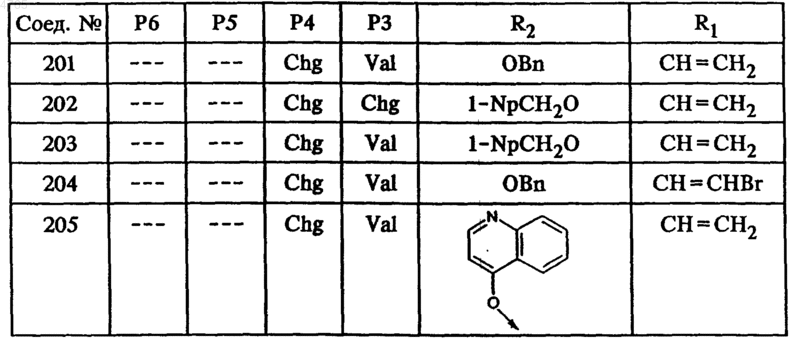
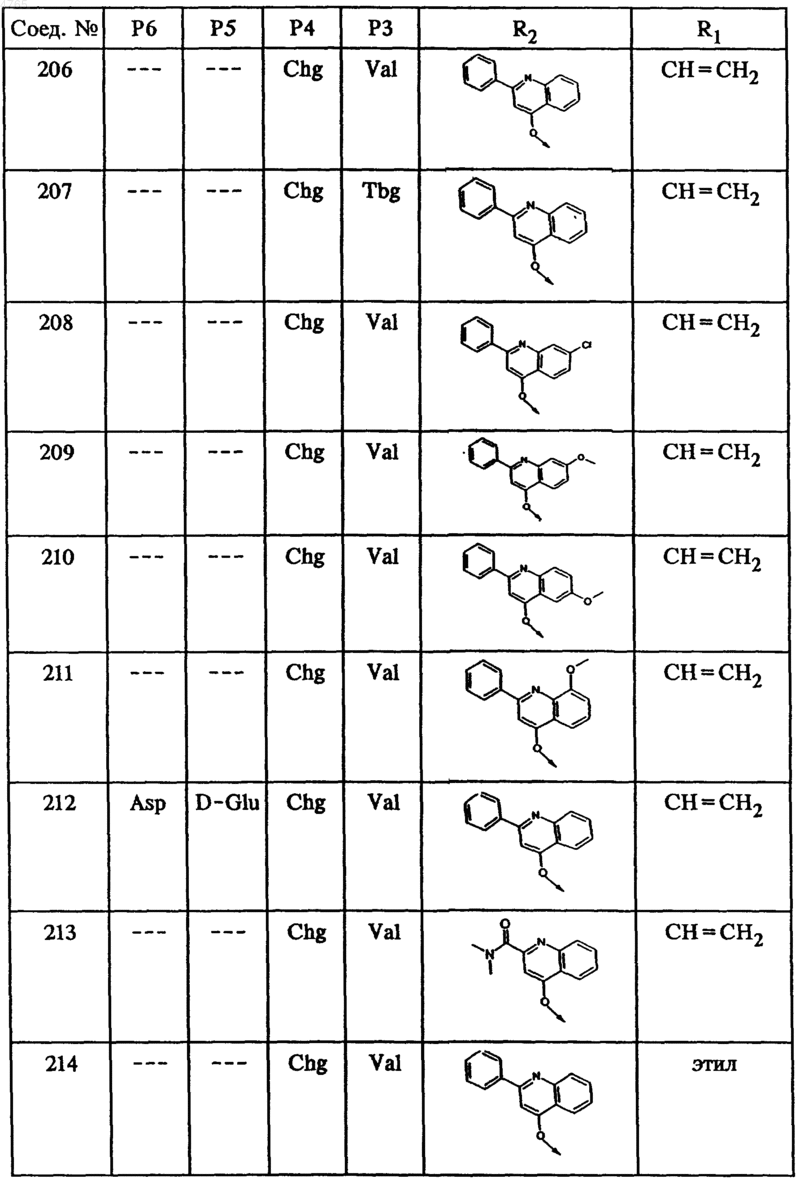
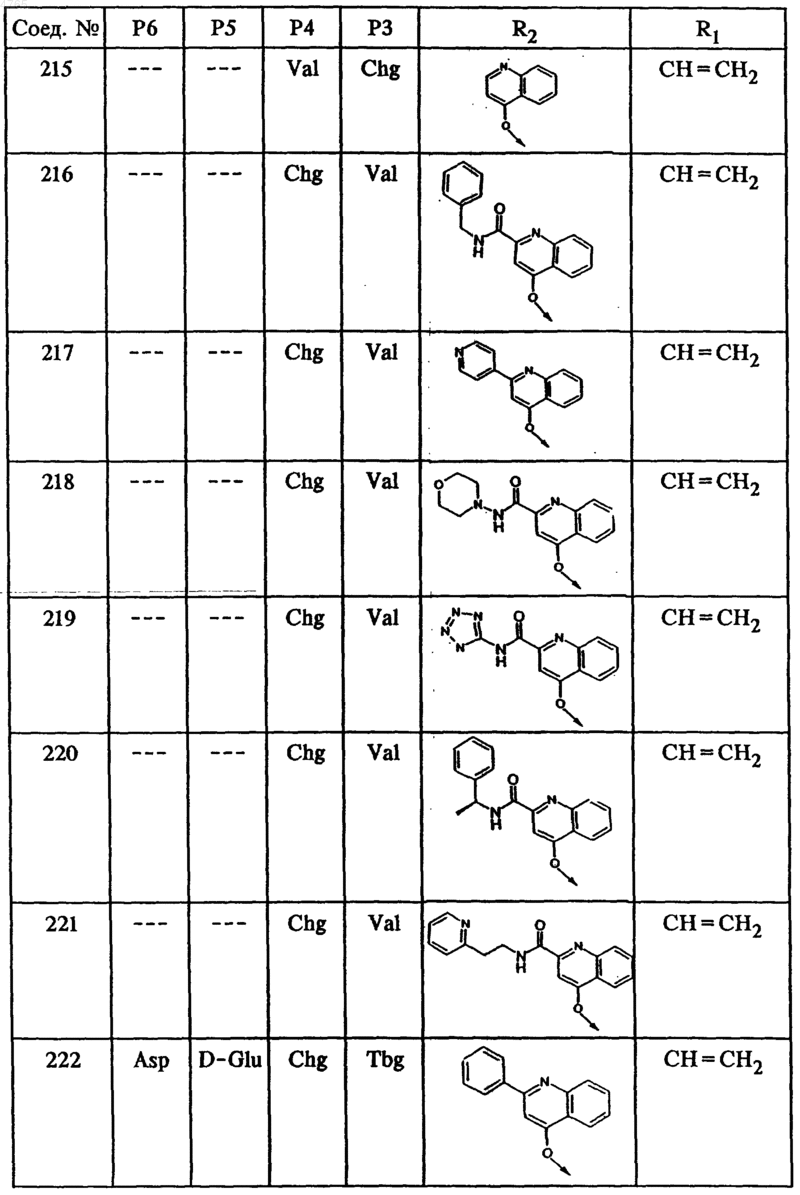
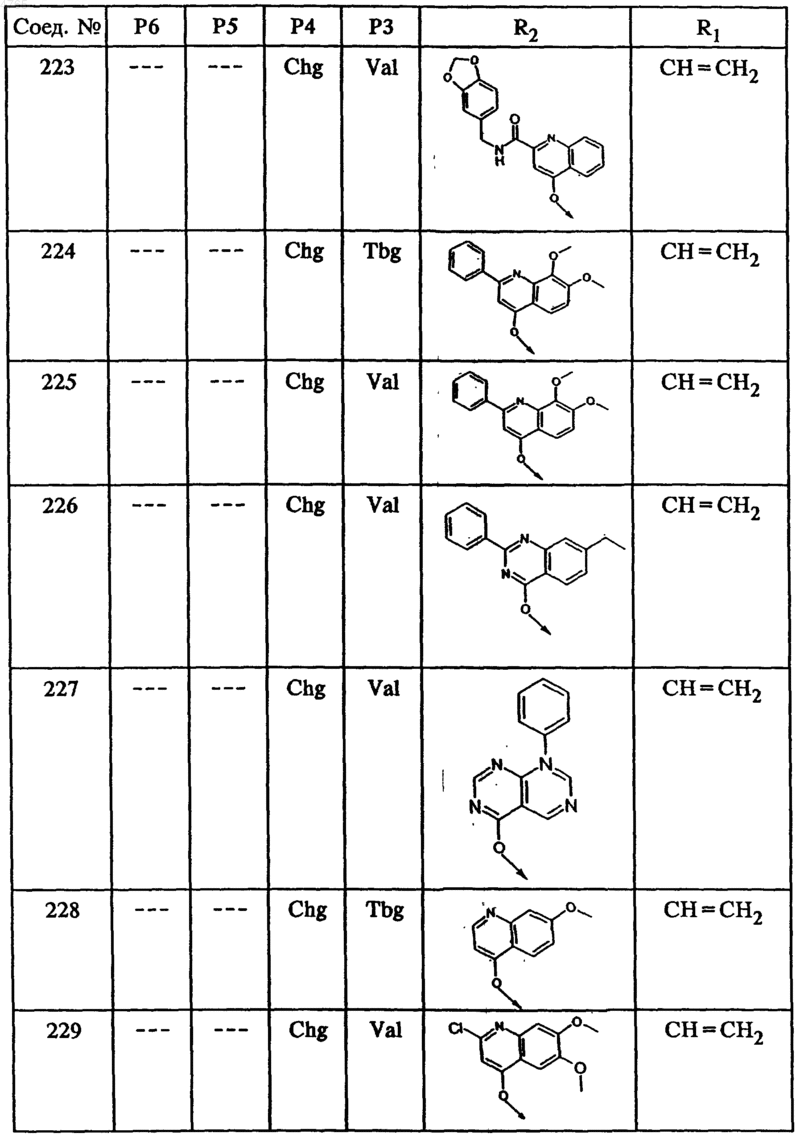
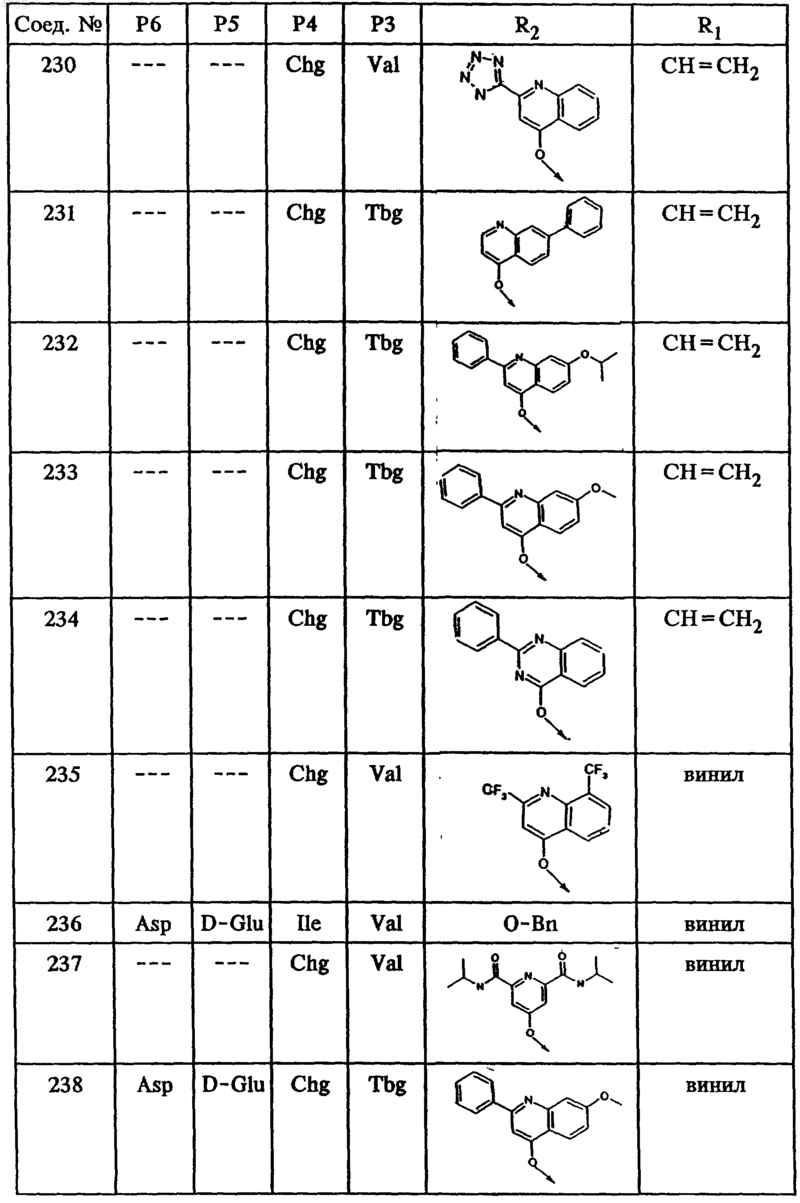
46. Соединение по п.41, представленное формулой
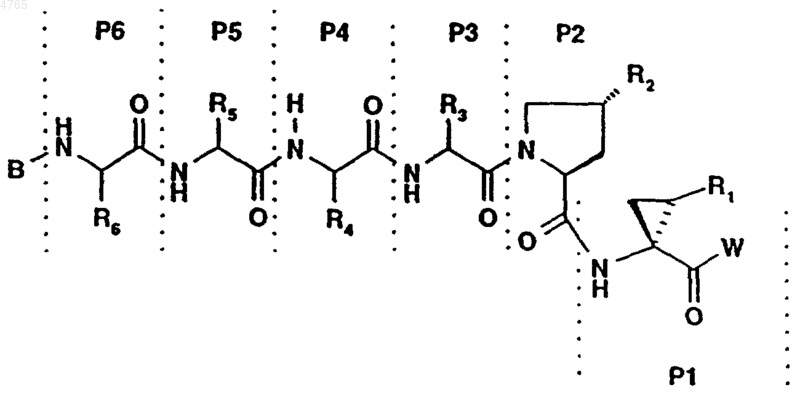 ,
,
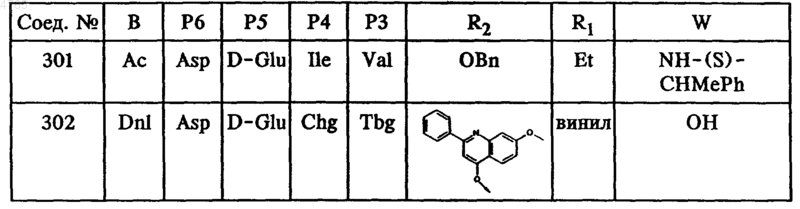
где B, P6, P5, P4, P3, R2, R1 и W имеют значения, указанные в следующей таблице
47. Соединение по п.41, представленное формулой
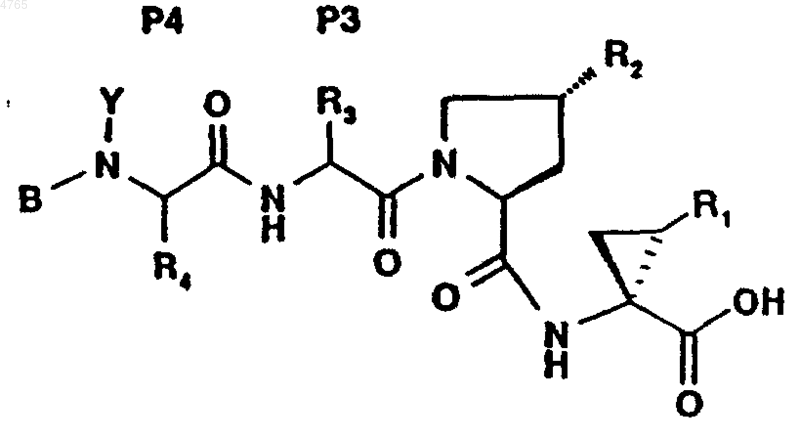 ,
,
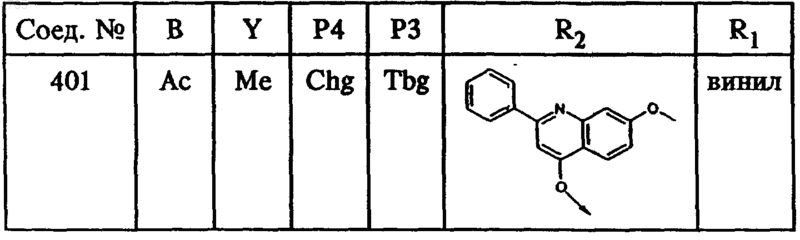
где B, Y, P4, P3, R2 и R1 имеют значения, указанные в следующей таблице:
48. Соединение по п.41, представленное формулой
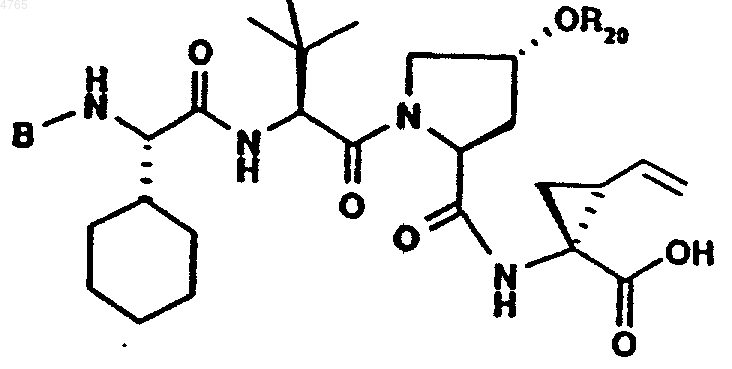 ,
,
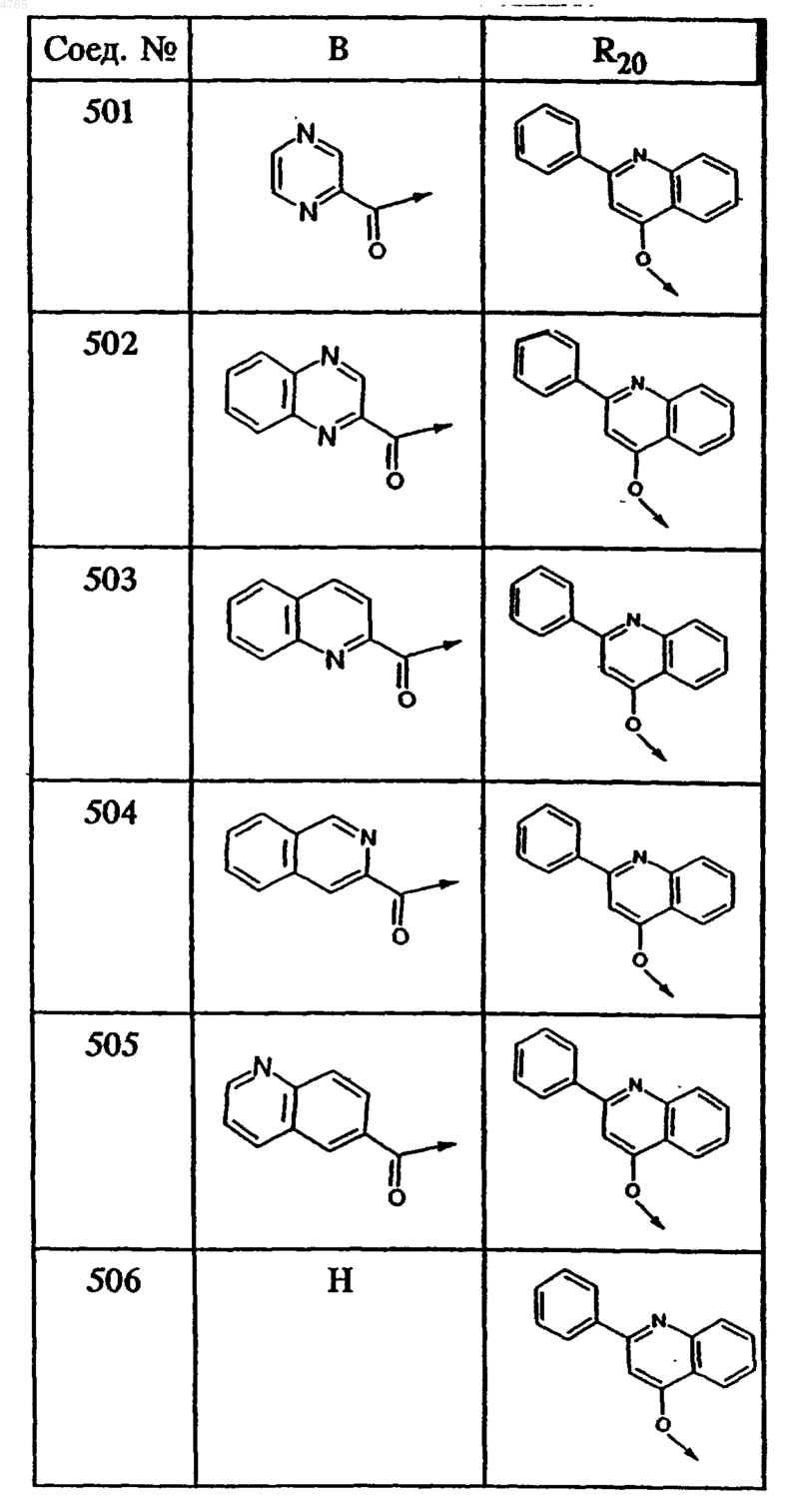
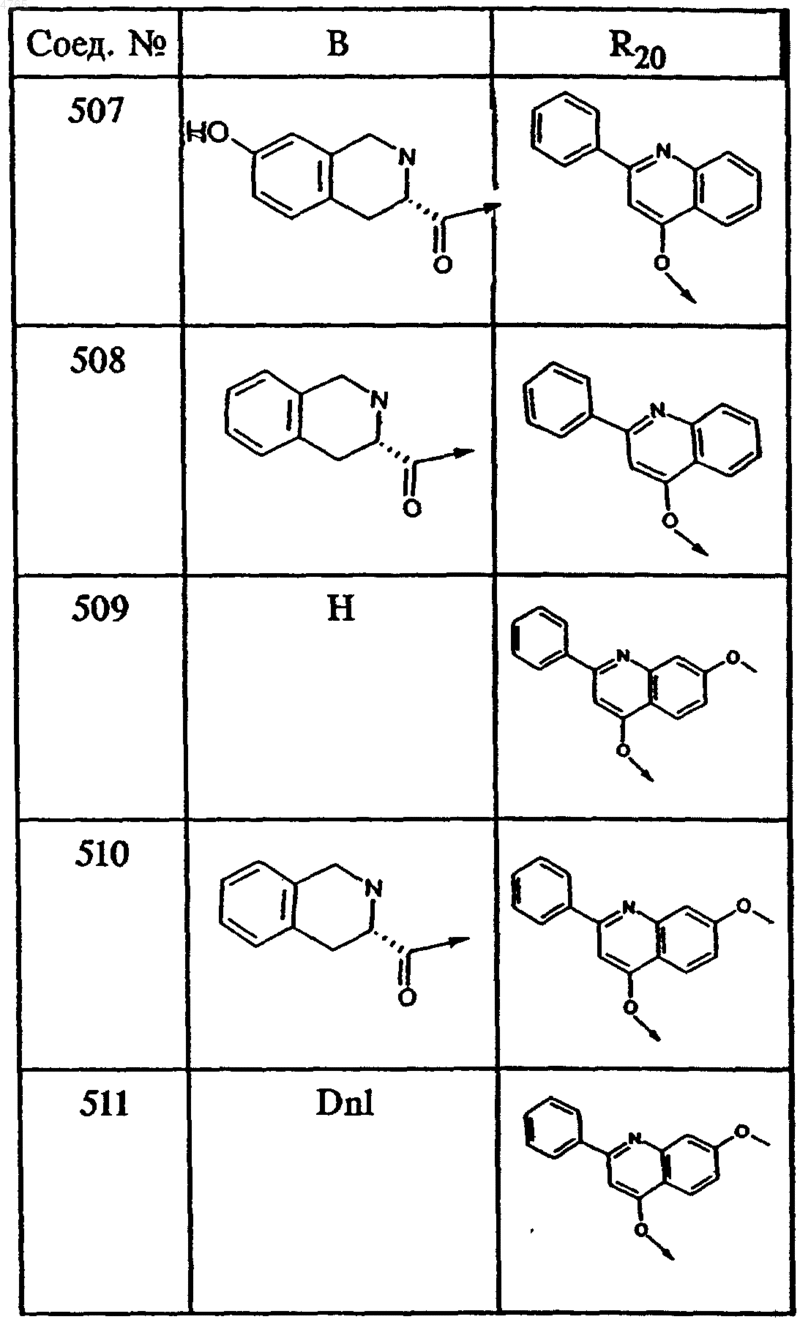
где B и R20 имеют значения, указанные в следующей таблице
49. Гексапептид формулы I по п.44, выбранный из группы, включающей соединения ьь 108, 116, 117 и 120.
50. Гексапептид формулы I по п.45, выбранный из группы, включающей соединения ьь 212, 222, 236 и 238.
51. Гексапептид формулы I по п.46, выбранный из группы, включающей соединения ьь 301 и 302.
52. Тетрапептид формулы I по п.44, выбранный из группы, включающей соединения ьь 122 и 123.
53. Тетрапептид формулы I по п.45, выбранный из группы, включающей соединения ьь 202, 203, 205, 206, 207, 208, 209, 210, 211, 214, 215, 216, 218, 219, 220, 221, 223, 224, 225, 226, 228, 229, 230, 231, 232, 233, 234 и 235.
54. Тетрапептид формулы I по п.46, выбранный из группы, включающей соединение ь 401.
55. Тетрапептид формулы I по п.48, выбранный из группы, включающей соединения ьь 501, 502, 503, 504, 505, 506, 507, 508, 509, 510 и 511.
56. Способ ингибирования репликации вируса гепатита C путем обработки вируса ингибирующим NS3-протеазу вируса гепатита C количеством соединения формулы I по п.1 или его терапевтически приемлемой соли либо сложного эфира.
57. Способ получения пептидного аналога формулы (I) по п.1, где P1 представляет собой остаток замещенной аминоциклопропилкарбоновой кислоты, предусматривающий сочетание пептида, выбранного из ряда, включающего APG-P6-P5-P4-P3-P2, APG-P5-P4-P3-P2, APG-P4-P3-P2, APG-P3-P2 и APG-P2, с P1-промежуточным продуктом формулы
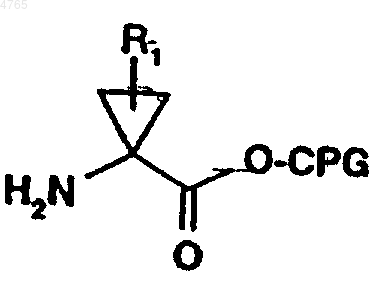
где R1 обозначает C1-C6алкил или C2-C6алкенил, необязательно замещенный галогеном, CPG обозначает карбоксильную защитную группу, а P6-P2 имеют значения, указанные в п.1.
58. Способ получения пептидного аналога формулы (I) по п.1, где P1 представляет собой остаток замещенной аминоциклопропилкарбоновой кислоты, предусматривающий сочетание пептида, выбранного из ряда, включающего APG-P6-P5-P4-P3-P2, APG-P5-P4-P3-P2, APG-P4-P3-P2, APG-P3-P2 и APG-P2, с P1-промежуточным продуктом формулы
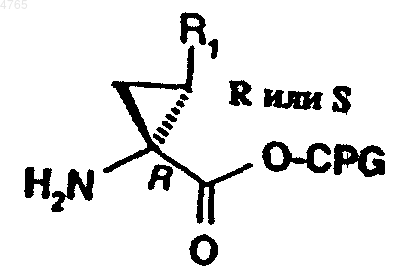
где R1 обозначает этил, винил или бромвинил, CPG обозначает карбоксильную защитную группу, а P6-P2 имеют значения, указанные в п.1.
59. Способ получения пептидного аналога формулы (I) по п.1, где P1 представляет собой остаток замещенной аминоциклопропилкарбоновой кислоты, предусматривающий сочетание пептида, выбранного из ряда, включающего APG-P6-P5-P4-P3-P2, APG-P5-P4-P3-P2, APG-P4-P3-P2, APG-P3-P2 и APG-P2, с P1-промежуточным продуктом формулы
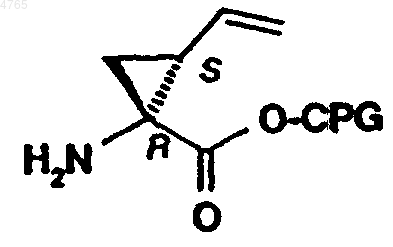
где CPG обозначает карбоксильную защитную группу, а P6-P2 имеют значения, указанные в п.1.
60. Способ по пп.57, 58 или 59, где карбоксильную защитную группу (CPG) выбирают из ряда, включающего сложные алкиловые эфиры, сложные аралкиловые эфиры и сложные эфиры, которые расщепляются при обработке слабыми основаниями или в мягких восстановительных условиях.
61. Применение аминокислотного аналога формулы
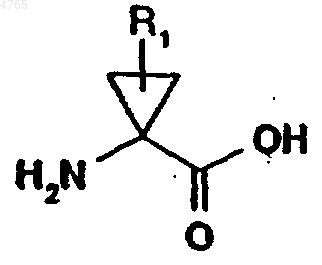
где R1 обозначает C1-C6алкил или C2-C6алкенил, необязательно замещенный галогеном, для получения соединения формулы I по п.1.
62. Применение аминокислотного аналога формулы
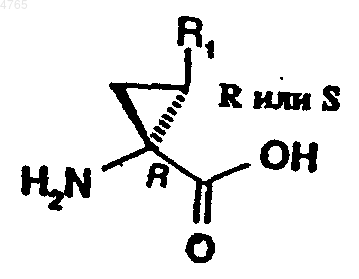
где R1 обозначает этил, винил или бромвинил, для получения соединения формулы I по п.1.
63. Применение аминокислотного аналога формулы

для получения соединения формулы I по п.1.
Текст
1 Область техники, к которой относится изобретение Настоящее изобретение относится к соединениям, композициям и способам, предназначенным для лечения инфекции, вызываемой вирусом гепатита С (HCV). В частности, настоящее изобретение относится к новым пептидам, их аналогам и промежуточным продуктам,фармацевтическим композициям, содержащим такие пептиды, и к способам применения этих пептидов для лечения HCV-инфекции. Предпосылки создания изобретения Вирус гепатита С (HCV) является основным возбудителем гепатита, который не относится к гепатитам А и В и который возникает после переливания крови и поражает людей во всем мире. Было установлено, что свыше 150 миллионов людей в мире заражено этим вирусом. Высокий процент носителей становится хронически инфицированными, а у многих пациентов это приводит к хроническому заболеванию печени, так называемому хроническому гепатиту С. В свою очередь, эта группа больных имеет высокий риск заболевания такой серьезной болезнью печени, как цирроз печени, печеночно-клеточный рак и последняя стадия болезни печени, приводящая к смерти. Механизм, с помощью которого происходит сохранение вируса HCV в организме и обеспечивается высокий коэффициент заболеваемости хронической болезнью печени, пока изучен не достаточно глубоко. Не известно, каким образом HCV взаимодействует с иммунной системой хозяина и преодолевает ее действие. Кроме того, еще не выявлена роль клеточных и гуморальных иммунных ответов в защите отHCV-инфекции и при заболевании гепатитом. Имеются данные о том, что иммуноглобулины могут применяться для профилактики связанного с переливанием крови вирусного гепатита,однако Центр по контролю заболеваемости в настоящее время не рекомендует лечение с использованием иммуноглобулинов для этой цели. Отсутствие эффективного защитного иммунного ответа затрудняет разработку вакцины или адекватных профилактических мер после экспозиции, поэтому в ближайшее время надежды в основном возлагаются на антивирусные средства. С целью выявления фармацевтических агентов, обладающих эффективностью в отношении лечения HCV-инфекции у пациентов,страдающих хроническим гепатитом С, были проведены различные клинические испытания. В этих испытаниях применяли интерферональфа индивидуально или в сочетании с другими антивирусными агентами. Результаты этих исследований свидетельствуют о том, что у основного большинства участников эксперимента не обнаружено реакции на такие схемы лечения,а из тех участников, которые оказались чувст 004765 2 вительными к лечению, у большей части после окончания лечения наблюдался рецидив. Таким образом, в настоящее время терапия с использованием интерферона (IFN) остается единственным доступным методом лечения пациентов, страдающих хроническим гепатитом С, с подтвержденной в клинических условиях эффективностью. Однако эффект при таком лечении является непродолжительным, и, кроме того, лечение интерфероном вызывает серьезные побочные действия (т.е. ретинопатию, тиреоидит, острый панкреатит, депрессию), что снижает качество жизни пациентов, подвергающихся лечению. В настоящее время интерферон в сочетании с рибавирином предложен для лечения пациентов, не чувствительных только к IFN. Однако побочные действия, вызванные IFN, не уменьшаются при такой совместной терапии. Таким образом, существует необходимость в разработке эффективных антивирусных агентов для лечения HCV-инфекции, которые были бы лишены недостатков существующих методов лечения с использованием фармацевтических средств.HCV представляет собой заключенную в оболочку положительную цепь РНК-ового вируса семейства Flaviviridae. Геном HCV, представленный одноцепочечной РНК, состоит из 9500 нуклеотидов и имеет одну открытую рамку считывания (ОРС), которая кодирует один большой полипротеин, состоящий примерно из 3000 аминокислот. В зараженных клетках этот полипротеин расщепляется во многих сайтах клеточными и вирусными протеазами с образованием структурных и неструктурных (NS) протеинов. В случае HCV под действием двух вирусных протеаз образуются зрелые неструктурные протеины (NS2, NS3, NS4A, NS4B, NS5A иNS5B). Первая из них, которая пока еще недостаточно охарактеризована, расщепляет связьNS2-NS3, а вторая представляет собой серинпротеазу, содержащуюся в N-концевой областиNS3 (далее обозначена как NS3-протеаза), и опосредует все последующие расщепления,происходящие по ходу транскрипции относительно NS3, как в цис-ориентации в сайте расщепления NS3-NS4A, так и в трансориентации в остальных сайтах NS4A-NS4B, NS4B-NS5A,NS5A-NS5B. Протеин NS4A, вероятно, обладает множественными функциями, действуя в качестве кофактора для NS3-протеазы и возможно способствуя локализации на мембране NS3 и других компонентов вирусной репликазы. Образование комплекса протеина NS3 с NS4A, вероятно, необходимо для процессирования, усиления протеолитической эффективности во всех сайтах. Протеин NS3 также обладает нуклеозидтрифосфатазной активностью и РНК-геликазной активностью. NS5B представляет собой РНКзависимую РНК-полимеразу, участвующую в репликации HCV. 3 Общая стратегия разработки антивирусных агентов состоит в инактивации кодируемых вирусом ферментов, которые важны для репликации вируса. В этом отношении в WO 97/06804 описан (-)-энантиомер нуклеозидного аналога цитозин-1,3-оксатиолана (также известный как 3 ТС), активный в отношении HCV. Хотя в проведенных ранее клинических испытаниях для этого соединения и была обнаружена активность в отношении ВИЧ и HBV, тем не менее,пока нет клинического подтверждения его активности в отношении HCV и не выявлен его механизм действия в отношении этого вируса. Значительные усилия, предпринятые для выявления соединений, которые ингибируютNS3-протеазу или РНК-геликазу HCV, привели к следующим результатам. В патенте US 5633388 описаны замещенные гетероциклом карбоксамиды и их аналоги,обладающие активностью в отношении HCV. Объектом действия этих соединений является геликазная активность протеина NS3 вируса,однако пока нет данных об их клинических испытаниях. У Chu и др. (Tet. Lett., (1996), 7229-7232) описан фенантренхинон, обладающий активностью в отношении NS3-протеазы HCV in vitro. Никакие дополнительные данные об этом соединении не опубликованы. В научном докладе, представленном на Девятой международной конференции по антивирусным исследованиям (Ninth InternationalConference on Antiviral Research, Urabandai, Fukyshima, Japan (1996) (Antiviral Research, (1996),30, 1, A23 (тезис 19, сообщалось о триазолидиновых производных, обладающих ингибирующей активностью в отношении HCVпротеазы. В некоторых исследованиях описаны соединения, обладающие ингибирущим действием в отношении других серинпротеаз, таких как человеческая эластаза лейкоцитов. Одна группа таких соединений описана в WO 95/33764 (на имя Hoechst Marion Roussel, 1995). Описанные в этой заявке пептиды представляют собой морфолинилкарбонилбензоилпептидные аналоги,которые структурно отличаются от пептидов по настоящему изобретению. В WO 98/17679 (на имя Vertex Pharmaceuticals Inc.) описаны ингибиторы серинпротеазы,в частности NS3-пртеазы вируса гепатита С. Эти ингибиторы представляют собой пептидные аналоги, основой которых является природный субстрат NS5A/5B. Характерной особенностью всех указанных пептидов является то, что они содержат С-концевую активированную карбонильную функцию. Для этих аналогов также известно, что они являются активными в отношении другой серинпротеазы и, таким образом,не являются специфичными для NS3-протеазыHoffman LaRoche, также описаны гексапептиды,являющиеся ингибиторами протеиназы, в качестве антивирусных агентов для лечения HCVинфекции. Эти пептиды содержат альдегид или бороновую кислоту на С-конце. У Steinkhler и др. и Ingallinella и др. опубликованы данные о продукте ингибированияNS4A-4B (Biochemistry (1998), 37, 8899-8905 и 8906-8914). Однако описанные в этих публикациях пептиды или пептидные аналоги не включают пептиды по настоящему изобретению и не могут привести к их созданию. В WO 98/46597 на имя Emory University описаны ингибиторы серинпротеазы, в частности протеазы вируса гепатита С. Все описанные соединения отличаются по строению от пептидов по настоящему изобретению. В WO 98/46630 на имя фирмы PeptideThetapeutics Ltd. описаны ингибиторы NS3 протеазы вируса гепатита С. Однако ни один из описанных пептидов не обладает сходством с пептидами по изобретению. В JP 10298151 на имя фирмы Japan EnergyCorp. описаны N-(2,3-дигидроксибензоил) - замещенные производные серина в качестве ингибиторов серинпротеазы, в частности в качестве ингибиторов протеазы вируса гепатита С. Эти соединения не имеют никакого структурного сходства с аналогами пептидов по настоящему изобретению. Одно из преимуществ настоящего изобретения состоит в том, что в нем предложены пептиды, которые обладают ингибирующей активностью в отношении NS3-протеазы вируса гепатита С. Еще одно преимущество настоящего изобретения заключается в том, что эти пептиды специфически ингибируют NS3-протеазу и не проявляют заметной ингибирующей активности в концентрации до 300 мкМ в отношении других серинпротеаз, таких как эластаза лейкоцитов человека (HLE), эластаза панкреатической железы свиньи (РРЕ) или бычий химотрепсин панкреатической железы, или цистеинпротеаз,таких как катепсин В печени человека (Cat В). Краткое изложение сущности изобретения Объектом изобретения в данной заявке являются рацематы, диастериоизомеры и оптические изомеры соединения формулы (I) в которой а равно 0 или 1,b обозначает 0 или 1,Y обозначает Н или С 1-С 6 алкил, 5 В обозначает Н, ацильное производное формулы R7-C(O)- или сульфонил формулы R7SO2, где R7 обозначает С 1-С 10 алкил, необязательно замещенный карбоксилом, С 1-С 6 аланоилокси- или C1-C6 алкоксигруппой, С 6- или С 10 арил или С 7-С 16 аралкил, необязательно замещенный C1-С 6 алкилом, гидрокси- или аминогруппой, необязательно замещенной C1 С 6 алкилом, или Het, необязательно замещенный С 1-С 6 алкилом, гидрокси- или аминогруппой,необязательно замещенной С 1-С 6 алкилом, или амидиногруппой, необязательно замещенной С 1-С 6 алкилом, R6 при его наличии обозначает С 1-С 6 алкил, замещенный карбоксилом, R5 при его наличии обозначает С 1-С 6 алкил, необязательно замещенный карбоксилом, R4 обозначает С 1-С 10 алкил, С 3-С 7 циклоалкил или С 4-С 10(алкилциклоалкил), R3 обозначает С 1-С 10 алкил, С 3 С 7 циклоалкил или С 4-С 10(алкилциклоалкил), R2 обозначает CH2-R20 или О-R20, где R20 обозначает насыщенный или ненасыщенный С 3 С 7 циклоалкил или С 4-С 10(алкилциклоалкил), необязательно моно-, ди- или тризамещенный радикалом R21, или R20 обозначает С 6- или С 10 арил или С 7-С 16 аралкил, необязательно моно-, диили тризамещенный радикалом R21, или R20 обозначает Het или (низш.)алкил-Неt, необязательно моно-, ди- или тризамещенный радикаломR21, где R21 в каждом случае независимо обозначает C1-С 6 алкил, С 1-С 6 алкокси-, галоген, галоалкил, амидогруппу, необязательно монозамещенную С 1-C6 алкилом, С 6- или С 10 арилом, С 7 С 16 аралкилом, Het или (низш.)алкил-Неt, С 6 или С 10 арил или Het, где арил или Het необязательно замещены радикалом R22, гдеNзамещенную аминогруппу,и его фармацевтически приемлемая соль или сложный эфир; причем Het обозначает 6- или 10-членный содержащий азот гетероцикл. Кроме того, в заявке описаны соединения формулы (I), включая их рацематы, диастереоизомеры и оптические изомеры в которой а равно 0 или 1,b равно 0 или 1,Y обозначает Н или С 1-С 6 алкил,В обозначает Н, ацильное производное формулы R7-C(O)- или сульфонил формулы R7SO2, где R7 обозначает С 1-С 10 алкил, необязательно замещенный карбоксилом,С 1 004765 6 С 6 алканоилокси- или С 1-С 6 алкоксигруппой, С 3 С 7 циклоалкил, необязательно замещенный карбоксилом, (C1-С 6 алкокси)карбонилом или фенилметоксикарбонилом, С 6- или С 10 арил или С 7 С 16 аралкил, необязательно замещенный С 1 С 6 алкилом, гидрокси- или аминогруппой, необязательно замещенной С 1-С 6 алкилом, или Het,необязательно замещенный С 1-С 6 алкилом, гидрокси- или аминогруппой, необязательно замещенной С 1-С 6 алкилом, или амидиногруппой,необязательно замещенной С 1-С 6 алкилом,R6 при его наличии обозначает С 1-С 6 алкил,замещенный карбоксилом,R5 при его наличии обозначает С 1-С 6 алкил,необязательно замещенный карбоксилом,R4 обозначает С 1-С 10 алкил, С 3-С 7 циклоалкил или С 4-С 10(алкилциклоалкил), R3 обозначает С 1-С 10 алкил, С 3-С 7 циклоалкил или С 4 С 10(алкилциклоалкил), R2 обозначает CH2-R20,NH-R20, O-R20 или S-R20, где R20 обозначает насыщенный или ненасыщенный С 3-С 7 циклоалкил или С 4-С 10(алкилциклоалкил), необязательно моно-, ди- или тризамещенный R21, или R20 обозначает С 6- или С 10 арил или С 7-С 16 аралкил, необязательно моно-, ди- или тризамещенный радикалом R21, или R20 обозначает Het или(низш.)алкил-Неt, необязательно моно-, ди- или тризамещенный радикалом R21, где R21 в каждом случае независимо обозначает C1-С 6 алкил,С 1-С 6 алкоксигруппу, аминогруппу, необязательно моно- или дизамещенную С 1-С 6 алкилом,сульфонил, NO2, ОН, SH, галоген, галоалкил,амидогруппу, необязательно монозамещенную С 1-С 6 алкилом, С 6- или С 10 арилом, С 7 С 16 аралкилом, Het или (низш.)алкил-Неt, карбоксил, карбокси(низш.)алкил, С 6- или С 10 арил,С 7-С 16 аралкил или Het, где арил, аралкил илиHet необязательно замещены радикалом R22, при этом R22 обозначает С 1-С 6 алкил, С 1-С 6 алкоксигруппу, аминогруппу, необязательно моно- или дизамещенную С 1-C6 алкилом, сульфонил, NO2,ОН, SH, галоген, галоалкил, карбоксил, амид или (низш.)алкиламид, R1 обозначает С 1 С 6 алкил или C2-С 6 алкенил, необязательно замещенный галогеном, иW обозначает гидрокси- или N-замещенную аминогруппу, и их фармацевтически приемлемые соли или сложные эфиры. В изобретении предлагается также фармацевтическая композиция, включающая эффективное в отношении вируса гепатита С количество соединения формулы I или его фармацевтически приемлемой соли либо его сложного эфира в смеси с фармацевтически приемлемым носителем или вспомогательным веществом. Еще одним объектом изобретения является способ лечения инфекции, вызываемой вирусом гепатита С у млекопитающего, предусматривающий введение млекопитающему эффективного в отношении вируса гепатита С количества соединения формулы I или его терапевтически приемлемой соли либо сложного эфира или описанной выше композиции. Еще одним объектом изобретения является способ ингибирования репликации вируса гепатита С путем обработки вируса ингибирующимNS3-протеазу вируса гепатита С количеством соединения формулы I или его терапевтически приемлемой соли либо сложного эфира или описанной выше композиции. Другим объектом изобретения является способ лечения инфекции, вызываемой вирусом гепатита С у млекопитающего, предусматривающий введение млекопитающему эффективного в отношении вируса гепатита С количества комбинации, включающей соединение формулыI или его терапевтически приемлемую соль либо сложный эфир и интерферон. Фармацевтическая композиция, включающая указанную комбинацию в смеси с фармацевтически приемлемым носителем или вспомогательным веществом,также является объектом настоящего изобретения. Подробное описание предпочтительных вариантов осуществления Определения Если не указано иное, то в контексте настоящего описания использованные понятия имеют следующие значения. В тех случаях, когда для обозначения конфигурации заместителя, например R4 в соединении формулы I, используют символы (R) или(S), то обозначение относится ко всему соединению, а не только к заместителю. Природные аминокислоты, за исключением глицина, содержат хиральный атом углерода. Если не указано иное, то предпочтительными являются соединения, содержащие природные аминокислоты с L-конфигурацией. Однако подразумевается, что в конкретных случаях некоторые аминокислоты формулы I могут иметь либоD-, либо L-конфигурацию или могут являться смесями D- и L-изомеров, включая рацемические смеси. Обозначение "P1, P2 и Р 3 и т.д." в контексте настоящего описания относится к положению аминокислотных остатков, начиная с Сконца пептидных аналогов в сторону N-конца Аминокислота аланин аспарагиновая кислота цистеин циклогексилглицин (также называемый 2-амино-2-циклогексилуксусной кислотой) глутаминовая кислота изолейцин лейцин фенилаланин пролин валин трет-бутилглицин В контексте настоящего описания понятие. В контексте настоящего описания понятие. Понятие "остаток" со ссылкой на аминокислоту или аминокислотное производное обозначает радикал, полученный из соответствующей -аминокислоты путем удаления гидроксильной или карбоксильной группы и одного водорода -аминогруппы. Так, например, понятия Gln, Ala, Gly, Ile, Arg, Asp, Phe, Ser, Leu,Cys, Asn, Sar и Туr обозначают "остатки" Lглутамина, L-аланинина, глицина, L-изолейцина, L-аргинина, L-аспарагиновой кислоты, Lфенилаланина, L-серина, L-лейцина, L-цистеина, L-аспарагина, саркозина и L-тирозина соответственно. Понятие "боковая цепь" со ссылкой на аминокислоту или аминокислотный остаток обозначает группу, присоединенную к атому углерода -аминокислоты. Например, R-группа боковой цепи глицина обозначает водород, аланина - метил, валина - изопропил. КонкретныеR-группы или боковые цепи -аминокислот описаны у A.L. Lehninger's text on Biochemistry(см. главу 4). Понятие "гало" в контексте настоящего описания обозначает галогеновый заместитель,выбранный из группы, включающей бром, хлор,фтор или йод. Понятие "С 1-С 6 алкил" или "(низш.)алкил" в контексте настоящего описания индивидуально или в сочетании с другим заместителем обозначает ациклические алкильные заместители с прямой или разветвленной цепью, содержащие от 1 до 6 атомов углерода, и включает, например, метил, этил, пропил, бутил, трет-бутил,гексил,1-метилэтил,1-метилпропил,2 метилпропил, 1,1-диметилэтил (например, третбутил). Понятие "С 3-С 7 циклоалкил" в контексте настоящего описания индивидуально или в со 9 четании с другим заместителем обозначает циклоалкильный заместитель, содержащий от 3 до 7 атомов углерода, и включает, например, циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. Понятие "ненасыщенный циклоалкил" включает, например, циклогексенил углерода. С 7-С 16 аралкил включает, например,бензил, бутилфенил и 1-нафтилметил. Понятие "аминоаралкил" в контексте настоящего описания индивидуально или в сочетании с другим радикалом обозначает аминогруппу, замещенную С 7-С 16 аралкильной группой, такую, например, как аминоаралкил. Понятие С 4-С 10(алкилциклоалкил) в контексте настоящего описания обозначает циклоалкильный радикал, содержащий от 3 до 7 атомов углерода, связанных с алкильным радикалом, причем присоединенные радикалы содержат до 10 атомов углерода, например циклопропилметил, циклопентилэтил, циклогексилметил,циклогексилэтил или циклогептилэтил. Понятие "С 2-С 10 алкенил" в контексте настоящего описания индивидуально или в сочетании с другим радикалом обозначает алкильный радикал, как он определен выше, содержащий от 2 до 10 атомов углерода и, кроме того,содержащий по меньшей мере одну двойную связь. Например, алкенил включает аллил и винил. Понятие "С 1-С 6 алканоил" в контексте настоящего описания индивидуально или в сочетании с другим радикалом обозначает 1 оксоалкильные радикалы, содержащие от 1 до 6 атомов углерода, и включает формил, ацетил, 1 оксопропил (пропионил), 2-метил-1-оксопропил, 1-оксогексил и т.п. Понятие "С 1-С 6 алкокси" в контексте настоящего описания индивидуально или в сочетании с другим радикалом обозначает радикал-O(C1-C6 алкил), где алкил имеет указанные выше значения, содержащий до 6 атомов углерода. Алкокси включает метокси, этокси, пропокси, 1 метилэтокси, бутокси и 1,1-диметилэтокси. Последний радикал обычно называют третбутокси. Понятие "С 3-С 7 циклоалкокси" в контексте настоящего описания индивидуально или в сочетании с другим радикалом обозначает С 3 С 7 циклоалкильную группу, связанную с атомом кислорода, такую, например, как. Понятие "карбокси(низш.)алкил" в контексте настоящего описания индивидуально или в сочетании с другим радикалом обозначает карбокcильную группу (СООН), связанную через(низш.)алкильную группу, как она определена выше, и включает, например, масляную кислоту. Понятие "гетероцикл" или "Het" в контексте настоящего описания индивидуально или в сочетании с другим радикалом обозначает одновалентный радикал, полученный удалением водорода из 5-, 6- или 7-членного насыщенного или ненасыщенного (в том числе ароматического) гетероцикла, содержащего от 1 до 4 гетероатомов, выбранных из ряда, включающего азот,кислород и серу. Кроме того, "Het" в контексте настоящего описания обозначает гетероцикл,как он определен выше, сконденсированный с одним или несколькими другими циклическими группами, которые могут представлять собой гетероцикл или любую другую циклическую группу. Примеры приемлемых гетероциклов включают пирролидин, тетрагидрофуран, тиазолидин, пиррол, тиофен, диазепин, 1 Нимидазол, изоксазол, тиазол, тетразол, пиперидин, 1,4-диоксан, 4-морфолин, пиридин, пиримидин, тиазол[4,5-b] пиридин, хинолин или индол или следующие гетероциклы. Понятие "С 6- или С 10-арил" в контексте настоящего описания индивидуально или в сочетании с другим радикалом обозначает либо ароматическую моноциклическую группу, содержащую 6 атомов углерода, либо ароматическую бициклическую группу, содержащую 10 атомов углерода. Примерами арила являются фенил, 1 нафтил или 2-нафтил. Понятие "С 7-С 16 аралкил" в контексте настоящего описания индивидуально или в сочетании с другим радикалом обозначает С 6- или С 10-арил, как он определен выше, связанный с алкильной группой, где алкил имеет указанные выше значения, содержащий от 1 до 6 атомов. Понятие " (низш.)-Het" в контексте настоящего описания обозначает гетероциклический радикал, как он определен выше, связанный через алкильную группу с прямой или разветвленной цепью, где алкил имеет указанные выше значения, содержащий от 1 до 6 атомов углерода. Примеры (низш.)алкил-Неt включают. Понятие "фармацевтически приемлемый сложный эфир" в контексте настоящего описания индивидуально или в сочетании с другим заместителем обозначает сложные эфиры соединения формулы I, в котором любая из карбоксильных функций в молекуле, но предпочтительно С-концевая функция, замещена алкоксикарбонильной функцией. где фрагмент R сложного эфира выбирают из алкила (например, метила, этила, н-пропила,трет-бутила, н-бутила), алкоксиалкила (напри 11 мер, метоксиметила), алкоксиацила (например,ацетоксиметила), аралкила (например, бензила),арилоксиалкила (например, феноксиметила),арила (например, фенила), необязательно замещенного галогеном, C1-С 4 алкилом или C1 С 4 алкоксигруппой. Другие пригодные в качестве пролекарства сложные эфиры описаны в "Design of prodrugs", Bundgaard H., изд-во Elsevier(1985) (публикация включена в настоящее описание в качестве ссылки). Такие фармацевтически приемлемые сложные эфиры обычно гидролизуются in vivo при введении млекопитающему и превращаются в кислотную форму соединения формулы I. Что касается описанных выше сложных эфиров, то, если не указано иное, любой присутствующий алкильный фрагмент предпочтительно содержит 1-16 атомов углерода, особенно предпочтительно 1-6 атомов углерода. Любой присутствующий в таких сложных эфирах арильный фрагмент предпочтительно содержит фенильную группу. В частности, сложные эфиры могут представлять собой С 1-С 16 алкиловый эфир, незамещенный бензиловый эфир или бензиловый эфир, замещенный по меньшей мере одним галогеном, C1-С 16 алкилом, С 1-С 16 алкокси-, нитрогруппой или трифторметилом. Понятие "фармацевтически приемлемая соль" в контексте настоящего описания относится к солям, полученным из фармацевтически приемлемых оснований. Примеры приемлемых оснований включают холин, этаноламин и этилендиамин. В объем настоящего изобретения также включены соли Na +, К + и Са (см. такжеSci., (1977), 66, 1-19, публикация включена в настоящее описание в качестве ссылки). Предпочтительные варианты осуществления В объем изобретения включены соединения формулы I, в которых В предпочтительно обозначает R7-SO2 и R7 обозначает С 6- или С 10 арил, С 7-С 16 аралкил или Het, все необязательно замещенные С 1-С 6 алкилом. В другом варианте В предпочтительно обозначает Н или ацильное производное формулы R7-C(O)-, где R7 обозначает С 1-С 6 алкил,C1-С 6 алкокси, С 3-С 7 циклоалкил, необязательно замещенный гидроксигруппой, амидиногруппу,необязательно замещенную С 1-С 6 алкилом илиHet, C6- или С 10 арил, С 7-С 16 аралкил или Het, все необязательно замещенные С 1-С 6 алкилом или гидроксигруппой. Более предпочтительно В обозначает Н или R7-C(O)-, где R7 обозначает С 1-С 6 алкил или гетероциклы, такие как. Наиболее предпочтительно В обозначает Н, ацетил. Еще более предпочтительно В обозначает ацетил. В объем изобретения включены соединения формулы I, в которых R6, если он присутствует, предпочтительно обозначает боковую цепьAsp. В альтернативном варианте предпочтительно а равно 0 и в этом случае R6 отсутствует. В объем изобретения включены далее соединения формулы I, в которых R5, если он присутствует, предпочтительно обозначает боковую цепь аминокислоты, выбранной из группы,включающей D-Asp, L-Asp, D-Glu, L-Glu, D-Val,L-Val, D-трет-бутилглицин (Tbg) и L-Tbg. Более предпочтительно R5, если он присутствует, обозначает боковую цепь D-Asp, D-Val или D-Glu. Наиболее предпочтительно R5, если он присутствует, обозначает боковую цепь D-Glu. В альтернативном варианте а равно 0, b равно 0 и в этом случае и R6, и R5 отсутствуют. В объем изобретения включены также соединения формулы I, в которых R4 предпочтительно обозначает боковую цепь аминокислоты,выбранной из группы, включающей Val, циклогексилглицин (Chg), Tbg, Ile или Leu. Более предпочтительно R4 обозначает боковую цепьChg или Ile. Наиболее предпочтительно R4 обозначает боковую цепь Chg. В объем изобретения включены далее соединения формулы I, в которых Y предпочтительно обозначает Н или Me. Наиболее предпочтительно Y обозначает Н. В объем изобретения включены также соединения формулы I, в которых R3 предпочтительно обозначает боковую цепь аминокислоты,выбранной из группы, включающей Ilе, Chg, Val или Tbg. Более предпочтительно R3 обозначает боковую цепь Val, Chg или Tbg. Наиболее предпочтительно R3 обозначает боковую цепь Val или Tbg. В объем изобретения включены и соединения формулы I, в которых R2 предпочтительно обозначает S-R20, O-R20, где R20 предпочтительно обозначает С 6- или С 10 арил, С 7-С 16 аралкил,Het или -CH2-Het, все необязательно моно-, диили тризамещенные радикалом R21. Предпочтительно R21 обозначает С 1 С 6 алкил, С 1-С 6 алкокси, амино-, моно- или ди(низш.)алкиламиногруппу, амидогруппу, необя 13 зательно монозамещенную C1-С 6 алкилом, С 6 или С 10 арилом, С 7-С 16 аралкилом, Het илиHet необязательно замещены радикалом R22. Более предпочтительно R21 обозначает С 1 С 6 алкил, С 1-С 6 алкокси-, амино-, ди(низш.)алкиламиногруппу, ди(низш.)алкиламид, С 6- или С 10 арил или Het, где арил или Het необязательно замещены радикалом R22. Предпочтительно R22 обозначает С 1 С 6 алкил, С 1-С 6 алкоксигруппу, аминогруппу,моноили ди(низш.)алкиламиногруппу,(низш.)алкиламид, NO2, ОН, галоген, трифторметил или карбоксил. Более предпочтительно обозначает С 1-С 6 алкокси-,амино-,R22 ди(низш.)алкиламиногруппу, (низш.)алкиламид,галоген или трифторметил. Еще более предпочтительно R2 обозначает 1-нафтилметокси-, 2 нафтилметокси-, бензилокси-, 1-нафтилокси-, 2 нафтилокси- или хинолиноксигруппу, незамещенную, моно- или дизамещенную радикаломR2 обозначает 1-нафтилметокси- или хинолиноксигруппу, незамещенную, моно- или дизамещенную радикалом R21, как указано выше. Более предпочтительно R2 обозначает. Более предпочтительно R21A обозначает амидогруппу, необязательно монозамещенную С 1-С 6 алкилом, C6- или С 10 арилом, С 7-С 16 аралкил или Het, С 6- или С 10 арил или Het, необязательно замещенные радикалом R22. Наиболее предпочтительно R21A обозначает С 6- или С 10 арил илиHet, все необязательно замещенные R22. Наиболее предпочтительно R22 обозначает амино-,ди(низш.)алкиламиногруппу или (низш.)алкиламид. Еще более предпочтительно R22 обозначает амино-, диметиламино- или ацетамидогруппу. Более предпочтительно R21A обозначает C6 или С 10 арил или Het, все незамещенные. Предпочтительно R21B обозначает С 1 С 6 алкил, С 1-C6 алкокси-, амино-, ди(низш.)алкиламиногруппу, ди(низш.)алкиламид, NO2, ОН,галоген, трифторметил или карбоксил. Более предпочтительно R21B обозначает C1-С 6 алкокси или ди(низш.)алкиламиногруппу. Наиболее предпочтительно R21B обозначает метокси. В объем изобретения включены далее соединения формулы I, в которых R1 предпочтительно обозначает метил, этил, пропил, винил,все необязательно замещенные галогеном. Более предпочтительно R1 обозначает этил, винил или бромвинил. Наиболее предпочтительно R1 обозначает винил. В объем изобретения включены также соединения формулы I, в которых предпочтительно W обозначает гидроксигруппу или фарма 004765 14 цевтически приемлемую соль либо сложный эфир или (низш.)алкиламино-, ди(низш.)алкиламино- или аралкиламиногруппу. Более предпочтительно W обозначает гидроксигруппу или N(R13a)R13b, где R13 а и R13b независимо друг от друга обозначают Н, арил или С 1-С 6 алкил,необязательно замещенный гидроксигруппой или фенилом, или фармацевтически приемлемую соль. Наиболее предпочтительно W обозначает -ОН, -NH-бензил или -NH-CH(Me)Ph. Еще более предпочтительно W обозначает -ОН,-NH-(S)CH(Me)-фенил. Когда W обозначает сложный эфир, то этот сложный эфир выбирают из группы, включающей С 1-С 6 алкокси, фенокси или арил(С 1 С 6 алкокси). Более предпочтительно сложный эфир обозначает метокси, этокси, фенокси, бензилокси или РhСН(Ме)-О-. Как описано выше, сегмент Р 1 соединений формулы I представляет собой циклопропильную кольцевую систему,где C1 и С 2 каждый обозначает асимметричный атом углерода в положениях 1 и 2 циклопропильного кольца. Независимо от других возможных асимметричных центров на других сегментах соединений формулы I присутствие этих двух асимметричных центров обозначает, что соединения формулы I могут существовать в виде рацемических смесей диастереоизомеров. Как проиллюстрировано в приведенных ниже примерах, могут быть получены рацемические смеси, которые затем можно разделить на индивидуальные оптические изомеры, или эти оптические изомеры могут быть получены с помощью хирального синтеза. Из сказанного следует, что соединение формулы I может существовать в виде рацемической смеси диастереоизомеров, когда R1 в положении 2 находится в син-ориентации относительно карбонильной группы в положении 1,как это представлено радикалом или соединение формулы I может существовать в виде рацемической смеси диастереоизомеров, причем когда R1 в положении 2 находится в антиориентации относительно карбонильной группы в положении 1, то этот случай можно представить радикалом В свою очередь рацемические смеси могут быть разделены на индивидуальные оптические изомеры. Наиболее важное значение согласно изобретению имеет пространственная ориентация сегмента Р 1. Неожиданный эффект связан с конфигурацией асимметричного углерода в положении 1. Предпочтительно, когда один из асимметричных атомов углерода в положении 1 имеет R-конфигурацию Более конкретно, когда атом углерода в положении 1 имеет R-конфигурацию, то ингибирующая активность в отношении NS3 протеазы HCV дополнительно усиливается положением заместителя R1 (например, алкила или алкилена) на атоме углерода в положении 2 циклопропильного кольца. Наиболее предпочтительным соединением является оптический изомер, включающий заместитель R1 и карбонил в син-ориентации и имеющий следующую абсолютную конфигурацию где R22 обозначает амино-, ди(низш.)алкиламиногруппу, (низш.)алкиламид, NO2, ОН, галоген;,CF3 или карбоксигруппу; Р 1 обозначает циклопропильную кольцевую систему формулы. В случае, когда R1 обозначает, например,этил, асимметричные атомы углерода в положениях 1 и 2 имеют R,R-конфигурацию. Проиллюстрировать влияние абсолютной конфигурации заместителя на уровень эффективности соединения можно на примере соединения 112 (табл. 1), имеющего абсолютную конфигурацию 1R,2R, значение IC50 которого составляет 1,6 мкМ, при этом значение IC50 соответствующего 1S,2S-изомера (соединение 113) составляет 27,5 мкМ. Таким образом,1R,2R-изомер в 25 раз эффективнее соответствующего 1S,2S-изомера. В объем изобретения включены далее соединения формулы I, в которых В обозначает Н,(низш.)алкил-С(О)- или Het-C(O)-, R6 при его наличии обозначает боковую цепь Asp или Glu,R5 при его наличии обозначает боковую цепь D- или L-Asp, -Glu, -Val или -Tbg,Y обозначает Н или метил,R4 обозначает боковую цепь Val, Chg, Tbg,Ile или Leu,R3 обозначает боковую цепь Ilе, Chg, Val или Tbg,R2 обозначает 1-нафтилметокси, 2 нафтилметокси, О-Вn,N(R13a)R13b, где R13 а и R13b независимо друг от друга обозначают Н, арил или С 1-С 6 алкил, необязательно замещенный гидроксигруппой или фенилом,или их фармацевтически приемлемая соль или сложный эфир. Еще одна предпочтительная группа соединений представлена соединениями формулы I, в которых В обозначает Н, ацетил или Het-C(O)-,R6, если он присутствует, обозначает боковую цепь Asp, R5, если он присутствует, обозначает боковую цепь D-Asp, D-Glu или D-Val, Y обозначает Н, R4 обозначает боковую цепь Chg илиIlе, R3 обозначает боковую цепь Val, Chg или Р 1 обозначает циклопропильную кольцевую систему формулы-NH-(S)CH(Me)Ph, или их фармацевтически приемлемыми солями или сложными эфирами. Еще более предпочтительная группа соединений представлена соединениями формулыI, в которых В обозначает ацетил, R6, если он присутствует, обозначает боковую цепь Asp, R5,если он присутствует, обозначает боковую цепьD-Glu, Y обозначает Н, R4 обозначает боковую цепь Chg, R3 обозначает боковую цепь Val или и W обозначает гидроксигруппу, или их фармацевтически приемлемыми солями или сложными эфирами. Помимо этого, в объем изобретения включено каждое соединение формулы I, представленное в табл. 1-5. Согласно другому варианту осуществления фармацевтические композиции по изобретению могут дополнительно включать другой анти-НСV-агент. Примеры таких анти-НСVагентов включают - или -интерферон, рибавирин и амантадин. Согласно еще одному варианту осуществления фармацевтические композиции по изобретению могут дополнительно включать другие ингибиторы протеазы HCV. В соответствии еще с одним вариантом фармацевтические композиции по изобретению могут дополнительно включать ингибитор других мишеней жизненного цикла HCV, в том числе (но не ограничиваясь только ими) геликазу, полимеразу, металлопротеазу или внутренний сайт входа в рибосому (IRES). Фармацевтические композиции по изобретению можно вводить орально, парентерально или с помощью устройства для имплантации. Предпочтительным является оральное введение или введение с помощью инъекции. Фармацевтические композиции по изобретению могут содержать любые общепринятые нетоксичные фармацевтически приемлемые носители, адъюванты или наполнители. В некоторых случаях рН композиции можно регулировать с помощью фармацевтически приемлемых кислот, оснований или буферов с целью повышения стабильности соединения, введенного в композицию или в форму для его введения. В контексте настоящего описания понятие "парентеральный" включает подкожный, внутрикожный, внутривенный, внутримышечный, внутрисуставной,интрасиновиальный, интрастернальный, интратекальный путь введения с помощью инъекции или инфузии, а также введение в область повреждения. Фармацевтические композиции могут иметь форму стерильного препарата для инъекции, например стерильной инъецируемой водной или жирорастворимой суспензии. Эта суспензия может быть получена с помощью хорошо известных методов с использованием диспергирующих или смачивающих агентов (таких как Твин 80) и суспендирующих агентов. 18 Фармацевтические композиции по изобретению можно вводить орально в виде любой приемлемой дозируемой формы для орального введения, включая ( но не ограничиваясь только ими) имикапсулы, таблетки и водные суспензии и растворы. В случае таблеток для орального введения обычно применяемые носители включают лактозу и кукурузный крахмал. Как правило, также добавляют замасливатели, такие как стеарат магния. Для орального введения в форме капсул приемлемые разбавители включают лактозу и безводный кукурузный крахмал. Когда оральным путем вводят водные суспензии,действующее вещество объединяют с эмульгирующими и суспендирующими агентами. При необходимости могут быть добавлены определенные подслащивающие вещества и/или корригенты и/или красители. Другие пригодные наполнители или носители для указанных выше препаративных форм и композиций описаны в обычных фармацевтических справочниках, например, в "Remington'sCompany, Easton, Penn., (1995). Соединение по изобретению, являющееся ингибитором протеазы, можно применять для монотерапии с целью предупреждения и лечения опосредованной HCV болезни в дозах от примерно 0,01 до примерно 100 мг/кг веса тела в день, предпочтительно от примерно 0,5 до примерно 75 мг/кг веса тела в день. Как правило, фармацевтические композиции по изобретению могут вводиться от примерно 1 до примерно 5 раз в день или в другом варианте путем непрерывной инфузии. Такое введение может применяться как для экстренного, так и для длительного лечения. Количество действующего вещества, которое может быть объединено с носителями для получения стандартной дозируемой формы, может варьироваться в зависимости от конкретного пациента, подлежащего лечению, и конкретного пути введения. Обычная композиция может содержать от примерно 5 до примерно 95% действующего вещества(мас.%). Предпочтительно такие композиции содержат от примерно 20 до примерно 80% действующего вещества. Очевидно, что применяемые дозы могут отличаться от указанных выше как в большую,так и меньшую сторону. Специфические схемы дозирования и лечения для любого конкретного пациента могут зависеть от различных факторов, включая активность конкретно применяемого соединения, возраст, вес тела, общее состояние здоровья, пол, рацион, время введения,скорость выведения, сочетание лекарственных средств, серьезность и особенности развития болезни, предрасположенность пациента к инфекции, и определяются лечащим врачом. Как правило, лечение начинают с небольших доз,существенно более низких, чем оптимальная 19 доза пептида. Затем дозу постепенно повышают до достижения оптимального действия в конкретных условиях. Обычно наиболее предпочтительно вводить соединение в таком диапазоне концентраций, которые обеспечивают антивирусную активность, но не обладают какимилибо вредными или опасными побочными действиями. Когда композиции по изобретению включают комбинацию соединения формулы I и одного или нескольких дополнительных терапевтических или профилактических агентов, то доза соединения и дополнительного агента должна составлять от примерно 10 до 100%,более предпочтительно от примерно 10 до 80%,от дозы, обычно применяемой в режиме монотерапии. Когда эти соединения или их фармацевтически приемлемые соли объединяют в препаративной форме с фармацевтически приемлемым носителем, то полученная композиция может вводиться in vivo млекопитающему, такому как человек, для ингибирования NS3-протеазы HCV или для лечения или предупреждения инфекции, вызываемой вирусом HCV. Эффект при таком лечении также может быть достигнут при использовании соединения по изобретению в сочетании с агентами, включающими иммуномодуляторы, такие как -, - или интерфероны, другие антивирусные агенты,такие как рибавирин, амантадин, другие ингибиторы NS3-протеазы HCV, ингибиторы других мишеней в жизненном цикле HCV, которые включают (но не ограничиваясь только ими) геликазу, полимеразу, металлопротеазу или внутренний сайт входа в рибосому (IRES), или их комбинацию, при этом список ингибиторов не ограничен перечисленными выше. Дополнительные агенты могут быть объединены с соединениями по изобретению с получением однократной дозируемой формы. В альтернативном варианте эти агенты могут вводиться по отдельности млекопитающему в виде части многократной дозируемой формы. Еще одним объектом изобретения являются способы ингибирования активности NS3 протеазы HCV у млекопитающего путем введения соединения формулы I, в котором заместители имеют указанные выше значения. Согласно предпочтительному варианту осуществления эти способы могут применяться для понижения активности NS3-протеазы HCV у млекопитающего. Если фармацевтическая композиция включает только соединение по изобретению в качестве действующего вещества, такие способы могут дополнительно предусматривать введение млекопитающему агента,выбранного из иммуномодулятора, антивирусного агента, ингибитора протеазы HCV или ингибитора других мишеней в жизненном цикле 20 агент может вводиться млекопитающему до,одновременно или после введения композиций по изобретению. Согласно еще одному предпочтительному варианту осуществления эти способы могут применяться для ингибирования репликации вируса у млекопитающего. Такие способы могут применяться для лечения или предупреждения вызываемой HCV болезни. Если фармацевтическая композиция включает только соединение по изобретению в качестве действующего вещества, такие способы могут дополнительно предусматривать введение млекопитающему агента, выбранного из иммуномодулятора, антивирусного агента, ингибитора протеазы HCV или ингибитора других мишеней в жизненном циклеHCV. Такой дополнительный агент может вводиться млекопитающему до, одновременно или после введения композиции по изобретению. Предлагаемые в изобретении композиции также могут применяться в качестве лабораторных реагентов. Соединения по изобретению также могут применяться для лечения или предупреждения вирусного загрязнения материалов и тем самым понижать риск заражения вирусом персонала лабораторий или медицинских учреждений, которые имеют контакт с такими материалами (например, кровью, тканями, хирургическими инструментами и предметами одежды,лабораторными инструментами и предметами одежды, приборами и материалами для сбора крови). Предлагаемые в изобретении композиции также могут применяться в качестве реагентов для исследований. Соединения по изобретению могут также использоваться в качестве положительного контроля для обоснованного выбора заменителей в опытах на клетках или в опытах по репликации вирусов in vitro или in vivo. Способы получения Соединения по настоящему изобретению синтезировали в соответствии с общим процессом, который представлен на схеме I (где CPG обозначает карбоксильную защитную группу, a Этот способ состоит в основном в следующем: Р 1, Р 2, Р 3, Р 4 и необязательно Р 5 и Р 6 могут быть связаны с помощью хорошо известных методов пептидного сочетания. Группы Р 1, 21 Р 2, Р 3, Р 4, а также Р 5 и Р 6 могут быть соединены друг с другом в любом порядке таким образом, чтобы полученное конечное соединение соответствовало пептидам формулы I. Так, например, Р 6 может быть связан с Р 5 с получением фрагмента Р 5-Р 6, который в свою очередь связан с Р 4-Р 3-Р 2-Р 1, или Р 6 связан с фрагментом Р 5-Р 4-Р 3-Р 2, который далее связан с соответствующим образом защищенным Сконцевым Р 1. Обычно пептиды удлиняют путем удаления -аминогруппы на N-концевом остатке и соединения с незащищенной карбоксильной группой следующей пригодной соответствующим образом N-защищенной аминокислоты через пептидную связь, используя описанные методы. Эту процедуру удаления защитной группы и сочетания повторяют до получения требуемой последовательности. Это сочетание можно осуществлять с использованием в качестве составляющих аминокислот ступенчатым синтезом, как это показано на схеме I, или путем конденсации фрагментов (двух или большего количества аминокислот), или с помощью комбинации обоих методов, или с помощью твердофазного пептидного синтеза с использованием метода, впервые описанного у Merrifield,J. Am. Chem. Soc. 85. 2149-2154 (1963) (содержание публикации включено в настоящее описание в качестве ссылки). Сочетание двух аминокислот, аминокислоты и пептида или двух пептидных фрагментов можно осуществлять с помощью стандартных методов сочетания, таких как азидный метод,метод на основе смешанного ангидрида угольной-карбоновой кислоты (изобутилхлорформиат), карбодиимидный (дициклогексилкарбодиимид, диизопропилкарбодиимид или водорастворимый карбодиимид) метод, метод на основе активного сложного эфира (паранитрофениловый эфир, N-гидроксисукцинимидовый эфир),K-метод с использованием реагента Вудварда,карбонилдиимидазольный метод, метод, основанный на использовании фосфорных реагентов, и окислительно-восстановительные методы. Некоторые из этих методов (прежде всего карбодиимидный метод) может быть интенсифицирован добавлением 1-гидроксибензотриазола. Эти реакции сочетания можно проводить либо в растворе (жидкая фаза), либо в твердой фазе. Стадия сочетания включает, в частности,дегидрационное сочетание свободного карбоксила одного реагента со свободной аминогруппой другого реактанта в присутствии агента сочетания с получением амидной связи. Такие агенты сочетания описаны в общедоступных справочниках по химии пептидов, например у М. Bodanszky, "Peptide Chemistry", 2-е переработанное издание, изд-во Springer-Verlag, Berlin,Germany (1993). Примерами приемлемых агентов сочетания являются N,N'-дициклогексилкарбодиимид, 1-гидроксибензотриазол в при 004765N-этил-N'-[(3-диметиламино)пропил]карбодиимида. Пригодным для применения на практике агентом сочетания, который имеется в продаже,является гексафторфосфат бензотриазол-1 илокси) трис(диметиламино)фосфония либо индивидуально, либо в присутствии 1 гидроксибензотриазола. Другим пригодным для применения на практике агентом сочетания,который имеется в продаже, является тетрафторборат 2-(1 Н-бензотриазол-1-ил)-N,N,N',N'тетраметилурония. Еще одним пригодным для применения на практике агентом сочетания,который имеется в продаже, является гексафторфосфат О-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония. Реакцию сочетания проводят в инертном растворителе, например дихлорметане, ацетонитриле или диметилформамиде. Для поддержания значения рН реакционной смеси на уровне примерно 8 добавляют избыток третичного амина, например диизопропилэтиламина, Nметилморфолина или N-метилпирролидона. Температура реакции, как правило, составляет от 0 до 50 С, а время проведения реакции, как правило, колеблется от 15 мин до 24 ч. При применении твердофазного синтеза Сконцевую карбоновую кислоту присоединяют к нерастворимому носителю (обычно полистиролу). Эти нерастворимые носители содержат группу, которая может взаимодействовать с карбоксильной группой с образованием связи,которая сохраняет стабильность в течение требуемого продолжительного промежутка времени, а затем легко расщепляется. В качестве примеров таких носителей можно назвать хлор- или бромметиловую смолу, гидроксиметиловую смолу и аминометиловую смолу. Многие такие смолы с уже включенной требуемой С-концевой аминокислотой имеются в продаже. В другом варианте аминокислота может быть включена в твердый носитель с помощью известных методов (Wang S.-S., J. Am. Chem. Soc, (1973), 95,1328; Atherton E.; Shepard R.C. "Solid-phase peptide synthesis; a practical approach", изд-во IRLPress: Oxford, (1989), 131-148). Помимо вышеуказанных можно применять и другие методы пептидного синтеза, описанные у Stewart и(1984) (содержание этих публикаций включено в настоящее описание в качестве ссылки). Функциональные группы применяемых аминокислот, как правило, должны быть защищены во время реакций сочетания во избежание образования нежелательных связей. Защитные группы, которые могут применяться для этойPress, New York (1981) (содержание этих публикаций включено в настоящее описание в качестве ссылки).-Карбоксильную группу С-концевого остатка, как правило, защищают в виде сложного эфира (CPG), который должен быть расщеплен с образованием карбоновой кислоты. Защитные группы, которые могут применяться с этой целью, включают 1) сложные алкиловые эфиры,такие как метиловый, триметилсилилэтиловый и трет-бутиловый, 2) сложные аралкиловые эфиры, такие как бензиловый и замещенный бензиловый, или 3) сложные эфиры, которые могут расщепляться в результате обработки слабым основанием или в слабых восстановительных условиях, такие как трихлорэтиловый и фенациловый эфиры.-Аминогруппа каждой аминокислоты, которая должна присоединяться, удлиняя пепетидную цепь, должна быть защищенной (APG). Для этого могут применяться любые защитные группы. Примеры таких групп включают 1) ацильные группы, такие как формил, трифторацетил, фталил и паратолуолсульфонил, 2) ароматические карбаматные группы, такие как бензилоксикарбонил (Cbz или Z) и замещенные бензилоксикарбонилы, а также 9-флуоренилметилоксикарбонил (Fmoc), 3) алифатические карбаматные группы, такие как трет-бутоксикарбонил (Воc), этоксикарбонил, диизопропилметоксикарбонил и аллилоксикарбонил, 4) циклические алкилкарбаматные группы, такие как циклопентилоксикарбонил и адамантилоксикарбонил, 5) алкильные группы, такие как трифенилметил и бензил, 6) триалкилсилил, такой как триметилсилил, и 7) тиолсодержащие группы, такие как фенилтиокарбонил и дитиасукциноил. Предпочтительными -аминозащитными группами являются либо Воc, либо Fmoc. Многие аминокислотные производные, защищенные таким образом, как это требуется для синтеза пептидов, имеются в продаже.-Аминозащитную группу вновь добавляемого остатка аминокислоты отщепляют перед сочетанием со следующей аминокислотой. Если применяют группу Воc, то выбирают метод на основе трифторуксусной кислоты, чистой или в дихлорметане, или НСl в диоксане или в этилацетате. Образовавшуюся аммонийную соль затем нейтрализуют либо до сочетания,либо in situ с помощью основных растворов,таких как водные буферы или третичные амины в дихлорметане, ацетонитриле или диметилформамиде. Если применяют группу Fmoc, то выбирают такие реагенты, как пиперидин или замещенный пиперидин в диметилформамиде,но также может использоваться любой вторич 004765 24 ный амин. Защитные группы удаляют при температуре от 0 С до комнатной (КТ), обычно составляющей 20-22 С. Любые аминокислоты, имеющие функционально активные группы в боковой цепи,должны быть защищены в процессе получения пептида с помощью любой из описанных выше групп. Очевидно, что выбор и применение защитных групп для этих функционально активных групп в боковой цепи зависит от аминокислоты и наличия других защитных групп в пептиде. Выбор таких защитных групп является важным в том плане, что группа не должна быть удалена во время удаления защитных групп и сочетания -аминогруппы. Так, например, когда в качестве аминозащитной группы используют Воc, то приемлемыми являются следующие защитные группы боковой цепи: паратолуолсульфонильные (тозильные) фрагменты, которые можно применять для защиты аминогруппы боковой цепи таких аминокислот, как Lys и Arg, ацетамилометильный, бензильный (Вn) или третбутилсульфонильный фрагменты,которые можно применять для содержащей сульфид боковой цепи цистеина, простые бензиловые (Вn) эфиры, которые можно применять для содержащих гидроксигруппу боковых цепей серина,треонина или гидроксипролина, и сложные бензиловые эфиры, которые можно применять для защиты содержащих карбоксильные группы боковых цепей аспарагиновой кислоты и глутаминовой кислоты. Когда для защиты -аминогрупп выбирают Fmoc, как правило, приемлемыми являются защитные группы на основе трет-бутила. Например, Воc может применяться для лизина и аргинина, простой трет-бутиловый эфир - для серина, треонина и гидроксипролина, а сложный трет-бутиловый эфир - для аспарагиновой кислоты и глутаминовой кислоты. Трифенилметильный фрагмент (тритил) может применяться для защиты содержащей сульфид боковой цепи цистеина. Если W обозначает амид (w), P1 подвергают сочетанию с соответствующим амином до сочетания с Р 2. Такое аминирование хорошо известно в данной области. По завершении удлинения пептида все защитные группы удаляют. Если используют синтез в жидкой фазе, то защитные группы удаляют любым методом, который зависит от выбора защитных групп. Эти методы хорошо известны. Если используют синтез в твердой фазе, то пептид отщепляют от смолы одновременно с удалением защитных групп. Если для синтеза применяют метод на основе защиты с помощью Воc, то обработка безводной HF, содержащей такие добавки, как диметилсульфид, анизол,тиоанизол или пара-крезол, при 0 С представляет собой предпочтительный метод отщепления 25 пептида от смолы. Отщеплять пептид также можно с помощью других кислотных реагентов,таких как смеси трифторметансульфоновой кислоты/трифторуксусной кислоты. Если для синтеза применяют метод на основе защиты с помощью Fmoc, то N-концевую групп Fmoc отщепляют с помощью указанных выше реагентов. Другие защитные группы и пептиды отщепляют от смолы с помощью раствора трифторуксусной кислоты и различных добавок, таких как анизол и т.д. Синтез блокирующей группы В и фрагментов Р 6, Р 5, Р 4 и Р 3 Различные блокирующие группы В вводят в Р 4, Р 5 или Р 6 или любой другой пептидный сегмент, защищенный с помощью соотвествующего ацилхлорида или сульфонилхлорида,который либо имеется в продаже, либо синтез которого хорошо известен в данной области. Различные фрагменты Р 6-Р 3 имеются в продаже или могут быть синтезированы с помощью хорошо известного метода. 1. Синтез фрагментов Р 2. 1.1. Синтез предшественников. А) Синтез галоарилметановых производных. Галометил-8-хинолин IId получали по методу, описанному у K.N. Campbell и др., J. Amer. Этот метод состоит в основном в следующем: 8-хинолинкарбоновую кислоту IIа превращали в соответствующий спирт IIс восстановлением соответствующего ацилгалогенидаIIb с помощью такого восстановителя, как алюмогидрид лития. Обработкой спирта IIb соответствующей галогенводородной кислотой получали требуемое галогенсодержащее производное IId. Конкретный вариант осуществления этого способа представлен в примере 1 А. Б) Синтез ариловых спиртовых производных 2-фенил-4-гидроксихинолиновые производные IIIс получали по методу, описанному уR22 и R21B обозначают алкил, ОН, SH, галоген, NH2, NO2. Бензоилацетамид (IIIа) конденсировали с соответствующим анилином (IIIb) и полученный имин подвергали циклизации с полифосфорной кислотой (ПФК), получая соответст 004765 26 свующий 2-фенил-4-гидроксихинолин (IIIс). Конкретный вариант осуществления этого способа представлен в примерах 1 Б и 1 В. 1.2. Синтез Р 2. А) Синтез 4-замещенного пролина (где R2 присоединен к кольцу через атом углерода) Синтез осуществляли в соответствии со схемой IV по методу, описанному у J. Ezquerra и др. (Tetrahedron 38, 8665-8678 (1993 и С. Этот метод состоит в основном в следующем: Вос-пироглутаминовую кислоту защищали в виде бензилового эфира. После обработки сильным основанием, таким как диизопропиламид лития, с последующим добавлением алкилирующего агента (Br-R20 или I-R20) получали требуемые соединения IVe после восстановления амида и удаления сложного эфира. Б) Синтез О-аралкилированного 4-(R)гидроксипролина.(низш.)алкил-Неt, процесс можно осуществлять по методу, описанному у Е.М. Smith и др. (J.Med. Chem. 31, 875-885 (1988. Этот метод состоит в основном в следующем: имеющийся в продаже Вос-4(R)-гидроксипролин обрабатывали основанием, таким как гидрид натрия или K-tBuo(трет-бутоксид калия), и образовавшийся алкоксид подвергали взаимодействию с гало-R20 (BrR20, I-R20 и т.д.), получая требуемые соединения. Конкретные варианты осуществления этого способа представлены в примерах 2, 3 и 4 Б. В) В альтернативном варианте, когда R20 обозначает арил или Het, соединения также могут быть получены по реакции Митсунобу (Mitsunobu, Synthesis, январь, 1-28 (1981); Rano и др., Tet. Lett. 36(22), 3779-3792 (1995); Krchnak и др., Tet. Lett. 36(5), 62193-62196 (1995); Richter и др., Tet. Lett. 35(27), 4705-4706 (1994. Этот метод состоит в основном в следующем: имеющийся в продаже метиловый эфир Вос-4-(S)гидроксипролина подвергали взаимодействию с соответствующим ариловым спиртом или тиолом в присутствии трифенилфосфина и диэтилазодикарбоксилата (ДЭАД) и образовавшийся сложный эфир гидролизовали с получением 27 кислоты. Конкретный вариант осуществления этого способа представлен в примере 4 А. В альтернативном варианте реакцию Митсунобу можно проводить в твердой фазе (схемаV). Для этого в 96-луночный блок синтезатора модели 396 (поставляемый фирмой ChemTech) вносили аликвоты связанного со смолой соединения (Va) и различные ариловые спирты или тиолы и добавляли соответствующие реагенты. После инкубации каждый связанный со смолой продукт (Vb) промывали, сушили и отщепляли от смолы. Для дополнительного введения функциональных групп в арильный заместитель может также применяться реакция Сузуки (Miyaura и др., Synth. Comm. 11, 513 (1981); Sato и др.,Chem. Lett., 1405 (1989); Watanabe и др., Synlett,207 (1992); Takayuki и др., J. Org. Chem. 58, 2201(1996. 2. Синтез фрагментов P1 (2-замещенная 1 аминоциклопропилкарбоновая кислота). Синтез осуществляли согласно схеме VI. а) Этот метод состоит в основном в следующем: дважды защищенный малонат VIa и 1,2-дигалоалкан VIb или циклический сульфатVIc (синтезированный по методу, описанному у К. Burgess и Chun-Yen KE (Synthesis (1996),1463-1467), подвергали взаимодействию в основных условиях, получая диэфир VId. б) Осуществляли избирательный по отношению к определенной области гидролиз наи 004765 28 менее пространственно затрудненного эфира,получая кислоту VIe. в) Эту кислоту VIe подвергали перегруппировке Курциуса, получая рацемическую смесь производных 1-аминоциклопропилкарбоновой кислоты VIf, в которых R1 находится в син-ориентации относительно карбоксильной группы. Конкретный вариант осуществления этого способа представлен в примере 5. г, д) В альтернативном варианте избирательное образование эфира из кислоты VIe с помощью галогенида (Р Сl) или спирта (Р ОН) позволило получить диэфир VIg, в котором Рэфир может подвергаться избиральному гидролизу в виде Р-эфира. Гидролиз Р-эфира позволил получить кислоту VIh. е) Перегруппировка Курциуса кислоты VIh позволила получить рацемическую смесь производных 1-аминоциклопропилкарбоновой кислоты VIi, в которых группа R1 находится в анти-ориентации относительно карбоксильной группы. Конкретный вариант осуществления этого способа представлен в примере 10. Ниже описан альтернативный вариант синтеза производных VIIf (где R1 обозначает винил и находится в син-ориентации относительно карбоксильной группы).VIIa с помощью 1,4-дигалобутена VIIb в присутствии оснований получали после гидролиза образовавшего имина VIIc соединение VIId,которое имеет аллильный заместитель, находящийся в син-ориентации относительно карбоксильной группы. Конкретный вариант осуществления этого способа представлен в примере 11. Все указанные выше энантиомерные смеси можно разелять относительно углерода в положении 1 (VIe и VIId) путем: 1) ферментативного разделения (примеры 9 и 13),2) кристаллизации с хиральной кислотой(пример 14) или 3) химической дериватизации (пример 6). После разделения абсолютную стереохимию можно определять по методике, описанной в примере 7. Разделение энантиомеров и определение стереохимического строения можно осуществлять аналогично тому, как это описано для энантиомерных смесей относительно углерода в положении 1, в которых заместитель С 2 находится в анти-ориентации относительно карбоксильной группы (VIi). Изобретение также относится к способу получения пептидного аналога формулы (I), в 29 котором Р 1 обозначает остаток замещенной аминоциклопропилкарбоновой кислоты, предусматривающему сочетание пептида, выбранного из ряда, включающего APG-P6-P5-P4-P3-P2,APG-P5-P4-P3-P2, APG-P4-P3-Р 2, APG-P3-P2 и где R1 обозначает С 1-С 6 алкил или С 2 С 6 алкенил, необязательно замещенный галогеном, CPG обозначает карбоксизащитную группу, APG обозначает аминозащитную группу, а Р 6-Р 2 имеют указанные выше значения. Кроме того, изобретение относится к применению промежуточного продукта формулы: МС где R1 обозначает С 1-С 6 алкил или С 2 С 6 алкенил, необязательно замещенный галогеном, предназначенному для получения соединения формулы I, как оно определено выше. Примеры Ниже изобретение проиллюстрировано на примерах, не ограничивающих его объем. Температуры указаны в градусах Цельсия. Проценты для растворов представляют собой отношения массы к объему (мас./об.), а соотношения в растворах представляют собой объемные соотношения, если не указано иное. Спектры ядерного магнитного резонанса (ЯМР) регистрировали с помощью спектрометра фирмыBrucker при частоте 400 МГц, химические сдвигивыражены в част./млн. Экспрессхроматографию проводили на силикагеле (SiO2) согласно экспресс-хроматографическому методу Стилла (W.C. Still и др., J. Org. Chem., 43,2923 (1978. В примерах использованы следующие сокращения: Вn бензил трет-бутилоксикарбонил ВоcMe3 СОС(О) БСА бычий сывороточный альбумин 3-[(3-холамидопропил)диметилХАПС аммоний]-1-пропансульфонат ДБУ 1,8-диазабицикло[5.4.0]ундец-7-ен СН 2 Сl2 = метиленхлорид ДХМ ДЭАД диэтилазодикарбоксилат ДИАД диизопропилазодикарбоксилат ДИЭА диизопропилэтиламин ДИПЭА диизопропилэтиламин ДМАП диметиламинопиридин ДЦК 1,3-дициклогексилкарбодиимид ДМЭ 1,2-диметилоксиэтан ДМФ диметилформамид ДМСО диметилсульфоксидPNA ТБАФ ТБТУ ТКЭФ ТФК ТГФ ТИС ТСХ ТМСЭ Трис/HCl дитиотреитол или трео-1,4 димеркапто-2,3-бутандиол дифенилфосфорилазид этилендиаминтетрауксусная кислота этил этанол этилацетат диэтиловый эфир гексафторфосфат О-7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония жидкостная хроматография высокого разрешения масс-спектрометрияFlight (время пролета при лазерной десобционной ионизации с участием матрицы; FAB: бомбардировка ускоренными атомами) алюмогидрид лития метил метанолN-метилпирролидин пропил 3-карбоксипропаноил 4-нитрофениламино или паранитроанилид тетра-н-бутиламмонийфторид тетрафторборат 2-(1 Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония гидрохлорид трис(2-карбоксиэтил)фосфина трифторуксусная кислота тетрагидрофуран триизопропилсилан тонкослойная хроматография триметилсилилэтил гидрохлорид трис(гидроксиметил)аминометана К имеющейся в продаже 8-хинолинкарбоновой кислоте (2,5 г, 14,4 ммоля) добавляли чистый тионилхлорид (10 мл, 144 ммоля). Эту смесь выдерживали при 80 С в течение 1 ч,после чего избыток тионилхлорида удаляли путем перегонки при пониженном давлении. К 31 образовавшемуся твердому продукту коричневатого цвета добавляли абсолютный EtOH (15 мл) и смесь выдерживали при 80 С в течение 1 ч, после чего концентрировали в вакууме. Остаток распределяли между ЕtOАс и насыщенным водным раствором NaHCO3, органическую фазу сушили (MgSO4), фильтровали и концентрировали, получая масло коричневатого цвета (2,8 г). Этот продукт (приблизительно 14,4 ммоля) добавляли по каплям в течение 35 мин к суспензии АГЛ (0,76 г, 20,2 ммоля) в Et2O, которая была охлаждена до -60 С. Реакционную смесь медленно негревали в течение 1,5 ч до -35 С до завершения реакции. Реакцию прекращали,медленно добавляя в течение 30 минMgSO410H2O, а затем влажный ТГФ. Смесь распределяли между Еt2 О и 10%-ным водным раствором NaHCO3. Органическую фазу сушили(MgSO4), фильтровали и концентрировали, получая твердый продукт желтоватого цвета (2,31 г, 80% для 2 стадий), представляющий собой спирт. Этот спирт (2,3 г, 11,44 ммоля) растворяли в АсОН/HBr (20 мл, 30%-ный раствор, поставляемый фирмой Aldrich) и выдерживали при 70 С в течение 2,5 ч. Смесь концентрировали в вакууме досуха, распределяли между ЕtOАс (100 мл) и насыщенным водным раствором NaHCO3, после чего сушили (MgSO4),фильтровали и концентрировали, получая требуемое соединение (1 А) в виде твердого вещества коричневатого цвета (2,54 г, 100%). Пример 1 Б. Синтез 2-фенил-4-гидроксихинолина (1B).(6,00 г, 31,2 ммоля) выдерживали при 85 С (в запечатанной пробирке) в течение 2 ч в 75 мл 30%-ного NH4OH. Образовавшийся после охлаждения твердый продукт фильтровали и кипятили с обратным холодильником в воде в течение 2 ч. Раствор экстрагировали три разаCH2Cl2. Органические слои объединяли, сушили над MgSO4, фильтровали и концентрировали. Остаток желтого цвета хроматографировали на силикагеле, элюируя смесью EtOAc/гексан (3:7),с получением соответствующего амида в виде твердого вещества белого цвета, 1,60 г, выход 31%. Этот амид (250 мг, 1,53 ммоля) кипятили с обратным холодильником в аппарате ДинаСтарка с анилином (143 мг, 1,53 ммоля) и анилинНСl (10 мг, 0,08 ммоля) толуоле (10 мл) в течение 16 ч. Раствор концентрировали, получая масло коричневого цвета, смешанное с полифосфорной кислотой (2 г), и выдерживали при 135 С в течение 20 мин. Реакционную смесь сливали в воду и значение рН доводили до 8 с помощью 5M NaOH. Водную суспензию дважды экстрагировали этилацетатом. Органические 32 слои объединяли, промывали соляным раствором, сушили над MgSO4 фильтровали и концентрировали. Остаток подвергали экспрессхроматографии на силикагеле, элюируя 3%-ным МеОН в этилацетате, с получением 2-фенил-4 гидроксихинолина (1 В), 67 мг, выход 20%. 1(b) (100,0 г, 0,52 моля), метаанидизин (а) (128,1 г, 1,04 моля) и 4 н. НСl/диоксан (5,2 мл) в толуоле (1,0 л), кипятили с обратным холодильником в течение 6,25 ч в аппарате Дина-Старка. Охлажденный толуольный раствор последовательно промывали 10%-ным водным раствором НС 1(2x300 мл), 1 н. NaOH (2x300 мл), Н 2 О (300 мл) и соляным раствором (150 мл). Толуольную фазу сушили (MgSO4), фильтровали и концентрировали при пониженном давлении, получая смесь(1,2:1,0) сложного эфира с и амида d (144,6 г,выход неочищенных продуктов 45%/38%) в виде масла темно-коричневого цвета. Неочищенное масло нагревали до 280 С в течение 80 мин,отгоняя при этом образовавшийся EtOH. Полученный охлажденный твердый продукт растирали с CH2Cl2 (200 мл). Суспензию фильтровали и образовавшийся твердый продукт промывали СН 2 Сl2, получая соединение е (22,6 г, 17% относительно а) в виде твердого вещества бежевого цвета. 1(s, 1H), 3,87 (s, 3H). 4-Хлор-2-фенил-7-метоксихинолин (1 С). Суспензию соединения (е) (8,31 г, 33,1 ммоля) в РОСl3 (90 мл) нагревали с обратным холодильником в течение 2 ч (после нагревания получали прозрачный раствор). Реакционную смесь концентрировали при пониженном давлении. Остаток распределяли между 1 н. NaOH(экзотермическая реакция, для поддержания высокого значения рН добавляли 10 н. NaOH) и ЕtOАс (500 мл). Органический слой промывали Н 2 О (100 мл) и соляным раствором (100 мл), а затем сушили (MgSO4), фильтровали и концентрировали при пониженном давлении, получая 33 соединение 1 С (8,60 г, выход 96%) в виде твердого вещества светло-желтого цвета. 1 Н-ЯМР (ДМСО-d6):8,28-8,30 (m, 2 Н),8,20 (s, 1H), 8,10 (d, J = 9,1 Гц, 1H), 7,54-7,58 (m,3H), 7,52 (d, J = 2,5 Гц, 1H), 7,38 (dd, J = 9,1, 2,5 Гц, 1 Н), 3,98 (s, 3H). Эту реакцию повторяли трижды и всегда получали выход 96-98%, что существенно превышает 68%-ный выход, о котором сообщалось в J. Med. Chem. (1997), 40, 1794. Пример 2. Синтез Вос-4-(R)-(нафталин-1 илметокси)пролина (2). Имеющийся в продаже Вос-4-(R)гидроксипролин (5,00 г, 21,6 ммоля) растворяли в ТГФ (100 мл) и охлаждали до 0 С. Порциями в течение 10 мин добавляли гидрид натрия (60%ная дисперсия в масле, 1,85 г, 45,4 ммоля) и суспензию перемешивали при комнатной температуре в течение 1 ч. Затем добавляли 1(бромметил)нафталин (8,00 г, 36,2 ммоля) (полученный по методу, описанному у Е.А. Dixon и др., Can. J. Chem. 59, 2629-2641 (1981 и смесь нагревали с обратным холодильником в течение 18 ч. Смесь сливали в воду (300 мл) и промывали гексаном. Водный слой подкисляли 10%-ным водным раствором НСl и дважды экстрагировали этилацетатом. Водные слои объединяли и промывали соляным раствором, сушили(MgSO4), фильтровали и концентрировали. Остаток очищали с помощью экспресс-хроматографии (смесь гексан/этилацетат/уксусная кислота в соотношении 49:49:2), получая указанное в заголовке соединение в виде бесцветного масла (4,51 г, выход 56%). Н-ЯМР (ДМСО-d6), результаты свидетельствуют о наличии двух ротамеров:8,05 (m,1H), 7,94 (m, 1 Н), 7,29 (d, J = 14 Гц, 1 Н), 7,557,45 (m, 4 Н), 4,96 (m, 2 Н), 4,26 (шир. s, 1H), 4,12 К суспензии NaH (1,4 г, 60%-ная в масле,34 ммоля) в ТГФ (100 мл) добавляли Вос-4-(R)гидроксипролина (1,96 г, 8,5 ммоля) в безводном ТГФ (20 мл). Эту смесь перемешивали в течение 30 мин, после чего добавляли бромметил-8-хинолин из примера 1 (2,54 г, 11,44 ммоля) в ТГФ (30 мл). Реакционную смесь выдерживали при 70 С (5 ч), после чего избыток NaH осторожно растворяли влажным ТГФ. Реакци 004765 34 онную смесь концентрировали в вакууме и образовавшийся продукт растворяли в ЕtOАс и Н 2 О. Основную водную фазу отделяли и подкисляли с помощью 10%-ного водного раствора НС 1 до рН 5, после чего экстрагировали ЕtOАс(150 мл). Органическую фазу сушили (MgSO4),фильтровали и концентрировали, получая масло коричневого цвета. После очистки с помощью экспресс-хроматографии (элюент: 10%-ный МеОН/СНСl3) получали требуемое соединение(5) в виде твердого вещества светло-желтого цвета (2,73 г, выход 86%), ЖХВР (97,5%). 1 Н-ЯМР (ДМСО-d6), результаты свидетельствуют о наличии ротамеров в соотношении 6:4:12-11,4 (шир. s, 1H), 8,92 (2xd, J = 4,14 и 4,14 Гц, 1 Н), 8,38 (2xd, J = 8,27 и 8,27 Гц, 1 Н),7,91 (d, J = 7,94 Гц, 1H), 7,77 (d, J = 7,0 Гц, 1H),7,63-7,54 (m, 2H), 5,14 (2xs, 2H), 4,32-4,29 (m,1H), 4,14-4,07 (m, 1 Н), 3,52-3,44 (m, 2H), 2,432,27 (m, 1H), 2,13-2,04 (m, 1H), 1,36 и 1,34 (2xs,9H). Пример 4 А. Получение Вос-4-(R)-(7-хлорхинолин-4-оксо)пролина (4 А). Имеющийся в продаже метиловый эфир Вос-4-(S)-гидроксипролина (500 мг, 2,04 ммоля) и 7-хлор-4-гидроксихинолин (440 мг, 2,45 ммоля) растворяли в безводном ТГФ (10 мл) при 0 С. Добавляли трифенилфосфин (641 мг, 2,95 ммоля), а затем медленно добавляли ДИАД (426 мг, 2,45 ммоля). Смесь перемешивали при КТ в течение 20 ч. Затем реакционную смесь концентрировали, растворяли в этилацетате и трижды экстрагировали 1 н. НСl. Водную фазу подщелачивали с помощью Na2CO3 и дважды экстрагировали этилацетатом. Органические слои объединяли, сушили над MgSO4, фильтровали и концентрировали, получая масло желтого цвета. Масло очищали экспресс-хроматографией, получая сложный метиловый эфир в виде твердого вещества белого цвета, 498 мг, выход 58%. Этот сложный метиловый эфир (400 мг,0,986 ммоля) подвергали гидролизу с помощью 1 М водного раствора гидроксида натрия (1,7 мл,1,7 ммоля) в метаноле (4 мл) при 0 С в течение 3 ч. Раствор концентрировали для удаления метанола и нейтрализовали 1 М водным раствором НСl. Суспензию концентрировали досуха и растворяли в метаноле (20 мл), соли отфильтровывали и фильтрат концентрировали, получая требуемое соединение (4 А) в виде твердого вещества белого цвета, 387 мг, количественный выход. 1(6,73 г, 29,1 ммоля) в ДМСО (83 мл), температуру которого поддерживали на уровне 25 С,малыми порциями в течение 15 мин добавляли трет-бутоксид калия (8,16 г, 72,7 ммоля). Смесь перемешивали при 25 С в течение 1,5 ч. К реакционной смеси 4-мя порциями в течение 15 мин добавляли хлор-2-фенил-7-метоксихинолин 1 С(8,61 г, 32,0 ммоля). Реакционную смесь перемешивали при 25 С в течение 19 ч. Образовавшуюся суспензию сливали на Н 2 О (650 мл) и смесь промывали Et2O (3x150 мл) для удаления избытка хлорхинолина (в последующем было установлено, что ЕtOАс является более эффективным). Водный слой подкисляли 1 н. водным раствором НСl (по расчету требуется 1,5 экв.,т.е. 38 мл, брали 43,6 мл) до значения рН 4-5. Осадившийся твердый продукт белого цвета выделяли фильтрацией. Влажный твердый продукт сушили при пониженном давлении над Р 2 О 5, получая пролиновое производное 4 В (12,6 г, выход 91%, содержание ДМСО 2,3 об.%) в виде твердого вещества бежевого цвета. 1H-ЯМР (ДМСО-d6) (смесь ротамеров 2:1):8,27 (d, J = 7,0 Гц, 2 Н), 8,00, 7,98 (2d, J = 9,2,9,2 Гц, 1H), 7,48-7,56 (m, 3H), 7,45, 7,43 (2s,1H), 7,39 (d, J = 2,5 Гц, 1 Н), 7,17 (dd, J= 9,2, 2,5 Гц, 1H), 5,53-5,59 (m, 1 Н), 4,34-4,41 (m, 1 Н),3,93 (s, 3H), 3,76 (широкий S, 2 Н), 2,63-2,73 (m,1H), 2,32-2,43 (m, 1H), 1,36, 1,33 (2s, 9H). Элементы структуры P1. Пример 5. Синтез смеси изомеров (1R,2R)/(1S,2R)-1-амино-2-этилциклопропилкарбоновой кислоты. а) К суспензии бензилтриэтиламмонийхлорида (21,0 г, 92,19 ммоля) в 50%-ном водном растворе NaOH (92,4 г в 185 мл Н 2 О) последовательно добавляли ди-трет-бутилмалонат (20,0 г,92,47 ммоля) и 1,2-дибромбутан (30,0 г, 138,93 ммоля). Реакционную смесь интенсивно пере 004765 36 мешивали в течение ночи при КТ, а затем добавляли смесь льда и воды. Неочищенный продукт трижды (3 х) экстрагировали CH2Cl2, последовательно промывали водой (3 х) и соляным раствором. Органический слой сушили(MgSO4), фильтровали и концентрировали. Остаток подвергали экспресс-хроматографии (7 см, от 2 до 4% Et2O в гексане), получая требуемое циклопропановое производное 5 с (19,1 г,70,7 ммоля, выход 76%). 1 Н-ЯМР (CDCl3):1,78-1,70 (m, 1 Н), 1,47(m, 3H), 1,02 (t, 3H, J = 7,6 Гц). б) К суспензии трет-бутоксида калия (6,71 г, 59,79 ммоля, 4,4 экв.) в безводном простом эфире (100 мл) при 0 С добавляли Н 2 О (270 мкл,15,00 ммоля, 1,1 экв.). Через 5 мин к суспензии добавляли сложный диэфир 5 с (3,675 г, 13,59 ммоля) в простом эфире (10 мл). Реакционную смесь перемешивали в течение ночи при КТ, а затем сливали на смесь лед/вода и промывали простым эфиром (3 х). Водный слой подкисляли 10%-ным водным раствором лимонной кислоты при 0 С и экстрагировали AcOEt (3 х). Объединенные органические слои последовательно промывали водой (2 х) и соляным раствором. После обычной переработки (Na2SO4, фильтрация, концентрирование) выделяли требуемую кислоту 5d в виде масла светло-желтого цвета(dd, J = 3,0, J = 8,2 Гц, 1H), 1,63-1,56 (m, 1H),1,51 (s, 9H), 1,0 (t, J = 7,3 Гц, 3H). в) К кислоте 5d (2,017 г, 9,414 ммоля) в безводном бензоле (32 мл) последовательно добавляли Et3N (1,50 мл, 10,76 ммоля, 1,14 экв.) и ДФФА (2,20 мл, 10,21 ммоля, 1,08 экв.). Реакционную смесь кипятили с обратным холодильником в течение 3,5 ч и затем добавляли 2 триметилсилилэтанол (2,70 мл, 18,84 ммоля, 2,0 экв.). Кипячение с обратным холодильником продолжали в течение ночи, а затем реакционную смесь разбавляли Et2O и последовательно промывали 10%-ным водным раствором лимонной кислоты, водой, насыщенным водным раствором NaHCO3, водой (2 х) и соляным раствором. После обычной переработки (MgSO4,фильтрация, концентрирование) остаток очищали с помощью экспресс-хроматографии (5 см,10%-ный AcOEt в гексане), получая требуемый карбамат 5 е (2,60 г, 7,88 ммоля, выход 84%) в виде масла светло-желтого цвета. МС (FAB) 330 (МН+). 1 Н-ЯМР (CDCl3):5,1 (шир. s, 1H), 4,184,13 (m, 2 Н), 1,68-1,38 (m, 4 Н), 1,45 (s, 9 Н), 1,241,18 (m, 1 Н), 1,00-0,96 (m, 5 Н), 0,03 (s, 9H). г) К карбамату 5 е (258 мг, 0,783 ммоля) добавляли 1,0 М раствор ТБАФ в ТГФ (940 мкл,0,94 ммоля, 1,2 экв.). Через 4,5 ч добавляли дополнительное количество 1,0 М ТБАФ (626 мкл, 37 0,63 ммоля, 0,8 экв.). Реакционную смесь перемешивали при КТ в течение ночи, кипятили с обратным холодильником в течение 30 мин и затем разбавляли AcOEt. Раствор последовательно промывали водой (2 х) и соляным раствором. После обычной переработки (MgSO4,фильтрация, концентрирование) выделяли требуемый амин 5f (84 мг, 0,453 ммоля, выход 58%) в виде жидкости светло-желтого цвета. 1(dd, J = 4,1, 7,3 Гц, 1 Н), 1,02 (dd, J = 4,1, 9,2 Гц,1 Н), 0,94 (t, J = 7,3 Гц, 3H). Пример 6. Химическое разделение изомеров трет-бутил-(1R,2R)/(1S,2R)-1-амино-2 этилциклопропилкарбоксилата (из примера 5). Соединение 5 е из примера 5 (8,50 г, 25,86 ммоля) обрабатывали 1 М ТБАФ/ТГФ (26 мл) при кипячении с обратным холодильником в течение 45 мин. Охлажденную реакционную смесь разбавляли EtOAc, промывали водой (3 х) и соляным раствором (1 х), а затем сушили(MgSO4), фильтровали и упаривали, получая свободный амин в виде масла светло-желтого цвета. Этот свободный амин растворяли в безводном CH2Cl2 (120 мл), N-MM (8,5 мл, 77,57 ммоля), последовательно добавляли соединение 2 (пример 2) (10,08 г, 27,15 ммоля) и ГАТУ(11,79 г, 31,03 ммоля). Реакционную смесь перемешивали при КТ в течение ночи и затем подвергали описанной выше переработке. Неочищенную смесь диастереоизомеров разделяли с помощью экспресс-хроматографии (элюент: гексан/Еt2 О в соотношении 25:75), получая дипептид 6 а (менее полярное элюированное пятно) в виде пены белого цвета (4,42 г; выход 64% от теоретического) и 6b (более полярное элюированное пятно) в виде пены цвета слоновой кости (4 г, выход 57% от теории). К этому моменту два изомера были разделены, но абсолютное стереохимическое строение еще не было известно. Пример 7. Определение абсолютного стереохимического строения соединений 6 а и 6b на основе корелляции с известным трет-бутил(1Rамино-2R-этилциклопропилкарбоксилатом. Соединение 7 а, имеющее приведенное выше абсолютное стереохимическое строение,которое было определено с помощью рентгеноструктурного анализа (J. Am. Chem. Soc, 117,12721, 1995), было предоставлено проф. A.Charette из Монреальского университета. Соединение 7 а (13,2 мг, 0,046 ммоля) растворяли в 1 М HCl/EtOAc (240 мкл) и перемешивали в течение приблизительно 48 ч. Смесь упаривали досуха, получая соединение 7b в виде пасты светло-желтого цвета, и осуществляли сочетание с соединением 2 (18 мг, 0,049 ммоля), как это описано в примере 10, используя N-MM(20,3 мкл, 0,185 ммоля) и ГАТУ (21,1 мг, 0,056 ммоля) в СН 2 Сl2. Неочищенный продукт очищали с помощью экспресс-хроматографии(элюент: гексан/Еt2 О в соотношении 50:50), получая дипептид 7 с в виде масла (7,7 мг; выход 31%). Путем сравнения данных, полученных с помощью ТСХ, ЖХВР и ЯМР, было установлено, что дипептид 7 с идентичен менее полярному соединению 6 а, полученному в примере 10, а это свидетельствует о том, что абсолютное стереохимическое стороение соединения 6 а описывается как (1R, 2R). Пример 8. Получение изомеров (1R,2R)/ Карбамат 5 е из примера 9 (2,6 г, 7,88 ммоля) смешивали в течение 40 мин с ТФК при 0 С. Затем смесь концентрировали и разбавляли ТГФ(10 мл). Добавляли водный раствор NaOH (700 мг, 17,5 ммоля в 8,8 мл Н 2 О), а затем раствор(Вос)2 О (2,06 г, 9,44 ммоля, 1,2 экв.) в ТГФ (13 мл). Реакционную смесь перемешивали в течение ночи при КТ (значение рН поддерживали на уровне 8 путем добавления при необходимости 10%-ного водного раствора NaOH), а затем разбавляли Н 2 О, промывали Et2O (3 х) и подкисляли при 0 С с помощью 10%-ного водного раствора лимонной кислоты. Водный слой экстрагировали EtOAc (3 х) и последовательно промывали Н 2 О (2 х) и соляным раствором. После обычной переработки (MgSO4, фильтрация и концентрирование) выделяли требуемую Вос-защищенную аминокислоту (8 а) (788 мг, 3,44 ммоля,выход 44%). Н-ЯМР (CDCl3)5,18 (ibh- s, 1H), 1,641,58 (m, 2H), 1,55-1,42 (m, 2 Н), 1,45 (s, 9 Н), 1,321,25 (m, 1H), 0,99 (t, 3H, J = 7,3 Гц). Получение изомеров метилового эфира Вос-защищенное производное 8 а (0,30 г,1,31 ммоля) растворяли в Et2O (10 мл) и обрабатывали свежеприготовленным диазометаном вEt2O при 0 С до появления устойчивой желтой окраски, свидетельствующей о небольшом избытке диазометана. После перемешивания в течение 20 мин при КТ реакционную смесь концентрировали досуха, получая соединение 8b в виде прозрачного бесцветного масла (0,32 г,выход 100%). 1 Н-ЯМР (CDC13):5,1 (шир. s, 1H), 3,71 (s,3H), 1,62-1,57 (m, 2 Н), 1,55 (s, 9H), 1,53-1,43 (m,1H), 1,28-1,21 (m, 2H), 0,95 (t, J = 7,3 Гц, 3H). Пример 9. Ферментативное разделение изомеров метил(1R,2R)/(1S,2R)-Boc-1-амино-2 этилциклопропилкарбоксилата. а) Смесь энантиомеров метилового эфира(1S,2R)/(1R,2R)-1-Boc-aминo-2-этилкарбоновой кислоты из примера 10 (0,31 г, 1,27 ммоля) растворяли в ацетоне (3 мл) и затем при интенсивном перемешивании разбавляли водой (7 мл). Значение рН раствора доводили до 7,5 с помощью 0,05 М водного раствора NaOH, после чего добавляли алкалазу Alcalase [2,4 л экстракта,полученного от фирмы Novo Nordisk Industrials](300 мг). В процессе инкубации значение рН стабилизировали с помощью NaOH и измеряли значение рН для регулирования процесса добавления раствора NaOH. Через 40 ч смесь разбавляли ЕtOАс и Н 2 О (в смеси с 5 мл насыщенногоNaНСО 3) и фазы разделяли. Водную фазу подкисляли с помощью 10%-ного водного раствора НСl и экстрагировали ЕtOАс, сушили (MgSO4),фильтровали и концентрировали, получая кислоту 9 а (48,5 мг). Абсолютное стереохимическое строение определяли с помощью корреляции, как это описано в примерах 10 и 11. б) Обработкой аликвотного количества кислоты 9 а диазометаном в Et2O получали метиловый эфир, при этом ЖХВР-анализ с использованием хиральной колонки [Chiralcel OD-H,2,5% изопропанол/гексан, изократические условия] показал, что соотношение (S,R)-изомеров составляет 51:1. В качестве исходного продукта использовали кислоту 5d, описанную в примере 5. в) К кислоте 5d (1,023 г, 4,77 ммоля) в(620 мкл, 7,16 ммоля, 1,5 экв.). Реакционную смесь перемешивали в течение 4 ч при КТ и затем концентрировали. Остаток разбавлялиEt2O и последовательно промывали 10%-ным водным раствором лимонной кислоты (2 х), Н 2 О,насыщенным водным раствором NаНСО 3, Н 2 О(2 х) и соляным раствором. После обычной переработки (MgSO4, фильтрация и концентрирование) выделяли требуемый сложный эфир 10 а(1,106 г, 3,35 ммоля, выход 91%) в виде бесцветного масла. МС (FAB) 255 (МН+). 1 Н-ЯМР (CDCl3):5,96-5,86 (m, 1H), 5,375,22 (m, 2H), 4,70-4,65 (m, 1H), 4,57-4,52 (m,1H), 1,87-1,79 (m, 1H), 1,47 (s, 9H), 1,45-1,40 (m,1H), 1,33-1,24 (m, 3H), 1,03 (t, J = 7,3 Гц, 3H). г) К сложному эфиру 10 а (1,106 г, 4,349 ммоля) в безводном СН 2 Сl2 (5 мл) при КТ добавляли ТФК (5 мл). Реакционную смесь перемешивали в течение 1,5 ч и затем концентрировали, получая соединение 10b (854 мг, 4,308 ммоля, выход 99%). МС (FAB) 199 (МН+). 1H-ЯМР (CDCl3):5,99-5,79 (m, 1H), 5,405,30 (m, 2H), 4,71-4,62 (m, 2H), 2,22-2,00 (m,2H), 1,95-1,88 (m, 1H), 1,84-1,57 (m, 2H), 0,98 (t,J = 7,3 Гц, 3H). д) К кислоте 10b (853 мг, 4,30 ммоля) в безводном бензоле (14,8 мл) последовательно добавляли Et3N (684 мкл, 4,91 ммоля, 1,14 экв.) и ДФФА (992 мкл, 4,60 ммоля, 1,07 экв.). Реакционную смесь кипятили с обратным холодильником в течение 4,5 ч, а затем добавляли 2 триметилсилилэтанол (1,23 мл, 8,58 ммоля, 2,0 экв.). Кипячение с обратным холодильником продолжали в течение ночи и затем реакционную смесь разбавляли Et2O и последовательно промывали 10%-ным водным раствором лимонной кислоты, водой, насыщенным водным раствором NaHCO3, водой (2 х) и соляным раствором. После обычной переработки (MgSO4,фильтрация, концентрирование) остаток подвергали экспресс-хроматографии (5 см, от 10 до(m, 1 Н), 1,03 (t, J = 7,6 Гц, 3H), 0,96-0,86 (m, 1H),0,04 (s, 9H). е) К карбамату 10 с (267 мг, 0,810 ммоля) добавляли 1,0 М раствор ТБАФ в ТГФ (1,62 мл,1,62 ммоля, 2,0 экв.). Реакционную смесь перемешивали в течение ночи при КТ, кипятили с обратным холодильником в течение 30 мин и затем разбавляли AcOEt. Раствор последовательно промывали водой (2 х) и соляным раствором. После обычной переработки (MgSO4,фильтрация и концентрирование) выделяли требуемый амин 10d (122 мг, 0,721 ммоля, выход 89%) в виде жидкости светло-желтого цвета. 1 а) К раствору трет-бутоксида калия (4,62 г,41,17 ммоля, 1,1 экв.) в ТГФ (180 мл) при -78 С добавляли имеющийся в продаже имин 11 а (10,0 г, 37,41 ммоля) в ТГФ (45 мл). Реакционную смесь нагревали до 0 С и перемешивали при этой температуре в течение 40 мин. Затем смесь снова охлаждали до -78 С, добавляли 1,4 дибромбутен 11b (8,0 г, 37,40 ммоля) и затем перемешивали при 0 С в течение 1 ч и снова охлаждали до -78 С, после чего добавляли третбутоксид калия (4,62 г, 41,17 ммоля, 1,1 экв.). После этого реакционную смесь перемешивали еще в течение более одного часа при 0 С и концентрировали, получая соединение 11 с. б, в, г) Соединение 11 с растворяли в Et2O(265 мл) и обрабатывали 1 н. водным раствором НСl (106 мл). После выдерживания в течение 3,5 ч при КТ слои разделяли и водный слой промывали Et2O (2x) и подщелачивали насыщенным водным раствором NaHCO3. Требуемый амин экстрагировали Et2O (3 х) и объединенные органические экстракты промывали соляным раствором. После обычной переработки(187 мл, 748 ммоля). После концентрирования выделяли гидрохлорид 11d в виде твердого ве 004765 42 щества коричневого цвета (2,467 г, 12,87 ммоля,выход 34%). 1 Н-ЯМР (CDCl3):9,17 (шир. s, 3H), 5,755,66 (m, 1H), 5,39 (d, J = 17,2 Гц, 1H), 5,21 (d, J = 10,2 Гц, 1 Н), 4,35-4,21 (m, 2 Н), 2,77-2,70 (m,1H), 2,05 (dd, J = 6,4, 10,2 Гц, 1 Н), 1,75 (dd, J = 6,4, 8,3 Гц, 1H), 1,33 (t, J = 7,0 Гц, 3H). Пример 12. Получение изомеров этилового эфира(Вос)2O (1,2 г, 5,7 ммоля) растворяли в ТГФ (30 мл) и обрабатывали ДМАП (0,13 г, 1,04 ммоля,0,2 экв.) и диизопропилэтиламином (2,8 мл, 15,6 ммоля). Реакционную смесь перемешивали в течение 24 ч, после чего разбавляли EtOAc (40 мл) и промывали последовательно насыщенным раствором NaHCO3 (водный), 5%-ным водным раствором НСl и насыщенным соляным раствором. Органическую фазу сушили (MgSO4),фильтровали и концентрировали, получая после очистки с помощью экспресс-хроматографии(15%-ный EtOAc/гексан) соединение 12 а (0,29 г,выход 23%). 1 Н-ЯМР (CDCl3):5,80-5,72 (m, 1H), 5,295,25 (dd, J = 17,2, 17,2 Гц, 1H), 5,24-5,1 (шир. s,1H), 5,10 (dd, J = 9,2, 9,2 Гц, 1H), 4,22-4,13 (m,2H), 2,15-2,04 (m, 1H), 1,85-1,73 (шир. s, 1H),1,55-1,5 (m, 1H), 1,49 (s, 9H), 1,26 (t, J = 7,3 Гц,3H). Пример 13. Ферментативное разделение изомеров этил-(1R,2S)/(1S,2S)-1-aмино-2-винилциклопропилкарбоксилата. а) Производное 12 а в виде рацемической смеси (0,29 г, 1,14 ммоля) растворяли в ацетоне(5 мл) и разбавляли Н 2 О (10 мл). Значение рН доводили до 7,2 с помощью 0,2 н. водного раствора NaOH, после чего добавляли алкалазуAlcalase (300 mg). Для поддержания значения рН во время инкубации на постоянном уровне с помощью статического титратора рН в течение 9 дней добавляли раствор NaOH до тех пор, пока не было добавлено теоретически рассчитанное количество основания. После экстракции кислотой/основанием, как это описано в примере 13, выделяли негидролизованный сложный эфир (0,15 г, выход 100%) и гидролизованный продукт (0,139 г, выход 95%). Путем анализа негидролизованного сложного эфира с помощью ЖХВР с использованием хиральной колонки было установлено, что соотношение требуемого соединения 17 с составляет 43:1. Соединение 206 (где R1 обозначает винил, табл. 2)Pd(OH)2 при давлении 1 атм. Н 2 в течение 45 мин, получая соединение 214 (где R1 обозначает этил, табл. 2). На основе химической корелляции согласно методу, описанному в примерах 6 и 7, было установлено, что стереохимическое строение соединения 206 (R1 обозначает винил) соответствует (R,S), и оно имеет такую же абсолютную конфигурацию, что и соединение 13 с(хотя оно описывается как 1R,2S, поскольку R1 обозначает винил). Условия проведения анализа с помощью ЖХВР: Chiralcel OD-H (4,6 мм х 25 см), изократические условия с использованием в качестве подвижной фазы 2,5%-ного изопропанола/гексана. Пример 14. Разделение изомеров (1R,2S)/ К раствору неочищенной рацемической смеси (1S,2S)- и (1R,2S)-изомеров этил-1-амино 2-винилциклопропилкарбоксилата [полученного из этилового эфира N-(дифенилметилен) глицина (25,0 г, 93,5 моля) согласно примеру 15] в EtOAc (800 мл) добавляли дибензоил-Dвинную кислоту (33,5 г, 93,5 моля). Смесь нагревали до температуры дефлегмации, выдерживали при КТ в течение 15 мин, а затем охлаждали до 0 С. Через 30 мин получали твердое вещество белого цвета. Это твердое вещество отфильтровывали, промывали EtOAc (100 мл) и сушили на воздухе. Твердое вещество суспендировали в ацетоне (70 мл), обрабатывали ультразвуком и фильтровали (3 х). Затем твердое вещество дважды перекристаллизовывали в горячем ацетоне (партия А). Маточные растворы концентрировали и остаток трижды перекристаллизовывали в горячем ацетоне (партия Б). Две партии соли дибензоил-D-винной кислоты в виде аморфного твердого продукта белого цвета объединяли (5,53 г) и суспендировали в смеси(150 мл). Органический слой промывали соляным раствором, сушили (MgSO4) и фильтровали. Фильтрат разбавляли 1 н. HCl/Et2O (100 мл) и концентрировали при пониженном давлении. Маслянистый остаток упаривали с ССl4, получая гидрохлорид этил-1-(R)-амино-2-(S)-винилциклопропанкарбоксилата (940 мг, выход 11%) в виде гигроскопичного твердого вещества белого цвета, абсолютное стереохимическое строение которого было установлено на основе корелляции с соединением 13 с из примера 13.H-ЯМР (ДМСО-d6):9,07 (шир. s, 2H),5,64 (ddd, J = 17,2, 10,4, 8,7 Гц, 1H), 5,36 (dd, J = 17,2, 1,6 Гц, 1 Н), 5,19 (dd, J = 10,4, 1,6 Гц, 1H),4,24-4,16 (m, 2 Н), 2,51-2,45 (m, выделению пиков препятствовал ДМСО, 1 Н), 1,84 (dd, J = 10,0, 6,0 Гц, 1 Н), 1,64 (dd, J = 8,3, 6,0 Гц, 1 Н),1,23 (t, J = 7,1 Гц, 3H).MC (ESI) m/z 156 (MH) +. Чистота энантиомера Вос-защищенного производного по данным ЖХВР-анализа составляла 91% (колонка типа CHIRALPAK AS,гексан/изо-РrОН) (пример 13). Элементы структуры Р 4-Р 2. Пример 15. Синтез сегмента Ac-Chg-ChgPro-(4-(R)-нафталин-1-илметокси)-OH (15g). Соединение 15 а (идентичное соединению 2 из примера 2) (4,45 г, 11,98 ммоля) растворяли в безводном CH3CN (60 мл), последовательно добавляли ДБУ (2,2 мл, 14,38 ммоля) и аллилбромид (1,1 мл, 13,18 ммоля) и реакционную смесь перемешивали при КТ в течение 24 ч. Смесь концентрировали, образовавшееся масло разбавляли EtOAc и водой и последовательно промывали водой (2 х) и соляным раствором(1 х). Этилацетатный слой сушили (MgSO4),фильтровали и упаривали досуха. Образовавшееся масло желтого цвета очищали экспрессхроматографией (элюент: гексан/EtOAc в соотношении от 90:10 до 85:15), получая продукт 15b в виде масла желтого цвета (2, 4,17 г; выход 85%). 1H-ЯМР (CDCl3), смесь ротамеров в соотношении приблизительно 1:2:(d, J = 8 Гц, 1 Н),7,87 (d, J = 8 Гц, 1H), 7,82 (d, J = 8 Гц, 1H), 7,557,41 (m, 4 Н), 5,95-5,85 (m, 1H), 5,34-5,21 (m,2 Н), 5,03-4,88 (m, 2 Н), 4,70-4,56 (m, 2 Н), 4,48 и 4,39 (t, J = 8, 15 Гц, 1H), 4,28-4,23 (m, 1H), 3,813,55 (m, 2 Н), 2,46-2,36 (m, 1H), 2,13-2,05 (m,1H), 1,44 и 1,41 (s, 9H). Соединение 15b (2,08 г, 5,05 ммоля) обрабатывали в течение 30 мин при КТ смесью 4 н.HCl/диоксан. После упаривания досуха получали соответствующий гидрохлорид амина в виде 45 масла. Гидрохлорид амина 15 с растворяли в безводном ДХМ (25 мл) и последовательно добавляли N-MM (2,2 мл, 20,22 ммоля), Boc-ChgOHH2O (1,53 г, 5,56 ммоля) и ТБТУ (1,95 г, 6,07 ммоля). Реакционную смесь перемешивали при КТ в течение ночи, а затем разбавляли EtOAc и последовательно промывали 10%-ным водным раствором лимонной кислоты (2 х), насыщенным водным раствором NaHCO3 (2x), водой (2 х) и соляным раствором (1 х). Этилацетатный слой сушили (MgSO4), фильтровали и упаривали досуха, получая продукт 15d в виде пены желтовато-белого цвета (приблизительно 2,78 г, выход 100%). МС (FAB) 551,4 МН+. 1HCl/диоксан (25 мл), как это описано для синтеза соединения 15 с. Неочищенный гидрохлорид подвергали реакции сочетания с Boc-Chg-ОНН 2 О (1,53 г,5,55 ммоля) с помощью N-MM (2,22 мл, 20,22 ммоля) и ТБТУ (1,95 г, 6,07 ммоля) в DCM (25 мл), как это описано для синтеза соединения 15d, получая неочищенный трипептид 15 е в виде маслянистой пены желтого цвета. Неочищенный продукт очищали с помощью экспрессхроматографии (элюент: гексан/EtOAc в соотношении от 80:20 до 75:25), получая трипептид 15 е в виде пены белого цвета (2,75 г; выход 79% по двум стадиям). МС (FAB) 690,5 МН+. 1 Н-ЯМР (CDCl3), в основном один ротамер:8,06 (d, J = 8 Гц, 1H), 7,87 (шир. d, J = 8,5 Гц, 1 Н), 7,82 (d, J = 8 Гц, 1 Н), 7,57-7,40 (m, 4H),6,41 (d, J = 8,5 Гц, 1 Н), 5,92-5,84 (m, 1H), 5,31(s, 9H), 1,23-0,89 (m, 10 Н). Трипептид 15 е (2,75 г, 3,99 ммоля) обрабатывали смесью 4 н. НСl/диоксан (20 мл), как это описано для синтеза соединения 15 с. Неочищенный гидрохлорид растворяли в безводном ДХМ (20 мл). Последовательно добавляли NMM (1,75 мл, 15,94 ммоля) и уксусный ангидрид (752 мкл, 7,97 ммоля). Реакционную смесь перемешивали при КТ в течение ночи и затем 46 разбавляли EtOAc. Органический слой последовательно промывали 10%-ным водным раствором лимонной кислоты (2 х), насыщенным водным раствором NaHCO3 (2 х), водой (2 х) и соляным раствором (1 х), сушили (MgSO4), фильтровали и упаривали досуха, получая неочищенный трипептид 15f в виде пены белого цвета (2,48 г,выход 98%). МС (FAB) 632,4 МН + 1. 1 Н-ЯМР (CDCl3), в основном один ротамер:8,06 (шир. d, J = 8 Гц, 1 Н), 7,87 (шир. d, J(m, 11H), 1,25-0,88 (m, 11H). Неочищенный трипептид 15f (2,48 г, 3,93 ммоля) растворяли в безводной смеси СН 3 СN/ДХМ (20 мл). Последовательно добавляли трифенилфосфин (53,5 мг, 0,200 ммоля) и тетракис(трифенилфосфин)палладий(0) в качестве катализатора (117,9 мг, 0,102 ммоля), а затем пирролидин (353,9 мкл, 4,24 ммоля). Реакционную смесь перемешивали при КТ в течение 18 ч. После этого растворитель выпаривали. Остаток растворяли в ЕtOАс и 10%-ном водном растворе лимонной кислоты и затем промывали еще дважды 10%-ным водным раствором лимонной кислоты, водой (2 х) и соляным раствором (1 х). Органический слой сушили (MgSO4),фильтровали и упаривали. Неочищенный продукт растирали в Еt2 О/ДХМ (85:15), получая после фильтрации трипептид 15 г в виде твердого вещества белого цвета (2,09 г, выход 90%). МС (FAB) 592,4 МН+; 614,3 (M + Na)+. 1 Соединение 16 а (22,89 г, 7,02 ммоля) обрабатывали смесью 4 н. НСl/диоксан (30 мл), как это описано для синтеза соединения 15 с. Неочищенный гидрохлорид подвергали реакции сочетания с Boc-Val-OH (1,53 г, 7,73 ммоля) сN-MM (3,1 мл, 28,09 ммоля) и ТБТУ (2,71 г, 8,43 ммоля) в ДХМ (35 мл) в течение 3,5 ч, как это описано для синтеза соединения 15d, получая неочищенный дипептид 16b в виде маслянистой пены цвета слоновой кости (примерно 3,60 г,выход 100%). МС (FAB) 509,3 МН-, 511,3 МН+, 533,2 (MH-ЯМР (CDCl3):8,04 (шир. d, J = 8 Гц,1H), 7,87 (шир. d, J = 7 Гц, 1 Н), 7,82 (d, J = 8 Гц,1 Н), 7,56-7,40 (m, 4 Н), 5,93-5,85 (m, 1 Н), 5,345,28 (m, 1H), 5,24-5,19 (m, 2 Н), 5,04 (d, J = 12 Гц,1H), 4,92 (d, J = 12 Гц, 1 Н), 4,67-4,60 (m, 3H),4,31-4,26 (m, 2 Н), 4,11-4,09 (m, 1 Н), 3,72 (dd, J = 4,11 Гц, 1 Н), 2,48-2,41 (m, 1H), 2,07-1,99 (m,1H), 1,44-1,36 (m, 1H), 1,37 (s, 9H), 1,01 (d, J = 7 Гц, 3H), 0,93 (d, J = 7 Гц, 3H). Неочищенный дипептид 16b (примерно 7,02 ммоля) обрабатывали смесью 4 н. НСl/диоксан (30 мл), как это описано для синтеза соединения 15 с. Неочищенный гидрохлорид подвергали реакции сочетания с Boc-ChgОНН 2 О (2,13 г, 7,73 ммоля) с N-MM (3,1 мл,28,09 ммоля) и ТБТУ (2,71 г, 8,43 ммоля) в СН 2 Сl2 (35 мл), как это описано для синтеза соединения 15d, получая неочищенный трипептид 16 с в виде пены цвета слоновой кости (примерно 4,6 г, выход 100%). МС (FAB) 648,5 МН-, 672,4 (M + Na)+. 1 Н-ЯМР (CDCl3):8,06 (шир. d, J = 8 Гц,1H), 7,87 (шир. d, J = 7,5 Гц, 1H), 7,82 (шир. d, J 48 Неочищенный трипептид 16 с (примерно 7,02 ммоля) обрабатывали смесью 4 н. НСl/диоксан (30 мл), как это описано для синтеза соединения соединения 15 с. Неочищенный гидрохлорид затем обрабатывали уксусным ангидридом (1,33 мл, 14,05 ммоля) и N-MM (3,1 мл, 28,09 ммоля) в СН 2 Сl2 (35 мл), как это описано для синтеза соединения 15d. Неочищенный продукт подвергали очистке с помощью экспресс-хроматографии (элюент: гексан/EtOAc в соотношении 30:70), получая ацетилированный защищенный трипептид 16d в виде пены белого цвета (3,39 г, выход 81% по 3 стадиям). МС (FAB) 590,3 МН-, 592,4 МН+, 614,4 (M(dd, J = 1, 10,5 Гц, 1H), 5,05 (d, J = 12 Гц, 1H),4,94 (d, J = 12 Гц, 1H), 4,66-4,57 (m, 4 Н), 4,314,22 (m, 2 Н), 4,11-4,05 (m, 1 Н), 3,73 (dd, J = 4,5,11 Гц, 1H), 2,50-2,43 (m, 1H), 2,09-2,01 (m, 2H),2,00 (s, 3H), 1,68-1,55 (m, 5H), 1,15-0,89 (m, 6H),0,99 (d, J = 7 Гц, 3H), 0,91 (d, J = 7 Гц, 3H). У ацилированного трипептида 16d (3,39 г,5,73 ммоля) удаляли защитную группу с помощью тетракис(трифенилфосфин)палладия(0) в качестве катализатора (172,1 мг, 0,149 ммоля) с трифенилфосфином (78,1 мг, 0,298 ммоля) и пирролидином (516 мкл, 6,19 ммоля) в смеси 1:1 безводного СН 3 СN/ДХМ (30 мл), как это описано для синтеза соединения 15g. Неочищенный продукт в виде пены светло-желтого цвета растирали в смеси Et2O/ДXM (85:15), получая после фильтрации трипептид 16 е в виде беловатого твердого вещества (3,0 г; выход 95%). МС (FAB) 550,3 МН-. 1 Н-ЯМР (CDCl3):8,08 (d, J = 8 Гц, 1), 8,04 Соединение 17 а (4,27 г, 7,93 ммоля, соединение 6 а в примере 6) обрабатывали смесью 4 н. НСl/диоксан (40 мл) в течение 5 ч, как это описано для соединения 15 с. Неочищенный гидрохлорид растворяли в ТГФ (10 мл) и добавляли раствор NaOH (348,7 мг, 8,72 ммоля) в Н 2 О (5 мл), после чего по каплям добавляли (Вос)2 О(1,73 г, 7,93 ммоля), растворенный в ТГФ (13 мл). Значение рН поддерживали на уровне 8,добавляя при необходимости 10%-ный водный раствор. Реакционную смесь интенсивно перемешивали, а затем разбавляли Et2O и Н 2 О и экстрагировали более одного раза Et2O. Водный слой подкисляли до рН 3 с помощью 10%-ного водного раствора лимонной кислоты. Смесь экстрагировали ЕtOАс (3 х). ОбъединенныеEtOАс-экстракты промывали Н 2 О (2 х), соляным раствором (1 х), сушили (MgSO4), фильтровали и упаривали досуха, получая неочищенное соединение 17b в виде пены цвета слоновой костиH-ЯМР (CDCl3), смесь ротамеров примерно 1:1:8,04 (шир. d, J = 7,5 Гц, 1 Н), 7,87 (шир.CH3CN (40 мл) в течение 48 ч, как это описано для соединения 15b, получая аллилированный дипептид 17 с в виде пены цвета слоновой кости 50 МС (FAB): 521,3 МH-, 545,2 (M + Na)+. 1 Н-ЯМР (CDCl3), смесь ротамеров примерно 1:1:8,05 (шир. d, J = 8 Гц, 1 Н), 7,86 (шир. d,J = 7,5 Гц, 1 Н), 7,82 (d, J = 8 Гц, 1H), 7,55-7,40(35 мл), как это описано для соединения 15 с. Неочищенный гидрохлорид подвергали реакции сочетания с Boc-Chg-OHH2O (684 мг, 2,48 ммоля) с N-MM (993 мкл, 9,03 ммоля) и ТБТУ (870 мг, 2,71 ммоля) в ДХМ (11 мл), как это описано для соединения 15d, получая неочищенный трипептид 17d в виде пены цвета слоновой кости(m, 1H), 2,71-2,61 (m, 1H), 2,12-2,02 (m, 1 Н),1,79-1,48 (m, 10H), 1,45-1,39 (m, 1H), 1,38 (s,9H), 1,25-1,01 (m, 5H), 0,94 (t, J = 7,5, 14 Гц, 3H). Неочищенный трипептид 17d (265 мг,0,400 ммоля) обрабатывали смесью 4 н. НС 1/диоксан (3 мл), как это описано для соединения 15 с. Неочищенный гидрохлорид подвергали реакции сочетания с Boc-Chg-OHH2O(3 мл), как это описано для соединения 15d, получая неочищенный тетрапептид 17 е в виде пены цвета слоновой кости (примерно 0,400 ммоля; 100%). МС (FAB): 799,5 МН-, 801,5 МН+, 823 (M +H-ЯМР (CDCl3), смесь ротамеров примерно 1:1:8,05 (шир. d, J = 8,5 Гц, 1H), 7,87 (шир.d, J = 7,5 Гц, 1H), 7,81 (d, J = 8,5 Гц, 1H), 7,557,40 (m, 4 Н), 7,37 (s, 1H), 6,58-6,41 (m, 1H), 5,895,78 (m, 1H), 5,26 (шир. dd, J = 1,5, 17 Гц, 1H),5,16 (шир. dd, J = 1,5, 10,5 Гц, 1H), 5,20-4,92 (m,3H), 4,68-4,58 (m, 2 Н), 4,57-4,47 (m, 1H), 4,434,26 (m, 1H), 3,99-3,81 (m, 2 Н), 3,78-3,60 (m,2 Н), 2,67-2,60 (m, 1H), 2,11-2,02 (m, 1H), 1,781,42 (m, 14 Н), 1,44-1,43 (s, 9 Н), 1,25-0,91 (m,13 Н), 0,95 (t, J = 7,5, 15 Гц, 3H). Неочищенный тетрапептид 17 е (примерно 0,400 ммоля) обрабатывали смесью 4 н. НСl/диоксан (3 мл), как это описано для соединения 15 с. Неочищенный гидрохлорид затем обрабатывали уксусным ангидридом (83 мкл,0,884 ммоля) и N-MM (194 мкл, 1,77 ммоля) в 51 ДХМ (3 мл), как это описано для соединения 15f, получая неочищенный ацетилированный тетрапептид 17f в виде пены цвета слоновой кости (примерно 0,400 ммоля). МС (FAB): 741,5 МН-, 743,4 МН+, 765,4 (M(примерно 0,400 ммоля) удаляли защитную группу в присутствии тетракис(трифенилфосфин)палладия(0) в качестве катализатора(5,12 мг, 0,020 ммоля) и пирролидином (34 мкл,0,406 ммоля) в смеси 1:1 безводный СН 3 СN/ДХМ (2 мл), как это описано для соединения 15g. Неочищенный продукт очищали экспресс-хроматографией (элюент: 1-й ЕtOАс, затем 2-й 1,92% НОАс, 3,85% МеОН в ДХМ), получая после лиофилизации соединение, представляющее собой тетрапептид 104 из табл. 1 в виде беловатого аморфного твердого вещества Соединение 5f из примера 5 подвергали реакции сочетания с предварительно полученным трипептидом 18 а, описанным выше в примере 15. В частности, соединение 18b (примерно 0,521 ммоля) объединяли с соединением 18 а(237,6 мг, 0,625 ммоля). Реакционную смесь перемешивали при КТ в течение 18 ч, после че 004765 52 го, работая аналогично тому, как это описано для соединения 15d, получали неочищенный тетрапептид в виде рацемической смеси относительно Р 1. Обо изомера частично очищали с помощью экспресс-хроматографии (элюент: толуол/EtOAc в соотношении 40:60). После объединения элюированных первыми фракций получали смесь 9:1, в которой основным компонентом был аналогичный сложный третбутиловый эфир соединения 17f (58 мг). Элюированные в середине фракции содержали различные соотношения соответствующих сложных трет-бутиловых эфиров соединения 17f и сложного трет-бутилового эфира соединения 105 (163 мг). Элюированные последними фракции содержали в качестве основного компонента соответствующий сложный трет-бутиловый эфир соединения 105 (75,8 мг). Последний эфир (74 мг, 0,0975 ммоля) растворяли в смеси 4 н. НСl/диоксан (2 мл), перемешивали при КТ в течение 5,5 ч и затем упаривали досуха, получая масло. После очистки с помощью экспресс-хроматографии (элюент: 1-йEtOAc, затем 2-й 1,92% НОАс, 3,85% МеОН в ДХМ) получали после лиофилизации соединение 105 в виде аморфного твердого вещества белого цвета (38,7 мг, выход 56%). ЖХВРанализ показал наличие смеси 3:1 соединения 105 и соединения 104. Данные, полученные с помощью МС и ЯМР для соединения 105. МС (FAB): 701,5 МН-, 703,5 МН+, 725,6 (M+ Na)+. 1 Н-ЯМР (ДМСО), смесь ротамеров примерно 1:2,5:8,76 и 8,34 (s, 1H), 8,05 (шир. d, J(t, J = 7, 14 Гц, 3H). Пример 19. Синтез соединений 103 из табл. 1. Работая аналогично процедуре, описанной для синтеза соединения 104 из примера 17,смесь 1(R)-, 2(R)- и 1(R),2(S)-изомеров промежуточного соединения 10d, полученного в примере 10, подвергали реакции сочетания с соединением 2, получая смесь изомеров промежуточных соединений 19 а и 19b. Аналогично примеру 18 изомерные соединения 19 а и 19b разделяли и превращали в соответствующее соединение формулы 1 для выделения соответствующего соединения 103 из табл. 1. Данные спектрального анализа. Неочищенный тетрапептид 17 е из примера 17 (примерно 0,963 ммоля) обрабатывали раствором 4 н. НСl/диоксан (5 мл), как это описано для соединения 15 с. Неочищенный гидрохлорид подвергали реакции сочетания с Вос-(D)Glu(Оаллил)-ОН (331,9 мг, 1,155 ммоля) с N-MM (423 мкл, 3,850 ммоля) и ТБТУ (370,8 мг, 1,155 ммоля) в ДХМ (5 мл) в течение 3 ч при КТ, как это описано для соединения 15d. В результате получили неочищенный пентапептид 20b в виде пены цвета слоновой кости (примерно 933,9 мг,0,963 ммоля). МС (FAB): 968,6 МН-, 970,6 МН+, 992,5 (M+ Na). 1 Н-ЯМР (CDCl3), смесь ротамеров примерно 1:4:8,05 (d, J = 8,5 Гц, 1 Н), 7,87 (шир. d, J = 7,5 Гц, 1H), 7,81 (d, J = 8,5 Гц, 1H), 7,58-7,34 (m,5H), 6,77-6,25 (m, 2 Н), 5,98-5,77 (m, 2 Н), 5,385,21 (m, 4 Н), 5,16 (dd, J = 1,5, 10,5 Гц, 1H), 5,064,89 (m, 2 Н), 4,68-4,13 (m, 7 Н), 3,96-3,52 (m,4 Н), 2,69-2,38 (m, 3H), 2,23-1,87 (m, 2H), 1,781,37 (m, 17H), 1,46 и 1,44 (s, 9H), 1,22-0,87 (m,11 Н), 0,95 (t, J = 7, 14,5 Гц, 3H). Неочищенный пентапептид 20b (примерно 0,963 ммоля) обрабатывали раствором 4 н. НСl/диоксан (5 мл), как это описано для соединения 15 с. Неочищенный гидрохлорид подвергали реакции сочетания с Вос-Аsp(O-аллил)-ОН(5 мл), как это описано для соединения 15d. Таким путем получили неочищенный гексапептид 54 20 с в виде пены цвета слоновой кости (примерно 1,083 г, 0,963 ммоля).MС (FAB): 1147,6 (M + Na)+. 1 Н-ЯМР (CDCl3), смесь ротамеров примерно 1:1:8,06 (шир. d, J = 8 Гц, 1H), 7,86 (d, J = 8 Гц, 1 Н), 7,81 (d, J = 8 Гц, 1H), 7,59-7,39 (m, 5H),7,39-6,34 (m, 4 Н), 5,98-5,76 (m, 3H), 5,38-5,10(m, 3H), 1,79-1,33 (m, 19 Н), 1,47 и 1,45 (s, 9 Н),1,33-0,86 (m, 14 Н). Неочищенный гексапептид 20 с (примерно 0,963 ммоля) обрабатывали раствором 4 н. НСl/диоксан (5 мл), как это описано для соединения 15 с. Неочищенный гидрохлорид ацетилировали уксусным ангидридом (182 мкл, 1,193 ммоля) и N-MM (423,5 мкл, 3,850 ммоля) в ДХМ (5 мл), как это описано для соединения 15f, получая неочищенный ацетилированный тетрапептид. Остаток в виде пены очищали экспресс-хроматографией (элюент: 1-й гексан/ ЕtOАс в соотношении от 20:80 до 10:90 и 2-й чистый EtOAc), получая ацетилированный гексапептид 20d в виде пены цвета слоновой кости(528 мг, выход 51% по 4 стадиям). МС (FAB): 1067,6 (МН+), 1089,6 (M + Na). Ацетилированный гексапептид 20d (528 мг, 0,495 ммоля) растворяли в ДХМ (3 мл) и обрабатывали предварительно приготовленной смесью, которую получали перемешиванием в течение 15 мин раствора тетракис(трифенилфосфония)палладия(0) (90 мг, 0,078 ммоля) в качестве катализатора и пирролидина (134 мкл,1,603 ммоля) в ДХМ (3 мл). Реакционную смесь перемешивали при КТ в течение 48 ч, после чего растворитель выпаривали. Неочищенный продукт частично очищали, растирая вEt2O/ДXM (85:15), и затем очищали двумя порциями с помощью препаративной ЖХВР. Половину частично очищенного продукта растворяли в ледяной уксусной кислоте (5 мл), фильтровали через фильтр типа Millipor: Millex-HV с размером пор 0,45 мкм и вводили с помощью инжектора в уравновешенную С 18-колонку с обращенной фазой типа Whatman Partisil 10-ODS3 (2,2x50 см). Запрограммированные условия для очистки: линейный градиент при скорости 15 мл/мин, 230 мкм, ввод при 5% А; после того элюирования всего НОАс начинали работу по следующей программе: при 5% А в течение 10 мин, 5-58% А в течение 70 мин; А: 0,06%-наяTФK/CH3CN; Б: 0,06%-ная ТФК/Н 2 О. Фракции анализировали с помощью аналитической ЖХВР, при этом соответствующие фракции,полученные в результате обеих очисток с использованием ЖХВР, собирали и лиофилизировали, получая требуемое соединение, представляющее собой гексапептид 108, в виде аморфного твердого вещества белого цветаH-ЯМР (ДМСО), смесь ротамеров примерно 1:9:8,55 и 8,31 (s, 1H), 8,16 (d, J = 7,5 Гц, 1 Н), 8,11 (d, J = 8 Гц, 1H), 8,05 (d, J = 8,5 Гц,1H), 7,97-7,85 (m, 2 Н), 7,88 (d, J= 8,5 Гц, 1 Н),7,75 (d, J = 9 Гц, 1H), 7,59-7,39 (m, 4 Н), 4,99 (d, J Раствор моногидрата гидроксида лития (23 мг, 0,56 ммоля) в Н 2 О (4 мл) добавляли к раствору сложного эфира соединения 21 а (45 мг,0,185 ммоля, описанного выше как (R,R)-изомер 9 с) в МеОН (3,5 мл) и ТГФ (3,5 мл). Образовавшийся раствор интенсивно перемешивали в течение 16 ч и затем распределяли между ЕtOАс(MgSO4), фильтровали и концентрировали, получая соответствующую кислоту с количественным выходом. Этот продукт (примерно 0,185 ммоля) объединяли с (S)-(-)метилбензиламином (27 мг,0,22 ммоля), ГАТУ (77 мг, 0,20 ммоля) и ДИПЭА (0,11 мл, 0,65 ммоля) в ДМФ (5 мл). Через 20 ч реакционную смесь концентрировали. Остаток растворяли в EtOAc и раствор последовательно промывали насыщенным водным растовром NаНСО 3, 10%-ным водным раствором НСl и соляным раствором, после чего сушили(MgSO4), фильтровали и концентрировали в вакууме. После очистки экспресс-хроматографией (элюент: 35% EtOAc/гексан) получили 11 мг (28%) полученного в результате сочетания продукта 21b. Этот продукт (11 мг, 0,033 ммоля) обрабатывали смесью 4 н. HCl/диоксан в течение 35 мин. После этого реакционную смесь концентрировали досуха, получая гидрохлорид соответствующего амина. Последний продукт подвергали сочетанию с(33 мг, 0,036 ммоля), полученного согласно примерам 15 и 20), ГАТУ (14 мг, 0,036 ммоля) и ДИПЭА (0,116 мл, 0,02 ммоля) в ДМФ (4 мл). После перемешивания реакционной смеси в течение 16 ч ее концентрировали. Остаток растворяли в EtOAc. Раствор промывали последовательно насыщенным водным раствором NaHCO3, 10%-ным раствором НСl и соляным раствором, сушили (MgSO4), фильтровали и концентрировали в вакууме, получая твердое вещество белого цвета. Этот продукт (примерно 0,033) растворяли в EtOH (6 мл) и обрабатывали ацетатом аммония (7 мг, 0,09 ммоля) и 10%-нымPd/C (10 мг) в атмосфере газообразного водорода. Через 3 ч реакционную смесь фильтровали через диатомовую землю. Фильтрат концентрировали досуха. Затем остаток растворяли в ДМСО и очищали с помощью ЖХВР, получая после лиофилизации твердое вещество белого цвета (17,6 мг, выход по 2 стадиям 57%). Данные спектрального анализа: МС (FAB)(m, 7 Н), 1,38-1,30 (m, 1H), 1,27-1,22 (m, 1H),1,12-0,94 (m, 5 Н), 0,89 (d, J = 6,4 Гц, 3H), 0,84 (d,J = 6,4 Гц, 3H). Пример 24. Соединение 118 из табл. 1 синтезировали по методу, описанному в примере 17. Соотношение ротамеров, определенное с помощью ЯМР примерно (1:6,3). МС (FAB) m/z: 677,4 (МН+). 1 Н-ЯМР (ДМСО-d6):8,58 и 8,38 (2 х шир.(m, 7 Н), 1,30 (квинт., J = 8 Гц, 1H), 1,20 (dd, J = 8, 5 Гц, 1 Н), 0,99-0,72 (m, 21 Н). Пример 30. Клонирование, экспрессия и очистка рекомбинантной NS3-протеазы HCV типа 1b. Сыворотку пациента, зараженного HCV,получали в рамках международного сотрудничества (д-р мед. Bernard Willems, Hpital St-Luc,Montreal, Canada, и д-р Donald Murphy, Laboratoire de Sant Publique du Quebec, Ste-Anne deBellevue, Canada). Конструировали полноразмерную кДНК-матрицу генома HCV из фрагментов ДНК, полученных с помощью ПЦР с обратной транскрипцией (ОТ-ПЦР) сывороточной РНК и с использованием праймеров, выбранных на основе гомологии между штаммами с другими генотипами 1b. После определения полной геномной последовательности оценивали генотип 1b изолята(J. Clin. Microbiol. 31, стр. 1493-1503 (1993. Было установлено, что аминокислотная последовательность неструктурной области, т.е. NS2NS4B, была более чем на 93% идентична генотипу 1b HCV (изоляты ВK, JK и 483) и на 88% идентична генотипу 1a HCV (изолят HCV-1). Фрагмент ДНК, кодирующий полипротеиновый предшественникNS5B), получали с помощью ПЦР и встраивали в эукариотические экспрессионные векторы. После непродолжительной трансфекции процессирование полипротеина, опосредованноеNS3-протеазой HCV, выявляли по наличию зрелого протеина NS3 с использованием анализа методом Вестерн-блоттинга. Зрелый протеинNS3 не образовывался при экспрессии предшественника полипротеина, содержащего мутациюNS3-протеазы HCV. Фрагмент ДНК, содержащий рекомбинантную NS3-протеазу HCV (аминокислоты 1027-1206), клонировали в бактериальном экспрессионном векторе pET11d. Экспрессию NS3 протеазы в штамме Е. coli BL21(DE3)pLysS индуцировали инкубацией с 1 мМ ИПТГ в течение 3 ч при 22 С. С помощью обычной ферментации(18 л) получали примерно 100 г влажной клеточной пасты. Клетки ресуспендировали в буфере для лизиса (3,0 мл/г), включающего 25 мМ фосфат натрия, рН 7,5, 10% глицерина (об./об.),1 мМ ЭДТК, 0,01% NP-40, и хранили при -80 С. Клетки подвергали оттаиванию и гомогенизировали после добавления 5 мМ ДТТ. Затем к гомогенату добавляли хлорид магния и ДНКазу в конечных концентрациях 20 мМ и 20 мкг/мл соответственно. После инкубации в течение 25 мин при 4 С гомогенат обрабатывали ультразвуком и центрифугировали при 15000xg в течение 30 мин при 4 С. Затем значение рН супернатанта доводили до 6,5 с помощью 1 М раствора фосфата натрия. К двухступенчатой процедуре очистки,описанной в WO 95/22985 (включена в настоящее описание в виде ссылки), добавляли стадию гель-фильтрации. Этот способ состоит в основном в следующем: супернатант бактериального экстракта вносили в предварительно уравновешенную колонку SP HiTrap (фирма Pharmacia) при скорости потока 2 мл/мин в буфере А (50 мМ фосфат натрия, рН 6,5, 10% глицерина, 1 мМ ЭДТК, 5 мМ ДТТ, 0,01% NP-40). Затем колонку промывали буфером А, содержащим 0,15 М NaCl, и протеазу элюировали с помощью 10 объемов элюента относительно объема колонки с линейным градиентом от 0,15 до 0,3MNaCl. Фракции, содержащие NS3-протеазу, объединяли и разбавляли до конечной концентрации NaCl 0,1 М. Фермент дополнительно очищали на HiTrap-гепариновой колонке (фирма 60 ДТТ, 0,01% NP-40). Образец загружали при скорости потока 3 мл/мин. Затем колонку промывали буфером Б, содержащим 0,15 М NaCl, при скорости потока 1,5 мл/мин. Осуществляли две стадии промывки в присутствии буфера Б, содержащего 0,3 М или 1 М NaCl. Протеазу выделяли в смыве 0,3 М NaCl, разбавляли в 3 раза буфером Б, повторно вносили в HiTrapгепариновую колонку и элюировали буфером Б,содержащим 0,4 М NaCl. В завершение фракции,содержащие NS3-протеазу, вносили в колонкуNaCl. С помощью электрофореза в полиакриламидном геле в присутствии ДСН (ДСН-ПААГ) с последующим денсиометрическим анализом удалось установить, что чистота NS3-протеазыHCV, полученной из объединенных фракций,составляет более 95%. Фермент хранили при -80 С и перед применением подвергали оттаиванию на льду и разбавляли. Пример 31. Радиометрический анализ NS3 протеазы HCV/пептидного кофактора NS4A. Фермент клонировали, экспрессировали и получали согласно протоколу, описанному в примере 30. Фермент хранили при -80 С, подвергали оттаиванию на льду и перед применением разбавляли в буфере для анализа, содержащим пептидный кофактор NS4A. Субстрат, который используется для радиометрического анализа NS3-протеазы/пептидного кофактора NS4A, DDIVPC-SMSYTW,расщепляется между остатками цистеина и серина с помощью фермента. ПоследовательностьDIVPC-SMSYTW соответствует естественному сайту расщепления NS5A/NS5B, в котором остаток цистеина в Р 2 заменен на пролин. Пептидный субстрат DDIVPC-SMSYTW и метку биотин-DDIVPC-SMS[125I-Y]TW инкубировали с рекомбинантой NS3-протеазой и пептидным кофактором NS4A KKGSVVIVGRIILSGRK(молярное соотношение фермент/кофактор 1:100) в присутствии ингибиторов или без них. Отделение субстрата от продуктов проводили,добавляя покрытые авидином агарозные гранулы к смеси для анализа с последующей фильтрацией. Количество продукта SMS[125I-Y]TW,обнаруженное в фильтрате, позволяет рассчитать процент превращения субстрата и процент ингибирования. А. Реагенты. Трис и Трис-HCl (высокой степени чистоты (UltraPure были получены от фирмы GibcoBRL. Глицерин (UltraPure), МЭС и БСА были получены от фирмы Sigma. ТКЭФ был получен от фирмы Pierce, ДМСО был получен от фирмыAldrich и NaOH был получен от фирмы
МПК / Метки
МПК: A61P 31/14, C07K 14/81, A61K 38/55
Метки: вируса, ингибиторы, гепатита, пептидные
Код ссылки
<a href="https://eas.patents.su/30-4765-peptidnye-ingibitory-virusa-gepatita-s.html" rel="bookmark" title="База патентов Евразийского Союза">Пептидные ингибиторы вируса гепатита с</a>
Предыдущий патент: Тартратные соли производного тиазолидиндиона
Следующий патент: Модуляция функции возбуждаемых тканей за счет периферического введения эритропоэтина
Случайный патент: Устройство и способ мониторинга скважинной коррозии


































