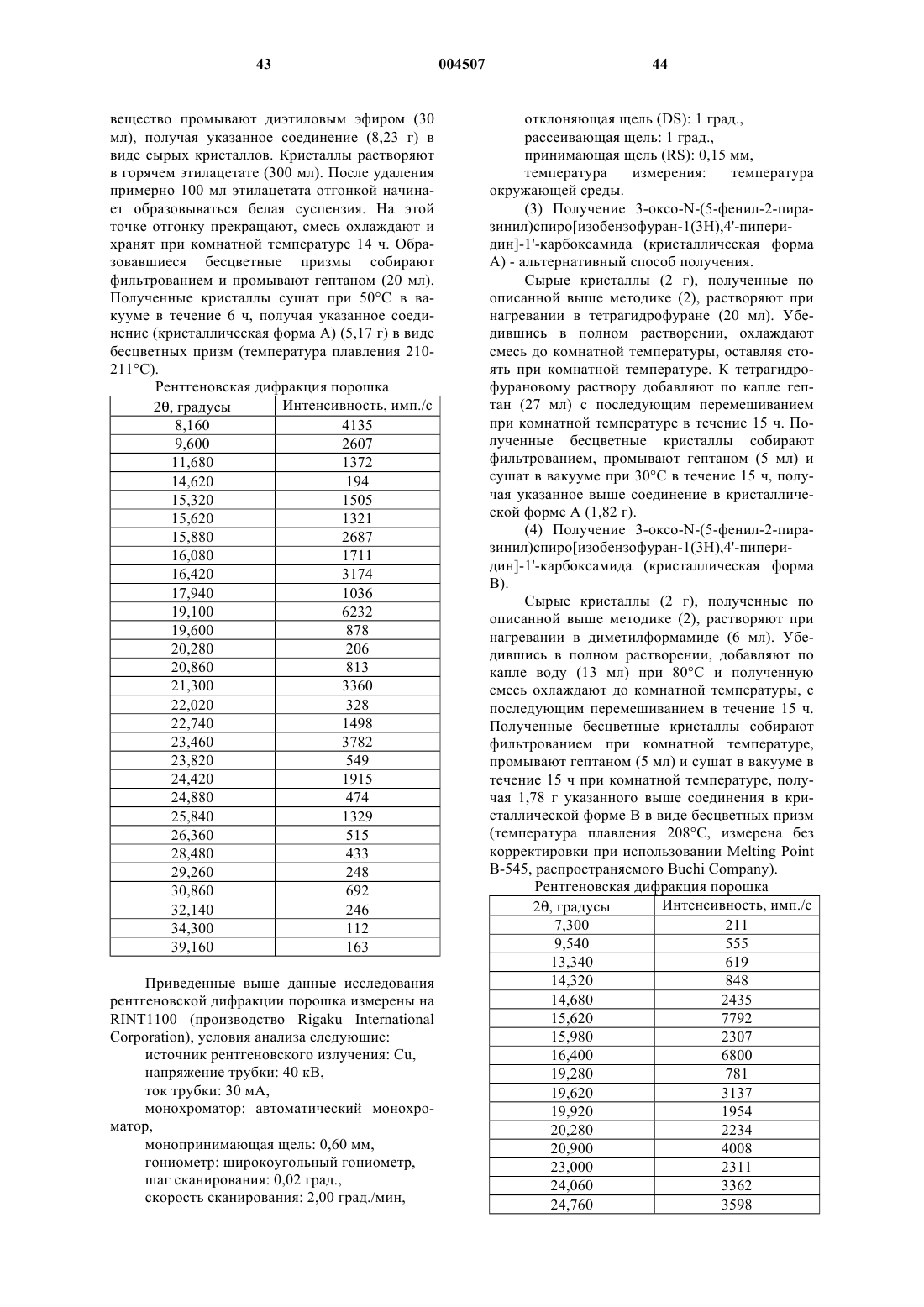
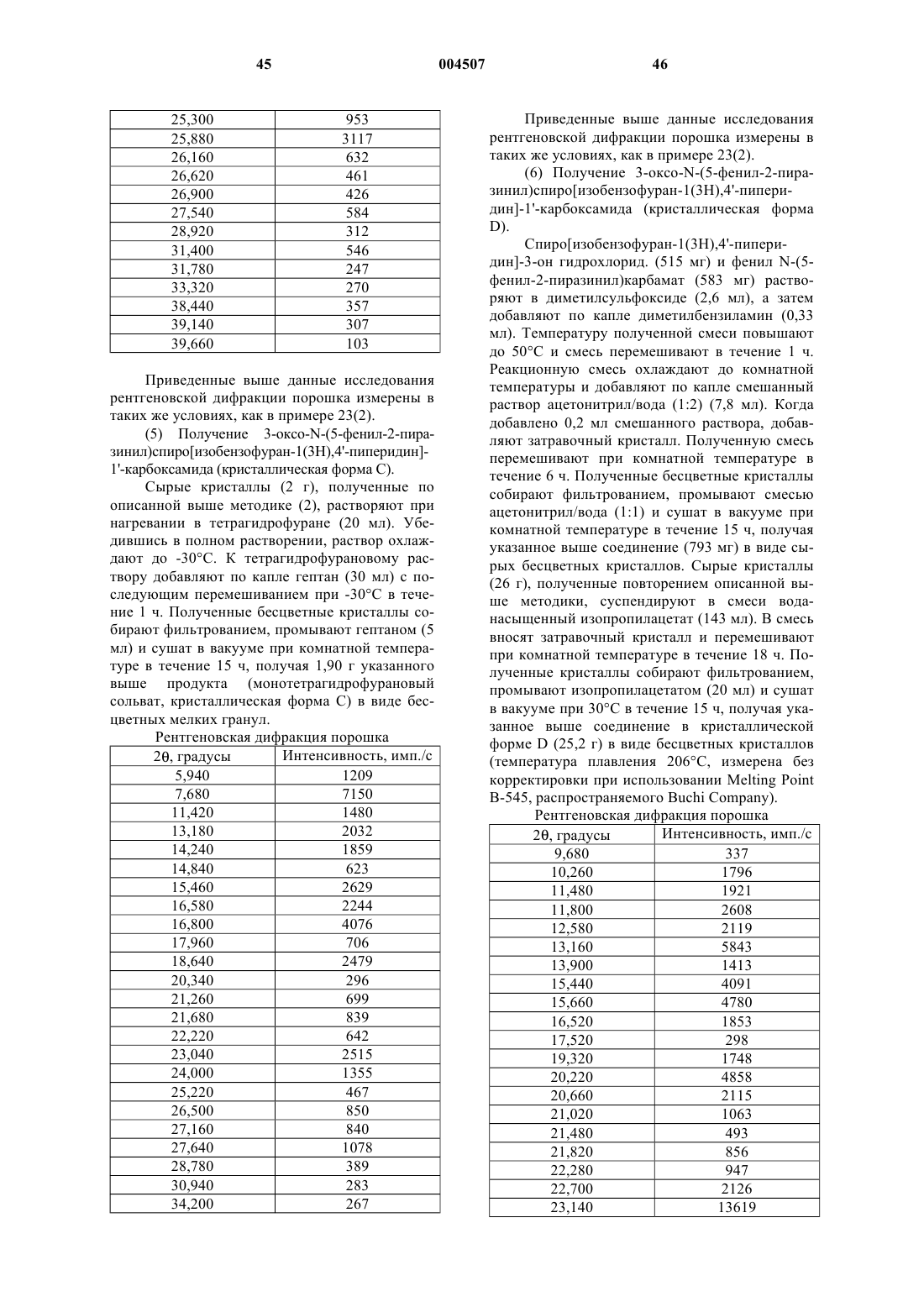
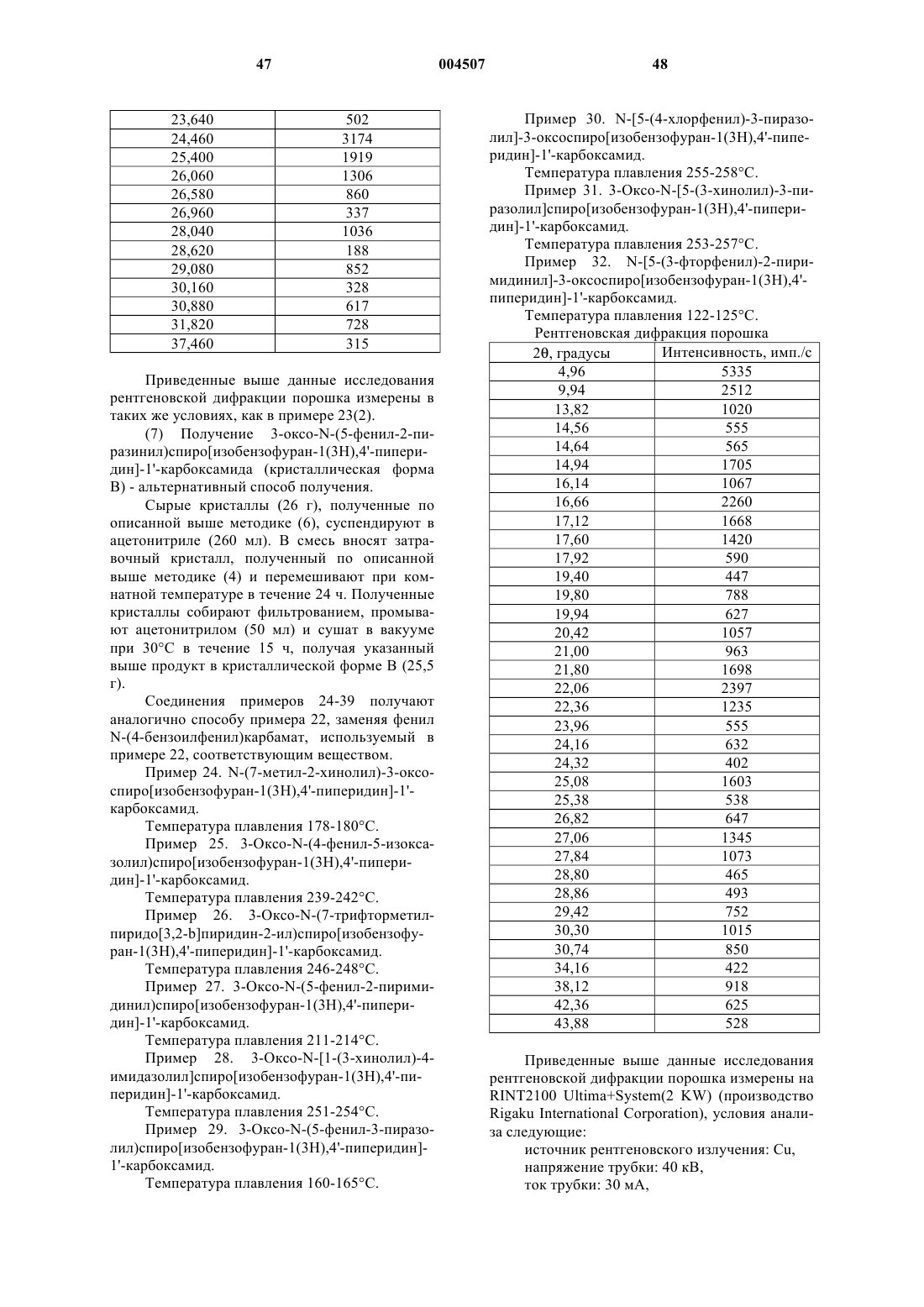
Новые спиросоединения
Номер патента: 4507
Опубликовано: 29.04.2004
Авторы: Исии Ясуюки, Хага Юдзи, Фуками Такехиро, Такахаси Тосиюки, Исихара Акане, Канатани Акио, Сакамото Тосихиро, Итох Такахиро
Формула / Реферат
1. Соединение, представленное общей формулой (I)
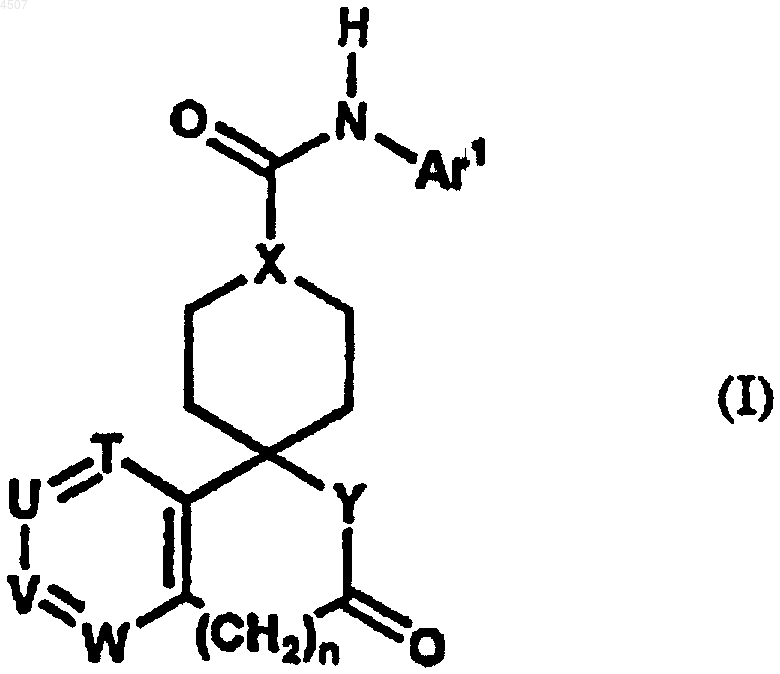
где Ar1 представляет арил или гетероарил, который может быть замещен одним или двумя заместителями, причем указанный арил или гетероарил выбран из группы, включающей фенил, пиразинил, имидазолил, изоксазолил, триазолил, оксазолил, бензотиазолил, бензоксазолил, пиридо[3,2-b]пиридил, пиримидинил, пиразолил, пиридил, тиадиазолил, пирролил, хинолил, триазинил и тиазолил, а указанный заместитель выбран из группы, включающей галоген, C1-6алкил, галоген-C1-6алкил, гидрокси-C1-6алкил, C2-6алкенил, C1-6алкокси, галоген-C1-6алкокси, C2-7алканоил, C2-6алкилен, необязательно замещенный оксогруппой, и группу, представленную формулой -Q-Ar2;
Ar2 представляет арил или гетероарил, который может быть замещен одним или двумя заместителями, причем указанный арил или гетероарил выбран из группы, включающей фенил, хинолил, пиридил, имидазолил и бензофуранил причем заместитель выбран из группы, включающей галоген, цианогруппу, C1-6алкил, галоген-C1-6алкил, гидрокси-C1-6алкил, гидрокси, C1-6алкокси, галоген-C1-6алкокси, C2-7алканоил;
n равно 0 или 1;
Q представляет простую связь или карбонил;
T, U, V и W независимо представляют атом азота или метиновую группу, которая может иметь заместитель, выбранный из группы, состоящей из галогена, C1-6алкила и гидрокси, причем по меньшей мере три из указанных T, U, V и W представляют указанную метиновую группу;
X представляет метиновую группу или азот;
Y представляет иминогруппу, которая может быть замещена C1-6алкилом, или кислород;
его соль или сложный эфир.
2. Соединение по п.1, где арил в Ar1 является фенилом.
3. Соединение по п.1, где гетероарил в Ar1 обозначает пирролил, имидазолил, пиразолил, тиазолил, оксазолил, изоксазолил, 1,2,3-триазолил, 1,2,4-тиадиазолил, пиридил, пиразинил, пиримидинил, 1,2,4-триазинил, бензоксазолил, бензотиазолил, хинолил или пиридо[3,2-b]пиридил.
4. Соединение по п.1, в котором T, U, V и W независимо представляют метин, который может иметь заместитель, выбранный из группы, состоящей из галогена, C1-6алкила, гидроксила и C1-6алкоксигруппы.
5. Соединение по п.4, в котором T, U, V и W независимо представляют метин, который может быть замещен галогеном.
6. Соединение по п.1, в котором один из T, U, V и W представляет азот.
7. Соединение по п.1, в котором Y представляет незамещенную иминогруппу или кислород.
8. Соединение по п.1, в котором Y представляет кислород.
9. Соединение по п.1, которое представлено общей формулой (I-a)
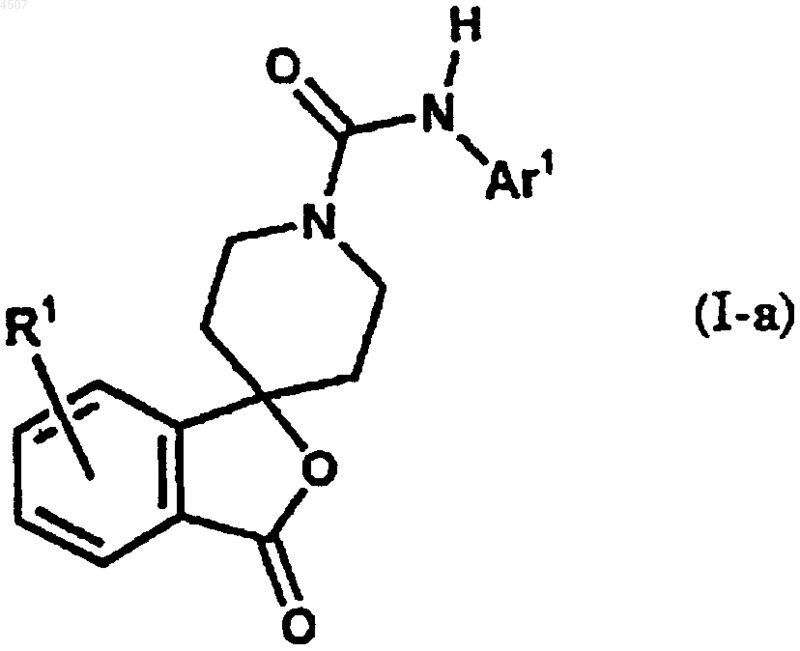
где Ar1 представляет арил или гетероарил, который может быть замещен одним или двумя заместителями, причем указанный арил или гетероарил выбран из группы, включающей фенил, пиразинил, имидазолил, изоксазолил, триазолил, оксазолил, бензотиазолил, бензоксазолил, пиридо[3,2-b]пиридил, пиримидинил, пиразолил, пиридил, тиадиазолил, пирролил, хинолил, триазинил и тиазолил, причем заместитель выбран из группы, включающей галоген, C1-6алкил, галоген-C1-6алкил, гидрокси-C1-6алкил, C2-6алкенил, C1-6алкокси, галоген-C1-6алкокси, C2-7алканоил, C2-6алкилен, необязательно замещенный оксогруппой, и группу, представленную формулой -Q-Ar2;
Ar2 представляет арил или гетероарил, который может быть замещен одним или двумя заместителями, причем указанный арил или гетероарил выбран из группы, включающей фенил, хинолил, пиридил, имидазолил и бензофуранил, причем заместитель выбран из группы, включающей галоген, цианогруппу, C1-6алкил, галоген-C1-6алкил, гидрокси-C1-6алкил, гидрокси, C1-6алкокси, галоген-C1-6алкокси, C2-7алканоил;
Q представляет простую связь или карбонил;
R1 представляет атом водорода или галоген.
10. Соединение по п.9, где арил в Ar1 обозначает фенил.
11. Соединение по п.9, где гетероарил в Ar1 обозначает имидазолил, пиразолил, изоксазолил, 1,2,4-тиадиазолил, пиразинил, пиримидинил, хинолил или пиридо[3,2-b]пиридил.
12. Соединение по п.1, которое представлено общей формулой (I-b)
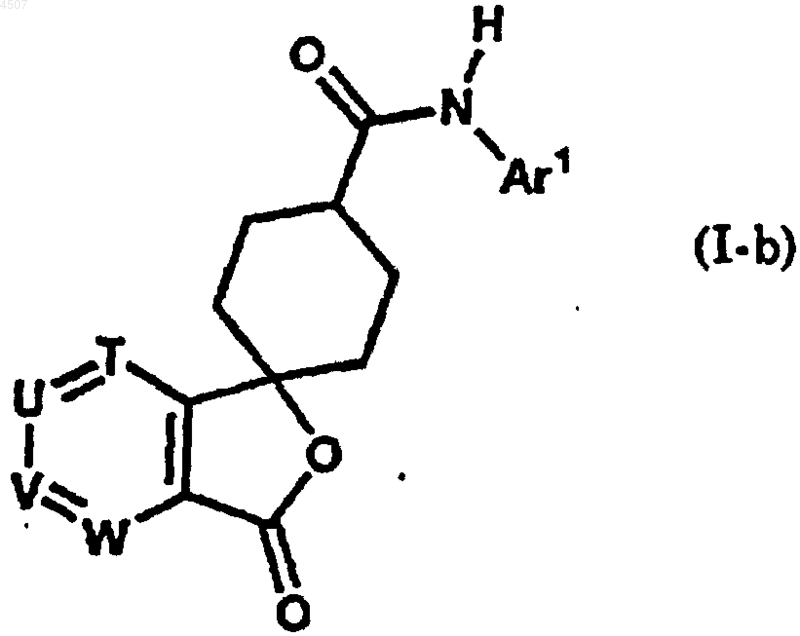
где Ar1 представляет арил или гетероарил, который может быть замещен одним или двумя заместителями, причем указанный арил или гетероарил выбран из группы, включающей фенил, пиразинил, имидазолил, изоксазолил, триазолил, оксазолил, бензотиазолил, бензоксазолил, пиридо[3,2-b]пиридил, пиримидинил, пиразолил, пиридил, тиадиазолил, пирролил, хинолил, триазинил и тиазолил,
причем заместитель выбран из группы, включающей галоген, C1-6алкил, галоген-C1-6алкил, гидрокси-C1-6алкил, C2-6алкенил, C1-6алкокси, галоген-C1-6алкокси, C2-7алканоил, C2-6алкилен, необязательно замещенный оксогруппой, и группу, представленную формулой -Q-Ar2;
Ar2 представляет арил или гетероарил, который может быть замещен одним или двумя заместителями, причем указанный арил или гетероарил выбран из группы, включающей фенил, хинолил, пиридил, имидазолил и бензофуранил, причем заместитель выбран из группы, включающей галоген, цианогруппу, C1-6алкил, галоген-C1-6алкил, гидрокси-C1-6алкил, гидрокси, C1-6алкокси, галоген-C1-6алкокси, C2-7алканоил;
Q представляет простую связь или карбонил;
T, U, V и W независимо представляют атом азота или метиновую группу, которая может иметь заместитель, выбранный из группы, состоящей из галогена, C1-6алкила и гидроксила и C1-6алкоксигруппы, причем по меньшей мере три из T, U, V и W представляют указанную метиновую группу.
13. Соединение по п.12, где арил в Ar1 обозначает фенил.
14. Соединение по п.12, где гетероарил в Ar1 обозначает пирролил, имидазолил, пиразолил, тиазолил, оксазолил, изоксазолил, 1,2,3-триазолил, 1,2,4-тиадиазолил, пиридил, пиразинил, пиримидинил или 1,2,4-триазинил.
15. Соединение по п.12, в котором один из T, U, V и W представляют азот.
16. Соединение по п.12, в котором V представляет азот и каждый из T, U и W представляет метиновую группу.
17. Соединение по п.1, которое представляет собой
N-(4-бензоилфенил)-3-оксоспиро[изоиндолин-1,4'-пиперидин]-1'-карбоксамид,
3-оксо-N-(5-фенил-2-пиразинил)спиро[изоиндолин-1,4'-пиперидин]-1'-карбоксамид,
N-(7-метил-2-хинолил)-3-оксоспиро[изоиндолин-1,4'-пиперидин]-1'-карбоксамид,
N-(4-бензоилфенил)-2-метил-3-оксоспиро[изоиндолин-1,4'-пиперидин]-1'-карбоксамид,
N-(4-бензоилфенил)-3,4-дигидро-3-оксоспиро[изохинолин-1(2H),4'-пиперидин]-1'-карбоксамид,
3,4-дигидро-3-оксо-N-(5-фенил-2-пиразинил)спиро[изохинолин-1(2H),4'-пиперидин]-1'-карбоксамид,
3,4-дигидро-N-(7-метил-2-хинолил)-3-оксоспиро[изохинолин-1(2H),4'-пиперидин]-1'-карбоксамид,
N-(4-ацетилфенил)-3,4-дигидро-3-оксоспиро[изохинолин-1(2H),4'-пиперидин]-1'-карбоксамид,
3,4-дигидро-3-оксо-N-[1-(2-хинолил)-4-имидазолил]спиро[изохинолин-1(2H),4'-пиперидин]-1'-карбоксамид,
3,4-дигидро-3-оксо-N-(5-оксо-5,6,7,8-тетрагидро-2-нафтил)спиро[изохинолин-1(2H),4'-пиперидин]-1'-карбоксамид,
3,4-дигидро-N-[5-(2-метил-1-пропенил)-2-пиразинил]-3-оксоспиро[изохинолин-1(2H),4'-пиперидин]-1'-карбоксамид,
3,4-дигидро-3-оксо-N-(3-фенил-5-изоксазолил)спиро[изохинолин-1(2H),4'-пиперидин]-1'-карбоксамид,
N-[1-(7-бензо[b]фуранил)-4-имидазолил]-3,4-дигидро-3-оксоспиро[изохинолин-1(2H),4'-пиперидин]-1'-карбоксамид,
N-[1-(3-дифторметоксифенил)-4-имидазолил]-3,4-дигидро-3-оксоспиро[изохинолин-1(2H),4'-пиперидин]-1'-карбоксамид,
3,4-дигидро-3-оксо-N-[4-(2-пиридилкарбонил)фенил]спиро[изохинолин-1(2H),4'-пиперидин]-1'-карбоксамид,
N-(3,4-дихлорфенил)-3,4-дигидро-3-оксоспиро[изохинолин-1(2H),4'-пиперидин]-1'-карбоксамид,
N-[1-(3-хлорфенил)-4-имидазолил]-3,4-дигидро-3-оксоспиро[изохинолин-1(2H),4'-пиперидин]-1'-карбоксамид,
3,4-дигидро-3-оксо-N-(5-фенил-2-тиазолил)спиро[изохинолин-1(2H),4'-пиперидин]-1'-карбоксамид,
3,4-дигидро-3-оксо-N-[5-(2-пиридил)-2-пиразинил]спиро[изохинолин-1(2H),4'-пиперидин]-1'-карбоксамид,
3,4-дигидро-N-(4-метил-2-бензотиазолил)-3-оксоспиро[изохинолин-1(2H),4'-пиперидин]-1'-карбоксамид,
N-(5-хлор-2-бензоксазолил)-3,4-дигидро-3-оксоспиро[изохинолин-1(2H),4'-пиперидин]-1'-карбоксамид,
N-(4-бензоилфенил)-3-оксоспиро[изобензофуран-1(3H),4'-пиперидин]-1'-карбоксамид,
3-оксо-N-(5-фенил-2-пиразинил)спиро[изобензофуран-1(3H),4'-пиперидин]-1'-карбоксамид,
N-(7-метил-2-хинолил)-3-оксоспиро[изобензофуран-1(3H),4'-пиперидин]-1'-карбоксамид,
3-оксо-N-(4-фенил-5-изоксазолил)спиро[изобензофуран-1(3H),4'-пиперидин]-1'-карбоксамид,
3-оксо-N-(7-трифторметилпиридо[3,2-b]пиридин-2-ил)спиро[изобензофуран-1(3H),4'-пиперидин]-1'-карбоксамид,
3-оксо-N-(5-фенил-2-пиримидинил)спиро[изобензофуран-1(3H),4'-пиперидин]-1'-карбоксамид,
3-оксо-N-[1-(3-хинолил)-4-имидазолил]спиро[изобензофуран-1(3H),4'-пиперидин]-1'-карбоксамид,
3-оксо-N-(5-фенил-3-пиразолил)спиро[изобензофуран-1(3H),4'-пиперидин]-1'-карбоксамид,
N-[5-(4-хлорфенил)-3-пиразолил]-3-оксоспиро[изобензофуран-1(3H),4'-пиперидин]-1'-карбоксамид,
3-оксо-N-[5-(3-хинолил)-3-пиразолил]спиро[изобензофуран-1(3H),4'-пиперидин]-1'-карбоксамид,
N-[5-(3-фторфенил)-2-пиримидинил]-3-оксоспиро[изобензофуран-1(3H),4'-пиперидин]-1'-карбоксамид,
3-оксо-N-[5-(3-трифторметилфенил)-2-пиримидинил]спиро[изобензофуран-1(3H),4'-пиперидин]-1'-карбоксамид,
N-[5-(3-хлорфенил)-2-пиримидинил]-3-оксоспиро[изобензофуран-1(3H),4'-пиперидин]-1'-карбоксамид,
N-(7-фторметоксипиридо[3,2-b]пиридин-2-ил)-3-оксоспиро[изобензофуран-1(3H),4'-пиперидин]-1'-карбоксамид,
3-оксо-N-(5-фенил-1,2,4-тиадиазол-3-ил)спиро[изобензофуран-1(3H),4'-пиперидин]-1'-карбоксамид,
N-{1-[3-(2-гидроксиэтил)фенил]-4-имидазолил}-3-оксоспиро[изобензофуран-1(3H),4'-пиперидин]-1'-карбоксамид,
N-[4-(1-этил-2-имидазолил)фенил]-3-оксоспиро[изобензофуран-1(3H),4'-пиперидин]-1'-карбоксамид,
N-[1-(3-метоксифенил)-4-имидазолил]-3-оксоспиро[изобензофуран-1(3H),4'-пиперидин]-1'-карбоксамид,
6-фтор-3-оксо-N-(5-фенил-2-пиразинил)спиро[изобензофуран-1(3H),4'-пиперидин]-1'-карбоксамид,
6-фтор-3-оксо-N-(5-фенил-2-пиримидинил)спиро[изобензофуран-1(3H),4'-пиперидин]-1'-карбоксамид,
5-фтор-3-оксо-N-(5-фенил-2-пиразинил)спиро[изобензофуран-1(3H),4'-пиперидин]-1'-карбоксамид,
5-фтор-3-оксо-N-(5-фенил-2-пиримидинил)спиро[изобензофуран-1(3H),4'-пиперидин]-1'-карбоксамид,
N-(4-бензоилфенил)-3,4-дигидро-3-оксоспиро[1H-2-бензопиран-1,4'-пиперидин]-1'-карбоксамид,
3,4-дигидро-3-оксо-N-(5-фенил-2-пиразинил)спиро[1H-2-бензопиран-1,4'-пиперидин]-1'-карбоксамид,
N-(5-бензоил-2-пиразинил)-3,4-дигидро-3-оксоспиро[1H-2-бензопиран-1,4'-пиперидин]-1'-карбоксамид,
транс-N-(4-бензоилфенил)-3'-оксоспиро[циклогексан-1,1'(3'H)изобензофуран]-4-карбоксамид,
транс-3'-оксо-N-(5-фенил-2-пиразинил)спиро[циклогексан-1,1'(3'H)изобензофуран]-4-карбоксамид,
транс-3'-оксо-N-(1-фенил-4-имидазолил)спиро[циклогексан-1,1'(3'H)изобензофуран]-4-карбоксамид,
транс-3'-оксо-N-(5-фенил-2-пиримидинил)спиро[циклогексан-1,1'(3'H)изобензофуран]-4-карбоксамид,
транс-N-[1-(3,5-дифторфенил)-4-имидазолил]-3'-оксоспиро[циклогексан-1,1'(3'H)изобензофуран]-4-карбоксамид,
транс-3'-оксо-N-(5-фенил-3-пиразолил)спиро[циклогексан-1,1'(3'H)изобензофуран]-4-карбоксамид,
транс-N-[1-(2-фторфенил)-4-имидазолил]-3'-оксоспиро[циклогексан-1,1'(3'H)изобензофуран]-4-карбоксамид,
транс-N-(4-ацетил-3-трифторметилфенил)-3'-оксоспиро[циклогексан-1,1'(3'H)изобензофуран]-4-карбоксамид,
транс-3'-оксо-N-[1-(3-хинолил)-4-имидазолил]спиро[циклогексан-1,1'(3'H)изобензофуран]-4-карбоксамид,
транс-N-[1-(3-цианофенил)-4-имидазолил]-3'-оксоспиро[циклогексан-1,1'(3'H)изобензофуран]-4-карбоксамид,
транс-N-(4-бензоилфенил)-3-оксоспиро[4-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид,
транс-3-оксо-N-(5-фенил-2-пиразинил)спиро[4-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид,
транс-3-оксо-N-(3-фенил-5-изоксазолил)спиро[4-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид,
транс-3-оксо-N-(5-фенил-2-пиримидинил)спиро[4-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид,
транс-N-(4-бензоилфенил)-3-оксоспиро[5-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид,
транс-N-(4-бензоилфенил)-3-оксоспиро[6-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид,
N-[5-(4-гидроксифенил)-2-пиразинил]-3-оксоспиро[изобензофуран-1(3H),4'-пиперидин]-1'-карбоксамид,
N-[5-(3-гидроксифенил)-2-пиразинил]-3-оксоспиро[изобензофуран-1(3H),4'-пиперидин]-1'-карбоксамид,
4-фтор-3-оксо-N-(5-фенил-2-пиримидинил)спиро[изобензофуран-1(3H),4'-пиперидин]-1'-карбоксамид,
7-фтор-3-оксо-N-(5-фенил-2-пиримидинил)спиро[изобензофуран-1(3H),4'-пиперидин]-1'-карбоксамид,
6-этил-3-оксо-N-(5-фенил-2-пиразинил)спиро[изобензофуран-1(3H),4'-пиперидин]-1'-карбоксамид,
6-гидрокси-3-оксо-N-(5-фенил-2-пиразинил)спиро[изобензофуран-1(3H),4'-пиперидин]-1'-карбоксамид,
транс-3-оксо-N-(5-фенил-2-пиримидинил)спиро[5-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид,
транс-N-[5-(3-фторфенил)-2-пиримидинил]-3-оксоспиро[5-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид,
транс-N-[5-(2-фторфенил)-2-пиримидинил]-3-оксоспиро[5-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид,
транс-3-оксо-N-(4-фенил-2-оксазолил)спиро[5-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид,
транс-N-[5-(2-метилфенил)-2-пиримидинил]-3-оксоспиро[5-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид,
транс-N-[5-(3-метилфенил)-2-пиримидинил]-3-оксоспиро[5-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид,
транс-N-[5-(3-фторметоксифенил)-2-пиримидинил]-3-оксоспиро[5-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид,
транс-N-[5-(3-фторметилфенил)-2-пиримидинил]-3-оксоспиро[5-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид,
транс-N-[5-(3-фтор-5-метоксифенил)-2-пиримидинил]-3-оксоспиро[5-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид,
транс-N-[5-(2-фтор-5-метилфенил)-2-пиримидинил]-3-оксоспиро[5-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид,
транс-N-[4-(3-фторметоксифенил)-2-оксазолил]-3-оксоспиро[5-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид,
транс-N-[5-(3-гидроксиметилфенил)-2-пиримидинил]-3-оксоспиро[5-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид,
транс-N-[5-(3-гидроксифенил)-2-пиримидинил]-3-оксоспиро[5-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид,
транс-3-оксо-N-(5-фенил-2-пиримидинил)спиро[6-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид,
транс-N-[5-(3-фторметилфенил)-2-пиримидинил]-3-оксоспиро[6-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид,
транс-N-[5-(3-фторметоксифенил)-2-пиримидинил]-3-оксоспиро[6-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид,
транс-3-оксо-N-(6-фенил-1,2,4-триазин-3-ил)спиро[6-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид,
транс-N-[5-(2-дифторметоксифенил)-3-пиразолил]-3-оксоспиро[6-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид,
транс-N-[5-(3-дифторметоксифенил)-3-пиразолил]-3-оксоспиро[6-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид,
транс-N-[5-(3-фторфенил)-3-пиразолил]-3-оксоспиро[6-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид,
транс-N-[5-(4-фторфенил)-3-пиразолил]-3-оксоспиро[6-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид,
транс-N-(4-бензоилфенил)-3-оксоспиро[7-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид,
транс-N-[1-(3,5-дифторфенил)-4-имидазолил]-3-оксоспиро[7-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид,
транс-3-оксо-N-(2-фенил-4-пиридил)спиро[7-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид,
транс-3-оксо-N-(1-фенил-4-пиразолил)спиро[7-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид,
транс-3-оксо-N-(1-фенил-3-пирролил)спиро[7-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид,
транс-N-[1-(4-фторфенил)-3-пиразолил]-3-оксоспиро[7-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид,
транс-3-оксо-N-(1-фенил-3-пиразолил)спиро[4-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид,
транс-3-оксо-N-(1-фенил-4-пиразолил)спиро[4-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид,
транс-N-[1-(3-фторфенил)-4-пиразолил]-3-оксоспиро[4-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид,
транс-3-оксо-N-(1-фенил-3-пиразолил)спиро[6-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид,
транс-N-[1-(4-фторфенил)-3-пиразолил]-3-оксоспиро[6-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид,
транс-N-[1-(2-фторфенил)-3-пиразолил]-3-оксоспиро[6-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид,
транс-3-оксо-N-(5-фенил-1,2,4-тиадиазол-3-ил)спиро[6-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид,
транс-3-оксо-N-(5-фенил-3-изоксазолил)спиро[6-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид,
транс-3-оксо-N-(6-фенил-3-пиридил)спиро[6-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид,
транс-3-оксо-N-(2-фенил-3-тиазолил)спиро[6-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид или
транс-3-оксо-N-(2-фенил-1,2,3-триазол-4-ил)спиро[6-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид.
18. Соединение по п.1, которое представляет собой 3-оксо-N-(5-фенил-2-пиразинил)спиро[изобензофуран-1(3H),4'-пиперидин]-1'-карбоксамид.
19. Соединение по п.1, которое представляет собой 3-оксо-N-(7-трифторметилпиридо[3,2-b]пиридин-2-ил)спиро[изобензофуран-1(3H),4'-пиперидин]-1'-карбоксамид.
20. Соединение по п.1, которое представляет собой N-[5-(3-фторфенил)-2-пиримидинил]-3-оксоспиро[изобензофуран-1(3H),4'-пиперидин]-1'-карбоксамид.
21. Соединение по п.1, которое представляет собой транс-3'-оксо-N-(5-фенил-2-пиримидинил)спиро[циклогексан-1,1'(3'H)изобензофуран]-4-карбоксамид.
22. Соединение по п.1, которое представляет собой транс-3'-оксо-N-[1-(3-хинолил)-4-имидазолил]спиро[циклогексан-1,1'(3'H)изобензофуран]-4-карбоксамид.
23. Соединение по п.1, которое представляет собой транс-3-оксо-N-(5-фенил-2-пиразинил)спиро[4-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид.
24. Соединение по п.1, которое представляет собой транс-N-[5-(3-фторфенил)-2-пиримидинил]-3-оксоспиро[5-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид.
25. Соединение по п.1, которое представляет собой транс-N-[5-(2-фторфенил)-2-пиримидинил]-3-оксоспиро[5-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид.
26. Соединение по п.1, которое представляет собой транс-N-[1-(3,5-дифторфенил)-4-имидазолил]-3-оксоспиро[7-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид.
27. Соединение по п.1, которое представляет собой транс-3-оксо-N-(1-фенил-4-пиразолил)спиро[4-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид.
28. Соединение по п.1, которое представляет собой транс-3-оксо-N-(1-фенил-3-пиразолил)спиро[6-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид.
29. Соединение по п.1, которое представляет собой транс-3-оксо-N-(2-фенил-1,2,3-триазол-4-ил)спиро[6-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид.
30. Способ получения соединения общей формулы (I-1)
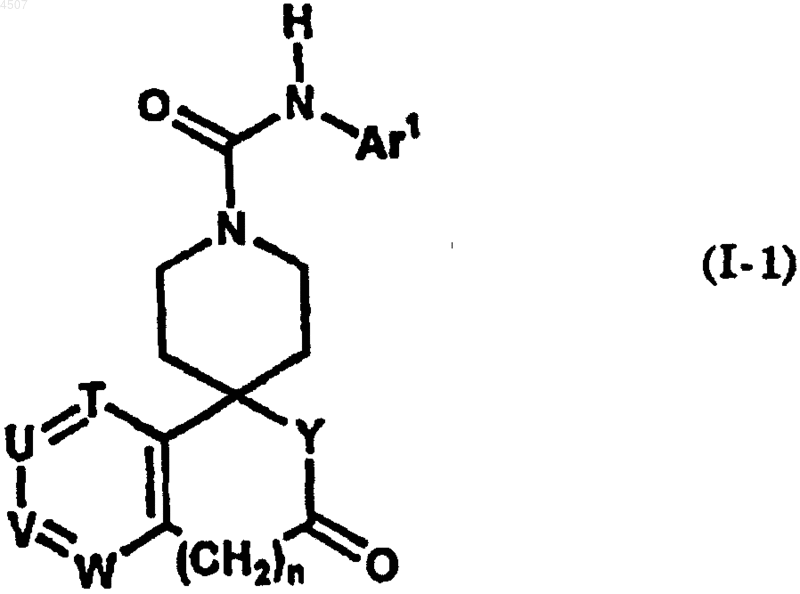
где Ar1 представляет арил или гетероарил, который может быть замещен одним или двумя заместителями, причем указанный арил или гетероарил выбран из группы, включающей фенил, пиразинил, имидазолил, изоксазолил, триазолил, оксазолил, бензотиазолил, бензоксазолил, пиридо[3,2-b]пиридил, пиримидинил, пиразолил, пиридил, тиадиазолил, пирролил, хинолил, триазинил и тиазолил, причем заместитель выбран из группы, включающей галоген, C1-6алкил, галоген-C1-6алкил, гидрокси-C1-6алкил, C2-6алкенил, C1-6алкокси, галоген-C1-6алкокси, C2-7алканоил, C2-6алкилен, необязательно замещенный оксогруппой, и группу, представленную формулой -Q-Ar2;
Ar2 представляет арил или гетероарил, который может быть замещен одним или двумя заместителями, причем указанный арил или гетероарил выбран из группы, включающей фенил, хинолил, пиридил, имидазолил и бензофуранил, причем заместитель выбран из группы, включающей галоген, цианогруппу, C1-6алкил, галоген-C1-6алкил, гидрокси-C1-6алкил, гидрокси, C1-6алкокси, галоген-C1-6алкокси, C2-7алканоил;
Q представляет простую связь или карбонил;
T, U, V и W независимо представляют атом азота или метиновую группу, которая может иметь заместитель, выбранный из группы, состоящей из галогена, C1-6алкила и гидроксила, причем по меньшей мере три из них представляют указанную метиновую группу;
n и Y имеют значения, описанные далее;
его соли или сложного эфира, который включает взаимодействие соединения общей формулы (II)
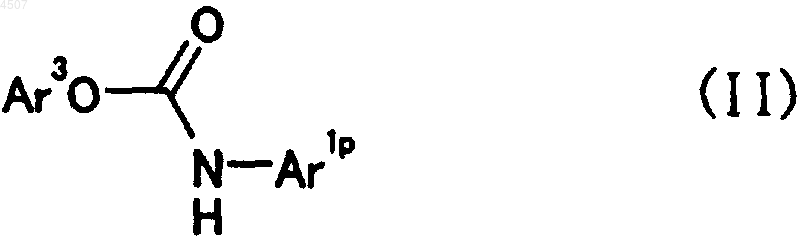
где Ar1p представляет арил или гетероарил, который может быть замещен одним или двумя заместителями, причем указанный арил или гетероарил выбран из группы, включающей фенил, пиразинил, имидазолил, изоксазолил, триазолил, оксазолил, бензотиазолил, бензоксазолил, пиридо[3,2-b]пиридил, пиримидинил, пиразолил, пиридил, тиадиазолил, пирролил, хинолил, триазинил и тиазолил, причем заместитель выбран из группы, включающей галоген, C1-6алкил, галоген-C1-6алкил, C2-6алкенил, C1-6алкокси, галоген-C1-6алкокси, C2-7алканоил, необязательно защищенный C2-6алкилен, необязательно замещенный оксогруппой, необязательно защищенный гидрокси-C1-6алкил, и группу, представленную формулой -Qp-Ar2p;
Ar2p представляет арил или гетероарил, который может быть замещен одним или двумя заместителями, причем указанный арил или гетероарил выбран из группы, включающей фенил, хинолил, пиридил, имидазолил и бензофуранил, причем заместитель выбран из группы, включающей галоген, цианогруппу, C1-6алкил, галоген-C1-6алкил, необязательно защищенный гидрокси-C1-6алкил, необязательно защищенный гидрокси, C1-6алкокси, галоген-C1-6алкокси, C2-7алканоил;
Ar3 представляет фенил, который может быть замещен галогеном или нитрогруппой;
Qp представляет простую связь или необязательно защищенный карбонил;
с соединением общей формулы (III)
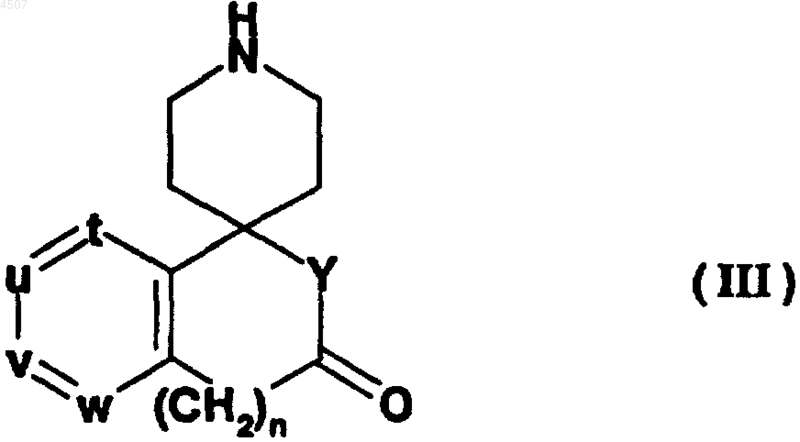
где n равно 0 или 1;
t, u, v и w независимо представляют атом азота или метиновую группу, которая может иметь заместитель, выбранный из группы, состоящей из галогена, C1-6алкила и необязательно защищенного гидроксила, причем по меньшей мере три из них (t, u, v и w) представляют указанную метиновую группу;
Y представляет иминогруппу, которая может быть замещена C1-6алкилом, или атом кислорода;
с получением соединения общей формулы (IV-1)
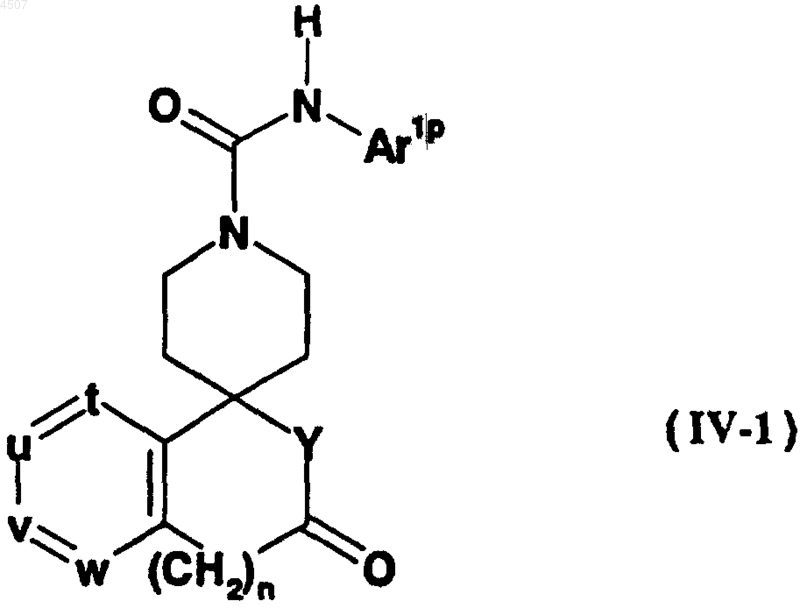
где Ar1p, n, t, u, v, w и Y имеют те же значения, что указаны выше;
с необязательным последующим удалением защитной группы.
31. Способ получения соединения общей формулы (I-2)
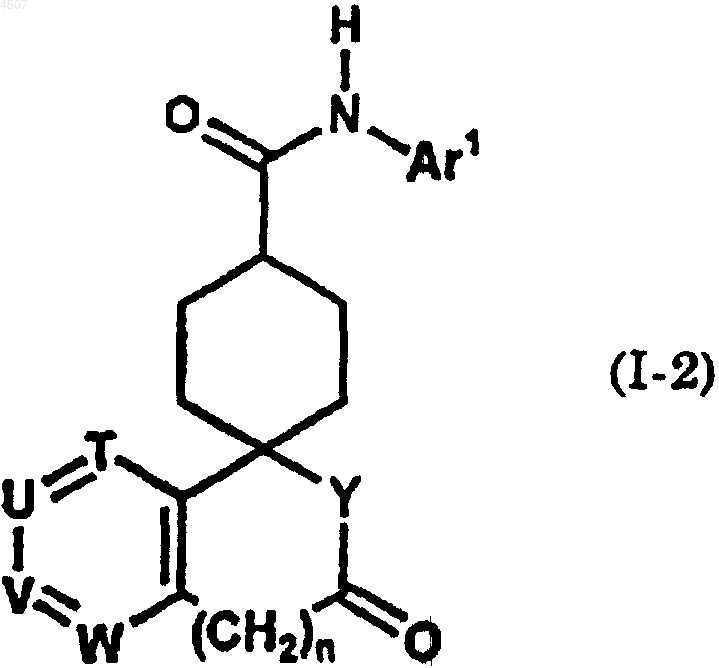
где Ar1 представляет арил шыш гетероарил, который может быть замещен одним или двумя заместителями, причем указанный арил или гетероарил выбран из группы, включающей фенил, пиразинил, имидазолил, изоксазолил, триазолил, оксазолил, бензотиазолил, бензоксазолил, пиридо[3,2-b]пиридил, пиримидинил, пиразолил, пиридил, тиадиазолил, пирролил, хинолил, триазинил и тиазолил, причем заместитель выбран из группы, включающей галоген, C1-6алкил, галоген-C1-6алкил, гидрокси-C1-6алкил, C2-6алкенил, C1-6алкокси, галоген-C1-6алкокси, C2-7алканоил, C2-6алкилен, необязательно замещенный оксогруппой, и группу, представленную формулой -Q-Ar2;
Ar2 представляет арил или гетероарил, который может быть замещен одним или двумя заместителями, причем указанный арил или гетероарил выбран из группы, включающей фенил, хинолил, пиридил, имидазолил и бензофуранил, причем заместитель выбран из группы, включающей галоген, цианогруппу, C1-6алкил, галоген-C1-6алкил, гидрокси-C1-6алкил, гидрокси, C1-6алкокси, галоген-C1-6алкокси, C2-7алканоил;
Q представляет простую связь или карбонил;
T, U, V и W независимо представляют атом азота или метиновую группу, которая может иметь заместитель, выбранный из группы, состоящей из галогена, C1-4алкила и гидроксила, причем по меньшей мере три из них (T, U, V и W) представляют указанную метиновую группу;
n и Y имеют те же значения, что определены далее;
его соль или сложный эфир, который включает взаимодействие соединения (V)
Ar1p-NH2 (V)
где Ar1p представляет арил или гетероарил, который может быть замещен одним или двумя заместителями, причем указанный арил или гетероарил выбран из группы, включающей фенил, пиразинил, имидазолил, изоксазолил, триазолил, оксазолил, бензотиазолил, бензоксазолил, пиридо[3,2-b]пиридил, пиримидинил, пиразолил, пиридил, тиадиазолил, пирролил, хинолил, триазинил и тиазолил, причем заместитель выбран из группы, включающей галоген, C1-6алкил, галоген-C1-6алкил, C2-6алкенил, C1-6алкокси, галоген-C1-6алкокси, C2-7алканоил, необязательно защищенный C2-6алкилен, необязательно замещенный оксогруппой, необязательно защищенный гидрокси-C1-6алкил и группу формулы -Qp-Ar2p;
Ar2p представляет арил или гетероарил, который может быть замещен одним или двумя заместителями, причем причем указанный арил или гетероарил выбран из группы, включающей фенил, хинолил, пиридил, имидазолил и бензофуранил, причем заместитель выбран из группы, включающей галоген, цианогруппу, C1-6алкил, галоген-C1-6алкил, необязательно защищенный гидрокси-C1-6алкил, необязательно защищенный гидрокси, C1-6алкокси, галоген-C1-6алкокси, C2-7алканоил;
Qp представляет простую связь или необязательно защищенный карбонил;
с карбоновой кислотой общей формулы (VI)
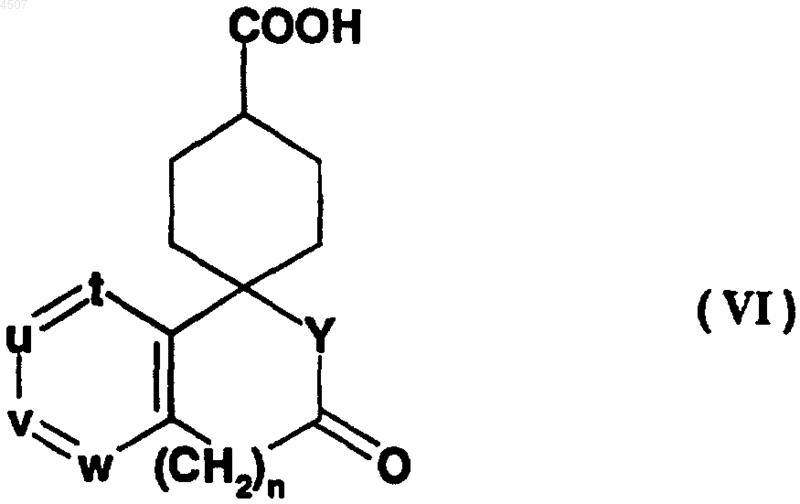
где n равно 0 или 1;
t, u, v и w независимо представляют атом азота или метиновую группу, которая может иметь заместитель, выбранный из группы, состоящей из галогена, C1-4алкила и необязательно защищенного гидроксила, причем по меньшей мере три из них (t, u, v и w) представляют указанную метиновую группу;
Y представляет иминогруппу, которая может быть замещена C1-6алкилом, или атом кислорода;
или ее реакционноспособным производным, с получением соединения общей формулы (IV-2)
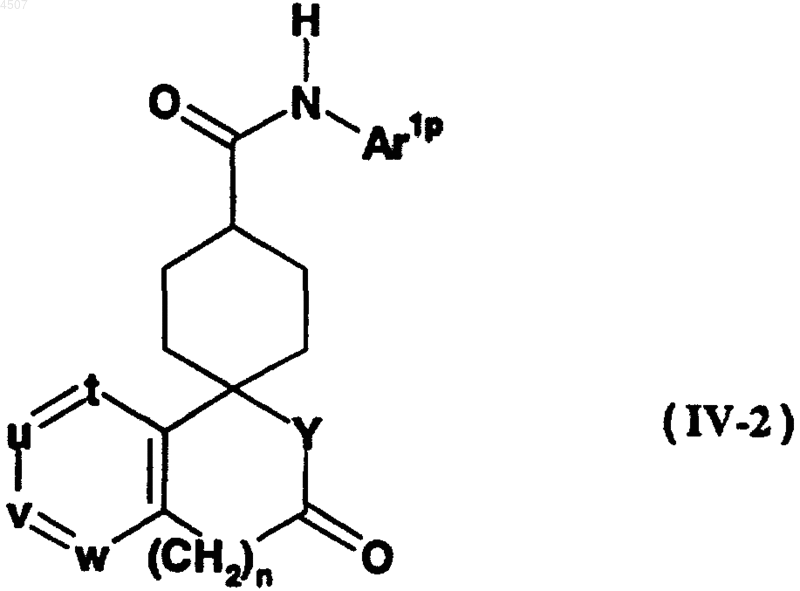
где Ar1p, n, t, u, v, w и Y имеют те же значения, как описано выше;
с необязательным последующим удалением защитной группы.
32. Применение соединения общей формулы (I), его соли или сложного эфира в качестве антагониста рецептора нейропептида Y.
33. Применение соединения общей формулы (I), его соли или сложного эфира в качестве активного ингредиента фармацевтической композиции для лечения булемии, ожирения или диабета.
34. Фармацевтическая композиция, содержащая в качестве активного ингредиента соединение общей формулы (I), его соль или сложный эфир для лечения заболеваний, опосредованных NPY Y5-рецептором.
35. Фармацевтическая композиция по п.34 для лечения булемии, ожирения или диабета, содержащая в качестве активного ингредиента соединение общей формулы (I), его соль или сложный эфир.
36. Соединение общей формулы (VI-1)
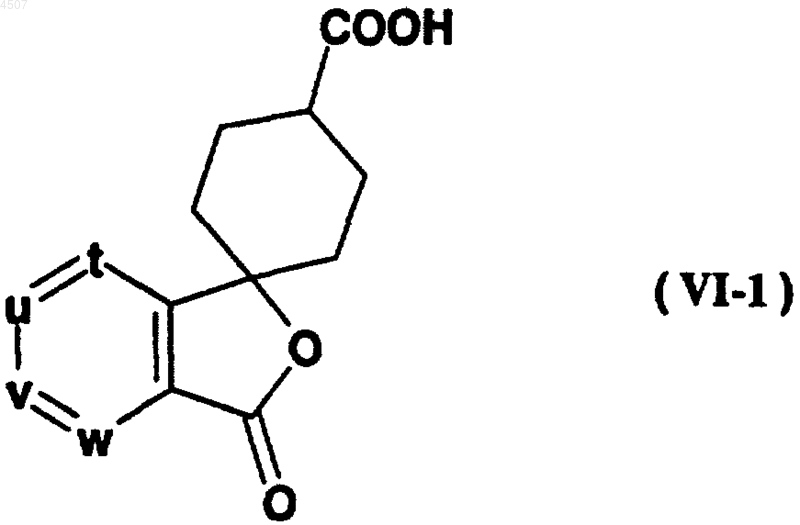
где t, u, v и w независимо представляют атом азота или метиновую группу, которая может иметь заместитель, выбранный из группы, состоящей из галогена, C1-4алкила и необязательно защищенного гидроксила, причем по меньшей мере три из них (t, u, v и w) представляют указанную метиновую группу.
37. Соединение по п.1, представляющее собой транс-3-оксо-N-(5-фенил-2-пиримидинил)спиро[4-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид.
38. Соединение по п.1, представляющее собой транс-N-[5-(2-метилфенил)-2-пиримидинил]-3-оксоспиро[5-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид.
39. Соединение по п.1, представляющее собой транс-3-оксо-N-(5-фенил-2-пиримидинил)спиро[6-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид.
40. Соединение по п.1, представляющее собой транс-3-оксо-N-(1-фенил-4-пиразолил)спиро[7-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид.
41. Соединение по п.1, представляющее собой транс-N-[1-(3-фторфенил)-4-пиразолил]-3-оксоспиро[4-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид.
42. Соединение по п.1, представляющее собой транс-N-[1-(2-фторфенил)-3-пиразолил]-3-оксоспиро[6-азаизобензофуран-1(3H),1'-циклогексан]-4'-карбоксамид.
Текст
1 Область изобретения Настоящее изобретение применимо в медицинских областях. Более подробно, новые спиросоединения данного изобретения полезны в качестве антагонистов рецепторов нейропептида Y и агентов для лечения сердечнососудистых нарушений разных типов, нарушений центральной нервной системы, нарушений обмена веществ и подобного. Предпосылки изобретения Нейропептид Y (здесь далее обозначенNPY), пептид, состоящий из 36 аминокислот,впервые был выделен из мозга свиньи Tatemoto и др. в 1982 [Nature, 296: 659 (1982)]. NPY широко распространен в центральной нервной системе и периферической нервной системе и играет различные роли как один из наиболее распространенных пептидов в нервной системе. А именно, NPY действует в центральной нервной системе как вещество, возбуждающее аппетит, и заметно способствует накоплению жиров посредничеством секреции различных гормонов или действия нервной системы. Известно, что длительное интрацеребровентрикулярное введение NPY вызывает ожирение и невосприимчивость к инсулину (инсулинорезистентность),основанные на данных действиях (InternationalNPY обладает центральным действием на такие состояния, как депрессия, тревога, шизофрения,боль, слабоумие и подобные (Drugs, vol.52, 371(1996. Кроме того, на периферии NPY сосуществует с норэпинефрином в симпатическом окончании и вовлекается в тонус симпатической нервной системы. Известно, что периферическое введение NPY вызывает сужение кровеносных сосудов и усиливает действие других сосудосуживающих веществ, таких как норэпинефрин (British Journal of Pharmacology, vol.95: 419 (1988. Сообщается также, что NPY может участвовать в развитии сердечной гипертрофии в результате симпатической стимуляции (Proceeding National Academic Science USA, vol.97,1595 (2000. С другой стороны, сообщается, что NPY вовлекается также в секреторную функцию половых гормонов и гормона роста, сексуальное поведение и репродуктивную функцию, желудочно-кишечную двигательную функцию,бронхоконстрикция, воспаление и злоупотребление спиртным (Life Science, vol.55, 551 (1994);NPY имеет разнообразные фармакологические эффекты в результате связывания NPY сNPY-рецепторами. Другие родственные NPY пептиды, включая пептид YY и панкреатический полипептид, также связывают NPYрецепторы. Известно, что такие фармакологические эффекты опосредованы действием, по меньшей мере, пяти подтипов рецепторов при 2 синергических взаимодействиях или без оныхY1: Сообщается, что центральный эффект,опосредованный NPY Y1-рецептором, включает значительное возбуждение аппетита (Endocrinology, vol.137, 3177 (1996); Endocrinology,vol.141, 1011 (2000. Еще сообщается, что Y1 рецептор вовлекается в чувство тревоги и боли(Nature, vol.259, 528 (1993); Brain Research, vol. 859, 361 (2000. Кроме того, сообщается также,что прессорные эффекты, опосредованные сильным сосудосуживающим действием NPY на периферии, опосредованы Yl (FEBS Letters, vol. 362, 192 (1995); Nature Medicine, vol.4, 722(1998. Y2: Известно, что ингибирующее действие на высвобождение различных нейротрансмиттеров в симпатических нервных окончаниях опосредовано NPY Y2-рецепторомNPY вызывает сужение кровяных сосудов или семявыносящего протока напрямую или через регуляцию высвобождения различных нейротрансмиттеров (The Journal of Pharmacology(1992); British Journal of Pharmacology, vol.100,190 (1990. Кроме того, известно ингибирование липолиза в жировых тканях (Endocrinology,vol.131, 1970 (1992. Еще сообщается об ингибировании секреции ионов в желудочнокишечном тракте (British Journal of Pharmacology, vol.101, 247 (1990. С другой стороны, сообщается об ингибирующем действии на функции центральной нервной системы, такие как память и тревогаY3: Сообщается, что NPY Y3-рецепторы расположены, главным образом, в стволе мозга и в сердце и имеют отношение к регуляции кровяного давления и частоты сердечных сокращений (The Journal of Pharmacology and Experimental Therapeutics, vol.258, 633 (1991); Peptides,vol.11, 545 (1990. Кроме того, известно, чтоY3-рецептор вовлекается в регуляцию секреции катехоламинов в надпочечниках (The Journal ofY4: NPY Y4-рецептор обладает высоким сродством к панкреатическому полипептиду. Сообщается что аналогичные фармакологические эффекты, опосредованные Y4-рецептором,включают ингибирование секреции поджелудочной железы и моторики желудочнокишечного тракта (Gastroenterology, vol.85, 1411(1983. Кроме того, сообщается, что NPY усиливает секрецию полового гормона в центральной нервной системе (Endocrinology, vol.140,5171 (1999.Y5: Эффект, опосредованный NPY Y5 рецептором, включает стимуляцию питания и(1999. Сообщается, что NPY Y5-рецептор опосредует также некоторые эффекты CNS, такие как припадок и эпилепсия, или боль и симптомы отмены морфина (Natural Medicine, vol.3, 761Experimental Therapeutics, vol.284, 633 (1998. Сообщается, что на периферии Y5-рецептор вовлечен в диурез и гипогликемический эффект,вызванный NPY (British Journal of Pharmacology,vol.120, 1335 (1998); Endocrinology, vol.139,3018 (1998. Сообщается также, что NPY увеличивает сердечную гипертрофию в результате преобладания симпатической составляющей(Proceeding National Academic Science USA,vol.97, 1595 (2000. Эффекты NPY происходят (проявляются) при связывании NPY-рецепторов в центральной и периферической нервных системах. Таким образом, действие NPY можно предотвратить путем блокирования связыванияNPYрецепторов. Вещества, противодействующие связыванию NPY с NPY-рецепторами, могут быть полезны для профилактики или лечения различных заболеваний, связанных с NPY, таких как сердечно-сосудистые нарушения (например, гипертензия, нефропатия, болезнь сердца, вазоспазм), нарушения центральной нервной системы (например, булемия, депрессия, тревога, припадок, эпилепсия, слабоумие,боль, алкоголизм, синдром отмены наркотика),нарушения обмена веществ (например, ожирение, диабет, гормональные нарушения), сексуальная и репродуктивная дисфункция, нарушение желудочно-кишечной моторики, респираторные заболевания, воспаление или глаукома,и подобных (Trends in Pharmacological Sciences,15: 153 (1994); Life Science, 55, 551 (1994);USA, vol.97, 1595 (2000. Согласно исследованиям авторов настоящего изобретения недавно было обнаружено,что некоторые типы антагонистов NPYрецепторов полезны для профилактики или лечения гиперхолестеринемии, гиперлипидемии и артериосклероза [публикация международной заявки W099/27965]. Описание изобретения Целью настоящего изобретения является предоставление новых лекарственных средств,которые демонстрируют NPY-антагонистические активности. Заявители настоящего изобретения обнаружили, что соединения общей формулы (I) где Аr1 представляет арил или гетероарил,который может быть замещен, причем заместитель выбран из группы, включающей галоген,нитрогруппу, низший алкил, галоген (низший) алкил, гидрокси(низший)алкил, цикло(низший) алкил, низший алкенил, низший алкокси, галоген(низший)алкокси, низший алкилтио, карбоксил, низший алканоил, низший алкоксикарбонил, низший алкилен, необязательно замещенный оксогруппой, и группу, представленную формулой -Q-Ar2; где Аr2 представляет арил или гетероарил,который может быть замещен, причем заместитель выбран из группы, включающей галоген,цианогруппу, низший алкил, галоген(низший) алкил, гидрокси(низший)алкил, гидроксил,низший алкокси, галоген(низший)алкокси, низший алкиламино, ди(низший алкил)амино, низший алканоил и арил;Q представляет простую связь или карбонил; Т, U, V и W независимо представляют атом азота или метиновую группу, которая может иметь заместитель, выбранный из группы,состоящей из галогена, низшего алкила, гидроксила и низшей алкоксигруппы, причем, по меньшей мере, два из них (Т, U, W и V) представляют указанную метиновую группу; Х представляет метиновую группу или азот;Y представляет иминогруппу, которая может быть замещена низшим алкилом, или кислород; демонстрируют NPY-антагонистическую активность и полезны в качестве терапевтических агентов для лечения различных заболеваний, связанных с NPY, что и составляет настоящее изобретение. Соединения (I) настоящего изобретения полезны в качестве агентов для лечения различных заболеваний, связанных с NPY, например,сердечно-сосудистых нарушений (например,гипертензии, нефропатии, болезни сердца, вазоспазма, артериосклероза), нарушений центральной нервной системы (например, булемии,депрессии, тревоги, припадка, эпилепсии, слабоумия, боли, алкоголизма, синдрома отмены наркотика), нарушений обмена веществ (например, ожирения, диабета, гормонального нарушения, гиперхолестеринемии, гиперлипидемии), сексуальной и репродуктивной дисфункции, желудочно-кишечных нарушений, респи 5 раторных заболеваний, воспаления, глаукомы и подобных. Более конкретно, соединения общей формулы (I) полезны в качестве агентов для лечения булемии, ожирения, диабета и подобных состояний. Настоящее изобретение касается соединений общей формулы (I), их солей или эфиров,способа их получения и применения. В другом варианте настоящее изобретение касается промежуточного продукта получения соединения общей формулы (I). Конкретно, оно касается соединения, представленного общей формулой (VI-1): где t, u, v и w независимо представляют атом азота или метиновую группу, которая может иметь заместитель, выбранный из группы, состоящей из галогена, низшего алкила, низшей алкоксигруппы и необязательно защищенного гидроксила, причем, по меньшей мере, два из них (t, u, v и w) представляют указанную метиновую группу. Далее определены значения использованных в настоящем описании терминов и представлено более подробное описание данного изобретения. Термин атом галогена относится к атому фтора, атому хлора, атому брома и атому йода. Термин низший алкил относится к линейной или разветвленной алкильной группе C1C6, такой как метил, этил, пропил, изопропил,бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, гексил, изогексил и подобные. Термин галоген(низший)алкил относится к указанному выше низшему алкилу, замещенному 1, 2 или более 2, предпочтительно 1-3 указанными выше атомами галогенов, одинаковыми или разными в поддающихся замещению произвольных положениях, такому как фторметил, дифторметил, трифторметил, 2-фторэтил,1,2-дифторэтил, хлорметил, 2-хлорэтил, 1,2 дихлорэтил, бромметил, йодметил и подобные. Термин гидрокси(низший)алкил относится к указанному выше низшему алкилу, замещенному 1, 2 или более 2 гидроксигруппами,предпочтительно 1 или 2 в поддающихся замещению произвольных положениях, такому как гидроксиметил, 2-гидроксиэтил, 1-гидрокси-1 метилэтил, 1,2-дигидроксиэтил, 3-гидроксипропил и подобные. Термин цикло(низший)алкил относится к циклоалкильной группе С 3-С 6, такой как циклопропил, циклобутил, циклопентил, циклогексил и подобные. 6 Термин низший алкенил относится к линейной или разветвленной алкенильной группеC2-C6, такой как винил, 1-пропенил, 2-пропенил,изопропенил, 3-бутенил, 2-бутенил, 1-бутенил,1-метил-2-пропенил, 1-метил-1-пропенил, 1 этил-1-этенил, 2-метил-2-пропенил, 2-метил-1 пропенил, 3-метил-2-бутенил, 4-пентенил и подобные. Термин низший алкокси относится к линейной или разветвленной алкоксигруппе C1-С 6,например метокси, этокси, пропокси, изопропокси, бутокси, втор-бутокси, изобутокси, третбутокси, пентилокси, изопентилокси, гексилокси, изогексилокси и подобным. Термин галоген(низший)алкокси относится к указанной выше низшей алкоксигруппе,замещенной 1, 2 или более 2 атомами галогенов из указанных выше, предпочтительно 1-3, одинаковыми или разными в поддающихся замещению произвольных положениях, например,фторметокси, дифторметокси, трифторметокси,2-фторэтокси, 1,2-дифторэтокси, хлорметокси,2-хлорэтокси, 1,2-дихлорэтокси, бромметокси,йодметокси и подобным. Термин низший алкилтио относится к линейной или разветвленной алкилтиогруппеC1-C6, например метилтио, этилтио, пропилтио,изопропилтио, бутилтио, втор-бутилтио, изобутилтио, трет-бутилтио, пентилтио, изопентилтио, гексилтио, изогексилтио и подобным. Термин низший алканоил относится к алканоильной группе, содержащей указанный выше низший алкил, то есть алканоильной группе C2-C7, такой как ацетил, пропионил, бутирил, изобутирил, валерил, изовалерил, пивалоил и подобные. Термин низший алкоксикарбонил относится к алкоксикарбонильной группе, содержащей указанный выше низший алкокси, то есть алкоксикарбонильной группе С 2-С 7, такой как метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил, бутоксикарбонил, изобутоксикарбонил, трет-бутоксикарбонил, пентилоксикарбонил и подобные. Выражение низший алкилен, необязательно замещенный оксогруппой относится к линейной или разветвленной алкиленовой группе С 2-С 6, которая может быть замещена в поддающихся замещению произвольных положениях, 1, 2 или более 2, предпочтительно 1 оксогруппой, такой как этилен, триметилен, тетраметилен, пентаметилен, гексаметилен, 1-оксоэтилен, 1-оксотриметилен, 2-оксотриметилен, 1 оксотетраметилен, 2-оксотетраметилен и подобные. Термин арил включает фенил, нафтил и подобные. Термин гетероарил относится к 5- или 6 членной моноциклической гетероароматической группе, которая содержит 1, 2 или более 2,предпочтительно 1-3 гетероатомов, одинаковых или разных, выбранных из группы, состоящей 7 из атома кислорода, атома азота и атома серы; или конденсированной гидроароматической группе, где указанная выше моноциклическая гетероароматическая группа конденсирована с указанной выше арильной группой или с идентичной или отличающейся указанной выше моноциклической гетероароматической группой,такой как пирролил, фурил, тиенил, имидазолил, пиразолил, тиазолил, изотиазолил, оксазолил, изоксазолил, 1,2,3-триазолил, 1,2,4-триазолил, тетразолил, оксадиазолил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,3,4-тиадиазолил,пиридил, пиразинил, пиримидинил, пиридазинил, 1,2,4-триазинил, 1,3,5-триазинил, индолил,бензофуранил, бензотиенил, бензимидазолил,бензоксазолил, бензизоксазолил, бензотиазолил,бензизотиазолил, индазолил, пуринил, хинолил,изохинолил, фталазил, нафтилидинил, хиноксалинил, хиназолинил, циннолинил, птеридинил,пиридо[3,2-b]пиридил и подобные. Термин низший алкиламино относится к аминогруппе, монозамещенной указанным выше низшим алкилом, такой как метиламино,этиламино, пропиламино, изопропиламино, бутиламино, втор-бутиламино, трет-бутиламиногруппу и подобные. Термин ди(низший алкил)амино относится к аминогруппе, дизамещенной указанными выше одинаковыми или разными низшими алкилами, такой как диметиламино, диэтиламино, этилметиламино, дипропиламино, метилпропиламино, диизопропиламиногруппу и подобные. Соли соединений формулы (I) относятся к фармацевтически приемлемым обычным солям,например, основно-аддитивным солям по карбоксильной группе, если соединение имеет карбоксильную группу, или кислотно-аддитивным солям по аминогруппе или основному гетероциклическому радикалу, если соединение имеет аминогруппу или основную гетероциклическую группу, и подобным. Указанные выше основно-аддитивные соли включают соли со щелочными металлами(например,натрием,калием); щелочноземельными металлами (например, кальцием,магнием); аммиаком или органическими аминами (например, триметиламином, триэтиламином, дициклогексиламином, этаноламином, диэтаноламином, триэтаноламином, прокаином,N,N'-дибензилэтилендиамином) и подобные. Указанные выше кислотно-аддитивные соли включают соли с неорганическими кислотами (например, соляной, серной, азотной, фосфорной, перхлорной); органическими кислотами(например, малеиновой, фумаровой, винной,лимонной, аскорбиновой, трифторуксусной); сульфоновыми кислотами (например, метансульфоновой, изэтионовой, бензолсульфоновой,пара-толуолсульфоновой) и подобные. Сложные эфиры соединений формулы (I) представляют, например, фармацевтически при 004507 8 емлемые обычные сложные эфиры по карбоксильной группе, если соединение имеет карбоксильную группу, например, сложные эфиры с низшими алкилами (например, метилом, этилом, пропилом, изопропилом, бутилом, вторбутилом, трет-бутилом, пентилом, изопентилом,неопентилом, циклопропилом, циклобутилом,циклопентилом), аралкилами (например, бензилом, фенетилом), низшими алкенилами (например, аллилом, 2-бутенилом), низший алкокси(низшими)алкилами (например, метоксиметилом, 2-метоксиэтилом, 2-этоксиэтилом), низший алканоилокси(низшими)алкилами(например,ацетоксиметилом, пивалоилоксиметилом, 1-пивалоилоксиэтилом), низший алкоксикарбонил(низшими)алкилами (например, метоксикарбонилметилом, изопропоксикарбонилметилом),карбокси(низшими)алкилами (например, карбоксиметилом), низший алкоксикарбонилокси(низшими)алкилами (например, 1-(этоксикарбонилокси)этилом, 1-(циклогексилоксикарбонилокси)этилом), карбамоилокси(низшими)алкилами (например, карбамоилоксиметилом),фталидилом, (5-замещенным-2-оксо-1,3-диоксол-4-ил)метилом (например, (5-метил-2-оксо 1,3-диоксол-4-ил)метилом) и подобные. Выражение агент для лечения относится к лекарственному средству, которое применяют для лечения и/или профилактики различных заболеваний. Для более подробного раскрытия указанных выше соединений общей формулы (I) в предпочтительных вариантах более подробно объяснены используемые в формуле (I) обозначения. Аr1 представляет арил или гетероарил, который может быть замещен, причем заместитель выбран из группы, включающей галоген,нитрогруппу, низший алкил, галоген(низший) алкил, гидрокси(низший)алкил, цикло(низший) алкил, низший алкенил, низший алкокси, галоген(низший)алкокси, низший алкилтио, карбоксил, низший алканоил, низший алкоксикарбонил, низший алкилен, необязательно замещенный оксогруппой, и группу, представленную формулой -Q-Ar2. Выражение арил или гетероарил, который может быть замещен, причем заместитель выбран из группы, включающей галоген, нитрогруппу, низший аркил, галоген(низший)алкил,гидрокси(низший)алкил, цикло(низший)алкил,низший алкенил, низший алкокси, галоген(низший)алкокси, низший алкилтио, карбоксил, низший алканоил, низший алкоксикарбонил, низший алкилен, необязательно замещенный оксогруппой, и группу, представленную формулой -Q-Ar2, относится к указанному выше незамещенному арилу или гетероарилу или указанному выше арилу или гетероарилу, который имеет заместитель (заместители) в поддающемся замещению произвольном положении (положениях). Указанные выше заместите 9 ли могут быть одинаковыми или разными, один,два или более 2, предпочтительно 1 или 2, выбранными из группы, включающей галоген,нитрогруппу, низший алкил, галоген(низший) алкил, гидрокси(низший)алкил, цикло(низший) алкил, низший алкенил, низший алкокси, галоген(низший)алкокси, низший алкилтио, карбоксил, низший алканоил, низший алкоксикарбонил, низший алкилен, необязательно замещенный оксогруппой, и группу формулы -Q-Ar2. Атом галогена в качестве указанного выше заместителя предпочтительно включает атом фтора, атом хлора и подобные. Низший алкил в качестве указанного выше заместителя предпочтительно включает метил,этил, пропил, изопропил и подобные. Галоген(низший)алкил в качестве указанного выше заместителя предпочтительно включает дифторметил, трифторметил и подобные. Гидрокси(низший)алкил в качестве указанного выше заместителя предпочтительно включает гидроксиметил, 2-гидроксиэтил, 1 гидрокси-1-метилэтил и подобные. Цикло(низший)алкил в качестве указанного выше заместителя предпочтительно включает циклопропил, циклобутил и подобные. Низший алкенил в качестве указанного выше заместителя предпочтительно включает винил, 1-пропенил, 2-метил-1-пропенил и подобные. Низший алкокси в качестве указанного выше заместителя предпочтительно включает метокси-, этоксигруппу и подобные. Галоген(низший)алкокси в качестве указанного выше заместителя предпочтительно включает фторметокси-, дифторметокси-, трифторметоксигруппу и подобные. Низший алкилтио в качестве указанного выше заместителя предпочтительно включает метилтио-, этилтиогруппу и подобные. Низший алканоил в качестве указанного выше заместителя предпочтительно включает ацетил, пропионил и подобные. Низший алкоксикарбонил в качестве указанного выше заместителя предпочтительно включает метоксикарбонил, этоксикарбонил и подобные. Низший алкилен, необязательно замещенный оксогруппой, в качестве указанного выше заместителя предпочтительно включает 1 оксотетраметилен и подобные. В группе формулы -Q-Ar2 в качестве указанного выше заместителя Аr2 относится к арилу или гетероарилу, который может быть замещен, причем заместитель выбран из группы,включающей галоген, цианогруппу, низший алкил, галоген(низший)алкил, гидрокси(низший)алкил, гидроксил, низший алкокси, галогенQ представляет простую связь или карбонил. 10 Выражение арил или гетероарил, который может быть замещен, причем заместитель выбран из группы, включающей галоген, цианогруппу, низший алкил, галоген(низший)алкил,гидрокси(низший)алкил, гидроксил, низший алкокси, галогеннизший)алкокси, низший алкиламино, ди(низший алкил)амино, низший алканоил и арил относится к указанному выше незамещенному арилу или гетероарилу или указанному выше арилу или гетероарилу, который имеет заместитель(заместители) в поддающемся замещению произвольном положении (положениях). Указанные выше заместители могут быть одинаковыми или разными, один или не менее 2, предпочтительно 1 или 2, выбранными из группы, включающей галоген, цианогруппу,низший алкил, галоген(низший)алкил, гидрокси(низший)алкил, гидроксил, низший алкокси,галоген(низший)алкокси, низший алкиламино,ди(низший алкил)амино, низший алканоил и арил. Атом галогена в качестве указанного выше заместителя предпочтительно включает атом фтора, атом хлора и подобные. Низший алкил в качестве указанного выше заместителя предпочтительно включает метил,этил, пропил, изопропил и подобные. Галоген(низший)алкил в качестве указанного выше заместителя предпочтительно включает дифторметил, трифторметил и подобные. Гидрокси(низший)алкил в качестве указанного выше заместителя предпочтительно включает гидроксиметил, 2-гидроксиэтил, 1 гидрокси-1-метилэтил и подобные. Низший алкокси в качестве указанного выше заместителя предпочтительно включает метокси-, этоксигруппу и подобные. Галоген(низший)алкокси в качестве указанного выше заместителя предпочтительно включает фторметокси-, дифторметокси-, трифторметоксигруппу и подобные. Низший алкиламино в качестве указанного выше заместителя предпочтительно включает метиламино-, этиламиногруппу и подобные. Ди(низший алкил)амино в качестве указанного выше заместителя предпочтительно включает диметиламино-, диэтиламиногруппу и подобные. Низший алканоил в качестве указанного выше заместителя предпочтительно включает ацетил, пропионил и подобные. Арил в качестве указанного выше заместителя предпочтительно включает фенил и подобные. Заместитель(заместители) Аr2 предпочтительно включает галоген, цианогруппу, низший алкил, галоген(низший)алкил, гидрокси(низший)алкил, гидроксил, галоген(низший)алкокси и подобные. Арил в Аr2 предпочтительно включает фенил и подобные, и гетероарил включает имида 11 золил, пиридил, бензофуранил, хинолил и подобные. Следовательно, группа формулы -Q-Ar2 включает, например, фенил, 2-фторфенил, 3 фторфенил, 4-фторфенил, 2,3-дифторфенил, 2,4 дифторфенил, 3,5-дифторфенил, 2-хлорфенил,3-хлорфенил, 4-хлорфенил, 2-цианфенил, 3-цианфенил, 4-цианфенил, 2-метилфенил, 3-метилфенил, 4-метилфенил, 2-фтор-5-метилфенил, 3 фторметилфенил, 2-трифторметилфенил, 3-трифторметилфенил, 4-трифторметилфенил, 2-метоксифенил, 3-метоксифенил, 4-метоксифенил,3-фтор-5-метоксифенил, 3-фторметоксифенил,3-дифторметоксифенил, 3-(2-гидроксиэтил)фенил, 3-гидроксиметилфенил, 3-(1-гидрокси-1 метилэтил)фенил, 3-гидроксифенил, 4-гидроксифенил, 2-имидазолил, 1-этил-2-имидазолил,1,2,4-тиадиазол-5-ил, 1,3,4-тиадиазол-2-ил, 2-пиридил, 3-пиридил, 4-пиридил, 2-этил-4-пиридил,4-пиримидинил, 5-пиримидинил, 4-бензо[b]фуранил, 5-бензо[b]фуранил, 7-бензо[b]фуранил,2-хинолил, 3-хинолил, 4-хинолил, 5-хинолил, 6 хинолил, 8-хинолил, бензоил, 2-пиридилкарбонил и подобные и предпочтительно фенил, 2 фторфенил, 3-фторфенил, 3,5-дифторфенил, 3 хлорфенил, 4-хлорфенил, 3-цианфенил, 3 трифторметилфенил, 3-дифторметоксифенил, 3(2-гидроксиэтил)фенил, 3-гидроксифенил, 4 гидроксифенил, 1-этил-2-имидазолил, 2-пиридил, 7-бензо[b]фуранил, 2-хинолил, 3-хинолил, бензоил, 2-пиридилкарбонил и подобные. Заместитель Аr1 предпочтительно включает галоген, низший алкил, галоген(низший) алкил, низший алкенил, низший алканоил, низший алкилен, необязательно замещенный оксогруппой, и группу формулы: -Q-Ar2 и подобные. Арил в Аr1 предпочтительно включает фенил и подобные, гетероарил в Аr1 включает пирролил, имидазолил, пиразолил, тиазолил,оксазолил, изоксазолил, 1,2,3-триазолил, 1,2,4 тиадиазолил, пиридил, пиразинил, пиримидинил, 1,2,4-триазинил, бензоксазолил, бензотиазолил, хинолил, пиридо[3,2-b]пиридил и подобные. Следовательно, Аr1 включает, например, 3 фторфенил, 4-фторфенил, 3,4-дифторфенил, 3 хлорфенил, 4-хлорфенил, 3,4-дихлорфенил, 4 ацетилфенил, 5-оксо-5,6,7,8-тетрагидро-2-нафтил, 4-ацетил-3-трифторметилфенил, 4-(1-этил 2-имидазолил)фенил, 3-(2-пиридил)фенил, 3-(4 пиридил)фенил, 4-(2-пиридил)фенил, 4-(3-пиридил)фенил, 4-(2-этил-4-пиридил)фенил, 4-(4 пиримидинил)-фенил, 4-бензоилфенил, 4-(2 пиридилкарбонил)фенил,1-фенил-3-пирролил,1-фенил-4-имидазолил, 1-(2-фторфенил)-4-имидазолил, 1-(3-фторфенил)-4-имидазолил, 1-(4 фторфенил)-4-имидазолил,1-(2,3-дифторфенил)-4-имидазолил, 1-(2,4-дифторфенил)-4-имидазолил, 1-(3,5-дифторфенил)-4-имидазолил, 1(3-хлорфенил)-4-имидазолил, 1-(2-цианофенил)4-имидазолил, 1-(3-цианофенил)-4-имидазолил,1-(4-цианофенил)-4-имидазолил, 1-(3-трифтор 004507n равно 0 или 1, предпочтительно 0. Т, U, V и W независимо представляют атом азота или метин, который может иметь заместитель, выбранный из группы, состоящей из галогена, низшего алкила, гидроксила и низшей алкоксигруппы, причем, по меньшей мере,два из них (Т, U, V и W) представляют указанный метин. Выражение метин, который может иметь заместитель, выбранный из группы, состоящей из галогена, низшего алкила, гидроксила и низшей алкоксигруппы относится к незамещенному метину или метину, имеющему заместитель,который может быть выбран из группы, состоящей из галогена, низшего алкила, гидроксила и низшей алкоксигруппы. Атом галогена в качестве указанного выше заместителя предпочтительно включает атом фтора, атом хлора и подобные. Низший алкил в качестве указанного выше заместителя предпочтительно включает метил,этил и подобные. Низший алкокси в качестве указанного выше заместителя предпочтительно включает метокси-, этоксигруппу и подобные. Указанный выше заместитель предпочтительно включает галоген и подобные. Предпочтительный вариант Т, U, V и W включает, например, Т, U, V и W, которые независимо представляют метин, необязательно имеющий указанный выше заместитель, предпочтительно галоген; или вариант, когда один из Т, U, V и W является атомом азота. Х представляет метин или азот.Y представляет иминогруппу, которая может быть замещена низшим алкилом, или кислород. Выражение иминогруппа, которая может быть замещена низшим алкилом относится к незамещенной иминогруппе или иминогруппе,замещенной низшим алкилом. Указанный выше низший алкил предпочтительно включает метил, этил и подобные.Y предпочтительно является незамещенной иминогруппой или кислородом, в особенности, кислородом. Более конкретно, группа формулы (15) включает группы формул (16) 16 более предпочтительны, например, соединения,в которых V представляет собой атом азота, а Т,U и W представляют собой незамещенную метиновую группу. Соединения данного изобретения могут включать стереоизомеры, такие как оптические изомеры, диастереоизомеры и геометрические изомеры или таутомеры в зависимости от варианта заместителей. Соединения данного изобретения включают все стереоизомеры, таутомеры и их смеси. Например, соединения общей формулы (Ib) включают стереоизомеры, такие как трансформа соединения общей формулы (I-1b) и подобные. Предпочтительными соединениями общей формулы (I) являются, например, соединения общей формулы (I-а): и цис-форма соединения общей формулы (I-2b) где R1 обозначает атом водорода или галоген,Аr1 имеет значение, указанное выше; или соединения общей формулы (I-b) где Аr1, Т, U, V и W имеют указанные выше значения. Что касается соединения, представленного общей формулой (I-а), предпочтительны, например, соединения, в которых арильная группа в Аr1 является фенилом, или гетероарильная группа в Аr1 является имидазолилом, пиразолилом, изоксазолилом, 1,2,4-тиадиазолилом, пиразинилом, пиримидинилом, хинолилом или пиридо[3,2-b]пиридилом. Что касается соединения, представленного общей формулой (I-b), предпочтительны, например, соединения, в которых арильная группа в Аr1 является фенилом, или гетероарильная группа в Аr1 является пирролилом, имидазолилом, пиразолилом, тиазолилом, оксазолилом,изоксазолилом,1,2,3-триазолилом,1,2,4 тиадиазолилом, пиридилом, пиразинилом, пиримидинилом или 1,2,4-триазолилом. Кроме того, что касается соединения,представленного общей формулой (I-b), предпочтительны, например, соединения, в которых Т, U, V и W представляют собой атом азота, и причем предпочтительна транс-форма. В объем данного изобретения включены также полиморфы, гидраты и сольваты соединений данного изобретения. Настоящее изобретение включает в свой объем пролекарства соединений данного изобретения. Вообще, такие пролекарства являются функциональными производными соединений данного изобретения, которые легко превращаются in vivo в требуемые соединения. Таким образом, в способах лечения настоящего изобретения выражение прием подразумевает лечение различных состояний, описанное с применением конкретного раскрытого соединения или соединения, которое конкретно не раскрыто, но превращается в описанное соединениеin vivo после введения пациенту. Обычные методики выбора и получения подходящих производных пролекарств описаны, например, в публикации Design of Prodrugs", ed. H. Bundgaard,Elsevier, 1985, которая включена здесь во всей своей полноте в виде ссылки. Метаболиты данных соединений включают активные разновидности, продуцируемые при введении соединений данного изобретения в биологические среды. Конкретными соединениями, представленными общей формулой (I), являются, например[6-азаизобензофуран-1(3 Н),1'-циклогексан]-4'карбоксамид,или транс-3-оксо-N-(2-фенил-1,2,3-триазол-4 ил)спиро[6-азаизобензофуран-1(3 Н),1'-циклогексан]-4'-карбоксамид. Среди данных соединений предпочтительными являются, например,3-оксо-N-(5-фенил-2-пиразинил)спиро[изобензофуран-1(3 Н),4'-пиперидин]-1'-карбоксамид,3-оксо-N-(7-трифторметилпиридо[3,2-b] пиридин-2-ил)спиро[изобензофуран-1(3 Н),4'пиперидин]-1'-карбоксамид,N-[5-(3-фторфенил)-2-пиримидинил]-3-оксоспиро[изобензофуран-1(3 Н),4'-пиперидин]-1'карбоксамид,транс-3'-оксо-N-(5-фенил-2-пиримидинил) спиро[циклогексан-1,1'(3'Н)-изобензофуран]-4 карбоксамид,транс-3'-оксо-N-[1-(3-хинолил)-4-имидазолил]спиро[циклогексан-1,1'(3'Н)-изобензофуран]-4-карбоксамид,транс-3-оксо-N-(5-фенил-2-пиразинил)спиро[4-азаизобензофуран-1(3 Н),1'-циклогексан]-4'карбоксамид,транс-N-[5-(3-фторфенил)-2-пиримидинил]-3-оксоспиро[5-азаизобензофуран-1(3 Н),1'циклогексан]-4'-карбоксамид,транс-N-[5-(2-фторфенил)-2-пиримидинил]-3-оксоспиро[5-азаизобензофуран-1(3 Н),1'циклогексан]-4'-карбоксамид,транс-N-[1-(3,5-дифторфенил)-4-имидазолил]-3-оксоспиро[7-азаизобензофуран-1(3 Н),1'циклогексан]-4'-карбоксамид,транс-3-оксо-N-(1-фенил-4-пиразолил)спиро[4-азаизобензофуран-1(3 Н),1'-циклогексан]-4'карбоксамид,транс-3-оксо-N-(1-фенил-3-пиразолил)спиро[6-азаизобензофуран-1(3 Н),1'-циклогексан]-4'карбоксамид или транс-3-оксо-N-(2-фенил-1,2,3-триазол-4 ил)спиро[6-азаизобензофуран-1(3 Н),1'-циклогексан]-4'-карбоксамид. Далее проиллюстрирован способ получения соединений данного изобретения. Соединения настоящего изобретения (I) можно синтезировать, например, используя способы получения или способы, показанные в примерах, но имеется в виду, что данные варианты не ограничивают способ получения соединений (I) настоящего изобретения. Способ получения 1. Соединение общей формулы (II) где Аr1p представляет арил или гетероарил, который может быть замещен, причем заместитель выбран из группы, включающей галоген, 23 нитрогруппу,низший алкил,галоген(низший)алкил, цикло(низший)алкил, низший алкенил,низший алкокси,галоген(низший)алкокси, низший алкилтио, низший алканоил, низший алкоксикарбонил, группу,представленную формулой -Qp-Аr2p и необязательно защищенный низший алкилен, необязательно замещенный оксогруппой, гидрокси(низшим)алкилом или карбоксильной группой; Аr2p представляет арил или гетероарил, который может быть замещен, причем заместитель выбран из группы, включающей галоген,цианогруппу, низший алкил, галоген(низший) алкил, низший алкокси, галоген(низший) алкокси, ди(низший алкил)амино, низший алканоил,арил и необязательно защищенный гидрокси(низший)алкил, гидроксил или низший алкиламино; Аr3 представляет фенил, который может быть замещен галогеном или нитрогруппой;Qp представляет простую связь или необязательно защищенный карбонил; подвергают взаимодействию с соединением общей формулы (III) где n, t, u, v, w и Y имеют такие же значения,как указано выше; получая соединение общей формулы (IV-1) где Ar1p, n, t, u, v, w и Y имеют такие же значения, как указано выше; с необязательным последующим удалением защитной группы и получением соединения общей формулы (I-1) где Аr1, n, Т, U, V, W и Y имеют такие же значения, как указано выше. Данный способ получения касается способа получения соединения общей формулы (I),где Х обозначает атом азота, то есть соединения общей формулы (I-1). Если реагент имеет аминогруппу, гидроксил, карбоксил, оксогруппу, карбонил или по 004507 24 добную группу, которая не участвует во взаимодействии, то реакцию можно проводить после защиты аминогруппы, гидроксила, карбоксила,оксогруппы, карбонила или подобной группы при помощи аминозащитной, гидроксизащитной, карбоксизащитной, оксо- или карбонилзащитной группы с последующим удалением защиты и завершением реакции. Аминозащитная группа включает аралкил (например, бензил, пара-метоксибензил, 3,4 диметоксибензил,орто-нитробензил,паранитробензил, бензгидрил, тритил); низший алканоил (например, формил, ацетил, пропионил,бутирил, пивалоил); бензоил; арилалканоил (например, фенилацетил, феноксиацетил); низший алкоксикарбонил (например, метоксикарбонил,этоксикарбонил, пропилоксикарбонил, третбутоксикарбонил); аралкилоксикарбонил (например, бензилоксикарбонил, паранитробензилоксикарбонил, фенетилоксикарбонил); низший алкилсилил (например, триметилсилид,трет-бутилдиметилсилил) и подобные, в особенности ацетил, пивалоил, бензоил, этоксикарбонил, трет-бутоксикарбонил и подобные. Гидроксизащитная группа включает низший алкил (например, метил, этил, пропил,изопропил, трет-бутил); низший алкилсилил(например, триметилсилил, трет-бутилдиметилсилил); низший алкоксиметил (например, метоксиметил, 2-метоксиэтоксиметил); тетрагидропиранил; триметилсилилэтоксиметил; аралкил (например, бензил, параметоксибензил, 2,3-диметоксибензил, ортонитробензил,пара-нитробензил, тритил); ацил (например,формил, ацетил) и подобные, в особенности,метил, метоксиметил, тетрагидропиранил, тритил,триметилсилилэтоксиметил,третбутилдиметилсилил, ацетил и подобные. Карбоксизащитная группа включает низший алкил (например, метил, этил, пропил,изопропил, трет-бутил); низший галогеналкил(например, 2-пропенил); аралкил (например,бензил, пара-метоксибензил, пара-нитробензил,бензгидрил, тритил) и подобные, в особенности,метил, этил, трет-бутил, 2-пропенил, бензил,пара-метоксибензил, бензгидрил и подобные. Оксо- и карбонилзащитные группы включают ацеталь или кеталь (например, этиленкеталь, триметиленкеталь, диметилкеталь) и подобные. Взаимодействие между соединением общей формулы (II) и соединением общей формулы (III) обычно проводят, используя количество от эквивалентного до молярного избытка, предпочтительно от эквивалента до 1,5 моль соединения (III) на 1 моль соединения (II). Обычно проводят взаимодействие в инертном растворителе и в качестве инертного растворителя предпочтительно используют, например, метиленхлорид, хлороформ, тетрагидрофу 25 ран, диметилформамид, диметилсульфоксид, их смесь и подобные. Указанное выше взаимодействие можно проводить в присутствии основания, включая органические основания (например, триэтиламин, диизопропилэтиламин, пиридин, 4-диметиламинопиридин) или неорганические основания (например, гидроксид натрия, гидроксид калия) и подобные. Количество используемого основания обычно составляет от эквивалентного до молярного избытка, предпочтительно 1-5 моль основания на 1 моль соединения общей формулы(II). Температура реакции обычно составляет от -30 до 200 С, предпочтительно от 20 до 100 С. Время реакции обычно составляет от 5 мин до 7 дней, предпочтительно от 30 мин до 24 ч. В завершение реакции сырой продукт соединения общей формулы (IV-1) можно получить посредством обычной обработки. Полученное таким образом соединение общей формулы (IV-1) очищают обычным способом или не очищают, если требуется последующая необязательная комбинация реакции по удалению амино-, гидрокси-, карбокси-, оксо и карбонилзащитной группы с получением соединения общей формулы (I-1). Удаление защитных групп в зависимости от типа указанных выше защитных групп, стабильности требуемого соединения (I-1) и т.п. можно проводить, например, описанным в литературе способом [Protective Groups in OrganicSynthesis, Т.W. Green, John WileySons (1981)] или аналогичным способом, например, сольволизом с использованием кислоты или основания, а именно, например, от 0,01 моль до большого избытка кислоты, предпочтительно трифторуксусной, муравьиной, соляной или подобной кислоты, или от эквивалента до большого избытка основания, предпочтительно гидроксида калия, гидроксида кальция или подобного; химическим восстановлением с использованием комплексного гидрида металла или подобного; или каталитическим восстановлением с использованием катализатора: палладия на угле, никеля Ренея или подобного. Способ получения 2. Соединение общей формулы (V) Аr1p-NН 2(V) 1p где Аr имеет такое же значение, как указано выше; подвергают взаимодействию с получением карбоновой кислоты общей формулы (VI) 26 где n, t, u, v, w и Y имеют такие же значения,как указано выше; или его реакционноспособным производным, получая соединение общей формулы (IV2) где Ar1p, n, t, u, v, w и Y имеют такие же значения, как указанно выше; с необязательным последующим удалением защитной группы и получением соединения общей формулы (I-2): где Аr1, n, Т, U, V, W и Y имеют такие же значения, как указано выше. Данный способ получения касается способа получения соединения общей формулы (I),где Х обозначает метин, то есть соединения общей формулы (I-2). Взаимодействие между соединением общей формулы (V) и карбоновой кислотой общей формулы (VI) обычно проводят, используя от 0,5 моль до молярного избытка, предпочтительно от 1 моль до 1,5 моль карбоновой кислоты(VI) на 1 моль соединения (V). Обычно проводят взаимодействие в инертном растворителе, и предпочтительные примеры инертных растворителей включают метиленхлорид, хлороформ, тетрагидрофуран, диметилформамид, пиридин, их смесь и подобные. Указанное выше взаимодействие предпочтительно проводят в присутствии конденсирующих агентов, например, N,N'-дициклогексилкарбодиимида, N,N'-диизопропилкарбодиимида,1-(3-диметиламинопропил)-3-этилкарбодиимида,1-(3-диметиламинопропил)-3 этилкарбодиимид гидрохлорида, бензотриазол 1-илокси-трис-(диметиламино)фосфоний гексафторфосфата,бензотриазол-1-илокси-триспирролидинофосфоний гексафторфосфата,бром-трис-(диметиламино)фосфоний гексафторфосфата, дифенилфосфорилазида, 1,1'-карбонилдиимидазола или подобных. Обычно используют от 1 моль до молярного избытка, предпочтительно от 1 до 1,5 моль указанного конденсирующего агента на 1 моль соединения (VI). 27 Температура реакции обычно составляет от -50 до 100 С, предпочтительно от -20 до 50 С. Время реакции обычно составляет от 30 мин до 7 дней, предпочтительно от 1 до 24 ч. Соединение формулы (I-2) получают также путем взаимодействия соединения общей формулы (V) с реакционноспособным производным карбоновой кислоты (VI) вместо карбоновой кислоты (VI). Реакционноспособные производные карбоновой кислоты общей формулы (VI) включают галогенангидриды кислот, смешанные галогенангидриды кислот, активированные сложные эфиры, активированные амиды и подобные. Галогенангидриды карбоновой кислоты общей формулы (VI) можно получить обычным способом путем взаимодействия карбоновой кислоты общей формулы (VI) с агентом галогенирования. Агент галогенирования включает тионилхлорид, трихлорид фосфора,пентахлорид фосфора, оксихлорид фосфора,трибромид фосфора, оксалилхлорид, фосген и подобные. Смешанные галогенангидриды карбоновой кислоты общей формулы (VI) можно получить обычным способом путем взаимодействия карбоновой кислоты общей формулы (VI) с алкилхлоркарбонатом (например, этилхлоркарбонатом); хлорангидридом алифатической карбоновой кислоты (например, пивалоилхлоридом) и подобным. Активированные эфиры карбоновой кислоты общей формулы (VI) можно получить обычным способом путем взаимодействия карбоновой кислоты общей формулы (VI) с N-гидрокси-соединением (например, N-гидроксисукцинимидом, N-гидроксифталимидом, 1-гидроксибензотриазолом); фенольным соединением(например,N,N'-дициклогексилкарбодиимида, 1-(3-диметиламинопропил)-3-этилкарбодиимида). Активированные амиды карбоновой кислоты общей формулы (VI) можно получить обычным способом путем взаимодействия карбоновой кислоты общей формулы (VI), например, с 1,1'-карбонилдиимидазолом, 1,1'-карбонилбис(2-метилимидазолом) или подобным. Взаимодействие между соединением общей формулы (V) и реакционноспособным производным карбоновой кислоты общей формулы (VI), обычно проводят, используя от 0,5 моль до молярного избытка, предпочтительно от 1 до 1,5 моль реакционноспособного производного карбоновой кислоты (VI) на 1 моль соединения (V). Обычно проводят взаимодействие в инертном растворителе, и предпочтительные примеры инертных растворителей включают 28 метиленхлорид, хлороформ, тетрагидрофуран,диметилформамид, пиридин, их смесь и подобные. Указанное взаимодействие протекает в отсутствие оснований, но предпочтительно проводить взаимодействие в присутствии оснований,что способствует спокойному протеканию реакции. Указанные выше основания включают органические основания (например, триэтиламин,диизопрoпилэтиламин, пиридин, 4-диметиламинопиридин) или неорганические основания (например, гидроксид натрия, гидроксид калия,карбонат натрия, карбонат калия, гидрокарбонат натрия) и подобные. Предпочтительно использовать от 1 моль до молярного избытка указанного выше основания на 1 моль соединения общей формулы (V). Если указанное основание представляет собой жидкость, то его также можно использовать в качестве растворителя. Температура реакции обычно составляет от -50 до 100 С, предпочтительно от -20 до 50 С. Время реакции обычно составляет от 5 мин до 7 дней, предпочтительно от 30 мин до 24 ч. Соединение общей формулы (I-2) можно получить обычной обработкой реакционной смеси в завершение реакции после удаления защиты, если продукт имеет защитную группу, или обычной обработкой непосредственно смеси, если защитная группа отсутствует. Удаление защитных групп, последующую обработку и подобное можно проводить способом, описанным выше в способе получения 1. Соединения общей формулы (I-1) или (I-2) можно легко выделить и очистить обычными способами разделения, например, экстракцией растворителем, перекристаллизацией, колоночной хроматографией, тонкослойной хроматографии и/или подобными. Данные соединения можно обычными способами перевести в фармацевтически приемлемые соли или сложные эфиры, с другой стороны, обычными способами можно провести превращение солей или сложных эфиров в свободные соединения. Соединения общей формулы (II), (III), (V) или (VI) являются коммерчески доступными или их получают описанными в литературе способами [Japanese Patent Unexamined Publication94/263737-A, патент США 3301857, J. Org.Chem., 40:1427 (1975), международная патентная заявка WO95/28389 или др.], или аналогичными способами, или способами, представленными ниже или в примерах, необязательно в комбинации. где L1 обозначает галоген; Аr1p и Аr3 имеют такие же значения, что даны выше. Данный способ касается способа получения соединения общей формулы (II). Согласно данному способу соединение (II) получают, подвергая соединение общей формулы (V) взаимодействию с соединением общей формулы 1. Взаимодействие между соединением общей формулы (V) и соединением 1 обычно проводят, используя от 0,5 моль до молярного избытка, предпочтительно от эквивалента до 1,5 моль соединения 1 на 1 моль соединения (V). Обычно проводят взаимодействие в инертном растворителе, и предпочтительные примеры инертных растворителей включают метиленхлорид, хлороформ, тетрагидрофуран, этиловый эфир, бензол, толуол, диметилформамид их смесь и подобные. Предпочтительно проводить взаимодействие в присутствии оснований. Указанные основания включают органические основания (например, триэтиламин, диизопропилэтиламин,пиридин, 4-диметиламинопиридин) или неорганические основания (например, гидроксид натрия, гидроксид калия, карбонат натрия, карбонат калия, гидрокарбонат натрия) и подобные. Предпочтительно использовать от эквивалента до молярного избытка указанного основания на 1 моль соединения (V). Если указанное основание представляет собой жидкость, то его можно также использовать в качестве растворителя. Температура реакции обычно составляет от -78 до 100 С, предпочтительно от -20 до 50 С. Время реакции обычно составляет от 5 мин до 7 дней, предпочтительно от 30 мин до 24 ч. Соединения формулы 1 являются коммерчески доступными или их получают обычным способом, способами, описанными в примерах,или подобными, необязательно в комбинации.R10 представляет водород, нитрогруппу,низший алкил или низший алкокси; L1, t, u, v и w имеют такие же значения, как даны выше. Данный способ касается способа получения соединений общей формулы (III-1). Соединение (III-1) получают настоящим способом, где соединение общей формулы 2 подвергают конденсации с дегидрированием с соединением общей формулы 3, получая соединение общей формулы 4, которое подвергают взаимодействию с соединением общей формулы 5 в присутствии основания,получая соединение общей формулы 6, и далее соединение 6 циклизуют внутримолекулярной реакцией Хека, получая соединение общей формулы 7, а затем соединение 7 подвергают восстановлению необязательно с последующим удалением аминозащитной группы Р 1. Аминозащитная группа Р 1 включает аминозащитные группы, описанные ранее в способе получения 1. Стадию получения соединения 4 посредством конденсации с дегидрированием соединения 2 с соединением 3 обычно проводят в инертном растворителе, например,бензоле, толуоле или подобном. Предпочтительна температура реакции от комнатной до температуры кипения используемого растворителя, а время реакции предпочтительно составляет от 30 мин до 24 ч. Стадию получения соединения 6 из соединения 4 обычно проводят в инертном растворителе (например, бензоле, толуоле, метиленхлориде, хлороформе, ацетонитриле,диметилформамиде) в присутствии основания (например, триэтиламина, диизопропилэтиламина, пиридина, 4-диметиламинопиридина). Температура реакции предпочтительно составляет от 0 С до температуры кипения используемого растворителя, а время реак 31 ции предпочтительно составляет от 30 мин до 24 ч. На стадии получения соединения 7 из соединения 6 можно использовать так называемую реакцию Хека, хорошо известную в области органической химии. Указанную стадию обычно проводят в инертном растворителе (например, бензоле,толуоле, тетрагидрофуране, ацетонитриле,диметилформамиде, N-метилпирролидоне) в присутствии палладиевого катализатора (например,ацетата палладия,хлорида палладия), фосфинового лиганда (например,трифенилфосфина,три-2-фурилфосфина),основания (например, карбоната калия, триэтиламина) и необязательно добавок (например, тетраэтиламмоний хлорида). Предпочтительна температура реакции от комнатной до температуры кипения используемого в реакции растворителя, а время реакции предпочтительно составляет от 30 мин до 24 ч. В качестве способа восстановления на стадии получения соединения (III-1) из соединения 7 предпочтительно, например, каталитическое восстановление. Каталитическое восстановление обычно проводят в инертном растворителе (например, метаноле, этаноле, метиленхлориде,хлороформе, тетрагидрофуране, диметилформамиде, уксусной кислоте) в присутствии катализатора, такого как палладий на угле при давлении водорода от 1 до 50 атмосфер. Предпочтительна температура реакции от комнатной до температуры кипения используемого в реакции растворителя, а время реакции предпочтительно составляет от 30 мин до 24 ч. В завершение реакции, если продукт реакции имеет защитную группу, соединение(III-1) можно получить посредством удаления защитной группы. Удаление защитной группы можно проводить способом, описанным выше в способе получения 1. Данную стадию можно проводить, удаляя защитную группу соединения 7 с последующим восстановлением полученного соединения. Соединения общей формулы 2, 3 или 5 являются коммерчески доступными или их можно получить обычным способом, способами, представленными в примерах, или подобными им, необязательно в комбинации. где L1 представляет водород или галоген;Y1 представляет кислород или иминогруппу, замещенную низшим алкилом или арилом;t, u, v и w имеют такие же значения, как указано выше. Данный способ получения касается способа получения соединения общей формулы (VI1). Соединение, представленное общей формулой (V-1), является новым соединением, которое не раскрыто в литературе. Данное соединение можно получить, используя настоящий способ получения, а именно, соединение общей формулы 8 подвергают лидированию, взаимодействию с соединением 9 и лактонизации кислотой с последующим декеталированием с получением соединения общей формулы 10; и 1) в соединение 10 вводят метиленовую группу, а затем проводят гидроборирование, получая соединение общей формулы 11, и данное соединение подвергают окислению, или 2) соединение 10 восстанавливают, получая соединение общей формулы 12, в которое вводят уходящую группу, а затем подвергают цианированию, получая соединение общей формулы 13, с последующим гидролизом соединения 13 по цианогруппе. Литирование на стадии получения соединения 10 из соединения 8 обычно проводят, позволяя органическому литиевому реагенту (например, н-бутиллитию, литий 2,2,6,6-тетраметилпиперидиду) воздействовать на сoединение 8 в инертном растворителе (например, тетрагидрофуране, диэтиловом эфире). Температура реакции обычно составляет от -120 до 0 С, предпочтительно от -100 до-50 С, а время реакции предпочтительно составляет от 1 до 4 ч. Взаимодействие между полученным соединением лития и кетоном общей формулы 9 обычно проводят в инертном растворителе (например, тетрагидрофуране, диэтилoвом эфире). Температура реакции предпочтительно составляет от -100 С до комнатной температуры, а время реакции предпочтительно составляет от 10 мин до 2 ч. Полученное соединение можно подвергнуть лактонизации при обработке кислотой (например, соляной кислотой, серной кислотой). Температура реакции предпочтительно составляет от 0 С до температуры кипения используемого растворителя, а время реакции предпочтительно составляет от 30 мин до 8 ч. Соединение 10 можно получить, подвергая полученное соединение лактонового типа декетализации обычным способом. Температура реакции предпочтительно составляет от 50 С до температуры кипения используемого растворителя, а время реакции предпочтительно составляет от 1 до 24 ч. На стадии получения соединения 11 из соединения 10 можно применять способ, используемый для превращения оксогруппы в гидроксиметильную группу, который хорошо известен в области органической химии, и данную стадию обычно проводят при взаимодействии соединения 10, например, с метилентрифенилфосфораном, вводя метиленовую группу, с последующим гидроборированием в инертном растворителе (например, бензоле, толуоле, метиленхлориде, хлороформе, ацетонитриле, тетрагидрофуране, диметилформамиде). На обeих стадиях введения метиленовой группы и гидроборирования температура реакции предпочтительно составляет от 0 С до температуры кипения используемого растворителя,а время реакции предпочтительно составляет от 30 мин до 8 ч. На стадии получения соединения (VI-1) из соединения 11 можно применять способ, используемый для окисления гидроксиметильной группы до карбоксильной группы, который хорошо известен в области органической химии, и данную стадию обычно проводят, используя окислительный агент, такой как периодат натрия, и каталитическое количество хлорида рутения в инертном растворителе (например, бензоле, толуоле, метиленхлориде, хлороформе,ацетонитриле, диметилформамиде). Температура реакции предпочтительно составляет от 0 С до температуры кипения используемого растворителя, а время реакции предпочтительно составляет от 30 мин до 8 ч. На стадии получения соединения 12 из соединения 10 можно применять способ, используемый для восстановления оксогруппы до гидроксильной группы, который хорошо известен в области органической химии, и данную стадию обычно прово 004507 34 дят, используя восстановительный агент (например,боргидрид натрия, боргидрид лития) в инертном растворителе (например, воде, метаноле, этаноле,тетрагидрофуране или их смеси). Температура реакции предпочтительно составляет от -20 до 50 С, а время реакции предпочтительно составляет от 10 мин до 4 ч. На стадии получения соединения 13 из соединения 12 можно применять способ, используемый для превращения гидроксигруппы в цианогруппу, который хорошо известен в области органической химии, и данную стадию обычно проводят, при взаимодействии соединения 12, например, с метансульфонилхлоридом,пара-толуолсульфонилхлоридом или подобным с превращением гидроксигруппы в уходящую группу в присутствии основания (например,триэтиламина, пиридина) с последующим взаимодействием полученного соединения с цианидом (например, цианидом натрия, цианидом калия, тетраэтиламмоний цианидом, тетрабутиламмоний цианидом). Данную стадию превращения гидроксигруппы в уходящую группу обычно проводят в инертном растворителе (например, метиленхлориде,хлороформе, этилацетате, ацетонитриле, тетрагидрофуране, диметилформамиде). Температура реакции предпочтительно составляет от-20 С до комнатной температуры, а время реакции предпочтительно составляет от 10 мин до 8 ч. Стадию взаимодействия с цианидом обычно проводят в инертном растворителе (например, тетрагидрофуране, диоксане, диметилформамиде, N-метилпирролидоне, диметилсульфоксиде). Температура реакции предпочтительно составляет от 50 до 120 С, а время реакции предпочтительно составляет от 2 до 24 ч. На стадии получения соединения (VI-1) можно проводить гидролиз цианогруппы, который хорошо известен в области органической химии, а именно гидролиз цианогруппы соединения 13, и данную стадию обычно проводят, используя кислоту (например, соляную кислоту, серную кислоту) или основание (например, гидроксид натрия, гидроксид калия, гидроксид кальция) в растворителе(например, метаноле, этаноле, тетрагидрофуране,диоксане, воде или их смеси). Температура реакции предпочтительно составляет от 50 С до температуры кипения используемого растворителя, а время реакции предпочтительно составляет от 1 до 48 ч. Соединения общей формулы (VI-1) имеют два типа стереоизомеров, представленных общими формулами (VI-1-a) и (VI-1-b) 35 где t, u, v и w имеют такие же значения, как указано выше. Данные стереоизомеры можно выделить из смеси общеизвестным способом, таким как хроматография, фракционированная перекристаллизация и подобные. Соединения общей формулы (VI-1-a) или(VI-1-b) можно получить, используя промежуточный продукт, который получают путем разделения стереоизомеров соединения общей формулы 11, 12 или 13. Соединения общей формулы 8 или 9 коммерчески доступны или их получают, используя обычный способ, способы, описанные в примерах или подобные способы, необязательно в комбинации. Применимость соединений настоящего изобретения в качестве лекарственных средств обеспечена описанием NPY-антагонистической активности, например, в следующих фармакологических тестах. Фармакологический тест 1 (исследование ингибирования NPY-связывания). Последовательность кДНК, кодирующуюInvitrogen Inc.) и pCI-neo (получен Promega Inc.). Полученные вектора экспрессии трансфицируют в клетки-хозяева COS-7, CHO и LM(tk-) (AmericanType Culture Collection) способом с использованием катионных липидов [разработан в National(BSA при 25 С в течение 2 ч, затем фильтруют через стеклянный фильтр GF/C и промывают 5 мМ Трис-буфером (рН 7,4), содержащим 0,3%BSA. Измеряют радиоактивность осадка на стеклянном фильтре. Неспецифическое связывание измеряют в присутствии 1 мкМ пептидаYY и определяют концентрацию исследуемого соединения, вызывающую 50% ингибирование(IC50) специфического связывания пептида YY Как показано выше, соединения данного изобретения эффективно ингибируют связывание пептида YY (гомолог NPY) с NPY Y5 рецепторами. Фармакологический тест 2 (aнтагонистическое действие на bРР-индуцированное поведение при кормлении). Направляющую канюлю (внешний диаметр 0,8 мм, внутренний диаметр 0,5 мм, длина 10 мм) вводят стереотаксически в правый латеральный желудочек головного мозга самцов крыс SD (возраст 7-8 недель, 200-300 г) под наркозом из пентобарбитала (одно внутрибрюшинное введение 50 мг/кг) и фиксируют стоматологической смолой. Верхний конец канюли располагают на 0,9 мм выше брегмы, на 1,2 мм правее средней линии и на глубину 1,5 мм от поверхности головного мозга, таким образом,чтобы при введении в направляющую канюлю инъекционной иглы она выступала на 2 мм над верхним краем направляющей канюли и достигала латерального желудочка головного мозга. Примерно через 1 неделю восстановительного периода в латеральный желудочек головного мозга вводят бычий панкреатический полипептид (bРР, 5 мкг/10 мкл/голова, 0,01 М, рН 7,4 фосфатный буферный физиологический раствор, содержащий 0,05% бычий сывороточный альбумин). Исследуемое соединение, суспендированное в водной 0,5% метилцеллюлозе, вводят перорально за 2 ч до введения bРР и определяют потребление пищи через 2 ч после введения bРР. Соединения данного изобретения существенно ингибируют увеличение потребления пищи, вызванное bРР (гомолог NPY), введенный в латеральный желудочек головного мозга. Соединения общей формулы (I) можно принимать перорально или парентерально и можно готовить в виде подходящего для приема препарата, обеспечивая агент для лечения различных заболеваний, связанных с NPY, которые включают, например, сердечно-сосудистые нарушения (например, гипертензия, нефропатия,болезнь сердца, вазоспазм, артериосклероз),нарушения центральной нервной системы (например, булемия, депрессия, тревога, припадок,эпилепсия, слабоумие, боль, алкоголизм, синдром отмены наркотика), нарушения обмена веществ (например, ожирение, диабет, гормональные нарушения, гиперхолестеринемия, гиперлипидемия), сексуальную и репродуктивную дисфункции, нарушение желудочно-кишечной моторики, респираторные заболевания, воспаление или глаукому и подобные, предпочтительно булемию, ожирение, диабет и подобные. 37 При клиническом использовании соединения данного изобретения можно вводить после составления подходящего препарата вместе с фармацевтически приемлемыми добавками в соответствии со способом приема. В качестве указанных добавок можно использовать добавки, обычно применяемые в приготовлении фармацевтических препаратов, например, желатин,лактозу, сахарозу, оксид титана, крахмал, кристаллическую целлюлозу, гидроксипропилметилцеллюлозу, карбоксиметилцеллюлозу, кукурузный крахмал, микрокристаллический воск,вазелин, метасиликат алюминат магния, безводный фосфат кальция, лимонную кислоту, цитрат натрия, гидроксипропилцеллюлозу, сорбит,сложный эфир сорбита и жирной кислоты, полисорбат, сложный эфир сахарозы и жирной кислоты, полиоксиэтилен, гидрированное касторовое масло, поливинилпирролидон, стеарат магния, легкий кремниевый ангидрид, тальк,растительное масло, бензиловый спирт, гуммиарабик, пропиленгликоль, полиалкиленгликоль,циклодекстрин или гидроксипропилциклодекстрин. Смесь с указанными добавками можно приготовить в виде твердых препаратов (например, таблетки, капсулы, гранулы, порошки, суппозитории) или жидких препаратов (например,сиропы, эликсиры, препараты для инъекций). Такие препараты можно готовить по методикам,хорошо известным в области получения фармацевтических препаратов. Жидкие препараты могут быть в виде препаратов, которые при применении растворяют или суспендируют в воде или других подходящих средах, и, главным образом, препараты для инъекций можно растворять или суспендировать в физиологическом растворе или, если необходимо, в растворе глюкозы, необязательно вместе с буфером и консервантом. Такие препараты могут содержать от 0,1 до 100 мас.%, предпочтительно от 1,0 до 60 мас.% соединений данного изобретения, а также могут содержать другие терапевтически эффективные соединения. Соединения настоящего изобретения можно использовать в комбинации с другими агентами, полезными для лечения нарушений обмена веществ и/или питания. Индивидуальные компоненты таких комбинаций можно принимать отдельно в разное время в течение курса терапии или вместе в виде отдельных или единых комбинированных форм. Таким образом,следует понимать, что данное изобретение включает все подобные схемы одновременного или поочередного лечения и соответственно следует интерпретировать термин прием. Следует также понимать, что область комбинаций соединений данного изобретения с другими агентами, полезными для лечения нарушений обмена веществ и/или питания, в принципе включает любую комбинацию с любой фарма 004507 38 цевтической композицией, полезной для лечения нарушений обмена веществ и/или питания. Если соединения данного изобретения используют клинически, дозу и частоту приема можно варьировать в зависимости от пола, возраста, веса тела, степени симптомов и типа и диапазона требуемых терапевтических эффектов. Дневная доза для взрослого составляет 0,01-100 мг/кг, предпочтительно 0,03-3 мг/кг перорально, или 0,001-10 мг/кг, предпочтительно 0,001-0,1 мг/кг парентерально, предпочтительно единой дозой или разделив на несколько доз. Обычный специалист - лечащий врач, ветеринар или клиницист - может легко определить и назначать эффективное количество лекарства, необходимое для профилактики, противодействия или подавления развития болезненного состояния. Наилучший способ осуществления изобретения Следующие примеры приведена для более конкретной иллюстрации настоящего изобретения, но никоим образом не предназначены для его ограничения. Если не отмечено иначе, температуры плавления определены с использованием MP-S3Model (производства Yanagimoto Seisakusho) и раскрыты в данном описании без корректировок. Пример 1. Получение N-(4-бензоилфенил)3-оксоспиро[изоиндолин-1,4'-пиперидин]-1'-карбоксамида.(1) Получение N-бензил-N-(1-трет-бутоксикарбонил-1,2,3,6-тетрагидропиридин-4-ил)-2 йодбензамида. Смесь N-трет-бутоксикарбонил-4-пиперидона (1,11 г) и бензиламина (597 мг), растворенную в толуоле (20 мл), перемешивают при 100 С в течение 3 ч и затем концентрируют. Добавляют к остатку толуол (30 мл), ортойодбензоилхлорид (1,13 г) и триэтиламин (0,70 г) и смесь перемешивают при 80 С в течение 2 ч. Реакционную смесь выливают в воду и экстрагируют этилацетатом. Этилацетатный слой сушат над безводным Na2SO4 и концентрируют. Остаток очищают способом колоночной хроматографии на силикагеле (гексан/этилацетат от 4/1 до 1/2), получая указанное соединение (2,44 г).N-бензил-N-(1-трет-бутоксикарбонил 1,2,3,6-тетрагидропиридин-4-ил)-2-йодбензамиду (2,4 г), растворенному в ацетонитриле, добавляют ацетат палладия (80 мг), трифенилфосфин (187 мг), безводный K2 СО 3 (987 мг) и тетраэтиламмонийхлорид (591 мг) и перемешивают при 80 С в течение 6 ч. Реакционную смесь выливают в воду и экстрагируют этилацетатом. Этилацетатный слой сушат над безводнымNa2SO4 и концентрируют. Остаток очищают способом колоночной хроматографии на сили 39 кагеле (гексан/этилацетат от 4/1 до 1/2), получая указанное соединение (1,64 г).(20 мл) и смесь перемешивают 1 ч. Реакционную смесь концентрируют. Остаток растворяют в метаноле и гидрируют смесью 4 М хлористый водород/этилацетат в присутствии 20% палладия на угле при давлении водорода 1 атм в течение 14 ч. Катализатор удаляют фильтрованием и фильтрат концентрируют. К остатку добавляют водный 1 н гидроксид натрия (5 мл), дитрет-бутилдикарбонат (655 мг) и диоксан (10 мл) и смесь перемешивают при комнатной температуре в течение 4 ч. Реакционную смесь выливают в воду и экстрагируют этилацетатом. Органический слой сушат над безводнымNа 2SО 4 и концентрируют. Остаток очищают способом колоночной хроматографии на силикагеле (гексан/этилацетат от 4/1 до 1/2), получая указанное соединение (200 мг).(200 мг) добавляют к металлическому натрию (235 мг) в жидком аммиаке (10 мл) и смесь перемешивают 30 мин. К реакционной смеси добавляют метанол, нейтрализованный насыщенным водным раствором хлорида аммония и экстрагируют этилацетатом. Органический слой сушат над безводным Na2SО 4 и концентрируют. Остаток растворяют в метаноле и перемешивают со смесью 4 М хлористый водород/этилацетат при 50 С в течение 1 ч. Реакционный раствор концентрируют, получая указанное соединение(5) Получение фенил N-(4-бензоилфенил)карбамата. К 4-аминобензофенону (1,97 г), растворенному в пиридине (50 мл), добавляют фенилхлоркарбонат (1,38 г) при 0 С и смесь перемешивают при комнатной температуре 1 ч. Реакционную смесь выливают в воду и экстрагируют этилацетатом. Органический слой сушат над безводным Na2SO4 и выпаривают. Остаток очищают способом колоночной хроматографии на силикагеле (гексан/этилацетат от 4/1 до 1/2),получая указанное соединение (3,1 г). 40 Смесь спиро[1H-изоиндол-1,4'-пиперидин]-3(2 Н)-он гидрохлорида (48 мг), триэтиламина (0,14 мл) и фенил N-(4-бензоилфенил)карбамата (58 мг) перемешивают в хлороформе при 80 С в течение 2 ч. Реакционную смесь выливают в воду и экстрагируют хлороформом. Органический слой сушат над безводным Na2SO4 и концентрируют. Остаток очищают способом колоночной хроматографии на силикагеле (гексан/этилацетат от 4/1 до 1/2) и кристаллизуют из смеси этиловый эфир-гексан,получая указанное соединение (49 мг) в виде бесцветных кристаллов (температура плавления 253 С). Соединения примеров 2 и 3 получают аналогично способу примера 1-(6), заменяя фенилN-(4-бензоилфенил)карбамат, используемый в примере 1-(6), на соответствующие вещества. Пример 2. 3-Оксо-N-(5-фенил-2-пиразинил)спиро[изоиндолин-1,4'-пиперидин]-1'-карбоксамид. Температура плавления 286-287 С. Пример 3. N-(7-метил-2-хинолил)-3-оксоспиро[изоиндолин-1,4'-пиперидин]-1'-карбоксамид. Температура плавления 194-196 С. Пример 4. Получение N-(4-бензоилфенил)2-метил-3-оксоспиро[изоиндолин-1,4'-пиперидин]-1'-карбоксамид. Указанное соединение получают аналогично способу примера 1-(6), заменяя спиро[1Hизоиндол-1,4'-пиперидин]-3(2 Н)-он гидрохлорид на 2-метилспиро[1 Н-изоиндол-1,4'-пиперидин]-3(2 Н)-он гидрохлорид. Температура плавления 154-156 С. Пример 5. Получение N-(4-бензоилфенил)3,4-дигидро-3-оксоспиро[изохинолин-1(2 Н),4'пиперидин]-1'-карбоксамида. Спиро[изохинолин-1(2 Н),4'-пиперидин]3(4 Н)-он гидрохлорид (30 мг) и фенил N-(4 бензоилфенил)карбамат (37 мг) растворяют в диметилсульфоксиде (2 мл) и перемешивают вместе с водным 10 н гидроксидом натрия (12 мкл) при комнатной температуре в течение 30 мин. Реакционную смесь выливают в воду и экстрагируют этилацетатом (20 мл). Органический слой промывают водой (20 мл) и насыщенным солевым раствором (20 мл), затем сушат над безводным Na2SО 4 и концентрируют. Остаток очищают способом колоночной хроматографии на силикагеле (гексан/этилацетат от 4/1 до 1/2) и перекристаллизовывают из смеси хлороформ-ацетон (1:3), получая указанное соединение (81 мг) в виде бесцветных кристаллов(температура плавления 241-243 С). Соединения примеров 6-21 получают аналогично способу примера 1-(6) или примера 5,используя спиро[изохинолин-1(2 Н),4'-пиперидин]-3(4 Н)-он гидрохлорид и производные фенил карбамата, соответствующие требуемый соединениям. 42 Пример 21. N-(5-хлор-2-бензоксазолил)3,4-дигидро-3-оксоспиро[изохинолин-1(2 Н),4'пиперидин]-1'-карбоксамид. Температура плавления 256-258 С. Пример 22. Получение N-(4-бензоилфенил)-3-оксоспиро[изобензофуран-1(3 Н),4'-пиперидин]-1'-карбоксамид. Смесь спиро[изобензофуран-1(3 Н),4'-пиперидин]-3-он гидрохлорида (48 мг), фенил N-(4 бензоилфенил)карбамата (58 мг) и триэтиламина (0,14 мл) в хлороформе (5 мл) перемешивают при 80 С в течение 2 ч. Реакционную смесь выливают в воду и экстрагируют хлороформом (20 мл). Органический слой промывают насыщенным солевым раствором (20 мл), затем сушат над безводным Na2SО 4 и концентрируют. Остаток очищают способом колоночной хроматографии на силикагеле (гексан/этилацетат от 4/1 до 1/2) и перекристаллизовывают из смеси этиловый эфир-гексан, получая указанное соединение (81 мг) в виде бесцветных кристаллов (температура плавления 161-163 С). Пример 23. Получение 3-оксо-N-(5-фенил 2-пиразинил)спиро[изобензофуран-1(3 Н),4'-пиперидин]-1'-карбоксамид.(17,12 г) в пиридине (200 мл). Смесь перемешивают при комнатной температуре 2 ч. К реакционной смеси добавляют воду (200 мл) и этиловый эфир (200 мл). Все перемешивают, получая суспензию, содержащую указанное соединение в виде кристаллов. Кристаллы собирают фильтрованием и промывают этиловым эфиром (50 мл), затем сушат при пониженном давлении, получая указанное соединение (24,57 г) в виде бесцветных кристаллов (температура плавления 192-198 С,разлагается).(2) Получение 3-оксо-N-(5-фенил-2-пиразинил)спиро[изобензофуран-1(3 Н),4'-пиперидин]-1'-карбоксамида (кристаллическая форма А). Смесь спиро[изобензофуран-1(3 Н),4'-пиперидин]-3-он гидрохлорида (6,24 г, 26,6 ммоль),фенил N-(5-фенил-2-пиразинил)карбамата (7,59 г, 26,0 ммоль) и триэтиламина (18 мл, 180 ммоль) в хлороформе (200 мл) перемешивают при 80 С в течение 3 ч. Реакционную смесь промывают насыщенным водным раствором бикарбоната натрия (100 мл). Затем органический слой промывают 10% водным раствором лимонной кислоты (100 мл), 1 н водным гидроксидом натрия (100 мл) и далее насыщенным солевым раствором (100 мл), органический слой сушат над безводным Na2SO4 и концентрируют. Остаток очищают способом колоночной хроматографии на силикагеле (гексан/этилацетат= 1/2), получая указанное соединение в виде бесцветного твердого вещества. Данное твердое 43 вещество промывают диэтиловым эфиром (30 мл), получая указанное соединение (8,23 г) в виде сырых кристаллов. Кристаллы растворяют в горячем этилацетате (300 мл). После удаления примерно 100 мл этилацетата отгонкой начинает образовываться белая суспензия. На этой точке отгонку прекращают, смесь охлаждают и хранят при комнатной температуре 14 ч. Образовавшиеся бесцветные призмы собирают фильтрованием и промывают гептаном (20 мл). Полученные кристаллы сушат при 50 С в вакууме в течение 6 ч, получая указанное соединение (кристаллическая форма А) (5,17 г) в виде бесцветных призм (температура плавления 210211 С). Рентгеновская дифракция порошка Интенсивность, имп./с 2, градусы 8,160 4135 9,600 2607 11,680 1372 14,620 194 15,320 1505 15,620 1321 15,880 2687 16,080 1711 16,420 3174 17,940 1036 19,100 6232 19,600 878 20,280 206 20,860 813 21,300 3360 22,020 328 22,740 1498 23,460 3782 23,820 549 24,420 1915 24,880 474 25,840 1329 26,360 515 28,480 433 29,260 248 30,860 692 32,140 246 34,300 112 39,160 163 Приведенные выше данные исследования рентгеновской дифракции порошка измерены на(3) Получение 3-оксо-N-(5-фенил-2-пиразинил)спиро[изобензофуран-1(3 Н),4'-пиперидин]-1'-карбоксамида (кристаллическая форма А) - альтернативный способ получения. Сырые кристаллы (2 г), полученные по описанной выше методике (2), растворяют при нагревании в тетрагидрофуране (20 мл). Убедившись в полном растворении, охлаждают смесь до комнатной температуры, оставляя стоять при комнатной температуре. К тетрагидрофурановому раствору добавляют по капле гептан (27 мл) с последующим перемешиванием при комнатной температуре в течение 15 ч. Полученные бесцветные кристаллы собирают фильтрованием, промывают гептаном (5 мл) и сушат в вакууме при 30 С в течение 15 ч, получая указанное выше соединение в кристаллической форме А (1,82 г).(4) Получение 3-оксо-N-(5-фенил-2-пиразинил)спиро[изобензофуран-1(3 Н),4'-пиперидин]-1'-карбоксамида (кристаллическая форма В). Сырые кристаллы (2 г), полученные по описанной выше методике (2), растворяют при нагревании в диметилформамиде (6 мл). Убедившись в полном растворении, добавляют по капле воду (13 мл) при 80 С и полученную смесь охлаждают до комнатной температуры, с последующим перемешиванием в течение 15 ч. Полученные бесцветные кристаллы собирают фильтрованием при комнатной температуре,промывают гептаном (5 мл) и сушат в вакууме в течение 15 ч при комнатной температуре, получая 1,78 г указанного выше соединения в кристаллической форме В в виде бесцветных призм(температура плавления 208 С, измерена без корректировки при использовании Melting PointB-545, распространяемого Buchi Company). Рентгеновская дифракция порошка Интенсивность, имп./с 2, градусы 7,300 211 9,540 555 13,340 619 14,320 848 14,680 2435 15,620 7792 15,980 2307 16,400 6800 19,280 781 19,620 3137 19,920 1954 20,280 2234 20,900 4008 23,000 2311 24,060 3362 24,760 3598 Приведенные выше данные исследования рентгеновской дифракции порошка измерены в таких же условиях, как в примере 23(2).(5) Получение 3-оксо-N-(5-фенил-2-пиразинил)спиро[изобензофуран-1(3 Н),4'-пиперидин]1'-карбоксамида (кристаллическая форма С). Сырые кристаллы (2 г), полученные по описанной выше методике (2), растворяют при нагревании в тетрагидрофуране (20 мл). Убедившись в полном растворении, раствор охлаждают до -30 С. К тетрагидрофурановому раствору добавляют по капле гептан (30 мл) с последующим перемешиванием при -30 С в течение 1 ч. Полученные бесцветные кристаллы собирают фильтрованием, промывают гептаном (5 мл) и сушат в вакууме при комнатной температуре в течение 15 ч, получая 1,90 г указанного выше продукта (монотетрагидрофурановый сольват, кристаллическая форма С) в виде бесцветных мелких гранул. Рентгеновская дифракция порошка Интенсивность, имп./с 2, градусы 5,940 1209 7,680 7150 11,420 1480 13,180 2032 14,240 1859 14,840 623 15,460 2629 16,580 2244 16,800 4076 17,960 706 18,640 2479 20,340 296 21,260 699 21,680 839 22,220 642 23,040 2515 24,000 1355 25,220 467 26,500 850 27,160 840 27,640 1078 28,780 389 30,940 283 34,200 267 46 Приведенные выше данные исследования рентгеновской дифракции порошка измерены в таких же условиях, как в примере 23(2).D). Спиро[изобензофуран-1(3 Н),4'-пиперидин]-3-он гидрохлорид. (515 мг) и фенил N-(5 фенил-2-пиразинил)карбамат (583 мг) растворяют в диметилсульфоксиде (2,6 мл), а затем добавляют по капле диметилбензиламин (0,33 мл). Температуру полученной смеси повышают до 50 С и смесь перемешивают в течение 1 ч. Реакционную смесь охлаждают до комнатной температуры и добавляют по капле смешанный раствор ацетонитрил/вода (1:2) (7,8 мл). Когда добавлено 0,2 мл смешанного раствора, добавляют затравочный кристалл. Полученную смесь перемешивают при комнатной температуре в течение 6 ч. Полученные бесцветные кристаллы собирают фильтрованием, промывают смесью ацетонитрил/вода (1:1) и сушат в вакууме при комнатной температуре в течение 15 ч, получая указанное выше соединение (793 мг) в виде сырых бесцветных кристаллов. Сырые кристаллы(26 г), полученные повторением описанной выше методики, суспендируют в смеси воданасыщенный изопропилацетат (143 мл). В смесь вносят затравочный кристалл и перемешивают при комнатной температуре в течение 18 ч. Полученные кристаллы собирают фильтрованием,промывают изопропилацетатом (20 мл) и сушат в вакууме при 30 С в течение 15 ч, получая указанное выше соединение в кристаллической форме D (25,2 г) в виде бесцветных кристаллов(температура плавления 206 С, измерена без корректировки при использовании Melting PointB-545, распространяемого Buchi Company). Рентгеновская дифракция порошка Интенсивность, имп./с 2, градусы 9,680 337 10,260 1796 11,480 1921 11,800 2608 12,580 2119 13,160 5843 13,900 1413 15,440 4091 15,660 4780 16,520 1853 17,520 298 19,320 1748 20,220 4858 20,660 2115 21,020 1063 21,480 493 21,820 856 22,280 947 22,700 2126 23,140 13619 Приведенные выше данные исследования рентгеновской дифракции порошка измерены в таких же условиях, как в примере 23(2).(7) Получение 3-оксо-N-(5-фенил-2-пиразинил)спиро[изобензофуран-1(3 Н),4'-пиперидин]-1'-карбоксамида (кристаллическая форма В) - альтернативный способ получения. Сырые кристаллы (26 г), полученные по описанной выше методике (6), суспендируют в ацетонитриле (260 мл). В смесь вносят затравочный кристалл, полученный по описанной выше методике (4) и перемешивают при комнатной температуре в течение 24 ч. Полученные кристаллы собирают фильтрованием, промывают ацетонитрилом (50 мл) и сушат в вакууме при 30 С в течение 15 ч, получая указанный выше продукт в кристаллической форме В (25,5 г). Соединения примеров 24-39 получают аналогично способу примера 22, заменяя фенил 48 Пример 30. N-[5-(4-хлорфенил)-3-пиразолил]-3-оксоспиро[изобензофуран-1(3 Н),4'-пиперидин]-1'-карбоксамид. Температура плавления 255-258 С. Пример 31. 3-Оксо-N-[5-(3-хинолил)-3-пиразолил]спиро[изобензофуран-1(3 Н),4'-пиперидин]-1'-карбоксамид. Температура плавления 253-257 С. Пример 32. N-[5-(3-фторфенил)-2-пиримидинил]-3-оксоспиро[изобензофуран-1(3 Н),4'пиперидин]-1'-карбоксамид. Температура плавления 122-125 С. Рентгеновская дифракция порошка Интенсивность, имп./с 2, градусы 4,96 5335 9,94 2512 13,82 1020 14,56 555 14,64 565 14,94 1705 16,14 1067 16,66 2260 17,12 1668 17,60 1420 17,92 590 19,40 447 19,80 788 19,94 627 20,42 1057 21,00 963 21,80 1698 22,06 2397 22,36 1235 23,96 555 24,16 632 24,32 402 25,08 1603 25,38 538 26,82 647 27,06 1345 27,84 1073 28,80 465 28,86 493 29,42 752 30,30 1015 30,74 850 34,16 422 38,12 918 42,36 625 43,88 528 Приведенные выше данные исследования рентгеновской дифракции порошка измерены наN-(5-фенил-2-пиразинил)карбамата (73 мг) и триэтиламина (174 мкл) в хлороформе (5 мл) перемешивают при 80 С в течение 2 ч. Реакционную смесь выливают в воду и экстрагируют хлороформом (20 мл). Органический слой промывают насыщенным солевым раствором (20 мл), затем сушат над безводным Na2SO4 и концентрируют. Остаток очищают способом колоночной хроматографии на силикагеле (гексан/этилацетат от 4/1 до 1/2) и перекристаллизовывают из смеси этиловый эфир-гексан, получая указанное соединение (101 мг) в виде бесцветных кристаллов (температура плавления 222-224 С). Пример 41. Получение 6-фтор-3-оксо-N-(5 фенил-2-пиримидинил)спиро[изобензофуран 1(3 Н),4'-пиперидин]-1'-карбоксамид. 50 Указанное соединение получают аналогично способу примера 40, заменяя фенил N-(5 фенил-2-пиразинил)карбамат, используемый в примере 40, на фенил N-(5-фенил-2-пиримидинил)карбамат. Температура плавления 176-178 С. Пример 42. Получение 5-фтор-3-оксо-N-(5 фенил-2-пиразинил)спиро[изобензофуран 1(3 Н),4'-пиперидин]-1'-карбоксамида. Смесь 5-фторспиро[изобензофуран-1(3 Н),4'-пиперидин]-3-он гидрохлорида (64 мг), фенилN-(5-фенил-2-пиразинил)карбамата (73 мг) и триэтиламина (174 мкл) в хлороформе (5 мл) перемешивают при 80 С в течение 2 ч. Реакционную смесь выливают в воду и экстрагируют хлороформом (20 мл). Органический слой промывают насыщенным солевым раствором (20 мл), затем сушат над безводным Na2SO4 и концентрируют. Остаток очищают способом колоночной хроматографии на силикагеле (гексан/этилацетат от 4/1 до 1/2) и перекристаллизовывают из смеси этиловый эфир-гексан, получая указанное соединение (100 мг) в виде бесцветных кристаллов (температура плавления 236-238 С). Пример 43. Получение 5-фтор-3-оксо-N-(5 фенил-2-пиримидинил)спиро[изобензофуран 1(3 Н),4'-пиперидин]-1'-карбоксамида. Указанное соединение получают аналогично способу примера 42, заменяя фенил N-(5 фенил-2-пиразинил)карбамат, используемый в примере 42, на фенил N-(5-фенил-2-пиримидинил)карбамат. Температура плавления 255-257 С. Пример 44. Получение N-(4-бензоилфенил)-3,4-дигидро-3-оксоспиро[1 Н-2-бензопиран-1,4'-пиперидин]-1'-карбоксамида. Спиро[1H-2-бензопиран-1,4'-пиперидин]3(4 Н)-он гидрохлорид (50,6 мг) и фенил N-(4 бензоилфенил)карбамат (63,4 мг) суспендируют в диметилсульфоксиде (1,0 мл) и суспензию интенсивно перемешивают с 10 М водным гидроксидом натрия (30 мкл) в течение 5 мин. Реакционную смесь разбавляют водой и экстрагируют этилацетатом. Органический слой промывают насыщенным солевым раствором, затем сушат над безводным Na2SO4 и концентрируют. Остаток кристаллизуют из смеси метанолдиизопропиловый эфир, получая указанное соединение (68,0 мг) в виде бесцветных кристаллов (температура плавления 138-146 С). Соединения примеров 45 и 46 получают аналогично способу примера 44, заменяя фенил(1) Получение спиро[циклогексан 1,1'(3'Н)-изобензофуран]-3',4-диона. Раствор 2-бромбензойной кислоты (4,77 г) в безводном тетрагидрофуране (100 мл) охлаждают до -78 С в атмосфере азота, к нему добавляют по капле н-бутиллитий (1,53 М раствор в гексане, 31 мл), поддерживая внутреннюю температуру ниже -55 С. После перемешивания в течение 1 ч к смеси добавляют по капле раствор 1,4-циклогександион моноэтиленкеталя (5,18 г) в безводном тетрагидрофуране (10 мл), поддерживая внутреннюю температуру ниже -67 С. После повышения температуры до комнатной реакционный раствор распределяют между водой (150 мл) и гексаном (100 мл). Водный слой подкисляют концентрированной соляной кислотой и кипятят 2 ч с обратным холодильником вместе с ацетоном (10 мл). После охлаждения полученную таким образом смесь нейтрализуют карбонатом калия и экстрагируют этилацетатом. Органический слой промывают насыщенным солевым раствором, затем сушат над безводнымNa2SO4 и выпаривают. Остаток кристаллизуют из смеси этилацетат-гексан, получая указанное соединение (2,42 г).(2) Получение 4-метиленспиро[циклогексан-1,1'(3'Н)-изобензофуран]-3-она. Суспензию метилтрифенилфосфоний бромида (715 мг) в безводном тетрагидрофуране(7,0 мл) охлаждают до 0 С в атмосфере азота,добавляют к ней н-бутиллитий (1,53 М раствор в гексане, 1,3 мл), перемешивают при данной температуре 20 мин и затем охлаждают до-78 С. Добавляют к реакционной смеси раствор спиро[циклогексан-1,1'(3'Н)-изобензофуран]3',4-диона (216 мг) в безводном тетрагидрофуране (3 мл) и повышают температуру до 0 С. После перемешивания в течение 20 мин к полученной смеси добавляют водный хлорид аммония и полученный сырой продукт экстрагируют этилацетатом. Органический слой промывают насыщенным солевым раствором, затем сушат над безводным Na2SO4 и концентрируют. Остаток очищают способом колоночной хроматографии на силикагеле (гексан/этилацетат=4/1),получая указанное соединение (196 мг).[циклогексан-1,1'(3'Н)-изобензофуран]-3'-она. Раствор 4-метиленспиро[циклогексан 1,1'(3'Н)-изобензофуран]-3-она (196 мг) в безводном тетрагидрофуране (5,0 мл) охлаждают до 0 С, к нему добавляют комплекс борандиметилсульфоксид (2 М раствор в тетрагидрофуране, 690 мкл) и смесь перемешивают при данной температуре 1,5 ч, затем еще 20 мин вместе с 2 М водным гидроксидом натрия (5,0 мл) и 30% водным пероксидом водорода (5,0 мл). Реакционную смесь разбавляют водой, экс 004507 52 трагируют этилацетатом, промывают насыщенным солевым раствором, затем сушат над безводным Na2SO4 и выпаривают. Остаток очищают способом колоночной хроматографии на силикагеле (гексан/этилацетат=2/1), получая указанное соединение (190 мг) в виде диастереоизомеров.(612 мг) и н-гидрат хлорида рутения (III) (10 мг) и смесь перемешивают 30 мин. Данную реакционную смесь перемешивают вместе с 1 н соляной кислотой (2,0 мл) в течение 30 мин и распределяют между водой (50 мл) и этилацетатом(50 мл). Органический слой промывают насыщенным солевым раствором, сушат над безводным Na2SO4 и концентрируют. Остаток очищают способом колоночной хроматографии на силикагеле (хлороформ/метанол=100/1), получая указанное соединение (98,6 мг).(19,8 мг) и 1-(3 диметиламинопропил)-3-этилкарбодиимид гидрохлорид (57,5 мг) и смесь перемешивают при 50 С в течение 2 ч. Данную реакционную смесь распределяют между водой и этилацетатом. Органический слой промывают водным гидросульфатом калия, водным гидрокарбонатом натрия и насыщенные солевым раствором, а затем сушат над безводным Na2SO4 и выпаривают. Остаток перекристаллизовывают из смеси этилацетат-гексан, получая указанное соединение(31,2 мг) в виде бесцветных кристаллов (температура плавления 194 С). Соединения примеров 48-56 получают аналогично способу примера 47-(5), заменяя 4 аминобензофенон, используемый в примере 47(5), на соответствующие вещества. Пример 48. Транс-3'-оксо-N-(5-фенил-2 пиразинил)спиро[циклогексан-1,1'(3'Н)-изобензофуран]-4-карбоксамид. Температура плавления 223 С. Пример 49. Транс-3'-оксо-N-(1-фенил-4 имидазолил)спиро[циклогексан-1,1'(3'Н)-изобензофуран]-4-карбоксамид. Температура плавления 264 С. Пример 50. Транс-3'-оксо-N-(5-фенил-2 пиримидинил)спиро[циклогексан-1,1'(3'Н)-изобензофуран]-4-карбоксамид. Температура плавления 184 С.(9,53 г) в безводном тетрагидрофуране (400 мл) охлаждают до -78 С в атмосфере азота, к нему добавляют по капле н-бутиллитий (1,54 М раствор в гексане, 100 мл). После перемешивания в течение 1,5 ч при той же температуре к смеси добавляют по капле раствор 1,4-циклогександион моноэтиленкеталя (10,93 г) в безводном тетрагидрофуране (100 мл). После повышения температуры до комнатной реакционную смесь распределяют между водой (300 мл) и этиловым эфиром (100 мл). Водный слой подкисляют 2 н соляной кислотой, перемешивают 30 мин, нейтрализуют карбонатом калия и оставляют на ночь. Полученный осадок собирают фильтрованием и сушат, получая указанное соединение (6,84 г).(2) Получение спиро[4-азаизобензофуран 1(3 Н),1'-циклогексан]-3,4'-диона. Смесь диспиро[4-азаизобензофуран-1(3 Н),1'-циклогексан-4',2"-1",3"-диоксолан]-3-она (6,8 г), 2 н соляной кислоты (20 мл) и ацетона (5 мл) нагревают при кипячении с обратным холодильником в течение 13 ч. После охлаждения смесь нейтрализуют карбонатом калия и перемешивают с изопропиловым эфиром (5 мл) в течение 3 ч. Полученный осадок собирают фильтрованием и сушат, получая указанное соединение (3,39 г). 54 Спиро[4-азаизобензофуран-1(3 Н),1'-циклогексан]-3,4'-дион (5,7 г) растворяют в тетрагидрофуране (50 мл) и воде (10 мл) и охлаждают до 0 С. Раствор перемешивают вместе с боргидридом натрия (993 мг) в течение 20 мин, подкисляют 10% серной кислотой, доводят рН до 7,4 насыщенным водным раствором гидрокарбоната натрия и экстрагируют смесью хлороформ-этанол и смесью хлороформтетрагидрофуран. Органический слой сушат над безводным Na2SO4 и концентрируют. Остаток кристаллизуют из смеси этилацетатизопропиловый эфир, получая указанное соединение (2,02 г).(2,02 г) в безводном тетрагидрофуране (60 мл) добавляют триэтиламин (3,08 мл) и охлаждают до 0 С. К смеси добавляют по капле метансульфонилхлорид (1,3 мл) и перемешивают при данной температуре 1 ч. Реакционную смесь разбавляют водой и экстрагируют хлороформом. Органический слой сушат над безводнымNa2SO4 и выпаривают. Остаток перекристаллизовывают из смеси этилацетат-изопропиловый эфир, получая мезилат (2,47 г). Полученный таким образом мезилат растворяют в диметилформамиде (25 мл) и перемешивают вместе с тетраметиламмонийцианидом (3,25 г) при 100 С в течение 3 ч. После охлаждения реакционную смесь разбавляют водой и экстрагируют этилацетатом. Органический слой промывают водой и насыщенным солевым раствором, сушат над безводным Na2SO4 и затем концентрируют. Остаток очищают способом колоночной хроматографии на силикагеле (гексан/этилацетат=2/3),получая указанное соединение (1,0 г).(1,0 г) в 30% серной кислоте нагревают при кипячении с обратным холодильником в течение 11 ч. После охлаждения реакционную смесь разбавляют водой и доводят рН до 6 карбонатом калия. Полученный осадок собирают фильтрованием, промывают водой и сушат на воздухе,получая указанное соединение (974 мг).(6) Получение транс-N-(4-бензоилфенил)3-оксоспиро[4-азаизобензофуран-1(3 Н),1'циклогексан]-4'-карбоксамида. К раствору транс-3-оксоспиро[4-азаизобензофуран-1(3 Н),1'-циклогексан]-4'-карбоновой кислоты (66 мг) в пиридине (1 мл) добавляют 4-аминобензофенон (52,6 мг) и 1-(3 диметиламинопропил)-3-этилкарбодиимид гидрохлорид (153 мг) и смесь перемешивают при 40 С в течение 2 ч. Данную реакционную смесь 55 концентрируют и остаток распределяют между водой и этилацетатом. Органический слой промывают насыщенным солевым раствором, сушат над безводным Na2SO4 и затем концентрируют. Остаток кристаллизуют из смеси этилацетат-гексан, получая указанное соединение (94,4 мг) в виде бесцветных кристаллов (температура плавления 237 С). Соединения примеров 58-60 получают аналогично способу примера 57-(6), заменяя 4 аминобензофенон, используемый в примере 57(6), на соответствующие вещества. Пример 58. Транс-3-оксо-N-(5-фенил-2 пиразинил)спиро[4-азаизобензофуран-1(3 Н),1'циклогексан]-4'-карбоксамид. Температура плавления 203 С. Пример 59. Транс-3-оксо-N-(3-фенил-5 изоксазолил)спиро[4-азаизобензофуран-1(3 Н),1'-циклогексан]-4'-карбоксамид. Температура плавления 217 С. Пример 60. Транс-3-оксо-N-(5-фенил-2-пиримидинил)спиро[4-азаизобензофуран-1(3 Н),1'циклогексан]-4'-карбоксамид. Температура плавления 237 С. Пример 61. Получение транс-N-(4-бензоилфенил)-3-оксоспиро[5-азаизобензофуран 1(3 Н),1'-циклогексан]-4'-карбоксамида.(1) Получение диспиро[5-азаизобензофуран-1(3 Н),1'-циклогексан-4',2"-1",3"-диоксолан]3-она. 2,2,6,6-Тетраметилпиперидин (41,1 мл) растворяют в безводном тетрагидрофуране (400 мл) охлаждают до -50 С, к нему последовательно добавляют н-бутиллитий (1,50 М раствор в гексане, 217 мл) и никотиновую кислоту (10,0 г). После перемешивания в течение 1 ч при-50 С в течение 1 ч. После повышения температуры до комнатной реакционную смесь выливают в воду (800 мл) и экстрагируют смесью гексан-эфир (1:1, 500 мл). Доводят рН водного слоя до 3 при помощи 6 н соляной кислоты и перемешивают при комнатной температуре в течение 2 ч. Полученный осадок собирают фильтрованием и промывают водой. Полученное таким образом твердое вещество растворяют в хлороформе (300 мл), промывают насыщенным водным раствором бикарбоната натрия(150 мл), сушат и затем концентрируют. Остаток перекристаллизовывают из смеси этилацетат-гексан, получая указанное соединение (4,29 г).(3,74 г) растворяют в ацетоне (80 мл) и воде (8 мл) и раствор нагревают при кипячении с обратным холодильником в течение 3 ч. После 56 охлаждения ацетон выпаривают и к остатку добавляют хлороформ (100 мл). Смесь промывают насыщенным водным раствором бикарбоната натрия (50 мл х 2), сушат над безводным Na2SO4 и выпаривают. Полученные кристаллы перекристаллизовывают из смеси этилацетат-гексан,получая указанное соединение (2,68 г).(3) Получение цис-4'-гидроксиспиро[5 азаизобензофуран-1(3 Н),1'-циклогексан]-3-она. Суспензию спиро[5-азаизобензофуран 1(3 Н),1'-циклогексан]-3,4'-диона (167 мг) в смеси тетрагидрофуран-вода (10:1, 4 мл) охлаждают до 0 С и перемешивают вместе с боргидридом натрия (32 мг) при 0 С в течение 30 мин. Реакционную смесь выливают в воду (5 мл),перемешивают 30 мин при комнатной температуре и затем экстрагируют хлороформом (20 мл х 3). Экстракт сушат над безводным Na2SО 4 и концентрируют. Остаток перекристаллизовывают из смеси этилацетат-гексан, получая указанное соединение (77,7 мг).(4) Получение транс-3-оксоспиро[5 азаизобензофуран-1(3 Н),1'-циклогексан]-4'-карбонитрила. Раствор цис-4'-гидроксиспиро[5-азаизобензофуран-1(3 Н),1'-циклогексан]-3-она (1,31 г) в безводном тетрагидрофуране (20 мл) охлаждают до 0 С и перемешивают вместе с метансульфонилхлоридом (0,555 мл) при 0 С в течение 1 ч. Реакционную смесь выливают в воду (50 мл),экстрагируют этилацетатом (100 мл х 2), сушат над безводным Na2SO4 и концентрируют, получая сырой мезилат (1,87 г). Данный мезилат растворяют в безводном диметилформамиде (30 мл) и перемешивают вместе с триэтиламмоний цианидом (2,98 г) при 100 С в течение 5 ч. Реакционную смесь выливают в воду (100 мл) и экстрагируют эфиром (150 мл х 3) и смесью эфир-этилацетат (2:1, 200 мл). Объединенные экстракты сушат над безводным Na2SO4 и концентрируют. Полученный маслянистый остаток очищают способом колоночной хроматографии на силикагеле (гексан/этилацетат/метанол от 2/1/0 до 1/1/0 и далее 30/30/1) и полученное твердое вещество перекристаллизовывают из смеси этилацетат-гексан, получая указанное соединение (631 мг).(100 мг), воды (0,7 мл) и концентрированной серной кислоты (0,3 мл) кипятят с обратным холодильником в течение 11 ч. Реакционную смесь охлаждают до комнатной температуры и доводят рН до 4 при помощи 4 н гидроксида натрия. Полученный осадок собирают фильтрованием, промывают последовательно водой, этанолом и диизопропиловым эфиром и затем сушат, получая указанное соединение (78 мг).(6) Получение транс-N-(4-бензоилфенил)3-оксоспиро[5-азаизобензофуран-1(3 Н),1'-циклогексан]-4'-карбоксамида. Раствор транс-3-оксоспиро[5-азаизобензофуран-1(3 Н),1'-циклогексан]-4'-карбоновой кислоты (20 мг) и 4-аминобензофенона (16 мг) в безводном пиридине (0,5 мл) перемешивают вместе с 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлоридом (20 мг) при 60 С в течение 2 ч. Реакционную смесь выливают в воду (10 мл) и экстрагируют этилацетатом (30 мл х 2). Объединенные органические слои сушат над безводным Nа 2SO4 и концентрируют. Полученный маслянистый остаток очищают способом колоночной хроматографии на силикагеле (гексан/этилацетат от 1/1 до 1/2) и полученное твердое вещество перекристаллизовывают из смеси этилацетат-гексан, получая указанное соединение (10 мг) в виде бесцветных кристаллов (температура плавления 256-257 С). Пример 62. Получение транс-N-(4-бензоилфенил)-3-оксоспиро[6-азаизобензофуран 1(3 Н),1'-циклогексан]-4'-карбоксамида.(1) Получение диспиро[6-азаизобензофуран-1(3 Н),1'-циклогексан-4',2"-1",3"-диоксолан]-3-она. 2,2,6,6-Тетраметилпиперидин (50 мл) растворяют в безводном тетрагидрофуране (500 мл) и данный раствор охлаждают до -50 С, к нему последовательно добавляют н-бутиллитий(1,50 М раствор в гексане, 270,7 мл) и изоникотиновую кислоту (12,5 г). Реакционную смесь перемешивают 10 мин при -50 С и повышают температуру до 25 С за 30 мин. Реакционную смесь перемешивают еще 10 мин при 25 С и охлаждают до -65 С. Добавляют 1,4-циклогександион моноэтиленкеталя (19 г) и реакционную смесь перемешивают при -65 С в течение 10 мин. Повышают температуру реакционной смеси до -15 С за 1 ч, затем до 0 С за 30 мин. Затем данную смесь выливают в воду (300 мл) и отделяют водный слой. Органический слой экстрагируют 2 н водным гидроксидом натрия. Доводят рН объединенных водных слоев до 3 при помощи концентрированной соляной кислоты и экстрагируют этилацетатом (500 мл). Органический слой промывают насыщенным водным раствором бикарбоната натрия (200 мл), насыщенным солевым раствором, сушат над безводным МgSO4 и концентрируют. Остаток очищают способом колоночной хроматографии на силикагеле (гексан/этилацетат от 1/0 до 4/1 и далее 3/2) и перекристаллизовывают из смеси этилацетат-гексан, получая указанное соединение (7,20 г).(15 мл) и раствор нагревают при кипячении с обратным холодильником в течение 5,5 ч. После охлаждения ацетон выпаривают и остаток экстрагируют этилацетатом (100 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (50 мл), сушат над безводным МgSO4 и выпаривают. Полученные кристаллы перекристаллизовывают из смеси этилацетат-диизопропиловый эфир, получая указанное соединение (1,96 г).(3) Получение цис-4'-гидроксиспиро[6 азаизобензофуран-1(3 Н),1'-циклогексан]-3-она. Раствор спиро[6-азаизобензофуран-1(3 Н),1'-циклогексан]-3,4'-диона (1,0 г) в этаноле (100 мл) охлаждают до 0 С и перемешивают вместе с боргидридом натрия (174 мг) при 0 С в течение 1 ч. Доводят рН реакционной смеси до 4 при помощи 10% серной кислоты, затем при помощи насыщенного водного раствора бикарбоната натрия делают его основным и далее экстрагируют хлороформом (200 мл х 2). Экстракт сушат над безводным МgSO4 и концентрируют. Остаток перекристаллизовывают из смеси этилацетат-гексан, получая указанное соединение (954,5 мг).(954 мг) и триэтиламина (0,91 мл) в диметилформамиде (10 мл) охлаждают до 0 С и перемешивают вместе с метансульфонилхлоридом (0,40 мл) при 0 С в течение 1 ч. Реакционную смесь разбавляют этилацетатом (100 мл), промывают насыщенным водным раствором бикарбоната натрия (50 мл х 2) и насыщенным солевым раствором (50 мл), сушат над безводным MgSO4 и концентрируют. Остаток перекристаллизовывают из смеси этилацетат-диизопропиловый эфир, получая мезилат (995 мг). Данный мезилат растворяют в безводном диметилформамиде(30 мл) и перемешивают вместе с триэтиламмоний цианидом (1,57 г) при 100 С в течение 1,5 ч. Реакционную смесь разбавляют этилацетатом(200 мл), насыщенным водным раствором бикарбоната натрия (200 мл) и насыщенным солевым раствором (100 мл). Органический слой сушат над безводным MgSO4 и концентрируют. Остаток перекристаллизовывают из смеси этилацетат-изопропиловый эфир, получая указанное соединение (447 мг).(445 мг), воды (3,5 мл) и концентрированной серной кислоты (1,5 мл) кипятят с обратным холодильником в течение 6 ч. Реакционную смесь охлаждают до комнатной температуры и доводят рН до 8 при помощи 5 н гидроксида натрия, затем до рН 4 концентрированной соляной кислотой. Полученные кристаллы собирают фильтрованием, промывают водой и сушат, получая указанное соединение (416 мг) в виде бесцветных кристаллов (температура плавления 222-223 С). 1(6) Получение транс-N-(4-бензоилфенил)3-оксоспиро[6-азаизобензофуран-1(3 Н),1'циклогексан]-4'-карбоксамида. Раствор транс-3-оксоспиро[6-азаизобензофуран-1(3 Н),1'-циклогексан]-4'-карбоновой кислоты (50 мг) и 4-аминобензофенона (51,6 мг) в безводном пиридине (1 мл) перемешивают вместе с 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлоридом (48,7 мг) при 60 С в течение 2 ч. Реакционную смесь разбавляют этилацетатом (20 мл) и последовательно промывают водой (20 мл), 10% водным раствором лимонной кислоты (20 мл х 2), насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором. Органический слой сушат над безводным МgSO4 и концентрируют. Полученный маслянистый остаток очищают способом колоночной хроматографии на силикагеле (гексан/этилацетат от 3/2 до 1/4) и полученное твердое вещество перекристаллизовывают из смеси этилацетат-гексан, получая указанное соединение (62,7 мг) в виде бесцветных кристаллов (температура плавления 147-149 С). Пример 63. Получение N-[5-(4-гидроксифенил)-2-пиразинил]-3-оксоспиро[изобензофуран-1(3 Н),4'-пиперидин]-1'-карбоксамида.(1) Получение 2-амино-5-(4-гидроксифенил)пиразина. К раствору 2-амино-5-бромпиразина (366 мг) в диметоксиэтане (20 мл) добавляют 4 гидроксифенилбороновую кислоту (320 мл),1,5 н водный раствор карбоната натрия (2,5 мл) и тетракис(трифенилфосфин)палладий (0) (54 мг). Смесь перемешивают при 80 С в течение 3 ч. К реакционной смеси добавляют воду (20 мл) и все экстрагируют этилацетатом (50 мл х 3). Экстракт промывают насыщенным солевым раствором, затем сушат над безводным Na2SO4. Удаление растворителя дает кристаллический остаток, который промывают диэтиловым эфиром(10 мл), получая указанное соединение (305 мг).(2) Получение фенил N-[5-(4-гидроксифенил)-2-пиразинил]карбамата. К раствору 2-амино-5-(4-гидроксифенил)пиразина (283 мг) в пиридине (20 мл) добавляют при охлаждении льдом фенил хлорформиат (199 мкл) и смесь перемешивают 1 ч. 60 Реакционную смесь выливают в воду (30 мл) и экстрагируют этилацетатом (20 мл х 3). Органический слой промывают насыщенным солевым раствором и сушат над безводным Na2SO4. Концентрирование раствора дает кристаллический остаток, который промывают диэтиловым эфиром (10 мл), получая указанное соединение (314 мг).(3) Получение N-[5-(4-гидроксифенил)-2 пиразинил]-3-оксоспиро[изобензофуран-1(3 Н),4'-пиперидинил]-1'-карбоксамида. Смесь спиро[изобензофуран-1(3 Н),4'-пиперидин]-3-он гидрохлорида (96 мг), фенил N-[5(4-гидроксифенил)-2-пиразинил]карбамата (128 мг) и триэтиламина (279 мкл) в хлороформе (5 мл) перемешивают при 80 С в течение 2 ч. Реакционную смесь выливают в воду и экстрагируют хлороформом (20 мл). Органический слой промывают насыщенным солевым раствором (20 мл) и сушат над безводнымNа 2SO4. Концентрирование раствора обеспечивает остаток, который очищают способом колоночной хроматографии на силикагеле (гексан/этилацетат от 4/1 до 1/2) с последующей перекристаллизацией из смеси этиловый эфиргексан, получая указанное соединение (114 мг) в виде бесцветных кристаллов (температура плавления 263-265 С). Пример 64. Получение N-[5-(3-гидроксифенил)-2-пиразинил]-3-оксоспиро[изобензофуран-1(3 Н),4'-пиперидин]-1'-карбоксамида.(1) Получение 2-амино-5-(3-метоксифенил)пиразина. К раствору 2-амино-5-бромпиразина (642 мг) в диметоксиэтане (40 мл) добавляют 3 метоксифенилбороновую кислоту (560 мг), 1,5 н водный раствор карбоната натрия (4 мл) и тетракис(трифенилфосфин)палладий (0) (86 мг). Смесь перемешивают при 80 С в течение 6 ч. К реакционной смеси добавляют воду (20 мл) и все экстрагируют этилацетатом (50 мл х 3). Экстракт промывают насыщенным солевым раствором и затем сушат над безводным Na2SO4. Концентрирование раствора дает кристаллический остаток, который промывают этиловым эфиром(10 мл), получая указанное соединение (760 мг).(2) Получение 2-амино-5-(3-гидроксифенил)пиразина. 2-Амино-5-(3-метоксифенил)пиразин (566 мг) растворяют в метиленхлориде (10 мл). К смеси добавляют при охлаждении льдом трехбромистый бор (530 мкл) и все перемешивают при комнатной температуре в течение 14 ч. К реакционной смеси добавляют 1 н водный гидроксид натрия. Все экстрагируют этилацетатом(30 мл х 2). Органический слой промывают насыщенным солевым раствором и сушат над безводным Na2SO4. Концентрирование раствора дает указанное соединение (94 мг) в виде желтого твердого вещества.
МПК / Метки
МПК: A61K 31/438, A61P 9/00, C07D 491/10, C07D 471/10
Метки: спиросоединения, новые
Код ссылки
<a href="https://eas.patents.su/30-4507-novye-spirosoedineniya.html" rel="bookmark" title="База патентов Евразийского Союза">Новые спиросоединения</a>