Замещенные 3-цианохинолины в качестве ингибиторов протеинтирозинкиназ
Номер патента: 4427
Опубликовано: 29.04.2004
Авторы: Фрост Филип, Цоу Хвей-Ру, Флойд Миддлтон Бронер Мл., Бергер Дэн Маартен, Висснер Аллан, Хаманн Филип Росс, Занг Нан
Формула / Реферат
1. Соединение формулы 1, имеющее структуру
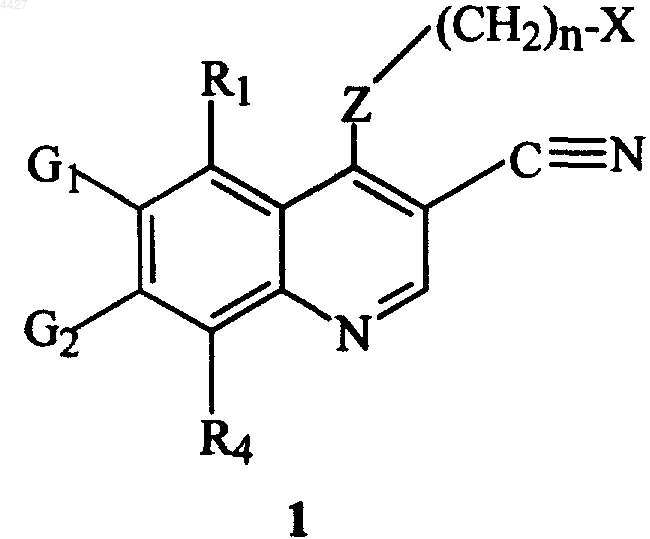
где X представляет циклоалкил из 3-7 атомов углерода, который необязательно может быть замещен одной или несколькими алкильными группами из 1-6 атомов углерода; или представляет пиридинильное, пиримидинильное или фенильное кольцо, где указанное пиридинильное, пиримидинильное или фенильное кольцо необязательно может быть моно-, ди- или тризамещенными заместителем, выбранным из группы, включающей галоген, алкил из 1-6 атомов углерода, алкенил из 2-6 атомов углерода, алкинил из 2-6 атомов углерода, азидо, гидроксиалкил из 1-6 атомов углерода, галогенметил, алкоксиметил из 2-7 атомов углерода, алканоилоксиметил из 2-7 атомов углерода, алкокси из 1-6 атомов углерода, алкилтио из 1-6 атомов углерода, гидрокси, трифторметил, циано, нитро, карбокси, карбалкокси из 2-7 атомов углерода, карбалкил из 2-7 атомов углерода, фенокси, фенил, тиофенокси, бензоил, бензил, амино, алкиламино из 1-6 атомов углерода, диалкиламино из 2-12 атомов углерода, фениламино, бензиламино, алканоиламино из 1-6 атомов углерода, алкеноиламино из 3-8 атомов углерода, алкиноиламино из 3-8 атомов углерода, карбоксиалкил из 2-7 атомов углерода, карбалкоксиалкил из 3-8 атомов углерода, аминоалкил из 1-5 атомов углерода, N-алкиламиноалкил из 2-9 атомов углерода, N,N-диалкиламиноалкил из 3-10 атомов углерода, N-алкиламиноалкокси из 2-9 атомов углерода, N,N-диалкиламиноалкокси из 3-10 атомов углерода, меркапто и бензоиламино;
Z представляет -NH-, -O-, -S- или -NR-;
R представляет алкил из 1-6 атомов углерода или карбалкил из 2-7 атомов углерода;
G1, G2, R1 и R4, каждый независимо, представляет водород, галоген, алкил из 1-6 атомов углерода, алкенил из 2-6 атомов углерода, алкинил из 2-6 атомов углерода, алкенилокси из 2-6 атомов углерода, алкинилокси из 2-6 атомов углерода, гидроксиметил, галогенметил, алканоилокси из 1-6 атомов углерода, алкеноилокси из 3-8 атомов углерода, алкиноилокси из 3-8 атомов углерода, алканоилоксиметил из 2-7 атомов углерода, алкеноилоксиметил из 4-9 атомов углерода, алкиноилоксиметил из 4-9 атомов углерода, алкоксиметил из 2-7 атомов углерода, алкокси из 1-6 атомов углерода, алкилтио из 1-6 атомов углерода, алкилсульфинил из 1-6 атомов углерода, алкилсульфонил из 1-6 атомов углерода, алкилсульфонамидо из 1-6 атомов углерода, алкенилсульфонамидо из 2-6 атомов углерода, алкинилсульфонамидо из 2-6 атомов углерода, гидрокси, трифторметил, трифторметокси, циано, нитро, карбокси, карбалкокси из 2-7 атомов углерода, карбалкил из 2-7 атомов углерода, фенокси, фенил, тиофенокси, бензил, амино, гидроксиамино, алкоксиамино из 1-4 атомов углерода, алкиламино из 1-6 атомов углерода, диалкиламино из 2-12 атомов углерода, N-алкилкарбамоил, N,N-диалкилкарбамоил, N-алкил-N-алкениламино из 4-12 атомов углерода, N,N-диалкениламино из 6-12 атомов углерода, фениламино, бензиламино,
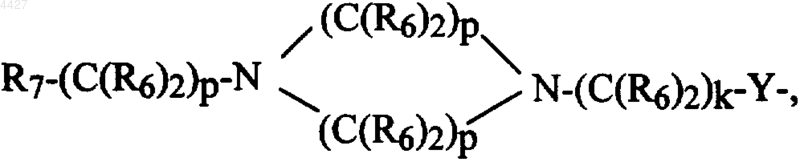
R8R9-CH-M-(C(R6)2)k-Y-, R7-(C(R6)2)g-Y-, R7-(C(R6)2)p-M-(C(R6)2)k-Y- или Het-(C(R6)2)q-W-(C(R6)2)k-Y-;
при условии, что либо G1, либо G2, или оба G1 и G2 должны быть радикалом, выбранным из группы
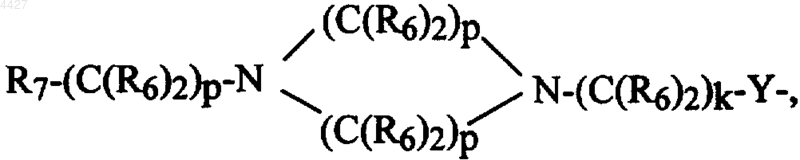
R8R9-CH-M-(C(R6)2)k-Y-, R'7-(C(R6)2)g-Y-, R7-(C(R6)2)p-M-(C(R6)2)k-Y-, Het-(C(R6)2)q-W-(C(R6)2)k-Y- или R2-NH-;
Y представляет двухвалентный радикал, выбранный из группы, включающей
-(CH2)a-, -O- и 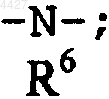
R7 представляет -NR6R6, -J, -OR6, -N(R6)3+ или -NR6(OR6);
R'7 представляет -NR6(OR6), -N(R6)3+, алкенокси из 1-6 атомов углерода, алкинокси из 1-6 атомов углерода, N-алкил-N-алкениламино из 4-12 атомов углерода, N,N-диалкениламино из 6-12 атомов углерода, N-алкил-N-алкиниламино из 4-12 атомов углерода, N-алкенил-N-алкиниламино из 4-12 атомов углерода или N,N-диалкиниламино из 6-12 атомов углерода, при условии, что алкенильный или алкинильный фрагмент связаны с атомами азота или кислорода через насыщенный атом углерода;
M представляет >NR6, -O-, >N-(C(R6)2)pNR6R6 или >N-(C(R6)2)p-OR6;
W представляет >NR6, -O- или связь;
Het представляет гетероцикл, выбранный из группы, включающей морфолин, тиоморфолин, S-оксид тиоморфолина, S,S-диоксид тиоморфолина, пиперидин, пирролидин, азиридин, пиридин, имидазол, 1,2,3-триазол, 1,2,4-триазол, тиазол, тиазолидин, тетразол, пиперазин, фуран, тиофен, тетрагидротиофен, тетрагидрофуран, диоксан, 1,3-диоксолан, тетрагидропиран и
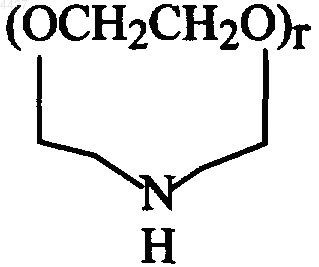
где гетероцикл является необязательно моно- или дизамещенным по атому углерода или азота R6, является необязательно моно- или дизамещенным по атому углерода гидрокси, -N(R6)2 или -OR6, необязательно является моно- или дизамещенным по атому углерода моновалентными радикалами - (C(R6)2)sOR6 или -(C(R6)2)sN(R6)2 или является необязательно моно- или дизамещенным по насыщенному атому углерода двухвалентными радикалами -O- или -O(C(R6)2)sO-;
R6 представляет водород, алкил из 1-6 атомов углерода, алкенил из 2-6 атомов углерода, алкинил из 2-6 атомов углерода, циклоалкил из 1-6 атомов углерода, карбалкил из 2-7 атомов углерода, карбоксиалкил (2-7 атомов углерода), фенил или фенил, необязательно замещенный одним или несколькими галогеном, алкокси из 1-6 атомов углерода, трифторметилом, амино, алкиламино из 1-3 атомов углерода, диалкиламино из 2-6 атомов углерода, нитро, циано, азидо, галогенметилом, алкоксиметилом из 2-7 атомов углерода, алканоилоксиметилом из 2-7 атомов углерода, алкилтио из 1-6 атомов углерода, гидрокси, карбоксилом, карбалкокси из 2-7 атомов углерода, фенокси, фенилом, тиофенокси, бензоилом, бензилом, фениламино, бензиламино, алканоиламино из 1-6 атомов углерода или алкилом из 1-6 атомов углерода;
R2 выбирают из группы, состоящей из
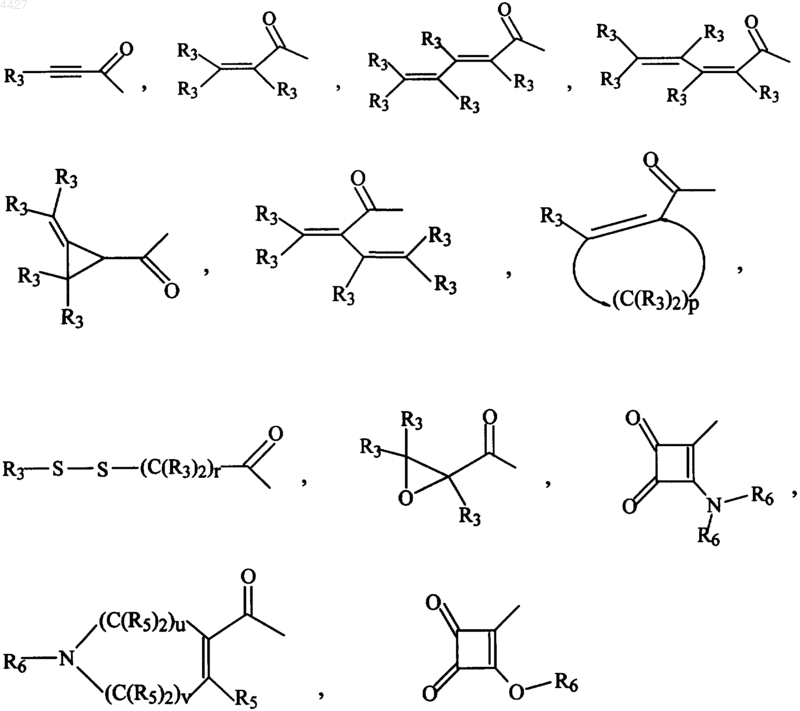
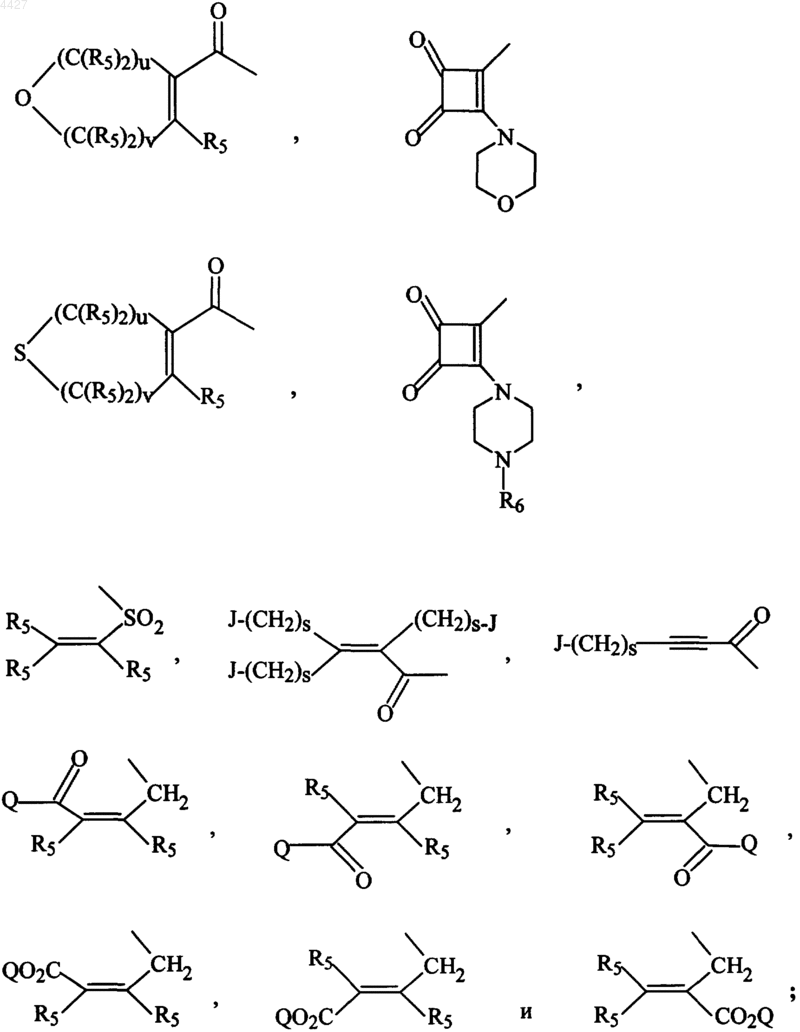
R3 независимо представляет водород, алкил из 1-6 атомов углерода, карбокси, карбалкокси из 1-6 атомов углерода, фенил, карбалкил из 2-7 атомов углерода,
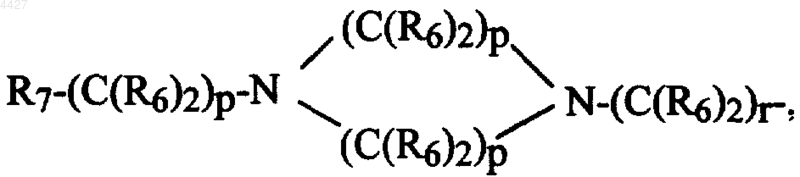
R7-(C(R6)2)s-, R7-(C(R6)2)p-M-(C(R6)2)r-,
R8R9-CH-M-(C(R6)2)r- или Het-(C(R6)2)q-W-(C(R6)2)r-;
при условии, что, по крайней мере, одну из групп R3 выбирают из группы
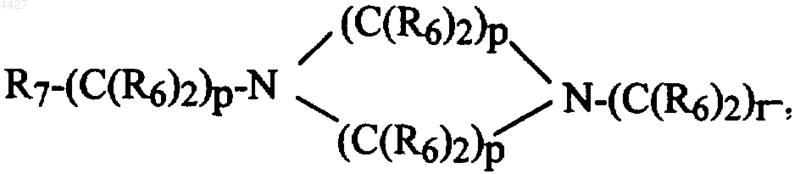
R'7-(C(R6)2)s-, R7-(C(R6)2)p-M-(C(R6)2)r-R8R9-CH-M-(C(R6)2)r- или Het-(C(R6)2)q-W-(C(R6)2)r-;
R5 независимо представляет водород, алкил из 1-6 атомов углерода, карбокси, карбалкокси из 1-6 атомов углерода, фенил, карбалкил из 2-7 атомов углерода,
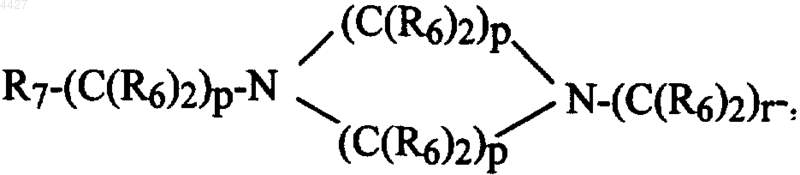
R7-(C(R6)2)s-, R7-(C(R6)2)p-M-(C(R6)2)r-,
R8R9-CH-M-(C(R6)2)r- или Het-(C(R6)2)q-W-(C(R6)2)r-;
R8 и R9, каждый независимо, представляет -(C(R6)2)r-NR6R6 или (C(R6)2)r-OR6;
J независимо представляет водород, хлор, фтор или бром;
Q представляет алкил из 1-6 атомов углерода или водород;
a=0 или 1;
g=1-6;
k=0-4;
n составляет 0-1;
p=2-4;
q=0-4;
r=1-4;
s=1-6;
u=0-4 и v=0-4, где сумма u+v составляет 2-4;
или его фармацевтически приемлемая соль,
при условии, что
когда R6 представляет алкенил из 2-7 атомов углерода или алкинил из 2-7 атомов углерода, такой алкенильный или алкинильный фрагмент связан с атомами азота или кислорода через насыщенный атом углерода;
и при дополнительном условии, что
когда Y представляет -NR6-, a R7 представляет -NR6R6, -N(R6)3+ или -NR6(OR6), тогда g=2-6;
когда M представляет -O- и R7 представляет -OR6, тогда p=1-4;
когда Y представляет -NR6-, тогда k=2-4;
когда Y представляет -O-, а M или W представляют -O-, тогда k=1-4;
когда W не является связью с Het, связанным через атом азота, тогда q=2-4;
и когда W представляет связь с Het, связанным через атом азота, и Y представляет -O- или -NR6-, тогда k=2-4.
2. Соединение по п.1, где Z представляет -NH- и n=0, или его фармацевтически приемлемая соль.
3. Соединение по п.2, где X представляет необязательно замещенный фенил, или его фармацевтически приемлемая соль.
4. Соединение по п.3, где R1 и R4 представляют водород, или его фармацевтически приемлемая соль.
5. Соединение по п.1, представляющее собой
a) [4-(3-бромфениламино)-3-цианохинолин-6-ил]амид 1-метил-1,2,5,6-тетрагидропиридин-3-карбоновой кислоты или его фармацевтически приемлемую соль;
b) N-[4-[(3-бромфенил)амино]-3-циано-6-хинолинил]-4-(N-аллил-N-метиламино)-2-бутинамид или его фармацевтически приемлемую соль;
c) N-[4-[(3-бромфенил)амино]-3-циано-6-хинолинил]-4-(N-метоксиэтил-N-метиламино)-2-бутинамид или его фармацевтически приемлемую соль;
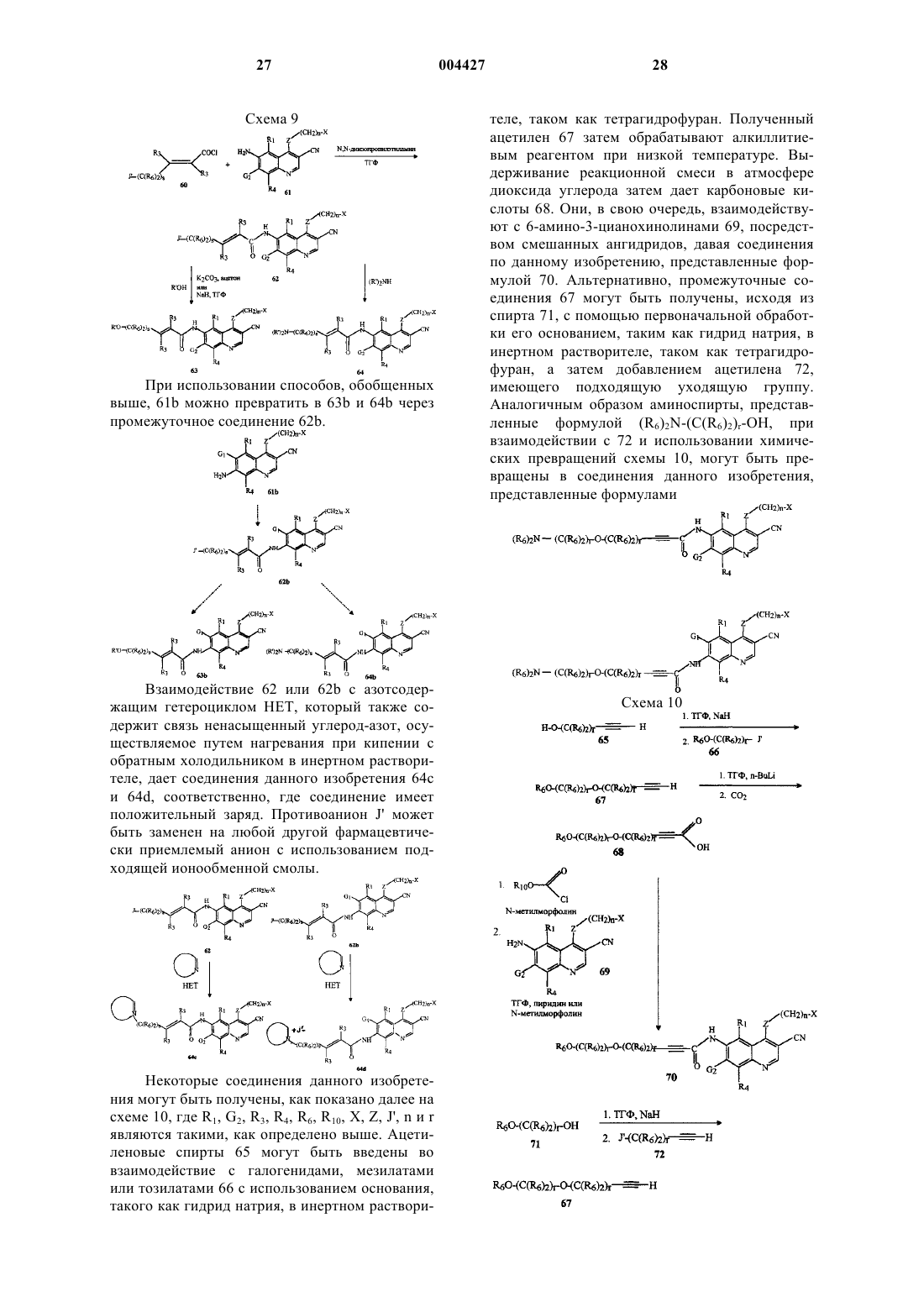
d) N-[4-[(3-бромфенил)амино]-3-циано-6-хинолинил]-4-(бис-(2-метоксиэтил)амино)-2-бутинамид или его фармацевтически приемлемую соль;
e) [4-(3-бромфениламино)-3-цианохинолин-6-ил]амид 4-метоксиметоксибут-2-иновой кислоты или его фармацевтически приемлемую соль;
f) 4-(4-хлор-2-фторфениламино)-6-метокси-7-(2-пиридин-4-илэтокси)хинолин-3-карбонитрил или его фармацевтически приемлемую соль;
g) [4-(3-бромфениламино)-3-цианохинолин-6-ил]амид 4-(2-метоксиэтокси)бут-2-иновой кислоты или его фармацевтически приемлемую соль;
h) [4-(3-бромфениламино)-3-цианохинолин-6-ил]амид 4-((2S)-2-метоксиметилпирролидин-1-ил)бут-2-иновой кислоты или его фармацевтически приемлемую соль;
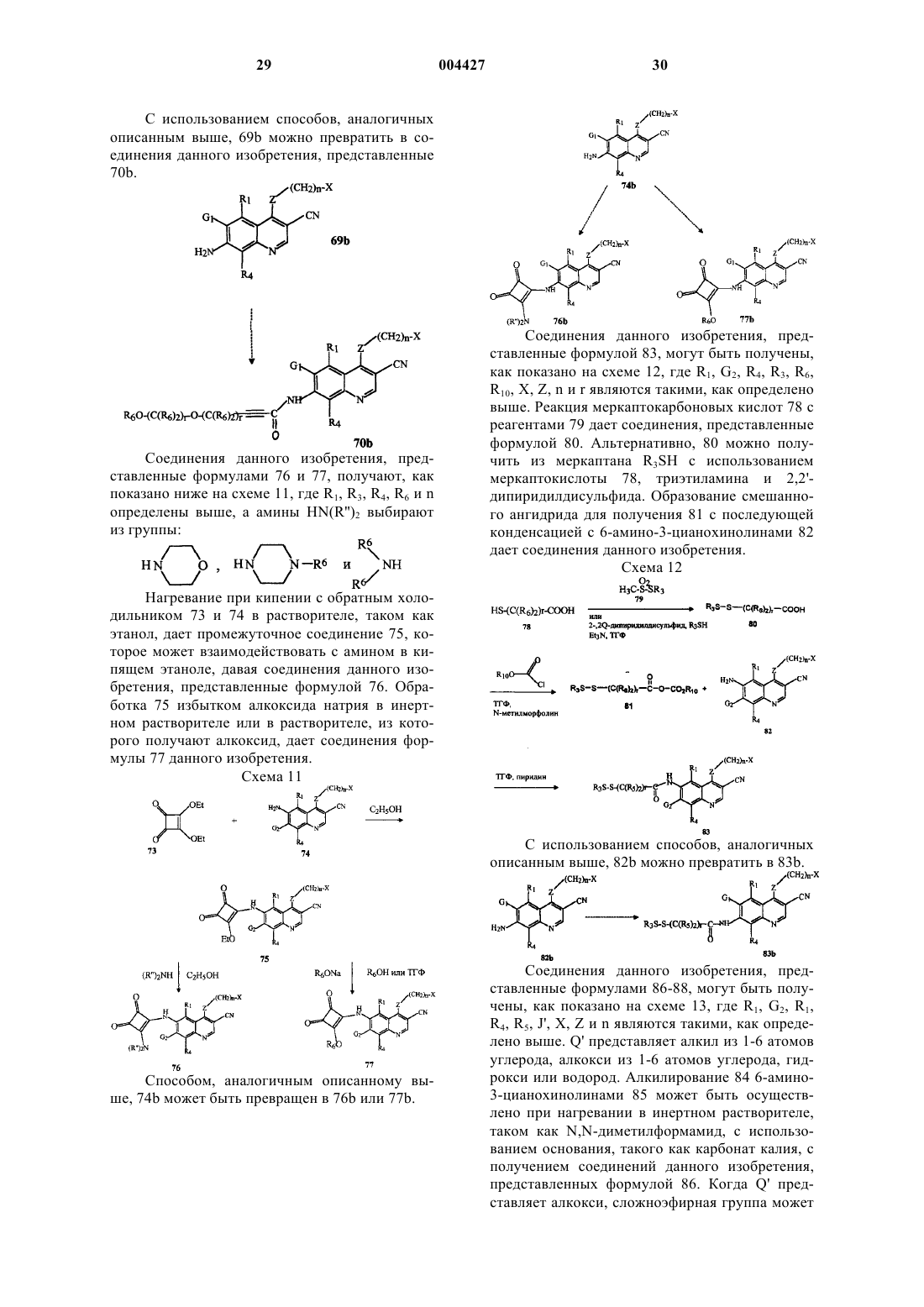
i) [4-(3-бромфениламино)-3-цианохинолин-6-ил]амид 4-(1,4-диокса-8-азаспиро[4,5]дек-8-ил)бут-2-иновой кислоты или его фармацевтически приемлемую соль;
j) 4-(3-бромфениламино)-6-(2-этокси-3,4-диоксоциклобут-1-ениламино)хинолин-3-карбонитрил или его фармацевтически приемлемую соль;
k) [4-(3-хлор-4-фторфениламино)-3-циано-7-метоксихинолин-6-ил]амид 4-[(2-метоксиэтил)метиламино]бут-2-еновой кислоты или его фармацевтически приемлемую соль;
l) дигидрохлорид [4-(3-хлор-4-фторфениламино)-3-циано-7-метоксихинолин-6-ил]амида (S)-4-(2-метоксиметилпирролидин-1-ил)бут-2-еновой кислоты или его фармацевтически приемлемую соль;
m) [4-(3-хлор-4-фторфениламино)-3-циано-7-метоксихинолин-6-ил]амид 4-(3-гидроксиметилпиперидин-1-ил)бут-2-еновой кислоты или его фармацевтически приемлемую соль;
n) [4-(3-хлор-4-фторфениламино)-3-циано-7-метоксихинолин-6-ил]амид 4-(1,4-диокса-8-азаспиро[4,5]дек-8-ил)бут-2-еновой кислоты или его фармацевтически приемлемую соль;
o) [4-(3-хлор-4-фторфениламино)-3-циано-7-метоксихинолин-6-ил]амид 4-(2-гидроксиметилпиперидин-1-ил)бут-2-еновой кислоты или его фармацевтически приемлемую соль;
p) [4-(3-хлор-4-фторфениламино)-3-циано-7-метоксихинолин-6-ил]амид 4-бромбут-2-еновой кислоты или его фармацевтически приемлемую соль;
q) 4-(3-гидрокси-4-метилфениламино)-6-метокси-7-(3-пиридин-4-илпропокси)хинолин-3-карбонитрил или его фармацевтически приемлемую соль;
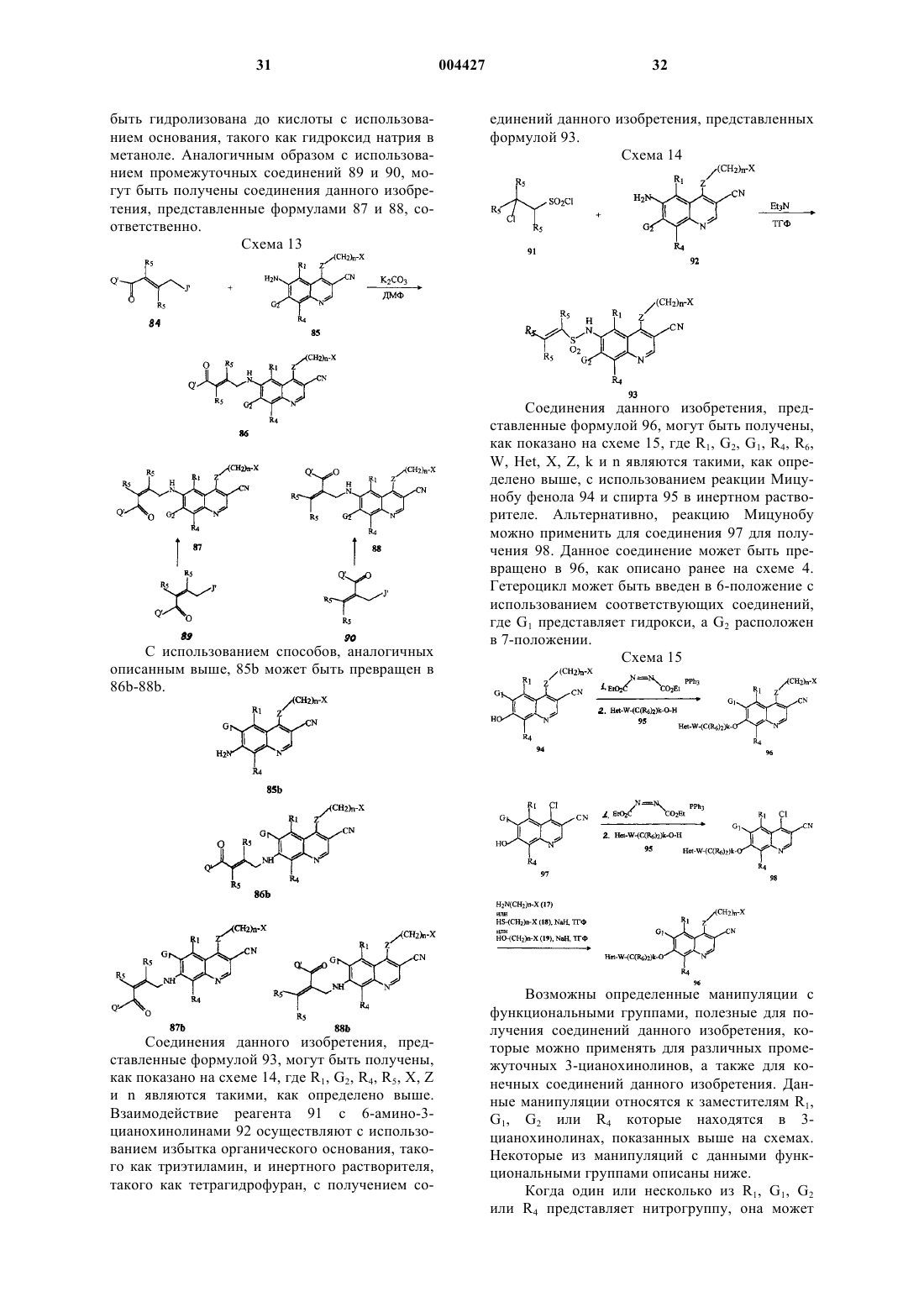
r) [4-(3-хлор-4-фторфениламино)-3-циано-7-метоксихинолин-6-ил]амид 4-диаллиламинобут-2-еновой кислоты или его фармацевтически приемлемую соль;
s) [4-(3-хлор-4-фторфениламино)-3-циано-7-метоксихинолин-6-ил]амид 4-[бис-(2-метоксиэтил)амино]бут-2-еновой кислоты или его фармацевтически приемлемую соль;
t) [4-(3-хлор-4-фторфениламино)-3-циано-7-метоксихинолин-6-ил]амид 4-([1,3]диоксолан-2-илметилметиламино)бут-2-еновой кислоты или его фармацевтически приемлемую соль;
u) [4-(3-хлор-4-фторфениламино)-3-циано-7-метоксихинолин-6-ил]амид 4-[бис-(2-гидроксиэтил)амино]бут-2-еновой кислоты или его фармацевтически приемлемую соль;
v) [4-(3-хлор-4-фторфениламино)-3-циано-7-метоксихинолин-6-ил]амид 4-тиоморфолин-4-ил-бут-2-еновой кислоты или его фармацевтически приемлемую соль;
w) [4-(3-хлор-4-фторфениламино)-3-циано-7-метоксихинолин-6-ил]амид 4-[4-(2-гидроксиэтил)пиперазин-1-ил]бут-2-еновой кислоты или его фармацевтически приемлемую соль;
x) [4-(3-хлор-4-фторфениламино)-3-циано-7-метоксихинолин-6-ил]амид 4-(1,4,7-триокса-10-азациклододек-10-ил)бут-2-еновой кислоты или его фармацевтически приемлемую соль;
y) [4-(3-хлор-4-фторфениламино)-3-циано-7-метоксихинолин-6-ил]амид 4-(метоксиметиламино)бут-2-еновой кислоты или его фармацевтически приемлемую соль;
z) [4-(3-хлор-4-фторфениламино)-3-циано-7-метоксихинолин-6-ил]амид 4-(4-гидроксипиперидин-1-ил)бут-2-еновой кислоты или его фармацевтически приемлемую соль;
aa) [4-(3-хлор-4-фторфениламино)-3-циано-7-метоксихинолин-6-ил]амид 4-[1,4']бипиперидинил-1'-илбут-2-еновой кислоты или его фармацевтически приемлемую соль;
bb) [4-(3-хлор-4-фторфениламино)-3-циано-7-метоксихинолин-6-ил]амид 4-тиазолидин-3-илбут-2-еновой кислоты или его фармацевтически приемлемую соль;
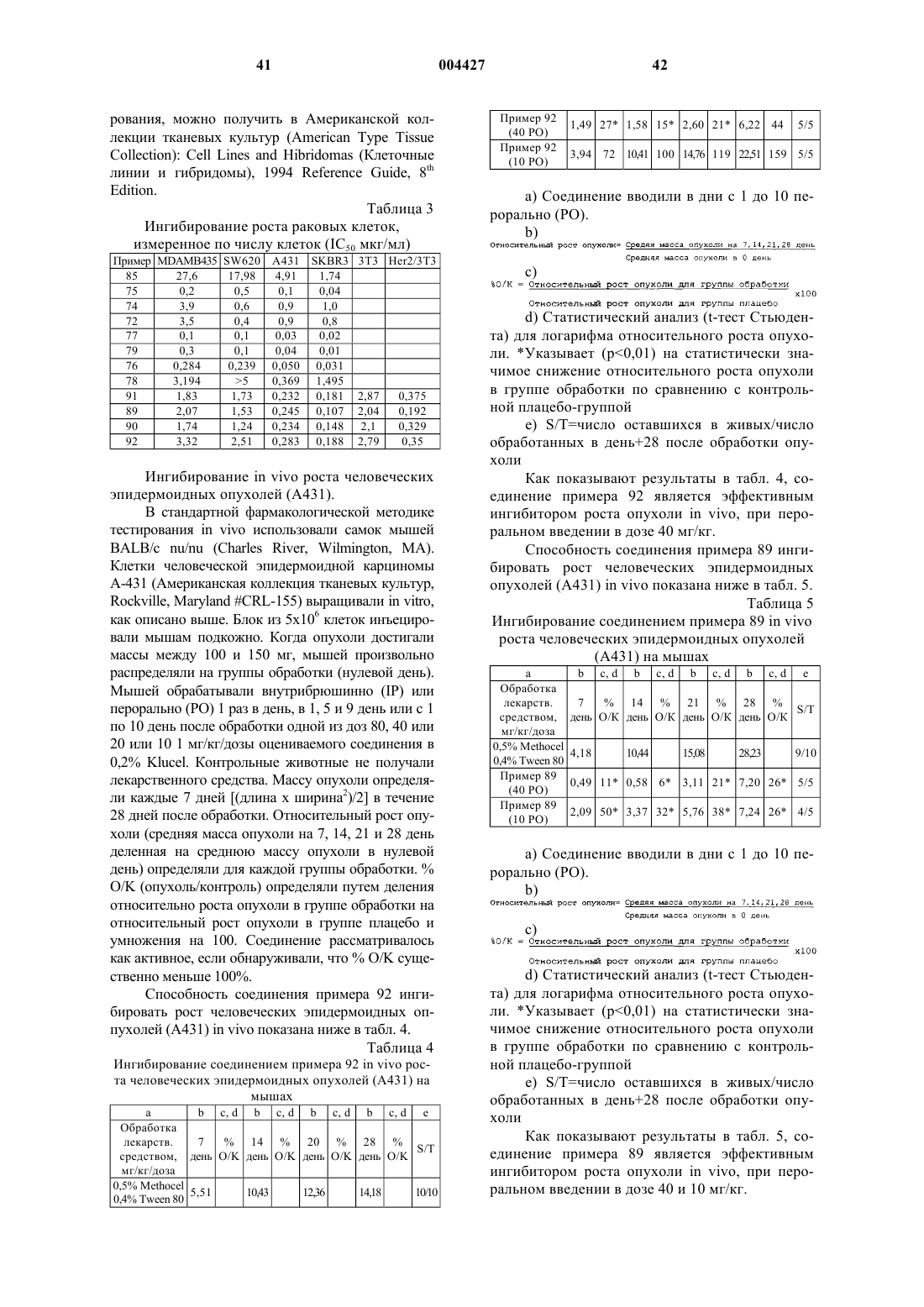
cc) бромид 3-{3-[4-(3-хлор-4-фторфениламино)-3-циано-7-метоксихинолин-6-илкарбамоил]аллил}-4-метилтиазол-3-ия или его фармацевтически приемлемую соль;
dd) [4-(3-хлор-4-фторфениламино)-3-циано-7-метоксихинолин-6-ил]амид 4-(2,6-диметилпиперидин-1-ил)бут-2-еновой кислоты или его фармацевтически приемлемую соль;
ee) [4-(3-хлор-4-фторфениламино)-3-циано-7-метоксихинолин-6-ил]амид 4-[бис-(2-гидроксипропил)амино]бут-2-еновой кислоты или его фармацевтически приемлемую соль;
ff) [4-(3-хлор-4-фторфениламино)-3-циано-7-метоксихинолин-6-ил]амид 4-(3-гидроксипирролидин-1-ил)бут-2-еновой кислоты или его фармацевтически приемлемую соль;
gg) [4-(3-хлор-4-фторфениламино)-3-циано-7-метоксихинолин-6-ил]амид 4-[(2-гидроксиэтил)метиламино]бут-2-еновой кислоты или его фармацевтически приемлемую соль;
hh) [4-(3-хлор-4-фторфениламино)-3-циано-7-метоксихинолин-6-ил]амид 4-(2,5-диметилпирролидин-1-ил)бут-2-еновой кислоты или его фармацевтически приемлемую соль;
ii) [4-(3-хлор-4-фторфениламино)-3-циано-7-метоксихинолин-6-ил]амид 4-(4,4-дигидроксипиперидин-1-ил)бут-2-еновой кислоты или его фармацевтически приемлемую соль;
jj) 4-(3-хлор-4-фторфениламино)-7-метокси-6-пирролидин-1-илхинолин-3-карбонитрил или его фармацевтически приемлемую соль;
kk) 4-(3-хлор-4-фторанилино)-7-метокси-6-(1H-пиррол-1-ил)-3-хинолинкарбонитрил или его фармацевтически приемлемую соль;
ll) 6-(1-азиридинил)-4-(3-хлор-4-фторанилино)-7-метокси-3-хинолинкарбонитрил или его фармацевтически приемлемую соль;
mm) [4-(3-бромфениламино)-3-циано-7-этоксихинолин-6-ил]амид 4-[(2-метоксиэтил)метиламино]бут-2-еновой кислоты или его фармацевтически приемлемую соль;
nn) 4-(2,4-дихлор-5-метоксифениламино)-7-[3-(4-гидроксипиперидин-1-ил)пропокси]-6-метоксихинолин-3-карбонитрил или его фармацевтически приемлемую соль;
oo) 4-(2,4-дихлор-5-метоксифениламино)-7-{3-[4-(2-гидроксиэтил)пиперазин-1-ил]пропокси}-6-метоксихинолин-3-карбонитрил или его фармацевтически приемлемую соль;
pp) 4-(2-бром-4-хлорфениламино)-7-{2-[(2-гидроксиэтил)метиламино]этокси}-6-метоксихинолин-3-карбонитрил или его фармацевтически приемлемую соль;
qq) 4-(2,4-дихлор-5-метоксифениламино)-7-{3-[(2-гидроксиэтил)метиламино]пропокси}-6-метоксихинолин-3-карбонитрил или его фармацевтически приемлемую соль;
rr) 4-(2,4-дихлор-5-метоксифениламино)-6-метокси-7-(3-тиоморфолин-4-илпропокси)хинолин-3-карбонитрил или его фармацевтически приемлемую соль;
ss) 4-(2,4-дихлор-5-метоксифениламино)-6-метокси-7-[3-(2-метоксиэтиламино)пропокси]хинолин-3-карбонитрил или его фармацевтически приемлемую соль;
tt) 4-(2,4-дихлор-5-метоксифениламино)-6-метокси-7-[3-(4-метилпиперидин-1-ил)пропокси]хинолин-3-карбонитрил или его фармацевтически приемлемую соль;
uu) 4-(2,4-дихлор-5-метоксифениламино)-7-[3-(2,6-диметилморфолин-4-ил)пропокси]-6-метоксихинолин-3-карбонитрил или его фармацевтически приемлемую соль;
vv) 4-(2-бром-4-хлорфениламино)-7-{2-[4-(2-гидроксиэтил)пиперазин-1-ил]этокси}-6-метоксихинолин-3-карбонитрил или его фармацевтически приемлемую соль;
ww) 4-(2-бром-4-хлорфениламино)-7-[2-(4-гидроксипиперидин-1-ил)этокси]-6-метоксихинолин-3-карбонитрил или его фармацевтически приемлемую соль;
xx) 4-(2-бром-4-хлорфениламино)-6-метокси-7-(2-тиоморфолин-4-илэтокси)хинолин-3-карбонитрил или его фармацевтически приемлемую соль;
yy) 4-(2,4-дихлор-5-метоксифениламино)-7-[3-(2,5-диметилпирролидин-1-ил)пропокси]-6-метоксихинолин-3-карбонитрил или его фармацевтически приемлемую соль;
zz) 4-(2,4-дихлор-5-метоксифениламино)-7-[3-(3-гидроксипропиламино)пропокси]-6-метоксихинолин-3-карбонитрил или его фармацевтически приемлемую соль;
aaa) этиловый эфир 1-{3-[3-циано-4-(2,4-дихлор-5-метоксифениламино)-6-метоксихинолин-7-илокси]пропил}пиперидин-4-карбоновой кислоты или его фармацевтически приемлемую соль;
bbb) 7-[3-(4-ацетил-1-пиперазинил)пропокси]-4-[(2,4-дихлор-5-метоксифенил)амино]-6-метокси-3-хинолинкарбонитрил или его фармацевтически приемлемую соль;
ccc) 4-(3-хлор-4-фторанилино)-7-метокси-6-(4-морфолинил)-3-хинолинкарбонитрил или его фармацевтически приемлемую соль;
ddd) 7-[3-(4-бензилпиперазин-1-ил)пропокси]-4-(2,4-дихлор-5-метоксифениламино)-6-метоксихинолин-3-карбонитрил или его фармацевтически приемлемую соль;
eee) 4-(2,4-дихлор-5-метоксифениламино)-7-[3-(2-гидроксиэтиламино)пропокси]-6-метоксихинолин-3-карбонитрил или его фармацевтически приемлемую соль;
fff) 4-(2,4-дихлор-5-метоксифениламино)-7-{3-[этил-(2-гидроксиэтил)амино]пропокси}-6-метоксихинолин-3-карбонитрил или его фармацевтически приемлемую соль;
ggg) 7-{3-[бис-(2-метоксиэтил)амино]пропокси}-4-(2,4-дихлор-5-метоксифениламино)-6-метоксихинолин-3-карбонитрил или его фармацевтически приемлемую соль;
hhh) 7-{3-[бис-(2-гидроксиэтил)амино]пропокси}-4-(2,4-дихлор-5-метоксифениламино)-6-метоксихинолин-3-карбонитрил или его фармацевтически приемлемую соль;
iii) 4-(3-хлор-4-фторанилино)-7-(4-морфолинил)-6-нитро-3-хинолинкарбонитрил или его фармацевтически приемлемую соль;
jjj) N-[4-(3-хлор-4-фторанилино)-3-циано-7-(4-морфолинил)-6-хинолинил]-2-бутинамид или его фармацевтически приемлемую соль;
kkk) 6-амино-4-(3-хлор-4-фторанилино)-7-(4-морфолинил)-3-хинолинкарбонитрил или его фармацевтически приемлемую соль;
lll) 4-(2,4-дихлор-5-метоксианилино)-6-метокси-7-(3-{[2-(4-морфолинил)этил]амино}пропокси)-3-хинолинкарбонитрил или его фармацевтически приемлемую соль;
mmm) 7-{3-[(2-анилиноэтил)амино]пропокси}-4-(2,4-дихлор-5-метоксианилино)-6-метокси-3-хинолинкарбонитрил или его фармацевтически приемлемую соль;
nnn) N-[4-(3-хлор-4-фторанилино)-3-циано-7-(4-морфолинил)-6-хинолинил]акриламид или его фармацевтически приемлемую соль;
ooo) 4-(3-хлор-4-фторанилино)-7-{4-[2-(диметиламино)этил]-1-пиперазинил}-6-нитро-3-хинолинкарбонитрил или его фармацевтически приемлемую соль;
ppp) 6-амино-4-(3-хлор-4-фторанилино)-7-{4-[2-(диметиламино)этил]-1-пиперазинил}-3-хинолинкарбонитрил или его фармацевтически приемлемую соль;
qqq) N-(4-(3-хлор-4-фторанилино)-3-циано-7-{4-[2-(диметиламино)этил]-1-пиперазинил}-6-хинолинил)акриламид или его фармацевтически приемлемую соль;
rrr) 4-(2,4-дихлор-5-метоксианилино)-6-метокси-7-({2-[4-(2-метоксиэтил)-1-пиперазинил]этил}амино)-3-хинолинкарбонитрил или его фармацевтически приемлемую соль;
sss) 4-(2,4-дихлор-5-метоксианилино)-6-метокси-7-[3-(2H-1,2,3-триазол-2-ил)пропокси]-3-хинолинкарбонитрил или его фармацевтически приемлемую соль;
ttt) 4-(2,4-дихлор-5-метоксианилино)-6-метокси-7-[3-(1H-1,2,3-триазол-1-ил)пропокси]-3-хинолинкарбонитрил или его фармацевтически приемлемую соль;
uuu) 4-(2,4-дихлор-5-метоксианилино)-6-метокси-7-(3-тиенил)-3-хинолинкарбонитрил или его фармацевтически приемлемую соль;
vvv) 4-[(E)-2-(2-хинолинил)этенил]анилин или его фармацевтически приемлемую соль;
www) 4-(2,4-дихлор-5-метоксианилино)-6-метокси-7-{[2-(2H-1,2,3-триазол-2-ил)этил]амино}-3-хинолинкарбонитрил или его фармацевтически приемлемую соль;
xxx) 4-(2,4-дихлор-5-метоксианилино)-6-метокси-7-{[2-(1H-1,2,3-триазол-1-ил)этил]амино}-3-хинолинкарбонитрил или его фармацевтически приемлемую соль;
yyy) 4-(2,4-дихлор-5-метоксианилино)-7-(3-тиенил)-3-хинолинкарбонитрил или его фармацевтически приемлемую соль;
zzz) 4-(2,4-дихлор-5-метоксианилино)-6-метокси-7-[3-(1H-1,2,4-триазол-1-ил)пропокси]-3-хинолинкарбонитрил или его фармацевтически приемлемую соль;
aaaa) 4-(2,4-дихлор-5-метоксианилино)-7-[3-(1H-имидазол-1-ил)пропокси]-6-метокси-3-хинолинкарбонитрил или его фармацевтически приемлемую соль;
bbbb) 4-(2,4-дихлор-5-метоксианилино)-6-метокси-7-[3-(1H-пиразол-1-ил)пропокси]-3-хинолинкарбонитрил или его фармацевтически приемлемую соль;
cccc) N-[3-циано-4-(2,4-дихлор-5-метоксианилино)-6-метокси-7-хинолинил]-N-[4-(4-этил-1-пиперазинил)бутил]ацетамид или его фармацевтически приемлемую соль;
dddd) N-[3-циано-4-(2,4-дихлор-5-метоксианилино)-6-метокси-7-хинолинил]-N-(3-(4-этил-1-пиперазинил)пропил)ацетамид или его фармацевтически приемлемую соль;
eeee) 4-(2,4-дихлор-5-метоксианилино)-6-метокси-7-{3-[4-(2-метоксиэтил)-1-пиперазинил]пропокси}-3-хинолинкарбонитрил или его фармацевтически приемлемую соль;
ffff) 4-(2,4-дихлор-5-метоксианилино)-6-метокси-7-(1H-пиррол-1-ил)-3-хинолинкарбонитрил или его фармацевтически приемлемую соль;
gggg) 4-(4-бром-2-фторанилино)-6-метокси-7-[2-(1H-1,2,3-триазол-1-ил)этокси]-3-хинолинкарбонитрил или его фармацевтически приемлемую соль;
hhhh) 4-(4-бром-2-фторанилино)-6-метокси-7-[2-(2H-1,2,3-триазол-2-ил)этокси]-3-хинолинкарбонитрил или его фармацевтически приемлемую соль;
iiii) 4-(2,4-дихлор-5-метоксианилино)-6-метокси-7-[3-(1H-тетразол-1-ил)пропокси]-3-хинолинкарбонитрил или его фармацевтически приемлемую соль;
jjjj) 4-(2,4-дихлор-5-метоксианилино)-6-метокси-7-[3-(2H-тетразол-2-ил)пропокси]-3-хинолинкарбонитрил или его фармацевтически приемлемую соль;
kkkk) 4-(4-бром-2-фторанилино)-6-метокси-7-[2-(1H-1,2,3-триазол-1-ил)этокси]-3-хинолинкарбонитрил или его фармацевтически приемлемую соль;
llll) 4-(4-бром-2-фторанилино)-6-метокси-7-[2-(2H-1,2,3-триазол-2-ил)этокси]-3-хинолинкарбонитрил или его фармацевтически приемлемую соль; или
mmmm) 4-(2,4-дихлор-5-метоксианилино)-7-{3-[[2-(диметиламино)этил](метил)амино]пропокси}-6-метокси-3-хинолинкарбонитрил или его фармацевтически приемлемую соль.
6. Способ лечения, ингибирования роста новообразований (опухолей) у нуждающегося в этом млекопитающего, который включает введение указанному млекопитающему эффективного количества соединения формулы 1, имеющего структуру
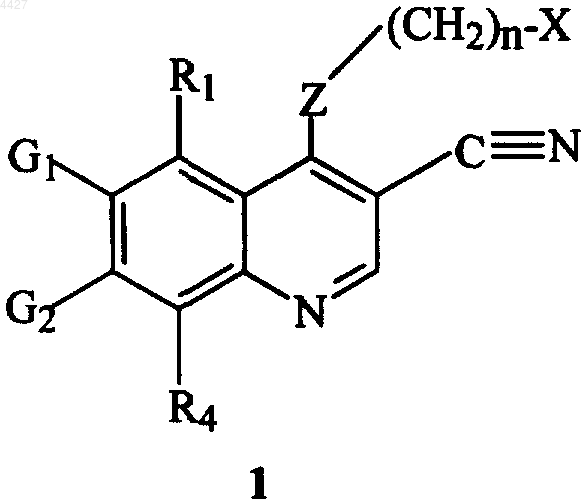
где X, Z, R1, R4, G1, G2 и n имеют указанные в п.1 значения, или его фармацевтически приемлемой соли.
7. Способ по п.6, где новообразование выбирают из группы, включающей новообразование молочной железы, почки, мочевого пузыря, ротовой полости, гортани, пищевода, желудка, прямой кишки, яичника и легкого.
8. Способ лечения, ингибирования прогрессирования поликистозного заболевания почки у нуждающегося в этом млекопитающего, включающий введение указанному млекопитающему эффективного количества соединения формулы 1, имеющего структуру
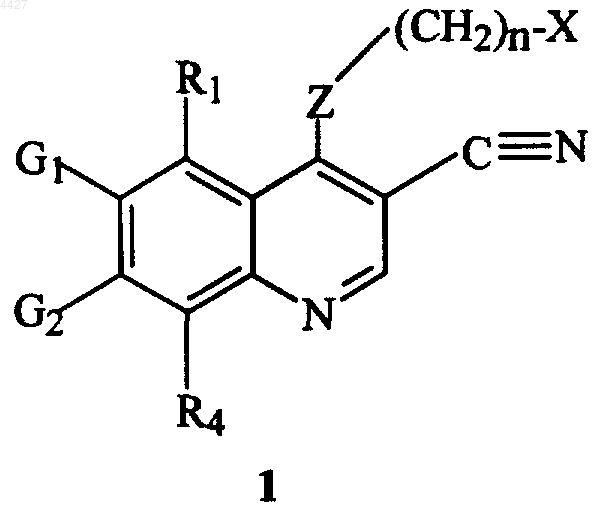
где X, Z, R1, R4, G1, G2 и n имеют указанные в п.1 значения, или его фармацевтически приемлемой соли.
9. Фармацевтическая композиция, включающая соединение формулы 1, имеющее структуру
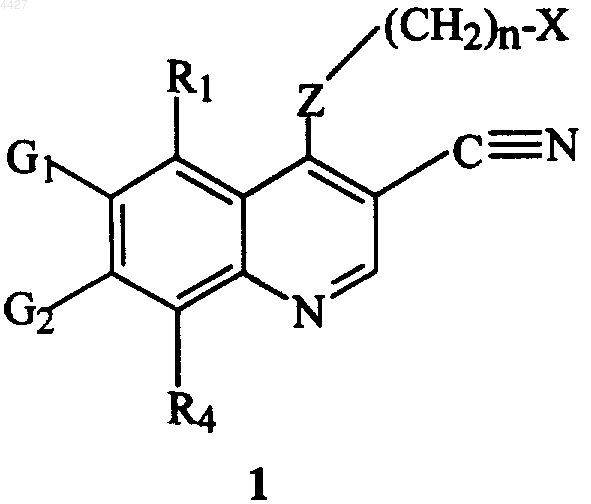
где X, Z, R1, R4, G1, G2 и n имеют указанные в п.1 значения, или его фармацевтически приемлемую соль.
10. Способ получения соединения формулы 1 или его фармацевтически приемлемой соли, включающий взаимодействие соединения, имеющего формулу
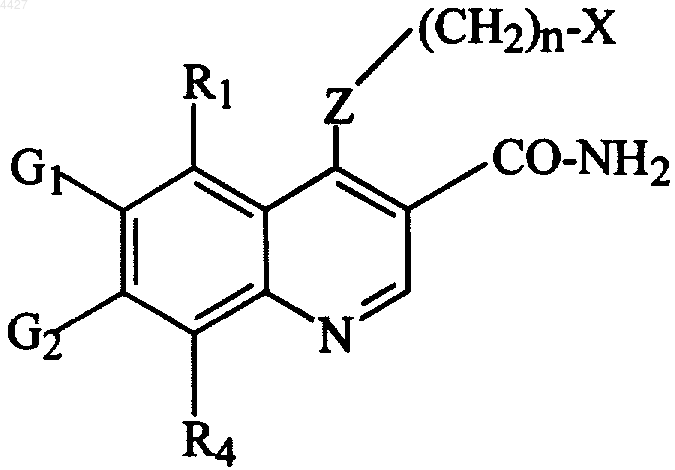
где R1, G1, G2, R4, Z, n и X являются такими, как определено выше, с дегидратирующим агентом, так чтобы преобразовать аминокарбонильную группу в цианогруппу, и последующее добавление кислоты к соединению формулы 1 в случае получения кислотно-аддитивной соли.
11. Способ получения соединения формулы 1 или его фармацевтически приемлемой соли, включающий взаимодействие соединения, имеющего формулу
A1-NH-A2
или его соли с соединением формулы Q-A3, где Q представляет уходящую группу, a A1, A2 и A3 являются такими, что A1-NA2-A3 представляет соединение, соответствующее формуле 1;
и последующее добавление кислоты к соединению формулы 1 в случае получения кислотно-аддитивной соли.
12. Способ получения соединения формулы 1 или его фармацевтически приемлемой соли, включающий взаимодействие соединения формулы
A4-OH
или его соли с соединением, имеющим формулу Q-A5, где Q является таким, как определено выше, а A4 и A5 являются такими, что A4-Q-A5 представляет соединение, соответствующее формуле 1;
и последующее добавление кислоты к соединению формулы 1, в случае получения кислотно-аддитивной соли.
Текст
1 Предпосылки изобретения Данное изобретение относится к некоторым замещенным 3-цианохинолиновым соединениям, а также их фармацевтически приемлемым солям. Соединения настоящего изобретения ингибируют действие некоторых протеинтирозинкиназ (РТК) рецепторов фактора роста и других протеинкиназ, ингибируя тем самым аномальный рост некоторых типов клеток. Следовательно, соединения данного изобретения полезны при лечении некоторых заболеваний,являющихся результатом дерегуляции этих РТК. Соединения данного изобретения являются противораковыми агентами и полезны для лечения рака у млекопитающих. Кроме того,соединения данного изобретения полезны для лечения поликистозного заболевания почек у млекопитающих. Данное изобретение также относится к получению указанных 3-цианохинолинов, их применению для лечения рака и поликистозного заболевания почек и к содержащим их фармацевтическим композициям. Протеинтирозинкиназы представляют собой класс ферментов, которые катализируют перенос фосфатной группы от АТФ к тирозиновому остатку, расположенному на белковом субстрате. Протеинтирозинкиназы явно играют роль в нормальном росте клеток. Многие из белков рецепторов фактора роста функционируют как тирозинкиназы, и именно с помощью данного процесса они осуществляют передачу сигнала. Взаимодействие факторов роста с данными рецепторами является необходимым событием при нормальном регулировании (нормальной регуляции) роста клеток. Однако в некоторых условиях, в результате либо мутации,либо сверхэкспрессии, нарушается функционирование данных рецепторов, результатом чего является неконтролируемая клеточная пролиферация, которая может приводить к росту опухоли и, в конечном итоге, к заболеванию, известному как рак [Wilks A.F., Adv.Cancer Res., 60, 43(1993) и Parsons J.T., Parsons S.J., Important Advances in Oncology, DeVita V.T.Ed., J.B. Lippincott Co., Phila., 3 (1993)]. К числу киназ рецепторов фактора роста и их протоонкогенов, которые были идентифицированы и которые являются мишенями для соединений данного изобретения, относятся киназа рецептора эпидермального фактора роста (EGF-R киназа, белковый продукт erbB онкогена) и продукт, продуцируемый еrbВ-2 (также называемым nеu илиHER2) онкогеном. Поскольку фосфорилирование является необходимым сигналом для осуществления клеточного деления, и вследствие того, что сверхэспрессированные или мутированные киназы связаны с раком, ингибитор данного события, ингибитор протеинтирозинкиназы, будет обладать терапевтической ценностью при лечении рака и других заболеваний, характеризуемых неконтролируемым или аномальным ростом клеток. Например, сверхэкспрессия 2 рецепторного киназного продукта erb-2 онкогена связана с раком молочной железы и яичника у человека [Slamon D.J., et al., Science, 244, 707[Macias A. et al., Anticancer Res., 7, 459 (1987)] и опухолями других важных органов [GullickW.J., Brit.Med.Bull., 47, 87 (1991)]. Из-за важности роли, которую играют имеющие нарушения рецепторные киназы в патогенезе рака, многие исследования недавнего времени связаны с разработкой специфических ингибиторов РТК в качестве потенциальных противораковых терапевтических агентов [некоторые недавние обзоры: Burke Т.R. Drugs Future, 17, 119 (1992) и(1992)]. Соединения данного изобретения ингибируют активность киназы EGF-R и, следовательно, полезны для лечения определенных болезненных состояний, таких как рак, который является результатом, по крайней мере, частично, дерегуляции (разрегулирования) данного рецептора. Соединения данного изобретения также полезны для лечения и профилактики некоторых предраковых состояний, таких как рост полипов прямой кишки, которые являются результатом, по крайней мере, частично, разрегулирования данного рецептора. Также известно, что разрегулированиеEGF рецепторов является фактором роста эпителиальных кист или цист при заболевании,описанном как поликистозное заболевание почки [Du J., Wilson P.D., Amer.J.Physiol., 269 (2 Pt 1), 487 (1995); Nauta J. et al., Pediatric Research,37(6), 755 (1995); Gattone V.H. et al., Developmental Biology, 169(2), 504 (1995); Wilson P.D. etal., Eur.J.Cell Biol., 61(1), 131, (1993)]. Следовательно, соединения данного изобретения, ингибирующие каталитическую функцию EGF рецепторов, являются полезными агентами для лечения данного заболевания. Путь метаболизма митоген-активированной протеинкиназы (МАРК) представляет собой главный путь в каскаде клеточной сигнальной трансдукции от факторов роста к ядрам клеток. Путь метаболизма включает киназы на двух уровнях: МАР-киназные киназы(МАРК). Они являются различными изоформами семейства MAP киназ. (Для обзора смотриRony Seger and Edwin G.Krebs, FASEB, Vol.9,726, June 1995). Соединения данного изобретения могут ингибировать действие двух из таких киназ: МЕК, MAP киназную киназу, и ее субстрат ERK, MAP киназу. МЕК активируется фосфорилированием по двум сериновым остаткам с помощью высших киназ, таких как членыraf семейства. Будучи активированным, МЕК катализирует фосфорилирование по треониновому и тирозиновому остатку ERK. Активиро 3 ванный ERK затем фосфорилирует и активирует факторы транскрипции в ядрах, такие как fos иjun, или другие клеточные мишени с PXT/SP последовательностями. Установлено, что ERK,р 42 МАРК, является существенным для пролиферации и дифференциации клеток. Установлено, что сверхэкспрессия и/или сверхактивацияMek или ERK связаны с различными видами рака человека (например, Vimala S.Sivaraman,Hsien-yu Wang, Gerard J.Nuovo and CraigC.Malbon, J.Clin.Invest., Vol.99, No.7, April 1997). Показано, что ингибирование МЕК предотвращает активацию ERK и последующую активацию ERK субстратов в клетках, приводя к ингибированию стимуляции роста клеток и инверсии фенотипа rаs-трансформированных клеток (David T. Dudley, Long Pang, Stuart J. Decker,Alexander J. Bridges and Alan R.Saltiel, PNAS,Vol.92, 7686, August 1995). Поскольку, как это продемонстрировано ниже, соединения данного изобретения могут ингибировать сопряженное действие МЕК и ERK, они полезны для лечения заболеваний, таких как рак, которые характеризуются неконтролируемой пролиферацией клеток, и которые, по крайней мере частично, зависят от МАРК пути метаболизма. Эпителиальная клеточная киназа (ЕСК) представляет собой рецепторную протеинтирозинкиназу (RPTK), принадлежащую к семейству ЕРН (эритропоэтин продуцирующая гепатома). Хотя первоначально идентифицированная как эпителиальная тирозинкиназа специфической линии дифференцировки, впоследствии было покaзано, что ЕСК экспрессируется на сосудистых эндотелиальных клетках, клетках гладких мышц и фибробластах. ЕСК представляет собой трансмембранный гликопротеин типа I с межклеточным лиганд-связывающим доменом, состоящим из обогащенной цистеином области сопровождаемой тремя повторами фибронектина типа III. Внутриклеточный домен ЕСК обладает тирозинкиназным каталитическим доменом, который инициирует каскад сигнальной трансдукции, отражающий ЕСК функцию. ЕСК связывается и впоследствии активируется своим противорецептором,лигандом дляEphродственной киназы (LERK)-1, который представляет генный продукт немедленного раннего ответа, легко индуцируемый неограниченным по линии дифференцировки образом провоспалительными цитокинами, такими как IL-1 илиTNF. На мышиной модели развития кровеносных сосудов роговицы показано, что растворимый LERK-1 частично стимулирует развитие кровеносных сосудов (ангиогенез) путем стимулирования ЕСК. В отличие от своих нормальных копий, опухолевые клетки различных линий дифференцировки существенно экспрессируют LERK-1, и данная экспрессия может дополнительно повышаться за счет гипоксии (кислородной недостаточности) и провоспалительных цитокинов. Многие из таких опухолевых 4 клеток экспрессируют ЕСК на более высоком уровне, чем их нормальные копии, создавая таким образом возможность аутокринной стимуляции за счет взаимодействия ЕСК:LERK-1. Повышенную экспрессию как ЕСК, так и LERK1, сопоставляют с трансформацией меланом из неинвазивной горизонтальной фазы роста в весьма инвазивные вертикально растущие метастазные меланомы. Считается, что совместное взаимодействие ЕСК:LERK-1 промотирует рост опухоли через его промотирующее рост опухоли и ангиогенное действия. Таким образом, ингибирование тирозинкиназной активности ЕСК,опосредующей сигнальный каскад, индуцируемый его связыванием и поперечной сшивкой сLERK-1, может быть терапевтически благоприятным при раке, воспалительных заболеваниях и гиперпролиферативных болезненных состояниях. Как показано ниже, соединения данного изобретения ингибируют тирозинкиназную активность ЕСК и следовательно полезны для лечения вышеуказанных нарушений и расстройств. Рост большинства солидных опухолей зависит от развития кровеносных сосудов, включающего активацию, пролиферацию и миграцию эндотелиальных клеток сосудов и их последующую дифференциацию в капиллярные сосуды. Ангиогенизация опухолей открывает им доступ к полученным из крови кислороду и питательным веществам, а также обеспечивает им адекватное кровоснабжение. Следовательно,ингибирование развития кровеносных сосудов представляет важную терапевтическую стратегию не только при раке, но и в ряде хронических заболеваний, таких как ревматоидный артрит, псориаз, диабетическая ретинопатия, появление возрастных пятен и так далее. Клетки опухоли продуцируют ряд ангиогенных молекул. Сосудистый эндотелиальный фактор роста(VEGF) представляет собой один из таких ангиогенных факторов. VEGF, гомодимерный дисульфид-связанный член семейства PDGF,представляет собой эндотелиальный клеточноспецифический митоген, и известно, что он вызывает полное увеличение эндотелиальной проницаемости сосудов в пораженных тканях.VEGF также является предотвращающим старение фактором выживания эндотелиальных клеток. Почти все имеющие ядра ткани тела обладают способностью экспрессировать VEGF в ответ на различные стимулирующие факторы,включая гипоксию, недостаток глюкозы, продукты избыточного образования полисахаридов,воспалительные цитокины и т.д. Промотирующее рост ангиогенное действие VEGF опосредуется главным образом через его сигнальный рецептор - рецептор, содержащий киназаинсерционный домен (KDR). ЭкспрессированиеKDR на большинстве эндотелиальных клеток происходит на низком уровне; однако активация ангиогенными агентами приводит к значитель 5 ному повышению выхода KDR на эндотелиальных клетках. Большинство развитых кровеносных сосудов экспрессирует высокие уровни содержания KDR. KDR представляет собой рецепторную протеинтирозинкиназу с межклеточнымVEGF-связывающим доменом, состоящим из 7 иммуноглобулиноподобных доменов и цитоплазматического домена, содержащего каталитический тирозинкиназный домен, расщепляемый киназа-инсерционной областью. Связывание с VEGF вызывает димеризацию KDR, приводя к ее автофосфорилированию и инициированию сигнального каскада. Тирозинкиназная активность KDR является существенной для опосредования ее функционального действия в качестве рецептора для VEGF. ИнгибированиеKDR-опосредованного функционального действия путем ингибирования каталитической активности KDR рассматривается как важная терапевтическая стратегия при лечении ангиогенизированных болезненных состояний, включая рак. Как показано ниже, соединения данного изобретения ингибируют тирозинкиназную активность KDR и, следовательно, являются полезными для лечения вышеуказанных болезненных состояний. В дополнение к вышеуказанным областям применения, некоторые соединения данного изобретения полезны для получения других соединений данного изобретения. Соединения данного изобретения представляют собой определенные замещенные 3 цианохинолины. В данной патентной заявке хинолиновая кольцевая система будет нумероваться как указано в формуле ниже, также показана нумерация для хиназолиновой кольцевой системы Не сообщалось о 3-цианохинолинах, обладающих биологической активностью в качестве ингибиторов протеинтирозинкиназы. Описан 3 цианохинолин с 4-(2-метиланилино)заместителем, обладающий ингибирующей активностью в отношении желудочной (Н+/K+)-АТФазы в высоких концентрациях [Ife R.J. et al., J. Med.Chem., 35 (18), 3413 (1992)]. Имеются хинолины, которые не содержат 3-цианозаместителя и, в отличие от соединений данного изобретения, являются незамещенными в 4-положении, но сообщается, что они являются ингибиторами протеинтирозинкиназ [Gazit A.et al., J.Med.Chem., 39(11), 2170 (1996)]. Ряд хинолинов, имеющих 3-пиридильный заместитель и не имеющих заместителя в 4-положении, был описан в качестве ингибиторов тромбоцитов,полученных из рецепторной киназы фактора роста [Dolle R.E. et al., J.Med.Chem., 373, 2627 6 129 (1994)]. В заявках на патенты WO 96/09294 и WO-9813350 описаны ингибиторы протеинтирозинкиназ, которые включают 4-анилинохинолины с большим числом разнообразных заместителей в положениях 5-8, но которые также должны иметь водород или атом фтора в 3-положении. В патенте США 5480883 описаны производные хинолина, которые являются ингибиторами протеинтирозинкиназ, но такие производные не имеют специфического сочетания заместителей, включая 3-цианогруппу, содержащегося в соединениях настоящего изобретения. В заявках на патенты WO 9802434 и WO9802438 описаны производные хинолина, которые являются ингибиторами протеинтирозинкиназы, но такие хинолины не имеют важного 3-цианозаместителя. В дополнение к хинолинам, известно, что некоторые производные хиназолина, которые в некоторых отношениях подобны соединениям данного изобретения, являются ингибиторами протеинтирозинкиназ. В заявке ЕР-520722 описаны 4-анилинохиназолины, которые содержат простые заместители, такие как хлор, трифторметильная или нитрогруппа, в положениях 5-8. Аналогична заявка ЕР-566226, но здесь в положениях 5-8 возможно большее разнообразие заместителей. В заявке WO-9609294 описаны соединения с подобными заместителями в положениях 5-8 и с заместителем в 4-положении,включающем некоторые полициклические кольцевые системы. Некоторые простые замещенные хиназолины также описаны в заявкахWO-9524190, WO-9521613 и WO-9515758. Заявки ЕР-602851 и WO-9523141 охватывают подобные производные хиназолина, где арильная группа, присоединенная в 4-положение, может представлять собой множество гетероциклических кольцевых структур. В заявке ЕР-635498 описаны некоторые производные хиназолина,которые среди заместителей в 6-положении имеют алкеноиламино- и алкиноиламиногруппы, и атом галогена в 7-положении. В заявкеWO-9519774 описаны соединения, где один или несколько атомов углерода в положениях 5-8 могут быть заменены на гетероатомы, что приводит к большому числу бициклических систем,где расположенное слева кольцо представляет собой 5- и 6-членное гетероциклическое кольцо; кроме того, в кольце слева допускается множество заместителей. В заявке ЕР-682027-А 1 описаны некоторые пирролопиримидиновые ингибиторы РТК. В заявке WO-9519970 описаны соединения, где расположенное слева ароматическое кольцо основной хиназолиновой структуры замещено широким рядом различных гетероциклических колец так, что полученные ингибиторы являются трициклическими. В заявке ЕР-635507 описаны хиназолины, где дополнительное 5- или 6-членное гетероциклическое кольцо, имеющее необязательное замещение, конденсировано в положениях 5 и 6. 7 В дополнение к вышеуказанным патентным заявкам в ряде публикаций описаны 4 анилинохиназолины: Fry D.W. et al., Science,265, 1093 (1994), Rewcastle G.W. et al.,J.Med.Chem., 38, 3482 (1995) и Bridges A.J. et al.,J.Med.Chem., 39, 267 (1996). Не имеется публикаций, в которых описаны 3-цианохинолины в качестве ингибиторов РТК. Описание изобретения Данное изобретение относится к соединению формулы 1: где Х представляет циклоалкил из 3-7 атомов углерода, который необязательно может быть замещен одной или несколькими алкильными группами из 1-6 атомов углерода; или представляет пиридинильное, пиримидинильное или фенильное кольцо, где указанное пиридинильное, пиримидинильное или фенильное кольцо необязательно могут быть моно-, ди- или тризамещенными заместителем, выбранным из группы, включающей галоген, алкил из 1-6 атомов углерода, алкенил из 2-6 атомов углерода, алкинил из 2-6 атомов углерода, азидо, гидроксиалкил из 1-6 атомов углерода, галогенметил, алкоксиметил из 2-7 атомов углерода, алканоилоксиметил из 2-7 атомов углерода, алкокси из 1-6 атомов углерода, алкилтио из 1-6 атомов углерода, гидрокси, трифторметил, циано, нитро, карбокси, карбалкокси из 2-7 атомов углерода, карбалкил из 2-7 атомов углерода, фенокси,фенил, тиофенокси, бензоил, бензил, амино,алкиламино из 1-6 атомов углерода, диалкиламино из 2-12 атомов углерода, фениламино,бензиламино, алканоиламино из 1-6 атомов углерода, алкеноиламино из 3-8 атомов углерода,алкиноиламино из 3-8 атомов углерода, карбоксиалкил из 2-7 атомов углерода, карбалкоксиалкил из 3-8 атомов углерода, аминоалкил из 1-5 атомов углерода, N-алкиламиноалкил из 2-9 атомов углерода, N,N-диалкиламиноалкил из 310 атомов углерода, N-алкиламиноалкокси из 29 атомов углерода, N,N-диалкиламиноалкокси из 3-10 атомов углерода, меркапто и бензоиламино;R представляет алкил из 1-6 атомов углерода или карбалкил из 2-7 атомов углерода;R'7 представляет -NR6(OR6), -N(R6)3+, алкенокси из 1-6 атомов углерода, алкинокси из 1-6 атомов углерода, N-алкил-N-алкениламино из 412 атомов углерода, N,N-диалкениламино из 612 атомов углерода, N-алкил-N-алкиниламино из 4-12 атомов углерода, N-алкенил-N-алкиниламино из 4-12 атомов углерода или N,Nдиалкиниламино из 6-12 атомов углерода, при условии, что алкенильный или алкинильный фрагмент связаны с атомами азота или кислорода через насыщенный атом углерода; М представляет где гетероцикл является необязательно моноили дизамещенным по атому углерода или азотаR6, является необязательно моно- или дизамещенным по атому углерода гидрокси, -N(R6)2 или -OR6, является необязательно моно- или дизамещенным по атому углерода моновалентными радикалами-(C(R6)2)sN(R6)2, или необязательно является моно- или дизамещенным по насыщенному атому углерода двухвалентными радикаламиR6 представляет водород, алкил из 1-6 атомов углерода, алкенил из 2-6 атомов углерода,алкинил из 2-6 атомов углерода, циклоалкил из 1-6 атомов углерода, карбалкил из 2-7 атомов углерода, карбоксиалкил (2-7 атомов углерода),фенил или фенил, необязательно замещенный одним или несколькими галогеном, алкокси из 1-6 атомов углерода, трифторметилом, амино,алкиламино из 1-3 атомов углерода, диалкиламино из 2-6 атомов углерода, нитро, циано, азидо, галогенметилом, алкоксиметилом из 2-7 атомов углерода, алканоилоксиметилом из 2-7 атомов углерода, алкилтио из 1-6 атомов углерода, гидрокси, карбоксилом, карбалкокси из 27 атомов углерода, фенокси, фенилом, тиофенокси, бензоилом, бензилом, фениламино, бензиламино, алканоиламино из 1-6 атомов углерода или алкилом из 1-6 атомов углерода;R7-(C(R6)2)s-, R7-(С(R6)2)р-М-(С(R6)2)rR8R9-CH-M-(C(R6)2)r- или Het-(С(R6)2)q-W(С(R6)2)r-; при условии, что по крайней мере одну из групп R3 выбирают из группыQ представляет алкил из 1-6 атомов углерода или водород; а=0 или 1;u=0-4 и v=0-4, где сумма u+v составляет 24; или его фармацевтически приемлемой соли,при условии, что когда R6 представляет алкенил из 2-7 атомов углерода или алкинил из 2-7 атомов углерода, такой алкенильный или алкинильный фрагмент связан с атомами азота или кислорода через насыщенный атом углерода; и при дополнительном условии, что когдаY представляет -NR6-, a R7 представляет -NR6R6,-N(R6)3+ или -NR6(ОR6), тогда g=2-6; когда М представляет -О-, и R7 представляет -OR6, тогда р=1-4; когда Y представляет -NR6-, тогда k=2-4; когда Y представляет -О-, а М или W представляют -О-, тогда k=1-4; когда W не является связью с Het, связанным через атом азота, тогда q=2-4; и когда W представляет связь с Het, связанным через атом азота, и Y представляет -Оили -NR6-, тогда k=2-4. Фармацевтически приемлемыми солями являются такие, которые получены из таких органических и неорганических кислот как: уксусная, молочная, лимонная, винная, янтарная,малеиновая, малоновая, глюконовая, хлористоводородная, бромисто-водородная, фосфорная,азотная, серная, метансульфоновая и аналогичных известных приемлемых кислот. Алкильная часть таких заместителей, как алкил, алкокси, алканоилокси, алкоксиметил,алканоилоксиметил, алкилсульфинил, алкилсульфонил, аминоалкил, N-алкиламиноалкил,N,N-диалкиламиноалкил, N-алкиламиноалкокси, N,N-диалкиламиноалкокси, алкилсульфонамидо, карбалкокси, карбалкил, карбоксиалкил,карбоалкоксиалкил, алканоиламино, N-алкилкарбамоил и N,N-диалкилкарбамоил, включает как линейные, так и разветвленные углеродные цепи. Алкенильная часть алкенильного, алкеноилоксиметильного, алкенилокси, алкенилсульфонамидо заместителей включает как линейные, так и разветвленные углеродные цепи и одно или несколько мест ненасыщенности, и все возможные конфигурационные изомеры. Алкинильная часть алкинильного, алкиноилоксиметильного, алкинилсульфонамидо, алкинилокси заместителей включает как линейные, так и разветвленные углеродные цепи и одно или несколько мест ненасыщенности. Карбокси определяют как -CO2H радикал. Карбалкокси из 2-7 атомов углерода определяют как -CO2R радикал, где R представляет алкильный радикал из 1-6 атомов углерода. Карбоксиалкил определяют как HO2C-R-радикал, где R представляет двухвалентный алкильный радикал из 1-6 ато 004427 12 мов углерода. Карбалкоксиалкил определяют как RO2C-R-радикал, где R представляет двухвалентный алкильный радикал, и где R иR вместе имеют 2-7 атомов углерода. Карбалкил определяют как -COR радикал, где R представляет алкильный радикал из 1-6 атомов углерода. Алканоилокси определяют как OCOR радикал, где R" представляет алкильный радикал из 1-6 атомов углерода. Алканоилоксиметил определяют как RСO2 СН 2- радикал, гдеR представляет алкильный радикал из 1-6 атомов углерода. Алкоксиметил определяют какR"OCH2- радикал, где R" представляет алкильный радикал из 1-6 атомов углерода. Алкилсульфинил определяют как RSO- радикал, гдеR представляет алкильный радикал из 1-6 атомов углерода. Алкилсульфонил определяют какR"SO2- радикал, где R представляет алкильный радикал из 1-6 атомов углерода. Алкилсульфонамидо, алкенилсульфонамидо, алкинилсульфонамидо определяют как RSO2NН-радикал,где R представляет алкильный радикал из 1-6 атомов углерода, алкенильный радикал из 2-6 атомов углерода или алкинильный радикал из 26 атомов углерода, соответственно. N-алкилкарбамоил определяют как R"NНСО-радикал,где R представляет алкильный радикал из 1-6 атомов углерода. N,N-Диалкилкарбамоил определяют как RR'NCO-радикал, где R" представляет алкильный радикал из 1-6 атомов углерода,R' представляет алкильный радикал из 1-6 атомов углерода, и R' и R могут быть одинаковыми или различными. Когда Х является замещенным, предпочтительно, чтобы он был моно-, диили тризамещенным, где монозамещение является наиболее предпочтительным. Предпочтительно, чтобы по крайней мере один из заместителей R1 и R4 представлял водород, и наиболее предпочтительно, чтобы оба эти заместителя представляли водород. Также предпочтительно,когда Х представляет фенильное кольцо, Z представляет -NH-, а n=0.Het представляет гетероцикл, как определено выше, который может быть необязательно мбно- или дизамещенным заместителем R6 no атому углерода или азота, необязательно моноили дизамещенным по атому углерода гидрокси, -N(R6)2 или OR6, необязательно моно- или дизамещенным по атому углерода -(C(R6)2)sOR6 или -(C(R6)2)s-N(R6)2 и необязательно моно- или дизамещенным по насыщенному атому углерода двухвалентным радикалами -О- илиHet является замещенным -О- (карбонилом),карбонильная группа может быть гидрирована.Het может быть связан с W, когда q=0 через атом углерода гетероциклического кольца, или когда Het представляет азотсодержащий гетероцикл, который также содержит связь насыщенный углерод-азот, такой гетероцикл может быть связан с углеродом через азот, когда W пред 13 ставляет связь. Когда q=0, a Het представляет азотсодержащий гетероцикл, который также содержит связь ненасыщенный углерод-азот,такой атом азота гетероцикла может быть связан с углеродом, когда W представляет связь, и полученный гетероцикл будет обладать положительным зарядом. Когда Het замещен с помощью R6, такое замещение может быть по кольцевому углероду, или в случае азотсодержащего гетероцикла, который также содержит насыщенный углерод-азот, такой азот может быть замещен заместителем R6, или в случае азотсодержащего гетероцикла, который также содержит ненасыщенный углерод-азот, такой азот может быть замещен R6, в таком случае гетероцикл будет обладать положительным зарядом. Предпочтительные гетероциклы включают пиридин, 2,6-дизамещенный морфолин,2,5-дизамещенный тиоморфолин, 2-замещенный имидазол, замещенный тиазол, тиазолидин, Nзамещенный имидазол, N-замещенный 1,4 пиперазин, N-замещенный пиперидин, диоксан,1,3-диоксолан и N-замещенный пирролидин. Соединения данного изобретения могут содержать один или несколько асимметрических атомов углерода, в таких случаях соединения данного изобретения включают индивидуальные диастереомеры, рацематы, индивидуальные R и S энантиомеры. Некоторые из соединений данного изобретения могут содержать одну или несколько двойных связей, в таких случаях соединения данного изобретения включают каждый из возможных конфигурационных изомеров, а также смеси таких изомеров. Соединения, имеющие формулу 1, и их соли могут быть получены способом, который включает где R1, G1, G2, R4, Z, n и Х являются такими, как определено выше, с дегидратирующим агентом, так чтобы преобразовать аминокарбонильную группу в цианогруппу, илиA1-NH-A2 или его соли с соединением формулы 14 или его соли с соединением, имеющим формулу(d) добавление кислоты к соединению формулы 1, так что получают кислотноаддитивную соль. Получение соединений и промежуточных продуктов данного изобретения, охватываемых формулой 5, описано ниже на схеме 1, где Z и n являются такими, как определено выше, а X' представляет циклоалкил из 3-7 атомов углерода, который необязательно может быть замещен одной или несколькими алкильными группами из 1-6 атомов углерода; или представляет пиридинильное, пиримидинильное или фенильное кольцо, где пиридинильное, пиримидинильное или фенильное кольцо необязательно может быть моно-, ди- или тризамещенным заместителем, выбранным из группы, включающей галоген, алкил из 1-6 атомов углерода, алкенил из 2-6 атомов углерода, алкинил из 2-6 атомов углерода, азидо, гидроксиалкил из 16 атомов углерода, галогенметил, алкоксиметил из 2-7 атомов углерода, алкокси из 1-6 атомов углерода, алкилтио из 1-6 атомов углерода, гидрокси,трифторметил, циано, нитро, карбокси, карбалкил из 2-7 атомов углерода, фенокси, фенил, тиофенокси, бензил, амино, алкиламино из 1-6 атомов углерода, диалкиламино из 2-12 атомов углерода,фениламино, бензиламино, алканоиламино из 1-6 атомов углерода, алкеноиламино из 3-8 атомов углерода, алкиноиламино из 3-8 атомов углерода,карбоксиалкил из 2-7 атомов углерода, аминометил, N-алкиламинометил из 2-7 атомов углерода,N,N-диалкиламинометил из 3-7 атомов углерода,меркапто и бензоиламино;R1' , R2', R3' и R4', каждый независимо,представляет водород, галоген, алкил из 1-6 атомов углерода, алкенил из 2-6 атомов углерода, алкинил из 2-6 атомов углерода, алкенилокси из 2-6 атомов углерода, алкинилокси из 2-6 атомов углерода, галогенметил, алкоксиметил из 2-7 атомов углерода, алкокси из 1-6 атомов углерода, алкилтио из 1-6 атомов углерода, алкилсульфинил из 1-6 атомов углерода, алкилсульфонил из 1-6 атомов углерода, алкилсульфонамидо из 1-6 атомов углерода, трифторметил, циано, нитро, карбокси, карбалкил из 2-7 атомов углерода, фенокси, фенил, тиофенокси,бензил, алкоксиамино из 1-4 атомов углерода,диалкиламино из 2-12 атомов углерода, N,Nдиалкиламиноалкил из 3-14 атомов углерода,фениламино, бензиламино, N-алкилкарбамоил из 1-6 атомов углерода, N,N-диалкилкарбамоил из 2-12 атомов углерода. В соответствии с последовательностью реакций, представленных на схеме 1, сложный эфир хинолин-3-карбоновой кислоты формулы 2 гидролизуют с помощью основания с получением карбоновой кислоты 15 формулы 3. Карбоксильную группу кислоты 3 превращают в ацилимидазол путем нагревания с карбонилдиимидазолом в инертном растворителе, таком как диметилформамид (ДМФ) с последующим добавлением аммиака с получением амида 4. Дегидратация амидной функциональной группы с использованием дегидратирующего агента, такого как ангидрид трифторуксусной кислоты в пиридине, пентаоксид фосфора в инертном растворителе или тому подобные,дает 3-цианохинолины 5 данного изобретения. В тех случаях, когда какие-либо промежуточные соединения имеют асимметрический атом углерода, их можно использовать в виде рацемата или в виде индивидуальных R или S энантиомеров, в таком случае соединения данного изобретения будут представлять собой рацемические или R и S оптически активные формы,соответственно. Сложные эфиры хинолин-3 карбоновой кислоты формулы 2, хинолин-3 карбоновые кислоты формулы 3 и амиды хинолин-3-карбоновых кислот формулы 4, необходимые для получения соединений данного изобретения, либо уже известны в данной области,либо могут быть получены способами, известными в данной области, как подробно описано в следующих ссылках: Sarges Reinhard; GallagherPaul E.; Bambury Ronald E., J.Pharm.Sci., 73(8),114 (1984); заявка на патент WO 8908105; патент США 4343804; патент США 3470186. Схема 1 Получение соединений данного изобретения, охватываемых формулой 12, описано ниже на схеме 2, где X, Z, n, R1, G2, G1 и R4 определе 004427 16 ны выше. Замещенный анилин формулы 6 нагревали в присутствии растворителя или без растворителя с реагентом 7, получая промежуточное соединение 8 в виде смеси изомеров. Термолиз 8 в высококипящем растворителе,таком как дифениловый эфир, при 200-350 С дает 3-цианохинолины формулы 9; данные промежуточные соединения также могут существовать в таутомерной форме 4-гидроксихинолина. В тех случаях, когда R4 представляет атом водорода, промежуточные соединения 9 могут образовываться в виде смеси двух региоизомеров. Данные изомеры могут быть разделены способами, хорошо известными в данной области,включая, но не ограничиваясь ими, дробную кристаллизацию и хроматографические методы. Затем разделенные изомеры могут быть преобразованы по отдельности в соединения изобретения. Альтернативно, изомеры могут быть разделены на более поздней стадии синтеза. Нагревание соединений 9 в присутствии растворителя или без растворителя с хлорирующим агентом,таким как оксихлорид фосфора или пентахлорид фосфора дает 4-хлор-3-цианохинолины формулы 10. Конденсация 10 с нуклеофильным реагентом, таким как амин, анилин, меркаптан,тиофенол, фенол или спирт, формулы 11 дает промежуточные 3-цианохинолины формулы 12; данная конденсация может быть ускорена путем нагревания реакционной смеси или путем использования основных катализаторов, таких как триалкиламины, гидрид натрия в инертном растворителе, алкоксиды натрия или калия в спиртовых растворителях, и тому подобного. В данных случаях, где заместители могут способствовать образованию асимметрического атома углерода, промежуточные соединения можно использовать в виде рацемата или в виде индивидуальных R или S энантиомеров, в таком случае соединения данного изобретения будут представлять собой рацемические или R и S оптически активные формы, соответственно. В том случае, где заместители могут способствовать образованию более, чем одного асимметрического атома углерода, могут существовать диастереомеры; они могут быть разделены способами, хорошо известными в данной области,включая, но не ограничиваясь ими, дробную кристаллизацию и хроматографические методы. В тех случаях, когда фрагменты R1, G2, G1 и R4 содержат первичную или вторичную аминогруппы, сначала аминогруппы перед реакцией с реагентом 7 следует защитить. Подходящие защитные группы включают, но не ограничиваются ими, трет-бутоксикарбонильную (ВОС) и бензилоксикарбонильную (CBZ) защитные группы. Первая из защитных групп может быть удалена из конечных продуктов формулы 12 путем обработки кислотой, такой как трифторуксусная кислота, тогда как вторая защитная группа может быть удалена с помощью каталитического гидрирования. В тех случаях, где 17 фрагменты R1, G2, G1 и R4 содержат гидроксильные группы, гидроксильные группы перед реакцией с реагентом 7 сначала следует защитить. Подходящие защитные группы включают,но не ограничиваются ими,третбутилдиметилсилильную, тетрагидропиранильную или бензильную защитные группы. Первые две защитные группы могут быть удалены из конечных продуктов формулы 12 путем обработки кислотой, такой как уксусная кислота или хлористо-водородная кислота, тогда как последняя защитная группа может быть удалена путем каталитического гидрирования. Схема 2 18 но не ограничиваются ими,третбутилдиметилсилильную, тетрагидропиранильную или бензильную защитные группы. Первые две защитные группы могут быть удалены из конечных продуктов формулы 15 путем обработки кислотой, такой как уксусная кислота или хлористо-водородная кислота, тогда как последняя защитная группа может быть удалена путем каталитического гидрирования. Схема 3 Получение соединений данного изобретения, охватываемых формулой 24, описано ниже на схеме 4, где R1, G2, R4, Z, n и X определены выше. R10 представляет алкил из 1-6 атомов углерода (предпочтительно изобутил). R2' представляет радикал, выбранный из группы, включающей Получение промежуточного соединения 15(идентичного промежуточному соединению 9 на схеме 2) также может быть осуществлено,как описано ниже на схеме 3. Нагревание замещенного анилина формулы 13 с диметилацеталем диметилформамида в присутствии растворителя или без растворителя дает промежуточные соединения формулы 14. Взаимодействие 14 с литиевым анионом ацетонитрила, полученного с использованием основания, такого как нбутиллитий, или тому подобного, в инертных растворителях дает 3-цианохинолоны 15 или их 3-циано-4-гидроксихинолиновые таутомеры,которые могут быть превращены в соединения данного изобретения. В тех случаях, когда фрагменты R1, G2, G1 и R4 содержат первичную или вторичную аминогруппы, аминогруппы сначала следует защитить. Подходящие защитные группы включают, но не ограничиваются ими, трет-бутоксикарбонильную (ВОС) и бензилоксикарбонильную (CBZ) защитные группы. Первая из защитных групп может быть удалена из конечных продуктов формулы 15 путем обработки кислотой, такой как трифторуксусная кислота, тогда как вторая защитная группа может быть удалена с помощью каталитического гидрирования. В тех случаях, когда фрагментыR1, G2, G1 и R4 содержат гидроксильные группы,гидроксильные группы сначала следует защитить. Подходящие защитные группы включают, где R6, R3, R5, J, s, r, u и v определены выше. В соответствии с реакциями, представленными на схеме 4, 4-хлор-3-циано-6 нитрохинолин 16 может взаимодействовать с амином или анилином 17 при нагревании в инертном растворителе, таком как тетрагидрофуран, бутанол или метоксиэтанол, с получением соединения формулы 20, где Z представляет -NH-. Взаимодействие 16 с меркаптаном или тиофенолом 18 в инертном растворителе может быть осуществлено с использованием основания, такого как гид 19 рид натрия, с получением соединения формулы 20, где Z представляет -S-. Взаимодействие 16 со спиртом или фенолом 19 в инертном растворителе может быть осуществлено с использованием основания, такого как гидрид натрия, с получением соединения формулы 20, где Z представляет -О-. Соединения формулы 20 могут быть восстановлены в 6-амино-3-цианохинолин 21 с использованием восстанавливающего агента, такого как гидросульфит натрия в двухфазной системе, состоящей из тетрагидрофурана и воды в присутствии небольшого количества катализатора межфазного переноса или с использованием железа в нагреваемых при кипении с обратным холодильником протонных растворителях, содержащих уксусную кислоту или хлорид аммония. Ацилирование 21 либо хлорангидридом кислоты формулы 22, либо смешанным ангидридом формулы 23 (который получают из соответствующей карбоновой кислоты) в инертном растворителе, таком как тетрагидрофуран (ТГФ) в присутствии органического основания, такого как пиридин, триэтиламин, диизопропилэтиламин или N-метилморфолин, дает соединения данного изобретения формулы 24. В тех случаях, когда 22 или 23 имеют асимметрический атом углерода, их можно использовать в виде рацемата или в виде индивидуальных R илиS энантиомеров, в таком случае соединения данного изобретения будут представлять собой рацемические или R и S оптически активные формы, соответственно. В тех случаях, когда R2' содержит первичную или вторичную аминогруппы, аминогруппы сначала следует защитить перед образованием ангидрида или хлорангидрида кислоты. Подходящие защитные группы включают, но не ограничиваются ими, трет-бутоксикарбонильную(ВОС) и бензилоксикарбонильную (CBZ) защитные группы. Первая из защитных групп может быть удалена из конечных продуктов формулы 24 путем обработки кислотой, такой как трифторуксусная кислота, тогда как вторая защитная группа может быть удалена каталитическим гидрированием. В тех случаях, когда фрагмент R2' содержит гидроксильные группы, гидроксильные группы в первую очередь следует защитить перед образованием ангидрида или хлорангидрида кислоты. Подходящие защитные группы включают, но не ограничиваются ими, третбутилдиметилси-лильную, тетрагидропиранильную или бензильную защитные группы. Первые две защитные группы могут быть удалены из конечных продуктов формулы 24 путем обработки кислотой, такой как уксусная кислота или хлористо-водородная кислота, тогда как последняя защитная группа может быть удалена каталитическим гидрированием. В тех случаях, когда в промежуточ 004427 20 ных соединениях 17, 18 или 19 X содержит первичную или вторичную аминогруппы или гидрокисльные группы, может потребоваться защитить данные группы перед взаимодействием с 16. Можно использовать такие же защитные группы для амина или спирта, как описано выше, и они могут быть удалены из продуктов 24, как описано ранее. Схема 4 С использованием способов, аналогичных описанным выше на схеме 4, промежуточные соединения 25 могут быть превращены в соединения 26 данного изобретения. Для получения соединений данного изобретения необходимы определенные амины. Некоторые иллюстративные амины приведены ниже в списке А, где R6, р и r определены выше. Данные амины являются коммерчески доступными, известны в химической литературе или могут быть получены с помощью простых способов, хорошо известных в данной области. В некоторых случаях такие амины могут иметь асимметрические атомы углерода; их можно использовать в виде рацематов, или они могут быть разделены и использованы в виде индивидуальных R или S энантиомеров, в таком случае соединения данного изобретения будут представлять рацемические или оптически активные формы, соответственно. Во всем описании данной заявки на приведенных ниже схемах данные амины и другие подобные амины будут представлены общей структурой формулы (R')2NH,где данная формула может представлять первичный или вторичный амин. Для получения соединений данного изобретения необходимы определенные спирты. Некоторые иллюстративные спирты приведены ниже в списке В, где R6, р и r определены выше. Данные спирты являются коммерчески доступными, известны в химической литературе или могут быть получены с помощью простых способов, хорошо известных в данной области. В некоторых случаях такие спирты могут иметь асимметрические атомы углерода; их можно использовать в виде рацематов, или они могут быть разделены и использованы в виде индивидуальных R или S энантиомеров, в таком случае соединения данного изобретения будут представлять рацемические или оптически активные формы, соответственно. Во всем описании данной заявки на приведенных ниже схемах данные спирты и другие подобные спирты будут представлены общей структурой формулы R'OH. Список В Для получения некоторых соединений данного изобретения необходимы определенные смешанные ангидриды формул 31, 34 и 38; их получают, как описано ниже на схемах 5-6, где R6, R10, X,Z, n и s являются такими, как определено выше. J' представляет атом галогена - хлор, бром или иод, 004427(п-толуолсульфонатную) или мезилатную (метансульфонатную) группу. Взаимодействие 27 с амином из списка А осуществляют путем нагревания в инертном растворителе, таком как тетрагидрофуран или N,Nдиметилформамид или с использованием карбоната калия или цезия в ацетоне. Температура и продолжительность нагревания будут зависеть от реакционной способности 27; более продолжительное время реакции и более высокие температуры могут потребоваться, когдa s больше 1. Обработка 28 алкиллитиевым реагентом с последующим гашением с использованием атмосферы сухого диоксида углерода приводит к карбоновым кислотам формулы 29. Они могут быть превращены в смешанные ангидриды формулы 31 с использованием реагента,такого как изобутилхлорформиат, в инертном растворителе, таком как тетрагидрофуран, в присутствии основания, такого как N-метилморфолин. Данные ангидриды затем можно использовать для получения соединений данного изобретения, как описано выше для схемы 4. Взаимодействие 27 со спиртом списка В осуществляют с использованием гидрида натрия или другого ненуклеофильного основания, такого как карбонат калия или цезия, в инертном растворителе, таком как тетрагидрофуран, ацетон или N,N-диметилформамид. В некоторых случаях спирт из списка В также может выступать в качестве растворителя для реакции. Обработка 32 алкиллитиевым реагентом с последующим гашением с использованием атмосферы сухого диоксида углерода приводит к карбоновым кислотам формулы 33. Они могут быть превращены в смешанные ангидриды формулы 34 с использованием реагента, такого как изобутилхлорформиат, в инертном растворителе, таком как тетрагидрофуран, в присутствии основания, такого как Nметилморфолин. Данные ангидриды затем можено использовать для получения соединений данного изобретения, как описано выше на схеме 4. Схема 5 23 Как представлено ниже на схеме 6, где R1,G2, R4, R6, R10, X, Z, n и s являются такими, как определено выше, спирты 35 могут быть защищены трет-бутилдиметилсилильной защитной группой взаимодействием с сооответствующим силилхлоридом в хлористом метилене в присутствии триэтиламина и 4-N,N-диметиламинопиридина (DMAP). Полученные защищенные спирты 36 превращают в ацетиленовые реактивы Гриньяра, которые, в свою очередь, выдерживают в атмосфере сухого диоксида углерода,с получением карбоновых кислот 37. Как описано выше, их превращают в смешанные ангидриды 38, которые при взаимодействии с 6 амино-3-цианохинолином 39 дают 40. На конечной стадии данной последовательности силильную защитную группу удаляют обработкой кислотой в смеси протонных растворителей, с получением соединений, представленных формулой 41. Схема 6 24 соединения данного изобретения, представленные 47. В некоторых случаях спирт списка В также может выступать в качестве растворителя для реакции. Взаимодействие 46 с амином из списка А, дающее соединения данного изобретения, представленные формулой 48, осуществляют путем нагревания в инертном растворителе,таком как тетрагидрофуран илиN,Nдиметилформамид, или с использованием карбоната калия или цезия в ацетоне. Температура и продолжительность нагревания будут зависеть от реакционной способности 46; более продолжительное время реакции и более высокие температуры могут потребоваться, когда s больше 1. Схема 7 С использованием способов, аналогичных кратко изложенным выше, 45b может быть превращен в 47b или 48b. Соединения по данному изобретению также получают, как показано ниже на схеме 7, гдеR1, G2, R4, R6, R10, X, Z, n и s являются такими,как определено выше. J' представляет атом галогена - хлор, бром или иод, или представляет тозилатную или мезилатную группу. Обработка 42 алкиллитиевым реагентом при низкой температуре с последующим гашением в атмосфере сухого диоксида углерода приводит к карбоновым кислотам формулы 43. Они могут быть превращены в смешанные ангидриды формулы 44 с использованием реагента, такого как изобутилхлорформиат, в инертном растворителе, таком как тетрагидрофуран, в присутствии основания, такого как N-метилморфолин. Данные ангидриды затем можно использовать для получения соединений данного изобретения с использованием описанного выше на схемах взаимодействия с 6-амино-3-цианохинолинами 45. Взаимодействие 46 со спиртом из списка В осуществляют с использованием гидрида натрия или другого ненуклеофильного основания в инертном растворителе, таком как тетрагидрофуран или N,N-диметилформамид, получая Хлорангидриды и ангидриды других карбоновых кислот, необходимые для получения некоторых соединений данного изобретения,получают, как показано ниже на схеме 8, где R6,R3, R10, X, Z, J', n и s определены выше. Q' представляет алкильную группу из 1-6 атомов углерода. Сложные эфиры 49, 53 или 57 могут быть гидролизованы основанием, таким как гидроксид бария, давая соответствующие карбоновые кислоты 50, 54 или 58. Данные кислоты могут быть превращены в соответствующие хлорангдириды карбоновых кислот 51 или 56 с использованием оксалилхлорида и каталитического количества N,N-диметилформамида в инертном растворителе или в соответствующие смешанные ангидриды 55 или 59 с использованием изобутилхлорформиата и органического осно 25 вания, такого как N-метилморфолин. Уходящая группа в соединениях, представленных формулой 52, может замещаться аминами из списка А и спиртами из списка В с использованием ранее описанных способов, давая промежуточные соединения 57 и 53, соответственно. Данные хлорангидриды карбоновых кислот 51 и 56 и данные ангидриды 55 и 59 можно использовать для получения некоторых соединений данного изобретения с использованием способов, охарактеризованных выше на схемах данного описания. Схема 8 Используя способы, идентичные описанным выше на схеме 8, можно получать аналогичные хлорангидриды и ангидриды карбоновых кислот, перечисленные ниже в списке С,где R6, R3, р и s такие, как определено ранее. G представляет радикал а А представляет радикал -N(R')2, -OR' или -J' где -N(R')2 является производным аминов из списка A, -OR' является производным спиртов из списка В, a J' представляет уходящую группу, как определено ранее. Используя такие хлорангидриды и ангидриды карбоновых кислот, следуя способам, кратко изложенным выше на схемах, и следуя подробностям, описанным в приведенных ниже примерах, могут быть получены многие соединения данного изобретения. Соединения данного изобретения, представленные формулами 62-63, могут быть получены, как показано на схеме 9, где R1, G2, R4, R6,R3, R10, X, Z, J', n и s являются такими, как определено выше. Взаимодействие хлорангидридов карбоновых кислот 60 и 6-амино-3 цианохинолинов 61 с использованием органического основания в инертном растворителе дает соединения данного изобретения, представленные формулой 62. Реакцию 62 со спиртом из списка В проводят с использованием гидрида натрия или другого ненуклеофильного основания, такого как карбонат калия или цезия, в инертном растворителе, таком как тетрагидрофуран, ацетон или N,N-диметилформамид, с получением соединений данного изобретения,представленных формулой 63. В некоторых случаях спирт из списка В также может выступать в качестве растворителя для реакции. Взаимодействие 62 с амином из списка А, дающее соединения данного изобретения, представленные формулой 64, осуществляют путем нагревания в инертном растворителе, таком как тетрагидрофуран или N,N-диметилформамид. Температура и продолжительность нагревания будут зависеть от реакционной способности 62; более продолжительное время реакции и более высокие температуры могут потребоваться, когда s больше 1. Кроме того, при использовании данного способа для получения аналогичных соединений данного изобретения можно использовать хлорангидриды карбоновых кислот и смешанные ангидриды, перечисленные в списке С. При использовании способов, обобщенных выше, 61b можно превратить в 63b и 64b через промежуточное соединение 62b. Взаимодействие 62 или 62b с азотсодержащим гетероциклом НЕТ, который также содержит связь ненасыщенный углерод-азот, осуществляемое путем нагревания при кипении с обратным холодильником в инертном растворителе, дает соединения данного изобретения 64 с и 64d, соответственно, где соединение имеет положительный заряд. Противоанион J' может быть заменен на любой другой фармацевтически приемлемый анион с использованием подходящей ионообменной смолы. Некоторые соединения данного изобретения могут быть получены, как показано далее на схеме 10, где R1, G2, R3, R4, R6, R10, X, Z, J', n и r являются такими, как определено выше. Ацетиленовые спирты 65 могут быть введены во взаимодействие с галогенидами, мезилатами или тозилатами 66 с использованием основания,такого как гидрид натрия, в инертном раствори 004427 28 теле, таком как тетрагидрофуран. Полученный ацетилен 67 затем обрабатывают алкиллитиевым реагентом при низкой температуре. Выдерживание реакционной смеси в атмосфере диоксида углерода затем дает карбоновые кислоты 68. Они, в свою очередь, взаимодействуют с 6-амино-3-цианохинолинами 69, посредством смешанных ангидридов, давая соединения по данному изобретению, представленные формулой 70. Альтернативно, промежуточные соединения 67 могут быть получены, исходя из спирта 71, с помощью первоначальной обработки его основанием, таким как гидрид натрия, в инертном растворителе, таком как тетрагидрофуран, а затем добавлением ацетилена 72,имеющего подходящую уходящую группу. Аналогичным образом аминоспирты, представленные формулой (R6)2N-(С(R6)2)r-ОН, при взаимодействии с 72 и использовании химических превращений схемы 10, могут быть превращены в соединения данного изобретения,представленные формулами Соединения данного изобретения, представленные формулами 76 и 77, получают, как показано ниже на схеме 11, где R1, R3, R4, R6 и n определены выше, а амины HN(R)2 выбирают из группы: Соединения данного изобретения, представленные формулой 83, могут быть получены,как показано на схеме 12, где R1, G2, R4, R3, R6,R10, X, Z, n и r являются такими, как определено выше. Реакция меркаптокарбоновых кислот 78 с реагентами 79 дает соединения, представленные формулой 80. Альтернативно, 80 можно получить из меркаптана R3SH с использованием меркаптокислоты 78, триэтиламина и 2,2'дипиридилдисульфида. Образование смешанного ангидрида для получения 81 с последующей конденсацией с 6-амино-3-цианохинолинами 82 дает соединения данного изобретения. Схема 12 Нагревание при кипении с обратным холодильником 73 и 74 в растворителе, таком как этанол, дает промежуточное соединение 75, которое может взаимодействовать с амином в кипящем этаноле, давая соединения данного изобретения, представленные формулой 76. Обработка 75 избытком алкоксида натрия в инертном растворителе или в растворителе, из которого получают алкоксид, дает соединения формулы 77 данного изобретения. Схема 11 Способом, аналогичным описанному выше, 74b может быть превращен в 76b или 77b. Соединения данного изобретения, представленные формулами 86-88, могут быть получены, как показано на схеме 13, где R1, G2, R1,R4, R5, J', X, Z и n являются такими, как определено выше. Q' представляет алкил из 1-6 атомов углерода, алкокси из 1-6 атомов углерода, гидрокси или водород. Алкилирование 84 6-амино 3-цианохинолинами 85 может быть осуществлено при нагревании в инертном растворителе,таком как N,N-диметилформамид, с использованием основания, такого как карбонат калия, с получением соединений данного изобретения,представленных формулой 86. Когда Q' представляет алкокси, сложноэфирная группа может 31 быть гидролизована до кислоты с использованием основания, такого как гидроксид натрия в метаноле. Аналогичным образом с использованием промежуточных соединений 89 и 90, могут быть получены соединения данного изобретения, представленные формулами 87 и 88, соответственно. Схема 13 С использованием способов, аналогичных описанным выше, 85b может быть превращен в 86b-88b. Соединения данного изобретения, представленные формулой 93, могут быть получены,как показано на схеме 14, где R1, G2, R4, R5, X, Z и n являются такими, как определено выше. Взаимодействие реагента 91 с 6-амино-3 цианохинолинами 92 осуществляют с использованием избытка органического основания, такого как триэтиламин, и инертного растворителя,такого как тетрагидрофуран, с получением со 004427 Соединения данного изобретения, представленные формулой 96, могут быть получены,как показано на схеме 15, где R1, G2, G1, R4, R6,W, Het, X, Z, k и n являются такими, как определено выше, с использованием реакции Мицунобу фенола 94 и спирта 95 в инертном растворителе. Альтернативно, реакцию Мицунобу можно применить для соединения 97 для получения 98. Данное соединение может быть превращено в 96, как описано ранее на схеме 4. Гетероцикл может быть введен в 6-положение с использованием соответствующих соединений,где G1 представляет гидрокси, a G2 расположен в 7-положении. Схема 15 Возможны определенные манипуляции с функциональными группами, полезные для получения соединений данного изобретения, которые можно применять для различных промежуточных 3-цианохинолинов, а также для конечных соединений данного изобретения. Данные манипуляции относятся к заместителям R1,G1, G2 или R4 которые находятся в 3 цианохинолинах, показанных выше на схемах. Некоторые из манипуляций с данными функциональными группами описаны ниже. Когда один или несколько из R1, G1, G2 или R4 представляет нитрогруппу, она может 33 быть превращена в соответствующую аминогруппу восстановлением с использованием восстанавливающего агента, такого как железо в уксусной кислоте, или каталитическим гидрированием. Когда один или несколько из R1, G1,G2 или R4 представляет аминогруппу, она может быть превращена в соответствующую диалкиламиногруппу, содержащую от 2 до 12 атомов углерода, алкилированием с использованием, по крайней мере, двух эквивалентов галоидного алкила из 1-6 атомов углерода при нагревании в инертном растворителе или восстановительным алкилированием с использованием альдегида,содержащего от 1 до 6 атомов углерода, и восстанавливающего агента, такого как цианоборгидрид натрия. Когда один или несколько из R1,G1, G2 или R4 представляет метоксигруппу, она может быть превращена в соответствующую гидроксигруппу взаимодействием с деметилирующим агентом, таким как трибромид бора, в инертном растворителе или нагреванием с хлоридом пиридина в присутствии или в отсутствие растворителя. Когда один или несколько из R1,G1, G2 или R4 представляет аминогруппу, она может быть превращена в соответствующую алкилсульфонамидо, алкенилсульфонамидо или алкинилсульфонамидо группу из 2-6 атомов углерода взаимодействием с алкилсульфонилхлоридом, алкенилсульфонилхлоридом или алкинилсульфонилхлоридом, соответственно, в инертном растворителе с использованием основного катализатора, такого как триэтиламин или пиридин. Когда один или несколько из R1,G1, G2 или R4 представляет аминогруппу, она может быть превращена в соответствующую алкиламиногруппу из 1-6 атомов углерода алкилированием одним эквивалентом галоидного алкила из 1-6 атомов углерода при нагревании в инертном растворителе или восстановительным алкилированием с использованием альдегида из 1-6 атомов углерода и восстанавливающего агента, такого как цианоборгидрид натрия в протонном растворителе, таком как вода или спирт или их смесях. Когда один или несколько из R1, G1, G2 или R4 представляет гидрокси, она может быть превращена в соответствующую алканоилокси группу из 1-6 атомов углерода реакцией с подходящим хлорангидридом, ангидридом или смешанным ангидридом карбоновой кислоты в инертном растворителе с использованием пиридина или триалкиламина в качестве катализатора. Когда один или несколько изR1, G1, G2 или R4 представляет гидрокси, она может быть превращена в соответствующую алкеноилокси группу из 1-6 атомов углерода взаимодействием с подходящим хлорангидридом, ангидридом или смешанным ангидридом карбоновой кислоты в инертном растворителе с использованием пиридина или триалкиламина в качестве катализатора. Когда один или несколько из R1, G1, G2 или R4 представляет гидрокси,она может быть превращена в соответствую 004427 34 щую алкиноилокси группу из 1-6 атомов углерода взаимодействием с подходящим хлорангидридом, ангидридом или смешанным ангидридом карбоновой кислоты в инертном растворителе с использованием пиридина или триалкиламина в качестве катализатора. Когда один или несколько из R1, G1, G2 или R4 представляет карбокси или карбалкоксигруппу из 2-7 атомов углерода, она может быть превращена в соответствующую гидроксиметильную группу восстановлением с использованием подходящего восстанавливающего агента, такого как боран,боргидрид лития или литийалюминийгидрид, в инертном растворителе, гидроксиметильная группа, в свою очередь, может быть превращена в соответствующую галогенметильную группу взаимодействием в инертном растворителе с галогенирующим реагентом, таким как трибромид фосфора, давая бромметильную группу,или пентахлорид фосфора, давая хлорметильную группу. Гидроксиметильная группа может быть ацилирована подходящим хлорангидридом, ангидридом или смешанным ангидридом карбоновой кислоты в инертном растворителе с использованием пиридина или триалкиламина в качестве катализатора, давая соединения по данному изобретению с соответствующей алканоилоксиметильной группой из 2-7 атомов углерода, алкеноилоксиметильной группой из 2-7 атомов углерода или алкиноилоксиметильной группой из 2-7 атомов углерода. Когда один или несколько из R1, G1, G2 или R4 представляет галогенметильную группу, она может быть превращена в алкоксиметильную группу из 2-7 атомов углерода замещением атома галогена алкоксидом натрия в инертном растворителе. Когда один или несколько из R1, G1, G2 или R4 представляет галогенметильную группу, она может быть превращена в аминометильную группу, N-алкиламинометильную группу из 2-7 атомов углерода или N,N-диалкиламинометильную группу из 3-14 атомов углерода замещением атома галогена аммиаком, первичным или вторичным амином, соответственно, в инертном растворителе. В дополнение к описанным выше способам, имеется ряд заявок на патенты, в которых описаны способы, которые могут использоваться для получения соединений данного изобретения. Хотя данные способы описывают получение определенных хиназолинов, они также могут использоваться для получения соответственно замещенных 3-цианохинолинов. Химические способы, описанные в заявке WO-9633981,можно использовать для получения 3 цианохинолиновых промежуточных соединений, используемых в данном изобретении, гдеR1, G1, G2 или R4 представляют алкоксиалкиламиногруппы. Химические способы, описанные в заявке WO-9633980, можно использовать для получения 3-цианохинолиновых промежуточных соединений, используемых в данном изо 35 бретении, где R1, G1, G2 или R4 представляют аминоалкилалкоксигруппы. Химические способы, описанные в заявке WO-9633979, можно использовать для получения 3-цианохинолиновых промежуточных соединений, используемых в данном изобретении, где R1, G1, G2 или R4 представляют алкоксиалкиламиногруппы. Химические способы, описанные в заявкеWO-9633978, можно использовать для получения 3-цианохинолиновых промежуточных соединений, используемых в данном изобретении,где R1, G1, G2 или R4 представляют аминоалкиламиногруппы. Химические способы, описанные в заявке WO-9633977, можно использовать для получения 3-цианохинолиновых промежуточных соединений, используемых в данном изобретении, где R1, G1, G2 или R4 представляют аминоалкилалкоксигруппы. Хотя в вышеуказанных заявках на патенты описаны соединения,где указанные функциональные группы были введены в 6-положение хиназолина, те же самые химические реакции могут использоваться для введения таких же групп в положения, занимаемые заместителями R1, G1, G2 или R4 в соединениях данного изобретения. Представители соединений данного изобретения были оценены в нескольких стандартных процедурах фармакологических испытаний,что показало, что соединения данного изобретения обладают значительной активностью в качестве ингибиторов протеинтирозинкиназы и представляют собой антипролиферативные агенты. Таким образом, на основании активности, продемонстрированной в стандартных фармакологических испытаниях, соединения данного изобретения полезны в качестве противоопухолевых агентов. Использованные методики испытаний и полученные результаты представлены ниже. Ингибирование рецепторной киназы эпидермального фактора роста (EGF-R) с использованием рекомбинантного фермента. Представители тестируемых соединений оценивали на их способность ингибировать фосфорилирование тирозинового остатка пептидного субстрата, катализируемое ферментом,представляющим киназу рецептора эпидермального фактора роста. Пептидный субстрат(RR-SRC) имеет последовательность arg-arg-leuile-glu-asp-ala-glu-tyr-ala-ala-arg-gly. Фермент,использованный в данной методике испытаний,представляет собой His-маркированный цитоплазматический домен EGFR. Конструировали рекомбинантный бакуловирус (vHcEGFR52),содержащий EGFR кДНК кодирующие аминокислоты 645-1186, предшествующие Met-Ala(Нis)6. Sf9 клетки в 100 мм чашках Петри инфицировали 10 БОЕ/клетку и клетки собирали через 48 ч после инфицирования. Цитоплазматический экстракт получали с использованием 1%Triton X-100 и наносили на Ni-NTA колонку. После промывания колонки 20 мМ имидазолаNaCl). Собранные фракции подвергали диализу против смеси 10 мМ HEPES, pH 7,0, 50 мМ-70 С. Тестируемые соединения готовили в виде исходных растворов 10 мг/мл в 100% диметилсульфоксиде (ДМСО). Перед экспериментом исходные растворы разбавляли 100% ДМСО до 500 мкМ, а затем серийно разбавляли буферомHEPES (30 мМ HEPES, рН 7,4) до желательной концентрации. Для ферментативной реакции 10 мкл каждого ингибитора (в различных концентрациях) добавляли в каждую лунку 96-луночного планшета. Добавляли туда 3 мкл фермента (1:10 разбавление в 10 мМ HEPES, рН 7,4 до конечной концентрации 1:120). Оставляли на 10 мин на льду с последующим добавлением 5 мкл пептида (80 мкМ конечная концентрация), 10 мкл 4 Х буфера (табл. А), 0,25 мкл 33 Р-АТФ и 12 мкл Н 2 О. Реакции давали возможность протекать в течение 90 мин при комнатной температуре,после чего наносили весь объем на предварительно нарезанные Р 81 бумажные фильтры. Фильтровальные диски промывали 2 х 0,5% фосфорной кислотой и измеряли радиоактивность с использованием жидкостного сцинтилляционного счетчика. Таблица А Конечная 100 Rxns Реагент концентрация 1 М HEPES (рН 7,4) 12,5 мМ 50 мкл 10 мМ Na3VO4 50 мкМ 20 мкл 1 М MnCl2 10 мМ 40 мкл 1 мМ АТФ 20 мкМ 80 мкл 33 Р-АТФ 2,5 мкКюри 25 мкл Данные ингибирования для представителей соединений изобретения представлены далее в табл. 1. IC50 представляет концентрацию тестируемого соединения, необходимую для снижения общего количества фосфорилированного субстрата на 50%. % ингибирования тестируемого соединения определяли, по крайней мере, для трех различных концентраций и значение IC50 оценивали из кривой доза-ответная реакция. % ингибирования оценивали по следующей формуле:% ингибирования=100-[СРМ(лекарственное средство)/СРМ (контроль)]х 100 где СРМ (лекарственное средство) выражен в единицах числа импульсов в минуту и представляет собой число, выражающее количество радиоактивно меченного АТФ (-33P),включенного в RR-SRC пептидный субстрат с помощью фермента за 90 мин при комнатной температуре в присутствии тестируемого со 37 единения, измеренное с использованием жидкостного сцинтилляционного счетчика. СРМ (контроль) выражен в единицах числа импульсов в минуту и представляет собой число, выражающее количество радиоактивно меченного АТФ(-33P) , включенного в RR-SRC пептидный субстрат с помощью фермента за 90 мин при комнатной температуре в отсутствие тестируемого соединения, измеренное с использованием жидкостного сцинтилляционного счетчика. Значения СРМ скорректировали с учетом импульсов фона, производимых АТФ в отсутствие ферментативной реакции. Значения IС 50 в табл. 1 представляют собой среднее отдельных определений. Таблица 1(рекомбинантный фермент) Ингибирование рецепторной киназы эпидермального фактора роста СоединениеIC50, мкМ Число испытаний 72 0,006 1 74 0,01 1 75 0,0004 2 76 0,01 2 77 0,006 1 79 0,00036 3 82 0,05 1 93 1,0 1 95 0,005 1 96 0,1 1 108 0,026 2 106 0,013 2 107 0,5 1 109 0,007 2 89 0,01 1 115 0,005 1 91 0,015 1 119 0,00005 1 103 0,008 2 Ингибирование киназы эпителиальных клеток (ЕСК). В данной стандартной процедуре фармакологического исследования биотинилированный пептидный субстрат сначала иммобилизовали на микротитровочных планшетах, покрытых нейтравидином. Затем в лунки микротитровочного планшета, содержащие иммобилизованый субстрат, добавляли тестируемое лекарственное средство, киназу эпителиальных клеток(ЕСК), Мg, ванадат натрия (ингибитор протеинтирозинфосфатазы) и подходящий буфер для поддержания рН (7,2). Для инициирования фосфорилирования добавляли АТФ. После инкубирования планшеты для анализа промывали подходящим буфером, сохраняя фосфорилированный пептид, который подвергали действию антифосфотирозинового моноклонального антитела, конъюгированного с пероксидазой хрена(HRP). Обработанные антителом планшеты повторно промывали и измеряли HRP активность 38 в отдельных лунках как показатель степени фосфорилирования субстрата. Данный нерадиоактивный формат использовали для распознавания ингибиторов активности ЕСК тирозинкиназы, где IC50 представляет концентрацию лекарственного средства, которая ингибирует фосфорилирование субстрата на 50%. Результаты, полученные для представителей соединений данного изобретения, представлены в табл. 2. Несколько результатов для данного соединения указывает на то, что его исследовали несколько раз. Ингибирование киназа-инсерционный домен содержащего рецептора (KDR: каталитический домен VEGF рецептора). В данной стандартной процедуре фармакологического исследования KDR белок смешивали в присутствии или в отсутствие ингибирующего соединения с пептидом субстрата фосфорилирования (сополимер глутаминовой кислоты и тирозина, E:Y4:1) или с другими кофакторами, такими как Мg и ванадат натрия(ингибитор протеинтирозинфосфатазы) в подходящем буфере для поддержания рН (7,2). Затем для инициирования фосфорилирования добавляли АТФ и радиоактивную изотопную метку (АТФ меченная либо 32P, либо 33 Р). После инкубирования измеряли радиоактивный фосфат, связанный с кислотно-нерастворимой фракцией анализируемой смеси как показатель фосфорилирования субстрата. Данный радиоактивный формат использовали для идентификации ингибиторов активности KDR тирозинкиназы, где IС 50 представляет концентрацию лекарственного средства, которая ингибирует фосфорилирование субстрата на 50%. Результаты, полученные для представителей соединений данного изобретения, представлены в табл. 2. Несколько результатов для данного соединения указывает на то, что его исследовали несколько раз. Анализ митоген-активированной протеинкиназы (МАРК). Для оценки ингибиторов MAP (митогенактивированной протеин)киназы использовали стандартную процедуру фармакологического исследования двухкомпонентного связывания,при которой измеряют фосфорилирование серин/треонинового остатка в подходящей последовательности в субстрате в присутствии или в отсутствие предполагаемого ингибитора. Первоначально использовали рекомбинантный человеческий МЕК 1 (МАРКК) для активации рекомбинантного человеческого ERK2 (МАРК), и активированный МАРК (ERK) инкубировали с субстратом (МВР пептид или МYС пептид) в присутствии АТФ, Mg+2, и меченой изотопом 33 Р АТФ. Фосфорилированный пептид собирали на Р 81 фосфоцеллюлозном фильтре (бумажный фильтр или встроенный в микротитровочный планшет) промывали и обсчитывали сцинтилляционными методами. 39 Пептидные субстраты, использованные в анализе, представляли собой МВР, пептидный субстрат (APRTPGGRR) или синтетический Мус субстрат (KKFELLPTPPLSPSRR5 ТФУК). Использованные рекомбинантные ферменты получали как белки GST слияния человеческогоERK 2 и человеческого МЕК 1. Образцы ингибитора получали в виде 10 Х исходных растворов в 10% ДМСО и использовали подходящую аликвоту для достижения либо 10 мкг/мл в случае скриннинговой дозы для получения отдельной точки, либо конечной концентрации 100,10, 1 и 0,1 мкМ для кривой доза-ответная реакция. Конечные концентрации ДМСО составляли 1% или менее. Реакцию осуществляли в 50 мМ Трис киназном буфере, рН 7,4 в реакционном объеме 50 мкл следующим образом. Подходящий объем киназного буфера и образец ингибитора добавляли в пробирку. Проводили подходящее разбавление фермента для получения 2-5 мкг рекомбинантного МАРК (Erk) на пробирку. Ингибитор инкубировали с МАРК (Erk) в течение 30 мин при 0 С. Добавляли рекомбинантный Mek(MAPKK) (0,5-2,5 мкг) или полностью активированный Mek (0,05-0,1 единиц) для активацииErk и инкубировали в течение 30 мин при 30 С. Затем добавляли субстрат и гамма 33 Р АТФ для получения конечной концентрации 0,5-1 мМ МBРР или 250-500 мкМ Мyс; 0,2-0,5 мкKи гамма Р 33 АТФ/пробирку; конечная концентрация 50 мкМ АТФ. Образцы инкубировали при 30 С в течение 30 мин и реакцию останавливали, добавляя 25 мкл охлажденной льдом 10% ТХК(трихлоруксусная кислота). Затем образцы охлаждали на льду в течение 30 мин, 20 мкл образца переносили на Р 81 фосфоцеллюлозный бумажный фильтр или подходящий микротитровочный планшет со встроенным Р 81 фильтром. Бумажные фильтры или микротитровочные планшеты промывали 2 раза большим объемом 1% уксусной кислоты, затем 2 раза водой. Фильтры или микротитровочные планшеты непродолжительное время сушили на воздухе перед добавлением сцинтиллянта и образцы считывали с использованием подходящего сцинтилляционного счетчика, предназначенного для считывания 33 Р изотопа. Образцы включали положительный контроль (активированный фермент плюс субстрат); контроль в отсутствие фермента, контроль в отсутствие субстрата; образцы с различными концентрациями предполагаемого ингибитора и образцы со ссылочными ингибиторами (другие активные соединения или неспецифические ингибиторы, такие как стауроспорин или K252 В). Предварительные данные выражали в виде числа импульсов в минуту (срм). Повторы образцов усредняли и вводили поправку на фоновое число. Средние данные числа импульсов в минуту сводили в таблицу по группам и % ингибирования для тестируемого соединения рас 004427 40 считывали как значение (скорректированный контроль числа импульсов в минуту скорректированное число числа импульсов в минуту для образца/контроль)х 100=% ингибирования. Если тестировали несколько концентраций ингибитора, то значения IC50 (концентрация, дающая 50% ингибирования) определяли графически из кривой доза-ответная реакция для % ингибирования или с помощью подходящей компьютерной программы. Результаты, полученные для представителей соединений по данному изобретению, представлены в табл. 2, где может быть несколько отдельных значений для одного и того же соединения; это свидетельствует о том,что соединение тестировали более 1 раза. Таблица 2 Ингибирование киназа-инсерционный доменсодержащего рецептора (KDR), киназы эпителиальных клеток (Eck) и митогенактивированной протеинкиназы (Mek-Erk) При- VEGFEck Mek и Erk еrВ 2 % инг. мер мкМ мкМ мкМ 2 мкг/мл 72 41,724 100 96 74 42,982 100 95 75 37,284 100 76 40,617 100 96 77 42,162 100 105 78 21,269 40 53 79 38,610 80 82 1,8315 1,832 30 85 21,584 10 87 4 1,8 1,8 Ингибирование роста раковых клеток, измеренное по числу клеток. Линии человеческих опухолевых клеток наносили на 96-луночные планшеты (250 мкл/лунку,1-6 х 104 клеток/мл) в среде RPMI 1640,содержащей 5% FBS (фетальной бычьей сыворотки). Через 24 ч после нанесения добавляли тестируемые соединения в диапазоне пяти логарифмических концентраций (0,01-100 мг/мл) или для более сильных ингибиторов в более низких концентрациях. Через 48 ч воздействия тестируемых соединений клетки фиксировали трихлоруксусной кислотой и окрашивали сульфородамином В. После промывания трихлоруксусной кислотой связанный краситель солюбилизировали в 10 мM Трис-основания и определяли оптическую плотность с использованием планшетного ридера. В условиях анализа оптическая плотность пропорциональна числу клеток в лунке. IC50 (концентрации, вызывающие 50% ингибирования роста клеток) определяли из графиков ингибирования роста. Методика тестирования описана подробно(1990). Полученные данные приведены ниже в табл. 3. Информацию о некоторых клеточных линиях, использованных в данной методике тести 41 рования, можно получить в Американской коллекции тканевых культур (American Type TissueEdition. Таблица 3 Ингибирование роста раковых клеток,измеренное по числу клеток (IC50 мкг/мл) Пример MDAMB435 SW620 85 27,6 17,98 75 0,2 0,5 74 3,9 0,6 72 3,5 0,4 77 0,1 0,1 79 0,3 0,1 76 0,284 0,239 78 3,194 5 91 1,83 1,73 89 2,07 1,53 90 1,74 1,24 92 3,32 2,51 Ингибирование in vivo роста человеческих эпидермоидных опухолей (А 431). В стандартной фармакологической методике тестирования in vivo использовали самок мышейBALB/c nu/nu (Charles River, Wilmington, MA). Клетки человеческой эпидермоидной карциномы А-431 (Американская коллекция тканевых культур,Rockville, Maryland CRL-155) выращивали in vitro,как описано выше. Блок из 5 х 106 клеток инъецировали мышам подкожно. Когда опухоли достигали массы между 100 и 150 мг, мышей произвольно распределяли на группы обработки (нулевой день). Мышей обрабатывали внутрибрюшинно (IP) или перорально (РО) 1 раз в день, в 1, 5 и 9 день или с 1 по 10 день после обработки одной из доз 80, 40 или 20 или 10 1 мг/кг/дозы оцениваемого соединения в 0,2% Klucel. Контрольные животные не получали лекарственного средства. Массу опухоли определяли каждые 7 дней [(длина х ширина 2)/2] в течение 28 дней после обработки. Относительный рост опухоли (средняя масса опухоли на 7, 14, 21 и 28 день деленная на среднюю массу опухоли в нулевой день) определяли для каждой группы обработки. % О/K (опухоль/контроль) определяли путем деления относительно роста опухоли в группе обработки на относительный рост опухоли в группе плацебо и умножения на 100. Соединение рассматривалось как активное, если обнаруживали, что % О/K существенно меньше 100%. Способность соединения примера 92 ингибировать рост человеческих эпидермоидных оппухолей (А 431) in vivo показана ниже в табл. 4. Таблица 4 Ингибирование соединением примера 92 in vivo роста человеческих эпидермоидных опухолей (А 431) на мышах аd) Статистический анализ (t-тест Стьюдента) для логарифма относительного роста опухоли. Указывает (р 0,01) на статистически значимое снижение относительного роста опухоли в группе обработки по сравнению с контрольной плацебо-группойe) S/Т=число оставшихся в живых/число обработанных в день+28 после обработки опухоли Как показывают результаты в табл. 4, соединение примера 92 является эффективным ингибитором роста опухоли in vivo, при пероральном введении в дозе 40 мг/кг. Способность соединения примера 89 ингибировать рост человеческих эпидермоидных опухолей (А 431) in vivo показана ниже в табл. 5. Таблица 5 Ингибирование соединением примера 89 in vivo роста человеческих эпидермоидных опухолейd) Статистический анализ (t-тест Стьюдента) для логарифма относительного роста опухоли. Указывает (р 0,01) на статистически значимое снижение относительного роста опухоли в группе обработки по сравнению с контрольной плацебо-группойe) S/T=число оставшихся в живых/число обработанных в день+28 после обработки опухоли Как показывают результаты в табл. 5, соединение примера 89 является эффективным ингибитором роста опухоли in vivo, при пероральном введении в дозе 40 и 10 мг/кг. 43 На основании результатов, полученных для представителей соединений данного изобретения, соединения данного изобретения являются противоопухолевыми агентами, которые полезны для лечения, ингибирования роста или удаления новообразований (опухолей). В частности, соединения данного изобретения полезны для лечения, ингибирования роста или удаления опухолей, которые экспрессируют EGFR,таких как опухоли молочной железы, почки,мочевого пузыря, ротовой полости, гортани,пищевода, желудка, прямой кишки, яичника или легкого. Кроме того, соединения данного изобретения являются полезными для лечения, ингибирования роста или удаления опухолей молочной железы, которые экспрессируют рецепторный белок, продуцируемый еrbВ 2 (Неr2) онкогеном. На основании полученных результатов соединения данного изобретения также могут использоваться при лечении поликистозного заболевания почек. Соединения данного изобретения могут вводиться в состав рецептуры неразбавленными или их можно комбинировать для введения с одним или несколькими фармацевтически приемлемыми носителями. Например, с растворителями, разбавителями и тому подобным, их можно вводить перорально в таких формах как таблетки, капсулы, диспергируемые порошки,гранулы или суспензии, содержащие, например,от примерно 0,05 до 5% суспендирующего агента, сиропы, содержащие, например, от примерно 10 до 50% сахара, и эликсиры, содержащие, например, от примерно 10 до 50% сахара, и эликсиры, содержащие, например, от примерно 20 до 50% этанола и тому подобного, или парентерально в форме стерильного инъекционного раствора или суспензии, содержащей от примерно 0,05 до 5% суспендирующего агента в изотонической среде. Такие фармацевтические препаративные формы могут содержать, например, от примерно 0,05 вплоть до примерно 90% активного ингредиента в сочетании с носителем, более типично от 5 до 60% по весу. Эффективная дозировка используемого активного ингредиента может изменяться в зависимости от конкретного используемого соединения, способа введения и степени тяжести болезненного состояния, подвергаемого лечению. Однако обычно удовлетворительные результаты получают, когда соединения изобретения вводят в суточной дозе от примерно 0,5 до примерно 1000 мг/кг веса тела, необязательно применяемой в виде раздельных доз от 2 до 4 раз в день,или в виде формы замедленного высвобождения. Предполагаемая суммарная дневная доза будет составлять от примерно 1 до 1000 мг,предпочтительно от примерно 2 до 500 мг. Препаративные лекарственные формы, подходящие для внутреннего употребления, включают от примерно 0,5 до 1000 мг активного соединения в гомогенной смеси с твердым или жидким 44 фармацевтически приемлемым носителем. Данный режим дозировки может быть отрегулирован для обеспечения оптимального терапевтического ответа. Например, несколько отдельных доз могут вводиться ежедневно, или доза может быть пропорционально снижена по показаниям острой необходимости терапевтической ситуации. Соединения данного изобретения могут вводиться перорально, а также с использованием внутривенного, внутримышечного или подкожного путей введения. Твердые носители включают крахмал, лактозу, дикальцийфосфат,микрокристаллическую целлюлозу, сахарозу и каолин, тогда как жидкие носители включают стерильную воду, полиэтиленгликоли, неионные поверхностно-активные вещества и пищевые масла, такие как кукурузное, арахисовое и кунжутное масло, по мере соответствия природе активного ингредиента и конкретной желаемой форме введения. Благоприятным образом могут быть включены обычно применяемые при получении фармацевтических композиций вспомогательные добавки, такие как вкусовые агенты,красители, консерванты и антиоксиданты, например, витамин Е, аскорбиновая кислота, ВНТ и ВНА. Предпочтительными фармацевтическими композициями с позиции легкости получения и введения являются твердые композиции, в частности таблетки и твердые или мягкие желатиновые капсулы. Пероральное введение соединений является предпочтительным. В некоторых случаях может оказаться желательным вводить соединения непосредственно в дыхательные пути в форме аэрозоля. Соединения данного изобретения также можно вводить парентерально или внутрибрюшинно. Растворы или суспензии данных активных соединений в виде свободного основания или фармакологически приемлемой соли могут быть получены в воде, смешанной подходящим образом с поверхностно-активным веществом,таким как гидроксипропилцеллюлоза. Также могут быть получены дисперсии в глицерине,жидких полиэтиленгликолях и их смеси в маслах. В обычных условиях хранения и применения данные препаративные лекарственные формы содержат консервант для предотвращения роста микроорганизмов. Фармацевтические формы, подходящие для применения в виде инъекций, включают стерильные водные растворы или дисперсии и стерильные порошки для непосредственного получения стерильных инъекционных растворов или дисперсий. Во всех случаях форма должна быть стерильной и должна быть жидкой в такой степени, чтобы существовала возможность легкого введения с помощью шприца. Она должна быть стабильной в условиях производства и хранения и должна быть защищена от загрязняющего действия микроорганизмов, та 45 ких как бактерии и грибки. Носитель может быть растворителем или дисперсионной средой,содержащей, например, воду, этанол, многоатомный спирт (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль), их подходящие смеси и растительные масла. При лечении рака соединения данного изобретения можно вводить в сочетании с другими противоопухолевыми веществами или с лучевой терапией. Эти другие вещества и радиационное лечение могут назначаться в то же самое время или в другое время, нежели, чем соединения данного изобретения. Такая комбинированная терапия может создавать синергизм и приводить к повышенной эффективности. Например, соединения данного изобретения можно использовать в сочетании с митотическими ингибиторами, такими как таксол или винбластин, алкилирующими агентами, такими как цисплатин или циклофосамид, антиметаболитами, такими как 5-фторурацил или гидроксимочевина, интеркаляторами ДНК, такими как адриамицин или блеомицин, ингибиторами топоизомеразы, такими как этопозид или кампотецин,антиангиогенными агентами, такими как ангиостатин, и антиэстрогенами, такими как тамоксифен. Получение представительных примеров соединений данного изобретения описано ниже. Пример 1. 1,4-Дигидро-7-метокси-4-оксохинолин-3-карбонитрил. Смесь 30,2 г (245,2 ммоль) 3-метоксианилина и 41,5 г (245,2 ммоль) этил(этоксиметилен)цианоацетата нагревали в отсутствие растворителя при 140 С в течение 30 мин. К полученному маслу добавляли 1200 млDowtherm. Раствор при перемешивании нагревали при кипении с обратным холодильником в атмосфере азота в течение 22 ч. Смесь охлаждали до комнатной температуры, твердое вещество собирали и промывали гексанами. Твердый продукт перекристаллизовывали из уксусной кислоты, получая 17 г 1,4-дигидро-7-метокси-4 оксохинолин-3-карбонитрила: масс-спектр(электрораспыление, m/е): М+Н 200,9. Пример 2. 1,4-Дигидро-7-метокси-6-нитро 4-оксохинолин-3-карбонитрил. К суспензии 10 г (49,6 ммоль) 1,4-дигидро 7-метокси-4-оксохинолин-3-карбонитрила в 160 мл трифторуксусного ангидрида добавляли в течение 3 ч 6 г (74,9 ммоль) нитрата аммония. Смесь перемешивали еще в течение 2 ч. Избыток ангидрида удаляли при пониженном давлении при 45 С. Остаток перемешивали с 500 мл воды. Твердое вещество собирали и промывали водой. Твердое вещество растворяли в 1000 мл кипящей уксусной кислоты и раствор обрабатывали обесцвечивающим активированным углем. Смесь фильтровали и концентрировали до объема 300 мл. При охлаждении получали твердое вещество, которое собирали, получая 5,4 г 1,4 дигидро-7-метокси-6-нитро-4-оксохинолин-3 004427 46 карбонитрила в виде коричневого твердого вещества: масс-спектр (электрораспыление, m/е): М+Н 246. Пример 3. 4-Хлор-7-метокси-6-нитрохинолин-3-карбонитрил. Смесь 5,3 г (21,6 ммоль) 1,4-дигидро-7 метокси-6-нитро-4-оксохинолин-3-карбонитрила и 9 г (43,2 ммоль) пентахлорида фосфора нагревали при 165 С в течение 2 ч. Смесь разбавляли гексанами и твердое вещество собирали. Твердое вещество растворяли в 700 мл этилацетата и промывали холодным разбавленным раствором гидроксида натрия. Раствор сушили над сульфатом магния и фильтровали через слой силикагеля, получая 5,2 г 4-хлор-7 метокси-6-нитрохинолин-3-карбонитрила в виде коричневато-золотистого твердого вещества. Пример 4. 4-[(3-Бромфенил)амино]-7-метокси-6-нитрохинолин-3-карбонитрил. Раствор 5,2 г (19,7 ммоль) 4-хлор-7-метокси-6-нитрохинолин-3-карбонитрила и 3,7 г(21,7 ммоль) 3-броманилина в 130 мл метоксиэтанола нагревали при кипении с обратным холодильником в атмосфере азота в течение 4 ч. Реакционную смесь выливали в разбавленный раствор бикарбоната натрия. Собирали твердое вещество, промывали водой и сушили на воздухе. Твердое вещество хроматографировали на силикагеле, элюируя смесью хлороформэтилацетат 9:1. Из фракций продукта удаляли растворитель, получая 1,2 г 4-[(3-бромфенил) амино]-7-метокси-6-нитрохинолин-3-карбонитрила в виде желтого твердого вещества: массспектр (электрораспыление, m/е): М+Н 399,0,402,0. Пример 5. 6-Aмино-4-[(3-бромфенил)амино]-7-метоксихинолин-3-карбонитрил. Смесь 2,05 г (5,1 ммоль) 4-[(3-бромфенил)амино]-7-метокси-6-нитрохинолин-3-карбонитрила, 1,37 г (25,7 ммоль) хлорида аммония и 0,86 г (15,4 ммоль) порошка железа перемешивали при кипении с обратным холодильником в 26 мл воды и 26 мл метанола в течение 2 ч. Смесь разбавляли этилацетатом и горячую смесь фильтровали. Органический слой отделяли от фильтрата и сушили над сульфатом магния. Растворитель удаляли и остаток хроматографировали на силикагеле, элюируя смесью хлороформа и этилацетата. Фракции, содержащие продукт, объединяли, получая 1,3 г 6 амино-4-[(3-бромфенил)амино]-7-метоксихинолин-3-карбонитрила в виде желтого твердого вещества: масс-спектр (электрораспыление,m/е): М+Н 369,1, 371,1. Пример 6. Этиловый эфир 2-циано-3-(4 нитрофениламино)акриловой кислоты. В колбе механически перемешивали 4 нитроанилин (60,0 г, 0,435 моль) и этил(этоксиметилен)цианоацетат (73,5 г, 0,435 моль). Смесь нагревали при 100 С в течение 0,5 ч после расплавления и повторного отверждения. Порцию сырого продукта в 114 г перекристаллизовывали 47 из диметилформамида, получая 44,2 г желтых кристаллов; т.пл. 227-228,5 С. Пример 7. 1,4-Дигидрохинолин-6-нитро-4 оксо-3-карбонитрил. Суспензию 25,0 г (95,8 ммоль) этилового эфира 2-циано-3-(4-нитрофениламино)акриловой кислоты в 1,0 л Dowtherm A нагревали при 260 С в атмосфере N2 в течение 12,5 ч. Охлажденную реакционную смесь выливали в 1,5 л гексана. Продукт собирали, промывали гексаном и горячим этанолом и сушили в вакууме. Таким образом получали 18,7 г коричневого твердого вещества. Аналитически чистый образец получали перекристаллизацией из смеси диметилформамид/этанол: масс-спектр (электрораспыление, m/е): М+Н 216. Пример 8. 4-Xлор-6-нитрохинолин-3-карбонитрил. Смесь 31,3 г (0,147 моль) 6-нитро-4-оксо 1,4-дигидрохинолин-3-карбонитрил и 160 мл оксихлорида фосфора нагревали при кипении с обратным холодильником в течение 5,5 ч. Оксихлорид фосфора удаляли в вакууме, остаток выливали на лед и нейтрализовали бикарбонатом натрия. Продукт собирали, промывали водой и сушили в вакууме (50 С). Таким образом получали 33,5 г твердого вещества рыжеватокоричневого цвета; твердое вещество: массспектр (электрораспыление, m/е): М+Н 234. Пример 9. 4-[(3-Бромфенил)амино]-6-нитрохинолин-3-карбонитрил. Смесь 17,0 г (73,1 ммоль) 4-хлор-6-нитрохинолин-3-карбонитрила и 15,1 г (87,7 ммоль) 3 броманилина в 425 мл этанола нагревали при кипении с обратным холодильником в течение 5 ч. Добавляли насыщенный раствор бикарбоната натрия, а затем все летучие вещества удаляли в вакууме. Остаток суспендировали в гексане,продукт собирали и промывали гексаном. Неочищенный (сырой) продукт промывали водой и сушили в вакууме (60 С). При этом получали 22,5 г желтого твердого вещества. Аналитически чистый образец получали перекристаллизацией из этилацетата; т.пл. 258-259 С. Пример 10. 6-Амино-4-[(3-бромфенил)амино]хинолин-3-карбонитрил. Смесь 4,00 г (10,8 ммоль) 4-[(3-бромфенил)амино]-6-нитрохинолин-3-карбонитрила и 12,2 г (54,2 ммоль) дигидрата SnCl2 в 160 мл этанола нагревали при кипении с обратным холодильником в атмосфере N2 в течение 1,3 ч. После охлаждения до 25 С, добавляли ледяную воду и бикарбонат натрия и смесь перемешивали в течение 2 ч. После экстракции хлороформом, обработки Darco, сушки (сульфат магния) и удаления растворителя получали 3,9 г коричневых кристаллов: масс-спектр (электрораспыление, m/е): М+Н 339. Пример 11. 4-[(3,4-Дибромфенил)амино]6-нитрохинолин-3-карбонитрил. Смесь 6,20 г (26,6 ммоль) 4-хлор-6-нитрохинолин-3-карбонитрила и 8,00 г (31,9 ммоль) 48 3,4-диброманилина в 160 мл этанола нагревали при кипении с обратным холодильником в атмосфере N2 в течение 5 ч. Добавляли насыщенный раствор бикарбоната натрия, и летучие вещества удаляли. Остаток суспендировали в гексане, собирали, промывали гексаном и водой и сушили. Нерастворившее вещество повторно экстрагировали кипящим этилацетатом и затем раствор фильтровали через силикагель. Растворитель удаляли, получая 3,80 г зеленого твердого вещества: масс-спектр (электрораспыление,m/е): М+Н 449. Пример 12. 6-Амино-4-[(3,4-дибромфенил) амино]хинолин-3-карбонитрил. Смесь 4,90 г (10,9 ммоль) 4-[(3,4-дибромфенил)амино]-6-нитрохинолин-3-карбонитрила и 12,4 г (54,7 ммоль) дигидрата SnCl2 в 200 мл этанола нагревали при кипении с обратным холодильником в атмосфере N2 в течение 1,5 ч. После охлаждения до 25 С, реакционную смесь разбавляли ледяной водой, нейтрализовали бикарбонатом натрия и перемешивали в течение 2 ч. Затем этот раствор экстрагировали хлороформом, обрабатывали Darco, сушили (сульфат магния) и упаривали. После сушки в вакууме(40 С), получали 1,25 г коричневого твердого вещества: масс-спектр (электрораспыление,m/е): М+Н 417, 419, 421. Пример 13. 6-Нитро-4-[(3-трифторметилфенил)амино]хинолин-3-карбонитрил. Смесь 10,6 г (45,7 ммоль) 4-хлор-6 нитрохинолин-3-карбонитрила и 8,82 г (54,8 ммоль) 3-(трифторметил)анилина в 270 мл этанола нагревали при кипении с обратным холодильником в атмосфере N2 в течение 5 ч. Реакционную смесь разбавляли этанолом, нейтрализовали насыщенным раствором бикарбоната натрия и упаривали. Остаток суспендировали в гексане, собирали, промывали гексаном и водой и сушили в вакууме (60 С), получая 10,9 г желтого твердого вещества. Образец массой 2,00 г перекристаллизовывали из этанола, получая 1,20 г ярко-желтого твердого вещества; т.пл. 260-261 С. Пример 14. 6-Aмино-4-[(3-трифторметилфенил)амино]хинолин-3-карбонитрил. Суспензию 6,00 г (16,8 ммоль) 6-нитро-4[(3-трифторметилфенил)амино]хинолин-3-карбонитрила и 18,9 г (83,3 ммоль) дигидрата SnCl2 в 240 мл этанола нагревали при кипении с обратным холодильником в атмосфере N2 в течение 1 ч. После охлаждения до 25 С, реакционную смесь разбавляли ледяной водой, нейтрализовали бикарбонатом натрия и перемешивали в течение 2 ч. Продукт экстрагировали хлороформом, обрабатывали Darco, сушили (сульфат магния) и упаривали. Остаток фильтровали через силикагель (10% метанол в хлороформе),упаривали и сушили в вакууме (40 С), получая 4,87 г коричневого твердого вещества: массспектр (электрораспыление, m/е): М+Н 329.Soc., 52, 3167, 1930) в 15 мл дихлорметана обрабатывали 1,74 мл (0,02 моль) оксалилхлорида и 1 каплей N,N-диметилформамида. Через час растворители удаляли с использованием роторного испарителя. 4-Бромкротонилхлорид переносили в 25 мл тетрагидрофурана и добавляли по каплям 3,39 г 6-амино-4-(3-бромфениламино)-хинолин-3-карбонитрила в 25 мл тетрагидрофурана. После этого добавляли по каплям 1,92 мл (0,011 моль) диизопропилэтиламина. После добавления 25 мл воды и 50 мл этилацетата, слои разделяли. Органический слой сушили над безводным сульфатом натрия и доводили до твердого вещества в вакууме. Этот твердый продукт нагревали в течение часа в кипящем этилацетате, затем еще горячим фильтровали из этилацетата. Таким образом получали 3,31 г(68%) [4-(3-бромфениламино)-3-цианохинолин 6-ил]амид 4-бром-бут-2-еновой кислоты. Пример 16. Этиловый эфир 2-циано-3-(2 метил-4-нитрофенил)акриловой кислоты. Смесь 2-метил-4-нитроанилина (38,0 г, 250 ммоль), этил(этоксиметилен)цианоацетата (50,8 г, 300 ммоль) и 200 мл толуола нагревали при кипении с обратным холодильником в течение 24 ч, охлаждали, разбавляли смесью 1:1 диэтиловый эфир-гексан и фильтровали. Полученное белое твердое вещество промывали смесью гексан-диэтиловый эфир и сушили, получая 63,9 г,т.пл. 180-210 С. Пример 17. 1,4-Дигидрохинолин-8-метил 6-нитро-3-карбонитрил. Перемешиваемую смесь 64 г (230 ммоль) этилового эфира 2-циано-3-(2-метил-4-нитрофенил)акриловой кислоты и 1,5 л Dowtherm А нагревали при 260 С в течение 12 ч, охлаждали,разбавляли гексаном и фильтровали. Полученное таким образом серое твердое вещество промывали гексаном и сушили, получая 51,5 г, т.пл. 295-305 С. Пример 18. 4-Хлор-8-метил-6-нитрохинолин-3-карбонитрил. Перемешиваемую смесь 1,4-дигидрохинолин-8-метил-6-нитро-3-карбонитрила (47 г,200 ммоль) и 200 мл оксихлорида фосфора нагревали при кипении с обратным холодильником в течение 4 ч. Оксихлорид фосфора удаляли в вакууме, остаток перемешивали с хлористым метиленом при 0 С и обрабатывали суспензией льда и карбоната натрия. Органический слой отделяли и промывали водой. Раствор сушили и концентрировали до объема 700 мл. Продукт высаживали в осадок путем добавления гексана и охлаждения до 0 С. Белое твердое вещество отфильтровывали и сушили, получая 41,6 г,т.пл. 210-212 С. 50 Пример 19. 4-[(3-Бромфенил)амино]-8-метил-6-нитрохинолин-3-карбонитрил. Перемешиваемую смесь 4-хлор-8-метил-6 нитрохинолин-3-карбонитрила (14,8 г, 60 ммоль), 3-броманилина (12,4 г, 72 ммоль), гидрохлорида пиридина (6,93 г, 60 ммоль) и 180 мл этоксиэтанола нагревали при кипении с обратным холодильником в течение 1,5 ч, охлаждали,выливали в перемешиваемую смесь воды и количества карбоната натрия, необходимого для достижения рН 8-9. Полученное твердое желтое вещество отфильтровывали, промывали водой,сушили, нагревали в кипящем диэтиловом эфире, фильтровали и сушили, получая 22,6 г, т.пл. 263-267 С. Пример 20. 4-[(3-Бромфенил)-N-ацетиламино]-8-метил-6-нитрохинолин-3-карбонитрил. Перемешиваемую смесь 4-[(3-бромфенил) амино]-8-метил-6-нитрохинолин-3-карбонитрила (15,3 г, 40 ммоль), 0,37 г (3 ммоль) диметиламинопиридина, 40 мл уксусного ангидрида и 80 мл пиридина нагревали при кипении с обратным холодильником в течение 3 ч и концентрировали при 50 С в вакууме. Остаток перемешивали с хлористым метиленом и 0,1 н. НСl. После фильтрования через целит, органический слой промывали водой, сушили и концентрировали. Остаток хроматографировали на силикагеле с использованием 1%-ной уксусной кислоты в хлористом метилене, получая 11,2 г янтарного стекла, ЯМР (CDCl3) d 2,29 (N-ацетильная группа). Пример 21. 8-Бромметил-4-[(3-бромфенил)-N-ацетиламино]-6-нитрохинолин-3-карбонитрил. Перемешиваемую смесь 4-[(3-бромфенил)N-ацетиламино]-8-метил-6-нитрохинолин-3 карбонитрила (10,6 г, 25 ммоль), Nбромсукцинимида (6,68 г, 37,5 ммоль), 0,30 г дибензоилпероксида и 200 мл четыреххлористого углерода нагревали при кипении с обратным холодильником в течение 2 ч, обрабатывали дополнительно 0,30 г дибензоилпероксида и нагревали при кипении с обратным холодильником еще в течение 2,5 ч, охлаждали, разбавляли хлористым метиленом и перемешивали с водным раствором бисульфита натрия. Органический слой отделяли и промывали последовательно водой, раствором бикарбоната натрия и водой. Раствор сушили и упаривали, получая 15 г белого вспененного вещества. ЯМР (СDСl3) d 5,19 (дд, CH2Br). Пример 22. 4-[(3-Бромфенил)амино]-8-диметиламинометил-6-нитрохинолин-3-карбонитрил. К перемешиваемому раствору диметиламина в ТГФ (2,0 М; 115 мл; 230 ммоль) при 0 С добавляли в течение 15 мин раствор 8 бромметил-4-[(3-бромфенил)-N-ацетиламино]6-нитрохинолин-3-карбонитрила (11,6 г, 23 ммоль) в 115 мл ТГФ. После нагрева до 25 С 51 смесь перемешивали в течение 2 ч. ТГФ упаривали, а остаток нагревали при кипении с обратным холодильником в 230 мл метанола с 12,7 г(92 ммоль) карбоната калия в течение 1 ч. Смесь охлаждали, насыщали CO2 и концентрировали. Остаток распределяли между хлористым метиленом и водой. Органический слой промывали водой, сушили и концентрировали. Остаток хроматографировали на силикагеле с использованием смеси хлористый метилен-этилацетатметанол-триэтиламин, получая 6,0 г желтого твердого вещества, т.пл. 223-226 С. Пример 23. 6-Амино-4-[(3-бромфенил) амино]-8-диметиламинометилхинолин-3-карбонитрил. Перемешиваемую смесь 4-[(3-бромфенил)амино]-8-диметиламинометил-6-нитрохинолин-3-карбонитрила (5,98 г, 14,1 ммоль), порошка железа (2,76 г, 49 мг-атомов), уксусной кислоты (5,67 мл, 99 ммоль) и 70 мл метанола нагревали при кипении с обратным холодильником в течение 2 ч, а затем упаривали для удаления метанола. Остаток перемешивали с водой в течение 10 мин, оранжевое твердое вещество отфильтровывали и промывали 2%-ной уксусной кислотой. Объединенный фильтрат подщелачивали до рН 10 5 н. гидроксидом натрия. Полученный осадок экстрагировали хлористым метиленом. Экстракт промывали водой, сушили и концентрировали. Остаток хроматографировали на силикагеле с использованием смеси этилацетат-метанол-триэтиламин, получая 3,34 г твердого вещества янтарного цвета; массспектр (электрораспыление, m/e) M+H 396,2,398,1. Пример 24. 6-Aмино-4-[(3-иодфенил)амино]хинолин-3-карбонитрил. Смесь 6,70 г (16,1 ммоль) 4-[(3-иодфенил) амино]-6-нитрохинолин-3-карбонитрила, 300 мл этанола и 18,2 г (80,5 ммоль) дигидрата SnCl2 нагревали при кипении с обратным холодильником в атмосфере N2. Нагрев убирали через 2 ч, добавляли ледяную воду. Добавляли бикарбонат натрия до щелочного рН, при этом образовывались густая желтая смесь. Перемешивали в течение 2 1/2 ч. Экстрагировали хлороформом,перемешивали органическую часть с Darco и фильтровали через сульфат магния. Растворитель удаляли и сушили в вакууме, получая 3,48 г желто-коричневого твердого вещества: массспектр (электрораспыление, m/е): М+Н=387,0. Пример 25. 4-[(3-Иодфенил)амино]-6 нитрохинолин-3-карбонитрил. Смесь 3,10 мл (25,7 ммоль) 3-иоданилина,200 мл этанола и 5,00 г (21,4 ммоль) 4-хлор-6 нитрохинолин-3-карбонитрила нагревали при кипении с обратным холодильником в атмосфере N2 в течение 3 1/2 ч. Смесь охлаждали и доводили до щелочной реакции с использованием насыщенного раствора бикарбоната натрия. Растворители удаляли и осуществляли азеотропную отгонку с этанолом. Остаток суспен 004427 52 дировали в гексане и собирали. Сушили на воздухе, промывали твердое вещество водой и сушили в вакууме. Твердые вещества растворяли в 400 мл этилацетата, перемешивали с Darco,фильтровали и удаляли растворитель. Твердое вещество сушили, получая 7,38 г желтого твердого вещества: масс-спектр (электрораспыление, m/е): М+Н=417,0. Пример 26. 6-Амино-4-[(3-метилфенил) амино]хинолин-3-карбонитрил. В круглодонную колбу загружали 253 мг 10% палладия-на-угле в атмосфере N2 и заливали катализатор 140 мл этанола. Добавляли туда 2,49 г (8,18 ммоль) 6-нитро-4-[(3-метилфенил) амино]хинолин-3-карбонитрила и 640 мкл (20,4 ммоль) безводного гидразина. Смесь нагревали при кипении с обратным холодильником в течение 2 ч 15 мин и фильтровали горячим через целит. Удаляли растворитель и сушили в вакууме, получая 2,455 г желтого твердого вещества: масс-спектр(электрораспыление,m/е): М+Н=275,2. Пример 27. 6-Нитро-4-[(3-метилфенил) амино]хинолин-3-карбонитрил. Смесь 5,00 г (21,5 ммоль) 4-хлор-6 нитрохинолин-3-карбонитрила, 200 мл этанола и 2,75 мл (25,7 ммоль) 3-толуидина нагревали при кипении с обратным холодильником в течение 4 1/2 ч. Охлаждали и добавляли насыщенный раствор бикарбоната натрия до получения щелочного значения рН. Растворители удаляли и осуществляли азеотропную отгонку с этанолом. Суспендировали в гексане, собирали и сушили на воздухе. Промывали водой и сушили в вакууме. Кипятили в этилацетате, перемешивали с Darco и фильтровали. Удаляли растворитель и сушили в вакууме, получая 4,82 г желтооранжевого твердого вещества: масс-спектрSnCl2 нагревали при кипении с обратным холодильником в атмосфере N2. Нагрев убирали через 2 1/2 ч, добавляли ледяную воду и подщелачивали бикарбонатом натрия. Перемешивали в течение 2 ч и экстрагировали хлороформом. Органический слой сушили сульфатом натрия,фильтровали, удаляли растворитель и сушили остаток в вакууме, получая 5,74 г желтокоричневого твердого вещества: масс-спектр(электрораспыление, m/е): М+Н=295,1, 297,1. Пример 29. 4-[(3-Xлорфенил)амино]-6 нитрохинолин-3-карбонитрил. Смесь 10,0 г (42,9 ммоль) 4-хлор-6-нитрохинолин-3-карбонитрила, 260 мл этанола и 5,40 мл 3-хлоранилина нагревали при кипении с обратным холодильником в атмосфере N2. Удаляли нагрев через 4 ч, охлаждали до 25 С и добавляли насыщенный раствор бикарбоната натрия 53 до достижения щелочного значения рН. Растворители удаляли и осуществляли азеотропную отгонку с этанолом. Суспендировали остаток гексаном, собирали твердое вещество и сушили на воздухе. Твердые вещества промывали водой и сушили в вакууме. Растворяли в кипящем этилацетате, перемешивали с Darco и фильтровали. Удаляли растворитель и сушили остаток в вакууме, получая 6,5 г желтого твердого вещества: масс-спектр (электрораспыление, m/е): М+Н=325,0, 327,0. Пример 30. 6-Амино-4-[(3-метоксифенил) амино]хинолин-3-карбонитрил. В круглодонную колбу загружали 325 мг 10% палладия-на-угле в атмосфере N2 и заливали катализатор 165 мл этанола. Добавляли туда 3,29 г (10,3 ммоль) 4-[(3-метоксифенил)амино]6-нитрохинолин-3-карбонитрила и 800 мкл безводного гидразина и нагревали смесь при кипении с обратным холодильником. Через 1 1/2 ч смесь фильтровали горячей через целит, удаляли растворитель и сушили в вакууме, получая 2,876 г желтого твердого вещества: масс-спектр(электрораспыление, m/е): М+Н=291,2. Пример 31. 4-[(3-Метоксифенил)амино]-6 нитрохинолин-3-карбонитрил. Смесь 5,00 г (21,5 ммоль) 4-хлор-6-нитрохинолин-3-карбонитрила, 200 мл этанола и 3,0 мл (26,0 ммоль) м-анизидина нагревали при кипении с обратным холодильником в атмосфереN2. Удаляли нагрев через 4 1/2 ч и подщелачивали с помощью насыщенного раствора бикарбоната натрия. Растворители удаляли и осуществляли азеотропную отгонку с этанолом. Суспендировали остаток гексаном и собирали кристаллы. Промывали водой, сушили в вакууме. Растворяли 5,94 г сырого продукта в 320 мл кипящего этилацетата, перемешивали с Darco,фильтровали, удаляли растворитель, и сушили в вакууме, получая примерно 5 г желтооранжевого твердого вещества: масс-спектр(электрораспыление, m/е): М+Н=291,1. Пример 32. 6-Aмино-4-[(3-хлор-4-фторфенил)амино]хинолин-3-карбонитрил. Смесь 5,360 г (15,6 ммоль) 4-[(3-хлор-4 фторфенил)амино]-6-нитрохинолин-3-карбонитрила, 250 мл этанола и 17,67 г (78,2 ммоль) дигидрата SnCl2 нагревали при кипении с обратным холодильником в атмосфере N2. Удаляли нагрев через 1 1/2 ч и добавляли ледяную воду. Подщелачивали бикарбонатом натрия. Перемешивали в течение 2 ч, экстрагировали хлороформом. Для облегчения разделения слоев в делительную воронку добавляли насыщенный солевой раствор. Перемешивали органический слой с Darco и сушили сульфатом натрия. Фильтровали, удаляли растворитель и сушили в вакууме, получая 4,460 г желто-коричневого твердого вещества: масс-спектр (электрораспыление, m/е): М+Н=312,9, 315,0. 54 Пример 33. 4-[(3-Xлор-4-фторфенил)амино]-6-нитрохинолин-3-карбонитрил. Смесь 5,00 г (21,5 ммоль) 4-хлор-6 нитрохинолин-3-карбонитрила, 200 мл этанола и 3,75 г (25,8 ммоль) 3-хлор-4-фторанилина нагревали при кипении с обратным холодильником в атмосфере N2. Удаляли нагрев через 3 1/2 ч и добавляли насыщенный раствор бикарбоната натрия до достижения щелочной реакции смеси. Удаляли растворители и осуществляли азетропную отгонку с этанолом. Суспендировали остаток гексаном, собирали твердые вещества, промывали водой и сушили в вакууме. Растворяли твердые вещества в 250 мл кипящего этилацетат, перемешивали с Darco и фильтровали. Удаляли растворитель и сушили в вакууме,получая 6,036 г желтого твердого вещества: масс-спектрSnCl2 нагревали при кипении с обратным холодильником в атмосфере N2. Удаляли нагрев через 4 ч и добавляли ледяную воду. Подщелачивали бикарбонатом натрия и перемешивали в течение 2 ч. Все еще щелочную смесь экстрагировали хлороформом, перемешивали органический слой с Darco и сушили сульфатом натрия. Фильтровали, удаляли растворитель и сушили в вакууме, получая 2,265 г коричнево-желтого твердого вещества: масс-спектр (электрораспыление, m/е): М+Н=339,0, 341,0. Пример 35. 4-[(4-Бромфенил)амино]-6 нитрохинолин-3-карбонитрил. Смесь 5,00 г (21,5 ммоль) 4-хлор-6-нитрохинолин-3-карбонитрила, 200 мл этанола и 4,42 г (25,8 ммоль) п-броманилина нагревали при кипении с обратным холодильником в атмосфере N2 в течение 3 ч. Нагрев убирали и добавляли насыщенный раствор бикарбоната натрия до щелочной реакции среды. Растворители удаляли и проводили азеотропную отгонку с этанолом. Остаток суспендировали с гексаном, собирали твердые продукты и сушили на воздухе. Промывали водой и сушили в вакууме. Кипятили в 1,4 л этилацетата и, не достигая полного растворения всех твердых веществ, перемешивали сSnCl2 нагревали при кипении с обратным холодильником в атмосфере N2. Нагрев убирали через 1 1/2 ч, добавляли ледяную воду и подщела 55 чивали бикарбонатом натрия. Перемешивали в течение 2 ч и экстрагировали хлороформом. Органический слой перемешивали с Darco, сушили сульфатом натрия и фильтровали. Удаляли растворитель и сушили в вакууме, получая 3,660 г желто-зеленого твердого вещества: массспектр (электрораспыление, m/е): М+Н=297,1. Пример 37. 4-[(3,4-Дифторфенил)амино]6-нитрохинолин-3-карбонитрил. Смесь 5,00 г (21,5 ммоль) 4-хлор-6-нитрохинолин-3-карбонитрила, 250 мл этанола и 2,55 мл (25,8 ммоль) 3,4-дифторанилина нагревали при кипении с обратным холодильником в атмосфере N2. Нагрев убирали через 3 1/2 ч и подщелачивали насыщенным раствором бикарбоната натрия. Удаляли растворители и проводили азеотропную отгонку с этанолом. Остаток суспендировали в гексане, собирали твердые продукты и сушили на воздухе. Промывали водой и сушили в вакууме. Растворяли в этилацетате, перемешивали с Darco, фильтровали, удаляли растворитель и сушили в вакууме, получая 5,02 г желтого твердого вещества: масс-спектр(электрораспыление, m/е): М+Н=327,1. Пример 38. 6-Амино-4-[(3-хлор-4-тиофеноксифенил)амино]хинолин-3-карбонитрил. Смесь 6,753 г (15,6 ммоль) 4-[(3-хлор-4 тиофеноксифенил)амино]-6-нитрохинолин-3 карбонитрила, 250 мл этанола и 17,66 г (78/0 ммоль) дигидрата SnCl2 нагревали при кипении с обратным холодильником в атмосфере N2. Нагрев удаляли через 2 ч, добавляли большой объем ледяной воды и подщелачивали бикарбонатом натрия. Перемешивали в течение 2 ч и все еще щелочную смесь экстрагировали хлороформом. Органический слой перемешивали сDarco, сушили сульфатом натрия, фильтровали,удаляли растворитель и сушили в вакууме, получая 5,996 г желто-коричневого твердого вещества: масс-спектр (электрораспыление, m/е): М+Н=403,1, 405,1. Пример 39. 4-[(3-Хлор-4-тиофеноксифенил)амино]-6-нитрохинолин-3-карбонитрил. Смесь 5,00 г (21,5 ммоль) 4-хлор-6-нитрохинолин-3-карбонитрила, 250 мл этанола и 6,07 г (25,6 ммоль) 3-хлор-4-тиофеноксианилина нагревали при кипении с обратным холодильником в атмосфере N2. Нагрев удаляли примерно через 8 ч, подщелачивали насыщенным раствором бикарбоната натрия, удаляли растворители и проводили азеотропную отгонку с этанолом. Остаток суспендировали с гексаном и собирали твердые вещества. Промывали водой и сушили в вакууме. Растворяли практически полностью в 400 мл этилацетата, перемешивали с Darco и фильтровали. Удаляли растворитель и кипятили в гексане для окончательного избытка анилина. Сушили в вакууме, получая 6,90 г красного твердого вещества: масс-спектр (электрораспыление, m/е): М+Н=433,1, 435,1. 56 Пример 40. 6-Амино-4-[(3-цианофенил) амино]хинолин-3-карбонитрил. В круглодонную колбу загружали 100 мг 10% палладия-наугле в атмосфере N2 и заливали 50 мл этанола. Добавляли туда 1,00 г (3,17 ммоль) 4-[(3 цианофенил)амино]-6-нитрохинолин-3-карбонитрила и 250 мкл (7,39 ммоль) безводного гидразина и нагревали при кипении с обратным холодильником. Удаляли нагрев через 2 ч и фильтровали горячую реакционную смесь через целит. Растворитель удаляли и сушили в вакууме, получая 887 мг желтого твердого вещества: масс-спектр(21,5 ммоль) 4-хлор-6-нитрохинолин-3-карбонитрила, 200 мл этанола и 3,04 г (25,8 ммоль) 3 аминобензонитрила нагревали при кипении с обратным холодильником. Нагрев убирали через 3 1,2 ч и подщелачивали смесь насыщенным раствором бикарбоната натрия. Растворители удаляли и сушили на воздухе. Остаток суспендировали в гексане и собирали твердое вещество. Промывали водой и сушили в вакууме. Кипятили в большом объеме этилацетата, собирали твердое вещество и сушили в вакууме, получая 5,15 г желто-коричневого твердого вещества: масс-спектр (электрораспыление, m/е): 316,0. Пример 42. 6-Амино-4-[(3-этинилфенил) амино]хинолин-3-карбонитрил. Смесь 2,00 г (6,36 ммоль) 4-[(3-этинилфенил)амино]-6-нитрохинолин-3-карбонитрила,100 мл этанола и 7,19 г (31,8 ммоль) дигидратаSnCl2 нагревали при кипении с обратным холодильником в атмосфере N2. Нагрев убирали через 3 1/2 ч и добавляли ледяную воду. Подщелачивали бикарбонатом натрия и перемешивали в течение 2 ч. Экстрагировали хлороформом,перемешивали органический слой с Darco, сушили сульфатом натрия, фильтровали, удаляли растворитель и сушили в вакууме, получая 1,737 г желто-коричневого твердого вещества: масс-спектр(21,5 ммоль) 4-хлор-6-нитрохинолин-3-карбонитрила, 200 мл этанола и 3,82 г (32,6 ммоль) 3 этиниланилина нагревали при кипении с обратным холодильником в атмосфере N2. Нагрев убирали через 3 1/2 ч и добавляли насыщенный раствор бикарбоната натрия до достижения щелочной реакции среды. Растворители удаляли и осуществляли азеотропную отгонку с этанолом. Остаток суспендировали гексаном и собирали твердые продукты. Промывали водой и сушили в вакууме. Растворяли в этилацетате,перемешивали с Darco, фильтровали, удаляли растворитель и сушили в вакууме, получая(электрораспыление, m/е): М+Н=315,1. Пример 44. 4-[(3-Бром-4-фторфенил) амино]-6-нитрохинолин-3-карбонитрил. Смесь 3,8 г (16,33 ммоль) 4-хлор-6 нитрохинолин-3-карбонитрила и 3,7 г (20 ммоль) 3-бром-4-фторанилина в 200 мл этанола нагревали при кипении с обратным холодильником в течение 3 ч. После удаления растворителя, остаток растворяли в этилацетате и промывали бикарбонатом натрия. Продукт собирали в виде бледно-желтого твердого вещества,6,5 г (71%); ESMS m/z 387,3, 389,2, т.пл. 269270 С (разл.). Пример 45. 6-Амино-4-[(3-бром-4-фторфенил)амино]хинолин-3-карбонитрил. Смесь 8 г (20,67 ммоль) 4-[(3-хлор-4-фторфенил)амино]-6-нитрохинолин-3-карбонитрила,4 г (72,35 ммоль) тонкоизмельченного порошка железа и 8,9 г (165,36 ммоль) хлорида аммония в 240 мл смеси метанола и воды (соотношение 2:1) нагревали при кипении с обратным холодильником в течение 4 ч. Смесь фильтровали горячей и промывали метанолом и водой. Продукт выпадал в осадок из фильтрата при охлаждении. Твердое вещество собирали и сушили в вакууме, получая 5,8 г (79%) желтоватокоричневого твердого вещества; ESMS m/z 356,8, 358,8, т.пл. 210-212 С. Пример 46. 4-(3-Хлор-4-фторфениламино)7-метокси-6-нитрохинолин-3-карбонитрил. Смесь 4,4 г (16,7 ммоль) 4-хлор-7-метокси 6-нитрохинолин-3-карбонитрила и 2,67 г (18,3 ммоль) 3-хлор-4-фторанилина в 110 мл метоксиэтанола нагревали при кипении с обратным холодильником в атмосфере азота в течение 4 ч. Реакционную смесь разбавляли этилацетатом и промывали раствором бикарбоната натрия и раствором хлорида натрия. Органический слой сушили над сульфатом натрия и затем растворитель удаляли в вакууме. Остаток хроматографировали на силикагеле, элюируя смесью этилацетата и метанола, получая 3 г желтого твердого вещества: масс-спектр (электрораспыление,m/е): 372,9. Пример 47. 6-Амино-4-(3-хлор-4-фторфениламино)-7-метоксихинолин-3-карбонитрил. Смесь 4,88 г (13 ммоль) 4-[(3-хлор-4 фторфенил)амино]-7-метокси-6-нитрохинолин 3-карбонитрила, 5,2 г (97,5 ммоль) хлорида аммония и 3,3 г (58,5 ммоль) железа перемешивали при кипении с обратным холодильником в 60 мл воды и 60 мл метанолa в течение 4,5 ч. Смесь разбавляли 500 мл горячего этилацетата и горячую смесь фильтровали. Фильтрат промывали насыщенным раствором хлорида натрия и затем органический слой сушили над сульфатом натрия. Растворитель удаляли и остаток хроматографировали на силикагеле, элюируя смесью этилацетата и метанола, получая 3,38 г желтого твердого вещества: масс-спектр (электрораспыление, m/e): M+H 343,4. 58 Пример 48. 4-(3-Бром-4-фторфениламино)7-метокси-6-нитрохинолин-3-карбонитрил. Смесь 3,52 г (9,7 ммоль) 4-хлор-7-метокси 6-нитрохинолин-3-карбонитрила и 2,0 г (10,7 ммоль) 3-бром-4-фторанилина в 150 мл метоксиэтанола нагревали при кипении с обратным холодильником в атмосфере азота в течение 5,5 ч. Реакционную смесь разбавляли этилацетатом и промывали раствором бикарбоната натрия и раствором хлорида натрия. Органический слой сушили сульфатом натрия и затем растворитель удаляли в вакууме. Остаток хроматографировали на силикагеле, элюируя смесью этилацетата и гексана, получая указанное в заголовке соединение. Пример 49. 6-Амино-4-(3-бром-4-фторфениламино)-7-метоксихинолин-3-карбонитрил. Смесь 2,9 г (6,95 ммоль) 4-[(3-бром-4 фторфенил)амино]7-метокси-6-нитрохинолин-3 карбонитрила, 6,5 г (121,6 ммоль) хлорида аммония и 4,05 г (73 ммоль) железа в 50 мл воды и 50 мл метанола в течение 6 ч. Смесь разбавляли горячим этилацетатом и горячую смесь фильтровали. Фильтрат промывали насыщенным раствором хлорида натрия, затем органический слой сушили над сульфатом натрия. Растворитель удаляли и остаток хроматографировали на силикагеле, элюируя смесью этилацетата и метанола, получая 2,11 г светло-желтого твердого вещества: масс-спектр (электрораспыление,m/е): М+Н 386,7 и 388,8. Пример 50. 7-Этокси-4-гидроксихинолин 3-карбонитрил. Смесь 10 г (73 ммоль) 3-этоксианилина и 12,3 г (73 ммоль) этил(этоксиметилен)цианоацетата нагревали в 90 мл Dowther при 140 С в течение 7 ч. К этой смеси добавляли 250 млDowther. Раствор перемешивали и нагревали при кипении с обратным холодильником в атмосфере азота в течение 12 ч с периодической отгонкой выделяющегося этанола. Смесь охлаждали до комнатной температуры, твердое вещество собирали и промывали гексаном. Сырой твердый продукт обрабатывали кипящим этанолом и затем фильтровали, получая 9,86 г коричневого твердого вещества: масс-спектр (электрораспыление, m/е): М+Н 214,7. Пример 51. 7-Этокси-4-гидрокси-6-нитрохинолин-3-карбонитрил. К суспензии 5 г (23 ммоль) 7-этокси-4 гидроксихинолин-3-карбонитрила в 75 мл трифторуксусного ангидрида добавляли в течение 6 ч при комнатной температуре 5,5 г (69 ммоль) нитрата аммония. Избыток ангидрида удаляли при пониженном давлении при 45 С. Остаток перемешивали с 300 мл воды. Твердое вещество собирали и обрабатывали кипящим этанолом,получая 3,68 г желтовато-коричневого твердого вещества: масс-спектр (электрораспыление, m/е) М+Н 259,8. 59 Пример 52. 4-Хлор-7-этокси-6-нитрохинолин-3-карбонитрил. Смесь 3,45 г (13 ммоль) 7-этокси-4 гидрокси-6-нитрохинолин-3-карбонитрила, 5,55 г (26 ммоль) пентахлорида фосфора и 10 мл оксихлорида фосфора нагревали при кипении с обратным холодильником в течение 3 ч. Смесь разбавляли гексаном и собирали твердое вещество. Твердое вещество растворяли в 500 мл этилацетата и промывали холодным разбавленным раствором гидроксида натрия. Раствор сушили над сульфатом магния и фильтровали через слой силикагеля. Растворитель удаляли, получая 2,1 г бежевого твердого вещества: массспектр (электрораспыление, m/e) M+H 277,7. Пример 53. 4-(3-Бромфениламино)-7-этокси-6-нитрохинолин-3-карбонитрил. Смесь 2,1 г (7,6 ммоль) 4-хлор-7-этокси-6 нитрохинолин-3-карбонитрила и 0,91 мл (8,3 ммоль) 3-броманилина в 100 мл этанола нагревали при кипении с обратным холодильником в атмосфере азота в течение 4,5 ч. Реакционную смесь выливали в разбавленный раствор бикарбоната натрия. Этанол удаляли в вакууме. Смесь разбавляли этилацетатом и органический слой отделяли и сушили над сульфатом натрия. Раствор концентрировали, твердое вещество собирали и затем промывали гексаном. После сушки получали 2,6 г желтого твердого вещества: масс-спектр (электрораспыление, m/e) M+H 412,8 и 414,9. Пример 54. 6-Амино-4-(3-бромфениламино)-7-этоксихинолин-3-карбонитрил. Смесь 2,5 г (6 ммоль) 4-[(3-бромфенил)амино]-7-этокси-6-нитрохинолин-3-карбонитрила, 2,4 г (45 ммоль) хлорида аммония и 1,5 г (27 ммоль) железа перемешивали при кипении с обратным холодильником в 40 мл воды и 40 мл метанола в течение 4 ч. Смесь разбавляли 500 мл горячего этилацетата и горячую смесь фильтровали. Фильтрат промывали насыщенным раствором хлорида натрия и затем органический слой сушили над сульфатом натрия. Раствор концентрировали и собирали 1,5 г бежевого твердого вещества: масс-спектр (электрораспыление, m/e): M+H 382,8 и 384,8. Пример 55. 8-Метокси-4-гидрокси-6-нитрохинолин-3-карбонитрил. Смесь 12,6 г (75 ммоль) 2-метокси-4-нитроанилина и 12,7 г (75 ммоль) этил(этоксиметилен)цианоацетата нагревали в 100 млDowther при 120 С в течение ночи и при 180 С в течение 20 ч. К этой смеси добавляли 300 млDowther. Раствор перемешивали и нагревали при кипении с обратным холодильником в атмосфере азота в течение 12 ч с периодической отгонкой выделяющегося этанола. Смесь охлаждали до комнатной температуры и твердое вещество собирали и промывали гексаном. Сырой твердый продукт обрабатывали кипящим этанолом и затем фильтровали, получая 12 г(электрораспыление, m/е): М+Н 245,8. Пример 56. 4-Хлор-8-метокси-6-нитрохинолин-3-карбонитрил. Смесь 4 г (16 ммоль) 8-метокси-4 гидрокси-6-нитрохинолин-3-карбонитрила, 6,66 г (32 ммоль) пентахлорида фосфора и 15 мл оксихлорида фосфора нагревали при кипении с обратным холодильником в течение 2,5 ч. Смесь разбавляли гексаном и собирали твердое вещество. Твердое вещество растворяли в 500 мл этилацетата и промывали холодным разбавленным раствором гидроксида натрия. Раствор сушили над сульфатом магния и фильтровали через слой силикагеля. Растворитель удаляли,получая 2,05 г твердого вещества рыжеватокоричневого цвета: масс-спектр (электрораспыление, m/е) М+Н 263,7. Пример 57. 6-Нитро-4-(3-бромфениламино)-8-метоксихинолин-3-карбонитрил. Смесь 1,9 г (7,6 ммоль) 4-хлор-8-метокси 6-нитрохинолин-3-карбонитрила и 0,86 мл (8,3 ммоль) 3-броманилина в 95 мл этанола нагревали при кипении с обратным холодильником в атмосфере азота в течение 5 ч. Реакционную смесь выливали в разбавленный раствор бикарбоната натрия. Этанол удаляли в вакууме. Смесь разбавляли этилацетатом и органический слой отделяли и сушили над хлоридом натрия. Раствор концентрировали, твердое вещество собирали и затем промывали гексаном. После сушки получали 2,3 г желтого твердого вещества: масс-спектр (электрораспыление, m/e) M+H 398,8 и 400,8. Пример 58. 6-Амино-4-(3-бромфениламино)-8-метоксихинолин-3-карбонитрил. Смесь 2,15 г (5 ммоль) 4-[(3-бромфенил)амино]-8-метокси-6-нитрохинолин-3-карбонитрила, 1,95 г (37,5 ммоль) хлорида аммония и 1,26 г (22,5 ммоль) железа перемешивали при кипении с обратным холодильником в 40 мл воды и 40 мл метанола в течение 3 ч. Смесь разбавляли 500 мл горячего этилацетата и горячую смесь фильтровали. Фильтрат промывали насыщенным раствором хлорида натрия и затем органический слой сушили над сульфатом натрия. Раствор концентрировали и собирали 0,43 темно-желтого твердого вещества: масс-спектр(электрораспыление, m/e): M+H 368,9 и 370,9. Пример 59. 4-Хлор-бут-2-иновая кислота. Пропаргилхлорид (2 мл, 26,84 ммоль) растворяли в 40 мл тетрагидрофурана в атмосфере азота и охлаждали до -78 С. После добавления н-бутиллития (5,4 мл, 13,42 ммоль, 2,5 М в нгексане) и перемешивания в течение 15 мин через реакционную смесь в течение 2 ч при-78 С пропускали ток сухого диоксида углерода. Реакционный раствор фильтровали и нейтрализовали 3,5 мл 10%-ной серной кислоты. После упаривания раствора остаток экстрагировали простым эфиром. Эфирный раствор промывали насыщенным раствором соли и сушили
МПК / Метки
МПК: C07D 215/54, C07D 491/10, A61K 31/47
Метки: 3-цианохинолины, качестве, замещенные, ингибиторов, протеинтирозинкиназ
Код ссылки
<a href="https://eas.patents.su/30-4427-zameshhennye-3-cianohinoliny-v-kachestve-ingibitorov-proteintirozinkinaz.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные 3-цианохинолины в качестве ингибиторов протеинтирозинкиназ</a>
Предыдущий патент: Ароматические сложные эфиры для маркировки или мечения нефтепродуктов
Следующий патент: Модифицированные экзосомы и их применение
Случайный патент: Полупроводящая полиолефиновая композиция, ее применение, содержащий ее силовой кабель, способ получения кабеля