Ингибиторы герпесвирусов на основе альфа-метилбензилсодержащей тиомочевины, включающие фенилендиаминогруппу
Номер патента: 4205
Опубликовано: 26.02.2004
Авторы: Дигранди Мартин Джозеф, Нортон Эмили Бучер, Росс Эдма Антониа, Блум Джонатан Дэвид, О'хара Брайан Марк, Лэнг Стэнли Альберт, Каррэн Кевин Джозеф, Дашин Расселл Джордж
Формула / Реферат
1. Соединение, имеющее формулу
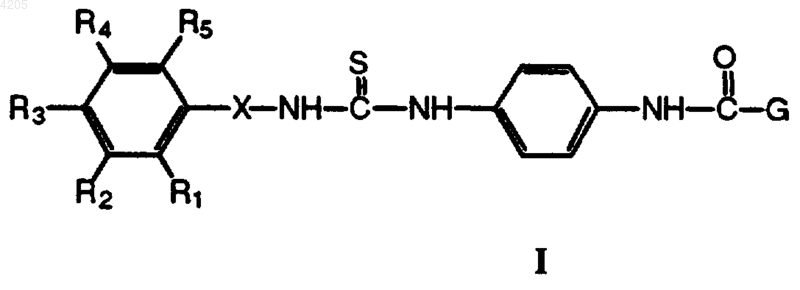
где
R1-R5 независимо выбраны из водорода, алкила с 1-6 атомами углерода, алкенила с 2-6 атомами углерода, алкинила с 2-6 атомами углерода, пергалогеналкила с 1-6 атомами углерода, циклоалкила с 3-10 атомами углерода, гетероциклоалкила, арила, гетероарила, галогена, -CN, -NO2, -CO2R6, -COR6, -OR6, -SR6, -SOR6, -SO2R6, -CONR7R8, -NR6N(R7R8), -N(R7R8) или W-Y-(CH2)n-Z, при условии, что по меньшей мере один из R1-R5 не является водородом; или R2 и R3 либо R3 и R4, взятые вместе, образуют (3-7)-членный гетероциклоалкил или (3-7)-членный гетероарил;
R6 и R7 независимо представляют водород, алкил с 1-6 атомами углерода, пергалогеналкил с 1-6 атомами углерода или арил;
R8 представляет водород, алкил с 1-6 атомами углерода, пергалогеналкил с 1-6 атомами углерода, циклоалкил с 3-10 атомами углерода, гетероциклоалкил с 3-10 членами, арил или гетероарил, или
R7 и R8, взятые вместе, могут образовывать (3-7)-членный гетероциклоалкил;
W представляет O, NR6 или отсутствует;
Y представляет -(CO)- или -(CO2)- или отсутствует;
Z представляет алкил с 1-4 атомами углерода, -CN, -CO2R6, -COR6, -CONR7R8, -OCOR6, -NR6COR7, -OCONR6R7, -OR6, -SR6, -SOR6, -SO2R6, -NR6N(R7R8), -N(R7R8) или фенил;
G представляет арил или конденсированный бициклический гетероарил;
X представляет связь, -NH-, алкилен с 1-6-атомами углерода, алкенилен с 2-6 атомами углерода, алкиленокси с 1-6 атомами углерода, алкилентио с 1-6 атомами углерода, алкиленамино с 1-6 атомами углерода или -CH(J)-;
J представляет алкил с 1-6 атомами углерода, циклоалкил с 3-7 атомами углерода, фенил или бензил и
n равно целому числу от 1 до 6;
причем в вышеуказанных определениях
"арил" означает ароматическую моно- или бициклическую группу с 5-10 атомами углерода;
"гетероарил" означает ароматическую моно- или бициклическую группу с 5-10 атомами - членами цикла, содержащими от 1 до 3 гетероатомов, выбранных из N, S и O;
"гетероциклоалкил" означает насыщенную моно- или бициклическую систему с 3-10 атомами - членами цикла, содержащими от 1 до 3 гетероатомов, выбранных из N, S и O,
и при этом алкильные, алкенильные, алкинильные, циклоалкильные, гетероциклоалкильные, арильные и гетероарильные группы в вышеуказанных определениях могут быть замещенными или незамещенными;
или его фармацевтическая соль.
2. Соединение по п.1, где R1-R5 независимо представляют алкил с 1-6 атомами углерода, галоген, пергалогеналкил с 1-6 атомами углерода, OR6 или N(R7R8).
3. Соединение по п.1, где R4 является галогеном, трифторметилом или цианогруппой.
4. Соединение по п.1, где G замещен одной или несколькими группами, выбранными из алкила с 1-6-атомами углерода, алкенила с 2-6 атомами углерода, алкинила с 2-6 атомами углерода, пергалогеналкила с 1-6 атомами углерода, циклоалкила с 3-10 атомами углерода, гетероциклоалкила с 3-10 углеродными членами, арила, гетероарила, галогена, -CN, -NO2, -CO2R6, -COR6, -OR6, -SR6, -SOR6, -SO2R6, -CONR7R8, -NR6N(R7R8), -N(R7R8) или W-Y-(CH2)n-Z.
5. Соединение по п.1, где G является фенилом.
6. Соединение по п.5, где G является замещенным фенилом.
7. Соединение по п.4, где G замещен одной или несколькими группами, выбранными из алкила с 1-6 атомами углерода, пергалогеналкила с 1-6 атомами углерода, галогена, -SR6, -SOR6, -N(R7R8) или W-Y-(CH2)n-Z.
8. Соединение по п.1, где G является 2-фторфенилом.
9. Соединение по п.1, где G является конденсированным бициклическим гетероарилом.
10. Соединение по п.9, где G является хинолином, изохинолином или бензофураном.
11. Соединение по п.1, где X представляет связь.
12. Соединение по п.1, где X представляет линейный алкил.
13. Соединение по п.1, где X представляет линейный алкил с 1-4 атомами углерода.
14. Соединение по п.1, где X является (CH)J.
15. Соединение по п.1, где J является метилом.
16. Соединение по п.1, выбранное из следующих:
N-{4-[3-(1-бензофуран-2-илэтил)тиоуреидо]фенил}-2-трифторметилбензамид,
N-(4-фторфенил)-4-{3-[1-(4-фторфенил)этил]тиоуреидо}бензамид,
(4-{3-[1-(4-фторфенил)этил]тиоуреидо}фенил)амид изохинолин-1-карбоновой кислоты,
{4-[3-(1-бензофуран-2-илэтил)тиоуреидо]фенил}амид изохинолин-1-карбоновой кислоты,
(4-{3-[1-(4-бромфенил)этил]тиоуреидо}фенил)амид изохинолин-1-карбоновой кислоты,
(4-{3-[1-(4-цианфенил)этил]тиоуреидо}фенил)амид изохинолин-1-карбоновой кислоты,
(4-{3-[1-(4-фторфенил)этил]тиоуреидо}фенил)амид бензофуран-2-карбоновой кислоты,
{4-[3-(1-бензофуран-2-илэтил)тиоуреидо]фенил}амид бензофуран-2-карбоновой кислоты,
(4-{3-[1-(4-бромфенил)этил]тиоуреидо}фенил)амид бензофуран-2-карбоновой кислоты,
(4-{3-[1-(4-цианфенил)этил]тиоуреидо}фенил)амид бензофуран-2-карбоновой кислоты,
(4-{3-[1-(4-фторфенил)этил]тиоуреидо}фенил)амид изохинолин-3-карбоновой кислоты,
{4-[3-(1-бензофуран-2-илэтил)тиоуреидо]фенил}амид изохинолин-3-карбоновой кислоты,
(4-{3-[1-(4-цианфенил)этил]тиоуреидо}фенил)амид изохинолин-3-карбоновой кислоты,
(4-{3-[1-(4-бромфенил)этил]тиоуреидо}фенил)амид изохинолин-3-карбоновой кислоты,
(4-{3-[1-(4-фторфенил)этил]тиоуреидо}фенил)амид хинолин-3-карбоновой кислоты,
(4-{3-[1-(4-фторфенил)этил]тиоуреидо}фенил)амид хинолин-4-карбоновой кислоты,
4-{3-[1-(4-фторфенил)этил]тиоуреидо}фенил)амид хинолин-6-карбоновой кислоты,
4-{3-[1-(4-фторфенил)этил]тиоуреидо}фенил)амид хинолин-8-карбоновой кислоты,
N-(4-{3-[1-(4-фторфенил)этил]тиоуреидо}фенил)-2-трифторметилбензамид,
2-циано-N-(4-{3-[1-(4-фторфенил)этил]тиоуреидо}фенил)бензамид,
N-{4-[3-(3-хлор-4-изобутоксифенил)тиоуреидо]фенил}-2-фторбензамид,
2-фтор-N-{4-[3-(3-фтор-4-метоксифенил)тиоуреидо]фенил}бензамид,
N-(4-{3-[3-хлор-4-(2-метоксиэтокси)фенил]тиоуреидо}фенил)-2-фторбензамид,
2-фтор-N-{4-[3-(3-фтор-4-метилфенил)тиоуреидо]фенил}-бензамид,
2-фтор-N-{4-[3-(4-метокси-3-трифторметилфенил)тиоуреидо]фенил}бензамид,
N-{4-[3-(2-амино-5-трифторметилфенил)тиоуреидо]фенил}-2-фторбензамид,
N-(4-{3-[1-(3-хлор-4-метоксифенил)этил]тиоуреидо}фенил)-2-фторбензамид,
N-{4-[3-(5-хлор-2-гидроксифенил)тиоуредо]фенил}-2-фторбензамид,
N-{4-[3-(1-бензофуран-2-илэтил)тиоуреидо]фенил}-2-фторбензамид,
2-фтор-N-{4-[3-(4-метил-3-трифторметилфенил)тиоуреидо]фенил}бензамид,
(S)-N-(4-{3-[1-(4-бромфенил)этил]тиоуреидо}фенил)-2-фторбензамид,
N-(4-{3-[(1R)-1-(4-бромфенил)этил]тиоуреидо}фенил)-2-фторбензамид,
2-фтор-N-(4-{3-[2-метокси-4-(2,2,2-трифторэтокси)фенил]тиоуреидо}фенил)бензамид,
N-{4-[3-(2-амино-5-фторфенил)тиоуреидо]фенил}-2-фторбензамид,
N-(4-{3-[1-(4-диметилсульфамоилфенил)этил]тиоуреидо}фенил)-2-фторбензамид,
2-фтор-N-[4-(3-{1-[4-(пиперидин-1-сульфонил)фенил]этил}тиоуреидо)фенил]бензамид,
N-(4-{3-[2,4-бис-(2,2,2-трифторэтокси)фенил]тиоуреидо}фенил)-2-фторбензамид,
2-фтор-N-{4-[3-((1S)-1-паратолилэтил)тиоуреидо]фенил}бензамид,
2-фтор-N-{4-[3-((1R)-1-паратолилэтил)тиоуреидо]фенил}бензамид,
2-фтор-N-{4-[3-((1S)-1-фенилэтил)тиоуреидо]фенил}бензамид,
N-(4-{3-[(1R)-1-(4-хлорфенил)этил]тиоуреидо}фенил)-2-фторбензамид,
N-(4-{3-[(1S)-1-(4-хлорфенил)этил]тиоуреидо}фенил)-2-фторбензамид,
2-фтор-N-{4-[3-((1R)-1-фенилэтил)тиоуреидо]фенил}бензамид,
N-(4-{3-[1-(4-цианфенил)этил]тиоуреидо}фенил)-2-метоксибензамид,
N-{4-[3-(1-бензофуран-2-илэтил)тиоуреидо]фенил}-2-метоксибензамид,
N-(4-{3-[1-(4-бромфенил)этил]тиоуреидо}фенил)-2-метоксибензамид,
3-циан-N-(4-{3-[1-(4-фторфенил)этил]тиоуреидо}фенил)бензамид,
N-(4-{3-[1-(4-фторфенил)этил]тиоуреидо}фенил)-4-трифторметилбензамид,
4-циан-N-(4-{3-[1-(4-фторфенил)этил]тиоуреидо}фенил)бензамид,
N-(4-{3-[1-(4-бромфенил)этил]тиоуреидо}фенил)-2-фторбензамид,
N-(4-{3-[(1S)-1-(4-бромфенил)этил]тиоуреидо}фенил)-4-фторбензамид,
N-(4-{3-[(1S)-1-(4-бромфенил)этил]тиоуреидо}фенил)-2-метоксибензамид,
N-(4-{3-[(1R)-1-(4-бромфенил)этил]тиоуреидо}фенил)-2-метоксибензамид,
2-фтор-N-(4-{[({1-[2-фтор-4-(трифторметил)фенил]этил}амино)карботиоил]амино}фенил)бензамид,
(4-{3-[(1S)-1-(4-бромфенил)этил]тиоуреидо}фенил)амид изохинолин-1-карбоновой кислоты,
(4-{3-[(1S)-1-(4-бромфенил)этил]тиоуреидо}фенил)амид изохинолин-3-карбоновой кислоты,
(4-{3-[(1S)-1-(4-хлорфенил)этил]тиоуреидо}фенил)амид изохинолин-1-карбоновой кислоты,
(4-{3-[1-(4-фторфенил)этил]тиоуреидо}фенил)амид изохинолин-1-карбоновой кислоты и
N-{4-[({[(1S)-1-(4-цианфенил)этил]амино}карботиоил)амино]фенил}-1-изохинолинкарбоксамид
и их фармацевтические соли.
17. Фармацевтическая композиция, включающая соединение по п.1 или его фармацевтическую соль и фармацевтически приемлемый носитель или разбавитель.
18. Способ ингибирования репликации герпесвируса, включающий приведение в контакт соединения по п.1 или его фармацевтической соли с герпесвирусом.
19. Способ по п.18, в котором герпесвирус является цитомегаловирусом человека.
20. Способ по п.18, в котором герпесвирус является вирусом ветряной оспы.
21. Способ по п.20, в котором соединение является, по существу, чистым (S) оптическим изомером.
22. Способ по п.18, в котором герпесвирус является вирусом простого герпеса.
23. Способ лечения пациента, страдающего от герпесвирусной инфекции, включающий введение данному пациенту терапевтически эффективного количества соединения по п.1 или его фармацевтической соли.
24. Способ по п.23, в котором герпесвирус является цитомегаловирусом человека.
25. Способ по п.23, в котором герпесвирус является вирусом ветряной оспы.
26. Способ по п.25, в котором соединение является, по существу, чистым (S) изомером.
27. Способ по п.23, в котором герпесвирус является вирусом простого герпеса.
Текст
1 Предпосылки изобретения Идентифицировано восемь вирусов, являющихся членами семейства HerpesviridaeKnipe и P.M. Howley (ред.) Fields Virology, 3-е изд., Lippincott-Raven Publishers, Philadelphia,PA). Каждый член этого семейства характеризуется как вирус с покрытием, содержащий белковоподобную оболочку, напоминающую белок, и нуклеокапсид, последний вмещает относительно большим вирусным геном, на основе двухцепочечной ДНК (а именно примерно 80-250 тысяч пар оснований). Члены подсемейства альфагерпесвирусов человека являются нейротропными и включают вирус простого герпеса типа 1 (HSV-1) и типа 2 (HSV-2) и вирус ветряной оспы (VZV). Бета-герпесвирусы человека представляют цитомегаловирус (HCMV), герпесвирус-6 человека (HHV-6) и герпесвирус-7 человека (HHV-7). Гамма-герпесвирусы являются лимфотропными и включают вирус ЭпштейнБарр (EBV) и герпесвирус Капози (HHV-8). Каждый из этих герпесвирусов является причиной заболеваний человека, включая herpes labialis и[Neipel F., Albrecht J.C. и Fleckenstein В., 1997,Cell-homologous genes in the Kaposi's sarcomaassociated rhadinovirus human herpesvirus 8: determinants of its pathogenicity J. Virol., 71:418792]). HCMV рассмотрен ниже более подробно. После первичного инфицирования герпесвирус создает у инфицированного человека латентное течение болезни и остается там на всю его/ее оставшуюся жизнь. Периодическая реактивация 2 латентного вируса является релевантной с клинической точки зрения. В случае HSV реактивированный вирус может передаваться детям при рождении, вызывая кожную или глазную инфекцию, инфекцию центральной нервной системы или распространенную инфекцию (то есть инфекцию многих органов или систем). Опоясывающий лишай является клиническим проявлением реактивации VZV. Лечение HSV иVZV обычно проводят антивирусными лекарственными препаратами, такими как ацикловир(Glaxo Wellcome), ганцикловир (Roche) и фоскарнет (Asta), объектом которых является кодируемая вирусная ДНК полимераза.HCMV является повсеместным условнопатогеном, инфицирующим 50-90% взрослого населения (Britt W.J. и Alford C.A., 1996, Cytomegalovirus, стр. 2493-2523. В В.N. Fields,D.M.Knipe и P.M. Howley (ред.) Fields Virology,3-е изд., Lippincott-Raven Publishers, Philadelphia, PA). Первичное заражение HCMV обычно не вызывает симптомов, хотя наблюдали гетерофильный негативный мононуклеоз. Данный вирус передается горизонтально при половом контакте, с грудным молоком и слюной. Происходит внутриматочная передача HCMV от беременной матери плоду, что часто является причиной серьезных клинических последствий.HCMV остается в латентном состоянии у инфицированного человека на всю его/ее оставшуюся жизнь. Клеточно-опосредованный иммунитет играет центральную роль в регулировании реактивации из латентного состояния. Ослабленный клеточный иммунитет ведет к реактивации латентного HCMV у сероположительных людей.HCMV-заболевание связано с дефицитом или недоразвитием клеточного иммунитета. Существует 3 основных категории людей сHCMV-заболеваниями (обзор Britt и Alford,1996). (1) У пациентов с нарушенной иммунологической реактивностью (СПИД) HCMV является одним из двух наиболее общих патогенов,вызывающих клиническое заболевание (другим является Рnеumосуstis). Наиболее общим проявлением HCMV при СПИД является ретинит,хотя также часто сообщается об инфицировании других органов, включая надпочечники, легкие,желудочно-кишечный тракт и центральную нервную систему. 90% пациентов со СПИДом имеют активную HCMV-инфекцию; 25-40%(85000 пациентов в Соединенных Штатах) имеют опасное для жизни или для зренияHCMV-заболевание. HCMV является причиной смерти у 10% человек со СПИДом. (2) Вследствие подавления иммунной системы для снижения риска отторжения трансплантата среди пациентов с трансплантатами почки, печени,сердца и аллогенными трансплантатами костного мозга обычна HCMV-реактивация или реинфицирование. Наиболее общимHCMVзаболеванием у таких пациентов является пневмония, поражающая до 70% таких пациентов с 3 трансплантатами. (3) Вызванные HCMV врожденные инфекции случаются при 1% родов,примерно 40 К в год. До 25% таких детей имеют симптомы HCMV-заболеваний от 0 до 3 лет.HCMV-заболевание является прогрессирующим, вызывая у детей замедление умственного развития и неврологические расстройства. Последние исследования предполагают, что лечение анти-HCMV лекарственными препаратами может снизить заболеваемость у таких детей. В настоящее время продаются некоторые антивирусные лекарственные препараты (D.Novel herpes treatment: a review, Exp. Opin. Invest. Drugs, 5:169-183). Они включают: ганцикловир (Roche), аналог нуклеозида с токсичностью относительно кроветворных клеток; фоскарнет (Astra), аналог пирофосфата с нефротоксичностью; и цидофовир (Gilead), нуклеозидофосфонат с сильной нефротоксичностью. Каждое из этих лекарств, объектом которых является кодируемая вирусной ДНК полимераза, вводят внутривенно вследствие их низкой биологической доступности и, как отмечено выше, они являются источником значительной токсичности. Ганцикловир-устойчивые мутанты, которые появляются при развитии болезни, часто перекрестно устойчивы с цидофовиром. Следовательно, существует потребность в более безопасных (то есть менее токсичных) биологически доступных при пероральном применении антивирусных лекарственных препаратах, которые направлены против новых вирусных мишеней. Для использования в разнообразных фармацевтических применениях раскрыты фенилтиомочевины. Armistead и др. (WO 97/40028) указывают мочевины и тиомочевины в качестве ингибиторов инозинмонофосфатдегидрогеназыWiddowson и др. (WO 96/25157) указывают соединения фенилмочевины и тиомочевины приведенных ниже формул для лечения заболеваний, опосредованных хемокином, интерлейкином-8.Morin, Jr. и др. (патент США 5593993) указывают определенные соединения фенилтиомочевины для лечения СПИДа и ингибирования репликации HIV и родственных вирусов. Таким образом, цель данного изобретения состоит в том, чтобы предложить соединения и их фармацевтически приемлемые соли для ингибирования и/или лечения заболеваний, свя 004205 4 занных с вирусами герпеса, включая цитомегаловирус человека, вирусы простого герпеса,вирус Эпштейн-Барр, вируса ветряной оспы,герпесвирусы-6 и -7 человека и герпесвирус Капози. Описание изобретения Согласно настоящему изобретению предлагаются соединения, имеющие формулуR1-R5 независимо выбраны из водорода,алкила с 1-6 атомами углерода, алкенила с 2-6 атомами углерода, алкинила с 2-6 атомами углерода, пергалогеналкила с 1-6 атомами углерода, циклоалкила с 3-10 атомами углерода, гетероциклоалкила с 3-10 углеродными членами,арила, гетероарила, галогена, -CN, -NO2,-CO2R6, -COR6, -OR6, -SR6, -SOR6, -SO2R6,-CONR7R8, -NR6N(R7R8), -N(R7R8) или W-Y(CH2)n-Z, при условии, что по меньшей мере один из R1-R5 не является водородом; или R2 иR6 и R7 независимо представляют водород,алкил с 1-6 атомами углерода, пергалогеналкил с 1-6 атомами углерода или арил;G представляет арил, необязательно замещенный одним или более заместителями, выбранными из алкила с 1-6 атомами углерода,алкенила с 2-6 атомами углерода, алкинила с 2-6 атомами углерода, пергалогеналкила с 1-6 атомами углерода, циклоалкила с 3-10 атомами углерода, гетероциклоалкила с 3-10 углеродными членами, арила, гетероарила, галогена, -CN,-NO2, -CO2R6, -COR6, -OR6, -SR6, -SOR6, -SO2R6,-CONR7R8,-NR6N(R7R8),-N(R7R8) илиG представляет конденсированный бициклический гетероарил; Х представляет связь, -NH, алкилен с 1-6 атомами углерода, алкенилен с 2-6 атомами углерода, алкиленокси с 1-6 атомами углерода, 5 алкилентио с 1-6 атомами углерода, алкиленамино с 1-6 атомами углерода или -(CH)J-;n равно целому числу от 1 до 6; или их фармацевтически приемлемые соли. В некоторых предпочтительных вариантах настоящего изобретения R1-R5 независимо представляют алкил с 1-6 атомами углерода,галоген, пергалогеналкил с 1-6 атомами углерода, -OR6 или -N(R7R8). Предпочтительно от 1 до 3 R1-R5 не являются водородом. В еще более предпочтительных вариантах данного изобретения R4 является галогеном, циано или трифторметилом. В некоторых вариантах настоящего изобретения G является замещенным. В предпочтительных вариантах настоящего изобретения G представляет 2-фторфенил. В других предпочтительных вариантах G представляет бензофуран, изохинолин или хинолин. В некоторых вариантах настоящего изобретения Х представляет связь, С 1-С 4-алкил или-(CH)J-; где J является C1-С 6-алкилом. Предпочтительно, если Х представляет С 1-С 4-алкил, указанный алкил является линейным алкилом. Если Х представляет -(CH)J-, J предпочтительно является метилом. Предпочтительны следующие соединения настоящего изобретения, включая их фармацевтические соли.N-4-[([(1S)-1-(4-цианфенил)этил]амино карботиоил)амино]фенил-1-изохинолинкарбоксамид и их фармацевтические соли. Если не указано по-другому, использованные здесь термины имеют следующие значения. Использованный здесь термин "алкил" обозначает линейный или разветвленный низший алкил с 1-6 атомами углерода. Примеры алкильных групп включают метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил,пентил и гексил. Использованный здесь термин "алкенил" обозначает линейный или разветвленный низший алкил с 2-6 атомами углерода, содержащий по меньшей мере одну углерод-углеродную двойную связь. Алкенил включает винильные группы. Использованный здесь термин "алкинил" обозначает линейный или разветвленный низший алкил с 2-6 атомами углерода, содержащий по меньшей мере одну углерод-углеродную тройную связь. Алкильные, алкенильные и алкинильные группы настоящего изобретения могут быть замещенными или незамещенными. Термин "циклоалкил" обозначает насыщенные моно- или бициклические системы с 310 атомами углерода. Примеры циклоалкильных 8 групп включают циклопентил, циклогексил и циклогептил. Циклоалкильные группы настоящего изобретения могут быть замещенными или незамещенными. Термин "гетероциклоалкил" обозначает насыщенные моно- или бициклические системы с 3-10 членами, имеющие от 1 до 3 гетероатомов, выбранных из N, S и О, включая, но не ограничиваясь этим, азиридинил, азетидинил,имидазолидинил, морфолинил, тиоморфолинил,пиперазинил, пиразолидинил, пиперидинил и пирролидинил. Гетероциклоалкильные группы настоящего изобретения могут быть замещенными или незамещенными. Использованный здесь термин "арил" обозначает ароматические моно- или бициклы с 510 атомами углерода. Примеры арильных групп настоящего изобретения включают фенил, нафтил и дифенил. Арильные группы настоящего изобретения могут быть замещенными или незамещенными. Использованный здесь термин "гетероарил" обозначает ароматические моно- или бициклы с 5-10 членами, имеющие от 1 до 3 гетероатомов, выбранных из N, S и О, включая, но не ограничиваясь этим, тиазолил, тиадиазолил,оксазолил, фурил, индолил, бензотиазолил, бензотриазолил, бензодиоксил, индазолил и бензофурил. Предпочтительные гетероарилы включают хинолил, изохинолил, нафталинил, бензофуранил, бензотиенил, индолил, пиридил, пиразинил, тиенил, фурил, пирролил, изоксазолил,оксазолил, изотиазолил, тиазолил, пиразолил,триазолил, тиадиазолил и имидазолил. Гетероарильные группы настоящего изобретения могут быть замещенными или незамещенными. Термин "пергалогеналкил" обозначает алкильную группу с 1-6 атомами углерода, в которой три или более атомов водорода замещены на галогены. Использованный здесь термин "фенил" обозначает 6-членное ароматическое кольцо. Использованный здесь термин "галоген" обозначает хлор, бром, иод и фтор. Если не указано по-другому, заместители являются незамещенными и могут включать алкил с 1-6 атомами углерода, циклоалкил с 1-6 атомами углерода, гетероциклоалкил с 1-6 членами, пергалогеналкил с 1-6 атомами углерода,амино, азидо, гидроксил, алкиламино, диалкиламино, арил или гетероарил. Количество атомов углерода означает количество атомов углерода в основной цепи и не включает атомы углерода, находящиеся в заместителях, таких как алкильные или алкоксильные заместители. Если термины используют в комбинации,то, если не определено иначе, применяют определение для каждой индивидуальной части. Например, алкилциклоалкил представляет алкилциклоалкильную группу, в которой алкил и циклоалкил такие, как определено ранее. 9 Фармацевтически приемлемыми солями являются аддитивные соли кислот, которые можно получить из соединения приведенной выше общей формулы и фармацевтически приемлемой кислоты, такой как фосфорная, серная,соляная, бромистоводородная, лимонная, малеиновая, янтарная, фумаровая, уксусная, молочная, азотная, сульфоновая, паратолуолсульфоновая,метансульфоновая кислота и подобные. Соединения данного изобретения содержат хиральный центр, обеспечивающий различные стереоизомерные формы данных соединений,такие как рацемические смеси, а также индивидуальные оптические изомеры. В некоторых предпочтительных вариантах настоящего изобретения соединения представляют, по существу, чистые оптические изомеры. Под "по существу чистыми" понимают композиции, содержащие более 75% требуемого изомера и которые могут включать не более 25% нежелательного изомера. В более предпочтительных вариантах чистый оптический изомер содержит более 90% требуемого изомера. В некоторых предпочтительных вариантах, когда мишенью является VZV, предпочтителен изомер (S). Индивидуальные изомеры можно получить непосредственно или путем асимметрического или стереоспецифического синтеза или путем обычного выделения оптических изомеров из рацемической смеси. Специалист в области органического синтеза может получить соединения настоящего изобретения, применяя описанные ниже способы, в которых используются легко доступные реагенты и исходные материалы, если не описано по-другому. Таким образом, соединения настоящего изобретения получают в соответствии со следующими схемами. Новые соединения настоящего изобретения получают согласно следующим схемам реакций. Ссылаясь на способы 31 (2 и 3, сверху) и 34 (4 и 5 снизу), взаимодействие замещенных подходящим образом аминов 2, в которых заместители R1-R5 и Х такие, как описано выше, с замещенными подходящим образом изотиоцианатами 3, в которых заместитель G такой, как описано выше, в чистом виде или в подходящем растворителе, таком как тетрагидрофуран, ацетонитрил, этилацетат, дихлорметан или N,Nдиметилформамид, дает требуемые тиомочевины 1. Аналогично взаимодействие замещенных подходящим образом изотиоцианатов 4, в которых заместители R1-R5 и Х такие, как описано выше, с замещенными подходящим образом анилинами 5, в которых заместитель G такой,как описано выше, в удобном растворителе, таком как перечисленные выше, дает требуемые тиомочевины 1. Альтернативно, замещенные подходящим образом тиомочевины 1 можно получить, как описано в способах 32 и 33, посредством взаимодействия анилинов 2 и 5, в которых заместители R1-R5 и G такие, как описано выше, в присутствии одного мольного эквивалента 1,1'тиокарбонилдиимидазола или 1,1'-карбонилдиимидазола в подходящем растворителе, таком как дихлорметан, тетрагидрофуран или их смеси, или одного мольного эквивалента 1,1'тиокарбонил-ди-(1,2,4)триазола или 1,1'-карбонил-ди-(1,2,3)триазола в подходящем растворителе, таком как дихлорметан, тетрагидрофуран или их смеси, при комнатной температуре. Способы 32 и 33 В некоторых случаях требуется последующая химическая модификация конечных тиомочевин 1. Такие способы, а именно способы 35-39, суммированы ниже. Тиомочевины 1, в которых по меньшей мере один заместитель из R1-R5 представляет 1 гидроксиэтокси или карбоксиметокси, G такой,как определено выше и Х определен выше,можно получить из соответствующих алкиль 11 ных сложных эфиров путем щелочного гидролиза водным гидроксидом натрия или калия в подходящем растворителе, таком как метанол,тетрагидрофуран или их смеси, при комнатной температуре согласно способам 35 и 36. Тиомочевины 1, в которых по меньшей мере один заместитель из R1-R5 представляет 1 ацилоксиэтокси или метансульфонилоксиэтокси, G такой, как определено выше, и Х представляет связь, можно получить из соответствующих 1-гидроксиэтокси-производных путем ацилирования подходящим ацилирующим агентом, таким как хлорангидрид бензойной кислоты или хлорангидрид метансульфоновой кислоты, в присутствии подходящего третичного аминного основания, такого как триэтиламин или диизопропилэтиламин, в подходящем растворителе, таком как дихлорметан или подобный, при комнатной температуре согласно способам 37 и 38. Тиомочевины 1, в которых по меньшей мере один заместитель из R1-R5 представляет 1 аминоэтокси, G такой, как определено выше, и Х представляет связь, можно получить из соответствующих 1-метансульфонилэтоксипроизводных путем взаимодействия с подходящим вторичным амином, таким как диметиламин, в подходящей смеси растворителей, такой как тетрагидрофуран и вода или подобной, при комнатной температуре согласно способу 39. Тиомочевины 1, в которых по меньшей мере один заместитель из R1-R5 представляет 1 аминоалкил, G определен выше, и Х представляет связь, можно получить из соответствующих 1-азидоалкилпроизводных путем взаимодействия с хлоридом олова (II) в подходящем растворителе, таком как метанол, этанол или подобные, при комнатной температуре согласно способу 40. Промежуточные изотиоцианаты 3 и 4, показанные выше в способах 31 и 34, получают согласно способу 41 (ниже), главным образом, в соответствии с методиками, описанными в работе Staab Н.А. и Walther G., Justus Liebigs Ann. Сhem., 657, 104 (1962), посредством взаимодействия замещенных подходящим образом аминов 5 и 2, соответственно, в которых R1-R5 и G определены выше, и Х определен выше, с одним мольным эквивалентом 1,1'-тиокарбонилдиимидазола в подходящем растворителе, таком как дихлорметан и тетрагидрофуран или их смесь. Способ 41 12 Промежуточные продукты 2 и 5 можно получить согласно следующим прописям. Согласно способам 1A-1G можно получить амины 2, в которых R1-R5 определены выше, и Х определен выше, и амины 5 можно получить путем восстановления замещенных подходящим образом нитробензолов различными способами,которые известны специалистам в данной области и описаны в работе R.J.Lindsay, Comprehensive Organic Chemistry (ред. Sutherland), том 2, глава 6.3.1 Aromatic Amines, 1979. Такие методики включают восстановление нитробензолов до аминов при воздействии:a) порошка железа и сильной кислоты, такой как соляная кислота, (способ 1 А) в чистом виде или в спиртовом растворителе, таком как метанол или этанол, при температуре в диапазоне от комнатной до температуры кипения растворителя с обратным холодильником; илиb) порошка железа и ледяной уксусной кислоты (способ 1 В) в чистом виде или в спиртовом растворителе, таком как метанол или этанол, при температуре в диапазоне от комнатной до температуры кипения растворителя с обратным холодильником; илиd) порошка железа и водного хлорида аммония (способ 1 С) в чистом виде или в спиртовом растворителе, таком как метанол или этанол, при температуре в диапазоне от комнатной до температуры кипения растворителя с обратным холодильником; или а) олова и сильной минеральной кислоты,такой как соляная кислота, (способ 1D) в чистом виде или в спиртовом растворителе, таком как метанол или этанол, при температуре в диапазоне от комнатной до температуры кипения растворителя с обратным холодильником; илиe) если R1-R5 выбраны из Сl, Вr, I, -(ОSO2)СF3 или -(OSO2)-1-(4-метилфенила), посредством каталитического восстановления, например,водородом с палладием на угле (способ 1 Е) в подходящем растворителе, таком как метанол,этанол или этилацетат, при давлении в одну атмосферу или более; или(способ 1F) в подходящем растворителе, таком как метанол или этанол, при температуре в диапазоне от комнатной до температуры кипения растворителя с обратным холодильником; илиg) водного гидросульфита натрия в спиртовом растворителе при температуре в диапазоне от комнатной до температуры кипения растворителя с обратным холодильником (способ 1G). Альтернативно, согласно способам 3A-3C амины 2, в которых R1-R5 определены выше, и Х определен выше, и анилины 5, определенные выше, можно получить путем расщепления анилиновой связи азот-углерод амидных и карба 13 матных производных таких анилинов согласно разнообразным способам, которые известны специалистам в данной области и описаны в работе Greene, Protective Groups in Organic Synthesis, том 2, глава 7, 1991 и ссылках к ней. Такие методики включают:a) воздействие на замещенные подходящим образом ариламино-трет-бутилкарбаматы сильной кислотой, такой как трифторуксусная кислота (способ 3 А) в чистом виде или в подходящем растворителе, таком как дихлорметан,при температуре от 0 С до комнатной; илиb) воздействие на замещенные подходящим образом ариламино-(2-триметилсилилэтил) карбаматы источником фторидионов, таким как фторид тетрабутиламмония или фторид калия,(способ 3 В) в водном ацетонитриле или тетрагидрофуране или их смеси при температуре в диапазоне от комнатной до температуры кипения растворителя с обратным холодильником; илиc) воздействие на замещенные подходящим образом ариламино-трифторацетамиды сильным основанием, таким как гидроксид натрия или калия или карбонат натрия или калия,в спиртовом растворителе, таком как метанол или этанол, (способ 3C) при температуре в диапазоне от комнатной до температуры кипения растворителя с обратным холодильником. Альтернативно, согласно способу 11 амины 2, в которых R1-R5 определены выше, Х представляет связь, и по меньшей мере один заместитель из R1-R5 является винилом, можно получить путем катализируемого палладием взаимодействия реагента - винилтриалкилолова,такого как трибутилвинилолово, с замещенным подходящим образом бром- или иоданилином,например, 3-хлор-4-иоданилином, используя такой палладиевый катализатор как трис-(дибензилидинацетон)дипалладий и лиганд, такой как трифениларсин, в подходящем растворителе, таком как тетрагидрофуран или N-метилпирролидинон, при температуре в диапазоне от комнатной до температуры кипения растворителя с обратным холодильником, главным образом, согласно методикам работы V.Farina иG.P.Roth в Advances in Metal-Organic Chemistry,том 5, 1-53, 1996 и ссылок к ней. Альтернативно, согласно способу 42 амины 2, в которых R1-R5 определены выше, Х определен выше, и по меньшей мере один заместитель из R2 или R4 является диалкиламино,можно получить путем катализируемого палладием аминирования замещенного подходящим образом 3- или 5-бром- или иоданилина, например, 3-амино-5-бромбензотрифторида, вторичными аминами в условиях, в которых применяют палладиевый катализатор, такой как бис(дибензилидинацетон)палладий, и лиганд,такой как триортотолилфосфин, и по меньшей мере два мольных эквивалента сильного основания, такого как литий бис(триметилсилил) 14 амид, в закупоренной пробирке в подходящем растворителе, таком как тетрагидрофуран или толуол, при температуре в диапазоне от комнатной до 100 С, главным образом, согласно методикам работы J.F. Hartwig и J. Louie, TetrahedronLetters, 36 (21), 3609 (1995). Альтернативно, согласно способу 43 амины 2, в которых R1-R5 определены выше, X представляет связь и по меньшей мере один заместитель из R2 или R4 является алкилом, можно получить путем катализируемого палладием алкилирования замещенного подходящим образом 3- или 5-бром- или иоданилина, например,3-амино-5-бромбензотрифторида, алкенами в условиях, когда применяют палладиевый катализатор, такой как комплекс [1,1'-бис(дифенилфосфино)ферроцен]палладий(II) хлорид дихлорметан, и в присутствии 9-борабицикло[3.3.1]нонана и подходящего основания, такого как водный гидроксид натрия, в подходящем растворителе, таком как тетрагидрофуран или подобный, при температуре в диапазоне от комнатной до температуры кипения растворителя с обратным холодильником. Ацил- и карбамоиламинные производные,используемые в качестве исходных материалов в способах 3A-3C, можно получить из соответствующих аминов, как описано в способах 2A2G, согласно методикам, которые известны специалистам в данной области и описаны в работеa) взаимодействие замещенного подходящим образом амина с ди-трет-бутилдикарбонатом (способ 2 А) в присутствии или в отсутствие одного или более мольных эквивалентов третичного амина, такого как триэтиламин илиN,N-диизопропилэтиламин, в подходящем растворителе, таком как ацетон, тетрагидрофуран,диметилформамид, дихлорметан и подобные,при температуре от комнатной до температуры кипения растворителя с обратным холодильником с получением соответствующего ариламино-трет-бутилкарбамата; илиb) взаимодействие замещенного подходящим образом анилина с 1-[2-(триметилсилил) этоксикарбонилокси]бензотриазолом(способ 2 В) в присутствии третичного амина, такого как триэтиламин или диизопропилэтиламин, в подходящем растворителе, таком как диметилформамид, при комнатной температуре с получением соответствующего ариламино(2-триметилсилилэтил)карбамата; илиc) взаимодействие замещенного подходящим образом анилина с хлорангидридом или ангидридом карбоновой кислоты (способ 2 С) в чистом виде или в подходящем растворителе,таком как тетрагидрофуран, диметилформамид,дихлорметан, пиридин и подобные, в присутствии одного или более мольных эквивалентов третичного аминного основания, такого какd) взаимодействие замещенного подходящим образом нитроанилина с хлорангидридом карбоновой кислоты (способ 2D) в присутствии или в отсутствие одного или более мольных эквивалентов третичного аминного основания,такого как триэтиламин или N,N-диизопропилэтиламин, в чистом виде или в подходящем растворителе, таком как тетрагидрофуран, 1,4 диоксан и подобные, при температуре в диапазоне от комнатной до температуры кипения растворителя с обратным холодильником с получением соответствующего нитроариламиноамида; или е) взаимодействие замещенного подходящим образом анилина с карбоновой кислотой(способ 2 Е) в присутствии связующего агента,такого как бензотриазол-1-илокси-трис(диметиламино)фосфоний гексафторфосфат, 2-(1 Нбензотриазол-1-илокси)-1,1,3,3-тетраметилуроний гексафторфосфат, дициклогексилкарбодиимид и подобные, и в присутствии третичного амина, такого как триэтиламин или диизопропилэтиламин, в подходящем растворителе,таком как дихлорметан, диметилформамид и подобные, при комнатной температуре с получением соответствующего ариламиноамида; илиf) взаимодействие защищенного подходящим образом анилина, такого как ариламинотрет-бутилкарбамат или подобный, в котором по меньшей мере один заместитель из R1-R12 определен как W-Y-(CH2)n-Z, где W, Y и Z такие, как определено выше, с ангидридом карбоновой кислоты (способ 2F) в присутствии подходящего основания, такого как пиридин, в подходящем растворителе, таком как дихлорметан, диметилформамид или подобные, при температуре в диапазоне от 0 С до комнатной с получением соответствующего эфира карбоновой кислоты; илиg) взаимодействие замещенного подходящим образом анилина, в котором по меньшей мере один заместитель из R1-R5 представляет гидроксил, с ди-трет-бутилдикарбонатом (способ 2G) в присутствии или в отсутствие одного или более мольных эквивалентов третичного амина, такого как триэтиламин или N,Nдиизопропилэтиламин, в подходящем растворителе, таком как ацетон, тетрагидрофуран, диметилформамид, дихлорметан и подобные, при температуре в диапазоне от комнатной до температуры кипения растворителя с обратным холодильником с получением соответствующего ариламино-трет-бутилкарбамата. Нитробензольные промежуточные продукты, которые, в конечном счете, превращают в амины 2 и 5 способами, показанными выше в способах 1A-1G, можно получить согласно способам 4 А, 4 С, 4E-4F. 16 Ссылаясь на способы 4 А, 4 С и 4 Е-4 Н, нитробензольные промежуточные продукты, которые, в конечном счете, превращают в амины 2,где R2 и R4 определены выше, и R1, R3 и/или R5 определены как алкокси, тиоалкокси, алкилсульфенил, алкилсульфинил и диалкиламино,можно получить путем нуклеофильного замещения замещенных подходящим образом 2-, 4 и/или 6-фтор-, хлор-, бром-, иод-, трифторметилсульфонил- или (4-метилфенил)сульфонилзамещенных нитробензолов способами, которые включают следующие:a) взаимодействие спиртов с замещенными подходящим образом 2- или 4-галоген- или сульфонат-эфирами нитробензолов или бензонитрилов (способ 4 А) в чистом виде или в подходящем растворителе, таком как тетрагидрофуран, диоксан, ацетонитрил, N,N-диметилформамид или диметилсульфоксид, в присутствии или в отсутствие одного или более мольных эквивалентов основания, такого как карбонат натрия, карбонат калия, гидроксид натрия, гидроксид калия, гидрид натрия, гидрид калия или подобные, при температуре в диапазоне от комнатной до температуры кипения растворителя с обратным холодильником;b) взаимодействие предварительно полученных фенолятов натрия, лития или калия с замещенными подходящим образом 2- или 4 галоген- или сульфонат-эфирами нитробензолов или бензонитрилов (способ 4 Н) в чистом виде или в подходящем растворителе, таком как тетрагидрофуран, диоксан, ацетонитрил, N,N-диметилформамид или диметилсульфоксид, при температуре в диапазоне от комнатной до температуры кипения растворителя с обратным холодильником; илиc) взаимодействие аммиака, первичных или вторичных аминов с замещенными подходящим образом 2- или 4-галоген- или сульфонатными эфирами нитробензолов или бензонитрилов (способы 4 С, F) в чистом виде или в подходящем растворителе, таком как тетрагидрофуран, диоксан, ацетонитрил, N,N-диметилформамид или диметилсульфоксид, при температуре в диапазоне от комнатной до температуры кипения растворителя с обратным холодильником;d) взаимодействие предварительно полученных натриевых, литиевых или калиевых солей аминов с замещенными подходящим образом 2- или 4-галоген- или сульфонатными эфирами нитробензолов или бензонитрилов (способы 4G) в подходящем растворителе, таком как тетрагидрофуран, при температуре в диапазоне от 0 С до температуры кипения растворителя с обратным холодильником; или е) взаимодействие сульфида натрия с замещенными подходящим образом 2- или 4 галоген- или сульфонатными эфирами нитробензолов или бензонитрилов в чистом виде или в подходящем растворителе, таком как тетра 17 гидрофуран, диоксан, ацетонитрил, N,N-диметилформамид или диметилсульфоксид, при температуре в диапазоне от комнатной до температуры кипения растворителя с обратным холодильником с последующим добавлением непосредственно к реакционной смеси алкилгалогенида (способ 4 Е). Альтернативно, ссылаясь на способы 5 С и 6, нитробензольные промежуточные продукты,которые, в конечном счете, превращают в амины 2, где по меньшей мере один заместитель R1R5 определен как алкокси, можно получить из соответствующих замещенных гидроксинитробензолов способами, которые включают следующие:a) взаимодействие гидроксинитробензола с алкилгалоген- или диалкилсульфонатным эфиром (способ 5 С) в присутствии основания, такого как карбонат калия, карбонат натрия, гидроксид калия, гидроксид натрия, гидрид калия или гидрид натрия, в подходящем растворителе,таком как ацетон, N,N-диметилформамид, тетрагидрофуран или диметилсульфоксид, при температуре в диапазоне от комнатной до температуры кипения растворителя с обратным холодильником; илиb) взаимодействие гидроксинитробензола с алифатическим спиртом, трифенилфосфином и диалкилазадикарбоксилатным реагентом (способ 6), таким как диэтилазодикарбоксилат, в безводном апротонном растворителе, таком как диэтиловый эфир или тетрагидрофуран, при температуре в диапазоне от 0 С до температуры кипения растворителя с обратным холодильником, главным образом, согласно способам, описанным в работе Mitsunobu О., Synthesis, 1981, 1 и ссылках к ней. Кроме того, ссылаясь на cпособ 5 А и 5 Е,карбамоиламинные производные, используемые в качестве исходных материалов в cпособах 3 А 3 С, которые, в конечном счете, превращают в амины 2, в которых по меньшей мере один заместитель R1-R5 определен как алкокси, можно получить из соответствующего замещенного гидроксиариламино-трет-бутилкарбамата путем взаимодействия с алкилгалогенидами, трифторметансульфонатами, 4-метилбензолсульфонатами, диалкилсульфонатом, этиленкарбонатом и подобным в присутствии подходящего основания, такого как карбонат калия, в подходящем растворителе, таком как ацетон, толуол илиN,N-диметилформамид, при температуре в диапазоне от комнатной до температуры кипения растворителя с обратным холодильником. Альтернативно, ссылаясь на способы 7AG, нитробензольные промежуточные продукты,которые, в конечном счете, превращают в амины 2, где R1 и/или R3 представляет алкокси, R2 и/или R4 представляет галоген, и Х представляет связь, можно получить стандартными способами галогенирования, которые включают следующие:b) взаимодействие 2-гидрокси-4-метоксиили 2,4-диметокси-нитробензола (способы 7 С и 7D) с бромом в подходящем растворителе, таком как хлороформ, дихлорметан, ледяная уксусная кислота или подобные, в присутствии или в отсутствие трифторацетата серебра при комнатной температуре; илиc) взаимодействие 2,4-диметоксинитробензола (способ 7 Е) с бензилтриметиламмоний дихлориодатом в присутствии безводного хлорида цинка в подходящем растворителе, таком как ледяная уксусная кислота, при комнатной температуре; илиd) взаимодействие 2-гидрокси-4-метоксинитробензола (способ 7F) с бензилтриметиламмоний дихлориодатом в присутствии бикарбоната натрия в подходящей смеси растворителей,такой как дихлорметан и метанол, при комнатной температуре; илиe) взаимодействие 2,4-диметоксинитробензола (способ 7G) с 3,5-дихлор-1-фторпиридин трифлатом в подходящем растворителе,таком как тетрахлорэтан, при температуре в диапазоне от комнатной до температуры кипения растворителя с обратным холодильником. Ссылаясь на способ 8, нитробензольные промежуточные продукты, которые, в конечном счете, превращают в амины 2, где R4 = -СF3, иR1-R3 и R5-R8 такие, как определено выше, и Х представляет связь, можно получить из соответствующих замещенных 4-иоднитробензолов путем взаимодействия с триметил(трифторметил)силаном в присутствии иодида меди (I) и фторида калия в подходящем растворителе, таком как N,N-диметилформамид или подобный,при температуре в диапазоне от комнатной до температуры кипения растворителя с обратным холодильником в закупоренном реакционном сосуде. Ссылаясь на способы 19 А и 19 В, нитробензольные промежуточные продукты, которые,в конечном счете, превращают в амины 2, где R4R5 такие, как определено выше, и Х представляет связь, можно получить из соответствующего замещенного 4-(N-хлорацетил)нитроанилина путем взаимодействия с подходящим вторичным амином, таким как диметиламин, морфолин или подобные, в подходящем растворителе,таком как тетрагидрофуран и/или водные смеси,при температуре в диапазоне от комнатной до температуры кипения растворителя с обратным холодильником или путем взаимодействия с подходящим тиолом в присутствии подходящего основания, такого как карбонат натрия или калия или подобное, в подходящем растворителе, таком как тетрагидрофуран, 1,4-диоксан или подобные, при температуре в диапазоне от ком 19 натной до температуры кипения растворителя с обратным холодильником. Ссылаясь на способ 25, нитробензольные промежуточные продукты, которые, в конечном счете, превращают в амины 2, где по меньшей мере один заместитель R1-R5 определен как трифлат, и Х представляет связь, можно получить из соответствующего фенола путем взаимодействия с трифторметансульфоновым ангидридом в присутствии третичного амина, такого как триэтиламин, диизопропилэтиламин или подобный, в подходящем растворителе, таком как дихлорметан, при температуре в диапазоне от 0 С до комнатной температуры. Ссылаясь на способы 9, 9 В и 10, карбамоиламинные производные, используемые в качестве исходных материалов в способах 3 А 3 С, которые, в конечном счете, превращают в амины 2, где по меньшей мере один заместительR1-R5 определен как алкилсульфенил или алкилсульфинил, можно получить путем взаимодействия подходящего 4-алкилтиоацилариламино- или карбамоилариламино-производного с подходящим окислителем, таким как диметилоксиран или периодат натрия, в подходящей смеси растворителей, такой как ацетон и дихлорметан или вода, при комнатной температуре. Ссылаясь на способ 12, карбамоиламинные производные, используемые в качестве исходных материалов в способах 3 А-3 С, которые, в конечном счете, превращают в амины 2, где R4 определен как 1-гидроксиэтил, R1-R3 и R5 такие,как определено выше, и Х представляет связь,можно получить посредством взаимодействия соответствующего 4-винилкарбамоиланилина с боргидридом натрия в присутствии ацетата ртути в подходящем растворителе, таком как тетрагидрофуран, 1,4-диоксан или подобные, и воды при комнатной температуре. Ссылаясь на способ 13, карбамоиламинные производные, используемые в качестве исходных материалов в способах 3 А-3 С, которые, в конечном счете, превращают в амины 2, где R4 определен как 2-гидроксиэтил, R1-R3 и R5 такие,как определено выше, и Х представляет связь,можно получить посредством взаимодействия соответствующего 4-винилкарбамоиланилина с боргидридом натрия в присутствии ледяной уксусной кислоты в подходящем растворителе,таком как тетрагидрофуран, 1,4-диоксан или подобные, при температуре в диапазоне от 0 С до комнатной температуры. Ссылаясь на способ 14, карбамоиламинные производные, используемые в качестве исходных материалов в способах 3 А-3 С, которые, в конечном счете, превращают в амины 2, где R4 определен как 1-азидоэтил, R1-R3 и R5 такие, как определено выше, и Х определен выше, можно получить посредством взаимодействия соответствующего 4-(1-гидроксиэтил)карбамоиланилина с азотистоводородной кислотой в присут 004205 20 ствии диалкилазодикарбоксилата, такого как диэтилазодикарбоксилат и трифенилфосфина в подходящей смеси растворителей, такой как тетрагидрофуран и дихлорметан, при температуре в диапазоне от 0 С до комнатной температуры. Ссылаясь на способ 15, карбамоиламинные производные, используемые в качестве исходных материалов в способах 3 А-3 С, которые, в конечном счете, превращают в амины 2, где R4 определен как 3-диметиламинопроп-1-инил, R1R3 и R5 такие, как определено выше, и Х определен выше, можно получить посредством взаимодействия соответствующего 4-иодкарбамоиланилина с 1-диметиламино-2-пропином в подходящем третичном амине в качестве растворителя, таком как триэтиламин или диизопропилэтиламин, в присутствии бис(трифенилфосфин)палладий(II) хлорида и иодида меди (I) при температуре в диапазоне от комнатной до температуры кипения растворителя с обратным холодильником. Ссылаясь на способ 16, карбамоиламинные производные, используемые в качестве исходных материалов в способах 3 А-3 С, которые, в конечном счете, превращают в амины 2, где R4 определен как 3-диметиламиноакрилоил, R1-R3 и R5 такие, как определено выше, и Х представляет связь, можно получить посредством взаимодействия соответствующего 4-(3-диметиламино-проп-1-инил)карбамоиланилина с подходящей перкислотой, такой как 3-хлорпероксибензойная кислота, в подходящей смеси растворителей, такой как дихлорметан и метанол, при температуре в диапазоне от 0 С до комнатной температуры. Ссылаясь на способы 17 и 18, карбамоиламинные производные, используемые в качестве исходных материалов в способах 3 А-3 С, которые, в конечном счете, превращают в амины 2,где R4 определен как 4-изоксазол-5-ил или 4(1H-пиразол-3-ил), R1-R3 и R5 такие, как определено выше, и Х представляет связь, можно получить посредством взаимодействия соответствующего 4-(3-диметиламиноакрилоил)карбамоиланилина с гидроксиламин гидрохлоридом или гидразингидратом в подходящем растворителе, таком как 1,4-диоксан или этанол и подобные, при комнатной температуре. Ссылаясь на способ 20, карбамоиламинные производные, используемые в качестве исходных материалов в способах 3 А-3 С, которые, в конечном счете, превращают в амины 2, гдеR4 = -HNCO2Z, R1-R3, R5 и Z такие, как определено выше, и Х представляет связь, можно получить посредством взаимодействия соответствующего 4-аминокарбамоиланилина с 1,1 карбонил-ди(1,2,4)триазолом и замещенным подходящим образом спиртом в подходящей смеси растворителей, такой как тетрагидрофуран и дихлорметан и подобные, при температуре в диапазоне от комнатной до температуры 21 кипения растворителя с обратным холодильником. Ссылаясь на способы 26 и 30, карбамоиламинные производные, используемые в качестве исходных материалов в способах 3 А-3 С, которые, в конечном счете, превращают в амины 2, в которых по меньшей мере один заместитель изR1-R5 определен как диалкиламино, и Х определен выше, можно получить путем взаимодействия подходящим образом замещенных альдегидов в присутствии цианборгидрида натрия или газообразного водорода и 10% палладия на угле в подходящем растворителе, таком как вода,метанол, смеси тетрагидрофурана или толуол или подобные, при комнатной температуре. Ссылаясь на способы 27 и 28, амины 2, в которых по меньшей мере один заместитель изR1-R5 определен как гидроксил, и Х определен выше, можно получить путем взаимодействия соответствующих сложных эфиров, таких как ацетаты, с подходящим основанием, таким как бикарбонат натрия или гидроксид натрия, в подходящей смеси растворителей, такой как смеси метанол-вода, при температуре в диапазоне от комнатной до температуры кипения растворителя с обратным холодильником. Ссылаясь на способ 29, амины 2, в которых по меньшей мере один заместитель из R1-R5 определен как 2-гидроксибензамидо, и Х определен выше, можно получить путем взаимодействия соответствующего N-(4-аминофенил) фталимида с боргидридом лития в подходящем растворителе, таком как тетрагидрофуран, диэтиловый эфир или подобные, при комнатной температуре. Промежуточные амины 2, в которых R1-R5 такие, как определено выше, и Х представляет-СН 2- или -(CH2)2-, можно получить следующими способами: а) восстановление замещенного подходящим образом бензо- или фенилацетонитрила комплексом боран-диметилсульфид в подходящем растворителе, таком как диметиловый эфир этиленгликоля, тетрагидрофуран или подобные при температуре в диапазоне от комнатной до температуры кипения растворителя с обратным холодильником (способ 44);b) восстановление при давлении водорода,равном одной атмосфере или более, в присутствии подходящего катализатора, такого как 5% или 10% палладий на угле, и кислоты, такой как 4-метилбензолсульфоновая кислота, хлористоводородная кислота или подобные, в подходящем растворителе, таком как монометиловый эфир этиленгликоля, этилацетат, этанол или подобные при комнатной температуре (способ 50);c) восстановление литийалюминийгидридом в подходящем растворителе, таком как тетрагидрофуран или диэтиловый эфир, при температуре в диапазоне от 0 С до комнатной температуры (способ 51). 22 Ненасыщенные нитро-предшественники,которые используют в качестве исходных материалов в способе 51 и, в конечном счете, превращают в амины 2, где R1-R5 такие, как определено выше, и Х представляет -(CH2)2-, можно получить посредством взаимодействия замещенного подходящим образом бензальдегида с нитрометаном в присутствии ацетата аммония в подходящем растворителе, таком как уксусная кислота, при температуре в диапазоне от комнатной до температуры кипения растворителя с обратным холодильником (способ 53). Бензальдегиды, используемые в качестве исходных материалов в способе 53, можно получить восстановлением замещенных подходящим образом бензонитрилов при помощи диизобутилалюминийгидрида (способ 52). Замещенные бензонитрилы, используемые в качестве исходных материалов в способе 52, можно получить из соответствующих арилбромидов путем взаимодействия с цианидом меди(II) в подходящем растворителе, таком как N,N-диметилформамид,при температуре в диапазоне от комнатной до температуры кипения растворителя с обратным холодильником (способ 59). Для аминов 2, где R1-R5 такие, как определено выше, и Х представляет -O(CH2)2NH2 или-S(CH2)2NH2, можно получить необходимые нитрильные предшественники посредством взаимодействия замещенных подходящим образом фенолов или тиофенолов с бромацетонитрилом в присутствии подходящего основания,такого как карбонат калия, в подходящем растворителе, таком как ацетон, при комнатной температуре согласно способу 49. Альтернативно, для аминов 2, где R1-R5 такие, как определено выше, и Х представляет-(СН 2)3-, можно получить нитрильные предшественники, главным образом, согласно методике работы Wilk В., Synthetic Соmm., 23, 2481(1993), посредством взаимодействия замещенного подходящим образом фенетанола с ацетонциангидрином и трифенилфосфином в присутствии подходящего азодикарбоксилата, такого как диэтилазодикарбоксилат, в подходящем растворителе, таком как диэтиловый эфир, тетрагидрофуран или подобные, при температуре в диапазоне от 0 С до комнатной температуры(способ 54). Альтернативно, промежуточные амины 2,где R1-R5 такие, как определено выше, и Х представляет -(СН(СН 3-, можно получить путем катализируемого кислотой или основанием гидролиза соответствующего формамида, используя подходящий кислотный катализатор, такой как 6 н. соляная кислота, или подходящий основный катализатор, такой как 5 н. гидроксид натрия или калия, в подходящей смеси растворителей, такой как вода и метанол или вода и этанол, при температуре в диапазоне от комнатной до температуры кипения растворителя с обратным холодильником (способ 46). 23 Формамидные предшественники, которые используют в качестве исходных материалов в способе 46 и, в конечном счете, превращают в амины 2, получают согласно способу 45, воздействуя на замещенный подходящим образом,ацетофенон, формиатом аммония, муравьиной кислотой и формамидом при температуре в диапазоне от комнатной до температуры кипения растворителя с обратным холодильником. Альтернативно, амины 2, где R1-R5 такие,как определено выше, и Х представляет-(СН(СН 3-, можно получить путем восстановления замещенного подходящим образом Oметилоксима в присутствии боргидрида натрия и тетрахлорида циркония в подходящем растворителе, таком как тетрагидрофуран или диэтиловый эфир, при комнатной температуре (способ 48), главным образом, согласно методике работы Itsuno S., Sakurai Y., Ito К., Synthesis,1988, 995. Необходимые O-метилоксимы можно получить из соответствующих ацетофенонов посредством взаимодействия с метоксиламин гидрохлоридом и пиридином в подходящем растворителе, таком как этанол или метанол, при температуре в диапазоне от комнатной до температуры кипения растворителя с обратным холодильником (способ 47). Амины 2, для которых R1-R5 такие, как определено выше, и Х представляет -CH(J)-, где J такой, как определено выше, можно получить путем восстановления замещенного подходящим образом кетона способами, описанными выше (способы 45, 47 и 48). Необходимые кетоны, если таковых нет в продаже, можно получить путем взаимодействия замещенного подходящим образом бензальдегида с подходящим металлоорганическим реагентом, таким как фениллитий, изопропилмагнийбромид или этилмагнийбромид и подобные, в подходящем растворителе, таком как диэтиловый эфир или тетрагидрофуран, при температуре в диапазоне от-78 С до 0 С (способ 57). Полученные спирты можно окислить до соответствующих кетонов при помощи подходящего окислителя, такого как триоксид хрома в водной серной кислоте и ацетон или пиридиний хлорохромат или пиридиний дихромат в подходящем растворителе,таком как дихлорметан или подобный, при комнатной температуре (способ 58). Промежуточные анилины 5 можно получить, как описано ранее в способе 3 А. Таким образом, обработка трет-бутилового эфира фенилкарбаминовой кислоты 6, где G такой, как описано выше, чистой трифторуксусной кислотой при комнатной температуре с последующей нейтрализацией водным гидроксидом натрия дает требуемые анилины 5. Необходимые эфиры карбаминовой кислоты 6, где G такой, как описано выше, получают, как показано в способе 2 С, посредством взаимодействия замещенных хлорангидридов кислот 8, где G такой, как описано выше, и трет-бутилового эфира 4 004205 24 аминофенилкарбаминовой кислоты 7 в присутствии триэтиламина в подходящем растворителе, таком как дихлорметан, диметилсульфоксид,диметилформамид или их смеси. Хлорангидриды карбоновых кислот 8 либо являются коммерчески доступными, либо их получают из соответствующей карбоновой кислоты путем взаимодействия с оксалилхлоридом в подходящем растворителе, таком как дихлорметан, при комнатной температуре. Способ 2 С, 3 А Альтернативно, эфиры карбаминовой кислоты 6, где G такой, как описано выше, получают, как показано в способе 2 Е, посредством взаимодействия замещенных карбоновых кислот 8 а, где G такой, как описано выше, и замещенных подходящим образом трет-бутиловых эфиров 4-аминофенилкарбаминовой кислоты 7 в присутствии подходящего агента сочетания,такого как бензотриазол-1-илокси-трис-(диметиамино)фосфоний гексафторфосфат, 2-(1 Нбензотриазол-1-илокси)-1,1,3,3-тетраметилуроний гексафторфосфат, дициклогексилкарбодиимид или подобные, и в присутствии третичного аминного основания, такого как триэтиламин или диизопропилэтиламин, в подходящем растворителе, таком как дихлорметан, диметилформамид и подобные при комнатной температуре с получением соответствующего ариламиноамида. Карбоновые кислоты 8 а либо имеются в продаже, либо их получают согласно способам,известным из литературы. Например, если G является замещенным тиадиазолом, кислоту получают из соответствующего эфира карбоновой кислоты путем взаимодействия с подходящим основанием, таким как гидроксид натрия или калия в подходящей смеси растворителей,такой как метанол или этанол и вода, при комнатной температуре. Если предшествующие эфиры карбоновых кислот, которые, в конечном счете, превращают в кислоты 8, отсутствуют в продаже, их можно получить известными из литературы способами. Например, эфиры 5-замещенных-1,2,3-тиадиазол-4-карбоновых кислот можно получить,главным образом, согласно методике работ Caron M., J. Org. Chem., 51, 4075 (1986) и Taber(1986). Так, согласно способу 21 обработка эфира бета-кетокарбоновой кислоты посредством 4 метилбензолсульфонилазида, метансульфонилазида или подобного в присутствии третичного аминного основания, такого как триэтиламин или диизопропилэтиламин, в подходящем растворителе, таком как ацетонитрил, дает соответствующий эфир диазо-бета-кетокарбоновой кислоты. Обработка данного соединения 2,4 25 бис(4-метоксифенил)-1,3-дитиа-2,4-дифосфетан-2,4-дисульфидом в подходящем растворителе, таком как бензол, толуол или подобный, при температуре в диапазоне от комнатной до температуры кипения растворителя с обратным холодильником дает требуемый эфир 5 замещенной-1,2,3-тиадиазол-4-карбоновой кислоты. Альтернативно, эфиры 4-замещенных 1,2,3-тиадиазол-5-карбоновых кислот можно получить, по существу, согласно методике работы Shafiee A., Lalezari I., Yazdani S., Shahbazian F.M., Partovi Т., J. Pharmaceutical Sci., 65,304 (1976). Так, согласно способам 22 и 23 взаимодействие замещенного подходящим образом эфира бета-кетокарбоновой кислоты в подходящем спиртовом растворителе, таком как метанол или этанол, с водным раствором семикарбазид гидрохлорида при температуре в диапазоне от комнатной до температуры кипения растворителя с обратным холодильником в присутствии подходящего основания, такого как пиридин, дает соответствующее семикарбазоновое производное. Обработка данного соединения чистым тионилхлоридом при 0 С с последующей обработкой избытком водного раствора бикарбоната натрия дает соответствующие эфиры 4-замещенной-1,2,3-тиадиазол-5-карбоновой кислоты. 4-Карбоалкокситиазолы получают, по существу, согласно методике работы Schollkopf(1979). Так, согласно способам 55 и 56 взаимодействие этилизоцианацетата с диметилацеталем N,N-диметилформамида в подходящем спиртовом растворителе, таком как этанол, при комнатной температуре дает соответствующий этиловый эфир 3-диметиламино-2-изоцианакриловой кислоты. Раствор данного соединения в подходящем растворителе, таком как тетрагидрофуран, обрабатывают газообразным сероводородом в присутствии подходящего третичного аминного основания, такого как триэтиламин, дииозопропилэтиламин или подобное, при комнатной температуре, получая соответствующий 4-карбоэтокситиазол. Кроме того, замещенные подходящим образом тиазолы можно получить, по существу,согласно методике работы Bredenkamp M.W.,Holzafel C.W., van Zyl W.J., Synthetic Comm., 20,2235 (1990). Подходящие ненасыщенные оксазолы получают, по существу, согласно методике работы Henneke K.H., Schollkopf U., Neudecker Т., Liebigs Ann. Сhem., 1979 (1979). Замещенные оксазолы можно получить, главным образом,согласно методикам работ Galeotti N., Montagne С., Poncet J., Jouin P., Tetrahedron Lett., 33, 2807Y., Chemistry Lett., 1305 (1994). Следующие конкретные примеры являются иллюстративными, а не рассматриваются как ограничения настоящего изобретения. 26 Пример 1 (способ 1 А). 4-Метокси-3-трифторметилфениламин. На суспензию 4-метокси-3-фторметилнитробензола (2,2 г) и порошка железа (1,68 г) в этаноле (35 мл) и воде (15 мл) воздействуют раствором концентрированной соляной кислоты(0,42 мл) в этаноле (6 мл) и воде (3 мл) и нагревают смесь при кипении с обратным холодильником в течение 1 ч. Затем смесь охлаждают,фильтруют и концентрируют при пониженном давлении. Полученное масло растворяют в этилацетате и экстрагируют три раза 5% водной соляной кислотой. После этого объединенные кислотные экстракты охлаждают на бане со льдом, подщелачивают твердым карбонатом калия и затем экстрагируют этилацетатом. Эти органические экстракты промывают насыщенным водным хлоридом натрия, сушат над безводным сульфатом натрия, концентрируют при пониженном давлении и затем пропускают через короткую колонку с силикагелем (в качестве элюента используют этилацетат), получая требуемое соединение в виде янтарно-желтого масла. Применяя описанную выше методику и подходящие исходные вещества, получают следующие соединения: 2,6-дихлорбензол-1,4-диамин,3-хлор-4-метилсульфанилфениламин,2,6-дибромбензол-1,4-диамин,3-хлор-4-трифторметилфениламин,3-хлор-4-этилсульфанилфениламин,4-метокси-3-трифторметилфениламин,3,5-дихлор-4-метокси-2-метилфениламин,5-хлор-2-этокси-4-метоксифениламин,5-хлор-4-этокси-2-метоксифениламин,5-иод-2,4-диметоксифениламин,3,5-дииод-2,4-диметоксифениламин,3,5-дибром-2,4-диметоксифениламин,5-хлор-2-метокси-4-метилфениламин,2-хлор-N(1),N(1)-диметилбензол-1,4 диамин,3-хлор-4-пиперидин-1-илфениламин,3-хлор-4-пирролидин-1-илфениламин,N(1)-бензил-2-хлорбензол-1,4-диамин,3-хлор-4-(4-метилпиперазин-1-ил)фениламин,2-хлор-N(1)-метил-N(1)-(1-метилпиперидин-4-ил)бензол-1,4-диамин,2-хлор-N(1)-метил-N(1)-(1-метилпирролидин-3-ил)бензол-1,4-диамин,2-хлор-N(1)-метил-N(1)-фенилбензол-1,4 диамин,N(1)-(1-бензилпирролидин-3-ил)-2-хлорN(1)-метилбензол-1,4-диамин,2-хлор-N(1)-циклопентил-N(1)метилбензол-1,4-диамин,2-[(4-амино-2-хлорфенил)-(2-гидроксиэтил)амино]этанол,2-хлор-N(1)-гексил-N(1)-метилбензол-1,4 диамин, 27 2-хлор-N(1)-изобутил-N(1)-метилбензол 1,4-диамин,2-[(4-амино-2-хлорфенил)метиламино] этанол,2-хлор-N(1)-(3-диметиламинопропил)N(1)-метилбензол-1,4-диамин,2-хлор-N(1)-(2-диметиламиноэтил)-N(1)метилбензол-1,4-диамин,2-хлор-N(1)-(2-диметиламиноэтил)бензол 1,4-диамин,N(1)-(1-бензилпиперидин-4-ил)-2-хлорбензол-1,4-диамин,2-хлор-N(1)-(2-метоксиэтил)-N(1)-метилбензол-1,4-диамин,2-хлор-N(1)-(3-диметиламинопропил)бензол-1,4-диамин,N(1)-(1-бензилпирролидин-3-ил)-2-хлорбензол-1,4-диамин,3-хлор-4-(1-метилпиперидин-4-илокси) фениламин,3-хлор-4-(2-диметиламиноэтокси)фениламин,3-хлор-4-(3-диметиламинопропокси)фениламин 3-хлор-4-(1-метилпирролидин-3-илокси) фениламин,3-хлор-4-циклогексилоксифениламин. Пример 2 (способ 1 В). 4-Бром-2,4-диметоксифениламин. Суспензию 4-бром-2,4-диметоксинитробензола (0,48 г) и порошка железа (0,42 г) в уксусной кислоте (10 мл) и этаноле (10 мл) нагревают при 120 С в течение примерно 5 ч. Затем смесь охлаждают, фильтруют и концентрируют при пониженном давлении. Добавляют воду и смесь охлаждают на бане со льдом, нейтрализуют твердым карбонатом калия и затем экстрагируют дихлорметаном. Эти органические экстракты промывают насыщенным водным хлоридом натрия, сушат над безводным сульфатом натрия, концентрируют при пониженном давлении и затем хроматографируют на силикагеле (в качестве элюента используют 20% этилацетат в гексане), получая требуемое соединение в виде янтарно-желтого масла. Пример 3 (способ 1 С). трет-Бутиловый эфир(4-амино-2,6-дихлорфенокси)уксусной кислоты. На раствор трет-бутилового эфира (4 нитро-2,6-дихлорфенокси) уксусной кислоты (1 г) в этаноле (17 мл) и воде (8,6 мл) воздействуют порошком железа (0,861 г) и хлоридом аммония (86 мг) и нагревают смесь при кипении с обратным холодильником в течение примерно 1 ч. Затем смесь фильтруют и концентрируют при пониженном давлении. Полученное масло распределяют между водой и этилацетатом и органическую фазу промывают насыщенным водным хлоридом натрия, сушат над безводным сульфатом натрия, концентрируют при пониженном давлении, получая требуемое соединение в виде бледно-желтого твердого вещества. 28 Применяя описанную выше методику и подходящие исходные вещества, получают следующие соединения: 4-хлорбензол-1,2-диамин,N-(4-амино-2-хлорфенил)ацетамид,(4-амино-2,6-дихлорфенокси)ацетонитрил,трет-бутиловый эфир (4-амино-2,6-дихлорфенокси)уксусной кислоты,(2-амино-4-хлор-5-метоксифенокси)ацетонитрил,метиловый эфир (4-амино-2-хлор-5-метоксифенокси)уксусной кислоты,трет-бутиловый эфир (4-амино-2-хлор-5 метоксифенокси)уксусной кислоты,трет-бутиловый эфир (2-амино-4-хлор-5 метоксифенокси)уксусной кислоты,N(1)-бензил-4-хлор-5-метоксибензол-1,2 диамин,N-(4-амино-2-хлорфенил)-2-фторбензамин,N-(4-амино-5-хлор-2-гидроксифенил)ацетамид,N-(4-амино-5-хлор-2-гидроксифенил)-2 фторбензамид,(4-амино-2-хлорфенил)амид фуран-2-карбоновой кислоты,этиловый эфир (4-амино-2-хлорфенил) карбоновой кислоты,N-(4-амино-5-хлор-2-метилфенил)ацетамид,N-(4-амино-5-хлор-2-метилфенил)-2-фторбензамид,(4-амино-5-хлор-2-метилфенил)амид фуран-2-карбоновой кислоты,N-(4-амино-3-хлорфенил)-2-фторбензамид,(4-амино-3-хлорфенил)амид фуран-2-карбоновой кислоты,N-(4-амино-2-хлорфенил)-2-диметиламиноацетамид,N-(4-амино-2-хлорфенил)-2-пиперидин-1 илацетамид,N-(4-амино-2-хлорфенил)-2-морфолин-4 илацетамид,N-(4-амино-2-хлорфенил)метансульфонамид,N-(4-амино-2-хлорфенил)бензамид,N-(4-амино-2-хлорфенил)-2-диэтиламиноацетамид,N-(4-амино-2-хлорфенил)-2-пирролидин-1 илацетамид,N-(4-амино-2-хлорфенил)-2-азепан-1-илацетамидN-(4-амино-2-хлорфенил)-2-(2-метилпиперидин-1-ил)ацетамид,N-(4-амино-2-хлорфенил)-2-(3-метилпиперидин-1-ил)ацетамид,3-хлорбензол-1,2-диамин,4-хлор-N,N-диметилбензол-1,2-диамин. Пример 4 (способ 1D). 3,5-Дихлор-4 феноксифениламин. К суспензии 3,5-дихлор-4-феноксинитробензола (6,1 г) и порошка олова (12 г) добавляют по капле концентрированную соляную ки 29 слоту (60 мл). Добавляют этанол (60 мл) и нагревают смесь при кипении с обратным холодильником в течение примерно 1 ч. Затем смесь охлаждают на бане со льдом и подщелачивают,добавляя твердый гидроксид натрия. Полученную суспензию фильтруют через подушку из диатомовой земли и экстрагируют три раза этилацетатом. Объединенные органические экстракты промывают насыщенным водным хлоридом натрия, сушат над безводным сульфатом магния и концентрируют при пониженном давлении, получая требуемый продукт в виде желтого твердого вещества. Перекристаллизация из смеси этилацетат-гексан дает продукт в виде бледно-желтого твердого вещества. Применяя описанную выше методику и подходящие исходные вещества, получают следующие соединения: 1-фуран-2-илэтиламин; 3-хлор-4-изопропоксифениламин; 2-бутокси-5-хлор-4-метоксифениламин; 3,5-дихлор-2-метокси-4-метилфениламин; 2-бензилокси-5-дихлор-4-метоксифениламин; 4-бензилокси-5-дихлор-2-метоксифениламин; 5-фтор-2,4-диметоксифениламин; этиловый эфир (4-амино-2,6-дихлорфенокси)уксусной кислоты; 3,5-дихлор-4-феноксифениламин; 2-(4-амино-2-хлор-5-метоксифенокси)ацетамид;(4-аминофенил)карбаминовой кислоты. К раствору N-(4-нитрофенил)изобутириламида (2,0 г) в монометиловом эфире этиленгликоля (100 мл) добавляют 10% палладий на угле (275 мг). Смесь гидрируют в аппарате Парра для гидрирования в течение 2 ч при комнатной температуре и давлении водорода 2,1 кг/см 2. Затем катализатор удаляют фильтрованием через диатомовую землю, а фильтрат выпаривают досуха при пониженном давлении путем троекратной азеотропной перегонки с гептаном. Растирание остатка с гептаном дает требуемый продукт в виде белого твердого вещества. Применяя описанную выше методику и подходящие исходные вещества, получают следующие соединения: 2-метил-3H-бензоимидазол-5-иламин,N-(4-аминофенил)формамид,1 Н-бензимидазол-5-иламин,изобутиловый эфир (4-аминофенил)карбаминовой кислоты,N-(4-аминофенил)изобутирамид,N-(5-аминопиридин-2-ил)-2-метилбензамид,(5-аминопиридин-2-ил)амид фуран-2-карбоновой кислоты,N-(5-аминопиридин-2-ил)-2-фторбензамид,трет-бутиловый эфир [6-(2,2,2-трифторацетиламино)пиридин-3-ил]карбаминовой кислоты,N-(5-аминопиридин-2-ил)-2,2,2-трифторацетамид,трет-бутиловый эфир (4-аминобензил) карбаминовой кислоты,2-(3,5-бис-трифторметилфенил)этиламин,1-трет-бутил-1 Н-имидазол-2-иламин,3-(3-диметиламинопропил)-5-трифторметилфениламин. Пример 6 (способ 1F). N-(4-Амино-2 метилфенил)-2-фторбензамид. Смесь 2-фтop-N-(2-метил-4-нитрофенил) бензамида (4,55 г), циклогексена (30 мл), этано 31 ла (70 мл), воды (30 мл) и 10% палладия на угле(3 г) нагревают при кипении с обратным холодильником в течение 30 мин. Смесь фильтруют через диатомовую землю и концентрируют при пониженном давлении. Полученное масло растворяют в 50 мл этилацетата и охлаждают при 4 С в течение 12 ч. Фильтрование дает продукт в виде рыжевато-коричневого твердого вещества. Применяя описанную выше методику и подходящие исходные вещества, получают следующие соединения:(200 мл) добавляют к раствору тиосульфата натрия (12 г) в воде (60 мл). Смесь нагревают при кипении с обратным холодильником в течение 12 ч, охлаждают и выливают в воду. Затем данную смесь экстрагируют этилацетатом. Этилацетатный раствор дважды промывают насыщенным водным хлоридом натрия, сушат над безводным карбонатом калия, фильтруют через подушку из диатомовой земли и концентрируют при пониженном давлении, получая масло. Добавляют толуол и раствор охлаждают, получая требуемый продукт в виде светло-оранжевого кристаллического твердого вещества. Применяя описанную выше методику и подходящие исходные вещества, получают следующие соединения:N-(4-амино-2-хлорфенил)-2-дипропиламиноацетамид. Пример 8 (способ 2 А). Трет-бутиловый эфир (3-хлор-4-иодфенил)карбаминовой кислоты. К раствору 3-хлор-4-иоданилина (10 г) в тетрагидрофуране (40 мл), содержащему диизопропилэтиламин (6,9 мл), добавляют ди-третбутилдикарбонат (8,6 г), и смесь нагревают до кипения с обратным холодильником. Примерно через 15 ч добавляют дополнительные порции диизопропилэтиламина (6,9 мл) и ди-третбутилдикарбоната (21 г) и продолжают нагревание в течение примерно 24 ч. Затем раствор охлаждают, концентрируют при пониженном давлении, разбавляют этилацетатом и последовательно промывают три раза 5% водной соляной кислотой и один раз насыщенным водным хлоридом натрия. Раствор сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении, получая сырой требуемый продукт в виде коричневого масла. Добав 33 ление гексана вызывает кристаллизацию, собранное твердое вещество перекристаллизовывают из гексана, получая требуемый продукт в виде белого твердого вещества. Применяя описанную выше методику и подходящие исходные вещества, получают следующие соединения: трет-бутиловый эфир N'-(4-нитробензоил)гидразинкарбоновой кислоты,трет-бутиловый эфир (3-хлор-4-иодфенил) карбаминовой кислоты,трет-бутиловый эфир (4-бром-3-хлорфенил)карбаминовой кислоты,трет-бутиловый эфир (3-хлор-4-винилфенил)карбаминовой кислоты,трет-бутиловый эфир (3-хлор-4-метилсульфанилфенил)карбаминовой кислоты,трет-бутиловый эфир (4-амино-3-хлорфенил)карбаминовой кислоты,трет-бутиловый эфир (4-хлор-2-нитрофенил)карбаминовой кислоты,трет-бутиловый эфир (3-трет-бутоксикарбониламино-5-хлорфенил)карбаминовой кислоты,трет-бутиловый эфир (4-нитробензил)карбаминовой кислоты,трет-бутиловый эфир (3-бром-5-трифторметилфенил)карбаминовой кислоты,трет-бутиловый эфир (2-амино-3-хлор-5 трифторметилфенил)карбаминовой кислоты. Пример 9 (способ 2 В). 2-Триметилсиланилэтиловый эфир (3-хлор-4-винилфенил) карбаминовой кислоты. К раствору 3-хлор-4-винилфениламина (3,4 г) в N,N-диметилформамиде (44 мл), содержащему диизопропилэтиламин (5,8 мл), добавляют 1-[2-(триметилсилил)этоксикарбонилокси] бензотриазол (7,1 г), и смесь перемешивают при комнатной температуре в атмосфере аргона в течение трех дней. Затем раствор разбавляют водой и экстрагируют три раза диэтиловым эфиром. Объединенные органические экстракты последовательно промывают водой,насыщенным водным хлоридом натрия, сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Полученный остаток хроматографируют на силикагеле (в качестве элюента используют 10% этилацетат в гексане), получая требуемый продукт в виде желтого масла. Пример 10 (способ 2 С). Трет-бутиловый эфир[4-(2-фторбензоиламино)фенил]карбаминовой кислоты. К раствору моно-N-(трет-бутоксикарбонил)-1,4-фенилендиамина (1,58 г) и триэтиламина (1,50 мл) в 25 мл дихлорметана добавляют орто-фторбензоилхлорид (1,20 г). Немедленно образуется твердое вещество, которое отфильтровывают и промывают свежим растворителем,получая белое твердое вещество, 1,90 г. 34 Применяя описанную выше методику и подходящие исходные вещества, получают следующие соединения:(150 мл) нагревают при кипении с обратным холодильником в течение 1 ч. Раствор охлаждают и концентрируют при пониженном давлении, получая влажное желтое твердое вещество. Добавляют эфир (250 мл) и собирают желтое твердое вещество. Применяя описанную выше методику и подходящие исходные вещества, получают следующие соединения: 38 трет-бутиловый эфир [4-(акрилоиламино) фенил]карбаминовой кислоты,изобутиловый эфир (4-нитрофенил)карбаминовой кислоты,(5-нитропиридин-2-ил)амид[1,2,3]тиадиазол-4-карбоновой кислоты,(5-нитропиридин-2-ил)амид фуран-2-карбоновой кислоты 2-фтор-N-(5-нитропиридин-2-ил)бензамид,N-(2-хлор-4-нитрофенил)-2-фторбензамид,(2,5-диметокси-4-нитрофенил)амид фуран 2-карбоновой кислоты,N-(2-циано-4-нитрофенил)-2-фторбензамид,2-фтор-N-(2-метокси-4-нитрофенил)бензамид,2-метил-N-(5-нитропиридин-2-ил)бензамид,(2-метокси-5-метил-4-нитрофенил)амид фуран-2-карбоновой кислоты,2-фтор-N-(2-метокси-5-метил-4 нитрофенил)бензамид,N-(2-бензоил-4-нитрофенил)ацетамид,N-(2-бензоил-4-нитрофенил)-2-фторбензамид,(2-бензоил-4-нитрофенил)амид фуран-2 карбоновой кислоты,N-(3-метил-4-нитрофенил)ацетамид,2-фтор-N-(3-метил-4-нитрофенил)бензамид,(3-метил-4-нитрофенил)амид фуран-2-карбоновой кислоты,2-ацетамино-5-нитро-N-фенилбензамид,2-[(2-фторбензоил)амино]-5-нитро-N-фенилбензамид,(4-нитро-2-фенилкарбамоилфенил)амид фуран-2-карбоновой кислоты,2-фтор-N-(4-нитронафталин-1 ил)бензамид,(4-нитронафталин-1-ил)амид фуран-2-карбоновой кислоты,N-(5-хлор-2-гидрокси-4-нитрофенил)ацетамид,N-(5-хлор-2-гидрокси-4-нитрофенил)-2 фторбензамид,(2-хлор-4-нитрофенил)амид фуран-2 карбоновой кислоты,N-(4-нитро-2-трифторметилфенил)ацетамид,(2-циано-4-нитрофенил)амид фуран-2-карбоновой кислоты,2-фтор-N-(4-нитро-2-трифторметилфенил) бензамид,(4-нитро-2-трифторметилфенил)амид фуран-2-карбоновой кислоты,2-фтор-N-(2-метил-4-нитрофенил)бензамид,N-(5-хлор-2-метил-4-нитрофенил)-2 фторбензамид,(5-хлор-2-метил-4-нитрофенил)амид фуран-2-карбоновой кислоты, 39 2-(2-фторбензоиламино)-5-нитробензойная кислота,2-[(фуран-2-карбонил)амино]-5-нитробензойная кислота,N-(3-хлор-4-нитрофенил)-2-фторбензамид,(3-хлор-4-нитрофенил)амид фуран-2-карбоновой кислоты,2,6-дифтор-N-(3-метил-4-нитрофенил)бензамид,2-фтор-N-(4-нитро-3-трифторметилфенил) бензамид,(4-нитро-3-трифторметилфенил)амид фуран-2-карбоновой кислоты,2-хлор-N-(2-хлор-4-нитрофенил)ацетамид,N-(2-хлор-4-нитрофенил)метансульфонамид,[3-метокси-4-(2,2,2-трифторацетиламино) фенил]амид фуран-2-карбоновой кислоты,N-(2-хлор-4-нитрофенил)-2,2,2-трифторацетамид. Пример 12. трет-Бутиловый эфир 4-[(4 фенил-[1,2,3]тиадиазол-5-карбонил)амино]фенилкарбаминовой кислоты. На раствор 1-(N-трет-бутоксикарбонил)1,4-фенилендиамина (0,8 г) и 4-фенил[1,2,3]тиадиазол-5-карбоновой кислоты (0,7 г) в дихлорметане (10 мл) воздействуют триэтиламином (1,3 мл) и бензотриазол-1-илокситрис(диметиламино)фосфоний гексафторфосфатом (1,6 г). После перемешивания при комнатной температуре реакционную смесь разбавляют водой и экстрагируют дихлорметаном. Органический слой промывают 0,5 н. соляной кислотой, насыщенным раствором бикарбоната натрия и водой, затем сушат над сульфатом магния, фильтруют и концентрируют при пониженном давлении, получая требуемый продукт. Применяя описанную выше методику и подходящие исходные вещества, получают следующие соединения: трет-бутиловый эфир 4-[(1 Н-пиррол-2 карбонил)амино]фенилкарбаминовой кислоты,трет-бутиловый эфир 4-[(пиразин-2 карбонил)амино]фенилкарбаминовой кислоты,трет-бутиловый эфир 4-[(5-метилтиофен 2-карбонил)амино]фенилкарбаминовой кислоты,трет-бутиловый эфир 4-[(1-метил-1 Нпиррол-2-карбонил)амино]фенилкарбаминовой кислоты,трет-бутиловый эфир 4-[(хинолин-8 карбонил)амино]фенилкарбаминовой кислоты,трет-бутиловый эфир 4-[(бензофуран-2 карбонил)амино]фенилкарбаминовой кислоты,трет-бутиловый эфир 4-[(изохинолин-1 карбонил)амино]фенилкарбаминовой кислоты,трет-бутиловый эфир 4-[(хинолин-2 карбонил)амино]фенилкарбаминовой кислоты,трет-бутиловый эфир 4-[(пиридин-2 карбонил)амино]фенилкарбаминовой кислоты,трет-бутиловый эфир 4-[(изохинолин-4 карбонил)амино]фенилкарбаминовой кислоты, 004205[1,2,3]тиадиазол-4 карбоновой кислоты,трет-бутиловый эфир 4-[([1,2,3]тиадиазол-4-карбонил)амино]фенилкарбаминовой кислоты,4-(4-трет-бутоксикарбониламинофенилкарбомаил)фениловый эфир уксусной кислоты,трет-бутиловый эфир 4-[(хинолин-6-карбонил)амино]фенилкарбаминовой кислоты. Пример 13 (способ 2F). 2-(4-трет-Бутоксикарбониламино-2,6-дихлорфенокси)этиловый эфир уксусной кислоты. На раствор трет-бутилового эфира [3,5 дихлор-4-(2-гидроксиэтокси)фенил]карбаминовой кислоты (0,85 г) в пиридине (14 мл) воздействуют уксусным ангидридом (1,24 мл), и смесь перемешивают при комнатной температуре в течение 15 ч. Растворитель удаляют при пониженном давлении, а остаток растворяют в этилацетате. Затем этот раствор промывают дважды 5% водной соляной кислотой, один раз насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия. Этот раствор сушат над безводным сульфатом магния и удаляют растворитель при пониженном давлении, получая требуемый продукт в виде бесцветного масла. Применяя описанную выше методику и подходящие исходные вещества, получают следующие соединения: фенилсульфанилацетонитрил,2-(4-трет-бутоксикарбониламино-2,6 дихлорфенокси)этиловый эфир уксусной кислоты. Пример 14 (способ 2G). Трет-бутиловый эфир(3,5-дихлор-4-гидроксифенил)карбаминовой кислоты. К раствору 2,6-дихлор-4-аминофенола (9,5 г) в тетрагидрофуране (130 мл) добавляют дитрет-бутилдикарбонат (11,7 г), и смесь нагревают при кипении с обратным холодильником примерно 15 ч. Затем раствор охлаждают, концентрируют при пониженном давлении, разбав 41 ляют этилацетатом и последовательно промывают три раза 5% водной соляной кислотой и один раз насыщенным водным раствором хлорида натрия. Раствор сушат над безводным сульфатом натрия и концентрируют при пониженном давлении, получая сырой требуемый продукт. Затем полученное вещество растирают с холодным дихлорметаном, получая продукт в виде белого твердого вещества. Применяя описанную выше методику и подходящие исходные вещества, получают следующее соединение: трет-бутиловый эфир(0,97 г), и смесь перемешивают примерно 45 мин при комнатной температуре. Затем добавляют воду, и смесь охлаждают на бане со льдом и подщелачивают твердым карбонатом калия. Раствор экстрагируют три раза этилацетатом и объединенные органические фазы промывают насыщенным водным раствором хлорида натрия, затем сушат над безводным сульфатом натрия. Концентрирование при пониженном давлении и перекристаллизация из гексана дают требуемый продукт в виде бледно-желтого кристаллического твердого вещества. Применяя описанную выше методику и подходящие исходные вещества, получают следующие соединения: 5-бромпиридин-3-иламин,3-хлор-4-метансульфонилфениламин,N-(4-аминофенил)-2-метилбензамид,2-(4-аминофенилкарбамоил)фениловый эфир уксусной кислоты,N-(4-аминофенил)-4-фторбензамид,N-(4-аминофенил)-3-фторбензамид,N-(4-аминофенил)-2-фторбензамид,N-(4-аминофенил)-2-метоксибензамид,N-(4-аминофенил)-3-метоксибензамид,N-(4-аминофенил)-4-метоксибензамид,N-(4-аминофенил)-2-фенилацетамид,N-(4-аминофенил)-2,2-диметилпропионамид,N-(4-аминофенил)-2,2,2-трифторацетамид,(4-аминофенил)амид тиофен-2-карбоновой кислоты,(4-аминофенил)амид 1 Н-пиррол-2-карбоновой кислоты,N-(4-аминофенил)-3-нитробензамид,3-ацетиламино-N-(4-аминофенил)бензамид,N-(4-аминофенил)-3-диметиламинобензамид,N-(4-аминофенил)-3-метансульфониламинобензамид,N-(4-аминофенил)-2-трифторметилбензамид,N-(4-аминофенил)-2,6-дифторбензамид,N-(4-аминофенил)-2-хлорбензамид, 004205(4-аминометилфенил)амид фуран-2-карбоновой кислоты,N-(4-аминометилфенил)-2-фторбензамид,(4-аминометилфенил)амид-[1,2,3]-тиадиазол-4-карбоновой кислоты,N-(4-аминометилфенил)-2,6-дифторбензамид,(4-аминофенил)амид оксазол-4-карбоновой кислоты,N-(4-аминофенил)-3-хлорбензамид,N-(4-аминофенил)-4-хлорбензамид,4-(4-аминофенилкарбамоил)фениловый эфир уксусной кислоты,N-(4-аминофенил)-4-диметиламинобензамид,1-(4-аминофенил)-3-(3,5-бис-трифторметилфенил)тиомочевина,N-(4-аминофенил)-2-иодбензамид,N-(4-аминофенил)-3-трифторметилбензамид. Пример 16 (способ 3 В). 1-(4-Амино-2 хлорфенил)этанол. 1 М раствор тетрабутиламмоний фторида в тетрагидрофуране (5,7 мл) добавляют к 2 триметилсиланилэтиловому эфиру [3-хлор-4-(1 гидроксиэтил)фенил]карбаминовой кислоты (0,5 г), и смесь перемешивают при комнатной температуре примерно 3,5 ч. Затем раствор концентрируют при пониженном давлении, растворяют в смеси 1:1 этилацетат-гексан, последовательно промывают водой и насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом магния. Удаление растворителя при пониженном давлении с последующей хроматографией на силикагеле (в качестве элюента используют 40% этилацетат в гексане) дает продукт в виде янтарно-желтого масла. Пример 17-1 (способ 3 С). N-(4-Амино-3 цианфенил)-2-фторбензамид. Карбонат калия (5,0 мл) добавляют к раствору N-[3-циано-4-(2,2,2-трифторацетиламино) фенил]-2-фторбензамида (2,5 г) в метаноле (270 мл) и воде (16 мл), и смесь кипятят с обратным холодильником в течение ночи. После удаления растворителя при пониженном давлении остаток суспендируют в воде и экстрагируют дихлорметаном. Органические экстракты объединяют, промывают водой и затем насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении, получая требуемое соединение в виде белого твердого вещества. Применяя описанную выше методику и подходящие исходные вещества, получают следующие соединения:(4-амино-3-фторметилфенил)амид фуран 2-карбоновой кислоты,N-(4-амино-3-метоксифенил)ацетамид,N-(4-амино-3-метоксифенил)-2-фторбензамид,(4-амино-3-метоксифенил)амид фуран-2 карбоновой кислоты. Пример 17-2 (способ 4 А). 2-Хлор-1 циклогексилокси-4-нитробензол. Циклогексанол (2,9 г) в диметилсульфоксиде (20 мл) медленно добавляют в колбу, содержащую гидрид калия (0,90 г, предварительно трижды промыт гексаном) в атмосфере аргона и раствор перемешивают при комнатной температуре примерно 1 ч. Добавляют раствор 3-хлор-4 фторнитробензола (1 г) в диметилсульфоксиде(10 мл) и полученный темно-красный раствор нагревают в течение 3 ч до температуры около 100 С. Затем реакционную смесь охлаждают,разбавляют диэтиловым эфиром (300 мл) и последовательно промывают насыщенным водным хлоридом аммония, три раза водой, затем насыщенным водным хлоридом натрия. Далее органический слой сушат над безводным сульфатом магния, удаляют растворитель при пониженном давлении и полученное масло хроматографируют на силикагеле (в качестве элюента используют 5% этилацетат в гексане), получая требуемый продукт в виде оранжевого твердого вещества. Пример 18 (способ 4 С). (2-Хлор-4-нитрофенил)метил(1-метилпирролидин-3-ил)амин. 3-Хлор-4-фторнитробензол (1,0 г) и N,Nдиметил-3-аминопирролидин (1,72 г) объединяют и перемешивают примерно 24 ч. Затем смесь разбавляют этилацетатом, дважды промывают водой и один раз насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия. После удаления растворителя при пониженном давлении остаток хроматографируют на силикагеле (в качестве элюентов используют чистый этилацетат, а потом чистый метанол), получая требуемый продукт в виде желтого масла. Применяя описанную выше методику и подходящие исходные вещества, получают следующие соединения:(2-хлор-4-нитрофенил)циклопентилметиламин,1-(2-хлор-4-нитрофенил)декагидрохинолин,аллил-(2-хлор-4-нитрофенил)циклогексиламин,2-[(2-хлор-4-нитрофенил)(2-гидроксиэтил) амино]этанол,(2-хлор-4-нитрофенил)изобутилметиламин,(2-хлор-4-нитрофенил)гексилметиламин,2-[(2-хлор-4-нитрофенил)метиламино] этанол,N-(2-хлор-4-нитрофенил)-N,N',N'триметилэтан-1,2-диамин,N-(2-хлор-4-нитрофенил)-N,N',N'-триметилпропан-1,3-диамин,(1-бензилпиперидин-4-ил)(2-хлор-4-нитрофенил)амин,N-(2-хлор-4-нитрофенил)-N',N'-диметилэтан-1,2-диамин,N-(2-хлор-4-нитрофенил)-N',N'-диметилпропан-1,3-диамин,(2-хлор-4-нитрофенил)(2-метоксиэтил)метиламин,(1-бензилпирролидин-3-ил)(2-хлор-4-нитрофенил)амин,4-пиперидин-1-ил-3-трифторметилбензонитрил,4-диметиламино-3-трифторметилбензонитрил,4-(4-метилпиперизин-1-ил)-3-трифторметилбензонитрил. Пример 19 (способ 4 Е). Бутил-(2-хлор-4 нитрофенил)тиоэфир. Раствор 3-хлор-4-фторнитробензола (5,0 г) и сульфида натрия (2,5 г) в N,N-диметилформамиде (30 мл) перемешивают при комнатной температуре в течение 1 ч и затем воздействуют 1-иодбутаном (12,6 г). Затем удаляют растворитель при пониженном давлении и воздействуют на полученный остаток этилацетатом и гексаном для осаждения неорганических солей. Твердые вещества удаляют фильтрованием, а фильтрат концентрируют при пониженном давлении. Полученный остаток затем пропускают через водный силикат магния, используя в качестве элюента дихлорметан, и получают требуемое соединение в виде желтого твердого вещества. Применяя описанную выше методику и подходящие исходные вещества, получают следующие соединения: 1-бутилсульфанил-2-хлор-4-нитробензол,2-хлор-1-циклогексилсульфанил-4-нитробензол,2-хлор-1-этилсульфанил-4-нитробензол. Пример 20 (способ 4F). (4-Хлор-5-метокси 2-нитрофенил)диметиламин. К раствору 4-хлор-5-метокси-2-нитрофенилового эфира трифторметансульфоновой кислоты (1,0 г) в тетрагидрофуране (2,0 мл) добав 47 ляют диметиламин (4,0 мл 40% водного раствора), и смесь перемешивают при комнатной температуре примерно 15 ч. Затем раствор концентрируют при пониженном давлении, а остаток растворяют в этилацетате и затем промывают водой. Водный слой экстрагируют один раз этилацетатом, а объединенные органические слои промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия. Растворитель удаляют выпариванием при пониженном давлении, остаток растирают с гексаном, получая требуемый продукт в виде бесцветного твердого вещества. Применяя описанную выше методику и подходящие исходные вещества, получают следующие соединения:(4-хлор-2-нитрофенил)диметиламин,4-(4-хлор-5-метокси-2-нитрофенил)морфолин,(4-хлор-5-метокси-2-нитрофенил)диметиламин,1-(4-хлор-5-метокси-2-нитрофенил)пиперидин,1-(4-хлор-5-метокси-2-нитрофенил)пирролидин,бензил(4-хлор-5-метокси-2-нитрофенил) амин,(2-хлор-6-нитрофенил)диметиламин. Пример 21 (способ 4G). (2-Хлор-4 нитрофенил)метилфениламин. н-Бутиллитий (12,3 мл 2,5 М раствора в гексане) добавляют по капле к раствору Nметиланилина (3,0 г) в тетрагидрофуране (75 мл) при 0 С. Смеси дают медленно нагреться до комнатной температуры, а затем снова охлаждают до 0 С и добавляют при помощи канюли к раствору 3-хлор-4-фторнитробензола (4,9 г) в тетрагидрофуране (35 мл), который хранят при-78 С. После добавления реакционной смеси дают нагреться до комнатной температуры в течение 1 ч, а затем концентрируют при пониженном давлении, гасят, добавляя насыщенный водный хлорид аммония, и экстрагируют три раза этилацетатом. Объединенные органические слои промывают три раза 5% водной соляной кислотой, один раз водой, один раз насыщенным водным раствором бикарбоната натрия,один раз насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом магния. После удаления растворителя при пониженном давлении остаток хроматографируют на силикагеле (в качестве элюента используют 5% диэтиловый эфир в гексане), получая требуемый продукт в виде прозрачного бесцветного масла. Пример 22 (способ 4H). 2,6-Дихлор-4 нитрофенол. 3,4,5-Трихлорнитробензол (14,86 г) добавляют к раствору фенолята калия (8,66 г) в диэтиленгликоле (66 мл), и смесь нагревают до 160 С в течение примерно 15 ч. Полученный темно-коричневый раствор охлаждают до ком 004205 48 натной температуры, выливают в 100 мл холодной воды и экстрагируют два раза диэтиловым эфиром. Объединенные органические слои промывают водой, 10% водным гидроксидом натрия и затем сушат над безводным сульфатом магния. После удаления растворителя при пониженном давлении полученное масло перегоняют в аппарате Кугельрора (Kugelrohr), получая желтое масло, которое затвердевает при стоянии. Перекристаллизация из смеси этанолвода дает требуемый продукт в виде бледножелтого твердого вещества. Пример 23 (способ 5 А). Трет-бутиловый эфир (3,5-дихлор-4-этоксифенил)карбаминовой кислоты. К раствору трет-бутилового эфира (3,5 дихлор-4-гидроксифенил)карбаминовой кислоты (1,0 г) и карбоната калия (1,0 г) в ацетоне (18 мл) добавляют этилиодид (0,36 мл), и смесь перемешивают при комнатной температуре примерно 15 ч. Затем раствор фильтруют, концентрируют при пониженном давлении и распределяют между этилацетатом и водой. Отделенный водный слой далее дважды экстрагируют этилацетатом и объединенные органические экстракты последовательно промывают 10% водным гидроксидом натрия, водой и затем сушат над безводным сульфатом натрия. Выпаривание растворителя при пониженном давлении дает требуемый продукт в виде красно-коричневого твердого вещества. Применяя описанную выше методику и подходящие исходные вещества, получают следующие соединения: трет-бутиловый эфир (3,5-дихлор-4-этоксифенил)карбаминовой кислоты,трет-бутиловый эфир (4-бутокси-3,5-дихлорфенил)карбаминовой кислоты,трет-бутиловый эфир (4-бензилокси-3,5 дихлорфенил)карбаминовой кислоты,трет-бутиловый эфир (4-карбамоилметокси-3,5-дихлорфенил)карбаминовой кислоты,трет-бутиловый эфир [3,5-дихлор-4-(нитрилоэтокси)фенил]карбаминовой кислоты,метиловый эфир (4-трет-бутоксикарбониламино-2,6-дихлор-фенокси)уксусной кислоты,метиловый эфир 3-бутоксибензоевой кислоты,метиловый эфир 3-трет-бутоксикарбонилметоксибензоевой кислоты,метиловый эфир 3-карбамоилметоксибензоевой кислоты,трет-бутиловый эфир [4-(3-карбамоилметоксибензоиламино)фенил]карбаминовой кислоты,трет-бутиловый эфир 4-[3-(2-хлорэтокси) бензоиламино]фенилкарбаминовой кислоты. Пример 24 (способ 5 С). трет-Бутиловый эфир (2,6-дихлор-4-нитрофенокси)уксусной кислоты. К раствору 2,6-дихлор-4-нитрофенола (2,5 г) и карбоната калия (3,3 г) в диметилформами 49 де (50 мл) добавляют трет-бутилбромацетат (10 мл), и смесь перемешивают при комнатной температуре 2 дня. Затем раствор выливают в 500 мл воды, три раза экстрагируют гексаном, а объединенные органические экстракты промывают насыщенным водным хлоридом аммония и затем сушат над безводным сульфатом магния. Выпаривание растворителя при пониженном давлении с последующим растиранием полученного масла с гексаном дает требуемый продукт в виде белого твердого вещества. Применяя описанную выше методику и подходящие исходные вещества, получают следующие соединения: 3-диметиламино-1-(4-нитрофенил)пропенон,2-хлор-1-изопропокси-4-нитробензол,1,3-дихлор-2-метокси-4-метил-5-нитробензол,1-хлор-4-этокси-2-метокси-5-нитробензол,1-бутокси-4-хлор-5-метокси-2-нитробензол,1-хлор-2-метокси-5-нитро-4-(фенилметокси)бензол (СА-имя),1-хлор-4-метокси-5-нитро-2-(фенилметокси)бензол (СА-имя),трет-бутиловый эфир (2,6-дихлор-4-нитрофенокси)уксусной кислоты,(2,6-дихлор-4-нитрофенокси)ацетонитрил,1-хлор-4-метокси-2-метил-5-нитробензол,2-(4-хлор-5-метокси-2-нитрофенокси)ацетамид,2-(2-хлор-5-метокси-4-нитрофенокси)ацетамид,(4-хлор-5-метокси-2-нитрофенокси)ацетонитрил,(2-хлор-5-метокси-4-нитрофенокси)ацетонитрил,4-(2-хлор-5-метокси-4-нитрофенокси)бутиронитрил,2-(4-хлор-5-метокси-2-нитрофенокси)этанол,2-(2-хлор-5-метокси-4-нитрофенокси)этанол,трет-бутиловый эфир (2-хлор-5-метокси-4 нитрофенокси)уксусной кислоты,метиловый эфир (2-хлор-5-метокси-4-нитрофенокси)уксусной кислоты,метиловый эфир (4-хлор-5-метокси-2-нитрофенокси)уксусной кислоты,трет-бутиловый эфир (4-хлор-5-метокси-2 нитрофенокси)уксусной кислоты,(2-хлор-4-нитрофенокси)ацетонитрил,1-бутокси-2-хлор-4-нитробензол,2-хлор-4-нитро-1-(2,2,2-трифторэтокси) бензол,2-хлор-4-нитро-1-пропоксибензол,2-хлор-1-этокси-4-нитробензол,1,3-дииод-2,4-диметокси-5-нитробензол,1,3-дибром-2,4-диметокси-5-нитробензол,3-хлор-2,4-диметоксинитробензол.(20 мл) добавляют этиленкарбонат (1,6 г), и смесь нагревают при кипении с обратным холодильником в течение 3 ч. К охлажденной реакционной смеси добавляют 2,5 М водный гидроксид натрия (50 мл), и отделенный органический слой последовательно промывают водой,насыщенным водным раствором хлорида натрия и затем сушат над безводным сульфатом натрия. Затем удаляют растворитель посредством выпаривания при пониженном давлении, а полученный остаток хроматографируют на силикагеле(в качестве элюента используют 30% этилацетат в гексане), получая требуемый продукт в виде белой пены. Пример 26 (способ 6). 3-(2-Хлор-4-нитрофенокси)-1-метилпирролидин. К раствору 2-хлор-4-нитрофенола (2,0 г) в тетрагидрофуране (60 мл) добавляют 1-метил-3 пирролидинол (2,3 г), трифенилфосфин (6,0 г) и диэтилазодикарбоксилат (3,6 мл) и смесь перемешивают при комнатной температуре в атмосфере аргона в течение 1,5 ч. Затем раствор концентрируют при пониженном давлении, разбавляют этилацетатом, последовательно промывают 10% водным гидроксидом натрия, водой,насыщенным водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Удаляют растворитель посредством выпаривания при пониженном давлении, а остаток хроматографируют на силикагеле (в качестве элюента используют 10% метанол в дихлорметане). После этого объединенные фракции продукта перекристаллизовывают из гексана, получая требуемый продукт в виде желтого твердого вещества. Применяя описанную выше методику и подходящие исходные вещества, получают следующие соединения: 4-(2-хлор-4-нитрофенокси)-1-метилпиперидин,3-(2-хлор-4-нитрофенокси)-1-метилпирролидин,[2-(2-хлор-4-нитрофенокси)этил]диметиламин,[3-(2-хлор-4-нитрофенокси)пропил]диметиламин. Пример 27 (способ 7 А). 2-Хлор-3-метокси 6-нитрофенол и 2,4-дихлор-3-метокси-6 нитрофенол. В колбу, содержащую 3-метокси-6 нитрофенол (0,5 г), добавляют водный гипохлорит натрия (5,25% водный раствор, 21 мл), и смесь перемешивают при комнатной температуре примерно 24 ч. Затем смесь охлаждают на бане со льдом, подкисляют, добавляя концентрированную соляную кислоту, затем дважды 51 экстрагируют этилацетатом. Органические экстракты сушат над безводным сульфатом магния,удаляют растворитель посредством выпаривания при пониженном давлении, а остаток хроматографируют на силикагеле (в качестве элюента используют 15% ацетон в гексане), получая оба продукта, моно- и дихлорированный, в виде желтых твердых веществ. Применяя описанную выше методику и подходящие исходные вещества, получают следующие соединения: 3-хлор-2-гидрокси-4-метоксинитробензол,3,5-дихлор-2-гидрокси-4-метоксинитробензол. Пример 28 (способ 7 В). 2,4-Дихлор-3 метил-6-нитрофенол. К раствору 3-метил-4-нитрофенола (5,0 г) в воде (150 мл) добавляют водный гипохлорит натрия (5,25% водный раствор, 230 мл) и смесь перемешивают при комнатной температуре примерно 15 ч. Добавляют еще водный гипохлорит натрия (5,25% водный раствор, 230 мл),и смесь оставляют перемешиваться при комнатной температуре в течение 2,5 дней. Затем смесь охлаждают на бане со льдом, подкисляют, добавляя концентрированную соляную кислоту,затем дважды экстрагируют этилацетатом. Органические экстракты сушат над безводным сульфатом магния, удаляют растворитель посредством выпаривания при пониженном давлении, а остаток хроматографируют на силикагеле (в качестве элюента используют этилацетат), получая требуемый продукт в виде желтого твердого вещества. Путем разовой перекристаллизации из хлороформа получают аналитически чистый образец. Пример 29 (способ 7 С). 1-Бром-2,4 диметокси-5-нитробензол. К раствору 2,4-диметоксинитробензола(0,50 г) в хлороформе (3 мл) добавляют по капле раствор брома (0,23 г) в хлороформе (1 мл), и смесь оставляют перемешиваться при комнатной температуре примерно на 15 ч. Добавляют еще бром (0,15 г) в хлороформе (1 мл), и реакционную смесь перемешивают еще 4 ч. Затем смесь выливают в 5% водный бисульфит натрия и экстрагируют хлороформом. Объединенные органические экстракты последовательно промывают 5% водным бисульфитом натрия, насыщенным раствором хлорида натрия и затем сушат над безводным сульфатом натрия. Удаление растворителя при пониженном давлении и перекристаллизация остатка из толуола дает нужный продукт в виде желтого твердого вещества. Пример 30 (способ 7D). 2,4-Дибром-3 метокси-6-нитрофенол. К раствору 5-метокси-2-нитрофенола (0,25 г) и трифторацетата серебра (0,49 г) в ледяной уксусной кислоте (3 мл) добавляют по капле раствор брома (1,42 г) в ледяной уксусной кислоте (3 мл), и смесь перемешивают при ком 004205 52 натной температуре примерно 24 ч. Затем раствор распределяют между этилацетатом и водой и органический слой последовательно промывают 5% водным бисульфитом натрия, три раза насыщенным водным раствором бикарбоната натрия и один раз насыщенным водным раствором хлорида натрия. Затем органический слой сушат над безводным сульфатом магния и удаляют растворитель при пониженном давлении. Остаток хроматографируют на силикагеле (в качестве элюента используют 20% этилацетат в гексане), затем перекристаллизовывают из хлороформа, получая требуемый дибромированный продукт в виде оранжевого твердого вещества. Пример 31 (способ 7 Е). 1-Иод-2,4 диметокси-5-нитробензол. К раствору 2,4-диметоксинитробензола(1,0 г) в ледяной уксусной кислоте (30 мл) добавляют бензилтриметиламмоний дихлориодат(1,90 г) и безводный хлорид цинка (1,0 г), и смесь перемешивают при комнатной температуре в атмосфере аргона. Через 5 ч добавляют еще бензилтриметиламмоний дихлориодат (0,4 г) и снова (0,4 г) через 24 ч. Через 24 ч добавляют еще хлорид цинка (0,5 г) и ледяную уксусную кислоту (15 мл). Смесь оставляют перемешиваться при комнатной температуре в течение 3 дней и затем фильтруют, разбавляют 5% водным бисульфитом натрия и три раза экстрагируют этилацетатом. Объединенные органические экстракты последовательно промывают 5% водным бисульфитом натрия, насыщенным водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. После удаления растворителя при пониженном давлении остаток растирают с гексаном, получая требуемый продукт в виде бледно-желтого твердого вещества. Пример 32 (способ 7F). 2,4-Дииод-3 метокси-6-нитрофенол. К раствору 5-метокси-2-нитрофенола (0,25 г) в дихлорметане (15 мл) и метаноле (6 мл) добавляют бензилтриметиламмоний дихлориодат(1,08 г) и бикарбонат натрия (0,85 г), и смесь оставляют перемешиваться при комнатной температуре на 24 ч. Затем раствор фильтруют, фильтрат концентрируют при пониженном давлении, остаток растворяют в этилацетате и последовательно промывают 5% водным бикарбонатом натрия,5% водным бисульфитом натрия и насыщенным водным хлоридом натрия. После сушки над безводным сульфатом магния удаляют растворитель посредством выпаривания при пониженном давлении, а остаток перекристаллизовывают из толуола, получая требуемый продукт в виде желтых игл. Пример 33 (способ 7G). 1-Фтор-2,4 диметокси-5-нитробензол. К раствору 2,4-диметоксинитробензола(1,0 г) в тетрахлорэтане (10 мл) добавляют 3,5 дихлор-1-фторпиридиний трифлат (85%, 5,07 г), 53 и смесь нагревают до 120 С в течение 5 ч. Добавляют еще 3,5-дихлор-1-фторпиридиний трифлат (85%, 0,25 г) и продолжают нагревание еще 1 ч. Затем раствор охлаждают до комнатной температуры и пропускают через колонку с силикагелем (в качестве элюента используют гексан, а затем 30% этилацетат в гексане). Фракции, содержащие продукт, объединяют, выпаривают при пониженном давлении, а остаток кристаллизуют из гексана, получая требуемый продукт в виде красно-коричневого твердого вещества. Пример 34 (способ 8). 3-Хлор-4-трифторметилнитробензол. Раствор 3-хлор-4-иоднитробензола (2,26 г),триметил(трифторметил)силана (5,68 г), иодида меди (I) (2,28 г) и фторида калия (0,56 г) в N,Nдиметилформамиде (8 мл) нагревают в закупоренной пробирке до 80 С в течение 40 ч. Затем раствор охлаждают, разбавляют диэтиловым эфиром, фильтруют через диатомовую землю, а фильтрат последовательно промывают водой,насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия. Растворитель удаляют при пониженном давлении, а остаток хроматографируют на силикагеле (в качестве элюента используют 1% диэтиловый эфир в гексане, а затем 10% этилацетат в гексане), получая требуемый продукт в виде бесцветного масла. Пример 35 (способ 9). Трет-бутиловый эфир (3-хлор-4-метансульфинилфенил)карбаминовой кислоты. К раствору трет-бутилового эфира (3-хлор 4-тиометилфенил)карбаминовой кислоты (0,89 г) в дихлорметане (15 мл) при 0 С добавляют раствор диметилдиоксирана (0,11 М в ацетоне,34 мл), и смесь перемешивают при 0 С в течение 1 ч. Растворитель удаляют при пониженном давлении, а остаток растворяют в дихлорметане,промывают насыщенным водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Удаление растворителя при пониженном давлении дает требуемый продукт в виде оранжевой пены. Пример 36 (способ 9 В). Трет-бутиловый эфир [4-(2-метилсульфинилбензоиламино)фенил]карбаминовой кислоты. К раствору 2-метилсульфанил-N-[4-(2,2,2 трифторацетиламино)фенил]бензамида (234 мг) добавляют насыщенный раствор периодата натрия (5 мл), и смесь перемешивают в течение 12 ч. Пурпурную смесь выливают в воду, экстрагируют этилацетатом, сушат над безводным карбонатом калия и выпаривают, получая красное твердое вещество, 101 мг. Применяя описанную выше методику и подходящие исходные вещества, получают следующие соединения: трет бутиловый эфир [4(2-метансульфинилбензоиламино)фенил]карбаминовой кислоты, 004205(3-хлор-4-метансульфонилфенил)карбаминовой кислоты. К раствору трет-бутилового эфира (3-хлор 4-тиометилфенил)карбаминовой кислоты (0,90 г) в дихлорметане (30 мл) при 0 С добавляют раствор диметилдиоксирана (0,11 М в ацетоне,80 мл), и смесь перемешивают при 0 С в течение 1 ч. Растворитель удаляют при пониженном давлении, а остаток растворяют в дихлорметане,промывают насыщенным водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Удаление растворителя при пониженном давлении дает требуемый продукт в виде оранжевой пены. Пример 38 (способ 11). 3-Хлор-4-винилфениламин. К обескислороженному раствору 3-хлор-4 иоданилина (6,95 г), трифениларсина (0,67 г) и трис(дибензилиденацетон)палладия(0) (0,50 г) в тетрагидрофуране (120 мл) при 50 С добавляют трибутилвинилолово (10 г), и смесь перемешивают примерно 15 ч при 50 С в атмосфере аргона. Затем реакционную смесь охлаждают,фильтруют через диатомовую землю, а фильтрат выпаривают досуха при пониженном давлении. Остаток растворяют в гексане и затем три раза экстрагируют 5% водной соляной кислотой. Водные кислые экстракты подщелачивают твердым карбонатом калия и три раза экстрагируют этилацетатом. Объединенные органические экстракты промывают насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом магния, и удаляют растворитель при пониженном давлении. Полученный остаток хроматографируют на силикагеле (в качестве элюента используют гексан и затем 10% этилацетат в гексане), получая требуемый продукт в виде янтарно-желтого масла. Пример 39 (способ 12). 2-Триметилсиланилэтиловый эфир [3-хлор-4-(1-гидроксиэтил) фенил]карбаминовой кислоты. 2-Триметилсиланилэтиловый эфир (3 хлор-4-винилфенил)карбаминовой кислоты (2,6 г) добавляют к раствору ацетата ртути (3,48 г) в воде (7 мл) и тетрагидрофуране (5,25 мл), и смесь перемешивают примерно 15 ч. Затем добавляют 3 н. водный гидроксид натрия (8,7 мл) и 0,5 М раствор боргидрида натрия в 3 н. водном гидроксиде натрия (8,7 мл) и перемешивание продолжают в течение 6 ч. Далее насыщают раствор хлоридом натрия и экстрагируют этилацетатом. Органические экстракты промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия. После удаления растворителя при пониженном давлении остаток хроматографируют на силикагеле (в качестве элюента используют 20% этилацетат в гексане), получая требуемый продукт в виде белого твердого вещества. 55 Пример 40 (способ 13). Трет-бутиловый эфир [3-хлор-4-(2-гидроксиэтил)фенил]карбаминовой кислоты. К перемешиваемой суспензии боргидрида натрия (0,45 г) в тетрагидрофуране (13 мл) при 0 С добавляют ледяную уксусную кислоту (0,75 мл), и смесь перемешивают при 0 С в течение 1 ч. Затем раствор нагревают до комнатной температуры и добавляют 2-триметилсиланилэтиловый эфир (3-хлор-4-винилфенил)карбаминовой кислоты (1,0 г). Реакционную смесь перемешивают при комнатной температуре примерно 15 ч, а потом нагревают при кипении с обратным холодильником примерно 20 ч. Затем смесь охлаждают и добавляют 5 н. водный гидроксид натрия (0,80 мл) и 30% водный пероксид водорода (0,56 мл). После перемешивания еще в течение 15 ч слои разделяют, водный слой три раза экстрагируют диэтиловым эфиром и органические экстракты сушат над безводным сульфатом магния. После удаления растворителя при пониженном давлении остаток хроматографируют на силикагеле (в качестве элюента используют 40% этилацетат в гексане), получая требуемый продукт в виде янтарно-желтого масла. Пример 41 (способ 14). 2-Триметилсиланилэтиловый эфир [4-(1-азидоэтил)-3-хлорфенил]карбаминовой кислоты. К раствору 2-триметилсиланилэтилового эфира [3-хлор-4-(1-гидроксиэтил)фенил]карбаминовой кислоты (1,25 г) в тетрагидрофуране(20 мл) при 0 С в атмосфере аргона добавляют трифенилфосфин (2,6 г), гидразоевую кислоту(примерно 2,5 молярных эквивалента в дихлорметане, полученную способом работы Fieser andFieser, Reagents for Organic Synthesis, т. 1, стр. 446; Wiley, New York) и диэтилазодикарбоксилат (1,72 г). Примерно через 10 мин растворитель удаляют при пониженном давлении, а остаток хроматографируют на силикагеле (в качестве элюента используют 5% этилацетат в гексане), получая требуемый продукт в виде бесцветного масла. Пример 42 (способ 15). Трет-бутиловый эфир [3-хлор-4-(3-диметиламинопроп-1-инил) фенил]карбаминовой кислоты. К дезоксигенированному раствору третбутилового эфира (3-хлор-4-иодфенил)карбаминовой кислоты (10,0 г) в триэтиламине (120 мл) добавляют 1-диметиламино-2-пропин (2,82 г), бис(трифенилфосфин)палладий(II) хлорид(0,4 г) и иодид меди (I) (0,054 г). Смесь перемешивают при комнатной температуре в атмосфере аргона примерно 6 ч и затем быстро (примерно 10 мин) нагревают до 60 С. Затем реакционную смесь охлаждают, фильтруют через диатомовую землю и удаляют растворитель путем выпаривания при пониженном давлении. Остаток растворяют в этилацетате, трижды промывают водой, один раз насыщенным водным раствором хлорида натрия и сушат над без 004205 56 водным сульфатом магния. Растворитель удаляют путем выпаривания при пониженном давлении, а остаток хроматографируют на силикагеле (в качестве элюента используют 80% этилацетат в гексане), получая очищенный продукт в виде янтарно-желтого масла, которое отверждается при стоянии. Применяя описанную выше методику и подходящие исходные вещества, получают следующие соединения: трет-бутиловый эфир [3-хлор-4-(3-диметиламинопроп-1-инил)фенил]карбаминовой кислоты,[3-(4-метоксифенил)проп-2-инил]диметиламин,4-(3-диметиламинопроп-1-инил)бензонитрил,диметил[3-(4-нитрофенил)проп-2-инил] амин. Пример 43 (способ 16). трет-Бутиловый эфир [3-хлор-4-(3-диметиламиноакрилоил)фенил]карбаминовой кислоты. К охлажденному на льду раствору третбутилового эфира [3-хлор-4-(3-диметиламинопроп-1-инил)фенил]карбаминовой кислоты (4,0 г) в дихлорметане (30 мл) добавляют небольшими порциями 3-хлорпероксибензойную кислоту (2,34 г). После перемешивания при 0 С в течение 20 мин реакционную смесь пропускают через двадцать весовых эквивалентов основного оксида алюминия (Brockmann Grade I, 150 меш) и элюируют N-оксид, применяя раствор 5% метанола в дихлорметане. Все фракции, содержащие требуемый N-оксид, объединяют, выпаривают почти досуха при пониженном давлении. Остаток последовательно три раза обрабатывают небольшими порциями метанола (примерно 50 мл), потом выпаривают почти досуха при пониженном давлении и доводят объем раствора до 250 мл, добавляя метанол. Затем метанольный раствор N-оксида нагревают при кипении с обратным холодильником примерно 15 ч,потом охлаждают и выпаривают растворитель досуха при пониженном давлении. Остаток очищают хроматографически на силикагеле (в качестве элюента используют 80% этилацетат в гексане), получая требуемый продукт в виде бледно-желтого твердого вещества. Пример 44 (способ 17). трет-Бутиловый эфир (3-хлор-4-изоксазол-5-илфенил)карбаминовой кислоты. На раствор трет-бутилового эфира [3-хлор 4-(3-диметиламиноакрилоил)фенил]карбаминовой кислоты (270 мг) в диоксане (3 мл) воздействуют гидроксиламин гидрохлоридом (122 мг),и смесь перемешивают при комнатной температуре в течение 10 дней. Смесь разбавляют этилацетатом, последовательно промывают водой,5% водным бикарбонатом натрия, насыщенным водным хлоридом натрия и затем сушат над безводным сульфатом магния. Растворитель удаляют путем выпаривания при пониженном 57 давлении, а полученный остаток хроматографируют на силикагеле (в качестве элюента используют 33% этилацетат в гексане), получая требуемый продукт в виде бесцветного твердого вещества. Пример 45 (способ 18). трет-Бутиловый эфир [3-хлор-4-(1 Н-пиразол-3-ил)фенил]карбаминовой кислоты. На раствор трет-бутилового эфира [3-хлор 4-(3-диметиламиноакрилоил)фенил]карбаминовой кислоты (250 мг) в этаноле (1,25 мл) воздействуют гидразингидратом (0,25 мл), и смесь перемешивают при комнатной температуре в течение 3 ч. Смесь разбавляют 30 мл диэтилового эфира, три раза промывают водой, один раз насыщенным водным хлоридом натрия и сушат над безводным сульфатом магния. Растворитель удаляют путем выпаривания при пониженном давлении, а полученный остаток хроматографируют на силикагеле (в качестве элюента используют 67% этилацетат в гексане), получая требуемый продукт в виде масла. Пример 46 (способ 19 А). N-(2-Хлор-4 нитрофенил)-2-тиоморфолино-4-илацетамид. К раствору N-(хлорацетил)-2-хлор-4-нитроанилина (3,80 г) в тетрагидрофуране (50 мл) добавляют тиоморфолин (10 мл) и раствор оставляют стоять в течение 1 ч. Эту реакционную смесь выливают в воду, собирают бледножелтое твердое вещество и перекристаллизовывают его из 2-пропанола, получая бледножелтое кристаллическое твердое вещество. Применяя описанную выше методику и подходящие исходные вещества, получают следующие соединения: трет-бутиловый эфир (4-2-[бис-(2-гидроксиэтил)амино]ацетиламинофенил)карбаминовой кислоты,трет-бутиловый эфир [4-(2-диметиламиноацетиламино)фенил]карбаминовой кислоты,трет-бутиловый эфир 4-[3-(2-диметиламиноэтокси)бензоиламино]фенилкарбаминовой кислоты,трет-бутиловый эфир 4-[3-(2-морфолин-4 илэтокси)бензоиламино]фенилкарбаминовой кислоты,N-(2-хлор-4-нитрофенил)-2-диметиламиноацетамид,N-(2-хлор-4-нитрофенил)-2-пиперидин-1 илацетамид,N-(2-хлор-4-нитрофенил)-2-морфолин-4 илацетамид,N-(2-хлор-4-нитрофенил)-2-дипропиламиноацетамид,N-(2-хлор-4-нитрофенил)-2-тиоморфолин 4-илацетамид,N-(2-хлор-4-нитрофенил)-2-диэтиламиноацетамид,N-(2-хлор-4-нитрофенил)-2-пирролидин-1 илацетамид,2-азепан-1-ил-N-(2-хлор-4-нитрофенил) ацетамид, 004205(100 мл) добавляют измельченный в порошок карбонат натрия (6,0 г) и 2-диметиламиноэтантиол гидрохлорид (6,0 г). Смесь перемешивают 1 ч при 25 С, выливают в воду и экстрагируют этилацетатом. Этилацетатный раствор сушат над безводным карбонатом калия и концентрируют при пониженном давлении,получая масло. Это масло кристаллизуют из смеси толуол-гексан (3:1), получая бледножелтое кристаллическое твердое вещество. Пример 48 (способ 20). 2-Пиперидин-1 илэтиловый эфир (4-трет-бутоксикарбониламино-2-хлорфенил)карбаминовой кислоты. К суспензии 1,1-карбонил-ди-(1,2,4)триазола (4,0 г) в дихлорметане (40 мл) добавляют по капле за 20 мин раствор трет-бутилового эфира(4-амино-3-хлорфенил)карбаминовой кислоты (5,0 г) в дихлорметане (45 мл). Реакционную смесь перемешивают при комнатной температуре в течение 30 мин, и в это время образуется осадок. К этой смеси для гомогенности добавляют пиперидинэтанол (6,6 мл) и тетрагидрофуран (20 мл). После нагревания при кипении с обратным холодильником в течение ночи реакционную смесь охлаждают и затем выливают в воду, органический слой отделяют и промывают насыщенным водным хлоридом натрия. Раствор сушат над безводным сульфатом натрия, фильтруют и концентрируют при пониженном давлении до сырого масла, которое очищают хроматографически на силикагеле (в качестве элюента используют 5% метанол в дихлорметане), получая требуемый продукт в виде белой пены. Пример 49 (способ 21). Метиловый эфир 5 фенил-[1,2,3]тиадиазол-4-карбоновой кислоты. На раствор этилбензоилацетата (1,1 г) в ацетонитриле (10 мл) воздействуют 4-метилбензолсульфонилазидом (1,3 г) и триэтиламином (1,6 г). После перемешивания в течение ночи при комнатной температуре реакционную смесь концентрируют при пониженном давлении и полученный сырой продукт растворяют в этилацетате и промывают 1 н. гидроксидом натрия. Затем органический слой сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении, получая желтое масло. Это масло помещают в дихлорметан и фильтруют через подушку водного силиката магния, элюируя дихлорметаном и получая частично очищенный диазокетон в виде 59 бесцветного масла. Образец диазокетона из описанного выше продукта (1,2 г) растворяют в толуоле (25 мл) и обрабатывают 2,4-бис(4 метоксифенил)-1,3-дитиа-2,4-дифосфетан-2,4 дисульфидом (2,8 г) и реакционную смесь нагревают до кипения с обратным холодильником. Через 3 ч реакционную смесь охлаждают до комнатной температуры, загружают на подушку из силикагеля и элюируют дихлорметаном. После удаления растворителя при пониженном давлении, полученное масло очищают хроматографически на силикагеле (в качестве элюента используют 30% диэтиловый эфир в петролейном эфире) и затем перекристаллизовывают из гексана, получая требуемый продукт в виде бледно-желтых игл. Применяя описанную выше методику и подходящие исходные вещества, получают следующие соединения: этиловый эфир 5-фенил-[1,2,3]тиадиазол 4-карбоновой кислоты,метиловый эфир 5-метил-[1,2,3]тиадиазол 4-карбоновой кислоты,Пример 50. Этилбензоилацета семикарбазид. Этилбензоилацетат (5,0 г) растворяют в метаноле (10 мл) и быстро добавляют к горячему раствору семикарбазида гидрохлорида (29 г) в воде (130 мл). К этой смеси добавляют пиридин (4,1 г) и после нагревания до кипения с обратным холодильником в течение 5 мин реакционную смесь охлаждают до -20 С в течение ночи. Полученный твердый семикарбазон собирают фильтрованием, промывают водой и затем диэтиловым эфиром, получая требуемый продукт в виде белых кристаллов. Применяя описанную выше методику и подходящие исходные вещества, получают следующие соединения: этил(2,5 г) в чистом тионилхлориде (5 мл) перемешивают при 0 С в течение 1 ч. Затем добавляют дихлорметан (25 мл), избыток тионилхлорида медленно разлагают насыщенным водным бикарбонатом натрия. Осадок, который образуется после гашения, удаляют фильтрованием, а фильтрат экстрагируют дихлорметаном. Объединенные органические экстракты сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Хроматография на силикагеле (в качестве элюента используют 50% гексан в дихлорметане) дает требуемый продукт в виде бесцветного масла. 60 Применяя описанную выше методику и подходящие исходные вещества, получают следующие соединения: метиловый эфир 4-метил-[1,2,3]-тиадиазол-5-карбоновой кислоты,этиловый эфир 4-фенил-[1,2,3]-тиадиазол 5-карбоновой кислоты,этиловый эфир 4-фуран-3-ил-[1,2,3]тиадиазол-5-карбоновой кислоты,Пример 52. 4-Метил-[1,2,3]-тиадиазол-5 карбоновая кислота. Метиловый эфир 4-метил-[1,2,3]-тиадиазол-5-карбоновой кислоты (1,7 г) растворяют в метаноле (15 мл) и воздействуют на него 1 н. гидроксидом натрия (16 мл). После перемешивания при комнатной температуре в течение 1 ч на реакционную смесь воздействуют концентрированной соляной кислотой (1,5 мл) и концентрируют ее при пониженном давлении. Полученный мутный водный слой дважды экстрагируют диэтиловым эфиром и объединенные органические слои сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении, получая требуемое соединение в виде белого порошка. Применяя описанную выше методику и подходящие исходные вещества, получают следующие соединения: 3-этоксикарбонилметоксибензойная кислота,5-фуран-3-ил-[1,2,3]тиадиазол-4-карбоновая кислота,тиазол-4-карбоновая кислота,4-метил-[1,2,3]тиадиазол-5-карбоновая кислота,5-метил-[1,2,3]тиадиазол-4-карбоновая кислота. Пример 53 (способ 25). 4-Хлор-5-метокси 2-нитрофениловый эфир трифторметансульфоновой кислоты. К раствору 4-хлор-5-метокси-2-нитрофенола (6,5 г) в дихлорметане (150 мл) при 0 С в атмосфере аргона добавляют триэтиламин (10 г) и потом раствор трифторметансульфонового ангидрида (13,5 г) в дихлорметане (30 мл). Раствор перемешивают при 0 С в течение 10 мин, а затем разбавляют дихлорметаном и промывают последовательно насыщенным водным бикарбонатом натрия и насыщенным водным хлоридом натрия. После сушки над безводным сульфатом натрия растворитель удаляют путем выпаривания при пониженном давлении, а остаток растворяют в 20% растворе дихлорметана в гексане и пропускают через короткую колонку с водным силикатом магния (в качестве элюента используют 20% дихлорметан в гексане). Фракции, содержащие продукт, объединяют и удаляют растворители путем выпаривания при пониженном давлении, получая требуемый продукт в виде желтого масла.
МПК / Метки
МПК: A61K 31/17, C07D 335/20, A61P 31/22
Метки: герпесвирусов, ингибиторы, тиомочевины, включающие, основе, фенилендиаминогруппу, альфа-метилбензилсодержащей
Код ссылки
<a href="https://eas.patents.su/30-4205-ingibitory-gerpesvirusov-na-osnove-alfa-metilbenzilsoderzhashhejj-tiomocheviny-vklyuchayushhie-fenilendiaminogruppu.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы герпесвирусов на основе альфа-метилбензилсодержащей тиомочевины, включающие фенилендиаминогруппу</a>
Случайный патент: Способ получения агомелатина


































