Производные фенилксантина
Номер патента: 4139
Опубликовано: 26.02.2004
Авторы: Остерхаут Мартин Хауард, Джергенсен Синтия Хоулдер, Мартин Майкл Тоулар, Дейлюдж Сьюзан Мэри
Формула / Реферат
1. Соединение формулы (I)
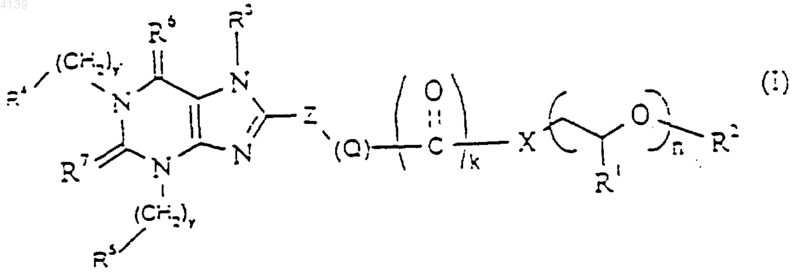
где Z представляет собой 5- или 6-членный циклоалкил, арил, замещенный циклоалкил или замещенный арил, причем указанный циклоалкил, арил, замещенный циклоалкил или замещенный арил возможно содержит один или более чем один гетероатом, выбранный из O, N или S;
R1 представляет собой водород или метил;
R2 представляет собой водород, C1-12алкил, арил или аралкил;
k представляет собой 0 или 1;
n представляет собой целое число от 8 до 20;
X представляет собой -O-, -N(H)-, -N(C1-6алкил)-, -N(C3-8циклоалкил)-, -N[(C1-8алкил)(C3-8циклоалкил)], -N[(CH2CH2O)m(C1-12алкил, арил или аралкил)]-, -CH2O-, -CH2NH-, -CH2N(C1-6алкил)-, -CH2N(C3-8циклоалкил)- или -C1-12алкил-;
m представляет собой 0-12;
Q представляет собой (-CH2-)p, (-CH=CH-)p, (-CуC-)p, (-(O)p1CH2-)p или (-CH2(O)p1)p, где p и p1 независимо представляют собой целое число от 0 до 4;
y и y' независимо представляют собой целые числа от 0 до 10;
R3 представляет собой H, нормальный или разветвленный C1-12алкил (возможно замещенный фенилом, -CO-фенил, CN, -CO(C1-3)алкил, -CO2(C1-3)алкил либо содержащий один или более чем один атом O в алкильной цепи), C2-6 нормальный или разветвленный алкенил, C2-6 нормальный или разветвленный алкинил или группу -C1-3алкил-NR8R9,
где R8 и R9 независимо представляют собой H, C1-3алкил или вместе образуют 5- или 6-членную гетероциклическую группу, возможно содержащую другие гетероатомы, выбранные из O, N или S;
R4 и R5 независимо представляют собой
C3-8циклоалкил,
C1-6алкил с нормальной или разветвленной цепью,
водород,
C2-6алкенил с нормальной или разветвленной цепью,
арил или замещенный арил,
гетероциклическую группу или замещенную гетероциклическую группу, включая гетероарильные и замещенные гетероарильные группы;
R6 и R7 независимо представляют собой O или S; при условии, что когда
y и y' оба представляют собой 1,
k представляет собой 1,
p1 представляет собой ноль,
R2 представляет собой H или Me,
R3 представляет собой H,
X представляет собой O или NH и
Z представляет собой фенил,
R4 и R5 оба не представляют собой циклогексил;
или его сольват.
2. Соединение формулы (Ia)
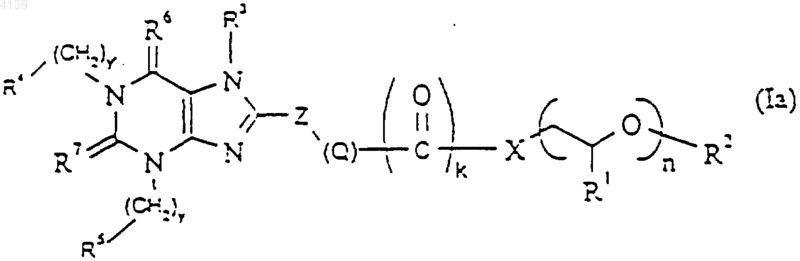
где Z представляет собой 5- или 6-членный циклоалкил, арил, замещенный циклоалкил или замещенный арил, причем указанный циклоалкил, арил, замещенный циклоалкил или замещенный арил возможно содержит один или более чем один гетероатом, выбранный из O, N или S;
R1 представляет собой водород или метил;
R2 представляет собой водород, C1-12алкил, арил или аралкил;
k представляет собой 0 или 1;
n представляет собой целое число от 8 до 20;
X представляет собой -O-, -N(H)-, -N(C1-6алкил)-, -N(C3-8циклоалкил)-, -N[(CH2CH2O)m(C1-12алкил, арил или аралкил)]-, -CH2O-, -CH2NH-, -CH2N(C1-6алкил)-, -CH2N(C3-8циклоалкил)- или -C1-12алкил-;
m представляет собой 0-12;
Q представляет собой (-CH2-)p, (-CH=CH-)p, (-CуC-)p, (-(O)p1CH2-)p или (-CH2(O)p1)p, где p и p1 независимо представляют собой целое число от 0 до 4;
y и y' независимо представляют собой целые числа от 0 до 10;
R3 представляет собой H, C1-12алкил с нормальной или разветвленной цепью (возможно замещенный фенилом, -CO-фенилом, CN, -CO(C1-3)алкилом, -CO2(C1-3)алкилом либо содержащий один или более чем один атом O в алкильной цепи); C2-6 нормальный или разветвленный алкенил; C2-6 нормальный или разветвленный алкинил или группу -C1-3алкил-NR8R9,
где R8 и R9 независимо представляют собой H, C1-3алкил или вместе образуют 5- или 6-членную гетероциклическую группу, возможно содержащую другие гетероатомы, выбранные из O, N или S;
R4 и R5 независимо представляют собой
C3-8циклоалкил,
C1-6алкил с нормальной или разветвленной цепью,
водород,
C2-6алкенил с нормальной или разветвленной цепью,
арил или замещенный арил либо гетероциклическую группу или замещенную гетероциклическую группу, включая гетероарильные и замещенные гетероарильные группы;
R6 и R7 независимо представляют собой O или S;
при условии, что когда
y и y' оба представляют собой 1,
k представляет собой 1,
p1 представляет собой ноль,
R3 представляет собой H,
X представляет собой O или NH и
Z представляет собой фенил,
R4 и R5 оба не представляют собой циклогексил;
или его сольват.
3. Соединение по п.1 или 2, где R3 представляет собой -C1-3алкил-NR8R9.
4. Соединение по п.1 или 2, где Z представляет собой фенильное кольцо, тиофеновое кольцо или пиридиновое кольцо.
5. Соединение по п.4, где Z представляет собой фенильное кольцо.
6. Соединение по п.5, где группировка
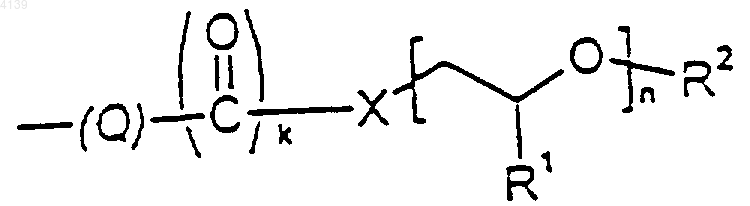
присоединена к фенильному кольцу в пара-положении.
7. Соединение по любому из пп.1-6, где R1 представляет собой H.
8. Соединение по любому из пп.1-7, где R2 представляет собой метил или этил.
9. Соединение по любому из пп.1-8, где k представляет собой 1.
10. Соединение по п. 9, где n представляет собой число от 8 до 15.
11. Соединение по любому из пп.1-10, где X представляет собой -O-, -N(H)- или -N(CH3)-.
12. Соединение по любому из пп.1-11, где Q представляет собой (-CH=CH-)p.
13. Соединение по п.12, где p представляет собой 1.
14. Соединение по любому из пп.1-13, где R3 представляет собой метил.
15. Соединение по любому из пп. 1-14, где y и y' являются одинаковыми.
16. Соединение по п.15, где y и y' представляют собой 1.
17. Соединение по любому из пп.1-16, где R4 и R5 независимо выбраны из C1-6алкила, C3-8циклоалкила и арила.
18. Соединение по п.17, где R4 и R5 независимо выбраны из циклобутила, циклопентила, циклогексила, пропила, бутила, изопропила, изобутила и фенила.
19. Соединение по п.17 или 18, где R4 и R5 являются одинаковыми.
20. Соединение по любому из пп.1-19, где R6 и R7 являются одинаковыми.
21. Соединение по п.20, где R6 и R7 представляют собой O.
22. Соединение по п.1 или 2, где X представляет собой -O-, a R1 представляет собой H.
23. Соединение по п.1, которое представляет собой
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(бензил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликюыя и (E)-4-(1,3-бис(циклопентилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(пропил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(циклопропилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-3-((1-пропил-3-бензил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(циклогептилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(циклогексилэтил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(фенил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(2-метилпропил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-((1-пропил-3-циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(бицикло(2.2.1)гепт-2-илметил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-((1-циклогексилметил-3-бутил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-((1-циклогексилметил-3-пропил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(бензил)-1,2,3,6-тетрагидро-2-тиоксо-6-оксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1-метил-3-(3-цианобензил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(3-фторбензил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(2-фторбензил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-((1,3-бисфенетил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-((1-циклогексилметил-3-метил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1-H-3-(2-метилпропил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(4-фторбензил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир додецилового эфира гексаэтиленгликоля и (E)-4-(1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(циклобутилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-((1-метил-3-циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-((1-метил-3-изобутил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(циклогексил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
N-(метилнонаоксиэтилен)амид (E)-4-(1,3-бис(циклопентилметил)-1,2,3,6-тетрагидро-6-оксо-2-тиоксо-9H-пурин-8-ил)коричной кислоты;
N-(метилнонаоксиэтилен)амид (E)-4-(1,3-бис(2-метилпропил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
N-(метилнонаоксиэтилен)амид (E)-4-((1-циклогексилметил-3-пропил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
N-метил-N-(метилнонаоксиэтилен)амид 4-(1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)бензойной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-бензил-1H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-(2-оксо-2-фенилэтил)-1H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-метил-1H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-(2-пропинил)-1H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-(2-оксо-2-метилэтил)-1H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-(3-морфолинопропил)-1H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-этил-1H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-(2-этокси-2-оксоэтил)-1H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-(2-метил-2-пропенил)-1H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-(цианометил)-1H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и 4-(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-бензил-1H-пурин-8-ил)бензойной кислоты;
эфир метилового эфира нонаэтиленгликоля и 4-(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-метил-1H-пурин-8-ил)бензойной кислоты;
эфир метилового эфира нонаэтиленгликоля и 4-[(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-метил-1H-пурин-8-ил)фенил]пропионовой кислоты;
N-(метилнонаоксиэтилен)амид (E)-4-(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-метил-1H-пурин-8-ил)коричной кислоты;
N-(метилнонаоксиэтилен)амид (E)-4-(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-бензил-1H-пурин-8-ил)коричной кислоты;
N-(метилнонаоксиэтилен)амид 4-(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-бензил-1H-пурин-8-ил)бензойной кислоты;
N-(метилнонаоксиэтилен)амид 4-(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-метил-1H-пурин-8-ил)бензойной кислоты;
1,3-бис(циклогексилметил)-8-[4-(2,5,8,11,14,17,20,23,26,29-декаоксатриаконт-1-ил)фенил]-3,7-дигидро-1H-пурин-2,6-дион;
эфир метилового эфира нонаэтиленгликоля и (E)-3-[5-[1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-1H-пурин-8-ил]-2-тиенил]-2-пропеновой кислоты;
N-(метилнонаоксиэтилен)амид 6-(1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)никотиновой кислоты;
N-циклопропилметил-N-(метилнонаоксиэтилен)амид (E)-3-(1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
N-(бензилгексаоксиэтилен)амид (E)-4-(1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира гептаэтиленгликоля и (E)-4-[(3-циклогексилметил )-2,3,6,7-тетрагидро-2,6-диоксо-7-метил-1H-пурин-8-ил]коричной кислоты;
эфир метилового эфира нонаоксиэтиленгликоля и (E)-4-[(3-циклогексилметил)2,3,6,7-тетрагидро-2,6-диоксо-7-метил-1H-пурин-8-ил]коричной кислоты;
эфир метилового эфира нонаоксиэтиленгликоля и (E)-4-[(3-циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-1,7-диметил-1H-пурин-8-ил]коричной кислоты;
N-(метилгептаоксиэтилен)-4-[1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил]бензиламин;
гидрохлорид N-(метилгептаоксиэтилен)-4-[1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил]бензиламина;
N-(метилнонаоксиэтилен)-4-[1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9 H-пурин-8-ил]бензиламин;
1,3-бис(циклогексилметил)-8-[3-(2,5,8,11,14,17,20,23,26,29-декаоксатриаконт-1-ил)фенил]-3,7-дигидро-1H-пурин-2,6-дион;
эфир метилового эфира гептаэтиленгликоля и (E)-4-(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-метил-1H-пурин-8-ил)коричной кислоты;
эфир метилового эфира пентаэтиленгликоля и (E)-4-(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-метил-1H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-пропил-1H-пурин-8-ил)коричной кислоты.
24. Соединение по п.23, которое представляет собой
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(бензил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(циклопентилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(пропил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(циклогептилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(циклогексилэтил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(фенил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(2-метилпропил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-((1-пропил-3-циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(бицикло(2.2.1)гепт-2-илметил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-((1-циклогексилметил-3-бутил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-((1-циклогексилметил-3-пропил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(3-фторбензил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(2-фторбензил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-((1,3-бисфенетил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1-H-3-(2-метилпропил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(4-фторбензил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир додецилового эфира гексаэтиленгликоля и (E)-4-(1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(циклобутилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-((1-метил-3-изобутил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
N-(метилнонаоксиэтилен)амид (E)-3-(1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
N-метил-N-(метилнонаоксиэтилен)амид (E)-4-(1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-бензил-1H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-(2-оксо-2-фенилэтил)-1H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-метил-1H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-(2-пропинил)-1H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-(2-оксо-2-метилэтил)-1H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-(3-морфолинопропил)-1H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-этил-1H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-(2-этокси-2-оксоэтил)-1H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-(2-метил-2-пропенил)-1H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-(цианометил)-1H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и 4-(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-бензил-1H-пурин-8-ил)бензойной кислоты;
эфир метилового эфира нонаэтиленгликоля и 4-(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-метил-1H-пурин-8-ил)бензойной кислоты;
N-(метилнонаоксиэтилен)амид (E)-4-(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-метил-1H-пурин-8-ил)коричной кислоты;
N-(метилнонаоксиэтилен)амид (E)-4-(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-бензил-1H-пурин-8-ил)коричной кислоты;
N-(метилнонаоксиэтилен)амид 4-(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-бензил-1H-пурин-8-ил)бензойной кислоты;
1,3-бис(циклогексилметил)-8-[4-(2,5,8,11,14,17,20,23,26,29-декаоксатриаконт-1-ил)фенил]-3,7-дигидро-1H-пурин-2,6-дион;
эфир метилового эфира нонаэтиленгликоля и (E)-3-[5-[1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-1H-пурин-8-ил]-2-тиенил]-2-пропеновой кислоты;
N-(метилнонаоксиэтилен)амид 6-(1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)никотиновой кислоты;
N-циклопропилметил-N-(метилнонаоксиэтилен)амид (E)-3-(1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаоксиэтиленгликоля и (E)-4-[(3-циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-метил-1H-пурин-8-ил]коричной кислоты;
гидрохлорид N-(метилгептаоксиэтилен)-4-[1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил]бензиламина;
1,3-бис(циклогексилметил)-8-[3-(2,5,8,11,14,17,20,23,26,29-декаоксатриаконт-1-ил)фенил]-3,7-дигидро-1H-пурин-2,6-дион;
N-(метилнонаоксиэтилен)амид (E)-4-(1,3-бис(циклопентилметил)-1,2,3,6-тетрагидро-6-оксо-2-тиоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-пропил-1H-пурин-8-ил)коричной кислоты.
25. Применение соединения по любому из пп.1-24 для профилактики или лечения воспалительных состояний, иммунных расстройств, повреждений ткани, инфекционных заболеваний, рака или другого расстройства, при котором измененная адгезия лейкоцитов вносит вклад в патогенез заболевания.
26. Фармацевтическая композиция, содержащая соединение по любому из пп.1-24 вместе с фармацевтически приемлемым разбавителем или носителем.
27. Применение соединения по любому из пп.1-24 для производства лекарства для лечения воспалительных состояний, иммунных расстройств, повреждения ткани, инфекционных заболеваний, рака и любого расстройства, при котором измененная адгезия лейкоцитов вносит вклад в патогенез заболевания.
28. Применение соединения по любому из пп.1-24 для производства лекарства для лечения периодонтального заболевания.
29. Применение соединения формулы (Ib)

или его сольвата,
где X представляет собой -O- или -NH-;
Q представляет собой (-CH2-)p, (-CH=CH-)p, (-CуC-)p, где p представляет собой целое число от 0 до 4;
R1 представляет собой водород или метил;
R2 и R3 независимо представляют собой O или S;
n представляет собой целое число от 1 до 50; и
R представляет собой водород или метил,
для производства лекарства для лечения периодонтального заболевания.
30. Применение соединения, которое представляет собой
эфир метилового эфира декаэтиленгликоля и (E)-4-(1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-3-[1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил]коричной кислоты;
N-(метилнонаоксиэтилен)амид (E)-4-[1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил]коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-[1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил]бензойной кислоты,
для производства лекарства для лечения периодонтального заболевания.
31. Применение эфира метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты в производстве лекарства для лечения периодонтального заболевания.
32. Способ лечения воспалительных состояний, иммунных расстройств, повреждения ткани, инфекционных заболеваний, рака и любого расстройства, при котором измененная адгезия лейкоцитов вносит вклад в патогенез заболевания, при котором субъекту вводят терапевтически эффективное количество соединения по любому из пп.1-24.
33. Способ лечения периодонтального заболевания, при котором субъекту вводят терапевтически эффективное количество соединения по любому из пп.1-24.
34. Способ лечения периодонтального заболевания, при котором субъекту вводят терапевтически эффективное количество соединения формулы (Ib)

или его сольвата,
где X представляет собой -O- или -NH-;
Q представляет собой (-CH2-)p, (-CH=CH-)p, (-CуC-)p, где p представляет собой целое число от 0 до 4;
R1 представляет собой водород или метил;
R2 и R3 независимо представляют собой O или S; n представляет собой целое число от 1 до 50; и R представляет собой водород или метил.
35. Способ лечения периодонтального заболевания, при котором субъекту вводят терапевтически эффективное количество соединения, которое представляет собой
эфир метилового эфира декаэтиленгликоля и (E)-4-(1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-3-[1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил]коричной кислоты;
N-(метилнонаоксиэтилен)амид (E)-4-[1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил]коричной кислоты;
эфир метилового эфира нонаэтиленгликоля и (E)-4-[1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил]бензойной кислоты.
36. Способ лечения периодонтального заболевания, при котором вводят терапевтически эффективное количество эфира метилового эфира нонаэтиленгликоля и (E)-4-(1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9H-пурин-8-ил)коричной кислоты.
37. Способ получения соединений формулы (I) или (Ia) или их сольватов, при котором осуществляют взаимодействие соединения формулы (II)
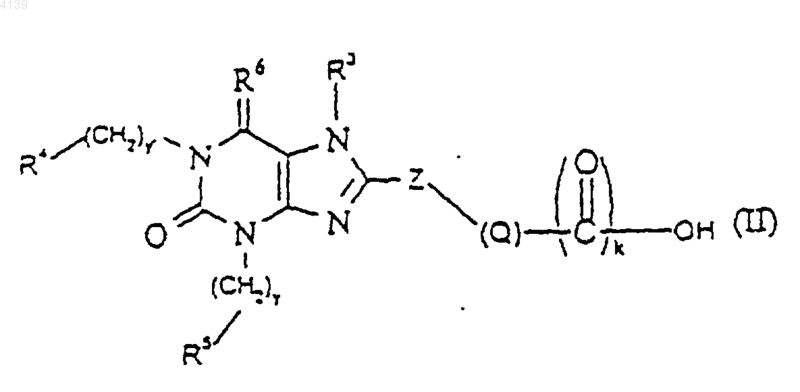
или его активированного производного с соединением формулы (III)

где Q, X, R1, R2, R4, R5, R6, y, y' и n являются такими, как определено в п.1;
и возможно превращают соединение формулы (I), образованное таким образом, в другое соединение формулы (I) либо в соответствующий сольват.
Текст
1 Область изобретения Настоящее изобретение относится к гликолевым производным ксантинов, способам их получения, фармацевтическим препаратам, содержащим их, и к их применению в медицине, в частности, в лечении и профилактике воспалительных состояний, иммунных расстройств,септического шока, расстройств кровообращения, а также желудочно-кишечного воспаления,инфекции или повреждения. Предпосылки изобретения Адгезия лейкоцитов к сосудистому эндотелию играет критическую роль в патогенезе различных заболеваний. Эта адгезия является ранней и необходимой стадией в миграции лейкоцитов в окружающие ткани, и также является непременной для инициации и сохранения воспалительных и иммунных расстройств. Процесс адгезии зависит от индукции или положительной регуляции молекул адгезии на эндотелии,тем самым представляя собой важную мишень для заболеваний, при которых лейкоциты вносят значительный вклад в повреждение сосудов и тканей. Открытие и разработка малых молекул,которые специфично блокируют или ингибируют адгезивные взаимодействия лейкоцитов и эндотелия, представляют собой привлекательную область терапевтического вмешательства, в частности, для воспалительных заболеваний. Современное противовоспалительное лечение,часто сопровождаемое тяжелыми побочными эффектами, имеет ограниченную эффективность. Здесь авторы изобретения описывают открытие ряда сложных эфиров и амидов избранных производных фенилксантина, которые при низких концентрациях ингибируют экспрессию молекул адгезии на культивируемых эндотелиальных клетках пупочной вены человека. Эти соединения, следовательно, показаны для лечения воспалительных состояний, иммунных расстройств, инфекционных заболеваний,расстройств кровообращения, а также ряда других состояний, при которых адгезия между лейкоцитами и эндотелием играет большую роль. В публикации заявки РСТWO 9604280 описаны соединения формулы: где m и n независимо представляют собой целые числа от 0 до 10;X и Y независимо представляют собой кислород или серу;(-СН=СН-)p, где р представляет собой целое число от 1 до 4; а А и В независимо представляют собой метил, разветвленный С 3-6 алкил, С 3-8 циклоалкил или С 3-8 циклоалкенил; 2 а также их соли, сольваты и фармацевтически приемлемые сложные эфиры и амиды; и их применение в лечении воспалительных заболеваний, иммунных расстройств, септического шока, расстройств кровообращения, а также желудочно-кишечного воспаления, инфекции или повреждения. Краткое изложение сущности изобретения Согласно настоящему изобретению предложено соединение формулы (I)Z представляет собой 5- или 6-членный циклоалкил, арил, замещенный циклоалкил или замещенный арил, причем указанный циклоалкил, арил, замещенный циклоалкил или замещенный арил возможно содержит один или более чем один гетероатом, выбранный из О, N или S;R1 представляет собой водород или метил;n представляет собой целое число от 1 до 50;Q представляет собой (-СН 2-)p, (-СН=СН-)p,(-СС-)p, (-(О)р 1 СН 2-)р или (-СН 2(О)р 1)р, где р и р 1 независимо представляют собой целое число от 0 до 4; у и у' независимо представляют собой целые числа от 0 до 10;R3 представляет собой Н, нормальный или разветвленный С 1-12 алкил (возможно замещенный фенилом, -СО-фенил, CN, -СО(С 1-3)алкил,-СО 2(С 1-3)алкил либо содержащий один или более чем один атом О в алкильной цепи); С 1-6 нормальный или разветвленный алкенил (возможно замещенный фенилом, -СО-фенил, CN,-СО(С 1-3)алкил, -СО 2(С 1-3)алкил либо содержащий один или более чем один атом О в алкильной цепи); С 1-6 нормальный или разветвленный алкинил или группу -С 1-3 алкил-NR8R9,где R8 и R9 независимо представляют собой Н, С 1-3 алкил или вместе образуют 5- или 6 членную гетероциклическую группу, возможно содержащую другие гетероатомы, выбранные из О, N или S;- С 1-6 алкил с нормальной или разветвленной цепью;- нормальный или разветвленный С 2-6 алкенил;- арил или замещенный арил;- гетероциклическую группу или замещенную гетероциклическую группу, включая гетероарил и замещенные гетероарильные группы;R6 и R7 независимо представляют собой О или S; при условии, что когда- у и у 1 оба представляют собой 1,- k представляет собой 1,- р 1 представляет собой ноль,- R2 представляет собой Н или Me,- R3 представляет собой Н,- X представляет собой О или NH, и- Z представляет собой фенил,R4 и R5 оба не представляют собой циклогексил; либо его сольват. Согласно настоящему изобретению предложено также соединение формулы (Ia)Z представляет собой 5- или 6-членный циклоалкил, арил, замещенный циклоалкил или замещенный арил, причем указанный циклоалкил, арил, замещенный циклоалкил или замещенный арил возможно содержит один или более чем один гетероатом, выбранный из О, N или S;R1 представляет собой водород или метил;n представляет собой целое число от 1 до 50;p1 независимо представляют собой целое число от 0 до 4; у и у' независимо представляют собой целые числа от 0 до 10;R3 представляет собой Н, нормальный или разветвленный С 1-12 алкил (возможно замещенный фенилом, -СО-фенил, CN, -СО(С 1-3)алкил,-СO2(С 1-3)алкил либо содержащий один или более чем один атом О в алкильной цепи); С 1-6 нормальный или разветвленный алкенил; С 1-6 нормальный или разветвленный алкинил или группу -С 1-3 алкил-NR8R9, 004139 4 где R8 и R9 независимо представляют собой Н, С 1-3 алкил или вместе образуют 5- или 6 членную гетероциклическую группу, возможно содержащую другие гетероатомы, выбранные из О, N или S;- С 1-6 алкил с нормальной или разветвленной цепью;- нормальный или разветвленный С 2-6 алкенил;- арил или замещенный арил;- гетероциклическую группу или замещенную гетероциклическую группу, включая гетероарил и замещенные гетероарильные группы;R6 и R7 независимо представляют собой О или S; при условии, что, когда- у и у' оба представляют собой 1,- к представляет собой 1,- р 1 представляет собой ноль,- R3 представляет собой Н,- X представляет собой О или NH, и- Z представляет собой фенил,R4 и R5 оба не представляют собой циклогексил; или его сольват. Подробное описание изобретения Термин арил, как его используют здесь,относится к карбоциклической группе, имеющей 6-14 атомов углерода, по меньшей мере с одним ароматическим кольцом (например фенильным или бифенильным) либо множественными конденсированными кольцами, в которых по меньшей мере одно кольцо является ароматическим (например 1,2,3,4-тетрагидронафтил,нафтил, антрил или фенантрил). Термин замещенный арил, как его используют здесь, относится к арилу, возможно замещенному одной или более чем одной функциональной группой, например галогеном, низшим алкилом, низшим алкокси, низшим алкилтио, трифторметилом, амино, амидо, карбоксилом, гидроксилом, арилом, арилокси, гетероциклом, гетероарилом, замещенным гетероарилом, нитро, циано, алкилтио, тиолом, сульфамидо и тому подобным. Термин аралкил, как его используют здесь, относится к С 1-12 алкилу, который может представлять собой нормальную или разветвленную алкильную группу, которая замещена арильной или замещенной арильной группой. Термины замещенный алкил или замещенный циклоалкил, как их используют здесь,относятся к алкилу или циклоалкилу, возможно замещенному одной или более чем одной функциональной группой, например галогеном, низшим алкилом, низшим алкокси, низшим алкилтио, трифторметилом, амино, амидо, карбоксилом, гидроксилом, арилом, арилокси, гетероциклом, гетероарилом, замещенным гетероари 5 лом, нитро, циано, алкилтио, тиолом, сульфамидо и тому подобным. Термин гетероциклическая группа, как его используют здесь, относится к насыщенной,ненасыщенной или ароматической карбоциклической группе, имеющей вплоть до семи членов в единственном кольце (например, к имидазолидинилу, пиперидилу, пиперазинилу, пирролидинилу, морфолинилу, пиридилу, пиридазинилу, пиримидинилу, пиразинилу, пирролилу, пиразолилу, имидазолилу, пиранилу, фурилу, тиенилу, оксазолилу, изоксазолилу, оксадиазолилу,тиазолилу, тиадиазолилу, триазолилу или тетразолилу) либо множественных конденсированных кольцах (например, к нафтопиридилу, хиноксалилу, индолицинилу или бензо[b]тиенилу), и имеющей от одного до трех гетероатомов, таких как N, О или S, в кольце. Гетероциклическая группа может быть возможно незамещенной или замещенной (то есть замещенной гетероциклической группой), например, галогеном, низшим алкилом, низшим алкокси, низшим алкилтио, трифторметилом, амино, амидо,карбоксилом, гидроксилом, арилом, арилокси,гетероциклической группой, гетероарилом, замещенным гетероарилом, нитро, циано, алкилтио, тиолом, сульфамидо и тому подобным. Термин гетероарил, как его используют здесь, относится к гетероциклической группе, в которой по меньшей мере одно гетероциклическое кольцо является ароматическим. Термин замещенный гетероарил, как его используют здесь, относится к гетероциклической группе, возможно замещенной одним или более чем одним заместителем, включая галоген, низший алкил, низший алкокси, низший алкилтио, трифторметил, амино, амидо, карбоксил, гидроксил, арил, арилокси, гетероцикл, гетероарил, замещенный гетероарил, нитро, циано, алкилтио, тиол, сульфамидо и тому подобное. Термин С 1-12 алкил, как его используют здесь, обозначает нормальные или разветвленные алкильные группы, содержащие указанное число атомов углерода. Термин С 2-6 алкенил относится к алкенильным группам с нормальной или разветвленной цепью, содержащим от 2 до 6 атомов углерода, например к пропенилену. Термин С 3-8 циклоалкил включает в себя циклические группы, содержащие 3-8 атомов углерода, такие как циклопропан, циклобутан,циклопентан, циклогексан, циклогептан и циклооктан, а также включает в себя мостиковые циклоалкильные группы, например норборнил. В одном частном аспекте изобретения предложено соединение формулы (I) или (Ia),где R4 и R5 независимо представляют собой:- С 1-6 алкил с нормальной или разветвленной цепью;- нормальный или разветвленный С 2-6 алкенил. В другом аспекте изобретения предложено соединение формулы (I) или (Ia), где R4 и R5 независимо представляют собой арил или замещенный арил. В другом аспекте изобретения предложено соединение формулы (I) или (Ia), где R4 и R5 независимо представляют собой гетероциклическую группу или замещенную гетероциклическую группу, включая гетероарильную и замещенную гетероарильную группы. В еще одном аспекте изобретения предложено соединение формулы (I) или (Ia), где R3 представляет собой С 1-3 алкилNR8R9, a R8 и R9 независимо представляют собой Н или С 1-3 алкил. В еще одном аспекте изобретении предложено соединение формулы (I) или (Ia), где R3 представляет собой С 1-3 алкилNR8R9, a R8 и R9 вместе образуют 5- или 6-членную гетероциклическую группу, возможно содержащую другие гетероатомы, выбранные из О, N или S. В еще одном аспекте изобретения предложено соединение формулы (I) или (Ia), где Z представляет собой 5- или 6-членный циклоалкил, арил, замещенный циклоалкил или замещенный арил, не содержащий гетероатомов. В еще одном аспекте изобретения предложено соединение формулы (I) или (Ia), где Z представляет собой 5- или 6-членный циклоалкил, арил, замещенный циклоалкил или замещенный арил, содержащий от одного до трех гетероатомов, независимо выбранных из О, N или S. В одном предпочтительном воплощении определены соединения формулы I, где Z представляет собой фенильное кольцо, тиофеновое кольцо или пиридиновое кольцо, более предпочтительно фенил. Предпочтительно группировка может быть присоединена к Z в любом подходящем положении. Когда Z представляет собой фенил, эта группировка предпочтительно присоединена к фенильному кольцу в параположении. В одном предпочтительном воплощении определены соединения формулы I, где R1 представляет собой Н. В другом предпочтительном воплощении определены соединения формулы I, где R2 представляет собой метил или этил. В еще одном предпочтительном воплощении определены соединения формулы I, где k представляет собой 1. Определен другой предпочтительный ряд соединений в пределах формулы I, где n представляет собой число от 8 до 20, более предпочтительно от 8 до 15. Однако в некоторых во 7 площениях настоящего изобретения, как например таких, где R3 является иным, чем Н, n предпочтительно может представлять собой число,меньшее чем от 8 до 20, например от 5 до 20. Подобным образом, когда k равно 0, n предпочтительно может представлять собой число,меньшее чем от 8 до 20, например 5-20. Определен еще один предпочтительный ряд соединений в пределах формулы I, где X представляет собой -О-, -N(Н)- или -N(CH3)-. В одном предпочтительном воплощении определены соединения формулы I, где Q представляет собой (-СН=СН-)p. Более предпочтительно, определены соединения, где Q представляет собой (-СН=СН-)p, а р равно 1. Определен один предпочтительный ряд соединений формулы I, где у и у' являются одинаковыми. Более предпочтительно, определены соединения формулы I, где у и у' представляют собой 1. В другом предпочтительном воплощении определены соединения формулы I, где R3 представляет собой метил. Определен другой предпочтительный ряд соединений формулы I, где R4 и R5 независимо выбраны из группы, состоящей из С 1-6 алкила,С 3-8 циклоалкила и арила. Более предпочтительно R4 и R5 независимо выбраны из циклобутила,циклопентила, циклогексила, пропила, бутила,изопропила, изобутила и фенила. Хотя определен один предпочтительный ряд соединений,где R4 и R5 являются различными, определен другой предпочтительный ряд соединений определена, где R4 и R5 являются одинаковыми. В другом предпочтительном воплощенииR6 и R7 являются одинаковыми. Более предпочтительно и R6, и R7 представляют собой О. Согласно дальнейшему аспекту настоящего изобретения предложено соединение формулы (I) или (Ia), как оно определено выше, где X представляет собой -О-, a R1 представляет собой Н; из них предпочтительными являются соединения, где n представляет собой целое число от 8 до 20, и более предпочтительными являются соединения, где n представляет собой целое число от 8 до 15. Следует понимать, что настоящее изобретение охватывает все комбинации частных и предпочтительных групп, описанных выше. Изобретение также включает в себя смеси соединений формулы (I) или (Ia) в любом соотношении, например, где n варьирует в одном и том же образце. Особенно предпочтительные соединения по изобретению включают в себя: эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(бензил)-1,2,3,6-тетрагидро 2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-[1,3-бис(циклогексилметил)-1,2,3,6 тетрагидро-2,6-диоксо-9 Н-пурин-8-ил]коричной кислоты; 8 эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(циклопентилметил)-1,2,3,6 тетрагидро-2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(пропил)-1,2,3,6-тетрагидро 2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(циклопропилметил)-1,2,3,6 тетрагидро-2,б-диоксо-9 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-3-1-пропил-3-бензил)-1,2,3,6-тетрагидро-2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(циклогептилметил)-1,2,3,6 тетрагидро-2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(циклогексилэтил)-1,2,3,6 тетрагидро-2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(фенил)-1,2,3,6-тетрагидро 2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(2-метилпропил)-1,2,3,6 тетрагидро-2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-1-пропил-3-циклогексилметил)1,2,3,6-тетрагидро-2,6-диоксо-9 Н-пурин-8 ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(бицикло(2.2.1)гепт-2-илметил)-1,2,3,6-тетрагидро-2,6-диоксо-9 Н-пурин 8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-1-циклогексилметил-3-бутил)-1,2,3,6-тетрагидро-2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-1-циклогексилметил-3-пропил)1,2,3,6-тетрагидро-2,6-диоксо-9 Н-пурин-8-ил) коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(бензил)-1,2,3,6-тетрагидро-2 тиоксо-6-оксо-9 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1-метил-3-(3-цианобензил)-1,2,3,6 тетрагидро-2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и(Е)-4-(1,3-бис(3-фторбензил)-1,2,3,6 тетрагидро-2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и 9 эфир метилового эфира нонаэтиленгликоля и (Е)-4-1,3-бисфенетил)-1,2,3,6-тетрагидро 2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-1-циклогексилметил-3-метил)-1,2,3,6-тетрагидро-2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и(Е)-4-1-Н-3-(2-метилпропил)-1,2,3,6 тетрагидро-2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(4-фторбензил)-1,2,3,6-тетрагидро-2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты; эфир додецилового эфира гексаэтиленгликоля и (Е)-4-(1,3-бис(циклогексилметил)-1,2,3,6 тетрагидро-2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(циклобутилметил)-1,2,3,6 тетрагидро-2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-1-метил-3-циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-1-метил-3-изобутил)-1,2,3,6-тетрагидро-2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и 4-(1,3-бис(циклогексилметил)-1,2,3,6 тетрагидро-2,6-диоксо-9 Н-пурин-8-ил)бензойной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(циклогексил)-1,2,3,6-тетрагидро-2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты;N-метил-N-(метилнонаоксиэтилен)амид 4(1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро 2,6-диоксо-9 Н-пурин-8-ил)бензойной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(циклогексилметил)-2,3,6,7 004139 10 тетрагидро-2,6-диоксо-7-бензил-1 Н-пурин-8 ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(циклогексилметил)-2,3,6,7 тетрагидро-2,6-диоксо-7-(2-оксо-2-фенилэтил)1 Н-пурин-8-ил)коричной; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(циклогексилметил)-2,3,6,7 тетрагидро-2,6-диоксо-7-метил-1 Н-пурин-8 ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(циклогексилметил)-2,3,6,7 тетрагидро-2,6-диоксо-7-(2-пропинил)-1 Нпурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(циклогексилметил)-2,3,6,7 тетрагидро-2,6-диоксо-7-(2-оксо-2-метилэтил)1 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(циклогексилметил)-2,3,6,7 тетрагидро-2,6-диоксо-7-(3-морфолинопропил)1 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(циклогексилметил)-2,3,6,7 тетрагидро-2,6-диоксо-7-этил-1 Н-пурин-8 ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(циклогексилметил)-2,3,6,7 тетрагидро-2,6-диоксо-7-(2-этокси-2-оксоэтил)1 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(циклогексилметил)-2,3,6,7 тетрагидро-2,6-диоксо-7-(2-метил-2-пропенил)1 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(циклогексилметил)-2,3,6,7 тетрагидро-2,6-диоксо-7-(цианометил)-1 Нпурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и 4-(1,3-бис(циклогексилметил)-2,3,6,7 тетрагидро-2,6-диоксо-7-бензил-1 Н-пурин-8 ил)бензойной кислоты; эфир метилового эфира нонаэтиленгликоля и 4-(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-метил-1 Н-пурин-8-ил)бензойной кислоты; эфир метилового эфира нонаэтиленгликоля и 4-[(1,3-бис(циклогексилметил)-2,3,6,7 тетрагидро-2,6-диоксо-7-метил-1 Н-пурин-8-ил) фенил]пропионовой кислоты;N-(метилнонаоксиэтилен)амид 4-(1,3 бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6 диоксо-7-метил-1 Н-пурин-8-ил)бензойной кислоты; 1,3-бис(циклогексилметил)-8-[4-(2,5,8,11,14,17,20,23,26,29-декаоксатриаконт-1-ил)фенил]-3,7-дигидро-1 Н-пурин-2,6-дион; эфир метилового эфира нонаэтиленгликоля и (Е)-3-[5-[1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-1 Н-пурин-8-ил]2 тиенил]-2-пропеновой кислоты;N-(бензилгексаоксиэтилен)амид (Е)-4-(1,3 бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6 диоксо-9 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира гептаэтиленгликоля и(Е)-4-[(3-циклогексилметил)-2,3,6,7 тетрагидро-2,6-диоксо-7-метил-1H-пурин-8-ил] коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-[(3-циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-метил-1 Н-пурин-8-ил]коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-[(3-циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-1,7-диметил-1 Н-пурин-8-ил] коричной кислоты;N-(метилнонаоксиэтилен)-4-[1,3-бис (циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо 9 Н-пурин-8-ил]бензиламин; 1,3-бис(циклогексилметил)-8-[3-(2,5,8,11,14,17,20,23,26,29-декаоксатриаконт-1-ил)фенил]-3,7-дигидро-1 Н-пурин-2,6-дион; эфир метилового эфира гептаэтиленгликоля и (Е)-4-(1,3-бис(циклогексилметил)-2,3,6,7 тетрагидро-2,6-диоксо-7-метил-1 Н-пурин-8-ил) коричной кислоты; эфир метилового эфира пентаэтиленгликоля и (Е)-4-(1,3-бис(циклогексилметил)-2,3,6,7 тетрагидро-2,6-диоксо-7-метил-1 Н-пурин-8 ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(циклогексилметил)-2,3,6,7 тетрагидро-2,6-диоксо-7-пропил-1 Н-пурин-8 ил)коричной кислоты. В частности более предпочтительны соединения: эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(бензил)-1,2,3,6-тетрагидро 2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты; 12 эфир метилового эфира нонаэтиленгликоля и (Е)-4-[1,3-бис(циклогексилметил)-1,2,3,6 тетрагидро-2,6-диоксо-9 Н-пурин-8-ил]коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(циклопентилметил)-1,2,3,6 тетрагидро-2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(пропил)-1,2,3,6-тетрагидро 2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(циклогептилметил)-1,2,3,6 тетрагидро-2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(циклогексилэтил)-1,2,3,6 тетрагидро-2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(фенил)-1,2,3,6-тетрагидро 2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(2-метилпропил)-1,2,3,6 тетрагидро-2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-1-пропил-3-циклогексилметил)1,2,3,6-тетрагидро-2,6-диоксо-9 Н-пурин-8-ил) коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-1,3-бис(бицикло(2.2.1)гепт-2-илметил)-1,2,3,6-тетрагидро-2,6-диоксо-9 Н-пурин 8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1-циклогексилметил-3-бутил)-1,2,3,6-тетрагидро-2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-1-циклогексилметил-3-пропил)1,2,3,6-тетрагидро-2,6-диоксо-9 Н-пурин-8-ил) коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(0,3-бис(3-фторбензил)-1,2,3,6-тетрагидро-2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и(Е)-4-1,3-бис(2-фторбензил)-1,2,3,6 тетрагидро-2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бисфенетил)-1,2,3,6-тетрагидро 2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и(Е)-4-(1-Н-3-(2-метилпропил)-1,2,3,6 тетрагидро-2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и 13 эфир додецилового эфира гексаэтиленгликоля и (Е)-4-(1,3-бис(циклогексилметил)-1,2,3,6 тетрагидро-2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(циклобутилметил)-1,2,3,6 тетрагидро-2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и(Е)-4-1-метил-3-изобутил)-1,2,3,6 тетрагидро-2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и 4-(1,3-бис(циклогексилметил)-1,2,3,6 тетрагидро-2,6-диоксо-9 Н-пурин-8-ил)бензойной кислоты;N-(метилнонаоксиэтилен)амид 4-(1,3 бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6 диоксо-9 Н-пурин-8-ил)бензойной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(циклогексилметил)-2,3,6,7 тетрагидро-2,6-диоксо-7-бензил-1 Н-пурин-8 ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(циклогексилметил)-2,3,6,7 тетрагидро-2,6-диоксо-7-(2-оксо-2-фенилэтил)1 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(циклогексилметил)-2,3,6,7 тетрагидро-2,6-диоксо-7-метил-1 Н-пурин-8-ил) коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(циклогексилметил)-2,3,6,7 тетрагидро-2,6-диоксо-7-(2-пропинил)-1 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(циклогексилметил)-2,3,6,7 тетрагидро-2,6-диоксо-7-(2-оксо-2-метилэтил)1 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(циклогексилметил)-2,3,6,7 тетрагидро-2,6-диоксо-7-(3-морфолинопропил)1 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(циклогексилметил)-2,3,6,7 тетрагидро-2,6-диоксо-7-этил-1 Н-пурин-8-ил) коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(циклогексилметил)-2,3,6,7 тетрагидро-2,6-диоксо-7-(2-этокси-2-оксоэтил)1 Н-пурин-8-ил)коричной кислоты; 14 эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(циклогексилметил)-2,3,6,7 тетрагидро-2,6-диоксо-7-(2-метил-2-пропенил)1 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(циклогексилметил)-2,3,6,7 тетрагидро-2,6-диоксо-7-(цианометил)-1 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и 4-(1,3-бис(циклогексилметил)-2,3,6,7 тетрагидро-2,6-диоксо-7-бензил-1 Н-пурин-8-ил) бензойной кислоты; эфир метилового эфира нонаэтиленгликоля и 4-(1,3-бис(циклогексилметил)-2,3,6,7 тетрагидро-2,6-диоксо-7-метил-1 Н-пурин-8-ил) бензойной кислоты;N-(метилнонаоксиэтилен)амид 4-(1,3 бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6 диоксо-7-бензил-1 Н-пурин-8-ил)бензойной кислоты; 1,3-биc(циклогексилметил)-8-[4-(2,5,8,11,14,17,20,23,26,29-декаоксатриаконт-1-ил)фенил]-3,7-дигидро-1 Н-пурин-2,6-дион; эфир метилового эфира нонаэтиленгликоля и (Е)-3-[5-[1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-1 Н-пурин-8-ил]-2 тиенил]-2-пропеновой кислоты;N-циклопропилметил-N-(метилнонаоксиэтилен)амид (Е)-3-(1,3-бис(циклогексилметил)1,2,3,6-тетрагидро-2,6-диоксо-9 Н-пурин-8-ил) коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-[(3-циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-метил-1 Н-пурин-8-ил]коричной кислоты; гидрохлорид N-(метилгептаоксиэтилен)-4[1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро 2,6-диоксо-9 Н-пурин-8-ил]бензиламина; 1,3-бис(циклогексилметил)-8-[3-(2,5,8,11,14,17,20,23,26,29-декаоксатриаконт-1-ил)фенил]-3,7-дигидро-1 Н-пурин-2,6-дион;N-(метилнонаоксиэтилен)амид (Е)-4-(1,3 бис(циклопентилметил)-1,2,3,6-тетрагидро-6 оксо-2-тиоксо-9 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(циклогексилметил)-2,3,6,7 тетрагидро-2,6-диоксо-7-пропил-1 Н-пурин-8 ил)коричной кислоты. Соединения по настоящему изобретению способны существовать в виде геометрических 15 и оптических изомеров. Все такие изомеры, индивидуально и в виде смесей, включены в объем настоящего изобретения. Там, где Q содержит двойную связь, предпочтительными являются соединения в форме Е-геометрических изомеров. Как упомянуто выше, соединения формулы (I) или (Ia) и их сольваты имеют применение в профилактике и лечении воспалительных состояний, иммунных расстройств, повреждения ткани, инфекционных заболеваний, рака и любого расстройства, при котором измененная адгезия лейкоцитов вносит вклад в патогенез этого заболевания. Это продемонстрировано ниже в биологических анализах, в которых показано,что репрезентативные соединения по настоящему изобретению являются активными. Примерами воспалительных состояний или иммунных расстройств являются воспалительные состояния или иммунные расстройства легких, суставов, глаз, кишечника, кожи, в частности, воспалительные состояния или иммунные расстройства, которые связаны с инфильтрацией лейкоцитов в воспаленную ткани. Состояния легкого включают в себя астму, респираторный дистресс-синдром взрослых, пневмонию, бронхит и муковисцидоз (в которые может быть дополнительно или альтернативно вовлечен кишечник или другая ткань(ткани. Состояния сустава включают в себя ревматоидный артрит,ревматоидный спондилит, остеоартрит, подагрический артрит и другие артритные состояния. Воспалительные глазные состояния включают в себя увеит (включая ирит) и конъюнктивит. Воспалительные состояния кишечника включают в себя болезнь Крона, язвенный колит и дистальный проктит. Другие состояния желудочнокишечного тракта включают в себя периодонтальное заболевание, эзофагит, индуцированное НСПВС (нестероидные противовоспалительные средства) желудочно-кишечное повреждение,индуцированное химиотерапией воспаление слизистой оболочки, связанную со СПИДом диарею и инфекционную диарею. Кожные заболевания включают в себя заболевания, которые связаны с пролиферацией клеток, такие как псориаз, экзема и дерматит (аллергического ли происхождения или неаллергического). Состояния сердца включают в себя коронарное инфарктное повреждение. Другие воспалительные состояния и иммунные расстройства включают в себя некроз ткани при хроническом воспалении, эндотоксический шок, расстройства пролиферации гладкой мускулатуры (например рестеноз после ангиопластики) и отторжение ткани после трансплантационной хирургии. Примерами расстройств кровообращения являются расстройства, в которые вовлечено повреждение ткани в результате инфильтрации лейкоцитов в ткань, такие как коронарное инфарктное повреждение и реперфузионное повреждение. Другие расстройства включают в себя рак и 16 инфекционные заболевания, такие как церебральная малярия, вирусные инфекции, такие как синдром приобретенного иммунодефицита(СПИД), а также любая другая инфекция, при которой в патогенность вносит вклад измененная экспрессия молекул адгезии. Соответственно, согласно настоящему изобретению также предложен способ профилактики или лечения воспалительного состояния или иммунного расстройства у млекопитающего, такого как человек, при котором вводят терапевтически эффективное количество соединения формулы (I) или (Ia) или его фармацевтически приемлемого сольвата. Далее, согласно настоящему изобретению предложен способ профилактики или лечения септического шока у млекопитающего, такого как человек,при котором вводят терапевтически эффективное количество соединения формулы (I) или (Ia) или его фармацевтически приемлемого сольвата. В качестве альтернативы также предложено соединение формулы (I) или (Ia) либо его фармацевтически приемлемый сольват для применения в медицинской терапии, в частности для применения в профилактике или лечении воспалительного состояния или иммунного расстройства у млекопитающего, такого как человек. Далее, согласно настоящему изобретению предложено соединение формулы (I) или (Ia) либо его фармацевтически приемлемый сольват для применения в профилактике или лечении септического шока. В следующем аспекте настоящего изобретения предложен ингибитор молекул клеточной адгезии, предпочтительно ингибитор молекул эндотелиальной клеточной адгезии, для применения в лечении периодонтального заболевания,а также способы лечения периодонтального заболевания, при которых применяют ингибитор молекул клеточной адгезии, предпочтительно ингибитор молекул эндотелиальной клеточной адгезии. Предложены также соединения формулы(I) или (Ia) для применения в производстве лекарства для лечения периодонтального заболевания и способы лечения периодонтального заболевания, при которых применяют соединения формулы (I) или (Ia). Предложены также соединения формулыQ представляет собой (-СН 2-)p, (-СН=СН-)p,(-CC-)p, где р представляет собой целое число от 0 до 4;R1 представляет собой водород или метил;R2 и R3 независимо представляют собой О или S;n представляет собой целое число от 1 до 50 иR представляет собой водород или метил,для применения в производстве лекарства для лечения периодонтального заболевания, а также способы лечения периодонтального заболевания посредством введения терапевтически эффективного количества соединения формулы(Ib). Предложено также соединение, которое представляет собой: эфир метилового эфира декаэтиленгликоля и(Е)-4-(1,3-бис(циклогексилметил)-1,2,3,6 тетрагидро-2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(циклогексилметил)-1,2,3,6 тетрагидро-2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты; эфир метилового эфира нонаэтиленгликоля и (Е)-3-[1,3-бис(циклогексилметил)-1,2,3,6 тетрагидро-2,6-диоксо-9 Н-пурин-8-ил]коричной кислоты;N-(метилнонаоксиэтилен)амид (Е)-4-[1,3 бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6 диоксо-9 Н-пурин-8-ил]коричной кислоты; или эфир метилового эфира нонаэтиленгликоля и (Е)-4-[1,3-бис(циклогексилметил)-1,2,3,6 тетрагидро-2,6-диоксо-9 Н-пурин-8-ил]бензойной кислоты для применения в производстве лекарства для лечения периодонтального заболевания, а также способы лечения периодонтального заболевания путем введения терапевтически эффективного количества указанного соединения. Предложен также эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9 Нпурин-8-ил)коричной кислоты для применения в производстве лекарства для лечения периодонтального заболевания, а также способы лечения периодонтального заболевания путем введения терапевтически эффективного количества сложного эфира метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9 Н-пурин 8-ил)коричной кислоты. Термин ингибитор молекул клеточной адгезии включает в себя соединения, которые специфично блокируют или ингибируют белки на поверхности животных клеток, которые опосредуют клеточно-клеточное связывание. Предпочтительно термин ингибитор молекул клеточной адгезии включает в себя соединения,которые ингибируют экспрессию молекул клеточной адгезии. Термин ингибитор "молекул эндотелиальной клеточной адгезии" включает в себя соединения, которые специфично блокируют или ин 004139 18 гибируют адгезивные взаимодействия лейкоцитов и эндотелия. Эти соединения можно идентифицировать путем проведения анализа эндотелиальной клеточной адгезии, как описано ниже. Предпочтительно соединения имеют значения IC50 в данном анализе 500 нМ или менее,более предпочтительно 100 нМ или менее и еще более предпочтительно 50 нМ или менее. Предпочтительно термин ингибитор молекул эндотелиальной клеточной адгезии включает в себя соединения, которые ингибируют экспрессию молекул эндотелиальной клеточной адгезии. Более предпочтительно, молекулы эндотелиальной клеточной адгезии включают в себя ICAM-1MadCAM. Количество соединения формулы (I) или(Ia), либо его фармацевтически приемлемого сольвата, которое требуется для достижения желаемого биологического эффекта, будет зависеть от ряда факторов, таких как применение,для которого оно предназначено, способ введения и реципиент. Можно ожидать, что типичная суточная доза для лечения септического шока,например, будет находиться в диапазоне 0,005100 мг/кг, предпочтительно 0,5-100 мг/кг и наиболее предпочтительно 0,5-20 мг/кг. Эту дозу можно вводить в виде однократной стандартной дозы, либо в виде нескольких отдельных стандартных доз, либо в виде непрерывной инфузии. Можно ожидать, что внутривенная доза будет находиться в диапазоне от 0,0025 до 200 мг/кг, и ее типично следует вводить в виде инфузии. Подобные дозировки применимы для лечения других болезненных состояний. Для введения в легкие субъекта посредством аэрозоля следует применять количество соединения, достаточное для достижения концентраций на поверхностной жидкости дыхательных путей субъекта, составляющих примерно от 2 до 1000 мкмоль. Для воспалительных кожных заболеваний достижение таких же концентраций (от 2 до 1000 мкмоль) на поверхности кожи будет желательно для местного нанесения соединения. Можно ожидать, что суточная доза, вводимая перорально для лечения воспалительных состояний, находится в диапазоне от 0,05 до 100 мг/кг, наиболее предпочтительно 0,5-20 мг/кг,причем ее можно вводить в виде однократной стандартной дозы или в виде нескольких отдельных стандартных доз. Таким образом, в следующем аспекте настоящего изобретения предложены фармацевтические композиции, содержащие в качестве активного ингредиента соединение формулы (I) или (Ia) либо его фармацевтически приемлемую соль или сольват вместе по меньшей мере с одним фармацевтическим носителем или эксципиентом. Эти фармацевтические композиции можно применять при профилактике и лечении состояний, таких как септический шок, воспа 19 лительные состояния и иммунные расстройства. Носитель должен быть фармацевтически приемлемым для реципиента и должен быть совместимым с другими ингредиентами композиции, то есть не оказывать на них вредного воздействия. Этот носитель может быть твердым или жидким, и его предпочтительно включают в препарат в виде препарата стандартной дозы,например таблетки, которая может содержать от 0,05 до 95 мас.%/мас. активных ингредиентов. Если желательно, в эти фармацевтические композиции по изобретению можно включать другие физиологически активные ингредиенты. Возможные препараты включают в себя препараты, которые являются подходящими для перорального, подъязычного, трансбуккального,парентерального (например подкожного, внутримышечного или внутривенного), ректального,местного, включая чрескожное, интраназальное и ингаляционное, введения. Наиболее подходящие способы введения для конкретного пациента будут зависеть от природы и тяжести состояния, которое лечат, и от природы активного соединения, но, где возможно, iv(внутривенно)введение является предпочтительным для лечения, например, септического шока. Однако для лечения такого состояния как астма предпочтительным путем введения является пероральный или ингаляционный. Препараты, подходящие для перорального введения, можно создать в виде дискретных единиц, таких как таблетки, капсулы, крахмальные облатки, лепешки, каждая из которых содержит заданное количество активного соединения; в виде порошков или гранул; в виде растворов или суспензий в водных или неводных жидкостях; либо в виде эмульсий масла в воде или воды в масле. Препараты, подходящие для подъязычного или трансбуккального введения, включают в себя лепешки, содержащие активное соединение и, типично, основу-корригент, такую как сахар и аравийская камедь или трагакант, и пастилки,содержащие активное соединение в инертной основе, такой как желатин и глицерин или сахароза, аравийская камедь. Препараты, подходящие для парентерального введения, типично содержат стерильные водные растворы, содержащие заданную концентрацию активного соединения; раствор предпочтительно является изотоническим относительно крови предполагаемого реципиента. Дополнительные препараты, подходящие для парентерального введения, включают в себя препараты, содержащие физиологически подходящие сорастворители и/или комплексообразующие агенты, такие как поверхностноактивные вещества и циклодекстрины. Эмульсии масла в воде также являются подходящими препаратами для парентеральных препаратов. Хотя такие растворы предпочтительно вводят внутривенно, их можно также вводить посред 004139 20 ством подкожной или внутримышечной инъекции. Препараты, подходящие для ректального введения, предпочтительно предоставляют в виде суппозиториев стандартной дозы, содержащих активный ингредиент в одном или более чем одном твердом носителе, образующем основу суппозитория, например в масле какао. Препараты, подходящие для местного или интраназального применения, включают в себя мази, кремы, лосьоны, пасты, гели, спреи, аэрозоли и масла. Подходящие носители для таких препаратов включают в себя вазелин, ланолин,полиэтиленгликоли, спирты, а также их комбинации. Активный ингредиент типично присутствует в таких препаратах в концентрации от 0,1 до 15 мас.%/мас. Препараты по изобретению можно приготовить любым подходящим способом, типично,путем смешивания, равномерного и до однородности, активного соединения с жидкостями или тонкоизмельченными твердыми носителями либо с тем и другим, в требуемых соотношениях, а затем, если необходимо, формования полученной смеси в виде желаемой формы. Например, таблетку можно изготовить путем прессования однородной смеси, содержащей порошок или гранулы активного ингредиента и одного или более чем одного возможного ингредиента, такого как связывающее вещество,смазывающее вещество, инертный разбавитель или поверхностно-активное диспергирующее вещество, либо с помощью формования однородной смеси порошкообразного активного ингредиента и инертного жидкого разбавителя. Подходящие препараты для введения путем ингаляции включают в себя порошки или туманы мелких частиц, которые можно получить посредством различных типов дозирующих аэрозолей под давлением, небулайзеров или инсуффляторов. Для введения в легкие через рот размер частиц порошка или капель типично находится в диапазоне 0,5-10 мкм, предпочтительно 1-5 мкм, чтобы гарантировать доставку в бронхиальное дерево. Для назального введения размер частиц в диапазоне 10-500 мкм является предпочтительным, чтобы гарантировать задержку в носовой полости. Дозирующие ингаляторы представляют собой дозаторы аэрозоля под давлением, типично содержащие препарат в виде суспензии или раствора активного ингредиента в сжиженном пропелленте. Во время применения эти устройства выпускают препарат через клапан, приспособленный для доставки дозированного объема,типично от 10 до 150 мкл, чтобы создать распыляемый раствор мелких частиц, содержащий активный ингредиент. Подходящие пропелленты включают в себя некоторые хлорфторуглеродные соединения, например дихлордифторметан, трихлорфторметан, дихлортетрафторэтан 21 и их смеси. Препарат может дополнительно содержать один или более чем один сорастворитель, например этанольные поверхностноактивные вещества, такие как олеиновая кислота или сорбитана триолеат, антиоксиданты и подходящие корригирующие вещества. Небулайзеры представляют собой имеющиеся в продаже устройства, которые превращают растворы или суспензии активного ингредиента в терапевтический аэрозоль либо посредством разгона сжатого газа, типично воздуха или кислорода, через узкую трубку Вентури,либо посредством ультразвукового возмущения. Подходящие препараты для применения в небулайзерах состоят из активного ингредиента в жидком носителе, составляющего вплоть до 40 мас.%/мас. препарата, предпочтительно менее чем 20 мас.%/мас. Носитель типично представляет собой воду или разбавленный водный спиртовой раствор, предпочтительно сделанный изотоническим по отношению к жидкостям организма посредством добавления, например,хлорида натрия. Возможные добавки включают в себя консерванты, если препарат не готовят стерильным, например, метилгидроксибензоат,антиоксиданты, корригирующие вещества,эфирные масла, забуферивающие агенты и поверхностно-активные вещества. Подходящие препараты для введения путем инсуффляции включают в себя тонкоизмельченные порошки, которые могут быть доставлены с помощью инсуффлятора или введены в носовую полость посредством нюханья. В инсуффляторе порошок содержится в капсулах или картриджах, типично изготовленных из желатина или пластика, которые либо протыкают,либо открывают in situ, и порошок доставляется путем втягивания воздуха из этого устройства при ингаляции либо с помощью насоса с ручным управлением. Порошок, применяемый в инсуффляторе, состоит либо только из активного ингредиента, либо из смеси порошков, содержащей активный ингредиент, подходящий порошкообразный разбавитель, такой как лактоза, а также возможное поверхностно-активное вещество. Активный ингредиент типично составляет от 0,1 до 100 мас.%/мас. препарата. Таким образом, согласно следующему аспекту настоящего изобретения предложено применение соединения формулы (I) или (Ia) либо его фармацевтически приемлемого сольвата в изготовлении лекарства для профилактики или лечения воспалительного состояния или иммунного расстройства. Соединения согласно изобретению можно получить любым подходящим способом органической химии. Таким образом, согласно следующему аспекту изобретения предложен способ получения соединений формулы (I) или (Ia) или их сольватов, при котором осуществляют взаимодействие соединения формулы (II) или его активированного производного с соединением формулы (III) где Q, X, R1, R2, R4, R5, R6, у, у' и n являются такими, как определено выше; и возможно превращают соединение формулы (I) или (Ia), образованное таким образом, в другое соединение формулы (I) или (Ia) либо в соответствующий сольват. Специалист в данной области может легко определить активированные производные, которые можно применять в настоящем способе, используя указания T.W.York, NY, 1991, pp. 227-229. Когда Х представляет собой кислород,этерификацию можно осуществлять стандартными способами, например, используя кислотный катализатор и, возможно, инертный растворитель, такой как толуол, бензол или ксилол. Подходящие кислотные катализаторы включают в себя минеральные кислоты, например серную кислоту, соляную кислоту и фосфорную кислоту; и органические кислоты; например метансульфоновую кислоту или толуолсульфоновую кислоту. Этерификацию типично осуществляют при повышенной температуре, например 50150 С, предпочтительно с удалением воды, образованной в результате дистилляции. Там, где X представляет собой кислород или -NH-, эту реакцию можно осуществлять,получая сначала активированное производное соединения формулы (II). Подходящие активированные производные включают в себя активированные эфиры или галогенангидриды кислот, и их можно либо выделить до взаимодействия с соединением формулы (III), либо получить in situ. Подходящими реагентами для данного способа являются тионилхлорид, оксалилхлорид, оксалилбромид, трихлорид фосфора,трибромид фосфора, пентахлорид фосфора,пентахлорид фосфора или диэтилхлорфосфат. Особенно полезными активированными эфирами соединения формулы (II) являются ацилимидазолы, которые легко получить путем взаимодействия соединения формулы (II) с N,N'карбонилдиимидазолом. Превращение активированного производного соединения формулы (II) в соединение формулы (I) или (Ia) можно осуществить в инертном растворителе, оптимально в присутствии ненуклеофильного основания. Подходящими растворителями для превращения активированного производного соединения формулы (II) 23 в соединение формулы (I) или (Ia) являются растворители, которые не претерпевают превращений в условиях реакции. Они предпочтительно включают в себя простые эфиры, такие как диэтиловый эфир, диоксан, тетрагидрофуран, диметиловый эфир гликоля, либо углеводороды, такие как бензол, толуол, ксилол, гексан,циклогексан или нефтяные дистилляты, либо галогензамещенные углеводороды, такие как дихлорметан, 1,2-дихлорэтан, трихлорметан,тетрахлорметан, дихлорэтилен, трихлорэтилен или хлорбензол, либо этилацетат, триэтиламин,пиридин,диметилсульфоксид,N,N-диметилформамид, гексаметилфосфорамид, ацетонитрил, ацетон или нитрометан. Возможно также использовать смеси упомянутых растворителей. Предпочтительным является N,Nдиметилформамид. Основания, которые можно применять в этом способе, представляют собой в основном ненуклеофильные неорганические или органические основания. Эти основания предпочтительно включают в себя карбонаты щелочных металлов, такие как карбонат натрия или карбонат калия, карбонаты щелочно-земельных металлов, такие как карбонат кальция, либо алкоголяты щелочных металлов или щелочноземельных металлов, такие как трет-бутилат натрия или калия, либо органические амины триалкил(С 1-С 6)-амины, такие как триэтиламин,либо гетероциклы, такие как 1,4-диазобицикло[2.2.2]октан (DABCO), 1,8-диазобицикло[5.4.0]ундек-7-ен (DBU), пиридин, коллидин, 4 диметиламинопиридин или N-метилпиперидин. В качестве оснований можно также использовать гидриды щелочных металлов, такие как гидрид натрия. Предпочтительным является карбонат калия. Как правило, реагенты используют в количестве от 0,5 до 3 молярных эквивалентов,предпочтительно от 1 до 1,5 молярных эквивалентов, по отношению к 1 молю соответствующего производного соединения формулы (II). Как правило, основание используют в количестве от 0,05 до 10 молярных эквивалентов, предпочтительно от 1 до 2 моль относительно 1 моль соединения по данному изобретению. Способы получения соединений по изобретению, как правило, осуществляют при температуре от примерно -30 С до примерно 155 С,предпочтительно от примерно -10 С до примерно 75 С. Эти способы получения, как правило,осуществляют при нормальном давлении. Однако можно также осуществлять эти способы при повышенной температуре или при пониженном давлении (например в диапазоне от 0,5 до 5 Бар). В общей формуле (I) или (Ia), там, где X представляет собой кислород или -NH-, введение заместителя R3, где R3 является таким, как определено выше, можно осуществлять путем взаимодействия с реакционноспособными ал 004139 24 кил- или ацилгалогенидами в инертном растворителе, оптимально - в присутствии ненуклеофильного основания. Подходящие растворители для данного способа предпочтительно включают в себя простые эфиры, такие как диэтиловый эфир, диоксан, тетрагидрофуран, диметиловый эфир гликоля, либо углеводороды, такие как бензол, толуол, ксилол, гексан, циклогексан или нефтяные дистилляты, либо галогензамещенные углеводороды, такие как дихлорметан, 1,2 дихлорэтан, трихлорметан, тетрахлорметан, дихлорэтилен, трихлорэтилен или хлорбензол,либо этилацетат, триэтиламин, пиридин, диметилсульфоксид, диметилформамид, гексаметилфосфорамид, ацетонитрил, ацетон или нитрометан. Возможно также использовать смеси упомянутых растворителей. Предпочтительными являются диметилформамид или 1,2 дихлорэтан. Соединение формулы (II) можно получить,как описано в заявке РСТGB 9501808 и в Патенте США 4981857, либо аналогичными способами, очевидными специалисту в данной области. Соединения формулы (III) имеются в продаже, либо их можно получить известными из литературы способами. Например, R.A. BartschPendri, D. Bolikal, J. Org. Chem. 1995, 60, 331336; J.M. Harris, Rev. Macromol. Chem. Phys.,1985, C25 (3), 325-373. Альтернативно соединения формулы (I) или (Ia) можно получить путем конденсации соединения формулы (IV) или его ацетального производного, соединения формулы (V) или его активированного производного либо соединения формулы (VI) где Q, X, Z, R1, R2 и n являются такими, как определено выше, с 1,3-дизамещенными 5,6 диаминоурацилами (которые можно получить,как описано в примерах). Конденсацию осуществляют подходящим образом в полярном растворителе при неэкстремальной температуре,как описано в заявке РСТGB 9501808. Соединения формулы (IV) можно получить с помощью сочетания соединения формулы (II) с подходящей карбоновой кислотой. Способы осуществления такого сочетания и 25 получения карбоновой кислоты описаны в заявке РСТGB 9501808. Превращение соединения формулы (I) или(Ia) в его сольват можно осуществить стандартными способами, известными специалисту в данной области. Соединения формулы (Ib) можно получить и включать в состав препаратов, как описано в публикации заявки РСТWO 9835966. Примеры Изобретение теперь будет описано только путем иллюстрации с помощью следующих примеров. Все реакции проводили в сухой стеклянной посуде при положительном давлении сухого аргона или азота и магнитно перемешивали,если не указано иначе. Чувствительные жидкости и растворы переносили посредством шприца или канюли и вводили в реакционные сосуды через резиновые перегородки. Если не определено иначе, термин концентрировали при пониженном давлении или в вакууме относится к использованию роторного испарителя Бучи(Buchi) примерно при приблизительно 15 мм рт. ст. Все температуры сообщаются нескорректированными в градусах Цельсия (С). Если не указано иначе, все доли и проценты даны по массе. Технические реагенты и растворители использовали без очистки. Тонкослойную хроматографию (ТСХ) проводили на пластинах из силикагеля 60 А F-254 250 мкм с предварительным покрытием на стеклянной подложке MerckKGA (EM Science). Визуализацию пластин осуществляли с помощью одной или более чем одной из следующих методик: (а) ультрафиолетовое облучение, (б) обработка парами иода, (в) окунание пластины в 10% раствор фосфорномолибденовой кислоты в этаноле с последующим нагреванием, (г) окунание пластины в раствор сульфата церия с последующим нагреванием,(д) окунание пластины в 10% водный раствор перманганата калия с последующим нагреванием и/или (е) окунание пластины в раствор молибдата аммония с последующим нагреванием. Колоночную хроматографию (флэш-хроматографию на силикагеле) проводили, используя 230-400 меш силикагель Mallinckrodt SilicAR. Точки плавления определены с использованием аппарата Mel-Temp для определения точки плавления и являются нескорректированными. Спектры протонного (1 Н) ядерного магнитного резонанса (ЯМР) регистрировали с помощью спектрометра либо (300 МГц), VarianUnity 400 (400 МГц), либо Varian VXR 300 (300 МГц) с использованием либо Me4Si ( 0.00),либо с растворителем с остаточными присоединенными протонами (СНСl37.26; МеОН 3.30; ДМСО (диметилсульфоксид)2.49) в качестве стандарта. Спектры углеродного (13 С)Micromass Platform, работая в режиме электрораспыления положительных ионов, либо спектрометр VG 70SQ, снабженный источником с бомбардировкой быстрыми атомами (FAB, fastatom bombardment) (цезиевой пушкой). ПриборMicromass калибровали с помощью иодида натрия в пределах диапазона 100-1100 атомных единиц массы (а.m.u.), что давало точность массы примерно 0,2 a.m.u. Разрешение прибора VG 70SQ устанавливали примерно при 1000 миллионных долей (ррm) (примерно 0,1 a.m.u.) для напряжения ускорения 7 кВ. Для калибровки этого прибора использовали в диапазоне 1001500 a.m.u. использовали йодид цезия. FABмасс-спектры получали, используя метанитробензиловый спирт в качестве матрицы образца. Элементные анализы проведены AtlanticMicrolab, Inc. Of Norcross, GA. Для всех соединений, описанных ниже, приведены ЯМР спектры, МСНР (масс-спектр низкого разрешения) и либо элементный анализ, либо МСВР (массспектр высокого разрешения), совпадающие с определенными структурами. Общий способ синтеза ксантинкарбоновых кислот Пример 1. Получение соединения 1.(а) 1,3-Бис(циклогексилметил)мочевина. Смесь циклогексанметиламина (Aldrich,68,66 г) и 5 н. гидроксида натрия (Fisher, 200 мл) энергично перемешивали при охлаждении(-10 С), в то же время быстро добавляли раствор фосгена (30,0 г) в толуоле (600 мл). После перемешивания в течение 20 мин полученную в результате смесь фильтровали и осажденное твердое вещество промывали водой и высушивали (0,5 тор (66,5 Па с получением 1,3 бис(циклогексилметил)мочевины в виде белого порошка (72,72 г, 95%), Тпл, 150-152 С; 1 Н-ЯМР (ДMCO-d6)5.74 (br t, J=5.8 Гц,2,2 NH), 2.81 (t, J=6.3 Гц, 4, 2 NCH2), 1.62, 1.25 и 0.85 (все m, 22, 2 циклогексил). Анализ. Вычислено для C15H28N2O: С 71.38; Н 11.18; N, 11.10. Обнаружено: С 71.22; Н 11.17; N 11.15.(б) 6-Амино-1,3-бис(циклогексилметил) урацил. Цианоуксусную кислоту (Aldrich, 21,0 г) растворяли в уксусном ангидриде (260 мл). Этот раствор добавляли к 1,3-бис(циклогексилметил) мочевине (со стадии (а), 54,5 г), и этот раствор поддерживали при 80 С в течение 2 ч в атмосфере азота. Летучие компоненты удаляли в вакууме, и остаточное масло высушивали выпа 27 риванием порций 10% воды - этанола (3x400 мл). Остаточные твердые вещества растворяли в этаноле (600 мл) - воде (300 мл) при 80 С с доведением рН до 10 путем добавления 10% водного карбоната натрия. Этот горячий раствор разбавляли водой (75 мл) и охлаждали до температуры окружающей среды. Бесцветные кристаллы, которые образовывались, отфильтровывали, промывали водой и высушивали при 0,5 тор (66,5 Па) с получением 6-амино-1,3 бис(циклогексилметил)урацила (64,98 г, 94%),Тпл 138-141 С; 1 Н-ЯМР (ДМСО-d6)6.73 (br s,2, NH2), 4.63 (s, 1, H-5), 3.67 (d, J=7.3 Гц, 2,NCH2), 3.57 (d, J=7.3 Гц, 2, NCH2), 1.55 и 1.09(в) 6-Амино-1,3-бис(циклогексилметил)-5 нитрозоурацил. 6-Амино-1,3-бис(циклогексилметил)урацил (со стадии (б), 25,0 г) растворяли в ледяной уксусной кислоте (440 мл), воде (440 мл) и этаноле (440 мл) при дефлегмации. К этому раствору добавляли нитрит натрия (5,65 г). Полученную в результате смесь перемешивали, пока она медленно охлаждалась до температуры окружающей среды. Бледно-лиловый осадок отфильтровывали, промывали водой - этанолом в соотношении 1:1 и высушивали с получением 6 амино-1,3-бис(циклогексилметил)-5-нитрозоурацила в виде светло-фиолетовых кристаллов(Е)-4-[1,3-Бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9 Н-пурин-8-ил]коричная кислота. Соединение, указанное в заголовке, получали из 1,3-бис(циклогексилметил)-5,6-диаминоурацила способом J. Perutmattam, Syn. Common. 1989, 19: 3367-3370. Готовили свежий 1,3 бис(циклогексилметил)-5,6-диаминоурацил,встряхивая смесь 6-амино-1,3-бис(циклогексилметил)-5-нитрозоурацила (со стадии (в), 5,00 г) в метаноле (250 мл) - воде (25 мл) с 10% палладием на углероде (0,50 г) в атмосфере азота(344,738 кПа) в шейкере Парра (Parr) в течение 2 ч. Катализатор отфильтровывали (целит), и бесцветный фильтрат концентрировали до 25 мл. К этому раствору 1,3-бис(циклогексилметил)-5,6-диаминоурацила добавляли 4-формилкоричную кислоту (Aldrich, 2,53 г, 14,35 ммоль), и полученную желтую смесь концентрировали, и оставшееся желтое твердое веще 004139 28 ство высушивали выпариванием нескольких порций абсолютного этанола. Полученный в результате желтый порошок (промежуточное соединение основание Шиффа) перемешивали в диметоксиэтане (115 мл) с иодом (4,0 г) при 60 С (масляная баня) в течение 20 ч. К этой теплой реакционной смеси добавляли насыщенный водный раствор тиосульфата натрия до полного обесцвечивания иода в результате. Бледножелтый осадок отфильтровывали, промывали водой и высушивали при 66,5 Па (0,5 тор) с получением(Е)-4-[1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9 Н-пурин 8-ил]коричной кислоты в виде бледно-желтого порошка (6,73 г, 91%), Тпл 300 С. Такие образцы затем очищали путем их растворения в 1 н. водном гидроксиде натрия, фильтрования полученного в результате мутного раствора через целит и подкисления прозрачного фильтрата соляной кислотой. Полученный в результате осадок фильтровали и промывали водой с получением соединения, указанного в заголовке, в виде бледно-желтого порошка, Tпл 300C. 1 Н-ЯМР (ДMCO-d6)13.80 и 12.40 (оба brm, 1 каждый, СО 2 Н и NH), 8.12 (d, J=8.3 Гц, 2, 2,фенил СН), 7.84 (d, J=8.4 Гц, 2, 2, фенил СН),7.64 (d, J=16.0 Гц, 1, СН=), 6.64 (d, J=16.0 Гц, 1,СН=), 3.93 (d, J=7.0 Гц, 2, CH2N), 3.79 (d, J=6.8 Гц, 2, CH2N), 2.0-1.4 и 1.3-0.85 (оба br m, суммарно 22, 2 циклогексил). Анализ. Вычислено для С 28 Н 34N4 О 4: С 68.55; Н 6.99; N 11.42. Обнаружено: С 68.45; Н 6.98; N 11.48. Соединения, приведенные ниже в табл. 1,получали способами, аналогичными способу,использованному выше для получения примера 1, а также как описано в WO 96/04280 (15 февраля, 1996), US 4981857 (1 января, 1991) и US 5017577 (21 мая, 1991). Пр. Общий способ синтеза сложных эфиров ксантинкарбоновых кислот Пример 34. Эфир метилового эфира нонаэтиленгликоля и (Е)-4-[(13-бис(бензил)-1,2,3,6 тетрагидро-2,6-диоксо-9 Н-пурин-8-ил]коричной кислоты. а) Монометиловый эфир нонаэтиленгликоля Гидрид натрия (8,6 г, 344 ммоль как 95%) добавляли к раствору гексаэтиленгликоля (Aldrich, 100 г) в безводном тетрагидрофуране(1000 мл) при 15 С. Полученную в результате смесь перемешивали, пока она доходила до температуры окружающей среды, в течение 1 ч. Бензилбромид (Aldrich, 59,9 г) добавляли по каплям в течение 1 ч и полученную в результате смесь перемешивали при температуре окружающей среды в течение 16 ч. Эту охлажденную смесь разбавляли водой (200 мл) и экстрагировали диэтиловым эфиром. Объединенные экстракты диэтилового эфира промывали водой. Объединенные водные слои насыщали хлоридом натрия и экстрагировали метиленхлоридом. Объединенные метиленхлоридные слои промывали насыщенным хлоридом натрия и высушивали (сульфат магния). При удалении летучих веществ при пониженном давлении оставался монобензиловый эфир гексаэтиленгликоля (80,5 г, 64%); 1 Н-ЯМР (CDCl3)7.30 (m, 5, 5 фенил СН),4.53 (s, 2, бензил СН 2), 3.69-3.54 (m, 22, 11 ОСН 2), 3.06 (br s, 3, ОН и СН 2 О). Раствор монобензилового эфира гексаэтиленгликоля (80,0 г) в безводном ТГФ (тетрагидрофуран) (750 мл) добавляли к суспензии гидрида натрия (95%, 5,4 г) в тетрагидрофуране. Полученную в результате смесь перемешивали при температуре окружающей среды в течение 30 мин, а затем добавляли по каплям раствор метилтозилового эфира триэтиленгликоля (полученного, как описано в части (а) примера 1, 68,4 г) в ТГФ (100 мл). Эту смесь кипятили с обратным холодильником в атмосфере азота в течение ночи. Добавляли дополнительное количество гидрида натрия (2,5 г), и кипячение с обратным холодильником продолжали в течение следующих 24 ч. Эту смесь охлаждали (ледяная баня), гасили водой(2 л) и экстрагировали диэтиловым эфиром. Водный слой промывали метиленхлоридом. Объединенные органические слои высушивали(сульфат магния) и концентрировали до коричневого масла, которое фильтровали через силикагелевую прокладку, промываемую метиленхлоридом. Метиленхлорид выпаривали до остатка бензилметилового эфира нонаэтиленгликоля в виде масла (63,1 г, 57%). 1 Н-ЯМР (300 МГц, ДМСО-d6)7.23 (m,5H, 5 фенил СН), 4.38 (s, 2H, бензил СН 2), 3.503.30 (m, 36 Н, 18 СН 2 О), 3.13 (s, 3H, СН 3). Раствор бензилметилового эфира нонаэтиленгликоля (10 г, 19,3 ммоль) в этаноле (200 мл) встряхивали с 10% палладием на угле (Aldrich,1,0 г) в атмосфере водорода (344,738 кПа) на аппарате Парра в течение 3 ч. Катализатор отфильтровывали (целит) и фильтрат концентрировали в вакууме и высушивали путем выпаривания толуола с получением монометилового эфира нонаэтиленгликоля в виде масла (8,17 г,99%). Н-ЯМР (300 МГц, ДМСО-d6)4.56 (t, 1 Н ОН), 3.60-3.35 (m, 36H, 18 ОСН 2), 3.22 (s, 3H,СН 3). Анализ. Вычислено для С 19 Н 40 О 10: С 53.26; Н 9.41. Обнаружено: С 53.25; Н 9.41. б) Эфир метилового эфира нонаэтиленгликоля и (E)-4-[(1,3-бис(бензил)-1,2,3,6-тетрагидро-2,6-диоксо-9 Н-пурин-8-ил]коричной кислоты. Суспензию (E)-4-[(1,3-бис(бензил)-1,2,3,6 тетрагидро-2,6-диоксо-9 Н-пурин-8-ил)] коричной кислоты (пример 2, 0,50 г, 1,05 ммоль) в безводном N,N-диметилформамиде (10 мл) быстро нагревали почти до дефлегмации в атмосфере азота. N,N'-Карбонилдиимидазол (Aldrich,0,210 г, 1,25 ммоль) добавляли к этой бледножелтой суспензии, которая разжижалась и становилась оранжевой по мере выделения газа. За минуты эта суспензия становилась ярко-желтой и загустевала по мере образования твердого вещества. Эту смесь перемешивали в течение 18 ч,разбавляли дихлорметаном (30 мл) и фильтровали. Ярко-желтую набивку фильтра промывали дихлорметаном (30 мл) и высушивали при 40 С с получением (Е)-1,3-бис(бензил)-8-(3-(2-(1 Нимидазол-1-илкарбонил)винил)фенил)-9 Н-пурин-2,6(1H, 3H)-диона в виде желтого порошка(0,415 г). Смесь этого соединения (0,41 г, 0,77 ммоль), монометилового эфира нонаэтиленгликоля (из примера 24, части (а), 0,348 г, 0,81 ммоль) и карбоната калия (Aldrich, 0,212 г, 1,54 ммоль) в ацетонитриле (10 мл) перемешивали при кипячении с обратным холодильником в течение 20 ч. Добавляли хлороформ (50 мл) и раствор промывали 1 н. соляной кислотой, насыщенным водным хлоридом натрия, высушивали над сульфатом магния и фильтровали. Этот раствор концентрировали при пониженном давлении, и неочищенный материал очищали хроматографией на силикагеле, элюируя 10% метанолом в хлороформе. Выпариванием растворителей получали соединение, указанное в заголовке (0,40 г, 59%), в виде желтого воскообразного твердого вещества. 1 Н-ЯМР (300 МГц, ДMCO-d6)8.15 (d,J=8.2 Гц, 2 Н, фенил СН), 7.87 (d, J=8.4 Гц, 2 Н, 2 фенил СН), 7.68 (d, J=15.9 Гц, 1 Н, СН=), 7.457.20 (m, 10H, 2 С 6 Н 5), 6.75 (d, J=15.9 Гц, 1 Н, СН-),5.24 и 5.10 (2s, 4 Н, 2 СН 2-фенил), 4.25 (m, 2 Н,СН 2 О), 3.70 (m, 2 Н, СН 2 О), 3.60-3.30 (m, 32 Н, 16 СН 2), 3.20 (s, 3H, СН 3). Анализ. Вычислено для C47H60N4O13: С 63.50; Н 6.80; N 6.30. Обнаружено: С 63.41; Н 6.65; N 6.52. Соединения, приведенные в табл. 2 ниже,получали способами, аналогичными способам,использованным выше для получения примера 34 (ИМ = исходный материал). Масс-спектр/ Название способ Эфир метилового эфира нонаэтиленгликоля и (Е)-4901FAB диоксо-9 Н-пурин-8-ил]коричной кислоты Эфир метилового эфира нонаэтиленгликоля и (Е)-4873FAB диоксо-9 Н-пурин-8-ил)коричной кислоты Эфир метилового эфира нонаэтиленгликоля и (Е)-4793FAB пурин-8-ил)коричной кислоты Эфир метилового эфира нонаэтиленгликоля и (Е)-4817FAB кислоты Эфир метилового эфира нонаэтиленгликоля и (Е)-4929FAB диоксо-9 Н-пурин-8-ил)коричной кислоты Эфир метилового эфира нонаэтиленгликоля и (Е)-4930FAB диоксо-9 Н-пурин-8-ил)коричной кислоты Эфир метилового эфира нонаэтиленгликоля и (Е)-4861FAB пурин-8-ил)коричной кислоты Эфир метилового эфира нонаэтиленгликоля и (Е)-4821FAB диоксо-9 Н-пурин-8-ил)коричной кислоты Эфир метилового эфира нонаэтиленгликоля и (Е)-4848 1-пропил-3-циклогексилметил)-1,2,3,6-тетрагидро(М+Н)+;FAB 2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты Эфир метилового эфира нонаэтиленгликоля и (Е)-4925FAB тетрагидро-2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты Эфир метилового эфира нонаэтиленгликоля и (Е)-3889FAB пурин-8-ил)коричной кислоты Эфир метилового эфира нонаэтиленгликоля и (Е)-4737FAB пурин-8-ил)коричной кислоты Эфир метилового эфира нонаэтиленгликоля и (Е)-4861 1-циклогексилметил-3-бутил)-1,2,3,6-тетрагидро(М+Н)+;FAB 2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты Эфир метилового эфира нонаэтиленгликоля и (Е)-4847 1-циклогексилметил-3-пропил )-1,2,3,6(М+Н)+;FAB тетрагидро-2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты Эфир метилового эфира нонаэтиленгликоля и (Е)-4905FAB оксо-9 Н-пурин-8-ил)коричной кислоты Эфир метилового эфира нонаэтиленгликоля и (Е)-4838FAB диоксо-9 Н-пурин-8-ил)коричной кислоты Эфир метилового эфира нонаэтиленгликоля и (Е)-4838FAB диоксо-9 Н-пурин-8-ил)коричной кислоты Эфир метилового эфира нонаэтиленгликоля и (Е)-4925FAB диоксо-9 Н-пурин-8-ил)коричной кислоты Эфир метилового эфира нонаэтиленгликоля и (Е)-4925FAB диоксо-9 Н-пурин-8-ил)коричной кислоты Эфир метилового эфира нонаэтиленгликоля и (Е)-4917FAB диоксо-9 Н-пурин-8-ил)коричной кислоты Эфир метилового эфира нонаэтиленгликоля и (Е)-4819 1-циклогексилметил-3-метил)-1,2,3,6-тетрагидро(М+Н)+;FAB 2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты Эфир метилового эфира нонаэтиленгликоля и (Е)-4765 1-Н-3-(2-метилпропил)-1,2,3,6-тетрагидро-2,6(М+Н)+; Анализ Вычислено для С 47 Н 72N4 О 13: С 62.65; Н 8.05; N 6.22. Обнаружено: С 62.33; Н 7.94; N 6.25 Вычислено для С 45 Н 68N4O130,50 Н 2O: С 61.28; Н 7.88; N 6.35. Обнаружено: С 61.27; Н 7.69; N 6.72 Вычислено для C39H60N4O130,82 H2O: С 58.00; Н 7.69; N 6.94. Обнаружено: С 57.99; Н 7.36; N 7.20 Вычислено для C41H60N4O130,93 H2O: С 59.07; Н 7.48; N 6.72. Обнаружено: С 59.07; Н 7.21; N 7.03 Вычислено для С 43 Н 60N4O13: С 61.41; Н 7.19; N 6.66. Обнаружено: С 61.19; Н 7.16; N 6.74 Вычислено для C49H76N4O13: С 63.34; Н 8.24; N 6.03. Обнаружено: С 63.35; Н 8.19; N 6.07 Вычислено для C49H76N4O13: С 63.34; Н 8.24; N 6.03. Обнаружено: С 63.18; Н 8.21; N 6.14 Вычислено для С 45 Н 56N4O131,22 Н 2O: С 61.22; Н 6.67; N 6.35. Обнаружено: С 61.21; Н 6.35; N 6.48 Вычислено для С 41 Н 64N4 О 13: С 59.98; Н 7.86; N 6.82. Обнаружено: С 59.73; Н 7.81; N 6.87 Вычислено для C43H66N4O13: С 60.98; Н 7.85; N 6.61. Обнаружено: С 60.81; Н 7.81; N 6.65 Вычислено для C49H72N4O130,76H2O: С 62.69; Н 7.89; N 5.97. Обнаружено: С 62.69; Н 7.77; N 6.02 Эфир метилового эфира нонаэтиленгликоля и (Е)-4(1,3-бис(4-фторбензил)-1,2,3,6-тетрагидро-2,6 диоксо-9 Н-пурин-8-ил)коричной кислоты Эфир додецилового эфира гексаэтиленгликоля и(Е)-4-(1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты Эфир метилового эфира нонаэтиленгликоля и (Е)-3(1,3-бис(пропил)-1,2,3,6-тетрагидро-2,6-диоксо-9 Нпурин-8-ил)коричной кислоты Эфир метилового эфира нонаэтиленгликоля и (Е)-4(1,3-бис(циклобутилметил)-1,2,3,6-тетрагидро-2,6 диоксо-9 Н-пурин-8-ил)коричной кислоты Эфир метилового эфира нонаэтиленгликоля и (Е)-4(1-метил-3-циклoгeкcилмeтил)-1,2,3,6-тетрагидро 2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты Эфир метилового эфира нонаэтиленгликоля и (Е)-4(1-метил-3-(2-метилпропил)-1,2,3,6-тетрагидро-2,6 диоксо-9 Н-пурин-8-ил)коричной кислоты Эфир метилового эфира нонаэтиленгликоля и (Е)-4(1,3-бис(3-пиридинилметил)-1,2,3,6-тетрагидро-2,6 диоксо-9 Н-пурин-8-ил)коричной кислоты Эфир метилового эфира нонаэтиленгликоля и 4(1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6 диоксо-9 Н-пурин-8-ил)бензойной кислоты Эфир метилового эфира нонаэтиленгликоля и (Е)-4[1,3-бис(циклогексил)-1,2,3,6-тетрагидро-2,6 диоксо-9 Н-пурин-8-ил]коричной кислоты Общий способ синтеза амидов ксантинкарбоновой кислоты Пример 67. N-(Метилнонаоксиэтилен) амид (E)-3-(1,3-бис(циклогексилметил)-1,2,3,6 тетрагидро-2,6-диоксо-9 Н-пурин-8-ил]коричной кислоты.(а) Метиловый эфир аминононаэтиленгликоля. К раствору монометилового эфира нонаэтиленгликоля из примера 33, часть (а), (8,0 г,18,7 ммоль) в дихлорметане (75 мл) и триэтиламине (5 мл, 3,74 моль) при 25 С добавляли метансульфонилхлорид (2,36 г, 20,5 ммоль). После перемешивания при комнатной температуре в течение 2 ч эту смесь упаривали до объема 20 мл и фильтровали. Промывочную воду фильтрата выпаривали до сухости, и суспендировали в дихлорметане (20 мл), и снова фильтровали. Промывочную воду фильтрата выпаривали до бесцветного масла (9,8 г). Раствор вышеуказанного промежуточного соединения (8,50 г) в концентрированном водном гидроксиде аммония (100 мл) кипятили с обратным холодильником в течение 2,5 ч. Летучие вещества удаляли в вакууме и остаточное масло высушивали путем выпаривания с толуолом с получением метилового эфира аминононаэтиленгликоля в виде бесцветного масла (8,1 г); 1 Н-ЯМР (300 МГц, ДМСО)3.60-3.40 (m,36H, 18 СН 2 и NH2), 3.20 (s, 3H, СН 3). МС (массспекстрометрия) (CI) 428 (m+1, 100%).(б) Хлорангидрид (Е)-3-(1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9 Нпурин-8-ил)коричной кислоты. Смесь (Е)-3-(1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9 Н-пурин-8-ил) коричной кислоты из примера 31 (0,20 г, 0,41 ммоль) в дихлорметане (5 мл) и тионилхлориде(Aldrich, 0,6 мл, 0,81 ммоль) кипятили с обратным холодильником в течение 1,5 ч. Летучие вещества удаляли в вакууме с получением хлорангидрида (Е)-3-(1,3-бис(циклогексилметил)1,2,3,6-тетрагидро-2,6-диоксо-9 Н-пурин-8-ил) коричной кислоты в виде желтого твердого вещества, которое использовали без дальнейшей очистки.(в) N-(Метилнонаоксиэтилен)амид (Е)-3(1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро 2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты. К промежуточному соединению из примера 67, часть (б), добавляли дихлорметан (15 мл) и реакционную смесь перемешивали при 0 С. Добавляли раствор метилового эфира аминононаэтиленгликоля из части (а) этого примера(0,262 г, 0,49 ммоль) и триэтиламина (0,12 г,1,22 ммоль) в дихлорметане (5 мл), и полученному раствору оставляли перемешиваться при комнатной температуре в течение 1,5 ч. Этот раствор разбавляли хлороформом (100 мл) и промывали насыщенным водным бикарбонатом натрия (20 мл) и насыщенным водным хлоридом натрия (20 мл). Органический слой высушивали с использованием сульфата магния,фильтровали и выпаривали до желтого воскообразного твердого вещества. Элюцией 15% метанолом - этилацетатом с колонки с силикагелем получали соединение, указанное в заголовке, в виде желтого воскообразного твердого вещества, которое растворяли в этилацетате (10 мл) и переосаждали путем добавления гексанов с получением N-(метилнонаоксиэтилен)амида (Е)-3[1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9 Н-пурин-8-ил]коричной кислоты(0,167 г, 45%) в виде воскообразного твердого вещества. Н-ЯМР (300 МГц, ДMCO-d6)8.22 (t,J=5.5 Гц, 1 Н, NH), 8.13 (d, J=8.4 Гц, 2 Н, фенил СН), 7.68 (d, J=8.4 Гц, 2 Н, фенил СН), 7.44 (d,J=16 Гц, 1 Н, СН=), 6.73 (d, J=16.1 Гц, 1 Н, СН=),3.99 (d, J=7.6 Гц, 2 Н, CH2N), 3.87 (d, J=7.6 Гц,2 Н, CH2N), 3.60-3.30 (m, 36 Н, 18 СН 2), 3.20 (s, 38 3H, СН 3), 2.55-2.25 (m, 2H, 2 СН), 1.80-1.20 (m,12H, циклопентил. СН 2). Анализ. Вычислено для С 47 Н 73N5 О 121,06 Н 2O: С 61.41; Н 8.24; N 7.62. Обнаружено: С 61.41; Н 7.93; N 7.65. Соединения, приведенные в табл. 3 ниже,получали способами, аналогичными способу, использованному выше для получения примера 67. Таблица 3 Общий способ синтеза сложных эфиров и амидов N7-замещенных ксантинкарбоновых кислот Пример 77. Эфир метилового эфира нонаэтиленгликоля и (Е)-4-(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-бензил 1 Н-пурин-8-ил)коричной кислоты. К эфиру метилового эфира нонаэтиленгликоля и (Е)-4-[1,3-бис(циклогексилметил)-1,2,3,6 тетрагидро-2,6-диоксо-9 Н-пурин-8-ил]коричной кислоты (0,52 г, 0,6 ммоль) из примера 35, N,Nдиметилформамид (10 мл), добавляли карбонат калия (Aldrich, 0,17 г, 1,2 ммоль) и бензилбромид (Aldrich, 0,154 г, 0,9 ммоль). Эту реакционную смесь перемешивали при комнатной температуре в течение 12 ч. Реакционную смесь разбавляли этилацетатом и экстрагировали Н 2 О(3 х). Органический слой высушивали над Эфир метилового эфира нонаэтиленгликоля и (Е)-4(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6 диоксо-7-(2-оксо-2-фенилэтил)-1 Н-пурин-8-ил) коричной кислоты Эфир метилового эфира нонаэтиленгликоля и (Е)-4(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6 диоксо-7-метил-1 Н-пурин-8-ил)коричной кислоты Анализ Вычислено для С 48 Н 75N5 О 120,11 Н 2 О: С 62.82; Н 8.25; N 7.63. Обнаружено: С 62.81; Н 8.35; N 7.51 Вычислено для C47H73N5O120,85 H2O: С 61.67; Н 8.22; N 7.65. Обнаружено: С 61.66; Н 8.07; N 7.67 Вычислено для C47H61N5O120,71H2O: С 62.67; Н 6.98; N 7.77. Обнаружено: С 62.66; Н 6.84; N 7.86 Вычислено для C45H69N5O120,95H2O: С 60.79; Н 8.04; N 7.88. Обнаружено: С 60.79; Н 7.90; N 7.94 Вычислено для C41H65N5O120,88H2O: С 58.92; Н 8.05; N 8.38. Обнаружено: С 58.92; Н 7.98; N 8.54 Вычислено для C43H67N5O120,78H2O: С 60.05; Н 8.03; N 8.14. Обнаружено: С 60.05; Н 7.89; N 8.17 Вычислено для C43H67N5O121,08H2O: С 59.67; Н, 8.05; N 8.09. Обнаружено: С 59.68; Н 7.93; N 7.97 Вычислено для C45H71N5O121,69H2O: С 59.75; Н 8.29; N 7.74. Обнаружено: С 59.75; Н 8.10; N 7.20 Вычислено для С 46 Н 73N5 О 120,14 Н 2 О: С 62.04; Н 8.29; N 7.86. Обнаружено: С 62.03; Н 8.27; N 7.85 пониженном давлении. Неочищенный материал очищали флэш-хроматографией на силикагеле(m, 10 Н). FAB-MC 991 (М+Н)+. Анализ. Вычислено для С 54 Н 78N4 О 130,5 Н 2 О: С 64.75; Н 7.97; N 5.59. Обнаружено: С 64.75; Н, 7.74; N 5.81. Соединения, приведенные в табл. 4 ниже,получали способами, аналогичными способу,использованному выше для получения примера 77. Таблица 4 Масс-спектр/ Анализ ИМ способ 1018 Вычислено для С 55 Н 78N4O130,95 Н 2O: С Пример 35 Эфир метилового эфира нонаэтиленгликоля и (Е)-4938 Вычислено для C50H74N4O130,14H2O: С Пример 35FAB диоксо-7-(2-пропинил)-1 Н-пурин-8-ил)коричной 63.77; Н 7.92; N 6.08 кислоты Эфир метилового эфира нонаэтиленгликоля и (Е)-4957 Вычислено для C50H76N4O141,23H2O: С Пример 35FAB диоксо-7-(2-оксо-2-метилэтил)-1 Н-пурин-8-ил) 61.32; Н 7.69; N 5.71 коричной кислоты Эфир метилового эфира нонаэтиленгликоля и (Е)-41028 Вычислено для С 54 Н 85N5 О 140,20 Н 2 О: С Пример 35FAB диоксо-7-(4-морфолинилметил)-1 Н-пурин-862.85; Н 8.24; N 6.70 ил)коричной кислоты Эфир метилового эфира нонаэтиленгликоля и (Е)-4929 Вычислено для С 49 Н 76N4O130,21 Н 2 О: С Пример 35FAB диоксо-7-этил-1 Н-пурин-8-ил)коричной кислоты 63.09; Н 8.22; N 5.92 Эфир метилового эфира нонаэтиленгликоля и (Е)-4987 Вычислено для C51H78N4O150,45H2O: С Пример 35FAB диоксо-7-(2-этокси-2-оксоэтил)-1 Н-пурин-8-ил) 61.54; Н 7.93; N 5.55 коричной кислоты Эфир метилового эфира нонаэтиленгликоля и (Е)-4943 Вычислено для C50H78N4O130,9H2O: С Пример 35FAB диоксо-7-пропил-1 Н-пурин-8-ил)коричной кислоты 63.48; Н 8.33; N 5.99 Эфир метилового эфира нонаэтиленгликоля и (Е)-4955 Вычислено для C51H78N4O130,11H2O: С Пример 35+ Эфир метилового эфира нонаэтиленгликоля и (Е)-4- 940 (М+Н) ; Вычислено для С 49 Н 73N5O130,5 Н 2 О/ 0,1 Пример 35(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6- ЕS(электрорас EtOAc: С 66.99; Н 7.87; N 7.31. Обнадиоксо-7-(цианометил)-1 Н-пурин-8-ил)коричной пыление)+ ружено: С 62.04; Н 7.71; N 7.52 кислоты Эфир метилового эфира нонаэтиленгликоля и 4966 Вычислено для С 52H76N4O130,14 Н 2O: С Пример 65FAB диоксо-7-бензил-1 Н-пурин-8-ил)бензойной кислоты 63.98; Н 7.785; N 5.74 Эфир метилового эфира нонаэтиленгликоля и 4889 Вычислено для C46H72N4O130,14 Н 2O: С Пример 65FAB диоксо-7-метил-1 Н-пурин-8-ил)бензойной кислоты 61.62; Н 8.12; N 6.21 Эфир метилового эфира нонаэтиленгликоля и 4917 Вычислено для C48H76N4O130,11 H2O: С(а) N,N-бис(Метилтриоксиэтилен)амин. Смесь метилтозилового эфира триэтиленгликоля из примера 33, часть (а) (1,0 г, 3,14 ммоль), карбоната калия (Aldrich, 0,5 г, 10,8 ммоль) и бензиламина (Aldrich, 0,168 г, 1,57 ммоль) перемешивали при 100 С в течение 18 ч. К этой смеси добавляли этилацетат (50 мл), и органический слой промывали водой, высушивали над сульфатом магния и фильтровали. Летучие вещества удаляли в вакууме и остаток элюировали 10% метанолом-хлороформом с колонки с силикагелем. Концентрированием собранных проб получали N,N-бис(метилтриоксиэтилен)бензиламин в виде бесцветного(m, 5 Н, С 6 Н 5), 4.10 (m, 2 Н, СН 2), 3.80-3.40 (m,20 Н, 10-5 СН 2), 3.20 (s, 3H, СН 3), 2.60 (m, 4 Н,2 СН 2N). Этот материал растворяли в этаноле (50 мл), и добавляли каталитическое количество 10% палладия на углероде (Aldrich, типDegussa), и в этой гетерогенной смеси проходила реакция в атмосфере водорода (0,689476 кПа) в течение 18 ч. Катализатор удаляли фильтрованием через целитовую прокладку и летучие вещества удаляли в вакууме с получением N,Nбис(метилтриоксиэтилен)амина, который использовали без дальнейшей очистки. 41 К хлорангидриду (Е)-4-[1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9 Нпурин-8-ил]коричной кислоты (0,25 г, 0,49 ммоль) из вышеприведенного примера 66, часть(б), в дихлорметане (10 мл) при 0 С добавляли раствор N,N-бис(метилтриоксиэтилен)амина из вышеприведенного примера 97, часть (а), и триэтиламина (0,15 г, 1,5 ммоль) в дихлорметане (5 мл). Полученный в результате раствор оставляли перемешиваться при комнатной температуре в течение 2 ч. Эту смесь разбавляли хлороформом (50 мл) и промывали насыщенным водным бикарбонатом натрия (20 мл), насыщенным водным хлоридом натрия (20 мл), высушивали над сульфатом магния и фильтровали. Летучие вещества удаляли в вакууме, и неочищенный материал очищали хроматографией на силикагеле, элюируя 15% метанолом-этилацетатом, с получением соединения, указанного в заголовке, в виде желтого твердого вещества (0,070 г,18%). 1 Н-ЯМР (300 МГц, ДMCO-d6)8.12 (d,J=8.3 Гц, 2 Н, фенил СН), 7.80 (d, J=8.2 Гц, 2 Н,фенил СН), 7.47 (d, J=15.3 Гц, 1 Н, СН=), 7.26 (d,J=15.5 Гц, 1 Н, СН=), 3.90 (d, J=7.1 Гц, 2 Н,СН 2N), 3.71 (d, J=7.6 Гц, перекрывающийся m при 3.7, суммарный 4 Н, CH2N и СН 2 О), 3.603.35 (m, 22 Н, 11 СН 2), 3.21 и 3.17 (2 s, 3 каждый,2-СН 3), 2.05-1.50 и 1.30-0.95 (m, 22 Н, циклопентил. СН 2). Анализ. Вычислено для C42H63N5O9: С 64.51; Н 8.12; N 8.96. Обнаружено: С 64.25; Н 8.00; N 8.89. Пример 96. 1,3-Бис(циклогексилметил)-8[4-(2,5,8,11,14,17,20,23,26,29-декаоксатриаконт 1-ил)фенил]-3,7-дигидро-1 Н-пурин-2,6-дион.(а) (4-Карбоксибензил)метиловый эфир нонаэтиленгликоля. Раствор монометилового эфира нонаэтиленгликоля (0,35 г, 0,82 ммоль) из примера 33,часть (а), 4-бромметилбензойной кислоты (Lancaster, 0,18 г, 0,82 ммоль) и карбоната калия (Aldrich, 0,23 г, 1,64 ммоль) в тетрагидрофуране (20 мл) перемешивали при кипячении с обратным холодильником в течение 3 ч. Эту смесь охлаждали до комнатной температуры и добавляли гидрид натрия (Aldrich, 0,065 г, 1,62 ммоль в виде 60% дисперсии в масле). Эту смесь оставляли кипеть с обратным холодильником в течение дальнейших 2 ч и охлаждали до комнатной температуры. Доводили рН до 3,0 путем добавления 1 н. соляной кислоты, и этот раствор разбавляли хлороформом (50 мл) и промывали водой (25 мл). Органический слой высушивали над сульфатом магния и фильтровали. Летучие вещества удаляли в вакууме с получением (4 карбоксибензил)метилового эфира нонаэтиленгликоля в виде масла янтарного цвета (0,45 г, 96%). 1 Н-ЯМР (300 МГц, ДMCO-d6)7.90 (d,J=8.1 Гц, 2 Н, 2 арил СН), 7.42 (d, J=8.0 Гц, 2 Н, 2(Fluka, 0,14 мл, 1,6 ммоль) и N,N-диметилформамид (1 каплю). Этому раствору давали перемешиваться в течение 0,5 ч, и летучие вещества удаляли в вакууме с получением рыжеватого масла. Этот материал растворяли в дихлорметане (20 мл) и добавляли раствор триэтиламина (0,5 мл, 3,8 ммоль) и 1,3-бис(циклогексилметил)-5,6-диаминоурацила из примера 21, раздел (а), (0,270 г, 0,80 ммоль) в дихлорметане (10 мл). Этому раствору давали перемешиваться в течение 18 ч, и летучие вещества удаляли в вакууме. Остаток растворяли в этаноле(25 мл) и доводили рН до 13,0 добавлением 2 н. гидроксида натрия. Этому раствору давали достичь флегмообразования в течение 0,5 ч, а затем охлаждали до комнатной температуры. Добавляли хлороформ (100 мл), и раствор промывали 1 н. соляной кислотой (50 мл), насыщенным водным хлоридом натрия (20 мл), высушивали над сульфатом магния и фильтровали. Летучие вещества удаляли в вакууме, и соединение, указанное в заголовке, элюировали с силикагеля 15% метанолом - этилацетатом в виде рыжеватого воскового твердого вещества после отвердевания из этилацетата - гексанов (0,098 г, 14%). 1 Н-ЯМР (300 МГц, ДMCO-d6)8.07 (d,J=8.2 Гц, 2 Н, фенил СН), 7.44 (d, J=8.1 Гц, 2 Н,фенил СН), 4.54 (s, 2 Н, СН 2 фенил), 3.89 (d, J=7.2 Гц, 2 Н, СН 2N), 3.70 (d, J=7.2 Гц, 2 Н, CH2N),3.60-3.35 (m, 36 Н, 18 СН 2), 3.20 (s, 3H, СН 3),2.05-1.50 и 1.30-0.95 (m, 22H, циклогексил. СН 2). Анализ. Вычислено для C45H72N4O12: С 62.77; Н 8.43; N 6.51. Обнаружено: С 62.43; Н 8.53; N 6.68. Пример 97. Эфир метилового эфира триэтиленголиколя и (Е)-4-[1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-(метиловый эфир триэтиленгликоля-1 Н-пурин-8-ил)] коричной кислоты(a) метиловый эфир (E)-4-[1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9 Нпурин-8-ил]коричной кислоты. Согласно способу примера 36, часть (б),(Е)-4-[1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9 Н-пурин-8-ил]коричную кислоту превращали в (Е)-1,3-бис(циклогексилметил)-8-3-(2-(1 Н-имидазол-1-илкарбонил) винил)фенил-9 Н-пурин-2,6(1 Н,3H)-дион в виде желтого порошка. Такой образец (2,50 г, 4,62 ммоль) перемешивали при кипении с обратным холодильником в ацетонитриле (75 мл) с карбонатом калия (1,28 г, 9,25 ммоль) и метанолом(10 мл) в течение 24 ч. Эту смесь охлаждали до комнатной температуры и фильтровали, и рН фильтрат-промывочной воды доводили до 3 добавлением 6 н. соляной кислоты. Полученный в результате осадок фильтровали и промывали метанолом, а затем высушивали с получением метилового эфира (Е)-4-[1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9 Н-пурин 8-ил]коричной кислоты (1,70 г, 74%) в виде белого твердого вещества. 1 Н-ЯМР (300 МГц, ДMCO-d6)8.16 (d,J=8.2 Гц, 2 Н, фенил СН), 7.83 (d, J=8.4 Гц, 2H, 2 фенил СН), 7.63 (d, J=15.9 Гц, 1 Н, СН=), 6.70 (d,J=15.9 Гц, 1 Н, СН-), 3.95 (d, J=7.0 Гц, 2 Н,CH2N), 3.75 (d, J=6.8 Гц, 2 Н, CH2N), 3.70 (s, 3H,СН 3), 2.0-1.50 и 1.20-0.80 (m, 22H, 2 С 6 Н 11).(б) Эфир метилового эфира триэтиленгликоля и (Е)-4-[1,3-бис(циклогексилметил)-2,3,6,7 тетрагидро-2,6-диоксо-7-(метиловый эфир триэтиленгликоля-1 Н-пурин-8-ил)]коричной кислоты. Смесь метилового эфира (Е)-4-[1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9 Н-пурин-8-ил]коричной кислоты (0,25 г,0,49 ммоль) из вышеприведенной части (а), метилтозилового эфира триэтиленгликоля (из примера 34, часть (а), 0,158 г, 0,49 ммоль) и карбоната калия (Aldrich, 0,137 г, 0,99 ммоль) вN,N-диметилформамиде (5 мл) перемешивали при комнатной температуре 24 ч. Добавляли дополнительное количество метилтозилового эфира триэтиленгликоля (0,48 г) и эту смесь перемешивали при 70 С в течение 3 суток. Эту смесь разбавляли этилацетатом (20 мл) и промывали водой, а затем высушивали над сульфатом магния и фильтровали. Летучие вещества удаляли в вакууме, и неочищенный материал очищали хроматографией на силикагеле, элюируя 10% метанолом - хлороформом, с получением соединения, указанного в заголовке, в виде масла янтарного цвета (0,100 г, 31%). 1 Н-ЯМР (300 МГц, ДМСО-d6)7.90 (m,4 Н, С 6 Н 4), 7.75 (d, J=15.3 Гц, 1 Н, СН=), 6.80 (d,J=15.5 Гц, 1 Н, СН=), 4.45 (m, 2 Н, СН 2 О), 4.30(m, 2 Н, СН 2 О), 3.65 (m, 2 Н, СН 2O), 3.60-3.35 (m,перекрывание Н 2 О, гликол. СН 2), 3.21 и 3.17 (2s,3H каждый, 2-СН 3), 2.00-1.50 и 1.30-0.95 (m,22 Н, циклопентил. СН 2). Анализ. Вычислено для C42H62N4O10: С 64.43; Н 7.98; N 7.15; Обнаружено: С 64.11; Н 7.90; N 7.12. Пример 98. Эфир метилового эфира нонаэтиленгликоля и (Е)-3-[5-[1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-1 Н-пурин 8-ил]-2-тиенил]-2-пропеновой кислоты. 44 ционную смесь оставляли перемешиваться при комнатной температуре в течение 12 ч. Эту реакцию разбавляли дихлорметаном и промывали 10% водным гидроксидом натрия и слои разделяли. Водный слой подкисляли (рН 2) концентрированной соляной кислотой и экстрагировали этилацетатом (х 2). Органические слои объединяли, высушивали над сульфатом натрия,фильтровали и концентрировали с получением 5-(метилпропеноат)-2-тиофенкарбоновой кислоты (4,1 г, 75%). Тпл 154-156 С; 1 Н-ЯМР (300 МГц, ДMCO-d6)13.34 (br s,1 Н), 7.80 (d, J=15.7 Гц, 1 Н), 7.68 (d, J=4 Гц, 1 Н),7.58 (d, J=15.7 Гц, 1 Н), 6.47 (d, J=15.7 Гц, 1 Н),3.71 (s, 3H).(б) Хлорангидрид 5-(Метилпропеноат)-2 тиофенкарбоновой кислоты. К 5-(метилпропеноат)-2-тиофенкарбоновой кислоте (2,0 г, 9,42 ммоль) из части (а) добавляли тионилхлорид (Aldrich, 25 мл) и эту реакционную смесь нагревали до температуры дефлегмации в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении с получением промежуточного соединения хлорангидрида 5-(метилпропеноат)-2-тиофенкарбоновой кислоты в виде желтовато-коричневого твердого вещества, которое использовали без дальнейшей очистки.(Е)-3-[5-[1,3-бис(циклогексилметил)2,3,6,7-тетрагидро-2,6-диоксо-1 Н-пурин-8-ил]-2 тиенил]-2-пропеновая кислота. К 1,3-бис(циклогексилметил)-5,6-диаминоурацилу (1,45 г, 4,33 ммоль) из примера 1,часть (г), в дихлорметане (25 мл) добавляли промежуточное соединение хлорангидрид 5(метилпропеноат)-2-тиофенкарбоновой кислоты(б) и диизопропилэтиламин (Aldrich, 0,84 г, 6,5 ммоль). Эту реакционную смесь перемешивали при комнатной температуре в течение 4 ч. Реакционную смесь концентрировали при пониженном давлении и неочищенный материал растворяли в 1 н. гидроксиде натрия и нагревали до температуры дефлегмации в течение 3 ч. Эту реакционную смесь охлаждали до комнатной температуры, разбавляли уксусной кислотой, и продукт осаждали из реакционной смеси с получением (Е)-3-[5-[1,3-бис(циклогексилметил)2,3,6,7-тетрагидро-2,6-диоксо-1 Н-пурин-8-ил]-2 тиенил]-2-пропеновой кислоты (0,503 г, 23%) в виде светло-зеленого твердого вещества, Тпл 300 С; 1 Н-ЯМР (300 МГц, ДМСО-d6)7.68 (d,J=15.7 Гц, 1 Н), 7.60 (br s, 1 Н), 7.45 (d, J=3.7 Гц,1 Н), 6.18 (d, J=15.7 Гц, 1 Н), 3.78 (d, J=7.3 Гц,2 Н), 3.73 (d, J=7.1 Гц, 2 Н), 1.89-1.40 (m, 12H),1.20-0.90 (m, 10 Н).(г) Эфир метилового эфира нонаэтиленгликоля и (Е)-3-[5-[1,3-6 ис(циклогексилметил)2,3,6,7-тетрагидро-2,6-диоксо-1 Н-пурин-8-ил]-2 тиенил]-2-пропеновой кислоты. 45 Согласно способу примера 34 осуществляли сочетание (Е)-3-[5-[1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-1 Н-пурин 8-ил]-2-тиенил]-2-пропеновой кислоты (0,30 г,0,6 ммоль) из вышеприведенной части (в) со спиртом метиловым эфиром нонаэтиленгликоля(0,26 г, 0,6 ммоль) с получением соединения,указанного в заголовке, в виде воскообразного твердого вещества (75 мг, 14%). 1 Н-ЯМР (300 МГц, ДMCO-d6)8.03 (d,J=3.9 Гц, 1 Н), 7.80 (d, J=15.7 Гц, 1 Н), 7.28 (d,J=3.9 Гц, 1 Н), 6.39 (d, J=15.7 Гц, 1 Н), 3.72 (m,2 Н), 4.02 (dd, J=13.0, 7.4 Гц, 4 Н), 3.86-3.76 (m,36H), 3.36 (s, 3H), 2.02-1.66 (m, 12H), 1.14 (m,10 Н); FAB-MC 907 (M+H)+. Анализ. Вычислено для С 45 Н 70N4O13 0,19 Н 2 О: С 59.36; Н 7.78; N 6.18; Обнаружено: С 59.36; Н 7.78; N 6.12. Пример 99. N-(Метилоксиэтилен)амид 6(1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро 2,6-диоксо-9 Н-пурин-8-ил)никотиновой кислоты.(а) Хлорангидрид 5-(метоксикарбонил)пиридин-2-карбоновой кислоты. К 5-(метоксикарбонил)пиридин-2-карбоновой кислоте (Maybridge, 1,0 г, 5,52 ммоль) добавляли тионилхлорид (Aldrich, 25 мл) и эту реакционную смесь нагревали до температуры дефлегмации в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении с получением промежуточного соединения хлорангидрида 5-(метоксикарбонил)пиридин-2-карбоновой кислоты в виде желто-коричневого твердого вещества, которое использовали без дальнейшей очистки.(б) 6-(1,3-Бис(циклогексилметил)-1,2,3,6 тетрагидро-2,6-диоксо-9 Н-пурин-8-ил)никотиновая кислота. К 1,3-бис(циклогексилметил)-5,6-диаминоурацилу (1,45 г, 4,33 ммоль) из вышеприведенного примера 1, часть (г), в дихлорметане(25 мл) добавляли промежуточное соединение хлорангидрид 5-(метоксикарбонил)пиридин-2 карбоновой кислоты (1,78 г, 5,52 ммоль) и диизопропилэтиламин (Aldrich, 0,84 г, 6,5 ммоль). Эту реакционную смесь перемешивали при комнатной температуре в течение 4 ч. Реакционную смесь концентрировали при пониженном давлении и неочищенный материал растворяли в 1 н. гидроксиде натрия и нагревали до температуры дефлегмации в течение 3 ч. Эту реакционную смесь охлаждали до комнатной температуры, разбавляли уксусной кислотой и продукт осаждали из реакционной смеси с получением 6-(1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9 Н-пурин-8-ил)никотиновой кислоты (1,44 г, 56%) в виде зеленого твердого вещества; 1 Н-ЯМР (300 МГц, ДМСО-d6)9.68 (s,1 Н), 9.10 (d, J=3.1 Гц, 1 Н), 8.43 (m, 1H), 8.12 (m, 004139(в) N-(Метилнонаоксиэтилен)амид 6-(1,36 ис(циклогексилметил)-1,2,3,6-тетрагидро-2,6 диоксо-9 Н-пурин-8-ил)никотиновой кислоты. Таки же образом, что и в примере 67 осуществляли сочетание 6-(1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9 Н-пурин 8-ил)никотиновую кислоты (0,56 г, 1,2 ммоль) из части (б) с монометиловым эфиром аминононаэтиленгликоля (0,512 г, 1,2 ммоль) с получением соединения, указанного в заголовке, в виде коричневого сиропа (45 мг, 5%). 1 Н-ЯМР (300 МГц, ДMCO-d6)9.08 (s,1 Н), 8.87 (t, J=5.0 Гц, 1 Н), 8.20 (d, J=8.1 Гц, 1 Н),3.91 (d, J=7.1 Гц, 2 Н), 3.76 (d, J=7.1 Гц, 2 Н),3.64-3.14 (m, 41 Н), 1.93 (br m, 1 Н), 1.89-1.57(br(Aldrich, 2,11 г, 19,7 ммоль) в течение 24 ч. Добавляли дополнительное количество (аминометил)циклопропана (2,11 г) и продолжали кипячение с обратным холодильником в течение дополнительных 8 ч. Летучие вещества удаляли в вакууме и остаточное масло растворяли в тетрагидрофуране (10 мл) и триэтиламине (0,65 мл,4,9 ммоль). Добавляли хлорангидрид (Е)-3-(1,3 бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6 диоксо-9 Н-пурин-8-ил)коричной кислоты (пример 67, часть (б), 0,50 г, 0,98 ммоль) и полученную в результате смесь перемешивали при комнатной температуре в течение ночи. Эту реакционную смесь разбавляли хлороформом (100 мл), промывали насыщенным водным раствором бикарбоната натрия (2x50 мл) и рассолом(25 мл). Летучие вещества удаляли в вакууме, и остаток подвергали хроматографии на силикагеле. Соединение, указанное в заголовке, элюировали в 10% метаноле - хлороформе в виде желтого воскообразного твердого вещества(а) Бензиловый эфир аминогексаэтиленгликоля. Триэтиламин (1,45 мл, 10,74 ммоль) и метансульфонилхлорид (0,48 мл, 5,9 ммоль) добавляли к раствору монобензилового эфира гексаэтиленгликоля (2,0 г, 5,37 ммоль) в метиленхлориде (30 мл) при 0 С и этот раствор перемешивали в течение 30 мин при температуре ледяной бани. Эту реакционную смесь фильтровали и концентрировали до масла, которое растворяли в 30% растворе гидроксида аммония (50 мл). Эту реакционную смесь нагревали с обратным холодильником в течение 3 суток и концентрировали. Остаточную воду удаляли выпариванием из толуола и сырой материал суспендировали с ТГФ и фильтровали. Фильтрат концентрировали при пониженном давлении с получением соединения, указанного в заголовке, в виде масла янтарного цвета (1,14 г, выход 57%). 1 Н-ЯМР (300 МГц, ДМСО-d6)7.77 (br s,2H), 7.40-7.10 (m, 5H), 4.48 (s, 2H), 3.61-3.48 (m,24 Н).(б) N-(бензил-гексаоксиэтилен)амид (Е)-4(1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро 2,6-диоксо-9 Н-пурин-8-ил)коричной кислоты. Осуществляли взаимодействие бензилового эфира аминогексаэтиленгликоля (пример 101 а) и соединения, указанного в заголовке примера 1, используя методики примеров 67 б и 67 в, с получением соединения, указанного в заголовке, в виде воскообразного твердого вещества (34 мг, выход 10%);1 Н-ЯМР (400 МГц, ДМСО-d6)8.24 (t, J=5.5 Гц, 1 Н), 8.14 (d, J=8.2 Гц, 2 Н), 7.69H2O: С 66.88; Н 7.76; N 8.30; Обнаружено: С 66.11; Н 7.69; N 8.19. Пример 102. (Е)-4-[(3-Циклогексилметил)1,2,3,6-тетрагидро-2,6-диоксо-9 Н-пурин-8-ил] коричная кислота. Способом примера 1 соединение, указанное в заголовке, синтезировали в виде беловатого твердого вещества (6,75 г). 1 48 Пример 103. Эфир метилового эфира гептаэтиленгликоля и (E)-4-[(3-циклогексилметил)2,3,6,7-тетрагидро-2,6-диоксо-7-метил-1 Н-пурин-8-ил]коричной кислоты.(а) Эфир метилового эфира гептаэтиленгликоля и (E)-4-[(3-циклогексилметил)-1,2,3,6 тетрагидро-2,6-диоксо-9 Н-пурин-8-ил]коричной кислоты. Данное соединение получали из монометилового эфира гептаэтиленгликоля (Heimann,U.; Voegtle, F. Liebigs Ann. Chem. 1980, 6, 858862) и соединения, указанного в заголовке примера 102, используя способы, подобные описанным в примере 346, и получали его в виде воскообразного твердого вещества (100 мг, выход 6%).(б) Эфир метилового эфира гептаэтиленгликоля и (E)-4-[(3-циклогексилметил)-2,3,6,7 тетрагидро-2,6-диоксо-7-метил-1 Н-пурин-8-ил] коричной кислоты. К раствору соединения, указанного в заголовке примера 103 а (98 мг, 0,137 ммоль) в ДМФ(диметилформамид) (2 мл) добавляли карбонат калия (38 мг, 0,27 ммоль) и метилиодид (13 мкл,0,2 ммоль) и эту реакционную смесь перемешивали при комнатной температуре в течение ночи и при 60 С в течение 2 ч. Растворитель удаляли при пониженном давлении и полученный в результате материал распределяли между дихлорметаном и 1 н. соляной кислотой. Органический слой высушивали, фильтровали и концентрировали и сырой продукт очищали флэшхроматографией на силикагеле, элюируя 10% метанолом - этилацетатом. Соединение, указанное в заголовке, получали в виде воскообразного твердого вещества (10 мг, выход 10%). 1 Н-ЯМР (400 МГц, ДMCO-d6)11.17 (s,1 Н), 7.95 (d, J=8.2 Гц, 2 Н), 7.86 (d, J=8.2 Гц, 2 Н),7.77 (d, J=16 Гц, 1 Н), 4.31 (m, 2 Н), 4.02 (s, 3H),3.83 (m, 2 Н), 3.71 (m, 2 Н), 3.58-3.42 (m, 24 Н),3.24 (s, 3H), 1.91 (m, 1 Н), 1.64 (m, 5 Н), 1.25-1.04(m, 5 Н). MC (ES+): 731 (М+1). Пример 104. Эфир метилового эфира нонаэтиленгликоля и (Е)-4-[(3-циклогексилметил)2,3,6,7-тетрагидро-2,6-диоксо-7-метил-1 Нпурин-8-ил]коричной кислоты.(а) Эфир метилового эфира нонаэтиленгликоля и (Е)-4-[(3-циклогексилметил)-1,2,3,6 тетрагидро-2,6-диоксо-9 Н-пурин-8-ил]коричной кислоты. Данное соединение получали из монометилового эфира нонаэтиленгликоля (пример 34 а) и соединения, указанного в заголовке примера 102, используя способы, подобные описанным в примере 34 б, и получали его в виде 49 воскообразного твердого вещества (1,3 г, выход 66%). 1 Н-ЯМР (400 МГц, ДMCO-d6)13.91 (s,1 Н), 11.16 (s, 1 Н), 8.13 (d, J=8.4 Гц, 2 Н), 7.87 (d,J=8.4 Гц, 2 Н), 7.69 (d, J=16 Гц, 1 Н), 4.27 (m, 2 Н),3.85 (m, 2 Н), 3.67 (m, 2 Н), 3.55-3.40 (тm, 32 Н),3.21 (s, 3H), 1.92 (m, 1 Н), 1.63 (m, 5 Н), 1.30-0.98(б) Эфир метилового эфира нонаэтиленгликоля и (Е)-4-[(3-циклогексилметил)-2,3,6,7 тетрагидро-2,6-диоксо-7-метил-1 Н-пурин-8 ил]коричной кислоты. Данное соединение получали из продукта примера 104 а и метилиодида, используя способы, подобные описанным в примере 103 б, и получали его в виде воскообразного твердого вещества (450 мг, выход 68%). 1 Н-ЯМР (400 МГц, ДMCO-d6)11.16 (s,1 Н), 7.92 (d, J=8.4 Гц, 2 Н), 7.83 (d, J=8.4 Гц, 2 Н),7.73 (d, J=16 Гц, 1 Н), 6.80 (d, J=16 Гц, 1 Н), 4.28H2O: С 59.48; Н 7.67; N 6.77. Обнаружено: С 59.45; Н 7.51; N 6.71. Пример 105. Эфир метилового эфира нонаэтиленгликоля и (Е)-4-[(3-циклогексилметил)2,3,6,7-тетрагидро-2,6-диоксо-1,7-диметил-1 Нпурин-8-ил]коричной кислоты. Данное соединение получали из продукта примера 104 б и метилиодида в ДМФ при 75 С,используя способы, подобные тем, что описаны в примере 103 б, и его получали в виде воскообразного твердого вещества (62 мг, выход 46%). 1 Н-ЯМР (400 МГц, ДМСО-d6)7.92 (d,J=8.4 Гц, 2 Н), 7.83 (d, J=8.4 Гц, 2 Н), 7.73 (d, J=16 Гц, 1 Н), 6.80 (d, J=16 Гц, 1 Н), 4.28 (m, 2 Н), 4.02(а) 4-[1,3-Бис(циклогексилметил)-1,2,3,6 тетрагидро-2,6-диоксо-9 Н-пурин-8-ил]бензальдегид. Готовили свежий 1,3-бис(циклогексилметил)-5,6-диаминоурацил (143,5 ммоль), как описано в примере 1 г, и растворяли в абсолютном этаноле (1 л). Добавляли монодиэтилацеталь терефтальдегида (Aldrich, 28,54 мл, 143,5 ммоль) и этот раствор перемешивали при комнатной температуре в течение 3 ч. Эту реакционную смесь концентрировали при пониженном давлении и остаточный этанол удаляли выпариванием из диметоксиэтана (400 мл). Полученное 50 в результате желтое твердое вещество растворяли в диметоксиэтане (1 л) и добавляли кристаллы иода (40,06 г, 157,85 ммоль). Эту реакционную смесь перемешивали при 50 С в течение 4 ч и при комнатной температуре в течение ночи. Добавляли насыщенный Na2S2O3 (300 мл) и диметоксиэтан удаляли при пониженном давлении. Полученное в результате твердое вещество собирали фильтрованием и объединяли с метанолом (300 мл), Н 2O (100 мл) и концентрированной (конц.) соляной кислотой (3 мл). После нагревания с обратным холодильником в течение десяти минут твердые вещества собирали фильтрованием и высушивали с получением соединения, указанного в заголовке, в виде желто-коричневого твердого вещества (53,05 г, выход 82%). 1 Н-ЯМР (400 МГц, ДMCO-d6)14.13 (s,1H), 10.05 (s, 1H), 8.31 (d, J=8.2 Гц, 2 Н), 8.03 (d,J=8.2 Гц, 2 Н), 3.91 (br d, J=7 Гц, 2 Н), 3.77 (br d,J=7 Гц, 2H), 1.93 (m, 1H), 1.74 (m, 1H), 1.60 (m,10 Н), 1.20-0.90 (m, 10 Н). МС (ES-): 447 (М-1).(б) Соль метансульфоновой кислоты метилового эфира аминогептаэтиленгликоля. Данное соединение получали из монометилового эфира гептаэтиленгликоля (Heimann,U.; Voegtle, F. Liebigs Ann. Chem. 1980, 6, 858862), метансульфонилхлорида и гидроксида аммония, используя способы, подобные описанным в примере 101 а. Неочищенный продукт получали в виде белого твердого вещества и использовали без дальнейшей очистки (2,1 г,выход 96%). 1 Н-ЯМР (400 МГц, ДMCO-d6)7.3 (br s,3H), 3.60-3.35 (m, 28H), 3.21 (s, 3H), 2.31 (s, 3H).(в) N-(Метилгептаэтиленгликоль)-4-[1,3 бис( циклогексилметил )-1,2,3,6-тетрагидро-2,6 диоксо-9 Н-пурин-8-ил]бензиламин. К смеси продукта примера 106 а (908 мг,2,01 ммоль) и продукта примера 106 б (1,1 г, 2,53 ммоль) в N,N-диметилформамиде (20 мл) добавляли триацетоксиборогидрид натрия (639 мг,3,02 мл). Эту реакционную смесь перемешивали при комнатной температуре в течение ночи,концентрировали при пониженном давлении и полученный в результате неочищенный материал распределяли между метиленхлоридом и раствором NaHCO3. После разделения двух фаз метиленхлоридный слой высушивали, фильтровали и концентрировали. Флэш-хроматографической очисткой на силикагеле, применяя элюцию 5% метанолом - метиленхлоридом, получали соединение, указанное в заголовке, в виде воскообразного твердого вещества (95 мг,выход 6%). 1 Н-ЯМР (400 МГц, ДMCO-d6)8.07 (d,J=8.2 Гц, 2 Н), 7.50 (d, J=8.2 Гц, 2 Н), 3.90 (m,4 Н), 3.76 (br d, J=7 Гц, 2 Н), 3.59-3.36 (m, 26 Н),3.21 (s, 3H), 2.78 (m, 2 Н), 1.91 (m, 1 Н), 1.73 (m,1 Н), 1.64-1.53 (m, 10 Н), 1.20-0.95 (m, 10 Н). МС 51 Анализ. Вычислено для С 41 Н 65N5O91,2 Н 2 О: С 62.05; Н 8.56; N 8.82. Обнаружено: С 61.97; Н 8.47; N 8.78. Пример 107. Гидрохлорид N-(метилгептаоксиэтилен)-4-[1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро-2,6-диоксо-9 Н-пурин-8-ил]бензиламина. Соединение, указанное в заголовке примера 106 (41 мг, 0,053 ммоль), растворяли в метиленхлориде (приблизительно 1 мл) и добавляли 1 М раствор соляной кислоты в диэтиловом эфире (примерно 2 мл). Эту реакционную смесь концентрировали при пониженном давлении с получением соединения, указанного в заголовке, в виде гигроскопичной пены (41 мг, выход 96%). 1 Н-ЯМР (400 МГц, ДMCO-d6)13.88 (s,1 Н), 9.19 (br s, 2 Н), 8.13 (d, J=8 Гц, 2 Н), 7.65 (d,J=8 Гц, 2 Н), 4.21 (m, 2H), 3.89 (br d, J=7 Гц, 2 Н),3.76 (br d, J=7 Гц, 2 Н), 3.69 (m, 2H), 3.55-3.37 (m,24H), 3.20 (s, 3H), 3.08 (m, 2H), 1.91 (m, 1H),1.73 (m, 1H), 1.70-1.50 (m, 10 Н), 1.20-0.90 (m,10 Н). МС (ES+): 772 (M+1). Анализ. Вычислено для C41H65N5O9(2H2O)(2HCl): С 55.90; Н 8.12; N 7.95; Cl 8.05; Обнаружено: С 56.10; Н 7.74; N 7.59; Cl 7.82. Пример 108. N-(Метилнонаоксиэтилен)-4[1,3-бис(циклогексилметил)-1,2,3,6-тетрагидро 2,6-диоксо-9 Н-пурин-8-ил]бензиламин. Соединение, указанное в заголовке, получали из продукта примера 106 а и метилового эфира аминононаэтиленгликоля (пример 67 а),используя способы, подобные описанным в примере 106 в, и выделяли в виде воскообразного твердого вещества (50 мг, выход 4%). 1 Н-ЯМР (400 МГц, ДМСО-d6)8.05 (d, J=8 Гц, 2 Н), 7.46 (d, J=8 Гц, 2 Н), 3.90 (br d, J=7.2 Гц,2 Н), 3.80 (m, 2 Н), 3.77 (br d, J=7.3 Гц, 2H), 3.40(Castro,J.L.; Matassa, V.G. J. Org. Chem. 1994, 59, 22892291) (1,07 r, 2,61 ммоль) добавляли к раствору 4-гидроксибензальдегида (214 мг, 1,75 ммоль) в метиленхлориде (75 мл) и этот раствор перемешивали при комнатной температуре в течение ночи. Растворитель удаляли при пониженном давлении и неочищенный продукт очищали флэш-хроматографией на силикагеле, элюируя(б) 4-[1,3-Бис(циклогексилметил)-8-[26 метокси-3,6,9,12,15,18,21,24(октаоксагексакоэилокси)]фенил]-3,7-дигидро-1 Н-пурин-2,6 дион. 1,3-Бис(циклогексилметил)-5,6-диаминоурацил (250 мг, 0,75 ммоль), свежеприготовленный, как описано в примере 1 г, и продукт из примера 109 а (400 мг, 0,75 ммоль) растворяли в толуоле (2,5 мл), и этот раствор нагревали с обратным холодильником в течение ночи с азеотропным удалением воды. Раствор концентрировали и неочищенный материал растворяли в диметоксиэтане (4 мл) и обрабатывали иодом(190 мг, 0,75 ммоль). Эту темную реакционную смесь нагревали при 50 С в течение ночи, а затем гасили насыщенным раствором Na2S2O3 и экстрагировали метиленхлоридом. Метиленхлоридный слой концентрировали и неочищенный продукт очищали флэшхроматографией на силикагеле, элюируя 2% метанолом метиленхлоридом с получением соединения, указанного в заголовке, в виде воскообразного твердого вещества (280 мг, выход 44%). 1 Н-ЯМР (400 МГц, CDCl3)12.24 (br s,1H), 8.11 (d, J=8.8 Гц, 2 Н), 7.01 (d, J=8.8 Гц, 2 Н),4.18 (t, J=5 Гц, 2H), 4.02 (d, J=7.3 Гц, 2H), 3.94H2O): С 61.73; Н 8.36; N 6.54; Обнаружено: С 61.65; Н 8.27; N 6.61. Пример 110. 1,3-Бис(циклогексилметил)-8[3-(2,5,8,11,14,17,20,23,26,29-декаоксатриаконт 1-ил)фенил]-3,7-дигидро-1 Н-пурин-2,6-дион. Раствор монометилового эфира нонаэтиленгликоля (0,25 г, 0,58 ммоль) из примера 33,часть (а), 3-хлорметилбензойной кислоты(Aldrich, 0,052 г, 1,28 ммоль в виде 60% дисперсии в масле) с иодидом натрия в качестве катализатора (1,0 мг) кипятили с обратным холодильником в течение 24 ч и охлаждали до комнатной температуры. Доводили рН до 3,0 добавлением 1 н. соляной кислоты и летучие вещества удаляли в вакууме. К остатку добавляли раствор оксалилхлорида (Fluka, 0,53 мл, 5,8 ммоль) и N,N-диметилформамида (одна капля) в метиленхлориде (20 мл). Полученную в результате смесь перемешивали в течение 1,5 ч и летучие вещества удаляли в вакууме, чтобы оста 53 лось желто-коричневое полутвердое вещество. Этот материал перемешивали в дихлорметане(20 мл) и добавляли раствор триэтиламина (0,4 мл, 2,86 ммоль) и 1,3-бис(циклогексилметил)5,6-диаминоурацила из примера 21, часть (а)(0,193 г, 0,58 ммоль) в дихлорметане (10 мл). Этот раствор перемешивали при комнатной температуре в течение 1 ч и летучие вещества выпаривали в вакууме. Остаток растворяли в этаноле (20 мл) и доводили рН до 13 добавлением 1 н. гидроксида натрия. Этот раствор подвергали кипячению с обратным холодильником в течение 0,5 ч, охлаждали до комнатной температуры и доводили рН до 5,0 добавлением 1 н. соляной кислоты. Эту смесь распределяли между водой (25 мл) и хлороформом (100 мл) и водный слой промывали дополнительным количеством хлороформа (25 мл). Объединенные органические слои промывали насыщенным водным хлоридом натрия (20 мл), высушивали над сульфатом магния и фильтровали. Летучие вещества удаляли в вакууме и остаток подвергали хроматографии на силикагеле. Соединение, указанное в заголовке, 5% метанолом - хлороформом элюировали в виде желтого воскообразного твердого вещества после отвердевания из хлороформа - гексанов (0,090 г, 17%); 1 Н-ЯМР (300 МГц, ДMCO-d6)8.08-7.98(m, 36 Н, 18 СН 2), 3.20 (s, 3H, СН 3), 2.05-1.50 и 1.30-0.95 (m, 22 Н, 2 циклогексил). Анализ. Вычислено для С 45 Н 72N4O120,86 Н 2 О: С 61.66; Н 8.48; N 6.39; Обнаружено: С 61.66; Н 8.37; N 6.81. Пример 111. Эфир метилового эфира гептаэтиленгликоля и (Е)-4-(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-метил 1 Н-пурин-8-ил) коричной кислоты.(а) Эфир метилового эфира гептаэтиленгликоля и (Е)-4-(1,3-6 ис(циклогексилметил) 54 1,2,3,6-тетрагидро-2,6-диоксо-9 Н-пурин-8-ил) коричной кислоты. Соединение, указанное в заголовке, получали из соединения, указанного в заголовке примера 1, и монометилового эфира гептаэтиленгликоля (Heimann, U.; Voegtle, F. LiebigsAnn. Chem. 1980, 6, 858-862), используя способы, подобные способам, описанным в примере 16, и получали его в виде воскообразного твердого вещества (800 мг, выход 49%). 1 Н-ЯМР (400 МГц, ДMCO-d6)8.22 (d,J=8.2 Гц, 2 Н), 7.96 (d, J=8.2 Гц, 2 Н), 7.77 (d, J=16 Гц, 1 Н), 6.84 (d, J=16 Гц, 1 Н), 4.35 (t, J=5 Гц,2 Н), 3.99 (d, J=7.3 Гц, 2 Н), 3.85 (d, J=7.2 Гц, 2 Н),3.76 (t, J=5 Гц, 2 Н), 3.65-3.45 (m, 24H), 3.29 (s,3H), 2.00 (m, 1 Н), 1.82 (m, 1 Н), 1.75-1.70 (m,10 Н), 1.30-1.10 (m, 10 Н). МС (ES+): 813 (М+1).(б) Эфир метилового эфира гептаэтиленгликоля и (Е)-4-(1,3-бис(циклогексилметил)2,3,6,7-тетрагидро-2,6-диоксо-7-метил-1 Нпурин-8-ил)коричной кислоты. Соединение, указанное в заголовке, получали из соединения, указанного в заголовке примера 111 а, и метилиодида, используя способы, подобные описанным в примере 77, и получали его в виде масла (35 мг, выход 10%). 1 Н-ЯМР (400 МГц, ДМСО-d6)7.72 (d,J=16 Гц, 1 Н), 7.71 (d, J=8.2 Гц, 2 Н), 7.64 (d, J=8.2 Гц, 2 Н), 6.54 (d, J=16 Гц, 1 Н), 4.37 (br t, J=5 Гц,2 Н), 4.06 (s, 3H), 3.97 (d, J=7.3 Гц, 2 Н), 3.88 (d,J=7.2 Гц, 2 Н), 3.77 (t, J=5 Гц, 2 Н), 3.68-3.60 (m,22H), 3.52 (m, 2 Н), 3.35 (s, 3H), 1.95 (m, 1H),1.82 (m, 1H), 1.75-1.58 (m, 10 Н), 1.24-0.98 (m,10 Н). MC(ES+):827(M+1). Анализ. Вычислено для C44H66N4O11: С 63.90; Н 8.04; N 6.7; Обнаружено: С 63.86; Н 8.00; N 6.81. Соединения, представленные в табл. 5 ниже, получали способами, аналогичными способам, описанным выше для примера 111 (ИМ = исходный материал). Таблица 5 Метиловый эфир (Е)-4-(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6-диоксо-7-метил-1 Нпурин-8-ил)коричной кислоты Эфир метилового эфира этиленгликоля и (Е)-4-(1,3 бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6 диоксо-7-метил-1 Н-пурин-8-ил)коричной кислоты Эфир метилового эфира диэтиленгликоля и (Е)-4(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6 диоксо-7-метил-1 Н-пурин-8-ил)коричной кислоты Эфир метилового эфира триэтиленгликоля и (Е)-4(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6 диоксо-7-метил-1 Н-пурин-8-ил)коричной кислоты Сложный эфир (Е)-4-(1,3-бис(циклогексилметил)2,3,6,7-тетрагидро-2,6-диоксо-1-метил-1 Н-пурин-8 ил)коричной кислоты тетраэтиленгликоля метилового эфира Эфир метилового эфира пентаэтиенгликоля и (Е)-4(1,3-бис(циклогексилметил)-2,3,6,7-тетрагидро-2,6 диоксо-7-метил-1 Н-пурин-8-ил)коричной кислоты Пример 118. 4-[1,3-Бис(циклогексилметил)-8-(11-метокси-3,6,9-триоксаундецилокси) фенил]-3,7-дигидро-1 Н-пурин-2,6-дион. Данное соединение получено из 1,3-бис(циклогексилметил)-5,6-диаминоурацила и 4(11-метокси-3,6,9-триоксаундецилокси)бензальдегида с использованием способов, подобных описанным в примере 109 б, и получено оно в виде желтого твердого вещества (240 мг, выход 32%); 1 Н-ЯМР (400 МГц, CDCl3)12.36 (br s,1 Н), 8.14 (d, J=8.8 Гц, 2 Н), 7.01 (d, J=8.8 Гц, 2 Н),4.18 (t, J=5 Гц, 2 Н), 4.03 (d, J=7.4 Гц, 2 Н), 3.96(ES+): 627 (М+1). Анализ. Вычислено для C34H50N4O7(0,25 Н 2 О): С 64.69; Н 8.06; N 8.88; Обнаружено: С 64.66; Н 7.92; N 9.24. Примеры фармацевтических препаратов В следующих примерах активный ингредиент может представлять собой любое соединение формулы (I) или (Ia) либо его фармацевтически приемлемую соль или сольват, предпочтительно соединение примеров 34, 35, 36,37, 40, 41, 42, 43, 44, 45, 48, 49, 53, 54, 55, 57, 58,59, 61, 63, 65, 67, 68, 69, 71, 75, 77, 78, 79, 80, 81,82, 83, 84, 85, 86, 87, 88, 89, 91, 92, 93, 96, 98, 99,100, 104, 107, 110.Avicel Лактоза Крахмал (кукурузный) Крахмал (предварительно желатинизированный, NF15) Натрий-гликолят крахмала Повидон Стеарат магнияAvicel Лактоза Маннит Сахароза Аравийская камедь Повидон Стеарат магния Препараты А-Д можно приготовить путем влажного гранулирования первых шести ингредиентов с повидоном с последующим добавлением стеарата магния и прессованием.(III) Трансбуккальный Активный ингредиент Гидроксипропилметилцеллюлоза 56 Этот препарат можно приготовить непосредственным прессованием смешанных ингредиентов. Препараты Е и Ж можно приготовить путем смешивания ингредиентов и наполнения полученной в результате смесью твердых желатиновых капсул, состоящих из двух частей.(II) Жидкий наполнитель Активный ингредиентMacrogol 4000 ВР Лецитин Арахисовое масло Препарат З можно приготовить путем плавления Macrogol 4000 ВР, диспергирования активного ингредиента в этом расплаве и наполнения им твердых желатиновых капсул, состоящих из двух частей. Препарат И можно получить путем диспергирования активного ингредиента в лецитине и арахисовом масле и наполнения этой дисперсией мягких эластичных желатиновых капсул.(III) Регулируемое высвобождение Активный ингредиент Этот препарат можно приготовить путем смешения и экструзии первых четырех ингредиентов и сферонизации и высушивания экструдата. На высушенные гранулы наносят слой этилцеллюлозы в качестве мембраны, регулирующей высвобождение, и наполняют ими твердые желатиновые капсулы из двух частей.(3) Препарат для внутривенных инъекций% мас./мас. Активные ингредиенты 2% Гидроксид натрия Сколько необходимо до рН 7 Вода для инъекций До 100% Активный ингредиент растворяют в цитратном буфере и добавляют соляную кислоту в количестве, достаточном для влияния на растворение и доведения рН до 7. Полученный в результате раствор доводят до требуемого объема и фильтруют его через микропористый фильтр в стерильные стеклянные флаконы, ко 57 торые герметично закрывают и дополнительно герметизируют. мг/мл Активные ингредиенты Гидроксипропил-бетациклодекстрин Соевое масло Фосфолипиды Глицерин Гидроксид натрия Вода для инъекций 200,0 12,0 22,5 Сколько необходимо до рН 7 Сколько необхо- Сколько необходимо до 1,0 мл димо до 1,0 мл Препарат А. Активный ингредиент растворяют в растворе гидроксипропил-бета-циклодекстрина и доводят рН до 7. Полученный в результате раствор доводят до требуемого объема и фильтруют через микропористый фильтр в стерильные стеклянные флаконы, которые герметично закрывают и дополнительно герметизируют. Препарат Б. Активный ингредиент растворяют в соевом масле и фосфолипидах. Добавляют остальные ингредиенты и доводят объем раствора до требуемого. Затем полученный в результате раствор гомогенизируют до тех пор,пока не будет достигнута желаемая консистенция. Пример Ж. Капсулы с порошком для ингаляции. Активный ингредиент (порошок 0,5-7,0 мкм) Лактоза (порошок 30-90 мкм) Порошки смешивают до гомогенности и заполняют ими твердые желатиновые капсулы подходящего размера (50 мг на капсулу). Пример 3. Ингаляционный аэрозоль. Активный ингредиент (порошок 0,5-7,0 мкм) 50,0 мг Сорбитантриолеат 100,00 мг Натриевая соль сахарина (порошок 0,5-7,0 мкм) 5,0 мг Метанол 2,0 мг Трихлорфторметан 4,2 г Дихлордифторметан До 10,0 мл Сорбитантриолеат и метанол растворяли в трихлорфторметане. Натриевую соль сахарина и активный ингредиент диспергировали в этой смеси, которую затем переносили в подходящий баллон для аэрозоля и дихлордифторметан вводили через систему клапанов. Эта композиция обеспечивает 0,5 мг активного ингредиента в каждой дозе 100 мкл. Пример И. Пероральная суспензия. мг/мл Активный ингредиент Сахароза Сорбит Натриевая соль сахарина Пропиленгликоль Полиэтиленгликоль Метилпарабен Пропилпарабен Бензоат натрия Искусственный клубничный корригент Искусственный банановый корригент 58 Мятный корригент ГПМЦ (гидроксипропилметил-целлюлоза) Ксантановая смолаPoloxamer 188 Лимонная кислота Гидроксид натрия Вода очищенная, мл 4,5 7,5 5,0 1 5 До рН До рН 6,0 4,0 До 1,0 До 1,0 До 1,0 До 1,0 Препарат А. Парабены растворяют в полипропиленгликоле. Остальные неактивные ингредиенты растворяют в воде, и в этот раствор добавляют раствор парабенов в полипропиленгликоле. Добавляют активный ингредиент и полученный в результате раствор перемешивают до тех пор, пока не будет достигнута желаемая консистенция. Доводят рН и раствор доводят до конечного объема. Препарат Б. Бензоат натрия растворяют в полиэтиленгликоле. Остальные неактивные ингредиенты растворяют в воде и в этот раствор добавляют раствор бензоата натрия в полиэтиленгликоле. Добавляют активный ингредиент и полученный в результате раствор смешивают до тех пор, пока не будет достигнута желаемая консистенция. Затем раствор доводят до конечного объема. Препараты В и Г. Неактивные ингредиенты растворяют в воде. Добавляют активный ингредиент и полученный в результате раствор смешивают до тех пор, пока не будет достигнута желаемая консистенция. Доводят рН и раствор доводят до конечного объема. Биологическая активность 1) Анализ клеточной адгезии. Противоадгезивную активность соединений по изобретению определяли, используя модификацию ранее описанного способа, Jurgensen, C.H. et al., J. Immunol., 1990, 144: 653-661. Адгезивность стимулированных цитокинами эндотелиальных клеток пупочной вены человека оценивали с помощью количественного определения адгезии меченых флуоресцентной меткой (кальцеин-АМ, Molecular Probes, Eugene,OR) лейкоцитов к монослоям эндотелиальных клеток. Активность определяли путем расчета ингибирования стимулированной цитокинами адгезии с вычетом базальной адгезии (нестимулированной). Результаты Пример 38 61 36 71 35 69 68 100 67 40 41 66 45 2) Анализ каррагинанового плеврита. Противовоспалительную активность соединений по изобретению определяли с помощью методики Vinegar, R., et al., Proc. Soc. Exp.Biol. Med., 1981, 168, 24-32, используя самцов крыс Lewis 15020 г. Доза каррагена составляла 0,075 мг/крысу. Плевральный экссудат собирали через четыре часа после инъекции каррагинана. Резкую противовоспалительную активность 60 определяли путем ингибирования плеврального отека и воспалительных клеток (нейтрофилов) из отрицательной (носитель) контрольной группы. Результаты Индуцированный каррагинаном плеврит Пример% ингибирования клеток экссудата 36 47 38 68 92 80 49 28 53 74 85 70 44 44 24 73 0 0 34 20 59 79 55 7 где Z представляет собой 5- или 6-членный циклоалкил, арил, замещенный циклоалкил или замещенный арил, причем указанный циклоалкил, арил, замещенный циклоалкил или замещенный арил возможно содержит один или более чем один гетероатом, выбранный из О, N или S;R1 представляет собой водород или метил;n представляет собой целое число от 8 до 20;Q представляет собой (-СН 2-)p, (-СН=СН-)p,(-CC-)p, (-(O)p1CH2-)p или (-CH2(O)p1)p, где р и р 1 независимо представляют собой целое число от 0 до 4; у и у' независимо представляют собой целые числа от 0 до 10;R3 представляет собой Н, нормальный или разветвленный С 1-12 алкил (возможно замещенный фенилом, -СО-фенил, CN, -СО(С 1-3)алкил,-CO2(C1-3)алкил либо содержащий один или более чем один атом О в алкильной цепи), С 2-6 нормальный или разветвленный алкенил, С 2-6 нормальный или разветвленный алкинил или группу -С 1-3 алкил-NR8R9,где R8 и R9 независимо представляют собой Н, C1-3 алкил или вместе образуют 5- или 6 членную гетероциклическую группу, возможно содержащую другие гетероатомы, выбранные из О, N или S;
МПК / Метки
МПК: A61K 31/522, C07D 473/06
Метки: производные, фенилксантина
Код ссылки
<a href="https://eas.patents.su/30-4139-proizvodnye-fenilksantina.html" rel="bookmark" title="База патентов Евразийского Союза">Производные фенилксантина</a>
Предыдущий патент: Производные бензо(b)циклодиоксаалкана
Следующий патент: Бета- карболиновые соединения, способ их получения и фармацевтическая композиция, их содержащая
Случайный патент: Способ визуализации и сравнения изображений или массивов данных физических величин












