Производные гидроксамовой кислоты в качестве ингибиторов металлопротеаз матрикса (мпм)
Формула / Реферат
1. Соединение формулы (I)
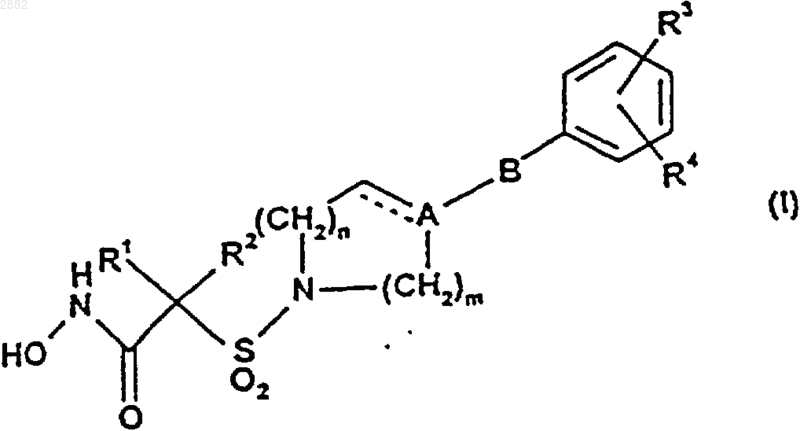
или его фармацевтически или ветеринарно приемлемая соль, или фармацевтически или ветеринарно приемлемый сольват любого из них, где пунктирная линия обозначает возможную связь;
А представляет собой С или СН;
В представляет собой СН2, О или отсутствует;
R1 и R2, каждый независимо, выбраны из водорода, С1-С6алкила, возможно замещенного С1-С4алкокси или фенилом, и С1-С6алкенила; или вместе с атомом углерода, к которому они присоединены, образуют С3-С6циклоалкильную группу, которая возможно включает в себя гетероатомную группу, выбранную из О, SO, SO2 и NR6, или которая является возможно бензоконденсированной;
R3 представляет собой водород, галогено, R7 или OR7;
R4 представляет собой водород, С1-С4алкил, С1-С4алкокси, трифторметил или галогено;
R6 представляет собой водород или С1-С4алкил;
R7 представляет собой моноциклическую или бициклическую кольцевую систему, выбранную из фенила, тиенила, фурила, пиридинила, пиримидинила, нафтила, инданила, бензотиенила, бензофуранила, 2,3-дигидробензофуранила, индолила, хинолинила, изохинолинила, бензодиоксолила, бензимидазолила, бензоксазолила, бензотиазолила и бензодиоксанила, причем любая из этих кольцевых систем возможно замещена одним или двумя заместителями, выбранными из С1-С4алкила, возможно замещенного С1-С4алкокси или гидрокси, С1-С4алкокси, возможно замещенного С1-С4алкокси или гидрокси, С1-С4алкилтио, трифторметила, трифторметокси, галогено и циано;
m представляет собой 1 или 2;
и n представляет собой 0, 1 или 2;
с условием, что В не представляет собой О, когда А представляет собой С.
2. Соединение по п.1, где В отсутствует; R1 представляет собой водород, С1-С4алкил, возможно замещенный метокси или фенилом, или С1-С5алкенил; R2 представляет собой водород или С1-C4алкил; или R1 и R2 вместе с атомом углерода, к которому они присоединены, образуют С4-С5циклоалкильную группу, которая возможно включает в себя гетероатомную группу, выбранную из О и NR6, или которая является возможно бензоконденсированной; R3 выбран из 4-фенила, 4-пиридинила, 4-(индан-5-ила), 4-(2,3-дигидробензофуран-5-ила), 4-(хинолин-3-ила), 4-(бензодиоксол-5-ила) и 4-(бензимидазол-5-ила), любая из которых возможно замещена одним или двумя заместителями, выбранными из C1-С3алкила, возможно замещенного метокси или гидрокси, С1-С3алкокси, возможно замещенного метокси или гидрокси, метилтио, трифторметила, трифторметокси, фторо, хлоро и циано; R4 представляет собой водород, метил, этил, метокси, трифторметил, фторо или хлоро; R6 представляет собой метил; m представляет собой 2 и n представляет собой 1.
3. Соединение по п.2, где R1 представляет собой водород, метил, этил, 2-метилпроп-1-ил, бут-1-ил, 2-метоксиэтил, бензил, 3-фенилпроп-1-ил, аллил, 2-метилаллил, 3,3-диметилаллил; R2 представляет собой водород, метил или этил; или R1 и R2 вместе с атомом углерода, к которому они присоединены, образуют циклобутильную, циклопентильную, тетрагидропиран-4,4-диильную, 1-метилпиперидин-4,4-диильную или индан-2,2-диильную группу; R3 представляет собой 4-фенил, 4-(2-метилфенил), 4-(3-метилфенил), 4-(3-этилфенил), 4-[3-(проп-2-ил)фенил], 4-(3,5-диметилфенил), 4-(3-метоксиметилфенил), 4-(3-гидроксиметилфенил), 4-(2-метоксифенил), 4-(3-метоксифенил), 4-(3-этоксифенил), 4-(4-этоксифенил), 4-[3-(проп-1-окси)фенил], 4-[3-(проп-2-окси)фенил], 4-[4-(проп-2-окси)фенил], 4-(3,4-диметоксифенил), 4-[3-(2-метоксиэтокси)фенил], 4-[3-(2-гидроксиэтокси)фенил], 4-(3-метилтиофенил), 4-(3-трифторметилфенил), 4-(3-трифторметоксифенил), 4-(2-фторфенил), 4-(3-хлор-4-фторфенил), 4-(3-цианофенил), 4-(пиридин-2-ил), 4-(пиридин-3-ил), 4-(пиридил-4-ил), 4-(6-этоксипиридин-2-ил), 4-(5-этоксипиридин-3-ил), 4-(индан-5-ил), 4-(2,3-дигидробензофуран-5-ил), 4-(хинолин-3-ил), 4-(бензодиоксол-5-ил), 4-(2,2-диметилбензодиоксол-5-ил) и 4-(1,2-диметилбензимидазол-5-ил); и R4 представляет собой водород, 2-метил, 3-метил, 3-этил, 3-метокси, 3-трифторметил, 3-фторо или 3-хлоро.
4. Соединение по п.3, где R1 и R2 оба представляют собой водород или метил или вместе с атомом углерода, к которому они присоединены, образуют циклобутильную, циклопентильную, тетрагидропиран-4,4-диильную или 1-метилпиперидин-4,4-диильную группу; R3 представляет собой4-фенил, 4-(3-метоксифенил), 4-(3-этоксифенил), 4-[3-(2-метоксиэтокси)фенил], 4-[3-(2-гидроксиэтокси)фенил] или 4-(6-этоксипиридин-2-ил) и R4 представляет собой 3-метил или 3-метокси.
5. Соединение по п.4, где соединение формулы (I) выбрано из
N-гидрокси-2-{4-[4-(3-этоксифенил)-3-метилфенил]-1,2,3,6-тетрагидропиридин-1-илсульфонил}ацетамида;
N-гидрокси-2-{4-[4-(3-этоксифенил)-3-метилфенил]-1,2,3,6-тетрагидропиридин-1-илсульфонил}-2-метилпропанамида;
N-гидрокси-2-{4-[4-(3-этоксифенил)-3-метилфенил]пиперидин-1-илсульфонил}-2-метилпропанамида;
N-гидрокси-1-{4-[4-(3-метоксифенил)-3-метилфенил]пиперидин-1-илсульфонил}циклопентанкарбоксамида;
N-гидрокси-1-{4-[4-(3-метоксифенил)-3-метилфенил]пиперидин-1-илсульфонил}циклобутанкарбоксамида;
N-гидрокси-2-{4-[4-(3-этоксифенил)-3-метоксифенил]пиперидин-1-илсульфонил}-2-метилпропанамида;
N-гидрокси-2-{4-[4-(6-этоксипиридин-2-ил)-3-метилфенил]пиперидин-1-илсульфонил}-2-метилпропанамида;
N-гидрокси-2-{4-[4-(3-[2-метоксиэтокси]фенил)-3-метилфенил]пиперидин-1-илсульфонил}-2-метилпропанамида; и
N-гидрокси-2-{4-[4-(3-[2-гидроксиэтокси]фенил)-3-метилфенил]пиперидин-1-илсульфонил}-2-метилпропанамида.
6. Фармацевтическая композиция, содержащая соединение формулы (I), или его фармацевтически приемлемую соль, или фармацевтически приемлемый сольват любого из них по любому из пп.1-5, вместе с фармацевтически приемлемым разбавителем или носителем.
7. Ветеринарный препарат, содержащий соединение формулы (I), или его ветеринарно приемлемую соль, или ветеринарно приемлемый сольват любого из них по любому из пп.1-5, вместе с ветеринарно приемлемым разбавителем или носителем.
8. Применение соединения формулы (I), или его фармацевтически приемлемой соли, или фармацевтически приемлемого сольвата любого из них по любому из пп.1-5 в качестве лекарства для людей.
9. Применение фармацевтической композиции по п.6 в качестве лекарства для людей.
10. Применение соединения формулы (I), или его ветеринарно приемлемой соли, или ветеринарно приемлемого сольвата любого из них по любому из пп.1-5 в качестве лекарства для животных.
11. Применение ветеринарного препарата по п.7 в качестве лекарства для животных.
12. Применение соединения формулы (I), или его фармацевтически приемлемой соли, или фармацевтически приемлемого сольвата любого из них по любому из пп.1-5 для изготовления лекарства для людей для лечения или профилактики медицинского состояния, для которого показан ингибитор металлопротеаз матрикса (МПМ).
13. Применение соединения формулы (I), или его ветеринарно приемлемой соли, или ветеринарно приемлемого сольвата любого из них по любому из пп.1-5 для изготовления лекарства для животных для лечения или профилактики медицинского состояния, для которого показан ингибитор МПМ.
14. Применение по п.12 или 13, где ингибитор представляет собой ингибитор МПМ-3.
15. Применение соединения формулы (I), или его фармацевтически приемлемой соли, или фармацевтически приемлемого сольвата любого из них по любому шч пп.1-5 для изготовления лекарства для людей для лечения или профилактики перфорации атеросклеротических бляшек, инфаркта миокарда, сердечной недостаточности, рестеноза, удара, периодонтального заболевания, изъязвления тканей, заживления ран, кожных заболеваний, ракового метастаза, опухолевого ангиогенеза, возрастной дегенерации желтого пятна, фиброзного заболевания, ревматоидного артрита, остеоартрита и воспалительных заболеваний, обусловленных мигрирующими воспалительными клетками.
16. Применение соединения формулы (I), или его ветеринарно приемлемой соли, или ветеринарно приемлемого сольвата любого из них по любому из пп.1-5 для изготовления лекарства для животных для лечения или профилактики перфорации атеросклеротических бляшек, инфаркта миокарда, сердечной недостаточности, рестеноза, удара, периодонтального заболевания, изъязвления тканей, заживления ран, кожных заболеваний, ракового метастаза, опухолевого ангиогенеза, возрастной дегенерации желтого пятна, фиброзного заболевания, ревматоидного артрита, остеоартрита и воспалительных заболеваний, обусловленных мигрирующими воспалительными клетками.
17. Соединение формулы (II)
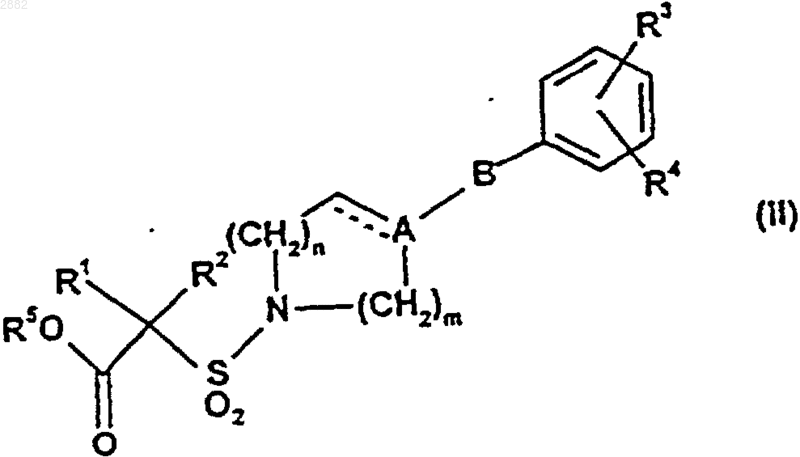
где R5 представляет собой водород или С1-С3алкил и пунктирная линия, А, В, R1, R2, R3, R4, m и n являются такими, как определено выше для формулы (I) в п.1.
18. Соединение по п.17, где R5 представляет собой C1-С3алкил, R3 представляет собой бромо или иодои R4 представляет собой водород, С1-С4алкил, С1-C4алкокси или трифторметил.
19. Способ получения соединения по п.17, где R5 представляет собой С1-С3алкил, R3 представляет собой R7 и R4 представляет собой водород, С1-С4алкил, С1-С4алкокси или трифторметил, при котором осуществляют взаимодействие соединения по п.18 с соединением формулы R7B(OH)2 или R7Sn(алкил)3, где R7 такой, как определено ранее в п.1, и возможные заместители на R7 возможно защищены подходящей защитной группой.
20. Способ по п.19, при котором осуществляют взаимодействие с соединением формулы R7B(OH)2.
21. Способ лечения или предотвращения медицинского состояния, для которого показан ингибитор МПМ, у млекопитающего (включая человека), при котором указанному млекопитающему вводят терапевтически эффективное количество соединения формулы (I), или его фармацевтически или ветеринарно приемлемой соли, или фармацевтически или ветеринарно приемлемого сольвата любого из них по любому из пп.1-5, или фармацевтической композиции или ветеринарного препарата, содержащих любое из вышеуказанных, по п.6 или 7 соответственно.
22. Способ по п.21, в котором ингибитор представляет собой ингибитор МПМ-3.
23. Способ лечения или предотвращения перфорации атеросклеротических бляшек, инфаркта миокарда, сердечной недостаточности, рестеноза, удара, периодонтального заболевания, изъязвления тканей, заживления ран, кожных заболеваний, ракового метастаза, опухолевого ангиогенеза, возрастной дегенерации желтого пятна, фиброзного заболевания, ревматоидного артрита, остеоартрита и воспалительных заболеваний, обусловленных мигрирующими воспалительными клетками у млекопитающего (включая человека), при котором указанному млекопитающему вводят терапевтически эффективное количество соединения формулы (I), или его фармацевтически или ветеринарно приемлемой соли, или фармацевтически или ветеринарно приемлемого сольвата любого из них по любому из пп.1-5, или фармацевтической композиции или ветеринарного препарата, содержащих любое из вышеуказанных, по п.6 или 7 соответственно.
24. Способ получения соединения формулы (I)
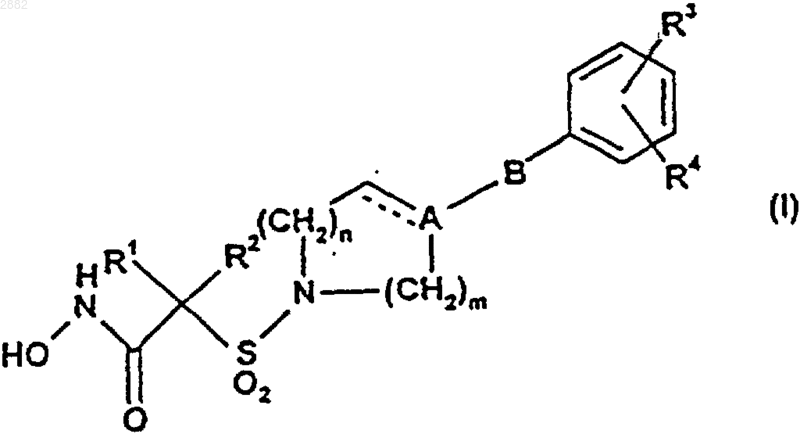
или его фармацевтически или ветеринарно приемлемой соли, или фармацевтически или ветеринарно приемлемого сольвата любого из них, где пунктирная линия обозначает возможную связь;
А представляет собой С или СН;
В представляет собой СН2, О или отсутствует;
R1 и R2, каждый независимо, выбраны из водорода, C1-С6алкила, возможно замещенного С1-C4алкокси или фенилом, и C1-С6алкенила; или вместе с атомом углерода, к которому они присоединены, образуют С3-С6циклоалкильную группу, которая возможно включает в себя гетероатомную группу, выбранную из О, SO, SO2 и NR6 или которая является возможно бензоконденсированной;
R3 представляет собой водород, галогено, R7 или OR7;
R4 представляет собой водород, С1-С4алкил, С1-С4алкокси, трифторметил или галогено;
R6 представляет собой водород или С1-С4алкил;
R7 представляет собой моноциклическую или бициклическую кольцевую систему, выбранную из фенила, тиенила, фурила, пиридинила, пиримидинила, нафтила, инданила, бензотиенила, бензофуранила, 2,3-дигидробензофуранила, индолила, хинолинила, изохинолинила, бензодиоксолила, бензимидазолила, бензоксазолила, бензотиазолила и бензодиоксанила, причем любая из этих кольцевых систем возможно замещена одним или двумя заместителями, выбранными из С1-С4алкила, возможно замещенного С1-С4алкокси или гидрокси, С1-С4алкокси, возможно замещенного С1-С4алкокси или гидрокси, С1-С4алкилтио, трифторметила, трифторметокси, галогено и циано;
m представляет собой 1 или 2; и
n представляет собой 0, 1 или 2;
с условием, что В не представляет собой О, когда А представляет собой С;
при котором соединение формулы (II)
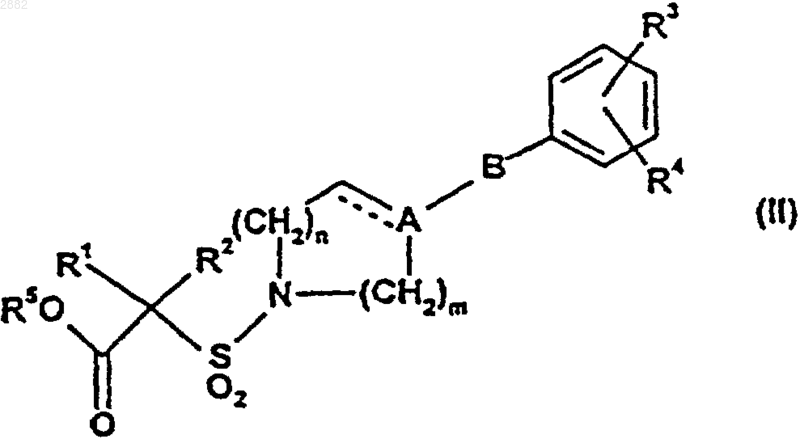
где R5 представляет собой водород или C1-С3алкил и пунктирная линия, А, В, R1, R2, R3, R4, m и n являются такими, как определено выше для формулы (I), подвергают взаимодействию с гидроксиламином, с возможным последующим образованием фармацевтически или ветеринарно приемлемой соли требуемого продукта или фармацевтически или ветеринарно приемлемого сольвата любого из них.
25. Способ по п.24, при котором, когда R5 представляет собой С1-С3алкил, сложный эфир формулы (II) обрабатывают гидрохлоридом гидроксиламина, взятым в избытке до 3-кратного, в присутствии молярного эквивалентного количества подходящего основания в подходящем растворителе при температуре от приблизительно комнатной до приблизительно 85шС.
26. Способ по п.25, где основание представляет собой карбонат или бикарбонат щелочного металла, растворитель представляет собой метанол, возможно в комбинации с тетрагидрофураном или дихлорметаном в качестве сорастворителя, и температура реакции составляет от приблизительно 65 до приблизительно 70шС.
27. Способ по п.24, при котором, когда R5 представляет собой водород, кислоту формулы (II) в присутствии активирующего агента в количестве от 1,1 до 2,0 молекулярных эквивалентов и третичного амина в количестве от 1,0 до 4,0 молекулярных эквивалентов в подходящем растворителе обрабатывают гидрохлоридом гидроксиламина, взятым в избытке до 3-кратного, возможно в том же самом растворителе при температуре от приблизительно 0шС до приблизительно комнатной.
28. Способ по п.27, где активирующий агент представляет собой O-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилуронийгексафторфосфат (ГАТУ), третичный амин представляет собой N-этилдиизопропиламин, растворитель представляет собой безводный диметилформамид или безводный 1-метилпирролидин-2-он и температура реакции представляет сосющ приблизительно комнатную температуру.
29. Способ получения соединения формулы (I), при котором снимают защиту с защищенного соединения формулы (I) с последующим возможным получением фармацевтически или ветеринарно приемлемой соли требуемого продукта или фармацевтически или ветеринарно приемлемого сольвата любого из них.
Текст
1 Данное изобретение относится к группе замещенных -аминосульфонилацетогидроксамовых кислот, которые являются ингибиторами цинкзависимых ферментов-металлопротеаз. В частности, данные соединения являются ингибиторами некоторых представителей семейства металлопротеаз матрикса (МПМ). Металлопротеазы матрикса (МПМ) составляют семейство структурно похожих цинксодержащих металлопротеаз, которые вовлечены в реконструкцию и расщепление белков внеклеточного матрикса как в нормальных физиологических процессах, так и при патологических состояниях. Поскольку они обладают высоким деструктивным потенциалом, МПМ обычно подчиняются строгой регуляции, и нарушение поддержания регуляции МПМ может быть составной частью множества заболеваний и патологических состояний, включающих в себя перфорацию атеросклеротических бляшек,сердечную недостаточность, рестеноз, периодонтальное заболевание, изъязвление тканей,заживление ран, раковый метастаз, опухолевый ангиогенез, возрастная дегенерация желтого пятна, фиброзное заболевание, ревматоидный артрит, остеоартрит и воспалительные заболевания, обусловленные мигрирующими воспалительными клетками. Другая важная функция некоторых МПМ заключается в том, чтобы активировать различные ферменты, включая другие МПМ, путем отщепления продоменов от их протеазных доменов. Следовательно, некоторые МПМ действуют таким образом, чтобы регулировать активности других МПМ, так что сверхсинтез одной МПМ может привести к избыточному протеолизу внеклеточного матрикса другими. Более того, МПМ обладают различными субстратными предпочтениями (показаны в следующей таблице для выбранных представителей семейства) и различными функциями при нормальных и патологических состояниях. Последние обзоры МПМ см. в Current Pharmaceutical Design,1996, 2, 624 и Exp. Opin. Ther. Patents, 1996, 6,1305. Таблица Предпочтительные субстраты МПМ-1 Коллагеназа-1; интерКоллагены I, II, III, VII,стициальная коллагеназа X; желатины МПМ-2 Желатиназа А; желатина- Желатины; коллагены за 72 кДа 2 Полагают, что избыточный синтез МПМ-3 является ответственным за патологическое разрушение ткани, которое лежит в основе множества заболеваний и состояний. Например,МПМ-3 был обнаружен в синовиальной оболочке и хряще пациентов, страдающих от остеоартрита и ревматоидного артрита, таким образом,МПМ-3 вовлекается в повреждение суставов,вызываемое этими заболеваниями: см. Biochemistry, 1989, 28, 8691 и Biochem. J., 1989,258, 115. Также полагают, что МПМ-13 играет важную роль при патологии остеоартрита и ревматоидного артрита: см. Lab. Invest., 1997,76, 717 и Arthritis Rheum., 1997, 40, 1391. Соединения по настоящему ингибируют и МПМ-3 и МПМ-13 и, таким образом, могут быть полезны при лечении этих заболеваний. Также полагают, что сверхсинтез МПМ-3 является ответственным за большую часть повреждения тканей и хронический характер хронических ран, таких как венозные язвы, диабетические язвы и пролежни: см. Brit. J. Dermatology, 1996, 135, 52. Кроме того, синтез МПМ-3 может также вызвать повреждение тканей в состояниях, при которых присутствует изъязвление толстой кишки (как при неспецифическом язвенном колите и болезни Крона: см. J. Immunol., 1997 158,1582 и J. Clin. Pathol., 1994, 47, 113) или двенадцатиперстной кишки (см. Am. J. Pathol., 1996,148, 519). Более того, МПМ-3 может также быть вовлечен в кожные заболевания, такие как дистрофический врожденный буллезный эпидермолиз (см. Arch. Dermatol. Res., 1995, 287, 428) и герпетиформный дерматит (см. J. Invest. Dermatology, 1995, 105, 184). Наконец, перфорация атеросклеротических бляшек под действием МПМ-3 может привести к инфаркту миокарда или головного мозга: см.Circulation, 1997, 96, 396. Таким образом, ингибиторы МПМ-3 могут быть полезными при предотвращении сердечного приступа и удара. Исследования злокачественных опухолей человека показали, что МПМ-2 активируется на поверхности инфазивной опухолевой клетки(см. J. Biol. Chem., 1993, 268, 14033) и сообщалось, что ВВ-94, неизбирательный пептидный гидроксаматный ингибитор МПМ, уменьшает тяжесть опухоли и продлевает срок жизни мыши, несущей ксенотрансплантаты яичниковой карциномы человека (см. Cancer Res., 1993, 53,2087). Некоторые соединения по настоящему изобретению ингибируют МПМ-2 и поэтому могут быть полезны при лечении ракового метастаза и опухолевого ангиогенеза. В патентной литературе представлены различные группы ингибиторов МПМ. Например,-арилсульфонамидозамещенные ацетогидроксамовые кислоты описаны в ЕР-А-0606046, WOA-9627583 и WO-A-9719068, в то время как ЕР 3 А-0780386 описывает некоторые родственные сульфонзамещенные гидроксамовые кислоты. Соединения по настоящему изобретению являются ингибиторами некоторых представителей семейства МПМ. В частности, они являются сильными ингибиторами МПМ-3 и МПМ 13, а некоторые соединения демонстрируют различающиеся степени избирательности в отношении других МПМ, таких как МПМ-1,МПМ-2 и МПМ-9. Некоторые из соединений являются сильными ингибиторами МПМ-2. Таким образом, в соответствии с настоящим изобретением предложено соединение формулы (I): или его фармацевтически или ветеринарно приемлемая соль, или фармацевтически или ветеринарно приемлемый сольват (включающий в себя гидрат) любого из них, где пунктирная линия обозначает возможную связь; А представляет собой С или СН; В представляет собой СН 2, О или отсутствует;R1 и R2, каждый независимо, выбраны из водорода, C1-С 6 алкила, возможно замещенного С 1-С 4 алкокси или фенилом, и C1-С 6 алкенила; или вместе с атомом углерода, к которому они присоединены, образуют С 3-С 6 циклоалкильную группу, которая возможно включает в себя гетероатомную группу, выбранную из О, SO, SО 2 иNR6 или которая возможно является бензоконденсированной;R6 представляет собой водород или С 1-С 4 алкил;R7 представляет собой моноциклическую или бициклическую кольцевую систему, выбранную из фенила, тиенила, фурила, пиридинила, пиримидинила, нафтила, инданила, бензотиенила, бензофуранила, 2,3-дигидробензофуранила, индолила, хинолинила, изохинолинила,бензодиоксолила, бензимидазолила, бензоксазолила, бензотиазолила и бензодиоксанила, причем любая из этих кольцевых систем возможно замещена одним или двумя заместителями, выбранными из С 1-С 4 алкила, возможно замещенного С 1-С 4 алкокси или гидрокси, С 1-С 4 алкокси,возможно замещенного С 1-С 4 алкокси или гидрокси, С 1-С 4 алкилтио, трифторметила, трифторметокси, галогено и циано;m представляет собой 1 или 2; и n представляет собой 0, 1 или 2; с условием, что В не представляет собой О, когда А представляет собой С. 4 В приведенном выше обозначении, если не указано иначе, алкильные, алкокси, алкилтио и алкенильные группы, имеющие три или более чем три атома углерода, могут представлять собой прямую цепь или разветвленную цепь. Галогено обозначает фторо, бромо или йодо. Соединения формулы (I) могут содержать один или более чем один хиральный центр и,поэтому, могут существовать в виде стереоизомеров, т.е. в виде энантиомеров или диастереоизомеров, а также их смесей. Данное изобретение включает в себя и отдельные стереоизомеры соединений формулы (I) и любую их смесь. Разделения диастереоизомеров можно достигнуть обычными способами, например фракционированной кристаллизацией или хроматографией(включая ВЭЖХ) диастереоизомерной смеси соединения формулы (I), или его подходящей соли, или производного. Отдельный энантиомер соединения формулы (I) можно получить из соответствующего оптически чистого промежуточного соединения или разделением либо при помощи ВЭЖХ рацемата с применением подходящего хирального носителя либо, там где это подходит, фракционированной кристаллизацией диастереоизомерных солей, образованных реакцией рацемата с подходящим оптически активным основанием или кислотой. Кроме того, соединение формулы (I), которое содержит алкенильные группы, может существовать в виде цис-стереоизомеров или транс-стереоизомеров. Кроме того, изобретение включает в себя как разделенные отдельные стереоизомеры, так и их смеси. Также в изобретение включены меченные радиоактивным изотопом производные соединений формулы (I), которые подходят для биологических исследований. Соединения формул (I) могут образовывать с основаниями фармацевтически или ветеринарно приемлемые основные соли, в частности, нетоксичные соли щелочных металлов. Примеры включают в себя соли натрия и калия. Фармацевтически или ветеринарно приемлемые соли соединений формулы (I), которые содержат основный центр, представляют собой, например, нетоксичные соли, образованные присоединением неорганических кислот, таких как соляная, бромисто-водородная, серная и фосфорная кислота, органических карбоновых кислот или органических сульфоновых кислот. Предпочтительная группа соединений формулы (I) представляет собой группу, где В отсутствует; R1 представляет собой водород, С 1 С 4 алкил, возможно замещенный метокси или фенилом, или С 1-С 5 алкенил; R2 представляет собой водород или С 1-С 4 алкил; или R1 и R2 вместе с атомом углерода, к которому они присоединены, образуют С 4-С 5 циклоалкильную группу, которая возможно включает в себя гетероатомную группу, выбранную из О и NR6, или которая является возможно бензоконденсиро 5 ванной; R3 выбран из 4-фенила, 4-пиридинила,4-(индан-5-ила),4-(2,3-дигидробензофуран-5 ила), 4-(хинолин-3-ила), 4-(бензодиоксол-5-ила) и 4-(бензимидазол-5-ила), любой из которых возможно замещен одним или двумя заместителями, выбранными из C1-С 3 алкила, возможно замещенного метокси или гидрокси, C1 С 3 алкокси, возможно замещенного метокси или гидрокси, метилтио, трифторметила, трифторметокси, фторо, хлоро и циано; R4 представляет собой водород, метил, этил, метокси, трифторметил, фторо или хлоро; R6 представляет собой метил;m представляет собой 2; и n представляет собой 1. Более предпочтительная группа соединений формулы (I) представляет собой группу, гдеR1 представляет собой водород, метил, этил, 2 метилпроп-1-ил, бут-1-ил, 2-метоксиэтил, бензил, 3-фенилпроп-1-ил, аллил, 2-метилаллил,3,3-диметилаллил; R2 представляет собой водород, метил или этил; или R1 и R2 вместе с атомом углерода, к которому они присоединены,образуют циклобутильную, цикпопентильную,тетрагидропиран-4,4-диильную, 1-метилпиперидин-4,4-диильную или индан-2,2-диильную группу; R3 представляет собой 4-фенил, 4-(2 метилфенил),4-(3-метилфенил),4-(3-этилфенил), 4-[3-(проп-2-ил)фенил], 4-(3,5-диметилфенил), 4-(3-метоксиметилфенил), 4-(3-гидроксиметилфенил), 4-(2-метоксифенил), 4-(3 метоксифенил),4-(3-этоксифенил),4-(4 этоксифенил), 4-[3-(проп-1-окси)фенил], 4-[3(проп-2-окси)фенил], 4-[4-(проп-2-окси)фенил],4-(3,4-диметоксифенил), 4-[3-(2-метоксиэтокси) фенил], 4-[3-(2-гидроксиэтокси)фенил], 4-(3 метилтиофенил), 4-(3-трифторметилфенил), 4(3-трифторметоксифенил), 4-(2-фторфенил), 4(3-хлор-4-фторфенил), 4-(3-цианофенил), 4(пиридин-2-ил), 4-(пиридин-3-ил), 4-(пиридил 4-ил), 4-(6-этоксипиридин-2-ил), 4-(5-этоксипиридин-3-ил), 4-(индан-5-ил), 4-(2,3-дигидробензофуран-5-ил), 4-(хинолин-3-ил), 4-(бензодиоксол-5-ил), 4-(2,2-диметилбензодиоксол-5 ил) и 4-(1,2-диметилбензимидазол-5-ил); и R4 представляет собой водород, 2-метил, 3-метил,3-этил, 3-метокси, 3-трифторметил, 3-фторо или 3-хлоро. Особенно предпочтительная группа соединений формулы (I) представляет собой группу,где R1 и R2 оба представляют собой водород или метил, или вместе с атомом углерода, к которому они присоединены, образуют циклобутильную, циклопентильную, тетрагидропиран-4,4 диильную или 1-метилпиперидин-4,4-диильную группу; R3 представляет собой 4-фенил, 4-(3 метоксифенил), 4-(3-этоксифенил), 4-[3-(2 метоксиэтокси)фенил], 4-[3-(2-гидроксиэтокси) фенил] или 4-(6-этоксипиридин-2-ил); и R4 представляет собой 3-метил или 3-метокси. Особенно предпочтительные отдельные соединения по изобретению включают в себяN-гидрокси-2-4-[4-(3-[2-гидроксиэтокси] фенил)-3-метилфенил]пиперидин-1-илсульфонил-2-метилпропанамид. В другом аспекте, настоящее изобретение предлагает способы получения соединения формулы (I), или его фармацевтически или ветеринарно приемлемой соли, или фармацевтически или ветеринарно приемлемого сольвата(включая гидрат) любого из них, как проиллюстрировано ниже. Специалисту в данной области техники будет понятно, что в пределах некоторых описанных способов, порядок используемых стадий синтеза может быть изменен и будет зависеть, в частности, от таких факторов, как природа других функциональных групп, присутствующих в конкретном субстрате, доступности ключевых промежуточных соединений и выбранной стратегии защитных групп (если применяют стратегии). Очевидно, что такие факторы будут также влиять на выбор реагента для применения на указанных стадиях синтеза. Характерными стратегиями защитных групп являются пути синтеза для примера 64, в которых перед требуемой стадией реакции Сузуки (Suzuki) получают гидроксамат, защищенный O-бензилом, и для примера 66, в котором применяется спиртовая защита с использованием трет-бутилдифенилсилильной группы. Также будет понятно, что различные взаимопревращения и превращения стандартных заместителей или функциональных групп в некоторых соединениях формулы (I) будут давать другие соединения формулы (I). Примером является перевод производного тетрагидропиридина (пример 28) в производное пиперидина 7 Следующие способы являются характерными для общих способов синтеза, которые можно выбирать, для того чтобы получить соединения по изобретению. Соединение формулы (I) можно получить непосредственно из сложного эфира формулы где R5 представляет собой C1-С 3 алкил, и пунктирная линия, А, В, R1, R2, R3, R4, m и n являются такими как определено выше для формулы(I), или через промежуточную соответствующую карбоновую кислоту формулы (II), где R5 представляет собой водород. При получении непосредственно из сложного эфира формулы (II) реакцию можно осуществлять путем обработки этого сложного эфира гидроксиламином, взятым в избытке до 3 кратного, в подходящем растворителе при температуре от приблизительно комнатной до приблизительно 85 С. Гидроксиламин удобно получать in situ из его соли гидрохлорида путем проведения реакции в присутствии молярного эквивалентного количества подходящего основания, такого как карбонат или бикарбонат щелочного металла, например карбоната калия. Предпочтительно, растворитель представляет собой метанол, возможно в комбинации с тетрагидрофураном или дихлорметаном в качестве сорастворителя, и температура реакции составляет от приблизительно 65 до 70 С. В качестве альтернативы, сложный эфир можно переводить обычным гидролизом в соответствующую карбоновую кислоту, которую затем превращают в требуемую гидроксамовую кислоту формулы (I). Предпочтительно, гидролиз осуществляют в основных условиях, используя гидроксид щелочного металла, взятый в избытке до приблизительно 6-кратного, в водном растворе, возможно в присутствии сорастворителя при температуре от приблизительно комнатной до приблизительно 85 С. Типично, сорастворитель выбирают из метанола, 1,4-диоксана, смеси метанола и тетрагидрофурана и смеси метанола и 1,4-диоксана, и температура реакции составляет от приблизительно 40 до приблизительно 70 С. Последующую стадию сочетания можно выполнять, применяя обычные методики образования амидной связи, например через ацилхлоридное производное и гидрохлорид гидроксиламина в присутствии избытка третичного амина, такого как триэтиламин, или пиридина,действующего в качестве акцептора кислоты,возможно в присутствии катализатора, такого как 4-диметиламинопиридин, в подходящем растворителе, таком как дихлорметан, при тем 002882 8 пературе от приблизительно 0 С до приблизительно комнатной. Для удобства в качестве растворителя можно также использовать пиридин. В частности, можно использовать любой из множества вариантов сочетания аминокислот. Например, кислоту формулы (II), где R5 представляет собой водород, можно активировать, применяя карбодиимид, такой как 1,3 дициклогексилкарбодиимид или 1-этил-3-(3 диметиламинопроп-1-ил)карбодиимид, возможно в присутствии 1-гидроксибензотриазола и/или катализатора, такого как 4-диметиламинопиридин, или применяя галогенотрисаминофосфониевую соль, такую как бромтрис(пирролидино)фосфонийгексафторфосфат. Любой тип сочетания проводят в подходящем растворителе, таком как дихлорметан или диметилформамид, возможно в присутствии третичного амина, такого как N-метилморфолин илиN-этилдиизопропиламин (например, когда или гидроксиламин, или активирующий реагент присутствует в форме соли, образованной присоединением кислоты), при температуре от приблизительно 0 С до приблизительно комнатной. Типично, используют активирующий реагент в количестве от 1,1 до 2,0 молекулярных эквивалентов и любой имеющийся в наличии третичный амин в количестве от 1,0 до 4,0 молекулярных эквивалентов. Предпочтительный реагент для того, чтобы опосредовать реакцию сочетания, представляет собой O-(7-азабензотриазол-1-ил)-1,1,3,3 тетраметилуронийгексафторфосфат (ГАТУ). Предпочтительно, раствор кислоты и Nэтилдиизопропиламина в количестве от 1,0 до 1,2 молекулярных эквивалентов в подходящем растворителе, таком как безводный диметилформамид или безводный 1-метилпирролидин 2-он в атмосфере азота, обрабатывают ГАТУ,взятым в избытке до 50 %, при приблизительно комнатной температуре, с последующим, через приблизительно от 15 до 30 мин, избытком гидрохлорида гидроксиламина (приблизительно до 3-кратного) и избытком N-этилдиизопропиламина (приблизительно до 4-кратного), возможно в том же самом растворителе при той же температуре. Сложный эфир формулы (II) можно получить из амина формулы (III) где пунктирная линия, А, В, R3, R4, m и n являются такими как определено выше для формулы(II), путем сульфонилирования с использованием соединения формулы (IV) 9 где Z представляет собой галогено, R5 представляет собой C1-С 3 алкил, и R1 и R2 являются такими как определено выше для формулы (II). Предпочтительно, Z представляет собой хлоро. Когда R6 представляет собой водород,обычно предпочтительно защищать эту вторичную аминосвязь обычной защитной группой амина. Реакцию можно осуществлять в присутствии соответствующего основания, взятого в избытке до 50%, в подходящем растворителе при температуре от приблизительно 0 С до приблизительно комнатной. Например, когда и R1 и R2 представляют собой водород, соответствующее основание представляет собой 1,8-диазабицикло[5,4,0]ундек-7-ен, и подходящий растворитель представляет собой дихлорметан. В качестве альтернативы, анион соединения (III) можно получить изначально, используя сильное основание, взятое в избытке до 20%, в подходящем растворителе в атмосфере азота, и затем осуществлять сульфонилирование с использованием соединения (IV) в количестве от 1,0 до 1,2 молекулярных эквивалентов. Удобно, если такое сочетание можно проводить при комнатной температуре с N,Oбис(триметилсилил)ацетамидом в качестве основания и безводным тетрагидрофураном в качестве растворителя. Дальнейшие пути получения сложного эфира формулы (II), где R3 представляет собойR7, зависят от использования либо реакции Сузуки, либо реакции Стила со сложным эфиром формулы (II), где R3 (но не R4) представляет собой или бромо или йодо. Таким образом, в реакции Сузуки последний сложный эфир обрабатывают бороновой кислотой формулы R7B(OH)2 в количестве от 1,0 до 1,5 молекулярных эквивалентов в присутствии фторида щелочного металла в количестве от 2,0 до 3,0 молекулярных эквивалентов, триарилфосфина в количестве приблизительно 0,1 молекулярного эквивалента и палладиевого катализатора в количестве приблизительно 0,05 молекулярного эквивалента в подходящем растворителе в атмосфере азота при температуре от приблизительно 65 до приблизительно 100 С. Типично, фторид представляет собой фторид цезия, фосфин представляет собой триортотолилфосфин, катализатор представляет собой трис(дибензилиденацетон)дипалладий(0) и растворитель представляет собой дегазированный 1,2-диметоксиэтан, возможно вместе с 1-метилпирролидин-2-оном в качестве сорастворителя. В реакции Стила исходное вещество - вышеупомянутый сложный эфир формулы (II) обрабатывают подходящим производным триалкилстаннана формулы R7Sn(aлкил)3 в количестве от 1,0 до 2,0 молекулярных эквивалентов,где алкил представляет собой, например, нбутил, в присутствии от 2,0 до 3,0 молекулярных эквивалентов третичного основания, от 0,3 10 до 0,6 молекулярных эквивалентов триарилфосфина и от 0,05 до 0,2 молекулярных эквивалентов палладиевого катализатора в подходящем растворителе в атмосфере азота при температуре от приблизительно от 65 до приблизительно 100 С. Типично, основание представляет собой триэтиламин, фосфин представляет собой триортотолилфосфин, катализатор представляет собой ацетат палладия (II) возможно в присутствии тетракис(трифенилфосфин)палладия(О), и растворитель представляет собой безводный ацетонитрил. Некоторые сложные эфиры формулы (II),где, по меньшей мере, один из R1 и R2 являются иным, чем водород, можно удобным способом получить из -карбаниона сложного эфира формулы (II), где, по меньшей мере, один из R1 и R2 представляет собой водород, обычными способами С-алкилирования, применяя алкилирующий агент формулы (VA) или (VБ): где R является таким как определено ранее дляR1 или R2, но не водородом, Х и Y могут быть одинаковыми или различными и представляют собой подходящие уходящие группы, и W представляет собой С 2-С 5 алкиленовую группу, которая возможно включает в себе гетероатомную группу, выбранную из О, SO, SO2 и NR6 или которая является возможно бензоконденсированной. Когда R6 должен представлять собой водород в соединении формулы (I), то обычная стратегия защитной группы амина может представлять преимущество во время этой процедуры алкилирования. Подходящую уходящую группу можно выбрать из галогено (например хлоро, бромо или йодо), С 1-С 4 алкансульфонилокси, трифторметансульфонилокси и арилсульфонилокси (например бензолсульфонилокси или паратолуолсульфонилокси). Предпочтительно, Х и Y выбирают из бромо, йодо и паратолуолсульфонилокси. Карбанион можно получить при применении соответствующего основания в подходящем растворителе. Типичные комбинации основание-растворитель могут быть выбраны из гидрида лития, натрия или калия, бис(триметилсилил)амида лития, натрия или калия, диизопропиламида лития и бутиллития, вместе с толуолом, простым эфиром, 1,2-диметоксиэтаном,тетрагидрофураном, 1,4-диоксаном, диметилформамидом, N,N-диметилацетамидом, 1-метилпирролидин-2-оном и любой их смесью. Предпочтительно, основание представляет собой гидрид натрия и растворитель представляет собой безводный диметилформамид, возможно вместе с безводным тетрагидрофураном в качестве сорастворителя, или безводный 1 метилпирролидин-2-он. Для моноалкилирования применяют основание, взятое в избытке до приблизительно 10%, в то время как для диал 11 килирования обычно подходят от приблизительно 2 до приблизительно 3 молярных эквивалентов. Типично, карбанион получают при приблизительно комнатной температуре в атмосфере азота и его последовательно обрабатывают требуемым алкилирующим агентом, взятым в избытке до приблизительно 30%, при той же самой температуре. Очевидно, что когда требуется диалкилирование и R1 и R2 являются различными, заместители можно вводить в тандеме в "реакции в одном сосуде" или на отдельных стадиях. Особенно удобно, когда альтернативный способ алкилирования включает в себя обработку субстрата требуемым алкилирующим агентом в присутствии безводного карбоната калия в количестве от 3,0 до 3,5 молекулярных эквивалентов в безводном диметилсульфоксиде или безводном 1,2-диметоксиэтане в атмосфере азота при приблизительно комнатной температуре. Очевидно, альтернативный вариант получения соединения формулы (II) заключается в том, чтобы ввести R1 и/или R2 в подходящее промежуточное йодо или бромо соединение до дальнейшей выработки с помощью, например,реакции Сузуки или Стилла. Амин формулы (III) можно получить с использованием стандартных химических способов. Например, когда В отсутствует, m представляет собой 2 и n представляет собой 1, подходящим образом N-защищенный пиперидин-4 он формулы (VI) где Р представляет собой обычную защитную группу для амина, реагирует с карбанионовым производным соединения формулы (VII) где Z является таким, как определено ранее для формулы (IV) и R3 и R4 являются такими, как определено ранее для формулы (III), с получением соединения формулы (VIII) Предпочтительно Z представляет собой хлоро, бромо или йодо. Удобно, если (VII) превращают в ариллитий или арильное производное Гриньяра, в то время как из множества защитных групп для амина Р типично представляет собой третбутоксикарбонил (Бок) или бензил. Когда Р представляет собой Бок, (VIII) можно превращать непосредственно в соединение формулы (III), где пунктирная линия обозначает связь, А представляет собой С, В отсутствует, m представляет собой 2, n представляет 12 собой 1, и R3 и R4 являются такими, как определено выше для формулы (III), применяя трифторуксусную кислоту, возможно в подходящем растворителе, как например дихлорметан, при приблизительно комнатной температуре. В качестве альтернативы, когда Р представляет собой бензил, (VIII) можно превращать в две стадии в то же самое соединение формулы (III). Например, на первой стадии дегидратацию можно проводить в нагреваемом с обратным холодильником толуоле, паратолуолсульфоновую кислоту и аппарат Дина-Старка. Удаление защиты с атома N полученного в результате алкена (производное 1,2,3,6-тетрагидропиридина) на второй стадии можно осуществлять,применяя 1-хлорэтилхлорформиат в нагреваемом с обратным холодильником толуоле, с последующей обработкой реакционной смеси при комнатной температуре или метанолом или этанолом. Этот ненасыщенный пиперидин можно превратить в соединение формулы (III), где пунктирная линия не представляет собой связь,А представляет собой СН, В отсутствует, m представляет собой 2, n представляет собой 1, иR3 и R4 являются такими, как определено выше для формулы (III), при обычных каталитических условиях гидрирования или условиях гидрирования с каталитическим переносом. В качестве альтернативы, эти условия гидрирования можно применять для превращения описанного ранееN-бензилалкена (производного 1,2,3,6-тетрагидропиридина) в то же самое производное пиперидина непосредственно в одну стадию. Более того, этот полностью насыщенный пиперидин также доступен в одну стадию из (VIII),когда Р представляет собой Бок, путем стандартного ионного гидрирования, применяя, например, триэтилсилан и трифторуксусную кислоту в дихлорметане. Другие амины формулы (III), если они не имеются в продаже и не описаны далее, можно получить или по аналогии со способами, описанными в разделе Получения или обычными способами синтеза, в соответствии со стандартными учебниками по органической химии или предшествующей литературой из легкодоступных исходных веществ, используя соответствующие реагенты и условия реакций. Кроме того, специалисты в данной области техники знают варианты и альтернативы этих способов, описанных ниже в разделах Примеры и Получения, которые позволяют получить соединения, определяемые формулой(I). Фармацевтически и ветеринарно приемлемые основные соли соединений формулы (I) можно также получить обычным образом. Например, раствор гидроксамовой кислоты обрабатывают соответствующим основанием, или неразбавленным или в подходящем растворителе, и полученную в результате соль выделяют 13 или фильтрацией или выпариванием в вакууме реакционного растворителя. Фармацевтически или ветеринарно приемлемые соли, образованные присоединением кислоты, можно получить аналогичным образом путем обработки раствора основного соединения формулы (I) соответствующей кислотой. Оба типа соли можно получать или превращать друг в друга, применяя методики ионообменной смолы. Биологические активности соединений по настоящему изобретению определяют следующими способами тестирования, которые основаны на способности соединений ингибировать расщепление МПМ 1, 2, 3, 9, 13 и 14 различных флуорогенных пептидов. Анализы для МПМ 2, 3, 9 и 14 основаны на оригинальном протоколе, описанном в FEBS,1992, 296, 263 с небольшими модификациями,описанными ниже. Ингибирование МПМ-1 Приготовление фермента Каталитический домен МПМ-1 был получен в центральных исследовательских лабораториях компании Pfizer. Готовый раствор МПМ 1 (1 мкМ) активировали добавлением ацетата аминофенилртути (ААФР) при конечной концентрации 1 мМ в течение 20 мин при 37 С. МПМ-1 затем разводили в буфере для анализа Трис-НСl (50 мМ Трис, 200 мМ NaCl, 5 мМ СаСl2, 20 мкМ ZnSO4 и 0,05% Brij 35, рН 7,5) до концентрации 10 нМ. Конечная концентрация использованного в анализе фермента составляла 1 нМ. Субстрат Флуорогенный субстрат, который применяли в этом анализе, представлял собой ДНФПроциклогексил-Ала-Гли-Цис(Метил)-ГисАла-Лиз-(N-Метил-Ала)-NН 2, как первоначально описано в Anal. Biochem., 1993, 212, 58. Конечная концентрация субстрата, использованного в анализе, составляла 10 мкМ. Определение ингибирования фермента Тестируемое соединение растворяли в диметилсульфоксиде и разбавляли буфером для анализа, так чтобы содержание диметилсульфоксида составляло не более 1%. Тестируемое соединение и фермент добавляли в каждую лунку 96-луночного планшета и дали возможность уравновешиваться в течение 15 мин при 37 С в орбитальном вибраторе перед добавлением субстрата. Планшеты затем инкубировали в течение 1 ч при 37 С перед определением флуоресценции (расщепление субстрата), применяя флуориметр (Fluostar; BMG Lab Technologies,Aylesbury, UK) при длине волны возбуждения 355 нм и длине волны излучения 440 нм. Силу ингибирования определяли по величине расщепления субстрата, которую получали, используя ряд концентраций тестируемого соединения, и по полученной в результате кривой доза-ответ рассчитывали величину ИК 50 (концентрация 14 ингибитора, которая требуется для ингибирования 50% активности фермента). Ингибирование МПМ-2, МПМ-3 и МПМ-9 Получение фермента Каталитические домены МПМ-2, МПМ-3 и МПМ-9 были получены в центральных исследовательских лабораториях компании Pfizer. Готовый раствор МПМ-2, МПМ-3 или МПМ-9(1 мкМ) активировали добавлением ААФР. Для МПМ-2 и МПМ-9 добавляли ААФР до конечной концентрации 1 мМ, затем инкубировали в течение 1 ч при 37 С. МПМ-3 активировали добавлением 2 мМ ААФР, с последующим инкубированием в течение 3 ч при 37 С. Ферменты затем разводили в буфере для анализа ТрисНСl (100 мМ Трис, 100 мМ NaCl, 10 мМ СаСl2,и 0,16% Brij 35, рН 7,5) до концентрации 10 нМ. Конечная концентрация использованного в анализе фермента составляет 1 нМ. Субстрат Флуорогенный субстрат, который применяли при этом скриннинге, представлял собой Мса-Арг-Про-Лиз-Про-Тир-Ала-Норвалин-ТриМет-Лиз(ДНФ)-NН 2 (Bachem Ltd., Essex, Великобритания) как первоначально описано в J.Biol. Chem., 1994, 269, 20952. Этот субстрат выбран, потому что он обладает сбалансированной скоростью гидролиза в отношении МПМ 2, 3 и 9(kcat/km составляет 54000, 59400 и 55300 с-1 М-1 соответственно). Конечная концентрация использованного в анализе субстрата, составляла 5 мкМ. Определение ингибирования фермента Тестируемое соединение растворяли в диметилсульфоксиде и разбавляли буфером для анализа, так чтобы содержание диметилсульфоксида составляло не более 1%. Тестируемое соединение и фермент добавляли в каждую лунку 96-луночного планшета и давали возможность уравновешиваться в течение 15 мин при 37 С в орбитальном вибраторе перед добавлением субстрата. Планшеты затем инкубировали в течение 1 ч при 37 С перед определением флуоресценции с применением флуориметра(Fluostar; BMG Lab Technologies, Aylesbury, UK) при длине волны возбуждения 328 нм и длине волны излучения 393 нм. Силу ингибирования определяли по величине расщепления субстрата, которую получали, используя ряд концентраций тестируемого соединения, и по полученной в результате кривой доза-ответ рассчитывали величину ИК 50 (концентрация ингибитора,которая требуется для ингибирования 50% активности фермента). Ингибирование МПМ-13 Получение фермента Рекомбинантная МПМ-13 человека получена PanVera Corporation (Madison, Wisconsin) и описана в центральных исследовательских лабораториях компании Pfizer. Готовый раствор концентрации 1,9 мг/мл активировали 2 мМ ААФР в течение 2 ч при 37 С. МПМ-13 затем 15 разводили в буфере для анализа (50 мМ Трис,200 мМ NaCl, 5 мМ СаСl2, 20 мкМ ZnCl2 и 0,02% Brij 35, рН 7,5) до концентрации 5,3 нМ. Конечная концентрация использованного в анализе фермента составляла 1,3 нМ. Субстрат Флуорогенный субстрат, который применяли при этом скриннинге, представлял собой ДНФ-Про-циклогексиламин-Гли-Цис(Мет)-ГисАла-Лиз(NМА)-NН 2. Конечная концентрация субстрата, использованного в анализе, составляла 10 мкМ. Определение ингибирования фермента Тестируемое соединение растворяли в диметилсульфоксиде и разводили буфером для анализа, так чтобы содержание диметилсульфоксида составляло не более 1%. Тестируемое соединение и фермент добавляли в каждую лунку 96-луночного планшета. Добавление субстрата в каждую лунку инициировало реакцию. Интенсивность флуоресценции определяли, используя флуориметр для 96-луночных планшетов (Cytofluor II; PerSeptive Biosystems, Inc.,Framingham, MA) при длине волны возбуждения 360 нм и длине волны излучения 460 нм. Силу ингибирования определяли по величине расщепления субстрата, которую получали, используя ряд концентраций тестируемого соединения, и по полученной в результате кривой доза-ответ рассчитывали величину ИК 50 (концентрация ингибитора, которая требуется для ингибирования 50% активности фермента). Ингибирование МПМ-14 Получение фермента Каталитический домен МПМ-14 был получен в центральных исследовательских лабораториях Pfizer. Готовый раствор фермента концентрации 10 мкМ активировали в течение 20 мин при 25 С, после добавления трипсина(Sigma, Dorset, UK) в концентрации 5 мкг/мл. Активность трипсина затем нейтрализовали добавлением ингибитора соевого трипсина(Sigma, Dorset, UK) в концентрации 50 мкг/мл перед разбавлением этого готового раствора фермента в буфере для анализа Трис-НСl (100 мМ Трис, 100 мМ NaCl, 10 мМ CaCl2, 0,16% Brij 35, рН 7,5) до концентрации 10 нМ. Конечная концентрация фермента, использованного в анализе, составляла 1 нМ. Субстрат Флуорогенный субстрат, использованный при этом скриннинге, представлял собой МсаПро-Лей-Гли-Лей-дифениламин-Ала-Арг-NH2(Bachem Ltd., Essex, UK) как первоначально описано в J. Biol. Chem., 1996, 271, 17119. Определение ингибирования фермента Проводили, как описано для МПМ 2, 3 и 9. При терапии человека соединения формулы (I), их фармацевтически приемлемые соли и фармацевтически приемлемые сольваты любого из них можно вводить отдельно, но, как правило, их нужно вводить в смеси с фармацевтиче 002882 16 ским носителем, который выбирают в соответствии с предполагаемым путем введения и общепринятой фармацевтической практикой. Их можно вводить перорально в форме таблеток, содержащих такие эксципиенты, как крахмал или лактоза, или в капсулах, или овулях, отдельно или в смеси с эксципиентами, или в форме эликсиров, растворов или суспензий,содержащих корригенты или красители. Их также можно вводить путем инъекции, например, внутривенно, внутримышечно или подкожно, и лучше всего примененять в форме стерильного водного раствора, который может содержать другие вещества, например соли или моносахариды, чтобы сделать раствор изотоническим по отношению к крови. Для других путей парентерального введения, как, например,трансбуккального или сублингвального, их можно вводить в форме таблеток или лепешек,которые можно приготовить обычным способом. В дополнение, соединения и их соли можно вводить местно в форме стерильных кремов,гелей, суспензий, лосьонов, мазей, присыпок,спреев, повязок, содержащих лекарство, или посредством кожных пластырей. Например, их можно включать в крем, состоящий из водной или масляной эмульсии полиэтиленгликолей или жидкого парафина, или их можно включать в мазь, состоящую мягкой парафиновой основы из белого воска, или в виде гидрогеля с целлюлозой или производными полиакрилатов или другими модификаторами вязкости, или в виде сухого порошка или жидкого спрея или аэрозоля со смесью бутан/пропан, пропеллентами HFA или хлорфторуглеродным, или в виде повязки,содержащей лекарство либо в виде сетчатого перевязочного материала с белым мягким парафином, либо марлевых повязок, пропитанных полиэтиленгликолем, либо гидрогелевых, гидроколлоидных, альгинатных, или пленчатых повязок. Кроме того, соединения и соли можно вводить внутриглазно в виде глазных капель с подходящими буферами, модификаторами вязкости (например, производными целлюлозы),консервантами (например, бензалконийхлоридами (БАХ и агентами для регулирования осмотического давления (например с хлоридом натрия). Все такие препараты могут также содержать стабилизирующие вещества и консерванты. В зависимости от пути введения пациентучеловеку, уровень суточной дозировки соединений формулы (I) и их солей может составлять от 0,001 до 20 мг/кг, в виде разовой или разделенных доз. Таким образом, например, таблетки или капсулы могут содержать от 0,02 до 500 мг активного соединения для введения по одной,две или более чем две одновременно по обстоятельствам. 17 Врач должен определить текущую дозировку, которая будет наиболее подходящей для отдельного пациента и которая будет изменяться с возрастом, весом и реакцией конкретного пациента. Приведенные выше дозировки являются иллюстративными для среднего случая; конечно, могут быть отдельные случаи, где адекватны большие или меньшие диапазоны дозировок, и такие входят в объем этого изобретения. Для ветеринарного использования соединение формулы (I), или его ветеринарно приемлемая соль, или ветеринарно приемлемый сольват любого из них вводят в виде соответственно приемлемого препарата в соответствии с обычной ветеринарной практикой и ветеринарный хирург определит схему приема лекарства и путь введения, который будет наиболее подходящим для конкретного животного. Таким образом, данное изобретение предлагает фармацевтическую композицию, содержащую соединение формулы (I), или его фармацевтически приемлемую соль, или фармацевтически приемлемый сольват любого из них вместе с фармацевтически приемлемым разбавителем или носителем. Также изобретение предлагает ветеринарный препарат, содержащий соединение формулы (I), или его ветеринарно приемлемую соль,или ветеринарно приемлемый сольват любого из них вместе с ветеринарно приемлемым разбавителем или носителем. Данное изобретение также предлагает соединение формулы (I), или его фармацевтически приемлемую соль, или фармацевтически приемлемый сольват любого из них, или фармацевтическую композицию, содержащую любое из вышеуказанных, для применения в качестве лекарства для людей. Кроме того, изобретение предлагает соединение формулы (I), или его ветеринарно приемлемую соль, или ветеринарно приемлемый сольват любого из них, или ветеринарный препарат, содержащий любое из вышеуказанных, для применения в качестве лекарства для животных. В еще одном аспекте, данное изобретение предлагает применение соединения формулы(I), или его фармацевтически приемлемой соли,или фармацевтически приемлемого сольвата любого из них для изготовления лекарства для людей для целительного или профилактического лечения медицинского состояния, для которого показан ингибитор МПМ. Изобретение также предлагает применение соединения формулы (I), или его ветеринарно приемлемой соли, или ветеринарно приемлемого сольвата любого из них для изготовления лекарства для животных для целительного или профилактического лечения медицинского состояния, для которого показан ингибитор МПМ. 18 Кроме того, данное изобретение предлагает применение соединения формулы (I), или его фармацевтически приемлемой соли, или фармацевтически приемлемого сольвата, содержащего любого из них для изготовления лекарства для людей для целительного или профилактического лечения перфорации атеросклеротических бляшек, инфаркта миокарда, сердечной недостаточности, рестеноза, удара, периодонтального заболевания, изъязвления тканей, заживления ран, кожных заболеваний, ракового метастаза,опухолевого ангиогенеза, возрастной дегенерации желтого пятна, фиброзного заболевания,ревматоидного артрита, остеоартрита и воспалительных заболеваний, обусловленных мигрирующими воспалительными клетками. Кроме того, данное изобретение предлагает применение соединения формулы (I), или его ветеринарно приемлемой соли, или ветеринарно приемлемого сольвата; содержащего любого из них, для изготовления лекарства для животных для целительного или профилактического лечения перфорации атеросклеротических бляшек,инфаркта миокарда, сердечной недостаточности, рестеноза, удара, периодонтального заболевания, изъязвления тканей, заживления ран,кожных заболеваний, ракового метастаза, ангиогенеза при опухолях, возрастной дегенерации желтого пятна, фиброзного заболевания,ревматоидного артрита, остеоартрита и воспалительных заболеваний, обусловленных мигрирующими воспалительными клетками. Дополнительно, данное изобретение предлагает способ лечения или предотвращения медицинского состояния, для которого показан ингибитор МПМ, у млекопитающего (включая человека), при котором указанному млекопитающему вводят терапевтически эффективное количество соединения формулы (I), или его фармацевтически или ветеринарно приемлемой соли, или фармацевтически или ветеринарно приемлемого сольвата любого из них, или фармацевтической композиции или ветеринарного препарата, содержащих любое из вышеуказанных. Также, данное изобретение предлагает способ лечения или предотвращения перфорации атеросклеротических бляшек, инфаркта миокарда, сердечной недостаточности, рестеноза, удара, периодонтального заболевания, изъязвления тканей, заживления ран, кожных заболеваний, ракового метастаза, ангиогенеза при опухолях, возрастной дегенерации желтого пятна, фиброзного заболевания, ревматоидного артрита, остеоартрита и воспалительных заболеваний, обусловленных мигрирующими воспалительными клетками, у млекопитающего(включая человека), при котором указанному млекопитающему вводят терапевтически эффективное количество соединения формулы (I),или его фармацевтически или ветеринарно приемлемой соли, или фармацевтически или вете 19 ринарно приемлемого сольвата любого из них,или фармацевтической композиции или ветеринарного препарата, содержащих любое из вышеуказанных. Данное изобретение также включает в себя любые новые промежуточные соединения, описанные здесь, например, промежуточные соединения формулы (II). Синтез соединения по изобретению и промежуточных соединений для использования здесь иллюстрируют следующие примеры и получения. Комнатная температура означает температуру от 20 до 25 С. Флэш-хроматография относится к колоночной хроматографии на силикагеле (Kiesegel 60, 230-400 меш). Точки плавления нескорректированы. Спектры 1 Н ядерного магнитного резонанса (ЯМР) были записаны с использованием спектрометров Bruker АС 300, Variant Unitylnova-300 или Variant Unity Inova-400, и во всех случаях соответствовали предполагаемым структурам. Характеристические химические сдвигипредставлены в миллионных долях относительно тетраметилсилана с применением обычных сокращений для обозначения основных пиков: например, s синглетный; d, дуплетный; t, триплетный; q, квартетный; m, мультиплетный; br, широкий. Масс-спектры записаны с использованием масс-спектрометра Finnigan Mat. TSQ 7000 илиFisons Instruments Trio 1000. MCHP обозначает масс-спектр низкого разрешения и рассчитываемые и наблюдаемые приведенные ионы относятся к изотопной композиции с наименьшей массой. Пример 1. N-Гидрокси-2-[4-(4-фенилфенил)-1,2,3,6-тетрагидропиридин-1-ил-сульфонил]ацетамид. Карбонат калия (207 мг, 1,5 ммоль) добавляют к перемешиваемой смеси соединения, указанного в заголовке получения 8 (186 мг, 0,5 ммоль), гидрохлорида гидроксиламина (104 мг,1,5 ммоль), тетрагидрофурана (2 мл) и метанола(3 мл). Реакционную смесь нагревают с обратным холодильником в течение 20 ч, дают охладиться, разбавляют водой (15 мл) и этилацетатом (10 мл) и подкисляют концентрированной соляной кислотой. Эту смесь затем быстро нагревают при 100 С, дают охладиться и фильтруют. Полученное таким образом вещество последовательно промывают водой и этилацетатом, затем сушат под вакуумом с получением указанного в заголовке соединения (125 мг,67%) в виде бесцветного твердого вещества,т.пл. 216-218 С. Обнаружено: С 61,05; Н 5,35; N 7,41. С 19 Н 20N2O4S требует С 61,27; Н 5,41; N 7,52 %.(m, 4 Н), 9,22 (s, 1H), 10,82 (s,1H). МСНР (ХИАД (химическая ионизация под атмосферным давлением: 373 (М+Н)+. Пример 2. N-Гидрокси-2-[4-(3-метил-4-фенилфенил)-1,2,3,6-тетрагидропиридин-1-илсульфонил]ацетамид. Получают в виде бесцветного твердого вещества (58%), т.пл. 190-191 С, из соединения,указанного в заголовке получения 9, применяя способ примера 1. Обнаружено: С 62,05; Н 5,74; N 7,12.(М+Н)+. Пример 3. N-Гидрокси-2[4-(4-фенилфенил) пиперидин-1-илсульфонил]ацетамид. Получают в виде бесцветного твердого вещества (62%), т.пл. 200-201 С, из соединения,указанного в заголовке получения 10, применяя способ примера 1. Обнаружено: С 60,96; Н 5,86; N 6,97.(М+Н)+. Пример 4. N-Гидрокси-2-(4-Фенил-1,2,3,6 тетрагидропиридин-1-илсульфонил)ацетамид. Получают в виде бесцветного твердого вещества (76%), т.пл. 175 -176 С, из соединения, указанного в заголовке получения 11, применяя способ примера 1. Обнаружено: С 52,41; Н 5,39; N 9,35.(s, 2H), 3,95 (m, 2H), 6,18 (brs, 1 Н), 7,23-7,48 (m,5 Н), 9,20 (s, 1 Н), 10,80 (s, 1H). Пример 5. N-Гидрокси-2-(4-фенилпиперидин-1-илсульфонил)ацетамид. Получают в виде бесцветного твердого вещества (44%), т.пл. 185 -187 С, из соединения, указанного в заголовке получения 12, применяя способ примера 1. Обнаружено: С 52,08; Н 6,04; N 9,23.(ДМСОd6): 1,62 (m, 2H), 1,82 (m, 2H), 2,62 (m,1H), 2,98 (t, 2H), 3,70 (m, 2H), 3,84 (s, 2H), 7,15 7,33 (m, 5H), 9,20 (s, 1H), 10,78 (s, 1H). Пример 6. N-Гидрокси-2-(4-бензилпиперидин-1-илсульфонил)ацетамид. Получают в виде бесцветного твердого вещества (35%), т.пл. 132 -135 С, из соедине 21 ния, указанного в заголовке получения 13, применяя способ примера 1. Обнаружено: С 53,66; Н 6,43; N 8,82.O-(7-Азабензотриазол-1-ил)-1,1,3,3-тетраметилуронийгексафторфосфат (100 мг, 0,26 ммоль) добавляют к перемешиваемому раствору соединения, указанного в заголовке получения 15 (70 мг, 0,18 ммоль), и N-этилдиизопропиламина (0,03 мл, 0,18 ммоль) в безводном диметилформамиде (1 мл) в атмосфере азота при комнатной температуре. Через 15 мин добавляют раствор гидрохлорида гидроксиламина (37 мг, 0,53 ммоль) и N-этилдиизопропиламина (0,12 мл, 0,7 ммоль) в безводном диметилформамиде (0,5 мл) и реакционную смесь перемешивают в течение 20 ч, затем реакционную смесь распределяют между этилацетатом и водным фосфатным буфером (рН 7). Органическую фазу отделяют, промывают водой, сушат (МgSO4) и выпаривают при пониженном давлении, затем остаток очищают флэш-хроматографией, применяя в качестве элюента смесь дихлорметан : метанол (97:3), с получением указанного в заголовке соединения(55 мг) в виде бесцветного аморфного твердого вещества.(М+Н)+. Пример 8. N-Гидрокси-2(R,S)-[4-(3-метил 4-фенилфенил)-1,2,3,6-тетрагидропиридин-1-ил сульфонил]пент-4-енамид. Получают в виде твердого вещества (13%) из соединения, указанного в заголовке получения 17, применяя способ примера 7, но с элюционным градиентом дихлорметан : метанол (от 100:0 до 90:10) для стадии хроматографической очистки.MCHP (ХИАД): 427 (М+Н)+. Пример 9. N-Гидрокси-5-фенил-2(R,S)-[4(4-фенилфенил)-1,2,3,6-тетрагидропиридин-1-ил сульфонил]пентанамид. Получают в виде бесцветного твердого вещества (35%), т.пл. 150 С (с разлож.), из соединения, указанного в заголовке получения 18, 002882 22 применяя способ примера 1.(ДМСОd6): 1,50(М+Н)+. Пример 10. N-Гидрокси-2-метил-2-[4-(4 фенилфенил)-1,2,3,6-тетрагидропиридин-1-ил сульфонил]пропанамид. Получают в виде аморфного твердого вещества (41%) из соединения, указанного в заголовке получения 19, применяя способ примера 7.(ДМСОd6): 1,50 (s, 6 Н), 2,66 (m, 2H), 3,50(m, 2 Н), 4,00 (m, 2H), 6,10 (brs, 1H), 7,30-7,70 (m,9H), 9,00 (s, 1H), 10,78 (s, 1H). Пример 11. N-Гидрокси-1-[4-(3-метил-4 фенилфенил)-1,2,3,6-тетрагидропиридин-1-илсульфонил]циклопентанкарбоксамид. Получают в виде твердого вещества (44%) из соединения, указанного в заголовке получения 21, применяя способ примера 7, но со смесью дихлорметан : метанол (99:1) в качестве элюента для стадии хроматографической очистки.(s, 3H), 2,37 (m, 2H), 2,48 (m, 2H), 2,62 (m, 2H),3,60 (t, 2H), 4,05 (m, 2H), 6,02 (brs, 1H), 7,20 7,43 (m, 8H). Пример 12. N-Гидрокси-2-этил-2-[4-(4 фенилфенил)-1,2,3,6-тетрагидропиридин-1-сульфонил]бутанамид. Получают в виде твердого вещества (56%) из соединения, указанного в заголовке получения 23, применяя способ примера 7.(ДМСО 6): 0,90 (m, 6H), 1,95-2,13 (m, 4H),2,52 (m, 2H), 3,48 (m, 2H), 3,98 (m, 2H), 6,10 (brs,1H), 7,35 (m, 1H), 7,44 (m, 2H), 7,52 (m, 2H), 7,64N-Гидрокси-2(R,S)-[4-(4 фенилфенил)-1,2,3,6-тетрагидропиридин-1-илсульфонил]гексанамид Получают в виде бесцветного твердого вещества (72%), т.пл. 186 -189 С, из соединения, указанного в заголовке получения 25, применяя способ примера 7, но с 1-метилпирролидин-2-оном в качестве реакционного растворителя и с кристаллизацией из смеси диизопропиловый эфир : этилацетат, а не флешхроматографией, в качестве способа очистки. Обнаружено: С 63,03; Н 6,60; N 6,43. С 23 Н 28N2O4S; 0,50 Н 2O требует С 63,13; Н 6,68; 23 Пример 14. N-Гидрокси-4-метил-2(R,S)-[4(4-фенилфенил)-1,2,3,6-тетрагидропиридин-1 илсульфонил]пент-4-енамид. Получают в виде бесцветного твердого вещества (33%), т.пл. 170 -171 С, из соединения, указанного в заголовке получения 27, применяя способ примера 7, но с элюцонным градиентом дихлорметан : метанол (от 100:0 до 98:2) для стадии хроматографической очистки.(ДМСОd6): 1,65 (s, 3 Н), 2,40 -2,80 (m, 4 Н),3,52 (m, 2H), 3,90 (dd, 1 Н), 4,00 (m, 2H), 4,70 (s,1H), 4,78 (s, 1H), 6,23 (brs, 1H), 7,35 (m, 1H), 7,44(m, 2H), 7,52 (d, 2H), 7,65 (m, 4H), 9,22 (s, 1H),10,85 (s, 1H). МСНР (ХИAД): 427 (М+Н)+. Пример 15. N-Гидрокси-2(R,S)-метил-2-[4(3-метил-4-фенилфенил)-1,2,3,6-тетрагидропиридин-1-илсульфонил]пент-4-енамид. Получают в виде бесцветной смолы (20%) из соединения, указанного в заголовке получения 29, применяя способ примера 7, но с элюционным градиентом дихлорметан : метанол (от 100:0 до 98:2 до 95:5) для стадии хроматографической очистки.(CDCl3): 1,60 (s, 3 Н), 2,28 (s, 3 Н), 2,64 (m,3H), 3,00 (m, 1H), 3,62 (m, 2H), 4,10 (m, 2H), 5,21(m, 8H). МСНР (ХИАД): 441 (М+Н)+. Пример 16. N-Гидрокси-2-[3-(4-фенилфенокси)азетидин-1-илсульфонил]ацетамид. Получают в виде бесцветного тврдого вещества (66%) из соединения, указанного в заголовке получения 32, применяя способ примера 1.(ДМСО): 4,03 (s, 2H), 4,05 (dd, 2H),5,09 (m, 1H), 6,94 (d, 2H), 7,30 (m, 1H), 7,40 (m,2H), 7,60 (m, 4H), 9,25 (s, 1H), 10,80 (brs, 1H). МСНР(М+Н)+. Пример 17. N-Гидрокси-2-4-[4-(3-этоксифенил)-3-метилфенил]-1,2,3,6-тетрагидропиридин-1-илсульфонилацетамид. Карбонат калия (406 мг, 3 ммоль) добавляют к перемешиваемой смеси соединения, указанного в заголовке получения 41 (429 мг, 1 ммоль), гидрохлорида гидроксиламина (212 мг,3 ммоль) и метанола (20 мл). Реакционную смесь нагревают с обратным холодильником в течение приблизительно 6 ч, дают охладиться и распределяют между этилацетатом и 1 М соляной кислотой. Отделенную органическую фазу сушат (MgSO4) и выпаривают при пониженном давлении, затем остаток растирают в порошок с диизопропиловым эфиром, и кристаллизуют из этилацетата с получением указанного в заголовке соединения (148 мг, 34%) в виде бесцветного твердого вещества, т.пл. 151 - 153 С. Обнаружено: С 61,01; Н 6,04; N 6,48. 24 4,03 (q, 2H), 6,10 (brs, 1 Н), 6,80 - 6,95 (m, 3 Н),7,17 (d, 1H), 7,28 - 7,38 (m, 3H), 9,20 (brs, 1 Н),10,8 (brs, 1H). МСНР (ХИАД): 431 (М+Н)+. Пример 18. N-Гидрокси-2-[4-(3-метокси-4 фенилфенил)-1,2,3,6-тетрагидропиридин-1-илсульфонил]ацетамид. Карбонат калия (95 мг, 0,7 ммоль) добавляют к перемешиваемой смеси соединения, указанного в заголовке получения 45 (170 мг, 0,4 ммоль), гидрохлорида гидроксиламина (49 мг,0,7 ммоль) и метанола (3 мл). Реакционную смесь нагревают с обратным холодильником в течение приблизительно 2 ч, дают охладиться,разбавляют фосфатным буфером (15 мл) и экстрагируют этилацетатом (2 х 15 мл). Объединенные органические фазы сушат (MgSO4) и выпаривают при пониженном давлении, затем остаток растирают в порошок с этилацетатом с получением указанного в заголовке соединения(50 мг, 30%) в виде бесцветного твердого вещества, т.пл. 175 -177 С. Обнаружено: С 58,84; Н 5,51; N 6,70. C20H20N2O5S; 0,10 CH2Cl2 требует С 58,75; Н 5,45; N 6,82%.(ДМСОd6): 2,63 (m,2H), 3,50 (t, 2H), 3,80 (s, 3H), 3,93 (s, 2H), 3,99 (s,2H), 6,27 (s, 1H), 7,10 (d, 1H), 7,16 (s, 1H), 7,27O-(7-Азабензотриазол-1-ил)-1,1,3,3-тетраметилуронийгексафторфосфат (274 мг, 0,72 ммоль) добавляют к перемешиваемому раствору соединения, указанного в заголовке получения 50 (200 мг, 0,48 ммоль), и N-этилдиизопропиламина (0,08 мл, 0,48 ммоль) в безводном диметилформамиде (4 мл) в атмосфере азота при комнатной температуре. Через 15 мин добавляют гидрохлорид гидроксиламина (100 мг, 1,44 ммоль) и N-этилдиизопропиламин (0,33 мл, 1,9 ммоль) и реакционную смесь перемешивают в течение приблизительно 3 ч, затем реакционную смесь распределяют между этилацетатом и водным фосфатным буфером (рН 7). Органическую фазу отделяют, промывают водой, сушат(MgSO4) и выпаривают при пониженном давлении, затем остаток растирают в порошок с диизопропиловым эфиром с получением указанного в заголовке соединения (71 мг, 36%) в виде бесцветного аморфного твердого вещества, т.пл. 156 -158 С. Обнаружено: С 60,80; Н 6,17; N 6,25. С 22 Н 26N2O5S; 0,10 Н 2 О требует С 61,12; Н 6,11; N 6,48%.(ДМСОd6): 1,51 (s, 6H), 2,57 (m, 2H), 3,43 25 МСНР (ХИАД): 431 (М+Н)+. Пример 20. N-Гидрокси-2-[4-(3-фтор-4 фенилфенил)-1,2,3,6-тетрагидропиридин-1-илсульфонил]ацетамид. Получают в виде бесцветного твердого вещества (40%), т. пл. 184 -188 С, из соединения, указанного в заголовке получения 47, применяя способ примера 1. Обнаружено: С 58,39; Н 4,90; N 6,84. C19H19FN2O4S требует С 58,45; Н 4,91; N 7,17%. 6 (ДМСОd6): 2,61 (m, 2H), 3,47 (t,2H), 3,94 (s, 2H), 4,00 (s, 2H), 6,35 (brs, 1H), 7,337,60 (m, 8H), 9,23 (brs, 1H), 10,80 (brs, 1H). МСНР(M+NH4)+. Пример 21. N-Гидрокси-2-4-[4-(3-этоксифенил)фенил]-1,2,3,6-тетрагидропиридин-1-илсульфонилацетамид. Получают в виде бесцветного твердого вещества (76%), т.пл. 168-170 С, из соединения,указанного в заголовке получения 56, применяя способ примера 1.(ДМСОd6): 1,34 (t, 3 Н), 2,61 (m, 2H), 3,49(M+NH4)+. Пример 22. N-Гидрокси-2-4-[4-(3-метоксифенил)-3-метилфенил]-1,2,3,6-тетрагидропиридин-1-илсульфонилацетамид. Получают в виде бесцветного твердого вещества (76%), т.пл. 162-165 С, из соединения,указанного в заголовке получения 61, применяя способ примера 1. Обнаружено: С 60,26; Н 5,86;(brs, 1H), 6,83 - 6,94 (m, 3 Н), 7,18 (d, 1H), 7,277,39 (m, 3 Н), 9,22 (brs, 1H), 10,80 (brs, 1H). МСНР (ХИАД): 416 (М)+. Пример 23. N-Гидрокси-2-4-[4-(3-этилфенил)-3-метилфенил]-1,2,3,6-тетрагидропиридин 1-илсульфонилацетамид. Получают в виде бесцветного твердого вещества (58%), т.пл. 151-154 С, из соединения,указанного в заголовке получения 63, применяя способ примера 1. Обнаружено: С 62,75; Н 6,24; N 6,26. 26 Получают в виде бледно-желтого твердого вещества (47%), т.пл. 160 -170 С, из соединения, указанного в заголовке получения 65, применяя способ примера 19.(ДМСОd6): 1,93 (m, 2 Н), 2,23 (s, 3 Н), 2,39(m, 2H), 2,43 (m, 2H), 3,20 (t, 2H), 3,49 (m, 2H),3,77 (s, 3 Н), 3,86 (m, 2H), 4,00 (m, 2H), 6,16 (brs,1H), 6,83-6,94 (m, 3 Н), 7,17 (d, 1H), 7,36 (m, 3 Н),9,21 (brs, 1H), 11,00 (brs, 1H). МСНР (ХИАД) 487 (М+Н)+. Пример 25. N-Гидрокси-4-4-[4-(3-метоксифенил)-3-метилфенил]пиперидин-1-илсульфонилтетрагидропиран-4-карбоксамид. Получают в виде белого твердого вещества(82%), т.пл. 200 - 202 С, из соединения, указанного в заголовке получения 67, применяя способ примера 19, за исключением того, что остаток кристаллизуют из метанола. Обнаружено: С 60,02; Н 6,78; N 5,45. С 25 Н 32N2O6S; СН 3 ОН требует С 59,98; Н 6,97; N 5,38%.(t, 1H), 9,16 (brs, 1H), 10,97 (brs, 1H). МСНР (ХИАД) 489 (М+Н)+. Пример 26. N-Гидрокси-2-4-[3-метокси-4(3-метоксифенил)фенил]пиперидин-1-илсульфонил-2-метилпропанамид. Получают в виде белого твердого вещества(47%), т.пл. 161-163 С, из соединения, указанного в заголовке получения 74, применяя способ примера 19, за исключением того, что остаток очищают флэш-хроматографией, используя смесь дихлорметан : метанол : концентрированный водный раствор аммиака (90:10:1) в качестве элюента. Обнаружено: С 59,39; Н 6,58; N 6,13. С 23 Н 30N2O6S требует С 59,72; Н 6,54; N 6,06 %.(ДМСОd6): 1,49 (s, 6H), 1,64 (m, 2H),1,81 (m, 2H), 2,70 (m, 1H), 3,06 (t, 2H), 3,75 (s,8H), 6,87 (m, 2H), 6,98 (m, 3 Н), 7,20 (d, 1H), 7,27(M+NH4)+. Пример 27. N-Гидрокси-2-4-[4-(3-этоксифенил)-3-метоксифенил]пиперидин-1-илсульфонил-2-метилпропанамид. Получают в виде белого твердого вещества(39%), т.пл. 134-136 С, из соединения, указанного в заголовке получения 77, применяя способ примера 26. Обнаружено: С 60,60; Н 6,80; N 5,82. С 24 Н 32N2 О 6S требует С 60,48; Н 6,77; N 5,88%. 27 Пример 28. N-Гидрокси-4-4-[4-(3-этоксифенил)-3-метилфенил]-1,2,3,6-тетрагидропиридин-1-илсульфонилтетрагидропиран-4-карбоксамид. Получают в виде бесцветного твердого вещества (87%), т.пл. 152 -154 С, из соединения, указанного в заголовке получения 79, применяя способ примера 19. Обнаружено: С 61,99; Н 6,47; N 5,54. С 26 Н 32N2O6S требует С 62,38; Н 6,44; N 5,60%.(ДМСОd6): 1,33 (t, 3 Н), 1,93 (m, 2H), 2,24(s, 3H), 2,40 (d, 2H), 2,52 (m, 2H), 3,21 (dd, 2H),3,50 (m, 2H), 3,88 (m, 2H), 3,98 - 4,10 (m, 4H),6,18 (brs, 1H), 6,80 - 6,95 (m, 3H), 7,18 (d, 1H),7,26 - 7,37 (m, 3H), 9,22 (brs, 1H), 11,05 (brs, 1H). МСНР (ХИАД): 501 (М+Н)+. Пример 29. N-Гидрокси-4-4-[4-(3-этоксифенил)-3-метилфенил]пиперидин-1-илсульфонилтетрагидропиран-4-карбоксамид. Палладий на сульфате бария (5%, 5 мг) добавляют к перемешиваемому раствору соединения, указанного в заголовке примера 28 (50 мг,0,1 ммоль) в смеси 1,2-диметоксиэтана (1 мл) и метанола (3 мл), затем реакционную смесь гидрируют при давлении 345 кПа (50 фунт/дюйм 2) в течение приблизительно 20 ч. Добавляют дополнительную порцию палладия на сульфате бария (5%, 5 мг) и гидрирование продолжают в течение следующих 20 ч. Катализатор удаляют путем фильтрации, растворитель выпаривают при пониженном давлении и остаток кристаллизуют из смеси простой эфир - гексан с получением указанного в заголовке соединения (34 мг,66%) в виде бесцветного твердого вещества,т.пл. 165-167 С. Обнаружено: С 60,81; Н 6,76; N 5,35. С 26 Н 34N2O6S; 0,50 H2O требует С 61,03; Н 6,89;(М+NH4)+. Пример 30. N-Гидрокси-2-4-[4-(3-этоксифенил)-3-метилфенил]-1,2,3,6-тетрагидропиридин-1-илсульфонил-2-метилпропанамид. Получают в виде бесцветного твердого вещества (33%), т.пл. 116-118 С, из соединения,указанного в заголовке получения 81, применяя способ примера 19. Обнаружено: С 62,52; Н 6,47; N 6,00.(М+Н)+. Пример 31. N-Гидрокси-2-4-[4-(3-этоксифенил)-3-метилфенил]пиперидин-1-илсульфонилацетамид. Получают в виде бесцветного твердого вещества (48%), т.пл. 179 -180 С, (кристаллизуют из диизопропилового эфира) из соединения, указанного в заголовке получения 82, применяя способ примера 17. Обнаружено: С 60,72; Н 6,49; N 6,36. С 22 Н 28N2O5S требует С 61,09; Н 6,53; N 6,48%.(ДМСОd6): 1,31 (t, 3H), 1,68 (m, 2H); 1,86(М+Н)+. Пример 32. N-Гидрокси-2-4-[4-(3-этоксифенил)-3-метилфенил]пиперидин-1-илсульфонил-2-метилпропанамид. Получают в виде бесцветного твердого вещества (53%), т.пл. 172 -174 С, (кристаллизуют из диизопропилового эфира) из соединения, указанного в заголовке получения 84, применяя способ примера 19. Обнаружено: С 62,20; Н 6,99; N 6,02.(m, 2H), 1,79 (m, 2H), 2,20 (s, 3H), 2,65 (m, 1H),3,05 (m, 2H), 3,75 (m, 2H), 4,03 (q, 2H), 6,80 6,90 (m, 3H), 7,08 - 7,18 (m, 3H), 7,30 (dd, 1H),8,98 (brs, 1H), 10,75 (brs, 1H). МСНР (ХИАД): 461 (М+Н)+. Пример 33. N-Гидрокси-2-4-[3-метил-4(пиридин-2-ил)фенил]-1,2,3,6-тетрагидропиридин-1-илсульфонилацетамид. Получают в виде бесцветного аморфного твердого вещества (50%) из соединения, указанного в заголовке получения 85, применяя способ примера 17.(ДМСОd6): 2,33 (s, 3H), 2,60 (m, 2H), 3,46(t, 2H), 3,91 (s, 2H), 3,97 (m, 2H), 6,12 (brs, 1H),7,30 - 7,40 (m, 4H), 7,50 (d, 1H), 7,84 (dd, 1H),8,63 (d, 1H), 9,20 (brs, 1H), 10,8 (brs, 1H). МСНР (ХИАД): 388 (М+Н)+. Пример 34. N-Гидрокси-2-4-[3-метил-4(пиридин-3-ил)фенил]-1,2,3,6-тетрагидропиридин-1-илсульфонилацетамид. Получают в виде бесцветного твердого вещества (57%), т.пл. 132 -136 С, из соединения, указанного в заголовке получения 86, применяя способ примера 31. 29 Пример 35. N-Гидрокси-2-4-[3-метил-4(пиридин-4-ил)фенил]-1,2,3,6-тетрагидропиридин-1-илсульфонилацетамид. Получают в виде бесцветного твердого вещества (20%), т.пл. 165-167 С, из соединения,указанного в заголовке получения 87, применяя способ примера 31.(brs, 1H), 10,8 (brs, 1H). МСНР (ХИАД): 388 (М+Н)+. Пример 36. N-Гидрокси-2-4-[4-(6-этоксипиридин-2-ил)-3-метилфенил]пиперидин-1-илсульфонил-2-метилпропанамид. Получают в виде бесцветного твердого вещества (30%), т.пл. 184 -187 С, из соединения, указанного в заголовке получения 91, применяя способ примера 19, за исключением того,что остаток очищают флэш-хроматографией,используя в качестве элюента смесь дихлорметан : этанол (98:2).(t, 1H), 9,00 (brs, 1H), 10,75 (brs, 1H). МСВР (электрораспыление положительных ионов): 462,206 (М+Н)+. Пример 37. N-Гидрокси-4-[4-(4-фенилфенил)-1,2,3,6-тетрагидропиридин-1-илсульфонил]тетрагидропиран-4-карбоксамид. Получают в виде бесцветного твердого вещества (68%), т.пл. 191-193 С, из соединения,указанного в заголовке получения 93, применяя способ примера 19, но с кристаллизацией остатка из метанола.(m, 2H), 3,20 (t, 2H), 3,48 (m, 2H), 3,85 (m, 2H),4,00 (m, 2H), 6,11 (brs, 1H), 7,35 (t, 1H), 7,44 (m,2H), 7,52 (d, 2H), 7,65 (m, 4H), 9,22 (brs, 1H),11,05 (brs, 1H). МСНР (ХИАД): 443 (М+Н)+. Пример 38. N-Гидрокси-4-4-[4-(4-этоксифенил)-3-метилфенил]-1,2,3,6-тетрагидропиридин-1-илсульфонилтетрагидропиран-4 карбоксамид. Получают в виде бесцветного твердого вещества (36%), т.пл. 159-161 С, из соединения,указанного в заголовке получения 95, применяя способ примера 19, но с кристаллизацией остатка из смеси дихлорметан-диизопропиловый эфир. 30 Пример 39. N-Гидрокси-2-4-[4-(3-гидроксиметилфенил)-3-метилфенил]-1,2,3,6-тетрагидропиридин-1-илсульфонилацетамид. Получают в виде бесцветного твердого вещества (63%), т.пл. 174-176 С (кристаллизуют из смеси метанол - диизопропиловый эфир), из соединения, указанного в заголовке получения 97, применяя способ примера 17. Обнаружено: С 60,35; Н 5,75; N 6,70.(t, 1 Н взаимозаменяемая), 6,20 (brs, 1 Н), 7,157,42 (m, 7 Н), 9,20 (brs, 1H), 10,80 (brs, 1H). МСНР (ХИАД): 417 (М+Н)+. Пример 40. N-Гидрокси-2-метил-2-4-[3 метил-4-(хинолин-3-ил)фенил]-1,2,3,6-тетрагидропиридин-1-илсульфонилпропанамид. Получают в виде бесцветного твердого вещества (51%), т.пл. 158-160 С, из соединения,указанного в заголовке получения 100, применяя способ примера 19.(t, 2H), 8,37 (s, 1H), 8,91 (s, 1H), 9,04 (brs, 1H),10,8 (brs, 1H). МСНР (ХИАД): 466 (М+Н)+. Пример 41. N-Гидрокси-2-4-[3-метил-4(3-метилтиофенил)фенил]-1,2,3,6-тетрагидропиридин-1-илсульфонилацетамид. Получают в виде бесцветного твердого вещества (17%) из соединения, указанного в заголовке получения 102, применяя способ примера 1.(m, 2H), 3,47 (t, 2H), 3,91 (s, 2H), 3,97 (s, 2H),6,22 (brs, 1H), 7,08 (d, 1H), 7,17 (m, 2H), 7,24 (d,1H), 7,34 (m, 3H), 9,22 (brs, 1H), 10,80 (brs, 1H). МСНР (ХИАД): 432 (M)+ Пример 42. N-Гидрокси-2-4-[4-(3-метоксиметилфенил)-3-метилфенил]-1,2,3,6-тетрагидропиридин-1-илсульфонилацетамид. Получают в виде бесцветного твердого вещества (28%), т.пл. 151-153 С, (кристаллизуют из смеси этилацетат - диизопропиловый эфир), из соединения, указанного в заголовке получения 104, применяя способ примера 17. Обнаружено: С 60,16; Н 6,00; N 6,28. С 22H26N2O5S; 0,10 Н 2 О требует С 60,11; Н 6,19;(М+Н)+. Пример 43. N-Гидрокси-2-4-[4-(3-[2-метоксиэтокси]фенил)-3-метилфенил]-1,2,3,6-тетрагидропиридин-1-илсульфонилацетамид. Получают в виде бесцветного твердого вещества (64%), т.пл. 158-160 С (кристаллизуют 31 из этилацетата), из соединения, указанного в заголовке получения 107, применяя способ примера 17. Обнаружено: С 59,78; Н 6,10; N 6,01. С 23 Н 28N2 О 6S требует С 59,98; Н 6,13; N 6,08%.(brs, 1H). МСНР (Терморазбрызгивание): 460 (М)+. Пример 44. N-Гидрокси-2-4-[4-(2,3-дигидробензофуран-5-ил)-3-метилфенил]-1,2,3,6 тетрагидропиридин-1-илсульфонилацетамид. Получают в виде бесцветного твердого вещества (56%), т.пл. 158 -162 С, из соединения, указанного в заголовке получения 112,применяя способ примера 17. Обнаружено: С 57,01; Н 5,47; N 5,26. C22H26N2O5S; 0,60 CH2Cl2 требует С 56,61; Н 5,30; N 5,84%.(t, 2H), 6,20 (brs, 1H), 6,78 (d, 1H), 7,01 (d, 1H),7,12 (d, 1H), 7,17 (s, 1H), 7,27 (d, 1H), 7,33 (s,1H), 9,20 (brs, 1H), 10,80 (brs, 1H). МСНР (ХИAД): 428 (М+Н)+. Пример 45. N-Гидрокси-2-4[3-метил-4-(3 трифторметилфенил)фенил]-1,2,3,6-тетрагидропиридин-1-илсульфонилацетамид. Получают в виде бесцветного твердого вещества (50%), т.пл. 168-170 С (кристаллизуют из диизопропилового эфира), из соединения,указанного в заголовке получения 116, применяя способ примера 17, за исключением того,что в качестве сорастворителя для реакции используют тетрагидрофуран. Обнаружено: С 54,96; Н 4,73; N 5,97. С 21 Н 21F3N2O4S; 0,25 H2O требует С 54,96; Н 4,72; N, 6,10 %.(ХИAД): 455 (М+Н)+. Пример 46. N-Гидрокси-2-[4-(4-феноксифенил)пиперидин-1-илсульфонил]ацетамид. Получают в виде бесцветного твердого вещества (13%), т.пл. 176-179 С, из соединения,указанного в заголовке получения 119, применяя способ примера 17, за исключением того,что в качестве сорастворителя для реакции применяют дихлорметан. Обнаружено: С 57,92; Н 5,62; N 6,97. 32 Пример 47. N-Гидрокси-2-4-[4-(3-[2 метоксиэтокси]фенил)-3-метилфенил]пиперидин-1-илсульфонил-2-метилпропанамид. Получают в виде бесцветного твердого вещества (42%), т.пл. 155 -156 С, из соединения, указанного в заголовке получения 122,применяя способ примера 19, за исключением того, что перед кристаллизацией из смеси дихлорметан - диизопропиловый эфир остаток очищают флэш-хроматографией, применяя в качестве элюента смесь дихлорметан : метанол(m, 2H), 2,20 (s, 3H), 2,65 (m, 1 Н), 3,05 (t, 2H),3,30 (s, 3 Н), 3,62 (t, 2H), 3,74 (d, 2H), 4,10 (t, 2H),6,80 - 6,92 (m, 3 Н), 7,10 -7,17 (m, 3H), 7,30 (t,1H), 9,02 (brs, 1H), 10,7 (brs, 1H). МСНР (Электрораспыление): 513 (M+Na)+. Пример 48. N-Гидрокси-4-метокси-2(R,S)[4-(3-метил-4-фенилфенил)-1,2,3,6-тетрагидропиридин-1-илсульфонил]бутанамид. Получают в виде бесцветного твердого вещества (39%), т.пл. 135-136 С, из соединения,указанного в заголовке получения 124, применяя способ примера 19, за исключением того,что перед кристаллизацией из диизопропилового эфира остаток очищают флэш-хроматографией, применяя в качестве элюента смесь дихлорметан : метанол (97:3).(m, 2H), 3,20 (s, 4H), 3,36 (m, 1H), 3,48 (m, 2H),3,87 (dd, 1H), 3,98 (m, 2H), 6,20 (brs, 1H), 7,16 (d,1H), 7,32 (m, 5H), 7,43 (m, 2H), 9,22 (brs, 1H),10,95 (brs, 1H). МСНР (Терморазбрызгивание): 444 (М)+. Пример 49. N-Гидрокси-4-[4-(3-метил-4 фенилфенил)-1,2,3,6-тетрагидропиридин-1-илсульфонил]тетрагидропиран-4-карбоксамид. Получают в виде бесцветного твердого вещества (91%), т.пл. 188 -190 С, из соединения, указанного в заголовке получения 126,применяя способ примера 38. Обнаружено: С 61,89; Н 6,15; N 5,94.MCHP (ХИАД): 457 (M+H)+. Пример 50. N-Гидрокси-2-4-[4-(3-метоксифенил)-3-метилфенил]пиперидин-1-илсульфонилиндан-2-карбоксамид. Получают в виде бесцветного твердого вещества (63%), т.пл. 199-202 С, из соединения,указанного в заголовке получения 130, применяя способ примера 19, но с кристаллизацией остатка из диизопропилового эфира. Обнаружено: С 66,25; Н 6,18; N 5,18.(s, 3H), 2,54 (m, 1 Н), 2,89 (t, 2H), 3,48 (m, 2H),3,77 (m, 7H), 6,87 (m, 3H), 7,07 - 7,35 (m, 8H),9,10 (brs, 1H), 11,05 (brs, 1H). Пример 51. N-Гидрокси-1-4-[4-(3-метоксифенил)-3-метилфенил]пиперидин-1-илсульфонилциклобутанкарбоксамид. Получают в виде бесцветного твердого вещества (52%), т.пл. 157 -160 С, из соединения, указанного в заголовке получения 132,применяя способ примера 50. Обнаружено: С 62,79; Н 6,60; N 5,93. С 24 Н 30N2O5S требует С 62,86; Н 6,59; N 6,11%.(M+H)+. Пример 52. N-Гидрокси-4-4-[4-(3-метоксифенил)-3-метилфенил]пиперидин-1-илсульфонил-1-метилпиперидин-4-карбоксамид. Получают в виде бесцветного твердого вещества (13%) из соединения, указанного в заголовке получения 134, применяя способ примера 19, за исключением того, что остаток очищают флэш-хроматографией, применяя в качестве элюента смесь дихлорметан : метанол : концентрированный водный раствор аммиака(M+H)+. Пример 53. N-Гидрокси-3-фенил-2(R,S)-[4(4-фенилфенил)-1,2,3,6-тетрагидропиридин-1 илсульфонил]пропанамид. Получают в виде бесцветного твердого вещества (31%), т.пл. 202 -205 С, из соединения, указанного в заголовке получения 136,применяя способ примера 19, за исключением того, что остаток растирают в порошок с дихлорметаном. Обнаружено: С 66,05; Н 5,82; N 6,15. С 26 Н 26N2O4S; 0,50 Н 2O требует С 66,22; Н 5,77;MCHP (ХИАД): 463 (М+Н)+. Пример 54. N-Гидрокси-2-[4-(4-фенилфенил)-1,2,3,6-тетрагидропиридин-1-илсульфонил]индан-2-карбоксамид. Получают в виде бесцветного твердого вещества (27%), т.пл. 159-161 С, из соединения,указанного в заголовке получения 138, применяя способ примера 19, за исключением того, 002882 34 что остаток очищают флэш-хроматографией,применяя в качестве элюента смесь дихлорметан : метанол (98:2), после чего следует растирание в порошок с диизопропиловым эфиром.MCHP (ХИAД): 463 (М+Н)+. Пример 55. N-Гидрокси-2-4-[4-(3-хлор-4 фторфенил)-3-метилфенил]-1,2,3,6-тетрагидропиридин-1-илсульфонилацетамид. Получают в виде бесцветного твердого вещества (60%), т.пл. 181-183 С (кристаллизуют из простого эфира), из соединения, указанного в заголовке получения 142, применяя способ примера 17, за исключением того, что в качестве сорастворителя для реакции применяют тетрагидрофуран. Обнаружено: С 54,65; Н 4,61; N 6,13.MCHP (ХИАД): 439 (М+Н)+. Пример 56. N-Гидрокси-2-4-[4-(1,3-бензодиоксол-5-ил)-3-метилфенил]-1,2,3,6-тетрагидропиридин-1-илсульфонилацетамид. Получают в виде бесцветного твердого вещества (69%), т.пл. 165-167 С, из соединения,указанного в заголовке получения 146, применяя способ примера 45. Обнаружено: С 58,60; Н 5,10; N 6,01.(brs, 1H), 10,80 (brs, 1H). МСНР (ХИАД): 431 (М+Н)+. Пример 57. N-Гидрокси-2-4-[4-(2-фторфенил)-3-метилфенил]-1,2,3,6-тетрагидропиридин 1-илсульфонилацетамид. Получают в виде бесцветного твердого вещества (32%), т.пл. 160-163 С, из соединения,указанного в заголовке получения 150, применяя способ примера 17, за исключением того,что в качестве сорастворителя для реакции применяют тетрагидрофуран.(m, 1H). МСНР (ХИАД): 405 (М+Н)+. Пример 58. N-Гидрокси-2-4-[4-(3,4-диметоксифенил)-3-метилфенил]-1,2,3,6-тетрагидропиридин-1-илсульфонилацетамид. Получают в виде бесцветного твердого вещества (61%), т.пл. 172 -174 С, из соедине 35 ния, указанного в заголовке получения 151,применяя способ примера 57. Обнаружено: С 59,36; Н 6,08; N 5,87. С 22 Н 26N2 О 6S требует С 59,18; Н 5,87; N 6,27%.(m, 2H), 6,19 (brs, 1H), 6,82 (d, 1H), 6,88 (s, 1H),7,00 (d, 1H), 7,19 (d, 1H), 7,29 (d, 1H), 7,36 (s,1H), 9,20 (brs, 1H), 10,80 (brs, 1H). МСНР (ХИАД): 447 (М+Н)+. Пример 59. N-Гидрокси-2-4-[4-(индан-5 ил)-3-метилфенил]-1,2,3,6-тетрагидропиридин 1-илсульфонилацетамид. Получают в виде бесцветного твердого вещества (58%), т.пл. 149-152 С, из соединения,указанного в заголовке получения 152, применяя способ примера 17.(m, 2H), 2,90 (m, 4H), 3,47 (m, 2H), 3,90 (s, 2 Н),3,96 (m, 2H), 6,19 (brs, 1 Н), 7,05 (d, 1H), 7,15 (m,2H), 7,23 -7,30 (m, 2H), 7,36 (s, 1 Н), 9,20 (brs,1 Н), 10,80 (brs, 1 Н). МСНР (ХИАД): 427 (М+Н)+. Пример 60. N-Гидрокси-2-4-[3-метил-4(3-трифторметоксифенил)фенил]-1,2,3,6-тетрагидропиридин-1-илсульфонилацетамид. Получают в виде бесцветного твердого вещества (13%), т.пл. 154 С (кристаллизуют из смеси дихлорметан - диизопропиловый эфир),из соединения, указанного в заголовке получения 153, применяя способ примера 17.(M+NH4)+. Пример 61. N-Гидрокси-2-[4-(4-фенил-3 трифторметилфенил)-1,2,3,6-тетрагидропиридин-1-илсульфонил]ацетамид. Получают в виде бесцветного твердого вещества (43%), т.пл. 143 -145 С, из соединения, указанного в заголовке получения 157,применяя способ примера 17. Обнаружено: С 54,63; Н 4,35; N 5,90. С 20 Н 19F3N2O4S требует С 54,54; Н 4,35; N 6,36%.(M+NH4)+. Пример 62. N-Гидрокси-2-4-[4-(2,2-диметил-1,3-бензодиоксол-5-ил)-3-метилфенил]пиперидин-1-илсульфонил-2-метилпропионамид. Получают в виде бесцветного твердого вещества (52%), т.пл. 184-186 С, из соединения,указанного в заголовке получения 161, применяя способ примера 19.(brs, 1H), 10,75 (brs, 1H). МСНР (ХИАД): 489 (М+Н)+. Пример 63. N-Гидрокси-2-4-[4-(1,2-диметилбензимидазол-5-ил)-3-метилфенил]пиперидин-1-илсульфонил-2-метилпропионамид. Получают в виде бесцветного твердого вещества (22%), т.пл. 213-215 С, из соединения,указанного в заголовке получения 165, применяя способ примера 19.(М+Н)+. Пример 64. N-Гидрокси-2-4-[4-(3-цианофенил)-3-метилфенил]пиперидин-1-илсульфонил-2-метилпропионамид. Палладий на сульфате бария (5%, 10 мг) добавляют к перемешиваемому раствору соединения, указанного в заголовке получения 168(70 мг, 0,13 ммоль), в метаноле (2 мл), затем реакционную смесь гидрируют при давлении 345 кПа (50 фунт/дюйм 2) в течение приблизительно 20 ч. Добавляют дополнительную порцию палладия на сульфате бария (5%, 10 мг) и гидрирование продолжают в течение следующих 4 дней. Катализатор удаляют путем фильтрации, растворитель выпаривают при пониженном давлении и остаток подвергают флэшхроматографии, применяя в качестве элюента смесь метанол : дихлорметан (5:95), с получением указанного в заголовке соединения (13 мг,23%) в виде бесцветного аморфного твердого вещества.(СDСl3): 1,63 (s, 6H), 1,63-1,95 (m, 4H),2,26 (s, 3H), 2,67 (m, 1H), 3,10 (m, 2H), 3,96 (m,2H), 7,04 - 7,20 (m, 3H), 7,50-7,70 (m, 4H). ИИ (КВr) 2240 см-1 для циано. Пример 65. N-Гидрокси-2-4-[4-(5-этоксипиридин-3-ил)-3-метилфенил]пиперидин-1 илсульфонил-2-метилпропионамид. Получают в виде бесцветной пены (62%) из соединения, указанного в заголовке получения 172, применяя способ примера 19, за исключением того, что остаток очищают флэшхроматографией, применяя в качестве элюента смесь дихлорметан:этанол (95:5).O-(7-Азабензотриазол-1-ил)-1,1,3,3-тетраметилуронийгексафторфосфат (510 мг, 1,15 ммоль) добавляют к перемешиваемому раствору соединения, указанного в заголовке получения 178 (530 мг, 0,76 ммоль), и N-этилдиизопропиламина (0,20 мл, 0,9 ммоль) в безводном диметилформамиде (4 мл) в атмосфере азота при комнатной температуре. Через 15 мин добавляют гидрохлорид гидроксиламина (188 мг,2,2 ммоль) и N-этилдиизопропиламина (0,6 мл,2,7 ммоль) и реакционную смесь перемешивают в течение приблизительно 16 ч, затем реакционную смесь распределяют между этилацетатом и водным фосфатным буфером (рН 7). Органическую фазу отделяют, промывают водой, сушат(МgSO4) и выпаривают при пониженном давлении. Остаток растворяют в безводном тетрагидрофуране (15 мл), добавляют тетра-н-бутиламмонийфторид (1,4 мл 1,0 М раствора в тетрагидрофуране; 1,4 ммоль) и полученный в результате раствор перемешивают при комнатной температуре в течение 1,5 ч, затем раствор распределяется между этилацетатом и водным фосфатным буфером (рН 7). Органическую фазу отделяют, промывают водой, сушат (MgSO4) и выпаривают при пониженном давлении. Очистка остатка флэш-хроматографией с применением в качестве элюента смеси дихлорметан : метанол : концентрированный водный раствор аммиака (90:10:1), затем следует кристаллизация из смеси метанол - вода, что позволяет получить продукт в виде бесцветного твердого вещества (155 мг, 43%), т.пл. 147 - 150 С. Обнаружено: С 60,26; Н 6,81; N 5,76. С 24H32N2O6S требует С 60,48; Н 6,77; N 5,88 %.(m, 3H), 7,10 (s, 2H), 7,16 (s, 1H), 7,30 (t, 1H),9,00 (brs, 1H), 10,75 (brs, 1H). Получение 1. Трет-бутил-4-гидрокси-4-(4 фенилфенил)пиперидин-1-карбоксилат. 2,5 М раствор н-бутиллития в гексане (8 мл, 20 ммоль) добавляют в течение приблизительно 10 мин к перемешиваемой смеси 4 бромбифенила (4,66 г, 20 ммоль), безводного простого эфира (100 мл) и безводного тетрагидрофурана (10 мл) в атмосфере азота при приблизительно -75 С. По истечении одного часа добавляют раствор трет-бутил-4-оксопиперидин 1-карбоксилата (3,98 г, 20 ммоль) в безводном тетрагидрофуране (10 мл) с такой скоростью,что температура реакции поддерживается ниже-60 С. Реакционную смесь перемешивают при приблизительно -75 С в течение 3 ч и реакцию останавливают водным раствором хлорида аммония, затем органическую фазу отделяют,промывают водой, сушат (МgSO4) и выпаривают при пониженном давлении. Кристаллизация остатка из диизопропилового эфира позволяет получить указанное в заголовке соединение(4,29 г) в виде бесцветного твердого вещества,т.пл. 144 - 146 С.(m, 2H), 7,50 -7,65 (m, 6H). МСНР (ХИAД): 354 (М+Н)+. Получение 2 4-(4-Фенилфенил)-1,2,3,6 тетрагидропиридин. Трифторуксусную кислоту (20 мл) добавляют к перемешиваемому раствору соединения,указанного в заголовке получения 1 (4,2 г, 11,9 ммоль), в дихлорметане (20 мл) при комнатной температуре. После следующих 3 ч реакционную смесь выпаривают при пониженном давлении и остаток подщелачивают 1 М водным раствором гидроксида натрия. Полученную в результате смесь экстрагируют дихлорметаном,затем объединенные экстракты промывают водой, сушат (MgSO4) и выпаривают при пониженном давлении с получением указанного в заголовке соединения (2,79 г) в виде бесцветного твердого вещества.(М+Н)+. Получение 3. 1-Бензил-4-гидрокси-4-(4 фенилфенил)пиперидин. 1,6 М раствор н-бутиллития в гексане (39 мл, 63 ммоль) добавляют к перемешиваемому раствору 4-бромбифенила (11,7 г, 50 ммоль) в безводном тетрагидрофуране (50 мл) в атмосфере азота при приблизительно -50 С, в то же время поддерживая температуру реакции ниже-40 С. После еще одного часа добавляют раствор 1-бензил-4-оксопиперидина (10,4 г, 55 ммоль) в безводном тетрагидрофуране (30 мл) с такой скоростью, что температура реакции поддерживается ниже -40 С. Охлаждающую баню затем удаляют и, после еще одного часа, реакционную смесь распределяют между дихлорметаном (400 мл) и рассолом (200 мл). Органическую фазу отделяют, промывают водой, сушат(МgSO4) и выпаривают при пониженном давлении, затем остаток кристаллизуют из этилацетата с получением указанного в заголовке соединения (13,9 г) в виде бесцветного твердого вещества.(brs, 1H). Получение 4. 1-Бензил-4-(4-фенилфенил)1,2,3,6-тетрагидропиридин. Раствор соединения, указанного в заголовке получения 3 (13,8 г, 40,2 ммоль), и паратолуолсульфоновой кислоты (15,3 г, 80,4 ммоль) в толуоле (100 мл) нагревают с обратным холодильником в аппарате Дина-Старка (Dean-Stark) до полного удаления воды (приблизительно 2 ч), затем дают охладиться и разбавляют водой(200 мл). Полученную в результате смесь подщелачивают концентрированным водным раствором аммиака и экстрагируют дихлорметаном(4 х 200 мл), затем объединенные экстракты сушат (MgSO4) и выпаривают при пониженном давлении с получением указанного в заголовке соединения (10,6 г) в виде не совсем белого твердого вещества.(m, 14 Н). Получение 5. 4-(4-Фенилфенил)пиперидин. Перемешиваемую смесь соединения, указанного в заголовке получения 4 (5,07 г, 15,6 ммоль), формиата аммония (4 г, 62 ммоль), гидроксида палладия на углероде (500 мг) и метанола (50 мл) нагревают с обратным холодильником в течение 4,5 ч, дают охладиться и фильтруют. Фильтрат выпаривают при пониженном давлении, и остаток распределяют между 2 М водным раствором гидроксида натрия и дихлорметаном. Органическую фазу отделяют и объединяют с дихлорметановыми экстрактами(3 х 100 мл) водной фазы, затем объединенные дихлорметановые растворы сушат (MgSO4) и выпаривают под давлением с получением указанного в заголовке соединения (3,5 г) в виде не совсем белого твердого вещества, т.пл. 104 107 С.(m, 2H), 2,62 (m, 1H), 2,75 (m, 2 Н), 3,19 (d, 2H),7,25 (m, 3 Н), 7,40 (m, 2H), 7,53 (m, 4H). Получение 6. Трет-бутил-4-гидрокси-4-(3 метил-4-фенилфенил)пиперидин-1-карбоксилат. Получают в виде бесцветного твердого вещества (60%), т.пл. 142 -144 С, из 4-бром-2 метилбифенила (J. Amer. Chem. Soc., 1926, 48,1372) и трет-бутил-4-оксопиперидин-1 карбоксилата, применяя способ получения 1.(М+Н)+. Получение 7. 4-(3-Метил-4-фенилфенил)1,2,3,6-тетрагидропиридин. Получают в виде бесцветного твердого вещества (90%) из соединения, указанного в заголовке получения 6, применяя способ получения 2.aцeтaт. Раствор метилхлорсульфонилацетата (0,35 г, 2 ммоль) в дихлорметане (2 мл) по каплям добавляют к перемешиваемому раствору соеди 002882 40 нения, указанного в заголовке получения 2 (470 мг, 2 ммоль), и 1,8-диазабицикло[5,4,0]ундец-7 ена (0,3 мл, 2 ммоль) в дихлорметане (8 мл) при приблизительно 0 С, охлаждающую баню удаляют и реакционную смесь перемешивают при комнатной температуре в течение 4 ч, затем разбавляют дихлорметаном. Полученную в результате смесь промывают 0,1 М соляной кислотой, сушат (MgSO4) и выпаривают при пониженном давлении. Остаток очищают флэшхроматографией, применяя в качестве элюента дихлорметан, затем следует кристаллизация из диизопропилового эфира с получением указанного в заголовке соединения (250 мг) в виде бесцветного твердого вещества, т.пл. 182-183 С. Обнаружено: С 64,32; Н 5,59; N 3,77.(m, 1H), 7,38 - 7,44 (m, 4H), 7,53 - 7,60 (m, 4H). МСНР (ХИАД): 372 (M+H)+. Получение 9. Метил-2-[4-(3-метил-4-фенилфенил)-1,2,3,6-тетрагидропиридин-1-илсульфонил]ацетат. Получают в виде бесцветного твердого вещества (30%), т.пл. 104-105 С, из соединения,указанного в заголовке получения 7, и метилхлорсульфонилацетата, применяя способ получения 8. Обнаружено: С 65,18; Н 6,03; N 3,59. С 21 Н 23NO4S требует С 65,43; Н 6,01; N 3,63%.(M+H)+. Получение 10. Метил-2-[4-(4-фенилфенил) пиперидин-1-илсульфонил]ацетат. Получают в виде бесцветного твердого вещества (27%), т.пл. 169-170 С, из соединения,указанного в заголовке получения 5, и метилхлорсульфонилацетата, применяя способ получения 8. Обнаружено: С 63,99; Н 6,18; N 3,69. С 20 Н 23NO4S требует С 64,32; Н 6,21; N 3,75.(m, 1H), 3,00 (t, 2H), 3,80 (s, 3 Н), 3,95 (s, 2H),3,97 (m, 2H), 7,20 - 7,35 (m, 3 Н), 7,40 (t, 2H),7,50-7,60 (m, 4H). Получение 11. Метил-2-(4-фенил-1,2,3,6 тетрагидропиридин-1-илсульфонил)ацетат. Получают в виде бесцветного твердого вещества (20%), т.пл. 93-94 С, из 4-фенил 1,2,3,6-тетрагидропиридина и метилхлорсульфонилацетата, применяя способ получения 8. Обнаружено: С 56,86; Н 5,79; N 4,76. 41 Получение 12. Метил-2-(4-фенилпиперидин-1-илсульфонил)ацетат. Получают в виде бесцветного твердого вещества (35%), т.пл. 98-100 С, из 4-фенилпиперидина и метилхлорсульфонилацетата, применяя способ получения 8. Обнаружено: С 56,43; Н 6,41; N 4,64.(m, 1H), 2,97 (m, 2H), 3,80 (s, 3 Н), 3,92 (s, 2H),3,93 (m, 2H), 7,15-7,33 (m, 5H). Получение 13. Метил-2-(4-бензилпиперидин-1-илсульфонил)ацетат. Получают в виде аморфного твердого вещества (24%) из 4-бензилпиперидина и метилхлорсульфонилацетата, применяя способ получения 8, но с элюционным градиентом дихлорметан : метанол (от 100:0 до 95:5) для стадии хроматографической очистки.(m, 2H), 2,54 (d, 2H), 2,78 (t, 2H), 3,73 (s, 3 Н),3,76 (m, 2H), 3,88 (s, 2H), 7,08 (d, 2H), 7,17 (t,1H), 7,24 (m, 2H). МСНР (ХИAД): 312 (М+Н)+. Получение 14. Mетил-2(R,S)-[4-(4-фенилфенил)-1,2,3,6-тетрагидропиридин-1-илсульфонил]пент-4-еноат. 60% дисперсия гидрида натрия в минеральном масле (21 мг, 0,53 ммоль) добавляют к перемешиваемому раствору соединения, указанного в заголовке получения 8 (180 мг, 0,48 ммоль), в смеси безводного тетрагидрофурана(1 мл) и безводного диметилформамида (1 мл) в атмосфере азота при комнатной температуре. Через 30 мин добавляют аллилбромид (0,05 мл,0,53 ммоль) и перемешивание продолжают в течение следующих 2 ч, затем полученную в результате смесь распределяют между этилацетатом и водным фосфатным буфером (рН 7). Органическую фазу отделяют, промывают водой, сушат (МgSO4) и выпаривают при пониженном давлении, затем остаток растирают в порошок с диизопропиловым эфиром с получением указанного в заголовке соединения (170 мг) в виде бесцветного твердого вещества.(СDСl3): 2,60 -2,85 (m, 4H), 3,55 - 3,77 (m,2H), 3,79 (s, 3H), 4,03 (dd, 1H), 4,12 (m, 2H),5,10 - 5,22 (m, 2H), 5,74 (m, 1H), 6,08 (brs, 1H),7,36 (m, 1H), 7,43 (m, 4H), 7,60 (m, 4H). МСНР (ХИАД): 411 (М+Н)+. Получение 15. 2(R,S)-[4-(4-Фенилфенил)1,2,3,6-тетрагидропиридин-1-илсульфонил] пент-4-еновая кислота. 1M Водный раствор гидроксида натрия(1,2 мл, 1,2 ммоль) добавляют к перемешиваемому раствору соединения, указанного в заголовке получения 14 (160 мг, 0,39 ммоль), в смеси тетрагидрофурана (5 мл) и метанола (10 мл). Полученный в результате раствор нагревают при 50 С в течение 3 ч, затем выпаривают при пониженном давлении и остаток растворяют в 42 воде. Этот водный раствор подкисляют концентрированной соляной кислотой и полученную в результате эмульсию экстрагируют этилацетатом. Объединенные экстракты сушат (MgSO4) и выпаривают при пониженном давлении, затем остаток очищают флэш-хроматографией, применяя элюционный градиент этилацетат : метанол : ледяная уксусная кислота (от 100:0:0 до 97:3:0 до 96:3:1), затем следует растирание в порошок с гексаном с получением указанного в заголовке соединения (90 мг) в виде бесцветного аморфного твердого вещества.(M+NH4)+. Получение 16. Метил 2(R,S)-[4-(3-метил-4 фенилфенил)-1,2,3,6-тетрагидропиридин-1-илсульфонил]пент-4-еноат. Получают в виде твердого вещества (67%) из соединения, указанного в заголовке получения 9, и аллилбромида, применяя способ получения 14, но с применением на стадии очистки флэш-хроматографии, в которой используют элюционный градиент гексан : этилацетат (от 100:0 до 80:2).(М+Н)+. Получение 17. 2(R,S)-[4-(3-Метил-4-фенилфенил)-1,2,3,6-тетрагидропиридин-1-илсульфонил]пент-4-еновая кислота. Получают в виде аморфного твердого вещества (46%) из соединения, указанного в заголовке получения 16, применяя способ получения 15.(brs, 1H), 7,20-7,43 (m, 8H). МСНР (Терморазбрызгивание): 368 (М+НСО 2)+. Получение 18. Метил-5-фенил-2(R,S)-[4(4-фенилфенил)-1,2,3,6-тетрагидропиридин-1 илсульфонил]пентаноат. Получают в виде бесцветного твердого вещества (65%), т.пл. 146-148 С, из соединения,указанного в заголовке получения 8, и 1-бром-3 фенилпропана, применяя способ получения 14. 43 Получение 19. 2-Метил-2-[4-(4-фенилфенил)-1,2,3,6-тетрагидропиридин-1-илсульфонил] пропановая кислота. 60% дисперсия гидрида натрия в минеральном масле (48 мг, 1,2 ммоль) добавляют к перемешиваемому раствору соединения, указанного в заголовке получения 8 (150 мг, 0,4 ммоль), в смеси безводного тетрагидрофурана(3 мл) и безводного диметилформамида (1 мл) в атмосфере азота при комнатной температуре. Через 30 мин добавляют метилпаратолуолсульфонат (220 мг, 1,2 ммоль) и перемешивание продолжают в течение следующих 20 ч, затем полученную в результате смесь распределяют между этилацетатом и водой. Водную фазу подкисляют 2 М соляной кислотой и экстрагируют дихлорметаном (3 х 50 мл). Объединенные экстракты сушат (МgSO4) и выпаривают при пониженном давлении, затем остаток очищают флэш-хроматографией, применяя в качестве элюента смесь дихлорметан : метанол : ледяная уксусная кислота (89:10:1), с получением указанного в заголовке соединения (60 мг) в виде бледно-желтого аморфного твердого вещества.(m, 9H). Получение 20. Метил-1-[4-(3-метил-4-фенилфенил)-1,2,3,6-тетрагидропиридин-1-илсульфонил]циклопентанкарбоксилат. 60% дисперсия гидрида натрия в минеральном масле (43 мг, 1,07 ммоль) добавляют к перемешиваемому раствору соединения, указанного в заголовке получения 9 (380 мг, 0,99 ммоль), в безводном диметилформамиде (5 мл) в атмосфере азота при комнатной температуре. Через 30 мин добавляют 1,4-дийодбутан (0,14 мл, 1,06 ммоль) и перемешивание продолжают в течение 18 ч, затем добавляют еще 60% дисперсию гидрида натрия (43 мг, 1,07 ммоль) и перемешивание продолжают в течение следующих 4 ч. Полученную в результате смесь распределяют между этилацетатом и водой, затем органическую фазу отделяют, промывают водой, сушат(MgSO4) и выпаривают при пониженном давлении. Остаток очищают флэш-хроматографией,применяя в качестве элюента смесь гексан : этилацетат (9:1), с получением указанного в заголовке соединения (340 мг) в виде аморфного твердого вещества.(М+Н)+. Получение 21. 1-[4-(3-Метил-4-фенилфенил)-1,2,3,6-тетрагидропиридин-1-илсульфонил] циклопентанкарбоновая кислота. Получают в виде твердого вещества (54%) из соединения, указанного в заголовке получе 002882 44 ния 20, применяя способ получения 15, но с элюционным градиентом гексан : этилацетат (от 75:25 до 0:100) для стадии хроматографической очистки.(СDСl3): 1,65 (m, 2H), 1,88 (m, 2H),2,27 (s, 3H), 2,39 (m, 2H), 2,50 (m, 2H), 2,63 (m,2H), 3,64 (t, 2H), 4,12 (m, 2H), 6,03 (brs, 1H),7,20 - 7,43 (m, 8H). МСНР(М+Н)+. Получение 22. Метил-2-этил-2-[4-(4-фенилфенил)-1,2,3,6-тетрагидропиридин-1-илсульфонил]бутаноат. Это получение осуществляют также, как и получение 19 и с теми же самыми молярными соотношениями, применяя указанное в заголовке соединение по получению 8 и этилиодид. Тем не менее, в этом случае не выявили сопутствующего гидролиза сложного эфира, и поэтому требуемый продукт выделяют из органической фазы во время получения и очищают флэшхроматографией, применяя в качестве элюента дихлорметан, с получением указанного в заголовке соединения (125 мг) в виде белого аморфного твердого вещества.(СDСl3): 1,04 (t, 6H), 2,08-2,26 (m, 4H),2,66 (m, 2H), 3,60 (m, 2H), 3,80 (s, 3H), 4,10 (m,2H), 6,08 (brs, 1H), 7,35 (m, 1H), 7,43 (m, 4H),7,60 (m, 4H). Получение 23. 2-Этил-2-[4-(4-фенилфенил)-1,2,3,6-тетрагидропиридин-1-илсульфонил] бутановая кислота. 1M Водный раствор гидроксида натрия(1,5 мл, 1,5 ммоль) добавляют к перемешиваемому раствору соединения, указанного в заголовке получения 22 (120 мг, 0,28 ммоль), в смеси тетрагидрофурана (5 мл) и метанола (2 мл). Полученную в результате смесь нагревают с обратным холодильником в течение 70 ч, дают охладиться до комнатной температуры, подкисляют 2 М соляной кислотой и экстрагируют дихлорметаном (3 х 20 мл). Объединенные экстракты сушат (МgSO4) и выпаривают при пониженном давлении с получением указанного в заголовке соединения (95 мг) в виде бледножелтого аморфного твердого вещества.(СDСl3): 1,10 (t, 6H), 2,10-2,28 (m, 4H),2,64 (m, 2 Н), 3,65 (m, 2H), 4,15 (m, 2H), 6,08 (brs,1H), 7,35 (m, 1H), 7,43 (m, 4H), 7,58 (m, 4 Н). Получение 24. Метил-2(R,S)-[4-(4-фенилфенил)-1,2,3,6-тетрагидропиридин-1-илсульфонил]гексаноат. Это получение осуществляют, по существу, так же, как и получение 14, применяя указанное в заголовке соединение по получению 8 и н-бутилиодид, но используя 1,0 мол. эквив. гидрида натрия, 1-метилпирролидин-2-он в качестве растворителя и время реакции алкилирования, составляющее 70 ч, с получением указанного в заголовке соединения (78%) в виде бесцветного твердого вещества, т.пл. 152-154 С.(M+H)+. Получение 25. 2(R,S)-[4-(4-фенилфенил)1,2,3,6-тетрагидропиридин-1-илсульфонил]гексановая кислота. 1 М Водный раствор гидроксида натрия(1,5 мл, 1,5 ммоль) добавляют к перемешиваемому раствору соединения, указанного в заголовке получения 24 (220 мг, 0,51 ммоль), в смеси 1,4-диоксана (3 мл) и метанола (10 мл). Полученную в результате смесь нагревают с обратным холодильником в течение 45 мин, разбавляют водой и подкисляют концентрированной соляной кислотой, затем осадок собирают и сушат в вакууме с получением указанного в заголовке соединения (200 мг) в виде бесцветного кристаллического твердого вещества, т.пл. 180 182 С. Обнаружено: С 65,64; Н 6,42; N 3,30. С 23 Н 27NO4S; 0,50 H2O требует С 65,38; Н 6,68; N 3,32 %.(M+NH4-CO2)+. Получение 26. Mетил-4-метил-2(R,S)-[4-(4 фенилфенил)-1,2,3,6-тетрагидропиридин-1-илсульфонил]пент-4-еноат. Получают в виде твердого вещества (79%),т.пл. 149-151 С после кристаллизации из диизопропилового эфира, из соединения, указанного в заголовке получения 8, и 3-бром-2-метилпроп-1 ена, применяя способ получения 14.(М+Н)+. Получение 27. 4-Метил-2(R,S)-[4-(4-фенилфенил)-1,2,3,6-тетрагидропиридин-1-илсульфонил]пент-4-еновая кислота. Получают в виде бесцветного твердого вещества (94%), т.пл. 153-155 С, из соединения,указанного в заголовке получения 26, применяя способ получения 15.(m, 4H). МСНР (Терморазбрызгивание): 368 (M+HCO2)+. Получение 28. Метил-2(R,S)-метил-2-[4-(3 метил-4-фенилфенил)-1,2,3,6-тетрагидропиридин-1-илсульфонил]пент-4-еноат. 60% дисперсия гидрида натрия в минеральном масле (70 мг, 1,75 ммоль) добавляют к перемешиваемому раствору соединения, указанного в заголовке получения 9 (600 мг, 1,56 ммоль), в безводном диметилформамиде (5 мл) в атмосфере азота при комнатной температуре. Через 20 мин добавляют аллилбромид (0,145 мл,1,72 ммоль) и перемешивание продолжают в течение 2 ч, затем добавляют еще 60% дисперсию гидрида натрия (70 мг, 1,75 ммоль), с последующим добавлением через 20 мин метилиодида (0,11 мл, 1,72 ммоль). Реакционную смесь перемешивают в течение следующих 20 ч,затем распределяют между этилацетатом и водой. Органическую фазу отделяют, сушат(МgSO4) и выпаривают при пониженном давлении,затем остаток очищают флэшхроматографией, применяя в качестве элюента смесь гексан : этилацетат (92,5:7,5) с получением указанного в заголовке соединения (263 мг) в виде бесцветной смолы.(М+Н)+. Получение 29. 2(R,S)-Метил-2-[4-(3-метил 4-фенилфенил)-1,2,3,6-тетрагидропиридин-1 илсульфонил]пент-4-еновая кислота. Получают в виде бесцветной смолы (90%) из соединения, указанного в заголовке получения 28, применяя способ получения 15, но длительность реакции составляет 24 ч.(2,95 г, 17,4 ммоль) и безводного диметилформамида (65 мл), затем полученную в результате смесь нагревают с обратным холодильником в течение 4 ч, дают охладиться, и смесь распределяют между этилацетатом и водой. Органическую фазу отделяют, промывают насыщенным рассолом, сушат (MgSO4) и выпаривают при пониженном давлении, затем остаток очищают 47 флэш-хроматографией, применяя в качестве элюента смесь гексан : этилацетат (95:5), с получением указанного в заголовке соединения(1,32 г) в виде бесцветного аморфного твердого вещества.(М+Н)+. Получение 31. 3-(4-Фенилфенокси)азетидин. Перемешиваемую смесь соединения, указанного в заголовке получения 30 (1,03 г, 2,63 ммоль), 10% гидроксида палладия на активированном угле (100 мг), этанола (100 мл), этилацетата (20 мл) и ледяной уксусной кислоты (10 мл) гидрируют при 345 кПа (50 фунт/дюйм 2) и 50 С в течение 20 ч, затем фильтруют. Фильтрующий слой промывают этанолом и объединенные промывочные воды и фильтрат выпаривают при пониженном давлении, затем остаток подщелачивают 2 М водным раствором гидроксида натрия. Смесь экстрагируют этилацетатом и объединенные экстракты сушат (MgSO4) и выпаривают при пониженном давлении с получением указанного в заголовке соединения, содержащего 1 мол. эквив. дифенилметана (456 мг) в виде бесцветного аморфного твердого вещества.(М+Н)+. Получение 32. Метил-2-[3-(4-фенилфенокси)азетидин-1-илсульфонил]ацетат. Получают в виде бесцветного аморфного твердого вещества (22%) из соединения, указанного в заголовке получения 31, и метилхлорсульфонилацетата, применяя способ получения 8.(3,8 мл, 9,4 ммоль) добавляют в течение приблизительно 10 мин к перемешиваемому раствору 2,5-дибромтолуола (2,35 г, 9,4 ммоль) в безводном простом эфире (50 мл) в атмосфере азота при приблизительно -75 С. По истечении одного часа добавляют раствор трет-бутил-4 оксопиперидин-1-карбоксилата (1,7 г, 8,5 ммоль) в безводном тетрагидрофуране (5 мл) с такой скоростью, что температура реакции поддерживается ниже -60 С. Реакционную смесь перемешивают при приблизительно -75 С в течение 1 ч, дают на 002882 48 греться до приблизительно 0 С и реакцию останавливают водным раствором хлорида аммония. Органическую фазу отделяют, промывают водой, сушат (МgSO4) и выпаривают при пониженном давлении. Остаток очищают флэшхроматографией, применяя в качестве элюента смесь простой эфир : гексан (50:50) с получением двух изомерных продуктов. Менее полярный изомер (0,6 г, 20%) выделяют в виде бесцветной пены и идентифицируют как трет-бутил-4-(4-бром-2-метилфенил)-4 гидроксипиперидин-1-карбоксилат.(М+Н)+. Более полярный изомер собирают в виде смеси указанного в заголовке соединения : третбутил-4-оксопиперидин-1-карбоксилата (2,15 г) в соотношении 4:1, порцию которой кристаллизуют из диизопропилового эфира с получением чистого указанного в заголовке соединения (570 мг) в виде бесцветного твердого вещества, т.пл. 102-103 С. Обнаружено: С 55,14; Н 6,58; N 3,76. С 17 Н 24 ВrNО 3 требует С 55,14; Н 6,53; N 3,78%.(М+Н)+. Б. 2,5M раствор н-бутиллития в гексане (38 мл, 94 ммоль) добавляют в течение приблизительно 10 мин к перемешиваемому раствору 2 бром-5-йодтолуола (28 г, 94 ммоль) в безводном простом эфире (500 мл) в атмосфере азота при приблизительно -75 С. По истечении 15 мин добавляют раствор трет-бутил-4-оксопиперидин-1-карбоксилата (17 г, 85 ммоль) в безводном тетрагидрофуране (50 мл) с такой скоростью, что температура реакции поддерживается ниже - 60 С. Реакционную смесь перемешивают при приблизительно -75 С в течение 1 ч, дают нагреться до приблизительно 0 С и реакцию останавливают водным раствором хлорида аммония. Органическую фазу отделяют, промывают водой, сушат (MgSО 4) и выпаривают при пониженном давлении. Остаток растворяют в пентане и полученный в результате раствор охлаждают до 0 С когда указанное в заголовке соединение кристаллизуется. Его собирают и сушат с получением бесцветного твердого вещества(20,1 г, 64%), идентичного веществу, полученному в получении 33 А. Получение 34. трет-Бутил-4-(4-бромфенил)-4-гидроксипиперидин-1-карбоксилат. Получают в виде аморфного твердого вещества (74%) из 1,4-дибромбензола и трет 49 бутил-4-оксопиперидин-1-карбоксилата, применяя способ получения 33.(М+Н)+. Получение 35. 4-(4-Бром-3-метилфенил)1,2,3,6-тетрагидропиридин. Трифторуксусную кислоту (100 мл) добавляют к перемешиваемому раствору соединения,указанного в заголовке получения 33 (20 г), в дихлорметане (100 мл) при комнатной температуре. По истечении 18 ч реакционную смесь выпаривают при пониженном давлении и остаток подщелачивают 2 М водным раствором гидроксида натрия до рН 12. Полученную в результате смесь экстрагируют простым эфиром,затем объединенные экстракты промывают водой, сушат (МgSO4) и выпаривают при пониженном давлении с получением указанного в заголовке соединения (13,6 г) в виде легкоплавкого твердого вещества.(t, 2H), 3,52 (m, 2H), 6,10 (brs, 1 Н), 7,05 (dd, 1H),7,22 (d, 1H), 7,46 (d, 1H). MCHP (Терморазбрызгивание): 251/253 (М+Н)+. Получение 36. 4-(4-Бромфенил)-1,2,3,6 тетрагидропиридин. Получают в виде твердого вещества (87%),т.пл. 76 - 78 С, из соединения, указанного в заголовке получения 34, и трифторуксусной кислоты, применяя способ получения 35.N,O-Бис(триметилсилил)ацетамид (0,9 мл,4,0 ммоль) добавляют к перемешиваемому раствору соединения, указанного в заголовке получения 35 (2 г, 7,9 моль), в безводном тетрагидрофуране (40 мл) в атмосфере азота при комнатной температуре. Затем добавляют раствор метилхлорсульфонилацетата (1,64 г, 9,5 ммоль) в безводном тетрагидрофуране (15 мл) и реакционную смесь перемешивают при комнатной температуре в течение 18 ч. Полученную в результате смесь выпаривают при пониженном давлении, остаток распределяют между этилацетатом и водным раствором бикарбоната натрия, затем органическую фазу отделяют, промывают водой, сушат (MgSO4) и выпаривают при пониженном давлении. Остаток очищают флэш-хроматографией, применяя в качестве элюента дихлорметан, затем следует кристаллизация из диизопропилового эфира с получением указанного в заголовке соединения (1,65 г, 55%) 50 в виде бесцветного твердого вещества, т.пл. 110 - 112 С. Обнаружено: С 46,32; Н 4,62; N 3,55.(M+NH4)+. Получение 38. Метил-2-[4-(4-бромфенил)1,2,3,6-тетрагидропиридин-1-илсульфонил]ацетат. Получают в виде бесцветного твердого вещества (32%), т.пл. 100-102 С, из соединения,указанного в заголовке получения 36, и метилхлорсульфонилацетата, применяя способ получения 37. Обнаружено: С 44,95; Н 4,26; N 3,65.(M+NH4)+. Получение 39. Метил-4-[4-(4-бром-3-метилфенил)-1,2,3,6-тетрагидропиридин-1-илсульфонил]тетрагидропиран-4-карбоксилат. Бис-2-йодэтиловый эфир (3,9 г, 12 ммоль) добавляют к перемешиваемой смеси соединения, указанного в заголовке получения 37 (3,6 г,9,3 ммоль), безводного карбоната калия (3,8 г,27,8 ммоль) и безводного диметилсульфоксида(50 мл) в атмосфере азота при комнатной температуре. Через 18 ч реакционную смесь распределяют между простым эфиром и водой,затем органическую фазу промывают водой,сушат (MgSO4) и выпаривают при пониженном давлении. Остаток очищают флэш-хроматографией, применяя в качестве элюента смесь дихлорметан : метанол (99:1), затем следует кристаллизация из диизопропилового эфира с получением указанного в заголовке соединения(3,43 г, 80%) в виде бесцветного твердого вещества, т.пл. 128 - 130 С. Обнаружено: С 49,92; Н 5,40; N 2,90.(M+NH4)+. Получение 40. Метил-2-[4-(4-бром-3-метилфенил)-1,2,3,6-тетрагидропиридин-1-илсульфонил]-2-метилпропаноат. Йодметан (2 мл, 32,1 ммоль) добавляют к перемешиваемой смеси соединения, указанного в заголовке получения 37 (5 г, 12,9 ммоль), безводного карбоната калия (5,4 г, 39,1 ммоль) и безводного диметилсульфоксида (50 мл) в атмосфере азота при комнатной температуре. Через 24 ч реакционную смесь распределяют между 51 простым эфиром и водой, затем органическую фазу промывают водой, сушат (MgSO4) и выпаривают при пониженном давлении. Остаток очищают флэш-хроматографией, применяя элюционный градиент простой эфир : пентан (от 40:60 до 100:0), затем следует кристаллизация из диизопропилового эфира с получением указанного в заголовке соединения (4,7 г, 87%) в виде бесцветного твердого вещества, т.пл. 100 101 С. Обнаружено: С 49,00; Н 5,33; N 3,28.(brs, 1H), 7,03 (dd, 1H), 7,21 (d, 1H), 7,49 (d, 1 Н). Получение 41. Метил-2-4-[4-(3-этоксифенил)-3-метилфенил]-1,2,3,6-тетрагидропиридин 1-илсульфонилацетат. К раствору соединения, указанного в заголовке получения 37 (776 мг, 2 ммоль), в дегазированном 1,2-диметоксиэтане (20 мл) добавляют 3-этоксифенилбороновую кислоту (430 мг, 2,6 ммоль), фторид цезия (790 мг, 5,2 ммоль), триортотолилфосфин (61 мг, 0,2 ммоль) и трис(дибензилиденацетон)дипалладий(0) (91 мг, 0,1 ммоль), затем реакционную смесь нагревают с обратным холодильником в течение приблизительно 3 ч в атмосфере азота. Полученной в результате смеси дают охладиться до комнатной температуры, затем разбавляют дихлорметаном и промывают водой. Органическую фазу сушат(MgSO4) и выпаривают при пониженном давлении, затем остаток очищают флэш-хроматографией, применяя в качестве элюента дихлорметан, затем следует кристаллизация из диизопропилового эфира с получением указанного в заголовке соединения (665 мг, 78%) в виде бесцветного твердого вещества, т.пл. 7981 С. Обнаружено: С 64,40; Н 6,37; N 3,17. С 23 Н 27NО 5S требует С 64,31; Н 6,34; N 3,26%.(М+NH4)+. Получение 42. 4-Бром-2-метоксибифенил. н-Амилнитрит (8,1 мл, 60 ммоль) медленно добавляют к перемешиваемой смеси 4-бром-2 метоксианилина (J. Med. Chem., 1989, 32, 1936; 8,1 г, 60 ммоль) и бензола (175 мл) в атмосфере азота при приблизительно 50 С. Когда добавление заканчивают, реакционную смесь нагревают с обратным холодильником в течение 3 ч, затем дают охладиться до комнатной температуры и выпаривают при пониженном давлении. Остаток подвергают азеотропной перегонке с тетрагидрофураном, затем с этилацетатом, и очищают флэш-хроматографией, применяя элюционный градиент гексан : этилацетат (от 100:0 до 95:5) с получением указанного в заголовке со 002882 52 единения (1,66 г) в виде бесцветного твердого вещества, т.пл. 50-52 С.(m, 2H). Получение 43. Трет-бутил-4-гидрокси-4(3-метокси-4-фенилфенил)пиперидин-1-карбоксилат. 2,5M раствор н-бутиллития в гексане (4,4 мл, 11 ммоль) добавляют в течение приблизительно 10 мин к перемешиваемой смеси соединения, указанного в заголовке получения 42 (2,6 г, 10 ммоль), в безводном тетрагидрофуране (30 мл) в атмосфере азота при приблизительно-75 С. По истечении одного часа добавляют раствор трет-бутил-4-оксопиперидин-1-карбоксилата (2,2 г, 11 ммоль) в безводном тетрагидрофуране (10 мл) с такой скоростью, что температура реакции поддерживается ниже -60 С. Реакционную смесь перемешивают при приблизительно -75 С в течение 1 ч, затем медленно нагревают до комнатной температуры и реакцию останавливают водным раствором хлорида натрия. Органическую фазу отделяют, промывают водой, сушат (МgSO4) и выпаривают при пониженном давлении. Очистка остатка флэшхроматографией с применением в качестве элюента смеси гексан : этилацетат (3:1) позволяет получать указанное в заголовке соединение (3,4 г) в виде бесцветного полутвердого вещества.(m, 2H), 7,52 (d, 2H). Получение 44. 4-(3-Метокси-4-фенилфенил)-1,2,3,6-тетрагидропиридин. Трифторуксусную кислоту (20 мл) добавляют к перемешиваемому раствору соединения,указанного в заголовке получения 43 (3,4 г, 11,9 ммоль), в дихлорметане (20 мл) при комнатной температуре. По истечении 72 ч реакционную смесь выпаривают при пониженном давлении и остаток подщелачивают 1 М водным раствором гидроксида натрия. Полученную в результате смесь экстрагируют дихлорметаном, затем объединенные экстракты промывают водой, сушат(MgSO4) и выпаривают при пониженном давлении с получением указанного в заголовке соединения (2,79 г) в виде бледно-желтого вязкого масла.N,O-Бис(триметилсилил)ацетамид (1,0 мл,4,4 ммоль) по каплям добавляют к перемеши 53 ваемому раствору соединения, указанного в заголовке получения 44 (1,95 г, 7,3 моль), в безводном тетрагидрофуране (40 мл) при комнатной температуре. Реакционную смесь перемешивают при комнатной температуре в течение 1 ч, затем добавляют раствор метилхлорсульфонилацетата (1,5 г, 8,8 ммоль) в тетрагидрофуране (10 мл). Полученную в результате смесь перемешивают при комнатной температуре в течение приблизительно 1,5 ч и затем добавляют насыщенный водный раствор бикарбоната натрия (50 мл). Смесь экстрагируют дихлорметаном (3 х 100 мл), затем объединенные экстракты сушат (MgSO4) и выпаривают при пониженном давлении. Остаток очищают флэш-хроматографией, применяя в качестве элюента дихлорметан, с получением указанного в заголовке соединения (1,0 г) в виде бледно-желтого твердого вещества, т.пл. 92-95 С. Обнаружено: С 62,24; Н 5,70; N 3,42.(s, 1H), 6,98 (s, 1H), 7,04 (d, 2H), 7,27-7,37 (m,2H), 7,44 (t, 2H), 7,56 (d, 2H). МСНР (Терморазбрызгивание): 402 (M)+. Получение 46. Тоет-бутил-4-(3-фтор-4 фенилфенил)-4-гидроксипиперидин-1-карбоксилат. Получают в виде бесцветного масла (67%) из 4-бром-3-фторбифенила и трет-бутил-4 оксопиперидин-1-карбоксилата, применяя способ получения 43.(m, 2H), 3,26 (t, 2H), 4,05 (m, 2H), 7,27 -7,51 (m,6H), 7,57 (d, 2H). Получение 47. 4-(3-Фтор-4-фенилфенил)1,2,3,6-тетрагидропиридин. Получают в виде бесцветного твердого вещества (90%), т.пл. 79-82 С, из соединения,указанного в заголовке получения 46, и трифторуксусной кислоты, применяя способ получения 44.(СDСl3): 1,85 (s, 1H), 2,49 (m, 2H), 3,13 (t,2H), 3,58 (m, 2H), 6,24 (brs, 1H), 7,12 - 7,27 (m,2H), 7,35 - 7,52 (m, 4H), 7,59 (d, 2H). МСНР (Терморазбрызгивание): 253 (М)+. Получение 48. Метил-2-[4-(3-фтор-4 фенилфенил)-1,2,3,6-тетрагидропиридин-1-илсульфонил]ацетат. Получают в виде бесцветного твердого вещества (38%) из соединения, указанного в заголовке получения 47, и метилхлорсульфонилацетата, применяя способ получения 45. 54 Получение 49. Метил-2-[4-(3-метокси-4 фенилфенил)-1,2,3,6-тетрагидропиридин-1-илсульфонил]-2-метилпропаноат. Йодметан (0,2 мл, 3,4 ммоль) добавляют к перемешиваемой смеси соединения, указанного в заголовке получения 45 (0,54 г, 1,4 ммоль),безводного карбоната калия (0,56 г, 4,1 ммоль) и безводного диметилсульфоксида (5 мл), затем реакционную смесь перемешивают при комнатной температуре в течение приблизительно 16 ч. Полученную в результате смесь распределяют между этилацетатом и водой, затем органическую фазу промывают водой, сушат (МgSO4) и выпаривают при пониженном давлении с получением указанного в заголовке соединения (540 мг) в виде бледно-желтого масла.(M+H)+. Получение 50. 2-[4-(3-Метокси-4-фенилфенил)-1,2,3,6-тетрагидропиридин-1-илсульфонил]-2-метилпропановая кислота. 1 М Водный раствор гидроксида натрия(1,2 мл, 1,2 ммоль) добавляют к перемешиваемому раствору соединения, указанного в заголовке получения 49 (250 мг, 0,58 ммоль), в метаноле (5 мл). Полученный в результате раствор нагревают при 50 С в течение приблизительно 2 ч, затем дают охладиться до комнатной температуры и выливают в этилацетат. Эту смесь промывают 2 М соляной кислотой, затем органическую фазу сушат (MgSO4) и выпаривают при пониженном давлении с получением указанного в заголовке соединения (210 мг) в виде бледно-желтого полутвердого вещества.Chem., 1989, 32, 1936; 17,9 г, 88,6 ммоль) в безводном простом эфире (350 мл) добавляют в течение приблизительно 1 ч к эфирату трифторида бора (27 мл, 212 ммоль) при -15 С. Полученный в результате раствор перемешивают при-15 С в течение приблизительно 5 мин и затем медленно добавляют раствор трет-бутилнитрита(100 мл), поддерживая внутреннюю температуру на уровне приблизительно -15 С. Реакционную смесь перемешивают при -15 С в течение следующих 15 мин и затем при 4 С в течение приблизительно 4 ч. Добавляют пентан и полученный в результате осадок собирают, промы 55 вают пентаном и сушат при пониженном давлении с получением указанного в заголовке соединения (20,1 г) в виде пурпурного твердого вещества.(s,1H), 8,16 (d,1H). МСНР (Терморазбрызгивание): 301 (M)+. Получение 52. 4-(3-Этоксифенил)-3-метоксибромбензол. Безводный 1,4-диоксан (80 мл) добавляют к смеси соединения, указанного в заголовке получения 51 (8,0 г, 26,6 ммоль), 3-этоксифенилбороновой кислоты (5,3 г, 31,9 ммоль) и ацетата палладия (II) (0,35 г, 1,3 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение приблизительно 16 ч. Полученную в результате смесь разбавляют водой (100 мл) и простым эфиром (100 мл),фильтруют и фильтрат экстрагируют простым эфиром (2 х 100 мл). Объединенные экстракты сушат (МgSO4) и затем выпаривают при пониженном давлении. Очистка остатка флэшхроматографией с применением в качестве элюента смеси пентан : простой эфир (20:1) позволяет получить указанное в заголовке соединение(СDСl3): 1,45 (t, 3 Н), 3,83 (s, 3 Н), 4,10 (q,2H), 6,89 (d, 1H), 7,06 (d, 2H), 7,10-7,24 (m, 3 Н),7,27-7,38 (m, 1H). МСНР (ХИАД): 308 (М+Н)+. Получение 53. Трет-бутил-4-[4-(3-этоксифенил)-3-метоксифенил]-4-гидроксипиперидин-1-карбоксилат. Получают в виде бесцветного масла (60%) из соединения, указанного в заголовке получения 52, и трет-бутил-4-оксопиперидин-1-карбоксилата, применяя способ получения 43.(m, 4H), 6,86 (d, 1H), 7,08 (m, 3 Н), 7,15 (s, 1H),7,31 (m, 2H). Получение 54. 4-[4-(3-Этоксифенил)-3 метоксифенил]-1,2,3,6-тетрагидропиридин. Получают в виде бледно-желтого вязкого масла (91%) из соединения, указанного в заголовке получения 53, и трифторуксусной кислоты, применяя способ получения 44.(М+Н)+. Получение 55. Метил-2-4-[4-(3-этоксифенил)-3-метоксифенил]-1,2,3,6-тетрагидропиридин-1-илсульфонилацетат. Получают в виде желтого полутвердого вещества (22%) из соединения, указанного в заголовке получения 54, и метилхлорсульфонилацетата, применяя способ получения 45.(М+Н)+. Получение 56. Метил-2-4-[4-(3-этоксифенил)фенил]-1,2,3,6-тетрагидропиридин-1-илсульфонилацетат. К раствору соединения, указанного в заголовке получения 38 (250 мг, 0,7 ммоль), в 1,2 диметоксиэтане (8 мл) добавляют 3-этоксифенилбороновую кислоту (168 мг, 1,0 ммоль),фторид цезия (226 мг, 1,5 ммоль), триортотолилфосфин (21 мг, 0,07 ммоль) и трис(дибензилиденацетон)дипалладий(0) (31 мг, 0,035 ммоль), затем реакционную смесь нагревают с обратным холодильником в течение приблизительно 4 ч в атмосфере азота. Полученной в результате смеси дают охладиться до комнатной температуры, затем разбавляют е этилацетатом и промывают насыщенным водным раствором бикарбоната натрия. Органическую фазу сушат(MgSO4) и выпаривают при пониженном давлении, затем остаток растирают со смесью гексанпростой эфир с получением указанного в заголовке соединения (222 мг) в виде бледножелтого твердого вещества, т.пл. 120-122 С. Обнаружено: С 64,25; Н 6,01; N 2,99.(М+NH4)+. Получение 57. 4-Бром-2-метилфенилдиазонийтетрафторборат. Получают в виде желтого твердого вещества (93%) из 4-бром-2-метиланилина и третбутилнитрита, применяя способ получения 51.(25%) из соединения, указанного в заголовке получения 57, и 3-метоксифенилбороновой кислоты, применяя способ получения 52.(СDСl3): 2,15 (s, 3 Н), 3,84 (s, 3 Н), 6,796,94 (m, 3 Н), 7,09 (s, 1H), 7,33 (d, 1H), 7,37 (d,1H), 7,43 (s, 1H). Получение 59. Трет-бутил-4-гидрокси-4[4-(3-метоксифенил)-3-метилфенил]пиперидин 1-карбоксилат. Получают в виде бесцветного масла (63%) из соединения, указанного в заголовке получения 58, и трет-бутил-4-оксопиперидин-1 карбоксилата, применяя способ получения 43.(М+Н)+. Получение 60. 4-[4-(3-Метоксифенил)-3 метилфенил]-1,2,3,6-тетрагидропиридин. Получают в виде бледно-желтого полутвердого вещества (93%) из соединения, указанного в заголовке получения 59, и трифторуксусной кислоты, применяя способ получения 44.(М+Н)+. Получение 61. Метил-2-4-[4-(3-метоксифенил)-3-метилфенил]-1,2,3,6-тетрагидропиридин-1-илсульфонилацетат. Раствор метилхлорсульфонилацетата (0,65 г, 3,7 ммоль) в дихлорметане (10 мл) по каплям добавляют к перемешиваемому раствору соединения, указанного в заголовке получения 60[5,4,0]ундек-7-ена (0,76 г, 4,9 ммоль) в дихлорметане (20 мл) при приблизительно 0 С, охлаждающую баню удаляют и реакционную смесь перемешивают при комнатной температуре в течение 4 ч, затем разбавляют дихлорметаном. Полученную в результате смесь промывают 0,1 М соляной кислотой, сушат (MgSO4) и выпаривают при пониженном давлении, затем остаток очищают флэш-хроматографией, применяя в качестве элюента дихлорметан, с получением указанного в заголовке соединения (250 мг) в виде бесцветного твердого вещества, т.пл. 8385 С.Bull., 1968, 16. 2456; 4,6 г, 25 ммоль) в безводном тетрагидрофуране (50 мл), в то же время поддерживая внутреннюю температуру ниже-60 С. Смесь перемешивают при приблизительно -70 С в течение 1 ч, затем по каплям добавляют триметилборат (4,4 мл, 38 ммоль), снова поддерживая внутреннюю температуру ниже 60 С. Реакционную смесь перемешивают при 70 С в течение 30 мин, затем дают медленно нагреться до комнатной температуры. Добавляют 2 М соляную кислоту, смесь экстрагируют дихлорметаном (3 х 50 мл) и объединенные экс 002882 58 тракты концентрируют при пониженном давлении. Остаток растворяют в простом эфире (50 мл), раствор экстрагируют 1 М водным раствором гидроксида натрия (2 х 30 мл) и водную фазу подкисляют 2 М соляной кислотой, затем экстрагируют простым эфиром (3 х 50 мл). Объединенные экстракты сушат (MgSO4) и выпаривают при пониженном давлении с получением указанного в заголовке соединения в виде белого твердого вещества (0,9 г, 24%).(t, 2H), 7,57 (t, 1H), 7,61 (s, 1H), 7,93 (s, 2H). Получение 63. Метил-2-4-[4-(3-этилфенил)-3-метилфенил]-1,2,3,6-тетрагидропиридин 1-илсульфонилацетат. Получают в виде желтого твердого вещества (75%), т.пл. 58-60 С, из соединений, указанных в заголовках получений 62 и 37, применяя способ получения 41.(M+NH4)+. Получение 64. Метил-4-4-[4-(3-метоксифенил)-3-метилфенил]-1,2,3,6-тетрагидропиридин-1-илсульфонилтетрагидропиран-4-карбоксилат. Получают в виде стекловидного твердого вещества (20%) из соединения, указанного в заголовке получения 61, и бис-2-йодэтилового эфира, применяя способ получения 39.(brs, 1H), 6,91 (m, 3 Н), 7,23 - 7,36 (m, 4H). МСНР (ХИАД): 486 (М+Н)+. Получение 65. 4-4-[4-(3-Метоксифенил)3-метилфенил]-1,2,3,6-тетрагидропиридин-1 илсульфонилтетрагидропиран-4-карбоновая кислота. Получают в виде бледно-желтого твердого вещества (93%), т.пл. 180-190 С, из соединения,указанного в заголовке получения 64, применяя способ получения 50.(СDСl3): 2,20-2,33 (m, 5H), 2,43 (m, 2H),2,65 (m, 2H), 3,43 (t, 2H), 3,67 (m, 2H), 3,82 (s,3 Н), 4,04 (m, 2H), 4,14 (m, 2H), 6,04 (brs, 1H),6,88 (m, 3 Н), 7,21 - 7,36 (m, 4H). Получение 66. Метил-4-4-[4-(3-метоксифенил)-3-метилфенил]пиперидин-1-илсульфонилтетрагидропиран-4-карбоксилат. Перемешиваемую смесь соединения, указанного в заголовке получения 64 (315 мг, 0,65 ммоль), формиата аммония (200 мг, 3,2 ммоль),10% палладия на углероде (50 мг) и метанола (5 мл) нагревают с обратным холодильником в течение 1,5 ч, затем дают охладиться и фильтруют. Фильтрат выпаривают при пониженном давлении и остаток распределяют между простым эфиром и водой. Органическую фазу су 59 шат (МgSO4) и выпаривают при пониженном давлении, затем остаток кристаллизуют из метанола с получением указанного в заголовке соединения (215 мг) в виде белого твердого вещества, т.пл. 137 -139 С.(m, 3H), 7,08 (m, 2H), 7,19 (d, 1H), 7,32 (m, 1H). МСНР (ХИАД): 486 (М+Н)+. Получение 67. 4-4-[4-(3-Метоксифенил)3-метилфенил]пиперидин-1-илсульфонилтетрагидропиран-4-карбоновая кислота. Получают в виде белого твердого вещества(84%), т.пл. 225-228 С, из соединения, указанного в заголовке получения 66, применяя способ получения 50, но со смесью метанола (5 мл) и тетрагидрофурана (10 мл) в качестве растворителя. Обнаружено: С 63,04; Н 6,59; N 2,91. С 25 Н 31NО 6S требует С 63,40; Н 6,60; N 2,96%.(78%) из соединения, указанного в заголовке получения 51, и 3-метоксифенилбороновой кислоты, применяя способ получения 52. Обнаружено: С 57,77; Н 4,51. C14H13BrO2 требует С 57,36; Н 4,47.(M+NH4)+. Получение 69. Трет-бутил-4-гидрокси-4[3-метокси-4-(3-метоксифенил)фенил]пиперидин-1-карбоксилат. Получают в виде бесцветного масла (67%) из соединения, указанного в заголовке получения 68, и трет-бутил-4-оксопиперидин-1 карбоксилата, применяя способ получения 43.(6,17 г, 32,5 ммоль) в толуоле (70 мл) нагревают с обратным холодильником в аппарате ДинаСтарка до полного удаления воды (приблизи 002882 60 тельно 4 ч), затем дают охладиться и разбавляют этилацетатом (100 мл). Полученную в результате смесь промывают 1 М водным раствором гидроксида натрия (3 х 50 мл), затем органическую фазу сушат (MgSО 4) и выпаривают при пониженном давлении с получением указанного в заголовке соединения (3,3 г) в виде желтого масла.(М+Н)+. Получение 71. Метил-2-4-[3-метокси-4(3-метоксифенил)фенил]-1,2,3,6-тетрагидропиридин-1-илсульфонилацетат. Получают в виде желтого полутвердого вещества (40%) из соединения, указанного в заголовке получения 70, и метилхлорсульфонилацетата, применяя способ получения 45. Обнаружено: С 58,87; Н 5,65; N 3,11.(М+Н)+. Получение 72. Метил-2-4-[3-метокси-4(3-метоксифенил)фенил]-1,2,3,6-тетрагидропиридин-1-илсульфонил-2-метилпропаноат. Получают в виде бесцветного полутвердого вещества (40%) из соединения, указанного в заголовке получения 71, и йодметана, применяя способ получения 49. Обнаружено: С 62,30; Н 6,29; N 3,00.(М+Н)+. Получение 73. Метил 2-4-[3-метокси-4-(3 метоксифенил)фенил]пиперидин-1-илсульфонил-2-метилпропаноат. Получают в виде бесцветного твердого вещества (80%), т.пл. 140-142 С, из соединения,указанного в заголовке получения 72, применяя способ получения 66. Обнаружено: С 62,31; Н 6,87; N 2,91. С 24 Н 31NО 6S требует С 62,45; Н 6,77; N 3,03%.
МПК / Метки
МПК: C07D 211/16, A61P 17/00, A61K 31/4425
Метки: производные, матрикса, мпм, качестве, кислоты, ингибиторов, металлопротеаз, гидроксамовой
Код ссылки
<a href="https://eas.patents.su/30-2882-proizvodnye-gidroksamovojj-kisloty-v-kachestve-ingibitorov-metalloproteaz-matriksa-mpm.html" rel="bookmark" title="База патентов Евразийского Союза">Производные гидроксамовой кислоты в качестве ингибиторов металлопротеаз матрикса (мпм)</a>
Предыдущий патент: Кристаллографически стабильные аморфные цефалоспориновые композиции и способ их получения
Следующий патент: Способ получения аминопроизводных алкилоксифуранона, получаемые этим способом соединения и применение этих соединений
Случайный патент: Способ и устройство для размещения отходов бурения с использованием вероятностного подхода


































