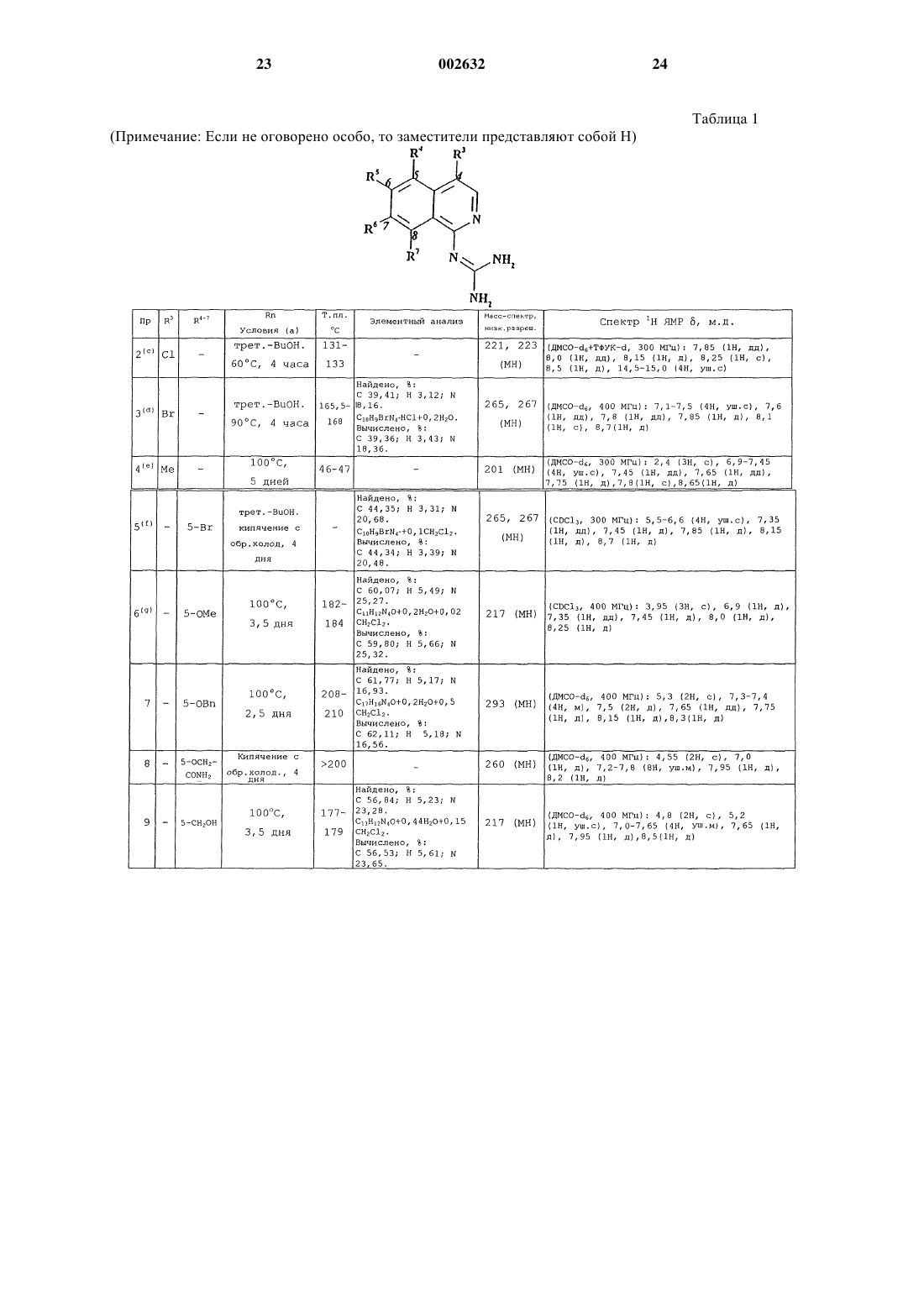
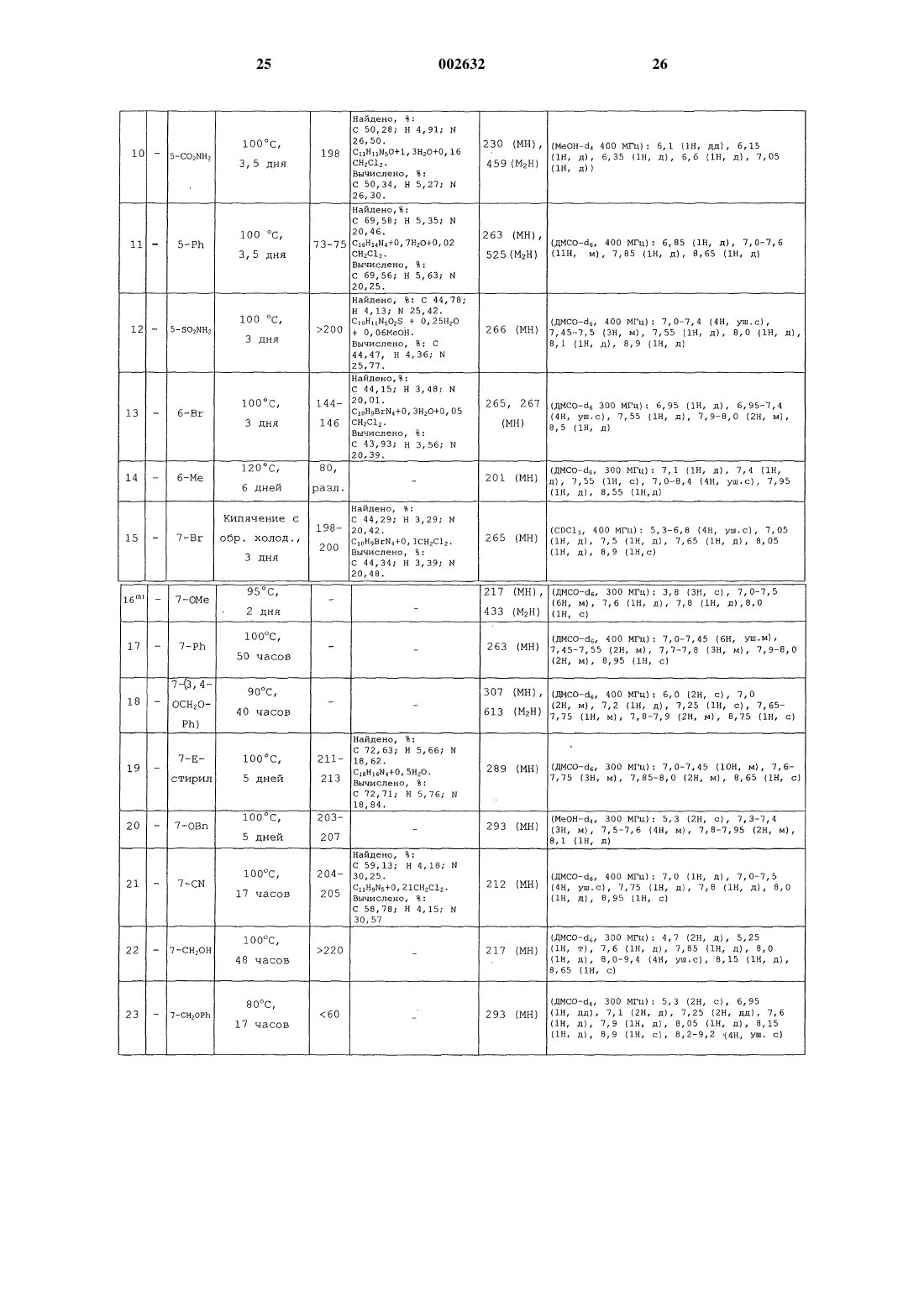
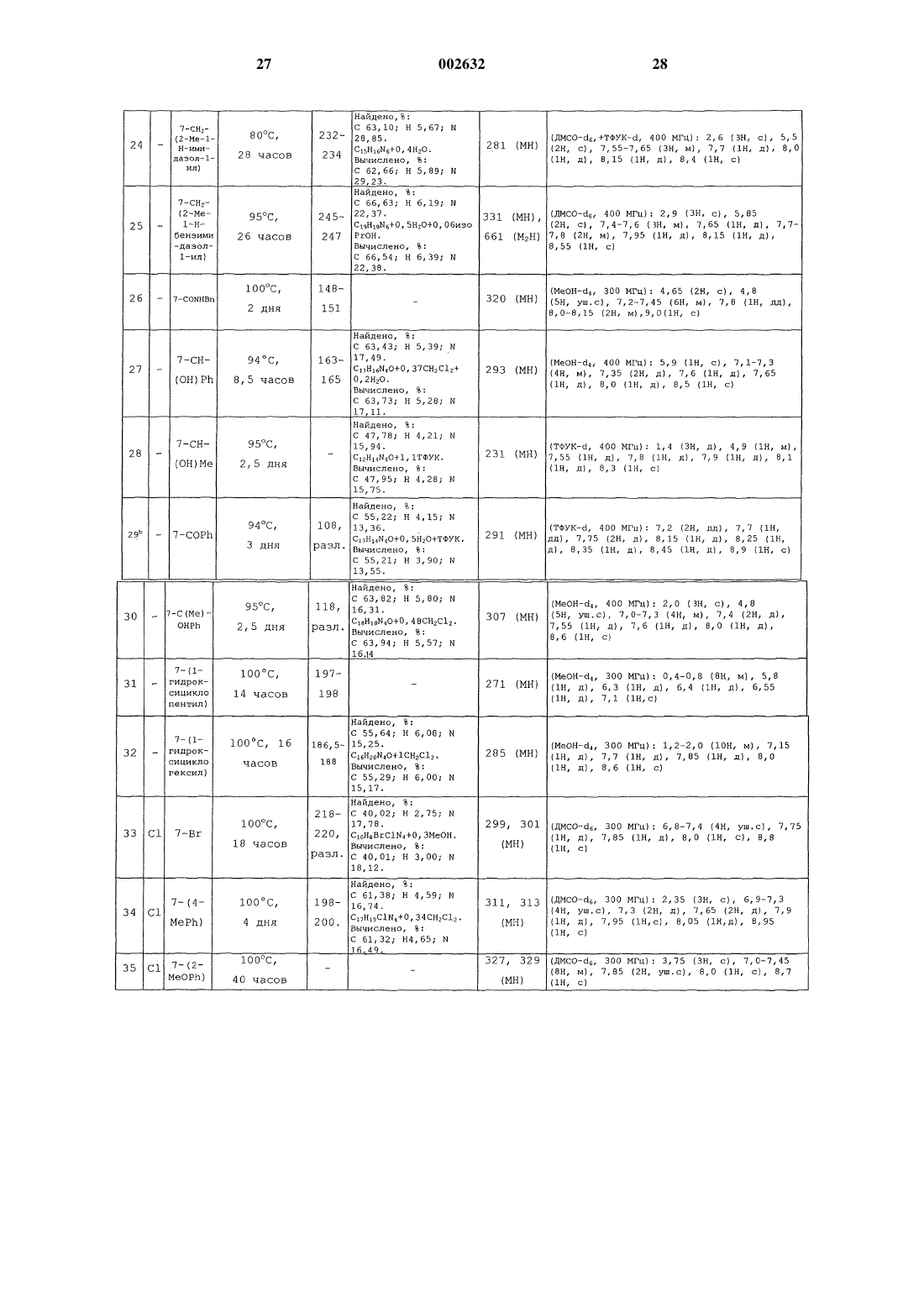
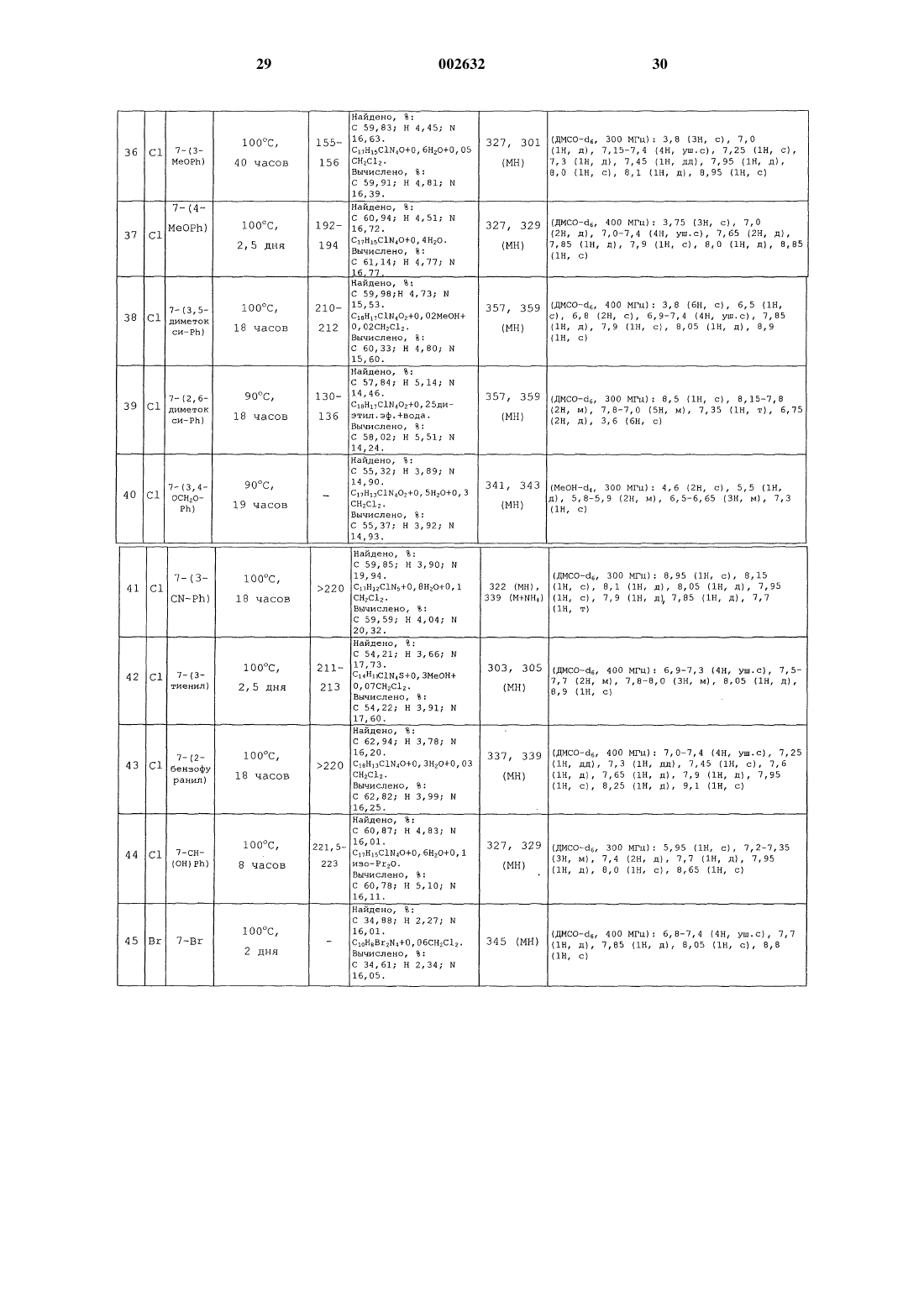
Изохинолины, способ их получения и применение в качестве ингибиторов урокиназы
Номер патента: 2632
Опубликовано: 29.08.2002
Авторы: Дикинсон Роджер Питер, Фиш Пол Винсент, Барбер Кристофер Гордон
Формула / Реферат
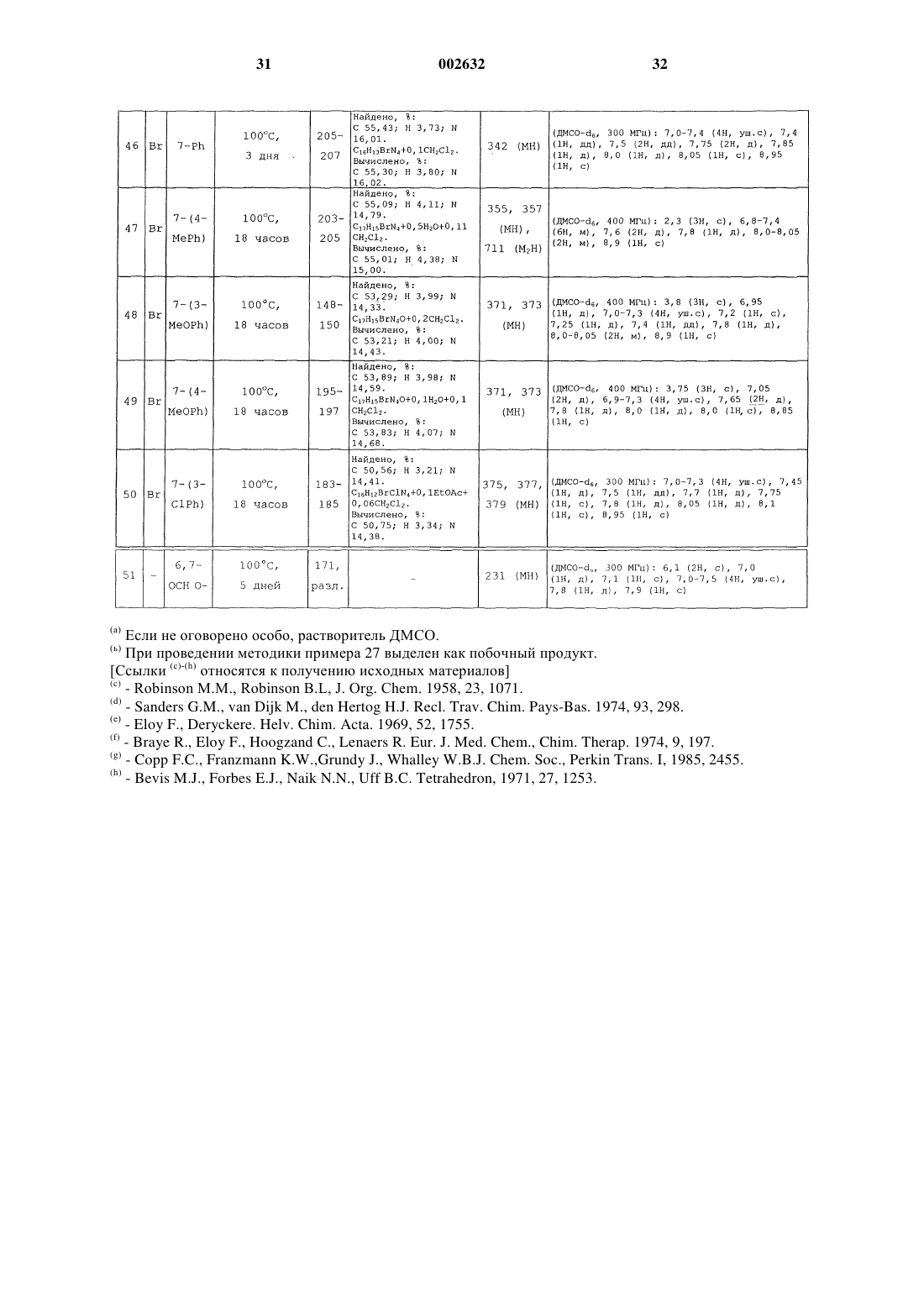
1. Соединение формулы (I)
или его фармацевтически приемлемая соль, где
один из R1 и R2 представляет собой Н, а другой представляет собой N=C(NH2)2 или NHC(=NH)NH2,
заместитель R3 представляет собой Н, галоген, С1-6-алкил, необязательно замещенный одним или более атомами галогена, или С1-6-алкоксигрулпу, необязательно замещенную одним или более атомами галогена,
каждый из заместителей R4, R5, R6 и R7 независимо представляет собой Н, ОН, галоген, C1-6-алкил, необязательно замещенный одним или более заместителями, независимо выбранными из атома галогена или ОH-гpyппы, С1-6-алкоксигруппу, необязательно замещенную одним или более атомами галогена, CN, СО(С1-6-алкил, необязательно замещенный одним или более атомами галогена), (Сm-алкилен)СО2R8, O(Сn-алкилен)СO2R8, О(Сn-алкилен)СN, (Сn-алкилен)СN, (Сm-алкилен)СONR9R10, (Сm-алкилен)NR9COR10, O(Сn-алкилен)СONR9R10, (Сm-алкилен)NR9SO2R11, (Сm-алкилен)S(O)pR11, (Сm-алкилен)SO2NR9R10, СН=СНСОR8, CH=CHCONR9R10, CH=CHSO2R8, CH=CHSO2NR9R10, CH=CHSO2-арил или группу формулы Х-арил или X-Нet или, когда два из R4, R5, R6 и R7 присоединены к соседним атомам углерода, они могут вместе образовывать -О(Сn-алкилен)O-часть,
R8 представляет собой Н, C1-6-алкил, необязательно замещенный одним или более атомами галогена, или арил(С1-6-алкилен),
R9 и R10, каждый независимо, представляет сoбой H, С1-6-алкил, необязательно замещенный одним или более атомами галогена, арил(С1-6-алкилен), арил, гетероарил или гетероарил (C1-6-алкилен) или R9 и R10 могут быть соединены вместе с помощью алкиленовой части с атомом, к которому они присоединены, с образованием 4-7-членного кольца, необязательно включающего дополнительную гетерогруппу, выбираемую из атомов О или S или NR12,
R11 представляет собой арил, гетероарил или C1-6-алкил, необязательно замещенный одним или более атомами галогена,
R12 представляет собой Н, C1-6-алкил, необязательно замещенный одним или более атомами галогена, или СO(С1-6-алкил, необязательно замещенный одним или более атомами галогена),
Х представляет собой простую связь, Сn-алкилен, О, (Сn-алкилен)О, O(Сn-алкилен), СН(ОН), С(С1-6-алкил)OН, СО, S(O)p(Сm-алкилен), (Сm-алкилен)S(O)p, СН=СН или CуC,
"арил" представляет собой фенил или нафтил, необязательно замещенный одним или более заместителями, независимо выбранными из атома галогена, С1-6-алкила, необязательно замещенного одним или более заместителями, независимо выбранными из атома галогена и ОН-группы, С1-6-алкоксигруппы, необязательно замещенной одним или более атомами галогена, CN, О(Сn-алкилен)СN, (Сn-алкилен)CN, СО(С1-6-алкил, необязательно замещенный одним или более атомами галогена), (Сm-алкилен) СО2R13, O(Сn-алкилен)СО2R13, (Сm-алкилен) CONR14R15, (Cm-aлкилен)NR14COR15, О(Сn-алкилен)CОNR14R15, (Сm-алкилен)S(O)pR13, (Cm-aлкилeн)SO2NR14R15, (Сm-алкилен)NR14SО2R15, CH=CHSO2R13, CH=CHSO2NR14R15, СН=СНSО2арил1, CH=CHCOR13 и CH=CHCONR14R15,
"гетероарил" представляет собой необязательно бензконденсированную 5- или 6-членную гетероциклическую группу, соединенную с помощью любого подходящего атома в гетероциклическом или бензольном кольце (если оно присутствует), и эта гетероциклическая группа выбрана из диоксолила, фурила, тиенила, пирролила, оксазолила, тиазолила, изоксазолила, изотиазолила, имидазолила, пиразолила, оксадиазолила, тиадиазолила, триазолила, тетразолила, пиридила, пиримидинила, пиридазинила, пиразинила и пиранила,
причем указанная "гетероарильная" группа необязательно замещена одним или более заместителями, независимо выбранными из атома галогена, С1-6-алкила, необязательно замещенного одним или более заместителями, независимо выбранными из атома галогена или ОН-группы, С1-6-алкоксигруппы, необязательно замещенной одним или более атомами галогена, CN, О(Сn-алкилен)СN, (Сn-алкилен)CN, СО(С1-6-алкила, необязательно замещенного одним или более атомами галогена), (Сm-алкилeн)СО2R13, O(Сn-алкилен)CO2ОR13, (Сm-алкилен)-CONR14R15, (Сm-алкилен)NR14COR15, O(Сn-алкилен)СОNR14R15, (Сm-алкилен)NR14SO2R16, (Сm-алкилен) S(O)pR13, (Сm-алкилен)SO2NR14R15, CH=CHCOR13, CH=CHCONR14R15, СН=СНSО2R13, CH=CHSO2NR14R15 или СН=СНSО2арил1,
Неt представляет собой необязательно бензоконденсированную 5- или 6-членную гетероциклическую группу, присоединенную к X части любым доступным атомом в гетероциклическом или бензольном (если оно присутствует) кольце, и эта гетероциклическая группа выбрана из диоксолила, диоксоланила, фурила, тиенила, пирролила, оксазолила, оксазинила, тиазинила, тиазолила, изоксазолила, изотиазолила, имидазолила, пиразолила, оксадиазолила, тиадиазолила, триазолила, тетразолила, пиридила, пиримидинила, пиридазинила, пиразинила и пиранила, или ее полностью ненасыщенный, частично или полностью насыщенный аналог,
причем такая Неt группа необязательно замещена одним или более заместителями, независимо выбранными из атома галогена, С1-6-алкила, необязательно замещенного одним или более заместителями, выбранными из атома галогена и ОН-групп C1-6-aлкоксигруппы, необязательно замещенной одним или более атомами галогена, CN, О(Сn-алкилен)ОN, (Сn-алкилен)СN, СО(C1-6-aлкилa, необязательно замещенного одним или более атомами галогена), (Сm-алкилен)СО2R13, О(Сn-алкилен)СО2R13, (Сm-алкилен)CONR14R15, (Сm-алкилен)NR14СОR15, O(Сn-алкилен)CONR14R15, (Сm-алкилен)NR14SO2R16, (Cm-aлкилeн)S(O)pR13, (Сm-алкилен)SO2NR14R15, CH=CHCOR13, CH=CHCONR14R15, CH=CHSO2R13, CH=CHSO2NR14R15 и CH=CHSO2apил1,
"арил1" представляет собой фенил или нафтил, необязательно замещенный одним или более заместителями, независимо выбранными из атома галогена, С1-6-алкила, необязательно замещенного одним или более заместителями, независимо выбранными из атома галогена и ОН-группы, С1-6-алкоксигруппы, необязательно замещенной одним или боыхх атомами галогена, CN, О(Сn-алкилен)СN, (Сn-алкилен)СN, СО(С1-6-алкила, необязательно замещенного одним или более атомами галогена), (Сm-алкилен)CO2R13, О(Cn-алкилен)CO2R13, (Сm-алкилен)-CONR14R15, (Сm-алкилен)NR14СОR15, О(Сn-алкилен)CONR14R15, (Сm-алкилен)S(О)pR13, (Сm-алкилен)SO2NR14R15, (Сm-aлкилен)NR14SO2R16, СH=СHSO2R13, CH=CHSO2NR14R15, CH=CHCOR13 и CH=CHCONR14R15,
R13 представляет собой Н, С1-6-алкил, необязательно замещенный одним или более атомами галогена, или арил2 (С1-6-алкилен),
R14 и R15 независимо представляют собой Н, С1-6-алкил, необязательно замещенный одним или более атомами галогена, apил2(C1-6-алкилен), арил2, гетероарил1 или гетероарил1(С1-6-алкилен),
R14 и R15 могут быть соединены вместе с помощью алкиленовой части с атомом, к которому они присоединены, с образованием 4-7-членного кольца, необязательно содержащего дополнительную гетерогруппу, выбранную из атомов О, или S, или NR12,
R16 представляет собой apил2, гетероарил1 или С1-6-алкил, необязательно замещенный одним или более атомами галогена,
"арил2" представляет собой фенил или нафтил, необязательно замещенный одним или более заместителями, независимо выбранными из атома галогена, С1-6-алкила, необязательно замещенного одним или более заместителями, независимо выбранными из атома галогена или ОН-группы, C1-6-алкоксигруппы, необязательно замещенной одним или более атомами галогена, CN, О(Cn-aлкилен)CN, (Cn-aлкилен)CN или СО(C1-6-алкила, необязательно замещенного одним или более атомами галогена),
"гетероарил1" представляет собой необязательно бензконденсированную 5- или 6-членную гетероциклическую группу, соединенную с помощью любого подходящего атома в гетероциклическом или бензольном кольце (если оно присутствует), и эту гетероциклическую группу выбирают из диоксолила, фурила, тиенила, пирролила, оксазолила, тиазолила, изоксазолила, изотиазолила, имидазолила, пиразолила, оксадиазолила, тиадиазолила, триазолила, тетразолила, пиридила, пиримидинила, пиридазинила, пиразинила и пиранила,
причем указанный "гетероарил1" необязательно замещен одним или более заместителями, независимо выбранными из атома галогена, C1-С6-алкила, необязательно замещенного одним или более заместителями, независимо выбранными из атома галогена или ОН-группы, C1-6-алкоксигруплы, необязательно замещенной одним или более атомами галогена, CN, О(Сn-алкилен)CN, (Сn-aлкилен)CN или СО(C1-6-алкила, необязательно замещенного одним или более атомами галогена),
где "С-алкилен"-связывающая группа в приведенных выше определениях представляет собой линейную или разветвленную группу и необязательно замещенную одним или более (C1-6-алкилами, необязательно замещенными одним или более атомами галогена),
m представляет собой целое число от 0 до 3,
n представляет собой целое число от 1 до 3, и
р представляет собой целое число от 0 до 2.
2. Соединение или соль по п.1, где R1 представляет собой N=C(NH2)2 или NHC(=NH)NH2 и R2 представляет собой Н.
3. Соединение или соль по п.1 или 2, где R3 представляет собой Н, галоген или C1-6-алкил, необязательно замещенный одним или более атомами галогена.
4. Соединение или соль по любому из предыдущих пунктов, где заместитель R4 представляет собой Н, ОН, атом галогена, C1-6-алкил, необязательно замещенный одним или более заместителями, независимо выбранными из атома галогена или ОН-группы, C1-6-алкоксигруппу, необязательно замещенную одним или более атомами галогена, CN, (Сm-алкилен)CONR9R10, О(Сn-алкилен)CONR9R10, (Сm-алкилен)SO2NR9R10, или группу Х-арил или X-Het.
5. Соединение или соль по любому из предыдущих пунктов, где заместитель R5 представляет собой Н, атом галогена или С1-6-алкил, необязательно замещенный одним или более заместителями, независимо выбранными из атома галогена или ОН-группы.
6. Соединение или соль по любому из предыдущих пунктов, где заместитель R6 представляет собой Н, атом галогена или C1-6-алкил, необязательно замещенный одним или более заместителями, независимо выбранными из атома галогена или ОН-группы, C1-6-алкоксигруппу, необязательно замещенную одним или более атомами галогена, CN, О(Сn-алкилен)CN, (Сn-алкилен)CN, (Сm-алкилен)CONR9R10, (Cm-алкилен)CO2R8, (Cm-алкилен)SO2NR9R10, (Cm-алкилен)S(O)pR11 или группу формулы Х-арил или X-Het.
7. Соединение или соль по любому из предыдущих пунктов, где заместитель R7 представляет собой Н.
8. Соединение или соль по любому из предыдущих пунктов, где заместитель R3 представляет собой Н, Сl, Вr или метил, необязательно замещенный одним или более атомами галогена.
9. Соединение или соль по любому из предыдущих пунктов, где заместитель R4 представляет собой Н, Br, OH, CN, C1-6-алкокси-, C1-6-алкил, необязательно замещенный одной или более группами OH, SO2NR9R10, CONR9R10, OCH2CONR9R10, ОСH2-арил, Неt или арил.
10. Соединение или соль по любому из предыдущих пунктов, где заместитель R5 представляет собой H, Вr или метил, необязательно замещенный одним или более атомами галогена.
11. Соединение или соль по любому из предыдущих пунктов, где заместитель R6 представляет собой Н, Сl, Вr, С1-6-алкил, необязательно замещенный одной или более ОН-группами, C1-6-алкоксигруппу, CN, (Сm-алкилен)СОNR9R10, (Сm-алкилен)CO2R8, (Сm-алкилен)-S(O)pR11, (Сm-алкилен)SO2NR9R10 или группу формулы Х-арил или X-Het, где Х представляет собой простую связь, СН=СН, СН(СH), CO, ОСH2, СH2O или СН2.
12. Соединение или соль по любому из предыдущих пунктов, где заместитель R3 представляет собой Н, Сl, Вr или метил.
13. Соединение или соль по любому из предыдущих пунктов, где заместитель R4 представляет собой Н, Вr, ОН, CN, C1-6-алкоксигруппу, C1-6-алкил, необязательно замещенный одной или более группами OH, SO2NR9R10, СОNH(арил(С1-6-алкил)), СONH2, OCH2CONR9R10, ОСН2-арил, фенил или нафтил.
14. Соединение или соль по любому из предыдущих пунктов, где R5 представляет собой Н, Вr или метил.
15. Соединение или соль по любому из предыдущих пунктов, где R6 представляет собой Н, Вr, метил, необязательно замещенный ОН-группой, этил, необязательно замещенный ОН-группой, циклопентил, необязательно замещенный ОН-группой, циклогексил, необязательно замещенный ОН-группой, C1-6-алкоксигруппу, CN, О(Сn-алкилен)CN, (Сn-алкилен)СN, SO2R11, SR11, CONR9R10, CO2R8, SO2NR9R10, группу формулы Х-(необязательно замещенный фенил) или X-Het1, где Х представляет собой простую связь, СН=СН, СН(ОН), СО, ОСН2, СН2О или СН2,
и где фенильная часть, связаннная через X, необязательно замещена одним или более атомами галогена, C1-6-алкилом, необязательно замещенным одним или более заместителями, независимо выбранным из галогена и ОН-группы, C1-6-алкоксигруппой, необязательно замещенной одним или более атомами галогена, или CO2R13,
где Het1 представляет собой необязательно бензконденсированный диоксолил, фурил, тиенил, имидазолил или их частично или полностью насыщенные аналоги,
и такая Het1-группа, связанная через X, необязательно замещена одним или более С1-6-алкилами, необязательно замещенными одним или более заместителями, независимо выбранными из атома галогена и ОН-группы.
16. Соединение или соль по любому из предыдущих пунктов, где R4 представляет собой Н, Br, CN, ОСН2, SO2NH2, CH2OH, СОNН2, OCH2CONH2, CONHBn, OBn, ОН или Ph.
17. Соединение или соль по любому из предыдущих пунктов, где R6 представляет собой Н, Br, CO2H, (E)CH=CHPh, Ph, ОСН3, 1,3-бензо[d]диoкcoл-5-ил, CN, СН2ОН, CONHBn, 4-метоксифенил, 1-гидроксициклогексил, 1-гидроксициклопентил, COPh, СН(ОН)СН3, CH(OH)Ph, CCH3(OH)Ph, OCH2Ph, SO2Ph, SPh, CH2OPh, SO2NH2, SO2NHPh, SO2NH(циклопентил), SO2(пирролидино), SO2(морфолино), SO2(N-метилпиперазино), (2-метилимидазол-1-ил)метил, (2-метилбензимидазол-1-ил)метил, бензофуран-2-ил, тиен-3-ил, тиен-2-ил, 4-метилфенил, 2-метоксифенил, 3-метоксифенил, 3,5-диметоксифенил, 2,6-диметоксифенил, 3-карбоксифенил, 3-цианофенил или 3-хлорфенил.
18. Соединение или соль по любому из предыдущих пунктов, где R6 представляет собой CH(OH)Ph, 2-метоксифенил, 3-метоксифенил, 4-метоксифенил, 2,6-диметоксифенил, SO2NH2, SO2NHPh, SO2NH(циклопентил), SO2(пирролидино), SO2(морфолино), SO2Ph, SPh, SO2(N-метилпиперазино) или 3-карбоксифенил.
19. Соединение или соль по п.1, где R1 представляет собой N=C(NH2)2 или NHC(=NH)NH2, каждый из R2, R4, R5 и R7 представляет собой Н, R3 представляет собой Br или Сl и R6 представляет собой 2-метоксифенил, 4-метоксифенил, CH(OH)Ph, SO2Ph, SPh, 3-карбоксифенил или 3-метоксифенил.
20. Соединение или соль по п.1, где два из заместителей R4, R5, R6 и R7 присоединены к соседним углеродным атомам и вместе образуют ОСН2О часть.
21. Соединение или соль по п.1, выбранные из
(4-хлор-7-(2-метоксифенил)изохинолин-1-ил)гуанидина;
(4-хлор-7-(3-метоксифенил)изохинолин-1-ил)гуанидина;
(4-хлор-7-(4-метоксифенил)изохинолин-1-ил)гуанидина;
(4-xлop-7-(2,6-диметоксифенил)изохинолин-1-ил)гуанидина;
(4-бром-7-(3-метоксифенил)изохинолин-1-ил)гуанидина;
(4-бром-7-(4-метоксифенил)изохинолин-1-ил)гуанидина;
(4-хлор-7-(a-гидроксибензил)изохинолин-1-ил)гуанидина;
(4-хлор-7-(3-карбоксифенил)изохинолин-1-ил)гуанидина;
1-гуанидино-7-сульфамоилизохинолина;
1-гуанидино-7-фенилсульфамоилизохинолина;
4-хлор-1-гуанидино-7-сульфамоилизохинолина;
4-хлор-7-циклопентилсульфамоил-1-гуанидиноизохинолина;
гидрохлорида 4-хлор-1-гуанидино-7-(1-пирролидиносульфонил)изохинолина;
гидрохлорида 4 -хлор-1-гуанидино-7-морфолиносульфонилизохинолина;
4-хлор-1-гуанидино-7-[(N-метилпиперазино)сульфонил]изохинолино;
4-хлор-1-гуанидино-7-(фенилсульфанил)изохинолина;
4-хлор-1-гуанидино-7-(фенилсульфонил)изохинолина
и их солей.
22. Фармацевтическая композиция, содержащая соединение или соль по любому из предыдущих пунктов, в смеси с совместимым адъювантом, разбавителем или носителем.
23. Соединение или соль по любому из пп.1-21 для применения в качестве медикамента.
24. Применение соединения или соли по любому из пп.1-21 для получения медикамента для лечения состояния или процесса, опосредуемого урокиназой.
25. Применение по п.24, где состояние или процесс выбираются из таких, как хроническая кожная язва, развитие кровеносных сосудов (нео-васкуляризация), костная реконструкция, имплантация эмбриона в матку, инфильтрация иммуноклеток в воспалительные сайты, овуляция, сперматогенез, восстановление ткани в процессе заживления раны и дифференциации органа, фиброз, локальная инвазия опухолей в соседние участки, метастатическое распространение опухолевых клеток от первичных сайтов к вторичным и разрушение ткани при артрите.
26. Способ лечения состояния или процесса, опосредуемого uPA, который включает введение эффективного количества соединения или соли по любому из пп.1-21 или фармацевтической композиции, определенной в п.22.
27. Способ по п.26, где состояние или процесс представляют собой хроническую кожную язву, развитие кровеносных сосудов (нео-васкуляризация), костную реконструкцию, имплантацию эмбриона в матку, инфильтрацию иммуноклеток в воспалительные сайты, овуляцию, сперматогенез, восстановление ткани в процессе заживления раны и дифференциации органа, фиброз, локальную инвазию опухолей в соседние участки, метастатическое распространение опухолевых клеток от первичных сайтов к вторичным и разрушение ткани при артрите.
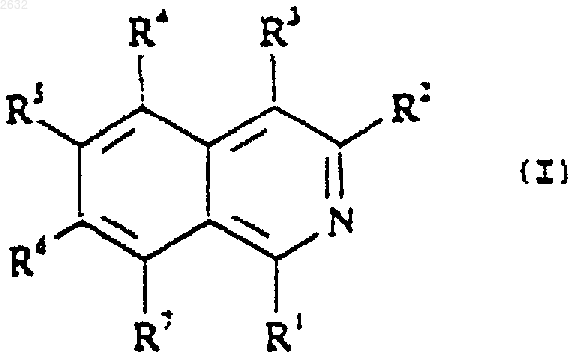
28. Способ получения соединения по п.1 или его соли, который включает взаимодействие производного 1- или 3-аминоизохинолина (II), где R3, R4, R5, R6 и R7 определены в п.1
с цианамидом (NH2CN) или другим реагентом, действующим как "NHC+=NH"-cинтон.
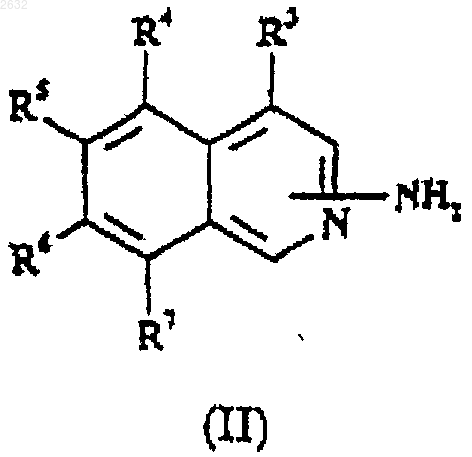
29. Способ получения соединения или соли по п.1, который включает взаимодействие производного 1- или 3-аминоизохинолина (II), которое определено в п.28, с реагентом, который действует как защищенный амидин(2+)синтон (IV)

где Р и P1 представляют собой N-защищающие группы, через образование соединения формулы (V) или его соли
и снятие защитных групп.
30. Способ получения соединения формулы (I) по п.1 или его соли, который включает взаимодействие соединения формулы (VI)
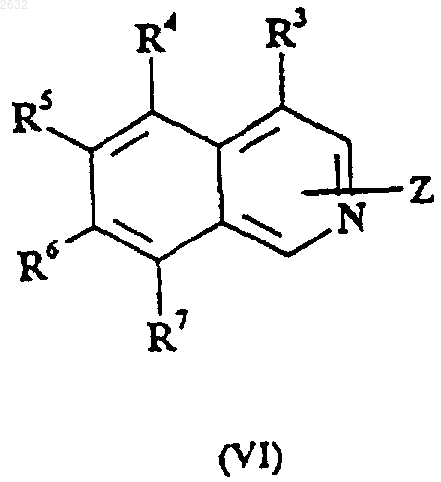
где R3, R4, R5, R6 и R7 определены в п.1 и где Z присоединен в 1 или 3 соответственно положении и представляет собой уходящую группу, путем замещения уходящей группы свободным основанием гуанидина.
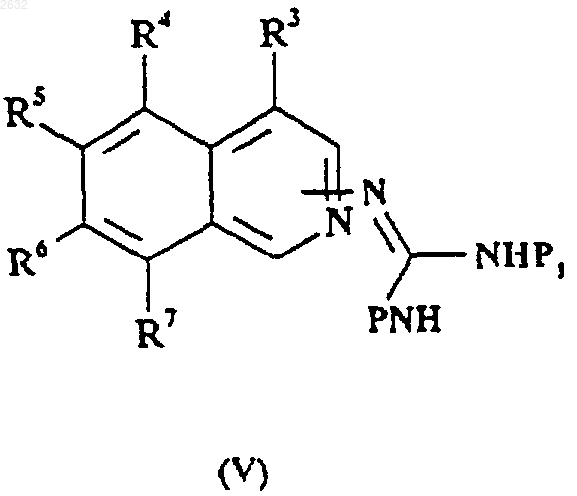
31. Соединение формулы (V)

где R3, R4, R5, R6 и R7 принимают значения, определенные в п.1,
P и P1 представляют собой N-защищающие группы,
или его соль.
Текст
1 Изобретение относится к некоторым изохинолинам, которые могут быть использованы в качестве ингибиторов урокиназы, и в частности к изохинолинилгуанидинам, полезным в качестве ингибиторов урокиназы. Урокиназа (активатор плазминогена уринового типа или uРА; классификационный номер по International Union of Biochemistry ЕС.3.4.21.31) представляет собой серинпротеазу, продуцируемую большим числом типов клеток (клетки гладких мышц, фибробласты, эндотелиальные клетки, макрофаги и опухолевые клетки). Считают, что она играет ключевую роль при клеточной инвазии и восстановлении ткани. Основным субстратом для uРА является плазминоген, который преобразуется uРА, связанной с поверхностью клетки, с образованием серинпротеазплазмина. Продуцированные локально высокие концентрации плазмина опосредуют инвазию клетки путем разрушения внеклеточной матрицы. Важными процессами,включающими клеточную инвазию и восстановление ткани, являются заживление ран, восстановление кости, развитие кровеносных сосудов, опухолевая инвазивность и распространение метастаз. Положительное влияние ингибиторов урокиназы было показано с использованием антиурокиназных моноклональных антител и некоторых других известных ингибиторов урокиназы. Например, как было сообщено, антиурокиназные моноклональные антитела блокируют инвазивность опухолевой клетки in vitro (W.Res. 51:274 (1991) и развитие кровеносных сосудов in vivo (J.A. Jerdan et al, J. Cell Biol. 115 [3Pt 2]:402a (1991). Кроме того, Amiloride, известный ингибитор урокиназы средней эффективности, как указывается, ингибирует опухолевые метастазы in vivo (J.A. Kellen et al, Anticancer Res., 8:1378 (1988 и развитие кровеносных сосудов/образование капиллярной сети in vitro(М.А. Alliegro et al., J. Cell Biol., 115 [3 Pt 2]: 402a). Состояния, представляющие особый интерес для лечения ингибиторами урокиназы,включают хронические кожные язвы (в том числе венозные язвы, диабетические язвы и пролежни), которые являются основной причиной болезненности у пожилых людей и причиной значительного экономического бремени на системы здравоохранения. Хронические кожные язвы характеризуются чрезмерным неконтролируемым протеолитическим разрушением, приводящим к распространению язвы, потере функциональных матричных молекул (например, фибронектина) и задержке эпителизации и заживления язвы. Рядом групп изучены ферменты, ответственные за чрезмерную деградацию в 2 области раны, и освещена роль активаторов плазминогена (М.С. Stacey et. al, Br. J. Surgery,80, 596; М. Palolahti et al., Exp. Dermatol., 2, 29,1993; A. A. Rogers et al., Wound Repair and Regen., 3, 273, 1995). Нормальная кожа человека имеет низкие уровни активаторов плазминогена,которые локализованы у кровеносных сосудов и идентифицируются как активаторы плазминогена тканевого типа (tPA). С другой стороны, хронические язвы отличаются высокими уровнями активатора плазминогена урокиназного типа(uРА), которые диффузионно локализованны по всему периметру язвы и повреждения и легко обнаруживаются в выделениях из раны.uРА может влиять на заживление ран несколькими путями. Плазмин, продуцируемый путем активации плазминогена, может вызывать разрушение внеклеточной матрицы посредством как непрямых (через активацию матричных металлопротеаз), так и прямых средств. Плазмин,как показано, разрушает несколько внеклеточных матричных компонентов, в том числе желатин, фибронектин, протеины протеоглуканового ядра, а также его основной субстрат, фибрин. Хотя активация матричных металлопротеаз(MМП) может быть осуществлена с помощью ряда протеаз воспалительных клеток (например,эластазы и катепсина G), каскад uРА/плазмин вовлечен в активацию ММП in situ, создавая широкую возможность для разрушения всех компонентов внеклеточной матрицы. Кроме того, помимо влияния на продуцирование плазмина, uРА, как показано, катализирует прямое расщепление фибронектина с образованием антипролиферативных пептидов. Следовательно,сверхэкспрессия uPA в окружении раны имеет потенциальную способность стимулировать неконтролируемое разложение матриц и ингибирование восстановления ткани. Ингибиторы фермента, таким образом, обладают потенциальной способностью содействовать заживлению хронических повреждений. Несколько родственных ферментов, таких как tPA, которые также действуют через продуцирование плазмина, играют ключевую роль в фибринолитическом каскаде. Из-за этого важно,чтобы ингибитор имел адекватную эффективность и селективность для uPA относительно как к tPA, так и к плазмину, чтобы исключить вероятность антифибринолитических побочных эффектов. Полезность таких активных и селективных ингибиторов урокиназы показана с помощью широкого ряда инвазивных биологических процессов, опосредуемых урокиназой. Такие процессы включают, но не ограничиваются ими,заживление ран, состояния, зависимые от развития кровеносных сосудов, такие как ретинопатия, костная реструктуризация, имплантация эмбриона в матку, инфильтрация иммуноклеток в восполнительные сайты, овуляция, стерматогенез, восстановление ткани в процессе зажив 3 ления раны и дифферециация органов, фиброз,локальная инвазия опухолей в соседние области, метастатическое распространение опухолевых клеток от первичного участка к вторичному и разрушение ткани при артрите. Сообщалось, что различные ароматические амидины ингибируют uPA (J.D. Geratz, M.C.-F.Res., 24, 73, 1981). Соединения, представленные в этой публикации, являются относительно слабыми и/или не селективными для uPA относительно других родственных серинпротеаз. В публикации ЕР 0568289 А 2 описана серия бензо[b]тиофен-2-карбоксамидинов со значительно большей активностью и селективностью по отношению к tPA и плазмину (см. также M.J.Bridges et al., Bioorg. Med. Chem., 1, 403, 1993). Есть несколько сообщений о производных гуанидина в качестве ингибиторов uPA. Amiloride (см. ниже) является слабым, но селективным ингибитором uPA (J.-D. Vassalli, D. Belin,FEBS Letters, 214, 187), а различные замещенные фенилгуанидины, как сообщалось, имеют аналогичный уровень активности (Н. Yang et al.,J.Med. Chem., 33, 2956, 1990). Соединения, описанные здесь, представляют собой активные обратимо конкурентоспособные ингибиторы урокиназной ферментативной активности с селективностью для урокиназы относительно некоторых других важных протеаз, в том числе фибринолитических ферментов активаторов плазминогена (tPA) тканевого типа и плазмина. Селективность заявляемых в настоящем изобретении соединений в отношении ингибирования урокиназы по сравнению с ингибированием других протеаз, таких как tPA и плазмин, и тот факт, что они ингибируют обратимо,обеспечивают отсутствие у них тромбогенных свойств. Таким образом, в настоящем изобретении предлагается производное изохинолинилгуанидина формулы (I) или его фармацевтически приемлемая соль, где 4 один из R1 и R2 представляет собой Н, а другой представляет собой N=C(NH2)2 илиNHC(=NH)NH2,заместитель R3 представляет собой Н, галоген, C1-6-алкил, необязательно замещенный одним или более атомами галогена, или C1-6 алкоксигруппу, необязательно замещенную одним или более атомами галогена,каждый из заместителей R4, R5, R6 и R7 независимо представляет собой Н, ОН, галоген,C1-6 алкил, необязательно замещенный одним или более заместителями, независимо выбранными из атома галогена или ОН-группы, C1-6 алкоксигруппу, необязательно замещенную одним или более атомами галогена, CN, СО(C1-6 алкил, необязательно замещенный одним или более атомами галогена), (Сm-алкилен)СO2R8,(Сn-алкилен)СN, О(Сn-алкилен)CN, O(Сn-алкилен)СO2R8, (Сm-алкилен)СОNR9R10, (Сm-алкилен)NR9CОR10, О(Сn-алкилен)CONR9R10, (Сmaлкилен)NR9SO2R11, (Сm-алкилен)S(O)pR11, (Cmaлкилeн)SO2NR9R10,CH=CHCOR8,CH= 9 10CHCONR R , CH=CHSO2R8,CH=CHSO2NR9R10, СН=СНSO2-арил, или группу формулы Х-арил или X-Het,или, когда два из R4, R5, R6 и R7 присоединены к соседним атомам углерода, они могут вместе образовывать -O(Сn-алкилен)O-часть,R8 представляет собой Н, C1-6-алкил, необязательно замещенный одним или более атомами галогена, или арил(C1-6-алкилен),R9 и R10 каждый независимо представляет собой Н, C1-6-алкил, необязательно замещенный одним или более атомами галогена, арил(C1-6 алкилен), арил, гетероарил или гетероарил(С 1-6 алкилен),или R9 и R10 могут быть соединены вместе с помощью алкиленовой части с атомом, к которому они присоединены, с образованием 4-7 членного кольца, необязательно включающего дополнительную гетерогруппу, выбранную из атомов О или S или NR12,R11 представляет собой арил, гетероарил или C1-6-алкил, необязательно замещенный одним или более атомами галогена,R12 представляет собой Н, C1-6-алкил, необязательно замещенный одним или более атомами галогена, или СО(С 1-6-алкил, необязательно замещенный одним или более атомами галогена),Х представляет собой простую связь, Сnалкилен, О, (Сn-алкилен)O, О(Сn-алкилен),СН(ОН), С(С 1-6-алкил)ОН, СО, S(O)p(Сm-алкилен), (Сm-алкилен)S(O)p, СН=СН или СС,"арил" представляет собой фенил или нафтил, необязательно замещенный одним или более заместителями, независимо выбранными из атома галогена, C1-6-алкила, необязательно замещенного одним или более заместителями,независимо выбранным из атома галогена и ОНгруппы, C1-6-алкоксигруппы, необязательно замещенной одним или более атомами галогена, 5CN, О(Сn-алкилен)CN, (Сn-алкилен)CN, СО(С 1-6 алкил, необязательно замещенный одним или более атомами галогена), (Сm-алкилен)CO2R13,О(Сn-алкилен)CO2R13, (Сm-aалкилен)CONR14R15,(Cm-aлкилен)NR14COR15,О(Сn-алкилен)CONR14R15,(Сm-алкилен)S(O)pR13,(Сmалкилен)SO2NR14R15, (Сm-алкилен)NR14SO2R16,CH=CHSO2R13, CH=HSO2NR14R15, СН=СНSO2 арил 1, CH=CHCOR13 и CH=CHCONR14R15,"гетероарил" представляет собой необязательно бензконденсированную 5- или 6-членную гетероциклическую группу, соединенную с помощью любого подходящего атома в гетероциклическом или бензольном кольце (если оно присутствует), и эта гетероциклическая группа выбрана из диоксолила, фурила, тиенила, пирролила, оксазолила, тиазолила, изоксазолила,изотиазолила, имидазолила, пиразолила, оксадиазолила, тиадиазолила, триазолила, тетразолила, пиридила, пиримидинила, пиридазинила,пиразинила и пиранила,причем указанная "гетероарильная" группа необязательно замещена одним или более заместителями, независимо выбранными из атома галогена, C1-6-алкила, необязательно замещенного одним или более заместителями, независимо выбранными из атома галогена или ОНгруппы, C1-6-алкоксигруппы, необязательно замещенной одним или более атомами галогена,CN, О(Сn-алкилен)CN, (Сn-алкилен)CN, СО(C1-6 алкила, необязательно замещенного одним или более атомами галогена), (Сm-алкилен)СO2R13,О(Сn-алкилен)CO2R13, (Сm-алкилен)CONR14R15,(Сm-алкилен)NR14 СОR15,О(Сn-алкилен)CHSO2R ,CH=CHSO2NR14R15 или СН=СНSO2aрил 1,"Het" представляет собой необязательно бензконденсированную 5- или 6-членную гетероциклическую группу, присоединенную к "X" части любым доступным атомом в гетероциклическом или бензольном (если оно присутствует) кольце, и эта гетероциклическая группа выбрана из диоксолила, диоксоланила, фурила, тиенила,пирролила, оксазолила, оксазинила, тиазинила,тиазолила, изоксазолила, изотиазолила, имидазолила, пиразолила, оксадиазолила, тиадиазолила, триазолила, тетразолила, пиридила, пиримидинила, пиридазинила, пиразинила и пиранила,или е полностью ненасыщенный, частично или полностью насыщенный аналог,причем такая "Het" группа необязательно замещена одним или более заместителями, независимо выбранными из атома галогена, C1-6 алкила, необязательно замещенного одним или более заместителями, выбранными из атома галогена и ОН-группы, C1-6-алкоксигруппы, необязательно замещенной одним или более атомами галогена, CN, О(Сn-алкилен)CN, (Сnалкилен)CN, СО(С 1-6-алкила, необязательно за 002632 6 мещенного одним или более атомами галогена),(Сm-алкилен)СO2R13, О(Сn-алкилен)CO2R13, (Сmалкилен)CONR14R15,(Сm-алкилен)NR14 СОR15,14 15 О(Сn-алкилен)CONR R ,(Сm-алкилен)NR14R15, CH=CHSO2R13, CH=CHSO2NR14R15 и СН=СНSO2 арил 1,"арил 1" представляет собой фенил или нафтил, необязательно замещенный одним или более заместителями, независимо выбранными из атома галогена, C1-6-алкила, необязательно замещенного одним или более заместителями,независимо выбираемыми из атома галогена и ОН-группы, C1-6-алкоксигруппы, необязательно замещенной одним или более атомами галогена,CN, О(Сn-алкилен)CN, (Сn-алкилен)CN, СО(C1-6 алкила, необязательно замещенного одним или более атомами галогена), (Сm-алкилен)СО 2R13,О(Сn-алкилен)CO2R13, (Сm-алкилен)СONR14R15,(Сm-алкилен)NR14COR15,O(Cn-aлкилен)CONCH=CHCONR14R15,R13 представляет собой Н, C1-6-алкил, необязательно замещенный одним или более атомами галогена, или арил 2(С 1-6-алкилен),R14 и R15, каждый независимо, представляет собой Н, C1-6-алкил, необязательно замещенный одним или более атомами галогена, арил 2(C1-6-алкилен), арил 2, гетероарил 1 или гетероарил 1(C1-6-алкилен),R14 и R15 могут быть соединены вместе с помощью алкиленовой части с атомом, к которому они присоединены, с образованием 4-7 членного кольца необязательно содержащего дополнительную гетерогруппу, выбранную из атомов О или S или NR12,R16 представляет собой арил 2, гетероарил 1 или C1-6-алкил, необязательно замещенный одним или более атомами галогена,"арил 2" представляет собой фенил или нафтил, необязательно замещенный одним или более заместителями, независимо выбранными из атома галогена, C1-6-алкила, необязательно замещенного одним или более заместителями,независимо выбранными из атома галогена или ОН-группы, C1-6-алкоксигруппы, необязательно замещенной одним или более атомами галогена,CN, О(Сn-алкилен)CN, (Сn-алкилен)CN или СО(C1-6-алкила, необязательно замещенного одним или более атомами галогена),"гетероарил 1" представляет собой необязательно бензконденсированную 5- или 6 членную гетероциклическую группу, соединенную с помощью подходящего атома в гетероциклическом или бензольном кольце (если оно присутствует), и эту гетероциклическую группу выбирают из диоксолила, фурила, тиенила, пирролила, оксазолила, тиазолила, изоксазолила,изотиазолила, имидазолила, пиразолила, окса 7 диазолила, тиадиазолила, триазолила, тетразолила, пиридила, пиримидинила, пиридазинила,пиразинила и пиранила,причем указанная "гетероарильная" группа необязательно замещена одним или более заместителями, независимо выбранными из атома галогена, C1-6-алкила, необязательно замещенного одним или более заместителями, независимо выбранными из атома галогена или ОНгруппы, C1-6-алкоксигруппы, необязательно замещенной одним или более атомами галогена,CN, О(Сn-алкилен)CN, (Сn-алкилен)CN- или СО(C1-6-алкила, необязательно замещенного одним или более атомами галогена),где "С-алкилен"-связывающая группа в приведенных выше определениях представляет собой линейную или разветвленную группу и необязательно замещенную одним или более(C1-6-алкилами, необязательно замещенными одним или более атомами галогена),m представляет собой целое число от 0 до 3,n представляет собой целое число от 1 до 3 иp представляет собой целое число от 0 до 2. Фармацевтически приемлемые соли представляют собой соли, хорошо известные квалифицированным в данной области специалистам,и, например, включают соли, упомянутые Веrge с соавторами в J. Pharm. Sci., 66, 1-19 (1977). Приемлемые кислотно-аддитивные соли образуются из кислот, которые образуют нетоксичные соли и к ним относятся гидрохлориды, гидробромиды, гидройодиды, нитраты, сульфаты,бисульфаты, фосфаты, кислые фосфаты, ацетаты, трифторацетаты, лактаты, салицилаты, цитраты, тартраты, аскорбаты, сукцинаты, малеаты,фумараты, глюконаты, формиаты, бензоаты,метансульфонаты, этансульфонаты, бензолсульфонаты и п-толуолсульфонаты. Когда один или более заместителей в соединении формулы (I) содержит кислый остаток, могут быть получены подходящие фармацевтически приемлемые основно-аддитивные соли из оснований, которые образуют нетоксичные соли, и они включают соли алюминия,кальция, лития, магния, калия, натрия, цинка и соли фармацевтически активных аминов, таких как диэтаноламин. Алкильные группы, в том числе алкильные части алкоксигрупп, могут быть линейными,разветвленными или циклическими, когда это позволяет количество атомов углерода. Определение "галоген" относится к атомам фтора, хлора, брома и йода. Некоторые соединения формулы (I) могут существовать в виде геометрических изомеров. Некоторые соединения формулы (I) могут существовать как таутомеры. Соединения формулы (I) могут иметь один или несколько асимметрических центров и, следовательно, сущест 002632 8 вовать в двух или более стереоизомерных формах. Настоящее изобретение включает все индивидуальные таутомеры, стереоизомеры и геометрические изомеры соединений формулы (I) и их смеси. Предпочтительно R1 представляет собойR4, R5, R6 и R7 представляют собой Н. Предпочтительно R3 представляет собой Н, галоген или C1-6-алкил, необязательно замещенный одним или более атомами галогена. Более предпочтительно R3 представляет собой Н, Сl, Вr или метил, необязательно замещенный одним или более атомами галогена. Наиболее предпочтительно R3 представляет собой Н, Сl,Вr или метил. Предпочтительно R4 представляет собой Н, ОН, атом галогена, C1-6-алкил, необязательно замещенный одним или более заместителями,независимо выбранными из атома галогена или ОН-группы, C1-6-алкоксигруппу, необязательно замещенную одним или более атомами галогена, CN, (Сm-алкилен)CONR9R10, О(Сn-алкилен)CONR9R10, (Сm-алкилен)SO2NR9R10,или группу Х-арил или X-Het. Наиболее предпочтительно R4 представляет собой Н, Вr, ОН, CN, C1-6-алкоксигруппу,C1-6-алкил, необязательно замещенный одним или более заместителями из числа ОН,SO2NR9R10, CONR9R10, OCH2CONR9R10, ОСН 2 арил, Het или арил. Еще более предпочтительно R4 представляет собой Н, Вr, ОН, CN, C1-6-алкоксигруппу,C1-6-алкил, необязательно замещенный одним или более заместителями из числа ОН,SO2NR9R10, CОNН(арил (C1-6-алкил, CONH2,OCH2CONR9R10, ОСН 2-арил, фенил или нафтил. Наиболее предпочтительно R4 представляет собой Н, Вr, CN, ОСН 3, SO2NH2, СН 2 ОН,CONH2, OCH2CONH2, CONHBn, OBn, ОН илиPh. Предпочтительно R5 представляет собой Н, атом галогена или C1-6-алкил, необязательно замещенный одним или более заместителями,независимо выбранными из атома галогена или ОН-группы. Более предпочтительно R5 представляет собой Н, Вr или метил, необязательно замещенный одним или более атомами галогена. Наиболее предпочтительно R5 представляет собой Н, Вr или метил. Предпочтительно R6 представляет собой Н, атом галогена, C1-6-алкил, необязательно замещенный одним или более заместителями, независимо выбранными из атома галогена или ОН-группы, C1-6-алкоксигруппу, необязательно замещенную одним или более атомами галогена, CN, О(Сn-алкилен)CN, (Сn-алкилен)CN, (Сmалкилен)CONR9R10, (Сm-алкилен)СO2R8, (Сm 9 алкилен)SO2NR9R10, (Сm-алкилен)S(O)pR11 или группу формулы Х-арил или X-Het. Более предпочтительно R6 представляет собой Н, Сl, Вr, C1-6-алкил, необязательно замещенный одной или более ОН-групп, C1-6 алкоксигруппу, CN, (Сm-алкилен)CONR9R10,(Сm-алкилен)CО 2R8, (Сm-алкилен)S(О)pR11, (Сmалкилен)SO2NR9R10, или группу формулы Харил или X-Het, где Х представляет собой простую связь, СН=СН, СН(ОН), СО, OCH2, CH2O или CH2. Еще более предпочтительно R6 представляет собой Н, Вr, метил, необязательно замещенный ОН-группой, этил, необязательно замещенный ОН-группой, циклопентил, необязательно замещенный ОН-группой, циклогексил,необязательно замещенный ОН-группой, C1-6 алкоксигруппу, CN, O(Сn-алкилен)СN, (Сnалкилен)CN, SO2R11, SR11, CONR9R10, CO2R8,SO2NR9R10, группу формулы Х-(необязательно замещенный фенил) или X-Het1,где Х представляет собой простую связь,СН=СН, СН(ОН), СО, ОСН 2, СН 2 О или СН 2,и где фенильная часть, связанная через X,необязательно замещена одним или более атомами галогена, C1-6-алкилом, необязательно замещенным одним или более заместителями,независимо выбранными из галогена и ОНгруппы, C1-6-алкоксигруппой, необязательно замещенной одним или более атомами галогена,или CO2R13,где "Het1" представляет собой необязательно бензконденсированный диоксолил, фурил, тиенил, имидазолил, или их частично или полностью насыщенные аналоги,и такая "Het1"-rpyппa, связанная через X,необязательно замещена одним или более C1-6 алкилами, необязательно замещенными одним или более заместителями, независимо выбранными из атома галогена и ОН-группы. Кроме того, более предпочтительно R6 представляет собой Н, Вr, СО 2 Н, (E)CH=CHPh,Ph, ОСН 3, 1,3-бензо[d]диоксол-5-ил, CN,СН 2 ОН, CONHBn, 4-метоксифенил, 1-гидроксициклогексил, 1-гидроксициклопентил, COPh,СН(ОН)СН 3, CH(OH)Ph, ССН 3(ОН)Рh, OCH2Ph,SO2Ph, SPh, CH2OPh, SO2NH2, SO2NHPh, SO2NH 10 Предпочтительно R7 представляет собой Н. Предпочтительную группу соединений составляют соединения, в которых R1 представляет собой N=C(NH2)2 или NHС(=NH)NН 2, каждый из R2, R4, R5 и R7 представляет собой Н, R3 представляет собой Вr или Сl, и R6 представляет собой 2-метоксифенил,4-метоксифенил,CH(OH)Ph, SO2Ph, SPh, 3-карбоксифенил или 3 метоксифенил. Другую группу предпочтительных соединений составляют соединения, в которых два изR4, R5, R6 и R7 присоединены к соседним углеродным атомам и вместе образуют ОСН 2 О часть. Еще одну группу предпочтительных соединений составляют соединения примеров и их соли. Наиболее предпочтительные соединения выбраны из числа следующих соединений:(4-хлор-7-(3-карбоксифенил)изохинолин 1-ил)гуанидин; 1 -гуанидино-7-сульфамоилизохинолин; 1-гуанидино-7-фенилсульфамоилизохинолин; 4-хлор-1-гуанидино-7-сульфамоилизохинолин; 4-хлор-7-циклопентилсульфамоил-1 гуанидиноизохинолин; 4-хлор-1-гуанидино-7-(1-пирролидиносульфонил)изохинолина гидрохлорид; 4-хлор-1-гуанидино-7-морфолиносульфонилизохинолина гидрохлорид; 4-хлор-1-гуанидино-7-[(N-метилпиперазино)сульфонил]изохинолин; 4-хлор-1-гуанидино-7-(фенилсульфанил) изохинолин; 4-хлор-1-гуанидино-7-(фенилсульфонил) изохинолин и их соли. Другой аспект настоящего изобретения представляет фармацевтическая композиция,содержащая соединение или соль в соответствии с приведенными выше определениями и фармацевтически приемлемый адъювант, носитель или разбавитель. Еще один аспект настоящего изобретения представляет соединение или соль в соответст 11 вии с приведенными выше определениями для применения в качестве медикамента. Еще один аспект изобретения представляет применение соединения или соли в соответствии с приведенными выше определениями для применения в качестве медикамента для лечения состояния или процесса, опосредуемогоuPA, такого как кожная язва, развитие кровеносных сосудов (неоваскуляризация), костная реконструкция, имплантация эмбриона в матку,инфильтрация иммуноклеток в воспалительные сайты, овуляция, сперматогенез, восстановление ткани в процессе заживления раны и дифференциации органа, фиброз, локальная инвазия опухолей в соседние участки, метастатическое распространение опухолевых клеток от первичных сайтов к вторичным и разрушение ткани при артрите. Еще один аспект настоящего изобретения представляет способ лечения состояния или процесса, опосредуемого uPA, такого как кожная язва, развитие кровеносных сосудов (неоваскуляризация), костная реконструкция, имплантация эмбриона в матку, инфильтрация иммуноклеток в воспалительные сайты, овуляция, сперматогенез, восстановление ткани в процессе заживления раны и дифференциации органа, фиброз, локальная инвазия опухолей в соседние участки, метастатическое распространение опухолевых клеток от первичных сайтов к вторичным и разрушение ткани при артрите,который включает введение терапевтического количества соединения, или соли, или композиции в соответствии с приведенными выше определениями. Следует понимать, что ссылка на лечение включает профилактику, а также ослабление проявляемых симптомов состояний, опосредуемых uPA. Изобретение также предлагает способы получения соединений изобретения, которые описаны ниже и в примерах. Для квалифицированного в данной области специалиста понятно,что соединения настоящего изобретения могут быть получены способами, отличающимися от способов, описанных здесь, путем адаптации описанных ниже способов и/или адаптации этих способов и способов, известных в данной области. В способах, приведенных ниже, если не оговорено особо, заместители имеют значения,определенные выше при описании соединений формулы (I). Способ 1. Соединения формулы (I) могут быть получены из соответствующих производных 1- или 3-аминоизохинолина (II) реакцией с цианамидом (NH2CN) или реагентом, который действует как "NHС+=NН"синтон, таким как производные карбоксамидина, например, 1 Н-пиразол-1-карбоксамидиномChem. (1986) 29, 984), S-метилизотиуроний сульфат (S. Botros et al., J.Med.Chem (1986), 29,874; P.S. Chauhan et al., Ind.J.Chem., 1993, 32B,858) или S-этилизотиуронийбромид (M.L. Pedersen et al., J.Org.Chem. (1993) 58, 6966). С другой стороны, могут быть использованы аминоиминометансульфиновая кислота или аминоиминометансульфоновая кислота (А.Е. Miller et al.,Synthesis (1986) 777; К. Kim et al., Tet. Lett.(1988) 29, 3183). Квалифицированным в данной области специалистам известны другие способы такого превращения (см., например, "Comprehensive(Ed.); Patai's "Chemistry of Functional Groups",Vol. 2, "The Chemistry of Amidines and Imidates", 1991, 488). Аминоизохинолины (II) могут быть получены стандартными способами, которые опубликованы (см., например, "The Chemistry of Heterocyclic Compounds", Vol. 38, Pt. 2, John WileySchuster), включая, например, перегруппировку соответствующего карбоксипроизводного (перегруппировки Гофмана, Курциуса, Лозена,Шмидта) и последующее снятие защитной группы. С другой стороны, аминоизохинолины (II) могут быть получены прямым замещением уходящей группы, такой как Сl или Вr, азотсодержащим нуклеофилом, таким как азид (с последующим восстановлением), или аммиак, или с использованием Pd-катализатора с подходящим амином (таким как бензиламин) с последующим снятием защитной группы с использованием стандартных условий, хорошо известных в данной области. 1-(Хлор- и бром)изохинолины могут быть получены обработкой соответствующих Nоксидов (III) РОСl3 или РОВr3,соответственно в инертном растворителе, таком как метиленхлорид, при кипячении с обратным холодильником. Галогенизохинолины являются коммерчески доступными соединениями или могут быть получены различными способами, например,способами, описанными в Goldschmidt, Chem.Pharm. Bull. (1964) 12, 1296. 1,4-(Дихлор- или дибром)изохинолины могут быть получены с помощью способов, описанных в M. Robison et al., J. Org. Chem. (1958) 23, 1071, реакцией соответствующего изокарбостирольного соединения с PCl5 или РВr5. Способ 2. Соединения формулы (I) могут быть получены из соответствующего производного аминоизохинолина (II), который описан выше в способе 1, реакцией с реагентом, который действует как защищенный амидин-(2+)синтон (IV) Таким как соединение PNHC(=X)NHP1,PN=CXNHP1 или PNHCX=NP1, где Х представляет собой уходящую группу, такую как Сl, Вr,I, мезилат, тозилат, алкилокси и др., и где Р и P1 могут быть одинаковыми или разными и представляют собой N-защищающие группы, которые хорошо известны в данной области, такие как трет.-бутоксикарбонил, бензилоксикарбонил, арилсульфонил, например, толуолсульфонил, нитрогруппа и др. Примерами реагентов, которые действуют как синтоны (IV), являются производные N,N'защищенного S-алкилтиурония, такие как N,N'бис(трет.-бутоксикарбонил)-S-Me-изотиомочевина, N,N'-бис-(бензилоксикарбонил)-3-метилизотиомочевина или их производные сульфоновой кислоты (J. Org. Chem. 1986, 51, 1882), или производные S-арилтиурония, такие как N,N'бис(трет.-бутоксикарбонил)-S-(2,4-динитробензол) (S.G. Lammin, B.L. Pedgrift, A.J. Ratcliffe,Tet. Lett. 1996, 37, 6815), или монoзащищенные аналоги, такие как метиловый эфир [(4-метокси 2,3,6-триметилфенил)сульфонил]-карбамимидотиокислоты или соответствующие 2,2,5,7,8 пентаметилхроман-6-сульфонильные аналогиSoc., 1954, 76, 1877) или различные замещенные тиомочевины,такие какLerpiniere, S.Y.Ko, Tet. 1997, 53, 5291) в присутствии или в отсутствие промотора, такого как реагент Mukaiyama (Yong Y.F., Коwalski J.A.,Lipton M.A., J. Org. Chem., 1997, 62, 1540), или соли меди, ртути или серебра, в особенности в присутствии хлорида ртути (II). Также могут быть использованы подходящие N-защищенныеChim.Trav.Pays-Bas (1962), 81, 69). С другой стороны, могут быть использованы другие гуанилирующие агенты, известные квалифицированным в данной области специалистам, такие как 1-Н-пиразоло-1-[N,N'-бис(трет.-бутоксикарбонил)]карбоксамидин,соответствующее бис-Cbz производное (M.S. Bernatowicz, Y.Wu,G.R. Matsueda, Tet.Lett., 1993, 34, 3389) или моно-Вос или моно-Cbz производные (B.Drake,Synthesis, 1994, 579; M.S. Bernatowicz, Tet. Lett.,1993, 34, 3389). Аналогично можно использовать 3,5-диметил-1-нитрогуанилпиразол (Т. Wakayima et al, Tet.Lett. (1986), 29, 2143). Реакция может быть проведена с использованием подходящего растворителя, такого как дихлорметан, N,N-диметилформамид (ДМФА),метанол. Реакцию также удобно проводить путем добавления хлорида ртути (II) к смеси аминоизохинолина (II) и производного тиомочевины типа (IV) в подходящей смеси основание/ растворитель, такой как триэтиламин/дихлорметан. Продукт этой реакции представляет собой защищенный изохинолинилгуанидин (V), с которого может быть легко снята защитная группа с образованием соединения (I) или его соли. Например, если защитная группа Р и/или Р 1 представляет собой трет.-бутоксикарбонильную группу, удобно реакцию снятия защитной группы проводить с использованием кислоты,такой как трифторуксусная кислота (ТФУК) или соляной кислоты, в подходящем растворителе,таком как дихлорметан, с получением бистрифторацетатной соли соединения (I). Если Р и/или P1 представляют собой гидрогенолизируемую группу, такую как бензилоксикарбонильная группа, то снятие защиты можно осуществить путем гидрогенолиза. Другие схемы защита/снятие защиты включают нитро (К. Suzuki et al., Chem.Lett., 1994, 922). Для квалифицированного в данной области специалиста очевидно, что другие схемы защиты и последующего снятия защиты в процессе синтеза соединений настоящего изобретения могут быть реализованы с использованием обычных методик, например, описанных вR1 представляет собой гуанидинил и заместитель R2 представляет собой Н, или R1 представляет собой Н, а R2 представляет собой гуанидинил, могут быть получены из соединений формулы (VI) где Z присоединен к 1- или 3-положению и представляет собой подходящую уходящую группу, такую как Сl, Вr или OPh, путем замещения уходящей группы свободным основанием гуанидина. Свободное основание гуанидина может быть получено in situ из подходящей соли, такой как гидрохлорид, карбонат, нитрат или сульфат,с помощью приемлемого основания, такого как гидрид натрия, гидрид калия или другие основания щелочного металла, предпочтительно в сухом апротонном растворителе, таком как тетрагидрофуран (ТГФ), ДМСО, N,N-диметилформамид (ДМФД), диметиловый эфир этиленгликоля (ДМЭ), N,N-диметилацетамид (ДМА), толуол или их смеси. С другой стороны, оно может быть получено из подходящей соли с использованием алкоксида в спиртовом растворителе, например, трет.-бутоксида калия в трет.бутаноле, или в апротонном растворителе, типа описанных выше. Полученное таким образом свободное основание гуанидина может быть соединено с производным 1- или 3-изохинолина, и реакция с образованием соединений формулы (I) может быть проведена при температуре от комнатной до 200 С, предпочтительно при температуре приблизительно от 50 до 150 С, предпочтительно в течение от 4 ч до 6 дней. 16 Способ 4. Соединения формулы (I), где один или более заместителей R4-7 представляют собой или содержат гидроксигруппу, могут быть получены из соответствующим образом защищенного гидроксипроизводного, то есть соединения формулы (I), в котором один или более заместителей R4-7 представляют собой или содержатO-защитную группу, например, O-бензил. Бензильная группа может быть удалена, например,путем каталитического гидрирования с использованием катализатора "палладий на угле" в подходящем растворителе, таком как, например,этанол, приблизительно при 20 С и при повышенном давлении, и необязательно в присутствии избытка кислоты, такой как НСl или АсОН,или ТФУК, или с помощью других известных способов снятия защитной группы. Подходящие O-защитные группы и способы защиты/снятия защиты можно найти в книгах Greene, Wuts и Kocienski (см. выше). Способ 5. Соединения настоящего изобретения, в которых заместители R5-R7 представляют собой или содержат карбоксильную группу или карбамоильную группу, могут быть получены из соответствующего соединения, в котором заместитель представляет собой нитрил, путем полного или частичного гидролиза. Соединения настоящего изобретения, в которых заместителиR5-R7 представляют собой или содержат карбоксильную группу, могут быть получены из соответствующего соединения, в котором заместитель представляет собой карбамоильную часть,путем гидролиза. Гидролиз может быть проведен способами, хорошо известными в данной области, например, способами, которые упомянуты в книге "Advanced Organic Chemistry",J.March, 3-rd edition (Wiley-Interscience), гл. 6-5,а также в ссылках, приведенных в ней. Обычно гидролиз проводят с использованием соляной кислоты при повышенных температурах, и продукт представляет собой гидрохлорид. Способ 6. Если желательно или необходимо, соединение формулы (I) превращают в его фармацевтически приемлемую соль. Фармацевтически приемлемая соль соединения формулы (I) может быть легко получена при смешении вместе растворов соединения формулы (I) и желаемой кислоты или основания. Соль может выпадать из раствора в виде осадка и может быть отфильтрована, или может быть выделена другими способами, такими как выпаривание растворителя. Общие способы взаимного превращения. Соединения формулы (I), где один или более заместителей R3-R7 представляют собой или содержат Сl или Вr могут быть дегалогенированы с образованием соответствующего гидридосоединения формулы (I) путем гидрогенолиза с использованием палладия на угле в качестве 17 катализатора в подходящем растворителе, таком как этанол, при температуре приблизительно 20 С и при повышенном давлении. Соединения формулы (I), в которых заместитель R1 представляет собой гуанидинил и один или более заместителей R4-R7 представляют собой или содержат карбоксигруппу, могут быть получены из соединения с гидролизуемой группой с получением карбоксильной части,например, из соответствующего нитрила или эфира, путем кислого гидролиза, например, кислого гидролиза концентрированной водной НСl при кипячении с обратным холодильником. Другие способы гидролиза хорошо известны в данной области. Соединения формулы (I), в которых один или более заместителей R4-R7 представляют собой или содержат амидный остаток, могут быть получены реакцией необязательно защищенного соответствующего карбоксисоединения или путем прямого сочетания с выбранным амином, или через начальное образование соответствующего хлорангидрида и последующую реакцию с амином, с последующим снятием защитной группы, если это необходимо. Такие превращения хорошо известны в данной области. Некоторые соединения формулы (I), которые содержат электрофильную группу, присоединенную к ароматическому кольцу, могут быть получены реакцией соответствующего гидридосоединения с электрофильным реагентом. Например, сульфонилирование ароматического кольца с использованием стандартных реагентов и способов, таких как дымящая серная кислота, дает соответствующую сульфоновую кислоту. Она затем может быть необязательно превращена в соответствующий сульфонамид способами, известными в данной области, например, путем первоначального превращения в сульфонилхлорид с последующим взаимодействием с амином. Некоторые соединения настоящего изобретения могут быть получены по методикам перекрестного сочетания, например, реакцией соединения, содержащего бром, присоединенный, например, к ароматическому кольцу, с производным бороновой кислоты, олефином или производным олова, по известным методикам, например, с использованием способов,описанных в методиках, приведенных ниже. Некоторые соединения изобретения,имеющие электрофильные заместители, могут быть получены путем обмена галоген/металл с последующей реакцией с электрофильным реагентом. Например, заместитель бром реагирует с литийсодержащим реагентом, таким как нбутиллитий, и последовательно с электрофильным реагентом, таким как СО 2, альдегид или кетон, с образованием соответственно кислоты или спирта. 18 Соединения настоящего изобретения могут быть получены или способами, описанными здесь в разделах способы и примеры, или при их подходящей адаптации с использованием способов, известных в данной области. Следует понимать, что методы синтетического превращения, названные здесь, могут быть осуществлены в различной последовательности для того,чтобы желаемые соединения могли быть получены эффективно. Квалифицированный химик может использовать свой опыт для выбора наиболее эффективной последовательности реакций, чтобы синтезировать данное соединение. Для квалифицированного в данной области специалиста очевидно, что чувствительные функциональные группы могут нуждаться в защите и последующем ее снятии в процессе синтеза соединения настоящего изобретения. Это может быть реализовано с помощью обычных методик, например, описанных в книгахInc., 1991; и "Protecting Groups", P.J.Kocienski,Georg Thieme Verlag, 1994. Соединения и соли настоящего изобретения могут быть разделены и очищены с помощью обычных методов. Разделение диастереомеров может быть достигнуто с помощью обычных методик, например, путем фракционной кристаллизации,хроматографии или ВЭЖХ смеси стереоизомеров соединения формулы (I) или их подходящих солей или производных. Индивидуальные энантиомеры соединения формулы (I) также могут быть получены из соответстующего оптически чистого промежуточного соединения или разделением, таким как разделение с помощью ВЭЖХ соответствующего рацемата с использованием подходящего хирального носителя или путем фракционной кристаллизации диастереомерных солей, полученных реакцией соответствующего рацемата с подходящими оптически активными кислотой или основанием. При использовании для лечения человека соединения формулы (I) и их соли могут быть введены отдельно, но обычно применяются в смеси с фармацевтически приемлемым адъювантом, разбавителем или носителем, которые выбираются с учетом предполагаемого способа введения и стандартной фармацевтической практики. Например, они могут быть введены перорально, в том числе подъязычно, в форме таблеток, содержащих такие наполнители, как крахмал или лактоза, или в капсулах или овулей отдельно или в смеси с наполнителями, или в форме эликсиров, растворов или суспензий, содержащих вкусовые вещества или красящие агенты. Они могут быть введены парентерально инъекцией, например, внутривенно, внутримышечно или подкожно. Для парентерального введения их лучше всего использовать в форме стерильного водного раствора или суспензии, 19 которые могут содержать другие вещества, например, достаточно соли или глюкозы, чтобы сделать раствор изотоничным с кровью. Они могут быть введены локально в форме стерильных кремов, гелей, суспензий, лосьонов, мазей,сыпучих порошков, спреев, содержащих лекарство повязок, или через кожный пластырь. Например, они могут быть введены в крем, содержащий водную или масляную эмульсию полиэтиленгликоля или жидкого парафина, или они могут быть введены в мазь, содержащую белый воск на основе мягкого парафина, или в виде гидрогеля с производными целлюлозы или полиакрилата или другими модификаторами вязкости, или в виде сухого порошка или жидкого спрея или аэрозоля с бутан/пропаном, HFA- илиCFC-пропеллентами, или в виде содержащих лекарство повязок или в виде марлевых повязок,пропитанных белым мягким парафином или полиэтиленгликолями, или в виде гидрогелевых, гидроколлоидных, альгинатных или пленочных повязок. Соединения или соли также могут быть введены внутриглазно в виде глазных капель с подходящими буферами, модификаторами вязкости (например, с производными целлюлозы), консервантами (например, бензалконийхлоридом (BZK и агентами, регулирующими тоничность (например, хлористый натрий). Все такие препараты могут также содержать подходящие стабилизаторы и консерванты. При пероральном и парентеральном введении человеку уровень ежедневных доз соединений формулы (I) или их солей будет составлять от 0,001 до 20, предпочтительно от 0,01 до 20,более предпочтительно от 0,1 до 10 и наиболее предпочтительно от 0,5 до 5 мг/кг (в единичной дозе или разделенной общей дозе). Следовательно, таблетки или капсулы соединений будут содержать от 0,1 до 500, предпочтительно от 50 до 200 мг активного соединения для введения один, два или более раз в подходящее время. Врач, в любом случае, будет определять точную дозу, которая будет наиболее приемлема для индивидуального пациента, которая зависит от возраста, веса и реакции данного пациента. Приведенные выше дозы являются примером усредненного случая; могут встречаться отдельные случаи, когда более высокие или более низкие интервалы доз являются более приемлемыми, и они также входят в объем настоящего изобретения. Следует отметить, что ссылка на лечение включает профилактику, а также ослабление установленных симптомов состояния, которое подвергается лечению. Методы испытаний Соединения испытаны на их способность ингибировать урокиназу человека, человеческую tPA и человеческий плазмин с использованием, по существу, тех же способов, которые описаны в Yang et al., J.Med.Chem., 1990, 33, 002632 20 2961. Урокиназный анализ проводят с использованием S-2444 (Quadratech 820357) в качестве субстрата, а используемая урокиназа представляет собой человеческую урокиназу HMWT(Calbiochem 672081). Анализ tPA проводят с использованием S-2288 (Quadratech 820832) в качестве tPA-субстрата, Quadratech 321116 в качестве стимулятора tPA, а используемая tPA представляет собой человеческую tPA (Quadratech 881157). Анализ на плазмин проводят с использованием человеческого плазмина (Quadratech 810665), действуя на Chromozym-PL (Boehringer 378461) в качестве субстрата. Как показано ниже, соединения настоящего изобретения являются селективными ингибиторами uPA: Некоторые соединения настоящего изобретения названы как производные гуанидина, а некоторые - как производные изохинолина. Примеры и методики Температуры плавления определяют с использованием устройства для определения температуры плавления Gallenkamp и они являются нескорректированными. Данные ядерного магнитного резонанса получены на спектрометреVarian Unity 300 или Varian Inova 400 и выражены в частях на миллион (миллионных долях) относительно тетраметилсилана. Данные массспектров получены на приборе Finnigan Mat.TSQ 700 или Fisons Instruments Trio 1000. Расчетные и наблюдаемые ионы относятся к изотопной композиции наименьшей массы. Определение "эфир" в этой части описания, если не оговорено особо, следует читать как диэтиловый эфир. "Ph" означает фенильную группу,"Вn" означает бензильную группу и "Me" означает метильную группу. ТСХ означает тонкослойную хроматографию "ТФУК" означает трифторуксусную кислоту. Пример 1. 1-Изохинолинилгуанидин. Гидрид натрия (192 мг, 60% дисперсия в минеральном масле, 4,8 ммоль) добавляют одной порцией при перемешивании к раствору гидрохлорида гуанидина (465 мг, 4,9 ммоль) в ДМСО (6,0 мл) в атмосфере азота при комнатной температуре. Смесь перемешивают до тех пор, пока выделение водорода не прекратится. 21 Добавляют 1-хлоризохинолин (300 мг, 1,83 ммоль), и смесь нагревают при 100 С в течение 3 дней. Растворители упаривают в вакууме и остаток непосредственно очищают колоночной хроматографией на силикагеле с использованием в качестве элюента смеси дихлорметан: метанол: 0,880 аммиак (от 95:5:0,5 до 90:10:1). Получают 1-изохинолинилгуанидин (195 мг, 1,0 ммоль) в виде белого твердого вещества. Т.пл. 163-5 С. Спектр 1H ЯМР (, ДМСО-d6, 400 МГц): 6,95 (1 Н, д), 7,4 (1 Н, дд), 7,55 (1 Н, дд), 7,65 (1 Н,д), 7,85 (1 Н, д), 8,55 (1 Н, д); Масс-спектр низкого разрешения: 187% С 61,81; Н 5,65; N 28,83. Другие соединения, полученные с помощью такого же общего способа с использованием подходящих исходных материалов, перечислены ниже в табл. 1. Примеры 2 и 3 описывают соответствующие гидрохлориды, полученные добавлением эфирного раствора НСl к раствору соответствующего свободного основания и упариванием досуха. Примеры 28 и 29 описывают трифторацетатные соли, полученные при растворении свободного основания в трифторуксусной кислоте и упаривании досуха.(Примечание: Если не оговорено особо, то заместители представляют собой Н) Если не оговорено особо, растворитель ДМСО. При проведении методики примера 27 выделен как побочный продукт. Хлорид ртути (II) (192 мг, 0,707 ммоль) добавляют одной порцией к перемешиваемой смеси 3-аминоизохинолина (84,5 мг, 0,586 ммоль),N,N'-ди-трет.-бутоксикарбонил-Sметилизотиомочевины (Bergeron R.J., McManisJ.S., J. Org. Chem. 1987, 52, 1700-1703) (204 мг,0,703 ммоль) и триэтиламина (250 мкл, 1,79 ммоль) в СН 2 Сl2 (3,0 мл) в атмосфере N2 при 23 С. Смесь перемешивают в течение 26 ч и затем напрямую очищают колоночной хроматографией на силикагеле с использованием в качестве элюента смеси гексаны:ЕtOАс (от 98:2 до 95:5). Получают 3-(N',N"-ди-трет.-бутоксикарбонил-N-гуанидинил)изохинолин (189,4 мг,0,492 ммоль) в виде белого твердого вещества. Спектр 1 Н ЯМР (, СDСl3, 300 МГц): 1,55(МН). Трифторуксусную кислоту (2,5 мл) добавляют к раствору 3-(N',N"-ди-трет.-бутоксикарбонил-N-гуанидинил)изохинолина (181 мг,0,468 ммоль) в CH2Cl2 (1,5 мл), и смесь перемешивают при комнатной температуре в течение 2 ч. Смесь разбавляют СН 2 Сl2 (5 мл) и растворитель упаривают в вакууме. Получают бис(трифторацетат) 3-изохинолинилгуанидина (186,9 мг,0,449 ммоль) в виде белого твердого вещества. Спектр 1 Н ЯМР (, MeOH-d4, 400 МГц): 4,8-5,0 (4 Н, уш.с), 7,4 (1H, с), 7,6 (1H, дд), 7,75(5-бензилоксиизохинолин-1-ил) гуанидина (290 мг, 1,0 ммоль) в EtOH (10 мл),содержащий 10%-й Pd-C (60 мг) и разбавленную НСl (1,5 мл, 2 М, 3,0 ммоль), перемешивают в атмосфере Н 2 (4 атмосферы) при 60 С в течение 3 дней. Добавляют еще одну часть катализатора(30 мг) и НСl (0,5 мл) и гидрирование продолжают еще в течение 3 дней. Смесь фильтруют через Arbocel с промывкой EtOH, фильтрат упаривают в вакууме и полученный остаток очищают колоночной хроматографией с использованием в качестве элюента смеси дихлорметан:метанол:0,88 аммиак (от 90:10:1 до 84:14:2). Получают (5-гидроксиизохинолин-1-ил)гуанидин (66 мг, 0,33 ммоль) в виде белого твердого вещества. Т.пл. 150 С (разл.); Спектр 1H ЯМР (, ДМСО-d6, 400 МГц): 3,0-3,4 (1 Н, уш.с), 7,05 (1 Н, д), 7,35 (1 Н, дд), 7,48,4 (3 Н, уш.с), 7,45 (1 Н, уш.с), 7,95 (1 Н, д), 8,1 Раствор (4-бром-7-(4-метоксифенил)изохинолин-1-ил)гуанидина (38 мг, 0,1 ммоль) в промышленных метилированных спиртах (2,0 мл), содержащий 5%-ный Pd-C (10 мг), перемешивают в атмосфере Н 2 (3,5 атмосфер) при 23 С в течение 3 дней. Смесь фильтруют через Arbocel с промывкой этанолом, фильтрат упаривают в вакууме и полученный остаток очищают колоночной хроматогрфией с использованием в качестве элюента смеси дихлорметан:метанол: 0,88 аммиак (97:3:0,3). Получают (7-(4-метоксифенил)изохинолин-1-ил)гуанидин (24 мг, 0,08 ммоль) в виде белого твердого вещества. Т.пл. 174 С; Спектр 1H ЯМР (, ДМСО-d6, 400 МГц): 3,25 (4 Н, уш.с, обмениваемый), 3,8 (3 Н, уш.с),7,05 (2 Н, д), 7,5-7,6 (1 Н, м), 7,85 (2 Н, д), 8,0 (1 Н,д), 8,05-8,15 (2 Н, м), 8,75 (1 Н, с); Масс-спектр (низкого разрешения): 293 Раствор (4-хлор-7-(цианофенил)изохинолин-1-ил)гуанидина (69 мг, 0,21 ммоль) в концентрированной соляной кислоте (10 мл) кипятят с обратным холодильником в течение 20 ч. 35 После охлаждения отфильтровывают осадок,промывают водой и сушат в высоком вакууме при 80 С с получением названной соли (55 мг,0,16 ммоль) в виде почти белого порошка. Т.пл. 312-316 С. Спектр 1H ЯМР (, ДМСО-d6, 400 МГц): 13,4-11,2 (1 Н, уш.с), 9,4-7,8 (5 Н, уш.с), 9,2 (1 Н,с), 8,45-8,1 (5 Н, м), 8,0 (1 Н, д), 7,65 (1 Н, т); Масс-спектр (низкого разрешения): 341,343 (МН); Элементный анализ: Найдено, %: С 53,25; Н 3,80; N 14,28. C17H14Cl2N4O2 + 0,33H20. Вычислено, %: С 53,29; Н 3,86; N 14,62. Пример 56. Гидрохлорид гуанидина (42 мг, 0,44 ммоль) добавляют одной порцией к суспензииNaH (13 мг, 80%-я дисперсия по весу в минеральном масле, 0,43 ммоль) в ДМСО (1,5 мл) и смесь нагревают при 60 С в атмосфере азота в течение 30 мин. Добавляют 1-хлор-7 изохинолинсульфонамид (37 мг, 0,152 ммоль) и смесь нагревают при 100 С в течение 24 ч. Растворители упаривают в вакууме и полученный остаток очищают колоночной хроматографией на силикагеле с использованием в качестве элюента смеси СН 2 Сl2:МеОН:0,880NH3 (от 97:3:0,3 до 90:10:1). Получают названное соединение (34 мг, 0,13 ммоль) в виде почти белого твердого вещества. Т.пл. 198-200 С (разл.); Спектр 1 Н ЯМР (, ДМСО-d6, 400 МГц): 7,0 (1 Н, д), 7,1-7,4 (4 Н, уш.с), 7,3 (2 Н, с), 7,8(ii) Дигидрохлорид 1-гуанидино-7-сульфамоилизохинолина. 1-Гуанидино-7-сульфамоилизохинолин (12 мг, 0,045 ммоль) растворяют в растворе этанола,насыщенного газообразным НСl (1,0 мл), и смесь перемешивают при комнатной температуре в течение 1 ч. Растворители упаривают в вакууме и полученный остаток сушат азеотропом с дихлорметаном (СН 2 Сl2) с получением дигидрохлорида 1-гуанидино-7-сульфамоилизохинолина (13 мг, 0,043 ммоль) в виде белого твердого вещества. Спектр 1 Н ЯМР (, ДМСО-d6, 400 МГц): 7,6 (2 Н, с), 7,7 (1 Н, д), 8,2 (1 Н, с), 8,2 (1 Н, д), 8,3 Гидрохлорид гуанидина (100 мг, 1,05 ммоль) добавляют одной порцией к суспензии гидрида натрия (NaH) (30 мг, 80%-я дисперсия по весу в минеральном масле, 1,0 ммоль) в диметилсульфоксиде (ДМСО) (3,5 мл), и смесь нагревают при 60 С в атмосфере азота в течение 30 мин. Добавляют 1-хлор-7-фенилсульфамоилизохинолин (110 мг, 0,345 ммоль) и смесь нагревают при 100 С в течение 3 дней. Растворители упаривают в вакууме и полученный остаток очищают колоночной хроматографией на силикагеле с использованием в качестве элюента смеси СН 2 Сl2:метанол:0,880NН 3 (от 97:3:0,3 до 90:10:1). Получают 1-гуанидино-7-фенилсульфамоилизохинолин (16 мг, 0,047 ммоль) в виде почти белого твердого вещества. Т.пл. 186-188 С; Спектр 1H ЯМР (, ДМСО-d6, 400 МГц): 6,95 (2 Н, д), 7,05 (2 Н, д), 7,1-7,3 (4 Н, уш.с), 7,157,2 (2 Н, м), 7,7 (1 Н, д), 7,75 (1 Н, д), 8,0 (1 Н, д),9,0 (1 Н, с), 10,2 (1 Н, с), млн. д. Масс-спектр (низкого разрешения): 341 Гидрохлорид гуанидина (70 мг, 0,73 ммоль) добавляют одной порцией к суспензииNaH (21 мг, 80%-я дисперсия по весу в минеральном масле, 0,66 ммоль) в ДМСО (2,0 мл) и смесь нагревают при 50 С в атмосфере азота в течение 30 мин. Добавляют 1,4-дихлор-7 сульфамоилизохинолин (70 мг, 0,25 ммоль) и смесь нагревают при 90 С в течение 18 ч. Охлажденную смесь распределяют между этилацетатом (EtOAc) и водой, органическую фазу промывают рассолом, сушат (MgSO4) и упаривают в вакууме. Полученный остаток очищают колоночной хроматографией на силикагеле с использованием в качестве элюента смесиCH2Cl2:MeOH:0,880NH3 (от 95:5:0,5 до 90:10:1). Получают 4-хлор-1-гуанидино-7-сульфамоил 37 изохинолин (50 мг, 0,167 ммоль) в виде почти белого твердого вещества. Т.пл. 230 С (разл.); Спектр 1 Н ЯМР (, ДМСО-d6, 300 МГц): 7,1-7,5 (4 Н, уш.с), 7,4 (2 Н, уш.с), 8,0 (1 Н, д), 8,1(2,0 мл), и смесь перемешивают при комнатной температуре в течение 1 ч. Растворители упаривают в вакууме и полученный остаток сушат азеотропом с СН 2 Сl2 с получением гидрохлорида 4-хлор-1-гуанидино-7-изохинолинсульфонамида (32 мг, 0,095 ммоль) в виде белого твердого вещества. Т.пл. 296 С (разл.); Спектр 1H ЯМР (, ДМСО-d6, 400 МГц): 7,6 (2 Н, с), 7,7 (1H, д), 8,2 (1H, с), 8,2 (1H, д), 8,3 Названное соединение получают по общей методике примера 56. Т.пл. 250 С (разл.); Спектр 1 Н ЯМР (, ДМСО-d6, 400 МГц): 1,2-1,4 (4 Н, м), 1,4-1,6 (4 Н, м), 3,4 (1H, м), 7,77,8 (1H, уш.д), 8,0-8,2 (2 Н, м), 9,1 (1H, c); Масс-спектр низкого разрешения: 368 38 Названную соль получают по общей методике примера 56. Т.пл. 299-300 С (разл.); Спектр 1 Н ЯМР (, ДМСО-d6, 300 МГц): 1,6-1,7 (4 Н, м), 3,2-3,3 (4 Н, м), 8,2-8,9 (4 Н, уш.с),8,3 (1H, д), 8,4 (1H, д), 8,5 (1H, с), 9,1 (1H, с); млн. д. Масс-спектр низкого разрешения: 354 Названную соль получают по общей методике примера 56. Т.пл. 285 С (разл.); Спектр 1H ЯМР (, трифторуксусная кислота-d, 400 МГц): 3,4 (4 Н, с), 4,1 (4 Н, с), 8,3 Названное соединение получают по общей методике примера 56. Т.пл. 262-263 С (разл.); Спектр 1 Н ЯМР (, трифторуксусная кислота-d, 400 МГц): 3,1 (3 Н, с), 3,3 (2 Н, м), 3,4 К раствору гидрохлорида гуанидина (44 мг, 0,46 ммоль) в ДМСО (2 мл) одной порцией добавляют NaH (13,6 мг, 80%-я дисперсия по весу в минеральном масле, 0,45 ммоль) и смесь 39 нагревают при 80 С в атмосфере N2; в течение 10 мин. Добавляют 1,4-дихлор-7-(фенилсульфанил)изохинолин (60 мг, 0,195 ммоль), и смесь нагревают при 80 С в течение 1 ч. Охлажденную смесь выливают в воду (20 мл) и экстрагируют EtOAc (315 мл). Объединенные экстракты промывают рассолом, сушат (Na2SO4) и упаривают в вакууме. Остаток экстрагируют смесью гексаны:изо-Рr2O, и этот органический раствор декантируют, затем перемешивают с раствором НСl в Et2O с получением осадка. Белое твердое вещество отфильтровывают и сушат в вакууме,получают 4-хлор-1-гуанидино-7(фенилсульфанил)изохинолин (51 мг, 0,13 ммоль). Спектр 1 Н ЯМР (, ДМСО-d6, 300 МГц): 7,3-7,5 (5 Н, м), 7,7 (1 Н, д), 8,1-9,2 (4 Н, уш.с), 8,1 К раствору гидрохлорида гуанидина (90 мг, 0,94 ммоль) в ДМСО (2 мл) одной порцией добавляют NaH (18 мг, 80%-я дисперсия по весу в минеральном масле, 0,60 ммоль), и смесь нагревают при 50 С в атмосфере N2 в течение 30 мин. Добавляют 1,4-дихлор-7-(фенилсульфонил)изохинолин (80 мг, 0,236 ммоль) и смесь нагревают при 50-60 С в течение 0,5 ч. Охлажденную смесь выливают в воду (30 мл) и экстрагируют EtOAc (320 мл). Объединенные экстракты промывают рассолом, сушат (Na2SO4) и упаривают в вакууме. Остаток растворяют вEtOAc и добавляют раствор НСl в Et2O (1 М) с получением осадка. Растворители упаривают в вакууме и остаток растирают с EtOAc, получают 4-хлор-1-гуанидино-7-(фенилсульфонил)изохинолин (65 мг, 0,18 ммоль) в виде желтого твердого вещества. Спектр 1H ЯМР (, ДМСО-d6, 400 МГц): 7,6-7,75 (3 Н, м), 8,1-9,2 (4 Н, уш.с), 8,2 (2 Н, д),8,35 (1 Н, д), 8,4 (1 Н, д), 8,45 (1 Н, с), 9,5 (1 Н, с),11,7 (1 Н, с); млн. д. Масс-спектр низкого разрешения: 361 40 К суспензии смеси гидрохлоридов 5- и 7 бромизохинолина (1:1) (получена путем циклизации диметил-(3-бромбензилиден)аминоацеталя в соответствии с методикой F.T.Tyson,J.Am.Chem.Soc., 1939, 61, 183-5) (11,43 г, 48,2 ммоль) в нитробензоле (12,5 мл) по каплям в течение 20 мин и при перемешивании добавляют бром (2,77 мл, 53,8 ммоль). Смесь нагревают при 170 С в течение 5 ч. Смесь охлаждают до 80 С, разбавляют толуолом (50 мл) с образованием осадка и оставляют на ночь при 23 С. Маточные жидкости декантируют с промывкой толуолом (220 мл). Твердый продукт настаивают в водном растворе гидроксида натрия (100 мл, 1 М), экстрагируют эфиром (3100 мл),эфирную фазу сушат сульфатом магния(MgSO4) и концентрируют в вакууме. Остаток очищают колоночной хроматографией на силикагеле с использованием в качестве элюента смеси гексаны:ЕtОАс (от 96:4 до 80:20). Получают 4,7-дибромизохинолин (5,91 г, 20,6 ммоль) в виде белого твердого вещества. Т.пл. 107-110 С. Спектр 1H ЯМР (, СDСl3, 300 МГц): 7,9(МН); Элементный анализ: Найдено, %: С 37,90; Н 1,67; N 4,83. C9H5Br2N. Вычислено, %: С 37,67; Н 1,76; N 4,88. Препаративный пример 2. 4-Бром-7 фенилизохинолин. Смесь 4,7-дибромизохинолина (556 мг,1,93 ммоль),тетракис-(трифенилфосфин) палладия(0) (73 мг, 3 мол.%), фенилбороновой кислоты (238 мг, 1,95 ммоль) и водного раствора карбоната натрия (Nа 2 СО 3) (3,9 мл, 1,0 М, 3,9 ммоль) в ДМФА (12 мл) кипятят с обратным холодильником в атмосфере азота в течение 20 ч. Смесь разбавляют этилацетатом (EtOAc) (100 мл), промывают водой (30 мл), сушат MgSO4 и упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле с использованием в качестве элюента смеси гексаны:EtOAc (от 95:5 до 80:20), получают 4 бром-7-фенилизохинолин (389 мг, 1,37 ммоль) в виде твердого вещества соломенного цвета. Спектр 1H ЯМР (, CDCl3, 300 МГц): 7,47,6 (3 Н, м), 7,65-7,75 (2 Н, м), 8,1 (1 Н, д), 8,15(i) Раствор 4-бромкоричной кислоты (5,03 г, 22,2 ммоль) в тионилхлориде (SOCl2) (15 мл) перемешивают при 23 С в течение 16 ч, а затем кипятят с обратным холодильником в течение еще 2 ч. Растворители упаривают в вакууме и остаток сушат азеотропом с толуолом (3 раза), 41 получают 4-бромциннамоилхлорид в виде оранжево-коричневого твердого вещества с количественным выходом. Спектр 1H ЯМР (, CDCl3, 300 МГц): 6,65(ii) Раствор азида натрия (NaN3) (2,2 г, 33,8 ммоль) в воде (7,5 мл) добавляют по каплям в течение 5 мин при перемешивании к раствору 4 бромциннамоилхлорида (22,2 ммоль) в ацетоне(22 мл) при -10 С. Гетерогенную смесь перемешивают при 0 С в течение 1 ч и разбавляют водой (25 мл). Осадок отфильтровывают и сушат в вакууме над пентаоксидом фосфора (Р 2O5), получают 4-бромциннамоилазид (5,22 г, 20,7 ммоль) в виде золотистого твердого вещества. Спектр 1H ЯМР (, CDCl3, 300 МГц): 6,4(iii) [Примечание Эта стадия потенциально взрывоопасна, будьте осторожны и используйте защитный экран]. Теплый раствор 4-бромциннамоилазида(Ph2O) (25 мл) добавляют по каплям в течение 15 мин при перемешивании к Ph2O (10 мл) при 270 С. Смесь нагревают при 270 С в течение 1,5 ч, охлаждают до 23 С и затем выливают в гексаны (400 мл). Осадок отфильтровывают с промывкой гексанами (2100 мл) и очищают колоночной хроматографией на силикагеле с использованием в качестве элюента смеси гексаны:ЕtOАс (от 6:4 до 100%-го EtOAc), получают 7-бромизохинолин (1,64 г, 7,3 ммоль) в виде белого твердого вещества. Спектр 1H ЯМР (, ДМСО-d6, 300 МГц): 6,55 (1 Н, д), 7,25-7,15 (1 Н, м), 7,6 (1 Н, д), 7,8(iv) Смесь 7-бромизохинолина (1,28 г, 5,69 ммоля) и PCl5 (2,04 г, 9,80 ммоль) нагревают при 140 С в течение 5 ч. Охлажденную смесь гасят льдом (50 г) и добавляют 0,880 аммиак до щелочной реакции, определяемой по лакмусовой бумаге. Водную смесь экстрагируют дихлорметаном (350 мл), объединенные органические фазы сушат МgSO4 и упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле с использованием в качестве элюента смеси гексаны:EtOAc (от 97:3 до 95:5). Получают 7-бром-1,4-дихлоризохинолин (1,13 г, 4,08 ммоль) в виде белого твердого вещества. Т.пл. 133,5-135 С. Спектр 1H ЯМР (, CDCl3, 300 МГц): 7,9 42 чение одного часа. Охлажденный раствор надуксусной кислоты добавляют к 6-бромизохинолину (Tyson F.T. J.Am.Chem. Soc., 1939,61, 183) (0,389 г 1,87 ммоля), и смесь затем нагревают при 80 С в течение 18 ч. Смесь разбавляют водой (15 мл) и концентрируют в вакууме до половины объема, остаток экстрагируютCH2Cl2 (225 мл). Объединенные органические фазы промывают насыщенным водным раствором NаНСО 3 (25 мл), сушат МgSO4, упаривают с получением масла. Азеотропная сушка с РhМе(3 раза) и затем с CH2Cl2 (3 раза) дает N-оксид 6-бромизохинолина (0,420 г, колич. выход) в виде твердого вещества кремового цвета. Спектр 1H ЯМР (, CDCl3, 300 МГц): 7,67,65 (2 Н, м), 7,77 (1 Н, дд), 8,0 (1H, с), 8,2 (1 Н,дд), 8,85 (1 Н, с). Масс-спектр низкого разрешения: 223, 226(МН). Следующие соединения препаративных примеров 5-8 получены аналогичным способом. Препаративный пример 5. (i) N-оксид 5 бромизохинолина иN-оксид 7 бромизохинолина. Названные соединения (смесь в соотношении 1:1) получены в виде белого порошка из смеси 5-бромизохинолина и 7-бромизохинолина(i) N-оксид 5-цианоизохинолина и (ii) Nоксид 7-цианоизохинолина. Названные соединения (смесь в соотношении 1:1) получены в виде светло-желтого порошка из смеси 5-цианоизохинолина и 7 цианоизохинолина (1:1) (Tyson F.T. J. Am.(МН), 341 (M2H). Препаративный пример 7. N-оксид 4,7 дибромизохинолина. Названное соединение получают из 4,7 дибромизохинолина. Спектр 1H ЯМР (, ДМСО-d6, 300 МГц): 7,85 (1H, д), 7,9 (1 Н, д), 8,25 (1H, с), 8,65 (1 Н, с),8,95 (1H, с). Масс-спектр низкого разрешения: 302, 303,305, 306 (МН). Препаративный пример 8. N-оксид 4-бром 7-фенилизохинолина. 43 Названное соединение получают из 4 бром-7-фенилизохинолина в виде твердого вещества лимонного цвета. Спектр 1H ЯМР (, ДМСО-d6, 300 МГц): 7,4-7,6 (3 Н, д), 7,75-7,85 (2 Н, м), 8,05 (2 Н, с),8,25 (1H, с), 8,6 (1H, с), 9,0 (1H, с). Масс-спектр низкого разрешения: 299, 301CH2Cl2 (20 мл) перемешивают с 3-хлорнадбензойной кислотой (м-ХНБК) (1,1 г, 3,19 ммоль) при комнатной температуре в течение 2,5 ч. Смесь разбавляют СН 2 Сl2 и затем промывают дитионитом натрия (1 М), карбонатом калия (1 М) и рассолом. Органический слой сушатMgSO4 и упаривают в вакууме, получают Nоксид 7-бензилоксиизохинолина (0,521 г, 2,09 ммоль) в виде порошка кремового цвета. Спектр 1H ЯМР (, СDСl3, 400 МГц): 5,15(МН). Следующие соединения припаративных примеров 10-14 получены аналогичным способом. Препаративный пример 10. N-оксид 5(этоксикарбонилметокси)изохинолина. Названное соединение получают из 5(этоксикарбонилметокси)изохинолина(МН). Препаративный пример 11. N-оксид 5 бензилоксиизохинолина. Названное соединение получают из 5 бензилоксиизохинолина (см. патент Японии JP 51070772) в виде желтого твердого вещества. Спектр 1H ЯМР (, CDCl3, 400 МГц): 5,2(МН). Препаративный пример 12. N-оксид 5 фенилизохинолина. Названное соединение получают из 5 фенилизохинолина (см. Pridgen L.N. J.Het.Chem. 1980, 17, 1289) в виде желтого вязкого масла. Спектр 1H ЯМР (, ДМСО-d6, 400 МГц): 7,4-7,5 (6 Н, м), 7,6 (1 Н, д), 7,7 (1 Н, дд), 7,9 (1 Н,д), 8,1 (1 Н, д), 9,0 (1 Н, с).(МН). Препаративный пример 13. N-оксид 6 метилизохинолина. Названное соединение получают из 6 метилизохинолина (см. Brown E.V., J.Org.Chem. 1977, 42, 3208) в виде почти белого твердого вещества. Спектр 1H ЯМР (, ДМСО-d6, 300 МГц): 2,5 (3 Н, с), 7,5 (1 Н, д), 7,7 (1 Н, с), 7,75-7,85 (2 Н,м), 8,1 (1 Н, д), 8,85 (1 Н, с). Масс-спектр низкого разрешения: 160(МН), 319 (М 2 Н). Препаративный пример 14. N-оксид 6,7(метилендиокси)изохинолина. Названное соединение получают из 6,7(метилендиокси) изохинолина (P.Fritsch, Ann. 1895, 286, 1) в виде твердого вещества кремового цвета. Спектр 1H ЯМР (, ДМСО-d6, 400 МГц): 6,1 (2 Н, с), 7,05 (1 Н, с), 7,15 (1 Н, с), 7,7 (1 Н, д),8,0 (1 Н, д), 8,7 (1 Н, с). Масс-спектр низкого разрешения: 190(МН), 379 (M2H). Препаративный пример 15. 6-Бром-1 хлоризохинолин. Оксихлорид фосфора (0,60 мл, 6,44 ммоль) добавляют одной порцией при перемешивании к раствору N-оксида 6-бромизохинолина (409 мг,1,83 ммоль) в CH2Cl2 (10 мл) и смесь кипятят с обратным холодильником в течение 6 ч. Избыток растворителей упаривают в вакууме, остаток суспендируют в воде (10 мл) и подщелачивают 0,880 аммиаком. Эту смесь экстрагируютCH2Cl2 (225 мл), объединенные органические фазы сушат MgSO4 и упаривают в вакууме, получают сырой продукт. Очистка колоночной хроматографией на силикагеле с использованием в качестве элюента смеси гексаны:EtOAc(90:10) дает 6-бром-1-хлоризохинолин (215 мг,0,86 ммоль) в виде твердого вещества кремового цвета. Т.пл. 105-107 С; Спектр 1H ЯМР (, CDCl3, 300 МГц): 7,5(МН). Элементный анализ: Найдено, %: С 44,50; Н 1,98; N 5,73. С 9 Н 5 ВrСlN. Вычислено, %: С 44,58; Н 2,08; N 5,78. Соединения препаративных примеров 1625, перечисленные ниже, получены аналогично с использованием соответствующих N-оксидов,из препаративного примера 15. Препаративный пример 16. 1-Хлор-5(этоксикарбонилметокси)изохинолин. Названное соединение получают из Nоксида 5-(этоксикарбонилметокси)изохинолина в виде белого твердого вещества. Т.пл. 52-4 С;(МН). Элементный анализ: Найдено, %: С 58,70; Н 4,48; N 5,18. C13H12ClNO3. Вычислено, %: С 58,77; Н 4,48; N 5,18. Препаративный пример 17. 5-Бензилокси 1-хлоризохинолин. Названное соединение получают из Nоксида 5-бензилоксиизохинолина в виде белого твердого вещества. Т.пл. 95-96 С; Спектр 1H ЯМР (, CDCl3, 300 МГц): 5,2(МН). Элементный анализ: Найдено, %: С 71,18; Н 4,43; N 5,09. C16H12ClNO. Вычислено, %: С 71,25; Н 4,48; N 5,19. Препаративный пример 18. 1-Хлор-5 фенилизохинолин. Названное соединение получают в виде масла из N-оксида 5-фенилизохинолина. Спектр 1H ЯМР (, CDCl3, 400 МГц); 7,357,55 (5 Н, м), 7,6-7,75 (3 Н, м), 8,2 (1H, д), 8,35(МH). Элементный анализ: Найдено, %: С 74,66; Н 4,17; N 5,81. C15H10ClN+0,1H2O. Вычислено,%: С 74,66; Н 4,26; N 5,80. Препаративный пример 19. 1-Хлор-6 метилизохинолин. Названное соединение получают в виде твердого вещества соломенного цвета из Nоксида 6-метилизохинолина. Спектр 1H ЯМР (, CDCl3, 300 МГц): 2,6(МН). Препаративный пример 20. 7-Бром-1 хлоризохинолин. Названное соединение получают из смесиN-оксидов 5- и 7-бромизохинолина и отделяют от 5-бром-1-хлоризохинолина с помощью хроматографии, получают белое твердое вещество. Спектр 1H ЯМР (, CDCl3, 300 МГц): 7,5(МН). Препаративный пример 21. 1-Хлор-7 цианоизохинолин. Названное соединение получают из смесиN-оксидов 5- и 7-цианоизохинолина и отделяют от 1-хлор-5-цианоизохинолина с помощью хроматографии, получают белое твердое вещество.(МН). Препаративный пример 22. 7-Бензилокси 1-хлоризохинолин. Названное соединение получают из Nоксида 7-бензилизохинолина, выделяя белый порошок. Т.пл. 128-131 С. Спектр 1H ЯМР (, CDCl3, 400 МГц): 5,2(МН). Элементный анализ: Найдено, %: С 71,04; Н 4,47; N 5,12. C16H12ClNO. Вычислено, %: С 71,25; Н 4,48; N 5,19. Препаративный прмер 23. 1-Хлор-4,7 дибромизохинолин. Названное соединение получают в виде белого твердого вещества из N-оксида 4,7 дибромизохинолина. Спектр 1H ЯМР (, СDСl3, 400 МГц): 7,9(МН). Препаративный пример 24. 4-Бром-1-хлор 7-фенилизохинолин. Названное соединение получают в виде белого твердого вещества из N-оксида 4-бром-7 фенилизохинолина. Т.пл. 144-147 С. Спектр 1H ЯМР (, СDСl3, 300 МГц): 7,47,6 (3 Н, м), 7,7-7,75 (2 Н, м), 8,1 (1 Н, д), 8,25 (1 Н,д), 8,45 (1 Н, с), 8,5 (1 Н, с). Масс-спектр низкого разрешения: 321(МН). Элементный анализ: Найдено, %: С 56,71; Н 2,89; N 4,30. C15H9BrClN. Вычислено, %: С 56,55; Н 2,85; N 4,40. Препаративный пример 25. 1-Хлор-6,7(метилендиокси)изохинолин. Названное соединение получают в виде твердого вещества кремового цвета из N-оксида 6,7-(метилендиокси)изохинолина. Спектр 1H ЯМР (, СDСl3, 300 МГц): 6,15-70 С добавляют н-BuLi (2,6 мл, 2,5 М раствор в гексанах). Через 10 мин прозрачный желтый раствор обрабатывают триметилборатом (1,5 мл, 13,2 ммоль) в ТГФ (2 мл) и перемешивают в 47 течение еще 6 ч, дают нагреться до комнатной температуры в течение 3 ч и гасят водой (10 мл). После разбавления водой (50 мл) смесь экстрагируют метиленхлоридом (2 раза). Объединенные органические фазы промывают рассолом и концентрируют до почти белого твердого вещества, которое перекристаллизовывают из диэтилового эфира. Получают белое твердое вещество (400 мг, 2,2 ммоль). Т.пл. 195-197 С. Спектр 1H ЯМР (, ДМСО-d6, 400 МГц): 3,7 (3 Н, с), 3,75 (3 Н, с), 6,45-6,5 (1 Н, м), 6,856,95 (2 Н, м). Масс-спектр низкого разрешения: 183(30 мл), сушат MgSO4 и упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле с использованием в качестве элюента смеси гексаны:ЕtОАс (от 99:1 до 97:3), получают 1,4-дихлор-7-(4-метилфенил)изохинолин (139 мг, 0,48 ммоль) в виде твердого вещества. Спектр 1H ЯМР (, CDCl3, 300 МГц): 2,45(3 Н, с), 7,35 (2 Н, д), 7,65 (2 Н, д), 8,1 (1 Н, дд),8,25 (1 Н, д), 8,3 (1 Н, с), 8,5 (1 Н, д). Масс-спектр низкого разрешения: 288, 290,292 (МН). Следующие соединения препаративных примеров 28-41 получены аналогично. Препаративный пример 28. 1-Хлор-7 фенилизохинолин. Названное соединение получают в виде масла из 7-бром-1-хлоризохинолина и фенилбороновой кислоты. Спектр 1 Н ЯМР (, CDCl3, 400 МГц): 7,47,55 (3 Н, м), 7,65 (1 Н, д), 7,75 (2 Н, д), 7,9 (1 Н,д), 8,05 (1 Н, д), 8,3 (1 Н, д), 8,55 (1 Н, с). Масс-спектр низкого разрешения: 240(МН). Препаративный пример 29. 1-Хлор-7-(3,4 метилендиоксифенил)изохинолин. Названное соединение получают в виде белого порошка из 7-бром-1-хлоризохинолина и 3,4-метилендиоксифенилбороновой кислоты(МН). Элементный анализ: Найдено, %: С 67,54; Н 3,51; N 4,87. C16H10ClNO2. Вычислено, %: С 67,74; Н 3,55; N 4,94. Препаративный пример 30. 7-(2-Бензилфуранил)-1,4-дихлоризохинолин. Названное соединение получено в виде твердого вещества желтого цвета из 7-бром-1,4 дихлоризохинолина и бензо[b]фуран-2-бороновой кислоты. Т.пл. 162 С. Спектр 1H ЯМР (, CDCl3, 400 МГц): 7,257,3 (2 Н, м), 7,3 (1 Н, дд), 7,55-7,65 (2 Н, м), 8,25(МН). Элементный анализ: Найдено, %: С 62,93; Н 2,79; N 4,33. С 17 Н 9 Сl2NО. Вычислено, %: С 63,21; Н 2,97; N 4,32. Препаративный пример 31. 1,4-Дихлор-7(3-тиенил)изохинолин. Названное соединение получают в виде твердого вещества желтого цвета из 7-бром-1,4 дихлоризохинолина и тиофен-3-бороновой кислоты. Т.пл. 109 С. Спектр 1H ЯМР (, CDCl3, 400 МГц): 7,45(МН). Препаративный пример 32. 1,4-Дихлор-7(2-метоксифенил)изохинолин. Названное соединение получают в виде твердого вещества светло-кремового цвета из 7 бром-1,4-дихлоризохинолина и 2-метоксифенилбороновой кислоты. Спектр 1H ЯМР (, CDCl3, 400 МГц): 3,8(МН). Препаративный пример 33. 1,4-Дихлор-7(3-метоксифенил)изохинолин. Названное соединение получают в виде твердого вещества светло-кремового цвета из 7 бром-1,4-дихлоризохинолина и 3-метоксифенилбороновой кислоты. Спектр 1H ЯМР (, CDCl3, 300 МГц): 3,95(1H, дд), 8,1 (1 Н, дд), 8,25 (1H, д), 8,35 (1H, с),8,5 (1H, с). Масс-спектр низкого разрешения: 304, 306,308 (МН). Препаративный пример 34. 1,4-Дихлор-7(4-метоксифенил)изохинолин. Названное соединение получают из 7 бром-1,4-дихлоризохинолина и 4-метоксифе 49 нилбороновой кислоты в виде бледно-желтого твердого вещества. Т. пл. 124-126 С; Спектр 1H ЯМР (, СDСl3, 400 МГц): 3,9(1H, д), 8,3 (1H, с), 8,45 (1H, с); Масс-спектр низкого разрешения: 304, 306,308 (МН); Элементный анализ: Найдено, %: С 62,28; Н 3,56; N 4,46. C16H11Cl2NO + 0,05CH2Cl3. Вычислено, %: С 62,50; Н 3,63; N 4,54. Препаративный пример 35. 1,4-Дихлор-7(3,4-метилендиоксифенил)изохинолин. Названное соединение получают из 7 бром-1,4-дихлоризохинолина и 3,4-метилендиоксифенилбороновой кислоты в виде твердого вещества. Спектр 1H ЯМР (, ДМСО-d6, 300 МГц): 6,1 (2 Н, с), 7,1 (1H, д), 7,35 (1H, д), 7,45 (1H, с),8,25 (1H, д), 8,35 (1H, д), 8,4 (1H, с), 8,45 (1H, с); Масс-спектр низкого разрешения: 318, 320(МН). Препаративный пример 36. 1,4-Дихлор-7(3,5-диметоксифенил)изохинолин. Названное соединение получают из 7 бром-1,4-дихлоризохинолина и 3,5-диметоксифенилбороновой кислоты в виде почти белого твердого вещества. Т. пл. 140-142 С. Спектр 1H ЯМР (, CDCl3, 400 МГц): 3,85(1H, д), 8,3 (1H, с), 8,5 (1H, с); Масс-спектр низкого разрешения: 333, 335,337 (МН); Элементный анализ: Найдено, %: С 61,17; Н 4,05; N 3,78. C17H13Cl2NO2 + 0,14EtOAc. Вычислено, %: С 60,86; Н 4,11; N 4,04. Препаративный пример 37. 7-(3-Цианофенил)-1,4-дихлоризохинолин. Названное соединение получают по методике, аналогичной препаративному примеру 42,из 7-бром-1,4-дихлоризохинолина и 3-цианофенилбороновой кислоты (международная патентная заявкаWO 94/11372) в виде почти белого твердого вещества. Т. пл. 197-199 С; Спектр 1H ЯМР (, CDCl3, 300 МГц): 8,5(1H, с), 7,95 (1 Н, д), 7,7 (1 Н, д), 7,65 (1 Н, д); Масс-спектр низкого разрешения: 298, 300; Элементный анализ: Найдено, %: С 64,01; Н 2,67; N 9,20. C16H8Cl2N2. Вычислено, %: С 64,24; Н 2,70; N 9,36. Препаративный пример 38. 4-Бром-1-хлор 7-(3-хлорфенил)изохинолин. Названное соединение получают по методике, аналогичной препаративному примеру 42,из 1-хлор-4,7-дибромизохинолина и 3-хлорфенилбороновой кислоты в виде белого твердого вещества. Т. пл. 140-142 С; Спектр 1H ЯМР (, CDCl3, 300 МГц): 7,47,55 (2 Н, м), 7,6 (1 Н, д), 7,75 (1H, с), 8,1 (1 Н, д),8,3 (1H, д), 8,5 (2 Н, с); Масс-спектр низкого разрешения: 352, 354,356 (МН); Элементный анализ: Найдено, %: С 50,38; Н 2,20; N 3,93. C15H8BrCl2N. Вычислено, %: С 50,60; Н 2,33; N 3,93. Препаративный пример 39. 4-Бром-1-хлор 7-(4-метилфенил)изохинолин. Названное соединение получают по методике, аналогичной препаративному примеру 42,из 1-хлор-4,7-дибромизохинолина и 4-метилфенилбороновой кислоты в виде белого твердого вещества. Т. пл. 108-110 С; Спектр 1H ЯМР (, CDCl3, 400 МГц): 2,4(1H, д), 8,4 (1H, с), 8,45 (1H, с); Масс-спектр низкого разрешения: 332, 334,336 (МН); Препарaтивный пример 40. 4-Бром-1-хлор 7-(4-метоксифенил)изохинолин. Названное соединение получают по методике, аналогичной препаративному примеру 42,из 1-хлор-4,7-дибромизохинолина и 4-метоксифенилбороновой кислоты в виде белого твердого вещества. Т. пл. 94-96 С; Спектр 1H ЯМР (, CDCl3, 400 МГц): 3,85(1 Н, д), 8,4 (2 Н, с); Масс-спектр низкого разрешения: 348, 350,352 (МH); Элементный анализ: Найдено, %: С 55,16; Н 3,13; N 4,02. C16H11BrClNO. Вычислено, %: С 55,12; Н 3,18; N 4,02. Препаративный пример 41. 4-Бром-1-хлор 7-(3-метоксифенил)изохинолин. Названное соединение получают по методике, аналогичной препаративному примеру 42,из 1-хлор-4,7-дибромизохинолина и 3-метоксифенилбороновой кислоты в виде белого твердого вещества. Спектр 1H ЯМР (, CDCl3, 400 МГц): 3,9 51 ммоль), и полученную смесь кипятят с обратным холодильником в атмосфере азота в течение 16 ч. Реакционную смесь охлаждают до комнатной температуры, распределяют междуEtOAc (35 мл) и водой (10 мл), сушат и упаривают, получают твердое вещество, которое очищают колоночной хроматографией на силикагеле с использованием в качестве элюента смеси гексаны-EtOAc (от 99:1 до 96:4), получают названное соединение в виде почти белого твердого вещества (120,6 мг, 0,36 ммоль). Спектр 1H ЯМР (, CDCl3, 300 МГц): 8,35(1 Н, т), 6,7 (2 Н, д), 3,75 (6 Н, с); Масс-спектр низкого разрешения: 334, 336,338 (МН); Препаративный пример 43. 1-Хлор-7-(2 фенил-Е-этенил)изохинолин. Раствор 7-бром-1-хлоризохинолина (200 мг, 0,80 ммоль), стирола (94 мг, 0,90 ммоль),три-о-толилфосфина (30 мг, 12 мол.%), ацетата палладия(II) (Pd(OAc)2) (10 мг, 5 мол.%) и триэтиламина (0,34 мл, 2,5 ммоль) в ДМФА (0,75 мл) помещают в микроволновую печь MOS2000 (650 Вт) и облучают при полной мощности в течение 740 с (ход реакции контролируют по ТСХ). Смесь выливают в воду и экстрагируют EtOAc. Объединенные органические слои сушат MgSO4, упаривают в вакууме и остаток очищают колоночной хроматографией на силикагеле с использованием смеси гексан-EtOAc(от 100:0 до 95:5) в качестве элюента, получают 1-хлор-(2-фенилэтен-1-ил)изохинолин (135 мг,0,508 ммоль) в виде желтого твердого вещества. Т. пл. 118-121 С. Спектр 1H ЯМР (, CDCl3, 300 МГц): 7,37,35 (3 Н, м), 7,44 (2 Н, дд), 7,55-7,65 (3 Н, м), 7,8Eur.J.Med.Chem., Chim. Therap. 1974, 9, 197) (1,0 г, 4,12 ммоль) в смеси ТГФ-эфир (36 мл, 1:1) при перемешивании и при температуре -78 С в атмосфере азота добавляют раствор н-BuLi (1,76 мл, 2,5 М раствор в гексанах, 4,4 ммоль). Через 20 мин добавляют ДМФА (0,66 мл, 8,5 ммоль) и через 30 мин выдерживания при -78 С реакционную смесь гасят EtOH (3 мл) и нагревают до комнатной температуры. Смесь разбавляют эфиром (150 мл), промывают насыщенным раствором NH4Cl (50 мл), рассолом, сушат MgSO4 и упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле, используя смесь гексаны-EtOAc (от 95:5 до 50:50) в 52 качестве элюента,получают 1-хлор-5 изохинолинкарбоксальдегид (308 мг, 1,61 ммоль) в виде белого твердого вещества. Спектр 1H ЯМР (, CDCl3, 400 МГц): 7,9(МН). Препаративный пример 45. 1-Хлор-7 изохинолинкарбоксальдегид. Названное соединение получают по методике, аналогичной препаративному примеру 44,из 7-бром-1-хлоризохинолина в виде белого твердого вещества. Спектр 1H ЯМР (, ДМСО-d6, 300 МГц): 7,95 (1H, д), 8,2 (2 Н, с), 8,4 (1H, д), 8,85 (1H, д),10,2 (1H, с); Масс-спектр низкого разрешения: 192, 194(МН). Препаративный пример 46. Гидрохлорид 7-карбокси-1-хлоризохинолина. К перемешиваемому раствору 7-бром-1 хлоризохинолина (0,64 г, 2,64 ммоль) в ТГФ (10 мл) и эфире (10 мл) при температуре -78 С в атмосфере азота добавляют по каплям раствор н-BuLi (1,2 мл, 2,5 М раствор в гексанах, 3,0 ммоль). Через 20 мин добавляют одной порцией истолченный твердый СО 2 (избыток) и смесь оставляют нагреваться до комнатной температуры. Растворители упаривают в вакууме, остаток распределяют между водным NaOH (20 мл,0,5 М) и эфиром (50 мл). Водную фазу подкисляют концентрированной НСl, экстрагируютEtOAc (350 мл), объединенные органические экстракты сушат MgSO4 и упаривают, получают гидрохлорид 7-карбокси-1-хлоризохинолина(0,277 г, 1,13 ммоль) в виде практически белого твердого вещества. Спектр 1H ЯМР (, ДМСО-d6, 300 МГц): 7,95 (1H, д), 8,15 (1H, д), 8,3 (1H, д), 8,4 (1H, д),8,8 (1H, с), 13,5 (1H, ушир.с); Масс-спектр низкого разрешения: 208, 210(1,3 М раствор в циклогексане, 0,7 мл, 0,91 ммоль), получают темно-зеленый раствор, который через 4 мин гасят циклогексаноном (100 мл,0,96 ммоль). Охлаждающую баню удаляют и реакционную смесь оставляют нагреваться до комнатной температуры, перемешивают в течение 20 мин и гасят каплей воды. ТГФ удаляют в вакууме и к остатку добавляют воду (5 мл), экстрагируют этилацетатом (310 мл). Объединенные органические слои промывают водой (5 мл) и рассолом (5 мл), затем сушат МgSO4 и наносят на силикагель (1 г) и очищают колоночной хроматографией (силикагель, 15 г), используя смесь 53 гексаны-EtOAc (от 100:15 до 100:20) в качестве элюента, получают названное соединение в виде белого твердого вещества (83 мг, 0,32 ммоля). Т.пл. 109,5-111 С; Спектр 1H ЯМР (, CDCl3, 300 МГц): 1,32,1 (11 Н, м), 7,55 (1H, д), 7,85 (1 Н, д), 7,95 (1H,д), 8,25 (1 Н, д), 8,45 (1H, с); Масс-спектр низкого разрешения: 262, 264(МН). Следующие соединения препаративных примеров 48-51 получают аналогичным способом. Препаративный пример 48. 1-Хлор-7-(1 гидроксициклопент-1-ил)изохинолин. Названное соединение получают из 7 бром-1-хлоризохинолина, образующийся анион гасят циклопентаноном, получают желтое твердое вещество. Спектр 1H ЯМР (, CDCl3, 300 МГц): 1,52,2 (9 Н, м), 7,6 (1H, д), 7,8 (1H, д), 7,9 (1H, д),8,25 (1H, д), 8,45 (1H, с). Масс-спектр низкого разрешения: 248, 250(МН). Препаративный пример 49. 1-Хлор-7-(1 гидрокси-1-фенилэтил)изохинолин. Названное соединение получают из 7 бром-1-хлоризохинолина, образующийся анион гасят ацетофеноном, получают твердое вещество кремового цвета. Т.пл. 134-135 С. Спектр 1H ЯМР (, CDCl3, 400 МГц): 2,0(МН). Элементный анализ: Найдено, %: С 71,49; Н 5,06; N 4,90. C17H14ClNO + 0,08EtOAc. Вычислено, %: С 71,54; Н 5,07; N 4,82. Препаративный пример 50. 1-Хлор-7-(гидроксибензил)изохинолин. Названное соединение получают из 7 бром-1-хлоризохинолина, образующийся анион гасят бензальдегидом, получают белое твердое вещество. Спектр 1H ЯМР (, CDCl3, 300 МГц): 2,45(МН). Элементный анализ: Найдено, %: С 70,11; Н 4,63; N 4,85. C16H12ClN + 0,2EtOAc. Вычислено, %: С 70,22; Н 4,77; N 4,87. Препаративный пример 51. 1,4-Дихлор-7(-гидроксибензил)изохинолин. Названное соединение получают из 7 бром-1,4-дихлоризохинолина,образующийся анион гасят бензальдегидом, получают белое твердое вещество. Т.пл. 121-122 С.(8 мл) при -78 С обрабатывают MeLi (1,0 М раствор в ТГФ, 0,86 мл, 0,86 ммоль) в течение 30 мин. Через 15 мин раствор нагревают до 0 С и перемешивают еще в течение 1 ч. Реакционную смесь разбавляют EtOAc (30 мл), промывают насыщенным раствором хлорида аммония (20 мл), рассолом (20 мл), сушат MgSO4 и конденсируют до оранжево-коричневого масла. После очистки колоночной хроматографией на силикагеле (25 г) с использованием в качестве элюента смеси гексаны-EtOAc (10:3), получают названное соединение в виде беловатого масла (85 мг,0,41 ммоль). Спектр 1H ЯМР (, CDCl3, 400 МГц): 1,55(NaBH4) (68 мг, 1,8 ммоль) в МеОН (6 мл) перемешивают при комнатной температуре в течение 2 ч. Реакционную смесь гасят водой (2 мл) и концентрируют в вакууме. Остаток суспендируют в CH2Cl2, промывают водой, рассолом и затем сушат MgSO4 и упаривают. Остаток очищают колоночной хроматографией на силикагеле с использованием в качестве элюента смеси гексаны-EtOAc (от 80:20 до 50:50), получают 1 хлор-5-(гидроксиметил)изохинолин (240 мг,1,23 ммоль) в виде белого твердого вещества. Спектр 1H ЯМР (, CDCl3, 400 МГц): 2,0(МН), 387 (M2H). Препаративный пример 54. 1-Хлор-7 гидроксиметилизохинолин. Названное соединение получают по методике, аналогичной препаративному примеру 53,из 1-хлоризохинолин-7-карбоксальдегида, получают белый порошок. Т.пл. 118-121 С; Спектр 1H ЯМР (, ДМСО-d6, 300 МГц): 4,7 (2 Н, д), 5,5 (1H, т), 7,8 (1H, д), 7,85 (1H, д),8,0 (1H, д), 8,2 (1H, с), 8,25 (1H, д).(МН). Элементный анализ: Найдено, %: С 62,24; Н 4,34; N 7,01. C10H8ClNO. Вычислено, %: С 62,01; Н 4,16; N 7,23. Препаративный пример 55. Гидрохлорид 1-хлор-7-хлорметилизохинолина. К тионилхлориду (4 мл) при комнатной температуре медленно добавляют 1-хлор-7(гидроксиметил)изохинолин (510 мг, 2,63 ммоль) и полученную смесь перемешивают в течение 1,5 ч, получают раствор. Тионилхлорид удаляют в вакууме и добавляют метиленхлорид(20 мл). Получаемый белый осадок отфильтровывают и еще раз промывают метиленхлоридом(20 мл), затем сушат в вакууме, получают названное соединение (400 мг, 1,61 ммоль). Вторую порцию (112 мг, 0,45 ммоль) получают,упаривая метиленхлорид и растирая остаток со смесью эфир/метиленхлорид. Т. пл. 138-140 С; Спектр 1H ЯМР (, ДМСО-d6, 300 МГц): 5,0 (2 Н, с), 7,8-7,95 (2 Н, м), 8,05 (1 Н, д), 8,258,35 (2 Н, м). Элементный анализ: Найдено, %: С 47,98; Н 3,17; N 5,58. C10H8Cl3N. Вычислено, %: С 48,32; Н 3,24; N 5,64. Препаративный пример 56. 1-Хлор-7-[(2 метил-1 Н-имидазол-1-ил)метил]изохинолин. К раствору 2-метилимидазола (100 мг, 1,2 ммоль) в сухом ДМФД (2 мл) добавляют гидрид натрия (60%-я дисперсия в масле, 48 мг, 1,2 ммоль) и перемешивают, пока не прекратится выделение Н 2, после чего добавляют гидрохлорид 1-хлор-7-(хлорметил)изохинолина (150 мг,0,6 ммоль). Реакционную смесь перемешивают в течение 3 ч, выливают в воду (10 мл) и экстрагируют EtOAc (310 мл). Органические экстракты объединяют, сушат MgSO4 и упаривают до масла, которое забирают в диизопропиловый эфир и оставляют кристаллизоваться. Твердые вещества отфильтровывают, получают белые кристаллы названного соединения (70 мг, 0,27 ммоль). Дополнительную порцию продукта (70 мг, 0,27 ммоль) получают концентрированием маточного раствора. Спектр 1H ЯМР (, CDCl3, 400 МГц): 2,35(МН). Элементный анализ: Найдено, %: С 65,14; Н 4,66; N 16,28. C14H12ClN3. Вычислено, %: С 65,24; Н 4,69; N 16,31. Соединения препаративных примеров 57 и 58 получают аналогичным способом. Препаративный пример 57. 1-Хлор-7-[(2 метил-1 Н-бензо[d]имидазол-1-ил)метил]изохинолин. 56 Названное соединение получают из 2 метилбензимидазола в виде твердого вещества кремового цвета. Т. пл. 245-247 С. Спектр 1H ЯМР (, CDCl3, 400 МГц): 2,6(МН). Элементный анализ: Найдено, %: С 70,16; Н 4,55; N 13,54. C18H14ClN3. Вычислено, %: С 70,24; Н 4,59; N 13,65. Препаративный пример 58. 1-Хлор-7(феноксиметил)изохинолин. Названное соединение получают из фенола и практически белое твердое вещество используют без дополнительной очистки. Т. пл. 60 С; Масс-спектр низкого разрешения: 270, 272(патент Германии DE 2816863) (1,75 г, 7,4 ммоль) и NaOH (0,8 г, 20 ммоль) в смеси МеОНН 2 О (50 мл, 4:1) перемешивают при температуре 23 С в течение 5 ч. Растворители упаривают в вакууме, остаток распределяют между СН 2 Сl2 и водным раствором NaOH (2 М). Водную фазу подкисляют концентрированной НСl и экстрагируют большим количеством EtOAc (4 раза). Объединенные органические слои промывают рассолом, сушат MgSO4 и концентрируют в вакууме, получают гидрохлорид 5-карбокси-1 хлоризохинолина (1,8 г, 7,4 ммоль) в виде белого твердого вещества. Спектр 1H ЯМР (, ДМСО-d6, 300 МГц): 7,8 (1 Н, дд), 8,4 (1 Н, д), 8,5 (1 Н, д), 8,6 (1 Н, д),8,7 (1 Н, д), 13,6 (1 Н, ушир.с); Масс-спектр низкого разрешения: 208, 210(МН). Препаративный пример 60. Гидрохлорид 5-карбоксиметокси-1-хлоризохинолина. Названное соединение получают по методике, аналогичной препаративному примеру 59,из 5-(этоксикарбонилметокси)-1-хлоризохинолина в виде белого твердого вещества. Т. пл. 200 С; Спектр 1H ЯМР (, ДMCO-d6, 300 МГц): 4,9 (2 Н, с), 7,2 (1 Н, д), 7,7 (1H, дд), 7,8 (1 Н, д),8,0 (1H, д), 8,3 (1 Н, д), 12,6 (1H, ушир.с); Масс-спектр низкого разрешения: 238(5 мл), содержащий ДМФА (1 капля) кипятят с обратным холодильником в атмосфере N2 в течение 2 ч. Растворители упаривают в вакууме, 57 остаток подвергают азеотропной сушке с PhMe,получают гидрохлорид 1-хлор-5-изохиноилхлорида (1,62 ммоль) в виде практически белого твердого вещества. Хлорангидрид кислоты используют сразу же без очистки и идентификации. Раствор гидрохлорида 1-хлор-5 изохиноилхлорида (1,62 ммоль) в CH2Cl2 (25 мл), насыщенном NН 3, перемешивают при температуре 23 С в течение 18 ч. Растворители упаривают в вакууме, остаток снова растворяют в CH2Cl2 и промывают водой и рассолом. Органическую фазу сушат MgSO4 и концентрируют в вакууме, получают сырой продукт, который очищают, растирая его с эфиром, получают 5 карбоксамидо-1-хлоризохинолин (92 мг, 0,45 ммоль) в виде белого твердого вещества. Спектр 1H ЯМР (, ДМСО-d6, 400 МГц): 7,7 (1 Н, ушир. с), 7,8 (1 Н, дд), 8,0 (1 Н, д), 8,1(МН); Элементный анализ: Найдено, %: С 57,61; Н 3,33; N 13,30. С 10 Н 7 СlN2O + 0,04 СН 2 Сl2. Вычислено, %: С 57,42; Н 3,40; N 13,34. Соединения препаративных примеров 62 и 63 получены аналогичным способом. Препаративный пример 62. 5-(Карбамоилметокси)-1-хлоризохинолин. Названное соединение получают из гидрохлорида 5-карбоксиметокси-1-хлоризохинолина в виде белого порошка. Т. пл. 163-166 С. Спектр 1 Н ЯМР (, ДМСО-d6, 400 МГц): 4,6 (2 Н, с), 7,2 (1 Н, д), 7,45 (1 Н, ушир.с), 7,65(МН). Элементный анализ: Найдено, %; С 51,83; Н 4,13; N 11,07. C11H9ClN2O2+H2O. Вычислено,%: С 51,88; Н 4,35; N 11,00. Препаративный пример 63. 7-N-Бензилкарбамоил-1-хлоризохинолин. Названное соединение получают из гидрохлорида 7-карбокси-1-хлоризохинолина и бензиламина,получают рыжевато-коричневое твердое вещество. Т. пл. 144-145 С. Спектр 1H ЯМР (, CDCl3, 400 МГц): 4,7(МН), 593 (M2H). Препаративный пример 64. 1-Хлор-5 сульфамоилизохинолин. К охлажденному льдом раствору дымящейся серной кислоты (20% SO3, 2 мл) порциями при перемешивании добавляют 1 хлоризохинолин (1,0 г, 6,1 ммоль). После пере 002632 58 мешивания при комнатной температуре в течение 3 ч реакционную смесь нагревают при 80 С в течение 18 ч, затем охлаждают на ледяной бане, выливают в лед (70 г), промывают эфиром и концентрируют в вакууме. Остаток обрабатывают изопропанолом, получают белое твердое вещество, которое фильтруют и сушат, получают 1-хлор-5-изохинолинсульфоновую кислоту(МН); Суспензию 1-хлор-5-изохинолинсульфоновой кислоты (1,14 г, 4,68 ммоль) в тионилхлориде (13 мл) и ДМФА (0,3 мл, 3,9 ммоль) кипятят с обратным холодильником в течение 3 ч. После концентрирования в вакууме и азеотропной сушки с толуолом получают 1-хлор-5 хлорсульфонилизохинолин в виде почти белого твердого вещества, которое используют сразу же. Раствор 1-хлор-5-хлорсульфонилизохинолина (613 мг, 2,34 ммоль) в метиленхлориде,насыщенном газообразным аммиаком (20 мл),перемешивают при комнатной температуре в течение 18 ч, концентрируют в вакууме, получают белое твердое вещество, которое очищают колоночной хроматографией на силикагеле(предварительно абсорбировано), в качестве элюента используют смесь EtOAc-гексаны (1:1),получают 1-хлор-5-сульфамоилизохинолин в виде белого твердого вещества (206 мг, 0,85 ммоль). Т. пл. 216-218 С; Спектр 1H ЯМР (, ДМСО-d6, 400 МГц): 7,8 (1H, с), 7,9 (1 Н, т), 8,4 (1H, д), 8,45 (1H, с),8,5 (1H, д); Масс-спектр низкого разрешения: 243, 245 К перемешиваемому раствору 7-бром-1 хлоризохинолина (200 мг, 0,825 ммоль) в смеси тетрагидрофуран-эфир (ТГФ-Et2O) (2,0 мл, 1:1) в атмосфере N2 при температуре -78 С добавляют по каплям н-бутиллитий (0,35 мл, 2,5 М раствор в гексанах, 0,875 ммоль). Через 5 мин смесь добавляют к раствору сульфурилхлорида(SO2Cl2) (0,14 мл, 1,74 ммоль) в гексане (2,0 мл) при температуре -25 С в атмосфере N2, и смесь нагревают до 23 С и перемешивают в течение 3 ч. Добавляют концентрированный водный раствор аммиака (3,0 мл, 0,880), после чего все рас 59 творители упаривают в вакууме. Остаток суспендируют в EtOAc, промывают водным раствором НСl (2 М), рассолом и затем упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле, в качестве элюента используют смесь гексаны-EtOAc (от 50:50 до 30:70), получают названное соединение (37 мг,0,152 ммоль) в виде белого твердого вещества. Т. пл. 220-222 С; Спектр 1H ЯМР (, CD3OD, 400 МГц): 7,9 К перемешиваемому раствору 7-бром-1 хлоризохинолина (500 мг, 2,06 ммоль) в смеси тетрагидрофуран-эфир (TГФ-Et2O) (10 мл, 1:1) в атмосфере N2 при температуре -78 С добавляют по каплям н-бутиллитий (0,88 мл, 2,5 М раствор в гексанах, 2,2 ммоль). Через 5 мин смесь добавляют к раствору SO2Cl2 (0,35 мл, 4,36 ммоль) в гексане (10 мл) при температуре -25 С в атмосфере N2, и смесь нагревают до 23 С и перемешивают в течение 4,5 ч. Растворители упаривают в вакууме, подвергая азеотропной сушке с РhМе, остаток суспендируют в CH2Cl2 (12 мл) и добавляют анилин (0,25 мл, 2,74 ммоль) и NEt3(1,15 мл, 8,25 ммоль). Смесь перемешивают при комнатной температуре в течение ночи, промывают водным раствором НСl (2 М), рассолом и упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле, используют смесь гексаны-EtOAc (от 80:20 до 50:50) в качестве элюента, получают названное соединение (116 мг, 0,36 ммоль) в виде почти белого твердого вещества. Спектр 1H ЯМР (, CD3OD, 400 МГц): 7,07,15 (3 Н, м), 7,2-7,25 (2 Н, м), 7,8 (1H, д), 8,1 (2 Н,2 хд), 8,4 (1H, д), 8,7 (1H, с); млн. д. Масс-спектр низкого разрешения: 319, 321(MeCN) (250 мл) по каплям добавляют раствор(80 мл) и смесь нагревают до кипения. Смесь кипятят с обратным холодильником в течение еще 1,5 ч и затем охлаждают до комнатной тем 002632 К перемешиваемой хлорсульфоновой кислоте (61 мл, 918 ммоль) при температуре 0 С порциями добавляют 4-хлор-1(2 Н)-изохинолон(20,62 г, 115 ммоль). Смесь нагревают до 100 С в течение 3,5 дней и затем охлаждают до комнатной температуры. Реакционную смесь маленькими порциями добавляют в ледяную воду(осторожно) и полученный осадок отфильтровывают. Твердое вещество промывают водой,растирают с MeCN и затем сушат в вакууме,получают 4-хлор-7-хлорсульфонил-1-(2 Н)-изохинолон (18,75 г, 67,4 ммоль) в виде твердого вещества кремового цвета. Спектр 1H ЯМР (, ДМСО-d6, 400 МГц): 7,45 (1 Н, с), 7,8 (1H, д), 8,0 (1 Н, д), 8,5 (1H, с),11,5 (1 Н, ушир.с); млн. д. Элементный анализ: Найдено, %: С 39,37; Н 2,09; N 4,94. С 9 Н 5 Сl2NО 3S. Вычислено, %: С 38,87; Н 1,81; N 5,04. К перемешиваемой суспензии 4-хлор-7 хлорсульфонил-1-(2 Н)-изохинолона (22,1 г, 79,6 ммоль) в MeCN (500 мл) при комнатной температуре добавляют оксихлорид фосфора (РОСl3)(9,65 мл, 103,5 ммоль) и смесь кипятят с обратным холодильником в течение 15 ч. После охлаждения раствор MeCN декантируют с нерастворимой суспензией и упаривают в вакууме. Остаток экстрагируют горячим EtOAc и упаривают, получают твердое вещество, которое перемешивают с Et2 О (1,2 л) в течение ночи при комнатной температуре. Эфирный раствор декантируют с нерастворимого остатка и упаривают в вакууме, получают 7-хлорсульфонил-1,4 дихлоризохинолин (20 г, 67 ммоль) в виде бледно-желтого твердого вещества. Спектр 1 Н ЯМР (, ДМСО-d6, 400 МГц): 8,2 (2 Н, с), 8,5 (1 Н, с), 8,55 (1 Н, с); млн.д. Элементный анализ: Найдено, %: С 37,19; Н 1,34; N 4,77. C9H4Cl3NO2S. Вычислено, %: С 36,45; Н 1,36; N 4,72.
МПК / Метки
МПК: C07D 217/22, A61K 31/47, C07D 491/04
Метки: способ, урокиназы, ингибиторов, применение, изохинолины, получения, качестве
Код ссылки
<a href="https://eas.patents.su/30-2632-izohinoliny-sposob-ih-polucheniya-i-primenenie-v-kachestve-ingibitorov-urokinazy.html" rel="bookmark" title="База патентов Евразийского Союза">Изохинолины, способ их получения и применение в качестве ингибиторов урокиназы</a>
Предыдущий патент: Производные 4-циано-4-деформилсордарина
Следующий патент: Способ синтеза производных хинолина
Случайный патент: Устройство и способ опускания/поднятия объекта в/из текучую среду/текучей среды