Спироциклические ацилгуанидины в качестве ингибиторов бета-секретазы (bace1)
Номер патента: 24995
Опубликовано: 30.11.2016
Авторы: Дорнер-Сиоссек Корнелла, Чжэн Яцзюнь, Цзя Ланьци, Какатиан Салвасион, Лала Дипак С., Ривз Джонатан, Моралес-Рамон Энджел, Венкатраман Шанкар, Раст Георг, Сингх Суреш Б., Чжао И, Фукс Клаус, Бухтияров Юрий, Юань Цзин, Диллард Лоуренс Уэйн, Сюй Чжэньжун
Формула / Реферат
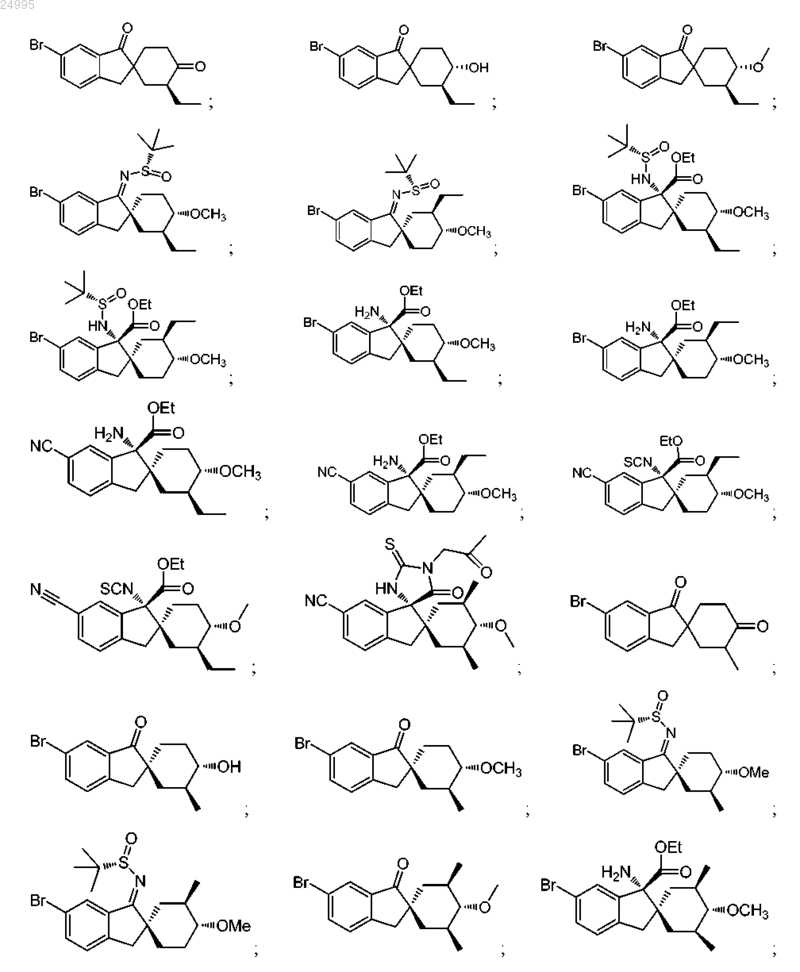
1. Соединение, представленное структурной формулой, выбранной из
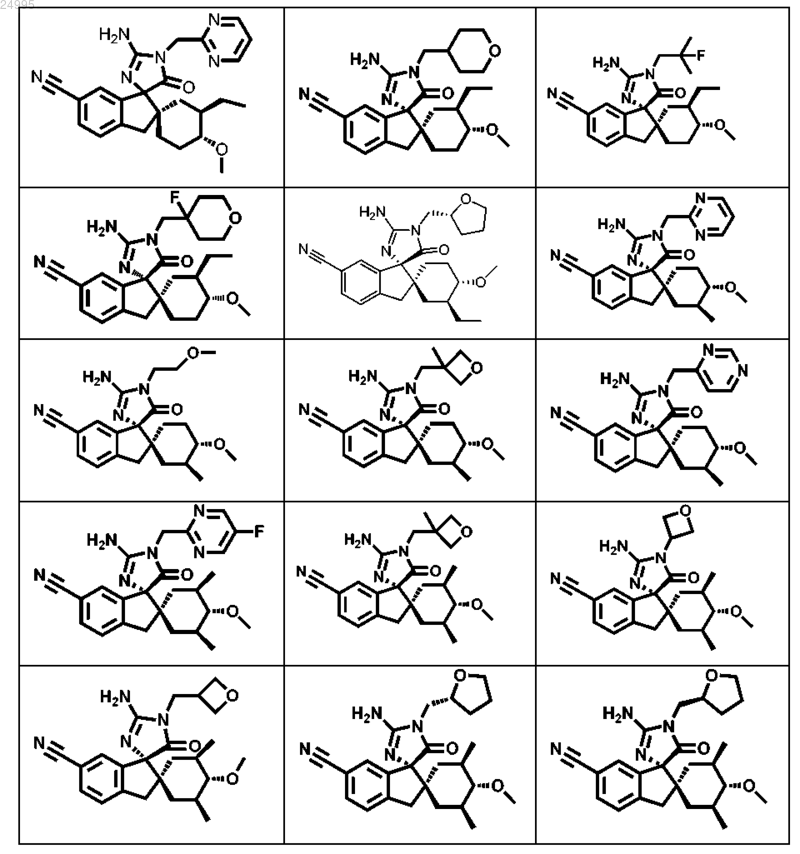

или его фармацевтически приемлемая соль.
2. Соединение по п.1 структурной формулы
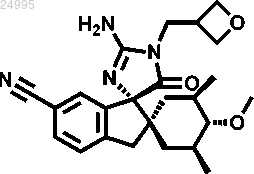
или его фармацевтически приемлемая соль.
3. Соединение по п.1 структурной формулы
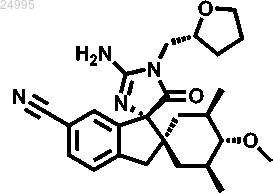
или его фармацевтически приемлемая соль.
4. Соединение по п.1 структурной формулы
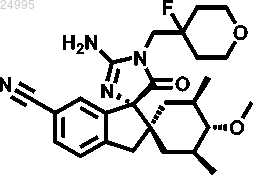
или его фармацевтически приемлемая соль.
5. Фармацевтическая композиция, содержащая по меньшей мере одно соединение по п.1 или его фармацевтически приемлемую соль в смеси с фармацевтически приемлемым адъювантом, разбавителем и/или носителем.
6. Применение соединения по п.1 или его фармацевтически приемлемой соли для лечения опосредованного ферментом β-секретазой (ВАСЕ1) нарушения или заболевания.
7. Применение по п.6, где опосредованное ВАСЕ1 нарушение или заболевание выбирают из нейродегенеративного нарушения, снижения когнитивных способностей, когнитивного нарушения, деменции и заболевания, характеризующегося формированием отложений β-амилоида или нейрофибриллярных клубков.
8. Применение по п.7, где нарушение или заболевание выбирают из болезни Альцгеймера, трисомии по 21 паре хромосом (синдром Дауна), наследственной церебральной геморрагии с амилоидозом голландского типа (HCHWA-D), сенильной деменции, церебральной амилоидной ангиопатии, дегенеративной деменции, деменций смешанного сосудистого и дегенеративного происхождения, деменции, ассоциированной с болезнью Паркинсона, деменции, ассоциированной с прогрессирующим супрануклеарным параличом, деменции, ассоциированной с корковой базальной дегенерацией, болезни Альцгеймера с диффузными тельцами Леви, сухой возрастной макулярной дегенерации (AMD) и глаукомы.
9. Применение по п.8, где нарушение или заболевание представляет собой болезнь Альцгеймера.
10. Применение по п.8, где нарушение или заболевание представляет собой глаукому.
11. Применение соединения по п.1 или его фармацевтически приемлемой соли для производства лекарственного средства для лечения у субъекта опосредованного ВАСЕ1 нарушения или заболевания.
12. Применение по п.11, где опосредованное ВАСЕ1 заболевание или нарушение выбирают из нейродегенеративного нарушения, снижения когнитивных способностей, когнитивного нарушения, деменции и заболевания, характеризующегося формированием отложений β-амилоида или нейрофибриллярных клубков.
13. Применение по п.12, где нарушение или заболевание выбирают из болезни Альцгеймера, трисомии по 21 паре хромосом (синдром Дауна), наследственной церебральной геморрагии с амилоидозом голландского типа (HCHWA-D), сенильной деменции, церебральной амилоидной ангиопатии, дегенеративной деменции, деменции смешанного сосудистого и дегенеративного происхождения, деменции, ассоциированной с болезнью Паркинсона, деменции, ассоциированной с прогрессирующим супрануклеарным параличом, деменции, ассоциированной с корковой базальной дегенерацией, болезни Альцгеймера с диффузными тельцами Леви, сухой возрастной макулярной дегенерации (AMD) и глаукомы.
14. Применение по п.13, где заболевание или нарушение представляет собой болезнь Альцгеймера.
15. Применение по п.13, где заболевание или нарушение представляет собой болезнь глаукому.
16. Соединение, выбранное из
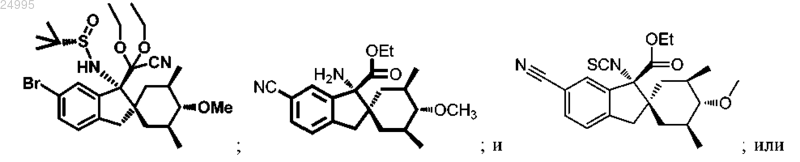
или его соль.
17. Соединение структурной формулы

или его фармацевтически приемлемая соль.
Текст
СПИРОЦИКЛИЧЕСКИЕ АЦИЛГУАНИДИНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ БЕТАСЕКРЕТАЗЫ (BACE1) Изобретение относится к спироциклическим ацилгуанидинам и их применению в качестве ингибиторов активности фермента -секретазы (ВАСЕ 1), к содержащим указанные соединения фармацевтическим композициям и к способам применения указанных соединений в качестве терапевтических средств для лечения нейродегенеративных нарушений, нарушений,характеризующихся снижением когнитивных способностей, когнитивных нарушений, деменции и заболеваний, характеризующихся формированием отложений -амилоида или нейрофибриллярных клубков.(71)(73) Заявитель и патентовладелец: БЕРИНГЕР ИНГЕЛЬХАЙМ ИНТЕРНЭШНЛ ГМБХ (DE); ВАЙТАИ ФАРМАСЬЮТИКЛЗ, ИНК. Родственные заявки По данной заявке испрашивается приоритет в соответствии с предварительной заявкой на выдачу патента США 61/606786, поданной 5 марта 2012 года, полное содержание которой включено в настоящий документ посредством ссылки. Область техники Настоящее изобретение относится к спироциклическим ацилгуанидинам и их применению в качестве ингибиторов активности фермента -секретазы (ВАСЕ 1), к содержащим указанные соединения фармацевтическим композициям и к способам применения указанных соединений в качестве терапевтических средств для лечения нейродегенеративных нарушений, нарушений, характеризующихся снижением когнитивных способностей, когнитивных нарушений, деменции и заболеваний, характеризующихся формированием отложений -амилоида или нейрофибриллярных клубков. Уровень техники Отложения -амилоида (также называемого в настоящем документе "Абета" или "А") и нейрофибриллярные клубки представляют собой две основные патологические характеристики, ассоциированные с болезнью Альцгеймера (AD), включая генетически связанные семейные формы с ранним началом, обусловленные мутациями в белке-предшественнике амилоида (АРР) пресенелине 1 и 2, а также спорадическую AD с поздним началом. Клинически AD характеризуется потерей памяти, когнитивной способности, способности к мышлению, суждению и ориентации. По мере прогрессирования заболевания также страдают двигательная, сенсорная и лингвистическая способности до тех пор, пока не происходит глобальное нарушение сложных когнитивных функций. Такие когнитивные потери происходят постепенно,но, как правило, ведут к тяжелому нарушению и, в конце концов, к смерти в пределах 4-12 лет. Отложения -амилоида преимущественно представляют собой агрегат пептида Абета, который, в свою очередь, представляет собой продукт протеолиза АРР. Более конкретно, пептид А возникает вследствие расщепления АРР на С-концах посредством одной или нескольких -секретаз и на N-концах посредством фермента -секретазы (ВАСЕ 1), также известной как аспартилпротеаза и мемапсин 2, как части -амилоидогенного пути. Активность ВАСЕ напрямую коррелирует с генерацией пептида А из АРР, и все больше исследований указывают на то, что ингибирование ВАСЕ ингибирует продукцию пептида А. Амилоидогенные бляшки и сосудистая амилоидная ангиопатия также характерна для головного мозга пациентов с трисомией по 21 паре хромосом (синдром Дауна), наследственной церебральной геморрагией с амилоидозом голландского типа (HCHWA-D) и другими нейродегенеративными нарушениями. Нейрофибриллярные клубки также возникают при других нейродегенеративных нарушениях,включая нарушения, индуцирующие деменцию. Недавно сообщалось, что Абета вовлечен в развитие апоптоза ганглиозных клеток сетчатки (RGC) при глаукоме, с наличием у пациентов с глаукомой опосредованного каспазой-3 аномального процессинга белка-предшественника амилоида, увеличенной экспрессии Абета в RGC при экспериментальной глаукомы и сниженными уровнями А в стекловидном теле (указывающими на отложение А в сетчатке). Отложения амилоида также были связаны с макулярной дегенерацией у пациентов, страдающих сухой возрастной макулярной дегенерацией (AMD), и в моделях AMD на животных. В WO 2010/021680, WO 2011/106414 и WO 2010/105179 раскрыты спироциклические ацилгуанидины со сприциклической структурой в качестве ингибиторов бета-секретазы. Сущность изобретения Настоящее изобретение относится к соединениям, которые являются ингибиторами ВАСЕ 1 и применимы в качестве терапевтических средств для лечения заболевания или нарушения, характеризующегося повышенным отложением -амилоида или уровнями -амилоида у пациента. Раскрытые ингибиторы ВАСЕ 1 являются не только очень мощными ингибиторами фермента ВАСЕ 1 (метод анализа 1), но также демонстрируют(1) очень мощную ингибирующую активность в методе анализа Abeta на клетках (метод анализа 2),(2) селективность в отношении канала hERG сердца в методе анализа на клетках (метод анализа 3),а также(3) низкую склонность вызывать фосфолипидоз в методе анализа фосфолипидоза на клетках (метод анализа 4). Таким образом, настоящее изобретение относится к соединениям, которые демонстрируют сочетание высокой активности в качестве ингибиторов ВАСЕ 1, высокой селективности в отношении каналаhERG сердца и низкой фосфолипидозной активности. Один вариант осуществления настоящего изобретения представляет собой соединение, представленное структурной формулой выбранной из или фармацевтически приемлемую соль любого из приведенных выше соединений. Непосредственно приведенные выше соединения называют в настоящем документе "соединениями согласно настоящему изобретению". Другой вариант осуществления настоящего изобретения представляет собой соединение согласно настоящему изобретению или его фармацевтически приемлемую соль для применения в качестве лекарственного средства. Другой вариант осуществления настоящего изобретения представляет собой фармацевтическую композицию, содержащую соединение согласно настоящему изобретению или его фармацевтически приемлемую соль в смеси с фармацевтически приемлемым адъювантом, разбавителем или носителем. Другой вариант осуществления настоящего изобретения представляет собой соединение согласно настоящему изобретению или его фармацевтически приемлемую соль для применения при лечении у субъекта опосредованного ВАСЕ 1 нарушения или заболевания. Другой вариант осуществления настоящего изобретения представляет собой применение соедине-2 024995 ния согласно настоящему изобретению или его фармацевтически приемлемой соли для производства лекарственного средства для лечения у субъекта опосредованного ВАСЕ 1 нарушения. Другой вариант осуществления настоящего изобретения представляет собой фармацевтическую композицию для лечения у субъекта опосредованного ВАСЕ 1 нарушения или заболевания, содержащую соединение согласно настоящему изобретению. Другой вариант осуществления настоящего изобретения представляет собой способ лечения у субъекта опосредованного ВАСЕ 1 нарушения или заболевания, включающий в себя введение субъекту эффективного количества соединения согласно настоящему изобретению или его фармацевтически приемлемой соли. Еще один вариант осуществления настоящего изобретения представляет собой промежуточный продукт, используемый при получении соединения согласно настоящему изобретению. Указанные промежуточные продукты представлены структурной формулой, выбранной из или соли любого из приведенных выше соединений. Подробное описание изобретения Соединения согласно настоящему изобретению обладают мощной ингибирующей активностью в отношении фермента ВАСЕ 1 и продукции Абета наряду с селективностью в отношении канала hERG и низкой склонностью вызывать фосфолипидоз. Например, соединения согласно настоящему изобретению демонстрируют ингибирование ВАСЕ 1 с IC5015 нМ, ингибирование продукции Абета в клетках с IC502 нМ, ингибирование hERG50% при 10 мкМ и фосфолипидоз со значением наименьшей эффективной концентрацией (FEC) 150 мкМ. Указанные сочетанные свойства делают соединения согласно настоящему изобретению применимыми для лечения у людей патологических состояний, в частности для лечения болезни Альцгеймера, а также других нарушений и заболеваний, опосредованных ВАСЕ 1. Как было установлено Sanguinetti et al. (1995, Cell, Apr. 21, 81(2):299-307) и большим объемом последующих данных, ингибирование канала hERG (ген специфических калиевых каналов человека) ксе-3 024995 нобиотиками и последующая замедленная реполяризация сердца ассоциированы с повышенным риском специфической полиморфной желудочковой тахиаритмии, двунаправленной желудочковой тахикардии. Чтобы избежать такого риска на ранних стадиях, обычной практикой является скрининг взаимодействия с hERG в системе in vitro с использованием гетерологичной экспрессии канала hERG, и такой тип анализа также является важной частью дальнейшего доклинического профилирования кандидата, рекомендованного в руководстве ICH S7B (International Conference on Harmonization (2005): ICH Topic S 7 В TheHuman Pharmaceuticals (www.ich.org/products/guidelines/safety/article/safety-guidelines.html. В этой связи,слабое ингибирование канала hERG, такое как продемонстрированное соединениями согласно настоящему изобретению, крайне желательно для терапевтических средств. Фосфолипидоз представляет собой нарушение накопления липидов, при котором избыток фосфолипидов накапливаются внутри клеток. Индуцированный лекарствами фосфолипидоз представляет собой нежелательную реакцию на лекарство. Следовательно, во избежание вредных побочных эффектов соединения с низкой фосфолипидозной активностью предпочтительны для применения в терапевтической практике на людях. Данные, представленные ниже в табл. 1, демонстрируют, что соединения согласно настоящему изобретению обладают таким сочетанием мощной активности в отношении ВАСЕ 1 в клетках, селективности в отношении hERG сердца и низкой склонности вызывать фосфолипидоз. Считается, что соединения,приведенные в качестве примера в WO 2010/021680 и WO 2010/105179, не обладают таким сочетанием желаемых свойств. Кроме того, в табл.2 представлены данные, демонстрирующие, что определенные соединения согласно настоящему изобретению характеризуются существенно более низкими ингибирующими значениями IC50 в методе анализа фермента ВАСЕ 1, а также в методе анализа Абета на клетках, по сравнению с определенными соединениями сравнения, описанными в WO 2010/105179. Терминам, конкретно не определенным в настоящем документе, следует присвоить значения, которые были бы присвоены им специалистом в данной области техники в свете настоящего раскрытия и контекста. Однако, если не указано иное, то используемые в настоящем описании следующие термины характеризуются указанным значением, и соблюдаются следующие условия. Если соединение согласно настоящему изобретению описывается посредством названия или структуры без указания всех таутомерных форм, то следует понимать, что такое соединение и его фармацевтически приемлемые соли охватывают все таутомеры. Если соединение согласно настоящему изобретению описывается посредством названия или структуры без указания стереохимии, то следует понимать, что такое соединение и его фармацевтически приемлемые соли охватывают все стереоизомеры, оптические и геометрические изомеры (например, энантиомеры, диастереомеры, E/Z изомеры и т. п.) и их рацематы, а также смеси с различными пропорциями отдельных энантиомеров, смеси диастереоизомеров или смеси любых из вышеизложенных форм. Если стереоизомер, оптический или геометрический изомер описан посредством названия или структуры, то следует понимать, что стереоизомерная, оптическая или геометрическая изомерная чистота поименованного или указанного стереоизомера, оптического или геометрического изомера составляет по меньшей мере 60, 70, 80, 90, 99 или 99,9 мас.% чистого вещества. Стереоизомерная, оптическая или геометрическая изомерная чистота определяется путем деления массы поименованного или указанного стереоизомера, оптического или геометрического изомера в смеси на суммарную массу всех стереоизомеров, оптических или геометрических изомеров в смеси. Если соединение согласно настоящему изобретению или его фармацевтически приемлемая соль поименованы или указаны посредством структуры, то следует понимать, что сольваты, гидраты и безводные формы такого соединения и сольваты, гидраты и безводные формы его фармацевтически приемлемой соли включены в настоящее изобретение. Термин "сольваты" относится к кристаллическим формам,в которых молекулы растворителя включены в кристаллическую решетку в процессе кристаллизации. Сольват может включать в себя воду или неводный растворитель, такой как этанол, изопропанол, DMSO,уксусную кислоту, этаноламин и EtOAc. Сольваты, в которых вода представляет собой молекулу растворителя, включенную в кристаллическую решетку, обычно называют "гидратами". Гидраты включают в себя стехиометрические гидраты, а также композиции, содержащие различные количества воды. Термин "безводные формы" относится к соединениям, не содержащим какого-либо растворителя или воды или, по существу, не содержащим растворителя или воды, включенных в кристаллическую структуру (например, молярное соотношение растворителя или воды к соединению менее чем 1/10, 1/20; 1/100 или 1/200). Соли. Используемое в настоящем документе выражение "фармацевтически приемлемый" относится к таким соединениям, веществам, композициям и/или лекарственным формам, которые в рамках здравого медицинского суждения являются подходящими для применения в контакте с тканями людей и животных без проявления чрезмерной токсичности, раздражения, аллергической реакции или другой проблемы или осложнения, и соразмерны с приемлемым соотношением польза/риск. Используемый в настоящем документе термин "фармацевтически приемлемые соли" относится к производным раскрытых соедине-4 024995 ний, в которых исходное соединение модифицировано посредством образования его кислых или щелочных солей. Примеры фармацевтически приемлемых солей включают в себя без ограничения соли неорганических или органических кислот с остатками оснований, таких как амины; щелочные или органические соли остатков кислот, таких как карбоновые кислоты; и т. п. Например, такие соли включают в себя соли аммония, L-аргинина, бетаина, бенетамина, бензатина, гидроксида кальция, холина, деанола, диэтаноламина (2,2'-иминобис(этанола, диэтиламина, 2-(диэтиламино)этанола, 2-аминоэтанола, этилендиамина, N-этилглюкамина, гидрабамина, 1 Н-имидазола, лизина, гидроксида магния, 4-(2 гидроксиэтил)морфолина, пиперазина, гидроксида калия, 1-(2-гидроксиэтил)пирролидина, гидроксида натрия, триэтаноламина (2,2',2"-нитрилотрис(этанола, трометамина, гидроксида цинка, уксусной кислоты, 2,2-дихлоруксусной кислоты, адипиновой кислоты, альгиновой кислоты, аскорбиновой кислоты,L-аспарагиновой кислоты, бензолсульфоновой кислоты, бензойной кислоты, 2,5-дигидроксибензойной кислоты, 4-ацетамидобензойной кислоты, (+)-камфорной кислоты, (+)-камфор-10-сульфоновой кислоты,карбоновой кислоты, коричной кислоты, лимонной кислоты, цикламовой кислоты, каприновой кислоты,додецилсерной кислоты, этан-1,2-дисульфоновой кислоты, этансульфоновой кислоты, 2 гидроксиэтансульфоновой кислоты, этилендиаминтетрауксусной кислоты, муравьиной кислоты, фумаровой кислоты, галактаровой кислоты, гентизиновой кислоты, D-глюкогептоновой кислоты, Dглюконовой кислоты, D-глюкуроновой кислоты, глутаминовой кислоты, глутаровой кислоты, 2 оксоглутаровой кислоты, глицерофосфорной кислоты, глицина, гликолевой кислоты, капроновой кислоты, гиппуровой кислоты, бромисто-водородной кислоты, соляной кислоты, изомасляной кислоты, DLмолочной кислоты, лактобионовой кислоты, лауриновой кислоты, лизина, малеиновой кислоты, (-)-Lяблочной кислоты, малоновой кислоты, DL-миндальной кислоты, метансульфоновой кислоты, галактаровой кислоты, нафталин-1,5-дисульфоновой кислоты, нафталин-2-сульфоновой кислоты, 1-гидрокси-2 нафтойной кислоты, никотиновой кислоты, азотной кислоты, октановой кислоты, олеиновой кислоты,оротовой кислоты, щавелевой кислоты, пальмитиновой кислоты, памоевой кислоты (эмбоновой кислоты), фосфорной кислоты, пропионовой кислоты, (-)-L-пироглутаминовой кислоты, салициловой кислоты,4-аминосалициловой кислоты, себациновой кислоты, стеариновой кислоты, янтарной кислоты, серной кислоты, таннина, (+)-L-винной кислоты, тиоциановой кислоты, пара-толуолсульфоновой кислоты и ундециленовой кислоты. Другие фармацевтически приемлемые соли могут быть образованы с катионами металлов, таких как алюминий, кальций, литий, магний, калий, натрий, цинк и т. п. (см. также Pharmaceutical salts, Berge S.M. et al., J. Pharm.Sci., (1977), 66, 1-19). Фармацевтически приемлемые соли согласно настоящему изобретению могут быть синтезированы из исходного соединения, которое содержит фрагмент основания или кислоты, посредством общепринятых химических способов. Как правило, такие соли могут быть получены путем осуществления взаимодействия форм свободной кислоты или основания таких соединений с достаточным количеством соответствующего основания или кислоты в воде или в органическом разбавителе, таком как простой эфир,этилацетат, этанол, изопропанол или ацетонитрил или их смесь. Соли отличных от упомянутых выше кислот, которые применимы, например, для очистки или выделения соединений согласно настоящему изобретению (например, трифторацетаты), также составляют часть настоящего изобретения. Биологические данные. Метод анализа ВАСЕ 1 (метод анализа 1). Ингибирующую активность соединений оценивали посредством анализа активности ВАСЕ 1 методом тушения флуоресценции с использованием коммерчески доступного субстрата HiLyte Fluor488Glu-Val-Asn-Leu-Asp-Ala-Glu-Phe-Lys-(QXL 520)-ОН (SEQ ID NO:1) AnaSpec, San Jose, CA) и процессированной бета-секретазы человека ВАСЕ 1 (аминокислоты 1-454), слитой с myc-Hys-меткой и секретируемой HEK293/BACEect. клетками в OptiMEM (Invitrogen). Субстрат растворяли в DMSO до концентрации 1 мг/мл. Анализ проводили в 384-луночном планшете в присутствии OptiMEM (супернатант, собранный через 24 ч и очищенный от клеточного дебриса путем центрифугирования), содержащего эктодомен ВАСЕ 1, 25 мкл воды с двукратной относительно желаемой концентрацией тестируемого соединения и 2%DMSO, 1 мкМ пептида субстрата, 20 мМ NaOAc, pH 4,4 и 0,04% Тритон-Х 100 в суммарном анализируемом объеме 50 мкл. В общем, в планшет добавляли 25 мкл разведения соединения с последующим добавлением 10 мкл ВАСЕ 1 с OptiMEM в разведении 1:10 в воде с 0,2% Тритона Х-100. Реакцию инициировали добавлением 15 мкл субстрата в NaOAc буфере. Реакционную смесь инкубировали при к.т. (в темноте) в ридере с множественным считыванием меток Envision (Perkin Elmer) и регистрировали расщепление субстрата в виде кинетики в течение 60 мин при длине волны возбуждения 485 нм и длине волны испускания 538 нм. В каждом планшете содержались контрольные лунки, не содержащие фермента. С целью получения значений скорости реакции во всех 384 лунках определяли убыль интенсивности флуоресценции во времени. Значения скорости использовали для вычисления регуляции (в %), принимая контроль с 1% DMSO и отсутствием ингибирования за 100% и контроль без фермента за 0%. Зна-5 024995 чения IC50 вычисляли посредством аппроксимации регуляции (в %) относительно концентрации тестируемого соединения с использованием Assay Explorer. Метод анализа на клетках H4-APPwt (метод анализа 2). Эффективность соединений согласно настоящему изобретению на клетках оценивали в методе анализа с мониторингом продукции Абета 1-х пептидов в линии клеток нейроглиомы Н 4 (АТСС, кат. НТВ-148), стабильно экспрессирующей АРР человека, с использованием иммуноанализа, такого как AlphaLISA (PerkinElmer, кат. AL288). Тестируемые соединения растворяли в DMSO и предварительно разбавляли культуральной средой (DMEM с 10% FBS и 1% пенициллина/стрептомицина) с получением двойной относительно конечной концентрации соединений для анализа. В 96-луночный культуральный планшет добавляли равные объемы двукратных растворов тестируемых соединений и суспензии клеток,так чтобы в каждой лунке содержалось 10000 клеток в конечном объеме в 200 мкл. Конечная концентрация DMSO при анализе составляла 0,2%. Планшеты инкубировали в течение 5 ч при температуре 37 С, 5% СО 2, чтобы позволить клеткам прилипнуть ко дну лунок в присутствии тестируемых соединений. Затем среду удаляли и заменяли свежей средой, содержащей тестируемые соединения в той же конечной концентрации. Планшеты инкубировали в течение 18 ч при температуре 37 С, 5% CO2. Концентрации Абета 1-х определяли с использованием иммуноанализа AlphaLISA (PerkinElmer, кат. AL288),следуя протоколу производителя. Для вычисления значений ингибирования (в%) в каждой лунке с тестируемыми соединениями в качестве контроля без ингибирования и фонового контроля соответственно использовали концентрации Абета 1-х в лунках, содержащих либо DMSO, либо 10 мкМ ингибитора бетасекретазы (ВАСЕ ингибитор IV, EMD Bioscience, кат. 565788). Значения ингибирования (в%) определяли относительно концентраций соединения с использованием аппроксимации кривой по четырем параметрам, и вычисляли значения IC50 (концентрация соединения, при которой наблюдается эффект ингибирования на 50%) как концентрацию соединения, соответствующую точке перегиба кривой. Метод анализа каналов hERG (метод анализа 3). Клетки. Клетки НЕК 293 (эмбриональные клетки почек человека) были стабильно трансфицированы кДНКhERG. Пипетки и растворы. Клетки переохлаждали омывающим раствором, содержащим (в мМ): NaCl (137), KCl (4,0), MgCl2(1,0), CaCl2 (1,8), глюкозу (10), HEPES (10), рН 7,4 с NaOH. Пэтч-пипетки изготавливали из трубок из боросиликатного стекла с использованием приспособления для горизонтального вытягивания и заполняли пипетируемым раствором, содержащим (в мМ): К-аспартат (130), MgCl2 (5,0), EGTA (5,0), К 2 АТР(4,0), HEPES (10,0), рН 7,2 с КОН. Сопротивление микроэлектродов находилось в пределах от 2 до 5 МОм. Стимулирование и регистрация. Мембранные токи регистрировали с использованием пэтч-кламп амплификатора ЕРС-10 и программного обеспечения PatchMaster. Опосредованные hERG мембранные токи регистрировали при 35 С с использованием метода пэтч-кламп в конфигурации "целая клетка". Исходный потенциал трансфицированных клеток НЕК 293 фиксировали (-60 мВ) и выявляли опосредованные hERG инактивирующие следовые токи с использованием последовательности импульсов с фиксированными амплитудами (активация/инактивация: 40 мВ в течение 2000 мс; восстановление: -120 мВ в течение 2 мс; линейное изменение до 40 мВ в течение 2 мс; инактивирующий следовой ток: 40 мВ в течение 50 мс) с повторяющимися интервалами в 15 с. Для процедуры вычитания Р/n утечки в течение каждого интервала между импульсами регистрировали 4 импульса, масштабированных с коэффициентом 0,2. Rs компенсацию использовали до уровня, позволяющего надежную регистрацию без затухания. Приготовление и применение соединения. Различные концентрации тестируемого соединения последовательно применяли в отношении каждой их различных исследуемых клеток. Уровень устойчивого состояния базового тока регистрировали на протяжении по меньшей мере 6 циклов измерения до использования первой концентрации тестируемого соединения. Тестируемое соединение растворяли в DMSO с получением основного маточного раствора, который в дальнейшем разбавляли DMSO до получения маточных растворов, необходимых для более низких концентраций. Перед началом каждого эксперимента из этих маточных растворов приготавливали свежие конечные разведения внеклеточным буфером путем разбавления 1:1000. Данные анализа. Максимальные амплитуды тока измеряли через 3 мс после линейного изменения до +40 мВ. Перед применением следующей концентрации для базовой линии и каждой концентрации усредняли максимальные значения тока в трех последних циклах. Остаточные токи (I/I0) вычисляли для каждой клетки в виде доли действительного среднего значения максимального тока и среднего значения максимального тока на базовой линии. Результаты представляли в виде процента (%) ингибирования (1-I/I0)100% при 10 мкМ. Метод анализа фосфолипидоза in vitro (метод анализа 4). Фосфолипидогенный потенциал тестируемых соединений оценивали с использованием гематопоэтической линии клеток U937 человека. Принцип теста заключался в анализе содержания фосфолипидов путем окрашивания клеток флуоресцентным красителем нильским красным. Клетки U937 высевали в культуральные планшеты в концентрации 0,510 клеток/мл в среде RPMI,содержащей 10% FBS, 1% DMSO и 0,005% гентамицина. Затем клетки культивировали в присутствии или в отсутствие различных концентраций тестируемых соединений в течение 48 ч в стандартных культуральных условиях. Для отбора на анализ клетки центрифугировали при 130g в течение 4 мин и однократно промывалиPBS. Затем, для измерения в нефиксированных клетках приготавливали 20,5 мл суспензии клеток (0,5 мл для измерения жизнеспособности с йодидом пропидия и 0,5 мл для измерения с нильским красным). Оставшиеся клетки фиксировали 3,7% формальдегидом в течение 30 мин. После последующего этапа центрифугирования клетки ресуспендировали с 1,3 мл рабочего раствора нильского красного (1 мкг/мл) и инкубировали в течение 5 мин при к.т. Затем, суспензию клеток дважды промывали 3 мл PBS и центрифугировали при 130g в течение 4 мин. Супернатант дискардировали, клетки ресуспендировали в 0,5 мл PBS и хранили для измерения методом проточной цитометрии. Для окрашивания нильским красным 0,5 мл образцов с нефиксированными клетками к образцу добавляли 50 мкл готового к использованию раствора нильского красного (10 мкг/мл). Образцы выдерживали на льду в течение 5 мин. Затем их однократно промывали 4 мл PBS (4C, 250g в течение 8 мин), а затем ресуспендировали в 400 мкл PBS и хранили для измерения методом проточной цитометрии. Для измерения жизнеспособности к 0,5 мл суспензии с нефиксированными клетками добавляли 12,5 мкл готового к использованию раствора PI (10 мкг/мл). После 15 мин инкубации на льду в образцах проводили измерение методом проточной цитометрии с использованием проточного цитометра CoulterEpics XL/MCL. Жизнеспособность клеток в каждом образце определяли путем измерения содержания PI на канале 2 методом проточной цитометрии (568/590 нм). Гейты для разделения живых и мертвых клеток на основании различий во флуоресценции определяли на основании анализа в контрольных образцах с культуральной средой. На фосфолипидоз анализировали лишь образцы с жизнеспособностью клеток 90% по сравнению с контрольными образцами. Для этого методом проточной цитометрии на канале 1 (504/541 нм) и на канале 4 (660/680 нм) проводили измерения в каждом образце с нильским красным (образцы с нефиксированными и фиксированными клетками). Для каждого канала относительную интенсивность флуоресценции нильского красного в тестируемом образце рассчитывали относительно контрольных образцов и выражали в процентах относительно интенсивности флуоресценции в контроле. Оценку фосфолипидогенного потенциала и наименьшей эффективной концентрации (FEC) тестируемого соединения проводили вручную на основании значений интенсивности флуоресценции на обоих длинах волн для фиксированных клеток, а также для нефиксированных клеток. Анализ снижения А в головном мозге крыс (метод анализа 5). Эффективность соединений согласно настоящему изобретению in vivo была продемонстрирована методом анализа снижения (редукции) содержания А в головном мозге крыс, и данные представлены в табл. 3. Для демонстрации способности соединений согласно настоящему изобретению снижать содержание амилоидных пептидов А 1-х в головном мозге использовали самцов крыс линии Sprague-Dawley в возрасте от 5 до 6 недель. Соединения вводили через пероральный зонд однократными дозами в 1%-ном Полисорбате-80 и 0,5%-ном Натрозоле, указанными в табл. 3. Животных умерщвляли спустя 3 ч после введения дозы, головной мозг извлекали, разделяли на мозжечок и левое и правое полушария и быстро замораживали в жидком азоте. Полушария головного мозга гомогенизировали (5 объемов по весу) в 20 мМ Трис-HCl, рН 8,5, 0,2% Тритон-Х 100, с добавлением ингибиторов протеаз (cOmplete, Roche Applied Science) при 4 С с использованием стеклянного гомогенизатора Даунса. Гомогенат центрифугировали при 120000g в течение 60 мин 4 С, супернатант собирали и анализировали на содержание А 1-х с использованием иммуноанализа с хемилюминесцентной детекцией (Meso-Scale Discovery, Rockville, MD (MSD. Обработанные стрептавидином 96-луночные планшеты (MSD) предварительно обрабатывали 5%ным раствором блокатора A (MSD) в течение 1 ч при к.т. на орбитальном шейкере и четырежды промывали фосфатным буферным солевым раствором (PBS). Лунки предварительно покрывали биотинилированными антителами SIG-39155 (20 нг/лунку, клон М 3.2, специфический для аминокислот 10-15 А грызунов) в течение 1 ч при к.т. и четырежды промывали PBS. Для анализа содержания А 1-х, 25 мкл очищенных лизатов головного мозга или А 1-40 стандартов (8-500 пг/мл, с двукратным увеличением) инкубировали в течение 1 ч при к.т. при постоянном перемешивании. Лунки четырежды промывали PBS, добавляли 25 мкл обнаруживающего антитела (меченное сульфо-меткой анти-А 40-антитело производстваMSD), и инкубировали в течение 1 ч при к.т. После 4-кратного промывания PBS добавляли 150 мкл хемилюминесцентного обнаруживающего реагента (Read Buffer T, MSD) и проводили считывание с план-7 024995 шета на приборе MSD Sector Imager 6000. Калибровочную кривую аппроксимировали с использованием нелинейной регрессионной модели с четырьмя параметрами и вычисляли концентрации А 1-х в каждой лунке, содержащей очищенные лизаты головного мозга. Процент снижения А вычисляли на основании отличий от средних значений концентрации А, полученных для головного мозга животных, подвергавшихся обработке только растворителем. В табл. 1 представлены следующие свойства соединений согласно настоящему изобретению: способность ингибировать ВАСЕ 1, измеренная согласно методу анализа 1; ингибирующая способность в клетках, измеренная согласно методу анализа 2; ингибирование hERG, измеренное согласно методу анализа 3; и наименьшая эффективная концентрация (FEC) в модели фосфолипидоза, измеренная согласно методу анализа 4. Таблица 1 Биологические свойства соединений согласно настоящему изобретению В табл. 2 представлены данные, демонстрирующие, что определенные соединения согласно настоящему изобретению характеризуются значительно меньшими значениями IC50 в методе анализа ингибирования ВАСЕ 1 (метод анализа 1) и в методе анализа в клетках Abeta (метод анализа 2) по сравнению с определенными соединениями сравнения, описанными в WO 2010/105179. Способность соединений согласно настоящему изобретению снижать содержание А в головном мозге продемонстрировали на крысах, как описано в методе анализа 5, и данные эффективности in vivo представлены в табл. 3. Таблица 3 Способ лечения. Настоящее изобретение относится к соединениям, которые применимы для лечения нарушений или заболеваний, характеризующихся повышенными отложениями -амилоида или уровнями -амилоида у субъекта, при которых ингибирование активности фермента -секретазы (ВАСЕ 1) терапевтически эффективно, включая без ограничения лечение, уменьшение интенсивности или профилактику нейродегенеративных нарушений, нарушений, характеризующихся снижением когнитивных способностей, когнитивных нарушений, деменции и заболеваний, характеризующихся формированием отложений амилоида или нейрофибриллярных клубков. Соединения согласно настоящему изобретению применимы для лечения болезни Альцгеймера, трисомии по 21 паре хромосом (синдром Дауна), наследственной церебральной геморрагии с амилоидозом голландского типа (HCHWA-D), сенильной деменции, церебральной амилоидной ангиопатии, дегенеративной деменции, деменций смешанного сосудистого и дегенеративного происхождения, деменции, ассоциированной с болезнью Паркинсона, деменции, ассоциированной с прогрессирующим супрануклеарным параличом, деменции, ассоциированной с корковой базальной дегенерацией, болезни Альцгеймера с диффузными тельцами Леви, сухой возрастной макулярной дегенерации (AMD) и глаукомы. "Сухая" форма AMD, также известная как "центральная географическая атрофия", возникает вследствие атрофии пигментного эпителиального слоя сетчатки под нейросенсорной частью сетчатки, что вызывает потерю зрения вследствие утраты фоторецепторов (палочек и колбочек) в центральной части глаза. На настоящий момент для такого состояния не существует какого-либо медицинского или хирургического лечения. На настоящий день доступные способы лечения (например, предложенные Национальным институтом глаза) включают в себя использование витаминных добавок с высокими дозами антиоксидантов,лютеина и зеаксантина, которые могут замедлить прогрессию сухой макулярной дегенерации. Глаукома представляет собой заболевание, при котором давление жидкости внутри глаза возрастает, вызывая необратимое повреждение зрительного нерва и потерю зрения. Абета колокализуется с апоптотическими клетками ганглия сетчатки при экспериментальной глаукоме и индуцирует выраженный апоптоз клеток ганглия сетчатки с дозовой и временной зависимостями. Соответственно настоящее изобретение относится к соединению или его фармацевтически приемлемой соли для применения в качестве лекарственного средства. Кроме того, настоящее изобретение относится к применению соединения для лечения заболевания и/или состояния, при котором ингибирование активности фермента -секретазы (ВАСЕ 1) терапевтически эффективно. Кроме того, настоящее изобретение относится к применению соединения для лечения нейродегенеративных нарушений, нарушений, характеризующихся снижением когнитивных способностей, когнитивных нарушений, деменции и заболеваний, характеризующихся формированием отложений амилоида или нейрофибриллярных клубков. Поэтому, настоящее изобретение относится к применению соединения согласно настоящему изобретению для лечения болезни Альцгеймера, трисомии по 21 паре хромосом (синдром Дауна), наследственной церебральной геморрагии с амилоидозом голландского типа (HCHWA-D), сенильной деменции,церебральной амилоидной ангиопатии, дегенеративной деменции, деменций смешанного сосудистого и дегенеративного происхождения, деменции, ассоциированной с болезнью Паркинсона, деменции, ассоциированной с прогрессирующим супрануклеарным параличом, деменции, ассоциированной с корковой базальной дегенерацией, болезни Альцгеймера с диффузными тельцами Леви, сухой AMD и глаукомы. Настоящее изобретение также относится к способу лечения нарушения, связанного с чрезмерной активностью ВАСЕ 1 или ассоциированного с ней, у нуждающегося в этом пациента, который включает в себя введение упомянутому пациенту эффективного количества раскрытого соединения или его фармацевтически приемлемой соли. Настоящее изобретение также относится к способам ингибирования активности ВАСЕ 1 у нуждающегося в этом пациента, включающим в себя введение субъекту эффективного количества по меньшей мере одного раскрытого соединения или его фармацевтически приемлемой соли и/или приведение его рецептора в контакт с ним. Настоящее изобретение также относится к способам уменьшения интенсивности отложения -амилоида у нуждающегося в этом субъекта, включающим в себя введение упомянутому субъекту эффективного количества по меньшей мере одного раскрытого соединения или его фармацевтически приемлемой соли. Настоящее изобретение включает в себя терапевтический способ лечения или уменьшения интенсивности опосредованного ВАСЕ 1 нарушения у нуждающегося в этом субъекта, включающий в себя введение нуждающемуся в этом субъекту эффективного количества соединения согласно настоящему изобретению, описанного в настоящем документе, или его фармацевтически приемлемой соли или его композиции. Используемый в настоящем документе термин "субъект" или "пациент" может быть использован взаимозаменяемо и означает нуждающееся в лечении млекопитающее, например домашних животных(например, собаки, кошки и т. п.), сельскохозяйственных животных (например, коровы, свиньи, лошади,овцы, козы и т. п.) и лабораторных животных (например, крысы, мыши, морские свинки и т. п.). Обычно,субъект представляет собой человека, нуждающегося в лечении. Используемый в настоящем документе термин "проведение лечения" или "лечение" относится к получению желаемого фармакологического и/или физиологического эффекта. Такой эффект может быть профилактическим (т. е. снижающим вероятность развития нарушения или заболевания) или терапевтическим, что включает достижение, частичное или существенное, одного или нескольких из следующих результатов: частичное или полное уменьшение степени заболевания, нарушения или синдрома; уменьшение интенсивности или улучшение ассоциированного с таким нарушением клинического симптома или индикатора или замедление, ингибирование или снижение вероятности прогрессирования заболевания, нарушения или синдрома. Диапазон доз соединений согласно настоящему изобретению, применимый в течение суток, обычно составляет от 0,1 до 3000 мг, предпочтительно от 1 до 2000 мг, более предпочтительно от 10 до 1000 мг,наиболее предпочтительно 50 или 500 мг. Каждая единица дозирования может традиционно содержать от 0,1 до 1000 мг, предпочтительно от 25 до 250 мг. Конкретное фармацевтически эффективное количество или терапевтическая доза будет, безусловно, зависеть от факторов, известных специалистам в данной области техники, таких как возраст и вес пациента, путь введения и тяжесть заболевания. В любом случае сочетание будет вводиться в дозировках и способом, которые позволят доставить фармацевтически эффективное количество исходя из индивидуального состояния пациента. Фармацевтические композиции. Подходящие препараты для введения соединений согласно настоящему изобретению будут очевидны специалистам в данной области техники и включают в себя, например, таблетки, пилюли, капсулы,суппозитории, леденцы, пастилки, растворы, сиропы, эликсиры, саше, инъекционные препараты, ингаляционные препараты и порошки и т. п. Содержание фармацевтически активного(ых) соединения(ий) должно быть в диапазоне от 0,1 до 95%, предпочтительно от 5 до 90% от массы композиции в целом. Подходящие таблетки могут быть получены, например, путем смешивания одного или нескольких соединений согласно настоящему изобретению с известными наполнителями, например с инертными разбавителями, носителями, разрыхлителями, адъювантами, поверхностно-активными веществами, связующими веществами и/или смазками. Такие таблетки также могут состоять из нескольких слоев. Сочетанная терапия. Согласно одному варианту осуществления настоящее изобретение включает в себя сочетанную терапию для лечения или уменьшения интенсивности заболевания или нарушения, описанного в настоящем документе. Сочетанная терапия включает в себя введение сочетания по меньшей мере одного соединения согласно настоящему изобретению с одним или несколькими средствами, выбранными из группы, например, состоящей из ингибиторов или модуляторов гамма-секретазы; ингибиторов агрегации амилоида, блокирующих формирование Абета олигомеров или Абета фибрилл (например, ELND-005); нейропротективных и/или модифицирующих заболевание веществ, действующих прямо или опосредованно; антиоксидантов (например витамин Е или гинколид); противовоспалительных веществ (например,ингибиторы Сох, NSAID, дополнительно или исключительно обладающие свойствами снижать Абета); ингибиторов HMG-CoA редуктазы (статины); ингибиторов ацетилхолинэстеразы (например, донепезил,ривастигмин, такрин, галантамин, такрин); антагонистов NMDA рецептора (например, мемантин); агонистов АМРА рецептора; позитивных модуляторов АМРА рецептора, АМРАкинов, ингибиторов рецептора обратного захвата моноамина, веществ, модулирующих концентрацию или высвобождение ней- 11024995 ротрансмиттеров; веществ, индуцирующих секрецию гормона роста (например, ибутаморен мезилат и капроморелин); антагонистов или обратных агонистов СВ-1 рецептора; антибиотиков (например, миноциклин или рифамипицин); ингибиторов PDE2, PDE4, PDE5, PDE9, PDE10, обратных агонистов GABAA рецептора, антагонистов GABAA рецептора, агонистов или частичных агонистов или позитивных модуляторов альфа-4-бета-2-никотинового рецептора, агонистов или частичных агонистов или позитивных модуляторов альфа-7-никотинового рецептора; антагонистов гистамина Н 3, агонистов или частичных агонистов 5 НТ-4, антагонистов 5 НТ-6, антагонистов альфа-2-адренорецептора, антагонистов кальция,агонистов или частичных агонистов или позитивных модуляторов мускаринового M1 рецептора, антагонистов мускаринового М 2 рецептора, антагонистов мускаринового М 4 рецептора, позитивных модуляторов метаботропного рецептора глутамата 5, антидепрессантов, таких как циталопрам, флуоксетин, пароксетин, сертралин и тразодон; анксиолитиков, таких как лоразепам и оксазепам; антипсихотиков, таких как арипипразол, клозапин, галоперидол, оланзапин, кветиапин, рисперидон и зипрасидон, и других веществ, которые модулируют рецепторы или ферменты таким образом, что эффективность и/или безопасность соединений согласно настоящему изобретению увеличивается, и/или нежелательные побочные эффекты снижаются. Соединения согласно настоящему изобретению также могут быть использованы в сочетании с иммунотерапиями (например, активная иммунизация Abeta или его частями или пассивная иммунизация гуманизированными анти-Абета антителами или нанотелами) для лечения вышеупомянутых заболеваний или состояний. Сочетанная терапия включает в себя совместное введение соединения согласно настоящему изобретению с одним или несколькими другими средствам, последовательное введение соединения и одного или нескольких других средств, введение композиции, содержащей соединение и одно или несколько других средств или одновременное введение отдельных композиций, содержащих соединение и одно или несколько других средств. Экспериментальный раздел. Способы получения соединений. Соединения согласно настоящему изобретению могут быть получены с применением традиционных способов, в которых используются легкодоступные реагенты и исходные вещества. Реагенты, использованные при получении соединений согласно настоящему изобретению, могут быть либо коммерчески доступными, либо могут быть получены посредством стандартных методик, описанных в литературе. Реакции с обработкой микроволнами проводят в реакторе СЕМ с использованием системы Discovery SP. В случае предоставления данных ЯМР-спектры получали на спектрометре Varian-400 (400 МГц), и приводили данные в м.д. в сторону слабого поля относительно тетраметилсилана с указанием в круглых скобках номера протона, мультиплетностей и констант взаимодействия, а также со ссылкой на дейтерированный растворитель. Соединения очищали базовым методом препаративной HPLC, описанным ниже. Метод 1. Подвижная фаза А: вода с 0.05%-ным раствором аммиака; подвижная фаза В: ACN; скорость потока 25 мл/мин; детекция УФ 220 нм/254 нм; колонка: Phenomenex Gemini С 18 25030 мм, 5 мкм; температура колонки 30 С Данные LC-MS получали с использованием следующих условий проведения хроматографии: Параметры масс-спектрометра: Масс-спектрометр: Waters SQD; ионизация: ионизация электрораспылением (ESI) с детекцией положительно заряженных ионов; режим сканирования (100-1400 m/z каждые 0.2 с); напряжение на ES капилляре 3.5 кВ; напряжение на ES конусе 25 В; температура источника 120 С; температура десольватации 500 С; поток газа-осушителя: азот в режиме 650 л/ч; поток газа на конусе: азот в режиме 50 л/ч. На стадии 2 примера 10 и на стадиях 1 и 2 альтернативного синтеза промежуточного продукта 38 использовали следующие условия проведения хроматографии и оборудование. Данные LC-MS получали с использованием следующих условий проведения хроматографии: В примере 27 использовали следующие условия проведения хроматографии и оборудование: Разделение методом SFC и охарактеризацию соединений проводили в соответствии со следующим способом. Метод А. Аппарат: Thar SFC 80; колонка: AD 25030 мм, 5 мкм; подвижные фазы: А: сверхкритический СО 2,- 13024995 В: IPA (0.05% DEA), А/В=80/20 при 60 мл/мин; температура колонки 38 С; давление в форсунке 100 бар; температура форсунки 60 С; температура испарителя 20 С; температура триммера 25 С; длина волны 220 нм. Метод В. Аппарат: SFC MG2; колонка: OJ 25030 мм, 5 мкм; подвижные фазы: А: сверхкритический СО 2, В: МеОН (0.05% DEA), А/В=90/10 при 70 мл/мин; температура колонки 38 С; давление в форсунке 100 бар; температура форсунки 60 С; температура испарителя 20 С; температура триммера 25 С; длина волны 220 нм. Следующие методики, растворители и реагенты могут обозначаться следующими сокращениями: Стадия 1. Синтез промежуточного продукта 3. Смесь соединения 1 (50,0 г, 236 ммоль) и метилакрилата (42,0 г, 472 ммоль) в безводном THF (900 мл) предварительно охлаждали при 0 С, в течение 30 мин равными порциями добавляли t-BuOK (31,8 г,284 ммоль, 1,1 экв.), затем смесь нагревали до к.т. в течение 1 ч и перемешивали в течение 40 мин при к.т. К этой реакционной смеси добавляли DMF (200 мл) и EtI (74 г, 472 ммоль), и перемешивали при к.т. в течение ночи. В условиях пониженного давления удаляли THF. Остаток разбавляли Н 2 О (300 мл) и экстрагировали EtOAc, концентрировали с получением неочищенного соединения 2 (120,0 г). Этот продукт использовали как есть на следующей стадии. Смесь соединения 2 (120,0 г, 310 ммоль) и LiCl (130,0 г, 3100 ммоль) в DMSO (900 мл) нагревали с обратным холодильником в течение ночи. Смесь гасили добавлением воды (3 л) и экстрагировали EtOAc(3400 мл). Разделенную органическую фазу сушили и концентрировали в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на силикагеле (петролейный эфир/EtOAc=20/1) с получением промежуточного продукта 3 (15 г, 20%). 1 Н NMR: (CDCl3)7,91 (s, 1H), 7,74 (dd, J=8,0 Hz, 1H), 7,41 (d, J=8,0 Hz, 1H), 3,80 (s, 2H), 2,48-2,53 (m,2H), 2,33-2,49 (m, 1H), 2,15-2,23 (m, 1H), 1,75-1,95 (m, 4H), 1,21-1,40 (m, 1H), 0,88 (t, J= 8,0 Hz, 3H). Стадия 2. Синтез промежуточного продукта 5 К смеси THF (20 мл) и МеОН (5 мл) при -78 С добавляли промежуточный продукт 3 (6,0 г, 18,7 ммоль), NaBH4 (355 мг, 9,3 ммоль) и CeCl37 Н 2 О (70 мг, 0,19 ммоль). Смесь перемешивали при -78 С в течение 20 мин, гасили добавлением нас. раствора NH4Cl (30 мл) и экстрагировали EtOAc (4400 мл).EtOAc фазы объединяли и концентрировали с получением неочищенного соединения 4 (6,5 г, неочищ.). К смеси соединения 4 (6,5 г, 20,0 ммоль) и NaH (3,2 г, 80,0 ммоль) в DMF (100 мл) при 0 С добавлялиMeI (11,4 г, 80,0 ммоль). Смесь перемешивали при к.т. в течение ночи. Смесь гасили добавлением Н 2 О,экстрагировали EtOAc, концентрировали с получением неочищенного продукта, который очищали на колонке с силикагелем (элюент:петролейный эфир/этилацетат=20/115/1) с получением промежуточного продукта 5 (3,5 г, 56%).(s, 2H), 2,88-2,94 (m, 1H), 2,21-2,26 (m, 1H), 1,81-1,87 (m, 1H), 1,70-1,78 (m, 1H), 1,40-1,59 (m, 4H), 1,121,39 (m, 2H), 0,88 (t, J=8,0 Hz, 3H). Стадия 3. Синтез промежуточного продукта 6 А и 6 В Смесь промежуточного продукта 5 (3,5 г, 10,4 ммоль) и этоксида титана (IV) (23,7 г, 104 ммоль) в безводном THF (40 мл) перемешивали при к.т. в течение 1 ч. Добавляли (S)-N-трет-бутилсульфинамид(1,6 г, 11,6 ммоль), и перемешивали полученную смесь при 80 С в атмосфере N2 в течение ночи. Затем реакционную смесь охлаждали, добавляли воду (400 мл) и фильтровали. Водный слой экстрагировалиEtOAc (3400 мл). Разделенные органические фазы объединяли, сушили и концентрировали в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на силикагеле (петролейный эфир/EtOAc=20/1) с получением промежуточного продукта 6 А (1,5 г, 33%) и 6 В (1,5 г, 33%), элюируемых в указанном порядке. Стадия 4. Синтез промежуточного продукта 7 В К смеси этоксиэтена (1,3 г, 17,0 ммоль) в безводном THF (20 мл) при -78 С в атмосфере N2 по каплям добавляли t-BuLi (13,0 мл, 17,0 ммоль, 1,3 М в гексане) и перемешивали в течение 20 мин. Затем полученную смесь дополнительно перемешивали при 0 С в течение 45 мин. К этой смеси при -78 С по каплям добавляли промежуточный продукт 6 В (1,5 г, 3,4 ммоль) в безводном THF (20 мл) и перемешивали в течение 2,5 ч. Реакционную смесь гасили добавлением нас. NH4Cl (50 мл) и экстрагировали EtOAc(3300 мл). Органические фазы объединяли и концентрировали с получением остатка, который очищали на колонке с силикагелем (петролейный эфир/EtOAc=20/1) с получением промежуточного продукта 7 В(1,2 г, 69%). Стадия 5. Синтез промежуточного продукта 8 В К DCM/MeOH (5/1, 20 мл) добавляли промежуточный продукт 7 В (1,2 г, 2,4 ммоль), смесь охлаждали до -78 С, и барботировали смесь озоном в течение 20 мин. Затем смесь продували N2 и обрабатывали Me2S при -78 С. Затем реакционную смесь оставляли нагреваться до к.т. и перемешивали в течение 3 ч. Растворитель удаляли в условиях вакуума, остаток очищали методом препаративной TLC (петролейный эфир/EtOAc=3/1) с получением соединения 8 В (860 мг, 70%).LC-MS: tR=1,351 мин, MS (ESI) m/z 516,1 [М+Н]+. Стадия 6. Синтез промежуточного продукта 9 В К соединению 8 В (860 мг, 1,7 ммоль) в МеОН (10 мл) добавляли 4 М раствор HCl в диоксане (2 мл). Полученную смесь перемешивали в течение 30 мин. Растворитель удаляли в условиях пониженного давления с получением неочищенного соединения 9 В (800 мг). Остаток использовали на следующей стадии без дополнительной очистки. Стадия 7. Синтез промежуточного продукта 10 В Суспензию промежуточного продукта 9 В (500 мг, 1,9 ммоль), Zn(CN)2 (300 мг, 2,6 ммоль), Pd2(dba)3(150 мг, 0,16 ммоль), dppf (160 мг, 0,32 ммоль) и Zn пыли (60 мг, 0,9 ммоль) в DMF (15 мл) нагревали при 120 С в течение 3 ч в микроволновом реакторе СЕМ. Смесь концентрировали в условиях вакуума, и очищали остаток на колонке с силикагелем (элюент:петролейный эфир/EtOAc=20/18/1) с получением соединения 10 В (150 мг, 40%). Стадия 8. Синтез промежуточного продукта 11 В К DCM (10 мл), Н 2 О (10 мл) и NaHCO3 (350 мг, 4,2 ммоль) добавляли промежуточный продукт 10 В(150 мг, 0,42 ммоль). К этой смеси при энергичном перемешивании добавляли тиофосген (100 мг, 0,84 ммоль), перемешивали в течение 50 мин при к.т. и экстрагировали DCM (340 мл). Органический слой промывали солевым раствором (240 мл), сушили, и удаляли растворитель в условиях пониженного давления с получением неочищенного соединения 11 В (150 г, 93%), которое использовали на следующей стадии без дополнительной очистки. Стадия 9. Синтез промежуточного продукта 12 В К смеси соединения 11 В (150 мг, 0,39 ммоль) в THF (5 мл) добавляли 2-аминометилпиримидин (67 мг, 0,78 ммоль) и TEA (395 мг, 3,90 ммоль). Смесь перемешивали в течение ночи при к.т. Реакционную смесь разбавляли водой и экстрагировали EtOAc (30 мл). Остаток очищали методом колоночной хроматографии (петролейный эфир/этилацетат=10/1) с получением 12 В (100 мг, 70%).LC-MS: tR=1,204 мин, MS (ESI) m/z 462,2 [М+Н]+. Стадия 1. Синтез соединения примера 1 К соединению 12 В (100 мг, 0,22 ммоль) в МеОН (10 мл) и NH4OH (3 мл) добавляли t-BuO2H (1 мл). После добавления смесь перемешивали при к.т. в течение 24 ч. Смесь гасили добавлением насыщенного раствора Na2S2O3 (0,5 мл). Остаток распределяли между EtOAc (20 мл) и Н 2 О (10 мл). Органический слой разделяли и промывали солевым раствором (10 мл), сушили, фильтровали и концентрировали в условиях вакуума. Остаток очищали методом HPLC (способ 1) с получением соединения примера 1 (14,60 мг,15%). Указанное соединение синтезировали из промежуточного продукта 10 В, полученного в примере 1,как представлено ниже на схеме Стадия 1. Синтез промежуточного продукта 13. К перемешанному раствору тиомочевины (23 г, 302 ммоль) в THF (5,0 л) в атмосфере аргона при 0 С добавляли гидрид натрия (29,9 г, 755 ммоль, 60% в минеральном масле). Спустя 5 мин, баню со льдом удаляли, и перемешивали реакционную смесь при комнатной температуре в течение 10 мин. Смесь снова охлаждали до 0 С, добавляли ди-трет-бутилдикарбонат (138 г, 635 ммоль), и после 30 мин перемешивания при указанной температуре удаляли баню со льдом. Полученную взвесь дополнительно перемешивали в течение 2 ч при к.т. Затем реакционную смесь гасили добавлением насыщенного водного раствора NaHCO3 (500 мл). Реакционную смесь вливали в воду (5,0 л) и экстрагировали EtOAc (32,0 л). Объединенный органический слой сушили, фильтровали и концентрировали в условиях вакуума с получением промежуточного продукта 13 (80 г, 96%) в виде белого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. К смеси промежуточного продукта 13 (4,14 г, 15,0 ммоль) и безводного THF (300 мл) при 0 С добавляли NaH (60% в минеральном масле, 720 мг, 18,0 ммоль). Реакционную смесь перемешивали при 0 С в течение 1 ч, затем добавляли TFAA (3,47 г/2,33 мл, 16,5 ммоль) и дополнительно продолжали перемешивание в течение 1 ч. Затем добавляли 4-(аминометил)тетрагидропиран (2,5 г, 16,5 ммоль) и Et3N (3,03 г/4,16 мл, 30,0 ммоль) в безводном THF (130 мл), и перемешивали полученную реакционную смесь при к.т. в течение ночи. Для гашения реакционной смеси добавляли Н 2 О (150 мл), и экстрагировали смесьEtOAc (3200 мл). Объединенные органические слои сушили, и удаляли растворитель в условиях пониженного давления. Остаток очищали методом флэш-хроматографии с получением соединения 13 (3,54 г,86%) в виде белого твердого вещества.LCMS: tR=0,973 мин; MS (ESI) m/z 219 [M-t-Bu]+. Стадия 2. Синтез промежуточного продукта 14. К смеси соединения 10 В (2,5 г, 7,0 ммоль) в 30 мл DMF добавляли соединение 13 (2,3 г, 8,4 ммоль),EDCI (2,5 г, 14,0 ммоль) и DIEA (1,7 г, 14,0 ммоль). Смесь перемешивали при к.т. в течение ночи. Смесь экстрагировали EtOAc (380 мл), промывали солевым раствором (350 мл), сушили, и удаляли растворитель в условиях пониженного давления. Остаток очищали методом колоночной хроматографии (петролейный эфир/этилацетат=5/1) с получением соединения 14 (2,7 г, 75%).LC-MS: tR=0,972 мин, MS (ESI) m/z 495,3 [M-t-Bu]+. Стадия 3. Синтез соединения примера 2. К смеси промежуточного продукта 14 (2,7 г, 4,9 ммоль) в DCM (30 мл) добавляли TFA (6 мл). После добавления смесь перемешивали при к.т. в течение 1 ч. Значение рН реакционной смеси корректировали до 8,0-9,0 добавлением раствора NaHCO3. Органический слой концентрировали в условиях пониженного давления. Остаток очищали методом колоночной хроматографии (петролейный эфир/этилацетат=1/1) с получением соединения примера 2 (1,83 г, 83%) в виде белого твердого вещества. Синтез промежуточного продукта 18 Стадия 1. Синтез промежуточного продукта 16. К раствору метилмагнийбромида (14 мл, 42 ммоль, 3,0 М в Et2O) при -30 С в атмосфере азота добавляли смесь соединения 15 (2,0 г, 10,6 ммоль) в безводном THF (20 мл). Смесь перемешивали при-30 С в течение 4 ч, а затем гасили добавлением воды (40 мл) и водн. HCl (50 мл, 1 М) при перемешивании при 0 С. Смесь разделяли, и экстрагировали водный слой EtOAc (20 мл). Объединенные органические слои промывали солевым раствором (250 мл), сушили, фильтровали и концентрировали в условиях вакуума с получением неочищенного промежуточного продукта 16 (2,1 г, 100% неочищ.) в виде бесцветного масла, которое использовали непосредственно на следующей стадии без очистки. 1H NMR: (CDCl3)4,97 (br, 1H), 3,10 (s, 2H), 2,17 (br, 1H), 1,44 (s, 9H), 1,20 (s, 6H). Стадия 2. Синтез промежуточного продукта 17. К смеси промежуточного продукта 16 (3,0 г, 15,9 ммоль, неочищ.) в безводном DCM (50 мл) при 78 С в атмосфере азота добавляли DAST (2,3 мл, 17,4 ммоль). Смесь перемешивали при -78 С в течение 1 ч и оставляли нагреваться до к.т. в течение ночи. Затем смесь охлаждали до 0 С и гасили добавлением насыщенного водного раствора NaHCO3 (30 мл) при медленном перемешивании при 0 С. Смесь разделяли, и водный слой экстрагировали DCM (220 мл). Объединенные органические слои промывали солевым раствором (230 мл), сушили, фильтровали и концентрировали в условиях вакуума с получением неочищенного промежуточного продукта 17 (2,5 г, 76% неочищ.), который использовали непосредственно на следующей стадии без очистки. 1 Н NMR: (CDCl3)4,82 (br, 1H), 3,30-3,35 (d, J=6,0 Hz, 1H), 3,24-3,26 (d, J=6,0 Hz, 1H), 1,44 (s, 9H),1,37 (s, 3H), 1,35 (s, 3H). 19F NMR: (CDCl3 400 MHz): -144,93. Стадия 3. Синтез промежуточного продукта 18. К смеси промежуточного продукта 17 (2,0 г, 10,5 ммоль, неочищ.) в безводном DCM (10 мл) при перемешивании добавляли HCl в диоксане (10 мл, 40 ммоль, 4M в диоксане). Смесь перемешивали при к.т. в течение 2 ч, после чего концентрировали растворитель в условиях вакуума. Остаток промывали смесью DCM/петролейный эфир (1/1, 310 мл), осадок собирали и сушили в условиях вакуума с получением неочищенного соединения 18 (1,1 г), которое использовали непосредственно на следующей стадии без очистки. 1 Н NMR: (CD3OD)3,15-3,25 (d, J=20,0 Hz, 2H), 1,51 (s, 3 Н), 1,48 (s, 3 Н). 19 Соединение примера 3 синтезировали из промежуточного продукта 11 В, полученного в примере 1,следуя тем же методикам, что и описанные в примере 1, и используя промежуточный продукт 18 на стадии 9 примера 1. Синтез промежуточного продукта 25 Стадия 1. Синтез промежуточного продукта 20. Смесь дигидро-2 Н-пиран-4(3 Н)-она (19, 50,0 г, 500 ммоль) и 2-хлорацетонитрила (35,0 г, 350 ммоль) в трет-бутаноле (50 мл) перемешивали в течение 30 мин. К этой смеси в течение 40 мин добавляли раствор t-BuOK (60 г, 550 ммоль) в трет-бутаноле (500 мл). Реакционную смесь перемешивали при к.т. в течение 16 ч. Смесь разбавляли водой и гасили добавлением 10% HCl. Реакционную смесь концентрировали до одной третьей первоначального объема и четырежды экстрагировали диэтиловым эфиром. Объединенные органические слои промывали солевым раствором, сушили над MgSO4, фильтровали и концентрировали с получением промежуточного продукта 20 (57 г), который использовали непосредственно на следующей стадии без очистки. Стадия 2. Синтез промежуточного продукта 21. Промежуточный продукт 20 (57 г) смешивали с дихлорметаном (200 мл) в бутыли из полипропилена. Бутыль охлаждали до 0 С, и медленно добавляли 70% фтороводород в пиридине (50 мл). Смесь оставляли нагреваться до комнатной температуры в течение ночи. Реакционную смесь разбавляли этилацетатом (500 мл) и вливали в насыщенный водный NaHCO3. Для нейтрализации смеси осторожно, до выделения пузырьков газа, использовали дополнительное количество твердого NaHCO3. Органический слой разделяли, и экстрагировали водный слой этилацетатом (3500 мл). Объединенные органические слои промывали 1%-ным водным раствором HCl, солевым раствором, сушили (MgSO4), фильтровали и концентрировали с получением неочищенного промежуточного продукта 21 (54 г), который использовали непосредственно на следующей стадии без очистки. 1 Н NMR: (CDCl3)4,37 (m, 2H), 3,96-2,70 (m, 4H), 1,97-1,81 (m, 4H). Стадия 3. Синтез промежуточного продукта 22. К смеси промежуточного продукта 21 (54 г; 340 ммоль) в 2-пропаноле (1000 мл) и воде (250 мл) при 0 С добавляли боргидрид натрия (20 г, 509 ммоль). Смесь перемешивали и оставляли нагреваться до к.т. в течение 3 ч. Реакционную смесь гасили добавлением ацетона и дополнительно перемешивали в течение 1 ч. Прозрачную жидкость отделяли от твердого вещества путем декантирования. Для промывки твердого вещества использовали дополнительное количество EtOAc и декантировали. Объединенный органический раствор концентрировали. Остаток очищали методом колоночной флэш-хроматографии на силикагеле, элюируя 5-20% EtOAc в гексанах с получением промежуточного продукта 22 (22 г, 40% за 3 стадии) в виде жидкости. 1 Н NMR: (CDCl3)3,82-3,77 (m, 4 Н), 3,72-3,52 (dd, J=20,8, 6,4 Hz, 2H), 2,69(s, 1H), 1,82-1,60 (m, 4H). Стадия 4. Синтез промежуточного продукта 23. К смеси промежуточного продукта 22 (20 г, 150 ммоль) и триэтиламина (22,7 г, 225 ммоль) в DCM(200 мл) при 0 С добавляли MsCl (25,8 г, 225 ммоль). Смесь перемешивали при к.т. в течение 2 ч, а затем добавляли воду. Водный слой экстрагировали DCM (2200 мл). Растворитель сушили и удаляли с получением неочищенного промежуточного продукта 23 (30 г, 100%), который использовали на следующей стадии без дополнительной очистки. 1 Н NMR: (CDCl3)4,22 (d, J=20,0 Hz, 2H), 3,87-3,82 (m, 4H), 3,06(s, 3 Н), 1,88-1,68 (m, 4H). Стадия 5. Синтез промежуточного продукта 24. К смеси промежуточного продукта 23 (10 г, 47 ммоль) и DMF (150 мл) при 120 С добавляли NaN3(16 г, 250 ммоль) и NaHCO3 (9,3 мг, 100 ммоль). Смесь перемешивали при 120 С в течение 20 ч, реакционную смесь гасили добавлением воды и экстрагировали EtOAc (2300 мл). Растворитель сушили и удаляли в условиях вакуума с получением неочищенного промежуточного продукта 24 (8 г), который использовали на следующей стадии без дополнительной очистки. Стадия 6. Синтез промежуточного продукта 25. К смеси промежуточного продукта 24 (8 г, 50 ммоль) в этилацетате (100 мл) в атмосфере азота добавляли Pd/C (0,8 г, содержание 10%), из смеси откачивали воздух и заменяли его водородом (трижды). Конечную смесь перемешивали в течение 24 ч при комнатной температуре и давлении 1 атм водорода. Катализатор отфильтровывали через слой Celite и промывали EtOAc (250 мл). Объединенный фильтрат концентрировали в условиях пониженного давления с получением промежуточного продукта 25 (5,3 г, 80%). 1 Н NMR: (CD3OD)3,83-3,79 (m, 4 Н), 2,76-2,71 (d, J=8,0 Hz, 2H), 1,83-1,65 (m, 4H). Соединение примера 4 синтезировали из промежуточного продукта 11 В, следуя той же методике,что и описанная в примере 1, используя на стадии 9 промежуточный продукт 25 вместо 2 пиримидилметанамина. Стадия 4. Синтез промежуточного продукта 7 А К смеси этоксиэтена (1,3 г, 17,0 ммоль) в безводном THF (20 мл) при -78 С в атмосфере N2 по каплям добавляли t-BuLi (13,0 мл, 17,0 ммоль, 1,3 М в гексане), и перемешивали смесь в течение 20 мин. Затем полученную смесь дополнительно перемешивали при 0 С в течение 45 мин, добавляли соединение 6 А (1,5 г, 3,4 ммоль) в безводном THF (20 мл) и перемешивали в течение 2,5 ч. Реакционную смесь гасили добавлением нас. NH4Cl (50 мл) и экстрагировали EtOAc (3300 мл). Органические фазы объединяли и концентрировали с получением неочищенного продукта. Продукт очищали на колонке с силикагелем(петролейный эфир/EtOAc=20/1) с получением соединения 7 А (1,2 г, 69%), которое использовали как есть на следующей стадии. Стадия 5. Синтез промежуточного продукта 8 А Смесь соединения 7 А (1,2 г, 2,4 ммоль) в DCM/MeOH = 5/1 (20 мл) охлаждали до -78 С, и барботировали смесь озоном в течение 20 мин. Смесь продували N2 и обрабатывали Me2S (5 мл) при -78 С, а затем оставляли нагреваться до к.т. и перемешивали в течение 3 ч. Растворитель удаляли в условиях вакуума, остаток очищали методом препаративной TLC (петролейный эфир/EtOAc=3/1) с получением соединения 8 А (860 мг, 70%).LC-MS: tR=1,333 мин; MS (ESI) m/z 516,1 [М+Н]+. Стадия 6. Синтез промежуточного продукта 9 А(2 мл). Полученную смесь перемешивали в течение 30 мин при к.т. Растворитель удаляли в условиях пониженного давления с получением неочищенного соединения 9 А (800 мг), которое использовали на следующей стадии без дополнительной очистки.LC-MS: tR=0,976 мин; MS (ESI) m/z 361,1 [М+Н] +. Стадия 7. Синтез промежуточного продукта 10 А Смесь соединения 9 А (500 мг, 1,9 ммоль), Zn(CN)2 (300 мг, 2,6 ммоль), Pd2(dba)3 (150 мг, 0,16 ммоль), dppf (160 мг, 0,32 ммоль) и Zn пыль (60 мг, 0,9 ммоль) в DMF (15 мл) нагревали до 120 С в течение 3 в микроволновом реакторе СЕМ. Смесь концентрировали в условиях вакуума, и очищали остаток на колонке с силикагелем (элюент:петролейный эфир/EtOAc=20/18/1) с получением соединения 10 АLC-MS: tR=0,880; MS (ESI) m/z 308,1 [М+Н]+. Стадия 8. Синтез промежуточного продукта 11 А К смеси соединения 10 А (300 мг, 0,84 ммоль) в DCM (10 мл), H2O (10 мл) и NaHCO3 (655 мг, 8,4 ммоль) добавляли тиофосген (180 мг, 1,68 ммоль). Смесь перемешивали в течение 50 мин, затем экстрагировали DCM (340 мл), промывали солевым раствором (240 мл), сушили, и удаляли растворитель в условиях пониженного давления с получением неочищенного соединения 11 А (300 г), которое использовали на следующей стадии без дополнительной очистки. Стадия 9. Синтез промежуточного продукта 12 А К соединению 11 А (200 мг, 0,50 ммоль) в THF (10 мл) добавляли R-(2 аминометил)тетрагидрофуран (61 мг, 0,6 ммоль) и триэтиламин (2 мл, 5,0 ммоль). Смесь перемешивали при к.т. в течение ночи. Реакционную смесь разбавляли водой и экстрагировали EtOAc (30 мл). Остаток очищали методом колоночной хроматографии (петролейный эфир/EtOAc=10/1) с получением соединения 12 А (180 мг, 79%). Стадия 10. Синтез соединения примера 5 К смеси промежуточного продукта 12 А (250 мг, 0,54 ммоль) в МеОН (10 мл) и NH4OH (3 мл) добавляли раствор t-BuO2H (1 мл, 9 М в гексане), и перемешивали при к.т. в течение 24 ч. Реакционную смесь гасили добавлением насыщенного Na2S2O3 (0,5 мл). Остаток распределяли между EtOAc (20 мл) и Н 2 О (10 мл). Органический слой разделяли и промывали солевым раствором (10 мл), сушили, фильтровали и концентрировали в условиях вакуума. Остаток очищали методом HPLC (способ 1) с получением соединения примера 5 (89,10 мг, 52%). Стадия 1. Синтез промежуточного продукта 27 В высушенную в печи колбу емкостью 3 л загружали 6-бром-1-инданон (100 г, 473,8 ммоль), метилакрилат (86,4 г, 90 мл, 995 ммоль, 2,1 экв.) и безводный THF (800 мл), колбу погружали в баню со льдом в воде и перемешивали. Сначала осторожно добавляли tBuOK (0,5 г), а спустя 2 мин добавляли вторую порцию tBuOK (0,5 г). Охлаждающую баню удаляли и добавляли оставшийся tBuOK (63 г) равными порциями в течение 20 мин (всего 64 г, 568,6 ммоль, 1,2 экв.). Смесь дополнительно перемешивали в течение 2 ч при к.т. К реакционной смеси добавляли DMF (240 мл), а затем MeI (134,6 г, 60 мл, 947,6 ммоль, 2,0 экв.), и дополнительно перемешивали смесь в течение 2 ч. Реакционную смесь гасили добавлением 10%-ного раствора лимонной кислоты. Затем для удаления большей части растворителя реакционную смесь концентрировали в условиях пониженного давления, после чего фильтровали. Осадок на фильтре промывали водой, а затем МеОН с получением неочищенного промежуточного продукта 26(200 г), который использовали непосредственно на следующей стадииH2O (92 г, 2190 ммоль, 4,0 экв.). Смесь перемешивали в течение 16 ч при к.т., а затем 12 ч при 70 С. Реакционную смесь концентрировали в условиях пониженного давления для удаления THF и фильтровали. Осадок на фильтре промывали Н 2 О, а затем перемешивали с МеОН (50 мл) в течение нескольких минут,снова фильтровали и промывали дополнительным количеством МеОН (50 мл). Твердое вещество собирали с получением промежуточного продукта 27 (75 г, 51,7%). Стадия 2. Синтез промежуточного продукта 29 В трехгорлую колбу в атмосфере азота загружали CeCl3 7H2O (1,2 г, 3,3 ммоль) и безводный МеОН(60 мл) и перемешивали с получением прозрачного раствора. В атмосфере азота добавляли соединение 27 (10,0 г, 32,6 ммоль) и безводный THF (240 мл), смесь охлаждали до -78 С. При -78 С в атмосфере азота добавляли NaBH4 (0,4 г, 13,0 ммоль) при энергичном перемешивании. Смесь перемешивали при -78 С в течение 20 мин. Реакционную смесь гасили добавлением насыщенного водного NH4Cl (100 мл) и Н 2 О(200 мл) при перемешивании при -78 С. Смесь оставляли медленно нагреваться до температуры окружающей среды. Смесь экстрагировали EtOAc (3150 мл). Объединенные органические слои промывали Н 2 О (2200 мл), солевым раствором (2200 мл), сушили, фильтровали и концентрировали в условиях вакуума, остаток очищали методом колоночной хроматографии на силикагеле, элюируя петролейным эфиром/EtOAc (20/13/1) с получением промежуточного продукта 28 (7,5 г, 75%). К смеси соединения 28 (6,18 г, 20 ммоль) в DMF (20 мл) при 0 С добавляли NaH (60% в минеральном масле, 0,96 г, 40 ммоль). Затем смесь перемешивали при 0 С в течение 2 ч, затем к смеси добавлялиMeI (3,5 мл) и перемешивали в течение ночи. Смесь разбавляли EtOAc (40 мл) и Н 2 О (40 мл), экстрагировали EtOAc (260 мл). Объединенные органические фазы сушили, и удаляли растворитель с получением промежуточного продукта 29 (5,0 г). Стадия 2. Синтез промежуточных продуктов 30 А и 30 В К раствору промежуточного продукта 29 (5,0 г, 15,3 ммоль) в THF (100 мл) добавляли Ti(OEt)4 (35,0 г, 153 ммоль). После перемешивания при к.т. в течение 1 ч добавляли (S)-N-трет-бутилсульфинамид (7,4 г, 61,2 ммоль). Реакционную смесь перемешивали при нагревании с обратным холодильником в течение ночи, и распределяли смесь между Н 2 О (80 мл) и EtOAc (80 мл). Смесь фильтровали, и экстрагировали фильтрат EtOAc (380 мл). Объединенные органические слои промывали солевым раствором (50 мл),сушили и концентрировали с получением остатка. Остаток очищали методом колоночной хроматогра- 22024995 фии на силикагеле (петролейный эфир/EtOAc=20/1) с получением промежуточного продукта 30 А (1,6 г,35%) и 30 В (1,4 г, 33%), элюируемых в указанном порядке. Синтез соединения примера 6 Промежуточный продукт 30 А дополнительно обрабатывали, как представлено на стадиях 4-10 примера 5. На стадии 9 вместо R-(2-аминометил)тетрагидрофурана использовали 2 аминометилпиримидин. Указанное соединение синтезировали согласно методике, описанной в примере 6. Промежуточный продукт 30 А дополнительно обрабатывали, как представлено на стадиях 4-10 примера 1. На стадии 9 использовали (2-метокси)этиламин, а затем проводили окисление, как представлено на стадии 10, с получением соединения примера 7. Указанное соединение синтезировали согласно методике, описанной в примере 6. (3-Метилоксетан 3-ил)метанамин использовали, как описано на стадии 9 примера 1, а затем проводили окисление, как представлено на стадии 10, с получением соединения примера 8. Указанное соединение синтезировали согласно методике, описанной в примере 6. 4(Аминометил)пиримидин использовали, как описано на стадии 9 примера 1, а затем проводили окисление, как представлено на стадии 10 примера 6, с получением соединения примера 9. Стадия 1. Синтез промежуточного продукта 32 К смеси 6-броминдан-1-она (100,00 г, 473,8 ммоль) в безводном THF (1 л) при 0 С добавляли tBuOK (58,5 г, 521,2 ммоль, 1,1 экв.), спустя 2 мин смесь нагревали до к.т. и дополнительно перемешивали в течение 10 мин, после чего одной порцией добавляли метилметакрилат (49,8 г, 53,2 мл, 497,5 ммоль,1,05 экв.). Спустя 2 ч к реакционной смеси добавляли метилакрилат (49,0 г, 51,2 мл, 568,6 ммоль, 1,2 экв.). Спустя 3 ч при к.т. к реакционной смеси добавляли MeI (101 г, 44,3 мл, 710,7 ммоль, 1,5 экв.), и перемешивали ее в течение 16 ч. Добавляли Н 2 О (1 л), а затем LiOH H2O (79,5 г, 1895,2 ммоль, 4,0 экв.),и перемешивали смесь в течение 28 ч при комнатной температуре. В условиях пониженного давления удаляли THF. Остаток разбавляли Н 2 О (1 л), фильтровали и промывали Н 2 О до нейтральных значений фильтрата. Продукт промывали МеОН с получением 50 г промежуточного продукта 32. Стадия 2. Синтез промежуточного продукта 33 К смеси промежуточного продукта 32 (60,0 г, 186,9 ммоль) и FeCl3 (33,0 г, 205,5 ммоль, 1,1 экв.) вTHF (600 мл) при 0 С добавляли NaBH3CN (29,4 г, 367,1 ммоль, 2,5 экв.). Смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 1 ч при к.т. Реакционную смесь гасили добавлением воды, и удаляли THF в условиях вакуума. Смесь экстрагировали DCM (3200 мл). Объединенные органические фазы промывали Н 2 О и солевым раствором, сушили и концентрировали в условиях вакуума с получением неочищенного продукта, который очищали методом колоночной хроматографии на силикагеле с получением соединения 33 (25,2 г, 42%) и 33 А (12,0 г).H-NMR (CDCl3):7,889-7,894 (s, 1H), 7,671-7,696 (d, 1H), 7,311-7,332 (d, 1H), 3,605 (s, 1H), 2,981 (s,2H), 1,769-1,797 (m, 4H), 1,072-1,082 (m, 2H), 1,019-1,056 (m, 6H). Стадия 2. Альтернативный синтез промежуточного продукта 33 Смесь FeCl3 (6,0 г, 37,0 ммоль) с толуолом (60 мл) охлаждали до 0 С. Затем к смеси добавляли смесь соединения 32 (11,9 г, 37,0 ммоль) в THF (48 мл). Смесь перемешивали в течение 5 мин при 0 С, а затем охлаждали до -10 С. К реакционной смеси при -10 С по каплям добавляли раствор t-BuNH2-BH3(3,5 г, 40,7 ммоль) в THF (12 мл). Реакционную смесь перемешивали приблизительно при -10 С в течение 30 мин, гасили добавлением 6 н водн. раствора HCl (10 мл), перемешивали приблизительно при 0 С в течение 30 мин, а затем оставляли нагреваться до комнатной температуры. Смесь концентрировали для удаления THF, и добавляли толуол (60 мл). Водный слой удаляли, и промывали органическую фазу водой (360 мл). Органическую фазу концентрировали до половины объема, нагревали до 50 С с получением раствора, а затем охлаждали до 0 С в течение 1 ч и выдерживали при 0 С в течение 1 ч. Твердое вещество фильтровали и промывали холодным (0 С) толуолом (12 мл) и сушили в условиях вакуума с получением соединения 33 (9,93 г, 83%).LC-MS: tR=2,36 мин, MS (ESI) m/z 323,0/325,0 [М+Н]+. Стадия 3. Синтез промежуточного продукта 34 К смеси соединения 33 (20,0 г, 61,9 ммоль) с DMF (200 мл) при 0 С добавляли NaH (5,0 г, 123,8 ммоль, 2,0 экв.). Затем смесь перемешивали в течение 15 мин при 0 С, и при 0 С добавляли MeI (17,6 г,123,8 ммоль, 2,0 экв.). Затем смесь нагревали до к.т. и перемешивали в течение 1,5 ч при к.т. Смесь гасили добавлением Н 2 О и экстрагировали EtOAc. Объединенные органические фазы промывали Н 2 О и солевым раствором, сушили, концентрировали с получением неочищенного продукта, который очищали на колонке с силикагелем (элюент:петролейный эфир/EtOAc=100/15/1) с получением промежуточного продукта 34 (20 г, 96,2%). Стадия 4. Синтез промежуточного продукта 35THF (200 мл) перемешивали при к.т. в течение 1 ч. Добавляли (S)-N-трет-бутилсульфинамид(29 г, 237,2 ммоль). Полученную смесь перемешивали при 80 С в атмосфере N2 в течение ночи. Затем реакционную смесь охлаждали, и добавляли воду (400 мл). Смесь фильтровали, и экстрагировали водный слой EtOAc(3400 мл). Разделенную органическую фазу сушили и концентрировали в условиях пониженного давления с получением неочищенного продукта. Остаток очищали методом колоночной хроматографии на силикагеле (петролейный эфир/EtOAc=20/1) с получением промежуточного продукта 35 (18,4 г, 70,5%). Стадия 5. Синтез промежуточного продукта 36 К раствору этилвинилового эфира (12,3 г, 170,3 ммоль, 5,0 экв.) в безводном THF (100 мл) при-78 С в атмосфере N2 по каплям добавляли t-BuLi (131 мл, 170,3 ммоль, 1,3 М в гексане), и перемешивали в течение 20 мин. Затем полученную смесь дополнительно перемешивали при 0 С в течение 45 мин. Раствор повторно охлаждали до -78 С, по каплям добавляли соединение 35 (15,0 г, 34,1 ммоль) в безводномTHF (50 мл), и перемешивали смесь в течение 2 ч при -78 С. Реакционную смесь гасили добавлением нас. NH4Cl (50 мл) и экстрагировали EtOAc (3300 мл). Органическую фазу концентрировали с получением остатка, который очищали методом колоночной хроматографии на силикагеле с получением промежуточного продукта 36 (11 г, 64,7%) и 36 А (1,441 г, чистота 100%).H-NMR (CD3OD):7,546 (s, 1H), 7,454-7,479 (d, 1H), 7,208-7,228 (d, 1H), 4,620-4,755 (d, 1H), 4,3734,381 (m, 1H),4,048-4,055 (m, 1H), 3,844-3,903 (m, 2H), 3,458-3,474 (s, 3 Н), 2,986-3,000 (m, 2H), 2,3262,377 (m, 1H), 1,969-2,001 (m, 1H), 1,671 (s, 1H), 1,457-1,520 (t, J=12 Hz, 3H),1,373-1,408 (m, 2H), 1,328 (s,9H), 1,169-1,278 (m, 5H), 1,073-1,106(d, 3H). Стадия 5. Синтез промежуточного продукта 37 Смесь промежуточного продукта 36 (4,8 г, 9,37 ммоль) в DCM/MeOH=5/1 (40 мл) охлаждали до-78 С, и барботировали смесь озоном в течение 20 мин. Затем смесь продували N2 и обрабатывали Me2S(10 мл) при -78 С, а затем оставляли нагреваться до к.т. и перемешивали в течение 3 ч. Растворитель удаляли в условиях вакуума, остаток очищали методом колоночной хроматографии на силикагеле (петролейный эфир/EtOAc=20/18/1) с получением промежуточного продукта 37 (3,5 г, 72,9%).Hz, 1H), 1,75-1,79 (m, 1H), 1,61-1,66 (m, 1H), 1,54-1,57 (m, 2H), 1,32-1,38 (m, 4H), 1,14 (s, 9H), 1,06-1,08 (d,J=6,0 Hz, 3H), 0,89-0,91 (d, J=6,0 Hz, 3H), 0,67-0,74 (m, 1H). Стадия 6. Синтез промежуточного продукта 38 К соединению 37 (860 мг, 1,7 ммоль) в МеОН (10 мл) добавляли 4 М раствора HCl в диоксане (2 мл). Полученную смесь перемешивали в течение 30 мин. Растворитель удаляли в условиях пониженного давления с получением неочищенного промежуточного продукта 38 (800 мг). Остаток использовали на следующей стадии без дополнительной очистки. Альтернативный синтез промежуточного продукта 38. Стадия 1. Синтез промежуточного продукта 39 Смесь промежуточного продукта 6 (5,00 г, 11,4 ммоль), диэтоксиацетонитрила (3,5 мл, 24,4 ммоль) и THF (50 мл) охлаждали до -7 С и по каплям обрабатывали LDA (25,0 мл, 45,0 ммоль, 1,8 М вTHF/гептан/этилбензол). Смесь перемешивали при (-7)-(-2)С в течение 2 ч, а затем гасили добавлением воды (50 мл) и насыщенного водного NH4Cl (25 мл). Добавляли гексаны (100 мл), и разделяли слои. Органический слой промывали водой, солевым раствором и концентрировали с получением неочищенного промежуточного продукта 39 (9,00 г, 139%), который использовали непосредственно на следующей стадии.LC-MS: tR=3,74 мин, MS (ESI) m/z 523,2/525,2 [M-OEt+H]+. Стадия 2. Синтез промежуточного продукта 38 Смесь полученного ранее промежуточного продукта 39 (9,00 г, 11,4 ммоль) в EtOH (30 мл) обрабатывали 6 н. водным HCl (20 мл). Реакционную смесь нагревали при 75 С в течение 24 ч и охлаждали до к.т. Реакционную смесь экстрагировали толуолом (50 мл), а затем подщелачивали водную фазу до рН 8 добавлением 2 н. водного NaOH (60 мл). Добавляли толуол (100 мл), слои перемешивали и разделяли. Органический слой промывали водным NaHCO3 и солевым раствором и концентрировали. Добавляли гексаны, и снова концентрировали раствор с получением неочищенного промежуточного продукта 38(3,47 г, 74%), который использовали непосредственно на следующей стадии.LC-MS: tR=0,86 мин, MS (ESI) m/z 410,2/412,2 [М+Н]+. Стадия 7. Синтез промежуточного продукта 40 Промежуточный продукт 40 синтезировали способом, аналогичным представленному на стадии 7 получения промежуточного продукта 10 А. Продукт использовали непосредственно на следующей стадии. Стадия 8. Синтез промежуточного продукта 41 Промежуточный продукт 41 синтезировали способом, аналогичным представленному на стадии 8 получения промежуточного продукта 11 А. Неочищенный промежуточный продукт 41 использовали непосредственно на следующей стадии. Стадия 9. Синтез промежуточного продукта 42 Промежуточный продукт 42 синтезировали способом, аналогичным представленному на стадии 9 получения промежуточного продукта 12 А. Неочищенный промежуточный продукт 42 использовали непосредственно на следующей стадии. Стадия 10. Синтез соединения примера 10 К раствору промежуточного продукта 42 (400 мг, 0,8 ммоль) в EtOH (8 мл) добавляли NH3-H2O (1 мл) и трет-бутиловый гидропероксид (1 мл). После добавления смесь перемешивали при комнатной температуре в течение 12 ч. Растворитель удаляли путем выпаривания в условиях вакуума. Остаток очищали методом препаративной HPLC (способ 1) с получением соединения примера 6 (65,0 мг, выход 20%). Соединение примера 11 синтезировали согласно методике, описанной в примере 10. На стадии 9 (3 метилоксетан-3-ил)метанамин использовали вместо (5-фторпиримидин)-2-метиламина с получением соединения примера 11. Соединение примера 12 синтезировали согласно методике, описанной в примере 10. На стадии 9 2 аминооксетан использовали вместо (5-фторпиримидин)-2-метиламина с получением соединения примера 12. Соединение примера 13 синтезировали согласно методике, описанной в примере 10. На стадии 9 оксетан-3-илметанамин использовали вместо (5-фторпиримидин)-2 метиламина с получением соединения примера 13.(S)-2-(аминометил)тетрагидрофуран использовали вместо (5-фторпиримидин)-2-метиламина с получением соединения примера 14.(R)-2-(аминометил)тетрагидрофуран использовали вместо (5-фторпиримидин)-2-метиламина с получением соединения примера 15. Соединение примера 16 синтезировали согласно методике, описанной в примере 10. На стадии 9 2(аминометил)тетрагидропиран использовали вместо (5-фторпиримидин)-2-метиламина с получением соединения примера 16. Соединение примера 17 синтезировали согласно методике, описанной в примере 10. На стадии 9 промежуточный продукт 18 использовали вместо (5-фторпиримидин)-2-метиламина с получением соединения примера 17. Стадия 9. Синтез промежуточного продукта 43 К раствору соединения 41 (1 г, 2,51 ммоль) в THF (25 мл) добавляли 2-(2-аминометил)оксетан (262 мг, 3,01 ммоль) и триэтиламин (760 мг, 7,53 ммоль). Смесь перемешивали при к.т. в течение ночи. Реакционную смесь разбавляли EtOAc (45 мл), а затем насыщенным водным NaHCO3 (235 мл) и солевым раствором (235 мл). Растворитель удаляли, после чего сушили с получением неочищенного соединения 43 и 43 А, которое очищали методом SFC (способ А). Диастереоизомеры разделяли методом SFC (способ В). В указанных условиях целевой диастереоизомер 43 выделяли в виде второго пика. Диастереоизомер обрабатывали, как представлено на стадии 10 примера 10 с получением соединения примера 18. Стадия 1. Синтез промежуточного продукта 44. К 3-оксанону (0,42 г, 6 ммоль) в DCM (20 мл) добавляли 2-(трифенилфосфоранилиден)ацетонитрил (1,8 г, 6 ммоль) и перемешивали в течение ночи при к.т. После этого растворитель удаляли в условиях пониженного давления с получением неочищенного продукта (260 мг, неочищ.), который очищали методом хроматографии на силикагеле (петролейный эфир/EtOAc, 3/1) с получением промежуточного продукта 44 (260 мг, выход 46%) в виде белого твердого вещества. Стадия 2. Синтез промежуточного продукта 45. К смеси промежуточного продукта 44 (260 мг, 2,74 ммоль) в МеОН (10 мл) добавляли Ni Ренея (100 мг) и перемешивали в атмосфере водорода при к.т. в течение 12 ч. Затем смесь фильтровали через слойCelite. Фильтрат концентрировали с получением промежуточного продукта 45 (200 мг, неочищ.). Пример 19. Соединение примера 19 синтезировали согласно методике, описанной в примере 10. На стадии 9 использовали промежуточный продукт 45 с получением соединения примера 19. Стадия 1. Синтез промежуточного продукта 46
МПК / Метки
МПК: A61P 25/28, C07D 407/06, C07D 403/06, C07C 49/323, A61K 31/4184, C07D 235/02
Метки: ацилгуанидины, качестве, бета-секретазы, bace1, спироциклические, ингибиторов
Код ссылки
<a href="https://eas.patents.su/30-24995-spirociklicheskie-acilguanidiny-v-kachestve-ingibitorov-beta-sekretazy-bace1.html" rel="bookmark" title="База патентов Евразийского Союза">Спироциклические ацилгуанидины в качестве ингибиторов бета-секретазы (bace1)</a>
Предыдущий патент: Экстракция поликарбоновой кислоты
Следующий патент: Жидкая композиция для очищения твердых поверхностей
Случайный патент: Система и способ установки и поддерживания в заданном положении системы морской разведки и добычи, содержащей камеру с регулируемой плавучестью












