Полициклический lpa1 антагонист и его применение
Номер патента: 24967
Опубликовано: 30.11.2016
Авторы: Кинг Кристофер Дэвид, Россо Виктор В., Сейдерс Томас Джон, Бриттэйн Джейсон Эдвард
Формула / Реферат
1. Кристаллическая форма натриевой соли 1-{4'-[3-метил-4-((R)-1-фенил-этоксикарбониламино)изоксазол-5-ил]бифенил-4-ил}циклопропанкарбоновой кислоты, где указанная кристаллическая форма представляет собой гидрат, где кристаллическая форма характеризуется следующим:
(a) имеет диаграмму порошковой рентгеновской дифракции (XRPD) с характеристическими пиками 13,2° 2-θ, 17,2° 2-θ, 19,3° 2-θ, 22,4° 2-θ и 25,6° 2-θ;
(b) имеет диаграмму порошковой рентгеновской дифракции (XRPD), по существу, такую как показанная на фиг. 4;
(c) имеет кривую дифференциальной сканирующей калориметрии (ДСК) или термогравиметрического анализа (ТГА), по существу, схожие с представленными на фиг. 5 и 6;
(d) имеет инфракрасный спектр, по существу, схожий с представленным на фиг. 7;
(e) получена из метилэтилкетона, ацетонитрила, 1,4-диоксан/трет-бутил метилового эфира, метилэтилкетона (МЕК)/трет-бутил метила или этанола/гептана;
(f) имеет параметры элементарной ячейки, по существу, равные при 25°С следующим:
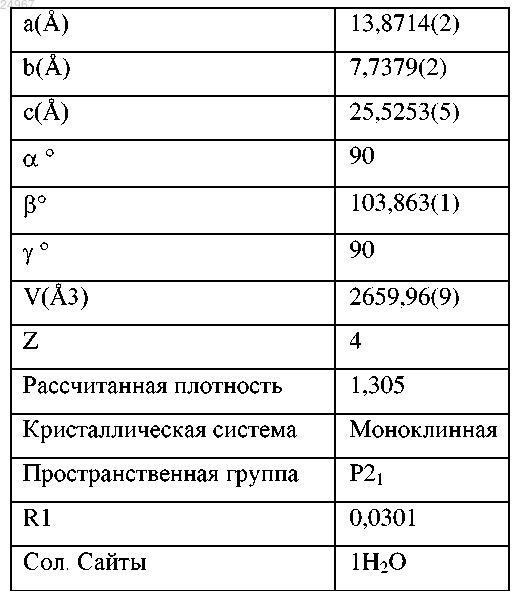
или
(g) комбинации указанного.
2. Кристаллическая форма 1-{4'-[3-метил-4-((R)-1-фенил-этоксикарбониламино)изоксазол-5-ил]бифенил-4-ил}циклопропанкарбоновой кислоты (соединение 1) или ее сольват, где кристаллическая форма характеризуется следующим:
(a) диаграммой порошковой рентгеновской дифракции (XRPD) с характеристическими пиками 4,7° 2-θ, 9,4° 2-θ, 14,5° 2-θ и 21,0° 2-θ;
(b) диаграммой порошковой рентгеновской дифракции (XRPD), по существу, такой как XRPD, показанная на фиг. 1;
(c) термограммой ДСК с эндотермой при 172-176°С;
(d) кривой ДСК или термогравиметрического анализа (ТГА), по существу, схожими с представленными на фиг. 2 и 3;
(e) по существу, такой же диаграммой порошковой рентгеновской дифракции (XRPD) после хранения в течение одной недели при 40°С/75% относительной влажности;
(f) параметрами элементарной ячейки, по существу, равными при 25°С следующим:
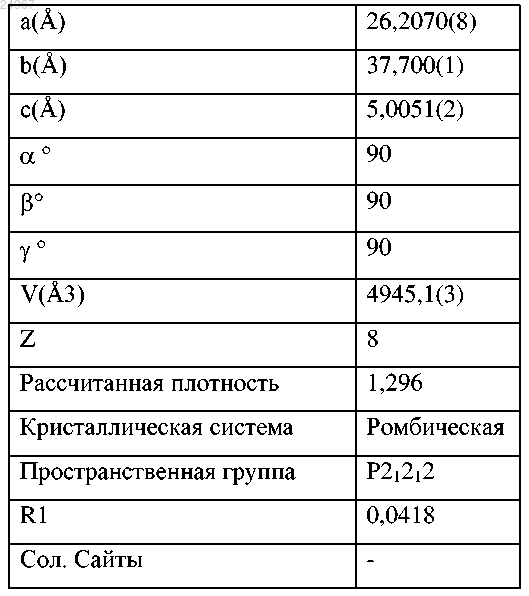
или
(g) комбинациями указанного.
3. Кристаллическая форма 1-{4'-[3-метил-4-((R)-1-фенил-этоксикарбониламино)изоксазол-5-ил]бифенил-4-ил}циклопропанкарбоновой кислоты (соединение 1) или ее сольват, где кристаллическая форма характеризуется следующим:
(а) диаграммой порошковой рентгеновской дифракции (XRPD), по существу, такой как XRPD, показанная на фиг. 12;
(b) диаграммой порошковой рентгеновской дифракции (XRPD) с характеристическими пиками 6,3° 2-θ, 12,8° 2-θ, 16,4° 2-θ, 17,0° 2-θ и 19,7° 2-θ;
(c) параметрами элементарной ячейки, приблизительно равными при 25°С следующим:
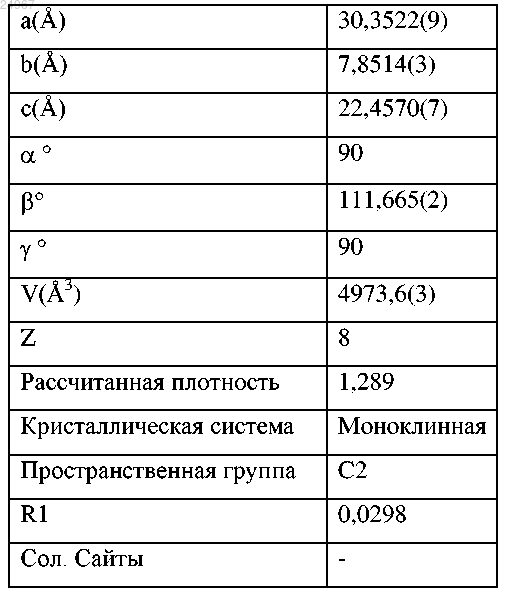
или
(d) комбинациями указанного.
4. Кристаллическая форма 1-{4'-[3-метил-4-((R)-1-фенил-этоксикарбониламино)изоксазол-5-ил]бифенил-4-ил}циклопропанкарбоновой кислоты (соединение 1) или ее сольват, где кристаллическая форма характеризуется следующим:
(a) диаграммой порошковой рентгеновской дифракции (XRPD), по существу, такой как XRPD, показанная на фиг. 13;
(b) диаграммой порошковой рентгеновской дифракции (XRPD) с характеристическими пиками 5,5° 2-θ, 5,9° 2-θ, 12,6° 2-θ и 16,7° 2-θ;
(c) параметрами элементарной ячейки, приблизительно равными при 25°С следующим:

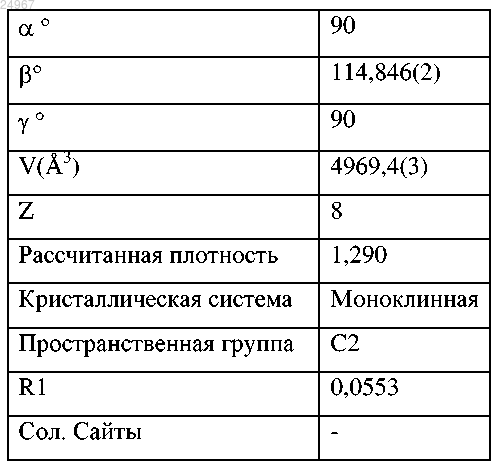
или
(d) комбинациями указанного.
5. Применение кристаллической формы по любому из пп.1-4 для лечения фиброза у млекопитающих.
Текст
(соединение 1) и ее фармацевтически приемлемые соли. Также описано применение таких кристаллических форм для лечения фиброза у млекопитающих. 024967 Родственные заявки Настоящая заявка испрашивает приоритет по предварительной заявке на патент США 61/420599,озаглавленной как "Полициклический LPA1 антагонист и его применение" и поданной 7 декабря 2010 г.,которая вкючена в настоящее описание в полном объеме посредством ссылки. Область техники В настоящем документе описан антагонист LPA рецептора 1-4'-[3-метил-4-R)-1-фенилэтоксикарбониламино)изоксазол-5-ил]бифенил-4-илциклопропанкарбоновая кислота (соединение 1),его фармацевтически приемлемые соли, полиморфы, аморфные фазы, метаболиты, а также его фармацевтические композиции и способы его применения в лечении или предупреждении или в диагностике заболеваний или состояний, связанных с активностью одного или более рецептора лизофосфатидной кислоты (LPA). Уровень техники Лизофосфолипиды являются биоактивными липидными медиаторами мембранного происхождения. Лизофосфолипиды влияют на основные клеточные функции, которые включают пролиферацию,дифференцировку, выживаемость, миграцию, адгезию, инвазию и морфогенез. Эти функции оказывают влияние на многие биологические процессы, которые включают, но не ограничиваются ими, нейрогенез,ангиогенез, заживление ран, фиброз иммунитет и канцерогенез. Лизофосфатидная кислота (LPA) представляет собой лизофосфолипид, который, как было показано,действуют через набор специфических G-белок-сопряженных рецепторов (GPCR) аутокринным и паракринным образом. Связывание LPA с соответствующими GPCR (LPA1, LPA2, LPA3, LPA4, LPA5, LPA6) активирует внутриклеточные сигнальные пути, вызывая различные биологические реакции. Антагонисты LPA рецепторов находят применение в лечении заболеваний, расстройств или состояний, в которых принимает участие LPA. Сущность изобретения В настоящем документе описана 1-4'-[3-метил-4-R)-1-фенил-этоксикарбониламино)изоксазол-5 ил]бифенил-4-илциклопропанкарбоновая кислота (соединение 1), включая ее фармацевтически приемлемые сольваты (в том числе гидраты), полиморфы, аморфные фазы и способы ее применения. Соединение 1, также как и его фармацевтически приемлемые соли применяют для лечения или предупрежденияLPA-опосредованных и/или LPA-зависимых заболеваний, расстройств или состояний. Соединение 1 представляет собой LPA1 антагонист. В одном аспекте описана кристаллическая форма 1-4'-[3-метил-4-R)-1-фенилэтоксикарбониламино)изоксазол-5-ил]бифенил-4-илциклопропанкарбоновой кислоты (соединение 1) либо ее фармацевтически приемлемая соль или сольват. В некоторых вариантах описана кристаллическая форма фармацевтически приемлемой соли соединения 1. В некоторых вариантах фармацевтически приемлемой солью является натриевая соль, кальциевая соль, калиевая соль, соль аммония, соль Lаргинина, соль L-лизина или соль N-метил-О-глюкамина либо ее сольват. В некоторых вариантах фармацевтически приемлемой солью является натриевая соль или ее сольват. В некоторых вариантах кристаллическая форма фармацевтически приемлемой соли соединения 1, по существу, не содержит аморфной фармацевтически приемлемой соли. В некоторых вариантах кристаллическая форма представляет собой гидрат. В некоторых вариантах кристаллическая форма 1-4'-[3-метил-4-R)-1-фенилэтоксикарбониламино)изоксазол-5-ил]бифенил-4-илциклопропанкарбоновой кислоты представляет собой сольват. В некоторых вариантах фармацевтически приемлемая соль соединения 1, по существу, не содержит S-изомеров. В некоторых вариантах фармацевтически приемлемая соль представляет собой натриевую соль 14'-[3-метил-4-R)-1-фенил-этоксикарбониламино)изоксазол-5-ил]бифенил-4-илциклопропанкарбоновой кислоты (соединение 2) или сольват. В некоторых вариантах фармацевтически приемлемая соль является аморфной. В некоторых вариантах фармацевтически приемлемая соль является кристаллической. В некоторых вариантах фармацевтически приемлемая соль представляет собой кристаллическую форму соединения 2 или ее сольват. В некоторых вариантах фармацевтически приемлемой солью является гидратированная кристаллическая форма соединения 2. В некоторых вариантах фармацевтически приемлемая соль представляет собой аморфную фазу соединения 2 или ее сольват. В некоторых вариантах осуществления описана кристаллическая форма 1-4'-[3-метил-4-R)-1 фенил-этоксикарбониламино)изоксазол-5-ил]бифенил-4-илциклопропанкарбоновой кислоты либо ее фармацевтически приемлемая соль или сольват. В некоторых вариантах описана кристаллическая форма фармацевтически приемлемой соли 1-4'[3-метил-4-R)-1-фенил-этоксикарбониламино)изоксазол-5-ил]бифенил-4-илциклопропанкарбоновой кислоты или ее сольват. В любом из вариантов описанная здесь кристаллическая форма является гидратированной. В любом из вариантов описанная здесь кристаллическая форма является моногидратом. В некоторых вариантах описана кристаллическая форма натриевой соли 1-4'-[3-метил-4-R)-1 фенил-этоксикарбониламино)изоксазол-5-ил]бифенил-4-илциклопропанкарбоновой кислоты. В некоторых вариантах описана кристаллическая форма гидрата натриевой соли 1-4'-[3-метил-4-1 024967R)-1-фенил-этоксикарбониламино)изоксазол-5-ил]бифенил-4-илциклопропановой кислоты. В некоторых вариантах кристаллическая форма натриевой соли 1-4'-[3-метил-4-R)-1-фенилэтоксикарбониламино)изоксазол-5-ил]бифенил-4-илциклопропановой кислоты (соединение 2), где указанная кристаллическая форма представляет собой гидрат, где кристаллическая форма характеризуется следующим:(a) имеет диаграмму порошковой рентгеновской дифракции (XRPD) с характеристическими пиками 13,2 2-Тета, 17,2 2-Тета, 19,3 2-Тета, 22,4 2-Тета и 25,6 2-Тета;(b) имеет диаграмму порошковой рентгеновской дифракции (XRPD), по существу, такую как показанная на фиг. 4;(c) имеет кривую дифференциальной сканирующей калориметрии (ДСК) или термогравиметрического анализа (ТГА), по существу, схожие с представленными на фиг. 5 и 6;(f) имеет параметры элементарной ячейки, по существу, равные при 25 С следующим:(g) комбинации указанного. В некоторых вариантах осуществления гидратированная кристаллическая форма соединения 2 имеет по меньшей мере одно свойство, выбранное из (а), (b), (с), (d), (e) и (f). В некоторых вариантах гидратированная кристаллическая форма соединения 2 имеет по меньшей мере два свойства, выбранных из(а), (b), (с), (d), (e) и (f). В некоторых вариантах гидратированная кристаллическая форма соединения 2 имеет по меньшей мере три свойства, выбранных из (а), (b), (с), (d), (e) и (f). В некоторых вариантах гидратированная кристаллическая форма соединения 2 имеет по меньшей мере четыре свойства, выбранных из (а), (b), (с), (d), (e) и (f). В некоторых вариантах гидратированная кристаллическая форма соединения 2 имеет по меньшей мере пять свойств, выбранных из (а), (b), (с), (d), (e) и (f). В некоторых вариантах гидратированная кристаллическая форма соединения 2 имеет свойства (а), (b), (с), (d), (e) и (f). В одном варианте осуществления описана кристаллическая форма натриевой соли 1-4'-[3-метил-4R)-1-фенил-этоксикарбониламино)изоксазол-5-ил]бифенил-4-илциклопропанкарбоновой кислоты (соединение 2) или ее сольват. В одном варианте осуществления описана кристаллическая форма натриевой соли 1-4'-[3-метил-4R)-1-фенил-этоксикарбониламино)изоксазол-5-ил]бифенил-4-илциклопропанкарбоновой кислоты (соединение 2) В некоторых вариантах осуществления кристаллическая форма соединения 2 является гидратированной. В некоторых вариантах осуществления кристаллическая форма соединения 2 имеет диаграмму порошковой рентгеновской дифракции (XRPD) с характеристическими пиками 13,2 2-Тета, 17,2 2-Тета,19,3 2-Тета, 22,4 2-Тета и 25,6 2-Тета. В некоторых вариантах осуществления кристаллическая форма соединения 2 имеет диаграмму порошковой рентгеновской дифракции (XRPD), по существу, такую же, как показанная на фиг. 4. В некоторых вариантах осуществления кристаллическая форма соединения 2 имеет термограмму ДСК, по существу, подобную показанной на фиг. 6. В некоторых вариантах осуществления кристаллическая форма соединения 2 имеет кривую термогравиметрического анализа (ТГА), по существу, подобную-2 024967 показанной на фиг. 5. В некоторых вариантах осуществления кристаллическая форма соединения 2 имеет кривую термогравиметрического анализа (ТГА) или ДСК, по существу, подобную показанным на фиг. 5 и 6. В некоторых вариантах осуществления кристаллическая форма соединения 2 получена из(iv) ацетонитрила или ацетонитрила и тетрагидрофурана;(vii) этанола и гептана. В некоторых вариантах осуществления кристаллическая форма соединения 2, по существу, не содержит S-изомеров. В некоторых вариантах осуществления кристаллическая форма соединения 2, по существу, не содержит аморфной фазы соединения 2. В некоторых вариантах осуществления кристаллическая форма соединения 2 имеет, по существу,такую же диаграмму порошковой рентгеновской дифракции (XRPD) после недельного хранения в условиях повышенной относительной влажности. В некоторых вариантах осуществления кристаллическая форма соединения 2 имеет, по существу,такую же диаграмму порошковой рентгеновской дифракции (XRPD) после недельного хранения при 40 С/75% относительной влажности или 25 С/95% относительной влажности. В некоторых вариантах осуществления кристаллическая форма соединения 2 представляет собой структуру 1. В некоторых вариантах осуществления кристаллическая форма соединения 2 представляет собой структуру 2. В некоторых вариантах осуществления кристаллическая форма соединения 2 представляет собой структуру 3. В некоторых вариантах осуществления описана кристаллическая форма 1-4'-[3-метил-4-R)-1 фенил-этоксикарбониламино)изоксазол-5-ил]бифенил-4-илциклопропанкарбоновой кислоты (соединение 1) или ее сольват. В некоторых вариантах осуществления описана кристаллическая форма соединения со следующей структурой: В некоторых вариантах осуществления описана кристаллическая форма соединения 1 или ее сольват, где кристаллическая форма характеризуется следующим:(a) диаграммой порошковой рентгеновской дифракции (XRPD) с характеристическими пиками 4,7 2-Тета, 9,4 2-Тета, 14,5 2-Тета и 21,0 2-Тета;(b) диаграммой порошковой рентгеновской дифракции (XRPD), по существу, такой как XRPD, показанная на фиг. 1;(d) кривой ДСК или термогравиметрического анализа (ТГА), по существу, схожими с представленными на фиг. 2 и 3;(e) по существу, такой же диаграммой порошковой рентгеновской дифракции (XRPD) после хранения при 40 С/75% относительной влажности в течение одной недели;(g) комбинациями указанного. В некоторых вариантах осуществления кристаллическая форма соединения 1 имеет диаграмму порошковой рентгеновской дифракции (XRPD) с характеристическими пиками 4,7 2-Тета, 9,4 2-Тета,14,5 2-Тета и 21,0 2-Тета. В некоторых вариантах осуществления кристаллическая форма соединения 1 имеет диаграмму порошковой рентгеновской дифракции (XRPD), по существу, такую как XRPD, показанная на фиг. 1. В некоторых вариантах осуществления кристаллическая форма соединения 1 имеет термограмму ДСК с эндотермой примерно 176 С. В некоторых вариантах осуществления кристаллическая форма соединения 1 имеет кривую ДСК или термогравиметрического анализа (ТГА), по существу, подобную показанным на фиг. 2 и 3. В некоторых вариантах осуществления кристаллическая форма соединения 1 имеет, по существу,такую же диаграмму порошковой рентгеновской дифракции (XRPD) после хранения при 40 С/75% относительной влажности в течение одной недели. В некоторых вариантах осуществления описана кристаллическая форма соединения 1 или ее сольват, где кристаллическая форма характеризуется следующим:(a) диаграммой порошковой рентгеновской дифракции (XRPD), по существу, такой как XRPD, показанная на фиг. 12;(b) диаграммой порошковой рентгеновской дифракции (XRPD) с характеристическими пиками 6,3 2-Тета, 12,8 2-Тета, 16,4 2-Тета, 17,0 2-Тета и 19,7 2-Тета;(c) параметрами элементарной ячейки, приблизительно равными при 25 С следующим:(d) комбинациями указанного. В некоторых вариантах осуществления описана кристаллическая форма соединения 1 или ее сольват, где кристаллическая форма характеризуется следующим:(a) диаграммой порошковой рентгеновской дифракции (XRPD), по существу, такой как XRPD, показанная на фиг. 13;(b) диаграммой порошковой рентгеновской дифракции (XRPD) с характеристическими пиками 5,5 2-Тета, 5,9 2-Тета, 12,6 2-Тета и 16,7 2-Тета;(c) параметрами элементарной ячейки, приблизительно равными при температуре 25 С следующим:(d) комбинациями указанного. В некоторых вариантах осуществления кристаллическая форма соединения 1, по существу, не со-4 024967 держит S-изомеров. В некоторых вариантах осуществления кристаллическая форма соединения 1, по существу, не содержит аморфного соединения 1. В некоторых вариантах осуществления кристаллическая форма соединения 1 кристаллизована из этанола, метанола, 2-метоксиэтанола, этанола, 1-пропанола, 2-пропанола, 1-бутанола, бутил ацетата, ацетона, метилэтилкетона, анизола, толуола, нитрометана, ацетонитрила, этил ацетата, кумола, 1-4 диоксана, тетрагидрофурана, дихлорметана, гептана или комбинаций указанного. В некоторых вариантах осуществления кристаллическая форма соединения 1 представляет собой структуру 1. В некоторых вариантах осуществления кристаллическая форма соединения 1 представляет собой структуру 2. В некоторых вариантах осуществления кристаллическая форма соединения 1 представляет собой структуру 3. В некоторых вариантах осуществления фармацевтически приемлемая соль соединения 1 включает детектируемое количество палладия, которое меньше чем 20 ppm. В некоторых вариантах осуществления фармацевтически приемлемая соль соединения 1 включает детектируемое количество палладия, которое меньше чем 15 ppm. В некоторых вариантах осуществления фармацевтически приемлемая соль соединения 1 не содержит детектируемое количество палладия. В некоторых вариантах осуществления соединение 2 или его сольват очищены более чем на 96%. В некоторых вариантах осуществления соединение 2 или его сольват очищены более чем на 97%. В некоторых вариантах осуществления соединение 2 или его сольват очищены более чем на 98%. В другом аспекте предложено применение кристаллической формы соединения 1 или его фармацевтически приемлемой соли (например, соединения 2) в лечении заболевания, расстройства или состояния, в котором активность по меньшей мере одного LPA рецептора вносит вклад в патологию и/или симптомы заболевания или состояния. В одном варианте воплощения этого аспекта LPA рецептор выбран изLPA1, LPA2, LPA3, LPA4, LPA5 и LPA6. В некоторых вариантах осуществления LPA рецептор представляет собой LPA1 или LPA2, или LPA3. В некоторых вариантах осуществления заболевание или состояние представляет собой любое из заболеваний или состояний, предусмотренных здесь. В одном аспекте LPA-зависимые или LPA-опосредованные заболевания или состояния включают,но не ограничиваются этим, фиброз органов или тканей, рубцевание, заболевания печени, дерматологические состояния, рак, сердечно-сосудистые заболевания или состояния, воспалительное заболевание,заболевание желудочно-кишечного тракта, заболевания почек, заболевания, ассоциированные с мочевыводящими путями, воспалительное заболевание нижних мочевыводящих путей, дизурию, частое мочеиспускание, заболевание поджелудочной железы, артериальную непроходимость, церебральный инфаркт,внутримозговое кровоизлияние, боль, периферическую невропатию и фибромиалгию. В некоторых вариантах осуществления кристаллическую форму соединения 1 или его фармацевтически приемлемой соли (например, соединение 2) применяют для лечения или предупреждения фиброза у млекопитающего. В некоторых вариантах осуществления млекопитающим является человек. В некоторых вариантах осуществления LPA-зависимое или LPA-опосредованное заболевание или состояние выбрано из идиопатического легочного фиброза; других диффузных паренхиматозных заболеваний легких различной этиологии, в том числе ятрогенного медикаментозного фиброза, фиброза, вызванного профессиональной деятельностью или условиями окружающей среды, гранулематозных заболеваний (саркоидоза, гиперсенситивной пневмонии), коллагенозных заболеваний сосудов, альвеолярного протеиноза, гранулематоза клеток Лангерганса, лимфангиолейомиоматоза, наследственных заболеваний(синдрома Германского-Пудлака, туберозного склероза, нейрофиброматоза, нарушений обмена веществ,семейной интерстициальной болезни легких); фиброза, вызванного облучением; хронической обструктивной болезни легких (ХОБЛ); склеродермии; блеомицин-индуцированного фиброза легких; хронической астмы; силикоза; асбест-индуцированного легочного фиброза; острого респираторного дистресссиндрома (ОРДС); фиброза почек; тубулоинтерстициального фиброза; гломерулярного нефрита; фокального сегментарного гломерулярного склероза; IgA нефропатии; гипертензии; синдрома Альпорта; кишечного фиброза; фиброза печени; цирроза; алкоголь-индуцированного фиброза печени; фиброза печени, вызванного токсическими/лекарственными препаратами; гемохроматоза; неалкогольного стеатогепатита (НАСГ); травмы желчных протоков; первичного билиарного цирроза; фиброза печени, вызванного инфекцией; вирус-индуцированного фиброза печени и аутоиммунного гепатита; рубцевания роговицы; гипертрофированного рубцевания; заболевания Дюпюитрена, келоидов, фиброза кожи; склеродермии кожи; травмы/фиброза спинного мозга; миелофиброза; рестеноза сосудов; атеросклероза; артеросклероза; гранулематоза Вегенера; болезни Пейрони, хронического лимфолейкоза, опухолевых метастаз, отторжения трансплантата органа, эндометриоза, респираторного дистресс-синдрома и невропатической боли. В одном аспекте кристаллическую форму соединения 1 или его фармацевтически приемлемой соли(например, соединение 2) применяют для лечения идиопатического легочного фиброза (обычной интерстициальной пневмонии) у млекопитающего. В одном аспекте кристаллическую форму соединения 1 или его фармацевтически приемлемой соли(например, соединение 2) применяют для лечения феномена Рейно. Феномен Рейно включает как бо-5 024967 лезнь Рейно (где феномен является идиопатическим), так и синдром Рейно, который вызывается некоторыми другими провоцирующими факторами. В некоторых вариантах осуществления кристаллическую форму соединения 1 или его фармацевтически приемлемой соли (например, соединение 2) применяют для лечения диффузных паренхимальных интерстициальных заболеваний легких у млекопитающего: ятрогенных заболеваний, вызванных лекарственными препаратами, гранулематозных заболеваний, вызванных профессиональной деятельностью/факторами окружающей среды ("легкое фермера"), гранулематозных заболеваний (саркоидоза, гиперсенситивной пневмонии), коллагенозных заболеваний сосудов (склеродермии и др.), альвеолярного протеиноза, гранулематоза клеток Лангерганса, лимфангиолейомиоматоза, синдрома ГерманскогоПудлака, туберозного склероза, нейрофиброматоза, расстройств обмена веществ, семейного интерстициального заболевания легких. В некоторых вариантах осуществления кристаллическую форму соединения 1 или его фармацевтически приемлемой соли (например, соединение 2) применяют для лечения пост-трансплантационного фиброза, ассоциированного с хроническим отторжением, у млекопитающего (например, облитерирующего бронхиолита для трансплантата легкого). В некоторых вариантах осуществления кристаллическую форму соединения 1 или его фармацевтически приемлемой соли (например, соединение 2) применяют для лечения фиброза кожи у млекопитающего (например, склеродермии кожи, заболевания Дюпюитрена, келоида). В некоторых вариантах осуществления кристаллическую форму соединения 1 или его фармацевтически приемлемой соли (например, соединение 2) применяют для лечения фиброза печени с или без цирроза у млекопитающего: фиброза, вызванного токсческими/лекарственными препаратами (гемохроматоза), алкогольного заболевания печени, вирусного гепатита (вируса гепатита В, вируса гепатита С, ВГС),неалкогольного заболевания печени (НАСГ), метаболического и аутоиммунного. В одном аспекте кристаллическую форму соединения 1 или его фармацевтически приемлемой соли(например, соединение 2) применяют для лечения фиброза почек у млекопитающего: тубулоинтерстициального фиброза, гломерулярного склероза. В любом из вышеуказанных аспектов, относящихся к лечению LPA-зависимых заболеваний или состояний, предложены дополнительные варианты воплощения, включающие введение по меньшей мере одного или более дополнительных агентов наряду с введением соединения 1 или его фармацевтически приемлемой соли (например, соединения 2). В различных вариантах воплощения каждый агент вводится в любом порядке, в том числе одновременно. В любом варианте воплощения, описанного здесь, млекопитающим является человек. В некоторых вариантах осуществления соединения, предложенные здесь, вводят человеку. В некоторых вариантах осуществления соединения, предложенные здесь, вводят человеку перорально. В некоторых вариантах осуществления кристаллическую форму соединения 1 или его фармацевтически приемлемой соли (например, соединение 2) применяют для ингибирования активности по меньшей мере одного LPA рецептора или для лечения заболевания или состояния, для которого было бы полезно ингибирование активности по меньшей мере одного LPA рецептора. В одном аспекте LPA рецептором является LPA1. В любом из вышеупомянутых вариантов предусмотрены дополнительные варианты осуществления,включающие однократное введение эффективного количества кристаллической формы соединения 1 или его фармацевтически приемлемой соли (например, соединения 2), в том числе дополнительные варианты осуществления, в которых кристаллическую форму соединения 1 или его фармацевтически приемлемой соли (например, соединение 2) вводят (i) один раз в день; (ii) два раза в день или (iii) несколько раз на протяжении одного дня. В любом из вышеупомянутых вариантов предусмотрены дополнительные варианты осуществления,включающие многократное введение эффективного количества кристаллической формы соединения 1 или его фармацевтически приемлемой соли (например, соединения 2), в том числе дополнительные варианты осуществления, в которых (i) соединение вводят в однократной дозе; (ii) время между множественными введениями составляет 6 ч; (iii) время между множественными введениями составляет 8 ч; (iv) время между множественными введениями составляет 12 ч. В некоторых вариантах осуществления фармацевтическую композицию вводят млекопитающему ежедневно. В некоторых вариантах осуществления фармацевтическую композицию вводят в циклах лечения,включающих: (а) первый период, в течение которого кристаллическую форму соединения 2 вводят млекопитающему ежедневно; и (b) второй период, в течение которого кристаллическую форму соединения 1 или его фармацевтически приемлемой соли (например, соединение 2) вводят в сокращенном количестве по сравнению с (а) или не вводят млекопитающему. В некоторых вариантах осуществления способы лечения или предупреждения, описанные здесь,включают лекарственные каникулы, в которых введение кристаллической формы соединения 1 или его фармацевтически приемлемой соли (например, соединения 2) временно приостановлено или вводимая доза временно уменьшена, в конце лекарственных каникул дозирование возобновляют. В некоторых ва-6 024967 риантах осуществления продолжительность лекарственных каникул варьирует в пределах от 2 дней до 1 года. Кристаллическую форму соединения 1 или его фармацевтически приемлемой соли (например, соединение 2) применяют для лечения любых заболеваний или состояний, описанных здесь. В некоторых вариантах осуществления в любом из вариантов осуществления, описанных здесь(включая способы, применения, составы, комбинационную терапию и т. д.), соединение 1 или его фармацевтически приемлемая соль либо сольват могут быть заменены: а) соединением 1 или его фармацевтически приемлемой солью либо сольватом более низкой хиральной чистоты; b) 1-4'-[3-метил-4-S)-1 фенил-этоксикарбониламино)изоксазол-5-ил]бифенил-4-илциклопропанкарбоновой кислотой или ее фармацевтически приемлемой солью либо сольватом любой оптической чистоты; или с) рацемической 14'-[3-метил-4-(1-фенил-этоксикарбониламино)изоксазол-5-ил]бифенил-4-илциклопропанкарбоновой кислотой или ее фармацевтически приемлемой солью либо сольватом. В любом из вариантов осуществления, описанных здесь (включая способы, применения, составы,комбинационную терапию и т. д.), может быть использовано аморфное соединение 1. В любом из вариантов осуществления, описанных здесь (включая способы, применения, составы, комбинационную терапию и т. д.), может быть использовано кристаллическое соединение 1. В любом из вариантов осуществления, описанных здесь (включая способы, применения, составы, комбинационную терапию и т. д.), может быть использовано кристаллическое соединение 1 (структура 1). В любом из вариантов осуществления, описанных здесь (включая способы, применения, составы, комбинационную терапию и т. д.), может быть использовано кристаллическое соединение 1 (структура 2). В любом из вариантов осуществления,описанных здесь (включая способы, применения, составы, комбинационную терапию и т. д.), может быть использовано кристаллическое соединение 1 (структура 3). В любом из вариантов осуществления, описанных здесь (включая способы, применения, составы,комбинационную терапию и т. д.), может быть использовано аморфное соединение 2. В любом из вариантов осуществления, описанных здесь (включая способы, применения, составы, комбинационную терапию и т. д.), может быть использовано кристаллическое соединение 2. В любом из вариантов осуществления, описанных здесь (включая способы, применения, составы, комбинационную терапию и т. д.), может быть использовано частично кристаллическое соединение 2. В любом из вариантов осуществления,описанных здесь (включая способы, применения, составы, комбинационную терапию и т. д.), может быть использовано кристаллическое соединение 2 (структура 1). В любом из вариантов осуществления, описанных здесь (включая способы, применения, составы, комбинационную терапию и т. д.), может быть использовано кристаллическое соединение 2 (структура 2). В любом из вариантов осуществления, описанных здесь (включая способы, применения, составы, комбинационную терапию и т. д.), может быть использовано кристаллическое соединение 2 (структура 3). В некоторых вариантах осуществления в любом из вариантов осуществления, описанных здесь(включая способы, применения, составы, комбинационную терапию и т. д.), соединение 1 или его фармацевтически приемлемая соль может быть заменено активным метаболитом соединения 1. В некоторых вариантах осуществления активный метаболит представлен в кристаллической форме. В некоторых вариантах осуществления активный метаболит представлен в аморфной фазе. В некоторых вариантах осуществления любом из вариантов осуществления, описанных здесь (включая способы, применения, составы, комбинационную терапию и т. д.), соединение 1 или его фармацевтически приемлемая соль может быть заменено пролекарством соединения 1 или дейтериевым аналогом соединения 1 или его фармацевтически приемлемой соли. Другие объекты, признаки и преимущества способов и композиций, описанных здесь, станут очевидными из следующего подробного описания. Следует понимать, однако, что подробное описание и конкретные примеры, указывающие на конкретные варианты осуществления, приведены только в качестве иллюстрации, т.к. различные изменения и модификации в пределах сущности и объема изобретения станут очевидными для специалистов в данной области техники из этого подробного описания. Краткое описание чертежей Фиг. 1 иллюстрирует XRPD структуры 1 кристаллического соединения 1. Фиг. 2 иллюстрирует ТГА структуры 1 кристаллического соединения 1. Фиг. 3 иллюстрирует ДСК структуры 1 кристаллического соединения 1. Фиг. 4 иллюстрирует XRPD структуры 1 кристаллического соединения 2. Фиг. 5 иллюстрирует ТГА структуры 1 кристаллического соединения 2. Фиг. 6 иллюстрирует ДСК структуры 1 кристаллического соединения 2. Фиг. 7 иллюстрирует ИК-спектр структуры 1 кристаллического соединения 2. Фиг. 8 иллюстрирует XRPD структуры 2 кристаллического соединения 2. Фиг. 9 иллюстрирует XRPD структуры 3 кристаллического соединения 2. Фиг. 10 иллюстрирует XRPD аморфного соединения 2. Фиг. 11 иллюстрирует ДСК аморфного соединения 2. Фиг. 12 иллюстрирует XRPD структуры 2 кристаллического соединения 1. Фиг. 13 иллюстрирует XRPD структуры 3 кристаллического соединения 1.-7 024967 Фиг. 14 иллюстрирует результаты действия соединения 1 на толщину кожи в модели блеомицининдуцированной склеродермы на мыши. Фиг. 15 иллюстрирует результаты действия соединения 1 на содержание коллагена в мышиной модели блеомицин-индуцированной склеродермы на мыши. Подробное описание изобретения Лизофосфолипиды (такие как лизофосфатидная кислота (LPA оказывают влияние на основные клеточные функции, включая клеточную пролиферацию, дифференциацию, выживаемость, миграцию,адгезию, инвазию и морфогенез. Эти функции влияют на многие биологические процессы, которые включают нейрогенез, ангиогенез, заживление ран, иммунитет и канцерогенез.LPA действует через ряд специфических G белок-сопряженных рецепторов (GPCR) аутокринным и паракринным образом. LPA связывание со своими когнантными GPCR (LPA1, LPA2, LPA3, LPA4, LPA5,LPA6) активирует внутриклеточные сигнальные пути, обеспечивая множество биологических ответов.LPA играет роль биологической эффекторной молекулы и имеет широкий диапазон физиологических действий, таких как, но без ограничений, влияние на кровяное давление, активацию тромбоцитов и сокращение гладких мышц, и множество клеточных эффектов, которые включают клеточный рост, округление клеток, ретракцию аксонов и образование актиновых стрессовых фибрилл, и клеточную миграцию. Эффекты LPA преимущественно рецептор-опосредованы. Активация LPA рецепторов посредством LPA опосредует ряд нисходящих сигнальных каскадов. Действующий путь и достигаемая конечная точка зависят от ряда переменных, которые включают использование рецепторов, тип клетки, уровень экспрессии рецептора или сигнального белка и концентрацию LPA. Почти все клетки млекопитающих, тканей и органов экспрессирует совместно несколько подтипов рецепторов LPA, что показывает то, что рецепторы LPA передают сигнал кооперативно. Аминокислотные последовательности LPA1, LPA2 и LPA3 имеют большое сходство.LPA регулирует многие функции фибробластов, играющие важную роль в заживлении ран, включая пролиферацию, миграцию, дифференцировку и сокращение. Пролиферация фибробластов в заживлении ран необходима для заполнения открытой раны. Напротив, фиброз характеризуется интенсивной пролиферацией и накоплением миофибробластов, которые активно синтезируют ЕСМ и провоспалительные цитокины. LPA может либо увеличивать либо подавлять пролиферацию клеток различных типов, играющих важную роль в заживлении ран. Повреждение ткани инициирует комплексные серии ответов организма на заживление раны; в удачном случае, такие ответы восстанавливают структуру и функции нормальной ткани. В противном случае, эти ответы могут привести к фиброзу ткани и потери функции. Множество мышечных дистрофий характеризуется прогрессирующей слабостью и истощением мускулатуры, а также обширным фиброзом. Было показано, что обработка LPA культурированных миобласт вызывает значительную экспрессию фактора роста соединительной ткани (CTGF). CTGF впоследствии индуцирует экспрессию коллагена, фибронектина и интегрина и вызывает дедифференциацию этих миобласт. Обработка LPA различных типов клеток вызывает воспроизводимый и высокий уровень индукции CTGF. CTGF является профибротическим цитокином, передающим сигнал дальше, параллельно с TGF-.LPA и LPA1 играют ключевую роль в патогенезе легочного фиброза. Хемоаттрактантная активность фибробластов играет важную роль в легких пациентов с легочным фиброзом. Профибротические эффекты стимуляции LPA1-рецептора объясняются LPA1-рецептор-опосредованным просачиванием сосудов и усиленным обновлением пула фибробластов, обоих профибротических событий. Путь LPA-LPA1 играет роль в опосредованной миграции фибробластов и просачивании жидкости через сосуды в ИЛФ. В итоге это приводит к аберрантному процессу заживления, который характеризует такое фибротической состояние.LPA-LPA2 путь способствует активации TGF- пути при легочном фиброзе. В некоторых вариантах воплощения соединения, которые ингибируют LPA2, показывают эффективность в лечении легочного фиброза. В некоторых вариантах воплощения соединения, которые ингибируют как LPA1, так и LPA2,показывают улучшенную эффективность в лечении легочного фиброза по сравнению с соединениями,которые ингибируют только LPA1 или LPA2.LPA и LPA1 вовлечены в этиологию фиброза почки. У мышей с нефункционирующим LPA1 рецептором (LPA1(-/- развитие почечного фиброза значительно ослаблено. Мыши с односторонней обструкцией мочеточника (UUO; животная модель почечного фиброза), которым вводили антагонист LPAрецептора Ki16425, имели сильное сходство с LPA1(-/-) мышами.LPA вовлечен в болезни печени и фиброз. Уровни LPA в плазме и аутотоксина в сыворотке повышены у пациентов с гепатитом и у животных моделей с повреждениями печени в корреляции с развивающимся фиброзом. LPA также регулирует функцию клеток печени. LPA1 и LPA2 рецепторы экспрессируются звездчатыми клетками печени мыши, и LPA стимулирует миграцию миофибробластов печени.LPA вовлечен в заживление ран глаз. LPA1 и LPA3 рецепторы обнаруживаются в нормальных эпителиальных клетках, кератоцитах и эндотелиальных клетках роговицы кролика, и экспрессия LPA1 иLPA3 увеличена в эпителиальных клетках роговицы после травмы.LPA присутствует во внутриглазной и слезной жидкости глаза кролика, и его уровни превышены у модели травмы роговицы на кролике.LPA индуцирует образование актиновых стрессовых волокон в эндотелиальных и эпителиальных клетках роговицы у кроликов и способствует сокращению фибробластов в роговице. LPA также стимулирует пролиферацию пигментированных эпителиальных клеток сетчатки человека.LPA вовлечен в инфаркт миокарда и фиброз сердца. Уровни сывороточного LPA повышены у пациентов, перенесших инфаркт миокарда (ИМ), и LPA стимулирует пролиферацию и продукцию коллагена(фиброз) фибробластами сердца крысы. Оба LPA1 и LPA3 рецептора экспрессируются в сердечной ткани человека. В одном аспекте соединение 1 или его фармацевтически приемлемую соль (например, соединение 2) применяют для лечения или предупреждения фиброза у млекопитающего. В одном аспекте соединение 1 или его фармацевтически приемлемую соль (например, соединение 2) применяют для лечения или предупреждения фиброза органа или ткани у млекопитающего. Термины "фиброз" или "фиброзные расстройства" при использовании здесь относятся к условиям,которые связаны с ненормальным накопление клеток и/или фибронектина, и/или коллагена, и/или ускоренным обновлением пула фибробластов и включают, но не ограничиваются этим, фиброз отдельных органов или тканей, таких как сердце, почки, печень, суставы, легкие, плевральная ткань, перитонеальная ткань, кожа, роговица, сетчатка, опорно-двигательный аппарат и желудочно-кишечный тракт. Примеры заболеваний, расстройств или состояний, которые вовлекают фиброз, включают, но не ограничиваются ими: заболевания легких, связанных с фиброзом, например идиопатический легочный фиброз, фиброз легких, вторичный к системному воспалительному заболеванию, такому как ревматоидный артрит, склеродермия, волчанка, криптогенный фиброзирующий альвеолит, лучевой фиброз, хроническая обструктивная болезнь легких (ХОБЛ), хроническая астма, силикоз, асбест-индуцированный легочный фиброз или плевральный фиброз, острое повреждение легких и острый респираторный дистресс(в том числе вызванный бактериальной пневмонией, травмой, вирусной пневмонией, сквозниками, нелегочным сепсисом и аспирацией), хронические нефропатии, связанные с травмой/фиброзом (фиброзом почек), например гломерулонефрит, вторичный к системным воспалительным заболеваниям, таким как волчанка и склеродермия, диабет, гломерулярный нефрит, фокальный сегментарный гломерулярный склероз, IgA нефропатия, гипертония, аллотрансплантат и синдром Альпорта; кишечный фиброз, например склеродермия и радиационно-индуцированный фиброз кишечника; фиброз печени, например цирроз печени, алкоголь-индуцированный фиброз печени, неалкогольный стеатогепатит (НАСГ), травмы желчных протоков, первичный билиарный цирроз, инфекции или фиброз печени, вызванный вирусом (например, хронический гепатит С), и аутоиммунный гепатит, фиброз головы и шеи, например, вызванный облучением; рубцевание роговицы, например LASIK (лазерный in situ кератомилез), трансплантат роговицы и трабекулэктомия; гипертрофическое рубцевание и келоиды, например, вызванные ожогом или хирургическим вмешательством; и другие фиброзные заболевания, например саркоидоз, склеродермия,повреждение/фиброз спинного мозга, миелофиброз, сосудистый рестеноз, атеросклероз, артериосклероз,гранулематоз Вегенера, смешанное заболевание соединительной ткани и болезнь Пейрони. В одном аспекте млекопитающему, страдающему от одного из следующих неограничивающих примеров заболеваний, расстройств или состояний, будет полезна терапия соединением 1 или его фармацевтически приемлемой солью (например, соединением 2): атеросклероз, тромбоз, заболевание сердца,васкулит, образование рубцовой ткани, рестеноз, флебит, ХОЗЛ (хроническое обструктивное заболевание легких), легочная гипертензия, легочный фиброз, воспаление легких, спайки кишечника, фиброз мочевого пузыря и цистит, фиброз носовых проходов, синусит, воспаление, опосредованное нейтрофилами,и фиброз, опосредованный фибробластами. В одном аспекте соединение 1 или его фармацевтически приемлемую соль (например, соединение 2) применяют для лечения дерматологических заболеваний у млекопитающего. Дерматологические заболевания включают, но не ограничиваются этим, пролиферативные или воспалительные заболевания кожи, такие как атопический дерматит, буллезные расстройства, коллагеноз, псориаз, псориатические поражения, склеродерма, дерматит, контактный дерматит, экзема, крапивница, розацеа, склеродермия,заживление ран, рубцевание, гипертрофическое рубцевание, келоиды, болезнь Кавасаки, розацеа, синдром Шегрена-Ларссона, крапивница.LPA высвобождается при повреждении тканей. LPA1 играет важную роль в инициировании невропатической боли. В одном аспекте соединение 1 или его фармацевтически приемлемую соль (например,соединение 2) применяют при лечении боли у млекопитающего. В одном аспекте боль представляет собой острую боль или хроническую боль. В другом аспекте боль представляет собой невропатическую боль. В другом аспекте боль представляет собой раковую боль. В одном аспекте соединение 1 или его фармацевтически приемлемую соль (например, соединение 2) применяют в лечении фибромиалгии. Сигнальный путь рецептора лизофосфолипидов играет роль в этиологии рака. Лизофосфатидная кислота (LPA) и ее G белок-связанные рецепторы (GPCR) LPA1, LPA2 и/или LPA3 участвуют в развитии различных типов рака.LPA способствует онкогенезу, увеличивая подвижность и инвазивность клеток. LPA вовлечен в инициирование или прогрессирование рака яичников. LPA присутствует в значительных концентрациях(2-80 мкм) в асцитической жидкости у больных раком яичников. LPA рецепторы (LPA2 и LPA3) также избыточно экспрессируются в клетках рака яичников по сравнению с нормальными эпителиальными клетками поверхности яичников. LPA также участвует в прогрессировании или инициировании рака предстательной железы, рака молочной железы, меланомы, рака головы и шеи, рака кишечника (колоректального рака), рака щитовидной железы, глиобластомы и других видов рака.LPA рецепторы опосредуют и миграцию, и инвазию клеточных линий рака поджелудочной железы:Kil6425 и LPA1-специфичные миРНК эффективно блокировали in vitro миграцию в ответ на LPA и перитонеальную жидкость (асцит) от больных раком поджелудочной железы; кроме того, Ki16425 блокировали активность LPA-индуцированной и асцит-индуцированной миграции сильно перитонеальных метастазов клеточной линии рака поджелудочной железы (Yamada et al., J. Biol. Chem., 279, 6595-6605, 2004). Клеточные линии колоректального рака характеризуются значительной экспрессией LPA1 мРНК и в ответ на LPA проявляют клеточную миграцию и продукцию факторов ангиогенеза. Избыточная экспрессия рецепторов LPA играет важную роль в патогенезе рака щитовидной железы. LPA3 первоначально клонировали из клеток рака предстательной железы, что согласуется с тем, что LPA способна вызвать аутокринную пролиферацию клеток рака предстательной железы.LPA играет роль стимулятора в прогрессировании многих типов рака. LPA продуцируется из и индуцирует пролиферацию клеточных линий рака предстательной железы. LPA индуцирует пролиферацию, миграцию, адгезию клеток и секрецию факторов ангиогенеза через сигнальный путь LPA1 в карциноме толстой кишки человека DLD1. В других клеточных линиях карциномы ободочной кишки человека(НТ 29 и WiDR) LPA усиливает пролиферацию клеток и секрецию ангиогенных факторов. В других клеточных линиях рака толстой кишки активация рецепторов LPA2 и LPA3 приводит к пролиферации клеток. LPA1 вовлечен в метастазирование кости (Boucharaba et al., Proc. Natl. Acad. Sci USA, 103, 96439648, 2006). В одном аспекте соединение 1 или его фармацевтически приемлемую соль (например, соединение 2) применяют в лечении рака. В одном аспекте соединение 1 или его фармацевтически приемлемую соль(например, соединение 2) применяют в лечение злокачественного и доброкачественного пролиферативного заболевания. В одном аспекте соединение 1 или его фармацевтически приемлемую соль (например,соединение 2) применяют для предупреждения или уменьшения пролиферации опухолевых клеток, инвазии и метастаз карцином, плевральной мезателиомы или перитонеальной мезателиомы, раковой боли,костных метастаз. В одном аспекте предложен способ лечения рака у млекопитающего, включающий введение млекопитающему соединения 1 или его фармацевтически приемлемой соли (например, соединения 2) и второго терапевтического агента, где второй терапевтический агент является противораковым агентом. В некоторых вариантах воплощения также применяется лучевая терапия. Типы рака включают, но без ограничений, твердые опухоли (такие как твердые опухоли мочевого пузыря, кишечника, мозга, молочной железы, эндометрия, сердца, почки, легкого, лимфатической ткани(лимфома), яичника, поджелудочной железы или других эндокринных органов (щитовидной железы),предстательной железы, кожи (меланома или базально-клеточный рак) или гематологический рак (такой как лейкемии) на любой стадии болезни с или без метастаз. Дополнительные неограничивающие примеры рака включают острый лимфобластный лейкоз, острый миелобластный лейкоз, адренокортикальную карциному, рак анального прохода, рак аппендикса,астроцитомы, базально-клеточную карциному, рак желчного протока, рак мочевого пузыря, рак кости(остеосаркому и злокачественные фиброзные гистиоцитомы), глиомы ствола мозга, опухоли головного мозга, опухоли головного и спинного мозга, рак молочной железы, бронхиальные опухоли, лимфому Беркитта, рак шейки матки, хронический лимфоцитарный лейкоз, хронический миелогенный лейкоз, рак толстой кишки, колоректальный рак, краниофарингиому, кожную Т-клеточную лимфому, эмбриональные опухоли, рак эндометрия, эпендимобластому, эпендимому, рак пищевода, опухоли семейства саркомы Юинга, рак глаз, ретинобластому, рак желчного пузыря, гастральный (желудка) рак, желудочнокишечную карциноидную опухоль, желудочно-кишечную стромальную опухоль (GIST), опухоль стромальных клеток желудочно-кишечного тракта, опухоль зародышевых клеток, глиому, лейкоз ворсистых клеток, рак головы и шеи, гепатоцеллюлярный (печени) рак, лимфому Ходжкина, гипофарингеальный рак, внутриглазную меланому, опухоли островковых клеток (эндокринной поджелудочной железы), саркому Капоши, рак почки, гистиоцитоз клеток Лангерганса, рак гортани, лейкоз, острый лимфобластный лейкоз, острый миелоидный лейкоз, хронический лимфоцитарный лейкоз, хронический миелогенный лейкоз, лейкоз ворсистых клеток, рак печени, немелкоклеточный рак легкого, мелкоклеточный рак легкого, лимфому Беркитта, кожную Т-клеточную лимфому, лимфому Ходжкина, неходжкинскую лимфому, лимфому, макроглобулинемию Вальденстрема, медуллобластому, медуллоэпителиому, меланому,мезотелиому, рак полости рта, хронический миелогенный лейкоз, миелоидный лейкоз, множественную миелому, рак носоглотки, нейробластому, неходжкинскую лимфому, немелкоклеточный рак легкого,внутриротовой рак, орофарингеальный рак, остеосаркому, злокачественную фиброзную гистиоцитому кости, рак яичников, эпителиальный рак яичников, опухоль зародышевых клеток яичников, опухоль- 10024967 яичников с низким злокачественным потенциалом, рак поджелудочной железы, папилломатоз, рак паращитовидной железы, рак полового члена, рак глотки, шишковидные паренхиматозные опухоли промежуточной дифференциации, пинеобластому и супратенториальные примитивные нейроэктодермальные опухоли, опухоль гипофиза, неоплазию плазматическими клетками/множественную миелому, плевролегочную бластому, первичную лимфому центральной нервной системы, рак предстательной железы, рак прямой кишки, почечно-клеточный (почки) рак, ретинобластому, рабдомиосаркому, рак слюнных желез,саркому, опухоли семейства саркомы Юинга, саркому Капоши, синдром Сезари, рак кожи, мелкоклеточный рак легкого, мелкоклеточный рак кишечника, саркому мягких тканей, плоскоклеточный рак, рак желудка (гастральный), супратенториальные примитивные нейроэктодермальные опухоли, Т-клеточную лимфому, тестикулярный рак, рак гортани, тимому и карциному тимуса, рак щитовидной железы, рак уретры, рак матки, саркому матки, рак влагалища, рак вульвы, макроглобулинемию Вальденстрема, опухоль Вильмса. В одном аспекте LPA участвует в патогенезе заболеваний дыхательных путей. Провоспалительные эффекты LPA включает дегрануляцию тучных клеток, сокращение гладкомышечных клеток и высвобождение цитокинов из дендритных клеток. LPA вызывает секрецию IL-8 бронхиальными эпителиальными клетками человека. IL-8 обнаруживается в повышенной концентрации в БАЛ жидкостях пациентов с астмой, хронической обструктивной болезнью легких, легочным саркоидозом и острым респираторным дистресс-синдромом и IL-8, как было показано, обостряет воспаление дыхательных путей и ремоделирование дыхательных путей у астматиков. Для всех рецепторов LPA1, LPA2 и LPA3 было показано, что они вносят вклад в LPA-индуцированную продукцию IL-8. Введение LPA in vivo вызывает гиперчувствительность дыхательных путей, ответы, провоцирующие зуд и расчесывание, инфильтрацию и активацию эозинофилов и нейтрофилов, ремоделирование сосудов и ноцицептивные реакции мышц-сгибателей. LPA также вызывает высвобождение гистамина из тучных клеток мыши и крысы. В одном аспекте эффекты LPA опосредованы LPA1 и/или LPA3. В одном аспекте соединение 1 или его фармацевтически приемлемую соль (например, соединение 2) применяют в лечении различных аллергических заболеваний у млекопитающих. В одном аспекте соединение 1 или его фармацевтически приемлемую соль (например, соединение 2) применяют в лечении респираторных заболеваний, расстройств или состояний у млекопитающих. В одном аспекте соединение 1 или его фармацевтически приемлемую соль (например, соединение 2) применяют в лечении астмы у млекопитающих. В одном аспекте соединение 1 или его фармацевтически приемлемую соль (например, соединение 2) применяют в лечении хронической астмы у млекопитающих. Термин "респираторное заболевание" при использовании здесь относится к заболеваниям органов,которые участвуют в дыхании, таких как нос, горло, гортань, евстахиевы трубы, трахея, бронхи, легкие,соответствующие мышцы (например, диафрагма и межреберные мышцы) и нервы. Респираторные заболевания включают, но не ограничиваются ими, астму, респираторный дистресс-синдром у взрослых и аллергическую (экзогенную) астму, неаллергическую (эндогенную) астму, острую тяжелую астму, хроническую астму, клиническую астму, ночную астму, аллерген-индуцированную астму, аспиринчувствительную астму, астму физического усилия, изокапническую гипервентиляцию, астму, начавшуюся в детстве, астму, начавшуюся во взрослом возрасте, кашлевую астму, профессиональную астму, устойчивую к стероидам астму, сезонную астму, сезонный аллергический ринит, круглогодичный аллергический ринит, хроническую обструктивную болезнь легких, в том числе хронический бронхит или эмфизему легких, легочную гипертензию, интерстициальный фиброз легкого и/или воспаление дыхательных путей и кистозный фиброз и гипоксию. В одном аспекте здесь предложено применение соединения 1 или его фармацевтически приемлемой соли (например, соединение 2) в лечении или профилактике хронической обструктивной болезни легких у млекопитающего, включающее введение млекопитающему по меньшей мере один раз эффективного количества соединения 1 или его фармацевтически приемлемой соли (например, соединения 2). Дополнительно хроническая обструктивная болезнь легких включает, но не ограничивается этим, хронический бронхит или эмфизему легких, легочную гипертензию, интерстициальный фиброз легкого и/или воспаление дыхательных путей и кистозный фиброз. Нервной системы является главным центром экспрессии LPA1. В одном аспекте предоставлено соединение 1 или его фармацевтически приемлемая соль (например, соединение 2) для применения в лечении или профилактике расстройства нервной системы у млекопитающего. Термин "расстройство нервной системы" при использовании здесь включает, но не ограничиваясь этим, болезнь Альцгеймера, отек мозга, церебральной ишемию, инсульт, рассеянный склероз, нейропатию, болезнь Паркинсона, рассеянный склероз, ишемию сетчатки, послеоперационную когнитивную дисфункцию, мигрень, периферическую невропатию/невропатическую боль, повреждение спинного мозга, отек мозга и травму головы. Ангиогенез, формирование новой капиллярной сети из уже существующей сосудистой сети, в норме запускается при заживлении ран, росте тканей и миокардиальном ангиогенезе после ишемического повреждения. Пептидные факторы роста и лизофосфолипиды контролируют согласованнную пролиферацию, миграцию, адгезию, дифференцировку и сборку сосудистых эндотелиальных клеток (СЭК) и окружающих сосудистых гладкомышечных клеток (СГМК). В одном аспекте дисрегуляция процессов, опо- 11024967 средующих ангиогенез, приводит к развитию атеросклероза, гипертензии, росту опухоли, ревматоидному артриту и диабетической ретинопатии. В одном аспекте соединение 1 или его фармацевтически приемлемую соль (например, соединение 2) применяют для лечения или профилактики сердечно-сосудистых заболеваний у млекопитающего, в том числе, но не ограничиваясь этим: аритмии (предсердий и/или желудочков); атеросклероза и его осложнений; стенокардии; нарушений ритма сердца, ишемии миокарда, инфаркта миокарда, сердечной или сосудистой аневризмы; васкулита, инсульта; периферийной обструктивной артериопатии конечности,органа или ткани; реперфузионного повреждения после ишемии головного мозга, сердца, почек или другого органа или ткани; эндотоксического, хирургического или травматического шока; гипертонии, порока сердца, сердечной недостаточности, нарушения кровяного давления; шока; вазоконстрикции (в том числе связанной с мигренью); сосудистой аномалии, воспаления, недостаточности, ограниченных одним органом или тканью. В одном аспекте здесь представлены способы профилактики или лечения вазоконстрикции, атеросклероза и его осложнений, ишемии миокарда, инфаркта миокарда, аневризма аорты, васкулита и инсульта, включающие введение млекопитающему по меньшей мере один раз эффективного количества соединения 1 или его фармацевтически приемлемой соли (например, соединения 2). В некоторых вариантах воплощения LPA антагонист, раскрытый здесь, применяется для лечения синдрома Рейно. Феномен Рейно включает в себя как болезнь Рейно (где этот феномен является идиопатическим) и синдром Рейно, который вызван каким-либо другим провоцирующим фактором. В одном аспекте здесь представлены способы снижения сердечной реперфузии после ишемии миокарда и/или эндотоксического шока, включающие введение млекопитающему по меньшей мере один раз эффективного количества соединения 1 или его фармацевтически приемлемой соли (например, соединения 2). В одном аспекте здесь представлены способы снижения констрикции кровеносных сосудов у млекопитающего, включающие введение млекопитающему по меньшей мере один раз эффективного количества соединения 1 или его фармацевтически приемлемой соли (например, соединения 2). В одном аспекте здесь представлены способы снижения или предотвращения повышения кровяного давления у млекопитающего, включающие введение млекопитающему по меньшей мере один раз эффективного количества соединения 1 или его фармацевтически приемлемой соли (например, соединения 2).LPA связан с различными воспалительными/иммунными заболеваниями. В одном аспекте соединение 1 или его фармацевтически приемлемую соль (например, соединение 2) применяют для лечения или предотвращения воспаления у млекопитающего. В одном аспекте антагонисты LPA1 и/или LPA3 находят применение в лечении или профилактике воспалительных/иммунных расстройств у млекопитающего. Примеры воспалительных/иммунных расстройств включают псориаз, ревматоидный артрит, васкулит, воспалительное заболевание кишечника, дерматит, остеоартрит, астму, воспалительное заболевание мышц, аллергический ринит, вагинит, интерстициальный цистит, склеродермию, экзему, аллогенную или ксеногенную трансплантацию (органа, костного мозга, стволовых клеток и других клеток и тканей),отторжение трансплантата, реакцию "трансплантат-против-хозяина", красную волчанку, воспалительное заболевание, диабет I типа, фиброз легких, дерматомиозит, синдром Шегрена, тиреоидит (например,Хашимото и аутоиммунный тиреоидит), миастению гравис, аутоиммунную гемолитическую анемию,рассеянный склероз, муковисцидоз, хронический рецидивирующий гепатит, первичный билиарный цирроз, аллергический конъюнктивит и аллергический дерматит. В соответствии с одним из аспектов предложены способы лечения, профилактики, обращения, приостановки или замедления прогрессирования LPA-зависимого или LPA-опосредованного заболевания или состояния, когда они становятся клинически очевидными, или лечения симптомов, ассоциированных или связанных с LPA-зависимыми или LPA-опосредованными заболеваниями или состояниями, путем введения млекопитающему соединения 1 или его фармацевтически приемлемой соли (например, соединения 2). В некоторых воплощениях субъект уже имеет LPA-зависимое или LPA-опосредованное заболевание или состояние в момент введения или подвержен риску развития LPA-зависимого или LPAопосредованного заболевания или состояния. В некоторых аспектах предложены способы предотвращения или лечения рекрутинга эозинофилов,и/или базофилов, и/или дендритных клеток, и/или нейтрофилов, и/или моноцитов, и/или Т-клеток, включающие введение млекопитающему по меньшей мере один раз эффективного количества соединения 1 или его фармацевтически приемлемой соли (например, соединения 2). В некоторых аспектах предложены способы лечения цистита, в том числе, например, интерстициального цистита, включающие введение млекопитающему по меньшей мере один раз терапевтически эффективного количества соединения 1 или его фармацевтически приемлемой соли (например, соединения 2). В соответствии с одним из аспектов способы, описанные здесь, включают диагностирование или определение того, является ли или нет пациент, страдающим от LPA-зависимого или LPAопосредованного заболевания или состояния, путем введения субъекту терапевтически эффективного количества соединения 1 или его фармацевтически приемлемой соли (например, соединения 2) и опреде- 12024967 ления того, реагирует или нет пациент на лечение. В одном аспекте в настоящем документе предполагается соединение 1, его фармацевтически приемлемые соли, фармацевтически приемлемые пролекарства и фармацевтически приемлемые сольваты,которое является антагонистом по меньшей мере одного LPA рецептора (например, LPA1, LPA2, LPA3) и применяется для лечения пациентов, страдающих от одного или более LPA-зависимых или LPAопосредованных состояний или заболеваний, включая, но не ограничиваясь этим, фиброз легких, фиброз почки, фиброз печени, рубцевание, склеродермию, астму, ринит, хроническое обструктивное заболевание легких, легочную гипертензию, интерстициальный фиброз легкого, артрит, аллергию, псориаз, воспалительное заболевания кишечника, респираторный дистресс-синдром у взрослых, инфаркт миокарда,аневризму, инсульт, рак, боль, пролиферативные заболевания и воспалительные состояния. В некоторых вариантах воплощения LPA-зависимые состояния или заболевания включают те, при которых присутствует и/или наблюдается абсолютный или относительный избыток LPA. В любом из вышеупомянутых аспектов LPA-зависимые или LPA-опосредованные заболевания или состояния включают, но не ограничиваются ими, фиброз органа, фиброз ткани, астму, аллергические заболевания, хронические обструктивные заболевания легких, легочную гипертензию, легочный или плевральной фиброз, перитонеальный фиброз, артрит, аллергию, рак, сердечно-сосудистые заболевания,респираторный дистресс-синдром у взрослых, инфаркт миокарда, аневризму, инсульт и рак. В одном аспекте соединение 1 или его фармацевтически приемлемую соль (например, соединение 2) применяют для улучшения чувствительности роговицы, снижение которой вызвано такими операциями на роговице, как лазерный in situ в кератомилез (LASIK) или операцией по удалению катаракты, для улучшения чувствительности роговицы, снижение которой вызвано дегенерацией роговицы и симптомом сухого глаза, имеющих те же причины. В одном аспекте здесь представлено применение соединения 1 или его фармацевтически приемлемой соли (например, соединение 2) при лечении или профилактике воспаления глаз и аллергического конъюнктивита, весеннего кератоконъюнктивита и папиллярного конъюнктивита у млекопитающего. В одном аспекте здесь представлено применение соединения или его фармацевтически приемлемой соли (например, соединение 2) при лечении или профилактике болезни Шегрена или воспалительного заболевания, сопровождающегося сухостью глаз у млекопитающего. В одном аспекте LPA и LPA рецепторы (например, LPA1) участвуют в патогенезе остеоартрита. В одном аспекте здесь предложено применение соединения 1 или его фармацевтически приемлемой соли(например, соединения 2) при лечении или профилактике остеоартрита у млекопитающего. В одном аспекте LPA рецепторы (например, LPA1, LPA3) участвуют в патогенезе ревматоидного артрита. В одном аспекте здесь представлено применение соединения 1 или его фармацевтически приемлемой соли (например, соединения 2) при лечении или профилактике ревматоидного артрита у млекопитающего. В одном аспекте LPA рецепторы (например, LPA1) участвуют в адипогенезе. В одном аспекте представлено применение соединения 1 или его фармацевтически приемлемой соли (например, соединения 2) для стимулирования формирования жировой ткани у млекопитающего.В одном аспекте соединение 1 или его фармацевтически приемлемую соль (например, соединение 2) применяют для лечения феномена Рейно у млекопитающего. Феномен Рейно включает в себя как болезнь Рейно (где это явление является идиопатическим) и синдром Рейно, который вызван каким-либо провоцирующим фактор. В одном варианте осуществления предложен способ приготовления кристаллической 1-4'-[3 метил-4-R)-1-фенил-этоксикарбониламино)изоксазол-5-ил]бифенил-4-илциклопропанкарбоновой кислоты (соединения 1), включающий выделение соединения 1 из этанола, метанола, 2-метоксиэтанола,этанола, 1-пропанола, 2-пропанола, 1-бутанола, бутил ацетата, ацетона, метилэтилкетона, анизола, толуола, нитрометана, ацетонитрила, этил ацетата, кумола, 1-4-диоксана или тетрагидрофурана. В одном варианте осуществления предложен способ приготовления кристаллической натриевой соли 1-4'-[3-метил-4-R)-1-фенил-этоксикарбониламино)изоксазол-5-ил]бифенил-4-илциклопропанкарбоновой кислоты (соединения 2), включающий выделение соединение 2 из(vii) этанола и гептана. В одном варианте осуществления предложен способ приготовления 1-4'-[3-метил-4-R)-1-фенилэтоксикарбониламино)изоксазол-5-ил]бифенил-4-илциклопропанкарбоновой кислоты (соединение 1),включающий стадии:(1) обработки соединения формулы XVIII дифенилфосфорил азидом в присутствии (R)-(+)-1 фенилэтанола где R1 представляет собой C1-С 6 алкил; получая соединение формулы X(2) гидролиза эфирной группы соединения формулы X с получением соединения 1. В некоторых вариантах осуществления стадия (2) включает обработку соединения формулы X гидроксидом натрия в подходящем растворителе с последующей корректировкой рН. В одном варианте осуществления предложен способ приготовления 1-4'-[3-метил-4-R)-1-фенилэтоксикарбониламино)изоксазол-5-ил]бифенил-4-илциклопропанкарбоновой кислоты (соединения 1),включающий стадии(1) взаимодействия соединения формулы VII где R1 представляет собой C1-С 6 алкил; и В представляет собой бороновую кислоту или боронатный эфир; в присутствии катализатора присоединения, подходящего основания и в подходящем растворителе с получением соединения формулы X(2) гидролиза эфирной группы соединения формулы X с получением соединения 1. В другом варианте осуществления предложен способ приготовления 1-4'-[3-метил-4-R)-1-фенилэтоксикарбониламино)изоксазол-5-ил]бифенил-4-илциклопропанкарбоновой кислоты (соединения 1),включающий стадии(1) взаимодействия соединения формулы IX где В представляет собой бороновую кислоту или боронатный эфир; с соединением формулы XII где R представляет собой С 1-С 6 алкил; а X является уходящей группой; в присутствии катализатора присоединения, подходящего основания и в подходящем растворителе с получением соединения формулы X(2) гидролиза эфирной группы соединения формулы X с получением соединения 1. В некоторых вариантах осуществления катализатор присоединения представляет собой палладиевый катализатор. В некоторых вариантах осуществления палладиевый катализатор представляет собой тетракис(трифенилфосфин)палладий или (1,1'-бис(дифенилфосфино)ферроцен)дихлорпалладий(II). В некоторых вариантах осуществления R1 представляет собой -СН 3 или -СН 2 СН 3. В некоторых вариантах осуществления подходящим основанием является триэтиламин, диизопропилэтиламин, 1,2,2,6,6-пентаметилпиперидин, трибутиламин, бикарбонат натрия, бикарбонат калия, карбонат натрия, карбонат калия, карбонат цезия, ацетат натрия, ацетат калия, фосфат натрия или фосфат калия. В некоторых вариантах осуществления подходящим растворителем является тетрагидрофуран, диоксан, вода или их комбинации. В некоторых вариантах осуществления X выбран из Cl, Br, I, -OSO2CF3, -OSO2(4-метилфенила), OSO2(фенила) и -OSO2CH3. В некоторых вариантах осуществления X представляет собой Br. В некоторых вариантах осуществления В представляет собой. В некоторых вариантах осуществления В представляет. В некоторых вариантах осуществления В представляет собой В некоторых вариантах осуществления стадия (1) дополнительно включает выделение соединения формулы X перед стадией (2). В некоторых вариантах осуществления стадия (1) дополнительно включает стадию очистки для уменьшения количества палладия до менее чем 20 ppm. Описанный способ обеспечивает синтез соединения 1 и его фармацевтически приемлемых солей(например, соединения 2). Способ, описанный здесь, может быть, в частности, применен к химическому приготовлению соединения 1 и его фармацевтически приемлемой соли в больших масштабах. Здесь описаны композиции, фармацевтические композиции, способы лечения, способы разработки,способы получения, способы производства, стратегии лечения, фармакокинетические стратегии с использованием соединения 1 или его фармацевтически приемлемых солей. Соединение 1 и его фармацевтически приемлемые соли."1-4'-[3-метил-4-R)-1-фенил-этоксикарбониламино)изоксазол-5-ил]бифенил-4-илциклопропанкарбоновая кислота," "(R)-1-фенилэтил-5-(4-бифенил-4-циклопропанкарбоновая кислота)-3-метилизоксазол-4-ил карбамат" или любое другое подобное наименование относятся к соединению со следующей структурой: В некоторых вариантах воплощения соединение 1, по существу, не содержит S-изомеров."По существу, не содержит" в отношении энантиомеров означает, что упомянутый энантиомер не содержится или составляет менее 5, менее 4, менее 3, менее 2 или менее 1% упомянутого энатиомера."(R)-1 фенилэтил-5-(4-бифенил-4-циклопропанкарбоновая кислота)-3-метилизоксазол-4-ил карбамата натриевая соль", или любое другое подобное наименование относится к соединению со следующей структурой: В некоторых вариантах воплощения соединение 2, по существу, не содержит S-изомеров. Из соединения 1 образуется большое множество фармацевтически приемлемых солей, включая соли, образованные при замещении протона кислотной группы карбоновой кислоты соединения 1 ионом металла, таким как, например, ион щелочного металла (например, лития, натрия, калия), ионом щелочно-земельного металла (например, магния или калия) или ионом алюминия, либо замещается катионом аммония (NH4+); соли, образованные путем взаимодействия соединения 1 с фармацевтически приемлемым органическим основанием, включая алкиламины, такие как холин, этаноламин, диэтаноламин, триэтаноламин,трометамин, N-метилглюкамин, дициклогексиламин, трис(гидроксиметил)метиламин, и соли с аминокислотами, такими как аргинин, лизин и т. п. В некоторых вариантах воплощения соединение 1 обрабатывают аминокислотой для получения соли. В другом варианте воплощения соединение 1 обрабатывают холином, этаноламином, диэтаноламином, триэтаноламином, трометамином, N-метилглюкамином, аргинином, лизином, аммония гидроксидом, кальция гидроксидом, калия гидроксидом, натрия карбонатом, натрия гидроксидом и т. п. для образования соли. Термин "фармацевтически приемлемая соль" в отношении соединения 1 относится к соли соединения 1, которая не вызывает значительного раздражения у млекопитающих при введении им и, по существу, не аннулирует биологическую активность и свойства соединения. В некоторых вариантах воплощения фармацевтически приемлемая соль соединения 1 является солью лития, солью натрия, солью калия,соль магния, солью кальция, солью аммония, солью холина, солью этаноламина, солью диэтаноламина,солью триэтаноламина, солью трометамина, солью N-метилглюкамина, солью дициклогексиламина, солью трис(гидроксиметил)метиламина, солью аргинина или солью лизина. В некоторых вариантах воплощения фармацевтически приемлемая соль соединения 1 является солью натрия. Следует понимать, что фармацевтически приемлемая соль включает формы присоединения растворителя (сольваты). Сольваты включают стехиометрические или нестехиометрические количества растворителя и формируются в процессе образования продукта или выделения с фармацевтически приемлемыми растворителями, такими как вода, этанол, метил-трет-бутиловый эфир, изопропанол, ацетонитрил,гептан и т. п. В одном аспекте сольваты формируются с использованием, но не ограничиваясь этим, растворителя (растворителями) класса 3. Категории растворителей определяются, например, на Международной конференции по гармонизации технических требований к регистрации лекарственных препаратов для человека (ICH), "Impurities: Guidelines for Residual Solvents, Q3C(R3)", (ноябрь 2005 года). Гидраты образуются в случае, если растворителем является вода, или образуются алкоголяты в случае, если растворителем является спирт. В одном варианте осуществления сольваты соединения 1 или его фармацевтически приемлемые соли обычно получаются или образуются в процессах, описанных в данном документе. Кроме того, соединение 1 или его фармацевтически приемлемые соли могут существовать в несольватированной форме. В некоторых вариантах воплощения соединение 1 или его фармацевтически приемлемые соли гидратировано. В некоторых вариантах воплощения соединение 2 гидратировано. В некоторых вариантах воплощения соединение 2 представляет собой моногидрат. В еще других вариантах соединение 1 или его фармацевтически приемлемую соль (например, соединение 2) получают в различных формах, включая, но не ограничиваясь этим, аморфную фазу, измельченные формы, и формах нано-частиц. Аморфное соединение 1. В некоторых вариантах воплощения соединение 1 является аморфным. В некоторых вариантах воплощения аморфная фаза соединения 1 имеет диаграмму XRPD, показывающую отсутствие кристалличности. Соединение 1 - структура 1.- 16024967 В некоторых вариантах воплощения соединение 1 является кристаллическим. В некоторых вариантах воплощения соединение 1 представляет собой кристаллическую структуру 1. Кристаллическая структура 1 соединения 1 характеризуется как имеющая:(a) диаграмму порошковой рентгеновской дифракции (XRPD) с характеристическими пиками 4,7 2-Тета, 9,4 2-Тета, 14,5 2-Тета и 21,0 2-Тета;(b) диаграмму порошковой рентгеновской дифракции (XRPD), по существу, такую как показанная на фиг. 1;(d) кривую ДСК или термогравиметрического анализа (ТГА), по существу, подобную показанной на фиг. 2 и 3;(e) по существу, такую же диаграмму порошковой рентгеновской дифракции (XRPD) после хранения при 40 С/75% относительной влажности в течение одной недели;(g) комбинации указанного. В некоторых вариантах воплощения кристаллическая форма соединения 1, по существу, не содержит S-изомеров. В некоторых вариантах воплощения кристаллическая форма соединения 1, по существу,не содержит аморфного соединения 1. В некоторых вариантах воплощения кристаллическая форма соединения 1 кристаллизована из этанола, метанола, 2-метоксиэтанола, этанола, 1-пропанола, 2-пропанола, 1-бутанола, бутилацетата, ацетона, метилэтилкетона, анизола, толуола, нитрометана, ацетонитрила, этилацетата, кумола, 1-4-диоксана,тетрагидрофурана, дихлорметана, гептана или комбинаций указанного. В некоторых вариантах воплощения кристаллическая структура 1 соединения 1 характеризуется как имеющая по меньшей мере одно свойство, выбранное из (а)-(f). В некоторых вариантах воплощения кристаллическая структура 1 соединения 1 характеризуется как имеющая по меньшей мере два свойства,выбранных из (а)-(f). В некоторых вариантах воплощения кристаллическая структура 1 соединения 1 характеризуется как имеющая по меньшей мере три свойства, выбранных из (а)-(f). В некоторых вариантах воплощения кристаллическая структура 1 соединения 1 характеризуется как имеющая по меньшей мере четыре свойства, выбранных из (а)-(f). В некоторых вариантах воплощения кристаллическая структура 1 соединения 1 характеризуется как имеющая по меньшей мере пять свойств, выбранных из (а)-(f). В некоторых вариантах воплощения кристаллическая структура 1 соединения 1 характеризуется как имеющая свойства (а), (b), (с), (d), (e) и (f). В некоторых вариантах воплощения кристаллическое соединение 1 имеет диаграмму порошковой рентгеновской дифракции (XRPD) с характеристическими пиками 4,7 2-Тета, 9,4 2-Тета, 14,5 2-Тета и 21,0 2-Тета. В некоторых вариантах воплощения кристаллическое соединение 1 имеет диаграмму порошковой рентгеновской дифракции (XRPD), по существу, такую же как XRPD, показанная на фиг. 1. В некоторых вариантах воплощения кристаллическое соединение 1 имеет термограмму ДСК с эндотермой приблизительно 172-176 С. В некоторых вариантах воплощения кристаллическое соединение 1 имеет кривую ДСК или термогравиметрического анализа (ТГА), по существу, подобную показанной на фиг. 2 или 3. В некоторых вариантах воплощения кристаллическое соединение 1 имеет, по существу, такую же диаграмму порошковой рентгеновской дифракции (XRPD) после хранения при 40 С/75% относительной влажности в течение одной недели. В одном варианте воплощения кристаллическая структура 1 соединения 1 характеризуется параметрами элементарной ячейки, приблизительно равными при температуре 25 С следующим: В следующем варианте воплощения кристаллическая структура 1 соединения 1 характеризуется дробными атомными координатами, по существу, такими же, как перечисленные в табл.2. Соединение 1 - структура 2. В некоторых вариантах воплощения соединение 1 является кристаллическим. В некоторых вариантах воплощения соединение 1 представляет собой кристаллическую структуру 2. Кристаллическая структура 2 соединения 1 характеризуется как имеющая:(a) диаграмму порошковой рентгеновской дифракции (XRPD), по существу, такую как XRPD, показанная на фиг. 12;(b) диаграмму порошковой рентгеновской дифракции (XRPD) с характеристическими пиками 6,3 2-Тета, 12,8 2-Тета, 16,4 2-Тета, 17,0 2-Тета и 19,7 2-Тета;(c) параметры элементарной ячейки, приблизительно равные при 25 С следующим:(d) комбинации указанного. В некоторых вариантах воплощения кристаллическая структура 2 соединения 1 характеризуется как имеющая по меньшей мере одно свойство, выбранное из (а)-(с). В некоторых вариантах воплощения кристаллическая структура 2 соединения 1 характеризуется как имеющая по меньшей мере два свойства,выбранные из (а)-(с). В некоторых вариантах воплощения кристаллическая структура 2 соединения 1 характеризуется как имеющая свойства (а), (b) и (с). В некоторых вариантах воплощения кристаллическая форма соединения 1, по существу, не содержит S-изомеров. В некоторых вариантах воплощения кристаллическая форма соединения 1, по существу,не содержит аморфного соединения 1. В некоторых вариантах воплощения кристаллическая форма соединения 1 имеет диаграмму порошковой рентгеновской дифракции (XRPD), по существу, такую же какXRPD, показанная на фиг. 12. В некоторых вариантах воплощения кристаллическая форма соединения 1 имеет диаграмму порошковой рентгеновской дифракции (XRPD) с характеристическими пиками 6,3 2 Тета, 12,8 2-Тета, 16,4 2-Тета, 17,0 2-Тета и 19,7 2-Тета. В одном варианте воплощения кристаллическая структура 2 соединения 1 характеризуется параметрами элементарной ячейки, приблизительно равными при 25 С следующим: В следующем варианте воплощения кристаллическая структура 2 соединения 1 характеризуется дробными атомными координатами, по существу, такими же, как перечисленные в табл.4. Соединение 1 - структура 3. В некоторых вариантах воплощения соединение 1 является кристаллическим. В некоторых вариантах воплощения соединение 1 представляет собой кристаллическую структуру 3. Кристаллическая структура 3 соединения 1 характеризуется как имеющая:(a) диаграмму порошковой рентгеновской дифракции (XRPD), по существу, такую как XRPD, показанная на фиг. 13;(b) диаграмму порошковой рентгеновской дифракции (XRPD) с характеристическими пиками 5,5 2-Тета, 5,9 2-Тета, 12,6 2-Тета и 16,7 2-Тета;(c) параметры элементарной ячейки, приблизительно равные при 25 С следующим:(d) комбинации указанных. В некоторых вариантах воплощения кристаллическая структура 3 соединения 1 характеризуется как имеющая по меньшей мере одно свойство, выбранное из (а)-(с). В некоторых вариантах воплощения кристаллическая структура 3 соединения 1 характеризуется как имеющая по меньшей мере два свойства,выбранные из (а)-(с). В некоторых вариантах воплощения кристаллическая структура 3 соединения 1 характеризуется как имеющая свойства (а), (b) и (с). В некоторых вариантах воплощения кристаллическая форма соединения 1, по существу, не содержит S-изомеров. В некоторых вариантах воплощения кристаллическая форма соединения 1, по существу,не содержит аморфного соединения 1. В некоторых вариантах воплощения кристаллическая форма соединения 1 имеет диаграмму порошковой рентгеновской дифракции (XRPD), по существу, такую же какXRPD, показанная на фиг. 13. В некоторых вариантах воплощения кристаллическая форма соединения 1 имеет диаграмму порошковой рентгеновской дифракции (XRPD) с характеристическими пиками 5,5 2 Тета, 5,9 2-Тета, 12,6 2-Тета, 16,7 2-Тета. В одном варианте воплощения кристаллическая структура 3 соединения 1 характеризуется параметрами элементарной ячейки, приблизительно равными при 25 С следующим: В следующем варианте воплощения кристаллическая структура 2 соединения 1 характеризуется дробными атомными координатами, по существу, такими же, как перечисленные в табл.6. Аморфное соединение 2. В некоторых вариантах воплощения соединение 2 является аморфным. В некоторых вариантах воплощения аморфная фаза соединения 2 имеет диаграмму XRPD, показывающую отсутствие кристалличности. В некоторых вариантах воплощения соединение 2 является аморфным и имеет диаграмму порошковой рентгеновской дифракции (XRPD), по существу, такую же, как показано на фиг. 10. В некоторых вариантах воплощения соединение 2 является аморфным и имеет кривую ДСК, по существу, подобную показанной на фиг. 11. Соединение 2 - структура 1. В некоторых вариантах воплощения соединение 2 является кристаллическим. В некоторых вариантах воплощения соединение 2 является кристаллическим и гидратированным. В некоторых вариантах воплощения соединение 2 представляет собой кристаллическую структуру 1. В некоторых вариантах воплощения описана гидратированная кристаллическая форма соединения 2(структура 1), где гидратированная кристаллическая форма соединения 2:(a) имеет диаграмму порошковой рентгеновской дифракции (XRPD) с характеристическими пиками 13.2 2-Тета, 17.2 2-Тета, 19.3 2-Тета, 22.4 2-Тета и 25.6 2-Тета;(b) имеет диаграмму порошковой рентгеновской дифракции (XRPD), по существу, такую же, как показано на фиг. 4;(c) имеет кривую термогравиметрического анализа (ТГА) или ДСК, по существу, подобную показанной на фиг. 5 и 6;(d) имеет инфракрасный спектр, по существу, подобный показанному на фиг. 7;(e) получена из метил этил кетона, ацетонитрила, 1,4-диоксана/трет-бутил метилового эфира, метил этил кетона (MEK)/трет-бутил метила или этанола/гептана;(f) имеет параметры элементарной ячейки, по существу, равные при 25 С следующим:(g) комбинации указанного. В некоторых вариантах воплощения гидратированная кристаллическая форма соединения 2 (структура 1) характеризуется как имеющая по меньшей мере одно свойство, выбранное из (a)-(f). В некоторых вариантах воплощения гидратированная кристаллическая форма соединения 2 (структура 1) характеризуется как имеющая по меньшей мере два свойства, выбранных из (a)-(f). В некоторых вариантах вопло- 20024967 щения гидратированная кристаллическая форма соединения 2 (структура 1) характеризуется как имеющая по меньшей мере три свойства, выбранных из (a)-(f). В некоторых вариантах воплощения гидратированная кристаллическая форма соединения 2 (структура 1) характеризуется как имеющая по меньшей мере три свойства, выбранных из (a)-(f). В некоторых вариантах воплощения кристаллическое соединение 2 (структура 1) имеет диаграмму порошковой рентгеновской дифракции (XRPD) с характеристическими пиками 13,2 2-Тета, 17,2 2-Тета,19,3 2-Тета, 22,4 2-Тета и 25,6 2-Тета. В некоторых вариантах воплощения кристаллическое соединение 2 (структура 1) имеет диаграмму порошковой рентгеновской дифракции, по существу, такую же, как показанная на фиг. 4. В некоторых вариантах воплощения кристаллическое соединение 2 (структура 1) имеет кривую термогравиметрического анализа (ТГА) или ДСК, по существу, подобную показанным на фиг. 5 и 6. В некоторых вариантах воплощения кристаллическое соединение 2 (структура 1) имеет кривую термогравиметрического анализа (ТГА), по существу, подобную показанной на фиг. 5. В некоторых вариантах воплощения кристаллическое соединение 2 (структура 1) имеет кривую ДСК, по существу, подобную показанной на фиг. 6. В некоторых вариантах воплощения кристаллическое соединение 2 (структура 1) имеет инфракрасный спектр, по существу, подобный показанному на фиг. 7. В некоторых вариантах воплощения кристаллическое соединение 2 (структура 1) получено из метилэтилкетона, ацетонитрила, 1,4-диоксана/трет-бутилметилового эфира, метилэтилкетона (MEK)/третбутилметила или этанола/гептанов. В некоторых вариантах воплощения кристаллическая структура 1 соединения 2 получена из:(vii) этанола и гептана. В одном варианте воплощения кристаллическая структура 1 соединения 2 характеризуется параметрами элементарной ячейки, приблизительно равными при 25 С следующим: В следующем варианте воплощения кристаллическая структура 2 соединения 1 характеризуется дробными атомными координатами, по существу, такими же, как перечисленные в табл. 8. Соединение 2 - структура 2. В некоторых вариантах воплощения соединение 2 является кристаллическим. В некоторых вариантах соединение 2 представляет собой кристаллическую структуру 2. В некоторых вариантах соединение 2 является кристаллическим и имеет диаграмму порошковой рентгеновской дифракции (XRPD), по существу, такую же, как показано на фиг. 8. Соединение 2 - структура 3. В некоторых вариантах воплощения соединение 2 является кристаллическим. В некоторых вариантах соединение 2 представляет собой кристаллическую структуру 3. В некоторых вариантах соединение 2 является кристаллическим и имеет диаграмму порошковой рентгеновской дифракции (XRPD), по существу, такую же, как показано на фиг. 9. Синтез соединения 1 и его фармацевтически приемлемых солей. Соединение 1 и его фармацевтически приемлемая соль (например, соединение 2) синтезированы в соответствии с описанным в настоящем документе. Кроме того, растворители, температуры и другие условия реакция, представленные здесь, могут варьировать. Исходные материалы, использованные для синтеза, синтезируют либо получают из коммерческих источников, таких как, но без ограничений, Sigma-Aldrich, Fluka, Acros Organics, Alfa Aesar, VWR Scien- 21024967tific и т. п. Общие способы приготовления соединений могут быть изменены путем использования подходящих реагентов и условия для введения различных групп, находящихся в структурах, предложенных здесь. В одном аспекте получение соединения 1 или его фармацевтически приемлемых солей (например,натриевой соли) начинают со стадий, изображенных на схеме 1. Схема 1 В одном аспекте синтез соединения 1 начинают с реакции алкил ацетоацетата с метиламином, получая соединение со структурой II. Соединения со структурой II взаимодействуют с 4-замещенным бензоил хлоридом (структура III), обеспечивая получение соединений со структурой IV. X представляет собой галогенид, трифлат или любую другую подходящую уходящую группу для использовании в реакции присоединения Сузуки. В некоторых вариантах осуществления X представлет собой Cl, Br, I, OSO2CF3,OSO2(4-метилфенил) и OSO2CH3. В некоторых вариантах осуществления X представляет собой галогенид. В некоторых вариантах осуществления X представляет собой Br. R1 представляет собой алкил или бензил. В некоторых вариантах осуществления R2 представляет собой метил, этил, пропил или бензил. Другие рассматриваемые алкилацетоацетаты включают этил ацетоацетат, изопропилацетоацетат, бензилацетоацетат. Обработка соединений со структурой IV гидроксил амином и уксусной кислотой обеспечивает получение изоксазолов со структурой V. Изоксазолы со структурой V используют в соответствии со схемой 2. Схема 2 Гидролиз эфирной группы изоксазолов со структурой V обеспечивает карбоновые кислоты со структурой VI. Гидролиз также может быть осуществлен с использованием подходящих оснований, таких как гидроксид лития или гидроксид натрия. Подходящие растворители для гидролиза включают воду, метанол, этанол, тетрагидрофуран или их комбинации. Перегруппировка Курциуса карбоновых кислот со структурой VI в присутствии (R)-1-фенилэтилового спирта обеспечивает получение карбаматных соединений со структурой VII. Схема 3 В некоторых вариантах осуществления реакция Сузуки между соединениями со структурой VII и соединениями со структурой VIII используется для получения соединений со структурой X. В некоторых вариантах осуществления R1 представляет собой алкил. В некоторых вариантах осуществления В представляет собой бороновую кислоту или бороновый эфир. В некоторых вариантах осуществления X представляет собой. В некоторых вариантах осуществления X представляет собой Cl, Br, I, OSO2CF3, OSO2(4-метилфенил) и OSO2CH3. В некоторых вариантах осуществления X представляет собой галогенид. В некоторых вариантах осуществления X представляет собой Br. В некоторых вариантах осуществления реакция Сузуки включает использование палладиевого катализатора, подходящего основания и подходящего растворителя. В некоторых вариантах осуществления палладиевый катализатор представляет собой фосфинсодержащий палладиевый катализатор. В некоторых вариантах осуществления палладиевый катализатор представляет собой Pd(PPh3)4 или Pd(dppf)Cl2. В неко- 22024967 торых вариантах осуществления подходящим основанием для реакции Сузуки является неорганическое основание. В некоторых вариантах осуществления подходящим основанием для реакции Сузуки является триэтиламин, диизопропилэтиламин, 1,2,2,6,6-пентаметилпиперидин, трибутиламин, бикарбонат натрия, Na2CO3, K2CO3, CS2CO3, NaOAc, KOAc, Na3PO4 или K3PO4. Для приготовления соединений со структурой X известны другие металл-опосредованные реакции сочетания. Другие металл-опосредованные реакции сочетания для образования биарилов включают, но не ограничиваются этим, реакции Сузуки, реакции кросс-сочетания Стилла, сочетания Негиши, сочетания Кумада, реакции Ульмана, сочетания Хияма и их варианты (Metal-Catalyzed Cross-Coupling Reactions,Armin de Meijere (Editor), Francois Diederich (Editor), John WileySons; 2nd edition, 2004; Ozdemir, et al.,Tetrahedron, 2005, 61, 9791-9798; Ackermann, et al., Org. Lett., 2006, 8, 3457-3460; Blakey, et al., J. Am.Chem. Soc, 2003, 125, 6046-6047; Dai, et al., Org. Lett., 2004, 6, 221-224; Yoshikai, et al., J. Am. Chem. Soc,2005, 127, 17978-17979; Tang, et al., J. Org. Chem., 2006, 71, 2167-2169; Murata, et al., Synthesis, 2001, 22312233). В некоторых вариантах осуществления соединения со структурой VIII приготавливают в соответствии со схемой 4. Схема 4 В некоторых вариантах осуществления соединения со структурой XI обрабатывают дигалогеналкил соединением, таким как 1,2-дибромэтан, для образования циклоалкил группы. Цианогруппа гидролизуется до кислоты, из которой формируется сложный эфир с получением трициклических соединений со структурой XII. В некоторых вариантах осуществления соединения со структурой XII взаимодействуют с борилирующим агентом с использованием условий переходный металл-опосредованной реакции перемещения и с образованием боронатных соединений со структурой VII. В некоторых вариантах осуществления R1 представляет собой этил. В некоторых вариантах осуществления X представляет собой галогенид. В некоторых вариантах осуществления X представляет собой Br. Схема 5 В некоторых вариантах осуществления соединения со структурой VII взаимодействуют с борилирующим агентом, применяя условия переходный металл-опосредованной реакции, с образованием боронатных соединений структуры IX. В некоторых вариантах осуществления борилирующая реакция с образованием IX включает применение палладиевого катализатора, такого как Pd(PPh3)4 или Pd(dppf)Cl2, в присутствии подходящего основания, такого как ацетат калия. В некоторых вариантах осуществления борилирующий реагент выбран среди пинаколбороната, катехолбороната, бис(неопентил гликолато)диборона, бис(пинаколато)диборона, бис(гексилен гликолато)диборона и бис(катехолато)диборона. В некоторых вариантах осуществления борилирующий агент представляет собой бис(пинаколато)диборон. В некоторых вариантах осуществления реакция борилирования осуществляется при нагревании. Боронатные соединения со структурой IX взаимодействуют с соединениями со структурой XII в палладийопосредованных условиях сочетания (условия реакции Сузуки) с образованием соединений со структурой X. В некоторых вариантах осуществления соединение 1 приготавливают так, как показано на схеме 6. В некоторых вариантах осуществления бифенил соединения со структурой XIV преобразуют в полициклическое соединение 1, как показано на схеме 6. Бифенил соединения со структурой XIV обрабатывают дигалогеналкил соединением, таким как 1,2-дибромэтан, с образованием циклоалкил группы. Цианогруппа гидролизуется до кислоты, из которой образуется сложный эфир, обеспечивая получение трициклических соединений со структурой XV. В некоторых вариантах осуществления R1 представляет собой этил. В некоторых вариантах осуществления R1 представляет собой изопропил. Трициклические соединения со структурой XV затем обрабатывают ацетилхлоридом в присутствии подходящей кислоты Льюиса с последующим преобразованием ацетильной группы в карбоновую кислоту и обработкой карбоновой кислоты тионилхлоридом, обеспечивая получение хлорангидридов со структурой XVI. Хлорангидриды со структурой XVI затем используют для приготовления изоксазолов структурой XVII, как проиллюстрировано на схеме 1. В некоторых вариантах осуществления R2 представляет собой алкилруппу. В некоторых вариантах осуществления R2 представляет собой метил и R2 удаляют из изоксазолов со структурой XVII в условиях гидролиза. В некоторых вариантах осуществления R2 представляет собой бензил и R2 удаляют из изоксазолов со структурой XVII в условиях гидрогенизации (например, Н 2, Pd/C). Перегруппировка Курциуса карбоновых кислот со структурой XVIII в присутствии (R)-1 фенилэтилового спирта обеспечивает получение карбаматных соединений со структурой X. Дополнительно на схеме 7 показан альтернативный путь синтеза соединения X. Схема 7 Превращение X группы в бифенил соединении XX в бороновую кислоту или боронатный эфир обеспечивает получение связывающего партнера для соединения XXI в реакции Сузуки, что обеспечивает получение соединения X. Гидролиз эфирной группы в соединении X с получением соединения 1 и соединения 2 проиллюстрирован на схеме 8. Схема 8 Гидролиз алкил эфиров со структурой X подходящим основанием в подходящем растворителе после корректировки рН дает соединение 1. Подходящие основания для гидролиза включают, но не ограничиваются этим, гидроксид лития и гидроксид натрия. Подходящие растворители для гидролиза вклю- 24024967 чают, но не ограничиваются этим, воду, метанол, этанол, тетрагидрофуран или их комбинации. Соединение 1 затем обрабатывают гидроксидом натрия в тетрагидрофуране, метаноле и воде с получением соединения 2. В некоторых вариантах осуществления соединение 2 приготавливают из соединения X путем осуществления одностадийного гидролиза и реакции образования соли. В некоторых вариантах осуществления одностадийный гидролиз и реакция образования соли включают обработку соединения X гидроксидом натрия в подходящем растворителе. В некоторых вариантах осуществления соединение 1 обрабатывают гидроксидом калия в растворителе с образованием калиевой соли соединения 1. В некоторых вариантах осуществления соединение 1 обрабатывают гидроксидом лития в растворителе с образованием литиевой соли соединения 1. В некоторых вариантах осуществления соединение 1 обрабатывают гидроксидом кальция в растворителе с образованием кальциевой соли соединения 1. В некоторых вариантах осуществления соединение 1 обрабатывают дициклогексиламином в растворителе с образованием соответствующей соли. В некоторых вариантах осуществления соединение 1 обрабатывают N-метил-D-глюкамином в растворителе с образованием соответствующей соли. В некоторых вариантах осуществления соединение 1 обрабатывают холином в растворителе с образованием соответствующей соли. В некоторых вариантах осуществления соединение 1 обрабатывают трис(гидроксиметил)метиламином в растворителе с образованием соответствующей соли. В некоторых вариантах осуществления соединение 1 обрабатывают аргинином в растворителе с образованием соответствующей соли. В некоторых вариантах осуществления соединение 1 обрабатывают лизином в растворителе с образованием соответствующей соли. В некоторых вариантах осуществления в связи с тем, что в способах синтеза, описанных выше, используют катализатор на основе переходного металла, осуществляют стадии очистки для уменьшения содержания палладия в продукте. Стадии очистки для уменьшения содержания палладия в продукте проводят таким образом, чтобы активные фармацевтические ингредиенты соответствовали рекомендованным требованиям к содержанию палладия ("Guideline on the Specification Limits for Residues of Metal Catalysts" European Medicines Agency Pre-authorisation Evaluation of Medicines for Human Use, London, January 2007, Doc. Ref. CPMP/SWP/QWP/4446/00 corr.). В некоторых вариантах осуществления стадии очистки для уменьшения содержания палладия в продукте включают, но не ограничиваясь этим, обработку твердым тримеркаптотриазидом (ТМТ), полистиролсвязанным ТМТ, меркапто-пористым полистиролсвязанным ТМТ, полистиролсвязанным этилендиамином, активированным углем, губками из стеклянных шариков, Smopex тм , диоксидом кремния, кварцевыми поглотителями, тиол-производными силикагеля, N-ацетилцистеином, n-Bu3P, кристаллизацией, экстракцией, L-цистеином, n-Bu3P /молочной кислотой. (Garrett et al., Adv. Synth. Catal. 2004, 346, 889-900). В некоторых вариантах осуществления активированный уголь включает, но не ограничивается, DARCO KB-G, DARCO KB-WJ. В одном аспекте кремниевые поглотители включают, но не ограничиваются где означает силикагель. В некоторых вариантах осуществления стадии очистки для уменьшения содержания палладия включают использование активированного угля, силикагеля, производных силикагеля (например, тиолпроизводных силикагеля) или их комбинации. Хотя вышеупомянутые схемы представлены только для примера синтеза с (R)-1-фенилэтиловым спиртом, те же самые процедуры синтеза могут быть осуществлены с (S)-1-фенилэтиоловым спиртом или (R/S)-1-фенилэтиловым спиртом вместо (R)-1-фенилэтилового спирта. В некоторых вариантах осуществления (R)-1-фенилэтиловый спирт является оптически чистым. В некоторых вариантах осуществления (R)-1-фенилэтиловый спирт имеет энантиомерный избыток по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99%. В одном аспекте соединение 1 получают в соответствии с описанным в примерах. В одном аспекте соединение 2 получают в соответствии с описанным в примерах. Подходящие растворители. Терапевтические агенты, вводимые для млекопитающих, таким как люди, должны быть получены по следующим нормативным рекомендациям. Такие руководящие нормативные рекомендации носят название Надлежащей производственной практики (GMP). Руководство GMP описывает допустимые уров- 25024967 ни загрязнения активных терапевтических веществ, такие как, например, остаточное количество растворителя в конечном продукте. Предпочтительными растворителями являются те, которые подходят для использования в соответствии с GMP и соответствуют нормам промышленной безопасности. Категории растворителей определяются, например, на Международной конференции по гармонизации технических требований к регистрации лекарственных препаратов для применения на человеке (ICH), "Impurities:Guidelines for Residual Solvents, Q3C(R3), (ноябрь 2005). Растворители разделяют на три класса. Растворители класса 1 токсичны и их следует избегать. Растворители класса 2 представляют собой растворители, использование которых в производстве терапевтического агента должно быть ограничено. Растворители класса 3 представляют собой растворители с низким потенциалом токсичности и более низкого риска для здоровья человека. Данные для растворителей класса 3 указывают, что они менее токсичны в острых или краткосрочных исследованиях и проявляют отрицательные результаты в исследованиях генотоксичности. Растворители класса 1, использования которых следует избегать, включают бензол; четыреххлористый углерод; 1,2-дихлорэтан; 1,1-дихлорэтан и 1,1,1-трихлорэтан. Примерами растворителей класса 2 являются ацетонитрил, хлорбензол, хлороформ, циклогексан,1,2-дихлорэтан, дихлорметан, 1,2-диметоксиэтан, N,N-диметилацетамид, N,N-диметилформамид, 1,4 диоксан, 2-этоксиэтанол, этиленгликоль, формамид, гексан, метанола 2-метоксиэтанол, метилбутилкетон, метилциклогексан, N-метилпирролидин, нитрометан, пиридин, сульфолан, тетралин, толуол, 1,1,2 трихлорэтен и ксилол. Растворители класса 3, которые обладают низкой токсичностью, включают уксусную кислоту, ацетон, анизол, 1-бутанол, 2-бутанол, бутилацетат, трет-бутилметиловый эфир (МТБЭ), кумол, диметил сульфоксид, этанол, этилацетат, этиловый эфир, этил формиат, муравьиную кислоту, гептан, изобутил ацетат, изопропил ацетат, метил ацетат, 3-метил-1-бутанол, метилэтил кетон, метилизобутил кетон, 2 метил-1-пропанол, пентан, 1-пентанол, 1-пропанол, 2-пропанол, пропил ацетат и тетрагидрофуран. Остатки растворителя в активных фармацевтических ингредиентах (АФИ) возникают при производстве АФИ. В некоторых случаях растворители удаляются неполностью при использовании практических методов производства. Правильный выбор растворителя для синтеза АФИ может повысить выход или определить такие характеристики, как кристаллическая форма, чистота и растворимость. Таким образом, растворитель является критическим параметром в процессе синтеза. В некоторых вариантах осуществления композиции, содержащие соли соединения 1, содержат органический(ее) растворитель(и). В некоторых вариантах осуществления композиции, содержащие соли соединения 1, содержат остаточные количества органического(их) растворителя(ей). В некоторых вариантах осуществления композиции, содержащие соли соединения 1, содержат остаточные количества растворителя класса 3. В некоторых вариантах осуществления органический растворитель представляет собой растворитель класса 3. В некоторых вариантах осуществления растворитель класса 3 выбран из группы, состоящей из уксусной кислоты, ацетона, анизола, 1-бутанола, 2-бутанола, бутилацетата, третбутилметилового эфира, кумола, диметил сульфоксида, этанола, этилацетата, этилового эфира, этил формиата, муравьиной кислоты, гептана, изобутил ацетата, изопропил ацетата, метил ацетата, 3-метил-1 бутанола, метилэтил кетона, метилизобутил кетона, 2-метил-1-пропанола, пентана, 1-пентанола, 1 пропанола, 2-пропанола, пропил ацетата и тетрагидрофурана. В некоторых вариантах осуществления растворитель класса 3 выбирают из этилацетата, изопропилацетата, трет-бутилметилового эфира, гептана, изопропанола и этанола. В некоторых вариантах осуществления композиции, содержащие соль соединения 1, включают детектируемое количество органического растворителя. В некоторых вариантах осуществления соль соединения 1 является натриевой солью (т. е. соединением 2). В некоторых вариантах осуществления органический растворитель представляет собой растворитель класса 3. В одном аспекте соль соединения 1 является натриевой солью, калиевой солью, литиевой солью,кальциевой солью, солью магния, солью аммония, солью холина, протонированной солью дициклогексиламина,протонированной сольюN-метил-D-глюкамина,протонированной солью трис(гидроксиметил)метиламина, солью аргинина или солью лизина. В одном аспекте соль соединения 1 является солью натрия. В другом варианте осуществления предложены композиции, содержащие соединение 2, где композиции содержат детектируемое количество растворителя, составляющее менее чем примерно 1%, где растворитель выбран из ацетона, 1,2-диметоксиэтана, ацетонитрила, этилацетата, тетрогидрофурана, метанола, этанола, гептана и 2-пропанола. В дополнительном варианте осуществления предложены композиции, содержащие соединение 2, где композиции содержат детектируемое количество растворителя,составляющее менее чем примерно 5000 ppm. В еще одном дополнительно варианте предложены композиции, содержащие соединение 2, где детектируемое количество растворителя составляет менее чем примерно 5000 ppm, менее чем примерно 4000 ppm, менее чем примерно 3000 ppm, менее чем примерно 2000 ppm, менее чем примерно 1000 ppm, менее чем примерно 500 ppm или менее чем примерно 100- 26024967 Если не установлено иное, в настоящей заявке, включая описания и формулу, следующие термины имеют значения, приведенные ниже. Необходимо отметить, что использующиеся в настоящем описании и приложенной формуле формы единственного числа включают формы множественного числа, если из контекста явно не следует обратное. Если не указано иное, используются общепринятые способы масс спектрометрии, ЯМР, ВЭЖХ, белковой химии, органического синтеза, биохимии, методы рекомбинантной ДНК и фармакологии в рамках сведений из данной области техники. В настоящей заявке использование "или" означает "и/или", если не указано иное. Кроме того, использование термина "включающий",также как и других его форм, таких как "включают", "включает" и "включенный", не являются ограничивающими. Термин "фармацевтически приемлемый наполнитель" при использовании здесь относится к материалу, такому как носитель, разбавитель, стабилизатор, диспергирующий агент, суспендирующий агент,загуститель и т. п., которые позволяют переработку активного фармацевтического ингредиента (АФИ) в форму, подходящую для введения млекопитающему. В одном аспекте млекопитающим является человек. Фармацевтически приемлемые наполнители относятся к материалам, которые, по существу, не отменяют желаемую биологическую активность или желаемые свойства соединения (т. е. АФИ), а также являются относительно нетоксичеными, т .е. материал вводят индивиду, не вызывая нежелательных биологических эффектов или взаимодействующих пагубным образом с любым из компонентов содержащих их композиций."Активный фармацевтический ингредиент" или АФИ относится к соединению, которое обладает желаемой биологической активностью или желаемыми свойствами. В некоторых вариантах воплощения АФИ представляет собой соединение 1. В некоторых вариантах воплощения АФИ представляет собой соединение 2. Здесь предложен фармацевтически активный ингредиент (АФИ), соединение 1 или его фармацевтически приемлемая соль (например, соединение 2), очищенный более чем на 80%, более чем на 85%, более чем на 90%, более чем на 95%, более чем на 96%, более чем на 97%, более чем на 98%,более чем на 98% или более чем на 99%. В конкретных вариантах воплощения предложен активный фармацевтический ингредиент (АФИ), соединение 2, очищенный более чем на 80%, более чем на 85%,более чем на 90%, более чем на 95%, более чем на 96%, более чем на 97%, более чем на 98% или более чем на 99%. Термин "фармацевтическая комбинация" при использовании здесь означает продукт, который получается при смешивании или объединении более одного активного ингредиента и включает фиксированные и нефиксированные комбинации активных ингредиентов. Термин "фиксированная комбинация" означает, что активные ингредиенты, например, соединение 1 или его фармацевтически приемлемая соль, и сопутствующий агент вводятся пациенту одновременно в виде единого целого или формы дозирования. Термин "нефиксированная комбинация" означает, что активные ингредиенты, например соединение 1 или его фармацевтически приемлемая соль, и сопутствующий агент вводят пациенту в виде отдельных объектов либо совместно, одновременно или последовательно без каких-либо конкретных промежуточных сроков, причем такое введение обеспечивает эффективные уровни двух соединений в организме пациента. Последнее относится также к коктейльной терапии, например к введению трех или более активных ингредиентов. Термин "фармацевтическая композиция" относится к смеси соединения 1 или его фармацевтически приемлемой соли и/или его сольвата с другими химическими компонентами, такими как носители, стабилизаторы, разбавители, диспергирующие агенты, суспендирующие агенты, загустители, наполнители и т. д. Фармацевтическая композиция облегчает введение соединения в организм млекопитающего. Введение комбинации агентов при использовании здесь включает введение агентов, описанных в одиночной композиции или в комбинационной терапии, в которой один или более агентов вводятся отдельно от по меньшей мере одного другого агента. Группа "алкил" относится к алифатической углеводородной группе. Алкильная часть является разветвленной прямой цепью или циклом. Алкильная группа может быть обозначена как "C1-С 6 алкил". В одном аспекте алкил выбран из метила, этила, пропила, изопропила, бутила, изобутила, трет-бутила,пентила, неопентила, гексила, винила, пропенила, аллила, бутенила, циклопропила, циклобутила, циклопентила, циклогексила и т. п."Детектируемое количество" относится к количеству, которое является измеримым с помощью стандартных аналитических методов (например, ионообменной хроматографией, масс хроматографией,ЯМР, ВЭЖХ, газовой хроматографией, элементарным анализом, ИК-спектроскопией, атомноэмиссионной спектрометрией с индуктивно связанной плазмой, USP231 способ II, т. д.) (ICH руководство, Q2A Text on Validation of Analytical Procedures (март 1995) и Q2B Validation of Analytical Procedures: Methodology (ноябрь 1996. Термин "приемлемый" в отношении состава, композиции или ингредиента при использовании здесь означает не имеющий стойкого отрицательного влияния на общее состояние здоровья пациента, подлежащего лечению. Термины "эффективное количество" или "терапевтически эффективное количество" при использовании здесь относятся к достаточному количеству вводимого агента, которое облегчит до некоторой сте- 27024967 пени один или более симптомов заболевания или состояния, подлежащих лечению. Результатом может быть снижение и/или облегчение признаков, симптомов или причин заболевания или любые другие желательные изменения биологической системы. Например, "эффективное количество" для терапевтических применений представляет собой количество композиции, содержащей соединение, как описано здесь, необходимое для того, чтобы обеспечить клинически значимое снижение симптомов заболевания. Термин "терапевтически эффективное количество" включает, например, профилактически эффективное количество. Эффективное количество может быть выбрано на основании данных отдельного пациента и уровня болезни. Следует понимать, что "эффективное количество" или "терапевтически эффективное количество" варьирует от субъекта к субъекту в связи с вариабельностью метаболизма препарата, возраста, веса, общего состояния субъекта, подлежащего лечению состояния, тяжести подлежащего лечению состояния и заключения лечащего врача. В одном из вариантов подходящее "эффективное" количество в каждом конкретном случае определяется с использованием методов, таких как изучение эскалации дозы. Термины "совместное введение" или т. п. при использовании здесь означают осуществление введения выбранных терапевтических агентов одному пациенту и предназначены для включения в режимы лечения, в которых агенты вводят одним и тем же или различными способами введения или в одно и то же или разное время. Термины "усилить" или "усиление" при использовании здесь означают увеличение или продление силы или продолжительности желаемого эффекта. Таким образом, в отношении усиления эффекта терапевтических агентов термин "усиление" относится к способности увеличивать или продлять силу или продолжительность действия других терапевтических агентов в системе. "Усиливающее эффективное количество" при использовании здесь относится к количеству, необходимому для усиления эффекта другого терапевтического агента в желаемой системе. Термины "комплект" и "изделие" используются как синонимы."Метаболит" соединения, описанного здесь, представляет собой производное соединения, которое формируется при метаболизировании этого соединения. Термин "активный метаболит" относится к биологически активному производному соединения, которое формируется при метаболизировании (биотрансформировании) этого соединения. Термин "метаболизированный" при использовании здесь относится к совокупности процессов (включая, но не ограничиваясь ими, реакции гидролиза и реакции, катализируемые ферментами), в которых конкретное вещество изменяется организмом. Таким образом, ферменты могут продуцировать специфические структурные изменения в соединении. Например, цитохром Р 450 катализирует различные окислительные и восстановительные реакции, в то время как дифосфатуридин глюкуронилтрансферазы (UGT) катализируют перенос активированной молекулы глюкуроновой кислоты на ароматические спирты, алифатические спирты, карбоновые кислоты, амины и свободные сульфгидрильные группы (например, реакции присоединения). В некоторых вариантах осуществления соединения, описанные здесь, метаболизируются с получением метаболитов таурина. Более подробная информация о метаболизме доступна в The Pharmacological Basis of Therapeutics, 9th Edition, McGraw-Hill(1996). В одном из вариантов метаболиты соединений, раскрытых в данном описании, определены либо путем введения соединений хозяину и анализом образцов ткани от хозяина, или путем инкубации соединений с клетками печени in vitro и анализом полученных соединений. Термин "модулировать" при использовании здесь означает взаимодействовать с мишенью прямо или косвенно таким образом, чтобы изменялась активность мишени, в том числе, в качестве примера, для повышения активности мишени, для ингибирования активности мишени, для ограничения активности мишени или продления активности мишени. Термин "модулятор" при использовании здесь относится к молекуле, которая взаимодействует с мишенью прямо или косвенно. Взаимодействия включают, но не ограничиваются этим, взаимодействия агониста и антагониста. Термин "агонист" при использовании здесь относится к молекуле, такой как соединение, лекарство,ферментный активатор или гормональный модулятор, который связывает специфический рецептор и запускает ответ в клетки. Агонист подражает действию эндогенного лиганда (такого как простогландин,гормон или нейротрансмиттер), который связывает тот же рецептор. Термин "антагонист" при использовании здесь относится к молекуле, такой как соединение, которое сокращает, ингибирует или предупреждает действие другой молекулы или активность рецепторного сайта. Термин"LPA-зависимый" при использовании здесь относится к состояниям или расстройствам, которые не будут происходить или не будут происходить в той же степени, в отсутствие LPA. Термин"LPA-опосредованный" при использовании здесь относится к состояниям или расстройствам, которые могли бы возникнуть в отсутствие LPA, но могут произойти в присутствии LPA. Термин "субъект" или "пациент" охватывает млекопитающих. В одном аспекте млекопитающим является человек. В другом аспекте млекопитающим является примат, отличный от человека, такой как шимпанзе, или другого вида обезьяны Старого Света и человекообразные обезьяны. В одном аспекте млекопитающим является сельскохозяйственное животное, включая крупный рогатый скот, лошадь, ов- 28024967 цу, козу или свинью. В одном аспекте млекопитающим является домашнее животное, такое как кролик,собака или кошка. В одном аспекте млекопитающим является лабораторное животное, в том числе грызуны, такие как крысы, мыши и морские свинки, и т. п."Биодоступность" относится к процентному весовому содержанию соединения 1 или его фармацевтически приемлемой соли и/или сольвата, дозированных так, что доставляются в общий кровоток исследуемого животного или человека. Общее воздействие (AUC(0- препарата при внутривенном введении обычно определяется как 100% биодоступности (F%). "Пероральная биодоступность" относится к степени, в которой соединение 1 или его фармацевтически приемлемая соль и/или сольват всасывается в общий кровоток в случае, когда фармацевтическую композицию следует принимать перорально в сравнении с внутривенным введением."Концентрация в плазме крови" относится к концентрации соединения 1 в плазменных компонентах крови млекопитающего. Должно быть понятно, что концентрация соединения 1 в плазме может значительно варьировать среди отдельных субъектов из-за изменчивости в отношении метаболизма и/или взаимодействия с другими терапевтическими агентами. В одном аспекте концентрация соединения 1 в плазме крови варьирует от субъекта к субъекту. Кроме того, такие значения, как максимальная концентрация в плазме (Cmax), или время достижения максимальной концентрации в плазме (Tmax), или полная площадь под кривой концентрации в плазме (AUC(0-, варьируют от пациента к пациенту. В связи с такой вариабельностью в одном варианте осуществления количество, необходимое для составления "терапевтически эффективного количество" соединения 1, варьирует от пациента к пациенту."Абсорбция препарата" или "абсорбция" обычно относятся к процессу движения лекарственного средства от места введения препарата через барьер в кровеносные сосуды или в место действия, например передвижение препарата от желудочно-кишечного тракта в воротную вену или лимфатическую систему."Концентрация в сыворотке" или "Концентрация в плазме" описывает концентрацию в сыворотке крови или концентрацию в плазме крови, обычно измеряемую в мг, мкг или нг терапевтического агента на мл, дл или л сыворотки крови, поглощенную в кровотоке после введения. Концентрации в плазме обычно измеряются в нг/мл или мкг/мл."Фармакодинамика" относится к факторам, которые определяют биологический ответ, наблюдаемый в отношении концентрации лекарства в месте действия."Фармакокинетика" относится к факторам, которые определяют достижение и поддержание соответствующей концентрации лекарства в месте действия."Устойчивое состояние" при использовании здесь относится к случаю, когда вводимое количество лекарства равно выводимому количеству лекарства в пределах одного интервала дозирования, приводящему к плато или постоянному присутствию лекарства в плазме. Термины "лечить", "получать лечение" или "лечение" при использовании здесь включают облегчение, ослабление или улучшение по меньшей мере одного симптома заболевания или состояния, предотвращение дополнительных симптомов, ингибирование заболевания или состояния, например остановку развития заболевания или состояния, облегчение заболевания или состояния, регрессию заболевания или состояния, облегчение состояния, вызванного заболеванием или состоянием, или остановку симптомов заболевания или состояния, профилактически и/или терапевтически. Фармацевтические композиции/смеси. Фармацевтические композиции приготавливают общепринятыми способами с использованием одного или более физиологически приемлемых носителей, включая наполнители и вспомогательные вещества, которые облегчают переработку активных соединений в препараты, которые используют в фармацевтических целях. Подходящие технологии, носители и наполнители включают те, которые могут быть найдены, например, в Remington: The Science and Practice of Pharmacy, Nineteenth Ed (Easton, Pa.: MackPublishing Company, 1995); Hoover, John E., Remington's Pharmaceutical Sciences, Mack Publishing Co.,Easton, Pennsylvania 1975; Liberman H.A. and Lachman L., Eds., Pharmaceutical Dosage Forms, Marcel Decker, New York, N.Y., 1980; и Pharmaceutical Dosage Forms and Drug Delivery Systems, Seventh Ed. (Lippincott WilliamsWilkins l999), которые включены сюда посредством ссылки в полном объеме. Фармацевтическая композиция при использовании здесь относится к смеси соединения формулы (I) с другими химическими компонентами (т. е. фармацевтически приемлемыми вспомогательными веществами), такими как носители, эксципиенты, связующие вещества, наполнители, суспендирующие агенты,ароматизирующие агенты, подслащивающие агенты, дезинтегрирующие агенты, диспергирующие агенты, поверхностно-активные вещества, смазывающие вещества, красители, разбавители, солюбилизирующие агенты, увлажняющие агенты, пластификаторы, стабилизаторы, усилители проникновения, смачивающие агенты, антипенные агенты, антиоксиданты, консерванты или комбинации одного или более указанных. Фармацевтическая композиция облегчает введение соединения в организм. Фармацевтические составы, описанные здесь, вводятся в субъекту различными способами многообразными путями введения, включая, но не ограничиваясь ими, пероральный, парентеральный (например, внутривенные, подкожные, внутримышечные, интрамедуллярные инъекции, интратекальные, пря- 29
МПК / Метки
МПК: A61K 31/42, A61P 37/08, C07D 261/14
Метки: антагонист, полициклический, применение
Код ссылки
<a href="https://eas.patents.su/30-24967-policiklicheskijj-lpa1-antagonist-i-ego-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Полициклический lpa1 антагонист и его применение</a>
Предыдущий патент: Способ и система вентиляции тоннеля в нормальных условиях и в условиях пожара
Следующий патент: Устройство и способ очистки воздуха от нежелательных компонентов и устранения таких компонентов
Случайный патент: Способ очистки пестицидов












