Антагонист cd 80
Формула / Реферат
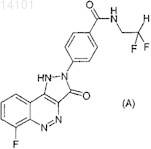
1. Холиновая соль 4-(6-фтор-3-оксо-1,3-дигидропиразоло[4,3-с]циннолин-2-ил)-N-(2,2-дифторэтил)бензамида формулы (А)
2. Фармацевтическая композиция для приема внутрь, содержащая холиновую соль по п.1 и по меньшей мере один фармацевтически приемлемый носитель.
3. Водный раствор указанной холиновой соли по п.1, предназначенный для инъекций.
4. Жидкость или мазь на водной основе для местного применения, содержащая холиновую соль по п.1.
Текст
Мэттьюс Иан Ричард (GB) Холиновая соль антагониста CD80 - 4-(6-фтор-3-оксо-1,3-дигидропиразоло[4,3-с]циннолин-2 ил)-N-(2,2-дифторэтил)бензамида - обладает хорошей растворимостью в воде и поэтому удобна для использования в составе лекарственных средств. 014101 Область техники Данное изобретение относится к антагонисту CD80 - холиновой соли 4-(6-фтор-3-оксо-1,3 дигидропиразоло[4,3-с]циннолин-2-ил)-N-(2,2-дифторэтил)бензамида. Уровень техники В международной патентной заявке WO 2004/081011 раскрыт целый класс веществ,в том числе (среди прочих) 4-(6-фтор-3-оксо-1,3-дигидропиразоло[4,3-с]циннолин-2-ил)-N-(2,2 дифторэтил)бензамид, имеющий структурную формулу (А) Вещества, раскрываемые в заявке WO 2004/081011, являются антагонистами CD80, способными ингибировать взаимодействия между CD80 и CD28, в связи с чем они полезны для иммуноингибирования, например при лечении ревматоидного артрита. Вещество (А) в форме свободной кислоты плохо растворимо в воде. Вообще говоря, хорошая растворимость в воде является желательной характеристикой для вещества, предназначенного для приема внутрь, парентерального введения или местного применения в носителе на водной основе, например в составе лечебного препарата. В заявке WO 2004/081011 также имеется указание на соли веществ того класса, к которому относится и вещество (А). Однако не все соли данного вещества обладают растворимостью в воде, в достаточной степени превышающей растворимость свободной кислоты, чтобы являться формами данного вещества, удобными для приема внутрь или для включения в состав препаратов на водной основе. Сущность изобретения Данное изобретение основывается на неожиданном обнаружении авторами того факта, что холиновая соль вещества (А) имеет искомую хорошую растворимость в воде. Подробное описание изобретения В данном изобретении предлагается холиновая соль 4-(6-фтор-3-оксо-1,3-дигидропиразоло[4,3 с]циннолин-2-ил)-N-(2,2-дифторэтил)бензамида, имеющего вышеприведенную формулу (А). Одним из аспектов данного изобретения являются фармацевтические препараты для приема внутрь,включающие указанную холиновую соль и по меньшей мере один фармацевтически приемлемый носитель. Еще одним аспектом данного изобретения являются водные растворы указанной холиновой соли,предназначенные для инъекций, а также жидкие составы и кремы на водной основе для местного применения, содержащие указанную холиновую соль. Препараты для приема внутрь могут быть в форме таблеток, капсул, пилюль, порошков, гранул, лепешек, жидких и желеобразных составов. Таблетки и капсулы для приема внутрь могут быть в форме,соответствующей приему однократной дозы, и могут содержать обычные лекарственные добавки, такие как связующие агенты, например патоку, гуммиарабик, желатин, сорбит, трагакантовую камедь или поливинилпирролидон; наполнители, например лактозу, сахарозу, кукурузный крахмал, фосфат кальция, сорбит, глицин; смазывающий агент для таблетирования, например стеарат магния, тальк, полиэтиленгликоль, кремнезем; разрыхлители, например картофельный крахмал, или приемлемые смачивающие агенты, например лаурилсульфат натрия. На таблетки может быть нанесено покрытие при помощи методов, хорошо известных в обычной фармацевтической практике. Жидкие препараты для приема внутрь могут представлять собой, например, суспензии в воде или в масле, растворов, эмульсий, сиропов или эликсиров либо сухой продукт для разведения водой или другой подходящей средой перед использованием. Указанные жидкие препараты могут содержать обычные добавки, такие как суспендирующие средства, например сорбит, патоку, метилцеллюлозу, сироп из глюкозы, желатин, гидрированные съедобные жиры; эмульгаторы, например лецитин, сорбитан моноолеат, гуммиарабик; неводные носители (к которым могут относиться пищевые жиры), например миндальное масло, фракционированное кокосовое масло, жирные эфиры, например, глицерина, пропиленгликоля, этанола; консерванты, например метил- или пропил-п-оксибензоат или сорбиновая кислота, а также по желанию - обычные ароматизаторы и красители. С целью местного нанесения на кожу лекарственное средство может быть включено в состав крема,лосьона или мази. Препараты в виде крема или мази, которые могут использоваться в качестве лекарственного средства, представляют собой обычные составы, хорошо известные в данной области, например,такие, как описано в стандартных фармацевтических руководствах, таких как Британская Фармакопея.-1 014101 Активный компонент может также вводиться парентерально в стерильной среде путем инъекции или инфузии. В зависимости от применяемой среды и концентрации лекарственное средство может быть либо суспендировано, либо растворено а среде. Предпочтительно, чтобы в среде также были растворены вспомогательные вещества, такие как анестетики местного действия, консерванты и буферные добавки. Приготовление и растворимость в воде холиновой соли по данному изобретению описаны ниже в следующем примере. Пример. По приведенному ниже методу получен 4-(6-фтор-3-оксо-1,3-дигидропиразоло[4,3-с]циннолин-2 ил)-N-(2,2-дифторэтил)бензамид и приготовлена его холиновая (т.е. (2-гидроксиэтил)триметиламмониевая) соль. Получение N-(2,2-дифторэтил)-4-(6-фтор-3-оксо-1,3-дигидропиразоло[4,3-с]циннолин-2-ил)бензамида. В круглодонную колбу, оборудованную магнитной мешалкой, обратным холодильником и барботером, поместили 12,9 г 4-(6-фтор-3-оксо-1,3-дигидропиразоло[4,3-с]циннолин-2-ил)-N-(5-дифторэтил)бензойной кислоты, приготовленной, как указано в примере 5 заявки WO 2004/081011. Медленно добавили тионилхлорид (65 мл). Создали атмосферу азота и нагревали смесь до кипения с обратным холодильником. При нагревании наблюдалось выделение газа, который улавливали при помощи газопромывной колонки. После прекращения выделения газа (примерно через 2 ч) смесь, представлявшую собой оранжево-красную суспензию, перешла в темно-красную суспензию, после чего ее охладили до комнатной температуры. Избыток тионилхлорида удалили под вакуумом и полученное твердое вещество красного цвета подвергли азеотропной перегонке с толуолом (50 мл). Было получено темно-красное твердое вещество, которое растворили в безводном ДМА (65 мл) с образованием темно-красного раствора. Диизопропилэтиламин (12,9 г, 17,4 мл) смешали с 2,2-дифтораминоэтаном (3,24 г, 2,76 мл) и эту смесь за 4-5 мин добавили по каплям к указанному выше раствору. Наблюдалась экзотермическая реакция. Смесь перемешивали при комнатной температуре. Реакционную смесь разложили добавлением 0,5 М HCl (150 мл), получив темно-красную суспензию. Твердые вещества собрали путем фильтрования и промыли небольшим количеством воды. Твердый продукт растирали с метанолом (250 мл) в течение приблизительно 1 ч при комнатной температуре, отфильтровали и промыли метанолом. Затем твердый продукт растирали с ацетоном (250 мл) в течение приблизительно 1 ч при комнатной температуре, отфильтровали и промыли ацетоном. Наконец, твердый продукт растирали с этилацетатом (250 мл) в течение приблизительно 45 мин, отфильтровали и промыли этилацетатом. Продукт (приблизительно 8 г) растворили в ДМА (10 мл) с образованием густого темно-красного раствора. Добавили метанол (150 мл) и ацетон (150 мл) и отфильтровали осадок. Жидкостная хроматомасс-спектрометрия (LC-MS): один пик требуемого продукта. Количественный анализ вещества показал, что его чистота составляет 91,6%. Получение 2-[4-(2,2-дифторэтилкарбамоил)фенил]-6-фтор-2 Н-пиразоло[4,3-с]циннолин-3-олат-(2 гидроксиэтил)триметиламмония. В круглодонную колбу с магнитной мешалкой поместили 2,50 г N-(2,2-дифторэтил)-4-(6-фтор-3 оксо-1,3-дигидропиразоло[4,3-с]циннолин-2-ил)бензамида. Твердое вещество суспендировали в метаноле (25 мл) и по каплям добавили холингидроксид (782 мг, 1,74 мл 45 мас.% в метаноле). В результате добавления образовался прозрачный темно-коричневый раствор. Смесь перемешивали 2 ч при комнатной температуре. Реакционную смесь упарили в вакууме, получив темно-коричневое масло. Добавили 100 мл этилацетата с получением двухфазной системы. После ультразвуковой обработки коричневое масло загустело и начало затвердевать. Полученное твердое вещество измельчили, добавили изопропанол (30 мл) и нагрели смесь до 65-70 С, получив суспензию. Смесь охладили до комнатной температуры и разбавили этилацетатом (около 100 мл). Твердый продукт собрали фильтрованием и промыли этилацетатом (50 мл). Твердый продукт высушили под вакуумом. Жидкостная хроматомасс-спектрометрия (LC-MS): выделенный твердый продукт; один главный пик [М+Н]+ 388, чистота 95%. Твердая соль представляла собой крупный порошок коричневого цвета, 2,26 г, 4,61 ммоль, 71%. Температура плавления: 172-180 С с разложением. Продукт подвергли дальнейшей очистке перекристаллизацией по следующей методике. Соль размешивали с этанолом и нагревали до кипения с обратным холодильником, перемешивали в течение 20 мин и фильтровали в горячем состоянии. Профильтрованный этанольный раствор нагревали до кипения с обратным холодильником, затем охлаждали до 5 С и перемешивали в течение 1 ч. Затем раствор фильтровали, а осадок промывали этанолом и гептаном и затем высушивали до постоянной массы. Растворимость холиновой соли N-(2,2-дифторэтил)-4-(6-фтор-3-оксо-1,3-дигидропиразоло[4,3 с]циннолин-2-ил)бензамида в воде и этаноле определяли в ходе анализа, описанного ниже. Растворимость свободной кислоты - N-(2,2-дифторэтил)-4-(6-фтор-3-оксо-1,3-дигидропиразоло[4,3-с]циннолин-2 ил)бензамида (несолевой формы) - и ряда других ее солей также определяли в ходе того же анализа.-2 014101 Определение растворимости. Отвешивали 10 мг исследуемого вещества в емкости и добавляли 1 мл растворителя. Если образец сразу же растворялся, что было видно по образованию прозрачного раствора, добавляли дополнительное количество исследуемого вещества и подвергали емкость ультразвуковой обработке в течение 15 мин. Эту процедуру повторяли до тех пор, пока испытуемое вещество не переставало растворяться, о чем свидетельствовало образование суспензии. Затем емкость с суспензией подвергали ультразвуковой обработке в течение 15 мин и помещали в аппарат для встряхивания на 24 ч при 25 С и относительной влажности 60%. После извлечения из аппарата для встряхивания образец центрифугировали и надосадочную жидкость анализировали методом ВЭЖХ. Результаты представлены в таблице. 2. Фармацевтическая композиция для приема внутрь, содержащая холиновую соль по п.1 и по меньшей мере один фармацевтически приемлемый носитель. 3. Водный раствор указанной холиновой соли по п.1, предназначенный для инъекций. 4. Жидкость или мазь на водной основе для местного применения, содержащая холиновую соль по п.1.
МПК / Метки
МПК: A61P 17/00, A61P 19/00, C07D 487/04, A61K 31/5025, A61P 3/00
Метки: антагонист
Код ссылки
<a href="https://eas.patents.su/4-14101-antagonist-cd-80.html" rel="bookmark" title="База патентов Евразийского Союза">Антагонист cd 80</a>







