Пиридазиноновые соединения и их применение в качестве ингибиторов daao
Номер патента: 24956
Опубликовано: 30.11.2016
Авторы: Ливермор Дэвид, Кинселла Наташа, Мёрчент Кевин, Филдхаус Шарлотт, Керр Катрина, Миллер Дэвид, Хейзел Кэтрин, Фарнаби Уильям
Формула / Реферат
1. Соединение формулы (I)
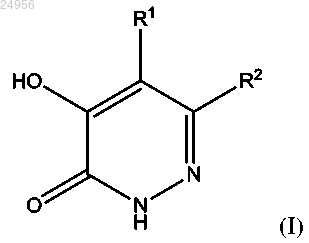
где R1 представляет собой атом водорода;
R2 представляет собой группу -X-Y-R3;
X и Y, каждый независимо, представляют собой связь, -S-, -NR4, 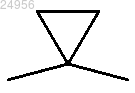
или -CR4R5- при условии, что оба X и Y не могут одновременно представлять собой связь, и при условии, что если оба X и Y являются отличными от связи, то по меньшей мере один из X и Y представляет собой -CR4R5-;
каждый R4 независимо представляет собой атом водорода или C1-C6 алкильную группу;
каждый R5 независимо представляет собой атом водорода, C1-C6 алкильную группу;
R3 представляет собой фенил, пиридинил, С3-6-циклоалкил и оксанил, которые сами необязательно замещены одним-тремя заместителями, выбранными из галогена, C1-C6 алкила, C1-C6 галоалкила, C1-C6 алкокси, C1-C6 галоалкокси, CN;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, отличающееся тем, что X представляет собой связь или группу -S-, -NR4,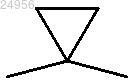 или -CR4R5 - и Y представляет собой связь или -CR4R5-.
или -CR4R5 - и Y представляет собой связь или -CR4R5-.
3. Соединение по п.2, отличающееся тем, что X представляет собой группу -S-, -NR4, -CHR4 или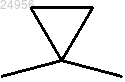 и Y представляет собой связь или группу -CHR4.
и Y представляет собой связь или группу -CHR4.
4. Соединение по п.3, отличающееся тем, что каждый R4 независимо представляет собой атом водорода или метильную группу.
5. Соединение по любому из пп.1-4, отличающееся тем, что R3 выбран из фенила, пиридинила, циклопропила, циклопентила, циклогексила.
6. Соединение по любому из пп.1-4, отличающееся тем, что R представляет собой необязательно замещенный фенил, пиридинил, С3-6-циклоалкил или оксанил.
7. Соединение по п.6, отличающееся тем, что R3 представляет собой фенил, пиридинил, С3-6-циклоалкил или оксанил, при этом R3 необязательно замещен одним, двумя или тремя заместителями, независимо выбранными из фтора, хлора, циано, С1-С4 алкила, C1-С2 галоалкила, С1-С4 алкокси, С1-С2 галоалкокси.
8. Соединение по п.6 или 7, отличающееся тем, что необязательные заместители выбраны из циано, фтора, хлора, дифторметила, дифторметокси, трифторметила, трифторметокси, метила и метокси.
9. Соединение формулы (I), описанное в п.1, выбранное из группы, состоящей из
4-гидрокси-6-(2-фенилэтил)пиридазин-3(2Н)-она,
6-[2-(4-фторфенил)этил]-4-гидроксипиридазин-3(2Н)-она,
4-гидрокси-6-{2-[5-(трифторметил)пиридин-2-ил]этил}пиридазин-3(2Н)-она,
6-[(4-хлорбензил)сульфанил]-4-гидроксипиридазин-3(2Н)-она,
4-гидрокси-6-{2-[6-(трифторметил)пиридин-3-ил]этил}пиридазин-3(2Н)-она,
6-[2-(3-фторфенил)этил]-4-гидроксипиридазин-3(2Н)-она,
6-[2-(2-фторфенил)этил]-4-гидроксипиридазин-3(2Н)-она,
6-[2-(3,5-дифторфенил)этил]-4-гидроксипиридазин-3(2Н)-она,
6-[2-(3,4-дифторфенил)этил]-4-гидроксипиридазин-3(2Н)-она,
4-гидрокси-6-{2-[3-(трифторметокси)фенил]этил}пиридазин-3(2Н)-она,
4-гидрокси-6-{2-[3-(трифторметил)фенил]этил}пиридазин-3(2Н)-она,
4-гидрокси-6-{2-[5-(трифторметил)пиридин-3-ил]этил}пиридазин-3(2Н)-она,
6-(2-циклогексилэтил)-4-гидроксипиридазин-3(2Н)-она,
6-(2-циклопропилэтил)-4-гидроксипиридазин-3(2Н)-она,
6-(2-циклопентилэтил)-4-гидроксипиридазин-3(2Н)-она,
4-гидрокси-6-[2-(4-метоксициклогексил)этил]пиридазин-3(2Н)-она,
6-[2-(2,4-дифторфенил)этил]-4-гидроксипиридазин-3(2Н)-она,
6-{2-[3-(дифторметил)фенил]этил}-4-гидроксипиридазин-3(2Н)-она,
6-бензил-4-гидроксипиридазин-3(2Н)-она,
6-[2-(3-хлорфенил)этил]-4-гидроксипиридазин-3(2Н)-она,
4-гидрокси-6-(1-фенилциклопропил)пиридазин-3(2Н)-она,
4-[2-(5-гидрокси-6-оксо-1,6-дигидропиридазин-3-ил)этил]бензонитрила,
6-[2-(3-фтор-4-метилфенил)этил]-4-гидроксипиридазин-3(2Н)-она,
6-[2-(4-фтор-3-метилфенил)этил]-4-гидроксипиридазин-3(2Н)-она,
6-[2-(3,4-диметоксифенил)этил]-4-гидроксипиридазин-3(2Н)-она,
4-гидрокси-6-{2-[3-(трифторметокси)фенил]этил}пиридазин-3(2Н)-она,
6-[2-(4-хлорфенил)этил]-4-гидроксипиридазин-3(2Н)-она,
6-[2-(2-хлорфенил)этил]-4-гидроксипиридазин-3(2Н)-она,
4-гидрокси-6-{2-[2-(трифторметил)фенил]этил}пиридазин-3(2Н)-она,
6-(4-(дифторметокси)фенетил)-4-гидроксипиридазин-3(2Н)-она,
6-(4-(трифторметокси)фенетил)-4-гидроксипиридазин-3(2Н)-она,
6-(3-(дифторметокси)фенетил)-4-гидроксипиридазин-3(2Н)-она,
6-[1-(4-фторфенил)циклопропил]-4-гидроксипиридазин-3(2Н)-она,
6-[1-(4-фторфенил)этил]-4-гидроксипиридазин-3(2Н)-она,
4-гидрокси-6-{1-[3-(трифторметил)фенил]этил}пиридазин-3(2Н)-она,
4-гидрокси-6-{2-[4-(трифторметил)фенил]этил}пиридазин-3(2Н)-она,
6-((циклопропилметил)(метил)амино)-4-гидроксипиридазин-3(2Н)-она,
6-((циклогексилметил)(метил)амино)-4-гидроксипиридазин-3(2Н)-она,
6-(3-хлорбензил)-4-гидроксипиридазин-3(2Н)-она,
6-(4-хлорбензил)-4-гидроксипиридазин-3(2Н)-она,
6-(циклогексилметил)-4-гидроксипиридазин-3(2Н)-она,
6-(4-фторбензил)-4-гидроксипиридазин-3(2Н)-она,
6-(2-хлор-6-фторбензил)-4-гидроксипиридазин-3(2Н)-она,
6-(2-хлорбензил)-4-гидроксипиридазин-3(2Н)-она,
6-(3-фторбензил)-4-гидроксипиридазин-3(2Н)-она,
6-(2-фторбензил)-4-гидроксипиридазин-3(2Н)-она,
6-(4-метилбензил)-4-гидроксипиридазин-3(2Н)-она,
6-(3-метилбензил)-4-гидроксипиридазин-3(2Н)-она,
4-гидрокси-6-(3-(трифторметил)бензил)пиридазин-3(2Н)-она,
4-гидрокси-6-{2-[5-(трифторметил)пиридин-3-ил]этил}пиридазин-3(2Н)-она,
4-гидрокси-6-[2-(оксан-4-ил)этил]пиридазин-3(2Н)-она,
6-{[(4-фторфенил)метил](метил)амино}-4-гидроксипиридазин-3(2Н)-она,
6-[2-(2,6-дифторфенил)этил]-4-гидроксипиридазин-3(2Н)-она,
6-[2-(2-хлор-6-фторфенил)этил]-4-гидроксипиридазин-3(2Н)-она,
6-{[3,5-бис-(трифторметил)фенил]метил}-4-гидроксипиридазин-3(2Н)-она,
6-(1-фенилэтил)-4-гидроксипиридазин-3(2Н)-она,
6-(циклопропилметил)-4-гидрокси-2,3-дигидропиридазин-3-она,
4-гидрокси-6-{1-[4-(трифторметил)фенил]циклопропил}-2,3-дигидропиридазин-3-она,
6-{2-[2-хлор-4-(трифторметил)фенил]этил}-4-гидрокси-2,3-дигидропиридазин-3-она,
6-{2-[2-фтор-4-(трифторметил)фенил]этил}-4-гидрокси-2,3-дигидропиридазин-3-она,
6-{2-[3,5-бис-(трифторметил)фенил]этил}-4-гидрокси-2,3-дигидропиридазин-3-она,
6-{2-[2,4-бис-(трифторметил)фенил]этил}-4-гидрокси-2,3-дигидропиридазин-3-она,
6-{2-[3,4-бис-(трифторметил)фенил]этил}-4-гидрокси-2,3-дигидропиридазин-3-она,
4-гидрокси-6-(3-метил-4-(трифторметил)фенетил)пиридазин-3(2Н)-она,
3,4-бис-(бензилокси)-6-((3-хлор-4-(трифторметил)фенил)этил)пиридазина,
4-гидрокси-6-{2-[2-метил-4-(трифторметил)фенил]этил}-2,3-дигидропиридазин-3-она,
6-{2-[3,5-дифтор-4-(трифторметил)фенил]этил}-4-гидрокси-2,3-дигидропиридазин-3-она,
6-{2-[3-фтор-4-(трифторметил)фенил]этил}-4-гидрокси-2,3-дигидропиридазин-3-она,
и его фармацевтически приемлемые соли.
10. Способ получения соединения формулы (I) или его фармацевтически приемлемой соли, как описано в п.1, который включает в случае, если X представляет собой атом серы или если X представляет собой связь, a Y представляет собой атом серы, взаимодействие соединения формулы (II)
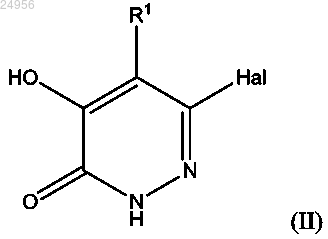
где Hal представляет собой атом галогена и R1 является водородом, с соединением формулы (III)
HS-[Y]t-R3,
где t равен 0 или 1, и Y и R3 являются такими, как описано в формуле (I);
и необязательно с последующим выполнением одной или более из следующих процедур:
преобразование соединения формулы (I) в другое соединение формулы (I);
снятие всех защитных групп;
образование фармацевтически приемлемой соли.
11. Способ получения соединения формулы (I) или его фармацевтически приемлемой соли, как описано в п.1, который включает, в случае если X представляет собой -NR4 или если X представляет собой связь, a Y представляет собой -NR4, взаимодействие соединения формулы (II)
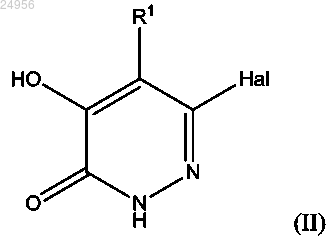
с соединением формулы (VIII)
R4HN-[Y]g-R3,
где g равен 0 или 1, a Y, R3 и R4 являются такими, как описано в формуле (I);
и необязательно с последующим выполнением одной или более из следующих процедур:
преобразование соединения формулы (I) в другое соединение формулы (I);
снятие всех защитных групп;
образование фармацевтически приемлемой соли.
12. Способ получения соединения формулы (I) или его фармацевтически приемлемой соли, как описано в п.1, который включает в случае, если X представляет собой -CR4 R5 - или если X представляет собой связь, a Y представляет собой -CR4R5- и каждый R4 и R5 независимо представляют собой атом водорода или C1-С6 алкильную группу, но одновременно не представляют собой C1-С6 алкильную группу, взаимодействие соединения формулы (II)

с соединением формулы (IXa)
R4C(O)-[Y]h-R3,
где h представляет собой 0 или 1 и Y, R3 и R4 являются такими, как описано выше в формуле (I), с последующей реакцией гидрогенирования;
и необязательно с последующим выполнением одной или более из следующих процедур:
преобразование соединения формулы (I) в другое соединение формулы (I);
снятие всех защитных групп;
образование фармацевтически приемлемой соли.
13. Способ получения соединения формулы (I) или его фармацевтически приемлемой соли, как описано в п.1, который включает в случае, если X представляет собой группу или если X представляет собой связь, a Y представляет собой группу
или если X представляет собой связь, a Y представляет собой группу , взаимодействие соединения формулы (XIII)
, взаимодействие соединения формулы (XIII)
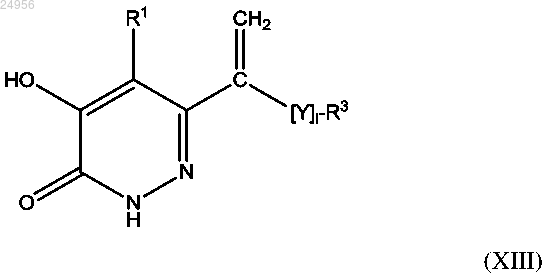
где 1 равен 0 или 1, a Y, R1 и R3 являются такими, как описано в формуле (I), с дийодметаном и цинкмедным элементом;
и необязательно с последующим выполнением одной или более из следующих процедур:
преобразование соединения формулы (I) в другое соединение формулы (I);
снятие всех защитных групп;
образование фармацевтически приемлемой соли.
14. Фармацевтическая композиция для ингибирования фермента оксидазы D-аминокислот (DAAO), содержащая соединение формулы (I) или его фармацевтически приемлемую соль, как описано в любом из пп.1-9, вместе с фармацевтически приемлемым адъювантом, разбавителем или носителем.
15. Применение соединения формулы (I) или его фармацевтически приемлемой соли, как описано в любом из пп.1-9, для лечения состояния, развитие или симптомы которого связаны с активностью фермента оксидазы D-аминокислот (DAAO).
16. Применение соединения формулы (I) или его фармацевтически приемлемой соли, как описано в любом из пп.1-9, для лечения шизофрении, шизофреноформного расстройства, шизоаффективного расстройства, когнитивных расстройств или боли.
17. Комбинация соединения формулы (I) или его фармацевтически приемлемой соли, как описано в любом из пп.1-9, и одного или более агентов, выбранных из карбамазепина, оланзапина, кветиапина, верапамила, ламотригина, окскарбазепина, рисперидона, арипипразола, зипразидона и лития карбонат.
18. Соединение формулы (XXX)
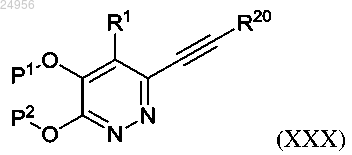
где Р1 и Р2, каждый независимо, представляют собой бензильную защитную группу, R20 представляет собой атом водорода или триметилсилановую уходящую группу и R1 является таким, как описано в формуле (I) в п.1.
Текст
В настоящем изобретении представлены соединения формулы (I) и их фармацевтически приемлемые соли(71)(73) Заявитель и патентовладелец: ТАКЕДА ФАРМАСЬЮТИКАЛ КОМПАНИ ЛИМИТЕД (JP) Изобретение относится к производным пиридазинона, способам их получения, фармацевтическим композициям, содержащим их, и к их применению в терапии, в частности, для лечения или предупреждения состояний, связанных с ферментом оксидазой D-аминокислот (DAAO). В последние десятилетия гипердопаминергическая теория обусловила открытие лекарств против шизофрении и дала известные лекарства, такие как клозапин и оланзапин. Эти эти лекарственные средства могут быть высокоэффективными против положительных симптомов шизофрении и обеспечивают значительное преимущество для многих пациентов, они не являются полным решением, обладая слабым эффектом или не обладая действием против отрицательных и когнитивных аспектов этого заболевания, и в некоторых случаях вызывая неблагоприятные профили побочных эффектов. Среди альтернативных гипотез, гиперглутаматергическая теория обладает гораздо большим достоинством, с первыми реальными данными, поступившими от применения РСР (фенилциклидина), МК 801 или кетамина, прямых антагонистов рецептора N-метил-D-аспартата (NMDA), которые способны вызывать подобную шизофрении симптоматологию у здоровых добровольцев или ухудшение клинических признаков у пациентов с шизофренией. Однако прямое модулирование рецептора NMDA с использованием агонистов оказалось неудачным из-за эксайтотоксичности (избыточной стимуляции нейротрансмиттером), приводящей к нежелательным побочным эффектам. Альтернативный подход заключается в направлении совместных агонистов, необходимых для активации рецептора NMDA. Ими являются глицин и серии (D-SER). В попытках усилить активность рецептора NMDA за счет применения ингибиторов транспорта глицина, были созданы клинические соединения (но до сих пор не имеющиеся в продаже лекарства). D-SER представляет собой совместный агонист даже с большей эффективностью, чем глицин, и поэтому модулирование DSER может представлять собой альтернативную стратегию. Одним из способов увеличения уровней DSER является снижение активности DAAO, фермента, который удаляет его из синаптической щели. В данной области техники известны ингибиторы фермента DAAO. Например, в публикации Adageet al., European Neuropsychopharmacology 2008,18, 200-214 описан AS-057278, низкомолекулярный ингибитор фермента DAAO. Точно так же, в публикации Sparey et al., BioorganicMedicinal Chemistry Letters, 2008, 18, 3386-3391 показано, что молекулы, содержащие небольшие гетероциклические кольца с группой карбоновой кислоты, могут ингибировать фермент DAAO. Ингибиторы DAAO, в которых нет группы карбоновой кислоты, были описаны в публикациях Ferraris et al., J. Med. Chem. 2008, 51, 33573359 и Duplantier et al., J. Med. Chem. 2009, 52, 3576-3585. Дополнительные серии ингибиторов ферментаDAAO с группой карбоновой кислоты, полученные компанией Sepracore, описаны в WO 2008/089453. Ниже представлено описание нового класса соединений, которые представляют собой ингибиторы фермента DAAO, обладающие заданными профилями активности. Соединения настоящего изобретения обладают благотворным действием, селективностью и/или фармакокинетическими свойствами. Таким образом, в соответствии с настоящим изобретением, представлено соединение формулы (I) где R1 представляет собой атом водорода;R2 представляет собой группу -X-Y-R3; или -CR4R5- при условии,X и Y, каждый независимо, представляют собой связь, -S-, -NR4,что оба X и Y не могут одновременно представлять собой связь, и при условии, что если оба X и Y являются отличными от связи, то по меньшей мере один из X и Y представляет собой -CR4R5-; каждый R4 независимо представляет собой атом водорода или C1-С 6 алкиловую группу; каждый R5 независимо представляет собой атом водорода, C1-С 6 алкиловую группу;R3 представляет собой фенил, пиридинил, С 3-6-циклоалкил и оксанил, которые сами необязательно замещены одним-тремя заместителями, выбранными из галогена, C1-С 6 алкила, C1-С 6 галоалкила, C1-С 6 алкокси, C1-С 6 галоалкокси, CN; или его фармацевтически приемлемая соль. В контексте настоящего описания, если не указано иное, то алкиловая, алкениловая или алкиниловая группа заместителя, или алкиловый, алкениловый или алкиниловый фрагмент в группе заместителя может быть линейным или разветвленным. Примеры C1-С 6 алкиловых групп/фрагментов включают метил, этил, пропил, 2-метил-1-пропил, 2-метил-2-пропил, 2-метил-1-бутил, 3-метил-1-бутил, 2-метил-3 бутил, 2,2-диметил-1-пропил, 2-метилпентил, 3-метил-1-пентил, 4-метил-1-пентил, 2-метил-2-пентил, 3 метил-2-пентил, 4-метил-2-пентил, 2,2-диметил-1-бутил, 3,3-диметил-1-бутил, 2-этил-1-бутил, н-бутил,изобутил, трет-бутил, н-пентил, изопентил, неопентил и н-гексил. Примеры С 2-С 6 алкениловых групп/фрагментов включают этенил, пропенил, 1-бутенил, 2-бутенил, 1-пентенил, 1-гексенил, 1,3 бутадиенил, 1,3-пентадиенил, 1,4-пентадиенил и 1-гексадиенил. Примеры C2-C6 алкиниловых групп/фрагментов включают этинил, пропинил, 1-бутинил, 2-бутинил, 1-пентинил и 1-гексинил. Точно так же, алкиленовая группа/фрагмент может быть линейным или разветвленным. Примеры гексилен, 1-метилэтилен, 2-метилэтилен, 1,2-диметилэтилен, 1-этилэтилен, 2-этилэтилен, 1-, 2- или 3 метилпропилен и 1-, 2- или 3-этилпропилен. C1-С 6 галоалкиловая или C1-С 6 галоалкокси группа/фрагмент заместителя содержит, по меньшей мере, один атом галогена, например, один, два, три, четыре или пять атомов галогена, примеры которых включают фторметил, дифторметил, трифторметил,фторметокси, дифторметокси, трифторметокси или пентафторэтил. C1-С 6 гидроксиалкиловая группа/фрагмент заместителя содержит, по меньшей мере, одну гидроксильную группу, например, одну, две,три или четыре гидроксильные группы, примеры которых включают -СН 2 ОН, -СН 2 СН 2 ОН,-СН 2 СН 2 СН 2 ОН, -СН(ОН)СН 2 ОН, -СН(СН 3)ОН и -СН(СН 2 ОН)2. Алкиловые группы в C1-С 6 алкиламиногруппе/фрагменте могут быть одинаковыми или отличающимися друг от друга. В определении R3, насыщенная или ненасыщенная 3-10-членная карбоциклическая или гетероциклическая кольцевая система может иметь алициклические или ароматические свойства, как и 4-6 членный насыщенный или ненасыщенный гетероциклический кольцевой заместитель. Ненасыщенная кольцевая система может быть частично или полностью ненасыщенной. Во избежание неясности, если R3 представляет собой необязательно замещенную 3-10-членную насыщенную или ненасыщенную карбоциклическую или гетероциклическую кольцевую систему, то следует понимать, что настоящее изобретение не охватывает какие-либо неустойчивые кольцевые структуры или любые связи О-О, O-S или S-S, и что заместитель, при его наличии, может быть присоединен к любому подходящему кольцевому атому. Фрагмент R3 может быть присоединен к любому гетероатому или углеродному атому, с образованием устойчивой структуры. Такие же комментарии относятся к необязательному 4-6-членному насыщенному или ненасыщенному гетероциклическому кольцевому заместителю в кольцевой системе R3. Если описано, что какой-либо химический фрагмент или группа в формуле (I) необязательно замещена, следует понимать, что этот фрагмент или группа может быть незамещенной или замещенной одним или более из указанных заместителей. Следует понимать, что количество и природу заместителей выбирают так, чтобы избегать стерически неприемлемых комбинаций. В одном варианте реализации настоящего изобретения, R1 представляет собой атом водорода. X иY, каждый независимо, представляют собой связь, атом кислорода или группу -S-, -NR4,или-CR4R5-, при условии, что оба X и Y не могут одновременно представлять собой связь, и при условии,что если оба X и Y являются отличными от связи, то по меньшей мере один из X и Y представляет собой-CR4R5-. Каждый R4 независимо представляет собой атом водорода или C1-С 6, или С 1-С 4, или С 1-С 2 алкиловую, предпочтительно, метиловую группу. Каждый R5 независимо представляет собой атом водорода или C1-С 6, или С 1-С 4, или С 1-С 2 алкиловую, предпочтительно, метиловую группу. В одном варианте реализации настоящего изобретения X представляет собой связь, атом кислорода или группу -S-, -NR4,или -CR4R5- (например, CH2 или СН(СН 3, a Y представляет собой связь 4 5 или -CR R - (например, СН 2 или СН(СН 3, с учетом представленных выше условий. В другом варианте реализации настоящего изобретения, X представляет собой связь, атом кислорода или группу -S-,или -CR4R5- (например, CH2 или СН(СН 3, a Y представляет собой связь или 4 5-CR R - (например, CH2 или СН(СН 3, с учетом представленных выше условий. В другом варианте реализации настоящего изобретения X представляет собой -CR4R5- (например,СН 2 или СН(СН 3, a Y представляет собой связь, или группу -S-, -NR4,или -CR4R5- (например,СН 2 или СН(СН 3, с учетом представленных выше условий. В следующем варианте реализации, X представляет собой группу -S-, -CHR4 (например, CH2 или СН(СН 3 или, a Y представляет собой связь или группу -CHR4 (например, СН 2), с учетом представленных выше условий. В следующем варианте реализации, X представляет собой группу -S-, -NR4 (например, N(СН 3,-CHR4 (например, СН 2 или СН(СН 3 или, в частности, -CHR4, a Y представляет собой группу 4-CHR (например, СН 2), с учетом представленных выше условий. Конкретные примеры комбинаций X и Y включают любую одну или более из следующих комбинаций: В одном варианте реализации настоящего изобретения предпочтительные комбинации X и Y включают любую одну или более из следующих комбинаций: В другом варианте реализации настоящего изобретения предпочтительно, чтобы оба X и Y представляли собой СН 2-. В соответствии с одним аспектом настоящего изобретения R3 может представлять собой фенил, пиридинил, С 3-6-циклоалкил и оксанил, которые необязательно замещены одним-тремя заместителями (например, независимо одним, двумя или тремя заместителями), выбранным из галогена (например, фтора,хлора или брома), C1-С 6, или С 1-С 4, или С 1-С 2 алкила, C1-C6, или С 1-С 4, или С 1-С 2 галоалкила, C1-C6, или С 1-С 4, или С 1-С 2 алкокси, C1-C6, или С 1-С 4, или С 1-С 2 галоалкокси, -CN. В одном варианте реализации настоящего изобретения R3 представляет собой фенил, пиридинил,С 3-6-циклоалкил и оксанил, необязательно замещенные, одним-тремя заместителями (например, независимо одним, двумя, тремя заместителями), выбранным из галогена (например, фтора, хлора или бром),циано, С 1-С 4 алкила (например, метила или этила), С 1-С 2 галоалкила (например, дифторметила или трифторметила), С 1-С 4 алкокси (например, метокси или этокси), С 1-С 2 галоалкокси (например, дифторметокси или трифторметокси). В другом варианте реализации настоящего изобретения, R3 представляет собой фенил, пиридинил,С 3-6-циклоалкил и оксанил, необязательно замещенные независимо одним, двумя, тремя заместителями,независимо выбранными из фтора, хлора, циано, С 1-С 4 алкила (например, метила или этила), С 1-С 2 галоалкила (например, дифторметила или трифторметила), С 1-С 4 алкокси (например, метокси или этокси, С 1 С 2 галоалкокси (например, дифторметокси или трифторметокси). В другом варианте реализации, R3 представляет собой 3-6-членную, предпочтительно, 5-6-членную насыщенную или ненасыщенную карбоциклическую или гетероциклическую кольцевую систему, такую как циклопропил, циклопентил, циклогексил, фенил или пиридинил, и эта кольцевая система необязательно замещена, одним-тремя заместителями (например, независимо одним, двумя, тремя, предпочтительно одним или двумя заместителями), выбранным из циано, фтора, хлора, метила, дифторметила, дифторметокси, трифторметила, трифторметокси и метокси. Конкретные примеры R3 включают один или более из следующих заместителей в любой комбинации: Кольцевые заместители R независимо выбраны из циано, галогена (например, фтора или хлора),метила, метокси, дифторметила, дифторметкоси, трифторметила или трифторметокси. В предпочтительном варианте реализации настоящего изобретенияR1 представляет собой атом водорода;R2 представляет собой группу -X-Y-R3;X представляет собой группу -S или -CHR4; иY представляет собой группу -CHR4; каждый R4 независимо представляет собой атом водорода или метиловую группу; иR3 представляет собой фенил, пиридинил, С 5-6-циклоалкил и оксанил, необязательно замещенные,одним-тремя заместителями, выбранными из фтора, хлора, трифторметила и метокси. В другом предпочтительном варианте реализации настоящего изобретенияR1 представляет собой атом водорода;R2 представляет собой группу -X-Y-R3;X представляет собой группу -S, -CHR4 или,a Y представляет собой связь или группу -CHR4; каждый R4 независимо представляет собой атом водорода или метиловую группу, предпочтительно атом водорода; иR3 представляет собой фенил, пиридинил, С 3-6-циклоалкил и оксанил, необязательно замещенные,одним-тремя заместителями (предпочтительно независимо одним или двумя заместителями), выбранным из фтора, хлора, дифторметила, трифторметила, трифторметокси и метокси. В другом предпочтительном варианте реализации настоящего изобретенияR1 представляет собой атом водорода;R2 представляет собой группу -X-Y-R3;,X представляет собой группу -S, -NR4, -CHR4 илиa Y представляет собой связь или группу -CHR4; каждый R4 независимо представляет собой атом водорода или метиловую группу, предпочтительно атом водорода; иR3 представляет собой фенил, пиридинил, С 3-6-циклоалкил и оксанил,необязательно замещенные, одним-тремя заместителями (предпочтительно независимо одним или двумя заместителями), выбранными из циано, фтора, хлора, дифторметила, дифторметокси, трифторметила, трифторметокси, метила и метокси. Примеры соединений настоящего изобретения включают 4-гидрокси-6-(2-фенилэтил)пиридазин-3(2 Н)-он,6-[2-(4-фторфенил)этил]-4-гидроксипиридазин-3(2 Н)-он,4-гидрокси-6-2-[5-(трифторметил)пиридин-2-ил]этилпиридазин-3(2 Н)-он,6-[(4-хлорбензил)сульфанил]-4-гидроксипиридазин-3(2 Н)-он,4-гидрокси-6-2-[6-(трифторметил)пиридин-3-ил]этилпиридазин-3(2 Н)-он,6-[2-(3-фторфенил)этил]-4-гидроксипиридазин-3(2 Н)-он,6-[2-(2-фторфенил)этил]-4-гидроксипиридазин-3(2 Н)-он,6-[2-(3,5-дифторфенил)этил]-4-гидроксипиридазин-3(2 Н)-он,6-[2-(3,4-дифторфенил)этил]-4-гидроксипиридазин-3(2 Н)-он,4-гидрокси-6-2-[3-(трифторметокси)фенил]этилпиридазин-3(2 Н)-он,4-гидрокси-6-2-[3-(трифторметил)фенил]этилпиридазин-3(2 Н)-он,4-гидрокси-6-2-[5-(трифторметил)пиридин-3-ил]этилпиридазин-3(2 Н)-он,6-(2-циклогексилэтил)-4-гидроксипиридазин-3(2 Н)-он,6-(2-циклопропилэтил)-4-гидроксипиридазин-3(2 Н)-он,6-(2-циклопентилэтил)-4-гидроксипиридазин-3(2 Н)-он,4-гидрокси-6-[2-(4-метоксициклогексил)этил]пиридазин-3(2 Н)-он,6-[2-(2,4-дифторфенил)этил]-4-гидроксипиридазин-3(2 Н)-он,6-2-[3-(дифторметил)фенил]этил-4-гидроксипиридазин-3(2 Н)-он,6-бензил-4-гидроксипиридазин-3(2 Н)-он,6-[2-(3-хлорфенил)этил]-4-гидроксипиридазин-3(2 Н)-он,4-гидрокси-6-(1-фенилциклопропил)пиридазин-3(2 Н)-он,-4 024956 4-[2-(5-гидрокси-6-оксо-1,6-дигидропиридазин-3-ил)этил]бензонитрил,6-[2-(3-фтор-4-метилфенил)этил]-4-гидроксипиридазин-3(2 Н)-он,6-[2-(4-фтор-3-метилфенил)этил]-4-гидроксипиридазин-3(2 Н)-он,6-[2-(3,4-диметоксифенил)этил]-4-гидроксипиридазин-3(2 Н)-он,4-гидрокси-6-2-[3-(трифторметокси)фенил]этилпиридазин-3(2 Н)-он,6-[2-(4-хлорфенил)этил]-4-гидроксипиридазин-3(2 Н)-он,6-[2-(2-хлорфенил)этил]-4-гидроксипиридазин-3(2 Н)-он,4-гидрокси-6-2-[2-(трифторметил)фенил]этилпиридазин-3(2 Н)-он,6-(4-(дифторметокси)фенетил)-4-гидроксипиридазин-3(2 Н)-он,6-(4-(трифторметокси)фенетил)-4-гидроксипиридазин-3(2 Н)-он,6-(3-(дифторметокси)фенетил)-4-гидроксипиридазин-3(2 Н)-он,6-[1-(4-фторфенил)циклопропил]-4-гидроксипиридазин-3(2 Н)-он,6-[1-(4-фторфенил)этил]-4-гидроксипиридазин-3(2 Н)-он,4-гидрокси-6-1-[3-(трифторметил)фенил]этилпиридазин-3(2 Н)-он,4-гидрокси-6-2-[4-(трифторметил)фенил]этилпиридазин-3(2 Н)-он,6-циклопропилметил)(метил)амино)-4-гидроксипиридазин-3(2 Н)-он,6-циклогексилметил)(метил)амино)-4-гидроксипиридазин-3(2 Н)-он,6-(3-хлорбензил)-4-гидроксипиридазин-3(2 Н)-он,6-(4-хлорбензил)-4-гидроксипиридазин-3(2 Н)-он,6-(циклогексилметил)-4-гидроксипиридазин-3(2 Н)-он,6-(4-фторбензил)-4-гидроксипиридазин-3(2 Н)-он,6-(2-хлор-6-фторбензил)-4-гидроксипиридазин-3(2 Н)-он,6-(2-хлорбензил)-4-гидроксипиридазин-3(2 Н)-он,6-(3-фторбензил)-4-гидроксипиридазин-3(2 Н)-он,6-(2-фторбензил)-4-гидроксипиридазин-3(2 Н)-он,6-(4-метилбензил)-4-гидроксипиридазин-3(2 Н)-он,6-(3-метилбензил)-4-гидроксипиридазин-3(2 Н)-он,4-гидрокси-6-(3-(трифторметил)бензил)пиридазин-3(2 Н)-он,4-гидрокси-6-2-[5-(трифторметил)пиридин-3-ил]этилпиридазин-3(2 Н)-он,4-гидрокси-6-[2-(оксан-4-ил)этил]пиридазин-3(2 Н)-он,6-[(4-фторфенил)метил](метил)амино-4-гидроксипиридазин-3(2 Н)-он,6-[2-(2,6-дифторфенил)этил]-4-гидроксипиридазин-3(2 Н)-он,6-[2-(2-хлор-6-фторфенил)этил]-4-гидроксипиридазин-3(2 Н)-он,6-[3,5-бис(трифторметил)фенил]метил-4-гидроксипиридазин-3(2 Н)-он,6-(1-фенилэтил)-4-гидроксипиридазин-3(2 Н)-он,6-(циклопропилметил)-4-гидрокси-2,3-дигидропиридазин-3-он,4-гидрокси-6-1-[4-(трифторметил)фенил]циклопропил-2,3-дигидропиридазин-3-он,6-2-[2-хлор-4-(трифторметил)фенил]этил-4-гидрокси-2,3-дигидропиридазин-3-он,6-2-[2-фтор-4-(трифторметил)фенил]этил-4-гидрокси-2,3-дигидропиридазин-3-он,6-2-[3,5-бис(трифторметил)фенил]этил-4-гидрокси-2,3-дигидропиридазин-3-он,6-2-[2,4-бис(трифторметил)фенил]этил-4-гидрокси-2,3-дигидропиридазин-3-он,6-2-[3,4-бис(трифторметил)фенил]этил-4-гидрокси-2,3-дигидропиридазин-3-он,4-гидрокси-6-(3-метил-4-(трифторметил)фенетил)пиридазин-3(2 Н)-он,3,4-бис(бензилокси)-6-3-хлор-4-(трифторметил)фенил)этил)пиридазин,4-гидрокси-6-2-[2-метил-4-(трифторметил)фенил]этил-2,3-дигидропиридазин-3-он,6-2-[3,5-дифтор-4-(трифторметил)фенил]этил-4-гидрокси-2,3-дигидропиридазин-3-он,6-2-[3-фтор-4-(трифторметил)фенил]этил-4-гидрокси-2,3-дигидропиридазин-3-он и фармацевтически приемлемые соли любых из этих соединений. Следует отметить, что каждое из химических соединений, перечисленных выше, представляет собой конкретный и независимый аспект настоящего изобретения. В настоящем изорбетении дополнительно представлен способ получения соединения формулы (I) или его фармацевтически приемлемой соли, описанной в настоящем документе, который включает(i) если X представляет собой атом серы или если X представляет собой связь, a Y представляет собой атом серы - взаимодействие соединения формулы (II) где Hal представляет собой атом галогена, такой как хлор, и R1 является таким, как описано в формуле (I), с соединением формулы (III), HS-[Y]t-R3, где t равен 0 или 1, и Y и R3 являются такими, как опи-5 024956-NR , - взаимодействие соединения формулы (II), описанного выше в пункте (i), с соединением формулы(х) если X представляет собой -CR4R5-, или если X представляет собой связь, a Y представляет собой -CR4R5-, и каждый R4 и R5 независимо представляют собой атом водорода или C1-C6 алкиловую группу, но одновременно не представляют собой C1-C6 алкиловую группу, - взаимодействие соединения формулы (II), описанного выше в пункте (i), с соединением формулы (IXa), R4C(O)-[Y]h-R3, где h представляет собой 0, или Y, R3 и R4 являются таким, как описано выше в формуле (I), с последующей реакцией гидрогенирования; или(xi) если каждый X и Y независимо представляет собой -CHR4, - гидрогенирование соединения формулы (X)(xiv) если X представляет собой группу ляет собой группу- взаимодействие соединения формулы (XIII) где l равен 0 или 1, a Y, R1 и R3 являются такими, как описано в формуле (I), с дийодметаном и цинкмедным элементом; и необязательно с последующим выполнением одной или более из следующих процедур: преобразование соединения формулы (I) в другое соединение формулы (I); снятие всех защитных групп; образование фармацевтически приемлемой соли. Способ (i) может быть легко выполнен в органическом растворителе, таком как толуол, в присутствии палладиевого катализатора, например, трис(дибензилиденацетон)дипалладия(0) (Pd2(DBA)3), и фосфорорганического соединения, такого как 4,5-бис(дифенилфосфино)-9,9-диметилксантен (Xantphos). Реакция аминирования в способе (viii) может быть легко выполнена в органическом растворителе,таком как толуол, в присутствии (1) палладиевого катализатора, такого как трис(дибензилиденацетон) дипалладий(0) (Pd2(DBA)3), (2) основания, такого как трет-бутоксид натрия, и (3) фосфорорганического соединения, такого как 4,5-бис(дифенилфосфино)-9,9-диметилксантен (Xantphos). Способы (ix) и (х) могут быть легко выполнены в органическом растворителе, таком как диэтиловый эфир, при низкой температуре (например, -78 С), в присутствии реагента, такого как бутиллитий. Реакция гидрогенирования в способе (х) и способе (xi) может быть выполнена в соответствии с известными в данной области приемами, например, в присутствии органического растворителя, такого как этанол, с использованием газообразного водорода и катализатора палладия на углероде, при необходимости, в условиях кислотного катализа. Способы (xiii) и (xiv) аналогичны реакции циклопропанирования алкенов Симмонса-Смита, например, как описано в публикации Howard H. Simmons, Ronald D. Smith (1959) "A New Synthesis of Cyclopropanes" J. Am. Chem. Soc. 81 (16): 4256-4264. Соединения формулы (IV), в которых Р 1 представляет собой защитную группу, такую как-СН 2 СН 2 С(О)ОСН 3, могут быть получены взаимодействием соединения формулы (II), описанной выше, с метил 3-сульфанилпропаноатом. Соединения формулы (VII) могут быть получены взаимодействием соединения формулы (II), описанной выше, с диоксидом углерода в органическом растворителе, таком как диэтиловый эфир, при низкой температуре (например, -78 С), в присутствии реагента, такого как бутиллитий. Соединения формулы (X), в которых группы CR4 связаны двойной углерод-углеродной связью, могут быть получены по способам, аналогичным способу (xii), описанному выше. Соединения формулы (X), в которых группы CR связаны тройной углерод-углеродной связью, и каждый R4 представляет собой атом водорода, a R3 представляет собой необязательно замещенную гетероциклическую кольцевую систему, могут быть получены по следующей схеме реакции: Стадию 1 осуществлют взаимодействием пиридазинового соединения (в котором R1 является таким, как описано ранее в настоящем документе) с этинилтриметилсиланом в органическом растворителе,таком как тетрагидрофуран. Стадию 2 осуществляют с использованием карбоната калия в полярном растворителе, таком как метанол. Стадию 3 осуществляют с использованием соединения формулы R3-Br, где R3 представляет собой необязательно замещенную гетероциклическую кольцевую систему, как описано ранее в настоящем документе, в присутствии йодида меди (I) и соответствующего палладиевого катализатора. Соединения формулы (X), в которых группы CR4 связаны тройной углерод-углеродной связью, и каждый R4 представляет собой атом водорода, a R3 представляет собой необязательно замещенную карбоциклическую кольцевую систему, могут быть получены по следующей схеме реакции: Стадию 4 осуществляют взаимодействием соединения формулы (II), описанной ранее в настоящем документе, с соединением формулы НС=C-R3, где R3 представляет собой необязательно замещенную карбоциклическую кольцевую систему, как описано ранее в настоящем документе, в присутствии йодида меди (I) и соответствующего палладиевого катализатора. Соединения формулы (XI) могут быть получены взаимодействием соединения формулы (II), описанной выше, с диметилформамидом в органическом растворителе, таком как диэтиловый эфир, при низкой температуре (например, -78 С), в присутствии реагента, такого как бутиллитий, необязательно с последующей реакцией алкилирования. Соединения формулы (XII) могут быть получены по такому же способу, который используют для получения соединений формулы (X). Соединения формулы (XIII) могут быть получены по следующей схеме реакции: Стадию а выполняют с использованием, например, цианида меди. Соединение формулы (II) является таким, как описано ранее в настоящем документе. Стадию b выполняют с использованием реагента Гриньяра формулы R3-[Y]l-MgBr где l, Y и R3 являются такими, как описано в формуле (XIII). Стадию с выполняют с использованием раствора реагента Теббе (бис(циклопентадиенил)хлор(диметилалюминий)метилентитан). Соединения формул (II), (III), (V), (Va), (VI), (VIII), (IX), (IXa) и (IXb) имеются в продаже, хорошо известны в литературе или могут быть получены по известным методикам. В настоящем изобретении дополнительно представлены некоторые новые промежуточные соединения, например, промежуточные соединения формулы (XXX) где Р 1 и Р 2, каждый независимо, представляют собой защитную группу (например, бензил), R20 представляет собой атом водорода или уходящую группу (например, триметилсилан, Si(СН 3)3), и R1 является таким, как описано выше в формуле (I). Специалистам в данной области понятно, что в способах настоящего изобретения для некоторых функциональных групп, таких как фенольные, гидроксильные или аминогруппы в реагентах, может потребоваться защита защитными группами. Так, получение соединений формулы (I) может включать на соответствующей стадии, снятие одной или более защитных групп. Защита и снятие защиты функциональных групп описано в публикации 'Protective Groups in OrganicChemistry', под редакцией J.W.F. McOmie, Plenum Press (1973) и в публикации 'Protective Groups in Organic Synthesis', 3 е издание, T.W. Greene and P.G.M. Wuts, Wiley-Interscience (1999). Соединения формулы (I), описанные выше, могут быть преобразованы в их фармацевтически приемлемые соли, предпочтительно, соли присоединения кислот, такие как гидрохлоридная, гидробромидная, бензолсульфонатная (безилатная), сахаринатная (например, моносахаринатная), трифторацетатная,сульфатная, нитратная, фосфатная, ацетатная, фумаратная, малеатная, тартратная, лактатная, цитратная,пируватная, сукцинатная, валератная, пропаноатная, бутаноатная, малонатная, оксалатная, 1-гидрокси-2 нафтоатная (ксинафоатная), метансульфонатная или п-толуолсульфонатная соль. В одном аспекте настоящего изобретения, соединения формулы (I) могут иметь одну или более радиоактивных меток. Такие радиоактивные метки могут быть внедрены с использованием реагентов, содержащих радиоактивную метку, при синтезе соединений формулы (I), или могут быть внедрены связыванием соединений формулы (I) с хелатирующими фрагментами, способными связываться с радиоактивным атомом металла. Такие варианты соединений с радиоактивной меткой могут быть использованы,например, в диагностических исследованиях с визуализацией. Соединения формулы (I) и их соли могут быть в форме гидратов или сольватов, которые образуют аспект настоящего изобретения. Такие сольваты могут быть образованы с обычными органическими растворителями, включая, но не ограничиваясь этим, спиртовые растворители, например, метанол, этанол или изопропанол. Соединения формулы (I) могут существовать в стереоизомерных формах. Следует понимать, что настоящее изобретение охватывает применение всех геометрических и оптических изомеров (включая атропизомеры) соединений формулы (I) и их смесей, включая рацематы. Применение таутомеров и их смесей также образует аспект настоящего изобретения. Особенно предпочтительны энантиомерно чистые формы. Соединения формулы (I) и их фармацевтически приемлемые соли обладают активностью фармацевтических средств, в частности, в качестве ингибиторов фермента оксидазы D-аминокислот (DAAO), и поэтому могут быть использованы при лечении шизофрении и других психотических расстройств (например, психотического расстройства, психоза), деменции и других когнитивных расстройств, тревожных расстройств (например, генерализованного тревожного расстройства), аффективных расстройств(например, депрессивных расстройств, основных депрессивных расстройств, биполярных расстройств,включая биполярное I и II, биполярную манию, биполярную депрессию), расстройств сна, расстройств,которые обычно впервые диагностируются в младенчестве, детстве или юности (например, расстройство дефицита внимания и расстройства разрушительного поведения), боли (например, невропатической боли) и нейродегенеративных расстройств (например, болезни Паркинсона или Альцгеймера). Таким образом, в настоящем изобретении представлено соединение формулы (I) или его фармацевтически приемлемая соль, как описано ранее в настоящем документе, для применения в терапии, в частности, для лечения состояний, развитие или симптомы которых связаны с активностью фермента DAAO. В настоящем изобретении представлено также применение соединения формулы (I) или его фармацевтически приемлемая соль, как описано ранее в настоящем документе, для получения лекарственного средства для лечения состояний, развитие или симптомы которых связаны с активностью ферментаDAAO. В контексте настоящего описания, термин "терапия" включает также "профилактику", если нет специальных указаний на обратное. Соответствующим образом следует толковать также термины "терапевтический" и "терапевтически". Профилактика, предположительно, особенно уместна при лечении людей, которые уже испытывали эпизод или иным образом считаются имеющими повышенный риск рассматриваемого расстройства или состояния. Субъекты с риском развития конкретного расстройства или состояния, как правило, включают тех, которые имеют семейный анемнез расстройства или состояния, или тех, которые генетическим тестированием или скринингом были идентифицированы как особенно подверженные развитию расстройства или состояния, или тех, которые находятся в продромальной фазе расстройства. В частности, соединения настоящего изобретения (включая фармацевтически приемлемые соли) могут быть использованы при лечении положительных симптомов шизофрении, шизофреноформного расстройства или шизоаффективного расстройства (например, голоса или галлюцинации), когнитивных расстройств (таких как деменция и ухудшенная познавательная способность), а также боли (такой как невропатическая боль). В настоящем изобретении представлен также способ лечения, по меньшей мере, одного симптома или состояния, связанного с шизофренией, шизофреноформным расстройством, шизоаффективным расстройством и другими психотическими расстройствами (например, психотическим расстройством, психозом), деменцией и другими когнитивными расстройствами, тревожными расстройствами (например,основным тревожным расстройством), аффективными расстройствами (например, депрессивными расстройствами, основными депрессивными расстройствами, биполярными расстройствами, включая биполярное I и II, биполярной манией, биполярной депрессией), расстройствами сна, расстройствами, которые обычно впервые диагностируются в младенчестве, детстве или юности (например, расстройство дефицита внимания, расстройства аутического спектра и расстройства разрушительного поведения), болью(например, невропатической болью) и нейродегенеративными расстройствами (например, болезнью Паркинсона или Альцгеймера), который включает введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, как описано ранее в настоящем документе. Такие симптомы и состояния включают, но не ограничиваясь этим, тревогу, волнение, враждебность, панику, нарушение питания, аффективный симптом, симптом изменения настроения, отрицательный и положительный психотический симптом, обычно связанный с психозом и нейродегенеративным расстройством. Для вышеупомянутых терапевтических применений, вводимые дозы, конечно, варьируются в зависимости от используемого соединения, способа введения, заданного лечения и указанного расстройства. Например, дневная доза соединения настоящего изобретения, при ингаляции, может быть в диапазоне от 0,05 микрограмм на килограмм веса тела (мкг/кг) до 100 микрограмм на килограмм веса тела (мкг/кг). Альтернативно, если соединение вводят перорально, то дневная доза соединения настоящего изобретения может быть в диапазоне от 0,01 микрограмм на килограмм веса тела (мкг/кг) до 100 миллиграмм на килограмм веса тела (мг/кг). Соединения формулы (I) и их фармацевтически приемлемые соли могут быть использованы в чистом виде, но обычно их вводят в форме фармацевтической композиции, в которой соединение формулы(1)/соль (активный ингредиент) смешан с фармацевтически приемлемым адъювантом, разбавителем или носителем. Следовательно, в настоящем изобретении дополнительно представлена фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемую соль, как описано ранее в настоящем документе, в сочетании с фармацевтически приемлемым адъювантом, разбавителем или носителем. В настоящем изобретении дополнительно представлен способ получения фармацевтической композиции настоящего изобретения, который включает смешивание соединения формулы (I) или его фармацевтически приемлемой соли, как описано ранее в настоящем документе, с фармацевтически приемлемым адъювантом, разбавителем или носителем. Стандартные способы для выбора и приготовления соответствующих фармацевтических композиций описаны, например, в публикации "Pharmaceutics -The Science of Dosage Form Design", M. E. Aulton,Churchill Livingstone, 1988. Фармацевтически приемлемые адъюванты, разбавители или носители, которые могут быть использованы в фармацевтических композициях настоящего изобретения, включают стандартно используемые в области составления фармацевтических композиции и включают, но не ограничиваясь этим, сахара,сахарные спирты, крахмалы, ионообменники, оксид алюминия, стеарат алюминия, лецитин, белки сыворотки, такие как альбумин сыворотки человека, буферные вещества, такие как фосфаты, глицин, сорбиновую кислоту, сорбат калия, смеси неполных глицеридов насыщенных растительных жирных кислот,воду, соли или электролиты, такие как сульфат протамина, гидрофосфат динатрия, гидрофосфат калия,хлорид натрия, соли цинка, коллоидный диоксид кремния, трисиликат магния, поливинилпирролидон,вещества на основе целлюлозы, полиэтиленгликоль, натрия карбоксиметилцеллюлозу, полиакрилаты,воски, полиэтилен-полиоксипропиленовые блок-полимеры, полиэтиленгликоль и ланолин. Фармацевтические композиции настоящего изобретения могут быть введены перорально, парентерально, ингаляцией спрея, ректально, назально, буккально, вагинально или через имплантированный резервуар. Предпочтительно пероральное введение. Фармацевтические композиции настоящего изобретения могут содержать любые стандартные нетоксичные фармацевтически приемлемые адъюванты, разбавители или носители. Термин "парентерально", используемый в настоящем документе, включает подкожный, внутрикожный, внутривенный, внутримышечный, внутрисуставный, внутрисиновиальный,внутристернальный, внутритекальный, внутритканевый и внутричерепный способ введения инъекций или инфузий. Фармацевтические композиции могут быть в форме стерильного препарата для инъекций, например, такого как стерильная водная или масляная суспензия для инъекций. Суспензия может быть составлена в соответствии с методиками, известными в данной области, при помощи пригодных диспергирующих или увлажняющих агентов (таких как, например, Tween 80) и суспендирующих агентов. Стерильные композиции для инъекций могут также быть стерильным раствором или суспензией для инъекций в нетоксичном, приемлемом для парентерального введения разбавителе или растворителе, например, таком как раствор в 1,3-бутандиоле. Среди приемлемых разбавителей и растворителей, которые можно использовать, - манит, вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, в качестве растворителей или суспендирующей среды обычно используют стерильные нелетучие масла. Для этой цели могут быть использованы любые безвкусные нелетучие масла, включая синтетические моно- или диглицериды. Жирные кислоты, такие как олеиновая кислота и ее глицеридные производные, пригодны в производстве препаратов для инъекций, как и природные фармацевтически приемлемые масла, такие как оливковое масло или касторовое масло, в частности, в их полиоксиэтилированных формах. Эти масляные растворы или суспензии могут также содержать длинноцепочечный спиртовый разбавитель или диспергирующее средство, такие как описаны в публикации Ph. Helv., или аналогичный спирт. Фармацевтические композиции настоящего изобретения могут быть введены перорально в любой лекарственной форме, приемлемой для перорального введения, включая, но не ограничиваясь этим, капсулы, таблетки, порошки, гранулы и водные суспензии и растворы. Эти лекарственные формы приготавливают в соответствии с методиками, хорошо известными в области составления фармацевтических композиций. В случае таблеток для перорального применения, обычно используемые носители включают лактозу и кукурузный крахмал. Обычно добавляют также смазывающие агенты, такие как стеарат магния. Для перорального введения в форме капсул, применимые разбавители включают лактозу и высушенный кукурузный крахмал. При пероральном введении водных суспензий, активный ингредиент смешивают с эмульгирующими и суспендирующими агентами. При необходимости могут быть добавлены некоторые подсластители и/или вкусовые добавки, и/или красители. Фармацевтические композиции настоящего изобретения также могут быть введены в форме суппозиториев для ректального введения. Эти композиции могут быть получены смешиванием активного ингредиента с пригодным нераздражающим формообразующим средством, которое является твердым при комнатной температуре, но жидким при ректальной температуре, и поэтому плавится в прямой кишке с высвобождением активного ингредиента. Такие материалы включают, но не ограничиваясь этим, масло какао, пчелиный воск и полиэтиленгликоли. Фармацевтические композиции настоящего изобретения также могут быть введены в виде назального аэрозоля или ингаляцией. Такие композиции приготавливают в соответствии с методиками, хорошо известными в области составления фармацевтических композиций, и они могут быть получены в виде растворов в физрастворе, с использованием бензилового спирта или других пригодных консервантов,ускорителей абсорбции для улучшения биодоступности, фторуглеродов и/или других солюбилизирующих или диспергирующих агентов, известных в данной области. В зависимости от способа введения, фармацевтическая композиция предпочтительно содержит от 0,05 до 99 вес.% (весовых процентов), более предпочтительно, от 0,05 до 80 вес.%, еще более предпочтительно от 0,10 до 70 вес.%, и еще более предпочтительно от 0,10 до 50 вес.% активного ингредиента, все весовые проценты рассчитаны в отношении общего веса композиции. Соединения настоящего изобретения (то есть соединения формулы (I) и их фармацевтически приемлемые соли) также могут быть введены вместе с другими соединениями, применяемыми для лечения указанных выше состояний и/или с серином. Таким образом, настоящее изобретение дополнительно относится к комплексным терапиям, в которых соединение настоящего изобретения или фармацевтическую композицию, или композицию, содержащую соединение настоящего изобретения, вводят с другим терапевтическим агентом или агентами,и/или с серином для лечения одного или более состояний, указанных ранее. Такие терапевтические агенты могут быть выбраны из следующих:(iv) транквилизаторы, включая, например, алнеспирон, азапироны, бензодиазепины, барбитураты и их эквиваленты и фармацевтически активные изомер(ы), и/или метаболит(ы). Примеры транквилизаторов включают адиназолам, алпразолам, балезепам, бентазепам, бромазепам, бротизолам, буспирон, клоназепам, клоразепат, хлордиазепоксид, ципразепам, диазепам, дифенгидрамин, эстазолам, фенобам, флунитразепам, флуразепам, фозазепам, лоразепам, лорметазепам, мепробамат, мидазолам, нитразепам, оксазепам, празепам, квазепам, реклазепам, траказолат, трепипам, темазепам, триазолам, улдазепам и золазепам; и их эквиваленты и фармацевтически активные изомер(ы), и/или метаболит(ы);(vi) средства против болезни Альцгеймера, включая, например, донепезил, мемантин, такрин и их эквиваленты и фармацевтически активные изомер(ы), и/или метаболит(ы);(vii) средства против болезни Паркинсона, включая, например, депренил, L-допа, реквип, мирапекс,ингибиторы МАОВ, такие как селегин и разагилин, ингибиторы comP, такие как тасмар, ингибиторы А 2, ингибиторы повторного захвата допамина, антагонисты NMDA, агонисты никотина и агонисты допамина, а также ингибиторы нейронной синтазы оксида азота, и их эквиваленты и фармацевтически активные изомер(ы), и/или метаболит(ы);(х) средства против недержания мочи, включая, например, дарафенацин, флавоксат, оксибутинин,пропиверин, робалзотан, солифенацин и толтеродин, и их эквиваленты и фармацевтически активные изомер(ы), и/или метаболит(ы);(xi) средства против невропатической боли, включая, например, габапентин, лидодерм и прегаблин,и их эквиваленты и фармацевтически активные изомер(ы), и/или метаболит(ы);(xii) средства против ноцицептивной боли, такие как, например, целекоксиб, эторикоксиб, лумиракоксиб, рофекоксиб, валдекоксиб, диклофенак, локсопрофен, напроксен и парацетамол, и их эквиваленты и фармацевтически активные изомер(ы), и/или метаболит(ы);(xviii) ингибиторы хемокинового рецептора CCR1; иWO 02/094794. В таких комбинированных продуктах используют соединения настоящего изобретения в пределах диапазона доз, описанного в настоящем документе, и другой фармацевтически активный агент в пределах разрешенных диапазонов доз и/или доз, описанных в публикации, на которую сделана ссылка. В дополнительном аспекте настоящего изобретения представлена комбинация (например, для лечения шизофрении, когнитивных расстройств или боли) соединения формулы (I) или его фармацевтически приемлемой соли, как описано ранее в настоящем документе, и одного или более агентов, выбранных из карбамазепина, оланзапина, кветиапина, верапамила, ламотригина, окскарбазепина, рисперидона, арипипразола, зипразидона и лития (лития карбоната). В настоящем изобретении представлен также фармацевтический продукт, содержащий, в комбинации, препарат первого активного ингредиента, который представляет собой соединение формулы (I) или его фармацевтически приемлемую соль, как описано ранее в настоящем документе, и препарат второго активного ингредиента, который представляет собой карбамазепин, оланзапин, кветиапин, верапамил,- 11024956 ламотригин, окскарбазепин, рисперидон, арипипразол, зипразидон или литий, для одновременного, последовательного или раздельного применения в терапии. В другом аспекте настоящего изобретения представлен набор, содержащий препарат первого активного ингредиента, который представляет собой соединение формулы (I) или его фармацевтически приемлемую соль, как описано ранее в настоящем документе, и препарат второго активного ингредиента, который представляет собой карбамазепин, оланзапин, кветиапин, верапамил, ламотригин, окскарбазепин, рисперидон, арипипразол, зипразидон или литий, и инструкции для одновременного, последовательного или раздельного введения указанных препаратов пациенту, нуждающемуся в этом. Далее настоящее изобретение дополнительно разъяснено со ссылкой на следующие иллюстративные примеры. Способы, пригодные для синтеза соединений настоящего изобретения, иллюстрированы общими схемами, представленными ниже, и препаративными примерами, которые следуют за ними. Исходные материалы и реагенты, использованные при получении этих соединений, имеются в продаже у коммерческих поставщиков. Эти общие схемы являются лишь иллюстративными для способов, по которым могут быть синтезированы соединения настоящего изобретения, и в рамках этих схем могут быть сделаны различные модификации, которые понятны специалистам в данной области, обращающимся к настоящему описанию. Спектры ядерного магнитного резонанса (ЯМР) были записаны при 400 МГц; химические сдвиги записаны в миллионных долях. Спектры были записаны при помощи прибора Bruker 400 Avance, оснащенного 5 мм датчиком BBFO или датчиком DUL. Прибором управляли при помощи программыBruker TopSpin 2.1, если не указано иное. Чистоту анализировали при помощи СЭЖХ с УФ (фотодиодная матрица) обнаружением в широком диапазоне длин волн, обычно 220-450 нм, используя систему Waters Acquity UPLC, оснащенную колонками Acquity UPLC ВЕН или HSS C18 (внутренний диаметр 2,1 ммдлина 50 мм), которые эксплуатировали при 50 или 60 С. Подвижные фазы обычно состояли из ацетонитрила или метанола, смешанного с водой, содержащей 0,05% муравьиной кислоты или 0,025% аммиака. Масс-спектры записали на одиночном квадрупольном масс-спектрометре Waters SQD, используя ионизацию при атмосферном давлении, если не указано иное. Соединения очистили при помощи нормально-фазовой хроматографии на диоксиде кремния или оксиде алюминия, или при помощи методов обращенно-фазовой хроматографии, используя картриджBiotage или Isolute KPNH, картридж SCX и картриджи твердофазной экстракции SCX-2. Препаративную высокоэффективную жидкостную хроматографию (ВЭЖХ) выполнили при помощи системы Agilent Technologies серии 1100, обычно используя колонки Waters C18 с внутренним диаметром 19 мм и длиной 100 мм, с такими материалами как XBridge или SunFire, 5 мкм, при 20 мл/мин. Подвижные фазы обычно состояли из ацетонитрила или метанола, смешанного с водой, содержащей 0,1% муравьиной кислоты или 0,1% аммиака, если не указано иное. В следующих описаниях "комнатная температура" означает температуру в диапазоне от 20 С до 25 С. Сокращения, использованыне в конкретных примерах, имеют следующие значения: ДМСО - диметилсульфоксид; ДМСО-d6 - дейтерированный диметилсульфоксид; Фенилметанол (6,72 г, 62,2 ммоль) по каплям добавили к суспензии гидрида натрия (60% суспензия в минеральном масле; 2,486 г, 62,2 ммоль) в тетрагидрофуране (общий объем: 100 мл) при комнатной температуре. Полученную смесь перемешивали в течение 1 ч, а затем охладили до 0 С, затем частями добавили 3,4,6-трихлорпиридазин (5,7 г, 31,1 ммоль) за 10 мин. Затем реакционную смесь оставили нагреваться до комнатной температуры и перемешивали в течение 16 ч, затем вылили в воду и экстрагировали этилацетатом (два раза). Органический слой промыли насыщенным солевым раствором, высушили(сульфат магния) и выпарили. Остаток очистили хроматографией на диоксиде кремния (элюируя 5-20% этилацетата в бензине, содержащем 5% тетрагидрофурана) для получения 3,4-бис(бензилокси)-6 хлорпиридазина (4,0 г, 12,24 ммоль, выход 39,4%) в качестве основного продукта. 1 Н ЯМР (400 МГц,ДМСО-d6):ppm 7.31-7.52 (m, 11 Н) 5.51 (s, 2 Н) и 5.31 (s, 2 Н). Промежуточное соединение 2. 3,4-бис(Бензилокси)-6-(фенилэтинил)пиридазин В 20 мл пробирку для микроволновых реакций загрузили 3,4-бис(бензилокси)-6-хлорпиридазин(Промежуточное соединение 1; 440 мг, 1,35 ммоль), DBU (1230 мг, 8,08 ммоль) и этинилбензол (413 мг,4,04 ммоль) в тетрагидрофуране (5 мл) для получения оранжевого раствора. Смесь продули азотом и добавили дихлорбис(трифенилфосфин)палладий (II) (47,3 мг, 0,067 ммоль) и йодид меди (I) (25,6 мг, 0,135 ммоль), затем смесь обрабатывали микроволновым излучением в течение 1 ч при 80 С. После охлаждения, полученную смесь разбавили этилацетатом и промыли насыщенным солевым раствором, а органический слой очистили хроматографией на диоксиде кремния (элюируя 0-30% этилацетата в бензине) для получения 3,4-бис(бензилокси)-6-(фенилэтинил)пиридазина (320 мг, 0,815 ммоль, выход 61%). 1 Н ЯМР Получили так, как описано для 3,4-бис(бензилокси)-6-(фенилэтинил)пиридазина (промежуточное соединение 2) из 3,4-бис(бензилокси)-6-хлорпиридазина (промежуточное соединение 1) и 1-этинил-4 фторбензола с выходом 72%. 1 Н ЯМР (400 МГц, ДМСО-d6):7.67-7.76 (m, 2 Н), 7.57 (s, 1H), 7.29-7.53 (m,12H), 5.58 (S, 2H) и 5.31 (S, 2H). MS ES+: 410. Схема 2 В 20 мл пробирку для микроволновых реакций загрузили 3,4-бис(бензилокси)-6-хлорпиридазин(промежуточное соединение 1, 3,06 ммоль) и этинилтриметилсилан (902 мг, 9,18 ммоль) в тетагидрофуране (5 мл) для получения оранжевого раствора. Реакционную смесь продули азотом, затем добавилиDBU (2,77 мл, 18,36 ммоль), дихлорбис(трифенилфосфин)палладий (II) (107 мг, 0,153 ммоль) и йодид меди (I) (58,3 мг, 0,306 ммоль), и обрабатывали смесь микроволновым излучением в течение 1 ч при 80 С. После охлаждения, реакционную смесь разбавили этилацетатом и промыли насыщенным солевым раствором. Органический слой очистили хроматографией на диоксиде кремния (элюируя 0-30% этилацетата в бензине) для получения 3,4-бис(бензилокси)-6-триметилсилил)этинил)пиридазина (838 мг, 2,16 ммоль, выход 70%). 1 Н ЯМР (400 МГц, ДМСО-d6):7.08 - 7.28 (m, 11 Н), 5.32 (s, 2 Н), 5.06 (s, 2 Н) и 0.08(Промежуточное соединение 4; 830 мг, 2,14 ммоль) и метанол (10 мл) добавили к тетрагидрофурану (5 мл) для получения оранжевой суспензии. Смесь перемешивали в течение 1 ч, а затем разделили между насыщенным солевым раствором и этилацетатом. Органический слой помыли насыщенным солевым раствором и выпарили, затем очистили остаток хроматографией на диоксиде кремния (элюируя 10-50% этилацетата в бензине) для получения 3,4-бис(бензилокси)-6-этинилпиридазина (530 мг, 1,68 ммоль, выход 78%). 1 Н ЯМР (400 МГц, ДМСО-d6):7.31-7.53 (m, 11 Н), 5.59 (s, 2 Н), 5.30 (s, 2 Н) и 4.53 (s, 1H). MS 3,4-бис(Бензилокси)-6-этинилпиридазин (Промежуточное соединение 5; 530 мг, 1,68 ммоль) и 2 бром-5-(трифторметил)пиридин (379 мг, 1,68 ммоль) растворили в тетрагидрофуране (5 мл) для получения оранжевого раствора. Реакционную смесь продули азотом, а затем добавили триэтиламин (1,40 мл,10,05 ммоль), дихлорбис(трифенилфосфин)палладий (II) (58,8 мг, 0,08 ммоль) и йодид меди (I) (31,9 мг,0,17 ммоль), затем обрабатывали смесь микроволновым излучением в течение 1 ч при 80 С. После охлаждения, смесь разбавили этилацетатом и промыли насыщенным солевым раствором. Органический слой концентрировали in vacuo, а затем неочищенный остаток очистили хроматографией на диоксиде кремния К раствору (4-метоксифенил)метанола (1,88 г, 13,63 ммоль) в тетрагидрофуране (7,89 мл) добавили раствор трет-бутоксида калия в тетрагидрофуране (13,63 мл, 13,63 ммоль). После перемешивания при комнатной температуре в течение 1,5 ч, смесь охладили до 0 С и частями добавили трихлорпиридазин(1,0 г, 5,45 ммоль) за период около 5-10 мин. Полученную смесь оставили перемешиваться и нагреваться до комнатной температуры в течение 16 ч, а затем вылили в воду, экстрагировали в этилацетат, а объединенные органические слой высушили (сульфат магния). Затем раствор выпарили in vacuo и очистили хроматографией на диоксиде кремния (элюируя 0-40% этилацетата в бензине) для получения 6-хлор-3,4 бис[(4-метоксибензил)окси]пиридазина (550 мг, 1,420 ммоль, выход 26%). 1H ЯМР (400 МГц, MeOH-d):7.51 (s, 1H), 7.38-7.45 (m, 4 Н), 6.91-6.99 (m, 4 Н), 5.39 (s, 2 Н), 5.19 (s, 2 Н) и 3.76 (s, 6 Н). Промежуточное соединение 8. 6-[(4-Хлорбензил)сульфанил 1-3,4-бис[(4-метоксибензил)окси] пиридазин Смесь 6-хлор-3,4-бис[(4-метоксибензил)окси]пиридазина (Промежуточное соединение 7; 550 мг,1,42 ммоль), (4-хлорфенил)метантиола (248 мг, 1,56 ммоль), Pd2(DBA)3 (52,1 мг, 0,057 ммоль), XANTPHOS (65,8 мг, 0,114 ммоль) и основания Хюнига (этилдиизопропиламин; 404 мг, 3,13 ммоль) обрабатывали микроволновым излучением при 120 С в течение 1 ч. Полученную смесь вылили в воду и экстрагировали в этилацетат, затем объединенные органические слои промыли насыщенным солевым раствором,а затем высушили (сульфат магния). Полученный раствор выпарили in vacuo и очистили хроматографией на диоксиде кремния (элюируя 0-40% дихлорметана в бензине) для получения 6-[(4 хлорбензил)сульфанил]-3,4-бис[(4-метоксибензил)окси]пиридазина (201 мг, 1,42 ммоль, выход 28%). 1H ЯМР (400 МГц, MeOH-d):7.25-7.48 (m, 8 Н), 6.88-6.95 (m, 4 Н), 5.42 (s, 2 Н), 5.08 (s, 2 Н), 4.41 (s, 2 Н) и 3.83 (s, 6 Н). MS ES+: 509. Промежуточное соединение 9. 3,4-бис(Бензилокси)-6-[6-(трифторметил)пиридин-3-ил]этинил пиридазин В пробирку для микроволновых реакций загрузили 5-йод-2-(трифторметил)пиридин (617 мг, 2,260 ммоль), йодид меди (I) (39,1 мг, 0,205 ммоль), бис(трифенилфосфин)палладия (II) хлорид (72,1 мг, 0,103 ммоль), 1,8-диазабициклоундец-7-ен (DBU; 1858 мкл, 12,33 ммоль) и тетрагидрофуран (6849 мкл). Затем реакционную смесь продули и вакуумировали азотом, а затем к ней добавили 3,4-бис(бензилокси)-6 этинилпиридазин (Промежуточное соединение 5: 650 мг, 2,1 ммоль). Реакционную смесь нагревали до 80 С, обрабатывая микроволновым излучением в течение 1 ч. После охлаждения, реакционную смесь разделили между этилацетатом и водой, и в это время образовалось твердое вещество, которое отфильтровали и отбросили. Затем органические слои промыли водой и насыщенным солевым раствором, высушили (MgSO4), отфильтровали и концентрировали для получения коричневого маслянистого вещества. Это вещество очистили хроматографией на диоксиде кремния (элюируя 0-100% этилацетата в бензине) для получения 3,4-бис(бензилокси)-6-[6-(трифторметил)пиридин-3-ил]этинилпиридазина в виде желтого аморфного вещества (выход = 10%). MS ES+: 462. Промежуточное соединение 10. 3,4-бис(Бензилокси)-6-[(3-фторфенил)этинил]пиридазин Получили так, как описано для 3,4-бис(бензилокси)-6-(фенилэтинил)пиридазина (промежуточное соединение 2) из 3,4-бис(бензилокси)-6-хлорпиридазина (промежуточное соединение 1) и 1-этинил-3 фторбензола. 1 Н ЯМР (400 МГц, ДМСО-d6):7.32-7.64 (m, 15 Н), 5.56 (s, 2 Н) и 5.30 (s, 2 Н). MS ES+: 411. Промежуточное соединение 11. 3,4-бис(Бензилокси)-6-[(2-фторфенил)этинил] пиридазин Получили так, как описано для 3,4-бис(бензилокси)-6-(фенилэтинил)пиридазина (промежуточное соединение 2) из 3,4-бис(бензилокси)-6-хлорпиридазина (промежуточное соединение 1) и 1-этинил-2 фторбензола. 1 Н ЯМР (400 МГц, ДМСО-d6):7.63-7.76 (m, 1 Н), 7.58 (s, 2 Н), 7.30-7.50 (m, 12 Н), 5.59(S,2H) И 5.32(S, 2H). MS ES+: 411. Промежуточное соединение 12. 3,4-бис(Бензилокси)-6-[(3,5-дифторфенил)этинил]пиридазин Получили так, как описано для 3,4-бис(бензилокси)-6-(фенилэтинил)пиридазина (промежуточное соединение 2) из 3,4-бис(бензилокси)-6-хлорпиридазина (промежуточное соединение 1) и 1-этинил-3,5 дифторбензола. 1 Н ЯМР (400 МГц, ДМСО-d6):7.63 (s, 1 Н), 7.32-7.52 (s, 13 Н), 5.59 (s, 2 Н) и 5.30 (s, 2 Н). Получили так, как описано для 3,4-бис(бензилокси)-6-(фенилэтинил)пиридазина (промежуточное соединение 2) из 3,4-бис(бензилокси)-6-хлорпиридазина (промежуточное соединение 1) и 1-этинил-3,4 дифторбензола. 1 Н ЯМР (400 МГц, ДМСО-d6):7.52-7.67 (s, 1 Н), 7.36-7.59 (s, 13 Н), 5.58 (s, 2H) и 5.31(S,2H). MS ES+: 429. Промежуточное соединение 14. 3,4-бис(Бензилокси)-6-2-[3-(трифторметокси)фенил]этинилпиридазин Получили так, как описано для 3,4-бис(бензилокси)-6-(фенилэтинил)пиридазина (Промежуточное соединение 2) из 3,4-бис(бензилокси)-6-хлорпиридазина (промежуточное соединение 1) и 1-этинил-3 трифторметоксибензола (полученного так, как описано в опубликованной заявке на международный патентWO 2005/94822, смотри получение 28). 1 Н ЯМР (400 МГц, ДМСО-d6):7.60-7.75 (m, 3 Н), 7.317.57 (s, 12 Н), 5.58 (s, 2 Н) и 5.28 (s, 2 Н). MS ES+: 477. Промежуточное соединение 15. 3,4-бис(Бензилокси)-6-2-[3-(трифторметил)фенил]этинилпиридазин Получили так, как описано для 3,4-бис(бензилокси)-6-[6-(трифторметил)пиридин-3-ил]этинил пиридазина (промежуточное соединение 9) из 3,4-бис(бензилокси)-6-этинилпиридазина (промежуточное соединение 5) и 1-йод-3-(трифторметил)бензола. 1 Н ЯМР (400 МГц, ДМСО-d6):8.01 (s, br, 1H), 7.96 (d,J=7.83 Гц, 1 Н), 7.87 (d, J=7.83 Гц, 1 Н), 7.70-7.77 (m, 1 Н), 7.64 (s, 1 Н), 7.29-7.52 (m, 10 Н), 5.59 (s, 2 Н), 5.31 Получили так, как описано для 3,4-бис(бензилокси)-6-[6-(трифторметил)пиридин-3-ил]этинил пиридазина (промежуточное соединение 9) из 3,4-бис(бензилокси)-6-этинилпиридазина (промежуточное соединение 5) и 3-бром-5-трифторметилпиридина. MS ES+: 462. Промежуточное соединение 17. 3,4-бис(Бензилокси)-6-(циклогексилэтинил)пиридазин Получили так, как описано для 3,4-бис(бензилокси)-6-(фенилэтинил)пиридазина (промежуточное соединение 2) из 3,4-бис(бензилокси)-6-хлорпиридазина (промежуточное соединение 1) и этинилциклогексана. 1 Н ЯМР (400 МГц, CD2Cl2)7.54-7.56 (m, 2 Н), 7.33-7.48 (m, 8 Н), 6.92 (s, 1H), 5.63 (s, 2 Н), 5.17 (s,2 Н), 2.61-2.73 (m, 1H), 1.90-2.00 (m, 2 Н), 1.75-1.84 (m, 2 Н), 1.52-1.67 (m, 4 Н), 1.35-1.46 (m, 2 Н). MS ES+: 399. Промежуточное соединение 18. 3,4-бис(Бензилокси)-6-(циклопропилэтинил)пиридазин Получили так, как описано для 3,4-бис(бензилокси)-6-(фенилэтинил)пиридазина (промежуточное соединение 2) из 3,4-бис(бензилокси)-6-хлорпиридазина (промежуточное соединение 1) и этинилциклопропана. 1 Н ЯМР (400 МГц, ДМСО-d6)7.14-7.55 (m, 11 Н), 5.53 (s, 2 Н), 5.25 (s, 2 Н), 1.57-1.67 (m, 1 Н),0.92-0.99 (m, 2 Н), 0.77-0.84 (m, 2 Н). MS ES+: 357. Промежуточное соединение 19. 3,4-бис(Бензилокси)-6-(циклопентилэтинил)пиридазин Получили так, как описано для 3,4-бис(бензилокси)-6-(фенилэтинил)пиридазина (промежуточное соединение 2) из 3,4-бис(бензилокси)-6-хлорпиридазина (промежуточное соединение 1) и этинилциклопентана. 1 Н ЯМР (400 МГц, CD2Cl2)7.28-7.55 (m, 10 Н), 6.82-6.90 (m, 1H), 5.57 (s, 2 Н), 5.14 (s, 2 Н), 2.792.94 (m, 1 Н), 1.97-2.13 (m, 2 Н), 1.49-1.86 (m, 6 Н) MS ES+: 385. Промежуточное соединение 20. 3,4-бис(Бензилокси)-6-[(4-метоксициклогекс-1-ен-1-ил)этинил] пиридазин В пробирку для микроволновых реакций загрузили 4-метоксициклогекс-1-енила трифторметансульфонат (1069 мг, 4,11 ммоль), йодид меди (I) (16,83 мг, 0,09 ммоль), тетракис(трифенилфосфин)палладий(0) (54,6 мг, 0,05 ммоль), триэтиламин (1432 мкл, 10,27 ммоль) и сухой N,N-диметилформамид (6849 мкл). Реакционную смесь вакуумировали и продули азотом, и добавили раствор 3,4-бис(бензилокси)-6 этинилпиридазина (промежуточное соединение 5; 650 мг, 2,06 ммоль) в сухом тетрагидрофуране (3 мл),затем эту смесь перемешивали в микроволновом реакторе при 70 С в течение 1 ч. После охлаждения,полученную смесь разделили между этилацетатом и водой, а органические экстракты промыли водой и насыщенным солевым раствором, высушили (MgSO4), отфильтровали и концентрировали для получения коричневого маслянистого вещества. Это вещество очистили хроматографией на диоксиде кремния,элюируя 0-75% этилацетата в бензине, для получения 3,4-бис(бензилокси)-6-[(4-метоксициклогекс-1-ен 1-ил)этинил]пиридазина (промежуточное соединение 20) в виде коричневого маслянистого вещества Получили так, как описано для 3,4-бис(бензилокси)-6-(фенилэтинил)пиридазина (промежуточное соединение 2) из 3,4-бис(бензилокси)-6-хлорпиридазина (промежуточное соединение 1) и 1-этинил-2,4 дифторбензола. 1 Н ЯМР (400 МГц, CD2Cl2)7.49-7.67 (m, 3 Н), 7.31-7.51 (m, 8 Н), 6.85-7.07 (m, 3 Н), 5.70 (s, 2 Н), 5.23 Получили так, как описано для 3,4-бис(бензилокси)-6-[6-(трифторметил)пиридин-3-ил]этинил пиридазина (промежуточное соединение 9) из 3,4-бис(бензилокси)-6-этинилпиридазина (промежуточное соединение 5) и 3-бром-5-дифторметилпиридина. 1 Н ЯМР (400 МГц, CDCl3)7.65-7.85 (m, 2 Н), 7.21-7.65 К раствору 3,4-бис(бензилокси)-6-хлорпиридазина (промежуточное соединение 1: 0,22 г, 0,67 ммоль) в тетрагидрофуране (6 мл) и воде (0,6 мл) добавили карбонат цезия (0,66 г, 2,01 ммоль) и [1,1'-бис(бифенилфосфино)ферроцен]дихлорпалладий (II) (0,049 г, 0,067 ммоль). Затем реакционную смесь не- 17024956 сколько раз продули и вакуумировали азотом, затем добавили 9-бензил-9-борабицикло[3.3.1]нонан (9BBN; 4,02 мл, 2,01 ммоль). Затем реакционный сосуд закрыли и нагревали до 60 С в течение 1 часа. После охлаждения, полученную смесь разбавили этилацетатом и 5 раз промыли 1:1 смесью воды и насыщенного водного солевого раствора. Органическую часть высушили (MgSO4), отфильтровали и концентрировали для получения оранжевого маслянистого вещества. Неочищенное маслянистое вещество очистили хроматографией на диоксиде кремния (элюируя 0-80% этилацетата в бензине) для получения 6 бензил-3,4-бис(бензилокси)пиридазина в виде бесцветного маслянистого вещества (выход = 64%). 1 Н ЯМР (400 МГц, CDCl3)7.56 (d, J = 7.33 Гц, 2 Н), 7.12-7.48 (m, 13 Н), 6.55 (s, 1 Н), 5.64 (s, 2 Н), 5.08 (s, 2 Н),4.17 (s, 2 Н). MS ES+: 383. Промежуточное соединение 24. 3,4-бис(Бензилокси)-6-3-хлорфенил)этинил)пиридазин К раствору 1-хлор-3-йодбензола (0,862 г, 3,62 ммоль) в сухом тетрагидрофуране (11 мл) добавили йодид меди (I) (0,063 г, 0,33 ммоль), бис(трифенилфосфин)-палладия (II) хлорид (0,115 г, 0,16 ммоль) и 1,8-диазабициклоундец-7-ен (DBU; 2,97 мл, 19,72 ммоль). Затем реакционную смесь несколько раз продули и вакуумировали азотом, затем добавили 3,4-бис(бензилокси)-6-этинилпиридазин (промежуточное соединение 5; 1,04 г, 3,29 ммоль). Реакционный сосуд закрыли и нагревали до 80 С в течение 1 ч. После охлаждения, полученную смесь разделили между этилацетатом и водой. Объединенные органические части промыли водой (2) и насыщенным солевым раствором, высушили (MgSO4), отфильтровали и концентрировали для получения коричневого маслянистого вещества. Неочищенное маслянистое вещество очистили хроматографией на диоксиде кремния (элюируя 0-20% этилацетата в бензине) для получения 3,4-бис(бензилокси)-6-3-хлорфенил)этинил)пиридазина в виде желтого твердого вещества (выход = 30%). 1 Н ЯМР (400 МГц, CDCl3)7.21-7.65 (m, 14 Н), 6.97 (s, 1 Н), 5.70 (s, 2 Н), 5.23 (s, 2 Н). MS ES+: 427/429. Промежуточное соединение 25. 3,4-бис(Бензилокси)-6-(1-фенилэтенил)пиридазин Смесь 3,4-бис(бензилокси)-6-хлорпиридазина (промежуточное соединение 1: 3 г, 9,18 ммоль), диоксана (32,1 мл) и воды (9,64 мл) дегазировали, и к ней добавили моно(бис(ди-трет-бутил(4(диметиламино)фенил)фосфонио)палладия (IV дихлорид (0,195 г, 0,275 ммоль), карбонат цезия (10,14 г, 31,1 ммоль) и 4,4,5,5-тетраметил-2-(1-фенилэтенил)-1,3,2-диоксаборолан (3 г, 13,04 ммоль). Смесь нагревали до 80 С в течение 6 ч, а после охлаждения ее разделили между дихлорметаном и водой. Органическую часть высушили (MgSO4), отфильтровали и концентрировали для получения оранжевого маслянистого вещества. Неочищенное маслянистое вещество очистили хроматографией на диоксиде кремния,элюируя 0-60% этилацетата в бензине, для получения 3,4-бис(бензилокси)-6-(1-фенилэтенил)пиридазина в виде коричневого маслянистого вещества (выход = 91%). 1 Н ЯМР (400 МГц, CHCl3-d)7.54-7.66 (m, 2 Н), 7.24 - 7.44 (m, 13 Н), 6.72 (s, 1H), 6.02 (s, 1H), 5.70 К суспензии гидрида натрия (0,487 г, 12,17 ммоль, 60% в минеральном масле) в ДМСО (33,8 мл),перемешивая под азотом, 4 порциями добавили триметилсульфоксония йодид (2,68 г, 12,17 ммоль) за 20 мин. Через капельную воронку добавили раствор 3,4-бис(бензилокси)-6-(1-фенилэтенил)пиридазина(Промежуточное соединение 25; 3,2 г, 8,11 ммоль) в тетрагидрофуране (50,7 мл) за 90 мин, затем реакционную смесь оставили перемешиваться при комнатной температуре в течение 18 ч. Полученную смесь концентрировали, вылили в ледяную воду и экстрагировали этилацетатом (3). Органическую часть высушили (MgSO4), отфильтровали и концентрировали для получения коричневого маслянистого вещества. Неочищенное маслянистое вещество очистили хроматографией на диоксиде кремния (элюируя 0-50% этилацетата в бензине) для получения 3,4-бис(бензилокси)-6-(1-фенилциклопропил)пиридазина в виде желтого маслянистого вещества (выход = 23%). 1 Н ЯМР (400 МГц, CHCl3-d)7.47-7.63 (m, 2 Н), 7.227.46 (m, 11 Н), 7.10-7.25 (m, 2 Н), 6.40 (s, 1 Н), 5.62 (s, 2 Н), 4.97 (s, 2 Н), 1.71-1.85 (m, 2 Н), 1.25-1.38 (m, 2 Н). Получили так, как описано для 3,4-бис(бензилокси)-6-[5-(трифторметил)пиридин-2-ил]этинил пиридазина (промежуточное соединение 6) из 3,4-бис(бензилокси)-6-этинилпиридазина (промежуточное соединение 5) и 4-йодбензонитрила с выходом 73%. 1H ЯМР (400 МГц, CD2Cl2)7.67-7.81 (m, 4 Н), 7.327.65 (m, 10 Н), 7.08 (s, 1H), 5.68 (s, 2 Н) и 5.23 (s, 2H). MS ES+: 418. Промежуточное соединение 28. 3,4-бис(Бензилокси)-6-[2-(3-(фтор-4-метилфенил)этинил]пиридазин Получили так, как описано для 3,4-бис(бензилокси)-6-[5-(трифторметил)пиридин-2-ил]этинил пиридазина (промежуточное соединение 6) из 3,4-бис(бензилокси)-6-этинилпиридазина (промежуточное соединение 5) и 2-фтор-4-йод-1-метилбензола с выходом 67%. Промежуточное соединение 29. 3,4-бис(Бензилокси)-6-[2-(4-(фтор-3-метилфенил)этинил]пиридазин Получили так, как описано для 3,4-бис(бензилокси)-6-[5-(трифторметил)пиридин-2-ил]этинил пиридазина (промежуточное соединение 6) из 3,4-бис(бензилокси)-6-этинилпиридазина (промежуточное соединение 5) и 1-фтор-4-йод-2-метилбензола с выходом 67%. 1 Н ЯМР (400 МГц, CD2Cl2)7.29-7.58 (m,12 Н), 6.99-7.08 (m, 2 Н), 5.62 (s, 2 Н), 5.17 (s, 2 Н) и 2.29 (s, 3 Н). MS ES+: 425. Промежуточное соединение 30. 3,4-бис(Бензилокси)-6-[2-(3,4-диметоксифенил)этинил]пиридазин Получили так, как описано для 3,4-бис(бензилокси)-6-[5-(трифторметил)пиридин-2-ил]этинил пиридазина (промежуточное соединение 6) из 3,4-бис(бензилокси)-6-этинилпиридазина (промежуточное соединение 5) и 4-йод-1,2-диметоксибензола с выходом 17%. 1H ЯМР (400 МГц, CDCl3)7.52-7.61 (m,2 Н), 7.33-7.47 (m, 8 Н), 7.18-7.26 (m, 1 Н), 7.09-7.15 (m, 1H), 6.97 (s, 1H), 6.87 (m, 1H), 5.69 (s, 2 Н), 5.22 (s,2 Н) и 3.89-3.96 (m, 6 Н). MS ES+: 453. Промежуточное соединение 31. 3,4-бис(Бензилокси)-6-2-[5-(трифторметил)пиридин-3-ил]этинил пиридазин Получили так, как описано для 3,4-бис(бензилокси)-6-[5-(трифторметил)пиридин-2-ил]этинил пиридазина (промежуточное соединение 6) из 3,4-бис(бензилокси)-6-этинилпиридазина (промежуточное соединение 5) и 3-бром-5-(трифторметил)пиридина с выходом 31%. MS ES+: 462. Промежуточное соединение 32. 3,4-бис(Бензилокси)-6-[2-(2-хлор-6-фторфенил)этинил]пиридазин Получили так, как описано для 3,4-бис(бензилокси)-6-[5-(трифторметил)пиридин-2-ил]этинил пиридазина (промежуточное соединение 6) из 3,4-бис(бензилокси)-6-этинилпиридазина (промежуточное соединение 5) и 1-хлор-3-фтор-2-йодбензола. MS ES+: 445. Промежуточное соединение 33. 3,4-бис(Бензилокси)-6-[2-(2,6-дифторфенил)этинил]пиридазин Получили так, как описано для 3,4-бис(бензилокси)-6-[5-(трифторметил)пиридин-2-ил]этинил пиридазина (промежуточное соединение 6) из 3,4-бис(бензилокси)-6-этинилпиридазина (промежуточное соединение 5) и 2-бром-1,3-дифторбензола. MS ES+: 429. Промежуточное соединение 34. 3,4-бис(Бензилокси)-6-[2-(4-хлорфенил)этинил]пиридазин Получили так, как описано для 3,4-бис(бензилокси)-6-[5-(трифторметил)пиридин-2-ил]этинил пиридазина (промежуточное соединение 6) из 3,4-бис(бензилокси)-6-этинилпиридазина (Промежуточное соединение 5) и 1-хлор-4-йодбензола с выходом 70%. 1H ЯМР (400 МГц, ДМСО-d6)7.22-7.75 (m, 15 Н),5.45-5.68 (m, 2 Н) и 5.30 (s, 2 Н). MS ES+: 427. Промежуточное соединение 35. 3,4-бис(Бензилокси)-6-[2-(2-хлорфенил)этинил]пиридазин Получили так, как описано для 3,4-бис(бензилокси)-6-[5-(трифторметил)пиридин-2-ил]этинил пиридазина (промежуточное соединение 6) из 3,4-бис(бензилокси)-6-этинилпиридазина (промежуточное соединение 5) и 1-хлор-2-йодбензола с выходом 59%. 1H ЯМР (400 МГц, ДМСО-d6)7.72-7.81 (m, 1 Н),7.61-7.68 (m, 1 Н), 7.29-7.58 (m, 13 Н), 5.58 (s, 2 Н) и 5.32 (s, 2H). MS ES+: 427 и 429. Промежуточное соединение 36. 3,4-бис(Бензилокси)-6-2-[4-(дифторметокси)фенил]этинилпиридазин Получили так, как описано для 3,4-бис(бензилокси)-6-[5-(трифторметил)пиридин-2-ил]этинил пиридазина (промежуточное соединение 6) из 3,4-бис(бензилокси)-6-этинилпиридазина (промежуточное соединение 5) и 1-(дифторметокси)-4-йодбензола с выходом 58%. 1 Н ЯМР (400 МГц, CD2Cl2)7.60-7.69 Получили так, как описано для 3,4-бис(бензилокси)-6-[5-(трифторметил)пиридин-2-ил]этинил пиридазина (промежуточное соединение 6) из 3,4-бис(бензилокси)-6-этинилпиридазина (промежуточное соединение 5) и 1-йод-4-(трифторметокси)бензола. MS ES+: 477. Промежуточное соединение 38. 3,4-бис(Бензилокси)-6-2-[3-(дифторметокси)фенил]этинилпиридазин Получили так, как описано для 3,4-бис(бензилокси)-6-[5-(трифторметил)пиридин-2-ил]этинил пиридазина (промежуточное соединение 6) из 3,4-бис(бензилокси)-6-этинилпиридазина (промежуточное соединение 5) и 1-(дифторметокси)-3-йодбензола с выходом 87%. 1 Н ЯМР (400 МГц, CD2Cl2)7.29-7.56 Получили так, как описано для 3,4-бис(бензилокси)-6-(фенилэтинил)пиридазина (промежуточное соединение 2) из 3,4-бис(бензилокси)-6-хлорпиридазина (промежуточное соединение 1) и 1-этинил-3(трифторметокси)бензола с выходом 37%. 1H ЯМР (400 МГц, ДМСО-d6)7.25-7.79 (m, 15 Н), 5.59 (s, 2 Н) и 5.25-5.34 (m, 2 Н). MS ES+: 477. Промежуточное соединение 40. 3,4-бис(Бензилокси)-6-2-[2-(трифторметил)фенил]этинилпиридазин Получили так, как описано для 3,4-бис(бензилокси)-6-(фенилэтинил)пиридазина (промежуточное соединение 2) из 3,4-бис(бензилокси)-6-хлорпиридазина (промежуточное соединение 1) и 1-этинил-2(трифторметил)бензола с количественным выходом. 1H ЯМР (400 МГц, ДМСО-d6)7.86-7.94 (m, 2 Н),7.76-7.83 (m, 1 Н), 7.67-7.74 (m, 1 Н), 7.28-7.54 (m, 11 Н), 5.59 (s, 2 Н) и 5.30-5.37 (m, 2 Н). MS ES+: 461. Схема 6 Получили так, как описано для 3,4-бис(бензилокси)-6-(1-фенилэтенил)пиридазина (Промежуточное соединение 25), из 3,4-бис(бензилокси)-6-хлорпиридазина (Промежуточное соединение 1) и 2-(1-(4 фторфенил)этенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана с выходом 92%. 1H ЯМР (400 МГц, CD2Cl2)7.54-7.64 (m, 2 Н), 7.18-7.46 (m, 10 Н), 6.94-7.07 (m, 2 Н), 6.71 (s, 1 Н), 5.95 (s, 1 Н), 5.70 (s, 2 Н), 5.59 (s, 1 Н) и 5.14 (s, 2 Н). MS ES+: 413. Промежуточное соединение 42. 3,4-бис(Бензилокси)-6-[1-(4-фторфенил)циклопропил]пиридазин Получили так, как описано для 3,4-бис(бензилокси)-6-(1-фенилциклопропил)пиридазина (промежуточное соединение 26) из 3,4-бис(бензилокси)-6-(1-фенилэтенил)пиридазина (промежуточное соединение 41) с выходом 16%. 1H ЯМР (400 МГц, CDCl3)7.48-7.60 (m, 2 Н), 7.14-7.45 (m, 10 Н), 6.95-7.07 (m,2 Н), 6.33 (s, 1 Н), 5.62 (s, 2 Н), 5.01 (s, 2 Н), 1.73-1.82 (m, 2 Н) и 1.22-1.34 (m, 2 Н). MS ES+: 427. Промежуточное соединение 43. 3,4-бис(Бензилокси)-6-1-[3-(трифторметил)фенил]этенилпиридазин Получили так, как описано для 3,4-бис(бензилокси)-6-(1-фенилэтенил)пиридазина (промежуточное соединение 25) из 3,4-бис(бензилокси)-6-хлорпиридазина (промежуточное соединение 1) и 4,4,5,5 тетраметил-2-(1-(3-(трифторметил)фенил)этенил)-1,3,2-диоксаборолана с выходом 45%. MS ES+: 463.(0,675 г, 1,38 ммоль), трет-бутоксид натрия (0,133 г, 1,38 ммоль) и ТГФ (100 мл) и перемешивали под азотом в течение 10 мин. К этому раствору добавили бис(пинаколато)диборан (7,72 г, 30,4 ммоль) и перемешивали смесь при комнатной температуре в течение 30 мин. Смесь охладили до -78 С и через шприц добавили раствор 1-этинил-3-(трифторметил)бензола (4,7 г, 27,6 ммоль) в ТГФ (20 мл) и МеОН(1,23 мл, 30,4 ммоль). Затем содержимое колбы перемешивали при -40 С (баня из ацетонитрила/СО 2) в течение ночи. Утром реакционная смесь достигла комнатной температуры. Реакционную смесь охладили до -78 С, а затем отфильтровали через слой диоксида кремния и диатомовой земли (продаваемой под торговой маркой "Целит") для получения коричневого раствора, который концентрировали, а остаток очистили хроматографией на диоксиде кремния, элюируя 0-5% Et2O в бензине, для получения 4,4,5,5 тетраметил-2-(1-(3-(трифторметил)фенил)этенил)-1,3,2-диоксаборолана (2,15 г, 26%). 1H ЯМР (400 МГц,хлороформ-d)7.74 (s, 1H), 7.63-7.70 (m, 1H), 7.48-7.53 (m, 1H), 7.40-7.47 (m, 1H), 6.09-6.20 (m, 2 Н), 1.34 В пробирку для микроволновых реакций загрузили 3,4-бис(бензилокси)-6-хлорпиридазин (промежуточное соединение 1) (5 г, 15,30 ммоль), (Е)-4-(трифторметил)стирилбороновую кислоту (4,96 г, 22,95 ммоль), карбонат калия (7,40 г, 53,6 ммоль) и тетракис(трифенилфосфин)палладий(0) (0,530 г, 0,459 ммоль). Реакционную смесь вакуумировали и продули азотом, затем добавили диоксан (3,40 мл) и нагревали смесь под вакуумом. Затем добавили воду (1,7 мл) и нагревали реакционную смесь при 120 С под микроволновым излучением в течение 1 ч. Реакционную смесь разбавили этилацетатом и промыли водой, а затем насыщенным солевым раствором, а объединенные органические слои высушили (MgSO4) и концентрировали in vacuo для получения заданного соединения в виде оранжевого твердого вещества 3,4-Бис(бензилокси)-6-хлорпиридазин (промежуточное соединение 1) (1 г, 3,1 ммоль), [1,1'-бис(дитрет-бутилфосфино)ферроцен]палладия (II) дихлорид (0,100 г, 0,15 ммоль) и трет-бутоксид натрия (0,59 г, 6,1 ммоль) добавили к диоксану (10,2 мл). Полученную смесь продули азотом, затем добавили 4 фторбензиламин (78 мг, 6,1 ммоль). Смесь нагревали при 120 С в течение 1 ч под микроволновым излучением. После охлаждения, неочищенную смесь погасили водой и экстрагировали этилацетатом, затем органические экстракты высушили (MgSO4) и концентрировали in vacuo. Остаток очистили колоночной хроматографией на диоксиде кремния, элюируя 0-100% этилацетата в бензине, для получения указанного в заголовке соединения. MS ES+: 416. Промежуточное соединение 46. 5,6-бис(Бензилокси)-N-(циклопропилметил)-N-метилпиридазин-3 амин Получили так, как описано для 5,6-бис(бензилокси)-N-[(4-фторфенил)метил]пиридазин-3-амина Получили так, как описано для 5,6-бис(бензилокси)-N-[(4-фторфенил)метил]пиридазин-3-амина(0,18 г, 0,153 ммоль) и (3-хлорбензил)цинка (II) хлорид (9,2 мл 0,5 М раствора в тетрагидрофуране, 4,6 ммоль). Реакционную смесь перемешивали при 60 С в течение 17 ч, а затем разделили между этилацетатом и водой. Органические экстракты промыли водой и насыщенным солевым раствором, а затем высушили, отфильтровали и концентрировали для получения желтого маслянистого вещества. Маслянистое вещество очистили, используя 0-70% этилацетата в бензине, для получения указанного в заголовке соединения (310 мг, 23%). 1H ЯМР (400 МГц, CD2Cl2)7.47-7.55 (m, 2 Н), 7.29-7.44 (m, 8 Н), 7.19-7.28 (m,3 Н), 7.09-7.17 (m, 1H), 6.57-6.63 (m, 1H), 5.57 (s, 2 Н), 5.04-5.12 (m, 2 Н) и 4.09-4.15 (m, 2 Н). MS ES+: 417. Промежуточное соединение 49. 3,4-бис(Бензилокси)-6-[(4-хлорфенил)метил]пиридазин Получили так, как описано для 3,4-бис(бензилокси)-6-[(3-хлорфенил)метил]пиридазина (промежуточное соединение 48) из 3,4-бис(бензилокси)-6-хлорпиридазина (промежуточное соединение 1) и (4 хлорбензил)цинка (II) хлорида с выходом 95%. 1H ЯМР (400 МГц, CD2Cl2)7.47-7.55 (m, 2 Н), 7.23-7.43 К раствору 3,4-бис(бензилокси)-6-хлорпиридазина (промежуточное соединение 1) (1 г, 3,06 ммоль) и бис(три-трет-бутилфосфин)палладия (0,063 г, 0,122 ммоль) в N-метилпирролидине (30,0 мл) под азотом добавили (циклогексилметил)цинка (II) бромид (0,5 М в тетрагидрофуране) (12,24 мл, 6,12 ммоль), и полученную коричневую смесь перемешивали при комнатной температуре в течение ночи, а затем нагревали при 100 С в течение 2 ч. Затем реакционную смесь оставили остывать, разбавили этилацетатом и промыли насыщенным водным раствором бикарбоната натрия, насыщенным водным раствором хлорида аммония и насыщенным солевым раствором. Органические слои высушили (MgSO4), отфильтровали, а растворитель удалили in vacuo для получения коричневого маслянистого вещества. Маслянистое вещество очистили хроматографией на диоксиде кремния (элюируя 0-30% этилацетата в бензине) для получения указанного в заголовке соединения (540 мг, 1,39 ммоль, выход 45%). 1H ЯМР (400 МГц, CDCl3)7.50-7.61 (m, 2 Н), 7.30-7.45 (m, 8 Н), 6.56 (s, 1H), 5.62 (s, 2 Н), 5.20 (s, 2 Н), 2.61-2.69 (m, 2 Н), 1.53 -1.76 (m,7 Н), 1.10-1.23 (m, 2 Н) и 0.84-1.04 (m, 2 Н). MS ES+: 389. Промежуточное соединение 51. 3,4-бис(Бензилокси)-6-[(4-фторфенил)метил]пиридазин(0,027 г, 0,122 ммоль) в тетрагидрофуране (6,12 мл) под азотом добавили (4-фторбензил)цинка (II) бромид (9,18 мл, 4,59 ммоль), и полученную красно-коричневую смесь нагревали при 65 С в течение 24 ч. Реакционную смесь охладили, разбавили этилацетатом и промыли насыщенным водным раствором бикарбоната натрия, насыщенным раствором хлорида аммония и насыщенным солевым раствором. Орга- 23024956 нические слои высушили (MgSO4), отфильтровали, а растворитель удалили in vacuo для получения коричневого маслянистого вещества. Маслянистое вещество очистили хроматографией на диоксиде кремния (элюируя 0-100% этилацетата в бензине) для получения указанного в заголовке соединения (663 мг,1,61 ммоль, выход 97%). 1H ЯМР (400 МГц, CDCl3)7.49-7.60 (m, 2 Н), 7.23-7.44 (m, 8 Н), 7.11-7.20 (m,2 Н), 6.92-7.02 (m, 2 Н), 6.48 (s, 1 Н), 5.62 (s, 2 Н), 5.08 (s, 2 Н) и 4.07-4.20 (m, 2 Н). MS ES+: 401. Промежуточное соединение 52. 3,4-бис(Бензилокси)-6-[(2-хлор-6-фторфенил)метил]пиридазин Получили так, как описано для 3,4-бис(бензилокси)-6-[(4-фторфенил)метил]пиридазина (промежуточное соединение 51) из 3,4-бис(бензилокси)-6-хлорпиридазина (промежуточное соединение 1) и (2 хлор-6-фторбензил)цинка (II) хлорида с выходом 23%. 1 Получили так, как описано для 3,4-бис(бензилокси)-6-[(4-фторфенил)метил]пиридазина (промежуточное соединение 51) из 3,4-бис(бензилокси)-6-хлорпиридазина (промежуточное соединение 1) и (2 хлорбензил)цинка (II) хлорида с выходом 38%. 1H ЯМР (400 МГц, CDCl3)7.48-7.62 (m, 2 Н), 7.15-7.45 Получили так, как описано для 3,4-бис(бензилокси)-6-[(4-фторфенил)метил]пиридазина (промежуточное соединение 51) из 3,4-бис(бензилокси)-6-хлорпиридазина (промежуточное соединение 1) и (3 фторбензил)цинка (II) хлорида с выходом 32%. 1H ЯМР (400 МГц, ДМСО-d6)6.99-7.55 (m, 15 Н), 5.435.58 (m, 2 Н), 5.18-5.31 (m, 2 Н) и 4.08-4.17 (m, 2 Н). MS ES+: 401. Промежуточное соединение 55. 3,4-бис(Бензилокси)-6-[(2-фторфенил)метил]пиридазин Получили так, как описано для 3,4-бис(бензилокси)-6-[(4-фторфенил)метил]пиридазина (промежуточное соединение 51) из 3,4-бис(бензилокси)-6-хлорпиридазина (промежуточное соединение 1) и (2 фторбензил)цинка (II) хлорида с выходом 77%. 1H ЯМР (400 МГц, ДМСО-d6)7.23-7.51 (m, 12 Н), 7.097.23 (m, 3 Н), 5.48 (s, 2 Н), 5.14-5.29 (m, 2 Н) и 4.13 (s, 2H). MS ES+: 401. Промежуточное соединение 56. 3,4-бис(Бензилокси)-6-[(4-метилфенил)метил]пиридазин Получили так, как описано для 3,4-бис(бензилокси)-6-[(4-фторфенил)метил]пиридазина (промежуточное соединение 51) из 3,4-бис(бензилокси)-6-хлорпиридазина (Промежуточное соединение 1) и (4 метилбензил)цинка (II) хлорида с выходом 45%. 1H ЯМР (400 МГц, ДМСО-d6)7.05-7.50 (m, 15 Н), 5.48 Получили так, как описано для 3,4-бис(бензилокси)-6-[(4-фторфенил)метил]пиридазина (промежуточное соединение 51) из 3,4-бис(бензилокси)-6-хлорпиридазина (промежуточное соединение 1) и (3 метилбензил)цинка (II) хлорида с выходом 66%. 1H ЯМР (400 МГц, ДМСО-d6)7.00-7.50 (m, 15 Н), 5.315.62 (m, 2 Н), 5.11-5.25 (m, 2 Н), 3.97-4.14 (m, 2 Н) и 2.21-2.29 (m, 3 Н). MS ES+: 397. Промежуточное соединение 58. 3,4-бис(Бензилокси)-6-[3-(трифторметил)фенил]метилпиридазин Получили так, как описано для 3,4-бис(бензилокси)-6-[(4-фторфенил)метил]пиридазина (промежуточное соединение 51) из 3,4-бис(бензилокси)-6-хлорпиридазина (промежуточное соединение 1) и (3(трифторметил)бензил)цинка (II) хлорида с выходом 33%. 1 Н ЯМР (400 МГц, CD2Cl2)ppm 7.47-7.54 (m,4 Н), 7.42-7.46 (m, 2 Н), 7.29-7.42 (m, 8 Н), 6.61 (s, 1 Н), 5.56 (s, 2 Н), 5.09 (s, 2 Н) и 4.24 (br s, 2 Н). MS ES+: 451. Промежуточное соединение 58 а. 3,4-бис(Бензилокси)-6-[3,5-бис(трифторметил)фенил]метилпиридазин(0,034 г, 0,15 ммоль) в тетрагидрофуране (10 мл) под азотом добавили надосадочную жидкость цинкового реагента [полученного добавлением 1-(хлорметил)-3,5-бис(трифторметил)бензола (3 г, 11,43 ммоль) к суспензии магния (0,694 г, 28,6 ммоль) в растворе хлорида лития (28,6 мл, 14,28 ммоль) в тетрагидрофуране (1 М) и хлорида цинка (II) (12,57 мл, 12,57 ммоль) в тетрагидрофуране, нагретом до 30 С для начала реакции, и перемешиванием в течение одного часа для завершения реакции], и полученную краснокоричневую смесь нагревали при 65 С в течение 16 ч. Реакционную смесь охладили, разбавили этилацетатом и промыли насыщенным водным раствором бикарбоната натрия, насыщенным водным раствором хлорида аммония и насыщенным солевым раствором. Органические слои высушили (MgSO4), отфильтровали, а растворитель удалили in vacuo для получения коричневого маслянистого вещества. Маслянистое вещество очистили хроматографией на диоксиде кремния, элюируя 0-40% этилацетата в бензине,для получения указанного в заголовке соединения (520 мг, 33%). 1 Н ЯМР (400 МГц, ДМСО-d6)7.938.10 (m, 3 Н), 7.23-7.53 (m, 11), 5.49 (s, 2 Н), 5.23 (s, 2 Н) и 4.34 (s, 2H). MS ES+: 519. Схема 9 3,4-бис(Бензилокси)-6-этинилпиридазин (Промежуточное соединение 5; 3,0 г, 9,49 ммоль) растворили в тетрагидрофуране (24 мл) под атмосферой азота, и полученный раствор охладили до -78 С. Медленно добавили н-бутиллитий (23% раствор в гексане; 7,92 мл, 28,48 ммоль, 3,0 экв.) при -78 С, и полученную смесь оставили перемешиваться в течение 30 мин. К реакционной массе медленно добавили дигидро-2 Н-пиран-4(3 Н)-он (1,0 г, 10,44 ммоль, 1,1 экв.), и оставили смесь нагреваться до комнатной температуры. Затем неочищенную смесь вылили в насыщенный водный раствор хлорида аммония (300 мл),а продукт экстрагировали в этилацетат (100 мл 2). Органический слой отделили, промыли насыщенным солевым раствором, высушили (Na2SO4) и концентрировали in vacuo. Неочищенный продукт очистили колоночной хроматографией на силикагеле (элюируя 0-30% этилацетата в гексане) для получения заданного вещества (2,0 г, выход 501%). Схема 10 4,8 ммоль) растворили в дихлорметане (20 мл). К прозрачному раствору добавили триэтиламин (2,94 г,28,82 ммоль, 6,0 экв.), затем добавили метансульфонилхлорид (1,64 г, 14,42 ммоль, 3,0 экв.) при комнатной температуре. Реакционную смесь перемешивали в течение одного часа при комнатной температуре,затем реакционную массу вылили в воду (200 мл) и экстрагировали продукт в этилацетат (100 мл 2). Органический слой отделили, промыли насыщенным солевым раствором, высушили (Na2SO4) и концентрировали in vacuo для получения неочищенного указанного в заголовке соединения (1,0 г, выход 52%),которое использовали в этом виде на следующей стадии без дополнительной очистки. Схема 11 Промежуточное соединение 61. 5,6-бис(Бензилокси)-N-[(4-фторфенил)метилъ-N-метилпиридазин 3-амин. 5,6-бис(Бензилокси)-N-[(4-фторфенил)метил]пиридазин-3-амин (Промежуточное соединение 45; 0,7 г, 1,68 ммоль) растворили в N,N-диметилформамиде (8 мл) и охладили раствор до 0 С, затем добавили гидрид натрия (60 вес.% в парафине; 0,101 г, 2,53 ммоль, 1,5 экв.) под атмосферой азота. Реакционную смесь оставили нагреваться при комнатной температуре приблизительно на 30 мин и добавили йодметан(1,189 г, 8,43 ммоль, 5 экв.). Реакционную смесь оставили перемешиваться при комнатной температуре в течение одного часа, затем вылили в воду (100 мл), а органические материалы экстрагировали в этилацетат (50 мл 2). Органический слой отделили, промыли насыщенным солевым раствором, высушили(Na2SO4) и концентрировали in vacuo. Неочищенное соединение очистили колоночной хроматографией 3,4-Бис(бензилокси)-6-хлорпиридазин (промежуточное соединение 1; 5,0 г, 15,33 ммоль) растворили в этаноле (75 мл) при комнатной температуре. Добавили ацетат натрия (2,52 г, 30,67 ммоль) и продували полученную суспензию азотом в течение 10 минут. Добавили дихлорметановый комплекс [1,1'бис(дифенилфосфино)ферроцен]дихлорпалладия (II) (0,877 г, 1,073 ммоль) и продували реакционную смесь газообразным монооксидом углерода. Через реакционную смесь продували дополнительное количество монооксида углерода в течение 15 мин при комнатной температуре, а затем смесь перемешивали при 90 С, продувая монооксид углерода, в течение 2 ч. После завершения, реакционную массу вылили в воду (50 мл), затем добавили насыщенный солевой раствор (100 мл) и экстрагировали продукт в этилацетат (3100 мл). Объединенные органические слои отделили, высушили (Na2SO4) и концентрировали invacuo. Неочищенный продукт очистили колоночной хроматографией (диоксид кремния, 0-20% этилацетата в гексане) для получения 5,6-бис(бензилокси)пиридазин-3-карбоксилата (3,8 г, выход 68%). 1 Н ЯМР Этил 5,6-бис(бензилокси)пиридазин-3-карбоксилат (промежуточное соединение 62; 3,8 г, 10,43 ммоль) растворили в ТГФ (95 мл) и охладили до 0-5 С под атмосферой азота. Добавили раствор диизобутил-алюминия гидрида в ТГФ (1 М, 21 мл, 20,8 ммоль) при 0-5 С и перемешивали реакционную смесь при комнатной температуре в течение 2 ч. После завершения, реакционную смесь погасили добав- 26024956 лением этилацетата, а затем насыщенного водного раствора хлорида аммония. Полученную массу отфильтровали и экстрагировали в этилацетат (350 мл), а объединенные органические слои промыли насыщенным солевым раствором, высушили (Na2SO4) и концентрировали in vacuo. Неочищенный продукт очистили колоночной хроматографией (диоксид кремния, элюируя дихлорметаном) для получения 5,6 бис(бензилокси)пиридазин-3-карбальдегида (2,9 г, выход 87%). Промежуточное соединение 64. (5,6-бис(Бензилокси)пиридазин-3-ил)(циклопропил)метанол 5,6-бис(Бензилокси)пиридазин-3-карбальдегид (промежуточное соединение 63; 0,5 г, 1,562 ммоль) растворили в ТГФ (10 мл) и охладили до 0-5 С под атмосферой азота. Добавили раствор циклопропилмагния бромида в ТГФ (0,5 М, 4,7 мл, 2,34 ммоль) при 0-5 С и перемешивали реакционную смесь при комнатной температуре в течение 4 ч. После завершения, реакцию погасили добавлением этилацетата и насыщенного водного раствора хлорида аммония и экстрагировали в этилацетат (250 мл). Объединенные органические слои отделили и промыли насыщенным солевым раствором, высушили (Na2SO4) и концентрировали in vacuo. Неочищенное соединение очистили колоночной хроматографией (диоксид кремния, 0-2% метанола в дихлорметане) для получения (5,6-бис(бензилокси)пиридазин-3-ил) (циклопропил)метанола (0,35 г, выход 61,9%). MS ES+: 363. Промежуточное соединение 65. 3,4-бис(Бензилокси)-6-(циклопропилиденметил)пиридазин(5,6-бис(Бензилокси)пиридазин-3-ил)(циклопропил)метанол (промежуточное соединение 64; 0,34 г,0,94 ммоль) растворили в дихлорметане (10,2 мл) и охладили при 0-5 С под атмосферой азота. К реакционной смеси добавили триэтиламин (0,474 г, 4,70 ммоль) и метансульфонилхлорид (0,162 г, 1,401 ммоль) и оставили ее перемешиваться при комнатной температуре в течение 3 ч. После завершения, реакцию погасили, вылив смесь в насыщенный водный раствор бикарбоната натрия (25 мл), и экстрагировали продукт в этилацетат (250 мл). Объединенные органические слои отделили, промыли насыщенным солевым раствором, высушили (Na2SO4) и концентрировали in vacuo. Неочищенное соединение очистили колоночной хроматографией (диоксид кремния, 0-10% этилацетата в н-гексане) для получения 3,4 бис(бензилокси)-6-(циклопропилиденметил)пиридазина (0,18 г, выход 56%). 1 Н ЯМР (CD2Cl2)7.28-7.57 Смесь (1,3-бис(2,6-диизопропилфенил)-2,3-дигидро-1H-имидазол-2-ил)меди (II) хлорида (0,718 г,1,469 ммоль), трет-бутоксида натрия (0,141 г, 1,469 ммоль) и ТГФ (106 мл) оставили перемешиваться под азотом в течение 10 мин. Добавили 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолан) (8,21 г, 32,3 ммоль) и перемешивали смесь в течение 30 мин при комнатной температуре. Смесь охладили до -78 С и через шприц добавили раствор 1-этинил-4-(трифторметил)бензола (5 г, 29,4 ммоль) в ТГФ (21,30 мл) и метанол (1,308 мл, 32,3 ммоль). Затем всю смесь перемешивали при -40 С при медленном нагревании до 20 С в течение ночи. Полученную смесь отфильтровали через слой диатомовой земли для получения коричневого раствора, который концентрировали in vacuo. Остаток очистили колоночной хроматографией (диоксид кремния, элюируя 0-6% диэтилового эфира в бензине). Объединенные фракции подвергли дальнейшей очистке колоночной хроматографией (диоксид кремния, элюируя 0-50% дихлорметана в бензине) для получения 4,4,5,5-тетраметил-2-1-[4-(трифторметил)фенил]этенил-1,3,2-диоксаборолана в виде желтого твердого вещества (2,82 г, 32%). 1H ЯМР (ДМСО-d6)7.67-7.72 (m, 2 Н) 7.61-7.66 (m, 2 Н) 6.21 (m, 1 Н) 6.11 (m, 1 Н) и 1.28 (s, 12 Н). Промежуточное соединение 67. 3,4-бис(Бензилокси)-6-1-[4-(трифторметил)фенил]этенилпиридазин Получили так, как описано для 3,4-бис(бензилокси)-6-3-метил-4-(трифторметил)фенил)этинил пиридазина (промежуточное соединение 74) из 3,4-бис(бензилокси)-6-этинилпиридазина (промежуточное соединение 5) и 1-бром-2-хлор-4-(трифторметил)бензола с выходом 75%. 1H ЯМР (ДМСО-d6)8.11 Получили так, как описано для 3,4-бис(бензилокси)-6-3-метил-4-(трифторметил)фенил)этинил пиридазина (промежуточное соединение 74) из 3,4-бис(бензилокси)-6-этинилпиридазина (промежуточное соединение 5) и 1-бром-2-фтор-4-(трифторметил)бензола с выходом 16%. 1H ЯМР (ДМСО-d6)7.908.00 (m, 2 Н), 7.72 (m, 1 Н), 7.64 (s, 1H) 7.30-7.53 (m, 10 Н), 5.60 (s, 2 Н) и 5.33 (s, 2 Н). MS: ES+: 479. Промежуточное соединение 71. 3,4-бис(Бензилокси)-6-[(Е)-2-[3,5-бис(трифторметил)фенил]этенил]пиридазин Получили так, как описано для 3,4-бис(бензилокси)-6-(1-фенилэтенил)пиридазина (промежуточное соединение 25) из 3,4-бис(бензилокси)-6-хлорпиридазина (промежуточное соединение 1) и 2-[(Е)-2-[3,5 бис(трифторметил)фенил]этенил]-4,4,5,5-тетраметил-1,3,2-диоксаборолана с выходом 77%. 1H ЯМР Смешали 3,4-бис(Бензилокси)-6-этенилпиридазин (промежуточное соединение 78: 0,578 г, 1,816 ммоль), карбонат цезия (0,887 г, 2,72 ммоль), трициклогексилфосфан дихлорпалладия (1:2) (0,067 г, 0,091 ммоль) и 4-хлор-1,2-бис(трифторметил)бензол (0,542 г, 2,179 ммоль). Реакционный сосуд вакуумировали и продули азотом, затем под вакуумом добавили толуол (6,05 мл) и перемешивали смесь под азотом, и нагревали до 140 С в течение 11 ч. После погашения насыщенным водным раствором хлорида аммония,полученную смесь разбавили дихлорметаном, пропустили через фазовый разделитель и концентрировалиin vacuo. Остаток очистили колоночной хроматографией (диоксид кремния, элюируя 0-50% этилацетата в бензине) для получения неочищенного 3,4-бис(бензилокси)-6-[(Е)-2-[3,4-бис(трифторметил)фенил]этенил] пиридазина, который использовали напрямую на следующей стадии без дополнительной очистки. Смешали 3,4-бис(бензилокси)-6-этинилпиридазин (промежуточное соединение 5; 3,0 г, 9,48 ммоль),йодид меди (I) (0,181 г, 0,948 ммоль) и бис(трифенилфосфин)палладия (II) дихлорид (0,333 г, 0,474 ммоль). Реакционный сосуд продули азотом, затем добавили 4-бром-2-метил-1-(трифторметил)бензол(2,493 г, 10,43 ммоль), 1,8-диазабициклоундец-7-ен (8,66 г, 56,9 ммоль) и тетрагидрофуран (32 мл), затем полученную смесь оставили перемешиваться при комнатной температуре в течение ночи. Реакцию погасили насыщенным солевым раствором и экстрагировали в этилацетат (х 2), а объединенные органические экстракты промыли насыщенным солевым раствором, высушили (MgSO4) и концентрировали in vacuo для получения темно-коричневого смолянистого вещества. Смолянистое вещество очистили колоночной хроматографией (диоксид кремния, 0-50% этилацетата в бензине) для получения 3,4-бис(бензилокси)-63-метил-4-(трифторметил)фенил)этинил)пиридазина в виде темно-коричневого маслянистого вещества Получили так, как описано для 3,4-бис(бензилокси)-6-3-метил-4-(трифторметил)фенил)этинил пиридазина (промежуточное соединение 74), используя 4-бром-2-хлор-1-(трифторметил)бензол, с выходом 98%. 1 Н ЯМР (CD2Cl2)7.80 (s, 1H), 7.71-7.76 (m, 1H), 7.62 - 7.69 (m, 1H), 7.52 (d, 1 Н), 7.32-7.46 (m,9 Н), 7.08 (s, 1H), 5.64 (s, 2 Н) и 5.22 (s, 2 Н). MS ES+: 495. Промежуточное соединение 76. 3,4-бис(Бензилокси)-6-[(Е)-2-[2-метил-4-(трифторметил)фенил] этенил]пиридазин Смешали 1-бром-2-метил-4-(трифторметил)бензол (1,144 г, 4,79 ммоль), 3,4-бис(бензилокси)-6 этенилпиридазин (промежуточное соединение 78; 1,27 г, 3,99 ммоль), ацетат палладия (II) (0,045 г, 0,199 ммоль), триэтиламин (10,56 мл, 76 ммоль), три-о-толилфосфин (0,243 г, 0,798 ммоль) и ацетонитрил (8 мл). Реакционную смесь обрабатывали микроволновым излучением при 120 С в течение 30 мин, затем погасили водой и экстрагировали в этилацетат. Объединенные органические слои промыли насыщенным солевым раствором, высушили (MgSO4) и концентрировали in vacuo для получения оранжевого смолянистого вещества. Это вещество очистили колоночной хроматографией (диоксид кремния, элюируя 030% этилацетата в бензине) для получения 3,4-бис(бензилокси)-6-[(Е)-2-[2-метил-4-(трифторметил)фенил]этенил]пиридазина в виде белого твердого вещества (1,04 г, 55%). 1 Н ЯМР (CD2Cl2)7.78 (d, 1H),7.71 (d, 1H), 7.26-7.57 (m, 13 Н), 7.09 (br. s., 1 Н), 5.62 (s, 2 Н), 5.28 (s, 2 Н) и 2.52 (s, 3 Н). MS ES+: 477. Промежуточное соединение 77. 3,4-бис(Бензилокси)-6-[(Е)-2-[3,5-дифтор-4-(трифторметил)фенил] этенил]пиридазин
МПК / Метки
МПК: A61P 25/28, C07D 407/10, A61K 31/50, A61P 25/18, C07D 237/16, A61P 29/00, A61K 31/501, C07D 401/10
Метки: соединения, ингибиторов, качестве, применение, пиридазиноновые
Код ссылки
<a href="https://eas.patents.su/30-24956-piridazinonovye-soedineniya-i-ih-primenenie-v-kachestve-ingibitorov-daao.html" rel="bookmark" title="База патентов Евразийского Союза">Пиридазиноновые соединения и их применение в качестве ингибиторов daao</a>
Предыдущий патент: Патронный фильтр
Следующий патент: Способ обработки древесной плиты
Случайный патент: Лекарственное средство и способ лечения эректильных дисфункций












