Производные пурина и их применение для лечения заболевания
Номер патента: 23935
Опубликовано: 29.07.2016
Авторы: Фюре Паскаль, Чжу Яни, Радетич Бранко, Сэндхэм Дэвид Эндрю, Бриар Эмманюэлль, Майер Петер, Лерхнер Андреас
Формула / Реферат
1. Соединение формулы (I) или его фармацевтически приемлемая соль
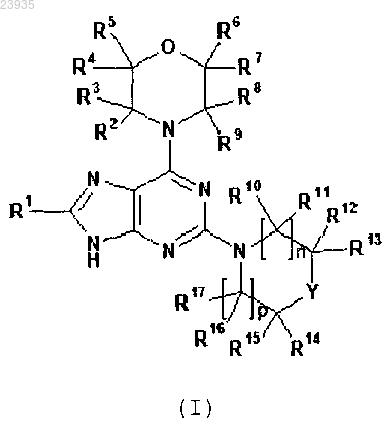
в которой
R1 выбран из группы, состоящей из
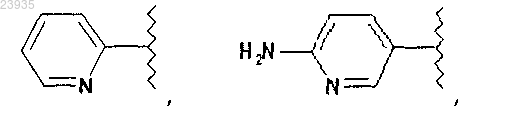
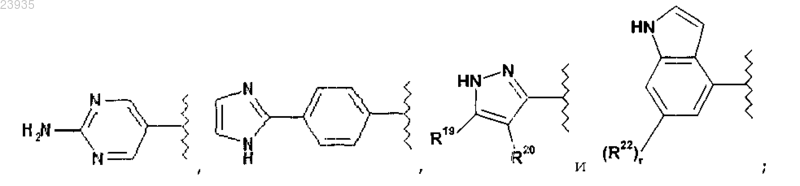
в которой
R19 и R20 независимо означает водород;
R22, в каждом случае независимо, означает фтор, метокси, гидроксиметил или метоксикарбонил;
r равно 1;
R2, R3, R4, R5, R6, R7, R8 и R9 независимо означает водород или C1-C3-алкил;
n и p независимо равны 0, 1 или 2;
R10, R11, R12, R13, R14, R15, R16 и R17, в каждом случае независимо, означает водород, C1-C3-алкил или гидрокси-С1-С3-алкил; или R11 и R16 вместе образуют этиленовый мостик; или R14 и R15 вместе с атомом углерода, к которому они присоединены, связаны с образованием тетрагидропиранильного кольца; и
Y означает О, CHR23, CR24R25 или NR26, где
R23 означает гидроксил; или R23 и R13 вместе с атомами углерода, к которым они присоединены, связаны с образованием конденсированного тетрагидрофуранильного кольца;
R24 и R25 независимо означает водород или галоген; или R24 и R25 вместе с атомом углерода, к которому они присоединены, связаны с образованием тетрагидропиранильного кольца; и
R26 означает С1-С3-алкил или оксетанил;
или соединение или его фармацевтически приемлемую соль, выбранное из следующего перечня соединений:
8-(1Н-индол-4-ил)-6-(3-метилморфолин-4-ил)-2-[1,4]оксазепан-4-ил-9Н-пурин;
8-(1Н-индол-4-ил)-6-(3-метилморфолин-4-ил)-2-(3-пропилморфолин-4-ил)-9Н-пурин;
8-[8-(1Н-индол-4-ил)-6-(3-метилморфолин-4-ил)-9Н-пурин-2-ил]-8-азабицикло[3.2.1]октан-3-ол;
8-[8-(1Н-индол-4-ил)-6-(3-метилморфолин-4-ил)-9Н-пурин-2-ил]-8-азабицикло[3.2.1]октан-3-ол;
2-(3-этилморфолин-4-ил)-8-(1Н-индол-4-ил)-6-(3-метилморфолин-4-ил)-9Н-пурин;
8-(1Н-индол-4-ил)-6-(3-метилморфолин-4-ил)-2-(4-метилпиперазин-1-ил)-9Н-пурин;
8-(1Н-индол-4-ил)-6-(3-метилморфолин-4-ил)-2-(6-окса-2-азаспиро[3.5]нон-2-ил)-9Н-пурин;
8-(1Н-индол-4-ил)-6-(3-метилморфолин-4-ил)-2-(4-оксетан-3-илпиперазин-1-ил)-9Н-пурин;
8-(1Н-индол-4-ил)-6-(3-метилморфолин-4-ил)-2-(тетрагидрофуро[3,4-с]пиррол-5-ил)-9Н-пурин;
2-(гексагидрофуро[3,4-с]пиридин-5-ил)-8-(1Н-индол-4-ил)-6-(3-метилморфолин-4-ил)-9Н-пурин;
8-(1Н-индол-4-ил)-2-(3-изопропилморфолин-4-ил)-6-(3-метилморфолин-4-ил)-9Н-пурин;
8-(1Н-индол-4-ил)-6-(3-метилморфолин-4-ил)-2-(4-трифторметилпиперидин-1-ил)-9Н-пурин;
2-(2,6-диметилморфолин-4-ил)- 8-(1Н-индол-4-ил)-6-(3-метилморфолин-4-ил)-9Н-пурин;
8-(1Н-индол-4-ил)-6-(3-метилморфолин-4-ил)-2-(7-окса-1-азаспиро[3.5]нон-1-ил)-9Н-пурин;
{4-[8-(1Н-индол-4-ил)-6-(3-метилморфолин-4-ил)-9Н-пурин-2-ил]морфолин-2-ил}метанол.
2. Соединение по п.1 или его фармацевтически приемлемая соль, в котором R1 означает

3. Соединение по п.1 или его фармацевтически приемлемая соль, в котором R1 означает

4. Соединение по п.1 или его фармацевтически приемлемая соль, в котором R1 означает
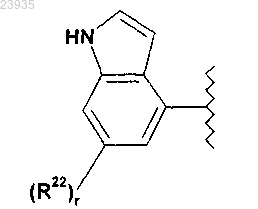
5. Соединение по любому из пп.1-4 или его фармацевтически приемлемая соль, в котором R2, R3, R4, R5, R6, R7, R8 и R9 независимо означает водород или метил.
6. Соединение по любому из пп.1-5 или его фармацевтически приемлемая соль, в котором Y означает О.
7. Соединение по любому из пп.1-5 или его фармацевтически приемлемая соль, в котором Y означает CHR23 или CR24R25.
8. Соединение или его фармацевтически приемлемая соль по п.1, которое выбрано из
2,6-бис-((R)-3-метилморфолин-4-ил)-8-пиридин-2-ил-9Н-пурина;
2-((S)-3-метилморфолин-4-ил)-6-((R)-3-метилморфолин-4-ил)-8-(1Н-пиразол-3-ил)-9Н-пурина;
8-(1Н-индол-4-ил)-6-((R)-3-метилморфолин-4-ил)-2-[1,4]оксазепан-4-ил-9Н-пурина;
8-[4-(1Н-имидазол-2-ил)фенил]-2,6-6ис-((R)-3-метилморфолин-4-ил)-9Н-пурина;
8-(6-фтор-1Н-индол-4-ил)-2-((S)-3-метилморфолин-4-ил)-6-((R)-3-метилморфолин-4-ил)-9Н-пурина;
{4-[2,6-бис-((R)-3-метилморфолин-4-ил)-9Н-пурин-8-ил]-1Н-индол-6-ил}метанола;
2-((S)-3-метилморфолин-4-ил)-6-((R)-3-метилморфолин-4-ил)-8-пиридин-2-ил-9Н-пурина;
2,6-бис-((S)-3-метилморфолин-4-ил)-8-пиридин-2-ил-9Н-пурина;
2,6-диморфолин-4-ил-8-пиридин-2-ил-9Н-пурина;
2,6-бис-((S)-3-метилморфолин-4-ил)-8-(1Н-пиразол-3-ил)-9Н-пурина;
2,6-бис-((R)-3-метилморфолин-4-ил)-8-(1Н-пиразол-3-ил)-9Н-пурина;
8-(1Н-индол-4-ил)-6-((R)-3-метилморфолин-4-ил)-2-((R)-3-пропилморфолин-4-ил)-9Н-пурина;
8-[8-(1Н-индол-4-ил)-6-((R)-3-метилморфолин-4-ил)-9Н-пурин-2-ил]-8-азабицикло[3.2.1]октан-3-ола;
8-[8-(1Н-индол-4-ил)-6-((R)-3-метилморфолин-4-ил)-9Н-пурин-2-ил]-8-азабицикло[3.2.1]октан-3-ола;
2-((R)-3-этилморфолин-4-ил)-8-(1Н-индол-4-ил)-6-((R)-3-метилморфолин-4-ил)-9Н-пурина;
8-(1Н-индол-4-ил)-6-((R)-3-метилморфолин-4-ил)-2-(4-метилпиперазин-1-ил)-9Н-пурина;
8-(1Н-индол-4-ил)-6-((R)-3-метилморфолин-4-ил)-2-(6-окса-2-азаспиро[3.5]нон-2-ил)-9Н-пурина;
8-(1Н-индол-4-ил)-6-((R)-3-метилморфолин-4-ил)-2-(4-оксетан-3-илпиперазин-1-ил)-9Н-пурина;
8-(1Н-индол-4-ил)-6-((R)-3-метилморфолин-4-ил)-2-(тетрагидрофуро[3,4-c]пиррол-5-ил)-9Н-пурина;
2-(гексагидрофуро[3,4-с]пиридин-5-ил)-8-(1Н-индол-4-ил)-6-((R)-3-метилморфолин-4-ил)-9Н-пурина;
8-(1Н-индол-4-ил)-2-((R)-3-изопропилморфолин-4-ил)-6-((R)-3-метилморфолин-4-ил)-9Н-пурина;
8-(1Н-индол-4-ил)-6-((R)-3-метилморфолин-4-ил)-2-(4-трифторметилпиперидии-1-ил)-9Н-пурина;
2-((2S,6R)-2,6-диметилморфолин-4-ил)-8-(1Н-индол-4-ил)-6-((R)-3-метилморфолин-4-ил)-9Н-пурина;
8-(1Н-индол-4-ил)-6-((R)-3-метилморфолин-4-ил)-2-(7-окса-1-азаспиро[3.5]нон-1-ил)-9Н-пурина;
{(S)-4-[8-(1Н-индол-4-ил)-6-((R)-3-метилморфолин-4-ил)-9Н-пурин-2-ил]морфолин-2-ил}метанола;
{(R)-4-[8-(1Н-индол-4-ил)-6-((R)-3-метилморфолин-4-ил)-9Н-пурин-2-ил]морфолин-2-ил}метанола;
5-[2,6-бис-((S)-3-метилморфолин-4-ил]-9Н-пурин-8-ил]пиридин-2-иламина;
5-[2,6-бис-((R)-3-метилморфолин-4-ил)-9Н-пурин-8-ил]пиридин-2-иламина;
5-[2,6-бис-((R)-3-метилморфолин-4-ил)-9Н-пурин-8-ил]пиримидин-2-иламина;
8-[4-(1Н-имидазол-2-ил)фенил]-2,6-бис-((S)-3-метилморфолин-4-ил)-9Н-пурина;
8-(6-метокси-1Н-индол-4-ил)-2-((S)-3-метилморфолин-4-ил)-6-((R)-3-метилморфолин-4-ил)-9Н-пурина;
метилового эфира 4-[2,6-бис-((R)-3-метилморфолин-4-ил)-9Н-пурин-8-ил]-1Н-индол-6-карбоновой кислоты и
их фармацевтически приемлемых солей.
9. Соединение по п.1, которое представляет собой 2,6-бис-((R)-3-метилморфолин-4-ил)-8-пиридин-2-ил-9Н-пурин, описывающийся следующей формулой:
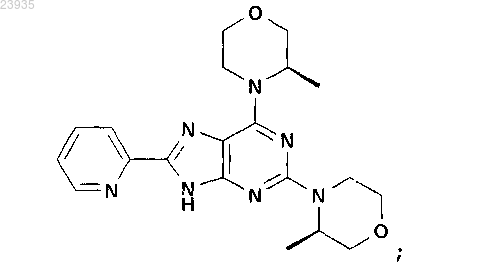
или его фармацевтически приемлемая соль.
10. Соединение по п.1, которое представляет собой 8-(6-фтор-1Н-индол-4-ил)-2-((S)-3-метилморфолин-4-ил)-6-((R)-3-метилморфолин-4-ил)-9Н-пурин, описывающийся следующей формулой:
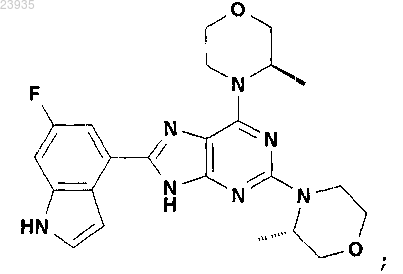
или его фармацевтически приемлемая соль.
11. Соединение по п.1, которое представляет собой 2-((S)-3-метилморфолин-4-ил)-6-((R)-3-метилморфолин-4-ил)-8-пиридин-2-ил-9Н-пурин, описывающийся следующей формулой:
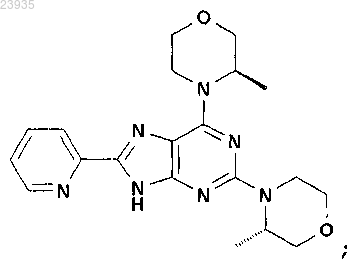
или его фармацевтически приемлемая соль.
12. Соединение по п.1, которое представляет собой 2,6-бис-((S)-3-метилморфолин-4-ил)-8-(1Н-пиразл-3-ил)-9Н-пурин, описывающийся следующей формулой:
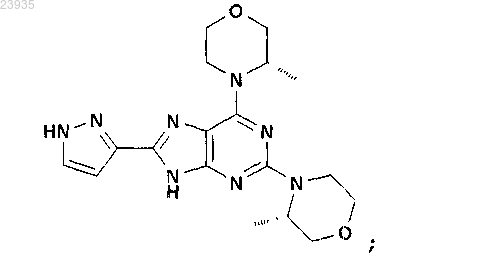
или его фармацевтически приемлемая соль.
13. Лекарственное средство для лечения или предупреждения одного или более заболеваний, причем заболевание представляет собой рак, нейродегенеративное нарушение или офтальмологическое заболевание, содержащее соединение по любому из пп.1-12 или его фармацевтически приемлемую соль.
14. Применение соединения по любому из пп.1-12 или его фармацевтически приемлемой соли для лечения или предупреждения рака, нейродегенеративного нарушения или офтальмологического заболевания.
15. Фармацевтическая композиция, содержащая соединение по любому из пп.1-12 или его фармацевтически приемлемую соль и фармацевтически приемлемый инертный наполнитель, разбавитель или носитель.
16. Применение соединения по любому из пп.1-12 или его фармацевтически приемлемой соли для приготовления лекарственного средства для лечения или предупреждения рака, нейродегенеративного нарушения или офтальмологического заболевания.
17. Фармацевтический набор, содержащий соединение по любому из пп.1-12 или его фармацевтически приемлемую соль и другое противораковое средство.
Текст
ПРОИЗВОДНЫЕ ПУРИНА И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЯ Настоящее изобретение относится к новым гетероциклическим соединениям формулы (I) Бриар Эмманюэлль, Фюре Паскаль,Лерхнер Андреас, Майер Петер (CH),Радетич Бранко (US), Сэндхэм Дэвид Эндрю (GB), Чжу Яни (US) в которой все переменные являются такими, как определено в описании, к их получению,применению в медицине, в частности к их применению для лечения рака и нейродегенеративных нарушений, и к содержащим их лекарственным средствам. Область техники, к которой относится изобретение Настоящее изобретение относится к производным пурина и их фармацевтически приемлемым солям, способам их получения, к их применению для лечения заболеваний, к их применению по отдельности или в комбинации по меньшей мере с одним дополнительным терапевтическим средством и необязательно в комбинации с фармацевтически приемлемым носителем для приготовления фармацевтических препаратов, к применению фармацевтических препаратов для лечения заболеваний и к способу лечения указанных заболеваний, включающему введение производных пурина теплокровному животному, предпочтительно человеку. Уровень техники Надсемейство фосфатидилинозит-3-киназ включает 4 разные связанные с PI3K липид- или протеинкиназы. Классы I, II и III включают липидкиназы, которые различаются по их специфичности по отношению к субстрату, а киназы класса IV PI3K (также обозначаемые, как PIKKs являются протеинкиназами. Класс I фосфатидилинозит-3-киназ включает семейство липидкиназ, которые катализируют перенос фосфата в D-3'-положение инозитсодержащих липидов с образованием фосфоинозит-3-фосфата(PIP), фосфоинозит-3,4-дифосфата (PIP2) и фосфоинозит-3,4,5-трифосфата (PIP3), которые, в свою очередь, действуют в качестве вторичных мессенджеров в каскадах передачи сигналов путем вовлечения белков, которые содержат гомологичные плекстрину FYVE, Phox и другие связывающие фосфолипиды домены, в различные передающие сигналы комплексы, которые часто присутствуют на плазматической мембране Vanhaesebroeck et al., Annu. Rev. Biochem 70:535 (2001); Katso et al., Annu. Rev. Cell. Dev. Biol. 17:615 (2001. Из двух классов I PI3K, PI3K класса 1 А представляют собой гетеродимеры, состоящие из каталитической субъединицы p110 (изоформы , , ), конститутивно ассоциированной с регуляторной субъединицей, которая может представлять собой p85, p55, p50, p85 или р 55. Подкласс, представляющий собой класс 1 В, состоит из одного представителя семейства, а именно гетеродимера, который включает каталитическую субъединицу p110, ассоциированную с одной из двух регуляторных субъединиц p101 или р 84 (Fruman et al., Annu Rev. Biochem. 67:481 (1998); Suire et al., Curr. Biol. 15:566(2005. Модулярные домены субъединиц p85/55/50 включают домены, гомологичные Src (SH2), которые связывают остатки фосфотирозина в контексте специфической последовательности на активированном рецепторе и цитопламатических тирозинкиназах, что приводит к активации и локализации PI3K класса 1 А. PI3K класса 1B активируются непосредственно связанными с протеином G рецепторами, с которыми связываются самые различные пептидные и непептидные лиганды (Stephens et al., Cell 89:105 (1997;Katso et al., Annu. Rev. Cell Dev. Biol. 17:615-675 (2001. В результате образовавшиеся фосфолипидные продукты PI3K класса 1 связывают рецепторы, расположенные выше в пути передачи сигнала с расположенными ниже в пути передачи сигнала клеточными элементами, оказывающими воздействие на пролиферацию, выживание, хемотаксис, направленную миграцию клеток, подвижность, метаболизм, воспалительные и аллергические ответы, транскрипцию и трансляцию (Cantley et al., Cell 64:281 (1991); Escobedo and Williams, Nature 335:85 (1988); Fantl et al., Cell 69:413 (1992. Во многих случаях P1P2 и P1P3 приводят к рекрутменту Akt, человеческого продукта, гомологичного вирусному онкогену v-Akt, на плазматической мембране, где он действует в качестве узловой точки для многих внутриклеточных путей передачи сигналов, важных для роста и выживания (Fantl et al., Cell 69:413-423(1992); Bader et al., Nature Rev. Cancer 5:921 (2005); Vivanco and Sawyer, Nature Rev. Cancer 2:489 (2002. Аберрантная регуляция PI3K, которая часто повышает выживание благодаря активацииAkt, является одним из наиболее превалирующих явлений при раке у человека и, как установлено, происходит на нескольких уровнях. У гена-супрессора опухолей PTEN, который дефосфорилирует фосфоинозитиды в 3' положении инозитного кольца и поэтому обладает способностью антагонизировать активность PI3K, во многих типах опухолей отсутствует функциональная активность. В других типах опухолей происходит амплификация генов, кодирующих изоформу p110, PIK3CA и Akt, и повышенный уровень экспрессии белковых продуктов этих генов был продемонстрирован при некоторых видах рака человека. Кроме того, для некоторых видов рака человека описаны мутации и транслокации субъединицыp85, которая служит для активации комплекса p85-p110. Кроме того, установлено, что соматические миссенс-мутации PIK3CA, которые активируют пути передачи сигнала в прямом направлении, достаточно часто встречаются при самых различных типах рака человека (Kang et al., Proc. Natl. Acad. Sci. USA 102:802 (2005); Samuels et al., Science 304:554 (2004); Samuels et al., Cancer Cell 7:561-573 (2005. Эти данные свидетельствуют о том, что нарушение регуляции фосфоинозит-3-киназы и компонентов, находящихся выше и ниже на этом пути передачи сигнала, является одним из наиболее распространенных видов нарушения регуляции, связанных с раком и пролиферативными заболеваниями человека (Parsonset al., Nature 436:792 (2005); Hennessey at el., Nature Rev. Drug Disc. 4:988-1004 (2005. Мишенью воздействия рапамицина (mTOR) у млекопитающих является представитель класса IVPI3K. mTOR проводит сборку системы передачи сигналов, которая передает сигналы питательных веществ и различных других стимулов для регуляции самых различных клеточных функций, включая рост,пролиферацию, выживание, аутофагию, различные типы дифференциации и метаболизма клеток. В клетках млекопитающих белок mTOR существует в виде двух комплексов, называющихся mTORC1 иmTORC2. Комплекс mTORC1, который представляет собой mTOR, связанный с raptor, был объектом многочисленных исследований. mTORC1 объединяет поступление питательных веществ и фактора роста и, в свою очередь, обеспечивает регуляцию роста клеток преимущественно с помощью регуляторов синтеза белка, таких как 4EBP1 или RPS6. Для активации mTORC1 необходимо поступление активных киназ PI3K и Akt, что означает, что mTORC1 представляет собой расположенный в прямом направлении эффектор пути PI3K. Показано, что mTOR при связывании в комплекс mTOR2 (mTORC2) обеспечивает активацию Akt путем фосфорилирования S473 (нумерация Akt 1) (Sarbassov et al., Science 307:7098(2005. Поэтому в данном случае mTORC2 считают расположенным в обратном направлении активатором Akt. Примечательно, что поэтому mTOR можно считать важным для расположенного в обратном и прямом направлении Akt. Поэтому каталитическое ингибирование mTOR может представлять собой уникальный путь введения очень прочного блока на пути PI3K-Akt путем использования расположенных в обратном и прямом направлении эффекторов. Также продемонстрирована взаимосвязь между ингибированием mTOR и аутофагией (Ravikumar etal., Nat Genet. 36(6):585-95 (2004. Аутофагия необходима для гомеостаза нейронов и ее дисфункция была связана с нейродегенерацией. Утрата аутофагии в нейронах вызывает нейродегенеративное заболевание у мышей (Komatsu et al., Nature 441:880-4 (2006); Hara et al., Nature 441:885-9 (2006, указывая на критически важную роль аутофагии для поддержания гомеостаза белков в нейронах. Нейродегенеративные заболевания характерируются включением неправильно упакованных белков в качестве одного из отличительных признаков. Индуцирование аутофагии увеличивает клиренс неправильно упакованных белков и оно предложено в качестве средства лечения нейродегенеративных протеинопатий. Болезнь Гентингтона (БГ) представляет собой аутосомное доминантное нейродегенеративное нарушение, при котором мутация гена IT15, кодирующего белок Huntingtin (Htt) приводит к полиглутаминовой экспансии в Exon1 в Htt. Внутриклеточная агрегация этого мутантного белка Htt и атрофия головного мозга (в особенности коры и полосатого тела) являются главными отличительными признаками БГ. Клинически наряду с психиатрическими нарушениями и потерей массы это приводит к нарушению движений и нарушению познавательной способности. Ингибирование mTOR индуцирует аутофагию уменьшает агрегацию мутантного Htt и опосредуемую мутантным Htt гибель клеток в in vitro и in vivo моделях БГ (Ravikumar et al., Nat Genet. 36(6):585-95(2004. Поэтому ингибирование mTOR делает возможным фармацевтическое вмешательство и модулирование нарушенных клеточных процессов, характерных для БГ. Вследствие указанного выше, ингибиторы mTOR считаются полезными для лечения пролиферативных заболеваний, таких как рак, и других нарушений, в частности БГ. Настоящее изобретение относится к новым производным пурина, обладающим ингибирующей активностью по отношению к mTOR, к их получению, применению в медицине и к содержащим их лекарственным средствам. Сущность изобретения Первым объектом настоящего изобретения является соединение формулы (I) или его фармацевтически приемлемая сольR18, в каждом случае независимо, означает фтор или метил;R19 и R20 независимо означает водород или фтор;R и R6 вместе образуют метиленовый мостик; или R3 и R8 вместе образуют этиленовый мостик; или R5 иR6 вместе образуют этиленовый мостик;R10, R11, R12, R13, R14, R15, R16 и R17, в каждом случае независимо, означает водород, C1-С 3-алкил,фтор-С 1-С 3-алкил или гидрокси-С 1-С 3-алкил; или R11 и R16 вместе образуют этиленовый мостик; или R13 и R14 вместе образуют этиленовый мостик; или R14 и R15 вместе с атомом углерода, к которому они присоединены, связаны с образованием тетрагидропиранильного кольца; иY означает О, CHR23, CR24R25 или NR26,где R23 означает гидроксигруппу или фтор-С 1-С 3-алкил; или R23 и R13 вместе с атомами углерода, к которым они присоединены, связаны с образованием конденсированного тетрагидрофуранильного кольца;R24 и R25 независимо означают водород или галоген; или R24 и R25 вместе с атомом углерода, к которому они присоединены, связаны с образованием тетрагидропиранильного кольца; иR26 означает C1-C3-алкил или оксетанил; и соединение или его фармацевтически приемлемая соль, выбранное из следующего перечня соединений: Определения При использовании в настоящем изобретении термин "галоген" означает фтор, хлор, бром и йод. При использовании в настоящем изобретении термин "C1-C3-алкил" означает полностью насыщенный разветвленный или неразветвленный углеводородный фрагмент, содержащий до 3 атомов углерода. Типичные примеры C1-C3-алкила включают метил, этил, н-пропил и изопропил. При использовании в настоящем изобретении термин "гидрокси-С 1-С 3-алкил" означает C1-C3 алкильную группу, определенную выше в настоящем изобретении, замещенную одним гидроксильным радикалом. Типичные примеры гидрокси-С 1-С 3-алкила включают, но не ограничиваются только ими,гидроксиметил, 2-гидроксиэтил, 2-гидроксипропил и 3-гидроксипропил. При использовании в настоящем изобретении термин "фтор-C1-С 3-алкил" означает C1-C3 алкильный радикал, определенный выше, замещенный одним или большим количеством фторных радикалов. Примеры фтор-С 1-С 3-алкила включают трифторметил, дифторметил, фторметил, 2,2,2 трифторэтил, 1-фторметил-2-фторэтил и 3,3-дифторпропил. При использовании в настоящем изобретении (в особенности в формуле изобретения) термины, использующиеся в единственном числе, включают множественное число, и наоборот, если в настоящем изобретении не указано иное и если это явно не противоречит контексту. Использование любого и всех примеров или указаний на типичные значения (например, "такой как") в настоящем изобретении предназначено просто для лучшего описания настоящего изобретения и не налагает ограничения на объем настоящего изобретения, определяющийся формулой изобретения. Термин "соединения, предлагаемые в настоящем изобретении" (если специально не указано иное) означает соединения формулы (I), соединения примеров, фармацевтически приемлемые соли таких соединений и/или гидраты или сольваты таких соединений, а также все стереоизомеры (включая диастереоизомеры и энантиомеры), таутомеры и изотопно-меченые соединения (включая дейтерозамещенные). Термин "средства, предлагаемые в настоящем изобретении" обладает таким же значением, как "соединения, предлагаемые в настоящем изобретении". При использовании в настоящем изобретении термин "ингибировать", "ингибирование" или "подавление" означает ослабление или подавление данного патологического состояния, симптома или нарушения или заболевания или значительное ослабление исходной биологической активности или процесса. При использовании в настоящем изобретении термин "изомеры" означает разные соединения, кото-4 023935 рые обладают одной и той же молекулярной формулой, но различаются по расположению и конфигурации атомов. Кроме того, при использовании в настоящем изобретении термин "оптический изомер" или"стереоизомер" означает любую из разных стереоизомерных конфигураций, которые могут существовать для данного соединения, предлагаемого в настоящем изобретении, и включает геометрические изомеры. Следует понимать, что заместитель может быть присоединен к атому углерода, являющемуся хиральным центром. Термин "хиральный" относится к молекулам, которые обладают зеркальными изображениями,не налагающимися друг на друга, в то время как термин "ахиральный" относится к молекулам, которые обладают зеркальными изображениями, налагающимися друг на друга. Поэтому в объем настоящего изобретения входят энантиомеры, диастереоизомеры или рацематы соединения. "Энантиомеры" представляют собой пару стереоизомеров, которые являются зеркальными изображениями, не налагающимися друг на друга. Смесь двух энантиомеров состава 1:1 называется "рацемической" смесью. Этот термин используется для обозначения рацемической смеси, если это является подходящим. "Диастереоизомеры" являются стереоизомерами, которые содержат не менее двух асимметрических атомов, но которые не являются зеркальными изображениями друг друга. Абсолютную стереохимическую конфигурацию описывают с помощью R-S системы Кана-Ингольда-Прелога. Если соединение является чистым энантиомером, то стереохимическую конфигурацию каждого хирального атома углерода можно описать, как R илиS. Разделенные соединения, абсолютная конфигурация которых не установлена, можно описать с помощью символов (+) или (-) в зависимости от направления, в котором они вращают плоскость поляризации света при длине волны линии D натрия (право- и левовращающие). Некоторые соединения, описанные в настоящем изобретении, содержат один или большее количество асимметрических центров и поэтому могут образовывать энантиомеры, диастереоизомеры и другие стереоизомерные формы, абсолютную стереохимическую конфигурацию которых можно обозначить как (R)- или (S)-. При использовании в настоящем изобретении термин "фармацевтически приемлемый носитель" включает любой и все растворители, диспергирующие среды, покрытия, поверхностно-активные вещества, антиоксиданты, консерванты (например, бактерицидные агенты, фунгицидные агенты), изотонические агенты, агенты, задерживающие всасывание, соли, консерванты, лекарственные средства, стабилизаторы лекарственных средств, связующие, инертные наполнители, разрыхлители, смазывающие агенты,подсластители, ароматизаторы, красители, аналогичные материалы и их комбинации, как это должно быть известно специалистам в данной области техники (см., например, публикацию Remington'с Pharmaceutical Sciences, 18th Ed. Mack Printing Company, 1990, pp. 1289-1329). За исключением случаев, когда обычный носитель несовместим с активным ингредиентом, подразумевается его использование в терапевтических или фармацевтических композициях. При использовании в настоящем изобретении термин "предупреждение" любого конкретного заболевания или нарушения означает введение субъекту соединения, предлагаемого в настоящем изобретении, до того, как станут выраженными симптомы заболевания или нарушения. При использовании в настоящем изобретении термины "соль" или "соли" означает соль присоединения с кислотой соединения, предлагаемого в настоящем изобретении. "Соли", в частности, включают"фармацевтически приемлемые соли". Термин "фармацевтически приемлемые соли" означает соли, которые сохраняют биологическую эффективность и характеристики соединений, предлагаемых в настоящем изобретении, и которые обычно не являются нежелательными в биологическом или ином отношении. При использовании в настоящем изобретении термин "субъект" означает животное. Обычно животным является млекопитающее. Субъект также означает, например, приматов (например, людей, мужчин или женщин), коров, овец, коз, лошадей, собак, кошек, кроликов, крыс, мышей, рыб, птиц и т.п. В некоторых вариантах осуществления субъектом является примат. В других вариантах осуществления субъектом является человек. При использовании в настоящем изобретении субъект "нуждается в" лечении, если лечение окажет на такой субъект благоприятное биологическое или медицинское воздействие или улучшит качество его жизни. Термин "терапевтически эффективное количество" соединения, предлагаемого в настоящем изобретении, означает количество соединения, предлагаемого в настоящем изобретении, которое приводит к биологической или медицинской реакции субъекта, например уменьшению или ингибированию активности фермента или белка, или смягчению симптомов, ослаблению патологических состояний, замедлению или задержке прогрессирования, или предупреждению заболевания и т.п. В одном неограничивающем варианте осуществления термин "терапевтически эффективное количество" означает количество соединения, предлагаемого в настоящем изобретении, которое при введении субъекту эффективно для(1) по меньшей мере, частичного ослабления, подавления, предупреждения и/или облегчения протекания патологического состояния или нарушения или заболевания, (i) опосредуемого mTOR, или (ii) связанного с активностью mTOR, или (iii) характеризующегося активностью (нормальной или аномальной)mTOR; или (2) уменьшения или ингибирования активности mTOR. В другом неограничивающем варианте осуществления термин "терапевтически эффективное количество" означает количество соединения,предлагаемого в настоящем изобретении, которое при введении в клетку, или ткань, или в неклеточное биологическое вещество или среду эффективно для, по меньшей мере, частичного уменьшения или ингибирования активности mTOR. Значение термина "терапевтически эффективное количество", как показано в приведенных выше вариантах осуществления, для mTOR также применимо в таком же смысле к другим соответствующим белкам/пептидам/ферментам, таким как PI3Ks класса IV. При использовании в настоящем изобретении термин "лечить", "лечение" любого заболевания или нарушения в одном варианте осуществления означает улучшение протекания заболевания или нарушения (т.е. ослабление развития или остановку заболевания или по меньшей мере одного из его клинических симптомов). В другом варианте осуществления "лечить", "лечение" означает изменение протекания заболевания или нарушения, физическое (например, стабилизацию проявляющегося симптома) или физиологическое (например, стабилизацию физикального параметра), или и то, и другое. Подробное описание изобретения Настоящее изобретение относится к соединениям и его фармацевтическим составам, которые можно использовать для лечения или предупреждения заболеваний, патологических состояний и/или нарушений, модулируемых ингибированием mTOR. Вариант осуществления 1: соединение формулы (I) или его фармацевтически приемлемая соль,описанное выше в настоящем изобретении. Вариант осуществления 2: соединение формулы (I) или его фармацевтически приемлемая сольR18, в каждом случае независимо, означает фтор или метил;R19 и R20 независимо означает водород или фтор;R и R6 вместе образуют метиленовый мостик; или R3 и R8 вместе образуют этиленовый мостик; или R5 иR6 вместе образуют этиленовый мостик;R10, R11, R12, R13, R14, R15, R16 и R17, в каждом случае независимо, означает водород, C1-C3-алкил,фтор-С 1-С 3-алкил или гидрокси-С 1-С 3-алкил; или R11 и R16 вместе образуют этиленовый мостик; или R13 и R14 вместе образуют этиленовый мостик; или R14 и R15 вместе с атомом углерода, к которому они присоединены, связаны с образованием тетрагидропиранильного кольца; иR23 означает гидроксигруппу или фтор-С 1-С 3-алкил; или R23 и R13 вместе с атомами углерода, к которым они присоединены, связаны с образованием конденсированного тетрагидрофуранильного кольца;R24 и R25 независимо означает водород или галоген; или R24 и R25 вместе с атомом углерода, к которому они присоединены, связаны с образованием тетрагидропиранильного кольца; иR26 означает C1-C3-алкил или оксетанил. Вариант осуществления 3: соединение варианта осуществления 1 или варианта осуществления 2 или его фармацевтически приемлемая соль,где R1 означает Вариант осуществления 4: соединение варианта осуществления 3 или его фармацевтически приемлемая соль, где m равно 0. Вариант осуществления 5: соединение варианта осуществления 1 или варианта осуществления 2 или его фармацевтически приемлемая соль,где R1 означает Вариант осуществления 6: соединение варианта осуществления 5 или его фармацевтически приемлемая соль, где R19 и R20 оба означают водород. Вариант осуществления 7: соединение варианта осуществления 1 или варианта осуществления 2 или его фармацевтически приемлемая соль,где R1 означает Вариант осуществления 8: соединение варианта осуществления 7 или его фармацевтически приемлемая соль, где q равно 0 или 1 и r равно 0, 1 или 2. Вариант осуществления 9: соединение, соответствующее любому из вариантов осуществления 1-8 или его фармацевтически приемлемая соль, где R2, R3, R4, R5, R6, R7, R8 и R9 независимо означает водород или метил; или R3 и R6 вместе образуют метиленовый мостик; или R3 и R8 вместе образуют этиленовый мостик; или R5 и R6 вместе образуют этиленовый мостик. Вариант осуществления 10: соединение, соответствующее любому из вариантов осуществления 1-9 или его фармацевтически приемлемая соль, где Y означает О. Вариант осуществления 11: соединение, соответствующее любому из вариантов осуществления 1-9 или его фармацевтически приемлемая соль, в котором Y означает CHR23 или CR24R25. Вариант осуществления 12: соединение или его фармацевтически приемлемая соль варианта осуществления 1, которое выбрано из группы, состоящей из и их фармацевтически приемлемых солей. Вариант осуществления 12: соединение или его фармацевтически приемлемая соль варианта осуществления 1, которое выбрано из группы, состоящей из и их фармацевтически приемлемых солей. Например, вследствие наличия одного или более чем одного асимметрического атома углерода, который может содержаться в соединении формулы (I), соответствующее соединение формулы (I) может находиться в чистой оптически активной форме или в форме смеси оптических изомеров, например в форме рацемической смеси. Все такие оптически чистые изомеры и их смеси, включая рацемические смеси, являются частью настоящего изобретения. В зависимости от выбора исходных веществ и методик соединения в зависимости от количества асимметрических атомов углерода могут содержаться в виде одного из возможных изомеров или их смесей, например в виде чистых оптических изомеров или в виде смесей изомеров, таких как рацематы и смеси диастереоизомеров. В объем настоящего изобретения входят все такие возможные изомеры, включая рацемические смеси, смеси диастереоизомеров и оптически чистые формы. Оптически активные (R)и (S)-изомеры можно получить с помощью хиральных синтонов или хиральных реагентов или выделить по обычным методикам. Если соединение содержит двойную связь, то заместители могут находиться в Е- или Z-конфигурации. Если соединение представляет собой дизамещенный циклоалкил, то заместители циклоалкила могут находиться в цис- или транс-конфигурации. Если соединение, содержащее один или большее количество хиральных центров, изображено в настоящем изобретении с указанием стереохимической конфигурации в изображенной структуре, то рассматривается индивидуальный оптический изомер. Если соединение, содержащее один или большее количество хиральных центров, изображено в настоящем изобретении без указания стереохимической конфигурации в изображенной структуре, то не рассматривается какой-либо конкретный оптический изомер и изображенная химическая структура может представлять собой любой оптический изомер или смесь изомеров, обладающих такой структурой,- 11023935 например, рацемическую смесь или смесь диастереоизомеров. Один вариант осуществления относится к соединению примеров в виде изолированного стереоизомера, в котором соединение обладает одним стереоцентром и стереоизомер находится в конфигурации R. Один вариант осуществления относится к соединению примеров в виде изолированного стереоизомера, в котором соединение обладает одним стереоцентром и стереоизомер находится в конфигурации S. Один вариант осуществления относится к соединению примеров в виде изолированного стереоизомера, в котором соединение обладает двумя стереоцентрами и стереоизомер находится в конфигурацииR R. Один вариант осуществления относится к соединению примеров в виде изолированного стереоизомера, в котором соединение обладает двумя стереоцентрами и стереоизомер находится в конфигурацииR S. Один вариант осуществления относится к соединению примеров в виде изолированного стереоизомера, в котором соединение обладает двумя стереоцентрами и стереоизомер находится в конфигурации S R. Один вариант осуществления относится к соединению примеров в виде изолированного стереоизомера, в котором соединение обладает двумя стереоцентрами и стереоизомер находится в конфигурации S S. Один вариант осуществления относится к соединению примеров, в котором соединение обладает одним или двумя стереоцентрами, в виде рацемической смеси. Кроме того, промежуточные продукты и соединения, предлагаемые в настоящем изобретении, могут существовать в разных таутомерных формах и все такие формы входят в объем настоящего изобретения. Термин "таутомер" или "таутомерная форма" означает структурные изомеры, обладающие различными энергиями, которые превращаются друг в друга вследствие низкого энергетического барьера. Например, протонные таутомеры (также известные, как прототропные таутомеры) включают таутомеры,превращающиеся друг в друга вследствие переноса протона, такие как изомеры кетон-енол и иминенамин. Конкретным примером протонного таутомера является имидазольный фрагмент, в котором протон может перемещаться между двумя кольцевыми атомами азота. Валентные таутомеры включают таутомеры, превращающиеся друг в друга вследствие перегруппировки некоторых связывающих электронов. Соединения, предлагаемые в настоящем изобретении, могут быть способны образовывать соли с кислотами вследствие наличия аминогрупп или сходных с ними групп. В одном варианте осуществления настоящее изобретение относится к соединению формулы (I), определенному в настоящем изобретении, в свободной форме. В другом варианте осуществления настоящее изобретение относится к соединению формулы (I), определенному в настоящем изобретении, в форме соли. В другом варианте осуществления настоящее изобретение относится к соединению формулы (I),определенному в настоящем изобретении, в форме соли присоединения с кислотой. В другом варианте осуществления настоящее изобретение относится к соединению формулы (I), определенному в настоящем изобретении, в форме фармацевтически приемлемой соли. В еще одном варианте осуществления настоящее изобретение относится к соединению формулы (I), определенному в настоящем изобретении,в форме фармацевтически приемлемой соли присоединения с кислотой. В еще одном варианте осуществления настоящее изобретение относится к любому из соединений примеров в свободной форме. В еще одном варианте осуществления настоящее изобретение относится к любому из соединений примеров в форме соли. В еще одном варианте осуществления настоящее изобретение относится к любому из соединений примеров в форме соли присоединения с кислотой. В еще одном варианте осуществления настоящее изобретение относится к любому из соединений примеров в форме фармацевтически приемлемой соли. В еще одном варианте осуществления настоящее изобретение относится к любому из соединений примеров в форме фармацевтически приемлемой соли присоединения с кислотой. Фармацевтически приемлемые соли присоединения с кислотами можно образовать с неорганическими кислотами и с органическими кислотами, например ацетат, аспартат, бензоат, безилат, бромид/гидробромид, бикарбонат/карбонат, бисульфат/сульфат, камфорсульфонат, хлорид/гидрохлорид,хлортеофиллонат, цитрат, этандисульфонат, фумарат, глюцептат, глюконат, глюкуронат, гиппурат, гидройодид/йодид, изетионат, лактат, лактобионат, лаурилсульфат, малат, малеат, малонат, манделат, мезилат, метилсульфат, нафтоат, напзилат, никотинат, нитрат, октадеканоат, олеат, оксалат, пальмитат, памоат, фосфат/гидрофосфат/дигидрофосфат, полигалактуронат, пропионат, стеарат, сукцинат, сульфосалицилат, тартрат, тозилат и трифторацетат. Неорганические кислоты, из которых можно образовать соли, включают, например, хлористоводородную кислоту, бромисто-водородную кислоту, серную кислоту, азотную кислоту, фосфорную кислоту и т.п. Органические кислоты, из которых можно образовать соли, включают, например, уксусную кислоту, пропионовую кислоту, гликолевую кислоту, щавелевую кислоту, малеиновую кислоту, малоновую кислоту, янтарную кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, бензойную кислоту, миндальную кислоту, метансульфоновую кислоту, этансульфоновую кислоту, толуолсульфоновую кислоту, салициловую кислоту и т.п. Фармацевтически приемлемые соли, предлагаемые в настоящем изобретении, можно синтезировать из кислотного фрагмента по обычным химическим методикам. Обычно такие соли можно получить по реакции форм свободных оснований этих соединений со стехиометрическим количеством соответствующей кислоты. Такие реакции обычно проводят в воде или в органическом растворителе или в их смеси. Обычно, если это возможно, предпочтительными являются неводные среды, такие как эфир, этилацетат, этанол, изопропанол или ацетонитрил. Перечни дополнительных подходящих солей приведены, например, в публикациях "Remington'с Pharmaceutical Sciences", 20th ed., Mack Publishing Company, Easton,Pa., (1985); и "Handbook of Pharmaceutical Salts: Properties, Selection, and Use" by Stahl and Wermuth(Wiley-VCH, Weinheim, Germany, 2002). Кроме того, соединения, предлагаемые в настоящем изобретении, включая их соли, также можно получить в форме их гидратов или в форме, включающей другие растворители, использованные для кристаллизации. Соединения, предлагаемые в настоящем изобретении, могут сами по себе или в ходе специально проводимых реакций образовывать сольваты с фармацевтически приемлемыми растворителями(включая воду); поэтому подразумевается, что в объем настоящего изобретения входят сольватированные и несольватированные формы. Термин "сольват" означает молекулярный комплекс соединения,предлагаемого в настоящем изобретении (включая его фармацевтически приемлемые соли) с одной или большим количеством молекул растворителя. Такими молекулами являются молекулы таких растворителей, которые обычно используют в области фармацевтики и которые не оказывают вредного воздействия на реципиента, например вода, этанол и т.п. Термин "гидрат" означает комплекс, в котором молекулой растворителя является молекула воды. Соединения, предлагаемые в настоящем изобретении, т.е. соединения формулы (I), которые содержат группы, способные выступать в качестве доноров и/или акцепторов водородных связей, могут образовывать совместные кристаллы с подходящими веществами, образующими совместные кристаллы. Эти совместные кристаллы можно получить из соединений формулы (I) по известным методикам совместной кристаллизации. Такие методики включают измельчение, нагревание, совместную возгонку, совместное плавление или взаимодействие в растворе соединения формулы (I) с веществами, образующими совместные кристаллы, при условиях кристаллизации с выделением образовавшихся таким образом совместных кристаллов. Подходящие вещества, образующие совместные кристаллы, включают описанные в WO 2004/078163. Следовательно, настоящее изобретение также относится к совместным кристаллам, включающим соединение формулы (I). Соединения, предлагаемые в настоящем изобретении, включая их соли, гидраты и сольваты, по своей природе или полученной структуре могут образовывать полиморфные формы. Любая формула, приведенная в настоящем изобретении, также характеризует немеченые формы, а также изотопно-меченые формы соединений. Изотопно-меченые соединения обладают структурами,описывающимися формулами, приведенными в настоящем изобретении, за исключением того, что один или большее количество атомов заменены на атомы, обладающими указанными атомными массами или массовыми числами. Примеры изотопов, которые можно вводить в соединения, предлагаемые в настоящем изобретении, включают изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора и хлора, такие как 2 Н, 3 Н, 11 С, 13 С, 14 С, 15N, 18F 31P, 32P, 35S, 36Cl, 125I соответственно. В объем настоящего изобретения входят различные изотопно-меченые соединения, предлагаемые в настоящем изобретении, например, в которые включены радиоактивные изотопы, такие как 3 Н и 14 С, или такие, в которых содержатся нерадиоактивные изотопы, такие как 2 Н и 13 С. Такие изотопно-меченые соединения применимы для изучения метаболизма (предпочтительно содержащие 14 С), кинетики реакций (содержащие, например, 2 Н или 3 Н), в методологиях детектирования и визуализации, таких как позитронная эмиссионная томография (ПЭТ) или однофотонная эмиссионная компьютерная томография (ОФЭКТ), включая исследование распределения лекарственного средства или субстрата в тканях или лучевую терапию пациентов. В частности, содержащее 18F или меченое им соединение может быть особенно предпочтительным для исследований с помощью ПЭТ или ОФЭКТ. Изотопно-меченые соединения формулы (I) обычно можно получить по методикам, известным специалистам в данной области техники, или по методикам,аналогичным описанным в приведенных примерах и синтезах с использованием подходящих изотопномеченых реагентов вместо использованного ранее немеченого реагента. Кроме того, замещение более тяжелыми изотопами, предпочтительно дейтерием (т.е. 2 Н или D),может обеспечить некоторые терапевтические преимущества, обусловленные их более высокой метаболической стабильностью, например увеличенной длительностью полувыведения in vivo или возможностью использования меньших доз или улучшением терапевтического индекса. Следует понимать, что в этом контексте дейтерий рассматривается в качестве заместителя в соединении формулы (I). Концентрацию такого более тяжелого изотопа, в частности дейтерия, можно определить с помощью коэффициента изотопного обогащения. Термин "коэффициент изотопного обогащения" при использовании в настоящем изобретении означает отношение содержания изотопа к содержанию конкретного изотопа в природе. Если заместитель в соединении, предлагаемом в настоящем изобретении, означает дейтерий, то такое соединение характеризуется коэффициентом изотопного обогащения для каждого обозначенного атома дейтерия, равным не менее 3500 (содержание дейтерия для каждого обозначенного атома дейтерия равно 52,5%), не менее 4000 (содержание дейтерия равно 60%), не менее 4500 (содержание дейтерия равно 67,5%), не менее 5000 (содержание дейтерия равно 75%), не менее 5500 (содержание дейтерия равно 82,5%), не менее 6000 (содержание дейтерия равно 90%), не менее 6333,3 (содержание дейтерия равно 95%), не менее 6466,7 (содержание дейтерия равно 97%), не менее 6600 (содержание дейтерия равно 99%) или не менее 6633,3 (содержание дейтерия равно 99,5%). Фармацевтически приемлемые сольваты, предлагаемые в настоящем изобретении, включают такие,в которых растворитель, использованный для кристаллизации, может быть изотопно замещенным, например, D2O, d6-ацетон, d6-ДМСО. Соединения, предлагаемые в настоящем изобретении, можно синтезировать путями, которые включают методики, аналогичные хорошо известным в химической науке, в частности, с учетом описания,приведенного в настоящем изобретении. Исходные вещества обычно можно приобрести у таких фирм,как Sigma-Aldrich или или легко получить по методикам, хорошо известным специалистам в данной области техники (например, получить по методикам, описанным в публикациях Louis F. Fieser and Maryorganischen Chemie, 4, Aufl. ed. Springer-Verlag, Berlin, включая дополнения (также доступные в виде баз данных Beilstein в интернете. Другим объектом настоящего изобретения является способ получения соединения формулы (I) в свободной форме или в форме фармацевтически приемлемой соли, включающий(а) реакцию соединения формулы (II) в которой Y, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, R16, R17, n и p являются такими, как определено для формулы (I), с соединением формулы (III), (IV) или (V) в которой R1 является таким, как определено для формулы (I), или(b) реакцию соединения формулы (VI) в которой R1, R2, R3, R4, R5, R6, R7, R8 и R9 являются такими, как определено для формулы (I), и Hal означает галоген, например хлор, с соединением формулы (VII) в которой Y, R10, R11, R12, R13, R14, R15, R16, R17, n и p являются такими, как определено для формулы (I), и(с) необязательно восстановление, окисление или другую функционализацию полученного соединения,(d) отщепление любой содержащейся защитной группы (групп),(е) выделение полученного таким образом соединения формулы (I) в свободной форме или в форме фармацевтически приемлемой соли,(f) необязательное разделение смесей оптически активных изомеров на их отдельные оптически активные изомерные формы. Реакции можно провести по обычным методикам. Например, реакцию описанную на стадии (а) выше, можно провести в присутствии подходящего содержащего металл катализатора, напримерPd(PPh3)4 или PdCl2(dppf), необязательно подходящего основания, например фторида цезия, подходящего растворителя, например толуола или NEt3, смеси ацетонитрил/вода, и при подходящей температуре, например, равной от 90 до 150 С. Реакцию описанную на стадии (b) выше, можно провести в присутствии подходящего основания,например ДИПЭА, подходящего растворителя, например 1-бутанола, и при подходящей температуре,например, равной от 70 до 90 С. Другое необязательное восстановление, окисление или другую функционализацию соединений формулы (I) можно провести по методикам, известным специалистам в данной области техники. В объеме настоящего описания только легко удаляемая группа, которая не является компонентом конкретного искомого конечного соединения, предлагаемого в настоящем изобретении, называется "защитной группой", если в контексте не указано иное. Защита функциональных групп такими защитными группами, сами защитные группы и реакции их отщепления описаны, например, в стандартных справочниках, таких как, например, J.F.W. McOmie, "Protective Groups in Organic Chemistry", Plenum Press, London and New York 1973, в Т.W. Greene and P.G.M. Wuts, "Protective Groups in Organic Synthesis", ThirdBeach, and Basel 1982. Особенностью защитных групп является то, что их можно удалить легко (т.е. без протекания нежелательных вторичных реакций), например, путем сольволиза, восстановления, фотолиза или, альтернативно, при физиологических условиях (например, путем ферментативного отщепления). Соли соединений, предлагаемых в настоящем изобретении, содержащие по меньшей мере одну солеобразующую группу, можно получить по методикам, известным специалистам в данной области техники. Например, соли присоединения с кислотами соединений, предлагаемых в настоящем изобретении,получают обычным образом, например путем обработки соединений кислотой или подходящим ионообменным реагентом. Соли можно превратить в свободные соединения по методикам, известным специалистам в данной области техники. Соли присоединения с кислотами, например, можно превратить путем обработки подходящим основным реагентом. Любые полученные смеси изомеров на основе использования различий физико-химических характеристик компонентов можно разделить на чистые или в основном чистые геометрические или оптические изомеры, диастереоизомеры, рацематы, например, с помощью хроматографии и/или фракционной кристаллизации. В тех соединениях, в которых имеется асимметрический атом углерода, соединение существует в виде отдельных оптически активных изомерных форм или в виде их смесей, например в виде рацемических смесей или смесей диастереоизомеров. Смеси диастереоизомеров можно разделить на отдельные диастереоизомеры на основании различий в физических и химических характеристиках по методикам,известным специалистам в данной области техники, например, с помощью хроматографии и/или фракционной кристаллизации. Энантиомеры можно разделить путем превращения смеси энантиомеров в смесь диастереоизомеров путем реакции с подходящим оптически активным соединением (например,хиральным вспомогательным веществом, таким как хиральный спирт или хлорангидрид кислоты Мошера), разделения диастереоизомеров и превращения (например, путем гидролиза) отдельных диастереоизомеров в соответствующие чистые энантиомеры. Энантиомеры также можно разделить на имеющейся в продаже хиральной колонке с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ). В объем настоящего изобретения также входит любой вариант способов, предлагаемых в настоящем изобретении, в которых компоненты реакции используют в форме их солей или оптически чистого вещества. Соединения, предлагаемые в настоящем изобретении, и промежуточные продукты также можно превратить друг в друга по методикам, обычно известным специалистам в данной области техники. Для иллюстративных целей на схемах реакций, представленных ниже, приведены возможные пути синтеза соединений, предлагаемых в настоящем изобретении, а также основных промежуточных продуктов. Более подробное описание отдельных стадий реакций приведено ниже в разделе "Примеры". Специалисты в данной области техники должны понимать, что для синтеза соединений, предлагаемых в настоящем изобретении, можно использовать другие методики синтеза. Хотя на схемах приведены и ниже обсуждены конкретные исходные вещества и реагенты, легко можно использовать другие исходные вещества и реагенты и/или условия проведения реакций и получить множество производных. Кроме того,многие соединения, полученные по описанным ниже методикам, можно дополнительно модифицировать с учетом настоящего раскрытия по обычным химическим методикам, хорошо известным специалистам в данной области техники. Схема 1. Общая методика 1 синтеза пуринов Обычно соединения формулы (I) можно получить в соответствии со схемой 1 в 4 стадии с использованием в качестве исходного вещества имеющегося в продаже соединения (VIII). Как и отдельные стадии, приведенные на представленной выше схеме, стадия 1 включает получение промежуточного продукта (X) путем замещения хлора нуклеофилом, таким как функционализированный морфолиновой группой промежуточный продукт (IX). Промежуточный продукт (XI) можно получить по реакции промежуточного продукта (X) с промежуточным продуктом (VII) в присутствии подходящего основания,такого как диизопропилэтиламин, растворителя, такого как диметилацетамид, и при нагревании. Стадия 3 включает бромирование промежуточного продукта (XI) с получением промежуточного продукта (II) бромом в подходящем растворителе, таком как дихлорметан. Искомые соединения формулы (I) можно получить путем сочетания промежуточного продукта (II) со множеством имеющихся в продаже или синтезированных бороновых кислот или их эфиров структуры (III) или (IV) или производными трибутилстаннила формулы (V) с использованием содержащих металл катализаторов, примерами которых чаще всего являются имеющиеся в продаже комплексы палладия. Схема 2. Общая методика 2 синтеза пуринов Обычно соединения формулы (I) можно получить в соответствии со схемой 2 в 4 стадии с использованием в качестве исходного вещества имеющегося в продаже соединения (VIII). Как и отдельные стадии, приведенные на представленной выше схеме, стадия 1 включает получение промежуточного продукта (X) путем замещения хлора нуклеофилом, таким как функционализированный морфолиновой группой промежуточный продукт формулы (IX). Промежуточный продукт (XII) можно получить бромированием промежуточного продукта (X) в присутствии подходящего растворителя, такого как дихлорметан. Стадия 3 включает сочетание промежуточного продукта (XII) с множеством имеющихся в продаже или синтезированных бороновых кислот или их эфиров структуры (III) или (IV) или производными трибутилстаннила формулы (V) с использованием содержащих металл катализаторов, примерами которых чаще всего являются имеющиеся в продаже комплексы палладия. Искомые соединения формулы (I) можно получить путем обработки промежуточного продукта (XIII) функционализированным морфолиновой группой промежуточным продуктом (VII) в присутствии подходящего основания, такого как диизопропилэтиламин, растворителя, такого как диметилацетамид, и с обычным нагреванием или нагреванием микроволновым излучением. Схема 3. Общая методика синтеза эфиров бороновой кислоты Эфиры бороновой кислоты формулы (IV) можно получить в соответствии со схемой 3 в одну стадию, где R1 является таким, как описано для формулы (I). Эта стадия включает реакцию замещенного арилбромида или гетероарилбромида формулы (XIV) с бис(пинаколято)дибором в присутствии имеющегося в продаже палладиевого катализатора, растворителя, такого как диоксан, и при температуре в диапа- 17023935 зоне от 80 до 120 С. В объем настоящего изобретения также входит любой вариант предлагаемых способов, в котором компоненты реакции используют в форме их солей или оптически чистого вещества. Соединения, предлагаемые в настоящем изобретении, и промежуточные продукты также можно превратить друг в друга по методикам, обычно известным специалистам в данной области техники. Соединения формулы (I), в свободной форме или в форме фармацевтически приемлемой соли, ниже в настоящем изобретении часто называющиеся "средствами, предлагаемыми в настоящем изобретении",по данным исследований in vitro обладают ценными фармакологическими характеристиками и поэтому могут использоваться в лекарственных средствах, для лечения или в качестве химикатов для исследований, например, в качестве небольших молекул для научных исследований. Средства, предлагаемые в настоящем изобретении, являются ингибиторами mTOR. Ингибирующую активность соединения, предлагаемого в настоящем изобретении, по отношению к mTOR можно изучить с помощью исследований, описанных ниже в настоящем изобретении. Биологические исследования Исследование 1: исследование связывания mTOR ATP на основе TR-FRET для рекомбинантного(исходные растворы 10 мМ) в 90% ДМСО и по 50 нл переносят в лунки 384-луночных планшетов для анализа (белые, изготовленные из полистирола, небольшого объема; Matrix/Thermo Scientific Cat. No. 4365). 2. Конечный объем для исследования равнялся 10 мкл и порядок прибавления был следующим: 50 нл разведения соединений; 5 мкл смеси GST-mTOR и конъюгированных с европием антител к GST с прибавлением или без прибавления ингибитора PI3K/mTOR PI-103 (3-(4-(4-морфолинил)пиридо[3',2':4,5]фуро[3,2-д]пиримидин-2-ил)фенол, Calbiochem); 5 мкл радиоактивного индикатора-314. Инкубируют в течение 60 мин при комнатной температуре. Измерения с помощью TR-FRET проводят в считывающем устройстве Biotek Synergy2 при следующих условиях: возбуждение при 340 нм/испускание при 665 нм,возбуждение при 340 нм/испускание при 620 нм. Буфер для анализа содержит 50 мМ HEPES рН 7,5, 5 мМ MgCl2, 1 мМ EGTA, 0,01% Pluromc F-127. Радиоактивный индикатор-314 (Alexa Fluor 647-меченый АТР-конкурентный ингибитор киназы; Cat.No. PV6087), конъюгированные с европием антитела к GST (Cat. No PV5594) и меченый на N-конце с помощью GST процессированный mTOR (FRAP1) человека (Cat. No PV4754) выпускаются фирмой Invitrogen. Используют следующие конечные концентрации: 3 нМ GST-mTOR; 1 нМ конъюгированных с европием антител к GST; 10 мкМ PI-103 и 10 нМ радиоактивный индикатор-314. Конечные концентрации разведенных соединений равнялись 9091; 2730; 910; 273; 91; 27; 9 и 3 нМ. Конечная концентрация ДМСО равнялась 0,45%. Используют следующие контроли: интенсивный сигнал: растворитель для разбавления, GST-mTOR, антитела Eu-анти-GST, радиоактивный индикатор-314; слабый сигнал : растворитель для разбавления, GST-mTOR, антитела Eu-анти-GST, PI-103, радиоактивный индикатор-314. 3. Определения IC50 можно провести следующим образом. Необработанный сигнал при 340/665 нм делят на необработанный сигнал при 340/620 нм и получают отношение интенсивностей испускания. Отношение интенсивностей испускания преобразуют в выраженное в процентах ингибирование для каждой концентрации соединения. Значения IC50 рассчитывают путем аппроксимации данных для зависимости от концентрации соединения сигмоидальной зависимостью доза-ответ. Все аппроксимации и анализы проводили с помощью программы XLfit4 (ID Business Solutions, Guildford, UK). Исследование 2: исследование mTOR с использованием клеток. Исследование с использованием клеток (в 384-луночных планшетах) разработано для определения влияния соединения на активность клеточной киназы mTOR в клетках MEFs (фибробласты мышиных эмбрионов), взятых у мышей, лишенных TSC1 (туберозно-склерозный комплекс 1), активного супрессора активности киназы mTOR. Вследствие отсутствия TSC1 киназа mTOR конститутивно активирована,что приводит к постоянно усиленному фосфорилированию Thr 389 в S6 киназе 1 (S6K1), которая являет- 18023935 ся одной из находящихся в прямом направлении мишеней mTOR (Kwiatkowski D.J., Zhang H., BanduraJ.L. et al. (2002)] A mouse model of TSC1 reveals sex-dependent lethality from liver hemangiomas, и upregulation of p70S6 kinase activity in TSC null cells. Hum.Mol.Gen. 11: 525-534). День 0. Высевание клеток; субконфлюэнтные TSC1-/- MEFs выращивают в среде DMEM с большим содержанием глюкозы, к которой добавлены 10% инактивированной нагреванием FCS и 2% Hepes. В этих клетках mTOR является конститутивно активным, что приводит к постоянно усиленному фосфорилированию киназы p7 0S6. Клетки собирают с помощью трипсинизации, повторно суспендируют в среде для выращивания, подсчитывают и устанавливают концентрацию, равную 133333 клеток/мл. С помощью прибора Multidrop (Thermo scientific) в каждую лунку 384-луночного планшета добавляют 30 мкл, что дает 4000 клеток/лунка. Планшеты инкубируют при 37 С/5% CO2 в течение 20 ч (для обеспечения осаждения и адгезии к поверхности). День 1. Обработка соединениями: восемь 3-кратных серийных разведений исследуемых соединений (начиная с 1,8 мМ) готовят в 90% ДМСО и помещают в 384-луночные эталонные планшеты (Greiner). Ингибитор pan-pPI3K/mTOR (0,8 мМ 8-(6-метоксипиридин-3-ил)-3-метил-1-(4-пиперазин-1-ил-3-трифторметилфенил)-1,3-дигидроимидазо[4,5-с]хинолин-2-она в 90% ДМСО) добавляют в лунки и получают нижние контрольные образцы. 90% ДМСО добавляют в лунки и получают верхние контрольные образцы. Соединения получают в виде порций по 250 нл (Hummingbird) в 384-луночных полипропиленовых микропланшетах (планшеты с соединениями). В планшеты с соединением с помощью Multidrop добавляют 50 мкл среды для выращивания (разведение 1:200). После встряхивания (1 мин при 2000 об/мин) с помощью устройства для пипетирования Matrix Plate Mate 23 10 мкл первого разведения переносят в планшет с клетками (конечное разведение 1:4). После обработки в течение 1 ч среду удаляют из планшета и с помощью Multidrop в каждую лунку добавляют 20 мкл литического буфера Surefire. Исследование с использованием Surefire: лизаты клеток замораживают в течение 15 мин, размораживают при встряхивании и переносят в экспериментальный 384-луночный планшет Proxiplate (5 мкл/лунка) для исследования с помощью P-P70S6K (Т 389) Surefire (Perkin Elmer TGR70S50). Первая смесь содержит буфер для проведения реакции (содержащий специфические антитела), активирующий буфер и акцепторные гранулы (40, 10 и 1 об. соответственно). По 5 мкл/лунка добавляют к лизатам вZephyr SPE Workstation (Caliper Life Sciences) и инкубируют в течение 2 ч при встряхивании при комнатной температуре. После этого периода инкубации в планшет с помощью того же прибора добавляют вторую смесь, содержащую буфер для разведения и донорные гранулы (20 и 1 об. соответственно) (2 мкл/лунка). Через 2 ч планшеты можно считывать с помощью считывающего устройства Envision Multilabel (Perkin Elmer). Поскольку гранулы чувствительны к свету, их перенос и инкубирование проводят в темном помещении (освещение зеленым светом). День 2. Анализ данных: необработанные данные используют для построения зависимостей доза-ответ для исследуемых соединений и по ним рассчитывают значения IC50. Исследование 3: исследование аутофагии. Аутофагия является катаболическим путем, на котором разрушается объемный цитозоль в лизосомальных компартментах, что позволяет восстанавливать аминокислоты и жирные кислоты. Одним из ключевых регуляторов аутофагии является мишень рапамицина (mTOR) у млекопитающих, консервативная серин/треонинкиназа, которая подавляет инициирование аутофагического процесса, когда имеются питательные вещества, факторы роста и энергия. Для количественного описания индукции аутофагии ингибиторами mTOR мы используем репортер mCherry-GFP-LC3, который подходит для ретровирусной доставки в клетки млекопитающих, стабильной экспрессии и анализу с помощью флуоресцентной микроскопии. Репортер mCherry-GFP-LC3. Аминокислотная последовательность для конструкции mCherry-GFP-LC3 приведена ниже (SEQ IDNO: 1). Последовательность mCherry подчеркнута, последовательность GFP указана полужирным шрифтом и последовательность LC3A приведена в рамке. Ниже в настоящем изобретении описан протокол и алгоритм распознавания изображения для визуальзации и определения изменений пути аутофагии. Количественное исследование аутофагии с использованием анализа изображений высокой информационной емкости. 1. День 0. Помещение клеток в планшеты. Субконфлюэнтные клетки Н 4 mCherry-GFP-LC3 собирают с помощью трипсинизации, повторно суспендируют в среде для выращивания и подсчитывают (клетки Н 4: линия клеток нейроглиомы человека (АТСС. Готовят суспензию клеток, содержащую 66000 клеток/мл, и с помощью электронной многоканальной пипетки 30 мкл добавляют в лунки 384-луночного планшета. Получают планшеты, содержащие 2000 клеток/лунка. Планшеты с клетками несколько раз переворачивают и выдерживают при 37 С и 5% CO2. 2. День 1. Обработка соединениями. Дозы соединений для определения ответа готовят в ДМСО. Затем дозы для определения ответа разводят в среде в соотношении 1:50. 10 мкл разведенных соединений добавляют к 30 мкл клеток и получают конечное разведение 1:200 исходного соединения и конечную концентрацию 0,5% ДМСО. Обработку соединениями проводят трижды. 384-Луночные планшеты выдерживают при 37 С и 5% CO2. Обработку соединениями проводят в течение 16-18 ч (см. примечание 1). 3. День 2. Фиксирование клеток. Клетки фиксируют путем добавления 10 мкл/лунка 5 концентрированного фиксатора Mirsky с добавлением 25 мкг/мл Hoechst33342. Это дает полный объем, равный 50 мкл/лунка, и 1 концентрацию фиксатора Mirsky и 5 мкг/мл Hoechst33342. 384-Луночный планшет несколько раз переворачивают и инкубируют в течение 1 ч при комнатной температуре. Затем клетки промывают с помощью устройства для промывки 384-луночного планшета по методике, включающей отсасывание до установления объема, равного 10 мкл/лунка, и последующее введение 100 мкл/лунка 1X TBS. Стадии и отсасывания и введения повторяют 4 раза и оставляют конечный объем, равный 100 мкл/лунка. Планшет герметизируют липкой фольгой для PCR. 4. Визуализация. Дно планшета очищают 70% этанолом и затем визуализируют с помощью автоматизированного эпифлуоресцентного микроскопа InCell 1000. Используют увеличение 20 и для каждой лунки визуализируют 4 разных участка (области), для этого обычно необходимо всего исследовать около 400 клеток/лунка. Изображения Hoechst33342 получают с возбуждением при 360 нм (фильтр D36040x),с испусканием при 460 нМ (фильтр HQ46040M) и при экспозиции длительностью 150 мс. ИзображенияHQ53550M) и при экспозиции длительностью 1 с. Изображения mCherry получают с возбуждением при 535 нм (фильтр HQ535 50 х), с испусканием при 620 нМ (фильтр HQ620 60 М) и при экспозиции длительностью 1 с. Для всех изображений используют зеркало с полосой пропускания с четырехкратным фильтром. 5. Анализ изображений. Для анализа изображений с использованием многоцелевого алгоритма используют программное обеспечение InCell Analysis. Во-первых, ядро изображения детектируют в изображении Hoechst33342 с использованием сегментации по максимумам и минимального размера ядра,равного 50 мкм 2. Клетки определяют с использованием кольца 10 мкм вокруг ядра. Во-вторых, небольшие участки (органеллы) идентифицируют в изображении mCherry внутри клеток с использованием многократной сегментации по максимумам. В третьих, маску ядра mCherry переносят на изображениеGFP. В четвертых, измеряют интенсивность флуоресценции GFP внутри маски ядра mCherry (эталонная интенсивность). 6. Параметр "органелл" характеризует положительные по mCherry ядра репортера mCherry-GFPLC3 и их используют для расчета количества LC3 ядер в клетке. Для этого рассчитывают количество органелл в клетке и усредняют по всем клеткам в данной лунке (среднее в пересчете на лунку). Строят зависимость количеств положительных по mCherry ядер (ось у) от значений ответов на дозу соединения(ось х) и для каждого соединения рассчитывают значения EC50. Значения ЕС 50 характеризуют активность соединения с точки зрения активации аутофагии (например, увеличения количества положительных поmCherry ядер). Примечания. 1. Модулирование аутофагии и перераспределение mCherry-GFP-LC3 можно наблюдать уже после обработки соединением в течение 3-4 ч. Однако более значительные эффекты видны после обработки в течение 16-18 ч. Соединения примеров, изученные с помощью описанных выше исследований, характеризуются значениями, приведенными ниже в табл. 1. Таблица 1 НО = не определено; НИ = не поддается измерению Как показывают результаты исследований, описанных выше в настоящем изобретении, соединения,предлагаемые в настоящем изобретении, могут быть применимы для лечения заболеваний, патологических состояний и нарушений, модулируемых ингибированием фермента mTOR; следовательно, соедине- 21023935 ния, предлагаемые в настоящем изобретении (включая использующиеся композиции и способы), можно использовать для приготовления лекарственного средства для применений в терапии, описанных в настоящем изобретении. Следовательно, другим вариантом осуществления настоящего изобретения является фармацевтическая композиция, содержащая соединение, предлагаемое в настоящем изобретении,или его фармацевтически приемлемую соль и фармацевтически приемлемый инертный наполнитель,разбавитель или носитель. Типичный состав получают смешиванием соединения, предлагаемого в настоящем изобретении, и носителя, разбавителя или инертного наполнителя. Подходящие носители, разбавители и инертные наполнители хорошо известны специалистам в данной области техники и включают такие материалы, как углеводы, воски, растворимые и/или набухающие в воде полимеры, гидрофильные или гидрофобные материалы, желатин, масла, растворители, воду и т.п. То, какой конкретный носитель, разбавитель или инертный наполнитель используют, зависит от путей и назначения применения соединения, предлагаемого в настоящем изобретении. Растворители для введения млекопитающему обычно выбирают из числа растворителей, известных специалистам в данной области техники, как безопасные. Обычно безопасными растворителями являются нетоксичные водные растворители, такие как вода, и другие нетоксичные растворители, которые растворимы в воде или смешиваются с водой. Подходящие водные растворители включают воду, этанол, пропиленгликоль, полиэтиленгликоли (например, PEG400, PEG300) и т.п. и их смеси. Составы также могут включать один или большее количество буферов, стабилизирующих агентов, поверхностно-активных веществ, смачивающих агентов, смазывающих агентов, эмульгаторов, суспендирующих агентов, консервантов, антиоксидантов, замутняющих агентов, агентов, придающих скользкость, технологических добавок, красителей, подсластителей, отдушек, вкусовых агентов и других известных добавок, что обеспечивает превосходный внешний вид лекарственного состава (т.е. соединения, предлагаемого в настоящем изобретении, или содержащей его фармацевтической композиции) или облегчает приготовление фармацевтического продукта (т.е. лекарственного средства). Составы можно приготовить по обычным методикам растворения и смешивания. Например, объемное лекарственное вещество (т.е. соединение, предлагаемое в настоящем изобретении, или стабилизированную форму соединения (например, комплекс с производным циклодекстрина или другим известным комплексообразующим агентом растворяют в подходящем растворителе в присутствии одного или большего количества инертных наполнителей. Соединение, предлагаемое в настоящем изобретении,обычно готовят в виде фармацевтических дозированных форм для обеспечения легкоконтролируемой дозировки лекарственного средства для предоставления пациенту обладающего превосходным внешним видом и удобного в использовании продукта. Фармацевтическую композицию (или состав), предназначенную для использования, в зависимости от методики, использующейся для введения лекарственного средства, можно упаковать по-разному. Обычно продукт, предназначенный для распространения, включает контейнер, содержащий помещенный в него фармацевтический состав в соответствующей форме. Подходящие контейнеры хорошо известны специалистам в данной области техники и включают такие материалы, как флаконы (пластмассовые и стеклянные), пакеты, ампулы, пластмассовые мешки, металлические цилиндры и т.п. Контейнер также может включать защищающее от неумелого обращения устройство, предназначенное для предупреждения непреднамеренного доступа к содержимому упаковки. Кроме того, на контейнер нанесена этикетка, на которой описано содержимое контейнера. На этикетке также могут находиться соответствующие предупреждающие сообщения. В одном варианте осуществления настоящее изобретение относится к лечению клеточных пролиферативных заболеваний, таких как опухоль и/или рост раковых клеток, опосредуемые с помощьюmTOR. Заболевания могут представлять собой включающие сверхэкспрессирование или амплификациюPI3K, Rheb, соматические мутации PIK3CA или гаметические мутации или соматические мутацииPTEN, TSC1, TSC2, или мутации и транслокацию р 85, которые служат для повышающей регуляции комплекса p85-p110. В частности, соединения применимы для лечения раковых заболеваний человека или животного (например, мышей), таких как, например, саркома легких, бронхов, предстательной железы, молочной железы (включая спорадические раковые заболевания молочной железы и болезнь Коудена), поджелудочной железы, желудочно-кишечный рак, толстой кишки, прямой кишки, карцинома толстой кишки, колоректальная аденома, щитовидной железы, печени, внутрипеченочного желчного протока, гепатоцеллюлярный, надпочечников, желудка, желудочно-кишечного тракта, глиома, глиобластома,эндометрия, меланома, почек, почечных лоханок, мочевого пузыря, тела матки, шейки матки, влагалища,яичников, множественная миелома, пищевода, лейкоз, острый миелолейкоз, хронический миелолейкоз,лимфолейкоз, миелолейкоз, головного мозга, карцинома головного мозга, полости рта и глотки, гортани,тонкой кишки, неходжкинская лимфома, меланома, ворсинчатая аденома толстой кишки, неоплазия, неоплазия эпителиального характера, лимфомы, карцинома молочной железы, базально-клеточная карцинома, плоскоклеточная карцинома, старческий кератоз, опухолевые заболевания, включая солидные опухоли, опухоль головы или шеи, истинная полицитемия, эссенциальная тромбоцитемия, миелофиброз с миелоидной метаплазией и болезни Вальденстрема. В других вариантах осуществления патологическое состояние или нарушение выбрано из группы,состоящей из истинной полицитемии, эссенциальной тромбоцитемии, миелофиброза с миелоидной метаплазией, астмы, ХОЗЛ (хроническое обструктивное заболевание легких), ОРДС (острый респираторный дистресс синдром), синдрома Леффлера, эозинофильной пневмонии, заражения паразитами (в частности, многоклеточными) (включая тропическую эозинофилию), бронхолегочного аспергиллеза, нодозного полиартериита (включая синдром Черджа-Штросса), эозинофильной гранулемы, связанных с эозинофилами нарушений, влияющих на дыхательные пути, вызванных реакцией на лекарственное средство,псориаза, контактного дерматита, атопического дерматита, гнездной алопеции, полиморфной эритемы,герпетиформного дерматита, склеродермии, витилиго, аллергического васкулита, крапивницы, буллезного пемфигоида, красной волчанки, обыкновенной пузырчатки, приобретенного буллезного эпидермолиза, аутоиммунных заболеваний крови (например, гемолитическая анемия, апластическая анемия, истинная эритроцитарная анемия и идиопатическая тромбоцитопения), системной красной волчанки, полихондрии, склеродермии, гранулематоза Вегенера, дерматомиозита, хронического активного гепатита, злокачественной миастении, синдрома Стивенса Джонсона, идиопатической спру, аутоиммунной воспалительной болезни кишечника (например, язвенный колит и болезнь Крона), эндокринной офтальмопатии,болезни Грейвса, саркоидоза, альвеолита, хронического гиперчувствительного пневмонита, рассеянного склероза, первичного билиарного цирроза, увеита (переднего и заднего), интерстициального фиброза легких, псориатического артрита, гломерулонефрита, сердечно-сосудистых заболеваний, атеросклероза,гипертензии, тромбоза глубоких вен, удара, инфаркта миокарда, нестабильной стенокардии, тромбоэмболии, легочной эмболии, тромболитических заболеваний, острой артериальной ишемии, тромботических окклюзий периферийных сосудов и заболевания коронарной артерии, реперфузионных поражений,ретинопатии, такой как диабетическая ретинопатия или вызванная кислородом гипербарическая ретинопатия и патологических состояний, характеризующихся повышенным внутриглазным давлением или секрецией внутриглазной жидкости, такие как глаукома. Дополнительные синдромы с установленной или возможной молекулярной связью с нарушением регуляции активности киназы mTOR описаны, например, в публикациях "K. Inoki et al.; Disregulation ofPI3K/Akt pathway for cancer drug discovery, Nature Reviews, vol. 4, 988-1004" и являются следующими: отторжение трансплантата органа или ткани, например, при лечении реципиентов трансплантатов,например сердца, легких, объединенных сердца-легких, печени, почек, поджелудочной железы, кожи или роговицы; реакция "трансплантант против хозяина", такая как после трансплантации костного мозга; рестеноз; туберозный склероз; лимфангиолейомиоматоз; пигментозный ретинит и другие дегенеративные нарушения сетчатки; аутоиммунные заболевания, включая энцефаломиелит, инсулинозависимый сахарный диабет, волчанку, дерматомиозит, артрит и ревматические заболевания; стойкий к стероидам острый лимфобластный лейкоз; фиброзные заболевания, включая склеродермию, фиброз легких, фиброз почек, муковисцидоз; легочная гипертензия; иммуномодуляция; рассеянный склероз; синдром фон Хиппеля-Линдау; комплекс Карни; семейный аденоматозный полипоз; синдром юношеского полипоза; синдром Берта-Хогга-Дьюка; семейная гипертрофическая кардиомиопатия; синдром Вольфа-Паркинсона-Уайта; нейродегенеративные нарушения, такие как болезнь Паркинсона, болезнь Гентингтона, болезнь Альцгеймера и слабоумие, вызванное мутациями tau, спинально-церебеллярная атаксия типа 3, боковой амиотрофический склероз, вызванный мутациями SOD1, неврональный цероид-липофусциноз/болезнь Баттена (нейродегенеративное заболевание у детей); офтальмологические заболевания, такие как мокрая и сухая дегенерация желтого пятна, увеит,включая аутоиммунный увеит, ретинопатия, такая как диабетическая ретинопатия или вызванная кислородом гипербарическая ретинопатия, и глаукома; мышечная слабость (атрофия, кахексия) и миопатии, такие как болезнь Данона; бактериальные и вирусные инфекции, включая М. tuberculosis, стрептококк группы А, вирус герпеса типа I, инфекция ВИЧ (вирус иммунодефицита человека); нейрофиброматоз, включая нейрофиброматоз типа 1, и синдром Пейтца-Егерса, болезнь Коудена. Показано, что соединения, обладающие ингибирующей активностью по отношению к mTORC1,полезны для иммуномодуляции и лечения пролиферативных заболеваний, таких как запущенная почечноклеточная карцинома или туберозный склероз (TSC), нарушения, связанные с мутацией зародышевой линии. Для указанных выше случаев применения необходимая доза, разумеется, меняется в зависимости от пути введения, конкретного подвергающегося лечению патологического состояния и необходимого эффекта. Обычно указывают, что удовлетворительные результаты наблюдаются при системном введении в суточных дозах, составляющих от примерно 0,03 до примерно 100,0 мг/(кг массы тела), например примерно 0,03 до примерно 10,0 мг/(кг массы тела). Показанная суточная доза для более крупного млекопитающего, например человека, находится в диапазоне от примерно 0,5 мг до примерно 3 г, например от примерно 5 мг до примерно 1,5 г и ее обычно вводят, например, в виде разделенных доз до четырех раз в сутки или в форме пролонгированного действия. Подходящие для перорального введения разовые дозированные формы содержат от примерно 0,1 до примерно 500 мг, например от примерно 1,0 до примерно 500 мг активного ингредиента. Обычно соединения, предлагаемые в предпочтительных вариантах осуществления, вводят в виде фармацевтических композиций по любому из следующих путей: перорально, системно (например, чрескожно, назально или с помощью суппозитория) или парентерально (например, внутримышечно, внутривенно или подкожно). Предпочтительным путем введения является пероральный с использованием обычного суточного режима, который можно изменить в соответствии со степенью поражения. Композиции могут находиться в форме таблеток, пилюль, капсул, полужидких веществ, препаратов пролонгированного действия, растворов, суспензий, эликсиров, аэрозолей или любых других подходящих композиций. Другим предпочтительным путем введения соединений, предлагаемых в предпочтительных вариантах осуществления, является ингаляция. Она является эффективной методикой доставки терапевтического средства непосредственно в дыхательные пути. Следовательно, настоящее изобретение также относится к способу предупреждения или лечения патологических состояний, нарушений или заболеваний,опосредуемых активацией PI3K (например, киназы PI3) и/или ферментов mTOR, например, таких как указанные выше, у субъекта, нуждающегося в таком лечении, способ включает введение указанному субъекту эффективного количества соединения, предлагаемого в настоящем изобретении, или его фармацевтически приемлемой соли. Один вариант осуществления относится к способу предупреждения или лечения рака, нейродегенеративного нарушения или офтальмологического заболевания, у субъекта, нуждающегося в таком лечении, способ включает введение указанному субъекту эффективного количества соединения, предлагаемого в настоящем изобретении, или его фармацевтически приемлемой соли. В другом варианте осуществления нейродегенеративным нарушением является болезнь Паркинсона, Гентингтона или болезнь Альцгеймера. В еще одном варианте осуществления нейродегенеративным нарушением является болезнь Гентингтона; соединению, предлагаемому в настоящем изобретении, или его фармацевтически приемлемой соли для применения в качестве лекарственного средства, например, для любого из патологических состояний, нарушений или заболеваний, указанных в настоящем изобретении, в частности для применения для одного или большего количества заболеваний, опосредуемых фосфатидилинозит-3-киназой. Один вариант осуществления относится к соединению, предлагаемому в настоящем изобретении, или его фармацевтически приемлемой соли для применения для лечения или предупреждения рака, нейродегенеративного нарушения или офтальмологического заболевания. В другом варианте осуществления нейродегенеративным нарушением является болезнь Паркинсона, Гентингтона или болезнь Альцгеймера. В еще одном варианте осуществления нейродегенеративным нарушением является болезнь Гентингтона; применению соединения, предлагаемого в настоящем изобретении, или его фармацевтически приемлемой соли в качестве активного фармацевтического ингредиента в лекарственном средстве, например, для лечения или предупреждения любого из патологических состояний, нарушений или заболеваний, указанных в настоящем изобретении, предпочтительно для лечения или предупреждения одного или большего количества заболеваний, опосредуемых фосфатидилинозит-3-киназой. Один вариант осуществления относится к применению соединения, предлагаемого в настоящем изобретении, или его фармацевтически приемлемой соли в качестве активного фармацевтического ингредиента в лекарственном средстве для лечения или предупреждения рака, нейродегенеративного нарушения или офтальмологического заболевания. В другом варианте осуществления нейродегенеративным нарушением является болезнь Паркинсона, Гентингтона или болезнь Альцгеймера. В еще одном варианте осуществления нейродегенеративным нарушением является болезнь Гентингтона; применению соединения, предлагаемого в настоящем изобретении, или его фармацевтически приемлемой соли для приготовления лекарственного средства для лечения или предупреждения одного или большего количества заболеваний, опосредуемых фосфатидилинозит-3-киназой. Один вариант осуществления относится к применению соединения, предлагаемого в настоящем изобретении, или его фармацевтически приемлемой соли для приготовления лекарственного средства для лечения или предупреждения рака, нейродегенеративного нарушения или офтальмологического заболевания. В другом варианте осуществления нейродегенеративным нарушением является болезнь Паркинсона, Гентингтона или болезнь Альцгеймера. В еще одном варианте осуществления нейродегенеративным нарушением является болезнь Гентингтона. Средство, предлагаемое в настоящем изобретении, можно вводить в виде единственного активного фармацевтического ингредиента или в виде комбинации по меньшей мере с одним другим активным фармацевтическим ингредиентом, эффективным, например, для лечения или предупреждения рака или нейродегенеративного нарушения. Такая фармацевтическая комбинация может представлять собой разовую дозированную форму и эта разовая дозированная форма может содержать заранее заданное количество каждого по меньшей мере из двух активных компонентов вместе по меньшей мере с одним фармацевтически приемлемым инертным наполнителем, разбавителем или носителем. Альтернативно, фармацевтическая комбинация может представлять собой упаковку, содержащую эти по меньшей мере два активных компонента по отдельности, например упаковку или дозирующее устройство, применимое для одновременного или раздельного введения по меньшей мере двух активных компонентов, в котором эти средства расположены по отдельности. Другим объектом настоящего изобретения являются такие фармацевтические комбинации. Поэтому другим объектом настоящего изобретения является комбинированный продукт, содержащий средство, предлагаемое в настоящем изобретении, или его фармацевтически приемлемую соль и другое терапевтическое средство. В одном варианте осуществления комбинированным продуктом является фармацевтическая композиция, содержащая средство, предлагаемое в настоящем изобретении, или его фармацевтически приемлемую соль и другое терапевтическое средство и фармацевтически приемлемый инертный наполнитель,разбавитель или носитель. В одном варианте осуществления комбинированным продуктом является набор, включающий две или большее количество отдельных фармацевтических композиций, по меньшей мере одна из которых содержит средство, предлагаемое в настоящем изобретении. В одном варианте осуществления набор включает средства для раздельного хранения указанных композиций, такие как контейнер, разделенный флакон или разделенный пакет из фольги. Примером такого набора является блистерная упаковка, которую обычно используют для упаковки таблеток, капсул и т.п. Набор, предлагаемый в настоящем изобретении, можно использовать для введения разных дозированных форм, например, перорально и парентерально, для введения отдельных композиций с разными интервалами или для предохранения отдельных композиций друг от друга. Чтобы содействовать соблюдению пациентом режима лечения, набор, предлагаемый в настоящем изобретении, обычно содержит указания по введению. Вследствие их ингибирующей активности по отношению к mTOR, соединения, предлагаемые в настоящем изобретении, по отдельности или в комбинации, могут быть применимы для лечения рака. Поэтому в одном варианте осуществления настоящее изобретение относится к соединению, предлагаемому в настоящем изобретении, или его фармацевтически приемлемой соли в комбинации с другим терапевтическим средством, где другое терапевтическое средство выбрано из группы противораковых средств,указанных ниже.(a) Ингибиторы киназы: например ингибиторы киназ рецептора эпидермального фактора роста(EGFR), такие как малые молекулы хиналозины, включая гефитиниб (US 5457105, US 5616582 и US 5770599), ZD-6474 (WO 01/32651), эрлотиниб (тарцева, US 5747498 и WO 96/30347) и лапатиниб (US 6727256 и WO 02/02552); ингибиторы киназ рецептора сосудистого эндотелиального фактора роста,включая SU-11248 (WO 01/60814), SU 5416 (US 5883113 и WO 99/61422), SU 6668 (US 5883113 и WO 99/61422), CHIR-258 (US 6605617 и US 6774237), ваталаниб или PTK-787 (US 6258812), VEGF-Trap (WO 02/57423), В 43-генистеин (WO-09606116), фенретинид (п-гидроксифениламиноретиноевая кислота) (US 4323581), IM-862 (WO 02/62826), бевацизумаб или авастин (WO 94/10202), KRN-951, 3-[5(метилсульфонилпиперидинметил)индолил]хинолон,AG-13736 и[1,2,4]триазины, ZK-304709, веглин, VMDA-3601, EG-004, СЕР-701 (US 5621100), Cand5 (WO 04/09769); ингибиторы тирозинкиназы Erb2, такие как пертузумаб (WO 01/00245), трастузумаб и ритуксимаб; ингибиторы Akt протеинкиназы, такие как RX-0201, ингибиторы протеинкиназы С (PKC), такие как LY-317615 (WO 95/17182) и перифосин (US 2003171303), ингибиторы киназы Raf/Map/MEK/Ras,включая сорафениб (BAY 43-9006), ARQ-350RP, LErafAON, BMS-354825 AMG-548 и другие, раскрытые в WO 03/82272; ингибиторы киназы рецептора фактора роста фибробластов (FGFR), ингибиторы клеточно-зависимой киназы (CDK), включая CYC-202 или росковитин (WO 97/20842 и WO 99/02162); ингибиторы киназ рецептора тромбоцитарного фактора роста (PDGFR), такие как CHIR-258, 3G3 mAb, AG13736, SU-11248 и SU6668; и ингибиторы киназы Bcr-Abl и белков слияния, такие как STI-571 или глеевек (иматиниб).(b) Антиэстрогены: такие как селективные модуляторы эстрогенного рецептора (SERMs), включая тамоксифен, торемифен, ралоксифен, ингибиторы ароматазы, включая аримидекс или анастрозол; негативные регуляторы эстрогенного рецептора (ERDs), включая фазлодекс или фулвестрант.(d) Другие ингибиторы: такие как ингибиторы протеинфарнезилтрансферазы, включая типифарниб или R-115777 (US 2003134846 и WO 97/21701), BMS-214662, AZD-3409 и FTI-277; ингибиторы топоизомеразы, включая мербарон и дифломотекан (BN-80915); ингибиторы митотических кинезиновых белков веретена (KSP), включая SB-743921 и MKI-833; модуляторы протеосомы, такие как бортезомиб или велкаде (US 5780454), XL-784; и ингибиторы циклооксигеназы 2 (СОХ-2), включая нестероидные противовоспалительные лекарственные средства I (NSAIDs).(е) Химиотерапевтические противораковые лекарственные средства: такие как анастрозол (аримидекс), бикалутамид (касодекс), блеомицина сульфат (бленоксан), бусульфан (милеран), бусульфан для инъекций (бусульфекс), капецитабин (кселода), N4-пентоксикарбонил-5-дезокси-5-фторцитидин,карбоплатин (параплатин), кармустин (BiCNU), хлорамбуцил (лейкеран), цисплатин (платинол),кладрибин (лейстатин), циклофосфамид (цитоксан или неосар), цитарабин, цитозинарабинозид (цитосар-U), липосомный цитарабин для инъекций (DepoCyt), дакарбазин (DTIC-Dome), дактиномицин (актиномицин D, космеган), даунорубицингидрохлорид (церубидин), липосомный даунорубицинцитрат для инъекций (дауноксом), дексаметазон, доцетаксел (таксотер), даунорубицингидрохлорид(иттрий-/МХ-DTPA), пентостатин, полифепросан 20 с имплантатом кармустина (глиадел), тамоксифенцитрат (нолвадекс), тенипозид (вумон), 6-тиогуанин, тиотепа, тирапазамин (тиразон), топотекангидрохлорид для инъекций (гикамптин), винбластин (велбан), винкристин (онковин) и винорелбин (навелбин).(телцита); темозоломид; трабектедин (US 5478932); АР-5280 (композиция цисплатина на основе платината); порфиромицин; и клеаразид (меклоретамин).(g) Хелатные средства: такие как тетратиомолибдат (WO 01/60814); RP-697; химерик Т 84.66(h) Модификаторы биологического ответа: такие как иммунномодуляторы, включая стауроспорин и его макроциклические аналоги, включая UCN-01, СЕР-701 и мидостаурин (см. WO 02/30941, WO 97/07081, WO 89/07105, US 5,621,100, WO 93/07153, WO 01/04125, WO 02/30941, WO 93/08809, WO 94/06799, WO 00/27422, WO 96/13506 и WO 88/07045); скваламин (WO 01/79255); DA-9601 (WO 98/04541 и US 6025387); алемтузумаб; интерфероны (например, IFN-, IFN- и т.п.); интерлейкины,предпочтительно IL-2 или алдеслейкин, а также IL-1, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11,IL-12 и их активные биологические варианты, содержащие аминокислотные последовательности, составляющие более 70% от нативной последовательности человека, алтретамин (гексален); SU 101 или лефлуномид (WO 04/06834 и US 6331555), имидазохинолины, такие как ресихимод и имихимод (US 4689338, 5389640, 5268376, 4929624, 5266575, 5352784, 5494916, 5482936, 5346905, 5395937, 5238944 и 5525612); и SMIPs, включая бензазолы, антрахиноны, тиосемикарбазоны и триптантрины (WO 04/87153,WO 04/64759 и WO 04/60308).GM-CSF и вакцины на основе моноцитогенов Listeria.GTI-2501 (WO 98/05769); капсулированные в липосомах антисмысловые олигодезоксинуклеотиды c-Raf(LErafAON) (WO 98/43095); и Sirna-027 (основанные на иммунной РНК лекарственные средства, воздействующие на VEGFR-1 мРНК). Таким образом, в другом варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:i) соединение, предлагаемое в настоящем изобретении, или его фармацевтически приемлемую соль, иii) по меньшей мере одно соединение, выбранное из группы, включающей:(a) ингибиторы киназы,(b) антиэстрогены,(c) антиандрогены,(e) химиотерапевтические противораковые лекарственные средства,(f) алкилирующие средства,(g) хелатные агенты,(h) модификаторы биологического ответа, иiii) один или большее количество фармацевтически приемлемых инертных наполнителей, разбавителей или носителей. В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей соединение, предлагаемое в настоящем изобретении, или его фармацевтически приемлемую соль и эверолимус (Афинитор). Вследствие их ингибирующей активности по отношению к mTOR соединения, предлагаемые в настоящем изобретении, по отдельности или в комбинации, могут быть применимы для лечения нейродегенеративных нарушений. Поэтому в одном варианте осуществления настоящее изобретение относится к соединению, предлагаемому в настоящем изобретении, или его фармацевтически приемлемой соли в комбинации с другим терапевтическим средством, где другое терапевтическое средство выбирают из(a) ингибиторов ацетилхолинэстеразы, таких как донепезил (арицепт), ривастигмин (экселон) и галантамин (разадин);(b) антагонистов глутамата, таких как мемантин (наменда);(c) антидепрессантных медикаментов, предназначенных для лечения плохого настроения и раздражительности, таких как циталопрам (целекса), флуоксетин (прозак), пароксеин (паксил), сертралин(d) анксиолитиков для лечения тревоги, беспокойства, вербально агрессивного поведения и резистентности, таких как лоразепам (ативан) и оксазепам (серакс);(е) антипсихотических препаратов, предназначенных для лечения галлюцинаций, бреда, агрессии,ажитации, враждебности и отсутствия сотрудничества, таких как арипипразол (абилифай), клозапин(f) стабилизаторов настроения, таких как карбамазепин (тегретол) и дивалпроекс (депакоте);(g) агонистов никотинового рецептора -7;(j) вакцины для амилоидной терапии. Таким образом, в другом варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей:i) соединение, предлагаемое в настоящем изобретении, или его фармацевтически приемлемую соль, иii) по меньшей мере одно соединение, выбранное из группы, включающей:(a) ингибиторы ацетилхолинэстеразы,(b) антагонисты глутамата,(c) антидепрессантные препараты,(d) анксиолитики,(е) антипсихотические препараты,(f) стабилизаторы настроения,(g) агонисты никотинового рецептора -7,(h) антагонисты mGluR5,(i) агонисты Н 3 иii) один или большее количество фармацевтически приемлемых инертных наполнителей, разбавителей или носителей. Таким образом, другими объектами настоящего изобретения являются фармацевтическая комбинация, например, для применения в любом из способов, описанных в настоящем изобретении, содержащая терапевтически эффективное количество соединения, предлагаемого в настоящем изобретении, или его фармацевтически приемлемой соли и другое терапевтическое средство для одновременного или последовательного введения,комбинированный продукт, содержащий соединение, предлагаемое в настоящем изобретении, или его фармацевтически приемлемую соль и другое терапевтическое средство,комбинированный продукт, содержащий соединение, предлагаемое в настоящем изобретении, или его фармацевтически приемлемую соль и другое терапевтическое средство в виде объединенного препарата для применения в терапии, например, для применения в любой терапии, описанной в настоящем изобретении. В одном варианте осуществления терапией является лечение или предупреждение рака или нейродегенеративного нарушения. В другом варианте осуществления терапией является лечение или предупреждение болезни Паркинсона, Гентингтона или болезни Альцгеймера. В еще одном варианте осуществления терапией является лечение или предупреждение болезни Гентингтона,фармацевтическая композиция, содержащая соединение, предлагаемое в настоящем изобретении,или его фармацевтически приемлемую соль и другое терапевтическое средство и фармацевтически приемлемый инертный наполнитель, разбавитель или носитель,способ, определенный выше, включающий совместное, например, одновременное или последовательное введение, терапевтически эффективного количества соединения, предлагаемого в настоящем изобретении, или его фармацевтически приемлемой соли и другое терапевтическое средство, например указанное выше,фармацевтическая комбинация, например, набор, включающий: а) первое средство, которым является соединение, предлагаемое в настоящем изобретении, раскрытое в настоящем изобретении, или его фармацевтически приемлемая соль и b) другое терапевтическое средство, например указанное выше; причем такой набор может содержать инструкции по его введению. Приведенные ниже примеры соединений, предлагаемых в настоящем изобретении, иллюстрируют настоящее изобретение. Методики получения таких соединений описаны ниже в настоящем изобретении. Примеры Аббревиатуры. Методики анализа. ЯМР: протонные спектры записывали на спектрометре Bruker Avance или спектрометре Varian Oxford 400, если не указано иное. Химические сдвиги приведены в м.д. относительно диметилсульфоксида( 2,50) или хлороформа ( 7,26). Небольшое количество сухого образца (2-5 мг) растворяли в подходящем дейтерированном растворителе (1 мл). ЖХ/МС: образец растворяли в подходящем растворителе, таком как MeCN, ДМСО или МеОН, и инжектировали прямо в колонку с помощью автоматического устройства для введения образцов. Анализ проводили по одной из следующих методик. Методика ЖХ-МС 1 Колонка: Acquity HSS Т 3, 1,8 мкм, 2,150 мм; Элюент: вода (+ 0,05% муравьиной кислоты + 3,75 мМ ацетата аммония):ацетонитрил (+ 0,04% муравьиной кислоты), от 98:2 до 2:98 за 1,4 мин, выдерживание при 98% в течение 0,75 мин; Скорость потока/температура: 1,2 мл/мин при 50 С. ЖХ-МС-методика 2 Колонка: Machery-Nagel Nucleosil 100-3 С 18 (704,6 мм); растворители/градиентный режим: А: 0,05% ТФК в воде; В: 0,05% ТФК в ацетонитриле; от 95% А/5% В до 5% А/95% В за 8 мин. Скорость потока/температура: 1,4 мл/мин при 45 С. Синтез промежуточных аминов. Промежуточные амины имеются в продаже или их можно получить, как это описано в литературе или аналогичным образом, или можно их получить, как описано ниже или аналогичным образом. Синтез промежуточных бициклических аминов. Бициклический амин 1: трет-бутиловый эфир 3-гидрокси-8-азабицикло[3.2.1]октан-8-карбоновой кислоты К раствору трет-бутилового эфира 3-оксо-8-азабицикло[3.2.1]октан-8-карбоновой кислоты (1,03 г,4,57 ммоль) в EtOH (20 мл) по каплям добавляли NaBH4. Смесь перемешивали в течение 4,5 ч при комнатной температуре в атмосфере азота, затем добавляли вторую порцию NaBH4 (0,36 г, 9,60 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 17,5 ч и последний раз добавлялиNaBH4 (0,36 г, 9,60 ммоль). Раствор перемешивали при комнатной температуре в течение 2 ч, затем добавляли насыщенный раствор хлорида аммония и водную фазу экстрагировали с помощью EtOAc. Объединенные органические фракции сушили над Na2SO4, фильтровали и концентрировали. Неочищенное вещество очищали с помощью флэш-хроматографии на силикагеле с использованием смеси циклогексан/EtOAc в качестве элюента и после выпаривания получали аксиальный и экваториальный изомеры (186 мг, 17,9%) и (205 мг, 19,7%) в виде белого твердого вещества. 1 Н ЯМР (600 МГц, CDCl3): 4,57 (д, 1 Н), 4,02 (м, 2 Н), 3,89 (д, 1 Нах), 1,89-1.71 (м, 5 Н), 1,65-1,54 (м,1 Н), 1,47- ,28 (м, 11 Н) и 4,60 (д, 1 Н), 3,99 (м, 2 Н), 3,91 (м, 1 Н), 2,18-2,03 (м, 2 Н), 1,92-1,72 (м, 4 Н), 1,671,56 (м, 2 Н), 1,39 (с, 9 Н). Бициклический амин 2: 8-азабицикло[3.2.1]октан-3-ол Раствор HCl (4 н. в диоксане,0,82 мл, 3,27 ммоль) добавляли к суспензии трет-бутилового эфира 3 гидрокси-8-азабицикло[3.2.1]октан-8-карбоновой кислоты в ацетонитриле. Смесь перемешивали при 70 С в течение 1 ч, охлаждали и концентрировали. Продукт (138 мг, 93%) выделяли в виде соли с хлористо-водородной кислотой. 1 Н ЯМР (600 МГц, CDCl3): 9,07-8,49 (м, 1 Н), 3,94 (м, 2 Н), 3,85 (м, 1 Н), 1,97-1,74 (м, 6 Н), 1,60 (т,2 Н). Аксиальный изомер (137 мг, 93%) получали таким же образом. 1 Н ЯМР (600 МГц, CDCl3): 9,01-8,44 (м, 1 Н), 3,89 (м, 3 Н), 2,29 (д, 2 Н), 2,07 (дт, 2 Н), 1,96-1,84 (м,2 Н), 1,83-1,71 (м, 2 Н). Синтез промежуточных индолов. Промежуточные индолы имеются в продаже или их можно получить, как это описано в литературе или аналогичным образом, или можно их получить, как описано ниже или аналогичным образом. Индол 1: 4-бром-6-метокси-1 Н-индол
МПК / Метки
МПК: C07D 519/00, C07D 473/16
Метки: производные, пурина, лечения, применение, заболевания
Код ссылки
<a href="https://eas.patents.su/30-23935-proizvodnye-purina-i-ih-primenenie-dlya-lecheniya-zabolevaniya.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пурина и их применение для лечения заболевания</a>
Предыдущий патент: Способ и реакторная система для получения богатого метаном продуктового газа
Следующий патент: Водные клеевые полимерные дисперсии с низкой вязкостью
Случайный патент: Гетеробициклические производные












