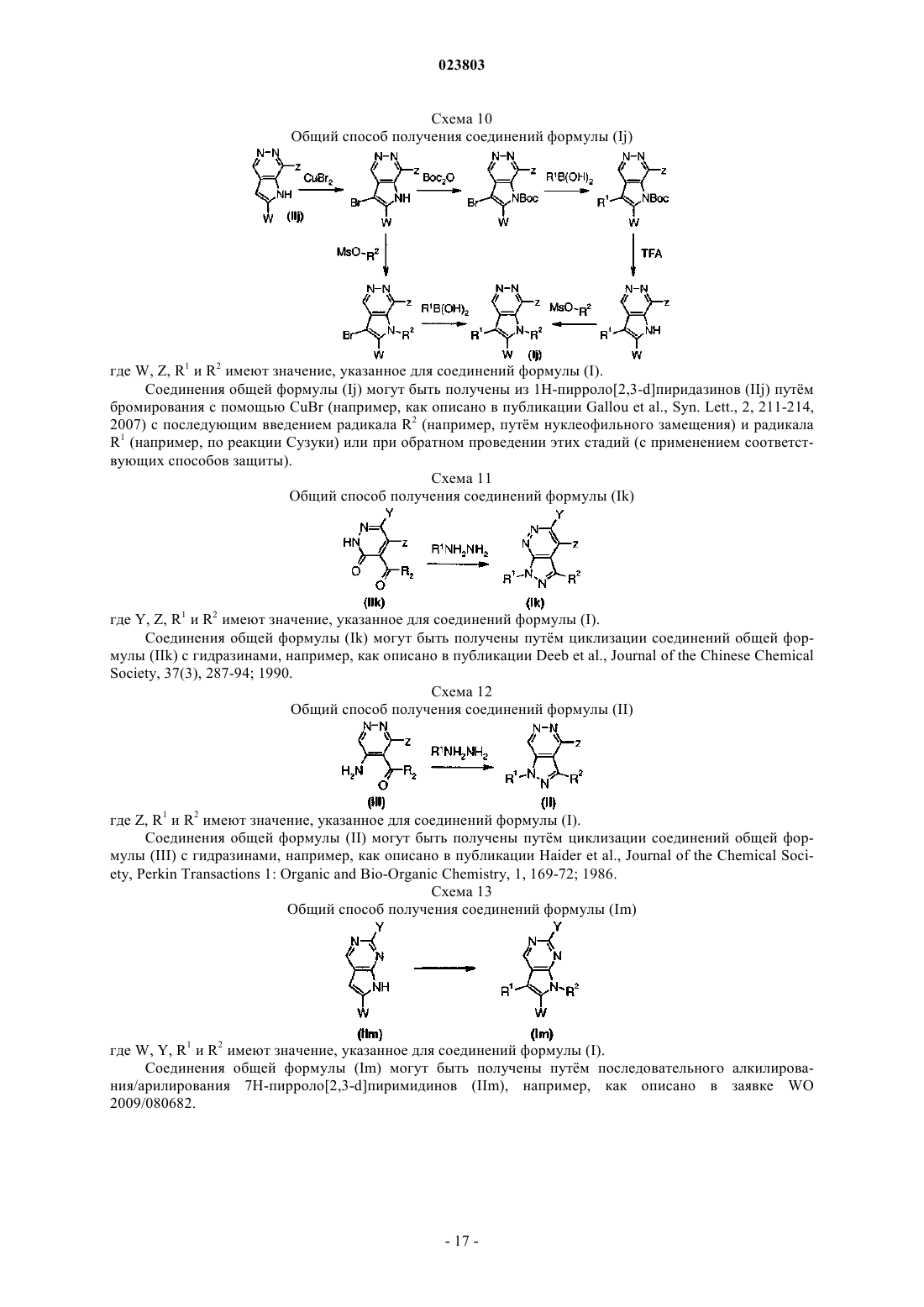
Ингибиторы ферментов
Формула / Реферат
1. Соединение формулы (I) или его фармацевтически приемлемая соль
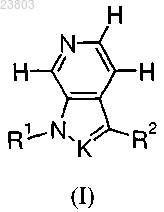
где K представляет собой -N= или -С(Н)=;
R1 обозначает фенил, необязательно замещенный одним или более заместителями, выбранными из галогена и C1-4-алкила;
R2 обозначает -Q-[R3]n или -NR6R11B, где R11B обозначает 5- или 6-членный гетероциклил-C1-4-алкил-;
где n = 1, 2, 3 или 4;
Q обозначает насыщенное или частично ненасыщенное моноциклическое 5- или 6-членное гетероциклическое кольцо или С5-6-циклоалкильное кольцо;
когда R2 обозначает -Q-[R3]n, R3 независимо выбран из 5- или 6-членного гетероциклила, 5- или 6-членного гетероциклил-C1-4-алкила, (5- или 6-членного гетероциклил-C1-4-алкил)амино-C1-4-алкила, амино-C1-4-алкокси-C1-4-алкила, (амино-C1-4-алкил)амино-C1-4-алкила, -C1-4-алкил-NR6C(O)OR5, -C1-4-алкил-NR6C(O)NR4AR4B, -C1-4-алкил-C(O)NR4AR4B, (5- или 6-членного гетероциклил-C1-4-алкил)-С(О)-, -C1-4-алкил-С(О)OR5, -OC(O)R5 или -C(O)NR9AR9B, где R9A и R9B вместе с атомом азота, к которому они присоединены, образуют 5- или 6-членную циклическую аминогруппу, замещенную одним или более заместителями, выбранными из C1-4-алкила, C1-4-алкокси-C1-4-алкила, C3-6-циклоалкила или -C(O)NR6R10B, где R10B обозначает 5- или 6-членный гетероциклил или 5- или 6-членный гетерциклил-С1-4-алкил или -C1-4-алкил-NR6C(O)R5; или
R4A, R4B и R5, каждый независимо, выбран из водорода, С1-4-алкила, 5- или 6-членного гетероциклил-С1-4-алкила, амино-С1-4-алкила, 5- или 6-членного гетероциклила, С3-6-циклоалкила или
R4A и R4B вместе с атомом азота, к которому они присоединены, образуют циклическую аминогруппу, выбранную из морфолина, пиперазина, пиперидина и пирролидина, любое из которых необязательно замещено одним или более заместителями, выбранными из С1-4-алкила, -NR4AR4B;
если иное не указано, 5- или 6-членные гетероциклильные кольца или гетероциклильная часть 5- или 6-членного гетероциклил-С1-4-алкила, (5- или 6-членного гетероциклил-С1-4-алкил)амино-С1-4-алкила или (5- или 6-членный гетероциклил-С1-4-алкил)-С(О)-группы необязательно замещены одним или более заместителями, выбранными из С1-4-алкила, -C(O)OR5, -C(O)R5, -C(O)NR4AR4B, -NR4AR4B, -C1-4-алкил-C(O)NR4AR4B или С1-4-алкокси-С1-4-алкила;
R6 независимо выбран из водорода или С1-4-алкила; и
где термин "гетероциклический" или "гетероциклильный" означает насыщенное или частично ненасыщенное моноциклическое кольцо, в котором одно или большее количество кольцевых атомов представляют собой азот или кислород;
при условии, что когда R2 обозначает -Q-[R3]n и R3 обозначает 5- или 6-членный гетероциклил, атом гетероциклического кольца, непосредственно связанный с Q, не является азотом,
и при условии, что соединение формулы (I) не является ни соединением
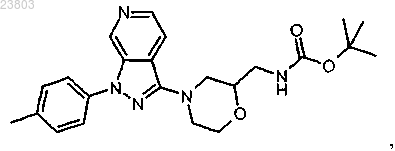
ни соединением

2. Соединение по п.1, где R2 обозначает
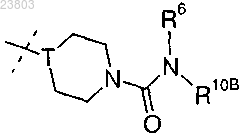
где Т обозначает N или СН
R6 обозначает водород или C1-4-алкил;
R10B обозначает 5- или 6-членный гетероциклил или 5- или 6-членный гетероциклил-C1-4-алкил, при этом любое из гетероциклических колец необязательно замещено одним или более заместителями, выбранными из C1-4-алкила и C1-4алкокси-C1-4алкила.
3. Соединение по п.1 или 2, где R2 обозначает
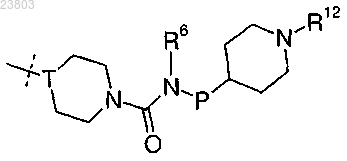
где Т обозначает N или СН;
Р обозначает простую связь или дирадикал, выбранный из метилена, этилена или пропилена;
R6 обозначает водород или C1-4-алкил;
R12 выбран из водорода, C1-4-алкила и C1-4алкокси-C1-4алкила.
4. Соединение по п.1 или 2, где R2 обозначает
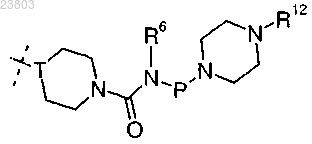
где Т обозначает N или СН;
Р обозначает дирадикал, выбранный из метилена, этилена или пропилена;
R6 обозначает водород или C1-4-алкил;
R12 выбран из водорода, C1-4-алкила и C1-4алкокси-C1-4алкила.
5. Соединение по п.1, где R2 обозначает
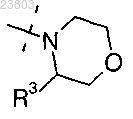
где R3 обозначает- C1-4-алкил-C(O)NR4AR4B,
где R4A и R4B, каждый независимо, выбран из водорода, C1-4-алкила и амино-C1-4-алкила, или
R4A и R4B вместе с атомом азота, к которому они присоединены, образуют циклическую аминогруппу, выбранную из морфолина, пиперазина, пиперидина и пирролидина, любое из которых необязательно замещено одним или более заместителями, выбранными из C1-4-алкила и -NR4AR4B.
6. Соединение, которое выбрано из
4-[1-(4-хлорфенил)-1Н-пирроло[2,3-с]пиридин-3-ил]-1-(пирролидин-3-ил)пиперидин;
4-[1-(4-хлорфенил)-1Н-пирроло[2,3-с]пиридин-3-ил]-1-(пиперидин-4-ил)пиперидин;
4-[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]-1-(пиперидин-4-илметил)пиперидин;
1-{4-[1-(4-хлорфенил)-1Н-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-ил}-2-(пиперидин-4-ил)этан-1-он;
1-({4-[1-(4-хлорфенил)-1Н-пирроло[2,3-с]пиридн-3-ил]пиперидин-1-ил}карбонил)-4-метилпиперазин;
4-[1-(4-хлорфенил)-1Н-пирроло[2,3-с]пиридин-3-ил]-N-(пиперидин-4-илметил)пиперидин-1-карбоксамид;
4-[1-(4-хлорфенил)-1Н-пирроло[2,3-с]пиридин-3-ил]-N-(пиперидин-4-ил)пиперидин-1-карбоксамид;
4-[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]-N-(1-метилпиперидин-4-ил)пиперидин-1-карбоксамид;
4-[1-(4-хлорфенил)-1Н-пирроло[2,3-с]пиридин-3-ил]-N-[1-(пропан-2-ил)пиперидин-4-ил]пиперидин-1-карбоксамид;
N-(1-ацетилпиперидин-4-ил)-4-[1-(4-хлорфенил)-1Н-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-карбоксамид;
4-[1-(4-хлорфенил)-1Н-пирроло[2,3-с]пиридин-3-ил]-N-[(1-метилпиперидин-4-ил)метил]пиперидин-1-карбоксамид;
4-[1-(4-хлорфенил)-1Н-пирроло[2,3-с]пиридин-3-ил]-N-[(1-этилпиперидин-4-ил)метил]пиперидин-1-карбоксамид;
4-[1-(4-хлорфенил)-1Н-пирроло[2,3-с]пиридин-3-ил]-N-метил-N-[(1-метилпиперидин-4-ил)метил] пиперидин-1-карбоксамид;
N-{[1-(карбамоилметил)пиперидин-4-ил]метил}-4-[1-(4-хлорфенил)-1Н-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-карбоксамид;
4-[1-(4-хлорфенил)-1Н-пирроло[2,3-с]пиридин-3-ил]-N-метил-N-{[(1-(пропан-2-ил)пиперидин-4-ил]метил}пиперидин-1-карбоксамид;
1-({4-[1-(4-хлорфенил)-1Н-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-ил}карбонил)-4-циклопропилпиперазин;
1-({4-[1-(4-хлорфенил)-1Н-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-ил}карбонил)-4-(пропан-2-ил)пиперазин;
1-({4-[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-ил}карбонил)-4-(2-метоксиэтил)пиперазин;
(3S)-1-({4-[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-ил}карбонил)-3-(пропан-2-ил)пиперазин;
4-[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]-N-(морфолин-2-илметил)пиперидин-1-карбоксамид;
4-[1-(4-хлорфенил)-1Н-пирроло[2,3-с]пиридин-3-ил]-N-[(1,4-диметилпиперазин-2-ил)метил]пиперидин-1-карбоксамид;
4-[1-(4-хлорфенил)-1Н-пирроло[2,3-с]пиридин-3-ил]-N-[2-(морфолин-4-ил)этил]пиперидин-1-карбоксамид;
4-[1-(4-хлорфенил)-1Н-пирроло[2,3-с]пиридин-3-ил]-N-[2-(пиперазин-1-ил)этил]пиперидин-1-карбоксамид;
4-[1-(4-хлорфенил)-1Н-пирроло[2,3-с]пиридин-3-ил]-N-[2-(1-метилпиперидин-4-ил)этил]пиперидин-1-карбоксамид;
4-[1-(4-хлорфенил)-1Н-пирроло[2,3-с]пиридин-3-ил]-N-[2-(4-метилпиперазин-1-ил)этил]пиперидин-1-карбоксамид;
4-[1-(4-хлорфенил)-1Н-пирроло[2,3-с]пиридин-3-ил]-N-[3-(морфолин-4-ил)пропил]пиперидин-1-карбоксамид;
4-[1-(4-хлорфенил)-1Н-пирроло[2,3-с]пиридин-3-ил]-N-{[1-(пропан-2-ил)пиперидин-4-ил]метил}пиперидин-1-карбоксамид;
4-[1-(4-хлорфенил)-1Н-пирроло[2,3-с]пиридин-3-ил]-N-{[1-(2-метоксиэтил)пиперидин-4-ил]метил}пиперидин-1-карбоксамид;
N-[3-({4-[1-(4-хлорфенил)-1Н-пирроло[2,3-с]пиридин-3-ил]пиперидин-1-ил}карбониламино)пропил]ацетамид;
пропан-2-ил N-({4-[1-(4-метилфенил)-1Н-пиразоло[3,4-с]пиридин-3-ил]морфолин-2-ил}метил)карбамат;
3-циклопропил-1-({4-[1-(4-метилфенил)-1Н-пиразоло[3,4-с]пиридин-3-ил]морфолин-2-ил}метил)мочевина;
2-({4-[1-(4-метилфенил)-1Н-пиразоло[3,4-с]пиридин-3-ил]морфолин-2-ил}метокси)этан-1-амин;
(2-аминоэтил)({4-[1-(4-метилфенил)-1H-пиразоло[3,4-с]пиридин-3-ил]морфолин-2-ил}метил)амин;
4-[1-(4-метилфенил)-1H-пиразоло[3,4-с]пиридин-3-ил]-2-(морфолин-4-илметил)морфолин;
4-[1-(4-хлорфенил)-1Н-пиразоло[3,4-с]пиридин-3-ил]-2-[(4-метилпиперазин-1-ил)метил]морфолин;
4-[1-(4-хлорфенил)-1Н-пиразоло[3,4-с]пиридин-3-ил]-2-(пиперазин-1-илметил)морфолин;
3-аминопропил 4-({4-[1-(4-хлорфенил)-1Н-пиразоло[3,4-с]пиридин-3-ил]морфолин-2-ил}метил)пиперазин-1-карбоксилат;
N-(3-аминопропил)-4-({4-[1-(4-хлорфенил)-1Н-пиразоло[3,4-с]пиридин-3-ил]морфолин-2-ил}метил)пиперазин-1-карбоксамид;
4-({4-[1-(4-хлорфенил)-1Н-пиразоло[3,4-с]пиридин-3-ил]морфолин-2-ил}метил)-N-этилпиперазин-1-карбоксамид;
метил 2-{4-[1-(4-хлорфенил)-1Н-пиразоло[3,4-с]пиридин-3-ил]морфолин-3-ил}ацетат;
4-[1-(4-хлорфенил)-1Н-пиразоло[3,4-с]пиридин-3-ил]-3-(морфолин-4-илметил)морфолин;
4-[1-(4-хлорфенил)-1H-пиразоло[3,4-с]пиридин-3-ил]-3-[2-(4-метилпиперазин-1-ил)этил]морфолин;
1-[1-(4-хлорфенил)-1Н-пиразоло[3,4-с]пиридин-3-ил]-N-[(1-метилпиперидин-4-ил)метил]пиперидин-2-карбоксамид;
1-(4-хлорфенил)-N-[2-(морфолин-4-ил)этил]-1Н-пиразоло[3,4-с]пиридин-3-амин;
1-(4-хлорфенил)-N-[2-(пиперазин-1-ил)этил]-1Н-пиразоло[3,4-с]пиридин-3-амин;
1-(4-хлорфенил)-N-[2-(4-метилпиперазин-1-ил)этил]-1H-пиразоло[3,4-с]пиридин-3-амин;
1-[1-(4-хлорфенил)-1Н-пиразоло[3,4-с]пиридин-3-ил]-N-(пиперидин-4-илметил)пиперидин-4-карбоксамид;
4-({1-[1-(4-хлорфенил)-1Н-пиразоло[3,4-с]пиридин-3-ил]пиперидин-4-ил}метил)морфолин;
1-({1-[1-(4-хлорфенил)-1Н-пиразоло[3,4-с]пиридин-3-ил]пиперидин-4-ил}метил)пиперазин;
({1-[1-(4-хлорфенил)-1H-пиразоло[3,4-с]пиридин-3-ил]пиперидин-4-ил}метил)(пиперидин-4-илметил)амин;
4-[1-(4-хлорфенил)-1Н-пиразоло[3,4-с]пиридин-3-ил]-N-[(1-метилпиперидин-4-ил)метил]пиперазин-1-карбоксамид;
2-{4-[1-(4-хлорфенил)-1H-пиразоло[3,4-с]пиридин-3-ил]морфолин-3-ил}уксусная кислота;
N-(2-аминоэтил)-2-{4-[1-(4-хлорфенил)-1H-пиразоло[3,4-с]пиридин-3-ил]морфолин-3-ил}ацетамид;
2-{4-[1-(4-хлорфенил)-1Н-пиразоло[3,4-с]пиридин-3-ил]морфолин-3-ил}-1-(4-метилпиперазин-1-ил)этан-1-он;
2-{4-[1-(4-хлорфенил)-1H-пиразоло[3,4-с]пиридин-3-ил]морфолин-3-ил}-1-[(3S)-3-(диметиламино)пирролидин-1-ил]этан-1-он;
2-{4-[1-(4-хлорфенил)-1H-пиразоло[3,4-с]пиридин-3-ил]морфолин-3-ил}-N-(1-метилпиперидин-4-ил)ацетамид;
2-{4-[1-(4-хлорфенил)-1Н-пиразоло[3,4-с]пиридин-3-ил]морфолин-3-ил}-N-[(1-метилпиперидин-4-ил)метил]ацетамид;
({4-[1-(4-хлорфенил)-1Н-пиразоло[3,4-с]пиридин-3-ил]морфолин-2-ил}метил)мочевина;
1-({4-[1-(4-хлорфенил)-1Н-пиразоло[3,4-с]пиридин-3-ил]морфолин-2-ил}метил)-3-метилмочевина;
1-(2-{[1-(4-хлорфенил)-1Н-пиразоло[3,4-с]пиридин-3-ил]амино}этил)имидазолидин-2-он
или их фармацевтически приемлемой соли.
7. Фармацевтическая композиция для применения в лечении воспаления, воспалительного заболевания, иммунного или аутоиммунного расстройства или подавлении роста опухоли, содержащая соединение по любому из пп.1-6 или 1-[1-(4-метилфенил)-1Н-пиразоло[3,4-с]пиридин-3-ил]пиперидин-4-ил ацетат вместе с одним или более фармацевтически приемлемыми носителями и/или эксципиентами.
8. Применение соединения по любому из пп.1-6 или 1-[1-(4-метилфенил)-1Н-пиразоло[3,4-с]пиридин-3-ил]пиперидин-4-ил ацетата для изготовления лекарственного средства для лечения воспаления, воспалительного заболевания, иммунного или аутоиммунного расстройства или ингибирования роста опухоли.
9. Применение по п.8, где воспаление или воспалительное заболевание или иммунное или аутоиммунное расстройство представляют собой артрит (включая ревматоидный артрит, ювенильный ревматоидный артрит, остеоартрит, а также псориазный артрит), воспаление синовиальной оболочки, васкулит, состояния, связанные с воспалением кишечника (включая болезнь Крона, язвенный колит, воспалительное заболевание кишечника, а также синдром раздраженного кишечника), атеросклероз, рассеянный склероз, болезнь Альцгеймера, сосудистую деменцию, легочные воспалительные заболевания (включая астму, хроническую обструктивную болезнь легких и острый респираторный дистресс-синдром), фиброзирующие болезни (включая муковисцидоз, идиопатический легочный фиброз, фиброз сердца и системный склероз (склеродермия)), воспалительные заболевания кожи (включая контактный дерматит, атопический дерматит и псориаз), синдром системной воспалительной реакции, сепсис, воспалительные и/или аутоиммунные состояния печени (включая аутоиммунный гепатит, первичный билиарный цирроз печени, алкогольную болезнь печени, склерозирующий холангит и аутоиммунный холангит), диабет (типа I или II) и/или осложнения, вызванные диабетом, хроническую сердечную недостаточность, застойную сердечную недостаточность, ишемические болезни (включая инсульт и ишемическое реперфузионное повреждение) и инфаркт миокарда и/или осложнения после такого инфаркта.
10. Применение по п.8 или 9, где воспалительное заболевание представляет собой ревматоидный артрит, хроническую обструктивную болезнь легких или атопический дерматит.
11. Применение по п.8 для изготовления лекарственного средства для ингибирования роста опухоли.
Текст
Настоящее изобретение относится к соединениям формулы (I), которые представляют собой ингибиторы семикарбазид-чувствительных аминооксидаз (SSAO) где R1, X и R2 имеют значения, указанные в формуле изобретения. Настоящее изобретение также относится к фармацевтическим композициям, содержащим эти соединения, и к применению этих соединений в лечении или профилактике болезней, в которых ингибирование активностиSSAO является благоприятным, таких как воспалительные болезни, иммунные расстройства и ингибирование роста опухолей. Область техники, к которой относится изобретение Настоящее изобретение относится к соединениям, которые представляют собой ингибиторы активности SSAO. Данное изобретение относится также к фармацевтическим композициям, содержащим эти соединения, и к применению этих соединений при лечении или профилактике медицинских состояний,когда ингибирование активности SSAO является благоприятным, Это могут быть такие состояния, как воспалительные болезни, иммунные расстройства и ингибирование роста опухолей. Сведения о предшествующем уровне техники Активность семикарбазид-чувствительной аминооксидазы (SSAO) представляет собой активность фермента, экспрессированного белком 1 сосудистой адгезии (VAP-1) или аминооксидазы, содержащей медь 3 (АОС 3), это соединение принадлежит к семейству ферментов, медьсодержащих аминооксидаз(ЕС.1.4.3.6). Следовательно, ингибиторы фермента SSAO могут также модулировать биологические функции белка VAP-1. Члены этого семейства ферментов чувствительны к ингибированию семикарбазидом и используют ион двухвалентной меди и топа-хиноновый (TPQ) кофактор на основе белка при окислительном деаминировании первичных аминов до альдегидов, перекиси водорода и аммиака в соответствии со следующей реакцией: Известные субстраты для человеческой SSAO включают эндогенный метиламин и аминоацетон, а также некоторые ксенобиотические амины, такие как бензиламин [Lyles, Int. J. Biochem. Cell Biol. 1996,28, 259-274; Klinman, Biochim. Biophys. Acta 2003, 1647(1-2), 131-137; Mtyus et al., Curr. Med. Chem,2004, 11(10), 1285-1298; O'Sullivan et al., Neurotoxicology 2004, 25(1-2), 303-315]. По аналогии с другими медьсодержащими аминооксидазами анализ ДНК-последовательности и определение структуры позволяет предположить, что связь с тканями человеческой SSAO представляет собой гомодимерный гликопротеин, состоящий из двух подъединиц с молекулярным весом 90-100 кДа,прикреплнных к плазменной мембране при помощи одного N-концевого трансмембранного домена[Morris et al., J. Biol. Chem. 1997, 272, 9388-9392; Smith et al., J. Exp. Med. 1998, 188, 17-27; Airenne et al.,Protein Science 2005, 14, 1964-1974: Jakobsson et al., Ada Cryslallogr. D Biol. Cryslallogr. 2005, 61(Pt 11),1550-1562]. Активность SSAO была обнаружена в различных тканях, включая сосудистые и несосудистые ткани гладких мышц, эндотелий и адипозную ткань [Lewinsohn, Braz. J. Med. Biol. Res. 1984, 17, 223-256;NakosGossrau, Folia Histochem. Cytobiol. 1994, 32, 3-10; Yu et al., Biochem. Pharmacol. 1994, 47, 10551059; Castillo et al., Neurochem. Int. 1998, 33, 415-423; LylesPino, J. Neural. Transm. Suppl. 1998, 52, 239250; Jaakkola et al., Am. J. Pathol. 1999,155, 1953-1965; Morin et al., J. Pharmacol. Exp. Ther. 2001, 297, 563572; SalmiJalkanen, Trends Immunol. 2001, 22, 211-216]. Кроме того, белок SSAO был обнаружен в плазме крови, и эта растворимая форма, как оказалось, имеет свойства, похожие на свойства формы, связанной с тканью [Yu et al., Biochem. Pharmacol. 1994, 47, 1055-1059; Kurkijrvi et al., J. Immunol. 1998,161, 1549-1557]. Недавно было показано, что циркулирующая SSAO у человека и у грызунов происходит из формы, связанной с тканью [Gktrk et al., Am. J. Pathol. 2003, 163(5), 1921-1928; Abella et al., Diabetologia 2004, 47(3), 429-438; Stolen et al., Circ. Res. 2004, 95(1), 50-57], в то время как у других млекопитающих SSAO в плазме/сыворотке также кодируется отдельным геном, называемым АОС 4[Schwelberger, J. Neural. Transm. 2007, 114(6), 757-762]. Точная физиологическая роль этого избыточного фермента до сих пор ещ не определена полностью, но оказывается, что SSAO и продукты е реакций могут иметь несколько функций в системе клеточных сигналов и регулировании. Например, последние работы показали, что SSAO играет роль и вet al., Biochem. J. 2001, 356, 769-777; Mercier et al., Biochem. J. 2001, 358, 335-342]. Кроме того, было показано, что SSAO участвует в воспалительных процессах, где она действует как белок адгезии для лейкоцитов [SalmiJalkanen, Trends Immunol. 2001, 22, 211-216; SalmiJalkanen, in "Adhesion Molecules:Functions and Inhibition" K. Ley (Ed.), 2007, pp. 237-251], и может также играть роль в развитии и поддержании матрицы соединительной ткани [Langford et al., Cardiovasc. Toxicol. 2002, 2(2), 141-150; Gktrk etal., Am. J. Pathol. 2003, 163(5), 1921-1928]. Более того, недавно была установлена связь между SSAO и ангиогенезом [Noda et al., FASEB J. 2008, 22(8), 2928-2935], и на основе этой связи ожидают, что ингибиторы SSAO будут обладать антиангиогенным действием. Некоторые исследования, проведенные на людях, показали, что активность SSAO в плазме крови повышается при таких условиях как застойная сердечная недостаточность, сахарный диабет, болезнь Альцгеймера и воспаление [Lewinsohn, Braz. J. Med. Biol. Res. 1984, 17, 223-256; Boomsma et al., Cardiovasc. Res. 1997, 33, 387-391; Ekblom, Pharmacol. Res. 1998, 37, 87-92; Kurkijrvi et al., J. Immunol. 1998,161, 1549-1557; Boomsma et al., Diabetologia 1999, 42, 233-237; Meszaros et al., Eur. J. Drug Metab. Pharmacokinet. 1999, 24, 299-302; Yu et al., Biochim. Biophys. Acta 2003,1647(1-2), 193-199; Mtyus et al., Curr. Механизмы, лежащие в основе этих изменений активности ферментов, не совсем ясны. Предполагалось, что реакционноспособные альдегиды и перекись водорода, продуцированные эндогенными аминооксидазами, способствуют развитию сердечно-сосудистых болезней, осложнений вызванных диабетом и болезни Альцгеймера[Callingham et al., Prog. Brain Res. 1995, 106, 305-321; Ekblom, Pharmacol. Res. 1998, 37, 87-92; Yu et al., Biochim. Biophys. Acta 2003, 1647(1-2), 193-199; Jiang et al., Neuropathol ApplNeurobiol. 2008, 34(2), 194-204]. Кроме того, ферментативная активность SSAO принимает участие в процессе экстравазации (просачивания) лейкоцитов в местах воспаления, при этом было показано, чтоSSAO сильно экспрессирована на поверхности сосудистого эндотелия [Salmi et al., Immunity 2001, 14(3),265-276; SalmiJalkanen, in "Adhesion Molecules: Functions and Inhibition" K. Ley (Ed.), 2007, pp. 237251]. Соответственно, можно предположить, что ингибирование SSAO имеет терапевтическое значение при предотвращении развития осложнений при диабете и воспалительных заболеваний [Ekblom, Pharmacol. Res. 1998, 37, 87-92; Salmi et al., Immunity 2001, 14(3), 265-276; Salter-Cid et al., J. Pharmacol Exp. Ther. 2005, 315(2), 553-562]. Животные с "выключенной" SSAO фенотипически обычно являются нормальными, но характеризуются заметным снижением воспалительных ответов в ответ на различные раздражители воспаления[Stolen et al., Immunity 2005, 22(1), 105-115]. Кроме того, антагонизм е функции у животных дикого типа на многочисленных животных моделях болезней людей (например, каррагинан-индуцированное воспаление лап, оксазолон-индуцированный колит, липосахарид-индуцированное воспаление лгких, коллаген-индуцированный артрит, эндоксин-индуцированный увеит) при применении антител и/или малых молекул оказался защитным фактором при уменьшении инфильтрации лейкоцитов, снижении степени серьзности фенотипа болезни и уменьшении уровней воспалительных цитокинов и хемокинов [Kirton etMolecules: Functions and Inhibition" K. Ley (Ed.), 2007, pp. 237-251; Noda et al., FASEB J. 2008 22(4), 10941103; Noda et al., FASEB J. 2008, 22(8), 2928-2935]. Эта противовоспалительная защита, кажется, наблюдается на широком круге воспалительных моделей с независимыми причинными механизмами, а не ограничена одной конкретной болезнью или моделью болезни. Это позволяет предположить, что SSAO может быть ключевым центральным фактором при регулировании воспалительного ответа и, следовательно, является возможным, что ингибиторы SSAO будут эффективными противовоспалительными лекарствами для широкого круга болезней у людей.VAP-1 также участвует в развитии и поддержании фиброзов, включая фиброзы печени и лгкого.Weston and Adams (J. Neural. Transm. 2011, 118(7), 1055-64) суммировали экспериментальные данные об участии VAP-1 в развитии фиброза печени, a Weston et al. (EASL Poster 2010) сообщили, что блокадаVAP-1 ускоряет нормализацию состояния при фиброзе, который индуцирован четырххлористым углеродом. Кроме того, VAP-1 участвует в развитии воспаления лгкого (e.g. Singh et al., 2003, Virchows Arch 442:491-495), что дат основания предположить, что блокаторы VAP-1 будут уменьшать воспаление лгких и тем самым, быть полезными при лечении кистозного фиброза путм лечения как профибротических, так и провоспалительных аспектов болезни.SSAO (VAP-1) активируется при раке желудка и была идентифицирована в сосудистой системе человеческой меланомы, гепатомы и опухолей головы и шеи (Yoong K.F., McNab G., Hubscher S.G., AdamsD.H. (1998), J. Immunol. 160, 3978-88.; Irjala H., Salmi M., Alanen K., Gre'nman R., Jalkanen S. (2001), Immunol. 166, 6937-6943; Forster-Horvath C., Dome B., Paku S., et al. (2004), Melanoma Res. 14, 135-40.). В одном исследовании (Marttila-Ichihara F., Castermans K., Auvinen K., Oude Egbrink M.G., Jalkanen S., Griffioen A.W., Salmi M. (2010), J. Immunol. 184, 3164-3173) было показано, что у мышей, имеющих ферментативно неактивный VAP-1 меланомы растут гораздо медленнее и имеют уменьшенное количество и меньший диаметр опухолей в кровеносных сосудах. Пониженный рост этих опухолей также отразился в сниженной (на 60-70%) инфильтрации супрессорных клеток миелоидного происхождения. Благоприятным является тот факт, что дефицит VAP-1 не оказывает влияния на образование сосудов или лимфы в нормальной ткани. Малые молекулы различной структуры уже были описаны в качестве ингибиторов SSAO, см., например, международные заявки WO 02/38153 (производные тетрагидроимидазо[4,5-с]пиридина), WO 03/006003 (производные 2-инданилгидразина), WO 2005/014530 (соединения аллилгидразина и гидроксиламина (аминооксисоединения и WO 2007/120528 (аллиламиносоединения). Другие ингибиторыSSAO описаны в заявках РСТ/ЕР 2009/062011 и РСТ/ЕР 2009/062018. Сущность изобретения Настоящее изобретение относится также к новому классу ингибиторов SSAO с биологическими,фармакологическими и фармакокинетическими свойствами, которые делают их подходящими для применения в качестве профилактических и терапевтических агентов для широкого круга воспалительных заболеваний и иммунных расстройств у людей. Эта терапевтическая способность призвана блокировать действие фермента SSAO, снижая уровни провоспалительных продуктов фермента (альдегидов, перекиси водорода и аммиака) и также уменьшая адгезивную способность иммунных клеток и, соответственно,их активацию и конечную экстравазацию. Заболевания, при которых такая активность, как ожидается,-2 023803 будет терапевтически благоприятной, включают все болезни, где иммунные клетки играют выдающуюся роль в инициировании, поддержании или уменьшении патологии, такие как рассеянный склероз, артрит и васкулит. Неожиданно было обнаружено, что соединения формулы (I), приведнной ниже, являются ингибиторами SSAO. Следовательно, они могут применяться для лечения или профилактики болезней, в которых ингибирование активности SSAO является благоприятным, таких как воспаление, воспалительные болезни, иммунные и аутоиммунные расстройства и ингибирование роста опухолей. Согласно данному изобретению предусмотрено соединение формулы (I) или его фармацетически приемлемая соль или его N-оксид где R1 обозначает фенил или 6-членный гетероарил, который может быть замещн одним или более заместителями, выбранными из галогена, цианогруппы, C1-4-алкила, галоген-C1-4-алкила, C1-4-алкокси-C1-4 алкила, гидрокси-C1-4-алкила, циано-C1-4-алкила, амино-C1-4-алкила, C1-4-алкиламино-C1-4-алкила, ди-(C1-4 алкил)амино-C1-4-алкила, NR4AR4B, NR6C(O)OR5, -NR6C(O)R5, -NR6C(O)NR4AR4B, -C(O)NR4AR4B,-C(O)R5, -C(O)OR5 и -NR6S(O)2R5;Q обозначает насыщенное или частично ненасыщенное моноциклическое 3-7-членное гетероциклическое кольцо или С 3-7-циклоалкильное кольцо; когда R2 обозначает -B-Q-[R3]n, R3 независимо выбран из 3-7-членного гетероциклила, 3-7-членного гетероциклил-C1-4-алкила-, (3-7-членного гетероциклил-C1-4-алкил)амино-С 1-4-алкила-, амино-C1-4 алкокси-C1-4-алкила-, (амино-C1-4-алкил)амино-C1-4-алкила-, -C1-4-алкил-NR6C(O)OR5, -C1-4-алкилNR6C(O)NR4AR4B, -C1-4-алкил-C(O)NR4AR4B, (3-7-членного гетероциклил-C1-4-алкил)-С(О)-, -C1-4-алкилС(О)OR5, -OC(O)R5 или -C(O)NR9AR9B, где R9A и R9B вместе с атомом азота, к которому они присоединены, образуют 3-7-членную циклическую аминогруппу, замещнную одним или более заместителями,выбранными из C1-4-алкила, C1-4-алкокси-C1-4 алкила-, C3-7-циклоалкила или -C(O)NR6R10B, где R10B обозначает:(ii) 5- или 6-членный гетероарил-C1-4-алкил-, где гетероарильное кольцо может быть замещено одним или более заместителями, выбранными из галогена, цианогруппы, C1-4-алкила, галоген-C1-4-алкила, и где часть C1-4-алкил может быть замещена одной или более C1-4-алкильными группами, или часть C1-4 алкил может быть замещена двумя C1-4-алкильными группами, которые вместе с атомом углерода, к которому они присоединены, соединяются вместе и образуют спиро-3-6-членное циклоалкильное кольцо; и где,когда R2 обозначает -B-R3, R3 обозначает -NR6R11B, и R11B обозначает 3-7-членный гетероциклил-C1-4 алкил-;R4A и R4B вместе с атомом азота, к которому они присоединены, образуют 3-7-членную циклическую аминогруппу, которая может быть замещена одним или более заместителями, выбранными из C1-4 алкила, -NR4AR4B; и где если иное не указано, 3-7-членный гетероциклил или гетероциклическая часть 3-7-членного гетероциклил-C1-4-алкила-, (3-7-членного гетероциклил-C1-4-алкил)амино-C1-4-алкила- или (3-7-членной гетероциклил-C1-4-алкил)-С(О)-группы может быть замещена одним или более заместителями, выбранными из оксо, C1-4-алкила-, -C(O)OR5, -C(O)R5, -C(O)NR4AR4B, -NR4AR4B, -C1-4-алкил-C(O)NR4AR4B или C1-4 алкокси-C1-4-алкила; и дирадикал -C1-4-алкильная группа, если она есть, непосредственно присоединнная к Q, может быть замещена одной или более группами, независимо выбранными из галогена, аминогруппы, метокси, гидроксильной группы; и гдеR4 и R6, каждый независимо, выбран из водорода или C1-4-алкила;X выбран из радикалов формул (1-16), где связь, отмеченная звздочкой , присоединена к R1- и связь, отмеченная двумя звздочками , присоединена к -R2W выбран из Н, C1-4-алкила, галоген-C1-4-алкила,при условии, что когда R2 обозначает -B-Q-[R3]n и R3 обозначает 3-7-членный гетероциклил, атом гетероциклического кольца в R3, непосредственно соединнный с Q, не является азотом. Согласно ещ одному варианту изобретения это изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли или его N-оксиду где R1 обозначает фенил или 6-членный гетероарил, который может быть замещн одним или более заместителями, выбранными из галогена, цианогруппы, C1-4-алкила, галоген-C1-4-алкила, C1-4-алкокси-C1-4 алкила, гидрокси-C1-4-алкила, циано-C1-4-алкила, амино-C1-4-алкила, C1-4-алкиламино-C1-4-алкила, ди-(C1-4 алкил)амино-C1-4-алкила, NR4AR4B, NR6C(O)OR5, NR6C(O)R5, -NR6C(O)NR4AR4B, -C(O)NR4AR4B, -C(O)R5,-C(O)OR5 и -NR6S(O)2R5;Q обозначает насыщенное или частично ненасыщенное моноциклическое 3-7-членное гетероциклическое кольцо или С 3-7-циклоалкильное кольцо; и когда R2 обозначает -B-Q-[R3]n, R3 независимо выбран из 3-7-членного гетероциклила, 3-7-членного гетероциклил-C1-4-алкила-, (3-7-членного гетероциклил-C1-4-алкил)амино-С 1-4-алкила-, амино-C1-4 алкокси-C1-4-алкила-, (амино-C1-4-алккил)амино-C1-4-алкила-, -C1-4-алкил-NR6C(O)OR5, -C1-4-алкилNR6C(O)NR4AR4B, -C1-4-алкил-C(O)NR4AR4B, (3-7-членного гетероциклил-C1-4-алкил)-С(О)-, -C1-4-алкилC(O)OR5, -OC(O)R5,или -C(O)NR9AR9B, где R9A и R9B вместе с атомом азота, к которому они присоединены, образуют 37-членную циклическую аминогруппу, замещнную одним или более заместителями, выбранными из C1-4 алкила, C1-4 алкокси-C1-4 алкила-, С 3-7-циклоалкила или -C(O)NR6R10B, где R10B обозначает 3-7-членный гетероциклил или 3-7-членный гетероциклил-C1-4-алкил- или -C1-4-алкил-NR6C(O)R5; или когда R2 обозначает -B-R3, R3 обозначает -NR6R11B и R11B обозначает 3-7-членный гетероциклил-C1-4 алкил-;R4A и R4B вместе с атомом азота, к которому они присоединены, образуют 3-7-членную циклическую аминогруппу, которая может быть замещена одним или более заместителями, выбранными из C1-4 алкила, -NR4AR4B; и если иное не указано, 3-7-членный гетероциклил, или гетероциклическая часть 3-7-членного гетероциклил-C1-4-алкила-, (3-7-членного гетероциклил-C1-4-алкил)амино-C1-4-алкила-, или (3-7-членной гетероциклил-C1-4-алкил)-С(О)-группы может быть замещена одним или более заместителями, выбранны-4 023803 ми из оксо, C1-4-алкила-, -C(O)OR5, -C(O)R5, -C(O)NR4AR4B, -NR4AR4B, -C1-4-алкил-C(O)NR4AR4B или C1-4-алкокси-C1-4-алкила; и дирадикал -C1-4-алкильная группа, если она есть, непосредственно присоединнная к Q, может быть замещена одной или более группами, независимо выбранными из галогена, аминогруппы, метокси, гидроксильной группы; и гдеR4 и R6, каждый независимо, выбран из водорода или C1-4-алкила; иX выбран из радикалов формул (1-16), где связь, отмеченная звздочкой , присоединена к R1- и связь, отмеченная двумя звздочками , присоединена к -R2W выбран из Н, C1-4-алкила, галоген-C1-4-алкила,при условии, что когда R2 обозначает -B-Q-[R3]n и R3 обозначает 3-7-членный гетероциклил, атом гетероциклического кольца, непосредственно связанный с Q, не является азотом. Ожидают, что соединения согласно данному изобретению могут быть получены в форме гидратов и сольватов. Любая ссылка, приведнная в данной заявке, включая формулу изобретения, на "соединения,которых касается настоящее изобретение". или на "соединения по изобретению", или на "данные соединения" и т.п. включает ссылки и на соли, гидраты и сольваты таких соединений. Термин "сольват", применяемый в данной заявке, предназначен для описания молекулярного комплекса, содержащего соединение по изобретению и стехиометрическое количество одного или более фармацевтически приемлемых молекул растворителя, например этилового спирта. Термин "гидрат" применяется, когда таким растворителем является вода. Индивидуальные соединения по изобретению могут существовать в аморфной форме и/или нескольких полиморфных форм и могут быть получены в различных кристаллических состояниях. Любая ссылка в данной заявке, в том числе в формуле изобретения, на "соединения, которых касается настоящее изобретение" или "соединения по изобретению" и т.п. включают ссылку на соединения независимо от того, аморфную или кристаллическую форму они имеют. Так как соединения по изобретению имеют атом азота в ароматическом кольце, они могут образовывать N-оксиды и поэтому данное изобретение включает соединения по изобретению в форме Nоксидов. Сведения, подтверждающие возможность осуществления изобретения Определения По всему тексту описания и формулы изобретения будут применяться следующие определения, если иное не заявлено и не указано. Термин "C1-4-алкил" означает линейную или разветвлнную алкильную группу, содержащую от 1 до 4 атомов углерода. В случае C1-4-алкила все его подгруппы предполагают такие группы, как C1-3 алкил, C1-2-алкил, C2-4-алкил, C2-3-алкил и C3-4-алкил. Примеры указанных C1-4-алкилов включают метил, этил, н-пропил, изопропил, н-бутил, изобутил,втор-бутил и трет-бутил. Если иное не оговорено, термин "C3-7-циклоалкил" относится к моноциклической насыщенной или частично ненасыщенной углеводородной кольцевой системе, содержащей от 3 до 7 атомов углерода. Примеры указанных C3-7-циклоалкилов включают циклопропил, циклобутил, циклопентил, циклогексил,-5 023803 циклогексенил, циклогептил и циклогептенил. Под "C3-7-циклоалкилом" данным изобретением подразумеваются такие подгруппы, которые представляют собой C3-7-циклоалкил, С 3-6-циклоалкил, С 3-5 циклоалкил, С 3-4-циклоалкил, С 4-7-циклоалкил, С 4-6-циклоалкил, С 4-5-циклоалкил, С 5-7-циклоалкил, С 5-6 циклоалкил и С 6-7-циклоалкил. Термин "C1-4-алкокси" относится к линейной или разветвлнной C1-4-алкильной группе, которая присоединена к остальной части молекулы через атом кислорода. В случае C1-4-алкокси все подгруппы могут быть такими как C1-3-алкокси, С 1-2-алкокси, С 2-4-алкокси, C2-3 алкокси и С 3-4-алкокси. Примеры таких C1-4-алкоксильных групп включают метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси и трет-бутокси. Термин "гидрокси-C1-4-алкил"обозначает линейную или разветвлнную C1-4-алкильную группу, в которой один или более атомов водорода замещены группой ОН. Примеры таких гидрокси-C1-4-алкилов включают гидроксиметил, 2-гидроксиэтил и 2,3-дигидроксипропил. Термин "галоген-C1-4-алкил" обозначает линейную или разветвлнную C1-4-алкильную группу, в которой один или более атомов водорода замещены галогеном. Примеры таких галоген-C1-4-алкилов включают фторметил, трифторметил, трихлорметил и 2-фторэтил. Термин "циано-C1-4-алкил" обозначает линейную или разветвлнную C1-4-алкильную группу, в которой один или более атомов водорода замещены цианогруппой. Примеры таких циано-C1-4-алкилов включают цианометил, 2-цианоэтил, а также 3-цианопропил. Термин "амино-C1-4-алкил" обозначает линейную или разветвлнную C1-4-алкильную группу, замещнную аминогруппой. Примеры таких амино-C1-4-алкильных групп включают аминометил и 2 аминоэтил. Термин "C1-4-алкиламино-C1-4-алкил" обозначает амино-C1-4-алкильную группу, определение которой дано выше, в которой аминогруппа замещена линейной или разветвлнной C1-4-алкильной группой. Примеры C1-4-алкиламино-C1-4-алкилов включают метиламиноэтил и этиламинопропил. Термин "ди(C1-4-алкил)амино-C1-4-алкил" обозначает амино-C1-4-алкильную группу, определение которой дано выше, в которой аминогруппа является дизамещнной линейной или разветвлнной C1-4 алкильными группами, которые могут быть одинаковыми или разными. Примеры указанных ди(C1-4 алкил)амино-C1-4-алкилов включают N,N-диметиламинометил, N-этил-N-метиламиноэтил и N,Nдиэтиламинометил. Термин "гетероарил" и "гетероароматическое кольцо" обозначают моноциклическое гетероароматическое кольцо, содержащее от 5 до 6 атомов в кольце, в котором один или более атомов в кольце отличаются от углерода, например являются атомами азота, серы или кислорода. Примеры гетероарильных групп включают фурил, пирролил, тиенил, оксазолил, изоксазолил, имидазолил, тиазолил, изотиазолил,пиридинил, пиримидинил, тетразолил, пиразолил, пиридазинил, пиразинил и тиадиазолил. Термины "гетероциклил" и "гетероциклическое кольцо" означают неароматическую, полностью насыщенную или частично ненасыщенную, предпочтительно полностью насыщенную, моноциклическую кольцевую систему, содержащую от 3 до 7 атомов, особенно 5 или 6 атомов, в которой один или более атомов в кольце отличаются от углерода, например являются атомами азота, серы или кислорода. Примерами гетероциклических групп являются пиперидинил, морфолинил, гомоморфолинил, азепанил, пиперазинил, оксопиперазинил, диазепинил, тетрагидропиридинил, тетрагидропиранил, пирролидинил,тетрагидрофуранил и дигидропирролил. Термин "гетероциклил-C1-4-алкил" относится к гетероциклическому кольцу, которое непосредственно связано с линейной или разветвлнной C1-4-алкильной группой через атом углерода или атом азота в указанном кольце. Примеры таких гетероциклил-C1-4-алкилов включают пиперидин-4-илметил, пиперидн-1-илметил, морфолин-4-илметил и пиперазин-4-илметил. C1-4-алкильная часть, которая включает метилен, этилен, пропилен или бутилен, может быть замещена одним или более заместителями, которые выбраны из галогена, аминогруппы, метокси и гидроксильной группы. Термин "C1-3 алкилен" обозначает линейную или разветвлнную насыщенную углеводородную цепь,содержащую от 1 до 3 атомов углерода C1-3-алкиленовая цепь может быть присоединена к остальной части молекулы и к радикалу через атом углерода в цепи или через любые два атома углерода в цепи. Примеры C1-3-алкиленовых радикалов включают метилен [-СН 2-], 1,2-этилен [-СН 2-СН 2-], 1,1-этилен[-СН(СН 3)-], 1,2-пропилен [-СН 2-СН(СН 3)-] и 1,3-пропилен [-СН 2-СН 2-СН 2-]. Когда речь идт о "C1-3 алкилене", могут быть такие подгруппы, как C1-2-алкилен и C2-3-алкилен. Термин "галоген" относится к фтору, хлору, брому или йоду, предпочтительно к фтору и хлору,наиболее предпочтительно к фтору. Термин "гидрокси" относится к радикалу -ОН. Термин "циано" относится к радикалу -CN. Термин "оксо" относится к карбонильной группе =O. Термин "возможный" или "возможно" означает, что описанное затем событие или обстоятельство может происходить, но не обязательно, и что описание заявки включает случаи, когда событие или обстоятельство имеют место, и случаи, когда это не происходит. Термин "фармацевтически приемлемый" означает, что этот ингредиент пригоден при изготовлении фармацевтической композиции, который вообще является безопасным, нетоксичным и не является биологически или другим образом нежелательным, и он полезен в ветеринарии, а также для фармацевтического применения для людей. Термин "лечение", используемый в данной заявке, включает профилактику указанного расстройства или состояния или облегчение или исчезновение расстройства, когда это установлено. Термин "эффективное количество" относится к количеству, которое оказывает терапевтическое действие на субъекта, подвергающегося лечению. Терапевтический эффект может быть объективным (то есть измеримым при проведении какого-либо теста или при применении маркра) или субъективным (то есть субъект сам свидетельствует об эффекте или чувствует наличие этого эффекта). Термин "пролекарства" относится к соединениям, которые могут быть превращены в физиологических условиях или при сольволизе в биологически активное соединение по изобретению. Пролекарство может быть неактивным при введении субъекту, который нуждается в этом, но затем оно превращаетсяin vivo в активное соединение по изобретению. Пролекарства обычно быстро превращаются in vivo с образованием родительского соединения по изобретению, например, путм гидролиза в крови. Пролекарство обычно имеет преимущества по растворимости, совместимости с тканями или пролонгированному высвобождению в организме млекопитающего (см. Silverman, R.В., The Organic Chemistry of Drug Designand Drug Action, 2nd Ed., Elsevier Academic Press (2004), pp. 498-549). Пролекарства согласно данному изобретению могут быть получены путм модификации функциональных групп, таких как гидроксильные, аминогруппы или меркаптогруппы, содержащиеся в соединении по изобретению, таким образом,чтобы модификации расщеплялись или при рутинной обработке или in vivo с образованием родительского соединения по изобретению. Примеры пролекарств включают, но без ограничения, ацетаты, формиаты, сукцинаты, являющиеся производными гидроксильных функциональных групп или фенилкарбаматы,производные функциональных аминогрупп. По всему тексту описания и прилагаемой формулы изобретения приведнные химическая формула или название будут также охватывать все их соли, гидраты, сольваты, N-оксиды и пролекарственные формы. Кроме того, данная химическая формула или название будут охватывать все их таутомерные и стереоизомерные формы. Таутомеры включают енольные формы и кетоформы. Стереоизомеры включают энантиомеры и диастереомеры. Энантиомеры могут быть представлены в чистом виде или как рацематы (равные) или как неравные смеси двух энантиомеров. Диастереомеры могут быть представлены в чистом виде или как смеси диастереомеров. Диастереомеры включают также геометрические изомеры,которые могут находиться в их чистых цис- или транс-формах или в виде их смесей. Соединения формулы (I) могут быть использованы как таковые или там, где это желательно, в виде фармацевтически приемлемых солей (соли присоединения кислоты или основания). Фармацевтически приемлемые соли присоединения, упомянутые ниже, включают терапевтически активные нетоксичные соли присоединения кислоты и основания, которые способны образовывать соединения по изобретению. Соединения, которые имеют основные свойства, могут быть превращены в их фармацевтически приемлемые соли путм обработки основания соответствующей кислотой. Примеры кислот включают неорганические кислоты, такие как соляная, бромисто-водородная, йодисто-водородная, серная кислота, фосфорная кислота, и органические кислоты, такие как муравьиная кислота, уксусная кислота, пропановая кислота, оксиуксусная кислота, молочная кислота, пировиноградная кислота, гликолевая кислота, малеиновая кислота, малоновая кислота, щавелевая кислота, бензосульфокислота, толуолсульфокислота, метансульфокислота, трифторуксусная кислота, фумаровая кислота, янтарная кислота, яблочная кислота,винная кислота, лимонная кислота, салициловая кислота, п-аминосалициловая кислота, памовая кислота,бензойная кислота, аскорбиновая кислота и т.п. Примеры солей присоединения оснований представляют собой соли натрия, калия, кальция и соли с фармацевтически приемлемыми аминами, такими как, например, аммиак, алкиламины, бензатин и аминокислоты, такие как, например, аргинин и лизин. Термин"соль присоединения", применяемый в данной заявке, включает также сольваты, которые способны образовывать соединения по изобретению, и их соли, такие как, например, гидраты, алкоголяты и т.п. Группа X. В соединениях по изобретению группа X может быть выбрана из любого радикала формул 1-16. Предпочтительные варианты данного изобретения включают соединения, в которых X представляет собой формулу 1, при этом определение R1, R2, Y, Z и W дано выше; или формулу 2, при этом определение R1, R2, Y, Z и W выше; или формулу 3, при этом определение R1, R2, Y, Z и W дано выше; или формулу 4, при этом определение R1, R2, Y, Z и W дано выше; или формулу 5, при этом определение R1, R2 и Y дано выше; или формулу 6, при этом определение R1, R2, Y и Z дано выше. Группа В. Согласно одному из вариантов данного изобретения В обозначает связь, О, NR4 обозначают NH,NCH3 или NCH2CH3, -С(О)- или C1-3-алкилен, такой как метилен, этилен или пропилен. Согласно предпочтительному варианту В обозначает связь, -С(О)- или метилен. Согласно другому предпочтительному варианту В обозначает связь. Группа Y. Согласно предпочтительному варианту данного изобретения группа Y выбирается из водорода,гидроксильной группы, аминогруппы (NH2), -NHR6, например NHCH3, NHCH2CH3 или -ОСН 3. Согласно другому предпочтительному варианту данного изобретения группа Y обозначает Н, ОН или NH2. Согласно альтернативному предпочтительному варианту Y является водородом. Группа Z. Группа Z выбирается из водорода, фтора, гидроксила, C1-4-алкокси, например метокси или этокси,галоген-C1-4-алкила, например фторметокси, дифторметокси или триметокси, CONH2, цианогруппы,SO2NH2, аминогруппы, -NHR6, например NHCH3, NHCH2CH3. Согласно предпочтительному варианту данного изобретения группа Z является водородом или гидроксилом. Группа W. Согласно предпочтительному варианту данного изобретения группа W выбрана из Н, C1-4-алкила,такого как метил, этил, пропил, изопропил, или гало-C1-4-алкила, такого как фторметил, дифторметил или трифторметил. Согласно другому предпочтительному варианту данного изобретения группа W является водородом. Группа R1. Согласно одному из вариантов данного изобретения R1 обозначает фенил или 6-членный гетероарил, такой как пиридин, пиридазин, пиримидин, пиразин, возможно замещнный одним или более заместителями, выбранными из галогена, такого как хлор или фтор, цианогруппы, C1-4-алкила, такого как метил, этил, пропил или изопропил, гало-C1-4-алкила, такого как фторметил, дифторметил или трифторметил, C1-4-алкокси-C1-4-алкила, гидрокси-C1-4-алкила, такого как гидроксиметил или гидроксиэтил, циано-C14-алкила, такого как цианометил или цианоэтил, амино-C1-4-алкила, такого как аминометил, этил или аминопропил, C1-4-алкиламино-C1-4-алкила, ди(C1-4-алкил)амино-C1-4-алкила, -NR4AR4B, -NR6C(O)OR5,-NR6C(O)R5, -NR6C(O)NR4AR4B, -C(O)NR4AR4B, -C(O)R5, -C(O)OR5 и -NR6S(O)2R5. Согласно предпочтительному варианту данного изобретения R1 может быть замещн одним или более заместителями, выбранными из галогена, такого как фтор или хлор, цианогруппы, гидроксила, C1-4 алкила, такого как метил или этил, гало-C1-4-алкила, такого как фторметил, дифторметил или трифторметил, C1-4 алкокси-C1-4 алкила, гидрокси-C1-4-алкила, циано-C1-4-алкила, такого как цианометил или цианоэтил, амино-C1-4-алкила, C1-4-алкиламино-C1-4-алкила, ди-(C1-4-алкил)амино-C1-4-алкила, -NR4AR4B. Согласно другому предпочтительному варианту данного изобретения R1 может быть гетероарилом,таким как пиридин-2-илом, пиридин-3-илом или пиридин-4-илом, возможно замещнным одним или более заместителями, выбранными из фтора, хлора и C1-4-алкила, такого как метил, этил, пропил или изопропил. Согласно альтернативному варианту R обозначает фенил, возможно замещнный в одном или более пара-, мета- или орто-положениях одним или более заместителями, выбранными из водорода, фтора,хлора, циано, гидроксила, C1-4-алкила, такого как метил, этил, пропил или изопропил, или фторметила,дифторметила и трифторметила. Согласно предпочтительному варианту R1 обозначает фенил, замещнный в пара-положении заместителем, выбранным из фтора, хлора, цианогруппы, гидроксила, C1-4-алкила, такого как метил, этил, пропил или изопропил, или фторметила, дифторметила и трифторметила. Согласно альтернативному предпочтительному варианту заместитель в пара-положении выбран из фтора, хлора или метила. Согласно ещ одному предпочтительному варианту R1 обозначает фенил, замещнный в метаположении водородом. Согласно ещ одному предпочтительному варианту R1 обозначает фенил, замещнный в ортоположении заместителем, выбранным из водорода, фтора, метила, фторметила, дифторметила или трифторметила. Согласно другому предпочтительному варианту R1 обозначает фенил, замещнный в ортоположении водородом, фтором или метилом. Согласно ещ одному предпочтительному варианту данного изобретения R1 может обозначать моно-, ди- или тризамещнное фенильное кольцо, в котором орто-, мета- и пара-положения могут содержать любую комбинацию заместителей, указанных выше. Согласно предпочтительному варианту данного изобретения возможные заместители в R1 имеют длину 4 атома или меньше, предпочтительно 3 атома или меньше и более предпочтительно 2 атома или меньше. Группа R2. Согласно ещ одному предпочтительному варианту данного изобретения R2 обозначает -B-Q-[R3]n,n может равняться 1, 2, 3 или 4. Согласно другому предпочтительному варианту n равен 1 или 2. Кольцо Q является насыщенным или частично ненасыщенным моноциклическим 3-7-членным гетероциклическим или C3-7-циклоалкильным кольцом, замещнным радикалом R3. Согласно предпочтительному варианту Q представляет собой 7-членное насыщенное или частично ненасыщенное 7-членное гетероциклическое кольцо, такое как гомоморфолиновое кольцо или мостиковое гомоморфолиновое кольцо, где мостик образован этиленовым или пропиленовым радикалом, или 7-членное циклоалкильное кольцо, такое как циклогептан. Согласно альтернативному предпочтительному варианту Q представляет собой 5- или 6-членное насыщенное ли частично ненасыщенное 5- или 6-членное гетероциклическое кольцо, такое как тетрагидрофуранил, тетрагидропиранил, пиперидинил, пиперазинил, морфолинил, циклогексил или любое описанное выше кольцо, содержащее мостик, образованный этиленовым или пропиленовым радикалом, или 5- или 6-членное циклоалкильное кольцо, такое как циклопентил или циклогексил. Согласно одному из вариантов изобретения Q обозначает пиперидинил, пиперазинил или морфолинил. Согласно одному из предпочтительных вариантов R2 обозначает -B-Q-[R3]n, где R3 выбран из(ii) -C(O)NR9AR9B, где R9A и R9B вместе с атомом азота, к которому они присоединены, образуют 37-членную циклическую аминогруппу, замещнную одним или более заместителями, выбранными из C1-4 алкила, C1-4 алкокси-C1-4 алкила, C3-7-циклоалкила. Согласно предпочтительному варианту данного изобретения циклическая аминогруппа представляет собой пирролидил, пиперидинил, пиперазинил или морфолинил, каждый из которых замещн у атома углерода или азота в кольце одним или более заместителями, выбранными из метила, этила, пропила, изопропила, н-бутила, втор-бутила, трет-бутила, метоксиэтила, циклопропила или циклобутила. Согласно предпочтительному варианту данного изобретения циклическая аминогруппа представляет собой пиперазинил, замещнный в 4 положении метилом, этилом, пропилом, изопропилом, втор-бутилом или циклопропилом, или(iii) -C(O)NR6R10B, где R10B обозначает 3-7-членный гетероциклил, такой как определнный выше,или 3-7-членный гетероциклил-C1-4-алкил, такой как определнный выше, или -C1-4-алкил-NR6C(O)R5; или R10B обозначает 5- или 6-членный гетероарил-C1-4-алкил, такой как тетразолилметил, где гетероарильное кольцо возможно замещено одним или более заместителями, выбранными из C1-4-алкила или галоген-C1-4-алкила, и где C1-4-алкильная часть гетероарил-C1-4-алкильной группы может быть замещена одним или более C1-4-алкильными группами, или C1-4-алкильная часть гетероарил-C1-4-алкильной группы может быть замещена двумя C1-4-алкильными группами, которые вместе с атомом углерода, к которому они присоединены, образуют спиро-3-6-членное циклоалкильное кольцо. Согласно предпочтительному варианту R10B обозначает тетразолилметил, где тетразольная группа может быть замещена одним или более заместителями, выбранными из C1-4-алкила или галоген-C1-4-алкила, и где метил в тетразолилметиле замещн двумя C1-4-алкильными группами, которые вместе с атомом углерода, к которому они присоединены, образуют вместе спироциклопропил, спироциклобутил или спироциклопентил. Группы R4A, R4B и R5, каждая независимо, выбирается из водорода, C1-4-алкила, такого как метил,этил, пропил, изопропил, н-бутил, втор-бутил, трет-бутил, 3-7-членного гетероциклил-C1-4-алкила, определение которого приведено выше, амино-C1-4-алкила, такого как аминометил, аминоэтил, 3-7-членного гетероциклила, такого как определнный выше, -C1-4-алкил-NR6C(O)OR5, или C3-7-циклоалкила, такого как циклопропил, циклобутил, циклопентил и циклогексил, илиR4A и R4B вместе с атомом азота, к которому они присоединены, образуют 3-7-членную циклическую аминогруппу, такую как пирролидил, пиперидинил, гомопиперидинил, пиперазинил, гомопиперазинил или морфолинил, возможно замещнные одним или более заместителями, выбранными из C1-4 алкила, такого как метил, этил, пропил, изопропил, н-бутил, втор-бутил, трет-бутил, -NR4AR4B, такого как-NH2, -NHCH3, NHCH2CH3 или NH(CH3)2. Согласно предпочтительным вариантам 3-7-членный гетероциклил (отличающийся от кольца Q),или гетероциклическая часть 3-7-членного гетероциклил-С 1-4-алкила, (3-7-членного гетероциклил-C1-4 алкил)амино-C1-4-алкила, или (3-7-членного гетероциклил-C1-4-алкил)-С(О)-группы могут быть замещены одним или более заместителями, выбранными из оксо, C1-4-алкила, такого как метил, этил, пропил,изопропил, н-бутил, втор-бутил, трет-бутил, -C(O)OR5, -C(O)R5, -C(O)NR4AR4B, -NR4AR4B такого как-NH2, -NHCH3, NHCH2CH3, или N(CH3)2, -C1-4-алкил-C(O)NR4AR4B, или C1-4 алкокси-C1-4 алкила, такого как метоксиэтил. Согласно данному предпочтительному варианту группа R3 включает двухвалентный радикал -C1-4 алкил, непосредственно присоединнный к кольцу Q таким образом, что R3 может обозначать, например,-9 023803 3-7-членный гетероциклил-C1-4-алкил, (3-7-членный гетероциклил-C1-4-алкил)амино-C1-4-алкил, аминоC1-4-алкокси-C1-4-алкил, (амино-C1-4-алкил)амино-C1-4-алкил-, -C1-4-алкил-NR6C(O)OR5, -C1-4-алкилNR6C(O)NR4AR4B, или -C1-4-алкил-C(O)NR4AR4B. Согласно предпочтительному варианту изобретения этот радикал -C1-4-алкил- может быть замещен одним или более заместителями, независимо выбранными из галогена, амино, метокси и гидроксила. Согласно одному из вариантов данного изобретения радикал -C1-4 алкил- выбран из метилена, этилена, пропилена или бутилена, каждый из которых может быть замещн одной или более группами, независимо выбранными из галогена, амино, метокси и гидроксила. Например, группа R3 включает -CH2-C(O)NR4AR4B, -(CH2)2-C(O)NR4AR4B, -(CH2)3-C(O)NR4AR4B или 3-7-членный гетероциклил-СН 2-, 3-7-членный гетероциклил-(СН 2)2- или 3-7-членный гетероциклил-(СН 2)3-.R4 и R6, каждый независимо, выбран из водорода или C1-4-алкила, такого как метил, этил, пропил,изопропил, н-бутил, втор-бутил, трет-бутил. Согласно другому варианту R2 обозначает -B-R3 и R3 обозначает -NR6R11B, где R11B представляет собой 3-7-членный гетероциклил-C1-4-алкил, определение которого дано выше, и R6 имеет значение, указанное выше. Согласно альтернативному предпочтительному варианту R2 обозначает -B-Q-[R3]n, и R3 обозначает:(i) -C(O)NR6R10B, где R6 обозначает метил или водород и R10B обозначает 3-7-членный гетероциклил, такой как пиперидинил, включая пиперидин-4-ил и 1-метилпиперидин-4-ил, или R10B обозначает 37-членный гетероциклил-C1-4-алкил, включая морфолин-4-илметил, морфолин-4-илэтил, морфолин-4 илпропил, пиперидин-4-илметил, пиперидин-4-илэтил, пиперидин-4-илпропил-, пиперазин-1-илметил или пиперазин-1-илэтил, где атом азота в пиперидине в положении 1 или в положении 4 замещн заместителем, выбранным из водорода, метила, этила, изопропила, а также метоксиэтила. Согласно ещ одному предпочтительному варианту данного изобретения R3 обозначает -C1-4-алкилC(O)NR4AR4B, где R4A обозначает водород и R4B обозначает аминоэтил, или R4A и R4B вместе с атомом азота, к которому они присоединены, образуют пирролидильное или пиперидинильное кольцо, которое может быть замещено одним или более заместителями, выбранными из -NH2, -NHCH3, NHCH2CH3 илиN(CH3)2. Согласно предпочтительному варианту R2 представляет собой где Т обозначает трхвалентный атом азота или метин (то есть СН);R6 обозначает водород или C1-4-алкил, такой как метил;R10B обозначает 3-7-членную гетероциклическую группу, такую как морфолин или пиперидин, или 3-7-членный гетероциклил-C1-4-алкил, такой как морфолинилметил, морфолинилэтил, морфолинилпропил, пиперидинилметил, пиперидинилэтил, пиперидинилпропил, пиперазинилметил, пиперазинилэтил или пиперазинилпропил, при этом любое из этих гетероциклических колец может быть замещено одним или более заместителями, выбранными из C1-4-алкила и C1-4 алкокси-C1-4 алкила. Согласно ещ одному варианту изобретения R2 обозначает где Т обозначает трхвалентный атом азота или метин (то есть СН); Р обозначает простую связь или дирадикал, выбранный из метилена, этилена или пропилена;R6 обозначает водород или C1-4-алкил;R12 выбран из водорода, C1-4-алкила, такого как метил, этил, пропил, бутил, изопропил, и C1-4 алкокси-C1-4-алкила, такого как метоксиэтил. Согласно другому варианту R2 обозначает где Т обозначает трхвалентный атом азота или метин (то есть СН); Р обозначает дирадикал, выбранный из метилена, этилена или пропилена;R6 обозначает водород или C1-4-алкил;R12 выбран из водорода, C1-4-алкила, такого как метил, этил, пропил, бутил, изопропил, и C1-4 алкокси-C1-4-алкила, такого как метоксиэтил. Согласно другому варианту R2 обозначаетR4A и R4B вместе с атомом азота, к которому они присоединены, образуют 3-7-членную циклическую аминогруппу, такую как пирролидин, пиперидин, пиперазин или морфолин, каждая из которых может быть замещена одним или более заместителями, выбранными из: C1-4-алкила или -NR4AR4B. В любом из соединений по изобретению группа R1 может быть любой из конкретных групп R1 в соответствующем положении по любому из примеров, описанных в данной заявке. В любом из соединений по изобретению группа R2 может быть любой из конкретных групп R2 в соответствующем положении по любому из примеров, описанных в данной заявке. В любом из соединений по изобретению группа R3 может быть любой из конкретных групп R3 в соответствующем положении по любому из примеров, описанных в данной заявке. Особенно предпочтительные варианты данного изобретения включают 4-[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]-N-(пиперидин-4-илметил)пиперидин-1 карбоксамид; 4-[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]-N-(1-метилпиперидин-4-ил)пиперидин-1 карбоксамид; 4-[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]-N-[(1-метилпиперидин-4-ил)метил]метил]пиперидин-1-карбоксамид; 4-[1-(4-хлорфенил)-1 Н-пирроло[2,3-с]пиридин-3-ил]-N-[(1-этилпиперидин-4-ил)метил]пиперидин 1-карбоксамид; 4-[1-(4-хлорфенил)-1 Н-пирроло[2,3-с]пиридин-3-ил-N-метил-N-[(1-метилпиперидин-4-ил)метил] пиперидин-1-карбоксамид; 4-[1-(4-хлорфенил)-1 Н-пирроло[2,3-с]пиридин-3-ил]-N-[2-(пиперазин-1-ил)этил]пиперидин-1 карбоксамид; 4-[1-(4-хлорфенил)-1 Н-пирроло[2,3-с]пиридин-3-ил]-N-[2-(1-метилпиперидин-4-ил)этил]пиперидин-1-карбоксамид; 4-[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]-N-[3-(морфолин-4-ил)пропил]пиперидин-1 карбоксамид; 4-[1-(4-хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]-N-[1-(пропан-2-ил)пиперидин-4-ил]метил пиперидин-1-карбоксамид; 4-[1-(4-хлорфенил)-1 Н-пирроло[2,3-с]пиридин-3-ил]-N-[1-(2-метоксиэтил)пиперидин-4-ил]метил пиперидин-1-карбоксамид; 4-[1-(4-хлорфенил)-1 Н-тиразоло[3,4-с]пиридин-3-ил]-N-[(1-метилпиперидин-4-ил]метилпиперазин-1-карбоксамид;N-(2-аминоэтил)-2-4-[1-(4-хлорфенил)-1H-пиразоло[3,4-с]пиридин-3-ил]морфолин-3-илацетамид; 2-4-[1-(4-хлорфенил)-1 Н-пиразоло[3,4-с]пиридин-3-ил]морфолин-3-ил-1-[(3S)-3-(диметиламино) пирролидин-1-ил]этан-1-он или их фармацевтически приемлемые соль или N-оксид. Согласно одному из аспектов настоящего изобретения оно относится к соединению формулы (I),которое можно применять в терапии. Эти соединения, описанные выше, пригодны в качестве ингибиторов активности SSAO. Как таковые, они полезны при лечении или профилактике состояний и болезней,когда ингибирование активности SSAO является благоприятным. Более конкретно, они могут применяться для лечения или профилактики воспаления, воспалительных болезней, иммунных или аутоиммунных расстройств, муковисцидоза или для ингибирования роста опухолей. В частности, полагают, что соединения формулы (I) полезны при лечении или профилактике артрита (такого как ревматоидный артрит, ювенильный ревматоидный артрит, остеоартрит, а также псориазный артрит), воспаления синовиальной оболочки, васкулита, состояний, связанных с воспалением кишечника (таких как болезнь Крона, язвенный колит, воспалительное заболевание кишечника, а также синдром раздражнного кишечника), атеросклероза, рассеянного склероза, болезни Альцгеймера, сосудистой деменции, лгочных воспалительных заболеваний (таких как астма, хроническая обструктивная болезнь лгких и острый респираторный дистресс-синдром), фиброзирующие болезни (включая идиопатический лгочный фиброз, фиброз сердца и системный склероз (склеродермия, воспалительных заболеваний кожи (таких как контактный дерматит, атопический дерматит и псориаз), синдрома системной воспалительной реакции, сепсиса, воспалительных и аутоиммунных состояний печени (таких как аутоиммунный гепатит, первичный билиарный цирроз печени, алкогольная болезнь печени, склерозирующий холангит и аутоиммунный холангит), диабет (типа I или II) и/или осложнений, вызванных диабетом,хронической сердечной недостаточности, застойной сердечной недостаточности, ишемических болезней(таких как инсульт и ишемическое реперфузионное повреждение) и инфаркта миокарда и/или осложнений после такого инфаркта. Полагают, что соединения по изобретению особенно полезны при лечении или профилактике васкулита, включая, но без ограничения, гигантоклеточный артериит, синдром дуги аорты (синдром Такаясу), нодозный полиартериит, болезнь Кавасаки, грануломатоз Вегенера, синдром Черджа-Строса, микроскопическая ангиопатия, болезнь Шенлейн-Геноха, криоглобулинемия, лейкоцитокластический ангиит и первичный ангиит центральной нервной системы. Считается, что соединения согласно данному изобретению особенно полезны для лечения ревматоидного артрита, хронического обструктивого заболевания лгких и атопического дерматита. С учтом данных, приведнных во введении к данной заявке, о том, что VAP-1 активируется в случае нескольких видов рака, включая рак желудка, меланому, гепатому и опухоли головы и шеи, и что у мышей с ферментативно неактивным VAP-1 меланомы растут гораздо медленнее, и с учтом связи между VAP-1 и ангиогенезом ожидают, что соединения согласно данному изобретению будут антиангиогенными и, следовательно, будут полезны при лечении раковых заболеваний путм ингибирования роста опухолей. Таким образом, данное изобретение включает соединения формулы (I), указанной выше, пригодные для лечения или профилактики упомянутых выше болезней и состояний. Настоящее изобретение также включает применение указанных соединений в изготовлении лекарственного средства для лечения или предотвращения указанных выше состояний и болезней. Помимо этого, настоящее изобретение включает способы лечения или предотвращения таких состояний и болезней, которые включают введение млекопитающему, включая человека, нуждающегося в таком лечении, эффективного количества соединения,описанного выше. Способы, предусмотренные данным изобретением, включают способы, когда субъект идентифицируется как нуждающийся в конкретном необходимом лечении. Идентификация субъекта на предмет необходимости лечения может быть произведена субъектом или профессиональным работником здравоохранения и может быть субъективной (например, мнением) или объективной (например, на основании теста или метода диагностики). Согласно другим аспектам заявленные способы включают также мониторинг ответа субъекта на проведение лечения. Такой мониторинг может включать периодический отбор образцов ткани субъекта,жидкостей, проб, клеток, белков, химических маркров, генетических материалов и т.д. в качестве маркров или индикаторов схемы лечения. В случае других методов субъекта подвергают скринингу или идентификации, как это необходимо для такого лечения, путм оценки пригодности релевантных маркра или индикатора для такого лечения. Согласно одному из вариантов данного изобретения оно предусматривает способ мониторинга процесса лечения. Этот способ включает стадию определения уровня диагностического маркра (маркра)(например, любой мишени или любого типа клетки, предусмотренных данным изобретением, модулированных соединением по изобретению) или диагностического измерения (например, анализа, скрининга) у субъекта, страдающего или восприимчивого к расстройству или его симптомам, которые описаны в данной заявке, при этом субъекту вводят терапевтическое количество соединения по изобретению для лечения болезни или е симптомов. Уровень маркра, определнного использованным методом, можно сравнить с известными уровнями маркра или у здоровых субъектов, или у других больных пациентов для того, чтобы установить статус болезни больного. Согласно предпочтительным вариантам второй уровень маркра у субъекта определяется в более поздний момент времени по сравнению с моментом времени определения первого уровня и эти два показателя сравнивают для мониторинга течения болезни или эффективности терапии. Согласно некоторым предпочтительным вариантам уровень маркра у субъекта перед началом лечения определяется до начала лечения согласно данному изобретению; этот уровень маркра до проведения лечения затем можно сравнить с уровнем маркра у субъекта после начала лечения для определения эффективности лечения. Согласно некоторым вариантам способа уровень маркра или активность маркра у субъекта определяют по меньшей мере один раз. Сравнение уровней маркра, например, с уровнем маркра, полученным ранее или впоследствии у того же самого пациента, другого пациента или здорового субъект, может быть полезным для определения наличия желательного эффекта от применяемого лечения и затем регулирования схемы лечения. Определение уровней маркра может быть проведено с помощью любого подходящего метода отбора образцов/экспрессии, известного из уровня техники или описанного в данной заявке. Предпочтительно, если вначале у субъекта удаляют образец ткани или жидкости. Примеры подходящих образцов включают кровь, мочу, ткань, клетки из ротовой полости или щеки и образцы волос с корнями. Другие подходящие виды образцов известны специалистам в данной области техники. Определение уровней белков и/или уровней мРНК (например, уровня маркра) в образце можно осуществлять любым подходящим методом, известным из уровня техники, включая, но без ограничения, иммуноферментный анализ, ELISA, методы введения радиометки/анализа, блоттинга/хемилюминесценции,ПЦР в режиме реального времени и т.п. Композиции Один из предпочтительных вариантов данного изобретения относится к фармацевтической композиции, содержащей соединение формулы (I) вместе с одним или более фармацевтически приемлемыми носителями и/или эксципиентами. Для клинического применения соединения по изобретению вводятся в состав фармацевтических композиций для различных методов введения. Следует отметить, что соединения по изобретению можно вводить вместе с физиологически приемлемым носителем, эксципиентом или разбавителем. Фармацевтические композиции по данному изобретению могут вводиться любым подходящим путм, предпочтительно оральным, ректальным, назальным, топическим (включая буккальный и подъязычный), подъязычным, трансдермальным, интратекальным. через слизистую оболочку или парентеральным методом(включая подкожный, внутримышечный, внутривенный и интрадермальный). Другие составы могут выпускаться в виде стандартных лекарственных форм, например в виде таблеток и капсул с пролонгированным высвобождением и в виде липосом, и могут быть приготовлены любыми методами, применяемыми в фармации. Фармацевтические составы обычно готовят путм смешения активного вещества с обычными фармацевтически приемлемыми носителями, разбавителями или эксципиентами. Примеры эксципиентов включают воду, желатин, гуммиарабик, лактозу, микрокристаллическую целлюлозу, крахмал, натрия крахмалгликолят, кислый фосфат кальция, стеарат магния, тальк,коллоидный диоксид кремния и т.п. Такие составы могут также содержать другие фармакологически активные агенты и обычные добавки, такие как стабилизаторы, смачивающие агенты, эмульгаторы, ароматизирующие вещества, буферные вещества и т.п. Обычно количество активных соединений находится между 0,1 и 95 вес.% в расчте на препарат, предпочтительно оно составляет 0,2-20 вес.% в препаратах для парентерального введения и более предпочтительно оно равно 1-50 вес.% в препаратах для орального введения. Эти составы могут быть приготовлены известными методами, такими как гранулирование, сжатие,микроинкапсулирование, покрытие при распылении и т.д. Такие составы могут быть приготовлены обычными способами в виде таких лекарственных форм, как таблетки, капсулы, гранулы, порошки, сиропы, суспензии, суппозитории или составы для инъекций. Жидкие составы могут быть получены путм растворения или суспендирования активного вещества в воде или в другом подходящем носителе. На таблетки и гранулы обычным методом могут быть нанесены покрытия. Для поддержания эффективной концентрации в плазме крови в течение длительного времени соединения по изобретению могут быть введены в составы с замедленным высвобождением. Величина дозы и частота дозирования конкретного соединения будет зависеть от ряда факторов,включая активность применяемого конкретного соединения, метаболическую стабильность и продолжительность действия этого соединения, возраст пациента, вес пациента, общее состояние здоровья, пол,питание, метод и время введения, скорость выделения, комбинации лекарств, степень серьзности состояния, которое подвергается лечению, а также курс лечения пациента. Дневная доза может, например,быть равна от примерно 0,001 до примерно 100 мг на 1 кг веса пациента при однократном введении или при применении многократных доз, например от примерно 0,01 до примерно 25 мг каждой дозы. Обычно такая дозировка применяется орально, но может быть выбрано и парентеральное введение. Получение соединений по изобретению Соединения формулы (I) могут быть получены обычными способами или по аналогии с ними. Получение промежуточных соединений и соединений в примерах по данному изобретению может быть, в частности, показано на следующих схемах. Определение переменных радикалов в структурах на схемах соответствует радикалам в соответствующих положениях в формулах, приведнных в данной заявке. Схема 1 Общий способ синтеза соединений формулы (Ia) где W,Y, Z, Q, R1 и R3 имеют значения, указанные для соединений формулы (I). Соединения общей формулы (Ia) могут быть легко получены из 1H-пирроло[2,3-с]пиридинов (IIa) или путм введения кольца Q (или защищенного кольца Q) с последующим введением R1, или при обратном применении этих стадий с получением промежуточных соединений общей формулы (IIIa). Соединения общей формулы (IIIa) затем могут быть превращены в соединения общей формулы (Ia) с помощью стандартных синтетических способов. Например, конденсация 1H-пирроло[2,3-с]пиридинов (IIa) с трет-бутил-4-оксопиперидин-1-карбоксилатом, восстановление, введение R1 путм арилирования и снятия Вос-защиты могут быть использованы для получения соединений общей формулы (IVa). Функционализация соединений общей формулы (IVa), например, путм образования мочевины, сочетания амида или восстановительного аминирования приведт к получению соединений общей формулы (Ia). Схема 2 Общий способ получения соединений формулы (Ib) где W, Y, Z, R1 и R2 имеют значения, указанные для соединений формулы (I). Соединения общей формулы (Ib) могут быть легко получены из броминдолов (IIb) или путм введения радикала R2 (например, путм нуклеофильного замещения) с последующим введением R1 (например, по реакции Сузуки), или путм обратного проведения этих стадий (с применением соответствующих способов защиты). Схема 3 Общий способ получения соединений формулы (Ic) где Y, Z, R1 и R2 имеют значение, указанное для соединений формулы (I). Соединения общей формулы (Ic) могут быть легко получены путм восстановительного аминирования 3-аминопиридин-4-карбальдегидов общей формулы (IIc) с получением соединений общей формулы (IIIc) и последующей циклизации с получением пиразоло[3,4-с]пиридинов общей формулы (IVc). Или же пиразоло[3,4-с]пиридины общей формулы (IVc) могут быть получены путм циклизации (3 фторпиридин-4-ил)карбонильных соединений общей формулы (Vc) в присутствии гидразина. Соединения общей формулы (Ic) могут быть приготовлены из соединений общей формулы (IVc) с помощью стандартных реакций N-арилирования. Схема 4 Общий способ получения соединений общей формулы (Id) где W, Y, R1 и R2 имеют значения, указанные для формулы (I). Соединения общей формулы (Id) могут быть легко получены стандартными методами, известными из научной литературы, например литированием 7-бром-4-хлор-5 Н-пирроло[3,2-d]пиримидинов (IId) и реакцией с альдегидом с последующим восстановлением и затем введением радикала R1 (например, по реакции арилирования). Такие способы известны специалистам в данной области, см., например, заявку WO 2008/070507, а также публикацию Antilla et al., JOC, 69, 5578, 2004. Схема 5 Общий способ получения соединений формулы (Ie) где Y, R1 и R2 имеют значения, указанные для соединений формулы (I). Соединения общей формулы (Ie) могут быть легко получены в соответствии со стандартными способами, известными из научной литературы, например путм конденсации 5-хлорпиримидинов (IIe) с амидом Вайнреба и последующей реакции с гидразином. Такие способы известны специалистам в данной области, например, см. заявку WO 2003/039469 и публикацию Verma et al., Tet. Lett., 50, 383, 2009. Схема 6 Общий способ получения соединений формулы (If) где Y, Z, R1 и R2 имеют значение, указанное для соединений формулы (I). Соединения общей формулы (If) могут быть легко получены путм конденсации пиразин-2- 15023803 карбонитрилов с реактивом Гриньяра с образованием аминных промежуточных соединений (IIf). Функционализация аминов (IIf) с образованием амидов или мочевин общей формулы (IIIf) и циклизация с оксихлоридом фосфора приводит к получению соединений общей формулы (If). Схема 7 Общий способ получения соединений формулы (Ig) где W, Z, R1 и R2 имеют значение, указанное для соединений формулы (I). Соединения общей формулы (Ig) могут быть получены из 1H-пирроло[2,3-d]пиридазинов (IIg) путм бромирования при помощи CuBr (например, как описано в публикации Gallou et al., Syn. Lett., 2, 211214, 2007) и последующего введения радикала R1 (например, путм проведения арилирования) и R2 (например, по реакции Бухвальда-Хартвига). Схема 8 Общий способ получения соединений формулы (Ih) где Y, Z, R1 и R2 имеют значение, указанное для соединений формулы (I). Соединения общей формулы (Ih) могут быть получены путм последовательного алкилирования 1 Н,2 Н,3 Н-имидазо[4,5-с]пиридин-2-онов (IIh), например, как описано в заявке WO 2008/054749. Схема 9 Общий способ получения соединений формулы (Ii) где W, Y, Z, R1 и R2 имеют значение, указанное для соединений формулы (I). Соединения общей формулы (Ii) могут быть получены из 1 Н-пирроло[2,3-d]пиридазинов (IIi) путм бромирования с помощью CuBr (например, как описано в публикации Gallou et al., Syn. Lett., 2, 211-214,2007) с последующим введением радикала R2 (например, путм нуклеофильного замещения) и с последующим введением радикала R1 (например, по реакции Сузуки) или при обратном проведении этих стадий (с применением соответствующих способов защиты). Схема 10 Общий способ получения соединений формулы (Ij) где W, Z, R1 и R2 имеют значение, указанное для соединений формулы (I). Соединения общей формулы (Ij) могут быть получены из 1H-пирроло[2,3-d]пиридазинов (IIj) путм бромирования с помощью CuBr (например, как описано в публикации Gallou et al., Syn. Lett., 2, 211-214,2007) с последующим введением радикала R2 (например, путм нуклеофильного замещения) и радикалаR1 (например, по реакции Сузуки) или при обратном проведении этих стадий (с применением соответствующих способов защиты). Схема 11 Общий способ получения соединений формулы (Ik) где Y, Z, R1 и R2 имеют значение, указанное для соединений формулы (I). Соединения общей формулы (Ik) могут быть получены путм циклизации соединений общей формулы (IIk) с гидразинами, например, как описано в публикации Deeb et al., Journal of the Chinese ChemicalSociety, 37(3), 287-94; 1990. Схема 12 Общий способ получения соединений формулы (II) где Z, R1 и R2 имеют значение, указанное для соединений формулы (I). Соединения общей формулы (II) могут быть получены путм циклизации соединений общей формулы (III) с гидразинами, например, как описано в публикации Haider et al., Journal of the Chemical Society, Perkin Transactions 1: Organic and Bio-Organic Chemistry, 1, 169-72; 1986. Схема 13 Общий способ получения соединений формулы (Im) где W, Y, R1 и R2 имеют значение, указанное для соединений формулы (I). Соединения общей формулы (Im) могут быть получены путм последовательного алкилирования/арилирования 7 Н-пирроло[2,3-d]пиримидинов (IIm), например, как описано в заявке WO 2009/080682. Схема 14 Общий способ получения соединений формулы (In) где Y, Z, R1 и R2 имеют значение, указанное для соединений формулы (I). Соединения общей формулы (In) могут быть получены циклизацией соединений общей формулыChemistry, 73(10), 3900-3906, 2008. Схема 15 Общий способ получения соединений формулы (Io) где Z, R1 и R2 имеют значение, указанное для соединений формулы (I). Соединения общей формулы (Io) могут быть получены, как показано на схеме 15, например, как описано в публикации Haider et al., Journal of the Chemical Society, Perkin Transactions 1: Organic and BioOrganic Chemistry, 1, 169-72; 1986. Схема 16 Общий способ получения соединений формулы (Ip) где R1 и R2 имеют значение, указанное для соединений формулы (I). Соединения общей формулы (Ip) могут быть получены, как показано на схеме 16, например, как описано в заявке WO 2007/134828. Соединение формулы (I) может быть также превращено в другое соединение формулы (I) способами, включающими одну или более стадий. Далее могут быть использованы следующие сокращения: Ас - ацетил,Ac2O - уксусный ангидрид,АсОН - уксусная кислота,aq - водный,Ar - арил,Boc - трет-бутилкарбонил,nBuLi - н-бутиллитий,calcd - вычислено,CDI - карбонилдиимидазол,conc - концентрированный,d - день,DCE - дихлорэтан,DCM - дихлорметан,DIBALH - диизобутилалюминийгидрид,DIPEA - диизопропилэтиламин,DMAP - 4-диметиламинопиридин,DMF - диметилформамид,EDC - 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорид,ES+ - ионизация электрораспылением,EtOAc - этилацетат,EtOH - этанол,Ех - пример,h - час(ы),HBTU - О-бензотриазол-N,N,N',N'-тетраметил-уроний-гексафторфосфат,- 18023803HOBt - 1-гидроксибензотриазолгидрат,HPLC - высокоэффективная жидкостная хроматография,HRMS - масс-спектрометрия с высоким разрешением,Int - промежуточное соединение,LCMS - жидкостная хроматография в тандеме с масс-спектроскопией,LDA - диизопропиламид лития,М - молярный,Me - метил,mCPBA - метахлорбензойная кислота,MeCN - ацетонитрил,МеОН - метанол,min - минута(ы),Ms - метансульфонат,MS - масс-спектроскопия,NaBH(OAc)3 - триацетоксиборгидрид натрия,NIS - N-йодсукцинимид,NMP - N-метилпирролидон,Rf - время удерживания,RT - комнатная температура,sat - насыщенный,SCX - сильный катионобменный,SM - исходный материал,TFA - трифторуксусная кислота,THF - тетрагидрофуран. Примеры и получение промежуточных соединений Экспериментальные методы. Реакции проводили при комнатной температуре, если не оговаривалось иное. Реакции при облучении микроволнами проводили в микроволновом реакторе Biotage, используя ампулы, снабжнные алюминиевыми крышками и перегородками. Гидрирование проводили, используя проточный реактор ThalesH-Cube. Препаративную флэш-хроматографию осуществляли на колонке Merck с силикагелем 60 (230400 меш) или использовали систему Flash Master Personal system, снабжнную гигатрубками из оксида кремния Strata SI-1, или используя систему CombiFlash Companion system, снабжнную колонками с силикагелем RediSep. Высокоэффективную хроматографию на колонках проводили в системе Gilson system (насос Gilson 321 и коллектор фракций Gilson FC204), снабжнной колонками Merck LiChroprep RP-18 (40-63 мкм). Обращнно-фазовую высокоэффективную жидкостную хроматографию проводили в системе Gilson с УФ-детектором, снабжнной колонками Phenomenex Synergi Hydro RP 15010 мм, или YMC ODS-A 100/15020 мм. Самые чистые фракции собирали, концентрировали и сушили под вакуумом. Соединения обычно сушили в вакуумной печи при температуре 40 С до определения степени чистоты. Анализ соединений проводили методом HPLC/LCMS, используя систему Agilent 1100 HPLC/масс-спектрометр(1504,6 мм, 4 мкм, 1,5 мл/мин, 30 С, градиент 5-100% MeCN (+0,085% TFA) в воде (+0.1% TFA) в течение 7 мин, 200-300 нм). Точные величины масс (HRMS) измеряли, используя Thermo Scientific LTQOrbitrap XL, снабжнный источником ионизации распылением Advio TriVersa NanoMate (во время проведения анализа калибровку проверяли по трм значениям масс. Спектры получали с ионизацией в режиме положительного электрораспыления. Полученные величины масс были в пределах m/z 100-2000. Образцы растворяли в DMSO с получением 10 мМ растворов, которые затем разбавляли с помощью МеОН или 10 мМ NH4OAc в МеОН до получения 0.1 М растворов до анализа. Полученные величины соответствуют протонированным молекулярным ионам [МН]+. Полученные соединения называли, используя версии программы ACD Name 6.0, 7.0 или 10.0. Промежуточное соединение 1. трет-Бутил-4-1H-пирроло[2,3-с]пиридин-3-ил-1,2,3,6-тетрагидропиридин-1-карбоксилат 6-Азаиндол (4,48 г, 37,9 ммоль) растворяли в МеОН (70 мл) и добавляли KOH (4,68 г, 83,4 ммоль) и трет-бутил-4-оксопиперидин-1-карбоксилат (8,31 г, 41,7 ммоль). Реакционную смесь нагревали при температуре 70 С в течение 18 ч. Остаток распределяли между водой (250 мл) и DCM (250 мл) и водную фазу экстрагировали DCM (2250 мл). Объединнные органические фракции высушивали (MgSO4) и концентрировали в вакууме (in vacuo) с получением титульного соединения в виде жлтой пены (11,3 г,99%). LCMS (ES+): 300.1 [МН]+. Промежуточное соединение 2. трет-Бутил-4-1H-пирроло[2,3-с]пиридин-3-илпиперидин-1 карбоксилат Промежуточное соединение 1 (11,3 г, 37,7 ммоль) растворяли в EtOH (200 мл) и гидрировали над 10% Pd/C в реакторе H-cube при температуре 90 С и давлении 90 бар. Реакционную смесь концентрировали под вакуумом с получением титульного соединения в виде жлтого тврдого вещества (11,1 г, 97%). Промежуточное соединение 2 (11,1 г, 36,7 ммоль) растворяли в DMF (60 мл) и в атмосфере азота добавляли 1-хлор-4-йодбензол (10,5 г, 44,0 ммоль), N,N'-диметилэтилендиамин (789 мкл, 7,33 ммоль),K3PO4 (16,3 г, 77,0 ммоль) и CuI (698 мг, 3,67 ммоль). Реакционную смесь нагревали при облучении микроволнами при температуре 160 С в течение 20 мин и концентрировали под вакуумом. Остаток распределяли между водой (250 мл) и DCM (250 мл) и водную фазу экстрагировали DCM (2250 мл). Соединнные органические фракции высушивали (MgSO4) и концентрировали под вакуумом. Полученный остаток очищали путм колоночной хроматографии с получением титульного соединения в виде тврдого вещества жлтого цвета (6,86 г, 45%). LCMS (ES+): 411,9 [МН]+, HPLC: Rt 5,91 мин, степень чистоты 76%. Промежуточное соединение 4. 4-[1-(4-Хлорфенил)-1 Н-пирроло[2,3-с]пиридин-3-ил]пиперидин Промежуточное соединение 3 (6.86 г, 16,6 ммоль) растворяли в DCM (200 мл) и TFA (50 мл) и перемешивали в течение 2 ч. Растворители удаляли под вакуумом и полученный остаток растворяли в 1 М водного раствора Na2CO3 (200 мл) и экстрагировали DCM (3200 мл). Соединнные органические фракции высушивали (MgSO4) и концентрировали под вакуумом. Полученный остаток очищали путм колоночной хроматографии с получением титульного соединения в виде красной смолы (3,18 г, 61%). LCMSCDI (936 мг, 5,77 ммоль) растворяли в DCM (50 мл), добавляли раствор трет-бутил-4(аминометил)пиперидин-1-карбоксилата (1,24 г, 5,77 ммоль) и DIPEA (1,25 мл, 7,22 ммоль) в DCM (10 мл) и полученную реакционную смесь перемешивали в течение 18 ч. Добавляли раствор промежуточного соединения 4 (1,50 г, 4,81 ммоль) и DIPEA (1,25 мл, 7,22 ммоль) в DCM (10 мл) и полученную реакционную смесь перемешивали в течение 24 ч, разбавляли 1 М водным раствором Na2CO3 (100 мл) и экстрагировали DCM (3100 мл). Соединнные органические фракции высушивали (MgSO4) и концентрировали под вакуумом. Полученный остаток очищали путм колоночной хроматографии, растворяли в DCM(10 мл) и TFA (2,5 мл) и перемешивали в течение 1 ч. Реакционную смесь концентрировали под вакуумом и остаток растворяли в 1 М водном растворе Na2CO3 (50 мл) и экстрагировали DCM (350 мл). Соединнные органические фракции высушивали (MgSO4) и концентрировали под вакуумом. Полученный остаток очищали путм колоночной хроматографии с получением титульного соединения в виде тврдо- 20023803 го вещества бледно-жлтого цвета (1,41 г, 65%). LCMS (ES+): 452,0 [МН]+ HPLC: Rt 3,98 мин, степень чистоты 97%. Промежуточное соединение 6. N-(3-аминопропил)-4-[1-(4-хлорфенил)-1 Н-пирроло[2,3-с]пиридин 3-ил]пиперндин-1-карбоксамид Промежуточное соединение 6 (178 мг, 8%) получали аналогично получению промежуточного соединения 5, применяя трет-бутил-N-(3-аминопропил)карбамат вместо трет-бутил-4-(аминометил)пиперидин-1-карбоксилата. LCMS (ES+): 412,3 [МН]+. HPLC: Rt 3.82 мин, степень чистоты 100%. Промежуточное соединение 7. трет-Бутил-N-(4-[(3-аминопириднн-4-ил)метил]морфолин-2 илметил)карбамат 3-Аминопиридин-4-карбальдегид (513 мг, 4,20 ммоль) растворяли в DCE (7,3 мл) и добавляли третбутил-(морфолин-2-илметил)карбамат (999 мг, 4,62 ммоль) и NaBH(OAc)3 (1,07 г, 5,04 ммоль). Реакционную смесь нагревали при помощи микроволн при температуре 60 С в течение 5 мин, разбавляли DCM(10 мл) и резко охлаждали насыщенным водным раствором Na2CO3 (5 мл). Водную фазу экстрагировали DCM (320 мл) и соединнные органические фракции высушивали(MgSO4) и концентрировали под вакуумом с получением титульного соединения в виде смолы жлтого цвета (1,37 г, 100%). LCMS (ES+): 323,1 [МН]+. Промежуточное соединение 8. трет-Бутил-N-[(4-1 Н-пиразоло-[3,4-с]пиридин-3-илморфолин-2 ил)метил]карбаматNaNO2 (290 мг, 4,20 ммоль) в воде (438 мкл). Полученную реакционную смесь перемешивали в течение 5 мин и концентрировали под вакуумом. Остаток растворяли в EtOAc (40 мл) и промывали насыщенным водным раствором Na2CO3 (220 мл). Органическую фракцию высушивали (MgSO4) и концентрировали под вакуумом с получением неочищенного титульного соединения в виде смолы жлтого цвета (999 мг, 71%). LCMS (ES+): 334,0 Промежуточное соединение 8 (999 мг, 3,00 ммоль) растворяли в DMF (4 мл) и добавляли 1-метил-4 йодбензол (784 мг, 3,60 ммоль), N,N'-диметилэтилендиамин (64,5 мкл, 0,60 ммоль), K3PO4 (1,34 г, 6,29 ммоль) и CuI (57,1 мг, 0,30 ммоль). Реакционную смесь нагревали при облучении микроволнами при температуре 140 С в течение 20 мин. Растворители удаляли под вакуумом и остаток очищали методом колоночной хроматографии с получением неочищенного титульного соединения, указанного в заголовке,в виде смолы жлтого цвета (438 мг, 35%). LCMS (ES+): 424,0 [МН]+. Промежуточное соединение 10. 4-[1-(4-Метилфенил)-1H-пиразоло[3,4-с]пиридин-3-ил]морфолин 2-илметанамина дигидрохлорид Промежуточное соединение 9 (438 мг, 1,03 ммоль) растворяли в 1,25 М HCl в EtOH (10 мл) и перемешивали в течение ночи. Растворители удаляли под вакуумом с получением неочищенного титульного соединения в виде смолы оранжевого цвета (400 мг, 98%). LCMS (ES+): 324,0 [МН]+. Промежуточное соединение 11. трет-Бутил-2-[(ацетилокси)метил]морфолин-4-карбоксилат Ас 2 О (5,17 мл, 54,7 ммоль) растворяли в DCM (200 мл), добавляли DMAP (611 мг, 5,00 ммоль),DIPEA (9,52 мл, 54,7 ммоль) и трет-бутил-2-(гидроксиметил)морфолин-4-карбоксилат (10,0 г, 49,7 ммоль) и перемешивали полученную реакционную смесь в течение 1 ч. Эту реакционную смесь промывали насыщенным водным раствором NH4Cl (3100 мл) и экстрагировали водные фракции при помощиDCM (2100 мл). Соединнные органические фракции высушивали (MgSO4) и концентрировали под вакуумом с получением титульного соединения в виде тврдого вещества почти белого цвета (14,1 г). Промежуточное соединение 11 (12,8 г, 49,5 ммоль) растворяли в TFA (20 мл) и DCM (80 мл) и перемешивали полученную реакционную смесь в течение ночи и затем концентрировали под вакуумом. Полученный остаток растворяли в DCE (80 мл), охлаждали до 0 С и по каплям добавляли Et3N (6,90 мл,49,5 ммоль). Затем добавляли 3-аминопиридин-4-карбальдегид (6,04 г, 49,5 ммоль) и МеОН (50 мл) и эту реакционную смесь перемешивали в течение 30 мин. Порциями добавляли NaBH(OAc)3 (12,6 г, 59,4 ммоль) и реакционную смесь перемешивали в течение ночи. Затем порциями добавляли 3-аминопиридин-4-карбальдегид (6,04 г, 49,5 ммоль) и NaBH(OAc)3 (25,2 г, 119 ммоль). Полученную реакционную смесь перемешивали при температуре 60 С в течение 30 ч, охлаждали до 0 С, реакцию обрывали насыщенным водным раствором Na2CO3 (50 мл) и разбавляли DCM (100 мл). Органическую фракцию промывали насыщенным водным раствором Na2CO3 (20 мл) и насыщенным водным раствором NH4Cl (220 мл), сушили (MgSO4) и концентрировали под вакуумом. Полученный остаток очищали путм фильтрации через диоксид кремния с получением неочищенного титульного продукта в виде смолы жлтого цвета (5,77 г, 44%). LCMS (ES+): 266,1 [МН]+. Промежуточное соединение 13. (4-1H-пиразоло[3,4-с]пиридин-3-илморфолин-2-ил)метилацетат Промежуточное соединение 12 (5,77 г, 21,8 ммоль) растворяли в АсОН (282 мл), охлаждали до 0 С и добавляли раствор NaNO2 (1,50 г, 21,8 ммоль) в воде (2,29 мл). Реакционную смесь перемешивали в течение 5 мин и концентрировали под вакуумом. Полученный остаток растворяли в EtOAc (200 мл) и промывали насыщенным водным раствором Na2CO3 (2100 мл), высушивали (MgSO4) и концентрировали под вакуумом с получением титульного продукта в виде смолы жлтого цвета (3,85 г, 64%). LCMS Промежуточное соединение 13 (3,85 г, 13,9 ммоль) растворяли в DMF (20 мл) и добавляли 1-метил 4-йодбензол (3,64 г, 16,7 ммоль), N,N'-диметилэтилендиамин (300 мкл, 2,78 ммоль), K3PO4 (6,21 г, 29,2 ммоль) и CuI (265 мг, 1,39 ммоль). Полученную реакционную смесь нагревали в микроволновом реакторе при температуре 140 С в течение 1 ч и концентрировали под вакуумом. Остаток очищали методом колоночной хроматографии с получением продукта, указанного в заголовке, в виде смолы жлтого цвета Промежуточное соединение 13 (200 мг, 0,72 ммоль), 4-хлорфенилбороновую кислоту (226 мг, 1,45 ммоль), Cu(OAc)2 (263 мг, 1,45 ммоль) и пиридин (292 мкл, 3,62 ммоль) суспендировали в DCM (10 мл) и перемешивали в течение 36 ч. Реакционную смесь концентрировали под вакуумом с получением неочищенного титульного продукта в виде тврдого вещества жлтого цвета (80,0 мг, 29%). LCMS (ES+): 387,0(302 мг, 2,18 ммоль). Реакционную смесь перемешивали в течение 30 мин и концентрировали под вакуумом. Остаток растворяли в DCM (20 мл) и воде (10 мл) и водную фазу экстрагировали DCM (350 мл). Соединнные органические фракции высушивали (MgSO4) и концентрировали под вакуумом с получением титульного соединения в виде смолы тмно-коричневого цвета (168 мг, 95%). LCMS (ES+): 325,1 Промежуточное соединение 17 (65,0 мг, 91%) получали аналогично промежуточному соединению 16, используя промежуточное соединение 15 вместо промежуточного соединения 14. LCMS (ES+): 345,0 Промежуточное соединение 16 (292 мг, 0,90 ммоль) растворяли в DCM (7 мл), охлаждали до 0 С и добавляли Et3N (138 мкл, 0,99 ммоль) и метансульфонилхлорид (76,6 мкл, 0,99 ммоль). Реакционную смесь перемешивали в течение 1 ч, разбавляли DCM (10 мл) и промывали насыщенным водным раствором NH4Cl (25 мл) и насыщенным водным раствором Na2CO3 (25 мл). Органическую фракцию высушивали (MgSO4) и концентрировали под вакуумом с получением титульного соединения в виде смолы коричневого цвета (277 мг, 77%). LCMS (ES+): 403,0 [МН]+. Промежуточное соединение 19. 4-[1-(4-Хлорфенил)-1H-пиразоло[3,4-с]пиридин-3-ил]морфолин-2 илметилметансульфонат Промежуточное соединение 19 (60,0 мг, 75%) получали аналогично промежуточному соединению 18, используя промежуточное соединение 17 вместо промежуточного соединения 16. LCMS (ES+): 422,9 3-Аминопиридин-4-карбальдегид (584 мг, 4,78 ммоль) растворяли в DCM (10 мл) и добавляли третбутил-4-(морфолин-2-илметил)пиперазин-1-карбоксилат (1,50 г, 5,26 ммоль) и NaBH(OAc)3 (1,11 г, 5,26 ммоль). Реакционную смесь нагревали в микроволновом реакторе при температуре 60 С в течение 2,5 мин, разбавляли DCM (20 мл) и реакцию обрывали насыщенным водным раствором Na2CO3 (10 мл). Органическую фракцию промывали насыщенным водным раствором NH4Cl (10 мл). Соединнные водные фракции экстрагировали DCM (220 мл) и соединнные органические фракции высушивали (MgSO4) и концентрировали под вакуумом с получением неочищенного титульного соединения в виде смолы жлтого цвета (2,46 г). LCMS (ES+): 392,1 [МН]+. Промежуточное соединение 21. трет-Бутил-4-[(4-1H-пиразоло[3,4-с]пиридин-3-илморфолин-2 ил)метил]пиперазин-1-карбоксилат Промежуточное соединение 20 (1,87 г, 4,76 ммоль) растворяли в АсОН (62 мл), охлаждали до 0 С и добавляли раствор NaNO2 (330 мг, 4,76 ммоль) в воде (502 мкл). Реакционную смесь перемешивали в течение 5 мин и концентрировали под вакуумом. Остаток растворяли в EtOAc (100 мл) и промывали насыщенным водным раствором Na2CO3 (250 мл). Органическую фракцию высушивали (MgSO4) и концентрировали под вакуумом с получением титульного соединения в виде смолы коричневого цвета (1,80 г, 93%). LCMS (ES+): 403,1 [МН]+. Промежуточное соединение 22. трет-Бутил-4-(4-[1-(4-хлорфенил)-1 Н-пиразоло[3,4-с]пиридин-3 ил]морфолин-2-илметил)пиперазин-1-карбоксилат Промежуточное соединение 21 (1,08 г, 2,69 ммоль), 4-хлорбензилбороновую кислоту (840 мг, 5,37 ммоль), Cu(ОАс)2 (976 мг, 5,37 ммоль) и пиридин (1,08 мл, 13,4 ммоль) суспендировали в DCE (19 мл) и перемешивали в течение ночи. Удаляли растворители под вакуумом и полученный остаток очищали методом колоночной хроматографии с получением титульного соединения в виде тврдого вещества бледно-жлтого цвета (58,0 мг, 4%). LCMS (ES+): 513,0 [МН]+ HPLC: Rt 4,81 мин, степень чистоты 97,1%. Промежуточные соединения 23-30. Промежуточные соединения 23-30 получали аналогично промежуточному соединению 20 путм восстановительного аминирования 3-аминопиридин-4-карбальдегида с помощью соответствующего амина; см. табл. 1 ниже. Таблица 1 Восстановительное аминирование 3-аминопиридин-4-карбальдегида(346 мг, 1,59 ммоль) и перемешивали полученную реакционную смесь в течение 1,5 ч. Реакционную смесь быстро охлаждали насыщенным водным раствором Na2CO3 (40 мл) и экстрагировали водную фракцию DCM (220 мл). Соединнные органические фракции промывали рассолом (30 мл), высушивали (MgSO4) и концентрировали под вакуумом с получением сырого титульного соединения в виде масла коричневого цвета (329 мг). LCMS (ES+): 337,0 [МН]+. Промежуточное соединение 32. трет-Бутил-4-(2-[(3-аминопиридин-4 ил)метил][(трет-бутокси)карбонил]аминоэтил)пиперазин-1-карбоксилат Промежуточное соединение 32 получали аналогично промежуточному соединению 31, применяя промежуточное соединение 26 вместо промежуточного соединения 25, с получением титульного соединения в виде масла коричневого цвета (409 мг, 54%). LCMS (ES+): 436,1 [МН]+. HPLC: Rt 4,18 мин, степень чистоты 93%. Промежуточные соединения 33-40. Промежуточные соединения 33-30 получали аналогично промежуточному соединению 21 путм циклизации 3-аминопиридинов 23-24 и 27-32 в присутствии NaNO2; см. табл. 2 ниже. Таблица 2 Циклизация 3-аминопиридинов Промежуточные соединения 41-43. Промежуточные соединения 41-43 получали аналогично промежуточному соединению 22 путм Nарилирования 1 Н-пиразоло[3,4-с]пиридинов; см. табл. 3 ниже. Таблица 3 Промежуточное соединение 41 (834 мг, 2.17 ммоль) растворяли в смеси 1:1 THF/вода (16 мл), добавляли LiOHH2O (200 мг, 4,77 ммоль) и перемешивали реакционную смесь в течение 3 ч. THF удаляли под вакуумом и подкисляли реакционную смесь до значения рН равного 1 с помощью 1 М водного раствора HCl (5 мл). Остаток собирали на фильтре и промывали водой с получением титульного соединения в виде тврдого вещества оранжевого цвета (450 мг, 53%). LCMS (ES+): 357,0 [МН]+ HPLC: Rt 4,92 мин,степень чистоты 99,6%. Промежуточное соединение 45. 4-(1-[1-(4-Хлорфенил)-1 Н-пиразоло[3,4-с]пирндин-3-ил]пиперидин-4-илкарбонил)морфолин(231 мг, 0,61 ммоль) и перемешивали реакционную смесь в течение 30 мин. Затем добавляли морфолин(53,4 мкл, 0,61 ммоль) и DIPEA (266 мкл, 1,53 ммоль) и перемешивали реакционную смесь в течение ночи. Удаляли растворители под вакуумом и полученный остаток разбавляли EtOAc (25 мл), промывали насыщенным водным раствором NH4Cl (425 мл), высушивали (MgSO4) и концентрировали под вакуумом. Полученный остаток очищали методом колоночной хроматографии с получением титульного соединения в виде тврдого продукта жлтого цвета (78,7 мг, 36%). HRMS (ESI+) рассчитано для Промежуточное соединение 46 получали аналогично промежуточному соединению 45, применяя трет-бутил-1-пиперазинкарбоксилат вместо морфолина, с получением титульного соединения в виде смолы жлтого цвета (260 мг, 97%). LCMS (ES+): 525,1 [МН]+. HPLC: Rt 6,14 мин, степень чистоты 100%. Промежуточное соединение 47. 1-[1-(4-Хлорфенил)-1H-пиразоло[3,4-с]пиридин-3-ил]пиперидин-2 карбоновой кислоты гидрохлорид Промежуточное соединение 47 получали аналогично промежуточному соединению 44, применяя промежуточное соединение 43 вместо промежуточного соединения 41, с получением сырого титульного соединения в виде тврдого продукта коричневого цвета (332 мг). LCMS (ES+): 357,0 [МН]+. Промежуточное соединение 48. 2-4-[1-(4-Хлорфенил)-1H-пиразоло[3,4-с]пиридин-3-ил]морфолин 3-илэтан-1-ол Соединение по примеру 40 (50,0 мг, 0,13 ммоль) растворяли в DCM (1 мл), охлаждали до 0 С и порциями добавляли DIBALH (0,78 мл, 1,0 М в гептане, 0,78 ммоль) в течение 6 дней. Реакционную смесь перемешивали в течение 1 недели, охлаждали до 0 С и обрывали реакцию путм добавления воды(1 мл). Реакционную смесь отфильтровывали и концентрировали под вакуумом с получением сырого титульного продукта в виде смолы жлтого цвета (51,0 мг). LCMS (ES+): 359,0 [МН]+. Промежуточное соединение 49. 2-4-[1-(4-Хлорфенил)-1H-пиразоло[3,4-с]пиридин-3-ил]морфолин 3-илэтилметансульфонат Промежуточное соединение 48 (50,0 мг, 0,14 ммоль) растворяли в DCM (1,5 мл), охлаждали до 0 С и добавляли Et3N (42,7 мкл, 0,31 ммоль) и метансульфонилхлорид (11,9 мкл, 0,15 ммоль). Реакционную смесь перемешивали в течение 20 ч, разбавляли DCM (5 мл), промывали насыщенным водным растворомNH4Cl (35 мл) и насыщенным водным раствором Na2CO3 (5 мл), высушивали (MgSO4) и концентрировали под вакуумом с получением титульного продукта в виде смолы тмно-жлтого цвета (60,0 мг, 99%). Промежуточное соединение 42 (80,0 мг, 0,19 ммоль) растворяли в HCl (1,25 М в EtOH, 10 мл) и полученную реакционную смесь перемешивали в течение 18 ч. Удаляли под вакуумом растворители с получением титульного соединения в виде тврдого вещества оранжевого цвета (76,0 мг, 100%). LCMS Промежуточное соединение 8 (290 мг, 0,87 ммоль), 4-хлорфенилбороновую кислоту (272 мг, 1,74 ммоль), безводный ацетат меди(II) (316 мг, 1,74 ммоль) и пиридин (350 мкл, 4,35 ммоль) суспендировали в DCM (12 мл) и перемешивали в течение 24 ч. Остаток растворяли в МеОН (15 мл) и очищали, применяя картридж SCX-2 и колоночную хроматографию с получением титульного соединения в виде тврдого вещества светло-жлтого цвета (100 мг, 26%). LCMS (ES+): 444,1 [МН]+. HPLC: Rt 6,01 мин, степень чистоты 84%. Промежуточное соединение 52. 4-[1-(4-Хлорфенил)-1 Н-пиразоло[3,4-с]пиридин-3-ил]морфолин-2 илметанамина дигидрохлорид Промежуточное соединение 52 получали аналогично промежуточному соединению 10, применяя промежуточное соединение 51 вместо промежуточного соединения 9, с получением титульного соединения в виде тврдого вещества оранжевого цвета (62.0 мг). LCMS (ES+): 344,1 [МН]+. Промежуточное соединение 53. трет-Бутил-N-[(3-аминопиридин-4-ил)метил]-N-[2-(2-оксоимидазолидин-1-ил)этил]карбамат 3-Аминопиридин-4-карбальдегид (0,86 г, 7,04 ммоль), 1-(2-аминоэтил)имидазолин-2-он (1,00 г, 7,74 ммоль) и АсОН (0,44 мл, 7,75 ммоль) растворяли в DCM (20 мл) и перемешивали в течение 1 ч. Добавляли NaBH(OAc)3 (2,24 г, 10,6 ммоль) и полученную реакционную смесь перемешивали в течение 3 ч и разбавляли DCM (10 мл) и водой (20 мл). Затем добавляли Na2CO3 (2,24 г, 21,1 ммоль) и дитретбутилдикарбонат (1,84 г, 8,45 ммоль) и реакционную смесь перемешивали в течение 20 ч. Водную фракцию экстрагировали DCM (50 мл) и соединнные органические фракции промывали насыщенным водным раствором NaHCO3 (40 мл), высушивали (MgSO4) и концентрировали под вакуумом. Остаток очищали методом колоночной хроматографии с получением титульного соединения (539 мг, 23%) в виде смолы жлтого цвета. LCMS (ES+): 336,2 [МН]+. Промежуточное соединение 54. трет-Бутил-N-[2-(2-оксоимидазолин-1-ил)этил]-N-1H-пиразоло Промежуточное соединение 54 получали аналогично промежуточному соединению 21, применяя промежуточное соединение 53 вместо промежуточного соединения 20, с получением титульного соединения в виде тврдого вещества светло-коричневого цвета (432 мг, 78%). LCMS (ES+): 347,2 [МН]+. Промежуточное соединение 55. трет-Бутил-N-[1-(4-хлорфенил)-1 Н-пиразоло[3,4-с]пиридин-3-ил]N-[2-(2-оксоимидазолин-1-ил)этил]карбамат Промежуточное соединение 55 получали аналогично промежуточному соединению 22, применяя промежуточное соединение 54 вместо промежуточного соединения 21, с получением титульного соединения в виде тврдого вещества жлтого цвета (74,0 мг, 13%). LCMS (ES+): 457,0 [МН]+ HPLC: Rt 5,33 мин, степень чистоты 100%. Пример 1. 4-[1-(4-Хлорфенил)-1H-пирроло[2,3-с]пиридин-3-ил]-1-(пирролидин-3-ил)пиперидин
МПК / Метки
МПК: C07D 471/04, A61P 35/00, A61P 29/00, A61K 31/437
Метки: ингибиторы, ферментов
Код ссылки
<a href="https://eas.patents.su/30-23803-ingibitory-fermentov.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы ферментов</a>
Предыдущий патент: Гербицидные соединения пиридазинона
Следующий патент: Оксабициклогептаны, их получение и применение
Случайный патент: Фармацевтическая композиция