Антипаразитарные соединения, способы и составы
Номер патента: 23711
Опубликовано: 29.07.2016
Авторы: Чэнь Лян, Дефо Джин Мари, У Вэньтао, Чзан Ян, Ань Цзенъюнь, Холмстром Скотт Дейл, Тан Чунчжи, Ху Пин, Уайт Уильям Хантер, Чэнь Шухуй
Формула / Реферат
1. Соединение формулы I или его соль
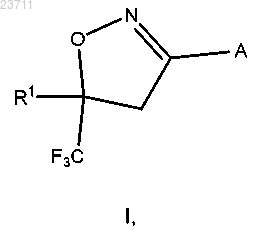
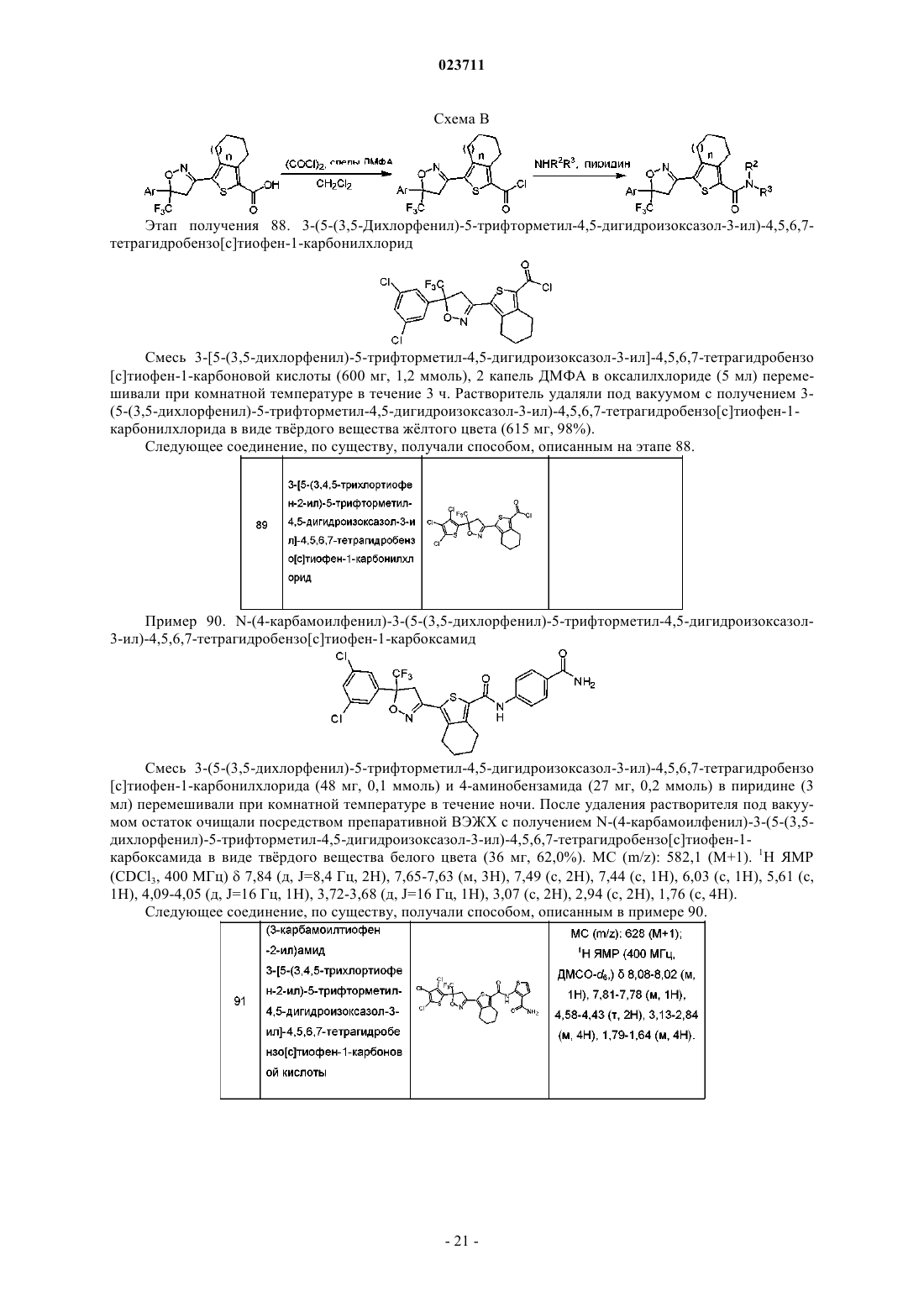
где А представляет собой
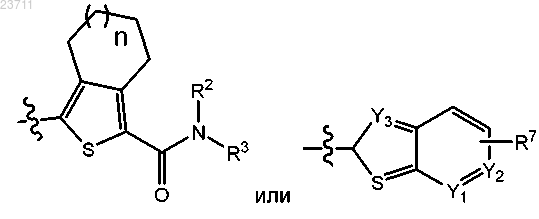
n составляет 0 или 1;
R1 представляет собой тиенил или фенил, причем указанные тиенил или фенил замещены 2 или 3 одинаковыми или различными атомами галогена;
R2, в каждом случае независимо, представляет собой водород, C1-C5 алкил, С3-С6 циклоалкил или C1-C5 галогеналкил;
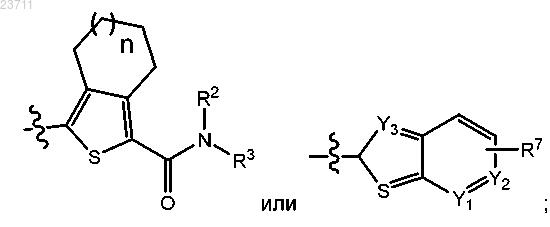
R3 представляет собой
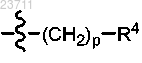
р, в каждом случае независимо, составляет 0 или 1;
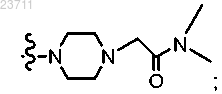
R4 представляет собой C1-C5 алкил, C1-C5 галогеналкил, C1-C5 цианоалкил, C1-C5 алкилтио, С3-С6 циклоалкил, необязательно замещенный гидрокси, галогеном или C1-C5 алкилом; С3-С5 циклогетероалкил, необязательно замещенный C1-C5 алкилом, С3-С6 циклоалкилом или C1-C5 галогеналкилом; фенил, тиенил, пиридинил или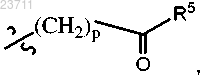
причем один из атомов углерода в указанных циклоалкилах, независимо, или в циклогетероалкиле может образовывать карбонильную группу, и указанный фенил, тиенил или пиридинил необязательно замещен галогеном или карбамоильной группой;
R5 представляет собой гидрокси, -О-(C1-C5 алкил) или
R6 представляет собой водород, C1-C5 алкил, C1-C5 галогеналкил, C1-C5 цианоалкил, C1-C5 алкилтио или С2-С5 алкинил;
или R2 и R3 совместно с атомом азота, к которому они присоединены, образуют
Y1, Y2 и Y3 представляют собой атом углерода или азота, причем не более чем один из Y1, Y2 и Y3 представляет собой атом азота, и в случае, если Y1, Y2 или Y3 представляет собой атом углерода, любой из них может быть замещен C1-C5 алкилом;
R7 представляет собой водород, галоген, C1-C5 алкил или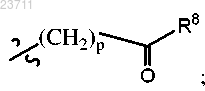 R8 представляет собой гидрокси, -О-(C1-C5 алкил) или
R8 представляет собой гидрокси, -О-(C1-C5 алкил) или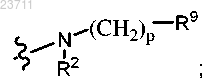 R9 представляет собой C1-C5 алкил,
R9 представляет собой C1-C5 алкил,
R10 представляет собой водород, C1-C5 алкил, C1-C5 галогеналкил, C1-C5 цианоалкил, C1-C5 алкилтио или С2-С5 алкинил.
2. Соединение по п.1 или его соль, отличающееся тем, что А представляет собой
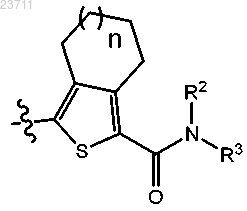
или

где R2 представляет собой водород, n составляет 1, a Y1 представляет собой азот.
3. Соединение по п.1 или 2 или его соль, отличающееся тем, что R3 представляет собой
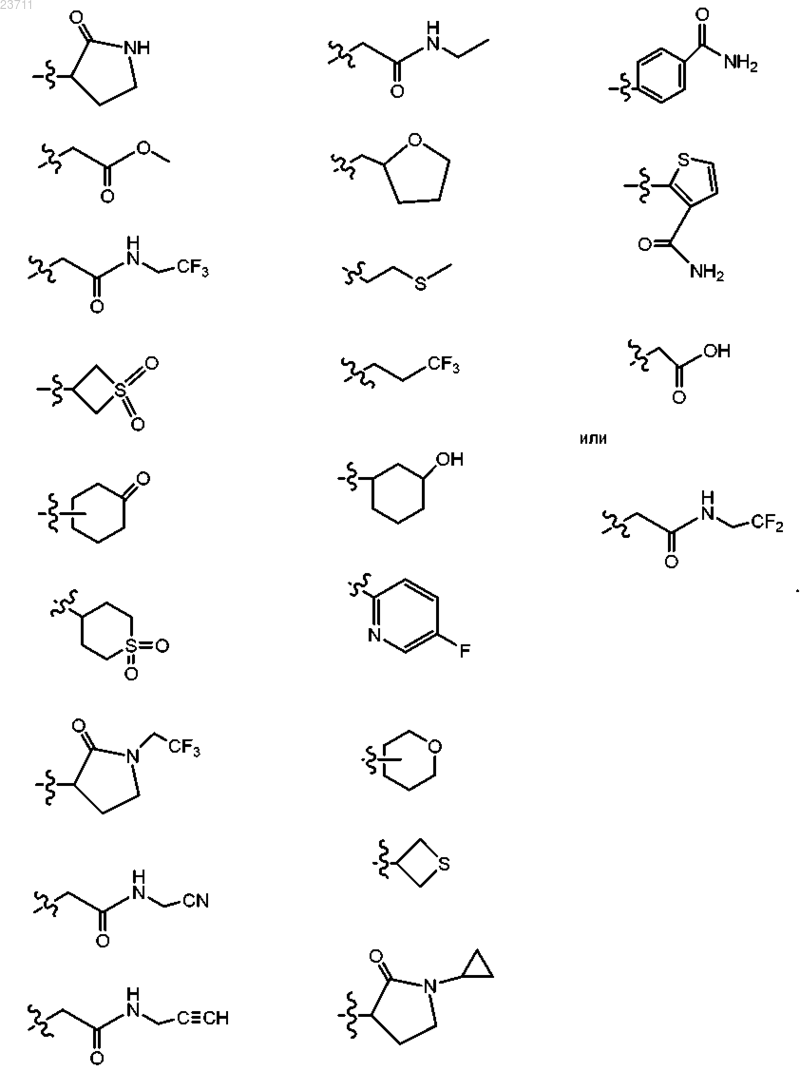
4. Соединение по п.1 или его соль, представляющее собой
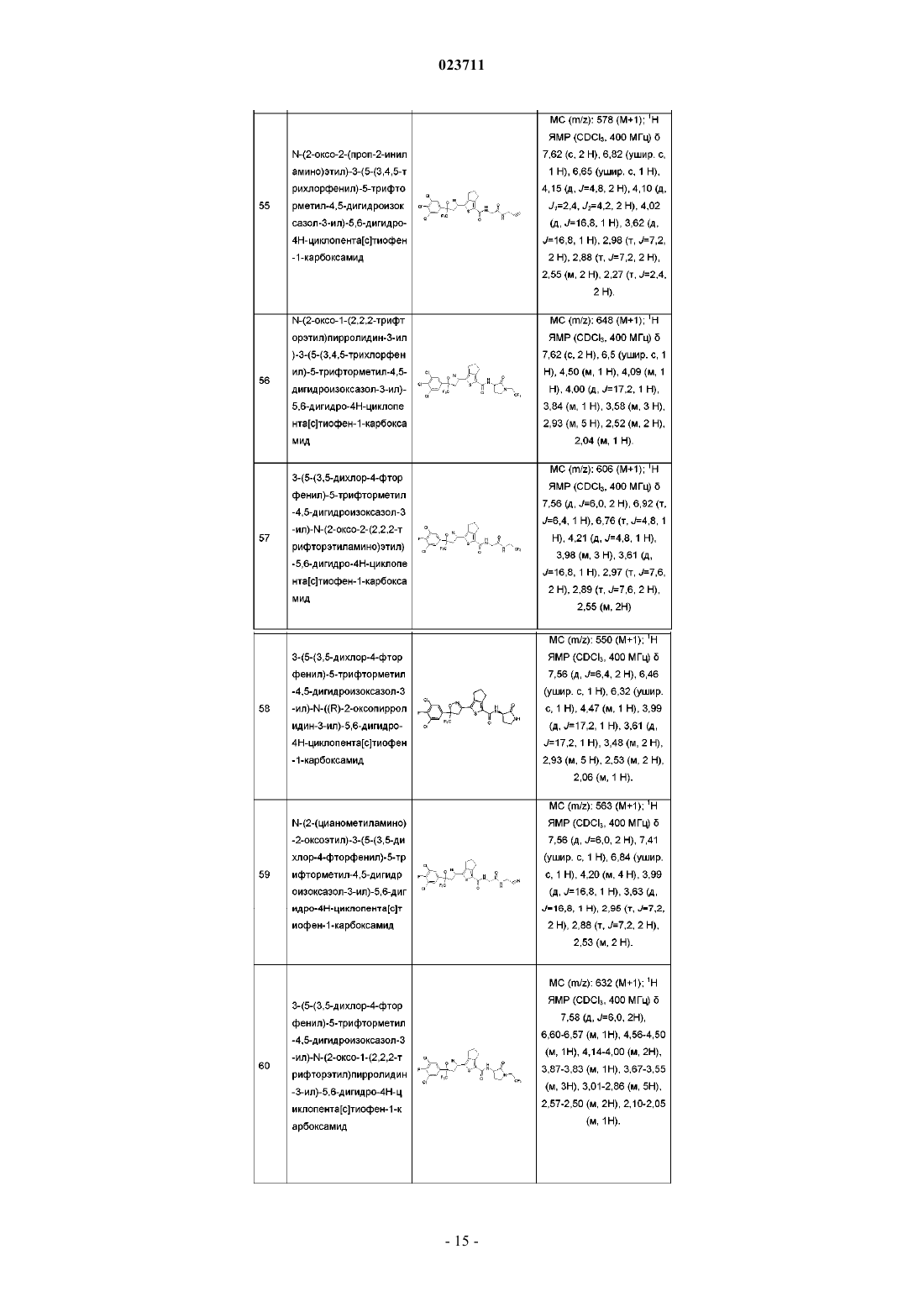
3-(5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-N-((R)-2-оксопирролидин-3-ил)-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоксамид;
N,N-диметил-2-(4-{3-[5-(3,4,5-трихлортиофен-2-ил)-5-трифторметил-4,5-дигидроизоксазол-3-ил]-4,5,6,7-тетрагидробензо[с]тиофен-1-карбонил}пиперазин-1-ил)ацетамид;
метиловый эфир ({3-[5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил]-4,5,6,7-тетрагидробензо[с]тиофен-1-карбонил}амино)уксусной кислоты;
метиловый эфир ({3-[5-(3,4,5-трихлортиофен-2-ил)-5-трифторметил-4,5-дигидроизоксазол-3-ил]-4,5,6,7-тетрагидробензо[с]тиофен-1-карбонил}амино)уксусной кислоты;
3-(5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-N-(2-оксо-2-(2,2,2-трифторэтиламино)этил)-5,6-дигидро-4Н-циклопента[с]тиофен-1-карбоксамид;
(1,1-диоксотиетан-3-ил)амид 3-[5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил]-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоновой кислоты;
3-(5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-N-(3-оксоциклогексил)-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоксамид;
(1,1-диоксогексагидро-1I6-тиопиран-4-ил)амид 3-[5-(3,5-дихпорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил]-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоновой кислоты;
[2-оксо-1-(2,2,2-трифторэтил)пирролидин-3-ил]амид 3-[5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил]-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоновой кислоты;
3-(5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-N-((R)-2-оксопирролидин-3-ил)-5,6-дигидро-4Н-циклопента[с]тиофен-1-карбоксамид;
N-(2-(цианометиламино)-2-оксоэтил)-3-(5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-5,6-дигидро-4Н-циклопента[с]тиофен-1-карбоксамид;
3-(5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-N-(2-оксо-2-(проп-2-иниламино)этил)-5,6-дигидро-4Н-циклопента[с]тиофен-1-карбоксамид;
N-(2-оксо-2-(2,2,2-трифторэтиламино)этил)-3-(5-(3,4,5-трихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоксамид;
N-((R)-2-оксопирролидин-3-ил)-3-(5-(3,4,5-трихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоксамид;
N-(2-(цианометиламино)-2-оксоэтил)-3-(5-(3,4,5-трихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоксамид;
N-(2-оксо-2-(проп-2-иниламино)этил)-3-(5-(3,4,5-трихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоксамид;
3-(5-(3,5-дихлор-4-фторфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-N-(2-оксо-2-(2,2,2-трифторэтиламино)этил)-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоксамид;
3-(5-(3,5-дихлор-4-фторфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-N-((R)-2-оксопирролидин-3-ил)-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоксамид;
N-(2-(цианометиламино)-2-оксоэтил)-3-(5-(3,5-дихлор-4-фторфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоксамид;
3-(5-(3,5-дихлор-4-фторфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-N-(2-оксо-2-(проп-2-иниламино)этил)-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоксамид;
N-(2-оксо-2-(2,2,2-трифторэтиламино)этил)-3-(5-(3,4,5-трихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-5,6-дигидро-4Н-циклопента[с]тиофен-1-карбоксамид;
N-((R)-2-оксопирролидин-3-ил)-3-(5-(3,4,5-трихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-5,6-дигидро-4Н-циклопента[с]тиофен-1-карбоксамид;
N-(2-(цианометиламино)-2-оксоэтил)-3-(5-(3,4,5-трихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-5,6-дигидро-4Н-циклопента[с]тиофен-1-карбоксамид;
N-(2-оксо-2-(проп-2-иниламино)этил)-3-(5-(3,4,5-трихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-5,6-дигидро-4Н-циклопента[с]тиофен-1-карбоксамид;
N-(2-оксо-1-(2,2,2-трифторэтил)пирролидин-3-ил)-3-(5-(3,4,5-трихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-5,6-дигидро-4Н-циклопента[с]тиофен-1-карбоксамид;
3-(5-(3,5-дихлор-4-фторфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-N-(2-оксо-2-(2,2,2-трифторэтиламино)этил)-5,6-дигидро-4Н-циклопента[с]тиофен-1-карбоксамид;
3-(5-(3,5-дихлор-4-фторфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-N-((R)-2-оксопирролидин-3-ил)-5,6-дигидро-4Н-циклопента[с]тиофен-1-карбоксамид;
N-(2-(цианометиламино)-2-оксоэтил)-3-(5-(3,5-дихлор-4-фторфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-5,6-дигидро-4Н-циклопента[с]тиофен-1-карбоксамид;
3-(5-(3,5-дихлор-4-фторфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-N-(2-оксо-1-(2,2,2-трифторэтил)пирролидин-3-ил)-5,6-дигидро-4Н-циклопента[с]тиофен-1-карбоксамид;
3-(5-(3,5-дихлор-4-фторфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-N-(2-оксо-2-(проп-2-иниламино)этил)-5,6-дигидро-4Н-циклопента[с]тиофен-1-карбоксамид;
3-(5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-N-(2-оксо-2-(2,2,2-трифторэтиламино)этил)-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоксамид;
3-(5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-N-(2-(этиламино)-2-оксоэтил)-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоксамид;
3-(5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-N-((тетрагидрофуран-2-ил)метил)-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоксамид;
3-(5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-N-(2-(метилтио)этил)-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоксамид;
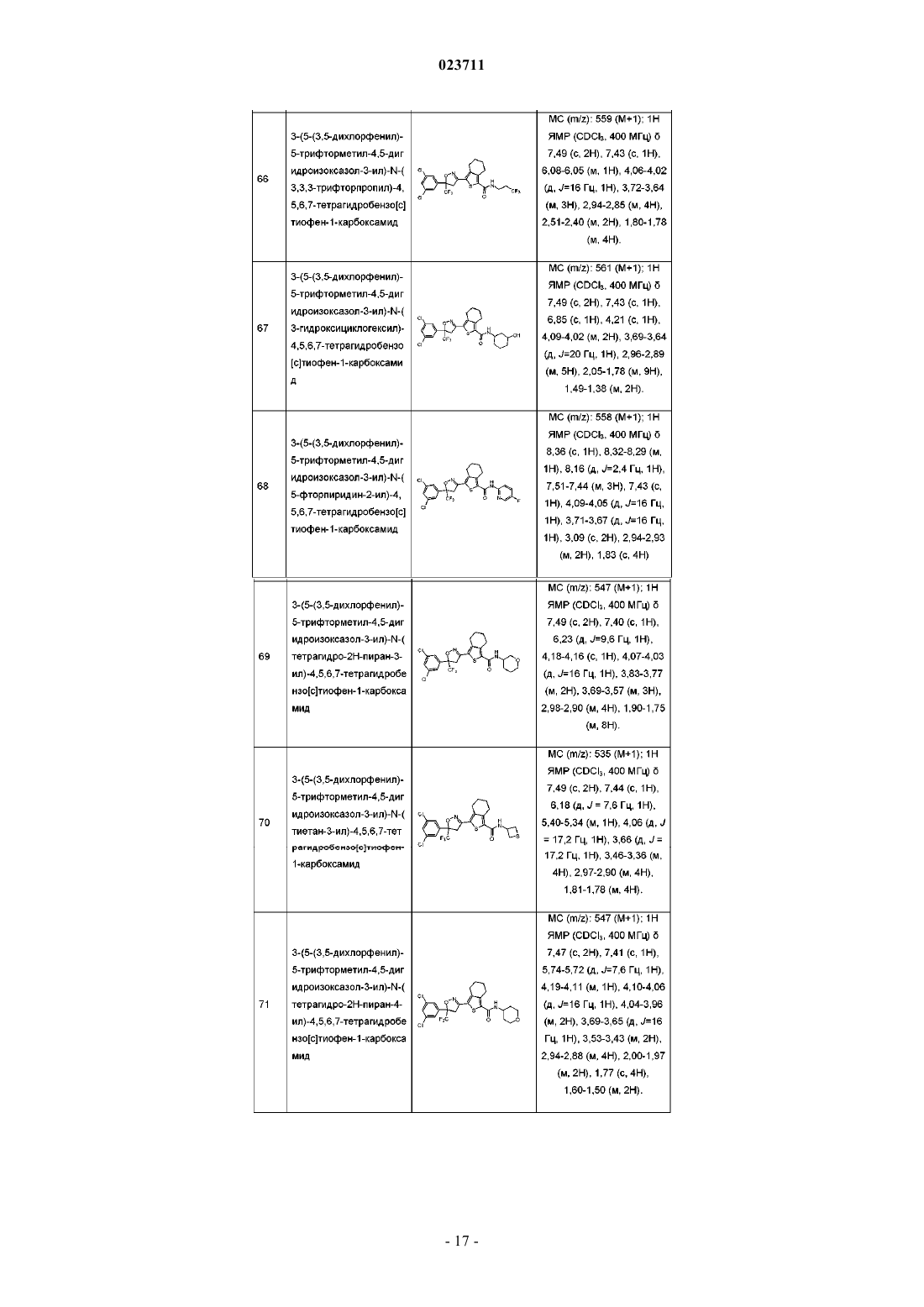
3-(5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-N-(3,3,3-трифторпропил)-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоксамид;
3-(5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-N-(3-гидроксициклогексил)-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоксамид;
3-(5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-N-(5-фторпиридин-2-ил)-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоксамид;
3-(5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-N-(тетрагидро-2Н-пиран-3-ил)-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоксамид;
3-(5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-N-(тиетан-3-ил)-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоксамид;
3-(5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-N-(тетрагидро-2Н-пиран-4-ил)-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоксамид;
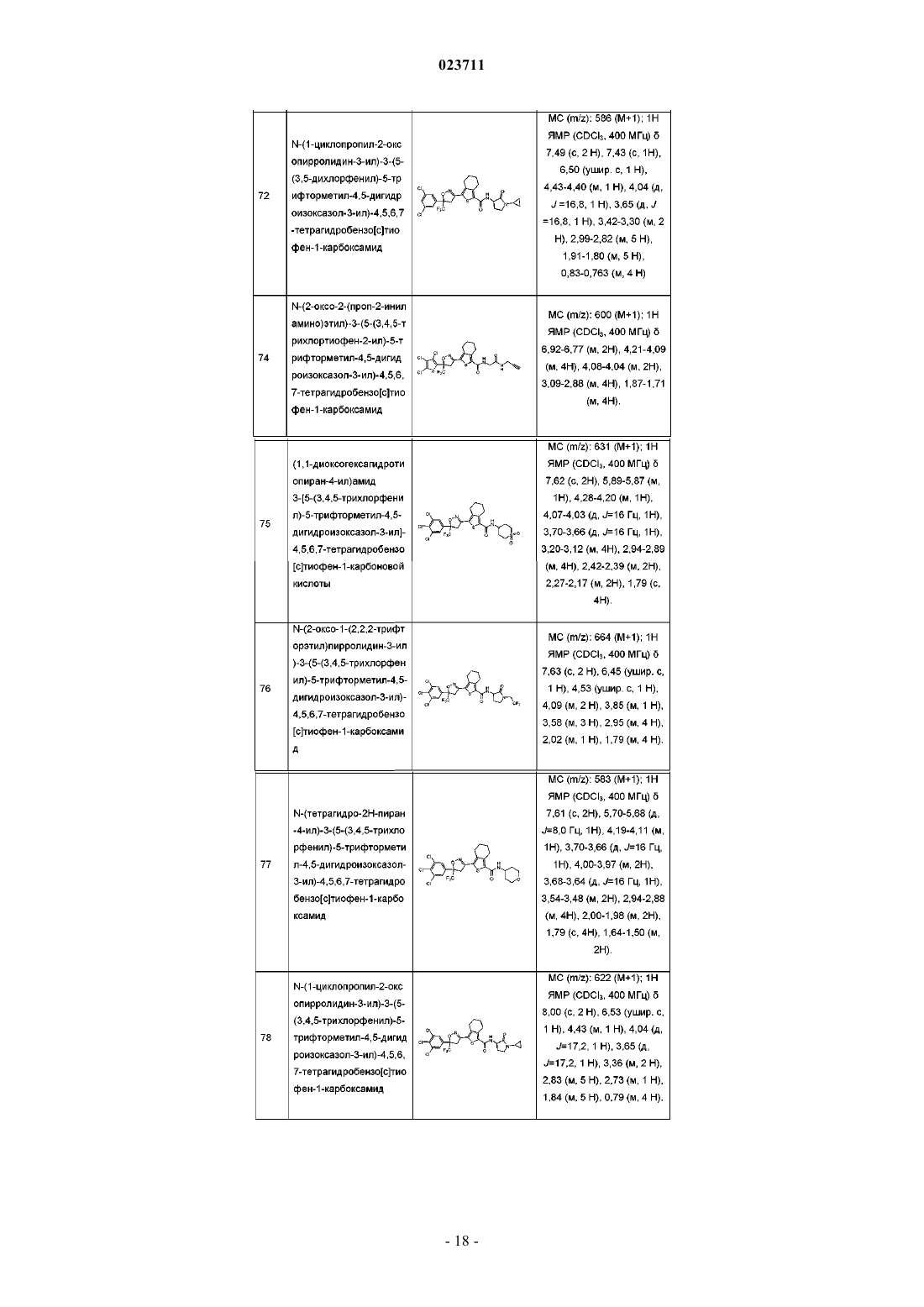
N-(1-циклопропил-2-оксопирролидин-3-ил)-3-(5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоксамид;
N-(2-оксо-2-(проп-2-иниламино)этил)-3-(5-(3,4,5-трихлортиофен-2-ил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоксамид;
(1,1-диоксогексагидротиопиран-4-ил)амид 3-[5-(3,4,5-трихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил]-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоновой кислоты;
N-(2-оксо-1-(2,2,2-трифторэтил)пирролидин-3-ил)-3-(5-(3,4,5-трихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоксамид;
N-(тетрагидро-2Н-пиран-4-ил)-3-(5-(3,4,5-трихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоксамид;
N-(1-циклопропил-2-оксопирролидин-3-ил)-3-(5-(3,4,5-трихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоксамид;
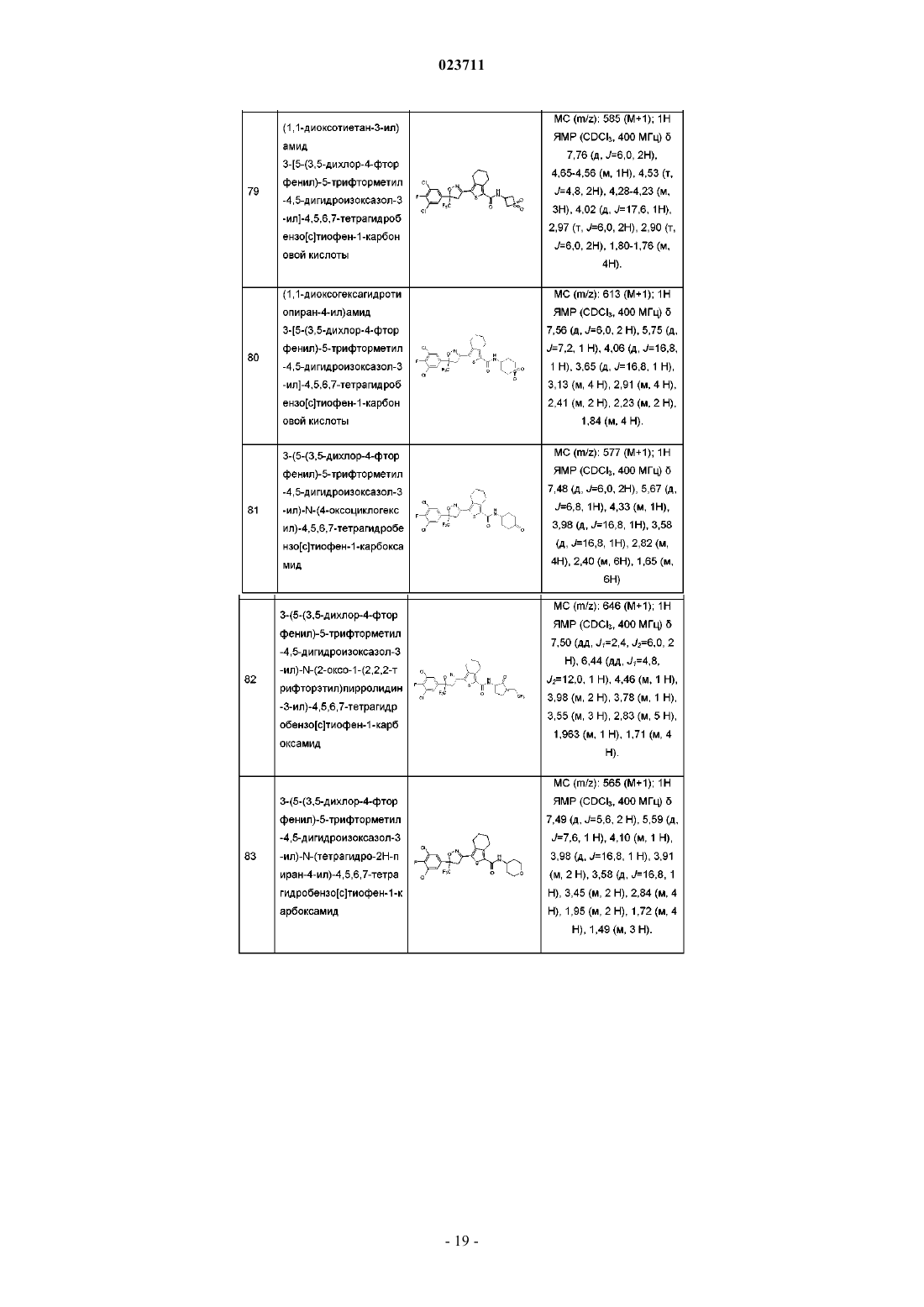
(1,1-диоксотиетан-3-ил)амид 3-[5-(3,5-дихпор-4-фторфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил]-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоновой кислоты;
(1,1-диоксогексагидротиопиран-4-ил)амид 3-[5-(3,5-дихлор-4-фторфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил]-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоновой кислоты;
3-(5-(3,5-дихлор-4-фторфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-N-(4-оксоциклогексил)-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоксамид;
3-(5-(3,5-дихлор-4-фторфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-N-(2-оксо-1-(2,2,2-трифторэтил)пирролидин-3-ил)-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоксамид;
3-(5-(3,5-дихлор-4-фторфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-N-(тетрагидро-2Н-пиран-4-ил)-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоксамид;
N-(1-циклопропил-2-оксопирролидин-3-ил)-3-(5-(3,5-дихлор-4-фторфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоксамид;
3-(5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-N-(4-оксоциклогексил)-5,6-дигидро-4Н-циклопента[с]тиофен-1-карбоксамид;
3-(5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-N-(2-оксо-1-(2,2,2-трифторэтил)пирролидин-3-ил)-5,6-дигидро-4Н-циклопента[с]тиофен-1-карбоксамид;
3-((R)-5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-N-((R)-2-оксопирролидин-3-ил)-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоксамид;
3-((S)-5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-N-((R)-2-оксопирролидин-3-ил)-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоксамид;
N-(4-карбамоилфенил)-3-(5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоксамид;
(3-карбамоилтиофен-2-ил)амид 3-[5-(3,4,5-трихлортиофен-2-ил)-5-трифторметил-4,5-дигидроизоксазол-3-ил]-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоновой кислоты;
2-(3-(5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоксамидо)уксусную кислоту;
({3-[5-(3,4,5-трихлортиофен-2-ил)-5-трифторметил-4,5-дигидроизоксазол-3-ил]-4,5,6,7-тетрагидробензо[с]тиофен-1-карбонил}амино)уксусную кислоту;
N-(2-(цианометиламино)-2-оксоэтил)-3-(5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоксамид;
3-(5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-N-(2-оксо-2-(проп-2-иниламино)этил)-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоксамид;
N-(2-(цианометиламино)-2-оксоэтил)-3-(5-(3,4,5-трихлортиофен-2-ил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоксамид;
(S)-3-(5-(3,5-дихлор-4-фторфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-N-(2-оксо-2-(2,2,2-трифторэтиамино)этил)-5,6-дигидро-4Н-циклопента[с]тиофен-1-карбоксамид;
[(2,2-дифторэтилкарбамоил)метил]амид 3-[5-(3,5-дихлор-4-фторфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил]-5,6-дигидро-4Н-циклопента[с]тиофен-1-карбоновой кислоты;
[(2-фторэтилкарбамоил)метил]амид 3-[5-(3,5-дихлор-4-фторфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил]-5,6-дигидро-4Н-циклопента[с]тиофен-1-карбоновой кислоты;
[(2-фторэтилкарбамоил)метил]амид (S)-3-[5-(3,5-дихлор-4-фторфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил]-5,6-дигидро-4Н-циклопента[с]тиофен-1-карбоновой кислоты;
3-(5-(3,5-дихлор-4-фторфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-N-(2-оксо-2-(проп-2-иниламино)этил)-5,6-дигидро-4Н-циклопента[с]тиофен-1-карбоксамид или
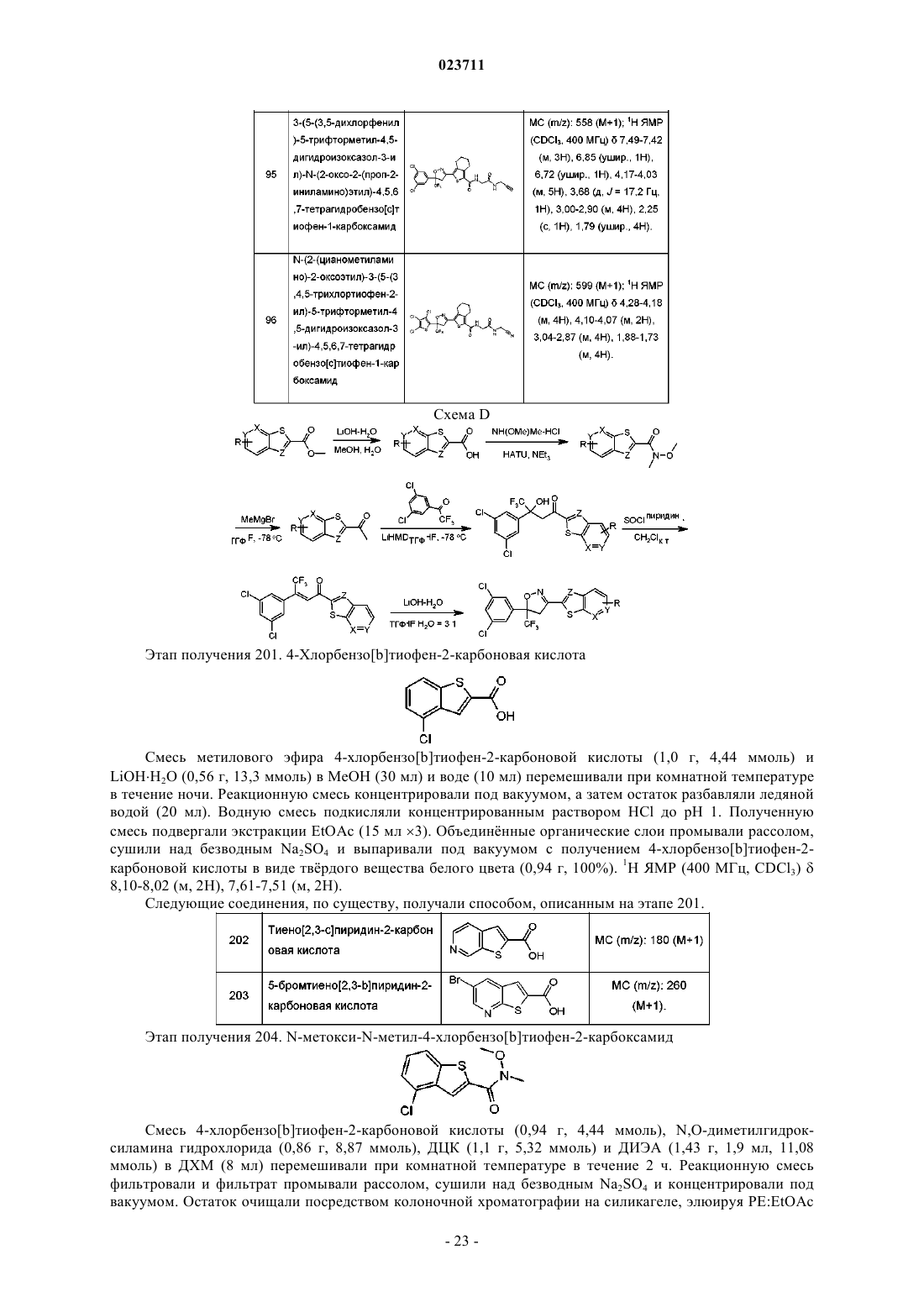
(S)-3-(5-(3,5-дихлор-4-фторфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-N-(2-оксо-2-(проп-2-иниламино)этил)-5,6-дигидро-4Н-циклопента[с]тиофен-1-карбоксамид.
5. Соединение по п.1 или 2 или его соль, отличающееся тем, что R7 представляет собой
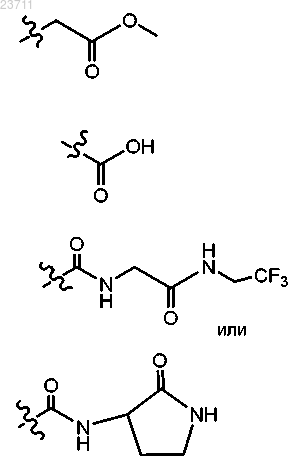
6. Соединение по п.1 или его соль, представляющее собой
3-(4-хлорбензо[b]тиофен-2-ил)-5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол;
2-[5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил]тиено[2,3-с]пиридин;
5-бром-2-[5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил]тиено[2,3-b]пиридин;
2-[5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил]тиено[2,3-b]пиридин;
3-(бензо[b]тиофен-2-ил)-5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол;
3-(бензо[d]тиазол-2-ил)-5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол;
5-(3,5-дихлорфенил)-3-(3-метилбензо[b]тиофен-2-ил)-5-трифторметил-4,5-дигидроизоксазол;
5-(3,5-дихлорфенил)-3-(5-метилбензо[b]тиофен-2-ил)-5-трифторметил-4,5-дигидроизоксазол;
3-(5-хлорбензо[b]тиофен-2-ил)-5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол;
метиловый эфир 2-(5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)тиено[2,3-b]пиридин-5-карбоновой кислоты;
2-[5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил]тиено[2,3-b]пиридин-5-карбоновую кислоту;
2-(5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-N-(2-оксо-2-(2,2,2-трифторэтиламино)этил)тиено[2,3-b]пиридин-5-карбоксамид или
2-(5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-N-((R)-2-оксопирролидин-3-ил)тиено[2,3-b]пиридин-5-карбоксамид.
7. Соединение по п.1 или его соль, представляющее собой
[(2,2-дифторэтилкарбамоил)метил]амид (S)-3-[5-(3,5-дихлор-4-фторфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил]-5,6-дигидро-4Н-циклопента[с]тиофен-1-карбоновой кислоты.
8. Соединение по п.1 или его соль, представляющее собой
(S)-3-(5-(3,5-дихлор-4-фторфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-N-(2-оксо-2-(проп-2-иниламино)этил)-5,6-дигидро-4Н-циклопента[с]тиофен-1-карбоксамид.
9. Состав для контролирования внутренней или наружной паразитарной инвазии у животного, содержащий соединение или соль по любому из пп.1-8 и один или более приемлемых носителей.
10. Способ контролирования внутренней или наружной паразитарной инвазии у животного, нуждающегося в этом, включающий введение указанному животному эффективного количества соединения по любому из пп.1-8.
11. Способ по п.10, отличающийся тем, что указанное домашнее животное представляет собой собаку или кошку, а указанный паразит представляет собой иксодового клеща.
12. Соединение формулы II или его соль
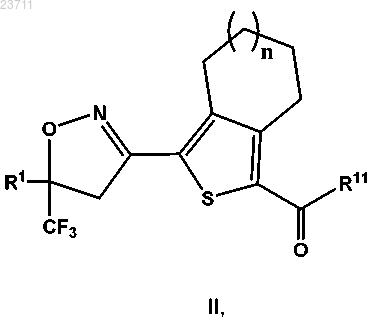
где n составляет 0 или 1;
R1 представляет собой тиенил или фенил, причем указанные тиенил или фенил замещены 2 или 3 одинаковыми или различными атомами галогена; и
R11 представляет собой гидрокси, -О-(С1-С4 алкил) или атом галогена.
13. Соединение по п.12, отличающееся тем, что представляет собой
метиловый эфир 3-[5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил]-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоновой кислоты;
метиловый эфир 3-[5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил]-5,6-дигидро-4Н-циклопента[с]тиофен-1-карбоновой кислоты;
метиловый эфир 3-[5-(3,4,5-трихлортиофен-2-ил)-5-трифторметил-4,5-дигидроизоксазол-3-ил]-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоновой кислоты;
метиловый эфир 3-[5-(3,4,5-трихлортиофен-2-ил)-5-трифторметил-4,5-дигидроизоксазол-3-ил]-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоновой кислоты;
метиловый эфир 3-[5-(3,5-дихлор-4-фторфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил]-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоновой кислоты;
метиловый эфир 3-[5-(3,4,5-трихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил]-5,6-дигидро-4Н-циклопента[с]тиофен-1-карбоновой кислоты;
метиловый эфир 3-[5-(3,5-дихлор-4-фторфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил]-5,6-дигидро-4Н-циклопента[с]тиофен-1-карбоновой кислоты;
3-[5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил]-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоновую кислоту;
3-[5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил]-5,6-дигидро-4Н-циклопента[с]тиофен-1-карбоновую кислоту;
3-[5-(3,4,5-трихлортиофен-2-ил)-5-трифторметил-4,5-дигидроизоксазол-3-ил]-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоновую кислоту;
3-[5-(3,4,5-трихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил]-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоновую кислоту;
3-[5-(3,5-дихлор-4-фторфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил]-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоновую кислоту;
3-[5-(3,5-дихлор-4-фторфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил]-5,6-дигидро-4Н-циклопента[с]тиофен-1-карбоновую кислоту;
3-[5-(3,4,5-трихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил]-5,6-дигидро-4Н-циклопента[с]тиофен-1-карбоновую кислоту;
3-(5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-4,5,6,7-тетрагидробензо[с]тиофен-1-карбонилхлорид или
3-[5-(3,4,5-трихлортиофен-2-ил)-5-трифторметил-4,5-дигидроизоксазол-3-ил]-4,5,6,7-тетрагидробензо[с]тиофен-1-карбонилхлорид.
14. Способ получения соединения формулы I
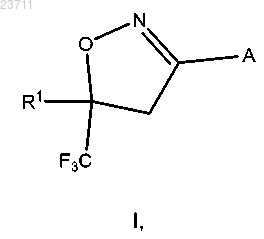
где А представляет собой
n составляет 0 или 1;
R1 представляет собой тиенил или фенил, причем указанные тиенил или фенил замещены 2 или 3 одинаковыми или различными атомами галогена;
R2, в каждом случае независимо, представляет собой водород, C1-C5 алкил, С3-С6 циклоалкил или C1-C5 галогеналкил;
R3 представляет собой
р, в каждом случае независимо, составляет 0 или 1;
R4 представляет собой C1-C5 алкил, C1-C5 галогеналкил, C1-C5 цианоалкил, C1-C5 алкилтио, С3-С6 циклоалкил, необязательно замещенный гидрокси, галогеном или C1-C5 алкилом; С3-С5 циклогетероалкил, необязательно замещенный C1-C5 алкилом, С3-С6 циклоалкилом или C1-C5 галогеналкилом; фенил, тиенил, пиридинил или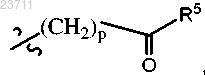
причем один из атомов углерода в указанных циклоалкилах, независимо, или в циклогетероалкиле может образовывать карбонильную группу, и указанный фенил, тиенил или пиридинил необязательно замещен галогеном или карбамоильной группой;
R5 представляет собой гидрокси, -О-(C1-C5 алкил) или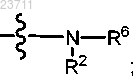
R6 представляет собой водород, C1-C5 алкил, C1-C5 галогеналкил, C1-C5 цианоалкил, C1-C5 алкилтио или С2-С5 алкинил;
или R2 и R3 совместно с атомом азота, к которому они присоединены, образуют
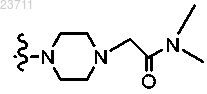
Y1, Y2 и Y3 представляют собой атом углерода или азота, причем не более чем один из Y1, Y2 и Y3 представляет собой атом азота, и в случае, если Y1, Y2 или Y3 представляет собой атом углерода, любой из них может быть замещен C1-C5 алкилом;
R7 представляет собой водород, галоген, C1-C5 алкил или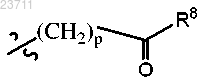 R8 представляет собой гидрокси, -О-(C1-C5 алкил) или
R8 представляет собой гидрокси, -О-(C1-C5 алкил) или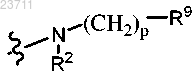 R9 представляет собой C1-C5 алкил,
R9 представляет собой C1-C5 алкил,
R10 представляет собой водород, C1-C5 алкил, C1-C5 галогеналкил, C1-C5 цианоалкил, C1-C5 алкилтио или С2-С5 алкинилил, и его соли,
включающий взаимодействие соединения формулы II
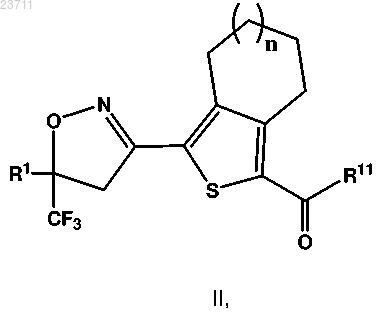
где n составляет 0 или 1;
R1 представляет собой тиенил или фенил, причем указанные тиенил или фенил замещены 2 или 3 одинаковыми или различными атомами галогена; и
R11 представляет собой гидрокси, -О-(С1-С4 алкил) или атом галогена,
или его соли с соединением формулы
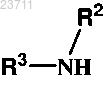
где R2 и R3 указаны выше.
Текст
В настоящем изобретении предложены дигидроизоксазольные соединения формулы I или его соли а остальные заместители имеют значения, как раскрыто в формуле изобретения. Данные соединения подходят для борьбы с паразитами как у животных, так и у сельскохозяйственных культур. Также предложены способы борьбы с паразитарными инвазиями у животного посредством введения животному эффективного количества соединения, описанного выше, или его фармацевтически приемлемой соли, а также составы для борьбы с паразитарными инвазиями с применением соединений, описанных выше, или их приемлемой соли и приемлемого носителя. Также предложены соединения и способы, подходящие для получения дигидроизоксазольных соединений.(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) Эктопаразиты, такие как блохи, вши, мухи, комары, иксодовые и другие клещи, а также эндопаразиты, такие как нематоды желудочно-кишечного тракта, сосальщики и филярии, создают проблемы как для человека, так и для животных. Такие паразиты серьзно влияют на производительность в промышленном животноводстве, снижая прирост массы, вызывая ухудшение качества шкуры, шерсти и мяса и в некоторых случаях приводя к гибели животных. Также экто- и эндопаразиты отчасти виновны в распространении заболеваний и недомоганий среди животных, употребляемых в пищу, и среди домашних животных. В частности известно, что эктопаразиты являются переносчиками различных патогенных микроорганизмов, включая бактерии, вирусы и паразитов, относящихся к простейшим, многие из которых являются патогенными для людей и других теплокровных млекопитающих и птиц. Заболевания, которые связывают с эктопаразитами, включают, но не ограничиваются ими, малярию, лимфатический и "кровяной" филяриатоз, трахому, трипаносомоз, лейшманиоз, пятнистую лихорадку Скалистых гор, болезнь Лайма, бабезиоз и болезни, распространяющиеся через пищеварительный тракт, например, вызываемыеSalmonella, E. coli и Campylobacter. Медицинское значение паразитарных инвазий послужило толчком к разработке реагентов, способных бороться с такими инвазиями. Например, в часто встречающихся способах борьбы с инвазиями обычно делался упор на применение инсектицидов, которое часто является безрезультатным или неудовлетворительным по одной или нескольким из следующих причин: (1) не соблюдение хозяином или лицом, проводящим лечение, врачебных предписаний (требуется частое применение); (2) поведенческая или физиологическая непереносимость животным пестицидного продукта или способов его применения;(3) возникновение устойчивости эктопаразитов к указанному реагенту и (4) негативное воздействие на окружающую среду и/или токсичность. В частности, иксодовые клещи паразитируют на диких и домашних животных, а также на людях и,как известно или предполагается, являются переносчиками патогенных микроорганизмов, включая бактерии, вирусы и простейшие. В настоящее время считается, что иксодовые клещи занимают второе место в мире после комаров в качестве переносчиков заболеваний человека, при этом считается, что они являются наиболее опасными переносчиками патогенных микроорганизмов в Северной Америке. Эффективная ликвидация клещевых инвазий трудна и зачастую невыполнима из-за необходимости сопутствующей терапии непосредственного хозяина, а также обработки мест обитания паразита в окружающей среде. В настоящее время борьба с клещами осуществляется посредством комплексной стратегии контролирования вредителей, согласно которой различные способы борьбы приспосабливают к применению на определенной территории или против определенного вида иксодовых клещей с учтом их воздействия на окружающую среду. Несмотря на то, что применение инсектицидов и пестицидов обеспечивало положительный эффект,существует необходимость в альтернативных или улучшенных соединениях, составах и способах. Желаемые соединения, составы и способы не только обеспечили бы альтернативные виды лечения, но и преодолели бы один или более недостатков существующих способов. Такие недостатки включают токсичность и необходимость обеспечения безопасности как животного, так и владельца/хозяина, ограниченную эффективность (например, активность и срок действия) и проблемы, связанные с возникновением устойчивости. На положительный эффект применения инсектицидов и пестицидов также влияют трудности их применения, которые включают способ и периодичность применения. Например, желательно сократить частоту применения при сохранении эффективности, так как избыточное и многократное лечение животных часто является неудобным и/или сложным. Настоящее изобретение включает антипаразитарные соединения, способы и составы для приема внутрь и наружного применения у животных и растений, обеспечивающие альтернативные варианты борьбы с инвазиями, в частности эктопаразитарными инвазиями. Кроме того, согласно некоторым аспектам настоящее изобретение преодолевает, по меньшей мере, некоторые ограничения, присущие применению существующих инсектицидов и пестицидов, в частности ограничения, связанные с обеспечением эффективных, долговременных, безопасных мер контролирования паразитов. В настоящем изобретении предложены соединения формулы I и их солиR1 представляет собой тиенил или фенил, причм указанный тиенил или фенил замещн 2 или 3 одинаковыми или различными атомами галогена;R4 представляет собой C1-C5 алкил, C1-C5 галогеналкил, C1-C5 цианоалкил, C1-C5 алкилтио, С 3-С 6 циклоалкил, необязательно замещнный гидроксильной группой, галогеном или C1-C5 алкилом; С 3-С 5 циклогетероалкил, необязательно замещнный C1-C5 алкилом, С 3-С 6 циклоалкилом или C1-C5 галогеналпричм один из атомов углерода в указанных циккилом; фенил, тиенил, пиридинил или лоалкилах, независимо, или циклогетероалкиле может образовывать карбонильную группу, и указанный фенил, тиенил или пиридинил необязательно замещн галогеном или карбамоильной группой;Y1, Y2 и Y3 представляют собой атом углерода или азота, причм не более чем один из Y1, Y2 и Y3 представляет собой атом азота, и в случае, если Y1, Y2 или Y3 представляет собой атом углерода, любой из них может быть замещн C1-C5 алкилом;R10 представляет собой водород, C1-C5 алкил, C1-C5 галогеналкил, C1-C5 цианоалкил, C1-C5 алкилтио или С 2-С 5 алкинил. В настоящем изобретении предложен состав, в частности фармацевтический состав, содержащий соединение или соль формулы I и один или более приемлемых носителей. Указанный состав может дополнительно содержать по меньшей мере один дополнительный активный ингредиент. Фармацевтический состав согласно настоящему изобретению может представлять собой фармацевтический состав для применения человеком или ветеринарный фармацевтический состав. В настоящем изобретении предложен способ контролирования экто- и эндопаразитарных инвазий у нуждающегося в этом животного, включающий введение указанному животному эффективного количества соединения или соли формулы I. Указанный способ также может обеспечивать введение указанному животному по меньшей мере одного иного активного ингредиента. Указанное животное может представлять собой млекопитающее и может представлять собой человека или животное-компаньон, например собаку или кошку. В настоящем изобретении предложен способ предотвращения и лечения заболеваний, передаваемых паразитами, включающий введение нуждающемуся в этом животному по меньшей мере одного соединения согласно настоящему изобретению. В настоящем изобретении предложен способ контролирования паразитов, характеризующийся тем,-2 023711 что обеспечена возможность действия соединения формулы I на вредителей и/или место их обитания. В настоящем изобретении предложено применение соединений формулы I или их солей для контролирования вредителей. В настоящем изобретении предложено соединение или соль формулы I для применения в терапии. Кроме того, в настоящем изобретении предложено соединение или соль формулы I для применения в борьбе с экто- и эндопаразитарными инвазиями. В настоящем изобретении также предложено применение соединения или соли формулы I для производства состава или лекарственного средства для контролирования экто- и эндопаразитарных инвазий. В настоящем изобретении предложены соединения формулы II или их солиR1 представляет собой тиенил или фенил, причм указанные тиенил или фенил замещены 2 или 3 одинаковыми или различными атомами галогена; иR11 представляет собой гидрокси, -О-(С 1-С 4 алкил) или атом галогена. Указанные соединения находят применение в качестве промежуточных продуктов в процессах получения некоторых соединений формулы I. Указанные соединения формулы II могут быть химически модифицированы с получением некоторых соединений формулы I. Животное, являющееся хозяином паразита, может представлять собой млекопитающее или животное, не являющееся млекопитающим, такое как птица (индейка, курица) или рыба. Если указанное животное-хозяин представляет собой млекопитающее, оно может представлять собой человека или млекопитающее, не являющееся человеком. Млекопитающие, не являющиеся человеком, включают домашних животных, таких как сельскохозяйственные животные и животные-компаньоны. Сельскохозяйственные животные включают крупный рогатый скот, животных семейства верблюдовые, свиней, овец, коз и лошадей. Животные-компаньоны включают собак, кроликов, кошек и других домашних животных, принадлежащих людям и сохраняющих с ними тесную связь в рамках связи человек-животное. Паразиты, иногда также называемые вредителями, включают как эктопаразитов, так и эндопаразитов. Эктопаразиты включают вредных насекомых и клещей, которые часто нападают на или заражают животных, и включают такие их стадии, как стадии яйца, личинки, куколки, нимфы и взрослой особи. Такие вредители включают блох, вшей, комаров, клещей отряда Ixodida, прочих клещей, жуков и кровососущие, кусающие или досаждающие виды мух. Эндопаразиты включают вредных нематод, которые часто заражают животных, и включают такие их стадии, как стадии яйца, личинки и взрослой особи. Такие вредители включают гельминтов (анкилостом, ленточных червей, сердечных гельминтов) и представляют значительную опасность для коммерческой деятельности, поскольку они вызывают серьзные заболевания у животных, например у овец, свиней, коз, крупного рогатого скота, лошадей, ослов, верблюдов, собак, кошек, кроликов, морских свинок, хомяков, куриц, индеек, цесарок и других сельскохозяйственных птиц, а также экзотических птиц. Типичными нематодами являются Haemonchus, Trichostrongylus, Ostertagia, Nematodirus, Cooperia, Ascaris, Bunostomum, Oesophagostomum, Chabertia, Trichuris,Strongylus, Thchonema, Dictyocaulus, Capillaha, Heterakis, Toxocara, Ascahdia, Oxyuris, Ancylostoma, Uncinaha, Toxascahs и Parascahs. Трематоды включают, в частности, семейство Fasciolidae, а конкретно Fasciola hepatica. Термин "борьба" означает как облегчение тяжести или устранение существующей инвазии, так и предотвращение инвазии внутри или на поверхности тела животного-хозяина или растения."Эффективное количество" означает количество соединения формулы I или его соли, достаточное для контролирования экто- или эндопаразитарной инвазии, и включает осуществление поддающегося измерению уменьшения инвазионной популяции экто- или эндопаразитов, и в силу этого будет зависеть от нескольких факторов. При применении на поверхности тела животных или внутри него количество соединения формулы I или его соли в указанных способах находится в диапазоне от 0,01 до 1000 мг/кг и более предпочтительно от 0,1 до 100 мг/кг массы тела животного. Частота введения также будет зависеть от нескольких факторов и может представлять собой введение однократной дозы один раз в сутки, один раз в неделю или один раз в месяц в течение срока, определнного лечащим врачом или ветеринаром. Дополнительные активные ингредиенты могут быть введены совместно с соединением формулы I. Термин "фармацевтически приемлемый", применяемый в настоящей заявке, например, по отношению к солям и компонентам состава, таким как носители, включает "ветеринарно приемлемый" и, следовательно, включает независимое употребление как человеком, так и животным. Соли соединений согласно настоящему изобретению, включая фармацевтически приемлемые соли,-3 023711 и общая методика их получения известны в данной области. См., например, P. Stahl с соавт. Handbook ofPharmaceutical Salts: Properties, Selection and Use (VCHA/Wiley-VCH, 2002); S.M. Berge с соавт. "Pharmaceutical Salts", Journal of Pharmaceutical Sciences, т. 66,1, январь 1977. Соединения согласно настоящему изобретению и их соли могут быть приготовлены в виде фармацевтических композиций для введения. Такие фармацевтические композиции как для людей, так и для млекопитающих, не являющихся человеком, и способы приготовления указанных композиций известны в данной области. См., например, Remington: The Science and practice of pharmacy (A. Gennaro с соавт.,eds., 19-е изд., Mack Publishing Co., 1995). Составы могут быть введены различными способами, включая пероральное введение, парентеральное введение, такое как инъекция (внутримышечная, подкожная,внутривенная, внутрибрюшинная) или другой подобный способ; наружное применение с проникновением через кожу или без него, такое как погружение в жидкость, распыление, обработка в ванне, мыть,лить жидкости и нанесение состава на объект обработки и обсыпание или другой подобный способ. Дополнительные активные ингредиенты могут быть включены в состав, содержащий соединение согласно настоящему изобретению или его соль. В настоящей заявке термин "носитель" применяют для описания любого ингредиента состава, отличного от активного компонента(ов). Выбор носителя во многом будет зависеть от таких факторов, как конкретный способ введения или применения, влияние указанного носителя на растворимость и стабильность и свойств лекарственной формы."C1-C5 алкил" означает алкилы с прямой цепью и разветвлнные алкилы, имеющие от одного до пяти атомов углерода, и включает метил, этил, пропил, н-бутил, изобутил, пентил, изопентил и неопентил."С 2-С 5 алкинил" означает алкинилы с прямой цепью и разветвлнные алкинилы, имеющие от двух до пяти атомов углерода, и включает этинил, 1-пропинил, 2-пропинил, 1-бутинил, 3-метил-1-бутинил,пентинил, изопентинил и неопентинил."Галоген" или "гало" означает фтор, бром, хлор и йод. В настоящей заявке "галогеналкил" означает алкил (упоминаемый выше), замещнный одним или более атомами галогена. Такие группы включают трифторметил, дифторметил, фторметил, метилхлорид,дихлорметил, пентилхлорид, бутилхлорид и изопропилхлорид. В настоящей заявке "цианоалкил" означает алкил (упоминаемый выше), замещнный цианогруппой. В настоящей заявке "алкилтио" означает алкил (упоминаемый выше), имеющий серу в составе указанной группы."С 3-С 5 циклогетероалкил" означает насыщенное кольцо, которое имеет от 3 до 5 атомов углерода и гетероатом. Указанный гетероатом может представлять собой серу, кислород, азот или сульфонильную группу. Заболевания, передаваемые паразитами, в частности эктопаразитами, представляют собой, например, бактериальные, вирусные, риккетсиозные и протозойные трансмиссивные заболевания. Примерами вирусных заболеваний, вызываемых арбовирусами, то есть вирусами, переносимыми членистоногими,являются геморрагическая лихорадка Крым-Конго (ГЛКК), лихорадочное заболевание, лихорадка паппатачи, энцефалит, менингит, которые вызывают вирусы семейства Bunyaviridae, такие как Bunyavirus, Nairovirus или Phlebovirus; катаральная лихорадка овец, менингоэнцефалит, лихорадочное заболевание, геморрагическая лихорадка, которые вызывают вирусы семейства Reoviridae, такие как Orbivirus, Colitivirus; лихорадочное заболевание, сыпь, энцефалит, полиартрит, лимфаденит, которые вызывают вирусы семейства Togaviridae, такие как Sindbis virus, Chikungunya Virus; клещевой менингоэнцефалит, геморрагическая лихорадка Денге, энцефалит, лихорадочное заболевание, жлтая лихорадка, которые вызывают вирусы семейства Flaviviridae, такие как Flavivirus (включая различные подгруппы). Примерами бактериальных заболеваний, передаваемых паразитами, являются риккетсиозы, такие как пятнистая лихорадка Скалистых гор, клещевой сыпной тиф, вызываемые заражением Rickettsia ssp.; туляремия, вызываемая заражением Francisella tularensis; боррелиоз или спирохетоз, такой как болезнь Лайма, или возвратный тиф, вызываемые заражением Borrelia ssp.; эрлихиоз, вызываемый заражением Ehrlichia ssp.; чума, вызываемая заражением Yersinia ssp. Примерами протозойных или риккетсиозных заболеваний являются бабезиозы, такие как техасская лихорадка, гемоглобинурия, Ку-лихорадка, вызываемые заражением Babesia ssp.; тейлериоз, такой как лихорадка восточного побережья, лихорадка средиземноморского побережья, вызываемый заражением Theileha ssp.; болезнь "нагана", сонная болезнь, вызываемые заражениемPlasmodium ssp.; лейшманиоз, вызываемый заражением Leishmania ssp. Принимая во внимание их активность, некоторые из соединений согласно настоящему изобретению подходят для применения в качестве почвенных инсектицидов против вредителей в почве, а также инсектицидов для растений, таких как злаки, хлопчатник, рис, кукуруза, соя, картофель, овощи, фрукты,табак, хмель, цитрусовые и авокадо. Некоторые соединения согласно настоящему изобретению подходят для защиты растений и органов растений, для повышения урожайности и для улучшения качества собираемого материала, который имеет место в сельском хозяйстве, в садоводстве, в лесах, в садах и соору-4 023711 жениях для отдыха, и для защиты хранящихся продуктов и материалов. Они могут быть применены в качестве агентов для защиты растений. Согласно настоящему изобретению могут быть обработаны все растения и части растений. В контексте настоящего изобретения термин "растения" следует понимать в значении все растения и популяции растений, такие как желаемые и нежелательные дикорастущие растения или культурные растения(включая культурные растения, встречающиеся в природе). Культурные растения могут представлять собой растения, которые могут быть получены традиционными методами селекции и оптимизации, или биотехнологическими методами и методами генной инженерии, или комбинациями указанных методов,включая трансгенные растения и включая сорта культурных растений, защищенные или не защищенные правами селекционеров. Термин "части растений" следует понимать в значении все поверхностные и подземные части и органы растений, такие как побег, лист, цветок и корень, в качестве примеров которых могут быть упомянуты листья, иголки, стебли, стволы, цветки, плодовые тела, плоды, семена, корни,клубни и корневища. Части растений также включают собираемый материал и материал для вегетативного и генеративного размножения, например черенки, клубни, корневища, боковые отростки и семена. Обработку согласно настоящему изобретению растений и частей растений активными соединениями осуществляют традиционными и известными способами, включая непосредственное действие на растения и части растений или обеспечение возможности действия указанных соединений на окружающую среду, среду обитания или помещение для хранения обычными способами обработки, например погружением в жидкость, опрыскиванием, испарением, аэрозольным орошением, распылением, нанесением на поверхность, впрыскиванием и в случае материала для размножения, в частности в случае семян, также путм применения однослойных или многослойных оболочек. Указанные соединения могут быть превращены в обычные препаративные формы, такие как растворы, эмульсии, смачивающиеся порошки, суспензии на водной и масляной основе, порошки, дусты,пасты, растворимые порошки, растворимые гранулы, гранулы для разбросного внесения, суспезионноэмульсионные концентраты, натуральные материалы, пропитанные активным соединением, синтетические материалы, пропитанные активным соединением, удобрения и микрокапсулы из полимерных веществ. Указанные формы получают известным способом, например путм смешивания активных соединений с наполнителями, то есть жидкими растворителями и/или тврдыми носителями, необязательно с применением поверхностно-активных веществ, то есть эмульгаторов, и/или диспергентов, и/или пенообразователей. Указанные формы получают или на подходящих растениях, или ещ до применения, или во время него. Подходящими для применения в качестве вспомогательных веществ являются вещества, которые подходят для придания самой указанной композиции и/или полученным на е основе составам (например, жидкостям для распыления, составам для обеззараживания семян) конкретных свойств, таких как некоторые технологические свойства и/или также конкретные биологические свойства. Типичными подходящими вспомогательными веществами являются наполнители, растворители и носители. Ниже приведены схемы A-J и примеры получения соединений согласно настоящему изобретению. Указанные схемы, примеры и содержащаяся в них информация являются иллюстративными и могут быть модифицированы различными способами, известными в данной области, для получения желаемых результатов. Схема А Раствор н-BuLi (21,6 мл, 2,5 М в гексане, 54,0 ммоль) добавляли к раствору 2,3,4,5 тетрахлортиофена (10 г, 45,0 ммоль) в сухом ТГФ (160 мл) при -78 С и перемешивали смесь в течение 2 ч. Добавляли раствор этилового эфира трифторуксусной кислоты (9,59 г, 67,6 ммоль) в ТГФ (15 мл) и перемешивали при -78 С в течение дополнительных 2,5 ч. Реакцию останавливали с помощью насыщенного раствора NH4Cl (100 мл). Водную смесь подвергали экстракции EtOAc (100 мл 3). Объединнные органические слои промывали рассолом, сушили над безводным Na2SO4 и выпаривали под вакуумом. Остаток очищали с помощью колонки для флэш-хроматографии на силикагеле, элюируя РЕ:EtOAc (от 10:1 до 5:1), с получением 2,2,2-трифтор-1-(3,4,5-трихлортиофен-2-ил)этанона в виде коричневого масла Метиловый эфир 2-(2-оксопропилтио)уксусной кислоты (35,4 г, 183,2 ммоль) добавляли к свежеприготовленному раствору тврдого натрия (8,78 г, 381,5 ммоль) в сухом МеОН (300 мл) при 0 С с последующим добавлением раствора циклогексан-1,2-диона (20 г, 152,6 ммоль) в МеОН (30 мл). Смесь перемешивали при 0 С в течение 30 мин, а затем при 50-60 С в течение дополнительных 1,5 ч. Растворитель удаляли под вакуумом и остаток разбавляли водой (100 мл). Водную смесь подвергали экстракции этилацетатом (100 мл 3). Объединнные органические слои промывали рассолом, сушили над безводным Na2SO4 и выпаривали под вакуумом. Остаток очищали с помощью колонки для флэшхроматографии на силикагеле, элюируя РЕ:EtOAc (от50:1 до 30:1), с получением метилового эфира 3 ацетил-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоновой кислоты в виде тврдого вещества белого цвета Смесь циклопентан-1,2-диона (2,00 г, 20,4 ммоль), метилового эфира 2-(2-оксопропилтио)уксусной кислоты (3,31 г, 20,4 ммоль) и карбоната калия (5,63 г, 40,8 ммоль) в ДМФА (40 мл) перемешивали при 80 С в течение 4 ч. Смесь отфильтровывали и растворитель удаляли под вакуумом. Остаток очищали с помощью колонки для флэш-хроматографии на силикагеле, элюируя РЕ:EtOAc (от 8:1 до 6:1), с получением метилового эфира 3-ацетил-5,6-дигидро-4 Н-циклопента[с]тиофен-1-карбоновой кислоты в виде тврдого вещества бледно-жлтого цвета (206 мг, 4,5%). МС (m/z): 225 (М+1). Этап получения 4. Метиловый эфир 3-(3-(3,5-дихлорфенил)-4,4,4-трифтор-3-гидроксибутаноил)4,5,6,7-тетрагидробензо[с]тиофен-1-карбоновой кислотыN2. После перемешивания в течение 1,5 ч к реакционной смеси добавляли 1-(3,5-дихлорфенил)-2,2,2 трифторэтанон (9,9 г, 3,73 ммоль) и перемешивали полученную смесь при той же температуре в течение дополнительных 2 ч. Реакцию останавливали с помощью насыщенного водного раствора NH4Cl. Водную смесь подвергали экстракции EtOAc (100 мл 3). Объединнные органические слои промывали рассолом, сушили над безводным Na2SO4 и концентрировали под вакуумом. Остаток очищали посредством хроматографии на силикагеле (РЕ:EtOAc в соотношении 50:1) с получением метилового эфира 3-(3-(3,5-дихлорфенил)-4,4,4-трифтор-3-6 023711 гидроксибутаноил)-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоновой кислоты в виде тврдого вещества оранжевого цвета (9,1 г, 60,4%). МС (m/z): 481 (М+1). Следующие соединения, по существу, получали способом, описанным на этапе 4. Смесь метилового эфира 3-(3-(3,5-дихлорфенил)-4,4,4-трифтор-3-гидроксибутаноил)-4,5,6,7 тетрагидробензо[с]тиофен-1-карбоновой кислоты (9,1 г, 18,9 ммоль), SOCl2 (9,0 г, 5,5 мл, 75,6 ммоль) и пиридина (2,99 г, 3,1 мл, 37,8 ммоль) в безводном ДХМ (100 мл) перемешивали при комнатной температуре в течение ночи. Полученную смесь разбавляли насыщенным водным раствором NH4Cl. Водную смесь подвергали экстракции ДХМ (100 мл 3). Объединнные органические слои промывали рассолом,сушили над безводным Na2SO4 и концентрировали под вакуумом. Остаток очищали посредством хроматографии на силикагеле (РЕ:EtOAc в соотношении 50:1) с получением метилового эфира 3-[3-(3,5 дихлорфенил)-4,4,4-трифтор-бут-2-еноил]-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоновой кислоты в виде тврдого вещества оранжевого цвета (8,75 г, 100%). МС (m/z): 463 (М+1). Следующие соединения, по существу, получали способом, описанным на этапе 11. Смесь метилового эфира 3-[3-(3,5-дихлорфенил)-4,4,4-трифторбут-2-еноил]-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоновой кислоты (8,75 г, 18,9 ммоль), NaOH (2,65 г, 66,1 ммоль) и NH2OH-HCl (2,6 г,37,8 ммоль) в МеОН (60 мл) и воде (15 мл) перемешивали при комнатной температуре в течение 2,5 ч. После удаления растворителя под вакуумом остаток разбавляли ледяной водой (50 мл). Водную смесь подкисляли концентрированной HCl до рН 1 и полученную смесь подвергали экстракции EtOAc (50 мл 3). Объединнные органические слои промывали рассолом, сушили над безводным Na2SO4 и концентрировали под вакуумом. Остаток очищали посредством хроматографии на силикагеле (РЕ:EtOAc в соотношении 50:1) с получением метилового эфира 3-[5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил]-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоновой кислоты в виде тврдого вещества оранжевого цвета (8,1 г, 93,1%). МС (m/z): 478 (М+1). Следующие соединения, по существу, получали способом, описанным на этапе 18. Смесь метилового эфира 3-[5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил]4,5,6,7-тетрагидробензо[с]тиофен-1-карбоновой кислоты (8,1 г, 17,0 ммоль) и LiOHH2O (3,57 г, 84,9 ммоль) в МеОН (64 мл) и воде (16 мл) перемешивали при комнатной температуре в течение ночи. После удаления под вакуумом органического растворителя остаток разбавляли ледяной водой (80 мл). Водную смесь подкисляли концентрированной HCl до рН 1 и полученную смесь подвергали экстракции EtOAc(100 мл 3). Объединнные органические слои промывали рассолом, сушили над безводным Na2SO4 и концентрировали под вакуумом. Остаток очищали посредством хроматографии на силикагеле (РЕ:EtOAc в соотношении 1:1) с получением 3-[5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол 3-ил]-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоновой кислоты в виде тврдого вещества бледно-жлтого цвета (6,8 г, 86,4%). МС (m/z): 464 (М+1). Следующие соединения, по существу, могут быть получены способом, описанным на этапе 25.[с]тиофен-1-карбоновой кислоты (850 мг, 1,84 ммоль), HATU (837 мг, 2,20 ммоль) и DIEA (539 мг, 0,8 мл, 4,6 ммоль) в ДХМ (8 мл) пемешивали при комнатной температуре в течение 15 мин с последующим добавлением гидрохлорида (R)-3-аминопирролидин-2-она (315 мг, 2,76 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение дополнительных 1,5 ч. Реакционную смесь разбавляли водой (20 мл) и подвергали экстракции ДХМ (20 мл 3). Объединнные органические слои промывали рассолом, сушили над безводным Na2SO4 и концентрировали под вакуумом. Остаток очищали посредством препаративной ВЭЖХ с получением 3-(5-(3,5-дихлорфенил)-5-(трифторметил)-4,5 дигидроизоксазол-3-ил)-N-R)-2-оксопирролидин-3-ил)-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоксамида в виде тврдого вещества белого цвета (730 мг, 73,0%). МС (m/z): 546 (М+1); 1 Н ЯМР (400 МГц,CDCl3)7,52-7,46 (м, 3 Н), 6,49 (с, 1 Н), 5,83 (с, 1 Н), 4,51-4,48 (м, 1 Н), 4,22 (д, J=17,2, 1H), 3,85 (д, J=17,2,1 Н), 3,52-3,47 (м, 2 Н), 3,09-2,87 (м, 5 Н), 2,12-2,03 (м, 1 Н), 1,89-1,73 (м, 4 Н). Следующие соединения, по существу, могут быть получены способом, описанным в примере 32.(колонка: Chiralcel OD 25030 мм I.D., 5 мкм; подвижная фаза: сверхкритический СО 2/МеОН в соотношении 60/40; скорость потока: 200 мл/мин) с получением двух диастереомеров, представлявших собой 3R)-5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-N-R)-2-оксопирролидин-3-ил)4,5,6,7-тетрагидробензо[с]тиофен-1-карбоксамид (2,7 г, 4,92 ммоль) и 3-S)-5-(3,5-дихлорфенил)-5 трифторметил-4,5-дигидроизоксазол-3-ил)-N-R)-2-оксопирролидин-3-ил)-4,5,6,7-тетрагидробензо[с] тиофен-1-карбоксамид (2,6 г, 4,74 ммоль), в виде тврдых веществ белого цвета.[с]тиофен-1-карбоновой кислоты (600 мг, 1,2 ммоль), 2 капель ДМФА в оксалилхлориде (5 мл) перемешивали при комнатной температуре в течение 3 ч. Растворитель удаляли под вакуумом с получением 3(5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-4,5,6,7-тетрагидробензо[с]тиофен-1 карбонилхлорида в виде тврдого вещества жлтого цвета (615 мг, 98%). Следующее соединение, по существу, получали способом, описанным на этапе 88.[с]тиофен-1-карбонилхлорида (48 мг, 0,1 ммоль) и 4-аминобензамида (27 мг, 0,2 ммоль) в пиридине (3 мл) перемешивали при комнатной температуре в течение ночи. После удаления растворителя под вакуумом остаток очищали посредством препаративной ВЭЖХ с получением N-(4-карбамоилфенил)-3-(5-(3,5 дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-4,5,6,7-тетрагидробензо[с]тиофен-1 карбоксамида в виде тврдого вещества белого цвета (36 мг, 62,0%). МС (m/z): 582,1 (М+1). 1 Н ЯМР Смесь метилового эфира 2-(3-(5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)4,5,6,7-тетрагидробензо[с]тиофен-1-карбоксамидо)уксусной кислоты (534 мг, 1,0 ммоль) и LiOHH2O(168 мг, 4,0 ммоль) в МеОН (20 мл) и воде (5 мл) перемешивали при комнатной температуре в течение ночи. После удаления органического растворителя под вакуумом остаток разбавляли ледяной водой (10 мл). Водную смесь подкисляли концентрированной HCl до рН 1 и полученную смесь подвергали экстракции EtOAc (15 мл 3). Объединнные органические слои промывали рассолом, сушили над безводным Na2SO4 и концентрировали под вакуумом. Остаток очищали посредством хроматографии на силикагеле (РЕ:EtOAc в соотношении 1:1) с получением 2-(3-(5-(3,5-дихлорфенил)-5-трифторметил-4,5 дигидроизоксазол-3-ил)-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоксамидо)уксусной кислоты в виде тврдого вещества бледно-жлтого цвета (427 мг, 82,0%). МС (m/z): 521 (М+1). Следующее соединение, по существу, получали способом, описанным на этапе 92.NEt3 (133 мг, 1,32 ммоль) в ДХМ (5 мл) перемешивали при комнатной температуре в течение 15 мин с последующим добавлением 2-аминоацетонитрила гидрохлорида (61 мг, 0,65 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение дополнительных 1,5 ч. Далее реакционную смесь разбавляли водой (20 мл) и подвергали экстракции ДХМ (20 мл 3). Объединнные органические слои промывали рассолом, сушили над безводным Na2SO4 и концентрировали под вакуумом. Остаток очищали посредством препаративной ВЭЖХ с получением N-(2-(цианометиламино)-2-оксоэтил)-3-(5-(3,5 дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-4,5,6,7-тетрагидробензо[с]тиофен-1-карбоксамида в виде тврдого вещества белого цвета (110 мг, 44,7%). МС (m/z): 559,1 (М+1). 1 Н ЯМР (ДМСО-d6,400 МГц)8,64 (т, J=5,6 Гц, 1 Н), 8,22 (т, J=5,6 Гц, 1 Н), 7,81-7,80 (м, 1 Н), 7,68 (с, 2 Н), 4,35-4,22 (м, 2 Н),4,16-4,15 (м, 2 Н), 3,88-3,86 (м, 2 Н), 2,94-2,86 (м, 4 Н), 1,70-1,69 (м, 4 Н). Следующие соединения, по существу, получали способом, описанным в примере 94. Смесь метилового эфира 4-хлорбензо[b]тиофен-2-карбоновой кислоты (1,0 г, 4,44 ммоль) иLiOHH2O (0,56 г, 13,3 ммоль) в МеОН (30 мл) и воде (10 мл) перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали под вакуумом, а затем остаток разбавляли ледяной водой (20 мл). Водную смесь подкисляли концентрированным раствором HCl до рН 1. Полученную смесь подвергали экстракции EtOAc (15 мл 3). Объединнные органические слои промывали рассолом,сушили над безводным Na2SO4 и выпаривали под вакуумом с получением 4-хлорбензо[b]тиофен-2 карбоновой кислоты в виде тврдого вещества белого цвета (0,94 г, 100%). 1 Н ЯМР (400 МГц, CDCl3)8,10-8,02 (м, 2 Н), 7,61-7,51 (м, 2 Н). Следующие соединения, по существу, получали способом, описанным на этапе 201. Смесь 4-хлорбензо[b]тиофен-2-карбоновой кислоты (0,94 г, 4,44 ммоль), N,O-диметилгидроксиламина гидрохлорида (0,86 г, 8,87 ммоль), ДЦК (1,1 г, 5,32 ммоль) и ДИЭА (1,43 г, 1,9 мл, 11,08 ммоль) в ДХМ (8 мл) перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь фильтровали и фильтрат промывали рассолом, сушили над безводным Na2SO4 и концентрировали под вакуумом. Остаток очищали посредством колоночной хроматографии на силикагеле, элюируя РЕ:EtOAc(от 5:1 до 3:1), с получением N-метокси-N-метил-4-хлорбензо[b]тиофен-2-карбоксамида в виде тврдого вещества белого цвета (0,85 г, 75,2%). 1 Н ЯМР (400 МГц, CDCl3)8,10-8,02 (м, 2 Н), 7,61-7,51 (м, 2 Н),3,84-3,79 (с, 3 Н), 3,37-3,35 (с, 3 Н). Следующие соединения, по существу, получали способом, описанным на этапе 204. Раствор CH3MgBr (3 М в ТГФ, 1,7 мл, 4,99 ммоль) добавляли к суспензии N-метокси-N-метил-4 хлорбензо[b]тиофен-2-карбоксамида (0,85 г, 3,33 ммоль) в сухом ТГФ (10 мл) при 0 С. Затем смесь перемешивали в течение ночи при комнатной температуре. Реакцию останавливали с помощью насыщенного водного раствора NH4Cl (15 мл) и водную смесь подвергали экстракции EtOAc (10 мл 3). Объединнные органические слои промывали рассолом, сушили над безводным Na2SO4 и концентрировали под вакуумом. Остаток очищали посредством хроматографии на силикагеле (РЕ:EtOAc в соотношении 6:1) с получением 1-(4-хлорбензо[b]тиофен-2-ил)этанона в виде тврдого вещества белого цвета (0,6 г, 86,9%). 1 Н ЯМР (400 МГц, CDCl3)8,10-8,07 (с, 1 Н), 7,75 (д, J=5,2, 1H), 7,47-7,36 (м, 2 Н), 2,72-2,68 (с, 3 Н). Следующие соединения, по существу, получали способом, описанным на этапе 207. 1-(4-Хлорбензо[b]тиофен-2-ил)-3-(3,5-дихлорфенил)-4,4,4-трифтор-3 Раствор LiHMDS (1M в ТГФ, 4,3 мл, 4,31 ммоль) добавляли к смеси 1-(4-хлорбензо[b]тиофен-2 ил)этанона (0,6 г, 2,87 ммоль) в сухом ТГФ (10 мл) при -78 С в атмосфере N2. После перемешивания в течение 1,5 ч при -78 С к реакционной смеси добавляли 1-(3,5-дихлорфенил)-2,2,2-трифторэтанон (836 мг, 3,44 ммоль) и перемешивали полученную смесь в течение дополнительных 2 ч. Реакцию останавливали с помощью насыщенного раствора NH4Cl и водную смесь подвергали экстракции EtOAc (10 мл 3). Объединнные органические слои промывали рассолом, сушили над безводным Na2SO4 и концентрировали под вакуумом с получением неочищенного 1-(4-хлорбензо[b]тиофен-2 ил)-3-(3,5-дихлорфенил)-4,4,4-трифтор-3-гидроксибутан-1-она в виде тврдого вещества коричневого цвета (1,1 г, 84,6%). 1 Н ЯМР (400 МГц, CDCl3)8,10-8,07 (с, 1 Н), 7,75 (д, J=5,2, 1 Н), 7,47-7,36 (м, 2 Н),2,72-2,68 (с, 3 Н). Следующие соединения, по существу, получали способом, описанным на этапе 211.(1,1 г, неочищенный, 2,43 ммоль), SOCl2 (1,16 г, 0,7 мл, 9,43 ммоль) и пиридина (384 мг, 0,4 мл, 4,86 ммоль) в безводном ДХМ (10 мл) перемешивали при комнатной температуре в течение ночи. Указанную смесь разбавляли насыщенным раствором NH4Cl и водную смесь подвергали экстракции ДХМ (10 мл 3). Объединнные органические слои промывали рассолом, сушили над безводным Na2SO4 и концентрировали под вакуумом с получением неочищенного 1-(4-хлорбензо[b]тиофен-2-ил)-3-(3,5 дихлорфенил)-4,4,4-трифторбут-2-ен-1-она в виде тврдого вещества коричневого цвета (1,05 г, 100%). 1 Н ЯМР (400 МГц, CDCl3)8,12-8,10 (с, 1 Н), 7,69-7,64 (м, 1 Н), 7,47-7,44 (м, 2 Н), 7,38-7,35 (м, 2 Н), 7,277,24 (м, 1 Н), 6,96-6,92 (с, 1 Н). Следующие соединения, по существу, получали способом, описанным на этапе 220. Смесь 1-(4-хлорбензо[b]тиофен-2-ил)-3-(3,5-дихлорфенил)-4,4,4-трифторбут-2-ен-1-она (1,05 г, неочищенный, 2,43 ммоль), NaOH (389 мг, 9,72 ммоль) и NH2OHHCl (335 мг, 4,8 ммоль) в МеОН (8 мл) и воде (8 мл) перемешивали при комнатной температуре в течение 4 ч. После удаления растворителя под вакуумом остаток разбавляли ледяной водой (20 мл). Водную смесь подвергали экстракции EtOAc (15 мл 3). Объединнные органические слои промывали рассолом, сушили над безводным Na2SO4 и концентрировали под вакуумом. Остаток очищали посредством препаративной ВЭЖХ с получением 3-(4 хлорбензо[b]тиофен-2-ил)-5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазола в виде тврдого вещества белого цвета (305 мг, 28,1%). МС (m/z): 450 (М+1). 1 Н ЯМР (400 МГц, CDCl3)7,74 (д, J=8,0,1 Н), 7,64-7,60 (с, 1 Н), 7,57-7,53 (м, 2 Н), 7,47-7,43 (м, 1 Н), 7,40-7,32. Следующие соединения, по существу, получали способом, описанным в примере 229. Смесь 5-бром-2-[5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил]тиено[2,3-b]пиридина (494 мг, 1 ммоль), Pd(dppf)Cl2 (100 мг) и триэтиламина (1 мл) в безводном ТГФ (10 мл) и метаноле (5 мл) в атмосфере монооксида углерода (50 фунт/кв.дюйм) перемешивали при 70 С в течение 10 ч. После удаления растворителя под вакуумом остаток очищали посредством хроматографии на силикагеле(элюируя 10% этилацетатом в петролейном эфире) с получением метилового эфира 2-(5-(3,5 дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)тиено[2,3-b]пиридин-5-карбоновой кислоты в виде тврдого вещества белого цвета (210 мг, 44,18%). МС (m/z): 475 (М+1). Этап получения 239. 2-[5-(3,5-Дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил]тиено[2,3b]пиридин-5-карбоновая кислота Раствор LiOHН 2 О (76 мг, 2 ммоль) в воде (0,5 мл) добавляли к раствору метилового эфира 2-(5(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)тиено[2,3-b]пиридин-5-карбоновой кислоты (237 мг, 0,5 ммоль) в ТГФ (3 мл). Указанную смесь перемешивали при температуре в течение 12 ч. После добавления 10 мл воды указанную смесь подкисляли концентрированной HCl до рН 6-7. Полученную смесь подвергали экстракции этилацетатом (310 мл). Объединнные органические слои промывали рассолом, сушили над безводным Na2SO4 и концентрировали под вакуумом с получением 2-[5-(3,5 дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил]тиено[2,3-b]пиридин-5-карбоновой кислоты в виде тврдого вещества бледно-жлтого цвета (170 мг, 73,9%), которое применяли на следующем этапе без дополнительной очистки. МС (m/z): 461 (М+1). Пример 240. 2-(5-(3,5-Дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-N-(2-оксо-2(2,2,2-трифторэтиламино)этил)тиено[2,3-b]пиридин-5-карбоксамид Смесь 2-амино-N-(2,2,2-трифторэтил)ацетамида (156 мг, 1 ммоль), 2-[5-(3,5-дихлорфенил)-5 трифторметил-4,5-дигидроизоксазол-3-ил]тиено[2,3-b]пиридин-5-карбоновой кислоты (160 мг, 0,24 ммоль), HATU (150 мг, 0,39 ммоль) и DIPEA (0,2 мл) перемешивали при комнатной температуре в течение 10 ч. После удаления растворителя указанную смесь очищали посредством препаративной ВЭЖХ с получением 2-(5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-N-(2-оксо-2-(2,2,2 трифторэтиламино)этил)тиено[2,3-b]пиридин-5-карбоксамида в виде тврдого вещества белого цвета (50 мг, 34,78%). МС (m/z): 599 (М+1). 1 Н ЯМР (400 МГц, CDCl3)9,02 (с, 1 Н), 8,51 (с, 1 Н), 7,52 (с, 2 Н), 7,447,41 (м, 2 Н), 7,22 (с, 1 Н), 6,64 (с, 1 Н), 4,27 (д, J = 5,2, 2 Н), 4,17 (д, J = 16,8, 1 Н), 4,04-3,95 (м, 2 Н), 3,80 (д,J=16,08, 1 Н). Следующее соединение, по существу, получали способом, описанным в примере 240. Смесь 3-(5-(3,5-дихлор-4-фторфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-5,6-дигидро-4 Нциклопента[с]тиофен-1-карбоновой кислоты (1,0 г, 2,14 ммоль), N,N-диизопропилэтиламина (827 мг,6,41 ммоль), 2-амино-N-(2,2,2-трифторэтил)ацетамида гидрохлорида (658 мг, 2,56 ммоль) и HATU (1,2 г,3,2 ммоль) в CH2Cl2 (10 мл) перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь разбавляли CH2Cl2 (50 мл) и промывали водой (10 мл 3) и рассолом. Затем органический слой сушили над безводным Na2SO4 и концентрировали под вакуумом. Остаток очищали посредством препаративной ВЭЖХ с получением 3-(5-(3,5-дихлор-4-фторфенил)-5-трифторметил-4,5-дигидроизоксазол-3 ил)-N-(2-оксо-2-(2,2,2-трифторэтиламино)этил)-5,6-дигидро-4 Н-циклопента[с]тиофен-1-карбоксамида в виде тврдого вещества белого цвета (1,1 г, 84,6%). МС (m/z): 606,0 (М+1). Пример 243. (S)-3-(5-(3,5-дихлор-4-фторфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-N-(2 оксо-2-(2,2,2-трифторэтиламино)этил)-5,6-дигидро-4 Н-циклопента[с]тиофен-1-карбоксамид 1 г 3-(5-(3,5-дихлор-4-фторфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-N-(2-оксо-2-(2,2,2 трифторэтиламино)этил)-5,6-дигидро-4 Н-циклопента[с]тиофен-1-карбоксамида разделяли посредством СФХ с получением (S)-3-(5-(3,5-дихлор-4-фторфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил)-N-(2 оксо-2-(2,2,2-трифторэтиламино)этил)-5,6-дигидро-4 Н-циклопента[с]тиофен-1-карбоксамида (400 мг,выход 80%, э.и. 100%). 1 Н ЯМР (400 МГц, CDCl3)7,56 (д, J=6,0, 2 Н), 6,92 (т, J=6,4, 1 Н), 6,76 (т, J=4,8, 1 Н), 4,21 (д, J=4,8,2 Н), 3,98 (м, 3 Н), 3,61 (д, J=16,8, 1 Н), 2,97 (т, J=7,6, 2 Н), 2,89 (т, J=7,6, 2 Н), 2,55 (м, 2 Н). МС (m/z): 606,0(М+1). Условия анализа посредством СФХ: колонка Chiralcel AD-H 2504,6 мм I.D., 5 мкм. Подвижная фаза: этанол в СО 2 от 5 до 40% в течение 3 мин. Скорость потока: 2,35 мл/мин. Длина волны: 220 нм. Sизомер элюировали в течение 1,4 мин. Условия разделения посредством СФХ: прибор Thar SFC 80; колонка AD 250 мм 20 мм, 20 мкм; подвижная фаза А: сверхкритический СО 2, В: МеОН (0,05%
МПК / Метки
МПК: A01N 43/80, C07D 413/14, C07D 495/04, C07D 413/04
Метки: соединения, составы, способы, антипаразитарные
Код ссылки
<a href="https://eas.patents.su/30-23711-antiparazitarnye-soedineniya-sposoby-i-sostavy.html" rel="bookmark" title="База патентов Евразийского Союза">Антипаразитарные соединения, способы и составы</a>
Предыдущий патент: Устройство для замены грузовой тележки
Следующий патент: Комбинации активных соединений, содержащие производное соединение (тио)карбоксамида и фунгицидное соединение
Случайный патент: Имидазопиридазины в качестве ингибиторов akt киназы