Бензотиофены, составы их содержащие и способы с их использованием.
Формула / Реферат
1. Соединение формулы I
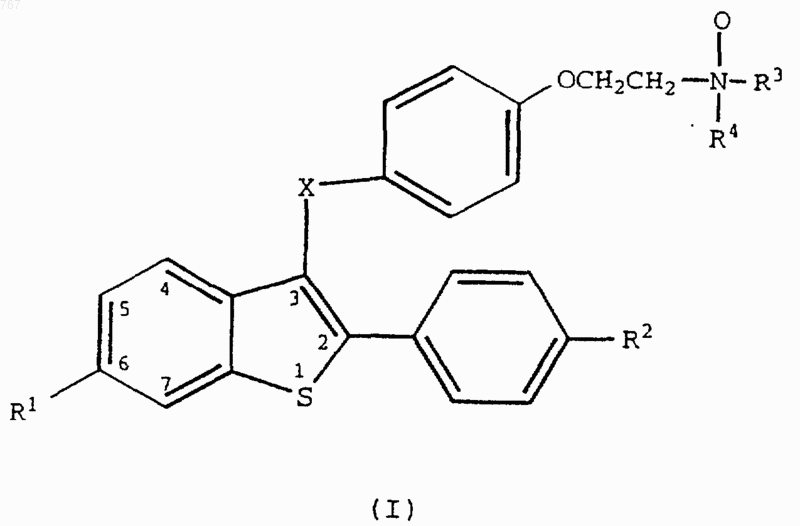
где R1 - водород, гидрокси, C1-C4 алкокси,
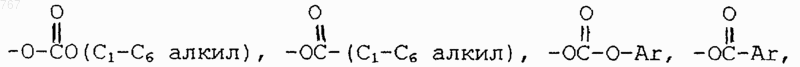
где Аr необязательно замещенный фенил, или -OSO2 (нормальный C4-C6 алкил);
R2 - является R1, Сl или F;
R3 и R4 являются, независимо, C1-C4 алкилом или объединяются с образованием С4-С6 полиметилена, либо вместе с азотом, к которому они присоединены, образуют морфолин;
Х является -CH2-, -CHOH2-, -О-, или 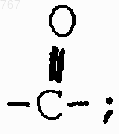
или его фармацевтически приемлемая соль или сольват.
2. Соединение, согласно п.1, представляющее собой [2-(4-гидроксифенил)-6-гидроксибензо[в]тиен-3-ил][4-[2-(1-пиперидинил)этокси]фенил]метанон-N-оксид.
3. Соединение, согласно п.2, представляющее собой соль хлористо-водородной кислоты.
4. Соединение согласно п.1, представляющее собой [6-гидрокси-3-[4-[2-(1-пиперидинил) этокси]фенокси]-2-(4-метоксифенил)]бензо[в]тиофен-N-оксид.
5. Соединение согласно п.1, представляющее собой [6-гидрокси-3-[4-[2-(1-пиперидинил) этокси]фенокси]-2-(4-гидроксифенил)бензо[в]тиофен-N-оксид.
6. Соединение согласно п.4, представляющее собой соль хлористо-водородной кислоты.
7. Способ ингибирования остеопороза, который включает введение пациенту, нуждающемуся в этом, эффективного количества соединения по п.1.
8. Способ снижения уровней холестерина в сыворотке, который включает введение пациентам, нуждающимся в этом, эффективного количества соединения по п.1.
9. Способ ингибирования эстрогензависимых злокачественных новообразований, включающий введение пациентам, нуждающимся в этом, эффективного количества соединения по п.1.
10. Фармацевтическая композиция, включающая соединение формулы I по п.1, дополнительно включающая [2-(4-гидроксифенил)-6-гидроксибензо[в]тиен-3-ил][4-[2-(1-пиперидинил)этокси] фенил]метанона гидрохлорид и, необязательно, фармацевтически приемлемые носители, разбавители или наполнители.
11. Композиция по п.10, отличающаяся тем, что соединение формулы I составляет менее 10% по весу от общего количества активных ингредиентов.
12. Композиция по п.11, отличающаяся тем, что соединение формулы I составляет менее 1% по весу от общего количества активных ингредиентов.
13. Композиция по п.12, отличающаяся тем, что соединение формулы I составляет менее 0,3% по весу от общего количества активных ингредиентов.
14. Композиция по п.10, отличающаяся тем, что соединение формулы I является [2-(4-гидроксифенил)-6-гидроксибензо[в]тиен-3-ил][4-[2-(1-пиперидинил)этокси]фенил]метанон-N-оксид.
Текст
1 Это изобретение относится к областям фармацевтической и органической химии и обеспечивает соединения бензотиофена, полезные для лечения при различных медицинских показаниях, связанных с постклимактерическим синдромом, и лечения и предупреждения рака молочной железы. Кроме того, изобретение относится к фармацевтическим композициям. Предпосылки создания изобретения Остеопороз включает группу заболеваний различной этиологии, но которые все характеризуются снижением плотности кости в результате потери массы костного вещества на единицу объема. Следствием такой потери массы костной ткани и происходящих в результате этого переломов костей является повреждение скелета и потеря способности обеспечить адекватную структурную опору для тела. Одним из наиболее обычных типов остеопорозов является остеопороз, связанный с менопаузой. Большинство женщин теряют от 20 до 60% костной массы в трабекулярных отделах костей в течение 3-6 лет после прекращения менструаций. Эта быстрая потеря связана, в основном, с увеличением резорбции и формирования костей. Однако резорбтивный цикл преобладает и результатом является потеря костной массы. Остеопороз общее и серьезное заболевание женщин, находящихся в постклимактерическом периоде. Только в США около 25 миллионов женщин страдает этим заболеванием. Последствия остеопороза пагубны для отдельных людей, а также приводят к большим экономическим потерям, вследствие хронического характера этого заболевания и необходимости интенсивной и долговременной поддержки пациентов (госпитализация и уход за больными дома) из-за осложнений. Это касается преимущественно более пожилых пациентов. Хотя обычно полагают,что остеопороз не является угрожающим жизни состоянием, от 20 до 30% случаев смертности пожилых женщин связаны с переломами верхней части бедренной кости. Такой высокий процент смертности может быть обусловлен непосредственно постклимактерическим остеопорозом. Наиболее уязвимыми тканями кости к воздействию постклимактерического остеопороза являются трабекулярные ткани. Подобная костная ткань находится в сетчатых и губчатых костях и концентрируется около концов кости(около суставов) и в поперечных отростках позвонков. Трабекулярная ткань характеризуется наличием небольших остеоидных структур, которые соединяются друг с другом, так же как и наличием более однородной и плотной кортикальной ткани, которая составляет внешнюю поверхность и центральный стержень кости. Эта взаимосвязанная сетчатая структура трабекул составляет латеральную опору внешней кортикальной структуре и является существенной для биомеханической устойчивости всей структуры. 2 При постклимактерическом остеопорозе резорбция сетчатой структуры и потеря трабекул приводит к декомпенсации и перелому кости. В свете разрушения трабекул не является неожиданным то, что у женщин, находящихся в постклимактерическом периоде, большинство переломов связаны с костями, в которых очень важна трабекулярная опора, т.е. это позвонки,шейки костей, выдерживающих нагрузку, таких как бедренная кость и предплечье. Действительно, перелом бедренной кости, перелом Коллиса (классический перелом лучевой кости) и компрессионные переломы позвонков характерны для постклимактерических остеопорозов. В настоящее время основными двумя общепринятыми методами лечения постклимактерических остеопорозов являются эстрогензаместительная терапия и введение бисфосфонатов. Хотя терапия, в основном, успешна, эффективность лечения эстрогеном низкая,главным образом вследствие того, что лечение эстрогеном приводит к нежелательным побочным эффектам. Терапия бис-фосфонатами оказалась успешной при лечении остеопорозов с некоторыми серьезными побочными эффектами, однако, эти препараты не эффективны в отношении других симптомов, связанных с менопаузой. В течение всего предменопаузального периода женщины менее подвержены сердечнососудистым заболеваниям, чем мужчины аналогичного возраста. После менопаузы, однако,частота сердечно-сосудистых заболеваний медленно увеличивается, приближаясь к частоте заболеваний среди мужчин. Эта утрата защиты связана с потерей эстрогена и, главным образом,способности эстрогена регулировать уровни липидов в сыворотке. Природа способности эстрогена регулировать уровни липидов в сыворотке не совсем понятна, но имеющиеся данные указывают, что эстроген может активировать рецепторы липидов низкой плотности (LDL) в печени, что приводит к выведению избытка холестерина. Кроме того, оказалось, что эстроген оказывает некоторое влияние на биосинтез холестерина и другие благоприятные воздействия на состояние сердечно-сосудистой системы. Имеются сообщения, что у женщин в постклимактерическом периоде эстрогензаместительная терапия восстанавливает уровни липидов в сыворотке до концентраций, которые были в предклимактерическом состоянии. Из этого следует, что эстроген может быть полезным при лечении данного состояния. Однако побочные эффекты, возникающие при эстрогензаместительной терапии, неприемлемы для многих женщин, что ограничивает применение этой терапии. Идеальным для терапии этого состояния мог бы быть агент, который будет регулировать уровни липидов в сыворотке, как это делает эстроген, но не будет оказывать побоч 3 ных эффектов и вызывать рисков, которые сопровождают лечение эстрогеном. Эстрогензависимые раки, особенно карцинома молочной железы, являются главной медицинской проблемой, касающейся женщин, в особенности, в возрасте от 35 до 65 лет. Установлено, что у большинства женщин имеется одна из десяти возможностей развития рака молочной железы в процессе жизни. Карцинома молочной железы является главной причиной смертности женщин, а также приводит к нарушению трудоспособности, психологической травме и экономическим потерям. Большой процент женщин, страдающих этим заболеванием, в конце концов, умирает либо от основного заболевания непосредственно, либо от осложнений, а именно метастазов, потери общего здоровья или побочных явлений от терапевтических воздействий, таких как хирургия, облучение или химиотерапия. Большой успех был достигнут с применением терапии, базирующейся на введении гормонов. Наиболее широко распространена терапия с использованием тамоксифена. Пять лет продления жизни для женщин с карциномой молочной железы является поразительным успехом этой терапии; однако, долговременного продления продолжительности жизни (10 лет+) не происходит. Таким образом, даже при наилучшем сочетании лечебных средств, например хирургии, излучения и/или химиотерапии, долговременный прогноз для пациентов - плохой,особенно, если имеется метастатическое заболевание. Ясно, чтосуществует большая потребность в улучшенных методах лечения и, возможно, что более важно, необходимость профилактики заболевания в первую очередь. В ответ на определенную потребность в новых фармацевтических агентах, которые способны облегчить симптомы, помимо прочего,постклимактерического синдрома и лечения эстрогензависимых раков, настоящее изобретение представляет соединения бензотиофена,фармацевтический состав их и способы использования таких соединений для ингибирования потери костной массы-остеопороза, для снижения уровней холестерина в сыворотке и для подавления эстрогензависимых раков. Специалистам в области органической химии хорошо известно, что окисление азота в соединениях приводит к снижению их основности и увеличению их полярности, т.е. эти соединения оказываются более нейтральными и, в основном, более водорастворимыми. Известно,что in vivo большинство аминосодержащих лекарственных соединений окисляются до Nоксидов в процессе их метаболизма и экскреции, так как это является общим механизмом выделения основных соединений для живых организмов. Часто окисление азота приводит к образованию соединений, которые фармакологически менее активны или неактивны по срав 000767 4 нению с их исходными основаниями; однако,этот процесс непредсказуем и должен быть исследован (см: Гудман и Гилман "Фармакологические основы терапии", Goodman and Gilman's,"The Pharmacological Basis of Therapeutics", 6 th,Ed., Macmillan Publishing Co., NYC, Chap. 1,1980). Например, N-окисление в противораковых соединениях - алколоидах Vinca приводит к биологической инактивации (см: Barnett, C.J., etal., J. Med. Chem., 21(1), p. 88-96, 1978). Краткое изложение сущности изобретения Это изобретение представляет соединение формулы IR3 и R4 являются независимо C1-C4 алкилом или объединяются с образованием С 4-С 6 полиметилена или вместе с азотом, к которому они присоединены, образуют морфолин, и Х является -СН 2-, -CHOH2-, -О-, или или его фармацевтически приемлемую соль или сольват. Данное изобретение также относится к фармацевтическим композициям, содержащим соединение формулы I, одно или в сочетании с другими активными ингредиентами. Подробное описание изобретения Данное изобретение относится к открытию того факта, что выбранная группа 2-арил-3 ароил (3-арилметил, или 3-фенокси) бензо[в]тиофен амин N-оксидов, т.е. соединения формулы I, являются полезными для лечения или предупреждения остеопороза, гиперлипидемии и эстрогензависимых раков, особенно,рака молочной железы. В вышеприведенной формуле, термин "C1C6 алкил" представляет нормальную или разветвленную цепь алкила, имеющую от 1 до 6 атомов углерода. Типичные C1-C6 алкильные группы включают метил, этил, н-пропил и нбутил. Термин "C1-C4 алкокси" включает такие группы, как метокси, этокси, н-пропокси и нбутокси. Необязательно замещенный фенил включает фенил и фенил, одно или двузамещенный: 5 Когда R3 и R4 образуют C4-C6 полиметилен, последний включает тетраметилен, пентаметилен и гексаметилен. С азотом, к которому они присоединяются, R3 и R4 образуют, например, пирролидино, пиперидино и гексаметилениминогруппы. Термин "сольват" представляет агрегат,который содержит одну или более молекул растворенного вещества, такого как соединение формулы I, с молекулой растворителя. Термин "ингибирование" включает препятствие, предохранение, сдерживание, облегчение, улучшение, замедление, остановку и прекращение развития процесса, либо его остроту,либо аналогичное действие на проявившийся симптом. По существу данное изобретение включает как медицинское терапевтическое, так и/или профилактическое применение, соответственно. Предпочтительные соединения данного изобретения следующие:(формула I) получены посредством избирательного окисления основного азота соединений формулы II, представленной ниже Соединения формулы II могут быть получены в соответствии с известными методиками. Соединения формулы II, где Х является -СО-,можно получить по методам, описанным в Патентах США 4 133 814, 4 418 068 и 4 380 635, которые указаны здесь в качестве ссылок. Вообще, способ начинается с бензо[в]тиофена, имеющего 6-гидроксигруппу и 2(4-оксифенильную)группу. Исходное соединение защищают, ацилируют и удаляют защиту с получением соединений формулы II. Примеры 6 получения таких соединений представлены в патентах США, приведенных выше. Соединения формулы II, которые являются эфирами карбоновых кислот или сульфонатами,могут быть получены по методам, описанным в Патентах США 5 393 763,5 482 949 и 5 482 949, включенных в данную заявку в качестве ссылки. Необходимость модификаций вышеупомянутых методов может быть обусловлена реакционноспособными функциональными группами конкретных заместителей. Такие модификации должны быть очевидны и понятны для специалистов в области органической химии. Соединения формулы II, где Х является-СН 2- или -СНОН-, могут быть получены по методам, описанным в Патенте США 5 484 798, который указан в качестве ссылки. Вкратце, восстановление карбонила до карбинола и далее до метилена может осуществляться ступенчато или от карбонила до метилена протекать в одну стадию. Карбонильные соединения формулы II могут быть восстановлены до карбонила с LiAlH4,NaBH4, или подобным реагентом в соответствующем растворителе, таком как хлорорганический растворитель, ТГФ, эфир и так далее, при температуре 0-30 С. Карбинол восстанавливается до метилена алкилсиланами и трифторуксусной кислотой, например триэтилсиланом, в соответствующем растворителе, таком как хлористый метилен, или ТГФ при комнатной температуре. Альтернативно, карбонильное соединение можно восстанавливать непосредственно до метилена используя LiAlH4 в растворителе с высокой точкой кипения, таком как пропилбензол при температуре флегмы. Соединения формулы II, где Х является-О-, можно получить по методам, описанным в Патенте США 5 488 058, который приведен в качестве ссылки. Кратко, 2-арилбензо[в]тиофен бромируется по положению 3. Этот бромид замещается феноксидом, содержащим основную боковую цепь, в условиях реакции УльманаII по боковой цепи в положениях 3-ароил, 3 фенокси или 3-арилметил осуществляют при использовании разбавленных водных растворов Н 2 О 2 с сорастворителем, таким как метанол, или этанол, или галогенированными углеводородами. Реакционные условия для этой реакции могут изменяться от комнатной температуры до 100 С и продолжительность от 1 до 72 ч. Следует отметить, что необходимо проявлять осторожность при выборе окисляющих агентов и что большинство обычно используемых агентов, например СrО 3, КМnO4 и др., окисляющие азот, нельзя использовать, так как они также могут окислить серу в бензо[в]тиофене. Таким образом, более слабый агент - Н 2O2 предпочтителен. Примеры получения соединений форму 7 лы I, использующие этот метод, перечислены ниже. Ниже представлены примеры получения соединений формулы I. Они представлены для иллюстрации, но не рассматриваются для ограничения объема этого изобретения. Далее в примерах использованы следующие обозначения:MS - МС (масс. спектр) ЭА - элементный анализ Пример 1.[2-(4 гидроксифенил)-6-гидроксибензо[в]тиен-3 ил][4-[2-(1-пиперидинил)этокси]фенил]метанона растворяют в 150 мл кипящего с обратным холодильником EtOH и добавляют 15 мл 30% водного раствора H2O2. Реакционную смесь кипятят в течение 18 ч, затем проверяют завершенность реакции с помощью тонкослойной хроматографии. Добавляют дополнительные 15 мл 30% Н 2 О 2, и реакция протекает еще в течение 18 ч при температуре флегмы. Затем охлаждают и летучие растворители удаляют выпариванием под вакуумом. Сырой продукт повторно растворяют в СНСl3 и распределяют с водой. СНСl3 слой сушат фильтрацией через безводный Na2SO4 и упаривают до сухого состояния. Получают выход 1590 мг названного соединения в виде светло-желтого аморфного порошка. ПМР: (CDCl3-DMSO-d6) 7.70(d, J=6Hz,2H), 7.43 (d, J=4Hz, 1H), 7.27 (d, J=1Hz, 1H), 7.15 8 акционная смесь сначала становится мутной, но через несколько часов светлеет. Реакция протекает в течение 72 ч при комнатной температуре. Реакционную смесь выпаривают до сухого состояния и экстрагируют в 100 мл EtOAc. Раствор EtOAc промывают разбавленным воднымNalco и сушат фильтрацией через безводныйNa2SO4. Добавляют гексан и раствор оставляют для кристаллизации при -20 С. Рыжеватокоричневое твердое вещество фильтруют, сушат и получают выход 720 мг названного соединения. ПМР: соответствует предполагаемой структуре МС: m/е=501 (М-16) FD[2-(4-гидроксифенил)-6 оксибензо[в]тиен-3-ил][4-[2-(N,N-диэтил)этокси]фенил]метанона N-окись. 2000 мг (4,33 ммоль) [2-(4-оксифенил)-6 оксибензо[в]тиен-3-ил][4-[2-(N,N-диэтил) этокси]фенил]метанона растворяют в 60 мл метанола и добавляют 10 мл 30% Н 2 О 2. Реакция протекает в течение 18 ч при температуре окружающей среды. Реакционную смесь выпаривают до сухого состояния и повторно растворяют в 100 мл EtOAc. Раствор EtOAc промывают водой и сушат над Na2SO4, выпаривают до сухого состояния. Получают выход 1150 мг вышеназванного соединения в виде рыжеватокоричневого аморфного порошка. ПМР: согласуется с предполагаемой структурой МС: m/e=478 (M+) и 462 (М-16) FD рКа: 6.15 кажущийся молекулярный вес=498 (66% DMF)[2-(4-гидроксифенил)-6 гидроксибензо[в]тиен-3-ил][4-[2-(1-морфолин) этокси]фенил]метанона N-окись. 1100 мг (2,23 моль) [2-(4-гидроксифенил)6-гидроксибензо[в]тиен-3-ил][4-[2-(1-морфолин)этокси]фенил]метанона растворяют в 50 мл метанола и добавляют 30 мл 10% Н 2 О 2. Реакция протекает в течение 18 ч при комнатной температуре. Реакцию проверяют по результатам тонкослойной хроматографии (ТСХ) и добавляют дополнительные 10 мл 30% H2O2. Реакция продолжается в течение дополнительных 18 ч. Реакционную смесь выпаривают до сухого состояния и повторно растворяют в 100 мл EtOAc. Раствор EtOAc промывают разбавленным, водным раствором NaCl, сушат с Na2SO4 и выпаривают до сухого состояния. Выход 460 мг вышеназванного соединения в виде рыжеватокоричневого аморфного порошка. ПМР: соответствует предполагаемой структуреN-окись. 1250 мг (1,27 ммоль) [2-(4-н-бутилсульфоноилфенил)-6-н-бутилсульфоноилбензо[в] тиен-3-ил][4-[2-(1-пиперидинил)этокси]фенил] метанона растворяют в 125 мл МеОН и добавляют 25 мл EtOH и 30 мл 30% Н 2O2. Реакция протекает в течение 18 ч при температуре окружающей среды. Реакционную смесь выпаривают до сухого состояния и повторно растворяют в 100 мл EtOAc. Раствор EtOAc промывают водой, высушивают над Na2SO4 и выпаривают досуха. Получают 390 мг указанного соединения в виде рыжевато-коричневого аморфного порошка. ПМР: соответствует предполагаемой структуре МС: m/е=730 (M+) и 714 (М-16) FD(об./об.) Пример 6. [2-(4-оксифенил)-6-оксибензо[в] тиен-3-ил][4-[2-(1-пиперидинил)этокси]фенил] метанол N-окись. Раствор готовят из 10 мл 10% Н 2 О 2 и 100 мл МеОН. К этому раствору добавляют 476 мг(1 ммоль) [2-(4-оксифенил)-6-оксибензо[в]тиен 3-ил][4-[2-(1-пиперидинил)этокси]фенил] метанола. Реакция протекает в течение 20 ч при температуре окружающей среды. Реакционную смесь выпаривают до сухого состояния и продукт растирают несколько раз с толуолом. Продукт сушат в вакууме. Получают 230 мг заявленного соединения в виде рыжеватокоричневого некристаллического порошка. ПМР: соответствует предполагаемой структуре МС: m/e=492 (M+) 476 (М-16) FD рКа: =6.41 ЭА: Расчет: для C28H29NO5S-2H2O: С 63.7; Н 5.87; N 2.65 Обнаружено: С 63.13; Н 5.81; N 2.43 Пример 7.[2-(4-гидроксифенил)-6 гидроксибензо[в]тиен-3-ил][4-[2-(1-пиперидинил)этокси]фенил]метан N-окись. Раствор готовят из 20 мл 10% Н 2 О 2 и 100 мл МеОН, к которому добавляют 1500 мг (3,27 ммоль)[2-(4-гидроксифенил)-6-гидроксибензо[в]тиен-3-ил][4-[2-(1-пиперидинил)этокси] фенил] метана. Реакционную смесь перемешивают при окружающей температуре в течение 20 ч. Реакционную смесь выпаривают до сухого состояния под вакуумом при температуре окружающей среды в течение нескольких дней. Получают 1090 мг заявленного соединения в виде рыжевато-коричневого аморфного порошка. ПМР: (СDСl3) 7.42(d, J=4Hz, 4H), 7.40 (d,J=4Hz, 1H), 7.38 (d, J=1Hz, 1H), 7.18 (d, J=4Hz, 000767H2O2 (0,5 мл 30% раствора). Полученную смесь осторожно подогревают на водяной бане до тех пор, пока ТСХ-анализ не показывает окончание реакции (1-2 ч). Растворитель удаляют под вакуумом для получения желтого твердого вещества, которое растирают до получения порошка из EtOH/Et2O. После фильтрации получают 46 мг (92%) заявленного соединения в виде желтого твердого вещества.FD mass spec: 492, 475, 390, 364. ЭА Рассчитано для С 28 Н 29NO5S0,45 Н 2 О: С 67.30; Н 6.03; N 2.80 Обнаружено: С 67.31; Н 5,96; N 2.57 Пример 9. [6-гидрокси-3-[4-[2-(1-пиперидинил)этокси]фенокси]-2-(4-гидроксифенил)] бензо[в]тиофен-N-окись. Получено вышеприведенное соединение по методике, подобно описанной в примере 8.FD mass spec: 477, 460. ЭА Рассчитано для С 27H27NO5S 0,5 Н 2 О: С 66.65; Н 5.80; N 2.88. Обнаружено: С 66.66; Н 5.98; N 2.89. Следующие примеры иллюстрируют способы применения соединений формулы I в экспериментальных моделях или клинических исследованиях. Методы исследования Общий метод получения Из примеров, иллюстрирующих методы исследования, выбрали модель постклимактерического синдрома, на которой изучали влияние различных видов терапии на уровни циркулирующих липидов. Самки крыс Spraque Dawley в возрасте 75 дней (вес колебался от 200 до 225 г) были получены от Charles River Laboratories лаборатории(Portage, MI). Животные подвергались либо двустороннему удалению яичников (овариэктомии), либо хирургическому вмешательству по методу Шама (Sham) в Charles River Laboratories, после чего через одну неделю их перевозили. Полученных животных размещают в металлических подвешенных клетках по 3-4 на клетку и обеспечивают им свободный доступ к пище(содержание кальция 0,5%) и воде в течение одной недели. Комнатная температура поддерживалась при 22,21,7 С с минимальной относительной влажностью 40%. Световой режим в помещении составлял 12 ч света и 12 ч темноты. Режим сбора материала. После периода акклиматизации в течение одной недели (т.е. через 2 недели после овариэктомии) было начато введение животным опытного соединения. 17-этинилэстрадиол или исследуемое соединение вводили животным орально, если не указан особо другой способ, в виде суспензии в 1% карбоксиметилцеллюлозе или растворенным в 20% циклодекстрине. Животные получали дозу препарата в течение 4 дней. После этого животных взвешивали, делали им анестезию смесью кетамин-хилазин (2:1, об/об) и отбирали образцы крови посредством пункции сердца. Затем умерщвляли животных посредством асфиксии СО 2, удаляли матку через разрез по средней линии и определяли влажный вес матки. Анализ холестерина. Образцы крови оставляли для свертывания при комнатной температуре в течение 2 ч, полученную сыворотку центрифугировали в течение 10 мин при 3000 об./мин. Холестерин сыворотки определяли по высокоэффективному методу по BoehringerMannheim Diagnostics. Вкратце, холестерин окисляли до холест-4-ен-3-она и перекиси водорода. H2O2 далее взаимодействовала с фенолом и 4-аминофеназоном в присутствии пероксидазы с образованием п-хинониминового красителя, который измеряли спектрофотометрически при 500 нм. Концентрацию холестерина рассчитывали по стандартной кривой. Полное исследование автоматизировали используя BiomekAutomated Workstation. Исследование пероксидазы эозинофилов матки. До исследования фермента матки хранили при 4 С. Затем матки гомогенизировали в 50 объемах 50 мМ трис-буфера (рН 8,0), содержащего 0,005% тритона Х-100. При добавлении 0,01% Н 2 О 2 и 10 мМ о-фенилендиамина (конечная концентрация) в трис-буфер наблюдали увеличение в поглощении в течение 1 мин при 450 нм. Присутствие эозинофилов в матке указывает на эстрогенную активность соединения. Максимальную скорость определяли с 15 минутными интервалами относительно начального линейного участка реакционной кривой. Источник соединения: 17-этинилэстрадиол был получен от фирмы: Sigma ChemicalCo., St. Louis, МО. Гиперлипидемия. В таблице представлены результаты сравнительного исследования крыс после удаления яичников,крыс,обработанных 17 этинилэстрадиолом (ЕЕ 2; 17-ЭЭ), и крыс, обработанных определенным соединением изобретения. Хотя 17-ЭЭ вызывал снижение уровня холестерина в сыворотке при оральном введении в концентрации 0,1 мг/кг/день, он также оказывал стимулирующее влияние на матку так,что вес 17-ЭЭ-матки был существенно больше,чем вес матки животных после удаления яичников. Такой ответ матки на эстроген известен в данной области. Соединения данного изобретения снижали уровень холестерина в сыворотке по сравнению с таковым у животных после овариэктомии. Как показано в нижеприведенных данных,эстрогенность также оценивали по выраженности ответа эозинофильной инфильтрации в матку. Соединения этого изобретения не вызывали значительного увеличения в количестве эозинофилов, обнаруженных в стромальном слое матки крыс после овариэктомии. 17-ЭЭ вызывал существенное и ожидаемое увеличение в инфильтрации эозинофилами. Данные, представленные в таблице, показывают ответ 5-6 крыс на опытную группу. Увеличение веса матки %б) 207,5 х 31,2 х 29,6 х 8,3 49,2 х 77,5 х 62,5 х 44,4 х Таблица Эозинофилы матки Холестерин сыво(Vмакс)в) ротки %г) х 205,8 87,3 х 4,4 44,9 х 4,6 68,7 х 2,5 70,3 х 11,2 65,7 х х 21,7 64,2 х 4,1 56,2 х 4,7 74,9 х 17 - этинилэстрадиол вес матки, % увеличения относительно контролей после овариэктомии в пероксидаза эозинофилов Vмаксимальн. г снижение холестерина сыворотки относительно контролей после овариэктомии х р.05 б Метод исследования остеопороза После общей подготовки, крыс ежедневно в течение 35 дней лечили (6 крыс на опытную группу), затем крыс умерщвляют посредством асфиксии СО 2 (двуокись углерода) на 36-ой день. Период в течение 35 дней достаточен для выявления максимального снижения плотности кости, определенной как описано ниже. В момент забоя крыс матку удаляли, освобождали от посторонней ткани, жидкое содержимое удаляли перед определением влажного веса для подтверждения дефицита эстрогена, связанного с полной овариэктомией. Вес матки обычно снижался на 75% в ответ на удаление яичников. Матки затем помещали в 10% раствор нейтрального буферированного формалина для последующего гистологического исследования. Правые бедренные кости иссекали, обрабатывали рентгеновскими лучами и анализировали дистальные метафизисы с помощью программы анализа изображения (NIH image). Проксимальную часть (расположенную ближе к центру) большеберцовых костей этих животных сканировали с помощью количественной компьютерной томографии. В соответствии с вышеизложенными методами, соединения данного изобретения и 17-ЭЭ в 20% гидроксипропил -циклодекстрине орально вводили исследуемым животным. Суммируя сказанное: удаление яичников у исследуемых животных вызывает значительное снижение плотности бедренной кости по сравнению с интактными, обработанными только носителями-контролями. Введенный орально 17-ЭЭ предотвращал эту потерю костной массы,но существовал риск стимуляции матки при этой обработке. Соединения данного изобретения предотвращают потерю костной массы дозазависимым образом. Исследование пролиферации на MCF-7 клеткахMCF-7 клетки аденокарциномы молочной железы (АТСС НТВ 22) содержали в MEM (минимальная существенная среда без фенола, фирмы Sigma, St. Louis, МО) с добавлением 10% эмбриональной бычьей сыворотки (FBS)(об./об.),(N-[2 оксиэтил]пиперазин-N-[2-этансульфоновая кислота]10 мМ, ненезаменимые аминокислоты и бычий инсулин (1 мкг/мл) (поддерживающая среда). За 10 дней до исследования MCF-7 клетки переводили в поддерживающую среду, лишенную эмбриональной бычьей сыворотки(ДСС-FBS) добавлением древесного угля, покрытого 10% декстраном, (среда исследования) вместо 10% эмбриональной бычьей сыворотки,для истощения запаса собственных стероидов.MCF-7 клетки удаляли из колб с поддерживающей средой, используя среду диссоциации клеток (Са-М без HBSS (без фенолового красного), обогащенную 10 мМ HEPES и 2 мМ ЭДТА - этилендиамин-тетрауксусной кислоты). Клетки дважды промывали средой исследования и доводили до концентрации 80000 клеток/мл. Приблизительно 100 мкл (8000 клеток) добавляли в ячейки с плоским основанием для микрокультур (Costar 3596) и инкубировали при 37 С в 5% CO2 в увлажненном инкубаторе в течение 48 ч, чтобы произошло сцепление и уравновешивание клеток после переноса. Серийные разбавления веществ или ДMSO (диметилсульфоксид) в качестве контрольного разбавителя готовили на среде исследования и по 50 мкл трижды вносили в ячейки микрокультур с последующим добавлением 50 мкл среды исследования до конечного объема 200 мкл. После дополнительных 48 ч инкубирования при 37 С в 5% CO2-увлажненном инкубаторе, материал метили тимидином, меченым по тритию (1 ед.Ci на ячейку), в течение 4 ч. Культивирование завершали замораживанием культур при -70 С в течение 24 ч с последующим оттаиванием и собиранием клеток из ячеек микрокультур, используя Skatron Semiautomatic Cell Harvester. Образцы обсчитали, используя жидкостную сцинтилляцию в -счетчике Wallac BetaPlace. Например, в этом анализе соединение из примера 1 имело IC50 приблизительно 1 мкМ. 15 ДМВА-индуцированное ингибирование опухоли молочной железы Образование эстрогензависимых опухолей молочной железы вызывали у самок крысSpraque-Dawley, которые были приобретены вHarlan Industries, Indianapolis, Indiana. Крысы в возрасте около 55 дней получали орально однократно 20 мг 7,12-диметилбенз[а]антрацена(ДМВА). Около 6 недель после введения ДМВА молочные железы крыс пальпировали еженедельно для обнаружения появления опухолей. Как только появлялась одна или более опухолей, наибольший и наименьший диаметры каждой из опухолей измеряли метрическим циркулем, измерения регистрировали и отбирали животных для эксперимента. Сделана попытка унифицировать распределение опухолей разных размеров в контрольную группу и группу опытных животных так, чтобы опухоли среднего размера были эквивалентно (равномерно) распределены между исследуемыми группами. Контрольные и опытные группы для каждого опыта содержали от 5 до 9 животных. Соединения формулы I вводили либо внутрибрюшинно в 2% растворе акации, либо орально. Вводимые орально соединения или растворяли, или суспендировали в кукурузном масле. Каждая обработка, включая контрольные обработки акацией и кукурузным маслом, вводилась 1 раз в сутки каждому опытному животному. После измерения исходной опухоли и отбора опытных животных, опухоли измеряли каждую неделю по вышеупомянутому методу. Обработку животных и измерение опухолей продолжали в течение 3-5 недель, во время которых определяли конечную площадь опухоли. Активность, определенная, по крайней мере, одним из вышеприведенных исследований,иллюстрирует эффективность соединений формулы I. Соединения этого изобретения образуют фармацевтически приемлемые кислые и основные соли-присоединения с разнообразными органическими и неорганическими кислотами и включают физиологически приемлемые соли,которые часто используются в фармацевтической химии. Такие соли также используются в этом изобретении. Типичные неорганические кислоты, использованные для образования таких солей, включают хлористо-водородную,бромисто-водородную,иодисто-водородную,азотную, серную, фосфорную, гипофосфорную и подобные кислоты. Соли, производные органических кислот, таких как алифатические моно и дикарбоновые кислоты, оксиалканоевые фенилзамещенные алкановые кислоты, гидроксидиалканоевые кислоты, гидроксиалкандионовые кислоты, кислоты ароматического ряда, алифатические кислоты и сульфокислоты ароматического ряда также могут быть использованы. Такие фармацевтически приемлемые соли включают: ацетат, фенилацетат, трифторацетат, ак 000767 16 рилат, аскорбат, бензоат, хлорбензоат, динитробензоат, гидроксибензоат, метоксибензоат, метилбензоат, о-ацетоксибензоат, нафталин-2 бензоат, бромид, изобутират, фенилбутират, (3 оксибутират, бутин-1,4-диоат, гексин-1,4-диоат,капрат, каприлат, хлорид, циннамат, цитрат,формиат, фумарат, оксималат, малонат, манделат, никотинат, изоникотинат, оксалат, фталат,тетрафталат, фосфат, кислый монофосфат, кислый дифосфат, метафосфат, пирофосфат, салицилат, себацат, сукцинат, суберат, сульфат, бисульфат, пиросульфат, сульфит, бисульфит,сульфонат, бензолсульфонат, п-бромфенилсульфонат, хлорбензолсульфонат, этансульфонат, 2-гидроксиэтансульфонат, метансульфонат,нафталин-1-сульфонат, нафталин-2-сульфонат,п-толуолсульфонат, ксилолсульфонат, тартрат и подобные соли. Предпочтительными солями являются соли хлористо-водородной кислоты. Фармацевтически приемлемые кислые соли-присоединения образуются обычно посредством реакции соединения формулы I с эквимолярным или избыточным количеством кислоты. Реактанты обычно комбинируются с таким растворителем, как диэтиловый эфир или бензол,метанол, этанол или ацетон. Соли обычно осаждаются из раствора в пределах периода от 1 ч до 10 дней и могут быть изолированы фильтрацией или растворитель может быть отделен общепринятыми средствами. Основания, обычно используемые для образования солей, включают гидроокись аммония, щелочь и гидроокись щелочноземельных металлов, карбонаты, также как алифатические и первичные, вторичные и третичные амины,алифатические диамины. Основания, которые наиболее удобны в получении солейприсоединения, включают гидроокись аммония,углекислый калий, метиламин, диэтиламин,этилендиамин и циклогексиламин. Фармацевтически приемлемые соли обычно характеризуются более высокой растворимостью по сравнению с соединениями, из которых они образованы. И, таким образом, они часто более соответствуют технологии приготовления лекарственных средств в качестве жидкостей и эмульсий. Обычно предпочтительно вводить соединение формулы I в форме кислой солиприсоединения, которая является привычной для введения фармацевтических препаратов,несущих основную группу, такую как кольцо пиперидина. Удобным для введения таких соединений оральный путь. Использованный здесь термин "эффективное количество" означает количество соединения формулы I, или количество соединения формулы I в сочетании с количеством соединения формулы II, которое способствует облегчению симптомов различных патологических состояний описанных здесь. Специфическая доза соединения, введенного в соответствии с этим 17 изобретением, будет определяться особыми обстоятельствами, сопровождающими состояние,которые включают, например, введенное вещество, способ введения, состояние пациента и патологический процесс, который лечат. Типичная суточная доза будет содержать нетоксичную дозировку от 0,1 мг до 1000 мг/день соединения данного изобретения и более конкретно от 20 мг до 200 мг/день. Соединения этого изобретения могут вводиться в организм различными способами,включающими оральный, ректальный, чрескожный, подкожный, внутривенный, внутримышечный и через нос. Эти соединения лучше составлять в композицию до введения, а решение о выборе препарата за врачом. Суммарные активные ингредиенты в таких препаратах составляют от 0,1 до 99,9% по весу от композиции. Под термином "фармацевтически приемлемые" имеют в виду, что носитель,разбавитель, наполнитель и соль должны быть совместимы с другими ингредиентами в препарате и безвредными для реципиента. Активный ингредиент в нижеприведенных препаратах означает соединение формулы I. Технология приготовления лекарственных средств в данном изобретении осуществлена с помощью методов, известных в этой области, и использования известных и легкодоступных ингредиентов. Например, соединения формулы I с или без других активных агентов таких, как соединения формулы II, могут сочетаться с обычными наполнителями, растворителями или носителями и входят в состав таблеток, капсул,суспензий, порошков, и прочее. Примеры наполнителей, растворителей и носителей, которые пригодны для таких композиций, включают следующее: наполнители и материалы, такие как крахмал, сахара, маннит и производные кремневой кислоты; связывающие агенты включают карбоксиметилцеллюлозу и другие производные целлюлозы, алгинаты, желатин и поливинил-пирролидон; увлажняющие агенты включают глицерин; дезинтегрирующие агенты, такие как карбонат кальция, бикарбонат натрия; агенты для замедления растворения, такие как четвертичные соединения аммония; поверхностно-активные агенты, такие как цетиловый спирт, глицерина моностеарат; адсорционные носители - каолин и бентонит; и смазки, такие как тальк, кальций, стеарат магния и твердый полиэтиленгликоль. Соединения также могут быть приготовлены в виде эликсиров или растворов для орального введения или растворов, для парентерального введения, например, внутримышечным,подкожным или внутривенным способом. Кроме того, соединения хорошо соответствуют технологии как дозированные формы с замедленным высвобождением и т.д. Препараты могут быть составлены так, что они будут вы 000767 18 свобождать активный ингредиент только или предпочтительно в особом физиологическом местоположении, возможно, в пределах периода времени. Покрытия, упаковки и защитная матрица могут быть составлены, например, из полимерных веществ или восков. Следующие примеры препаратов только иллюстрируют, но не ограничивают сферу данного изобретения. Композиции Композиция 1. Желатиновые капсулы. Твердые желатиновые капсулы приготовлены с использованием: Ингредиент(мг/капсулу) Активный ингредиент 0,1-1000 Крахмал, NF1) 0-650 Крахмальный текучий порошок 0-650 Силикон жидкий (350 сантистокс) 0-15 1) Национальная Фармакология США Вышеприведенная композиция может быть изменена в пределах приемлемых вариаций. Технология приготовления таблеток с использованием нижеприведенных ингредиентов. Композиция 2. Таблетки. Ингредиент Активный ингредиент Целлюлоза, микрокристаллическая Двуокись кремния (мелкодисперсная) Стеариновая кислота Компоненты смешивали и прессовали с образованием таблеток. Альтернативно, таблетки, каждая из которых содержит 2,5-1000 мг активного ингредиента, готовят следующим образом. Композиция 3. Таблетки. Ингредиент Активный ингредиент Крахмал Целлюлоза, микрокристаллическая Поливинилпирролидон(в виде 10% водного раствора) Натрийкарбоксиметилцеллюлоза Стеарат магния Тальк Активный ингредиент, крахмал и целлюлозу пропускали через сито 45 меш U.S. и тщательно смешивали. Раствор поливинилпирролидона смешивали с полученными порошками, которые затем просеивали через сито 14 меш. Гранулы, полученные таким образом, высушивали при 50-60 С и пропускали через сито 18 меш. Натрийкарбоксиметилкрахмал, стеарат магния и тальк предварительно пропускали через сито 60 меш и затем добавляли к гранулам, которые после смешивания прессовали на машине для изготовления таблеток и получали таблетки. Суспензии, содержащие каждая по 0,1-1000 мг медикамента на 5 мл дозы, готовили следующим образом. Композиция 4. Суспензии. Ингредиент Активный ингредиент Натрийкарбоксиметилцеллюлоза Сироп Раствор бензойной кислоты Корригент Пигмент Очищенная вода до Медикамент пропускали через сито 45 меш и смешивали с натрийкарбоксиметилцеллюлозой и сиропом до образования однородной пасты. Раствор бензойной кислоты, корригент и пигмент разбавляли небольшим количеством воды и добавляли при перемешивании. Затем добавляли необходимое количество воды и получали требуемый объем. Аэрозольные растворы готовили со следующими ингредиентами. Композиция 5. Аэрозоль. Ингредиент Активный ингредиент Этанол Пропеллент 22 (хлордифторметан) Активный ингредиент смешивали с этанолом и смесь добавляли к порции пропеллента 22, охлаждали до 30 С и переносили в приспособление для наполнения тары. Затем требуемое количество подавали в контейнер из нержавеющей стали и разбавляли оставшимся количеством пропеллента. Контейнер снабжали распылителем. Суппозитории получали следующим образом. Композиция 6. Суппозитории. Ингредиент Активный ингредиент Насыщенные глицериды жирной кислоты Активный ингредиент пропускали через сито 60 меш и суспендировали в глицеридах насыщенной жирной кислоты, предварительно расплавленных при минимально необходимом нагревании. Затем смесь выливали в суппозиторную форму с номинальной емкостью 2 г и охлаждали. Внутривенные препараты готовили следующим образом. Композиция 7. Раствор для внутривенного введения. Ингредиент Активный ингредиент Изотонический раствор Раствор, содержащий вышеприведенные ингредиенты, вводили пациентам внутривенно со скоростью 1 мл за 1 мин. Ингредиент Активный ингредиент Премарин Авицел рН 101 Крахмал 1500 Силиконовое масло Твин 80 Каб-O-Сил Композиция 9. Состав капсул II. Ингредиент Активный ингредиент Норэтилнордел Авицел рН 101 Крахмал 1500 Силиконовое масло Твин 80 Композиция 10. Состав таблеток. Ингредиент Активный ингредиент Премарин Кукурузный крахмал, FN Повидон, К 29-32 Авицел рН 101 Авицел рН 102 Кросповидон XL10 Стеарат магния Каб-O-Сил Композиция 8. Желатиновые капсулы. Ингредиент Соединение формулы I Соединение формулы II Крахмал NF Текучий порошок крахмала Силиконовая жидкость (350 сантистокс) Твердые желатиновые капсулы готовили вышеприведенным способом. Вышеприведенную композицию можно изменить в соответствии с приемлемыми вариациями. Таблетированные препараты получены с использованием нижеприведенных ингредиентов. Композиция 9. Таблетки. Ингредиент Соединение формулы II Соединение формулы Целлюлоза, микрокристаллическая Двуокись кремния Стеариновая кислота Компоненты смешивали и прессовали для образования таблеток. Альтернативно, таблетки, каждая из которых содержит 25-1000 мг активного ингредиента, были сделаны следующим образом. Композиция 10. Таблетки. Ингредиент Соединение формулы II Соединение формулы I Крахмал Целлюлоза, микрокристаллическая(в виде 10% водного раствора) Натрийкарбоксиметилцеллюлоза Стеарат магния Тальк Активные ингредиенты, крахмал и целлюлозу пропускали через сито 45 меш и тщательно смешивали. Раствор поливинилпирролидона смешивали с полученным порошком, который затем пропускали через сито 14 меш. Полученные гранулы высушивали при 50-60 С и пропускали через сито 18 меш. Натрийкарбоксиметилкрахмал, стеарат магния и тальк,предварительно просеянные через сито 60 меш, добавляли к гранулам, которые после смешивания прессовали на машине для изготовления таблеток с получением таблеток. Композиция 11. Таблетки. Ингредиент Соединение формулы II Соединение формулы I Крахмал Целлюлоза, микрокристаллическая Поливинилпирролидон(в виде 10% водного раствора) Натрийкарбоксиметилцеллюлоза Стеарат магния Тальк Активные ингредиенты, крахмал и целлюлозу пропускали через сито 45 меш и тщательно смешивали. Раствор поливинилпирролидона смешивали с полученным порошком и затем пропускали через сито 14 меш. Полученные гранулы высушивали при 50-60 С и пропускали через сито 18 меш. Натрийкарбоксиметил крахмал, стеарат магния и тальк после предварительного просеивания через сито 60 меш добавляли к гранулам, которые после смешивания прессовали в машине для изготовления таблеток и получали таблетки. Композиция 12. Таблетки. Ингредиенты Соединение формулы II Соединение формулы I Крахмал Целлюлоза,микрокристаллическая Поливинилпирролидон(в виде 10% водного раствора) Натрийкарбоксиметилцеллюлоза Стеарат магния Тальк Активные ингредиенты, крахмал и целлюлозу пропускали через сито 45 меш и тщательно смешивали. Раствор поливинилпирролидона смешивали с полученным порошком и пропускали через сито 14 меш. Полученные гранулы высушивали при 50-60 С и пропускали через сито 18 меш. Натрийкарбоксиметилцеллюлозу, стеарат магния и тальк после предварительного просеивания через сито 60 меш добавили к гранулам, которые после смешива 22 ния прессовали в машине для изготовления таблеток и получали таблетки. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы IR3 и R4 являются, независимо, C1-C4 алкилом или объединяются с образованием С 4-С 6 полиметилена, либо вместе с азотом, к которому они присоединены, образуют морфолин; Х является -CH2-, -CHOH2-, -О-, или или его фармацевтически приемлемая соль или сольват. 2. Соединение, согласно п.1, представляющее собой[2-(4-гидроксифенил)-6 гидроксибензо[в]тиен-3-ил][4-[2-(1-пиперидинил)этокси]фенил]метанон-N-оксид. 3. Соединение, согласно п.2, представляющее собой соль хлористо-водородной кислоты. 4. Соединение согласно п.1, представляющее собой [6-гидрокси-3-[4-[2-(1-пиперидинил) этокси]фенокси]-2-(4-метоксифенил)]бензо[в] тиофен-N-оксид. 5. Соединение согласно п.1, представляющее собой [6-гидрокси-3-[4-[2-(1-пиперидинил) этокси]фенокси]-2-(4-гидроксифенил)бензо[в] тиофен-N-оксид. 6. Соединение согласно п.4, представляющее собой соль хлористо-водородной кислоты. 7. Способ ингибирования остеопороза, который включает введение пациенту, нуждающемуся в этом, эффективного количества соединения по п.1. 8. Способ снижения уровней холестерина в сыворотке, который включает введение пациентам, нуждающимся в этом, эффективного количества соединения по п.1. 9. Способ ингибирования эстрогензависимых злокачественных новообразований, включающий введение пациентам, нуждающимся в этом, эффективного количества соединения по п.1. 10. Фармацевтическая композиция, включающая соединение формулы I по п.1, дополнительно включающая [2-(4-гидроксифенил)-6 23 гидроксибензо[в]тиен-3-ил][4-[2-(1-пиперидинил)этокси]фенил]метанона гидрохлорид и, необязательно, фармацевтически приемлемые носители, разбавители или наполнители. 11. Композиция по п.10, отличающаяся тем, что соединение формулы I составляет менее 10% по весу от общего количества активных ингредиентов. 12. Композиция по п.11, отличающаяся тем, что соединение формулы I составляет ме 24 нее 1% по весу от общего количества активных ингредиентов. 13. Композиция по п.12, отличающаяся тем, что соединение формулы I составляет менее 0,3% по весу от общего количества активных ингредиентов. 14. Композиция по п.10, отличающаяся тем, что соединение формулы I является [2-(4 гидроксифенил)-6-гидроксибензо[в]тиен-3-ил]
МПК / Метки
МПК: A61K 31/445, C07D 401/12
Метки: бензотиофены, составы, содержащие, использованием, способы
Код ссылки
<a href="https://eas.patents.su/13-767-benzotiofeny-sostavy-ih-soderzhashhie-i-sposoby-s-ih-ispolzovaniem.html" rel="bookmark" title="База патентов Евразийского Союза">Бензотиофены, составы их содержащие и способы с их использованием.</a>
Предыдущий патент: Способ получения гранулированного моющего средства.
Следующий патент: Способ лечения аутизма
Случайный патент: Способ получения гликозилированного интерферона бета












