Применение в терапии производных хиназолиндиона
Номер патента: 23670
Опубликовано: 30.06.2016
Авторы: Марсиньяк Жильбер, Нав Жан-Франсуа, Вивьяни Фабрис
Формула / Реферат
1. Применение соединения общей формулы (I)
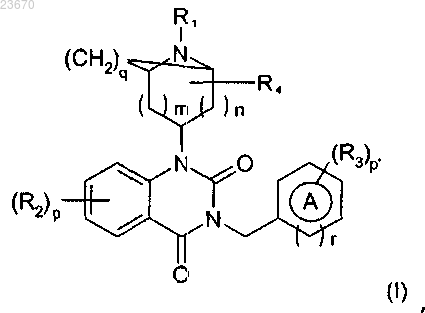
где А означает арил;
R1 означает -C(O)R, где R является атомом водорода;
R2 означает атом галогена, группу (C1-С6)алкил, необязательно замещенную группой -NH2 или -NHC(O)Rb, где Rb означает (C1-С6)алкильную группу;
группу -ORa, где Ra означает группу (C1-С6)алкил, необязательно замещенную одним или несколькими атомом(ами) галогена, одной или несколькими гидроксигруппой(ами);
R3 означает цианогруппу,
арильную или гетероарильную группу, группу (C1-С6)алкокси, необязательно замещенную группой
-C(O)NRbRc, где Rb и Rc образуют вместе с атомом азота, с которым они соединены, гетероциклоалкильную группу;
R4 означает атом водорода;
m и n означают, независимо друг от друга, величину 0 или 1;
р и р' означают, независимо друг от друга, величину 1 или 2 при условии, что когда значение р равно 2, тогда группы R2 находятся на разных атомах углерода и могут отличаться друг от друга, а когда значение р' равно 2, тогда группы R3 находятся на разных атомах углерода и могут отличаться друг от друга;
q имеет значение 0, тогда гетероциклическая азотсодержащая группа, соединенная с атомом азота и находящаяся в положении 1 2,4-диоксо-1,2,3,4-тетрагидрохиназолинового ядра, не имеет мостиковой связи и имеет вид
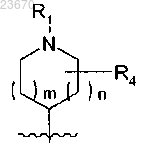
где R1, R4, m и n определены выше;
r имеет значение 1;
где гетероарил представляет собой ароматическую моноциклическую систему, содержащую 5-14 звеньев и от одного до нескольких гетероатомов, выбранных из атомов азота, кислорода или серы;
где арил представляет собой моноциклическую ароматическую систему, содержащую 5-14 звеньев в цикле;
где гетероциклоалкил представляет собой насыщенный цикл, содержащий 3-8 атомов углерода и содержащий от одного до нескольких гетероатомов, выбранных из атомов азота, кислорода или серы, по меньшей мере в одном из циклов,
в форме основания или кислотно-аддитивной соли,
для получения лекарственного средства, предназначенного для лечения и/или профилактики психических расстройств и неврологических расстройств, где психические расстройства выбирают из тревоги, депрессии, нарушений настроения, бессонницы, бредовых расстройств, обсессивных расстройств, психозов, нарушений, связанных с шизофренией, нарушений, связанных с дефицитом внимания и гиперактивностью (TDAH) у гиперкинетических детей, нарушений, связанных с применением психотропных веществ, мигрени, стресса, нарушений, связанных с психосоматическими заболеваниями, приступов паники, эпилепсии, мнезических нарушений, когнитивных расстройств, нарушений, связанных с болезнью Альцгеймера, нарушений внимания или сна, ишемии, нарушений, связанных с черепными травмами, нарушений, связанных с острыми или хроническими нейродегенеративными заболеваниями; где неврологические расстройства, проявляющиеся в виде двигательных или моторных нарушений или расстройств, ассоциированных с патологией, выбирают из дискинезий, болезни Паркинсона, постэнцефалического паркинсонизма, допа-чувствительных дистоний, синдрома Ши-Драгера, синдрома периодического нарушения движений конечностей (ПНДК), синдрома периодического нарушения движений конечностей во сне (ПНДКС), синдрома Туретта, синдрома усталых ног (СУН).
2. Применение по п.1, отличающееся тем, что нарушения, связанные с применением психотропных веществ, выбирают из злоупотреблений веществом и/или зависимости от вещества.
3. Применение по п.2, отличающееся тем, что злоупотребления веществом и/или зависимости от вещества представляют собой алкогольную зависимость и/или никотиновую зависимость.
4. Применение по п.1, отличающееся тем, что когнитивное расстройство представляет собой старческую деменцию.
5. Применение по п.1, отличающееся тем, что нарушение, связанное с острыми или хроническими нейродегенеративными заболеваниями, представляет собой хорею и хорею Хантингтона.
6. Применение по п.1, отличающееся тем, что двигательные или моторные нарушения или расстройства ассоциированы с болезнью Паркинсона.
7. Применение по п.6, отличающееся тем, что моторные нарушения или расстройства выбирают из дрожания в покое, ригидности, брадикинезии и недостаточности постуральных рефлексов.
8. Применение по п.1 а) в лечении и/или профилактике нарушений, связанных с шизофренией, (i) в профилактике и/или лечении положительных или отрицательных симптомов и/или (ii) в профилактике и/или лечении мнезического дефицита, b) в лечении и/или профилактике нарушений, ассоциированных с болезнью Паркинсона, (i) в профилактике и/или в симптоматическом лечении двигательных расстройств, депрессии и/или когнитивных нарушений и/или (ii) в ее основном лечении, и/или (с) в лечении и/или профилактике нарушений, ассоциированных с болезнью Альцгеймера, (i) в профилактике и/или в симптоматическом лечении когнитивных нарушений и/или поведенческих нарушений и/или (ii) в ее основном лечении.
9. Применение по п.1, отличающееся тем, что неврологические расстройства проявляются в виде двигательных или моторных нарушений или расстройств, ассоциированных с травмами спинного мозга.
10. Применение по п.9, отличающееся тем, что травмы спинного мозга выбирают из спинальных травм.
11. Применение по одному из предыдущих пунктов, отличающееся тем, что А означает фенильную группу.
12. Применение по одному из предыдущих пунктов, отличающееся тем, что q=0, m и n, каждый, означают 1.
13. Применение по одному из предыдущих пунктов, отличающееся тем, что R2 означает (C1-С6)алкил.
14. Применение по одному из предыдущих пунктов, отличающееся тем, что R2 означает метил, замещенный группой -NH-C(O)-Rb, где Rb определен в п.1.
15. Применение по любому из пп.1-12, отличающееся тем, что R2 означает группу -ORa, где Ra определен в п.1.
16. Применение по любому из пп.1-12, отличающееся тем, что R2 означает атом галогена или (C1-C6)алкил, необязательно замещенный -NH2 или -NHC(O)Rb, где Rb определен в п.1.
17. Применение по любому из пп.1-12, отличающееся тем, что А является фенилом, R1 является группой -C(O)R, где R означает атом водорода, q равен 0, n и m, каждый, означают 1, R2 означает -ORa, где Ra определен в п.1.
18. Применение по любому из пп.1-12, отличающееся тем, что А является фенилом, R1 является группой -C(O)R, где R означает атом водорода, q равен 0, n и m, каждый, означают 1, р=1 и R2 означает метил, замещенный группой -NHC(O)Rb, где Rb определен в п.1.
19. Применение по любому из пп.1-12, отличающееся тем, что А является фенилом, R1 является группой -C(O)R, где R означает атом водорода, q равен 0, n и m, каждый, означают 1, р равен 2, один из R2 означает -ORa, где Ra определен в п.1, а другой из R2 означает атом галогена.
20. Применение по любому из предыдущих пунктов, отличающееся тем, что группа R2 находится в положении 6 2,4-диоксо-1,2,3,4-тетрагидрохиназолинового кольца и, кроме того, другая группа R2, одинаковая или отличающаяся от указанной выше группы R2, может находиться в положении 7 2,4-диоксо-1,2,3,4-тетрагидрохиназолинового кольца.
21. Применение по любому из пп.1-10, отличающееся тем, что соединение формулы (I) выбирают из следующих соединений:
№ 11: 4-[3-(3,4-диметоксибензил)-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид;
№ 16: 4-[6-(2,2-дифторэтокси)-3-(3,4-диметоксибензил)-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид;
№ 72: 4-[3-(3,4-диметоксибензил)-6-(2-гидроксиэтокси)-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид;
№ 77: N-{[3-(3,4-диметоксибензил)-1-(1-формилпиперидин-3-ил)-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-6-ил]метил}ацетамид;
№ 97: 4-[5,7-дихлор-3-(3,4-диметоксибензил)-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид;
№ 111: 4-[6-(дифторметокси)-3-(3,4-диметоксибензил)-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил]пиперидин-1-карбальдегид;
№ 251: 4-{6-[2-фтор-1-(фторметил)этокси]-3-[3-метокси-4-(2-оксо-2-пиперидин-1-илэтокси)бензил]-2,4-диоксо-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид;
№ 294: 4-({6-[2-фтор-1-(фторметил)этокси]-1-(1-формилпиперидин-4-ил)-2,4-диоксо-1,4-дигидрохиназолин-3(2Н)-ил}метил)бифенил-2-карбонитрил;
№ 297: 4-{7-фтор-6-[2-фтор-1-(фторметил)этокси]-2,4-диоксо-3-(4-тиофен-2-илбензил)-3,4-дигидрохиназолин-1(2Н)-ил}пиперидин-1-карбальдегид;
в форме основания или кислотно-аддитивной соли.
Текст
Изобретение относится к применению соединений формулы (I) в форме основания или кислотно-аддитивной соли или их смесей в качестве лекарственных средств или для получения лекарственного средства, предназначенного(ых) для лечения и/или профилактики расстройств,связанных с центральной нервной системой (сокращенно ЦНС) и/или с периферической нервной системой (сокращенно ПНС). Изобретение относится к применению производных хиназолиндиона в качестве лекарственных средств или для получения лекарственного средства, предназначенного(ых) для лечения и/или профилактики расстройства (расстройств), связанного(ых) с центральной нервной системой (сокращенно ЦНС) и/или связанного(ых) с периферической нервной системой (сокращенно ПНС). Более конкретно, изобретение относится к применению производных хиназолиндиона в качестве лекарственных средств или для получения лекарственного средства, предназначенного(ых) для лечения и/или профилактики психического(их) расстройства (расстройств) и/или предназначенного(ых) для лечения и/или профилактики неврологического(их) расстройства (расстройств). Центральная нервная система или ЦНС включает головной мозг, спинной мозг и черепно-мозговые нервы. Периферическая нервная система или ПНС является частью нервной системы, сформированной ганглиями и нервами, которая передает информацию органам от центральной нервной системы или ЦНС и осуществляет двигательные команды из центральной нервной системы. Она включает соматическую нервную систему и автономную нервную систему. Изобретение относится к производным хиназолиндиона, ингибиторующим фосфодиэстеразу 7 типа(PDE7). Некоторые из этих производных ингибируют также фосфодиэстеразу 8 типа (PDE8). Фосфодиэстеразы (PDEs) являются внутриклеточными ферментами, отвечающими за гидролиз вторичных мессенджеров цАМФ (циклического аденозин-3',5'-монофосфата) и цГМФ (циклического гуанозин-3', 5'-монофосфата) до образования неактивных 5'-монофосфатных нуклеотидов. Вещества цАМФ и цГМФ играют существенную роль в проводимости сигнальных клеточных путей и задействованы в многочисленных физиологических процессах. Ингибирование фосфодиэстераз выражается в увеличении внутриклеточных концентраций цАМФ и цГМФ, которые приводят к специфической активации путей фосфорилирования, участвующих в разнообразных функциональных ответах. Увеличение внутриклеточных концентраций цАМФ или цГМФ с помощью селективных ингибиторов фосфодиэстераз представляется многообещающим решением дл лечения различных заболеваний (Bender et Beavo, Pharmacol Rev (2006) 58, 488-520). Следовательно, ингибиторы фосфодиэстераз представляют интерес как терапевтические агенты и как фармакологические средства. На сегодняшний день идентифицированы одиннадцать семейств фосфодиэстераз. Они различаются своей первичной структурой, специфичностью субстрата и их чувствительностью по отношению к разным эффекторам и специфическим ингибиторам PDE. Каждое семейство представляет собой один или несколько генов, которые экспрессируются в различных тканях в виде вариантов сплайсинга (Bender etBeavo, Pharmacol Rev (2006) 58, 488-520; Lugnier, Pharmacol Therapeut (2006) 109, 366-398). Фосфодиэстеразы (PDE) типа 4, 7 и 8 специфически гидролизуют цАМФ, а фосфодиэстеразы (PDE) типа 5, 6 и 9 специфически гидролизуют цГМФ. Семейство PDE7 представлено изоформами PDE7A и PDE7B, происходящими от двух отдельных генов. Человеческая PDE7A (Michaeli et al., J Biol Chera (1993) 268, 12925-12932; Han et al, J Biol ChemRes Commun (2000) 272, 186-192) селективно гидролизуют цАМФ с константами Михаэлиса (Km), которые составляют 0,1-0,2 мкМ и 0,13-0,2 мкМ, соответственно. Каталитический участок PDE7B имеет примерно 67% гомологию с каталитическим участком PDE7A. Известны три варианта спайсинга для PDE7A. Фосфодиэстеразы PDE7A1 и PDE7A3 экспрессируются, главным образом, в клетках иммунной системы и легких, а фосфодиэстераза PDE7A2 экспрессируется, преимущественно, в скелетных мускулах, в сердце и почках. В недавнее время для PDE7B были идентифицированы также три варианта спайсинга (Giernbycz et Smith, Drugs Future (2006) 31, 207-229). Профили распределения в тканях PDE7A и PDE7B очень различны, учитывая, что эти две изоформы имеют отличающиеся с точки зрения физиологии функции. Если PDE7A в большом количестве экспрессируется в гематопоэтических клетках, легких, плаценте, клетках Лейдига, селезенке, собирательных трубочках почек и надпочечниках, то для PDE7B высокая экспрессия наблюдается в поджелудочной железе, сердце, щитовидной железе и скелетных мышцах (Giembycz et Smith, Drugs Future (2006) 31, 207229). Кроме того, в некоторых тканях отмечается соэкспрессия матричных РНК (мРНК) PDE7A иPDE7B. Это явление происходит в остеобластах (Ahlstrom et al, Cell Mol Biol Lett (2005)10, 305-319) и в определенных участках головного мозга: несколько зон коры головного мозга, зубчатая извилина мозга,большинство компонентов обонятельной системы, полосатое тело, многочисленные ядра таламуса и пирамидальные клетки гиппокзмпа (MLro et al, Synapse (2001)40, 201-214; Reyes-Irisarri et al, Neuroscience(2005) 132, 1173-1185). И, напротив, в определенных зонах головного мозга экспрессируется только одна из двух изоформ. Так, в многочисленных ядрах ствола мозга находятся только мРНК PDE7A. Аналогично этому, мРНК PDE7B обнаружены в высоких концентрациях в ядре accumbens и в заднем двигательном ядре блуждающего нерва, тогда как мРНК PDE7A там обнаружены не были (Miro et al, Synapse Документ WO2008/119057 описывает способ лечения двигательных нарушений, ассоциированных с патологией на почве двигательного неврологического расстройства, такой как болезнь Паркинсона, способ лечения включает введение пациенту агента, ингибирующего PDE7, в количестве, эффективном для ингибирования ферментативной активности PDE7. В частности, объектом настоящего изобретения является применение в терапии производных хиназолиндиона, которые могут проявлять себя как сильные ингибиторы PDE7 или PDE7 и PDE8 в зависимости от производных. Изобретение относится к применению соединения, отзечающего следующей общей формуле (I)R2 означает атом галогена, группу (C1-С 6)алкил, необязательно замещенную группой -NH2 или-NHC(O)Rb, где Rb означает (C1-С 6) алкильную группу; группу -ORa, где Ra означает группу (C1-С 6)алкил, необязательно замещенную одним или несколькими атомом(ами) галогена, одной или несколькими гидроксигруппой(ами);R3 означает цианогруппу, арильную или гетероарильную группу, группу (C1-С 6)алкокси, необязательно замещенную группой -C(O)NRbRc, где Rb и Rc образуют вместе с атомом азота, с которым они соединены, гетероциклоалкильную группу;m и n означают, независимо друг от друга, величину 0 или 1; р и р' означают, независимо друг от друга, величину 1 или 2 при условии, что когда значение р равно 2, тогда группы R2 находятся на разных атомах углерода и могут отличаться друг от друга, а когда значение р' равно 2, тогда группы R3 находятся на разных атомах углерода и могут отличаться друг от друга;q имеет значение 0, тогда гетероциклическая азотсодержащая группа, соединенная с атомом азота и находящаяся в положении 1 2,4-диоксо-1,2,3,4-тетрагидрохиназолинового ядра, не имеет мостиковой связи и имеет вид: где R1, R4, m и n определены выше,r имеет значение 1,где гетероарил представляет собой ароматическую моноциклическую систему, содержащую 5-14 звеньев и от одного до нескольких гетероатомов, выбранных из атомов азота, кислорода или серы,где арил представляет собой моноциклическую ароматическую систему, содержащую 5-14 звеньев в цикле,где гетероциклоалкил представляет собой насыщенный цикл, содержащий 3-8 атомов углерода и содержащий от одного до нескольких гетероатомов, выбранных из атомов азота, кислорода или серы по меньшей мере в одном из циклов,в форме основания или кислотно-аддитивной соли,в качестве лекарственного средства или для получения лекарственного средств, предназначенного(ых) для лечения и/или профилактики расстройств, связанных с центральной нервной системой и/или связанных с периферической нервной системой. Согласно варианту осуществления указанные расстройства выбирают из психических расстройств и неврологических расстройств. Соединения общей формулы (I) могут содержать один или несколько асимметричных атомов углерода. Следовательно, они могут существовать в форме энантиомеров или диастереоизомеров. Эти энантиомеры, диастереоизомеры, а также их смеси, включая рацемические, составляют часть изобретения. Благодаря своей структуре соединения общей формулы (I) могут также существовать в форме изомеров ротамерного или атропоизомерного типа. Соединения общей формулы (I) могут также существовать в форме оснований или кислотноаддитивных солей. Эти аддитивные соли составляют часть изобретения. Указанные соли получают преимущественно с фармацевтически приемлемыми кислотами, но соли с другими кислотами, полезными, например, для очистки или выделения соединений общей формулы (I),-2 023670 также составляют часть изобретения. Соединения общей формулы (I) могут находиться в кристаллической, аморфной или масляной форме и эти формы составляют часть изобретения. Согласно настоящему изобретению N-оксиды соединений, содержащих одну аминогруппу, тоже составляют часть изобретения. Соединения общей формулы (I) согласно изобретению включают также соединения, в которых один или несколько атомов водорода, углерода или галогена, в частности, хлора или фтора, заменены их радиоактивными изотопами, например, тритием, для того, чтобы заменить водород или углерод 14 или углерод 12. Такие меченые соединения пригодны в качестве средства для исследовательских работ, для изучения метаболизма или фармакокинетических свойств, в биологических и фармакологических испытаниях. В рамках изобретения были определены:(C1-С 6): где цифровые индексы указывают на возможное количество атомов углерода, находящихся в цепи или в цикле. Так, например, C1-С 6 означает углеродную цепь, которая может иметь от 1 до 6 атомов углерода. Аналогично этому, например, (C1-C5) означает углеродную цепь, которая может иметь от 1 до 5 атомов углерода, или же (С 3-С 6) означает насыщенный углеродный цикп, который может иметь 3-6 атомов углерода; алкскси: -О-алкильная группа с насыщенной алифатической цепью, линейной или разветвленной; алкинил: алифатическая моно- или полиненасыщенная группа, линейная или разветвленная, содержащая, например, одну или две ацетиленненасыщенные связи. Например, (С 2-С 6)алкинильная группа может означать этинил, пропинил ; алкил: насыщенная алифатическая группа, линейная или разветвленная; например, (C1-C6)алкильная группа означает углеродную цепь с 1-6 атомами углерода, линейную или разветвленную, в частности, метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил; аминоалкил: группа -NH (C1-С 6)алкил или -N C1-С 6) алкил)2; арил: моноциклическая ароматическая система,необязательно замещенная, содержащая 5-14 звеньев в цикле, предпочтительно, 5-10 звеньев в цикле. В качестве примера арильных моноциклических групп можно назвать фенил или нафтил; арильная группа может быть замещена группой, которая может представлять собой, например, один или несколько атом(ов) галогена, группу гидрокси, циано, трифторметилтио, нитро, алкил, алкокси, алкилтио, метилсульфонил, алкил-амино-алкил или алкил-аминс-циклоалкил, необязательно замещенный, алкиламино-алкокси или циклоалкил-амино-алкокси или сульфониламид; полициклический арил: ароматическая полициклическая система, необязательно замещенная, содержащая 5-14 звеньев в цикле, предпочтительно, 5-10 звеньев в цикле, и содержащая 2-10 циклов, из которых по меньшей мере один является ароматическим. В качестве примера арильной полицикхической группы можно назвать ацеантрилен, антрацен, азулен, коронен, рубицен, нафталин; арильная полициклическая группа может быть замещена группой, которая может представлять собой, например, один или несколько атом(ов) галогена, группу гидрокси, циано, трифторметилтио, нитро, алкил, алкокси, алкилтио, метилсульфонил, алкил-амино-алкил или алкил-амино-циклоалкил, необязательно замещенный, алкил-амино-алкокси или циклоалкил-амино-алкокси или сульфониламид; мостиковый цикл: бициклическая структура, содержащая согласно изобретению один атом азота,где по меньшей мере 2 атома углерода соединены простой связью или углеродной цепью, которая может содержать 2 атома углерода. Например, вышеназванный цикл имеет вид: где q=1 или 2, а другие группы и индексь имеют определения, указанные выше; циклоалкил: алифатическая циклическая насыщенная группа, содержащая 3-8 атомов углерода. В качестве примера можно назвать группы циклопропил, метилциклопропил, циклобутил, циклопентил,циклогексил; галоген: фтор, хлор, бром или иод; галогеналкил: (C1-C6)алкил, замещенный от одного до трех атома(ов) галогена; гетероарил: ароматическая моноциклическая система, содержащая 5-14 звеньев, предпочтительно,5-10 звеньев, и содержащая от одного до нескольких гетероатомов, таких, как атомы азота, кислорода или серы. Атомы азота могут находиться в форме N-оксидов. Примером моноциклического гетероцикла может быть пиран, пиразин, пиразол, пиридазин, пиридин, пиримидин, пиррол, изотиазол, изоксазол,фуран, имидазол, морфолин, тиофен, пиперазин, диазетидин, дигидропирролидин, пиперидин или азепин и т.д.; бициклическим гетероциклом может быть изохинолин, птеридин, хроман и т.д.; трициклическим гетероциклом может быть фенантролин, ксантен и т.д. полициклический гетероарил: ароматическая полициклическая система, необязательно замещенная,содержащая от 5 до 14 звеньев в цикле, предпочтительно от 5 до 10 звеньев в цикле, и содержащая 2-10 циклов, содержащих, дополнительно, один или несколько гетероатомов, таких как атомы азота, кислорода или серы по меньшей мере в одном из циклов, из которых по меньшей мере один является ароматическим. В качестве примера полициклических гетероарильных групп можно назвать индол, бензофуран,бензимидазол, бензотиофен, бензотриазол, бензотиазол, бензоксазол, хинолин, изохинолин, индазол,хиназолин, фталазин, хиноксалин, нафтиридин, 2,3-дигидро-1 Н-индол, 2,3-дигидробензофуран, 2,3 дигидроинден, тетрагидрохинолин, тетрагидроизохинолин, тетрагидройзохиназолин; гетероциклоалкил: насыщенный цикл, необязательно замещенный, содержащий 3-8 атомов углерода и содержащий от одного до нескольких гетероатомов, таких как атомы азота, кислорода или серы по меньшей мере в одном из циклов, или несколько гетероатомов, одинаковых или отличающихся друг от друга. Примером гетероциклоалкила может быть пирролидин, морфолин, пиперазин, диазетидин, дигидропирролидин, пиперидин, пиперадин, азепан, имидазолидин, тиоморфолин, тетрагидропиран, тетрагидротиопиран, диазепан и т.д.; гидрокси: группа -ОН; нитро: группа -N2; оксо: группа -С(О)-; сульфонамид: группа, отвечающая формуле SO2-N-алкил или SO2-N-циклоалкил, где алкил и циклоалкил такие, как определено выше; трифторметилтио определяется формулой -S-CF3. Кроме того, в данном описании подразумевается, что, когда атом или группа замещены или необязательно замещены одной лли несколькими группой(ами) или атомом(ами), то заместители могут быть одинаковыми или отличающимися друг от друга, и их может нести, если необходимо, один и тот же атом или же различные атомы. Среди соединений согласно изобретению можно назвать группу соединений формулы (I), где А означает группу арил, в частности, фенил, и все другие заместители и индексы являются такими, как определено в общей формуле (I), описанной выше. Среди соединений согласно изобретению можно назвать группу соединений формулы (I), где q=0,m и n, каждый, означают 1, и все другие заместители и индексы являются такими, как определено в общей формуле (I), описанной выше. Среди соединений согласно изобретению можно назвать группу соединений формулы (I), где R2 означает группу (C1-С 6)алкил, в частности, метил, замещенный группой -NHC(O)Rb, где Rb, другие заместители и индексы являются такими, как определено для соединений общей формулы (I), описанной выше. Среди соединений согласно изобретению можно назвать группу соединений общей формулы (I),где R2 означает группу -ORa, где Ra, и все другие заместители и индексы являются такими, как определено в общей формуле (I), описанной выше. Среди соединений согласно изобретению можно назвать группу соединений общей формулы (I),где R2 означает атом галогена или циано, или водород, или гидроксил или (C1-С 6) алкил, необязательно замещенный -NH2 или группой -NHC(O)Rb, причем Rb и другие заместители и индексы являются такими, как определено в общей формуле (I), описанной выше. Среди соединений согласно изобретению можно назвать группу соединений общей формулы (I),где А означает фенил, R1 означает группу -C(O)R, где R означает атом водорода, q равен 0, n и m каждый равен 1 и R2 означает -ORa, причем Ra и все другие заместители и индексы являются такими, как определено в общей формуле (I), описанной выше. Среди соединений согласно изобретению можно назвать группу соединений общей формулы (I),где А означает фенил, R1 означает группу -C(O)R, где R означает атом водорода, q равен 0, n и m каждый равен 1, р равен 2, один из R2 означает -ORa, а другой из R2 является атомом галогена, причем Ra и все другие заместители и индексы являются такими, как определено в общей формуле (I), описанной выше. Среди соединений согласно изобретению можно назвать группу соединений общей формулы (I),где А означает фенил, R1 означает группу -C(O)R, где R означает атом водорода, q равен 0, n и m каждый равен 1, р=1 и R2 означает метил, замещенный группой -NH-CO-Rb, причем Rb и другие заместители и индексы являются такими, как определено в общей формуле (I), описанной выше. Преимущественно, в соединениях формулы (I) группа R2 находится в положении 6 2,4-диоксо 1,2,3,4-тетрагидрохиназолина. Соединения формулы (I) могут также содержать группу R2 в положении 7 2,4-диоксо-1,2,3,4-тетрагидрохиназолинового кольца. Группы R2 в положении 6 и 7 могут быть одинаковыми или разными. Преимущественно, в соединениях формулы (I) p равен 1 или 2. Соединения общей формулы (I) могут находиться в форме основания, гидрата, сольвата, изомеров или их смесей. В частном случае, когда р'=2, тогда две группы R3 находятся в положении 3 и 4 ядра А и могут быть одинаковыми или отличаться друг от друга. Комбинации групп соединений согласно изобретению, названных выше, также составляют часть изобретения. В качестве примера предпочтительных соединений согласно изобретению можно назвать следующие соединения: Соединения согласно изобретению могут быть получены способами, которые проиллюстрированы на схемах 1-4, представленных ниже. В последующем тексте под уходящей группой понимают группу, которая может быть легко замещена при одновременном уходе электронной пары в результате гидролитического разрыва связи. Эта группа может быть легко заменена другой группой во время, например, реакции замещения. Таким уходящими группами могут быть, например, атомы галогена или активированная гидроксильная группа,такая как мезилат, тозилат, трифлат и т.д. Примеры уходящих групп, а также условия их получения приведены в документе "Advanced Organic Chemistry", J. March, 3rd Edition, Wiley Interscience, c.310-316. Под защитной группой PG понимают группу, которая подавляет реакционоспособность функциональной группы или положения в процессе химической реакции, где она (оно) может участвовать, а после отщепления защитной группы с помощью известных специалисту методов молекула восстанавливается. Под временной защитной группой аминов или спиртов понимают те защитные группы, которые описаны в Protective Groups in Organic Sunthesis, Greene T.W. et Wuts P.G.M., Ed. Willey Intersciences 1999 и в Protecting Groups, Kocienski P.J., 1994, Georg Thieme Verlag. Можно назвать, например, временные защитные группы аминов: бензильные, карбаматные, (такие как трет-бутоксикарбонильная, отщепляемая в кислой среде, бензилоксикарбонильная, отщепляемая гидрогенолизом), временные защитные группы карбоновых кислот: сложные алкиловые эфиры (такие как метиловый или этиловый, трет-бутиловый эфиры, гидролизуемые в основной или кислотной среде) и бензиловые эфиры, удаляемые в условиях гидрогенолиза, временные защитные группы спиртов или фенолов, такие как простые эфиры тетрагидропиранила, метилоксиметила или метилэтоксиметила, третбутила и бензила, временные защитные группы карбонильных производных, такие как линейные или циклические ацетали, например, такие как 1,3-диоксан-2-ильная или 1,3-диоксолан-2-ильная группа; и можно сослаться на общие хорошо известные способы защиты, описанные в документе Protective Groups,цитированнном выше. В зависимости от необходимости, специалист может сам выбрать соответствующие защитные группы. Соединения формулы (I) могут включать защитные группы других функциональных групп, которые образуются в дальнейшем на одной или нескольких других стадиях. На представленных ниже общих схемах исходные соединения и реагенты, если способ их получения не описан, доступны в продаже или описаны в литературе или могут быть получены согласно способам, которые там описаны или известны специалисту. Чистые энантиомеры соединений согласно изобретению могут быть получены из энантиомерно чистых предшественников или путем хроматографии на хиральных фазах или, если соединения содержат кислотные функции или аминогруппы, методами селективной кристаллизации диастереоизомерных солей, получаемых взаимодействием соединений (I) соответственно с хиральными аминами или кислотами. Соединения общей формулы (I) могут быть получены согласно представленным ниже схемам 1-4. Для большей ясности, выбрана группа R4, означающая водород, р и р' означают соответственно 1 и 2,группы R2 и R3 находятся в положении, зафиксированном на схемах. При этом разумеется, что R4 может иметь определения, указанные в общей формуле (I), что R2 и R3 могут находиться в положениях, указанных в общей формуле (I), и что р и р' могут быть такими, как определено в общей формуле (I). Способы синтеза, описанные ниже, служат только для иллюстрации и не имеют никакого ограничительного характера. Специалист сможет без труда применить сведения, изложенные ниже, к соединениям формулы (I), в которых R, R1, R2, R3, R4, Ra, Rb, Rc, m, n, p, p' и q такие, как они определены в общей формуле (I). Согласно схеме 1 соединение формулы (IV) получают реакцией восстановительного аминирования при взаимодействии соединения формулы (II), в котором R' означает (C1-С 6) алкил, a R2 является таким,как определено для соединения формулы (I), с соединением формулы (III) в кислотной среде и в присутствии восстановителя, такого как триацетоксиборгидрид натрия. Группа GP соединения формулы (III) представляет собой защитную группу аминофункции, которая, преимущественно, может быть третбутоксикарбонилом (boc). Полученное соединение формулы (IV) затем ацилируют в соответствии со способами, известными специалисту, с использованием алкилхлорформиата или арилхлорформиата и получают соединение формулы (V), в котором R" означает (C1-С 6)алкил или арильную замещенную группу. Проведение реакции гидролиза в основной среде позволяет получить соединение формулы (VI),которое в результате сочетания с соединением формулы (VII), в котором R3 является таким, как определено для соединения формулы (I), приводит к соединениям формулы (VIII). После реакции внутримолекулярной циклизации в основной среде получают производные хиназолиндиона формулы (IX). Защитную группу GP аминофункции затем отщепляют в кислотной среде, если, например, GP означает bocгруппу, и получают соединение формулы (Ia), которое после реакции ацилирования приводит к соединениям формулы (Ib). Соединения формулы (Ia) являются соединениями формулы (I) и могут служить промежуточными для получения других соединений формулы (I), таких как соединения формулы (1b). Схема 1 Соединения формулы (I), в которых R2 означает -ORa, где Ra является таким, как определено для соединения формулы (I), отвечают формуле (Id). Они могут быть получены из соединений формулы (X) согласно нижеследующей схеме 2. Соединения формулы (Ic), полученные в результате реакции гидрогенолиза соединений формулы (X), подвергают, например, реакции алкилирования с алкилирующим агентом формулы Ra-X, где Ra является таким, как определено для соединения формулы (I), и X означает уходящую группу (такую, например, как атом галогена) в присутствии основания, такого как карбонат цезия (Cs2CO3), или реакции Мицунобу (Synthesis 1981, 1) со спиртом формулы Ra-OH, где Ra является таким, как определено для соединения формулы (I), с получением соединений формулы (Id). Соединения формулы (X), а также соединения формулы (Ic) являются соединениями формулы (I) и могут служить промежуточными для получения других соединений формулы (I), таких как соединения формулы (Id). Как вариант, соединения формулы (Id) могут быть получены согласно способу, описанному на схеме 3. Соединения формулы (XII) получают в результате реакции ароматического нуклеофильного замещения с использованием соединения формулы (XI), в котором R' является таким, как определено выше, и спирта формулы Ra-OH, в котором Ra является таким, как определено для соединения формулы (I), в присутствии основания. Восстановление нитрогруппы соединений формулы (XII) приводит к соответствующим производным анилина формулы (XIII). Реакция восстановительного аминирования с помощью соединения формулы (III), в котором GP является защитной группой для аминофункций, такой как, например, boc, приводит к соединениям формулы (XIV). Получение соединений формулы (XV) происходит в результате реакции соединения формулы (XIV) с изоцианатом калия (KNCO) в кислотной среде. Реакция внутримолекулярной циклизации в основной среде позволяет получить соединения формулы (XVI). Защитную группу GP отщепляют способами, известными специалисту, с получением соединений формулы (XVII). Реакция ацилирования приводит к соединениям формулы (XVIII). И, в заключение, получают соединения формулы (Id) либо реакцией алкилирования с производным формулы (XIX), в которомX означает уходящую группу, такую как атом галогена, в присутствии основания, такого как, например,карбонат цезия, либо согласно реакции Мицунобу с бензиловым спиртом формулы (XX). В соединениях Соединения формулы (Ie) и (If), в которых R2 означает, более конкретно, группу формулы -CH2NHC(О)Rb, где Rb определен как в соединении формулы (I), могут быть получены согласно нижеследующей схеме 4. Разумеется, что хотя на схеме 3 группа R2, иллюстрированная значением -O-Ra, находится в положении 6 хиназолиндионовой структуры (см., например, соединение (XVIII), возможно также присутствие второй группы R2, такой, как определено в общей формуле (I), в положении 7 той же хиназолиндионовой группы. Восстановление нитрогруппы соединений формулы (XXI), где R'и GP' такие, как определено выше,а группа GP' является преимущественно boc-группой, приводит к соответствующим производным анилина (XXII), которые в результате реакции восстановительного аминирования, протекающей в кислотной среде и, преимущественно, в присутствии восстановительного агента, такого как триацетоксиборгидрид натрия, с соединением формулы (III), в котором GP означает защитную для амина бензилоксикарбонильную группу, приводит к соединениям формулы (XXIII). Реакция ацилирования с алкилхлорформиатом или арилхлорформиатом, в котором R" означает (С 1-С 6)алкил или замещенный арил, приводит к соединениям формулы (XXIV). Аналоги хиназолиндиона формулы (XXV) могут быть получены реакцией гидролиза в основной среде, затем реакцией сочетания с соединением формулы (VII), где R3 такой, как определен для соединения формулы (I), с последующей реакцией внутримолекулярной циклизации в основной среде. Затем группу GP'(предпочтительно boc) отщепляют в кислотной среде с получением соединений формулы (XXVI), которые в результате ацилирования приводят к соединениям формулы(XXVII), в которых Rb такой, как определено для соединения формулы (I). Защитную группу GP формулы (XXVII) отщепляют путем гидрогенолиза и получают соединения формулы (Ie). И, в заключение, соединения формулы (If) получают ацилированием соединений формулы (Ie). Схема 4 Понятно, что специалист сможет выбрать сам, используя свои знания и литературные данные, другие подходящие защитные группы, позволяющие ввести все группы, описанные в общей формуле (I). Когда соединение формулы (I) включает мостиковый цикл, то оно может быть получено любым из способов синтеза, описанных выше. Следующие условия осуществления и примеры описывают получение некоторых соединений согласно изобретению. Эти условия осуществления и примеры не являются ограничивающими и служат только для иллюстрации изобретения. В условиях осуществления и примерах, представленных ниже: масс-спектры получены на квадрупольном масс-спектрометре модели Platform LCZ (WATERS) или модели ZQ 4000 (WATERS) метод ионизации: электроспрей, положительные ионы; ЯМР-спектры (ядерный магнитный резонанс) получены на спектрометре с преобразованием ФурьеCDCl3 = дейтерированный хлороформ; Смеси растворителей указаны в объемных соотношениях. Спектры ЯМР и масс-спектры подтверждают структуры соединений, полученных в примерах, описанных ниже. В следующих ниже примерах использована следующая абревиатура: АЦН: ацетонитрилTFA: трифторуксусная кислота Примеры Следующие примеры описывают получение некоторых соединений согласно изобретению. Эти примеры не являются ограничивающими и служат только для иллюстрации настоящего изобретения. Номера соединений, полученных согласно примерам, соответствуют тем же номерам, указанным в представленной ниже таблице, которая иллюстрирует химическую структуру и физические характеристики некоторых соединений согласно изобретению. Пример 1. Соединение 6. Получение Подвергают микроволновому облучению (Biotage Initiator Sixty) в течение 20 мин при 110 С смесь 2 г метил-2-амино-5-(бензилокси)бензоата, 3,1 г 1,1-диметилэтил-4-оксипиперидин-1-карбоксилата и 3,29 г NaBH(OAc)3 в 10 мг АсОН. Повторно осуществляют ту же реакцию с 2 другими партиями, содержащими 2 г метил-2-амино-5-(бензилокси)бензоата. Соединяют 3 реакционные среды. Обрабатывают с помощью AcOEt. Промывают органический слой водой, насыщенным раствором NH4Cl, насыщенным раствором NaHCO3, сушат над Na2SO4, фильтруют и выпаривают растворитель при пониженном давлении. Остаток подвергают хроматографии на силикагеле, элюируя смесью AcOEt/гептан от (5/95 об/об) до Подвергают микроволновому облучению в течение 30 мин при 80 С смесь 2 г 1,1-диметилэтил-4[4-(бензилокси)-2-(метоксикарбонил)фенил]аминопиперидин-1-карбоксилата, полученного на стадии 1.1, 0,87 мл DIEA, 1,78 мл IBCF, 1 г NaOH в 10 мл ДХЭ. Повторно осуществляют ту же реакцию с 4 другими партиями, содержащими 2 г 1,1-диметилэтил-4-[4-(бензилокси)-2-(метоксикарбонил)фенил] аминопиперидин-1-карбоксилата. Соединяют 5 реакционных сред. Обрабатывают при помощи AcOEt,фильтруют и выпаривают фильтрат при пониженном давлении. Подвергают хроматографии остаток на силикагеле, элюируя смесью AcOEt/гептан от (10/90 об/ об) до (50/50 об/об), и получают 9,3 г целевого продукта. Стадия 1.3. Натриевая соль 5-(бензоил)-2-(1-[(1,1-диметилэтокси)карбонил]пиперидин-4-ил[(2 метилпропокси)карбонил]амино)бензойной кислоты Нагревают 3 ч при 100 С смесь 9,3 г 1,1-диметилэтил-4-[4-(бензилокси)-2-(метоксикарбонил)фенил][(2-метилпропокси)карбонил]аминопиперидин-1-карбоксилата, полученного на стадии 1.2, 34,4 мл 2 н. NaOH в 57 мл МеОН. Выпаривают раствор при пониженном давлении и добавляют ДХМ. Сушат надNa2SO4, фильтруют и выпаривают растворитель при пониженном давлении с получением 8,7 г целевого продукта. Стадия 1.4. 1,1-Диметилэтил-4-[4-(бензилокси)-2-[(3,4-диметоксибензил)карбамоил]фенил(изобутоксикарбонил)амино]пиперидин-1-карбоксилат Перемешивают 15 мин при КТ смесь 6 г натриевой соли 5-(бензоилокси)-2-(1-[(1,1-диметилэтокси) карбонил]пиперидин-4-ил[(2-метилпропокси)карбонил]амино)бензойной кислоты, полученной на стадии 1.3, 4,42 г DIEA в 250 мл ДМФ. Добавляют 6,48 г HBTU и перемешивают в течение 30 мин. Прибавляют 2,48 г вератриламина и перемешивают реакционную смесь в течение 48 ч. Выпаривают при пониженном давлении, обрабатывают остаток при помощи AcOEt, промывают насыщенным растворомNH4Cl, затем насыщенным раствором NaHCO3, сушат над Na2SO4, фильтруют и выпаривают растворитель при пониженном давлении. Подвергают хроматографии остаток на силикагеле, элюируя смесью Подвергают микроволновому облучению в течение 30 мин при 110 С смесь 2,5 г 1,1-диметилэтил 4-[4-(бензилокси)-2-[(3,4-диметоксибензил)карбамоил]фенил(изобутоксикарбонил)амино]пиперидин 1-карбоксилата, полученного на стадии 1.4, 7,4 г NaOH в 18,5 мл ДХЭ. Повторно осуществляют ту же реакцию с 2 другими партиями, содержащими 2,5 г 1,1-диметилэтил-4-[4-(бензилокси)-2-[(3,4 диметоксибензил)карбамоил]фенил(изобутоксикарбонил)-амино]пиперидин-1-карбоксилата. Соединя- 26023670 ют 3 реакционные среды. Обрабатывают ДХМ, промывают водой, сушат над Na2SO4, фильтруют и выпаривают растворитель при пониженном давлении с получением 6,6 г целевого продукта. Стадия 1.6. 6-(Бензилокси)-3-(3,4-диметоксибензил)-1-пиперидин-4-илхиназолин-2,4(1 Н,3 Н)-дион Перемешивают в течение 2 ч при КТ смесь 3,5 г 1,1-диметилэтил-4-[6(бензилокси)-3-(3,4-диметоксибензил)-2,4-диоксо-3,4-дигидрохиназолин-1(2 Н)-ил]пиперидин-1-карбоксилата, полученного на стадии 1.5, и 2 5 мл TFA в 50 мл ДХМ. Нейтрализуют при помощи K2CO3. Фильтруют, выпаривают фильтрат при пониженном давлении. Обрабатывают ДХМ, промывают насыщенным раствором NaHCO3, затем 8%-ым раствором NaOH. Сушат над Na2SO4, фильтруют и выпаривают растворитель при пониженном давлении с получением 2,67 г целевого продукта. Стадия 1.7. 4-[6-(Бензилокси)-3-(3,4-диметоксибензил)-2,4-диоксо-3,4-дигидрохиназолин-1(2 Н)-ил] пиперидин-1-карбальдегид Подвергают микроволновому облучению в течение 1 ч при 140 С смесь 0,6 г 6-(бензилокси)-3-(3,4 диметоксибензил)-1-пиперидин-4-илхиназолин-2,4(1 Н,3 Н)-диона, полученного на стадии 1.6, 0,113 г формиата аммония в 5 мл АЦН. Фильтруют, выпаривают фильтрат при пониженном давлении и получают 0,62 г целевого продукта. Стадия 1.8. Соединение 5. 4-[3-(3,4-Диметоксибензил)-6-гидрокси-2,4-диоксо-3,4-дигидрохиназолин-1(2 Н)-ил]пиперидин-1 карбальдегид Подвергают микроволновому облучению в течение 2 ч при 80 С смесь 0,618 г 4-[6-(бензилокси)-3(3,4-диметоксибензил)-2,4-диоксо-3,4-дигидрохиназолин-1(2 Н)-ил]пиперидин-1-карбальдегида,полученного на стадии 1.7, 0,44 г формиата аммония и 0,124 г Pd/C (10%) в 10 мл EtOH, предварительно продутого азотом. Фильтруют, выпаривают при пониженном давлении и получают 0,513 г целевого продукта. Стадия 1.9. Соединение 6. Перемешивают при КТ в течение 15 мин 0,17 г 4-[3-(3,4-диметоксибензил)-6-гидрокси-2,4-диоксо 3,4-дигидрохиназолин-1(2 Н)-ил]пиперидин-1-карбальдегида, полученного на стадии 1.8, 0,25 г CS2CO3 в 3 мл ДМФ. Прибавляют 0,056 г бромацетонитрила и затем подвергают реакционную смесь микроволновому облучению в течение 15 мин при 100 С. Фильтруют, выпаривают при пониженном давлении. Подвергают хроматографии остаток на силикагеле, элюируя смесью МеОН/ДХМ от (1/99 об/об) до (4/96 об/об), и получают 0,112 г целевого продукта. Пример 2. Соединение 3. Получение [1-(1-ацетилпиперидин-4-ил)-3-(3,4-диметоксибензил)-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-6-ил]оксиацетонитрила Прибавляют 0,14 г ацетилхлорида к смеси 0,6 г 6-(бензилокси)-3-(3,4-диметоксибензил)-1 пиперидин-4-илхиназолин-2, 4 (1 Н,3 Н)-диона, полученного на стадии 1.6, 0,24 г NEt3 в 10 мл ДХМ, охлажденного до 0 С. Перемешивают при КТ в течение всей ночи. Промывают 2 раза насыщенным раствором NH4Cl, фильтруют, затем фильтрат выпаривают при пониженном давлении с получением 0,64 г целевого продукта. Стадия 2.2. Соединение 2. 1-(1-Ацетилпиперидин-4-ил)-3(3,4-диметоксибензил)-6-гидроксихиназолин-2,4(1 Н,3 Н)-дион Подвергают микроволновому облучению в течение 2 ч при 80 С смесь 0,64 г 1-(1-ацетилпиперидин-4-ил)-6-(бензилокси)-3-(3,4-диметоксибензил)хиназолин-2,4(1H,3H)-диона, полученного на стадии 2.1, 0,44 г формиата аммония и 0,125 г г Pd/C (10%) в 10 мл EtOH, предварительно продутого азотом. Фильтруют, выпаривают фильтрат при пониженном давлении и получают 0,48 г целевого продукта. Стадия 2.3. Соединение 3. Перемешивают при КТ в течение 15 мин 0,12 г 1-(1-ацетилпиперидин-4-ил)-3-(3,4 диметоксибензил)-6-гидроксихиназолин-2,4(1 Н,3 Н)-диона, полученного на стадии 2.2, 0,172 г CS2CO3 в 3 мл ДМФ. Прибавляют 0,038 г бромацетонитрила и затем подвергают реакционную смесь микроволновому облучению в течение 15 мин при 100 С. Фильтруют, выпаривают при пониженном давлении. Подвергают хроматографии остаток на силикагеле, элюируя смесью МеОН/ДХМ от (1/99, об/об) до (4/96,об/об), и получают 0,094 г целевого продукта. Пример 3. Соединение 34. Получение 4-[3-(4-хлорбензил)-6-(2,2-дифторэтокси)-2,4-диоксо-3,4-дигидрохиназолин-1(2 Н)-ил] пиперидин-1-карбальдегида Прибавляют 8,53 г 2,2-дифторэтанола к раствору 17,31 г метил-5-фтор-2-нитробензоата, 9,64 г Net3,32,71 г 2,8,9-триизобутил-2,5,8,9-тетрааза-1-фосфабицикло[3.3.3]ундекана в 250 мл безводной TFA. Перемешивают 30 мин при КТ.Выпаривают растворитель при пониженном давлении. Добавляют воду и экстрагируют при помощи AcOEt. Промывают 1 н. водным раствором HCl, водой, затем насыщенным раствором NaCl. Сушат над MgSO4, фильтруют и испаряют растворитель при пониженном давлении с получением 21 г целевого продукта. Стадия 3.2. Метил-2-амино-5(2,2-дифторэтокси)бензоат Перемешивают в атмосфере водорода в течение 24 ч при КТ 21 г метил-5-(2,2-дифторэтокси)-2 нитробензоата, полученного на стадии 3.1, и 1 г Pd/C (10%) в смеси 300 мл AcOEt, 50 мл EtOH и 5 мл АсОН. Фильтруют, выпаривают при пониженном давлении и получают 18,6 г целевого продукта. Стадия 3.3. 1,1-Диметилэтил-4-[4-(2,2-дифторэтокси)-2-(метоксикарбонил)фенил]амино пиперидин-1-карбоксилат Нагревают при 90 С в течение 10 мин смесь 4 г метил-2 амино-5-(2,2-дифторэотокси)бензоата, полученного на стадии 3.2, 6,88 г 1,1-диметилэтил-4-оксопиперидин-1-карбоксилата в 15 мл АсОН. Охлаждают до комнатной температуры и добавляют 7,3 г NaBH(OAc)3. Перемешивают при комнатной температуре в течение 12 ч. Экстрагируют при помощи AcOEt, промывают насыщенным раствором K2CO3,затем водой. Сушат над MgSO4, фильтруют и выпаривают при пониженном давлении с получением 6,63 г целевого продукта. Стадия 3.4. 1,1-Диметилэтил-4-карбамоил[4-(2,2-дифторэтокси)-2-(метоксикарбонил)фенил] аминопиперидин-1-карбоксилат Прибавляют 1,95 г изоцианата калия, растворенного в 4 мл воды, к раствору 1,1-диметилэтил-4-[4(2,2-дифторэтокси)-2-(метоксикарбонил)фенил]аминопиперидин-1-карбоксилата (6,63 г), полученного на стадии 3.3, в 40 мл АсОН. Перемешивают 12 ч при КТ. Экстрагируют при помощи AcOEt, промывают насыщенным раствором K2CO3, затем водой. Сушат над MgSO4, фильтруют, выпаривают при пониженном давлении и получают 6,95 г целевого продукта. Стадия 3.5. 1,1-Диметилэтил-4-[6-(2,2-дифторэтокси)-2,4-диоксо-3,4-дигидрохиназолин-1(2 Н)-ил] пиперидин-1-карбоксилат Подвергают микроволновому облучению при 130 С в течение 30 мин 2,5 г 1,1-диметилэтил-4 карбамоил[4-(2,2-дифторэтокси)-2-(метоксикарбонил)фенил]аминопиперидин-1-карбоксилата, полученного на стадии 3.4, растворенного в смеси 10 мл диоксана и 5 мл 1 н. водного раствора NaOH. Экстрагируют при помощи AcOEt, нейтрализуют 1 н. водным раствором HCl, промывают водой, сушат надMgSO4, фильтруют, выпаривают при пониженном давлении. Полученный остаток растирают в смесиAcOEt/пентан и получают целевой продукт. Воспроизводят ту же самую реакцию с 2 другими партиями,содержащими 2,5 г 1,1-диметилэтил-4-карбамоил[4-(2,2-дифторэтокси)-2-(метоксикарбонил)фенил] аминопиперидин-1-карбоксилата, полученного на стадии 3.4, и получают в сумме 5,63 г целевого продукта. Стадия 3.6. 6-(2,2-Дифторэтокси)-1-пиперидин-4-илхиназолин-2,4(1 Н,3 Н)-дион Перемешивают в течение 2 ч при КТ раствор 5,63 г 1,1-диметилэтил-4-[6-(2,2-дифторэтокси)-2,4 диоксо-3,4-дигидрохиназолин-1(2 Н)-ил]пиперидин-1-карбоксилата, полученного на стадии 3.5, в 70 мл
МПК / Метки
МПК: A61P 25/24, A61P 25/18, A61P 25/00, A61K 31/517, A61P 25/22, A61P 25/30, A61P 25/08, A61P 25/02, A61P 25/28, A61P 25/16, A61P 25/14
Метки: хиназолиндиона, терапии, производных, применение
Код ссылки
<a href="https://eas.patents.su/30-23670-primenenie-v-terapii-proizvodnyh-hinazolindiona.html" rel="bookmark" title="База патентов Евразийского Союза">Применение в терапии производных хиназолиндиона</a>
Предыдущий патент: Устройство для затягивания/ослабления резьбовой крепежной детали
Следующий патент: Механизм для преобразования возвратно-вращательного движения в одностороннее вращательное
Случайный патент: Фрезерное устройство, размещаемое в скважине


































