Димеры производных артемизинина, их получение и их применение в терапии
Формула / Реферат
1. Противораковое средство, представляющее собой соединение общей формулы (I)
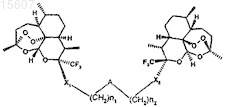
в которой
a) А означает двухвалентную группу, выбираемую из -S-, -SO-, -SO2-, NH-, N(CH3)-, -N(CH2-C(O)O-CH2-CH3)- или -N(CH2-СООН)-, эпоксидной группы, (C1-С6)-алкенилена, -NHCO-, -1,2,3-триазола, -NHSO2-;
b) X1 и Х2 являются одинаковыми и означают О;
d) n1 и n2являются одинаковыми или разными и имеют значение 1, 2, 3 или 4;
в виде основания или в виде кислотно-аддитивной соли, а также в виде гидрата или сольвата.
2. Средство формулы (I) по п.1, отличающееся тем, что n1 и n2являются одинаковыми и имеют значение 2, 3 или 4.
3. Средство формулы (I) по п.1, отличающееся тем, что А выбирают из -NH-, -N(СН2-С(О)О-СН2-СН3)- или
-N(СН2-СООН)-, и n1 и n2являются одинаковыми и имеют значение 2.
4. Средство формулы (I) по п.1, отличающееся тем, что А выбирают из (C1-С6)-алкенилена или эпоксидной группы, и n1 и n2 являются одинаковыми и имеют значение 1.
5. Средство формулы (I) по п.1, отличающееся тем, что А выбирают из -NHCO- или -1,2,3-триазола, и n1 и n2являются разными и, независимо, имеют значение 1 или 2.
6. Противораковое средство, представляющее собой соединение, выбранное из
(3S,5aS,6R,8aS,9R,10R,12R,12aR,3'S,5'aS,6'R,8'aS,9'R,10'R,12'R,12'aR)-10,10'-[тиобис(2,1-этандиилокси)]-бис[декагидро-3,6,9-триметил-10-(трифторметил)-3,12-эпокси-12Н-пирано[4,3-j]-1,2-бензодиоксепина];
(3S,5aS,6R,8aS,9R,10R,12R,12aR,3'S,5'aS,6'R,8'aS,9'R,10'R,12'R,12'aR)-10,10'-[сульфинилбис(2,1-этандиилокси)]-бис[декагидро-3,6,9-триметил-10-(трифторметил)-3,12-эпокси-12Н-пирано[4,3-j]-1,2-бензодиоксепина];
(3S,5aS,6R,8aS,9R,10R,12R,12aR,3'S,5'aS,6'R,8'aS,9'R,10'R,12'R,12'aR)-10,10'-[сульфонилбис(2,1-этандиилокси)]-бис[декагидро-3,6,9-триметил-10-(трифторметил)-3,12-эпокси-12Н-пирано[4,3-j]-1,2-бензодиоксепина];
(3S,5aS,6R,8aS,9R,10R,12R,12aR,3'S,5'aS,6'R,8'aS,9'R,10'R,12'R,12'aR)-10,10'-[тиобис(3,1-пропандиилокси)]-бис[декагидро-3,6,9-триметил-10-(трифторметил)-3,12-эпокси-12Н-пирано[4,3-j]-1,2-бензодиоксепина;
(3S,5aS,6R,8aS,9R,10R,12R,12aR,3'S,5'aS,6'R,8'aS,9'R,10'R,12'R,12'aR)-10,10'-[сульфинилбис(3,1-пропандиилокси)]-бис[декагидро-3,6,9-триметил-10-(трифторметил)-3,12-эпокси-12Н-пирано[4,3-j]-1,2-бензодиоксепина];
(3S,5aS,6R,8aS,9R,10R,12R,12aR,3'S,5'aS,6'R,8'aS,9'R,10'R,12'R,12'aR)-10,10'-[сульфонилбис(3,1-пропандиилокси)]-бис[декагидро-3,6,9-триметил-10-(трифторметил)-3,12-эпокси-12Н-пирано[4,3-j]-1,2-бензодиоксепина];
(3S,5aS,6R,8aS,9R,10R,12R,12aR,3'S,5'aS,6'R,8'aS,9'R,10'R,12'R,12'aR)-10,10'-[тиобис(4,1-бутандиилокси)]-бис[декагидро-3,6,9-триметил-10-(трифторметил)-3,12-эпокси-12Н-пирано[4,3-j]-1,2-бензодиоксепина];
2-[[(3R,5aS,6R,8aS,9R,10R,12R,12aR)-декагидро-3,6,9-триметил-10-(трифторметил)-3,12-эпокси-12Н-пирано[4,3-j]-1,2-бензодиоксепин-10-ил]окси]-N-[2-[[(3R,5aS,6R,8aS,9R,10R,12R,12aR)-декагидро-3,6,9-триметил-10-(трифторметил)-3,12-эпокси-12Н-пирано[4,3-j]-1,2-бензодиоксепин-10-ил]окси]этил]-N-метилэтанамина;
2-{[(3S,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9-триметил-10-(трифторметил)декагидро-3,12-эпокси[1,2]диоксепино[4,3-i]-изохромен-10-ил]окси}-N-(2-{[(3S,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9-триметил-10-(трифторметил)декагидро-3,12-эпокси[1,2]диоксепино[4,3-i]изохромен-10-ил]окси}этил) этанамина;
этил-N,N-бис(2-{[(3S,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9-триметил-10-(трифторметил)декагидро-3,12-эпокси[1,2]диоксепино-[4,3-i]изохромен-10-ил]окси}этил)глицината;
N,N-бис(2-{[(3S,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9-триметил-10-(трифторметил)декагидро-3,12-эпокси[1,2]диоксепино-[4,3-i]изохромен-10-ил]окси}этил)глицина;
2-{[(3S,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9-триметил-10-(трифторметил)декагидро-3,12-эпокси [1,2]диоксепино[4,3-i]-изохромен-10-ил]окси}-N-(2-{[(3S,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9-триметил-10-(трифторметил)декагидро-3,12-эпокси[1,2]-диоксепино[4,3-i]изохромен-10-ил]окси}этил)ацетамида;
(3S,5aS,6R,8aS,9R,10R,12R,12aR,3'S,5'aS,6'R,8'aS,9'R,10'R,12'R,12'aR)-10,10'-[(2Е)-бут-2-ен-1,4-диилбис(окси)]-бис[3,6,9-триметил-10-(трифторметил)декагидро-3,12-эпокси[1,2]диоксепино[4,3-i]изохромена];
(3S,5aS,6R,8aS,9R,10R,12R,12aR,3'S,5'aS,6'R,8'aS,9'R,10'R,12'R,12'aR)-10,10'-[(2Z)-бут-2-ен-1,4-диилбис(окси)]-бис[3,6,9-триметил-10-(трифторметил)декагидро-3,12-эпокси[1,2]диоксепино[4,3-i]изохромена];
(3S,5aS,6R,8aS,9R,10R,12R,12aR,3'S,5'aS,6'R,8'aS,9'R,10'R,12'R,12'aR)-10,10'-[(2R,3R)-оксиран-2,3-диилбис(метиленокси)]-бис[3,6,9-триметил-10-(трифторметил)декагидро-3,12-эпокси[1,2]диоксепино[4,3-i]изохромена];
(1-(2-{[(3S,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9-триметил-10-(трифторметил)декагидро-3,12-эпокси[1,2] диоксепино[4,3-i]изохромен-10-ил]окси}этил)-4-({[(3S,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9-триметил-10-(трифторметил)декагидро-3,12-эпокси[1,2]диоксепино[4,3-i]изохромен-10-ил]окси}метил)-1Н-1,2,3-триазола;
(1-(2-{[(3S,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9-триметил-10-(трифторметил)декагидро-3,12-эпокси[1,2]диоксепино[4,3-i]изохромен-10-ил]окси}этил)-5-({[(3S,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9-триметил-10-(трифторметил)декагидро-3,12-эпокси[1,2]диоксепино[4,3-i]изохромен-10-ил]окси}этил)-1Н-1,2,3-триазола.
7. Средство общей формулы (I) по любому из пп.1-6, отличающееся тем, что оно находится в
1) нехиральной форме, или
2) рацемической форме, или
3) обогащенной одним стереоизомером форме, или
4) обогащенной одним энантиомером форме;
и в случае необходимости может быть превращено в соль.
8. Лекарственное средство, отличающееся тем, что оно включает соединение формулы (I) по любому из пп.1-7, или его фармацевтически приемлемую кислотно-аддитивную соль, или гидрат или сольват соединения формулы (I).
9. Фармацевтическая композиция, отличающаяся тем, что она включает соединение формулы (I) по любому из пп.1-7, или фармацевтически приемлемую соль, гидрат или сольват этого соединения, а также по меньшей мере один фармацевтически приемлемый эксципиент.
10. Промежуточный продукт, представляющий собой соединение общей формулы (II)
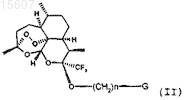
в которой n имеет значение 1, 2, 3 или 4, и G означает атом брома или группу -N3.
Текст
ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ЕВРАЗИЙСКОМУ ПАТЕНТУ Дата публикации и выдачи патента Изобретение относится к противораковому средству, представляющему собой соединение общей формулы (I), в которой а) А означает двухвалентную группу, выбираемую из -S-, -SO-, -SO2-, NH-,N(CH3)-, -N(CH2-C(O)O-CH2-CH3)- или -N(CH2-СООН)-, эпоксидной группы, (C1-С 6)-алкенилена,-NHCO-, -1,2,3-триазола, -NHSO2-; b) X1 и Х 2 являются одинаковыми и означают О; d) n1 и n2 являются одинаковыми или разными и имеют значение 1, 2, 3 или 4; в виде основания или в виде кислотно-аддитивной соли, а также в виде гидрата или сольвата. 015607 Изобретение относится к димерам производных артемизинина, их получению и их применению в терапии. Более конкретно, изобретение относится к димерам производных артемизинина, обладающим противораковой активностью и, в частности, ингибирующей клеточную пролиферацию активностью. На сегодняшний день в случае большинства коммерчески доступных соединений, используемых в химиотерапии, возникают значительные проблемы в отношении побочных действий, толерантности пациентами или резистентности. Таким образом, существует значительная потребность в новых классах соединений, способных действовать в качестве противораковых средств. Из природных соединений, артемизинин представляет собой эндопероксидный сесквитерпен, который выделен в 1971 г. из растения Artemisia annua и обладает противомалярийными свойствами. Получены некоторые простые производные, такие как гидроартемизинин или простой артемизининовый эфир, и они также обладают противомалярийными свойствами. Кроме этой активности, показано, что некоторые производные и димеры артемизинина обладают противораковыми свойствами (J. Med. Chem.,46, 987-994 (2003); патент США 6790863). Проблемой, которую предполагается решить согласно настоящему изобретению, является получение новых соединений в форме димеров артемизинина, обладающих противораковой активностью. Объектом настоящего изобретения является противораковое средство, представляющее собой соединение общей формулы (I)d) n1 и n2 являются одинаковыми или разными и имеют значение 1, 2, 3 или 4; в виде основания или в виде кислотно-аддитивной соли, а также в виде гидрата или сольвата. Ни один из известных димеров согласно уровню техники (J. Med, Chem. , 46, 987-994 (2003); патент США 6790863) не замещен группой CF3, как указано выше для соединений согласно настоящему изобретению. В предпочтительном варианте противораковое средство представляет собой соединение формулы(I), где n1 и n2 являются одинаковыми и имеют значение 2, 3 или 4. В другом предпочтительном варианте противораковое средство представляет собой соединение формулы (I), где А выбирают из -NH-, -N(CH2-C(O)O-CH2-CH3)- или -N(СН 2-СООН)-, и n1 и n2 являются одинаковыми и имеют значение 2. В ещ одном предпочтительном варианте противораковое средство представляет собой соединение формулы (I), где А выбирают из (C1-С 6)-алкенилена или эпоксидной группы, и n1 и n2 являются одинаковыми и имеют значение 1. В другом предпочтительном варианте противораковое средство представляет собой соединение формулы (I), где А выбирают из -NHCO- или -1,2,3-триазола, и n1 и n2 являются разными и, независимо,имеют значение 1 или 2. Согласно настоящему изобретению противораковое средство представляет собой соединение, выбранное из (3S,5aS,6R,8aS,9R,10R,12R,12aR,3'S,5'aS,6'R,8'aS,9'R,10'R,12'R,12'aR)-10,10'-[тиобис(2,1-этандиилокси)]-бис[декагидро-3,6,9-триметил-10-(трифторметил)-3,12-эпокси-12 Н-пирано[4,3-j]-1,2-бензодиоксепина];[1,2]диоксепино[4,3-i]-изохромен-10-ил]оксиэтил)-5-([(3S,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9-триметил-10-(трифторметил)декагидро-3,12-эпокси[1,2]диоксепино[4,3-i]-изохромен-10-ил]оксиэтил)-1 Н 1,2,3-триазола. Соединения формулы (I) могут включать один или несколько асимметрических атомов углерода. Следовательно, они могут существовать в форме энантиомеров или диастереоизомеров. Соединения формулы (I) могут существовать в виде оснований или кислотно-аддитивных солей. Эти соли могут быть получены с фармацевтически приемлемыми кислотами. Таким образом, в предпочтительном варианте объектом настоящего изобретения является средство общей формулы (I), которое находится в 1) нехиральной форме, или 2) рацемической форме, или 3) обогащенной одним стереоизомером форме, или 4) обогащенной одним энантиомером форме; и в случае необходимости может быть превращено в соль. Соединения формулы (I) также могут существовать в форме гидратов или сольватов, а именно, в форме ассоциаций или комбинаций с одной или несколькими молекулами воды или с растворителем. Соединения общей формулы (I) могут быть получены обычными способами органической химии. Примеры синтеза проиллюстрированы на нижеприводимых схемах 1-4, где исходные соединения и реагенты, когда способ их получения не описан, являются коммерчески доступными или описываются в литературе или же могут быть получены в соответствии со способами, которые там описаны или которые известны специалисту в данной области.-3 015607 Способ получения соединения общей формулы (I) состоит в том, что соединение следующей общей формулы (III) в котором В означает заместитель B1 или В 2, такой как указанный выше, подвергают реакции замещения атома брома с помощью нуклеофила, такого как бромсодержащий спирт, получая соединение следующей общей формулы (II) в котором X означает заместитель X1 или Х 2, такой как указанный выше, n означает n1 или n2, такой как указанный выше, и в котором либо G означает удаляемую группу, такую как атом брома, и тогда это соединение общей формулы (II) подвергают реакции нуклеофильного замещения с целью получения димера общей формулы (I) или предшественника соединения общей формулы (I), либо G означает химическую функциональную группу F1, которая может быть, в случае необходимости, активирована путем реакции восстановления или окисления, и тогда это соединение общей формулы (II) вводят во взаимодействие с другим соединением формулы (II), где G означает удаляемую группу, такую как атом брома,или химическую функциональную группу F2, которая может вступать во взаимодействие с F1, с целью получения димера общей формулы (I) или предшественника соединения общей формулы (I). Таким образом, объектом настоящего изобретения является промежуточный продукт, представляющий собой соединение общей формулы (II) в которой n имеет значение 1, 2, 3 или 4, и G означает атом брома, или группу -N3. Под удаляемой группой понимают группу, которая может быть легко удалена из молекулы путем разрыва гетеролитической связи с удалением электронной пары. Эта группа также может быть легко заменена другой группой, например, во время реакции замещения. Такими удаляемыми группами являются, например, галогены или активированная гидроксильная группа, такая как метансульфонат, бензолсульфонат, п-толуолсульфонат, трифлат, ацетат и т.д. Примеры удаляемых групп, а также ссылки на их получение, представлены в руководстве J. March Advances in Organic Chemistry, третье издание, WileyInterscience, с. 310-316. В нижеследующих примерах описывается получение некоторых соединений согласно изобретению. Эти примеры не являются ограничивающими объем охраны изобретения и предназначены только для пояснения настоящего изобретения. Аббревиатуры: С = градус Цельсия; ССМ = тонкослойная хроматография (ТСХ);= химический сдвиг;ES+/-= ионизация электронным распылением (методы образования положительных/отрицательных ионов);RMN 1 Н = протонный ядерный магнитный резонанс (1 Н-ЯМР); К раствору 942 мг (2,27 ммоль) (3S,5aS,6R,8aS,9R,10R,10S,12R,12aR)-10-(бром)декагидро-3,6,9 триметил-10-(трифторметил)-3,12-эпокси-12 Н-пирано[4,3-j]-1,2-бензодиоксепина 1 (получаемого согласно Org. Lett., 4, 757-759 (2002 в 20 мл дихлорметана последовательно добавляют, при комнатной температуре, 1,2 мл гексафторпропанола (5 экв.), затем 1,6 мл 2-бромэтанола (10 экв.). Реакционную смесь после этого перемешивают при комнатной температуре в течение 2 ч 15 мин, затем добавляют 10 мл насыщенного раствора гидрокарбоната натрия. Органическую фазу сушат над сульфатом магния и выпаривают досуха при пониженном давлении. Полученный маслянистый остаток хроматографируют на силикагеле, предварительно кондиционируемом с помощью гептана, затем элюируемом линейным градиентом 0-100% смеси В [(гептан/этилацетат), (90:10), (об./об.)] в А (гептан). Получают 217 мг (21%) ожидаемого соединения 2 в виде масла.Rf=0,45 в системе (гептан/этилацетат), (90:10), (об./об.). ES: m/z=481 (MNa+). 1 Н-ЯМР (400 МГц; при использовании спектрометра BRUKER AVANCE DRX-400; с химическими сдвигами ( в м.д.) - в дейтерированном хлороформе-d1 в качестве растворителя (CDCl3-d1), стандартизированном при 7,27, при температуре 303 K): частично скрытый 0,92 (м частично скрытый, 1 Н); 0,96 (д,J=6,5 Гц, 3 Н); 1,01 (д уш., J=7,5 Гц, 3 Н); от 1,21 до 1,58 (м, 4 Н); 1,42 (с, 3 Н); от 1,65 до 2,08 (м, 5 Н); 2,38b) Стадия 2. Получение соединения по примеру 1 К раствору 215 мг (0,47 ммоль) соединения 2 в 16 мл безводного этанола, в инертной атмосфере аргона и при температуре около 20 С, в течение 10 мин добавляют 18 мг (0,234 ммоль) сульфида натрия. Перемешивание поддерживают при этой температуре в течение примерно 190 чв. Затем добавляют 20 мл насыщенного раствора хлорида натрия. Смесь экстрагируют 3 раза по 20 мл этилацетата. Органические фазы объединяют, промывают с помощью 20 мл насыщенного раствора NaCl, сушат над сульфатом магния и выпаривают досуха при пониженном давлении. Полученный маслянистый остаток хроматографи-5 015607 руют на силикагеле, предварительно кондиционируемом с помощью гептана, затем элюируемом линейным градиентом 0-100% смеси В [(гептан/этилацетат), (85:15), (об./об.)] в А (гептан). Получают 60 мг(33%) ожидаемого соединения по примеру 1 в виде меренги.Rf=0,20 в системе (гептан/этилацетат), (90:10), (об./об.). ES: m/z=835 (M+HCOOH-H)-. 1 Н-ЯМР (400 МГц; при использовании спектрометра BRUKER AVANCE DRX-400; с химическими сдвигами ( в м.д.) - в дейтерированном диметилсульфоксиде-d6 в качестве растворителя (ДМСО-d6),стандартизированном при 2,50 м.д., при температуре 303 К): 0,86 (м частично скрытый, 2 Н); 0,90 (д,J=6,5 Гц, 6 Н); 0,93 (д уш., J=7,5 Гц, 6 Н); 1,22 (м, 2 Н); от 1,27 до 1,60 (м, 8 Н); 1,31 (с, 6 Н); 1,66 (м, 2 Н); от 1,75 до 1,89 (м, 4 Н); 2,04 (м, 2 Н); 2,21 (м, 2 Н); 2,67 (м, 2 Н); от 2,71 до 2,87 (м, 4 Н); 3,64 (м, 2 Н); 3,94 (м,2 Н); 5,58 (с, 2 Н). Пример 2. (3S,5aS,6R,8aS,9R,10R,12R,12aR,3'S,5'aS,6'R,8'aS,9'R,10'R,12'R,12'aR)-10,10'-[сульфинилбис(2,1-этандиилокси)]бисдекагидро-3,6,9-триметил-10-(трифторметил)-3,12-эпокси-12 Н-пирано К раствору 35 мг (0,044 ммоль) соединения по примеру 1 в 3 мл дихлорметана при температуре около 20 С медленно добавляют 16,4 мг (0,066 ммоль) м-хлорнадбензойной кислоты. Перемешивание поддерживают при этой температуре в течение примерно 3 ч, после чего добавляют 3 мл насыщенного раствора гидрокарбоната натрия. Смесь экстрагируют 3 раза по 10 мл этилацетата. Органические фазы объединяют, промывают 2 раза по 10 мл водного насыщенного раствора хлорида натрия, сушат над сульфатом магния, отфильтровывают и выпаривают досуха при пониженном давлении. Полученный маслянистый остаток хроматографируют на силикагеле, предварительно кондиционируемом с помощью гептана, затем элюируемым линейным градиентом 0-100% этилацетата в гептане. Получают 14,5 мг(40%) соединения по Примеру 3 в виде твердого вещества белого цвета:Rf=0,60 в системе (гептан/этилацетат), (50:50), (об./об.). ES: m/z=867 (М+НСООН-Н)-. 1 Н-ЯМР (500 МГц; при использовании спектрометра BRUKER AVANCE DRX-500; с химическими сдвигами ( в м.д.) - в дейтерированном диметилсульфоксиде-d6 в качестве растворителя (ДМСО-d6),стандартизированном при 2,50 м.д., при температуре 298 К): 0,85 (м частично скрытый, 2 Н); 0,89 (д,J=6,5 Гц, 6 Н); 0,92 (д уш., J=7,5 Гц, 6 Н); 1,18 (м, 2 Н); 1,32 (с, 6 Н); 1,36 (м, 2 Н); от 1,47 до 1,58 (м, 6 Н); 1,62 (м, 2 Н); 1,71 (м, 2 Н); 1,84 (м, 2 Н); 2,04 (м, 2 Н); 2,21 (м, 2 Н); 2,68 (м, 2 Н); 3,48 (м, 2 Н); 3,59 (м, 2 Н); 3,83 (м, 2 Н); 4,19 (м, 2 Н); 5,63 (с, 2 Н), а также 12,4 мг (35%) соединения по примеру 2 в виде меренги белого цвета:Rf=0,22 в системе (гептан/этилацетат), (50:50), (об./об.). ES: m/z=851 (M+HCOOH-H)-. 1 Н-ЯМР (500 МГц; при использовании спектрометра BRUKER AVANCE DRX-500; с химическими сдвигами ( в м.д.) - в дейтерированном диметилсульфоксиде-d6 в качестве растворителя (ДМСО-d6),стандартизированном при 2,50 м.д., при температуре 298 К (смесь 50%-50% изомеров: 0,85 (м частично скрытый, 2 Н); 0,88 (д, J=6,5 Гц, 3 Н); 0,90 (д, J=6,5 Гц, 3 Н); 0,93 (д уш., J=7,5 Гц, 6 Н); от 1,14 до 1,89 (м,16 Н); 1,31 (с, 3 Н); 1,32 (с, 3 Н); 2,03 (м, 2 Н); 2,20 (м, 2 Н); 2,67 (м, 2 Н); 2,98 (м, 2 Н); 3,12 (м, 2 Н); 3,79 (м,1 Н); 3,87 (м, 1 Н); от 4,11 до 4,20 (м, 2 Н); 5,58 (с, 1 Н); 5,61 (с, 1 Н). Пример 4. (3S,5aS,6R,8aS,9R,10R,12R,12aR,3'S,5'aS,6'R,8'aS,9'R,10'R,12'R,12'aR)-10,10'-[тиобис[3,1 пропандиилокси)]бисдекагидро-3,6,9-триметил-10-(трифторметил)-3,12-эпокси-12 Н-пирано[4,3-j]-1,2 бензодиоксепин. К раствору 471 мг (1,14 ммоль) соединения 1 в 7 мл дихлорметана последовательно добавляют, при комнатной температуре, 0,607 мл гексафторпропанола (5 экв.), затем 1,03 мл 3-бромпропанола (10 экв.). Реакционную смесь после этого перемешивают при комнатной температуре в течение 2 ч 30 мин, затем добавляют 5 мл насыщенного раствора гидрокарбоната натрия, органическую фазу сушат над сульфатом магния, отфильтровывают и выпаривают досуха при пониженном давлении. Полученный маслянистый остаток хроматографируют на силикагеле, предварительно кондиционируемом с помощью гептана, затем элюируемом линейным градиентом 0-100% смеси В [(гептан/этилацетат), (90:10), (об./об.)] в А (гептан). Получают 22 9 мг (43%) ожидаемого соединения 3 в виде масла.(MNH4)+); m/z=354 (m/z=490-BrCH2CH2CH2OH+2 Н)+ 1 Н-ЯМР (400 МГц; при использовании спектрометра BRUKER AVANCE DRX-400; с химическими сдвигами ( в м.д.) - в дейтерированном хлороформе-d1 в качестве растворителя (CDCl3-d1), стандартизированном при 7,27 м.д., при температуре 303 K): 0,90 (м частично скрытый, 1 Н); 0,97 (д, J=6,5 Гц, 3 Н); 1,00 (д уш., J=7,5 Гц, 3 Н); от 1,22 до 1,54 (м, 4 Н); 1,44 (с, 3 Н); от 1,60 до 1,73 (м, 2 Н); 1,82 (м, 1 Н); 1,91b) Стадия 2. Получение соединения по примеру 4. К раствору 220 мг (0,46 ммоль) соединения 3 в 16 мл безводного этанола, в инертной атмосфере аргона и при температуре около 20 С, в течение 10 мин добавляют 18,2 мг (0,23 ммоль) сульфида натрия,перемешивание поддерживают при этой температуре в течение примерно 80 ч, затем добавляют 20 мл насыщенного раствора хлорида натрия. Смесь экстрагируют 3 раза по 20 мл этилацетата. Органические фазы объединяют, промывают с помощью 20 мл водного насыщенного раствора хлорида натрия, сушат над сульфатом магния, отфильтровывают и выпаривают досуха при пониженном давлении. Полученный маслянистый остаток хроматографируют на силикагеле, предварительно кондиционируемом с помощью гептана, затем элюируемом линейным градиентом 0-100% смеси В [(гептан/этилацетат), (85:15), (объем/объем)] в А (гептан). Получают 103 мг (54%) ожидаемого соединения по примеру 4 в виде твердого вещества белого цвета.Rf=0,20 в системе (гептан/этилацетат), (90:10), (об./об.). ES: m/z=841 MNa+. 1 Н-ЯМР (4 00 МГц; при использовании спектрометра BRUKER AVANCE DRX-400; с химическими сдвигами ( в м.д.) - в дейтерированном хлороформе-d1 в качестве растворителя (CDCl3-d1), стандартизированном при 7,27, при температуре 303 K): 0,93 (м частично скрытый, 2 Н); 0,97 (д, J=6,5 Гц, 6 Н); 1,00 К раствору 21,4 мг (0,026 ммоль) соединения по примеру 4 в 2 мл дихлорметана при температуре около 20 С медленно добавляют 9,1 мг (0,036 ммоль) м-хлорнадбензойной кислоты. Перемешивание поддерживают при этой температуре в течение примерно 3 ч, после чего добавляют 3 мл насыщенного раствора гидрокарбоната натрия. Смесь экстрагируют 3 раза по 10 мл этилацетата. Органические фазы объединяют, промывают 2 раза по 10 мл водного насыщенного раствора хлорида натрия, сушат над сульфатом магния, отфильтровывают и выпаривают досуха при пониженном давлении. Полученный маслянистый остаток хроматографируют на силикагеле, предварительно кондиционируемом с помощью гептана, затем элюируемом линейным градиентом 0-100% этилацетата в гептане. Получают 7,7 мг (34%) соединения по примеру 6 в виде твердого вещества белого цвета: Rf=0,68 в системе (гептан/этилацетат),(50:50), (об./об.). ES: m/z=873 MNa+. 1 Н-ЯМР (400 МГц; при использовании спектрометра BRUKER AVANCE DRX-400; с химическими сдвигами ( в м.д.) - в дейтерированном хлороформе-d1 в качестве растворителя (CDCl3-d1), стандартизированном при 7,27, при температуре 303 K: 0,92 (м частично скрытый, 2 Н); 0,97 (д, J=6,5 Гц, 6 Н); 1,00(д уш., J=7,5 Гц, 6 Н); от 1,23 до 1,38 (м, 4 Н); 1,43 (с, 6 Н); от 1,44 до 1,72 (м, 8 Н); 1,83 (м, 2 Н); 1,92 (м,2 Н); 2,05 (м, 2 Н); 2,12 (м, 4 Н); 2,38 (м, 2 Н); 2,87 (м, 2 Н); 3,00 (м, 2 Н); 3,13 (м, 2 Н); 3,75 (м, 2 Н); 3,97 (м,2 Н); 5,34 (с, 2 Н), а также 8,5 мг (39%) соединения по примеру 5 в виде меренги белого цвета: Rf=0,20 в системе (гептан/этилацетат), (50:50), (об./об.).ES: m/z=857 MNa+ 1 Н-ЯМР (400 МГц; при использовании спектрометра BRUKER AVANCE DRX-400; с химическими сдвигами ( в м.д.) - в дейтерированном хлороформе-d1 в качестве растворителя (CDCl3-d1), стандартизированном при 7,27, при температуре 303 K (смесь 50-50% изомеров: 0,90 (м частично скрытый, 2 Н); 0,97 (д, J=6,5 Гц, 6 Н); 1,00 (д уш., J=7,5 Гц, 6 Н); от 1,24 до 1,36 (м, 4 Н); 1,43 (с, 6 Н); от 1,45 до 1,72 (м,8 Н); 1,82 (м, 2 Н); 1,92 (м, 2 Н); от 2,00 до 2,11 (м, 6 Н); 2,38 (м, 2 Н); от 2,68 до 2,82 (м, 4 Н); 2,86 (м, 2 Н); 3,77 (м, 2 Н); 3,96 (м, 2 Н); 5,33 (с, 1 Н); 5,35 (с, 1 Н). Пример 7. (3S,5aS,6R,8aS,9R,10R,12R,12aR,3'S,5'aS,6'R,8'aS,9'R,10'R,12'R,12'aR)-10,10'-[тиобис(4,1 бутандиилокси)]бис(декагидро-3,6,9-триметил-10-(трифторметил)-3,12-эпокси-12 Н-пирано[4,3-j]-1,2 бензодиоксепин К раствору 1,07 г (2,58 ммоль) соединения 1 в 15 мл дихлорметана последовательно добавляют, при комнатной температуре, 1,36 мл гексафторпропанола (5 экв.), затем 2,5 г 4-бромбутанола (6,3 экв.). Реакционную смесь после этого перемешивают при комнатной температуре в течение 3 ч, затем добавляют 6 мл насыщенного раствора гидрокарбоната натрия. Органическую фазу сушат над сульфатом магния, отфильтровывают и выпаривают досуха при пониженном давлении. Полученный маслянистый остаток-8 015607 хроматографируют на силикагеле, предварительно кондиционируемом с помощью гептана, затем элюируемом линейным градиентом 0-100% смеси В [(гептан/этилацетат), (90:10), (об./об.)] в А (гептан). Получают 90 мг (7%) ожидаемого соединения 4 в виде масла.Rf=0,40 в системе (гептан/этилацетат), (9:1), (об./об.). IC: m/z=504 MNH4+. 1 Н-ЯМР (400 МГц; при использовании спектрометра BRUKER AVANCE DRX-400; с химическими сдвигами ( в м.д.) - в дейтерированном диметилсульфоксиде-d6 в качестве растворителя (ДМСО-d6),стандартизированном при 2,50 м.д., при температуре 298 K: 0,92 (м частично скрытый, 1 Н); 0,97 (д, J=6,0 Гц, 3 Н); 1,00 (д уш., J=7,5 Гц, 3 Н); от 1,05 до 1,62 (м частично скрытый, 6 Н); 1,43 (с, 3 Н); от 1,65 до 2,10b) Стадия 2. Получение соединения по примеру 7 К раствору 90 мг (0,19 ммоль) соединения 4 в 5 мл безводного этанола, в инертной атмосфере аргона и при температуре около 20 С, в течение 10 мин добавляют 5,7 мг (0,073 ммоль) сульфида натрия. Перемешивание поддерживают при этой температуре в течение примерно 42 ч, затем добавляют 5 мл насыщенного раствора хлорида натрия. Смесь экстрагируют 3 раза по 5 мл этилацетата. Органические фазы объединяют, промывают с помощью 5 мл водного насыщенного раствора хлорида натрия, сушат над сульфатом магния, отфильтровывают и выпаривают досуха при пониженном давлении. Полученный маслянистый остаток хроматографируют на силикагеле, предварительно кондиционируемом с помощью гептана, затем элюируемом линейным градиентом 0-20% этилацетата в гептане. Получают 33 мг (50%) ожидаемого соединения по примеру 7 в виде меренги.Rf=0,20 в системе (гептан/этилацетат), (9:1), (об./об.), ES: m/z=891 (M+HCOOH-H)-. 1 Н-ЯМР (4 00 МГц; при использовании спектрометра BRUKER AVANCE DRX-400; с химическими сдвигами ( в м.д.) - в дейтерированном диметилсульфоксиде-d6 в качестве растворителя (ДМСО-d6),стандартизированном при 2,50 м.д., при температуре 298 K): 0,93 (м частично скрытый, 2 Н); 0,97 (д,J=6,0 Гц, 6 Н); 1,00 (д уш., J=7,5 Гц, 6 Н); от 1,22 до 1,37 (м, 4 Н); 1,43 (с, 6 Н); 1,50 (м, 4 Н); от 1,62 до 1,86 К раствору 100 мг (0,218 ммоль) соединения 2 в 0,6 мл тетрагидрофурана, в инертной атмосфере аргона и при температуре около 20 С, последовательно добавляют 33 мг (0,218 ммоль) иодида натрия и 0,545 мл (1,09 ммоль) 2 М раствора метиламина в тетрагидрофуране. Перемешивание поддерживают при температуре 40 С в течение примерно 20 ч. Реакционную смесь обрабатывают с помощью 3 мл водного насыщенного раствора гидрокарбоната натрия, затем экстрагируют 3 раза по 3 мл дихлорметана. Органические фазы объединяют, затем сушат над сульфатом магния, отфильтровывают и выпаривают досуха при пониженном давлении. Полученный маслянистый остаток хроматографируют на силикагеле, предварительно кондиционируемом с помощью гептана, затем элюируемом градиентом 0-30% этилацетата в гептане. Получают 15 мг (18%) ожидаемого соединения по примеру 8 в виде твердого вещества белого цвета.Rf=0,25 в системе (гептан/этилацетат), (7:3), (об./об.). ES: m/z=788 MH+. 1 Н-ЯМР (400 МГц; при использовании спектрометра BRUKER AVANCE DRX-400; с химическими сдвигами ( в м.д.) - в дейтерированном хлороформе-d1 в качестве растворителя (CDCl3-d1), стандартизированном при 7,27, при температуре 303 К, после добавления одной капли дейтерированной уксусной кислоты-d4 (CD3OD-d4: 0,91 (м частично скрытый, 2 Н); 0,95 (д, J=6,5 Гц, 6 Н); 0,98 (д уш., J=7,0 Гц, 6 Н); К раствору 574 мг (1,25 ммоль) соединения 2 в 20 мл диметилформамида, в инертной атмосфере аргона и при температуре около 20 С, добавляют 162,5 мг (2,5 ммоль) азида натрия. Перемешивание поддерживают при температуре около 20 С в течение 3 ч. Реакционную смесь обрабатывают с помощью 60 мл дистиллированной воды, после чего экстрагируют 2 раза по 100 мл этилацетата. Органическую фазу промывают 2 раза по 80 мл водного насыщенного раствора хлорида натрия, сушат над сульфатом магния, отфильтровывают и выпаривают досуха при пониженном давлении. Получают 527 мг (выход количественный) ожидаемого соединения 5 в виде масла желтого цвета. К раствору 527 мг (1,25 ммоль) соединения 5 в 7 мл тетрагидрофурана, в инертной атмосфере аргона и при температуре около 20 С, добавляют 328 мг (1,25 ммоль) трифенилфосфина. Перемешивание поддерживают при температуре около 20 С в течение примерно 24 ч. Реакционную смесь обрабатывают с помощью 1 мл дистиллированной воды, затем продолжают перемешивание в течение примерно 24 ч при той же температуре. Реакционную смесь концентрируют в вакууме и таким образом полученный остаток обрабатывают с помощью 5 мл дихлорметана, промывают с помощью 2 мл водного насыщенного раствора гидрокарбоната натрия, сушат над сульфатом магния, отфильтровывают и выпаривают досуха при пониженном давлении. Полученный маслянистый остаток хроматографируют на силикагеле,предварительно кондиционируемом с помощью дихлорметана, затем элюируемом линейным градиентом 0-100% смеси В [(дихлорметан/метанол), (90:10), (об./об.)] в А (дихлорметан). Получают 344 мг (70%) ожидаемого соединения 6 в виде порошка белого цвета. МС (масс-спектрометрия) : ES+: [M+H]+=396. 1 Н-ЯМР-спектр (400 МГц; при использовании спектрометра BRUKER AVANCE DRX-400; с химическими сдвигами ( в м.д.) - в дейтерированном хлороформе-d1 в качестве растворителя (CDCl3-d1),стандартизированном при 7,27, при температуре 303 K): 0,94 (м частично скрытый, 1 Н); 0,97 (д, J=6,5 Гц,3 Н); 1,03 (д уш., J=7,0 Гц, 3 Н); 1,30 (м, 2 Н); от 1,40 до 1,56 (м, 2 Н); 1,42 (с, 3 Н); от 1,63 до 1,95 (м, 4 Н); 2,04 (м, 1 Н); 2,38 (м, 1 Н); 2,45 (м ушир., 2 Н); 2,87 (м, 1 Н); 2,94 (м, 2 Н); 3,75 (м, 1 Н); 3,85 (м, 1 Н); 5,42 (с,1 Н). с) Стадия 3. Получение соединения по примеру 9. К раствору 282 мг (0,534 ммоль) соединения 2 в 7 мл диметилформамида, в инертной атмосфере аргона и при температуре около 20 С, последовательно добавляют 98 мг (0,593 ммоль) иодида калия, 164 мг (1,19 ммоль) карбоната калия и 232 мг (0,587 ммоль) соединения 6. Перемешивание поддерживают при температуре 70 С в течение примерно 7 ч. Реакционную смесь концентрируют досуха при пониженном давлении. Полученный остаток обрабатывают с помощью 10 мл дихлорметана, затем промывают с помощью б мл дистиллированной воды, водную фазу снова экстрагируют с помощью 10 мл дихлорметана. Объединенные органические фазы промывают с помощью 6 мл водного насыщенного раствора гидрокарбоната натрия, затем сушат над сульфатом магния, отфильтровывают и выпаривают досуха при пониженном давлении. Полученный остаток хроматографируют на силикагеле, предварительно кондиционируемом с помощью смеси (гептан/этилацетат), (9:1), (об./об.), после чего элюируемом градиентом 10-60% этилацетата в гептане. Получают 116 мг (28%) ожидаемого соединения по примеру 9 в виде твердого вещества бледно-желтого цвета.Rf=0,16 в системе (гептан/этилацетат), (8:2), (об./об.). МС: ES+: [M+H]+=774. ES-: [М+НСООН+Н]+= 818. 1 Н-ЯМР-спектр (400 МГц; при использовании спектрометра BRUKER AVANCE DRX-400; с химическими сдвигами ( в м.д.)в дейтерированном хлороформе-d1 в качестве растворителя (CDCl3-d1),стандартизированном при 7,27, при температуре 303 К): 0,92 (м частично скрытый, 2 Н); 0,98 (д, J=6,5 Гц,6 Н); 1,00 (д уш., J=7,0 Гц, 6 Н); от 1,20 до 1,39 (м, 4 Н); 1,42 (с, 6 Н); от 1,40 до 1,83 (м, 11 Н); 1,90 (м, 2 Н); 2,03 (м, 2 Н); 2,38 (м, 2 Н); от 2,73 до 2,91 (м, 6 Н); 3,75 (м, 2 Н); 3,91 (м, 2 Н); 5,47 (с, 2 Н). Пример 10. Этил-N,N-бис(2-[(3S,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9-триметил-10-(триформетил) декагидро-3,12-эпокси[1,2]диоксепино-[4,3-i]изохромен-10-ил]оксиэтил)глицинат К раствору 37 мг (0,047 ммоль) соединения по примеру 9 в 1 мл диметилформамида, в инертной атмосфере аргона и при температуре около 20 С, последовательно добавляют 15 мкл (0,133 ммоль) этилового эфира бромуксусной кислоты, 8 мг (0,04 7 ммоль) иодида калия, 10 мг (0,071 ммоль) карбоната калия. Перемешивание поддерживают при температуре 50 С в течение 1 ч. Реакционную смесь концентрируют досуха при пониженном давлении. Полученный остаток обрабатывают с помощью 5 мл этилацетата, затем промывают с помощью 3 мл дистиллированной воды, водную фазу снова экстрагируют 2 раза по 5 мл этилацетата. Объединенные органические фазы промывают 2 раза по 5 мл водного насыщенного раствора хлорида натрия, затем сушат над сульфатом магния, отфильтровывают и выпаривают досуха при пониженном давлении. Полученный остаток хроматографируют на силикагеле, предварительно кондиционируемом, затем элюируемом с помощью смеси (гептан/этилацетат), (80:20), (об./об.), получают 30 мг (74%) ожидаемого соединения по примеру 10 в виде бесцветного пастообразного вещества. ТСХ: Rf=0,49 в системе (гептан/этилацетат), (7:3), (об./об.). MC: ES+: [M+H]+=860. ES-:[M+HCOOH+H]+ =904. 1 Н-ЯМР-спектр (400 МГц; при использовании спектрометра BRUKER AVANCE DRX-400; с химическими сдвигами ( в м.д.) - в дейтерированном хлороформе-d1 в качестве растворителя (CDCl3-d1),стандартизированном при 7,27, при температуре 303 К): от 0,80 до 1,00 (м, 14 Н); от 1,19 до 1,38 (м частично скрытый, 4 Н); 1,28 (т, J=7,0 Гц, 3 Н); 1,40 (с, 6 Н); от 1,44 до 1,58 (м частично скрытый, 4 Н); от 1,61 до 1,82 (м, 6 Н); 1,89 (м, 2 Н); 2,02 (м, 2 Н); 2,36 (м, 2 Н); от 2,70 до 2,90 (м, 4 Н); 3,02 (м, 2 Н); 3,40 (д, J=17,5 Гц, 1 Н ); 3,61 (м, 2 Н); 3,67 (д, J=17,5 Гц, 1 Н); 3,98 (м, 2 Н); от 4,06 до 4,22 (м, 2 Н); 5,40 (с, 2 Н). Пример 11. N,N-бис(2-[(3S,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9-триметил-10-(триформетил)декагидро-3,12-эпокси[1,2]диоксепино-[4,3-i]изохромен-10-ил]оксиэтил)глицин. К раствору 10 мг (0,011 ммоль) соединения по примеру 10 в 0,5 мл метанола при температуре около- 11015607 20 С добавляют 59 мкл (0,059 ммоль) 1 н водного раствора гидроксида натрия. Перемешивание поддерживают при той же температуре в течение примерно 6,5 ч. Реакционную смесь концентрируют досуха при пониженном давлении. Полученный остаток обрабатывают с помощью 3 мл этилацетата, затем промывают с помощью 1 мл водного насыщенного раствора хлорида натрия. Водную фазу снова экстрагируют с помощью 3 мл этилацетата. Органические фазы объединяют, сушат над сульфатом магния, отфильтровывают и выпаривают досуха при пониженном давлении. Полученный остаток хроматографируют на силикагеле, предварительно кондиционируемом, затем элюируемом смесью (дихлорметан/метанол), (95:5), (об./об.). Получают 8 мг (81%) ожидаемого соединения по примеру 11 в виде бесцветного твердого вещества. МС: ES+: [M+H]+=832. ES-: [М-Н]-=830. 1 Н-ЯМР-спектр (300 МГц; при использовании спектрометра BRUKER AVANCE DRX-300; с химическими сдвигами ( в м.д.) - в дейтерированном хлороформе-d1 в качестве растворителя (CDCl3-d1),стандартизированном при 7,27, при температуре 303 K): 0,92 (м частично скрытый, 2 Н); 0,97 (д, J=6,5 Гц,6 Н); 1,01 (д уш., J=7,0 Гц, 6 Н); от 1,20 до 1,38 (м частично скрытый, 4 Н); 1,42 (с, 6 Н); от 1,44 до 1,75 (м,8 Н); от 1,80 до 2,10 (м, 6 Н); 2,39 (м, 2 Н); от 2,80 до 3,02 (м, 6 Н); 3,38 (д, J=17,5 Гц, 1 Н); 3,55 (д, J=17,5 Гц,1 Н); от 3,77 до 3,98 (м, 4 Н); 5,32 (с, 2 Н). Пример 12. 2-[(3S,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9-триметил-10-(триформетил)декагидро-3,12 эпокси[1,2]диоксепино[4,3-i]-изохромен-10-ил]окси-N-(2-[(3S,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9 триметил-10-(триформетил)декагидро-3,12-эпокси[1,2]-диоксепино[4,3-i]изохромен-10-ил]оксиэтил) ацетамид. К раствору 100 мг (0,255 ммоль) соединения 7 (получаемого согласно WO 2003035651) в 2 мл ацетона последовательно добавляют, при комнатной температуре, 117 мг (0,742 ммоль) перманганата калия,затем 11 мг (0,127 ммоль) гидрокарбоната натрия. Реакционную смесь затем перемешивают при комнатной температуре в течение 3 ч, после чего добавляют 1 экв. 1 н. водного раствора соляной кислоты. Перемешивание продолжают при комнатной температуре в течение примерно 18 ч. Реакционную среду отфильтровывают, затем выпаривают досуха при пониженном давлении. Полученный остаток обрабатывают с помощью 10 мл этилацетата. Органическую фазу промывают с помощью 3 мл дистиллированной воды, водную фазу подкисляют с помощью 2 мл 1 н. водного раствора соляной кислоты, потом экстрагируют с помощью 10 мл этилацетата. Органическую фазу сушат над сульфатом магния, отфильтровывают, затем выпаривают досуха при пониженном давлении. Получают 27 мг (26%) ожидаемого соединения 8 в виде твердого вещества белого цвета. 1 Н-ЯМР (CDCl3, 300 МГц)в м.д.: 5,47 (с, 1 Н); 4,67 (д, 1 Н); 4,26 (д, 1H1); 2,91 (кв, 1 Н); 2,38 (тд,1 Н); 2,19 (дкв, 1 Н); 2,04 (дт, 1 Н); 1,90 (м, 1 Н); 1,77 (м, 2 Н); 1,70 (м, 1 Н); 1,59-1,48 (м, 1 Н); 1,48-1,45 (м,1 Н); 1,42 (с, 3 Н); 1,40-1,24 (м, 2 Н); 1,05 (д, 3 Н); 0,98-0,87 (м, 1 Н); 0,96 (д, 3 Н).b) Стадия 2. Получение соединения по примеру 12 К раствору 37 мг (0,09 ммоль) соединения 8 в 3 мл дихлорметана, в инертной атмосфере аргона и при температуре около 20 С, последовательно добавляют 36 мг (0,27 ммоль) гидроксибензотриазола и 52 мг (0,27 ммоль) 1-(3-диметиламинопропил)-3-этилкарбодиимидгидрохлорида. Перемешивание поддерживают при температуре около 20 С в течение примерно 30 мин, затем добавляют 39 мг (0,099 ммоль) соединения 6. Перемешивание продолжают при этой температуре в течение 1 ч. Реакционную смесь обрабатывают с помощью 5 мл дистиллированной воды, затем экстрагируют 3 раза по 20 мл этилацетата.- 12015607 Органическую фазу промывают 2 раза по 10 мл водного насыщенного раствора хлорида натрия, сушат над сульфатом магния, отфильтровывают и выпаривают досуха при пониженном давлении. Полученный остаток хроматографируют на силикагеле, предварительно кондиционируемом с помощью смеси (гептан/этилацетат), (90:10), (об./об.), затем элюируемом градиентом 10-20% этилацетата в гептане. Получают 40 мг (56%) ожидаемого соединения по примеру 12 в виде вязкого смолоподобного вещества. МС: ES+: [M+H]+=788; [M+Na]+=810. ES-: [М-Н]- =786; [М+НСООН+Н]+=832. 1 Н-ЯМР-спектр (400 МГц; при использовании спектрометра BRUKER AVANCE DRX-400; с химическими сдвигами ( в м.д.) - в дейтерированном хлороформе-d1 в качестве растворителя (CDCl3-d1),стандартизированном при 7,27, при температуре 303 K): от 0,87 до 1,03 (м, 11 Н); 1,08 (д уш., 3 Н); от 1,21 до 1,40 (м, 4 Н); 1,43 (с, 6 Н); от 1,45 до 1,65 (м частично скрытый, 6 Н); 1,69 (м, 2 Н); от 1,78 до 1,97 (м,4 Н); 2,05 (м, 2 Н); от 2,32 до 2,43 (м частично скрытый, 2 Н); от 2,82 до 2,98 (м, 2 Н); 3,37 (м, 1 Н); от 3,65 до 3,81 (м, 2 Н); 3,95 (м, 1 Н); 4,14 (д, J=16,0 Гц, 1 Н); 4,43 (д, J=16,0 Гц, 1 Н); 5,33 (с, 1 Н); 5,36 (с, 1 Н); 6,52 Суспензию 200 мг (0,51 ммоль) соединения 7 и 43 мг (0,051 ммоль) бензилиденбис(трициклогексилфосфин)дихлоррутения в 1,3 мл дихлорметана перемешивают в течение примерно 7 ч при температуре около 20 С. Добавляют раствор, содержащий 633 мг (5,10 ммоль) трисгидроксиметилфосфина и 1,43 мл (10,2 ммоль) триэтиламина в 3 мл дихлорметана. Энергично перемешивают при температуре около 20 С в течение примерно 10 мин, затем добавляют 6 мл воды, перемешивание продолжают в течение 1 ч. Органическую фазу промывают с помощью 3 мл дистиллированной воды, сушат над сульфатом магния, отфильтровывают и выпаривают досуха при пониженном давлении. Полученный маслянистый остаток хроматографируют на силикагеле, предварительно кондиционируемом, затем элюируемом с помощью смеси (гептан/этилацетат), (95:5), (об./об.), получают 57,5 мг (38%) изомера Е по примеру 13 в виде кристаллов белого цвета. Получают 20 мг (10%) изомера Z по примеру 14 в виде кристаллов белого цвета. Пример 13. Rf=0,41 в системе (гептан/этилацетат), (8:2), (об./об.). ИК-спектр: 983 см-1 (характерная полоса транс-СН=СН). МС: ES+: [M+Na]+=779. ES-: К раствору 158 мг (0,209 ммоль) соединения по примеру 13 в 2,75 мл дихлорметана при температуре около 20 С добавляют 103 мг (0,417 ммоль) м-хлорнадбензойной кислоты. При этой температуре перемешивают в течение примерно 8 ч. Реакционную смесь последовательно промывают 3 раза по 5 мл водного насыщенного раствора гидрокарбоната натрия и с помощью 13 мл водного насыщенного рас- 13015607 твора хлорида натрия. Органическую фазу сушат над сульфатом магния, отфильтровывают и выпаривают досуха при пониженном давлении. Полученный маслянистый остаток хроматографируют на силикагеле, предварительно кондиционируемом, затем элюируемом с помощью смеси (гептан/этилацетат),(95:5), (об./об.), получают 70 мг (43%) одного из двух транс-изомеров по примеру 15 в виде кристаллов белого цвета.MC: ES+: [M+Na]+=795. 1 Н-ЯМР-спектр (400 МГц; при использовании спектрометра BRUKER AVANCE DRX-400; с химическими сдвигами ( в м.д.) - в дейтерированном хлороформе-d1 в качестве растворителя (CDCl3-d1),стандартизированном при 7,27, при температуре 303 K): от 0,86 до 0,98 (м, 14 Н); от 1,20 до 1,39 (м, 4 Н); 1,42 (с, 6 Н); от 1,44 до 1,55 (м, 4 Н); от 1,62 до 1,77 (м, 6 Н); 1,89 (м, 2 Н); 2,04 (м, 2 Н); 2,37 (м, 2 Н); 2,85 (м,2 Н); 3,11 (с уш., 2 Н); 3,69 (д уш., J=12,5 Гц, 2 Н); 4,31 (д, J=12,5 Гц, 2 Н); 5,39 (с, 2 Н). Пример 16. (1-(2-[(3S,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9-триметил-10-(трифторметил)декагидро 3,12-эпокси[1,2]диоксепино[4,3-i]-изохромен-10-ил]оксиэтил)-4-([(3S,5aS,6R,8aS,9R,10R,12R,12aR)3,6,9-триметил-10-(трифторметил)декагидро-3,12-эпокси[1,2]диоксепино[4,3-1]изохромен-10-ил]окси) метил)-1 Н-1,2,3-триазол; и Пример 17. (1-(2-[(3S,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9-триметил-10-(трифторметил)декагидро 3,12-эпокси[1,2]диоксепино[4,3-i]изохромен-10-ил]оксиэтил)-5-([(3S,5aS,6R,8aS,9R,10R,12R,12aR)3,6,9-триметил-10-(трифторметил)декагидро-3,12-эпокси[1,2]диоксепино[4,3-i]-изохромен-10-ил]окси этил)-1 Н-1,2,3-триазол.Org. Lett., 4, 757-759 (2002 в 5 мл дихлорметана при комнатной температуре последовательно добавляют 0,266 мл гексафторпропанола (5 экв.), затем 0,289 мл пропаргилового спирта (10 экв.). Реакционную смесь после этого перемешивают при комнатной температуре в течение 1 ч 15 мин, потом добавляют 5 мл насыщенного раствора гидрокарбоната натрия. Органическую фазу сушат над сульфатом магния и выпаривают досуха при пониженном давлении. Полученный маслянистый остаток хроматографируют на силикагеле, предварительно кондиционируемом с помощью гептана, затем элюируемом линейным градиентом 0-50% этилацетата в гептане. Получают 0,0 64 г (34%) ожидаемого соединения 9 в виде масла.Rf=0,40 в системе (гептан/этилацетат), (85:15), (об./об.). ES: m/z=391 MH+; m/z=335 MH+-C3H4O. 1 Н-ЯМР-спектр (400 МГц; при использовании спектрометра BRUKER AVANCE DRX-400; с химическими сдвигами ( в м.д.) - в дейтерированном диметилсульфоксиде-d6 в качестве растворителяb) Стадия 2. Получение соединения по примеру 16 и примеру 17. К раствору 119 мг (0,305 ммоль) соединения 9 в 2,5 мл этанола при температуре около 20 С добавляют 257 мг (0,610 ммоль) соединения 5. Выдерживают при перемешивании при кипячении с обратным холодильником в течение примерно 48 ч. Реакционную смесь выпаривают досуха в роторном испарителе- 14015607 и полученный маслянистый остаток хроматографируют на силикагеле, предварительно кондиционируемом с помощью дихлорметана, затем элюируемом линейным градиентом 0-100% смеси В [(дихлорметан/этилацетат), (96:4), (об./об.)] в А (дихлорметан). Получают 43 мг (18%) ожидаемого соединения по примеру 16 в виде твердого вещества белого цвета и 17 мг (7%) ожидаемого соединения по примеру 17 в виде твердого вещества белого цвета. Пример 16.Rf=0,26 в системе (дихлорметан/этилацетат), (96:4), (об./об.) ES: m/z=834 MNa+; m/z=812 MH+. 1 Н-ЯМР-спектр (400 МГц; при использовании спектрометра BRUKER AVANCE DRX-400; с химическими сдвигами ( в м.д.) - в дейтерированном хлороформе-d1 в качестве растворителя (CDCl3-d1),стандартизированном при 7,27, при температуре 303 K): от 0,75 до 1,70 (м частично скрытый, 16 Н); 0,92MH . 1 Н-ЯМР-спектр (500 МГц; при использовании спектрометра BRUKER AVANCE DRX-500; с химическими сдвигами ( в м.д.) - в дейтерированном хлороформе-d1 в качестве растворителя (CDCl3-d1),стандартизированном при 7,27, при температуре 303 K): от 0,55 до 1,70 (м частично скрытый, 16 Н); 0,90(д, J=13,0 Гц, 1 Н); 5,04 (д, J=13,0 Гц, 1 Н); 5,11 (с, 1 Н); 5,24 (с, 1 Н); 7,61 (с, 1 Н). Антипролиферативная активность полученных соединений Соединения согласно изобретению являлись объектом фармакологических тестов, позволяющих определить их антипролиферативную активность. Ее устанавливали путем определения ингибирования клеточной пролиферации клеток НСТ 116. Производили посев клеток на среду для культивирования клеток в концентрации 10000 клеток на лунку, при использовании 0,17 мл среды, и добавляли 20 мкл тестируемого соединения, в разных концентрациях, и 10 мкл тимидин[метил-14 С] (100 мкКи/мл - удельная активность 47,90 мКи/ммоль; NEN Technologies, номер по каталогу NEC568, серия 3550-001), затем клетки инкубировали при температуре 37 С и в атмосфере с 5% СО 2. Среда, используемая для культивирования клеток НСТ 116: модифицированная по способу Дульбекко среда Игла, 2 мМ L-глутамина, 200 Ед/мл пенициллина, 200 мкг/мл стрептомицина и 10% (об./об.) фетальной телячьей сыворотки (Life Technologies). Спустя 96 ч подсчитывали включение 14 С-тимидина при использовании жидкостного сцинтилляционного счетчика 1450 Microbeta Wallac Triflux. Результаты R выражали в имп/мин (импульсов в минуту) и переводили в процент ингибирования роста Gl%, осуществляя сначала вычитание среднего значения числа имп/мин в случае лунок без клеток В и затем деление на число имп/мин в случае лунок с необработанными клетками С, включающих 20 мкл среды разведения соединения, содержащей 1% этанолаIDBS, UK) путем нелинейного регрессионного анализа, используя алгоритм Marquardt (Donald W.MARQUARDT, J. Soc. industry, appl., vol. 11, 2, июнь 1963). Соединения обладают IC50 в отношении клеток НСТ 116 обычно ниже 10 мкМ и, предпочтительно,ниже 100 нМ. Соединения согласно изобретению, следовательно, могут быть использованы для получения лекарственных средств. Таким образом, согласно другому аспекту, объектом изобретения является лекарственное средство,которое включает соединение формулы (I) так, как оно определено выше, или его фармацевтически приемлемую кислотно-аддитивную соль, или гидрат или сольват соединения формулы (I). Это лекарственное средство находит свое применение в терапии, в частности, для лечения патологического состояния, и, более конкретно, для лечения рака. Соединения формулы (I) можно также использолвать для получения лекарственного средства, пригодного для лечения патологий, характеризующихся аномальной неоваскуляризацией или аномальным ангиогенезом, то есть, таких как раковые заболевания, в том числе конкретные раковые заболевания,такие, как саркома Капоши или инфантильная гемоангиома, и также такие как ревматоидный артрит,- 15015607 остеоартрит и/или связанные с ними боли, воспалительные заболевания кишечника, такие как геморрагический ректоколит или болезнь Крона, патологии глаза, такие как связанная с возрастом макулярная дегенерация, диабетическая ретинопатия, хроническое воспаление, псориаз. Ангиогенез представляет собой процесс генерации новых капилляров из предшествующих сосудов. Опухолевый ангиогенез (образование новых кровеносных сосудов), необходимый для роста опухоли,также является одним из существенных факторов метастатической диссеминации (Oncogene, 22(20),3172-3179 (2003, 19 мая); Nat. Med., 1.(1), 27-31 (1995, январь. Согласно другому аспекту, настоящее изобретение относится к фармацевтической композиции, которая включает соединение формулы (I) так, как оно определено выше, или фармацевтически приемлемую соль, гидрат или сольват этого соединения, а также по меньшей мере один фармацевтически приемлемый эксципиент. Вышеуказанные эксципиенты выбирают, в зависимости от фармацевтической формы и желательного способа введения, из обычных эксципиентов, которые известны специалисту в данной области. В случае фармацевтических композиций согласно настоящему изобретению для перорального, сублингвального, подкожного, внутримышечного, внутривенного, локального, интратрахеального, интраназального, чрескожного или ректального введения, действующее начало вышеприведенной формулы (I),или его соль, сольват или гидрат, может быть введено в стандартной лекарственной форме, в виде смеси с классическими фармацевтическими эксципиентами, животным и людям для профилактики или лечения вышеуказанных нарушений или заболеваний. Соответствующие стандартные формы введения включают формы для перорального введения, такие как таблетки, мягкие или твердые желатиновые капсулы, порошки, гранулы и пероральные растворы или суспензии, формы для сублингвального, буккального, интратрахеального, внутриглазного, интраназального введения, введения путем ингаляции, формы для локального, чрескожного, подкожного, внутримышечного или внутривенного введения, формы для ректального введения и имплантаты. Для локального применения можно использовать соединения согласно изобретению в кремах, гелях, мазях или лосьонах. В качестве примера, стандартная лекарственная форма введения соединения согласно изобретению в виде таблетки может включать следующие компоненты: Могут быть конкретные случаи, где используют более высокие или более незначительные дозировки; такие дозировки не входят в рамки изобретения. Согласно обычной практике дозировка, соответствующая каждому пациенту, определяется врачом в зависимости от способа введения, массы и ответной реакции вышеуказанного пациента. Соединения согласно настоящему изобретению могут быть введены индивидуально или в виде смеси с другими противораковыми средствами. Из возможных комбинаций можно назвать алкилирующие агенты и, в частности, циклофосфамид, мелфалан, ифосфамид, хлорамбуцил, бусульфан, тиотепа, преднимустин, кармустин, ломустин, семустин, стептозотоцин, декарбазин, темозоломид, прокарбазин и гексаметилмеламин; платиновые производные, как, в частности, цисплатин, карбоплатин или оксалиплатин; антибиотики, как, в частности, блеомицин, митомицин, дактиномицин; антимикроканальцевые агенты, как, в частности, винбластин, винкристин, виндезин, винорелбин,таксоиды (паклитаксел и доцетаксел); антрациклины, как, в частности, доксорубицин, даунорубицин, идарубицин, эпирубицин, митоксантрон, лозоксантрон; ингибиторы топоизомераз групп I и II, такие как этопозид, тенипозид, амсакрин, иринотекан, топотекан и томудекс; фторпиримидины, такие как 5-фторурацил, UFT, флоксуридин; аналоги цитидина, такие как 5-азацитидин, цитарабин, гемцитабин, 6-меркаптомурин, 6-тиогуанин; аналоги аденозина, такие как пентостатин, цитарабин или флударабинфосфат; метотрексат и фолиновая кислота; ферменты и различные соединения, такие как L-аспарагиназа, гидроксимочевина, транс-ретиноевая кислота, сурамин, дексразоксан, амифостин, герцептин, а также эстрогенные, андрогенные гормоны; антиваскулярные агенты, такие как производные комбретастатина, например, СА 4 Р, халконов или колхицина, например, ZD6126, и их пролекарственные формы; ингибиторы киназ, такие как эртонилиб или иматиниб;- 16015607 биотерапевтические средства, как антитела, такие как ритуксимаб, бевацизумаб, цетуксимаб, трастузумаб или алемтузумаб; ингибиторы протеазомы, такие как бортезомиб. С соединениями согласно настоящему изобретению также можно комбинировать лечение путем облучений. Эти лечения могут быть осуществлены одновременно, раздельно, последовательно. Лечение адаптируется врачом в зависимости от подвергаемого лечению заболевания. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Противораковое средство, представляющее собой соединение общей формулы (I)d) n1 и n2 являются одинаковыми или разными и имеют значение 1, 2, 3 или 4; в виде основания или в виде кислотно-аддитивной соли, а также в виде гидрата или сольвата. 2. Средство формулы (I) по п.1, отличающееся тем, что n1 и n2 являются одинаковыми и имеют значение 2, 3 или 4. 3. Средство формулы (I) по п.1, отличающееся тем, что А выбирают из -NH-, -N(СН 2-С(О)О-СН 2 СН 3)- или -N(СН 2-СООН)-, и n1 и n2 являются одинаковыми и имеют значение 2. 4. Средство формулы (I) по п.1, отличающееся тем, что А выбирают из (C1-С 6)-алкенилена или эпоксидной группы, и n1 и n2 являются одинаковыми и имеют значение 1. 5. Средство формулы (I) по п.1, отличающееся тем, что А выбирают из -NHCO- или -1,2,3-триазола,и n1 и n2 являются разными и, независимо, имеют значение 1 или 2. 6. Противораковое средство, представляющее собой соединение, выбранное из(1-(2-[(3S,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9-триметил-10-(трифторметил)декагидро-3,12 эпокси[1,2]диоксепино[4,3-i]изохромен-10-ил]оксиэтил)-5-([(3S,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9 триметил-10-(трифторметил)декагидро-3,12-эпокси[1,2]диоксепино[4,3-i]изохромен-10-ил]оксиэтил)1 Н-1,2,3-триазола. 7. Средство общей формулы (I) по любому из пп.1-6, отличающееся тем, что оно находится в 1) нехиральной форме, или 2) рацемической форме, или 3) обогащенной одним стереоизомером форме, или 4) обогащенной одним энантиомером форме; и в случае необходимости может быть превращено в соль. 8. Лекарственное средство, отличающееся тем, что оно включает соединение формулы (I) по любому из пп.1-7, или его фармацевтически приемлемую кислотно-аддитивную соль, или гидрат или сольват соединения формулы (I). 9. Фармацевтическая композиция, отличающаяся тем, что она включает соединение формулы (I) по любому из пп.1-7, или фармацевтически приемлемую соль, гидрат или сольват этого соединения, а также по меньшей мере один фармацевтически приемлемый эксципиент. 10. Промежуточный продукт, представляющий собой соединение общей формулы (II) в которой n имеет значение 1, 2, 3 или 4, и G означает атом брома или группу -N3.
МПК / Метки
МПК: A61K 31/357, C07D 493/22, A61P 35/00
Метки: артемизинина, производных, терапии, применение, димеры, получение
Код ссылки
<a href="https://eas.patents.su/19-15607-dimery-proizvodnyh-artemizinina-ih-poluchenie-i-ih-primenenie-v-terapii.html" rel="bookmark" title="База патентов Евразийского Союза">Димеры производных артемизинина, их получение и их применение в терапии</a>
Предыдущий патент: Способ лечения связанного с глюкозой расстройства
Следующий патент: Изолированные трубы
Случайный патент: Способ получения 3-фенилурацилов