Бензодиазепиновый ингибитор бромодомена
Номер патента: 23441
Опубликовано: 30.06.2016
Авторы: Уизерингтон Джейсон, Госмини Ромэн Люк Мари, Миргюэ Оливье, Бэйли Джеймс
Формула / Реферат
1. Применение соединения формулы (Ic)
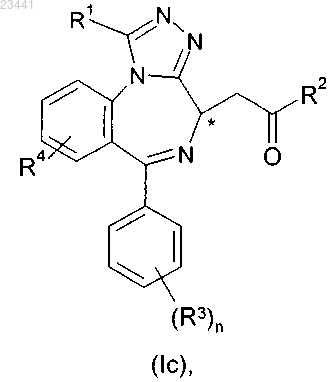
где R1 представляет собой С1-3алкил;
R2 представляет собой -NR2aR2a' или -OR2b;
один из R2a или R2a' представляет собой водород и R2b или другой из R2a или R2a' выбран из С1-6алкила, галогено-C1-6алкила, R2cR2c'N-C1-6алкила, карбоциклила, карбоциклил-C1-4алкила, гетероциклила и гетероциклил-C1-4алкила;
любая из карбоциклильных или гетероциклильных групп возможно замещена одной или более группами, выбранными из галогена, С1-6алкила, галогено-C1-6алкила, С1-6алкокси, галогено-C1-6алкокси, карбонила, -CO-карбоциклила, азидо, нитро и циано;
-CO-карбоциклильная группа дополнительно возможно замещена одной или более группами, выбранными из галогена, С1-6алкила, галогено-C1-6алкила, С1-6алкокси, галогено-C1-6алкокси, азидо, нитро и циано; или
две соседние группы на любой из карбоциклильных или гетероциклильных групп вместе с атомами, с которыми они связаны, образуют 5- или 6-членное кольцо, которое может содержать 1 или 2 гетероатома, независимо выбранных из О, S и N; или
R2a и R2a' вместе с N-атомом, к которому они присоединены, образуют 5-, 6- или 7-членное кольцо, которое возможно содержит 1 или 2 гетероатома, независимо выбранных из О, S и N, где 5-, 6- или 7-членное кольцо дополнительно возможно замещено С1-6алкилом;
R2c и R2c' независимо представляют собой водород или С1-6алкил;
каждый R3 независимо выбран из водорода, гидрокси, галогено, С1-6алкила, галогено-C1-6алкила, С1-6алкокси, галогено-C1-6алкокси, нитро, циано, CF3, -OCF3 и -COOR5;
R4 представляет собой гидрокси, галогено, C1-6алкил, галогено-C1-6алкил, С1-6алкокси, галогено-C1-6алкокси, нитро, циано, CF3, -OCF3, -COOR5 или -OS(O)2C1-4алкил;
R5 представляет собой С1-3алкил;
n представляет собой целое число от 1 до 5;
карбоциклил представляет собой карбоциклильную группу, которая содержит от 3 до 8 кольцевых атомов и может быть насыщенной, ненасыщенной или ароматической, или конденсированную комбинацию карбоциклильных групп, выбранную из нафтила, антрила, фенантрила, инданила, инденила, азуленила, азуланила и флуоренила; и любая гетероциклильная группа содержит от 5 до 7 кольцевых атомов, вплоть до 4 из которых могут представлять собой гетероатомы, выбранные из азота, кислорода и серы, и может быть насыщенной, ненасыщенной или ароматической,
или его фармацевтически приемлемой соли или его энантиомера для лечения рака.
2. Применение соединения по п.1 или его фармацевтически приемлемой соли, где R4 представляет собой гидроксил или С1-6алкокси.
3. Применение соединения по п.1 или его фармацевтически приемлемой соли, которое представляет собой соединение формулы (Ib)
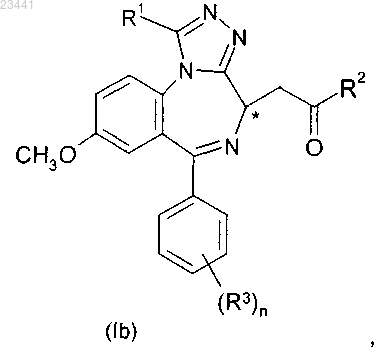
где R1, R2, R3 и n являются такими, как определено в п.1.
4. Применение соединения или его фармацевтически приемлемой соли по любому из пп.1-3, где R1 представляет собой метил.
5. Применение соединения или его фармацевтически приемлемой соли по любому из пп.1-4, где n равно 1.
6. Применение соединения или его фармацевтически приемлемой соли по любому из пп.1-5, где R3 представляет собой 3-фтор, 4-хлор, 4-фтор, 4-метокси или 4-CF3.
7. Применение соединения или его фармацевтически приемлемой соли по любому из пп.1-6, которое представляет собой S-энантиомер.
8. Применение соединения или его фармацевтически приемлемой соли, как определено в любом из пп.1-7, для изготовления лекарственного средства для лечения рака.
9. Способ лечения рака у субъекта, нуждающегося в этом, включающий введение терапевтически эффективного количества соединения формулы (Ic), как определено в п.1, или его фармацевтически приемлемой соли.
10. Способ по п.9, где рак выбран из гематологического, эпителиального рака, включающего карциномы легкого, молочной железы и толстой кишки, мезенхимальные, печеночные, почечные и неврологические опухоли.
Текст
Поликарпов А.В. (RU) Предложены применение бензодиазепиновых соединений формулы (Iс) или их фармацевтически приемлемых солей или их энантиомеров для лечения рака; а также способ лечения рака у субъекта, нуждающегося в этом, включающий введение терапевтически эффективного количества соединения формулы (Iс) или его фармацевтически приемлемой соли. Бэйли Джеймс (GB), Госмини Ромэн Люк Мари, Миргюэ Оливье (FR), Уизерингтон Джейсон (GB) Область изобретения Настоящее изобретение относится к бензодиазепиновым соединениям, фармацевтическим композициям, содержащим такие соединения, и к их применению в терапии. Предпоссылки изобретения Геномы эукариотических организмов высоко организованы внутри ядра клетки. Длинные цепи двухцепочечной ДНК обвиты вокруг октамера гистоновых белков (чаще всего содержащих две копии гистонов Н 2 А, Н 2 В, Н 3 и Н 4) с образованием нуклеосомы. Эта основная единица затем дополнительно уплотняется посредством агрегации и сворачивания нуклеосом с образованием высококонденсированной хроматиновой структуры. Возможен целый ряд различных состояний конденсации, и плотность этой структуры варьируется во время клеточного цикла, являясь наиболее компактной во время процесса клеточного деления. Хроматиновая структура играет решающую роль в регуляции генной транскрипции,которая не может происходить эффективно с высококонденсированного хроматина. Хроматиновая структура контролируется серией посттрансляционных модификаций в гистоновых белках, а именно гистонах Н 3 и Н 4, и чаще всего в гистоновых "хвостах", которые продолжаются за пределами коровой нуклеосомной структуры. Эти модификации включают в себя ацетилирование, метилирование, фосфорилирование, убиквитинилирование, сумоилирование (от англ. small ubiquitin-related modifier). Эти эпигенетические признаки записываются и стираются специфическими ферментами, которые помещают метки на специфические остатки в пределах гистонового "хвоста", таким образом образуя эпигенетический код, который затем интерпретируется клеткой для обеспечения геноспецифической регуляции хроматиновой структуры и, таким образом, транскрипции. Ацетилирование гистонов чаще всего связано с активацией генной транскрипции, поскольку модификация ослабляет взаимодействие ДНК и гистонового октомера благодаря изменению электростатики. В дополнение к этому физическому изменению, специфические белки связываются с ацетилированными лизиновыми остатками в пределах гистонов для считывания эпигенетического кода. Бромодомены представляют собой небольшие (примерно 110 аминокислот) отдельные домены в пределах белков, которые связываются с ацетилированными лизиновыми остатками обычно, но не исключительно, в пределах гистонов. Существует семейство из примерно 50 белков, о которых известно, что они содержат бромодомены, и они выполняют целый ряд функций внутри клетки.BET семейство бромодоменсодержащих белков содержит 4 белка (BRD2, BRD3, BRD4 и BRD-t),которые содержат тандемные бромодомены, способные связываться с двумя ацетилированными лизиновыми остатками в непосредственной близости, увеличивая специфичность взаимодействия. Как сообщается, BRD2 и BRD3 связываются с гистонами вместе с активно транскрибированными генами и могут быть вовлечены в облегчение транскрипционной элонгации (Leroy et al., Mol. Cell. 2008, 30(1):51-60),тогда как BRD4, по-видимому, вовлечен в рекрутинг pTEF- комплекса с индуцибельными генами, приводящий к фосфорилированию РНК-полимеразы и увеличенному транскрипционному выходуNUT (ядерный белок в яичке), образуя новые слитые онкогены BRD3-NUT или BRD4-NUT при высокозлокачественной форме эпителиальной неоплазии (French et al. Cancer Research, 2003, 63, 304-307 иFrench et al. Journal of Clinical Oncology, 2004, 22(20), 4135-4139). Данные подразумевают, что слитые белки BRD-NUT вносят вклад в канцерогенез (Oncogene, 2008, 27, 2237-2242). BRD-t экспрессируется исключительно в яичках и яичнике. Все члены семейства, как сообщалось, осуществляют некоторую функцию в контролирующих или исполнительных аспектах клеточного цикла и, как было показано, остаются в комплексе с хромосомами во время клеточного деления, что говорит о роли в поддержании эпигенетической памяти. Кроме того, некоторые вирусы используют эти белки для присоединения своих геномов к хроматину клетки-хозяина в процессе вирусной репликации (You et al., Cell, 2004, 117(3):34960). В японской патентной заявке JP2008-156311 описано бензимидазольное производное, которое называется агентом, связывающим бромодомен BRD2, который полезен в отношении вирусной инфекции/пролиферации. В патентной заявке WO 2009/084693A1 описан ряд тиенотриазолодиазепиновых производных, которые, как сообщается, ингибируют связывание между ацетилированным гистоном и бромодоменсодержащим белком, которые, как сообщается, полезны в качестве противораковых агентов. Был обнаружен новый класс соединений, которые ингибируют связывание бромодоменов с их когнатными ацетилированными белками, более конкретно класс соединений, которые ингибируют связывание бромодоменов BET семейства с ацетилированными остатками лизина. Такие соединения будут в дальнейшем называться "ингибиторами бромодоменов". Краткое изложение сущности изобретения В первом аспекте настоящего изобретения предложено применение соединения формулы (Ic) или его фармацевтически приемлемой соли или энантиомера для лечения рака:R2 представляет собой -NR2aR2a' или -OR2b; один из R2a или R2a' представляет собой водород и R2b или другой из R2a или R2a' выбран изC1-6 алкила, галогено-C1-6 алкила, R2cR2c'N-C1-6 алкила, карбоциклила, карбоциклил-C1-4 алкила, гетероциклила и гетероциклил-C1-4 алкила,любая из карбоциклильных или гетероциклильных групп возможно замещена одной или более группами, выбранными из галогена, C1-6 алкила, галогено-C1-6 алкила, C1-6 алкокси, галогено-C1-6 алкокси,карбонила, -CO-карбоциклила, азидо, нитро и циано,-CO-карбоциклильная группа возможно замещена одной или более группами, выбранными из галогена, С 1-6 алкила, галогено-C1-6 алкила, C1-6 алкокси, галогено-C1-6 алкокси, азидо, нитро и циано; или две соседние группы на любой из карбоциклильных или гетероциклильных групп вместе с атомами,с которыми они связаны, образуют 5- или 6-членное кольцо, которое может содержать 1 или 2 гетероатома, независимо выбранных из О, S и N; илиR2a и R2a' вместе с N-атомом, к которому они присоединены, образуют 5-, 6- или 7-членное кольцо,которое возможно содержит 1 или 2 гетероатома, независимо выбранных из О, S и N; где 5-, 6- или 7-членное кольцо дополнительно возможно замещено C1-6 алкилом;R2c и R2c' независимо представляют собой водород или С 1-6 алкил; каждый R3 независимо выбран из водорода, гидрокси, галогено, C1-6 алкила, галогено-C1-6 алкила,С 1-6 алкокси, галогено-C1-6 алкокси, нитро, циано, CF3, -OCF3 и -COOR5;n представляет собой целое число от 1 до 5,где карбоциклил представляет собой карбоциклильную группу, которая содержит от 3 до 8 кольцевых атомов и может быть насыщенной, ненасыщенной или ароматической, или конденсированную комбинацию карбоциклильных групп, выбранную из нафтила, антрила, фенантрила, инданила, инденила,азуленила, азуланила и флуоренила, и любая гетероциклильная группа содержит от 5 до 7 кольцевых атомов, вплоть до 4 из которых могут представлять собой гетероатомы, выбранные из азота, кислорода и серы, и может быть насыщенной, ненасыщенной или ароматической. В предпочтительном воплощении R4 представляет собой гидроксил или C1-6 алкокси. В еще одном предпочтительном воплощении соединение по настоящему изобретению представляет собой соединение формулы (Ib) где R1, R2, R3 и n являются такими, как определено выше. В еще одном предпочтительном воплощении R1 представляет собой метил. В еще одном предпочтительном воплощении n равно 1. В еще одном предпочтительном воплощении R3 представляет собой 3-фтор, 4-хлор, 4-фтор,4-метокси или 4-CF3. В еще одном предпочтительном воплощении соединение по настоящему изобретению представляет собой S-энантиомер. Во втором аспекте настоящего изобретения предложено применение соединения по настоящему изобретению или его фармацевтически приемлемой соли для изготовления лекарственного средства для лечения рака. В третьем аспекте настоящего изобретения предложен способ лечения рака у субъекта, нуждающегося в этом, включающий введение терапевтически эффективного количества соединения формулы (Ic) или его фармацевтически приемлемой соли. В предпочтительном воплощении рак выбран из гематологического, эпителиального рака, включающего карциномы легкого, молочной железы и толстой кишки, мезенхимальные, печеночные, почечные и неврологические опухоли. Подробное описание изобретения В настоящем изобретении раскрыты соединения формулы (Ic) или их фармацевтически приемлемые соли или энантиомеры:R2 представляет собой -NR2aR2a' или -OR2b; один из R2a или R2a' представляет собой водород и R2b или другой из R2a или R2a' выбран из С 1-6 алкила, галогено-C1-6 алкила, R2cR2c'N-C1-6 алкила, карбоциклила, карбоциклил-C1-4 алкила, гетероциклила и гетероциклил-C1-4 алкила,любая из карбоциклильных или гетероциклильных групп возможно замещена одной или более группами, выбранными из галогена, С 1-6 алкила, галогено-C1-6 алкила, С 1-6 алкокси, галогено-C1-6 алкокси,карбонила, -CO-карбоциклила, азидо, нитро и циано,-CO-карбоциклильная группа возможно замещена одной или более группами, выбранными из галогена, С 1-6 алкила, галогено-C1-6 алкила, С 1-6 алкокси, галогено-C1-6 алкокси, азидо, нитро и циано; или две соседние группы на любой из карбоциклильных или гетероциклильных групп вместе с атомами,с которыми они связаны, образуют 5- или 6-членное кольцо, которое может содержать 1 или 2 гетероатома, независимо выбранных из О, S и N; илиR2a и R2a' вместе с N-атомом, к которому они присоединены, образуют 5-, 6- или 7-членное кольцо,которое возможно содержит 1 или 2 гетероатома, независимо выбранных из О, S и N; где 5-, 6- или 7-членное кольцо дополнительно возможно замещено C1-6 алкилом;R2c и и R2c' независимо представляют собой водород или С 1-6 алкил; каждый R3 независимо выбран из водорода, гидрокси, галогено, C1-6 алкила, галогено-C1-6 алкила,С 1-6 алкокси, галогено-C1-6 алкокси, нитро, циано, CF3, -OCF3 и -COOR5;n представляет собой целое число от 1 до 5,где карбоциклил представляет собой карбоциклильную группу, которая содержит от 3 до 8 кольцевых атомов и может быть насыщенной, ненасыщенной или ароматической, или конденсированную комбинацию карбоциклильных групп, выбранную из нафтил, антрила, фенантрила, инданила, инденила, азуленила, азуланила и флуоренила, и любая гетероциклильная группа содержит от 5 до 7 кольцевых атомов, вплоть до 4 из которых могут представлять собой гетероатомы, выбранные из азота, кислорода и серы, и может быть насыщенной, ненасыщенной или ароматической. В одном из воплощений изобретения S-энантиомеры являются предпочтительными. Как использовано в данном описании, термин "алкил" относится к прямым или разветвленным углеводородным цепям, содержащим определенное число атомов углерода. Например, C1-6 алкил означает алкил с прямой или разветвленной цепью, содержащий по меньшей мере 1 и максимально 6 атомов углерода. Примеры "алкила", как использовано в данном описании, включают в себя, но не ограничиваются этим, метил, этил, н-пропил, н-бутил, н-пентил, н-гексил, изобутил, изопропил, трет-бутил и 1,1-диметилпропил. Как использовано в данном описании, термин "алкокси" относится к прямой или разветвленной алкоксигруппе, содержащей определенное число атомов углерода. Например, С 1-6 алкокси означает алкоксигруппу с прямой или разветвленной цепью, содержащую по меньшей мере 1 и максимально 6 атомов углерода. Примеры "алкокси", как использовано в данном описании, включают в себя, но не ограничиваются этим, метокси, этокси, пропокси, проп-2-окси, бутокси, бут-2-окси, 2-метилпроп-1-окси,2-метилпроп-2-окси, пентокси или гексилокси. Как использовано в данном описании, термин "галоген" или "галогено" относится к элементам фтору, хлору, брому и йоду. Примерами подходящих галогенов являются фтор, хлор и бром. Если не указано иное, любая карбоциклильная группа содержит от 3 до 14 кольцевых атомов, например от 3 до 10 кольцевых атомов или в другом примере от 3 до 8 кольцевых атомов, и может быть насыщенной, ненасыщенной или ароматической. Примеры насыщенных карбоциклильных групп включают в себя циклопропил, циклопентил или циклогексил. Примеры ненасыщенных карбоциклильных групп включают в себя группы, которые содержат до 3 двойных связей. Примером подходящей ароматической карбоциклильной группы является фенил. Термин "карбоциклический" следует истолковывать аналогичным образом. В дополнение к этому, термин "карбоциклил" включает в себя любую конденсированную комбинацию карбоциклильных групп, например, нафтил, антрил, фенантрил, инданил, инденил, азуленил, азуланил и флуоренил. Если не указано иное, любая гетероциклильная группа содержит от 4 до 7 кольцевых атомов, например от 5 до 7 кольцевых атомов, вплоть до 4 из которых могут представлять собой гетероатомы, такие как азот, кислород и сера, и может быть насыщенной, ненасыщенной или ароматической. Примерами гетероциклильных групп являются азетидинил, фурил, тиенил, пирролил, пирролинил, пирролидинил,имидазолил, диоксоланил, оксазолил, тиазолил, имидазолил, имидазолинил, имидазолидинил, пиразолил,пиразолинил, пиразолидинил, изоксазолил, изотиазолил, оксадиазолил, триазолил, тиадиазолил, пиранил, пиридил, пиперидинил, гомопиперазинил, диоксанил, морфолино, дитианил, тиоморфолино, тиоморфолино-1,1-диоксид, пиридазинил, пиримидинил, пиразинил, пиперазинил, сульфоланил, тетразолил,триазинил, азепинил, оксазепинил, тиазепинил, диазепинил и тиазолинил. Кроме того, термин "гетероциклил" включает в себя конденсированные гетероциклильные группы, например, бензимидазолил, бензоксазолил, имидазопиридинил, бензоксазинил, бензотиазинил, оксазолопиридинил, бензофуранил, хинолинил, хиназолинил, хиноксалинил, дигидрохиназолинил, бензотиазолил, фталимидо, бензофуранил,бензодиазепинил, индолил и изоиндолил. Термин "гетероциклический" следует истолковывать аналогичным образом. Как использовано в данном описании, термин "замещенный" относится к замещению указанным заместителем или заместителями. При множественных степенях замещения (например, 1 или 2) группы могут быть одинаковыми или разными. В одном из воплощений изобретения R1 означает метил. В одном из воплощений изобретения R2 означает -OR2b. Таким образом, раскрыто соединение формулы (Ia) где R1, R2b, R3, R4 и n являются такими, как определено выше для соединения формулы (Ic). В одном из воплощений изобретения R2 представляет собой -NR2aR2a'. В одном из воплощений изобретения один из R2a или R2a' представляет собой водород, а другой из R2a или R2a' выбран из С 1-6 алкила, карбоциклила, карбоциклил-C1-4 алкила, гетероциклила и гетероциклил-C1-4 алкила, где любая из карбоциклильных или гетероциклильных групп возможно замещена одной или более группами, выбранными из галогена, C1-6 алкила, галогено-C1-6 алкила, С 1-6 алкокси, галогено-C1-6 алкокси, карбонила,-CO-карбоциклила, азидо, амино, гидроксила, нитро и циано, где -CO-карбоциклильная группа возможно замещена одной или более группами, выбранными из галогена, C1-6 алкила, галогено-C1-6 алкила,C1-6 алкокси, галогено-C1-6 алкокси, азидо, нитро и циано. В другом воплощении один из R2a или R2a' представляет собой водород, а другой из R2a или R2a' выбран из С 1-6 алкила, фенила, бензила, бензофуранила, пиридинила, тиазоила, фуранила и морфолинила,где фенильная, бензильная, бензофуранильная, пиридинильная, тиазоильная, фуранильная или морфолинильная группы возможно замещены одним или более заместителями, выбранными из галогена,C1-6 алкила, галогено-C1-6 алкила, C1-6 алкокси, галогено-C1-6 алкокси, карбонила, азидо, нитро и циано. В другом воплощении R2a представляет собой водород и R2a' представляет собой C1-6 алкил. В другом воплощении R2a' представляет собой этил. В одном из воплощений изобретения R2a представляет собой водород и R2a' представляет собой 2cR RR2c и R2c'N-C1-6 алкил. В другом воплощении R2a' выбран из R2cR2c'N-CH2-, R2cR2c'N-CH2CH2-,R2cR2c'N-CH2CH2CH2- и R2cR2c'N-CH2CH2CH2CH2-. В другом воплощении R2c и R2c' выбраны из водорода и метила. В одном из воплощений изобретения R2a представляет собой водород и R2a' представляет собой кар-4 023441 боциклил. В другом воплощении R2a' представляет собой циклопентил или циклогексил, где каждая группа возможно замещена одним амино или гидроксилом. В одном из воплощений изобретения R2a представляет собой водород и R2a' представляет собой гетероциклил. В другом воплощении R2a' выбран из пирролидинила, пиперидинила, тетрагидрофуранила и тетрагидропирана, где каждая группа возможно замещена C1-6 алкилом. В другом воплощении R2a' выбран из: В одном из воплощений изобретения R2a представляет собой водород и R2a' представляет собой гетероциклил-C1-4 алкил, где гетероциклил возможно замещен одним амино, гидроксилом или метилом. В другом воплощении R2a' выбран из групп гетероциклил-CH2-, гетероциклил-CH2CH2-, гетероциклилCH2CH2CH2- и гетероциклил-CH2CH2CH2CH2-, где гетероциклил возможно замещен одним амино, гидроксилом или метилом. В другом воплощении гетероциклил выбран из пирролидинила, пиперидинила,тетрагидропиранила, пиперазинила, морфолино и тиоморфолинодиоксида, где каждая группа возможно замещена одним амино, гидроксилом или метилом. В другом воплощении гетероциклил выбран из: В другом воплощении гетероциклил выбран из:-5 023441 В одном из воплощений изобретения R2a и R2a' вместе с N-атомом, к которому они присоединены,образуют 5-, 6- или 7-членное кольцо, которое возможно содержит 1 или 2 гетероатома, независимо выбранных из О, S и N; где 5-, 6- или 7-членное кольцо возможно замещено C1-6 алкилом. В другом воплощении изобретения R2a и R2a' вместе с N-атомом, к которому они присоединены, образуют 4-, 5-, 6- или 7-членное кольцо, которое возможно содержит 1 или 2 гетероатома, независимо выбранных из О, S и N; где 4- 5-, 6- или 7-членное кольцо возможно замещено С 1-6 алкилом, гидроксилом или амино. В другом воплощении 4-, 5-, 6- или 7-членное кольцо выбрано из: В одном из воплощений изобретения R2b означает С 1-6 алкил, карбоциклил или карбоциклил-C1-4 алкил, где карбоциклильная группа возможно замещена одной или более группами, выбранными из галогена, C1-6 алкила, галогено-C1-6 алкила, С 1-6 алкокси, галогено-C1-6 алкокси, карбонила,-CO-карбоциклила, азидо, нитро и циано, и где -CO-карбоциклильная группа может быть дополнительно возможно замещена одной или более группами, выбранными из галогена, C1-6 алкила,галогено-C1-6 алкила, C1-6 алкокси, галогено-C1-6 алкокси, азидо, нитро и циано. В другом воплощении изобретения R2b означает С 1-6 алкил, фенил или бензил, где фенильная или бензильная группа возможно замещена одной или более группами, выбранными из галогена, C1-6 алкила,галогено-C1-6 алкила, C1-6 алкокси, галогено-C1-6 алкокси, карбонила, -CO-карбоциклила, азидо, нитро и циано, и где -CO-карбоциклильная группа может быть дополнительно возможно замещена одной или более группами, выбранными из галогена, С 1-6 алкила, галогено-C1-6 алкила, C1-6 алкокси,галогено-C1-6 алкокси, азидо, нитро и циано. В другом воплощении R2b означает метил, этил, н-бутил,трет-бутил, бензил, изопропил, изобутил или фенил. В другом воплощении R2b означает этил, трет-бутил,бензил, изопропил, изобутил или фенил; В одном из воплощений изобретения R3 означает галогено, C1-6 алкил, C1-6 алкокси или CF3. В другом воплощении R3 означает хлор, фтор, метокси или CF3. В другом воплощении R3 означает 3-фтор,4-хлор, 4-фтор, 4-метокси или 4-CF3. В другом воплощении R3 означает 4-хлор. В одном из воплощений изобретения R4 означает гидроксил или C1-6 алкокси. В другом воплощении 4R означает MeO. В одном из воплощений изобретения R4 находится в положении 8, таком как 8-MeO. Таким образом, в одном из воплощений в изобретении раскрыто соединение формулы (Ib) где R1, R2 и R3 и n являются такими, как определено выше для соединения формулы (Ic);n может представлять собой, например, целое число в диапазоне от 1 до 3, такое как 1. Хотя воплощения для каждой переменной в основном были перечислены выше отдельно для каждой переменной, это изобретение включает соединения, в которых несколько или каждое воплощение в формуле (Ic) выбрано из каждого из воплощений, перечисленных выше. Поэтому данное изобретение должно включать все комбинации воплощений для каждой переменной, описанной выше в данном документе, включая их соли. В одном из воплощений примеры соединений, раскрытых в настоящем изобретении включают в себя: 2-[6-(4-хлорфенил)-1-метил-8-(метилокси)-4 Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]-N-(2 фенилэтил)ацетамид; 6-(4-хлорфенил)-1-метил-8-(метилокси)-4-[2-оксо-2-(1-пиперидинил)этил]-4 Н-[1,2,4]триазоло[4,3 а][1,4]бензодиазепин; 2-[6-(4-хлорфенил)-1-метил-8-(метилокси)-4 Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]-N-(2 фуранилметил)ацетамид; 2-[6-(4-хлорфенил)-1-метил-8-(метилокси)-4 Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]-Nциклогексилацетамид;(S)-пиперидин-4-ил-2-(6-(4-хлорфенил)-8-метокси-1-метил-4 Н-бензо[f][1,2,4]триазоло[4,3 а][1,4]диазепин-4-ил)ацетат; или его соль. В другом воплощении примеры соединений по настоящему изобретению включают в себя: 2-[6-(4-хлорфенил)-1-метил-8-(метилокси)-4 Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]-N-(2 фенилэтил)ацетамид; 6-(4-хлорфенил)-1-метил-8-(метилокси)-4-[2-оксо-2-(1-пиперидинил)этил]-4 Н-[1,2,4]триазоло[4,3 а][1,4]бензодиазепин; 2-[6-(4-хлорфенил)-1-метил-8-(метилокси)-4 Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]-N-(2 фуранилметил)ацетамид; 2-[6-(4-хлорфенил)-1-метил-8-(метилокси)-4 Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]-Nциклогексилацетамид; 2-[6-(4-хлорфенил)-1-метил-8-(метилокси)-4 Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]-N(2,2,2-трифторэтил)ацетамид; 2-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4 Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]N-(3-фторфенил)ацетамид; 2-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4 Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]N-(4-фторфенил)ацетамид; 2-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4 Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]N-(4-фторфенил)ацетамид; 2-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4 Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]N-4-пиридинилацетамид; 2-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4 Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]N-3-пиридинилацетамид; 2-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4 Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]N-1,3-тиазол-2-илацетамид; 2-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4 Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]N-2-пиридинилацетамид;N-(1,3-бензодиоксол-5-илметил)-2-[6-(4-хлорфенил)-1-метил-8-(метилокси)-4 Н-[1,2,4]триазоло[4,3 а][1,4]бензодиазепин-4-ил]ацетамид; 2-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4 Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]N-[(1S)-1-фенилэтил]ацетамид; 2-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4 Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]N-[(1R)-1-фенилэтил]ацетамид; 2-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4 Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]N-этилацетамид; 2-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4 Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]N-(циклопропилметил)ацетамид; метил-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4 Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4 ил]ацетат; 2-[(4S)-6-(3-фторфенил)-1-метил-8-(метилокси)-4 Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]N-(4-фторфенил)ацетамид; 2-[(4S)-6-(3-фторфенил)-1-метил-8-(метилокси)-4 Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]N-этилацетамид; 2-[6-(4-хлорфенил)-8-гидрокси-1-метил-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]-N-(4 фторфенил)ацетамид; этил-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4 ил]ацетат; 1-метилэтил-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3 а][1,4]бензодиазепин-4-ил]ацетат; бутил-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4 ил]ацетат; 2-[6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]-N-[2(метиламино)этил]ацетамид; 2-[6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]-N-4 пиперидинилацетамид; или его соль. В другом воплощении примеры соединений по настоящему изобретению включают в себя: 2-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]N-этилацетамид; 2-[6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]-N-(2 фенилэтил)ацетамид; 2-[6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]-N-(2 фуранилметил)ацетамид; 2-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]N-(2-фторфенил)ацетамид; 2-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]N-(3-фторфенил)ацетамид; 2-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]N-(4-фторфенил)ацетамид; 2-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]N-2-пиридинилацетамид; 2-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]N-3-пиридинилацетамид; 2-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]N-4-пиридинилацетамид; 2-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]N-1,3-тиазол-2-илацетамид; 2-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]N-(циклопропилметил)ацетамид; 2-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]N-[(1S)-1-фенилэтил]ацетамид; 2-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]N-[4-(фенилкарбонил)фенил]метилацетамид;[4-(метилокси)фенил]метил-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3 а][1,4]бензодиазепин-4-ил]ацетат; 2-метилпропил-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3 а][1,4]бензодиазепин-4-ил]ацетат; тетрагидро-2H-пиран-4-ил-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3 а][1,4]бензодиазепин-4-ил]ацетат; 2-[6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]-N-4 пиридинилацетамид; 2-[6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]-N(циклопропилметил)ацетамид; 2-[6-(4-хлорфенил)-1-метил-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]-N-4 пиридинилацетамид; 2-[6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]-N-1,3 тиазол-2-илацетамид; метил-[6-(4-хлорфенил)-1-метил-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]ацетат; или его соль. В одном из воплощений изобретения раскрыто соединение, которое представляет собой 2-[(4S)-6(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]-N-этилацетамид или его соль. В другом воплощении раскрыто соединение, которое представляет собой 2-[(4S)-6-(4-хлорфенил)-1 метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]-N-этилацетамид или его фармацевтически приемлемую соль. В другом воплощении раскрыто соединение, которое представляет собой 2-[(4S)-6-(4-хлорфенил)-1 метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]-N-этилацетамид. Следует понимать, что настоящее изобретение охватывает соединения формулы (Ic) в виде свободного основания и в виде его солей, например в виде его фармацевтически приемлемой соли. В одном из воплощений изобретение относится к соединениям формулы (Ic) в виде свободного основания. В другом воплощении изобретение относится к соединениям формулы (Ic) или к их фармацевтически приемлемой соли. Вследствие их потенциального применения в медицине, соли соединений формулы (Ic) желательно являются фармацевтически приемлемыми. Подходящие фармацевтически приемлемые соли могут включать соли присоединения кислот или оснований. Для обзора подходящих солей см. Berge et al., J. Pharm.Sci., 66:1-19, (1977). Обычно фармацевтически приемлемая соль может быть легко получена с использованием желаемой кислоты или основания, по обстоятельствам. Полученная соль может выпасть в осадок из раствора и может быть собрана путем фильтрации или может быть выделена путем выпаривания растворителя. Фармацевтически приемлемая соль присоединения основания может быть образована путем взаимодействия соединения формулы (Ic) с подходящим неорганическим или органическим основанием (например, триэтиламином, этаноламином, триэтаноламином, холином, аргинином, лизином или гистидином), возможно в подходящем растворителе, с получением соли присоединения основания, которую обычно выделяют, например, посредством кристаллизации и фильтрации. Фармацевтически приемлемые соли оснований включают в себя аммониевые соли, соли щелочных металлов, такие как соли натрия и калия, соли щелочно-земельных металлов, такие как соли кальция и магния, и соли с органическими основаниями, включая соли первичных, вторичных и третичных аминов, таких как изопропиламин,диэтиламин, этаноламин, триметиламин, дициклогексиламин и N-метил-D-глюкамин. Фармацевтически приемлемая соль присоединения кислоты может быть образована путем взаимодействия соединения формулы (Ic) с подходящей неорганической или органической кислотой (такой как бромисто-водородная, соляная, серная, азотная, фосфорная, янтарная, малеиновая, уксусная, пропионовая, фумаровая, лимонная, винная, молочная, бензойная, салициловая, глутаминовая, аспарагиновая,п-толуолсульфоновая, бензолсульфоновая, метансульфоновая, этансульфоновая, нафталинсульфоновая,такая как 2-нафталинсульфоновая, или гексановая кислота), возможно в подходящем растворителе, таком как органический растворитель, с получением соли, которую обычно выделяют, например, посредством кристаллизации и фильтрации. Фармацевтически приемлемая соль присоединения кислоты соединения формулы (Ic) может включать или представлять собой, например, гидробромидную, гидрохлоридную, сульфатную, нитратную, фосфатную, сукцинатную, малеатную, ацетатную, пропионатную, фумаратную, цитратную, тартратную, лактатную, бензоатную, салицилатную, глутаматную, аспартатную,пара-толуолсульфонатную, бензолсульфонатную, метансульфонатную, этансульфонатную, нафталинсульфонатную (например, 2-нафталинсульфонатную) или гексаноатную соль. Другие фармацевтически неприемлемые соли, например формиаты, оксалаты или трифторацетаты,могут быть использованы, например, при выделении соединений формулы (Ic) и включены в объем данного изобретения. Изобретение включает в свой объем все возможные стехиометрические и нестехиометрические формы солей соединений формулы (Ic). Следует понимать, что многие органические соединения могут образовывать комплексы с растворителями, в которых они вступают в реакцию, или из которых они выпадают в осадок или кристаллизуются. Эти комплексы известны как "сольваты". Например, комплекс с водой известен как "гидрат". Растворители с высокими температурами кипения и/или способные образовывать водородные связи, такие вода, ксилол, N-метилпирролидинон, метанол и этанол, могут быть использованы для образования сольватов. Способы идентификации сольватов включают в себя, но не ограничиваются этим, ЯМР и микроанализ. Сольваты соединений формулы (Ic) находятся в пределах объема изобретения. Изобретение включает в свой объем все возможные стехиометрические и нестехиометрические формы сольватов соединений формулы (Ic). Изобретение охватывает все пролекарства соединений формулы (Ic) и их фармацевтически приемлемых солей, которые при введении реципиенту способны давать (прямо или опосредованно) соединение формулы (Ic) или его фармацевтически приемлемую соль, или его активный метаболит или остаток. Такие производные известны специалистам в данной области, без излишнего экпериментирования. Тем не менее, сделана ссылка на учебник Burger's Medicinal Chemistry and Drug Discovery, 5th Edition, vol. 1:Principles and Practice, который включен в данное описание посредством ссылки до степени раскрытия таких производных. Соединения формулы (Ic) могут находиться в кристаллической или аморфной форме. Более того,некоторые из кристаллических форм соединений формулы (Ic) могут существовать в виде полиморфов,- 11023441 которые включены в объем настоящего изобретения. Полиморфные формы соединений формулы (Ic) могут быть охарактеризованы и дифференцированы с использованием нескольких стандартных аналитических методов, включая, но не ограничиваясь этим, картины рентгеновской дифракции на порошке(DSC), термогравиметрический анализ (TGA) и твердотельный ядерный магнитный резонанс (SSNMR). Некоторые из соединений, описанных в данном документе, могут содержать один или более хиральных атомов, так что могут образовываться оптические изомеры, например энантиомеры или диастереоизомеры. Соответственно, настоящее изобретение охватывает все изомеры соединений формулы (Ic) либо в виде индивидуальных изомеров, выделенных так, что они являются, по существу, свободными от другого изомера (т.е. чистыми), либо в виде смеси (т.е. рацематов и рацемических смесей). Аналогично, изобретение также распространяется на конформационные изомеры соединений формулы (Ic) и любые геометрические (цис- и/или транс-) изомеры указанных соединений. Индивидуальный изомер, выделенный так, что он является, по существу, свободным от другого изомера (т.е. чистым), может быть выделен так, чтобы присутствовало менее 10%, в частности менее чем примерно 1%, например менее чем примерно 0,1% другого изомера. Разделение изомеров может быть достигнуто с помощью стандартных методов, известных специалистам в данной области, например посредством фракционной кристаллизации, хроматографии илиHPLC (высокоэффективная жидкостная хроматография). Некоторые соединения формулы (Ic) могут существовать в одной из нескольких таутомерных форм. Следует понимать, что настоящее изобретение охватывает все таутомеры соединений формулы(Ic) либо в виде индивидуальных таутомеров, либо в виде их смесей. Из вышесказанного следует понимать, что в объем изобретения включены сольваты, изомеры и полиморфные формы соединений формулы (Ic) и их солей. Соединения формулы (Ic) и их фармацевтически приемлемые соли могут быть получены различными способами, включая стандартную химию. Любая ранее определенная переменная будет иметь ранее определенное значение, если не указано иное. Иллюстративные общие синтетические способы приведены ниже, и затем конкретные соединения формулы (Ic) и их фармацевтически приемлемые соли получены в рабочих примерах. Эти способы образуют дополнительные аспекты настоящего изобретения. Во всем описании изобретения общие формулы обозначены как (Ic), (II), (III), (IV) и т.д. Подгруппы этих общих формул определены как (Ia), (Ib), (Ic) и т.д. Соединения формулы (Ia), т.е. соединения общей формулы (Ic), где R2 представляет собой OR2b,могут быть получены согласно реакционной схеме 1 путем взаимодействия соединений формулы (Id),т.е. соединений общей формулы (Ic), где R2 представляет собой ОН, с R2bOH в присутствии DIC и DMAP при комнатной температуре. Альтернативно, соединения формулы (If) могут быть получены путем взаимодействия соединений формулы (Id) с оксалилхлоридом с последующим добавлением R2bOH. Схема 1 Соединения формулы (Ie), т.е. соединения общей формулы (Ic), где R2 представляет собой NR2aR2a',могут быть получены согласно реакционной схеме 2 путем взаимодействия соединений формулы (Id),т.е. соединений общей формулы (Ic), где R2 представляет собой ОН, с R2aR2a'NH, в присутствии HATU или HBTU и DIEA при комнатной температуре. Альтернативно, соединения формулы (Ie) могут быть получены путем взаимодействия соединений формулы (Id) с оксалилхлоридом с последующим добавлением R2aR2a'NH в присутствии триэтиламина. Альтернативно, соединения формулы (Ie), т.е. соединения общей формулы (Ic), где R2 представляет собой NR2aR2a', могут быть получены согласно реакционной схеме 3 путем взаимодействия соединений формулы (III) с гидразином с последующим взаимодействием полученного гидразона (II) с R1C(OR)3. Предпочтительно гидразон (II) используют без дополнительной очистки и подвергают взаимодействию с где R означает С 1-4 алкил, такой как метил. Соединения формулы (Id), т.е. соединения общей формулы (Ic), где R2 представляет собой ОН, могут быть получены согласно реакционной схеме 4. Подходящие реакционные условия включают взаимодействие соединений формулы (Ia), т.е. соединений общей формулы (Ic), где R2 представляет собой OR2b,с гидроксидом щелочного металла, предпочтительно гидроксидом натрия или гидроксидом лития. Схема 4 Соединения формулы (Ia), т.е. соединения общей формулы (Ic), где R2 представляет собой OR2b,могут быть получены согласно реакционной схеме 5 путем взаимодействия соединений формулы (IV) с Соединения формулы (IV) могут быть получены согласно реакционной схеме 6 путем взаимодействия соединений формулы (VI) с гидразином при температуре ниже 15C с последующим взаимодействием полученного гидразона (V) с R1COCl при 0C. Обычно гидразон (V) используют без дополнительной очистки и подвергают взаимодействию с R1COCl, например, при 0C. Схема 6 Соединения формулы (III) могут быть получены согласно реакционной схеме 7 путем взаимодействия соединений формулы (VII) с R2aR2a'NH в присутствии HATU и DIEA, например, при комнатной температуре. Схема 7 Соединения формулы (VII) могут быть получены согласно реакционной схеме 8. Подходящие реакционные условия включают взаимодействие соединений формулы (VI) с гидроксидом щелочного металла, таким как гидроксид натрия. Схема 8 Соединения формулы (VI) могут быть получены согласно реакционной схеме 9 из соединений формулы (VIII) путем обработки реагентом Лавессона или P4S10. Подходящие реакционные условия включают взаимодействие соединений формулы (VIII) с P4S10 в 1,2-дихлорэтане, например, при 70C. Соединения формулы (VIII) могут быть получены согласно реакционной схеме 10 путем взаимодействия соединений формулы (X) с органическим основанием, таким как триэтиламин, с последующим взаимодействием полученного амина (IX) с уксусной кислотой. Обычно амин (IX) используют без дополнительной очистки и подвергают взаимодействию с AcOH, например, при 60C. Схема 10 Соединения формулы (X) могут быть получены согласно реакционной схеме 11 путем взаимодействия соединений формулы (XI) с ацилхлоридом (XII), происходящим из защищенной аспарагиновой кислоты. Схема 11 Соединения формулы (XI) могут быть получены согласно процедурам, описанным в Synthesis,1980, 677-688. Ацилхлориды (XII) могут быть получены согласно процедурам, описанным в J. Org. Chem., 1990,55, 3068-3074 и J. Chem. Soc. Perkin Trans. 1, 2001, 1673-1695. Специалистам в данной области будет понятно, что может быть выгодно защищать одну или более функциональных групп соединений, описанных в способах выше. Примеры защитных групп и способы их удаления можно найти в Т.W. Greene 'Protective Groups in Organic Synthesis' (4th edition, J. Wiley andSons, 2006). Подходящие защитные группы для амина включают в себя ацил (например, ацетил, карбамат(например, бензил), которые могут быть удалены посредством гидролиза (например, с использованием кислоты, такой как соляная кислота в диоксане или трифторуксусная кислота в дихлорметане) или восстановления (например, гидрогенолизом бензильной или бензилоксикарбонильной группы или восстановительным удалением 2',2',2'-трихлорэтоксикарбонильной группы с использованием цинка в уксусной кислоте), по обстоятельствам. Другие подходящие защитные группы для амина включают в себя трифторацетил (-COCF3), который может быть удален путем гидролиза, катализируемого основанием. Следует понимать, что в любом из путей, описанных выше, точный порядок синтетических стадий,с помощью которых в молекулу вводят различные группы и группировки, может различаться. Практикующий специалист в данной области сможет убедиться в том, чтобы группы и группировки, введенные на одной стадии способа, не будут подвергнуты влиянию последующих превращений и реакций, и соответствующим образом выбрать порядок синтетических стадий. Полагают, что некоторые промежуточные соединения, описанные выше, являются новыми и поэтому образуют еще один аспект изобретения. Соединения формулы (Ic) и их соли являются ингибиторами бромодоменов и, таким образом, как полагают, обладают потенциальной полезностью в лечении заболеваний или состояний, для которых показан ингибитор бромодомена. Таким образом, в описании изобретения раскрыто соединение формулы (Ic) или его фармацевтически приемлемая соль для применения в терапии. В описании раскрыт 2-[(4S)-6-(4-хлорфенил)-1-метил-8(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]-N-этилацетамид или его фармацевтически приемлемая соль для применения в терапии. Соединения формулы (Ic) или его фармацевтически приемлемые соли могут быть полезны для применения в лечении заболеваний или состояний, для которых показан ингибитор бромодомена. В описании раскрыто соединение формулы (Ic) или его фармацевтически приемлемая соль для применения в лечении заболеваний или состояний, для которых показан ингибитор бромодомена. В описании также раскрыто соединение или его фармацевтически приемлемая соль для применения в лечении хронического аутоиммунного и/или воспалительного состояния. В одном воплощении изобретения предложено соединение или его фармацевтически приемлемая соль для применения в лечении рака, такого как карцинома средней линии. В описании раскрыт 2-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3 а][1,4]бензодиазепин-4-ил]-N-этилацетамид или его фармацевтически приемлемая соль для применения в лечении заболеваний или состояний, для которых показан ингибитор бромодомена. В описании также раскрыт 2-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4 ил]-N-этилацетамид или его фармацевтически приемлемая соль для применения в лечении хронического аутоиммунного и/или воспалительного состояния. В одном воплощении предложен 2-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]-Nэтилацетамид или его фармацевтически приемлемая соль для применения в лечении рака, такого как карцинома средней линии. В описании раскрыто применение соединения формулы (Ic) или его фармацевтически приемлемой соли в изготовлении лекарственного средства для лечения заболеваний или состояний, для которых показан ингибитор бромодомена. В описании также раскрыто применение соединения формулы (Ic) или его фармацевтически приемлемой соли в изготовлении лекарственного средства для лечения хронического аутоиммунного и/или воспалительного состояния. В одном воплощении предложено применение соединения формулы (Ic) или его фармацевтически приемлемой соли в изготовлении лекарственного средства для лечения рака, такого как карцинома средней линии. В описании раскрыто применение 2-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4H[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]-N-этилацетамида или его фармацевтически приемлемой соли в изготовлении лекарственного средства для лечения заболеваний или состояний, для которых показан ингибитор бромодомена. В описании также раскрыто применение 2-[(4S)-6-(4-хлорфенил)-1 метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]-N-этилацетамида или его фармацевтически приемлемой соли в изготовлении лекарственного средства для лечения хронического аутоиммунного и/или воспалительного состояния. В одном воплощении предложено применение 2-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]-Nэтилацетамида или его фармацевтически приемлемой соли в изготовлении лекарственного средства для лечения рака, такого как карцинома средней линии. В описании раскрыт способ лечения заболевания или состояния, для которого показан ингибитор бромодомена, у субъекта, нуждающегося в этом, включающий введение терапевтически эффективного количества соединения формулы (Ic) или его фармацевтически приемлемой соли. В описании также раскрыт способ лечения хронического аутоиммунного и/или воспалительного состояния у субъекта, нуждающегося в этом, включающий введение терапевтически эффективного количества соединения формулы (Ic) или его фармацевтически приемлемой соли. В одном воплощении предложен способ лечения рака, такого как карцинома средней линии, у субъекта, нуждающегося в этом, включающий введение терапевтически эффективного количества соединения формулы (Ic) или его фармацевтически приемлемой соли. В описании раскрыт способ лечения заболевания или состояния, для которого показан ингибитор бромодомена, у субъекта, нуждающегося в этом, включающий введение терапевтически эффективного количества 2-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин 4-ил]-N-этилацетамида или его фармацевтически приемлемой соли. В описании также раскрыт способ лечения хронического аутоиммунного и/или воспалительного состояния у субъекта, нуждающегося в этом, включающий введение терапевтически эффективного количества 2-[(4S)-6-(4-хлорфенил)-1-метил 8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]-N-этилацетамида или его фармацевтически приемлемой соли. В одном воплощении предложен способ лечения рака, такого как карцинома средней линии, у субъекта, нуждающегося в этом, включающий введение терапевтически эффективного количества 2-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин 4-ил]-N-этилацетамида или его фармацевтически приемлемой соли. В одном из воплощений субъект, нуждающийся в этом, представляет собой млекопитающее, в частности человека. Как использовано в данном описании, термин "эффективное количество" означает такое количество лекарственного средства или фармацевтического агента, которое будет вызывать биологический или медицинский ответ ткани, системы, животного или человека, которые определяются, например, исследователем или клиницистом. Более того, термин "терапевтически эффективное количество" означает любое количество, которое, по сравнению с соответствующим субъектом, который не получал такого количества, приводит к улучшенному лечению, излечению, предупреждению или облегчению заболевания, расстройства или побочного эффекта, или уменьшению скорости развития заболевания или расстройства. Термин также включает в пределах своего объема количества, эффективные для усиления нормальной физиологический функции. Полагают, что ингибиторы бромодоменов являются полезными в лечении различных заболеваний или состояний, связанных с системным воспалением или воспалением ткани, воспалительными ответами на инфекцию или гипоксию, клеточной активацией и пролиферацией, липидным метаболизмом, фиброзом, и в предупреждении и лечении вирусной инфекции. Ингибиторы бромодоменов могут быть полезными в лечении широкого спектра хронических аутоиммунных и воспалительных состояний, таких как ревматоидный артрит, остеоартрит, острая подагра,псориаз, системная красная волчанка, рассеянный склероз, воспалительное заболевание кишечника (болезнь Крона и неспецифический язвенный колит), астма, хроническое обструктивное заболевание дыхательных путей, пневмонит, миокардит, перикардит, миозит, экзема, дерматит, алопеция, витилиго, буллезное заболевания кожи, нефрит, васкулит, атеросклероз, болезнь Альцгеймера, депрессия, ретинит,увеит, склерит, гепатит, панкреатит, первичный билиарный цирроз печени, склерозирующий холангит,болезнь Аддисона, гипофизит, тиреоидит, диабет I типа и острое отторжение трансплантированных органов. Ингибиторы бромодоменов могут быть полезными в лечении широкого спектра различных острых воспалительных состояний, таких как острая подагра, гигантоклеточный артериит, нефрит, включающий волчаночный нефрит, васкулит с вовлечением органов, такой как гломерулонефрит, васкулит, включающий гигантоклеточный артериит, гранулематоз Вегенера, узелковый полиартериит, болезнь Бехчета, болезнь Кавасаки, болезнь Такаясу и острое отторжение трансплантированных органов. Ингибиторы бромодоменов могут быть полезными в предупреждении или лечении заболеваний или состояний, которые вовлекают воспалительные ответы на инфекции, вызванные бактериями, вирусами,грибами, паразитами или их токсинами, такие как сепсис, септический синдром, септический шок, эндотоксемия, синдром системной воспалительной реакции (SIRS), синдром полиорганной недостаточности,синдром токсического шока, острое легочное повреждение, ARDS (респираторный дистресс-синдром взрослых), острая почечная недостаточность, молниеносный гепатит, ожоги, острый панкреатит, послеоперационные синдромы, саркоидоз, реакции Херксхеймера, энцефалит, миелит, менингит, малярия,SIRS, ассоциированный с вирусными инфекциями, такими как грипп, опоясывающий лишай, простой герпес и коронавирус. Ингибиторы бромодоменов могут быть полезными в предупреждении или лечении состояний, связанных с повреждением при ишемии-реперфузии, таких как инфаркт миокарда, цереброваскулярная ишемия (инсульт), острые коронарные синдромы, повреждение почек при реперфузии, процедуры трансплантации органа, шунтирования коронарной артерии, сердечно-легочного шунтирования и легочная, почечная, печеночная, желудочно-кишечная эмболия или периферическая эмболия конечности. Ингибиторы бромодоменов могут быть полезными в лечении расстройств липидного метаболизма посредством регуляции АРО-А 1, таких как гиперхолестеринемия, атеросклероз и болезнь Альцгеймера. Ингибиторы бромодоменов могут быть полезными в лечении фиброзных состояний, таких как идиопатический фиброз легких, фиброз почек, послеоперационная стриктура, образование келоидов,склеродермия и фиброз сердца. Ингибиторы бромодоменов могут быть полезными в предупреждении и лечении вирусных инфекций, таких как вирус герпеса, вирус папилломы человека, аденовирус, вирус оспы и другие ДНК-вирусы. Ингибиторы бромодоменов могут быть полезными в лечении рака, включая гематологический, эпителиальный, включающий карциномы легкого, молочной железы и толстой кишки, карциномы средней линии, мезенхимальные, печеночные, почечные и неврологические опухоли. Заболевание или состояние, для которого показан ингибитор бромодомена, выбрано из заболеваний, ассоциированных с синдромом системной воспалительной реакции, таких как сепсис, ожоги, панкреатит, серьезная травма, кровотечение и ишемия. Ингибитор бромодомена следует вводить в момент постановки диагноза для снижения частоты: SIRS, наступления шока, синдрома полиорганной недостаточности, который включает начало острого легочного повреждения, ARDS, острое почечное, печеночное, сердечное и желудочно-кишечное повреждение и смертность. Ингибитор бромодомена также следует вводить перед хирургическими или другими процедурами, связанными с высоким риском сепсиса,кровотечения, обширного повреждения ткани, SIRS или MODS (синдром полиорганной недостаточности). В описании заболевание или состояние, для которого показан ингибитор бромодомена, представляет собой сепсис, септический синдром, септический шок и эндотоксемию. Также ингибитор бромодомена показан для лечения острого или обострения хронического панкреатита. Кроме того, ингибитор бромодомена показан для лечения ожогов. В описании заболевание или состояние, для которого показан ингибитор бромодомена, выбрано из инфекций и реактиваций простого герпеса, герпетической лихорадки, инфекций и реактиваций опоясывающего герпеса, ветряной оспы, опоясывающего лишая, вируса папилломы человека, неоплазии шейки матки, аденовирусных инфекций, включая острое респираторное заболевание, и поксвирусных инфекций, таких как коровья оспа и натуральная оспа, и вируса африканской лихорадки свиней. В частности,ингибитор бромодомена показан для лечения человеческих папилломавирусных инфекций кожи или эпителия шейки матки. Термин "заболевания или состояния, для которых показан ингибитор бромодомена" предназначен для включения любого из или всех вышеперечисленных болезненных состояний. В изобретении раскрыт способ ингибирования бромодомена, который включает приведение бромодомена в контакт с соединением формулы (Ic) или его фармацевтически приемлемой солью. Хотя возможно, что для применения в терапии соединение формулы (Ic), а также его фармацевтически приемлемые соли можно вводить в виде исходного химического соединения, обычно активный ингредиент представлен в виде фармацевтической композиции. Поэтому в настоящем изобретении раскрыта фармацевтическая композиция, содержащая соединение формулы (Ic) или его фармацевтически приемлемую соль и один или более фармацевтически приемлемых носителей, разбавителей или эксципиентов. Соединения формулы (Ic) и их фармацевтически приемлемые соли являются такими, как описано выше. В изобретении раскрыта фармацевтическая композиция,содержащая 2-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3 а][1,4]бензодиазепин-4-ил]-N-этилацетамид или его фармацевтически приемлемую соль и один или более фармацевтически приемлемых носителей, разбавителей или эксципиентов. Носитель(и), разбавитель(и) или эксципиент(ы) должны быть приемлемыми в смысле совместимости с другими ингредиентами композиции и не вредными для ее реципиента. В изобретении также раскрыт способ получения фармацевтической композиции, включающий смешивание соединения формулы (Ic) или его фармацевтически приемлемой соли с одним или более фармацевтически приемлемыми носителями, разбавителями или эксципиентами. Фармацевтическая композиция может быть использована в лечении любого из состояний, описанных в данном документе. Поскольку соединения формулы (Ic) и их фармацевтически приемлемые соли предназначены для применения в фармацевтических композициях, будет легко понятно, что каждое из них раскрыто предпочтительно, по существу, в чистой форме, например по меньшей мере 60%-ной чистоты, более подходяще по меньшей мере 75%-ной чистоты и предпочтительно по меньшей мере 85%-ной чистоты, в частности по меньшей мере 98%-ной чистоты (мас.% от общей массы). Фармацевтические композиции могут быть представлены в стандартных лекарственных формах,содержащих заданное количество активного ингредиента на стандартную дозу. Предпочтительные стандартные лекарственные композиции представляют собой композиции, содержащие суточную дозу или часть дозы, или ее подходящую фракцию, активного ингредиента. Поэтому такие стандартные дозы можно вводить более чем один раз в сутки. Предпочтительные стандартные лекарственные композиции представляют собой композиции, содержащие суточную дозу или часть дозы (для введения более чем один раз в сутки), как указано в данном описании выше, или ее подходящую фракцию, активного ингредиента. Фармацевтические композиции могут быть адаптированы для введения любым подходящим путем,например пероральным (включая трансбуккальный или сублингвальный), ректальным, ингаляционным,интраназальным, местным (включая трансбуккальный, сублингвальный или трансдермальный), вагинальным или парентеральным (включая подкожный, внутримышечный, внутривенный или интрадермальный) путем. Такие композиции могут быть получены любым способом, известным в данной области фармацевтики, например, путем объединения активного ингредиента с носителем(ями) или эксципиентом(ами). В описании раскрыта фармацевтическая композиция, содержащая соединение формулы (Ic) или его фармацевтически приемлемую соль, адаптированная для перорального введения. Фармацевтическая композиция также может быть адаптирована для парентерального введения,конкретно, для внутривенного введения. Фармацевтические композиции, адаптированные для парентерального введения, включают водные и неводные стерильные растворы для инъекций, которые могут содержать антиоксиданты, буферы, бак- 18023441 териостатические агенты и растворенные вещества, которые делают композицию изотоничной относительно крови предполагаемого реципиента; и водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты и загустители. Композиции могут быть представлены в однодозовых и многодозовых контейнерах, например герметичных ампулах и флаконах, и могут храниться в высушенном замораживанием (лиофилизированном) состоянии, требующем только добавления стерильного жидкого носителя, например воды для инъекций, непосредственно перед применением. Экстемпоральные растворы и суспензии для инъекций могут быть получены из стерильных порошков, гранул и таблеток. Фармацевтические композиции, адаптированные для перорального введения, могут быть представлены в виде дискретных единиц, таких как капсулы или таблетки; порошков или гранул; растворов или суспензий в водных или неводных жидкостях; пищевых пен или взбитых сливок; или жидких эмульсий масло-в-воде или жидких эмульсий вода-в-масле. Например, для перорального введения в форме таблетки или капсулы, активный лекарственный компонент может быть объединен с пероральным, нетоксичным фармацевтически приемлемым инертным носителем, таким как этанол, глицерин, вода и т.п. Порошки, подходящие для включения в таблетки или капсулы, могут быть получены путем измельчения соединения до подходящего малого размера (например, посредством микронизации) и смешивания с аналогичным образом полученным фармацевтическим носителем, таким как пищевой углевод, такой как, например, крахмал или маннит. Также может присутствовать ароматизатор, консервант, диспергирующий агент и краситель. Капсулы могут быть изготовлены путем получения порошковой смеси, как описано выше, и заполнения ею формованных желатиновых оболочек. Скользящие агенты и смазывающие агенты, такие как коллоидный диоксид кремния, тальк, стеарат магния, стеарат кальция или твердый полиэтиленгликоль,могут быть добавлены в порошковую смесь перед процедурой заполнения. Диспергирующий или солюбилизирующий агент, такой как агар-агар, карбонат кальция или карбонат натрия, также может быть добавлен для улучшения доступности лекарственного средства, когда капсула проглатывается. Кроме того, когда это желательно или необходимо, в смесь также могут быть включены подходящие связующие агенты, скользящие агенты, смазывающие агенты, подсластители, разрыхлители и красители. Подходящие связующие агенты включают в себя крахмал, желатин, природные сахара, такие как глюкоза или бета-лактоза, кукурузные подсластители, природные и синтетические камеди, такие как гуммиарабик, трагакант или альгинат натрия, карбоксиметилцеллюлоза, полиэтиленгликоль, воски и т.п. Смазывающие агенты, используемые в этих лекарственных формах, включают в себя олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия и т.п. Разрыхлители включают в себя, без ограничения, крахмал, метилцеллюлозу, агар, бентонит, ксантановую камедь и т.п. Таблетки изготавливают, например, путем получения порошковой смеси, гранулирования или агрегирования, добавления смазывающего агента и разрыхлителя и прессования в таблетки. Порошковую смесь получают путем смешивания соединения, соответствующим образом измельченного, с разбавителем или основой,как описано выше, и возможно со связующим агентом, таким как карбоксиметилцеллюлоза, альгинат,желатин или поливинилпирролидон, замедлителем растворения, таким как парафин, ускорителем ресорбции, таким как четвертичная соль и/или агент абсорбции, такой как бентонит, каолин или фосфат дикальция. Порошковая смесь может быть гранулирована путем увлажнения связующим агентом, таким как сироп, крахмальная паста, гуммиарабик или растворы целлюлозных или полимерных материалов, и пропускания через сито. В качестве альтернативы гранулированию, порошковая смесь может быть пропущена через таблеточную машину, и результатом являются не полностью образованные бруски, распадающиеся на гранулы. Гранулы могут быть смазаны для предупреждения прилипания к таблеткообразующим штампам путем добавления стеариновой кислоты, стеаратной соли, талька или минерального масла. Затем смазанную смесь прессуют в таблетки. Соединения по настоящему изобретению также могут быть объединены со свободно текущим инертным носителем и спрессованы в таблетки непосредственно, без прохождения стадий гранулирования и агрегирования. Может быть предложено прозрачное или непрозрачное защитное покрытие, состоящее из изолирующего слоя шеллака, покрытия из сахара или полимерного материала и гладкого покрытия из воска. В эти покрытия могут быть добавлены различные красители для различения разных стандартных дозировок. Пероральные жидкости, такие как растворы, сиропы и эликсиры, могут быть получены в форме единицы дозирования, так чтобы заданное количество содержало заранее определенное количество соединения. Сиропы могут быть получены путем растворения соединения в соответствующем образом ароматизированном водном растворе, в то время как эликсиры получают путем применения нетоксичного спиртового носителя. Суспензии могут быть приготовлены путем диспергирования соединения в нетоксичном носителе. Также могут быть добавлены солюбилизаторы и эмульгаторы, такие как этоксилированные изостеариловые спирты и простые эфиры полиоксиэтилена и сорбита, консерванты, вкусовая добавка, такая как масло перечной мяты, или природные подсластители, или сахарин, или другие искусственные подсластители, и тому подобное. Где это подходит, композиции единицы дозирования для перорального введения могут быть микроинкапсулированы. Препарат также может быть приготовлен для продления или замедления высвобож- 19023441 дения, например, путем нанесения покрытия или включения зернистого материала в полимеры, воск и тому подобное. Соединения формулы (Ic) и их фармацевтически приемлемые соли также могут быть введены в форме липосомных систем доставки, таких как маленькие однослойные везикулы, большие однослойные везикулы и многослойные везикулы. Липосомы могут быть образованы из различных фосфолипидов,таких как холестерин, стеариламин или фосфатидилхолины. Фармацевтические композиции, адаптированные для местного введения, могут быть приготовлены в виде мазей, кремов, суспензий, лосьонов, порошков, растворов, паст, гелей, спреев, аэрозолей или масел. Для лечения глаза или других внешних тканей, например полости рта и кожи, композиции предпочтительно применяются в виде местной мази или крема. При приготовлении в виде мази активный ингредиент можно использовать либо с парафиновой, либо со смешиваемой с водой мазевой основой. Альтернативно, активный ингредиент может быть приготовлен в виде крема с кремовой основой масло-в-воде или вода-в-масле. Фармацевтические композиции, адаптированные для местного введения в глаз включают глазные капли, где активный ингредиент растворен или суспендирован в подходящем носителе, особенно в водном растворителе. Лекарственные формы для назального или ингаляционного введения могут быть легко приготовлены в виде аэрозолей, растворов, суспензий, гелей или сухих порошков. Для композиций, подходящих и/или адаптированных для ингаляционного введения предпочтительно, чтобы соединение формулы (Ic) или его фармацевтически приемлемая соль находились в форме с уменьшенным размером частиц, например полученной посредством микронизации. Предпочтительный размер частиц у соединения или соли с уменьшенным размером (например, микронизированного) определяется значением D50 от примерно 0,5 до примерно 10 мкм (например, при измерении с использованием лазерной дифракции). Аэрозольные композиции, например для ингаляционного введения, могут содержать раствор или мелкодисперсную суспензию активного вещества в фармацевтически приемлемом водном или неводном растворителе. Аэрозольные композиции могут быть представлены в единичных или многодозовых количествах в стерильной форме в герметичном контейнере, которые могут принимать форму картриджа или дозаправляться для применения с распылительным устройством или ингалятором. Альтернативно, герметичный контейнер может представлять собой единое диспергирующее устройство, такое как однодозовый назальный ингалятор или аэрозольный диспенсер, снабженный дозирующим клапаном (дозирующий ингалятор), предназначенное для выбрасывания, когда содержимое контейнера израсходовано. Когда лекарственная форма содержит аэрозольный диспенсер, она предпочтительно содержит подходящий пропеллент, находящийся под давлением, такой как сжатый воздух, диоксид углерода или органический пропеллент, такой как гидрофторуглерод (HFC). Подходящие HFC пропелленты включают 1,1,1,2,3,3,3-гептафторпропан и 1,1,1,2-тетрафторэтан. Аэрозольные лекарственные формы также могут принимать форму насоса-распылителя. Находящийся под давлением аэрозоль может содержать раствор или суспензию активного соединения. Для этого может потребоваться включение дополнительных эксципиентов, например сорастворителей и/или поверхностно-активных веществ для улучшения характеристик дисперсии и гомогенности суспензионных композиций. Для композиций в виде раствора также может потребоваться добавление сорастворителей, таких как этанол. Для фармацевтических композиций, подходящих и/или адаптированных для ингаляционного введения, фармацевтический композиция может представлять собой сухую порошковую ингаляционную композицию. Такая композиция может содержать порошковое основание, такое как лактоза, глюкоза,трегалоза, маннит или крахмал, соединение формулы (Ic) или его фармацевтически приемлемую соль(предпочтительно в форме с уменьшенным размером частиц, например в микронизированной форме) и возможно модификатор технических характеристик, такой как L-лейцин или другая аминокислота, и/или металлические соли стеариновой кислоты, такие как стеарат магния или кальция. Предпочтительно сухая порошковая ингаляционная композиция содержит сухую порошковую смесь лактозы, например лактозы моногидрат, и соединение формулы (Ic) или его фармацевтически приемлемую соль. Такие композиции могут быть введены пациенту с использованием подходящего устройства, такого как устройствоDISKUS, представленное на рынке GlaxoSmithKline, которое, например, описано в GB 2242134 А. Соединения формулы (Ic) и их фармацевтически приемлемые соли могут быть приготовлены в виде жидкой композиции для доставки из жидкостного диспенсера, например жидкостного диспенсера, имеющего диспергирующую насадку или диспергирующее отверстие, через которое распределяется отмеренная доза жидкой композиции при приложении приложенной пользователем силы к насосному механизму жидкостного диспенсера. Такие жидкостные диспенсеры в общем случае представлены с резервуаром для множества отмеренных доз жидкой композиции, где дозы диспергируются при последовательных приведениях в действие насоса. Диспергирующая насадка или отверстие могут быть сконфигурированы для введения в ноздри пользователя для распылительного распределения жидкой композиции в носовую полость. Жидкостной диспенсер вышеупомянутого типа описан и показан вWO 2005/044354 А 1. Терапевтически эффективное количество соединения формулы (Ic) или его фармацевтически приемлемой соли будет зависеть от ряда факторов, включая, например, возраст и массу животного, точное состояние, требующее лечения и его тяжесть, природу композиции и путь введения, и в итоге будет на усмотрении лечащего врача или ветеринара. В фармацевтической композиции каждая единица дозировки для перорального или парентерального введения предпочтительно содержит от 0,01 до 3000 мг, более предпочтительно от 0,5 до 1000 мг соединения формулы (Ic) или его фармацевтически приемлемой соли в расчете на свободное основание. Каждая единица дозировки для назального или ингаляционного введения предпочтительно содержит от 0,001 до 50 мг, более предпочтительно от 0,01 до 5 мг соединения формулы (Ic) или его фармацевтически приемлемой соли в расчете на свободное основание. Соединения формулы (Ic) и их фармацевтически приемлемые соли могут быть введены в суточной дозе (для взрослого пациента), например в пероральной или парентеральной дозе от 0,01 до 3000 мг в сутки или от 0,5 до 1000 мг в сутки или в назальной или ингаляционной дозе от 0,001 до 50 мг в сутки или от 0,01 до 5 мг в сутки соединения формулы (Ic) или его фармацевтически приемлемой соли в расчете на свободное основание. Данное количество можно давать в одной дозе в сутки или чаще в ряде (например, в виде двух, трех, четырех, пяти или шести) субдоз в сутки, так что суммарная суточная доза будет такой же. Эффективное количество его фармацевтически приемлемой соли может быть определено соразмерно эффективному количеству соединения формулы (Ic) самого по себе. Соединения формулы (Ic) и их фармацевтически приемлемые соли можно использовать сами по себе или в комбинация с другими терапевтическими агентами. Комбинированные терапии в соответствии с настоящим изобретением, таким образом, включают введение по меньшей мере одного соединение формулы (Ic) или его фармацевтически приемлемой соли, и применение по меньшей мере одного другого фармацевтически активного агента. Предпочтительно комбинированные терапии в соответствии с настоящим изобретением включают введение по меньшей мере одного соединения формулы (Ic) или его фармацевтически приемлемой соли и по меньшей мере одного другого фармацевтически активного агента. Соединение(я) формулы (Ic) и его(их) фармацевтически приемлемая(ый) соль(и) и другой(ие) фармацевтически активный(е) агент(ы) может(гут) быть введен(ы) вместе в одной фармацевтической композиции или отдельно, и, когда их вводят отдельно, это может происходить одновременно или последовательно в любом порядке. Количества соединения(й) формулы (Ic) и его(их) фармацевтически приемлемых солей и другого(их) фармацевтически активного(ых) агента(ов) и относительное время введения выбирают так, чтобы достичь желательного комбинированного терапевтического эффекта. Таким образом, в дополнительном аспекте раскрыта комбинация, содержащая соединение формулы (Ic) или его фармацевтически приемлемую соль и по меньшей мере один другой фармацевтически активный агент. В одном воплощении раскрыта комбинация фармацевтического продукта, содержащего соединение формулы (Ic) или его фармацевтически приемлемую соль, вместе с одну или более другими терапевтически активными агентами. Таким образом, соединения и фармацевтические композиции по изобретению можно использовать в комбинации с одним или более другими терапевтическими агентами или включать один или более другие терапевтические агенты, например, выбранные из антибиотиков, противовирусных средств, глюкокортикостероидов, мускариновых антагонистов и бета-2-агонистов. Очевидно, что, когда соединения по настоящему изобретению вводят в комбинации с другими терапевтическими агентами, обычно вводимыми ингаляционным, внутривенным, пероральным или внутриназальным путем, полученную фармацевтическую композицию можно вводить такими же путями. Альтернативно отдельные компоненты композиции можно вводить разными путями. В описании раскрыты комбинации, содержащие один или два других терапевтических агента. Специалисту в данной области техники понятно, что, где это целесообразно, другой(ие) терапевтический(е) ингредиент(ы) можно использовать в форме солей, например солей щелочного металла или амина или солей присоединения кислоты, или пролекарств, или сложных эфиров, например низших алкильных сложных эфиров, или в виде сольватов, например гидратов, чтобы оптимизировать активность и/или стабильность и/или физические характеристики, такие как растворимость, терапевтического ингредиента. Также понятно, что, где это целесообразно, терапевтические ингредиенты можно использовать в оптически чистой форме. Комбинации, упоминаемые выше, могут быть легко представлены для применения в форме фармацевтической композиции и таким образом фармацевтические композиции, содержащие комбинацию, как она определена выше, вместе с фармацевтически приемлемым разбавителем или носителем представляют собой дополнительный аспект изобретения. Соединения формулы (Ic) и их соли могут быть получены способами, описанными ниже или аналогичными способами. Таким образом, следующие Промежуточные соединения и Примеры служат для иллюстрации получения соединений формулы (Ic) и их солей, и их не следует расценивать как ограничивающие объем изобретения каким-либо образом. Общие подробности экспериментов Все упоминаемые температуры указаны в C. Сокращения.LC/MS относится к анализам посредством аналитической HPLC, которые выполняли на трех типах аппаратов: а) На колонке Supelcosil LCABZ+PLUS (3 мкм, 3,3 см 4,6 мм вн. д.), элюируя 0,1% HCO2H и 0,01 М ацетатом аммония в воде (растворитель А) и 95% ацетонитрилом и 0,05% HCO2H в воде (растворитель В), используя следующий градиент элюирования 0-0,7 мин 0%В, 0,7-4,2 мин 0100%В, 4,2-5,3 мин 100%В, 5,3-5,5 мин 1000%В со скоростью потока 3 мл/мин. Масс-спектр (MS) регистрировали на массспектрометре Fisons VG Platform, используя режимы положительной ионизации электрораспылением[(ES+ve с получением молекулярных ионов [М+Н]+ и [M+NH4]+] или отрицательной ионизации электрораспылением [(ES-ve с получением молекулярных ионов [М-Н]-]. Аналитические данные от этого аппарата приведены в следующем формате: [М+Н]+ или [М-Н]-. б) На колонке Chromolith Performance RP 18 (1004,6 мм вн. д.), элюируя 0,01 М ацетатом аммония в воде (растворитель А) и 100% ацетонитрилом (растворитель В), используя следующий градиент элюирования 0-4 мин 0100% В, 4-5 мин 100% В со скоростью потока 5 мл/мина. Масс-спектр (MS) регистрировали на микромассовом масс-спектрометре Platform-LC, используя режимы химической положительной ионизации при атмосферном давлении [AP+ve с получением молекулярных ионов МН+] или химической отрицательной ионизации при атмосферном давлении [AP-ve с получением молекулярных ионов (М-Н)-]. Аналитические данные из данных аппаратов приведены в следующем формате: [М+Н]+ или[М-Н]- с предшествующим акронимом APCI для конкретизации обоих источников массспектрометрических анализов. в) На колонке Acquity UPLC ВЕН С 18 (2,150 мм вн. д., 1,7 мкм набивочный диаметр) при 40C,элюируя 0,1% об./об. раствором муравьиной кислоты в воде (система растворителей А) и 0,1% об./об. раствором муравьиной кислоты в ацетонитриле (система растворителей В). Используемый градиент представлял собой: Система УФ-детекции представляла собой усредненный сигнал от длины волны 210 до 350 нм и масс-спектр регистрировали на масс-спектрометре, используя чередующееся сканирование в положительном и отрицательном режиме ионизации электрораспылением.LC/HRMS: Аналитическую HPLC выполняли на колонке Uptisphere-hsc (3 мкм 333 мм вн. д.),элюируя 0,01 М ацетатом аммония в воде (растворитель А) и 100% ацетонитрилом (растворитель В), используя следующий градиент элюирования 0-0,5 мин 5% В, 0,5-3,75 мин 5100% В, 3,75-4,5 мин 100% В, 4,5-5 мин 1005% В, 5-5,5 мин 5% В со скоростью потока 1,3 мл/мин. Масс-спектр (MS) регистрировали на микромассовом LCT масс-спектрометре, используя режимы положительной ионизации электрораспылением [ES+ve с получением молекулярных ионов МН+] или отрицательной ионизации электрораспылением [ES-ve с получением молекулярных ионов (М-Н)-]. Управляемая по массе авто-препаративная HPLC относится к способу, при котором вещество очищали посредством высокоэффективной жидкостной хроматографии на 5 мкм колонке HPLCABZ+(5 см 10 мм вн. д.) с 0,1% HCO2H в воде и 95% MeCN, 5% воды (0,5% HCO2H), используя следующие условия градиентного элюирования: 0-1,0 мин 5%В, 1,0-8,0 мин 530%В, 8,0-8,9 мин 30%В, 8,9-9,0 мин 3095%В, 9,0-9,9 мин 95%В, 9,9-10 мин 950%В со скоростью потока 8 мл/мин. Коллектор фракцийGilson 202 приводил в действие масс-спектрометр VG Platform для детекции интересующей массы. Спектры протонной ЯМР (1 Н ЯМР) регистрировали при температуре окружающей среды на спектрометре Bruker Avance 300 DPX, используя растворитель в качестве внутреннего стандарта, и химические сдвиги протонов выражали в м.д. (миллионных долях) в указанном растворителе. Для мультиплетности ЯМР-сигналов использованы следующие сокращения: s = синглет, d = дублет, t = триплет, q = квадруплет, dd = дублет дублета, m = мультиплет. Неочищенное промежуточное соединение 5 (предположительно 9,3 ммоль) суспендировали в смесиTHF и AcOH (1/1) и перемешивали в течение ночи, затем концентрировали при пониженном давлении. Неочищенную смесь суспендировали в DCM и промывали насыщенным раствором NaHCO3. Органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме и полученное твердое вещество растирали в i-Pr2O и фильтровали. Неочищенный продукт очищали посредством флэш-хроматографии на силикагеле (DCM/MeOH: 95/5) с получением указанного в заголовке соединения, которое использовали на следующий стадии без дополнительной очистки. К раствору примера 34 (28 г, 68 ммоль) в THF (450 мл) при к.т. добавляли 1 н. NaOH (136 мл,136 ммоль). Реакционную смесь перемешивали при данной температуре в течение 5 ч, затем охлаждали и гасили 1 н. HCl (136 мл). THF удаляли при пониженном давлении и водный слой экстрагировали DCM. Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенное твердое вещество перекристаллизовывали в CH3CN с получением указанного в заголовке соединения (23,9 г, 89%-ный выход) в виде бледно-желтого порошка. 1 Н ЯМР (300 МГц, CDCl3)7,55-7,48 (m, 2 Н), 7,41 (d, J=8,9 Гц, 1 Н), 7,38-7,31 (m, 2H), 7,22 (dd,J=2,9 и 8,9 Гц, 1 Н), 6,90 (d, J=2,9 Гц, 1 Н), 4,59 (dd, J=6,9 и 6,9 Гц, 1H), 3,81 (s, 3 Н), 3,70 (dd, J=6,9 и 25,7 Гц, 1H), 3,61 (dd, J=6,9 и 25,7 Гц, 1H), 2,63 (s, 3 Н).LC/MS: m/z 397 [M(35Cl)+H]+, Rt=2,11 мин. Промежуточное соединение 3 формулы (Ib), т.е. соединения общей формулы (Ic), где R2 представляет собой ОН, получали способами, аналогичными описанному для промежуточного соединения 2, начиная с промежуточного соединения 1 и используя диоксан вместо THF в качестве растворителя. Промежуточное соединение 3. К суспензии промежуточного соединения 6 (30,2 г, 77,7 ммоль) в THF (800 мл) при 0C по каплям добавляли гидразина моногидрат (11,3 мл, 233 ммоль). Реакционную смесь перемешивали в течение 4 ч при температуре между 0 и 15C, затем охлаждали при 0C. Затем медленно добавляли Et3N (32,4 мл,230 ммоль) и добавляли по каплям AcCl (16,3 мл, 230 ммоль). Смесь оставляли нагреваться до к.т. и перемешивали в течение 1 ч, затем гасили водой и концентрировали при пониженном давлении. Полученный водный слой затем экстрагировали DCM и органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением неочищенного указанного в заголовке соединения (34 г, выход 100%), которое использовали без дополнительной очистки.LC/MS: m/z 429 [M(35Cl)+H]+, Rt=2,83 мин. Описанный выше способ можно также применять к рацемической форме промежуточного соединения 6 с получением продукта в рацемической форме. Промежуточное соединение 5 получали способами, аналогичными описанным для промежуточного соединения 4, начиная с промежуточного соединения 7. Промежуточное соединение 5. Метил-[(3S)-2-[(1Z)-2-ацетилгидразино]-5-(3-фторфенил)-7(метилокси)-3H-1,4-бензодиазепин-3-ил]ацетат Суспензию P4S10 (85,8 г, 190 ммоль) и Na2CO3 (20,5 г, 190 ммоль) в 1,2-DCE (1,5 л) при к.т. перемешивали в течение 1 ч, затем добавляли Промежуточное соединение 9 (40 г, 107 ммоль). Полученную смесь перемешивали при 65C в течение 4 ч, затем охлаждали и фильтровали. Твердое вещество промывали DCM и фильтрат промывали насыщенным NaHCO3. Органический слой сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Указанное в заголовке соединение осаждали из смеси DCM/i-Pr2O и фильтровали. Фильтрат затем концентрировали и очищали посредством флэшхроматографии (DCM/MeOH: 98/2) с получением другой партии продукта. Указанное в заголовке соединение получали в виде желтого порошка, объединяя две фракции (30,2 г, 73%).(0,6 экв.) в дефлегмирующем толуоле с получением указанного в заголовке соединения в виде рацемической смеси. Промежуточное соединение 7 получали способами, аналогичными описанным для промежуточного соединения 6, начиная с промежуточного соединения 10. Промежуточное соединение 7. Метил-[(3S)-5-(3-фторфенил)-7-(метилокси)-2-тиоксо-2,3-дигидро 1H-1,4-бензодиазепин-3-ил]ацетат К раствору промежуточного соединения 11 (500 мг, 1,3 ммоль) в THF (50 мл) при к.т. добавлялиDIEA (0,35 мл, 2,0 ммоль), затем HATU (760 мг, 2,0 ммоль). Реакционную смесь перемешивали в течение 5 мин, затем добавляли циклогексиламин (0,23 мл, 2,0 ммоль). Смесь перемешивали в течение 30 ч и дополнительно добавляли при перемешивании 0,5 экв. HATU, DIEA и циклогексиламин. Органический слой промывали 1 н. NaOH. Водный слой экстрагировали DCM и органические вещества сушили надNa2SO4, фильтровали и концентрировали в вакууме. Неочищенное твердое вещество затем очищали посредством флэш-хроматографии на силикагеле с получением указанного в заголовке соединения (420 мг,62%) в виде желтой пены. К раствору неочищенного промежуточного соединения 12 (предположительно 0,2 моль) в DCM(500 мл) добавляли Et3N (500 мл, 3,65 моль) и полученную смесь кипятили с обратным холодильником в течение 24 ч, затем концентрировали. Полученный неочищенный амин растворяли в 1,2-DCE (1,5 л) и добавляли осторожно AcOH (104 мл, 1,8 моль). Реакционную смесь затем перемешивали при 60C в течение 2 ч, затем концентрировали в вакууме и растворяли в DCM. Органический слой промывали 1 н.HCl и водный слой экстрагировали DCM (3). Объединенные органические слои промывали два раза водой и рассолом, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенное твердое вещество перекристаллизовывали в MeCN с получением указанного в заголовке соединения (51 г) в виде бледно-желтого твердого вещества. Фильтрат можно было концентрировать и перекристаллизовывать в MeCN с получением еще 10 г промежуточного соединения 9 (суммарно: 61 г,69%-ный выход в расчете на извлеченное Промежуточное соединение 12).LC/MS m/z 373 [M(35Cl)+H]+, Rt=2,76 мин. Промежуточное соединение 10 получали способами, аналогичными описанным для промежуточного соединения 9, начиная с промежуточного соединения 13. Промежуточное соединение 10. Метил-[(3S)-5-(3-фторфенил)-7-(метилокси)-2-оксо-2,3-дигидро 1H-1,4-бензодиазепин-3-ил]ацетат К раствору рацемического промежуточного соединения 6 (2,6 г, 6,7 ммоль) в 1,4-диоксане (70 мл) при к.т. медленно добавляли 1 н. NaOH (13,5 мл) и реакционную смесь перемешивали в течение ночи,затем добавляли еще 1 н. NaOH (13,5 мл). Смесь затем дополнительно перемешивали в течение 2 ч, затем 1,4-диоксан удаляли в вакууме. Водный слой подкисляли 1 н. HCl примерно до рН 6 и экстрагировалиDCM. Органические вещества сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,9 г, 76%-ный выход) в виде желтого твердого вещества.,57 моль) и промежуточного соединения 14 (133 г, 0,5 моль) в CHCl3 (410 мл) перемешивали при 60C в течение 1,5 ч, затем охлаждали и концентрировали при пониженном давлении и использовали без дополнительной очистки.LC/MS: m/z 613 [M(35Cl)+H]+, Rt=3,89 мин. Промежуточное соединение 13 получали способами, аналогичными описанным для промежуточного соединения 12, начиная с метил-N-[(9H-флуорен-9-илметил)окси]карбонил-Lаспартил-хлорида К раствору промежуточного соединения 15 (40,0 г, 0,21 моль) в смеси толуол (560 мл)/эфир(200 мл) при 0C добавляли по каплям раствор 4-хлорфенилмагния бромида (170 мл, 1 M в Et2O,0,17 моль). Реакционную смесь оставляли нагреваться до к.т. и перемешивали в течение 1 ч, затем гасили 1 н. HCl. Водный слой экстрагировали EtOAc (3) и объединенные органические вещества промывали рассолом, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенное соединение затем растворяли в EtOH (400 мл) и добавляли 6 н. HCl (160 мл). Реакционную смесь кипятили с обратным холодильником в течение 2 ч, затем концентрировали при пониженном давлении. Полученное твердое вещество фильтровали и промывали два раза эфиром, затем суспендировали вEtOAc и нейтрализовали 1 н. NaOH. Водный слой экстрагировали EtOAc (3) и объединенные органические вещества промывали рассолом, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Указанное в заголовке соединение получали в виде желтого твердого вещества (39 г, выход 88%), которое использовали без дополнительной очистки. Промежуточное соединение 15. 2-Метил-6-(метилокси)-4H-3,1-бензоксазин-4-он Раствор 5-метоксиантраниловой кислоты (7,8 г, 46,5 ммоль) кипятили с обратным холодильником в уксусном ангидриде (60 мл) в течение 2 ч 15, затем охлаждали и концентрировали при пониженном давлении. Неочищенный остаток затем концентрировали два раза в присутствии толуола, затем фильтровали и промывали эфиром с получением указанного в заголовке соединения (6,8 г, выход 77%) в виде бежевого твердого вещества.(2,5 мл) и перемешивали при 50C в атмосфере N2 в течение ночи. Реакционную смесь оставляли охлаждаться до следующего утра, затем DMF упаривали под вакуумом и неочищенное масло разделяли междуEtOAc и насыщенным водным раствором бикарбоната натрия. Органическую фазу промывали насыщенным водным рассолом, сушили над безводным сульфатом магния и упаривали под вакуумом с получением бесцветного масла. В результате очистки остатка посредством флэш-хроматографии на силикагеле Промежуточное соединение 2 (100 мг, 0,252 ммоль), 1,1-диметилэтил-4-амино-1 пиперидинкарбоксилат (0,054 мл, 0,265 ммоль), HATU (115 мг, 0,302 ммоль) и DIPEA (0,106 мл,0,605 ммоль) растворяли в (DMF) (2,5 мл) и перемешивали при 50C в атмосфере N2 в течение ночи. Реакционную смесь оставляли охлаждаться до следующего утра, затем DMF упаривали под вакуумом и неочищенное масло разделяли между EtOAc и насыщенным водным раствором бикарбоната натрия. Органическую фазу промывали насыщенным водным рассолом, сушили над безводным сульфатом магния и упаривали под вакуумом с получением бесцветного масла. В результате очистки остатка посредством флэш-хроматографии на силикагеле (DCM-метанол градиент от 0,5 до 10%) получали указанное в заголовке соединение в виде желтого масла (165 мг, 0,285 ммоль, 113%-ный выход).LC/MS (M(35Cl)+H)+ 579, (M(37Cl)+H)+581, Rt=1,11 мин. Промежуточные соединения 18-21 получали из промежуточного соединения 2 и соответствующего амина, используя методику, описанную в промежуточном соединении 17. Раствор промежуточного соединения 2 (400 мг, 1 ммоль) в DCM (8 мл) охлаждали до -78C. Медленно добавляли раствор трибромида бора (1,26 г, 476 мкл, 5 ммоль) в дихлорметане (2 мл). Реакционную смесь перемешивали при -78C в течение 30 мин в атмосфере азота, затем оставляли нагреваться до к.т. и перемешивали в течение 4 ч. Реакционную смесь выливали на смесь лед/вода (100 мл) и органическую фазу отделяли. Водную фазу экстрагировали DCM (210 мл). Водную фазу упаривали досуха. Остаток экстрагировали MeOH (310 мл) и объединенную органическую фазу упаривали и остаток повторно выпаривали из толуола (2) с получением указанного в заголовке соединения в виде желтого твердого вещества (383 мг, 1,0 ммоль, 99%-ный выход). К раствору промежуточного соединения 2 (16,0 г, 40 ммоль) в THF при к.т. добавляли DIEA (14 мл,80 ммоль), затем HATU (30,4 г, 80 ммоль). Реакционную смесь перемешивали в течение 3 ч при данной температуре и добавляли этиламин (40 мл, 2 M в THF, 80 ммоль). Смесь перемешивали в течение 48 ч,затем концентрировали при пониженном давлении. Неочищенное вещество суспендировали в воде и экстрагировали DCM. Органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Неочищенное твердое вещество очищали хроматографией на SiO2 (DCM/MeOH 95/5) и полученное твердое вещество перекристаллизовывали в MeCN. Твердое вещество затем растворяли в DCM и осаждалиi-Pr2O с получением указанного в заголовке соединения (8 г, 47%-ный выход) в виде белого твердого вещества.LC/MS : m/z 424 [M(35Cl)+H]+, Rt=2,33 мин. Примеры 2-24, т.е. соединения общей формулы (Ic), где R2 представляет собой NR2aR2a', (см. табл. 1) получали способами, аналогичными описанным для примера 1 из промежуточного соединения 2, используя соответствующий амин. Промежуточное соединение 3 использовали вместо промежуточного соединения 1 для примеров 23 и 24.
МПК / Метки
МПК: A61P 35/00, C07D 487/04, A61K 31/55, A61P 43/00
Метки: бензодиазепиновый, бромодомена, ингибитор
Код ссылки
<a href="https://eas.patents.su/30-23441-benzodiazepinovyjj-ingibitor-bromodomena.html" rel="bookmark" title="База патентов Евразийского Союза">Бензодиазепиновый ингибитор бромодомена</a>
Предыдущий патент: Дегидратация спиртов на отравленных кислотных катализаторах
Следующий патент: Вспомогательное устройство для обучения игре на клавишных музыкальных инструментах
Случайный патент: Система смазки и содержащая ее машина












