Модуляторы рецептора сфингозин-1-фосфата и способы хирального синтеза
Номер патента: 23183
Опубликовано: 31.05.2016
Авторы: Йегер Адам Ричард, Брэнчмэри Ингурути, Тамийя Юнко, Хуанг Лиминг, Боэм Маркус Эф, Мурджани Маниша, Мартинборуг Эстер
Формула / Реферат
1. Соединение структурной формулы I-R или I-S или его фармацевтически приемлемая соль
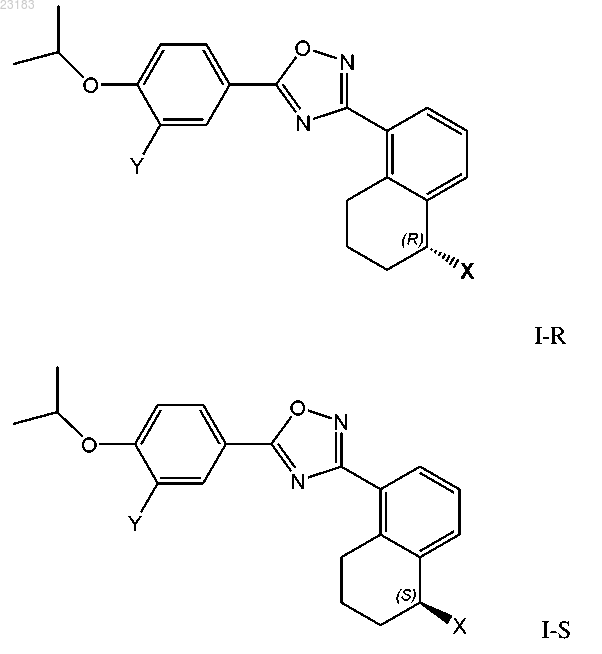
где X представляет собой -NR'R" или -OR'";
Y представляет собой -CN, -Cl, -CF3, I, -COOH или -COOR1;
R' представляет собой Н, C1-4алкил, н-гидрокси C1-4алкил, -SO2-R1 или -CO-R1;
R" представляет собой Н, -SO2-R3, C1-4алкил, необязательно замещенный одним 1-3 R2, или циклическую группу, необязательно замещенную R4, где такая циклическая группа представляет собой пиперидинил, циклогексил, морфолинил, тиазолил, пиразолил, пирролидинил, имидазолил или фенил;
или R' и R" вместе с атомом азота, с которым они связаны, образуют 4-, 5- или 6-членное насыщенное гетероциклическое кольцо, содержащее 0 или 1 дополнительных гетероатома, где такой дополнительный гетероатом представляет собой О или N, где такой гетероцикл необязательно замещен заместителями, независимо выбранными из группы, состоящей из -ОН, оксо, -NH2, н-гидрокси-C1-4алкила, -СООН, -(CH2)m-COOH, -(CH2)m-COOR1, -N(R1R1) и -(CH2)m-CO-N(R5R5);
R'" представляет собой Н, C1-4алкил или -CO-R1;
каждый R1 независимо представляет собой C1-4алкил или Н;
каждый R2 независимо представляет собой Н, галоген, ОН, оксо, =NH, NH2, -COOH, F, -NHR1, -N(R5R5), -SO2-R1, -SO2-N(R5R5), -N(R1)-SO2-R1, -COOR1, -OCO-R1, -CO-N(R5R5), -N(R1)-COR1, C1-3алкил, C1-3алкокси и циклическую группу, необязательно замещенную R4, где такая циклическая группа представляет собой пиперазинил, пиперидинил, морфолинил, пирролидинил, пиразолил, имидазолил, бензимидазолил, азетидинил, циклобутинил или фенил;
каждый R3 независимо представляет собой R2, C1-4алкил, С3-6циклоалкил или C1-4алкил, необязательно замещенный 1-3 R2;
каждый R4 независимо представляет собой галоген, ОН, -NH2, -NHR1, -N(R1R1), -COOH, -COOR1, -NHCO-R1; каждый R5 независимо представляет собой C1-4алкил или Н, или два R5 вместе с атомом азота, с которым они связаны, образуют 4-, 5- или 6-членное насыщенное гетероциклическое кольцо, содержащее 0 или 1 дополнительных гетероатома, где такой дополнительный гетероатом представляет собой О или N, где такой гетероцикл необязательно замещен-ОН, -NH2, -N(R1R1), н-гидрокси C1-4алкилом, -(CH2)m-COOH, -(CH2)m-COOR1; и
каждый m независимо обозначает 0, 1, 2 или 3.
2. Соединение по п.1, где соединение, по существу, является энантиомерно чистым.
3. Соединение по пп.1 и 2, где X представляет собой -NR'R".
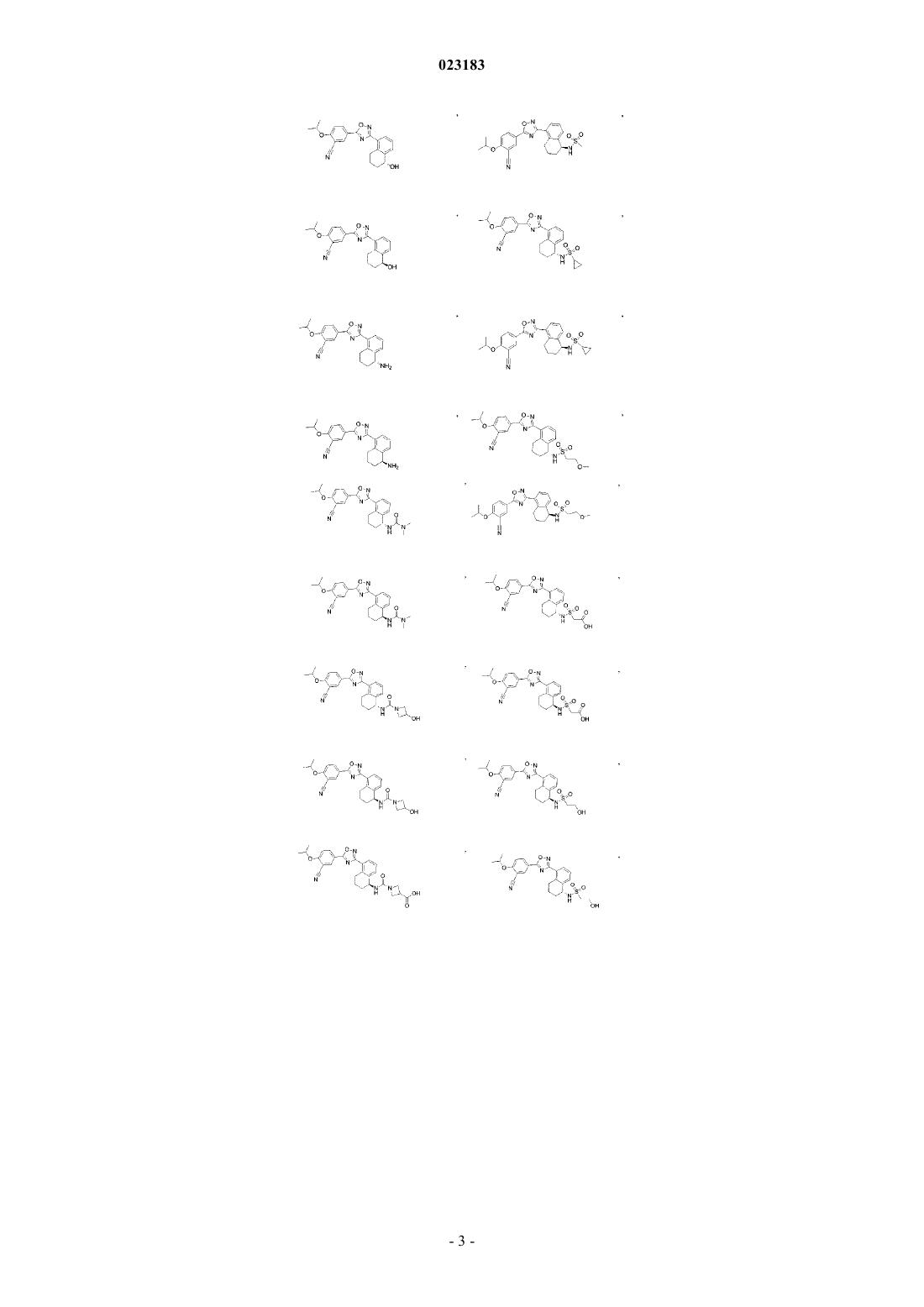
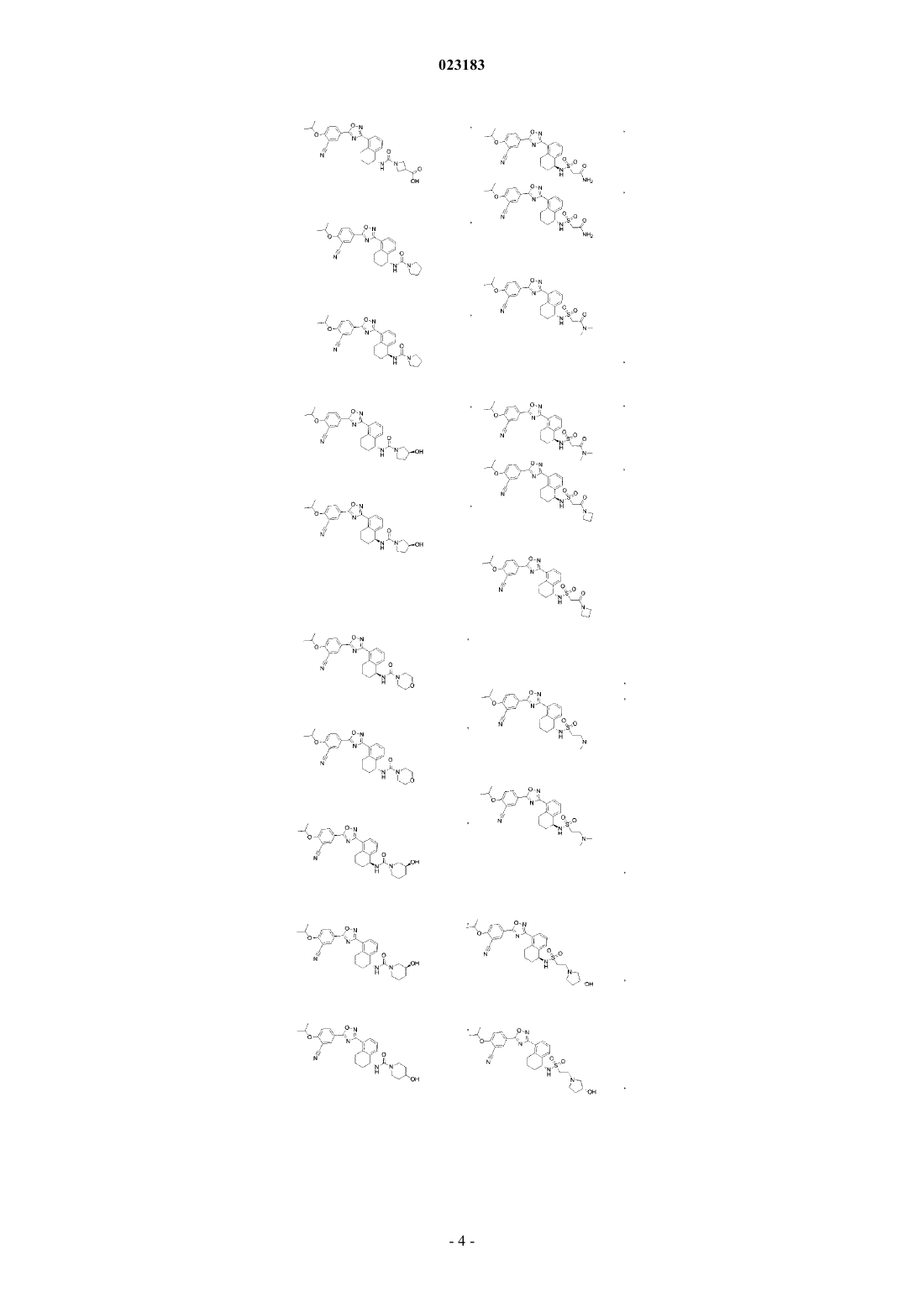
4. Соединение по пп.1 и 2, где соединение выбрано из соединений 1-55
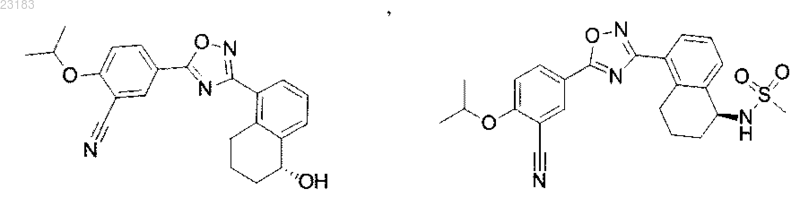
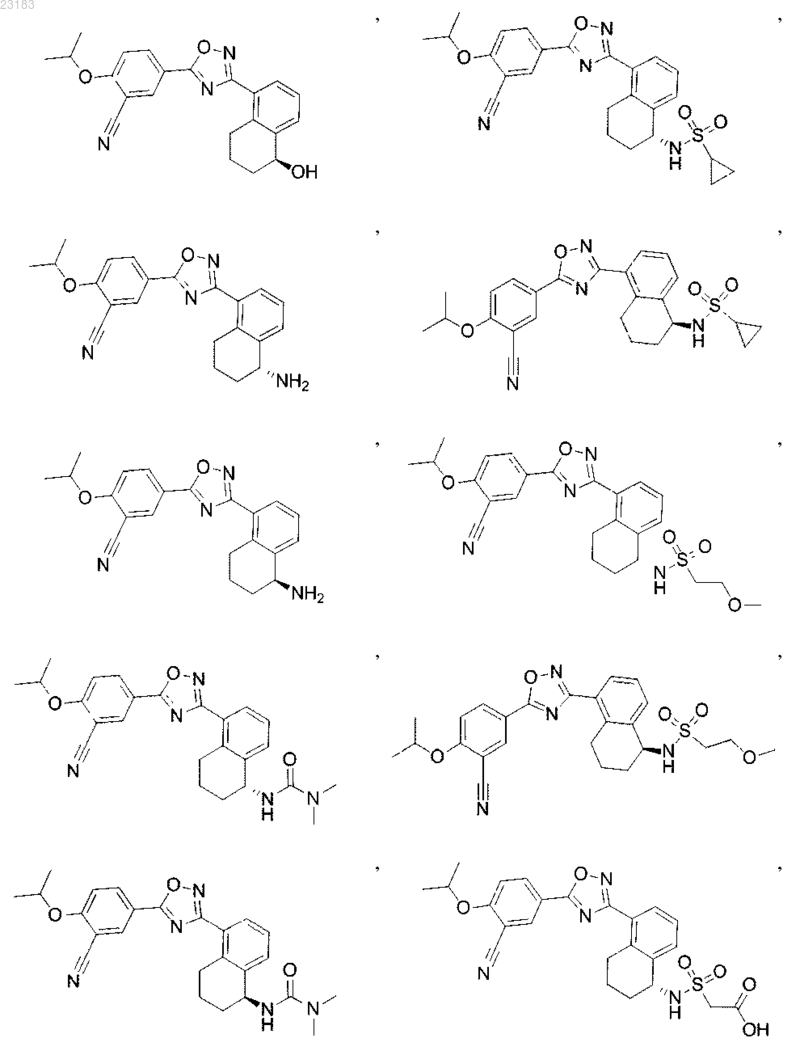
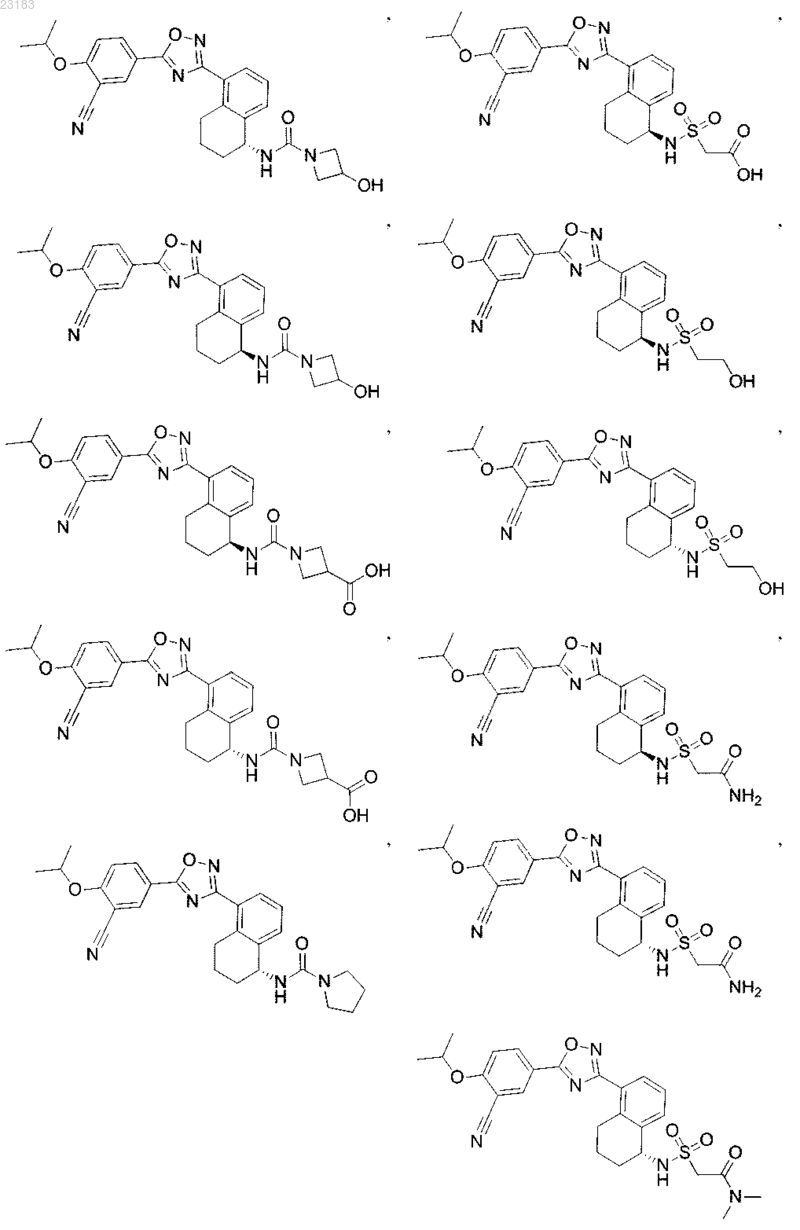
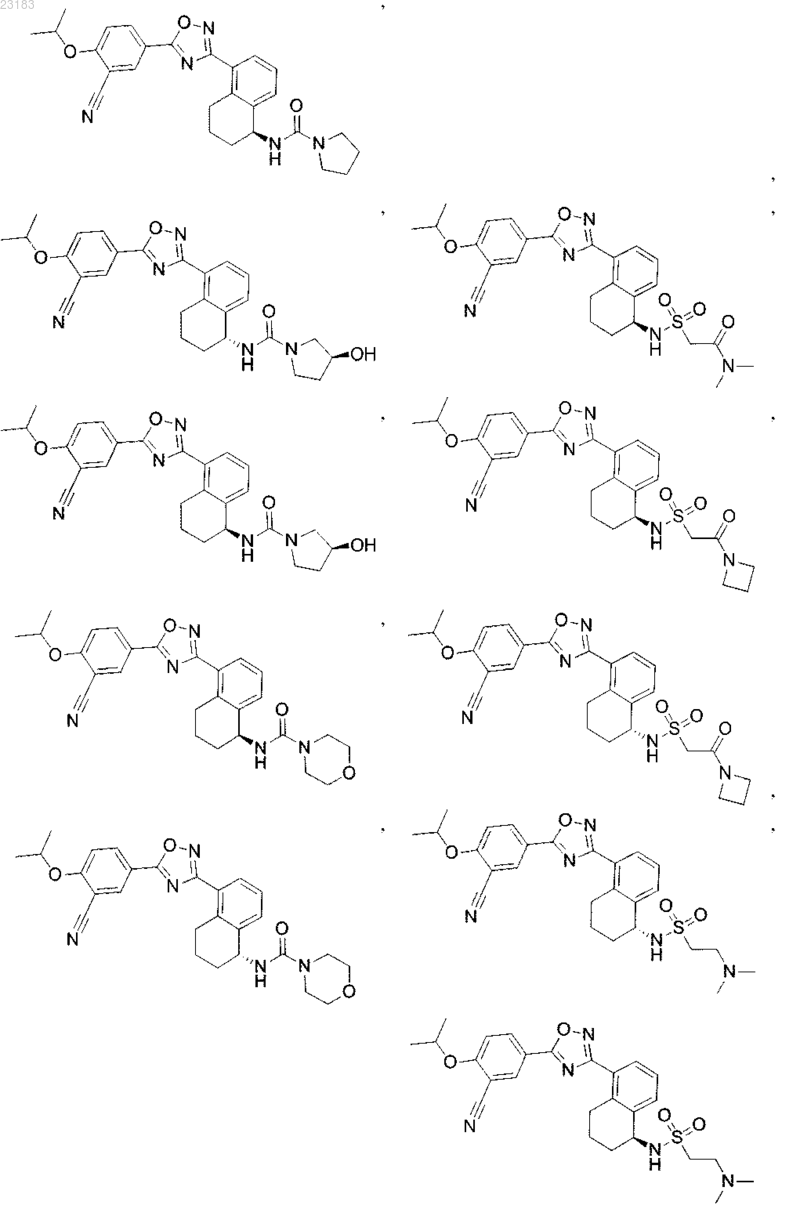
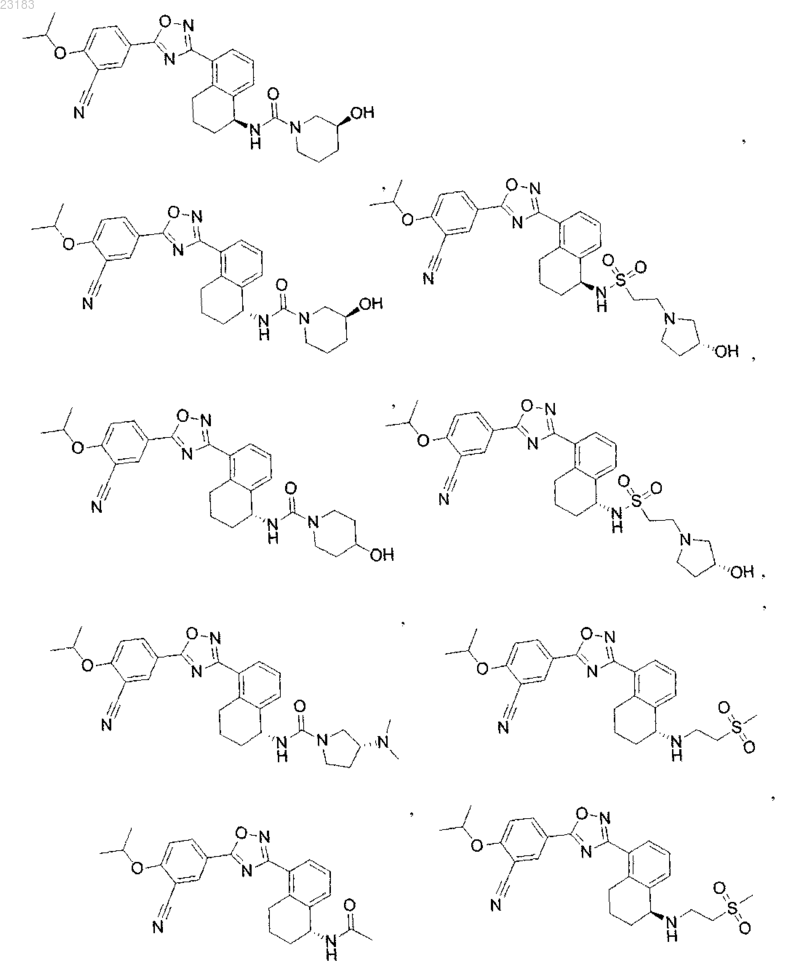
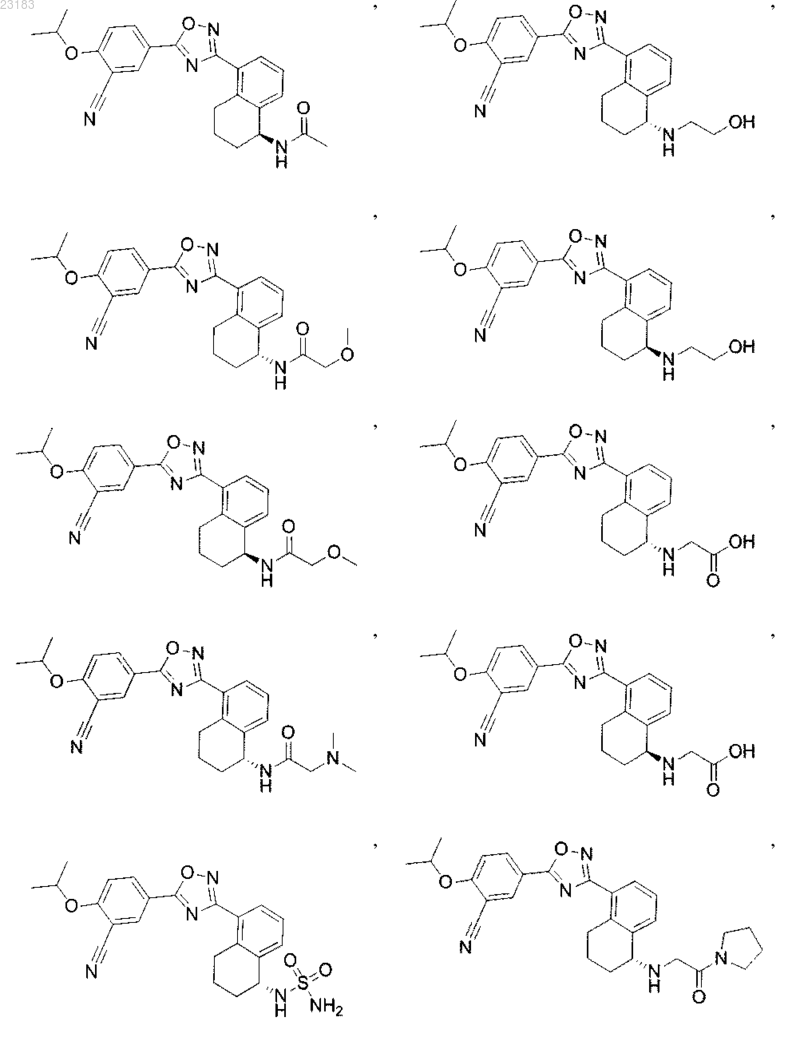

или его фармацевтически приемлемая соль.
5. Применение соединения по любому из пп.1-4 для изготовления лекарственного средства, предназначенного для лечения язвенного колита, гриппа или болезни Крона.
Текст
В изобретении представлено соединение структурной формулы I-R или I-S или его фармацевтически приемлемая соль где переменные являются такими, как определено в описании. Указанное соединение селективно модулирует рецептор сфингозин-1-фосфата, включая соединение, которое модулирует подтип 1 рецептора SIP. Описано применение указанного соединения для изготовления лекарственного средства, предназначенного для лечения язвенного колита, гриппа или болезни Крона. Перекрестные ссылки на родственные заявки Данная заявка является продолжением заявки US 61/261282, поданной 13.11.2009, и заявки US 61/262474, поданной 18.11.2009, описание которых сюда полностью включено. Область техники, к которой относится изобретение Настоящее изобретение относится к соединениям, которые являются агонистами рецептора сфингозин-1-фосфата подтипа 1, способам их получения и способам их терапевтического и/или профилактического применения. Уровень техники Рецептор S1P1/EDG1 представляет собой G-белоксвязанный рецептор (GPCR) и является членом семейства рецепторов гена дифференциации эндотелиальных клеток (ЭДГ). Эндогенные лиганды рецепторов ЭДГ включают лизофосфолипиды, такие как сфингозин-1-фосфат (S1P). Как и все GPCR, лигирование рецептора вызывает сигналы вторичного мессенджера через активацию G-белков (альфа, бета и гамма). Разработка низкомолекулярных агонистов и антагонистов S1P1 дала представление о некоторых физиологических ролях системы передачи сигнала рецептора S1P1/S1P. Агонизм рецептора S1P1 нарушает движение лимфоцитов, изолируя их в лимфатических узлах и других вторичных лимфоидных тканях. Это приводит к быстрой и обратимой лимфопении, и, вероятно, обусловлено лигированием рецептора как в лимфатических эндотелиальных клетках, так и в самих лимфоцитах (Rosen и др., Immunol. Rev.,2003, 195, c. 160-177). Клинически ценным следствием секвестрирования лимфоцитов является исключение их из проявлений воспалительных и/или аутоиммунных реакций в периферических тканях. Сообщалось также, что агонизм S1P1 способствует выживанию предшественников олигодендроцитов (Miron и др., Ann. Neurol., 2008, 63, c. 61-71). Эта активность в сочетании с секвестрированием лимфоцитов может быть полезна при лечении воспалительных и аутоиммунных заболеваний центральной нервной системы. Сущность изобретения Настоящее изобретение относится к гетероциклическим соединениям, подходящим для воздействия в качестве агонистов S1P рецептора подтипа 1, S1P1; способам получения и способам применения, таким как лечение злокачественностей, опосредованных активацией S1P1, или при медицинском показании активации S1P1. Некоторые варианты осуществления настоящего изобретения включают соединение структурной формулы I-R или I-S или его фармацевтически приемлемую соль, сложный эфир, пролекарство, гомолог,гидрат или сольватX может представлять собой -NR'R" или -OR'" и Y может представлять собой -CN, -Cl, -CF3, I,-COOH или -COOR1.R' может представлять собой Н, C1-4 алкил, н-гидрокси C1-4 алкил, -SO2-R1 или -CO-R1. R" может представлять собой Н, -SO2-R3, C1-4 алкил, необязательно замещенный 1-3 R2, или циклическую группу,необязательно замещенную R4, где такая циклическая группа представляет собой пиперидинил, циклогексил, морфолинил, пирролидинил, имидазолил или фенил. R'" может представлять собой Н, C1-4 алкил или -CO-R1. Альтернативно, R' и R" вместе с атомом азота, с которым они связаны, образуют 4-, 5- или 6 членное насыщенное гетероциклическое кольцо, содержащее 0 или 1 дополнительных гетероатома, где такой дополнительный гетероатом представляет собой О или N, где такой гетероцикл необязательно замещен заместителями, независимо выбранными из -ОН, оксогруппы, -NH2, н-гидрокси-С 1-4 алкила,-СООН, -(CH2)m-COOH, -(CH2)m-COOR1, -N(R1R1) и -(CH2)m-CO-N(R5R5). Каждый R1 может независимо представлять собой C1-4 алкил или Н, и каждый R2 может независимо представлять собой Н, галоген, ОН, оксогруппу, =NH, NH2, -СООН, F, -NHR1, -N(R5R5),-SO2-R1, -SO2N(R5R5), -N(R1)-SO2-R1, -COOR1, -OCO-R1, -CO-N(R5R5), -N(R1)-COR1, C1-3 алкил, C1-3 алкоксигруппу и циклическую группу, необязательно замещенную R4, где такая циклическая группа представляет собой пиперазинил, пиперидинил, морфолинил, пирролидинил, пиразолил, имидазолил, бензимидазолил, азетидинил, циклобутинил или фенил. Каждый R3 может независимо представлять собой R2, C1-4 алкил, С 3-6 циклоалкил или C1-4 алкил, необязательно замещенный 1 или несколькими R2; и каждый R4 может независимо представлять собой га-1 023183 логен, ОН, -NH2, -NHR1, -N(R1R1), -СООН, -COOR1, -NHCO-R1. Каждый R5 может независимо представлять собой C1-4 алкил или Н, или альтернативно, два R5 вместе с атомом азота, с которым они связаны,могут образовывать 4-, 5- или 6-членное насыщенное гетероциклическое кольцо, содержащее 0 или 1 дополнительных гетероатома, где такой дополнительный гетероатом представляет собой О или N, где такой гетероцикл необязательно замещен-ОН, -NH2, -N(R1R1), н-гидрокси C1-4 алкилом, -(CH2)m-COOH, (CH2)m-COOR1. Каждый m независимо обозначает 0, 1, 2 или 3. Подробное описание изобретения Некоторые варианты осуществления настоящего изобретения включают соединение структурной формулы I-R или I-S или его фармацевтически приемлемую соль, сложный эфир, пролекарство, гомолог,гидрат или сольватX может представлять собой -NR'R" или -OR'", и Y может представлять собой -CN, -Cl, -CF3, I,-СООН или -COOR1. R' может представлять собой Н, C1-4 алкил, н-гидрокси C1-4 алкил, -SO2-R1 или -COR1. R" может представлять собой Н, -SO2-R3, С 1-4 алкил, необязательно замещенный 1 или несколькимиR2, или циклическую группу, необязательно замещенную R4, где такая циклическая группа представляет собой пиперидинил, циклогексил, морфолинил, пирролидинил, имидазолил или фенил. R'" может представлять собой Н, C1-4 алкил или -CO-R1. Альтернативно, R' и R" вместе с атомом азота, с которым они связаны, образуют 4-, 5- или 6-членное насыщенное гетероциклическое кольцо, содержащее 0 или 1 дополнительных гетероатома, где такой дополнительный гетероатом представляет собой О или N, где такой гетероцикл необязательно один или несколько раз замещен заместителями, независимо выбранными из -ОН, оксогруппы, -NH2, н-гидрокси-C1-4 алкила, -СООН, -(CH2)m-COOH, -(CH2)m-COOR1, -N(R1R1) и (CH2)m-CO-N(R5R5). Каждый R1 может независимо представлять собой C1-4 алкил или Н, и каждый R2 может независимо представлять собой Н, галоген, ОН, оксогруппу, =NH, NH2, -СООН, F, -NHR1, -N(R5R5),-SO2- R1, -SO2N(R5R5), -N(R1)-SO2-R1, -COOR1, -OCO-R1, -CO-N(R5R5), -N(R1)-COR1, C1-3 алкил, C1-3 алкоксигруппу и циклическую группу, необязательно замещенную R4, где такая циклическая группа представляет собой пиперазинил, пиперидинил, морфолинил, пирролидинил, пиразолил, тиазолил, имидазолил, бензимидазолил, азетидинил, циклобутинил или фенил. Каждый R3 может независимо представлять собой R2, C1-4 алкил, С 3-6 циклоалкил или C1-4 алкил, необязательно замещенный 1 или несколькими R2; и каждый R4 может независимо представлять собой галоген, ОН, -NH2, -NHR1, -N(R1R1), -СООН, -COOR1, -NHCO-R1. Каждый R5 может независимо представлять собой C1-4 алкил или Н, или альтернативно, два R5 вместе с атомом азота, с которым они связаны,могут образовывать 4-, 5- или 6-членное насыщенное гетероциклическое кольцо, содержащее 0 или 1 дополнительных гетероатома, где такой дополнительный гетероатом представляет собой О или N, где такой гетероцикл необязательно замещен-ОН, -NH2, -N(R1R1), н-гидрокси C1-4 алкилом, -(CH2)m-COOH, (CH2)m-COOR1. Каждый m независимо обозначает 0, 1, 2 или 3. В некоторых вариантах осуществления изобретение относится к соединениям, которые, по существу, являются энантиомерно чистыми. В некоторых вариантах осуществления настоящее изобретение относится к соединениям, где X представляет собой -NR'R. В некоторых вариантах осуществления настоящее изобретение относится к одному или нескольким соединениям 1-55: или любым их фармацевтически приемлемым солям. В некоторых вариантах осуществления описан способ применения соединения по изобретению для изготовления лекарственного средства. В других вариантах осуществления описан способ лечения злокачественности у пациента, которому медицински показана активация или агонизм рецептора сфингозин-1-фосфата подтипа 1, путем введения соединения по изобретению в эффективном количестве пациенту с частотой и длительностью, достаточной для обеспечения благоприятного воздействия на пациента, где медицински показана селективная активация или агонизм S1P подтипа 1 рецептора в отношении других подтипов рецептора S1P. В других вариантах осуществления описан способ лечения злокачественности у пациента, которому медицински показана активация или агонизм рецептора сфингозин-1-фосфата подтипа 1, путем введения соединения по изобретению в эффективном количестве пациенту с частотой и длительностью, достаточной для обеспечения благоприятного воздействия на пациента, где злокачественность включает грипп; болезнь Крона, неспецифический язвенный колит. В других вариантах осуществления злокачественность представляет собой одно или несколько состояний: болезнь Крона; язвенный колит, грипп. В других вариантах осуществления злокачественность представляет собой одно из состояний: грипп, язвенный колит. В некоторых вариантах осуществления описаны способы применения соединения по изобретению для изготовления лекарственного средства, подходящего для лечения нарушения или злокачественности, в ко-5 023183 торых медицински показана активация или ингибирование рецептора сфингозин-1-фосфата подтипа 1. Дополнительные стадии получения таких соединений могут подбираться для описанных здесь способов синтеза, включая перекристаллизацию и другие способы очистки. Как используется в описании и формуле изобретения, формы единственного числа включают множественные формы, если из контекста ясно не предполагается иное. Как используется здесь, "пациент" (в отношении лечения) означает млекопитающих и немлекопитающих. Млекопитающие включают, например, людей; нечеловекообразных приматов, например приматов и обезьян; крупный рогатый скот; лошадей; овец и коз. Немлекопитающие включают, например рыб и птиц. Используемый здесь термин "S1P1" относится к подтипу 1 рецептора сфингозин-1-фосфата, вто время как другие подтипы рецептора сфингозин-1-фосфата обозначены соответствующим образом, например рецептор сфингозин-1-фосфата подтипа 3 обозначен как "S1P3"."Рецептор", как хорошо известно в данной области, представляет собой биомолекулярную группу,обычно содержащую белок, который специфически связывает структурный класс лигандов или единичный нативный лиганд в живом организме, связывание с которыми заставляет рецептор преобразовывать связывающий сигнал в другой вид биологического действия, такой как сигнализация клетки, в которой произошло связывание, которой заставляет клетки изменять свою функцию в некоторой степени. Примером трансдукции является рецепторное связывание лиганда, вызывающее изменение активности "Gбелка" в цитоплазме живой клетки. Любая молекула, естественная или нет, что связывает рецептор и активирует его для передачи сигнала, называется "состязания" или "активатор". Любая молекула, природная или нет, которая связывается с рецептором, но не вызывает передачи сигнала, и которая может блокировать связывание агонистов и их последующую передачу сигнала, называется "антагонистом"."Соединение S1P1", или "агонист S1P1", или "активатор S1P1", или "ингибитор S1P1", или "антагонист S1P1" являются терминами, используемыми здесь для описанных соединений, которые взаимодействуют в некотором роде с рецептором S1P подтипа 1. Они могут быть агонистами или активаторами или они могут быть антагонистами или ингибиторами. "Соединение S1P1" по изобретению может обладать селективным действием на подтип 1 S1P рецепторного семейства, например соединение по изобретению может работать при более низкой концентрации в отношении подтипа 1 S1P рецепторного семейства по сравнению с другими подтипами S1P рецепторного семейства, в частности "соединение S1P1" по изобретению может селективно воздействовать на подтип 1 рецепторов по сравнению с их действием на подтип 3 или рецепторы "S1P3". В некоторых вариантах осуществления соединения по изобретению являются ортостатическими агонистами. В некоторых других вариантах осуществления соединения по изобретению являются аллостерическими агонистами. Агонисты рецептора могут быть классифицированы как ортостерические или аллостерические. Ортостерические агонисты связываются с сайтом рецептора, что существенно перекрывается со связыванием природного лиганда и повторяет ключевые взаимодействия рецептора с природным лигандом. Ортостерические агонисты активируют рецептор с помощью молекулярного механизма, похожего на природный лиганд, и будут конкурировать с природным лигандом, и будут конкурентно антагонизироваться фармакологическими средствами, которые являются конкурентными антагонистами для природного лиганда. Аллостерические агонисты связываются с сайтом рецептора, что вызывает некоторые существенные взаимодействия, которые не перекрываются частично или полностью естественным лигандом. Аллостерические агонисты являются истинными агонистами и не являются аллостерическими усилителями. Следовательно, они активируют сигнализацию рецептора отдельно и без необходимости субмаксимальной концентрации природного лиганда. Аллостерические агонисты могут быть идентифицированы, когда известно, что антагонист является конкурентоспособным относительно ортостерического лиганда, показывающего неконкурентный антагонизм. Сайт аллостерического агониста может отражаться на рецепторном мутагенезе. Введение точечных мутаций в рецепторы, которые сохраняют рецепторную активацию аллостерическим агонистом, тогда как ослабление или отмена передачи сигнала, индуцированного ортостерическим агонистом или наоборот, обеспечивает формальные доказательства различия во взаимодействиях связывания. Ортостерические агонисты могут дестабилизировать структуры и конформации GPCR, в то время как аллостерические агонистов могут стабилизировать или дестабилизировать структуры и конформации GPCR. Аллостерические агонисты, в силу их различных взаимодействий с рецептором, могут быть фармацевтически полезны, поскольку аллостерический сайт может предоставлять дополнительные возможности для активности агониста и селективности в соответствующем семействе подтипов рецептора, которые разделяют аналогичный ортостерический лиганд. Кроме того, аллостерический сайт может потребовать различные физико-химические свойства агонистов по сравнению с ортостерическим лигандом. Эти химико-физические свойства, в том числе гидрофобность, ароматичность, распределение заряда и растворимость, могут также обеспечивать преимущества при производстве агонистов различных профилей фармакокинетики, биодоступности, распределения и метаболизма, которые способствуют разработке эффективных фармацевтических веществ. Термин "по существу", как здесь используется, означает полностью или почти полностью, например, композиция, которая является "по существу свободной" от компонента, не содержит ни одного ком-6 023183 понента или содержит такое следовое количество, что любое соответствующее функциональное свойство композиции не зависит от присутствия следового количества, или если соединение является "по существу чистым", то присутствуют лишь незначительные следы примесей. По существу, энантиомерно чистый обозначает уровень энантиомерного обогащения одного энантиомера по отношению к другому энантиомеру по крайней мере 90, 95, 98, 99, 99,5 или 99,9%."Лечение" или "лечить" здесь относится к облегчению симптомов, связанных с расстройствами или заболеваниями, или ингибированию дальнейшего прогрессирования или ухудшения этих симптомов, или предупреждению, или профилактике заболевания или расстройства. Выражение "эффективное количество", когда используется для описания применения соединения по изобретению для обеспечения лечения пациентов, страдающих расстройствами или злокачественностями, опосредованными рецептором сфингозин-1-фосфата подтипа 1, относится к количеству соединения по изобретению, которое является эффективным для связывания в качестве агонистов или антагонистов рецептора S1P1 в тканях человека, где S1P1 участвует в нарушении, при котором такое связывание происходит на уровне, необходимом для обеспечения полезного терапевтического воздействия на пациента. Аналогично, как здесь используется, "эффективное количество" или "терапевтически эффективное количество" соединения по изобретению относится к количеству соединения, которое облегчает, в целом или в части, симптомы, связанные с нарушением или состоянием, или останавливает или замедляет дальнейшее прогрессирование или ухудшение этих симптомов, или препятствует или обеспечивает профилактику нарушения или состояния. В частности, "терапевтически эффективное количество" относится к количеству, эффективному при дозах и в течение определенного необходимого времени для достижения желаемого терапевтического результата, действуя как агонист активности рецептора сфингозин-1 фосфата подтипа 1 (S1P1). Терапевтически эффективное количество является также тем, при котором токсичные или вредные эффекты соединения по изобретению превышают терапевтически благоприятные эффекты. Например, в контексте лечения злокачественности, опосредованной активацией S1P1, терапевтически эффективное количество агониста S1P1 по изобретению представляет собой количество,достаточное для контроля злокачественностью, чтобы смягчить ход злокачественности, или для облегчения симптомов злокачественности. Примеры злокачественностей, которые могут быть излечены, включают рассеянный склероз, отторжение трансплантата, взрослый респираторный дистресс-синдром. Заболевания, нарушения и состояния, которые могут лечиться соединениями по изобретению,включают грипп, болезнь Крона, неспецифический язвенный колит. Кроме того, соединения из формулыI-R или I-S также полезны в комбинации с одним или несколькими иммунодепрессантами для лечения заболеваний, нарушений и состояний, связанных с активированной иммунной системой и выбранных из приведенного выше списка. В соответствии с предпочтительным вариантом осуществления изобретения указанные иммунодепрессанты выбраны из группы, включающей или состоящей из циклоспорина, даклизумаба, басиликсимаба, эверолимуса, такролимуса (FK 506), азатиопирена, лефлуномида, 15 дезоксиспергуалина или других иммунодепрессантов. Подразумеваются все хиральные, диастереомерные, рацемические формы структур, если специально не указана конкретная стереохимия или изомерная форма. Соединения, используемые в настоящем изобретении, могут включать обогащенные или разделенные оптические изомеры при любых или всех асимметричных атомах, как указано в изображении, в любой степени обогащения. Рацемическая и диастереомерная смеси, а также индивидуальные оптические изомеры могут быть синтезированы так, чтобы быть, по существу, свободными от их энантиомерных или диастереомерных партнеров, и все это включено в объем конкретных вариантов осуществления изобретения. Изомеры, полученные при наличии хирального центра, включают пары неналагаемых изомеров,которые называют "энантиомеры". Отдельные энантиомеры чистого соединения являются оптически активными, то есть они способны вращать плоскость поляризованного света. Отдельные энантиомеры обозначены в соответствии с системой Кана-Ингольда-Прелога. После определения приоритета в четырех группах молекулы ориентируют так, что группа с самой низкой степенью важности отворачивается от зрителя. Затем, если убывание степени важности других групп происходит по часовой стрелке, то молекулу обозначают (R), и если убывание степени важности других групп происходит против часовой стрелки, то молекулу обозначают (S). В примерах степень важности Кана-Ингольда-Прелога представлена как АВCD. Атом с самой низкой степенью важности D ориентирован от зрителя."Выделенный оптический изомер" обозначает соединение, которое было, по существу, очищено от соответствующего оптического изомера (изомеров) той же формулы. Предпочтительно выделенные изомеры имеют чистоту по крайней мере около 80 вес.%, более предпочтительно по крайней мере 90 вес.%,еще более предпочтительно по крайней мере 98 вес.%, наиболее предпочтительно по крайней мере около 99 вес.%. Поворотная изомерия. Понятно, что вследствие химических свойств (например, резонансное придание некоторого характера двойной связи C-N) ограниченного вращения вокруг амидной связи (как показано ниже), можно наблюдать отдельные виды ротамера, и даже при определенных обстоятельствах выделить такие виды,пример показан ниже. Далее ясно, что определенные структурные элементы, включая пространственные или объемные заместители на атоме азота амида, могут повысить стабильность ротамера до такой степени, что соединение может быть выделено и существовать независимо как отдельный стабильный ротамер. Настоящее изобретение, следовательно, включает любые возможные стабильные ротамеры соединений по изобретению, которые являются биологически активными при лечении заболевания, нарушения или состояния, при котором соединение по изобретению может быть эффективно, как здесь описано. Региоизомерия. Предпочтительно соединения настоящего изобретения имеют особое пространственное расположение заместителей в ароматических кольцах, что связано с взаимосвязью структуры и активности, демонстрируемой классом соединения. Часто такой механизм замещения обозначается системой нумерации,однако система нумерации часто не согласуется с различными циклическими системами. В шестичленных ароматических системах пространственные расположения определяются общей номенклатурой "пара" для 1,4-замещения, "мета" для 1,3-замещения и "орто" для 1,2-замещения, как показано ниже. Все структуры, входящие в объем формулы изобретения, являются "химически осуществимыми",это подразумевает, что структуры, приведенные в любых комбинациях или субкомбинациях необязательных заместителей, перечисленных в формуле изобретения, физически способны существовать, по крайней мере, с некоторой стабильностью, что может быть определено законами структурной химии и экспериментами. Структуры, которые являются химически неприемлемыми, не входят в объем заявляемых соединений. Обычно "замещенный" обозначает органическую группу, как здесь определено, в которой одна или несколько содержащихся связей с атомом водорода замещены одной или несколькими связями с атомом,отличными от водорода, таким как, но не ограничиваясь ими, галоген (то есть F, Cl, Br и I); атом кислорода в группах, таких как гидроксильные группы, алкоксигруппы, арилоксигруппы, аралкилоксигруппы,оксо(карбонил)группы, карбоксильные группы, включая карбоновые кислоты, карбоксилаты и эфиры карбоксилатов; атом серы в группах, таких как тиольные группы, алкильные и арилсульфидные группы,сульфоксидные группы, сульфоновые группы, сульфонильные группы и сульфонамидные группы; атом азота в группах, таких как амины, гидроксиламины, нитрилы, нитрогруппы, N-оксиды, гидразиды, азиды и енамины; и другие гетероатомы в различных других группах. Неограничивающие примеры заместителей, которые могут быть связаны с замещенным атомом углерода (или другим атомом), включают F, Cl,Br, I, OR', OC(O)N(R')2, CN, CF3, OCF3, R', О, S, C(O), S(O), метилендиокси, этилендиокси, N(R')2, SR',SOR', SO2R', SO2N(R')2, SO3R, C(O)R', C(O)C(O)R', C(O)CH2C(O)R', C(S)R, C(O)OR', OC(O)R', C(O)N(R')2,OC(O)N(R')2, C(S)N(R')2, (CH2)0-2NHC(O)R', (CH2)0-2N(R')N(R')2, N(R')N(R')C(O)R', N(R')N(R')C(O)OR',N(R')N(R')CON(R')2,N(R')SO2R',N(R')SO2N(R')2,N(R')C(O)OR',N(R')C(O)R',N(R')C(S)R',N(R')C(O)N(R')2, N(R')C(S)N(R')2, N(COR')COR, N(OR')R', C(=NH)N(R')2, C(O)N(OR')R' или C(=NOR')R',где R' может представлять собой водород или углеродсодержащую группу, и где углеродсодержащая группа сама может быть замещена. Замещенные алкильные, алкенильные, алкинильные, циклоалкильные и циклоалкенильные группы,а также другие замещенные группы также включают группы, в которых одна или несколько связей с атомом водорода замещены одной или несколькими связями, включая двойные или тройные связи, с атомом углерода или с гетероатомом, таким как, но не ограничиваясь ими, кислород в группах карбонила(оксо), карбоксила, сложного эфира, амида, имида, уретана и мочевины; и азот в иминах, гидроксииминах, оксимах, гидразонах, амидинах, гуанидинах и нитрилах. Заместители замещенных групп далее могут быть замещены алкильными, алкенильными, циклоалкильными, арильными, гетероарильными и алкинильными группами, как здесь определено, которые сами могут быть замещены. Например, C1-4 алкильная группа может быть замещена амидом, и амид может быть далее замещен другим C1-4 алкилом,который может быть замещен. Замещенные циклические группы, такие как замещенные арильные, гетероциклильные и гетероарильные группы также включают кольца и конденсированные циклические системы, в которых связь с атомом водорода замещена связью с атомом углерода. Следовательно, замещенные арильные, гетероциклильные и гетероарильные группы также могут быть замещены алкильными, алкенильными, циклоалкильными, арильными, гетероарильными и алкинильными группами, как здесь определено, которые сами могут быть замещены. Термин "гетероатомы", как здесь используется, обозначает атомы, отличные от углерода и водорода, способные образовывать ковалентные связи с углеродом, и не ограничены иным образом. Обычными гетероатомами являются N, О и S. Когда описан атом (S), подразумевается, что сера может присутствовать в любой степени окисления, в которой она обнаружена, включая сульфоксиды (R-S(O)-R') и сульфоны (R-S(O)2-R'), если конкретно не указана степень окисления; так, термин "сульфон" включает только сульфоновую форму серы; термин "сульфид" включает только сульфидную (R-S- R') форму серы. Когда используется фраза "гетероатомы, выбранные из группы, состоящей из О, NH, NR' и S," или "[вариант]представляет собой О,S", подразумевается включение всех сульфидных, сульфоксидных и сульфоновых степеней окисления серы. Алкильные группы включают линейные и разветвленные алкильные группы и циклоалкильные группы, содержащие от 1 до около 20 атомов углерода (С 1-20 алкил), и обычно от 1 до 12 атомов углерода(C1-12 алкил), или в некоторых вариантах осуществления от 1 до 8 атомов углерода (C1-8 алкил), или в некоторых вариантах осуществления от 1 до 4 атомов углерода (C1-4 алкил), или в некоторых вариантах осуществления от 1 до 3 атомов углерода (C1-3 алкил). Примеры линейных алкильных групп включают,но не ограничиваются ими, метил, этил, н-пропил, н-бутил, н-пентил, н-гексил, н-гептил и н-октил. Примеры разветвленных алкильных групп включают, но не ограничиваются ими, изопропил, изо-бутил,втор-бутил, трет-бутил, неопентил, изопентил и 2,2-диметилпропил. Некоторые замещенные алкильные группы могут быть замещены один или несколько раз любыми группами, представленными выше, например аминогруппами, гидроксигруппами, цианогруппами, карбоксигруппами, нитрогруппами, тиогруппами, алкоксигруппами и группами галогена. Группа "н-гидрокси C1-4 алкил" представляет собойC1-4 алкил, замещенный терминальной гидроксигруппой. Циклоалкильные группы представляют собой алкильные группы, образующие кольцевые структуры, которые могут быть замещенными или незамещенными. Примеры циклоалкила включают, но не ограничиваются ими, циклопропильную, циклобутильную, циклопентильную, циклогексильную, циклогептильную и циклооктильную группу. В некоторых вариантах осуществления циклоалкил содержит от 3 до 8 членов в кольце, тогда как в других вариантах осуществления количество атомов углерода в кольце составляет от 3 до 5, от 3 до 6, или от 3 до 7. Циклоалкильные группы также включают полициклические циклоалкильные группы, такие как, но не ограничиваясь ими, норборнил, адамантил, борнил, камфенил, изокамфенил и каренил, и конденсированные кольца, такие как, но не ограничиваясь ими, декалинил и им подобные. Циклоалкильные группы также включают кольца, которые замещены линейными или разветвленными алкильными группами, как определено выше. Примерные замещенные циклоалкильные группы могут быть монозамещенными или замещены более одного раза, такие как, но не ограничиваясь ими, 2,2-, 2,3-, 2,4- 2,5- или 2,6-дизамещенные циклогексильные группы или моно-, ди- или тризамещенные норборнильные или циклогептильные группы, которые могут быть замещены, например,аминогруппами, гидроксигруппами, цианогруппами, карбоксигруппами, нитрогруппами, тиогруппами,алкоксигруппами и группами галогена. Термины "карбоциклил" и "карбоцикл" обозначают циклические структуры, в которых атомами кольца являются атомы углерода. В таких вариантах осуществления карбоцикл содержит от 3 до 8 членов в кольце, тогда как в других вариантах осуществления количество атомов углерода в кольце составляет 4, 5, 6 или 7. Если конкретно не указано иное, карбоциклическое кольцо может быть замещено N заместителями, где N обозначает размер карбоциклического кольца, например аминогруппами, гидроксигруппами, цианогруппами, карбоксигруппами, нитрогруппами, тиогруппами, алкоксигруппами и группами галогена.(Циклоалкил)алкильные группы, также обозначающие циклоалкилалкил, представляют собой алкильные группы как определено выше, в которых водородная или углеродная связь алкильной группы замещена связью с циклоалкильной группой, как определено выше. Алкенильные группы включают линейные и разветвленные и циклические алкильные группы, как определено выше, за исключением того, что существует по крайней мере одна двойная связь между двумя атомами углерода. Так, алкенильные группы содержат от 2 до около 20 атомов углерода и обычно от 2 до 12 атомов углерода или в некоторых вариантах осуществления от 2 до 8 атомов углерода. Примеры среди прочих включают, но не ограничиваются ими, -СН=СН(СН 3), -СН=С(СН 3)2, -С(СН 3)=СН 2,-С(СН 3)=СН(СН 3), -С(СН 2 СН 3)=СН 2, винил, циклогексенил, циклопентенил, циклогексадиенил, бутадиенил, пентадиенил и гексадиенил. Термин "циклоалкенил" отдельно или в комбинации обозначает циклическую алкенильную группу,где присутствует по крайней мере одна двойная связь в кольцевой структуре. Циклоалкенильные группы включают циклоалкильные группы, содержащие по крайней мере одну двойную связь между двумя соседними атомами углерода. Так, например, циклоалкенильные группы включают, но не ограничиваются ими, циклогексенил, циклопентенил и циклогексадиенил.(Циклоалкенил)алкильные группы представляют собой алкильные группы, как определено выше, в которых водородная или углеродная связь алкильной группы замещена связью с циклоалкенильной группой, как определено выше. Алкинильные группы включают линейные и разветвленные алкильные группы, за исключением того, что существует по крайней мере одна тройная связь между двумя атомами углерода. Так, алкинильные группы содержат от 2 до около 20 атомов углерода и обычно от 2 до 12 атомов углерода или в некоторых вариантах осуществления от 2 до 8 атомов углерода. Примеры среди прочих включают, но не ограничиваются ими,-CСН,-CС(СН 3),-CС(СН 2 СН 3),-CH2CСН,-CH2CС(СН 3) и-CH2CС(СН 2 СН 3). Арильные группы представляют собой циклические ароматические углеводороды, которые не содержат гетероатомов. Такие арильные группы включают, но не ограничиваются ими, фенил, азуленил,гепталенил, бифенил, индаценил, флуоренил, фенантренил, трифениленил, пиренил, нафтаценил, хризенил, бифениленил, антраценил и нафтил. В некоторых вариантах осуществления арильные группы содержат 6-14 атомов углерода в кольцевой части групп. Фраза "арильные группы" включает группы, содержащие конденсированные кольца, такие как конденсированные ароматически-алифатические циклические системы (например, инданил, тетрагидронафтил и им подобные), а также включает замещенные арильные группы, которые содержат другие группы, включая, но не ограничиваясь ими, алкил, галоген,амино, гидрокси, циано, карбокси, нитро, тио или алкоксигруппы, связанные с одним из кольцевых атомов. Примерные замещенные арильные группы могут быть монозамещенными или замещены более одного раза, такие как, но не ограничиваясь ими, 2-, 3-, 4-, 5- или 6-замещенные фенильные или нафтильные группы, которые могут быть замещены группами, включая, но не ограничиваясь ими, перечисленные выше группы. Аралкильные группы представляют собой алкильные группы, как определено выше, в которых водородная или углеродная связь алкильной группы замещена связью с арильной группой, как определено выше. Примерные аралкильные группы включают бензильные и фенилэтильные группы и конденсированные (циклоалкиларил)алкильные группы, такие как 4-этилинданил. Арильная группа или алкильная группа или они обе необязательно замещены другими группами, включая, но не ограничиваясь ими, алкил, галоген, амино, гидрокси, циано, карбокси, нитро, тио или алкоксигруппы. Аралкенильная группа представляет собой алкенильные группы, как определено выше, в которых водородная или углеродная связь алкильной группы замещена связью с арильной группой, как определено выше. Гетероциклические группы включают ароматические и неароматические циклические соединения(гетероциклические кольца), содержащие 3 или более членов в кольце, из которых один или несколько представляют собой гетероатомы, такие как, но не ограничиваясь ими, N, О, S или Р. В некоторых вариантах осуществления гетероциклические группы включают от 3 до 20 членов в кольце, тогда как другие такие группы содержат от 3 до 15 членов в кольце. По крайней мере одно кольцо содержит гетероатом,но каждое кольцо в полициклической системе должно содержать гетероатом. Например, диоксоланильная кольцевая и бенздиоксоланильная кольцевая система (метилендиоксифенильная кольцевая система) обе являются гетероциклическими группами в свете данных значений. Гетероциклическая группа, обозначенная как С 2-гетероциклил, может быть 5-членным кольцом с двумя атомами углерода и тремя гетероатомами, 6-членным кольцом с двумя атомами углерода и четырьмя гетероатомами и так далее. Аналогично, С 4-гетероциклилом может быть 5-членное кольцо с одним гетероатомом, 6-членное кольцо с двумя гетероатомами и так далее. Количество атомов углерода плюс количество гетероатомов должно равняться общему количеству атомов в кольце. Насыщенное гетероциклическое кольцо обозначает гетероциклическое кольцо, не содержащее ненасыщенных атомов углерода. Фраза "гетероциклическая группа" включает конденсированное кольцо, включая кольцо, содержащее конденсированные ароматические и неароматические группы. Фраза также включает полициклические кольцевые системы, содержащие гетероатом, такой как, но не ограничиваясь ими, хинуклидил, а также включает гетероциклильные группы, которые содержат заместители, включая, но не ограничиваясь ими, алкил, галоген, амино, гидрокси, циано, карбокси, нитро, тио или алкоксигруппы, связанные с одним из членов кольца. Гетероциклильная группа, как здесь определено, может быть гетероарильной группой или частично или полностью насыщенной циклической группой, включая по крайней мере один гетероатом в кольце. Гетероциклильные группы включают, но не ограничиваются ими, пирролидинил,фуранил, тетрагидрофуранил, диоксоланил, пиперидинил, пиперазинил, морфолинил, пирролил, пиразолил, триазолил, тетразолил, оксазолил, изоксазолил, тиазолил, пиридинил, тиофенил, бензотиофенил,бензофуранил, дигидробензофуранил, индолил, дигидроиндолил, азаиндолил, индазолил, бензимидазолил, азабензимидазолил, бензоксазолил, бензотиазолил, бензотиадиазолил, имидазопиридинил, изоксазолопиридинил, тианафталенил, пуринил, ксантинил, аденинил, гуанинил, хинолинил, изохинолинил,тетрагидрохинолинил, хиноксалинил и хиназолинил. Гетероциклильные группы могут быть замещены. Примерные замещенные гетероциклильные группы могут быть монозамещенными или замещены более одного раза, включая но не ограничиваясь ими, кольца, содержащие по крайней мере один гетероатом,который моно-, ди-, три-, тетра-, пента-, гекса- или выше замещен заместителями, такими как перечисленные выше заместители, включая, но не ограничиваясь ими, алкил, галоген, амино, гидрокси, циано,карбокси, нитро, тио и алкоксигруппы. Гетероарильные группы представляют собой ароматические циклические соединения, содержащие 5 или более членов в кольце, из которых один или несколько являются гетероатомами, такими как, но не ограничиваясь ими, N, О и S. Гетероарильная группа, обозначенная как С 2-гетероарил, может быть 5 членным кольцом с двумя атомами углерода и тремя гетероатомами, 6-членным кольцом с двумя атомами углерода и четырьмя гетероатомами и так далее. Аналогично, C4-гетероарил может представлять собой 5-членное кольцо с одним гетероатомом, 6-членное кольцо с двумя гетероатомами и так далее. Количество атомов углерода плюс количество гетероатомов должно быть равно общему количеству атомов в кольце. Гетероарильные группы включают, но не ограничиваются ими, группы, такие как пирролил,пиразолил, триазолил, тетразолил, оксазолил, изоксазолил, тиазолил, пиридинил, тиофенил, бензотиофенил, бензофуранил, индолил, азаиндолил, индазолил, бензимидазолил, азабензимидазолил, бензоксазолил, бензотиазолил, бензотиадиазолил, имидазопиридинил, изоксазолопиридинил, тианафталенил, пуринил, ксантинил, аденинил, гуанинил, хинолинил, изохинолинил, тетрагидрохинолинил, тетрагидроизохинолинил, хиноксалинил и хиназолинил. Термины "гетероарил" и "гетероарильные группы" включают конденсированные циклические соединения, в которых по крайней одно кольцо, но необязательно все кольца, являются ароматическими, включая тетрагидрохинолинил, тетрагидроизохинолинил, индолил и 2,3-дигидроиндолил. Термин также включает гетероарильные группы, которые содержат другие группы,связанные с одним из членов кольца, включая, но не ограничиваясь ими, алкил, галоген, амино, гидрокси, циано, карбокси, нитро, тио или алкоксигруппы. Примерные замещенные гетероарильные группы могут быть замещены один или несколько раз группами, такими как описанные выше. Дополнительные примеры арильных и гетероарильных групп включают, но не ограничиваются ими, фенил, бифенил, инденил, нафтил (1-нафтил, 2-нафтил), N-гидрокситетразолил, Nгидрокситриазолил, N-гидроксиимидазолил, антраценил (1-антраценил, 2-антраценил, 3-антраценил),тиофенил (2-тиенил, 3-тиенил), фурил (2-фурил, 3-фурил), индолил, оксадиазолил, изоксазолил, хиназолинил, флуоренил, ксантенил, изоинданил, бензгидрил, акридинил, тиазолил, пирролил (2-пирролил),пиразолил (3-пиразолил), имидазолил (1-имидазолил, 2-имидазолил, 4-имидазолил, 5-имидазолил), триазолил (1,2,3-триазол-1-ил, 1,2,3-триазол-2-ил 1,2,3-триазол-4-ил, 1,2,4-триазол-3-ил), оксазолил (2 оксазолил, 4-оксазолил, 5-оксазолил), тиазолил (2-тиазолил, 4-тиазолил, 5-тиазолил), пиридил (2 пиридил, 3-пиридил, 4-пиридил), пиримидинил (2-пиримидинил, 4-пиримидинил, 5-пиримидинил, 6 пиримидинил), пиразинил, пиридазинил (3- пиридазинил, 4-пиридазинил, 5-пиридазинил), хинолил (2 хинолил, 3-хинолил, 4-хинолил, 5-хинолил, 6-хинолил, 7-хинолил, 8-хинолил), изохинолил (1 изохинолил, 3-изохинолил, 4-изохинолил, 5-изохинолил, 6-изохинолил, 7-изохинолил, 8-изохинолил),бензо[b]фуранил (2-бензо[b]фуранил, 3-бензо[b]фуранил, 4-бензо[b]фуранил, 5-бензо[b]фуранил, 6 бензо[b]фуранил, 7-бензо[b]фуранил, 2,3-дигидробензо[b]фуранил (2-(2,3-дигидробензо[b]фуранил), 3(2,3-дигидробензо[b]фуранил), 4-(2,3-дигидробензо[b]фуранил), 5-(2,3-дигидробензо[b]фуранил), 6-(2,3 дигидробензо[b]фуранил), 7-(2,3-дигидробензо[b]фуранил, бензо[b]тиофенил (2-бензо[b]тиофенил, 3 бензо[b]тиофенил, 4-бензо[b]тиофенил, 5-бензо[b]тиофенил, 6-бензо[b]тиофенил, 7-бензо[b]тиофенил),2,3-дигидробензо[b]тиофенил (2-(2,3-дигидробензо[b]тиофенил), 3-(2,3-дигидробензо[b]тиофенил), 4(2,3-дигидробензо[b]тиофенил), 5-(2,3-дигидробензо[b]тиофенил), 6-(2,3-дигидробензо[b]тиофенил), 7(2,3-дигидробензо[b]тиофенил, индолил (1-индолил, 2-индолил, 3-индолил, 4-индолил, 5-индолил, 6 индолил, 7-индолил), индазол (1-индазолил, 3-индазолил, 4-индазолил, 5-индазолил, 6-индазолил, 7 индазолил),бензимидазолил(1-бензимидазолил,2-бензимидазолил,4-бензимидазолил,5 бензимидазолил, 6-бензимидазолил, 7-бензимидазолил, 8-бензимидазолил), бензоксазолил (1 бензоксазолил, 2-бензоксазолил), бензотиазолил (1-бензотиазолил, 2-бензотиазолил, 4-бензотиазолил, 5 бензотиазолил, 6-бензотиазолил, 7-бензотиазолил), карбазолил (1-карбазолил, 2-карбазолил, 3 карбазолил, 4-карбазолил), 5 Н-дибенз[b,f]азепин (5 Н-дибенз[b,f]азепин-1-ил, 5 Н-дибенз[b,f]азепин-2-ил,5 Н-дибенз[b,f]азепин-3-ил, 5 Н-дибенз[b,f]азепин-4-ил, 5 Н-дибенз[b,f]азепин-5-ил), 10,11-дигидро-5 Ндибенз[b,f]азепин (10,11-дигидро-5 Н-дибенз[b,f]азепин-1-ил, 10,11-дигидро-5 Н-дибенз[b,f]азепин-2-ил,10,11-дигидро-5 Н-дибенз[b,f]азепин-3-ил, 10,11-дигидро-5 Н-дибенз[b,f]азепин-4-ил, 10,11-дигидро-5 Ндибенз[b,f]азепин-5-ил) и им подобные. Гетероциклилалкильные группы представляют собой алкильные группы, как определено выше, в которых водородная или углеродная связь алкильной группы замещена связью с гетероциклильной группой, как определено выше. Примерные гетероциклилалкильные группы включают, но не ограничиваются ими, фуран-2-илметил, фуран-3-илметил, пиридин-2-илметил (-пиколил), пиридин-3-илметил(-пиколил), пиридин-4-илметил (-пиколил), тетрагидрофуран-2-илэтил и индол-2-илпропил. Гетероциклилалкильные группы могут быть замещены в гетероциклильной группе, алкильной группе или в обеих. Гетероарилалкильные группы представляют собой алкильные группы, как определено выше, в которых водородная или углеродная связь алкильной группы замещена связью с гетероарильной группой,как определено выше. Гетероарилалкильные группы могут быть замещены в гетероарильной группе, алкильной группе или обеих. Под "циклической системой" в качестве используемого здесь термина понимают группу, включающую одно, два, три или более колец, которые могут быть замещены нециклическими группами или дру- 11023183 гими циклическими системами или ими обеими, которая может быть полностью насыщенной, частично ненасыщенной, полностью ненасыщенной или ароматической, и когда кольцевая система включает более одного кольца, кольца могут быть конденсированы, связаны мостиковой связью или спироциклическими. Под "спироциклическими" понимают класс структур, где два кольца конденсированы при одном тетраэдральном атоме углерода, что хорошо известно из предшествующего уровня техники."Моноциклическое, бициклическое или полициклическое, ароматическое или частично ароматическое кольцо" в качестве используемого термина обозначает циклическую систему, включающую ненасыщенное кольцо, имеющее 4n+2 pi электронов, или его частично восстановленную (гидрированную) форму. Ароматическое или частично ароматическое кольцо может включать дополнительные конденсированные, мостиковые или спирокольца, которые сами не являются ароматическими или частично ароматическими. Например, нафталин и тетрагидронафталин оба являются "моноциклическим, бициклическим или полициклическим, ароматическим или частично ароматическим кольцом" в данных значениях. Также, например, бензо-[2.2.2]-бициклооктан также представляет собой "моноциклическое, бициклическое или полициклическое, ароматическое или частично ароматическое кольцо" в данных значениях,содержащее фенильное кольцо, конденсированное с мостиковой бициклической системой. Полностью насыщенное кольцо не содержит двойных связей и является карбоциклическим или гетероциклическим в зависимости от присутствия гетероатомов в данных значениях. Термин "алкокси" обозначает атом кислорода, связанный с алкильной группой, включая циклоалкильную группу, как определено выше. Примеры линейных алкоксигрупп включают, но не ограничиваются ими, метокси, этокси, н-пропокси, н-бутокси, н-пентилокси, н-гексилокси и им подобные. Примеры разветвленных алкоксигрупп включают, но не ограничиваются ими, изопропокси, втор-бутокси, третбутокси, изопентилокси, изогексилокси и им подобные. Примеры циклических алкоксигрупп включают,но не ограничиваются ими, циклопропилокси, циклобутилокси, циклопентилокси, циклогексилокси и им подобные. Термины "арилокси" и "арилалкокси" обозначают соответственно арильную группу, связанную с атомом кислорода, и аралкильную группу, связанную с атомом кислорода алкильной группы. Примеры включают, но не ограничиваются ими, фенокси, нафтилокси и бензилокси."Ацильная" группа в качестве используемого термина обозначает группу, содержащую карбонильную группу, где группа связана через карбонильный атом углерода. Карбонильный атом углерода также связан с другим атомом углерода, который может составлять часть алкила, арила, аралкилциклоалкила,циклоалкилалкила, гетероциклила, гетероциклилалкила, гетероарила, гетероарилалкила или им подобных. В конкретном случае, когда карбонильный атом углерода связан с атомом водорода, группа представляет собой "формильную" группу, ацильную группу в качестве определенного здесь термина. Ацильная группа может включать от 0 до около 12-20 дополнительных атомов углерода, связанных с карбонильной группой. Ацильная группа может включать двойные или тройные связи в приведенных значениях. Акрилоильная группа является примером ацильной группы. Ацильная группа также может включать гетероатомы в приведенных значениях. Никотиноильная группа (пиридил-3-карбонильная) группа является примером ацильной группы в приведенных значениях. Другие примеры включают ацетил, бензоил, фенилацетил, пиридилацетил, циннамоил и акрилоил и им подобные. Когда группа, содержащая атом углерода, который связан с карбонильным атомом углерода, содержит атом галогена, группа обозначается как "галогенацильная" группа. Примером является трифторацетильная группа. Термин "амин" включает первичные, вторичные и третичные амины, имеющие, например, формулуN(группа)3, где каждая группа независимо может представлять собой Н или группу, отличную от Н, такую как алкил, арил и им подобные. Амины включают, но не ограничиваются ими, RNH2, например алкиламины, ариламины, алкилариламины; R2NH, где каждый R выбирают независимо, такие как диалкиламины, диариламины, аралкиламины, гетероциклиламины и им подобные; и R3N, где каждый R выбирают независимо, такие как триалкиламины, диалкилариламины, алкилдиариламины, триариламины и им подобные. Термин "амин" также включает ионы аммония, как здесь используется."Аминогруппа" представляет собой заместитель формы -NH2, -NHR, -NR2, -NR3+, где каждый R выбирают независимо, и протонированные формы каждого. Соответственно любое соединение, замещенное аминогруппой, может рассматриваться как амин. Ион "аммония" включает незамещенный ион аммония NH4+, но если не указано иное, он также включает любые протонированные или кватернизированные формы аминов. Так, гидрохлорид триметиламмония и хлорид тетраметиламмония оба представляют собой ионы аммония и амины в приведенных значениях. Термин "амид" (или "амидо") включает С- и N-амидные группы, т.е. -C(O)N R'R", и -NR'C(O)R" группы соответственно. R' и R" в С-амиде могут быть связаны вместе с образованием гетероциклического кольца с атомом азота. Амидные группы, следовательно, включают, но не ограничиваются ими, карбамоильные группы (-C(O)NH2) и формамидные группы (-NHC(O)H). "Кабоксамидогруппа " представляет собой группу формулы C(O)NR2, где R может представлять собой Н, алкил, арил и т.д. Термин "уретан" (или "карбамил") включает N- и О-уретановые группы, т.е. -NRC(O)OR иSO2NR2 и -NRSO2R группы соответственно. Сульфонамидные группы следовательно включают, но не ограничиваются ими, сульфамоильные группы (-SO2NH2). Термин "амидин" или "амидино" включает группы формулы -C(NR)NR2. Обычно амидиногруппа представляет собой -C(NH)NH2. Термин "гуанидин" или "гуанидино" включает группы формулы -NRC(NR)NR2. Обычно гуанидиногруппа представляет собой -NHC(NH)NH2."Галоген," "гало" и "галид" включают фтор, хлор, бром и йод. Термины "включающий", "включая", "имеющий", "состоящий из" являются открытыми терминами,используемыми в настоящем документе, и не исключают наличия дополнительных элементов или компонентов. В заявленном элементе использование формы "включающий", "включая", "имеющий", "состоящий из" означает, что из какого бы элемента ни был он составлен, имеет, включает или состоит, он необязательно представляет собой единственный элемент, охватываемый заявленным термином, который содержит это слово."Соль", как хорошо известно в данной области техники, включает органическое соединение, такое как карбоновая кислота, сульфокислота, или амин в ионной форме, в комбинации с противоионом. Например, кислоты в анионной форме могут образовывать соли с катионами, такими как катионы металла,например натрия, калия и им подобных; с солями аммония, такими как NH4+ или катионы различных аминов, в том числе тетраалкильные соли аммония, такие как тетраметиламмониевые и алкиламмониевые соли, такие как соли трометамина, или другие катионы, такие как триметилсульфоний и им подобные. "Фармацевтически приемлемая" или "фармакологически приемлемая" соль представляет собой соль, полученную из иона, который был одобрен для использования человеком, и, как правило, нетоксичную, такую как хлорид или натриевая соль. "Цвиттерион" является внутренней солью, такой, которая может быть получена в молекуле, которая имеет по крайней мере две ионизируемых группы: одну, образующую анион, а другую - катион, которые служат для уравновешивания друг друга. Например, аминокислоты, такие как глицин, могут существовать в цвиттерионной форме. "Цвиттерион" является солью в приведенном значении. Соединения настоящего изобретения могут присутствовать в форме солей. Термин "соли" включает дополнительные соли свободных кислот или свободных оснований, которые являются соединениями по изобретению. Соли могут быть "фармацевтически приемлемыми солями". Термин"фармацевтически приемлемая соль" относится к солям, которые обладают токсичностью в пределах,которые обеспечивают применимость для фармацевтического применения. Фармацевтически неприемлемые соли тем не менее могут обладать такими свойствами, как высокая кристалличность, которые находят применение при осуществлении настоящего изобретения, таких как, например, удобство в процессе синтеза, очистки или получения состава из соединений по изобретению. Подходящие фармацевтически приемлемые соли кислот могут быть получены из неорганических кислот или из органических кислот. Примерами неорганических кислот являются соляная, бромистоводородная, йодисто-водородная, азотная, угольная, серная и фосфорная кислоты. Соответствующие органические кислоты могут быть выбраны из алифатических, циклоалифатических, ароматических,аралифатических, гетероциклических, карбоновых и сульфоновых классов органических кислот, примерами которых являются муравьиная, уксусная, пропионовая, янтарная, гликолевая, глюконовая, молочная, яблочная, винная, лимонная, аскорбиновая, глюкуроновая, малеиновая, фумаровая, пировиноградная, аспарагиновая, глутаминовая, бензойная, антраниловая, 4-гидроксибензойная, фенилуксусная, миндальная, эмбоновая (памовая), метансульфоновая, этансульфоновая, бензолсульфоновая, пантотеновая,трифторметансульфокислота, 2-гидроксиэтансульфоновая, n-толуолсульфокислота, сульфаниловая, циклогексиламиносульфоновая, стеариновая, альгиновая, -гидроксибутановая, салициловая, галактаровая и галактуроновая кислота. Примеры фармацевтически неприемлемых кислотных аддитивных солей включают, например, перхлораты и тетрафторбораты. Подходящие фармацевтически приемлемые основные аддитивные соли соединений по изобретению включают, например, соли с металлом, в том числе щелочным металлом, щелочно-земельным металлом, и соли переходных металлов, такие как, например, соли кальция, магния, калия, натрия и цинка. Фармацевтически приемлемые основные аддитивные соли также включают органические соли, полученные из основных аминов, таких как, например, N,N'-дибензилэтилендиамин, хлорпрокаин, холин, диэтаноламин, этилендиамин, меглумин (N-метилглюкамин) и новокаин. Примеры фармацевтически неприемлемых основных аддитивных солей включают соли лития и цианаты. Хотя фармацевтически неприемлемые соли обычно не являются полезными в качестве лекарственных средств, такие соли могут быть полезны, например, в качестве промежуточных соединений в синтезе соединений, например, для их очистки перекристаллизацией. Все эти соли могут быть получены с помощью традиционных средств из соответствующего соединения реакцией, например соответствующей кислоты или основания с соединением. Термин "фармацевтически приемлемые соли" относится к нетоксичным неорганическим или органическим кислотным и/или основным солям, см., например, Lit и др., Salt Selection for Basic Drugs, 1986, IntJ. Pharm., 33, c. 201-217, приведенной в качестве ссылки. Неограничивающие примеры возможных солей по изобретению включают, но не ограничиваются ими, гидрохлорид, цитрат, гликолат, фумарат, малат, тартрат, мезилат, эзилат, циннамат, изетионат,сульфат, фосфат, дифосфат, нитрат, гидробромид, гидроиодид, сукцинат, формиат, ацетат, дихлорацетат,лактат, п-толуолсульфонат, памитат, пидолат, памоат, салицилат, 4-аминосалицилат, бензоат, 4 ацетамидобензоат, глутамат, аспартат, гликолат, адипат, альгинат, аскорбат, безилат, камфорат, камфорсульфонат, камсилат, капрат, капроат, цикламат, лаурилсульфат, эдисилат, гентисат, галактарат, глуцептат, глюконат, глюкуронат, оксоглутарат, гиппурат, лактобионат, малонат, малеат, миндалат, напсилат,нападисилат, оксалат, олеат, себакат, стеарат, сукцинат, тиоцианат, ундециленат и ксинафоат. Любое соединение, которое может быть превращено in vivo в активный лекарственный препарат путем химических или биохимических превращений, функционирует в качестве пролекарства. Пролекарства заявленных соединений включены в объем настоящего изобретения. Некоторые примеры пролекарств в объеме настоящего изобретения включают:i. Если соединение содержит гидроксильную группу, гидроксильная группа может быть модифицирована с получением сложного эфира, карбоната или карбамата. Примеры включают ацетат, пивалат,метил- и этилкарбонаты и диметилкарбамат. Сложный эфир может быть получен из аминокислот, таких как глицин, серин или лизин.ii. Если соединение содержит аминогруппу, аминогруппа могут быть модифицирована с получением амида. Примеры включают ацетамид или производные с аминокислотами, такими как глицин, серин или лизин. Некоторые соединения по изобретению и их соли могут существовать в более чем одной кристаллической форме, и настоящее изобретение включает каждую кристаллическую форму и их смеси. Кроме того, соединения настоящего изобретения могут существовать в несольватированной, а также сольватированной формах с фармацевтически приемлемыми растворителями, такими как вода, образуя гидраты или аддукты со спиртами, такими как C1-4-спирты, и им подобные. Кроме того, соединения настоящего изобретения могут быть выделены в смеси с молекулами растворителя путем кристаллизации при выпаривании соответствующего растворителя. Такие растворители включают, но не ограничиваются ими,толуол, тетрагидрофуран, диоксан, диметилформамид, ацетонитрил, ацетат, такой как метилацетат, этилацетат, бутилацетат, изобутилацетат, пропил- и изопропилацетат, простые эфиры, такие как диэтиловый эфир и этиловый эфир, спирты, такие как метанол, этанол, 1 - или 2-бутанол, 1 - или 2-пропанол, пентанол, и диметилсульфоксид. Обычно изображение соединения структурой или наименованием подразумевает включение соединения в любой форме (например, само по себе, в виде гидрата, сольвата или в иной смеси). Кроме того, когда особенности или аспекты изобретения описаны в терминах групп Маркуша, специалистам в данной области понятно, что изобретение также описывается терминами отдельных членов или подгрупп членов группы Маркуша. Например, если X описывается как выбранный из группы, состоящей из брома, хлора и йода, притязания распространяются на X, представляющий собой бром, и наX, представляющий собой хлор и бром. Кроме того, когда особенности или аспекты изобретения описаны в терминах группы Маркуша, специалистам в данной области понятно, что изобретение также описывается в терминах любой комбинации отдельных членов или подгруппы членов группы Маркуша. Таким образом, например, если X описывается как выбранный из группы, состоящей из брома, хлора, и йода, иY выбран из группы, состоящей из метила, этила и пропила, подробно описаны притязания, где X представляет собой бром, и Y представляет собой метил. Композиции и комбинации для лечения Соединения S1P1, их фармацевтически приемлемые соли или гидролизуемые сложные эфиры настоящего изобретения могут объединяться с фармацевтически приемлемым носителем для получения фармацевтических композиций, полезных для лечения описанных здесь биологических состояний или нарушений у млекопитающего и более предпочтительно человека. Конкретный носитель, используемый в этих фармацевтических композициях, может изменяться в зависимости от типа нужного введения (например, внутривенного, перорального, местного, суппозиторного или парентерального). При получении композиций в пероральных жидких лекарственных формам (например, суспензии,эликсиры и растворы) могут использоваться обычные фармацевтические средства, такие как вода, гликоли, масла, спирты, ароматизаторы, консерванты, красители и им подобное. Кроме того, при получении пероральных твердых лекарственных форм (например, порошки, таблетки и капсулы) могут использоваться носители, такие как крахмалы, сахара, разбавители, гранулирующие агенты, смазывающие вещества, связующие, разрыхлители и им подобные. Другой аспект варианта осуществления по изобретению относится к композициям соединений по изобретению отдельно или в комбинации с другим ингибитором S1P1 или терапевтическим агентом другого типа или ими обоими. Как указано в настоящем документе, соединения по изобретению включают стереоизомеры, таутомеры, сольваты, гидраты, соли, в том числе фармацевтически приемлемые соли, и их смеси. Композиции, содержащие соединение по изобретению, могут быть получены обычными методами, например, как описано в книге The Science and Practice of Pharmacy, 19-e издание, 1995, включенной в качестве ссылки. Композиции могут присутствовать в обычных формах, например капсулах, таблетках, аэрозолях, растворах, суспензиях или составах местного применения. Типичные композиции включают соединение по изобретению и фармацевтически приемлемый эксципиент, которым может быть носитель или разбавитель. Например, активное соединение, как правило,смешивают с носителем, или разбавляют носителем, или заключают в носитель, который может присутствовать в виде ампул, капсул, саше, бумаги или других контейнеров. Когда активное соединение смешивают с носителем или когда носитель выступает разбавителем, он может быть твердым, полутвердым или жидким материалом, который выступает в качестве носителя, эксципиента или среды для активного соединения. Активное соединение может быть адсорбировано на гранулированном твердом носителе,например, содержащемся в саше. Некоторыми примерами подходящих носителей являются вода, растворы солей, спирты, полиэтиленгликоль, полигидроксиэтоксилированное касторовое масло, арахисовое масло, оливковое масло, желатин, лактоза, терра альба, сахароза, декстрин, карбонат магния, сахар, циклодекстрин, амилоза, стеарат магния, тальк, желатин, агар, пектин, камедь, стеариновая кислота или низшие алкильные эфиры целлюлозы, кремниевая кислота, жирные кислоты, амины жирных кислот, моноглицериды и диглицериды жирных кислот, пентаэритритовые эфиры жирных кислот, полиоксиэтилен,гидроксиметилцеллюлоза и поливинилпирролидон. Кроме того, носитель или разбавитель может включать любой материал замедленного высвобождения, известный в данной области, такой как глицерилмоностеарат или глицерилдистеарат, отдельно или в смеси с воском. Составы могут быть смешаны с добавками, которые не реагируют с активными соединениями. Такие добавки могут включать увлажняющие агенты, эмульгаторы и суспендирующие агенты, соль для регулирования осмотического давления, буферы и/или красители, консерванты, подсластители или ароматизаторы. При желании композиции можно стерилизовать. Способом введения может быть любой способ, который эффективно транспортирует активное соединение по изобретению, которое ингибирует активность фермента киназы фокальной адгезии, в соответствующий нужный сайт действия, такой как пероральный, назальный, легочный, буккальный, подкожный, внутрикожный, трансдермальный или парентеральный, например, ректальный, жировой, подкожный, внутривенный, внутриуретральный, внутримышечный, интраназальный, глазной раствор или мазь, причем пероральный путь является предпочтительным. Для парентерального введения носитель, как правило, включает стерильную воду, хотя также могут быть включены другие ингредиенты, которые облегчают растворимость или выступают в качестве консервантов. Кроме того, также могут быть получены инъекционные суспензии, и в этом случае могут использоваться соответствующие жидкие носители, суспендирующие агенты и тому подобные. Для местного введения соединения настоящего изобретения могут быть составлены с помощью мягких увлажняющих основ, таких как мази или кремы. Если для перорального введения используется твердый носитель, препарат может быть таблетирован, помещен в твердую желатиновую капсулу в виде порошка или гранул или он может присутствовать в форме пастилок или таблеток. Если используется жидкий носитель, препарат может присутствовать в виде сиропа, эмульсии, мягких желатиновых капсул или стерильной инъекционной жидкости, такой как водная или неводная жидкая суспензия или раствор. Инъекционные дозированные формы, как правило, включают водные суспензии или масляные суспензии, которые могут быть получены с использованием подходящего диспергирующего или увлажняющего агента и суспендирующего агента. Инъекционные формы могут присутствовать в растворенной фазе или в форме суспензии, которую получают с растворителем или разбавителем. Приемлемые растворители или носители включают стерилизованную воду, раствор Рингера или изотонический водный солевой раствор. Альтернативно, стерильные масла могут использоваться в качестве растворителей или суспендирующих агентов. Предпочтительно масло или жирная кислота является нелетучей, включая природные или синтетические масла, жирные кислоты, моно-, ди- или триглицериды. Для инъекций состав также может представлять собой порошок, подходящий для восстановления соответствующим раствором, как описано выше. Примеры их включают, но не ограничиваются ими, порошки, высушенные замораживанием-сушкой, роторной сушкой или сушкой спреем, аморфные порошки, гранулы, осадки или твердые частицы. Для инъекций составы необязательно могут содержать стабилизаторы, модификаторы рН, поверхностно-активные вещества, модификаторы биодоступности и их комбинации. Соединения могут быть составлены для парентерального введения путем инъекции, такой как болюсная инъекция или инфузия. Единичной дозированной формой для инъекций могут быть ампулы или многодозовые контейнеры. Составы по изобретению могут быть разработаны с получением быстрого, длительного или отсроченного высвобождения активного ингредиента после введения пациенту, используя методики, хорошо известные в данной области техники. Таким образом, составы можно получать для контролируемого высвобождения или для медленного высвобождения. Композиции, предусмотренные настоящим изобретением, могут включать, например, мицеллы или липосомы или другие инкапсулированные формы, или могут вводиться в форме длительного высвобождения для обеспечения длительного хранения и/или эффективной доставки. Следовательно, составы могут быть спрессованы в шарики или цилиндры и имплантированы подкожно или внутримышечно в качестве депонируемых инъекций. Такие имплантаты могут включать известные инертные материалы, такие как силиконы и биоразлагаемые полимеры, например полилактид-полигликолиды. Примеры других биоразлагаемых полимеров включают поли(ортоэфиры) и поли(ангидриды). Для назального введения препарат может содержать соединение по изобретению, который ингибирует активность киназы фокальной адгезии, растворенный или суспендированный в жидком носителе,предпочтительно водном носителе, для аэрозольного применения. Носитель может содержать добавки,такие как солюбилизирующие агенты, например, пропиленгликоль, поверхностно-активные вещества,усилители абсорбции, такие как лецитин (фосфатидилхолин) или циклодекстрин, или консерванты, такие как парабены. Для парентерального применения особенно подходят инъекционные растворы или суспензии,предпочтительно водные растворы с активным соединением, растворенным в полигидроксилированном касторовом масле. Дозированные формы могут вводиться один раз в день или более одного раза в день, например дважды или трижды в день. Альтернативно, лекарственные формы могут вводиться реже чем один раз в день, например в любой другой день или один раз в неделю, если установлено, что это целесообразно по назначению врача. Вариант осуществления изобретения также включает пролекарства соединения по изобретению, которые при введении подвергаются химическому превращению метаболическими или другими физиологическими процессами, прежде чем стать активными фармакологическими веществами. Превращение метаболическими или другими физиологическими процессами включает, без ограничения, ферментативное (например, катализируемое конкретным ферментом) и неферментативное (например, вызванное общей или конкретной кислотой или основанием) химическое превращение пролекарства в активное фармакологическое вещество. Обычно такие пролекарства являются функциональными производными соединения по изобретению, которые легко превращаются in vivo в соединение по изобретению. Обычные методики отбора и получения подходящих пролекарственных производных описаны, например, в книгеDesign of Prodrugs, под ред. Н. Bundgaard, Elsevier, 1985. В другом варианте осуществления описаны способы получения композиции описанного здесь соединения, включающие объединение соединения по изобретению с фармацевтически приемлемым носителем или разбавителем. В некоторых вариантах осуществления фармацевтически приемлемый носитель или разбавитель предназначен для перорального введения. В некоторых таких вариантах осуществления способы могут также включать стадию введения композиции в капсулу или таблетку. В других вариантах осуществления фармацевтически приемлемый носитель или разбавитель предназначен для парентерального введения. В некоторых таких вариантах осуществления способы также включают стадию лиофилизации композиции с получением лиофилизированного препарата. Соединения по изобретению могут использоваться терапевтически в комбинации с i) одним или несколькими другими ингибиторами S1P1 и/или ii) одним или несколькими другими типами ингибиторов протеинкиназы и/или одним или несколькими другими типами терапевтических агентов, которые могут вводиться перорально в той же дозированной форме, в отдельной пероральной лекарственной форме(например, последовательно или непоследовательно) или в виде инъекции вместе или раздельно (например, последовательно или непоследовательно). Соответственно в другом варианте осуществления изобретение относится к комбинациям, включающим:b) одно или несколько соединений, включающихi) другие соединения настоящего изобретения,ii) другие лекарственные средства, пригодные для лечения злокачественности, для которых медицински показана активация S1P1, например рассеянного склероза, отторжения трансплантата или зрелого респираторного дистресс-синдрома. Комбинации по изобретению включают смеси соединений из (а) и (b) в одном составе и соединения из (а) и (b) в виде отдельных составов. Некоторые комбинации по изобретению могут быть упакованы в отдельных составах в наборе. В некоторых вариантах осуществления два или более соединений из (b) составлены вместе, соединение по изобретению составлено отдельно. Дозы и составы для других используемых агентов, где возможно, приведены в последнем выпуске(S)-энантиомер получали аналогично последовательности, приведенной на схеме 1, используя RuCl(n-цимен) [(S,S)-Ts-DPEN] на стадии (ii). Рацемический материал может быть получен аналогично последовательности, приведенной на схеме 1, используя NaBH4 на стадии (ii). Схема 2 Реагенты: (i) DPPA, DBU, толуол; (ii) PG - защитная группа, например Вос: Pd/C, Н 2, Вос 2 О, ТЭА,МеОН; (iii) NH2OHHCl, NaHCO3, EtOH; (iv) HOBt, EDC, бензойная кислота, DMF; (v) снятие защит, например, 4 М HCl в диоксане; (vi) (a) R'-LG или R"-LG, где LG представляет собой уходящую группу,K2CO3, CH3CN; (b) R1-CO2H или R2-CO2H, HOBt, EDC, DMF или R1-COCl или R2-COCl, ТЭА, ДХМ; (с)(e) R1-OCOCl или R2-OCOCl, DIEA, DMF; (f) HN(R5R5), CDI, ТЭА, ДХМ; (g) H2NSO2NH2, , диоксан; (h) диметилоксиран, , EtOH; (vii) (a) если R' или R"=H, затем могут осуществляться реакции (vi) (a-d); (b) если R' или R" содержат сложный эфир, затем может осуществляться (i) гидролиз NaOH, EtOH или (ii) восстановление NaBH4, МеОН; (с) если R' или R" содержит кислоту, затем могут осуществляться конденсации HN(R5R5), HOBt, EDC, DMF; (d) если R' или R" содержит подходящий активированный алкен,затем может осуществляться реакция Михаэля HN(R5R5), DMF.(R)-энантиомер получают аналогично последовательности, приведенной на схеме 2, исходя из (S)5-гидрокси-5,6,7,8-тетрагидронафталин-1-карбонитрила. Схема 3 Реагенты: (i) (R)-2-метилпропан-2-сульфинамид, Ti(OEt)4, толуол; (ii) NaBH4, ТГФ; (iii) 4N HCl в диоксане, MeOH; (iv) Вос 2 О, ТЭА, ДХМ; (v) 4,4,4',4',5,5,5',5'-октаметил-2,2'-бис(1,3,2-диоксаборолан),PdCl2 (dppf), CH2Cl2, ацетат калия, диоксан; (vi) 5-(5-бромоксазол-2-ил)-2-изопропоксибензонитрил,K2CO3, Pd(PPh3)4, DME, Н 2 О; (vii) 4N HCl в диоксане; (viii) (a) R'-LG или R"-LG, где LG представляет собой уходящую группу, K2CO3, CH3CN; (b) R1-CO2H или R2-CO2H, HOBt, EDC, DMF или R1-COCl илиH2NSO2NH2, , диоксан; (h) диметилоксиран, , EtOH; (ix) (а) если R' или R"=H, затем могут осуществляться реакции (viii) (a-d); (b) если R' или R" содержат сложный эфир, затем может осуществляться (i) гидролиз NaOH, EtOH или (ii) восстановление NaBH-4, MeOH; (с) если R' или R" содержат кислоту, затем могут осуществляться конденсации HN(R5R5), HOBt, EDC, DMF; (d) если R' или R" содержат подходящий активированный алкен, затем может осуществляться реакция Михаэля HN(R5R5), DMF.(S)-энантиомер может быть получен с помощью (S)-2-метилпропан-2-сульфинамида на стадии (i). Схема 7 Реагенты: (i) (a) HOBt, EDC, 2-(3,4-диэтоксифенил)уксусная кислота, DMF; (b) снятие защит, например 4N HCl в диоксане; (ii) (a) R'-LG, где LG представляет собой уходящую группу, K2CO3, CH3CN;(S)-энантиомер может быть получен с помощью защищенного (R)-1-амино-N-гидрокси-2,3 дигидро-1H-инден-4-карбоксимидамида на стадии (i). Схема 10Mestrec 5,3,0 и 6,0,1. Пики 13 С ЯМР, которые помещены в скобки, представляют собой два ротамера одного углерода. Масс-спектры (LCMS) получали с помощью Agilent 1100/6110 ВЭЖХ системы, оснащенной Thompson ODS-A, 100A, 5 мкм (504,6 мм) колонка, используя воду с 0,1% муравьиной кислоты в качестве подвижной фазы А и ацетонитрил с 0,1% муравьиной кислоты в качестве подвижной фазы В. Градиент составлял 20-100% подвижной фазы В в течение 2,5 мин, затем при 100% в течение 2,5 мин. Скорость потока составляла 1 мл/мин. Если не указано иное, данные LCMS приведены с помощью этого способа. Для более гидрофобных соединений использовали следующий градиент, обозначенный как способ 1: 40-95% в течение 0,5 мин, выдерживали при 95% в течение 8,5 мин, со скоростью потока 1 мл/мин. Конечные соединения проверяли на чистоту с помощью способа 2: 5% в течение 1 мин, 5-95% в течение 9 мин, затем выдерживали при 95% в течение 5 мин со скоростью потока 1 мл/мин. Энантиомерный избыток определяли объединением пиков, которые разделяли на колонке Chiralpak AD-H, 2504,6 мм со скоростью потока 1 мл/мин и изократной подвижной фазой. Если не указано иное, хиральные данные приведены с помощью этого способа. Альтернативно, хиральные разделения осуществляли в следующих условиях, обозначенных как хиральный способ 1: колонка Chiralpak AY-H, 2504,6 мм со скоростью потока 1 мл/мин и изократной подвижной фазой. Хиральный способ 2: колонка Chiralcel OZ-3, 1504,6 мм со скоростью потока 0,75 мл/мин и изократной подвижной фазой. Пиридин, дихлорметан (ДХМ), тетрагидрофуран (ТГФ) и толуол используют в методиках от Aldrich в надежно закрытых бутылках, хранящихся в атмосфере азота (N2). Все реакционные смеси перемешивали магнитной мешалкой, и температурами являются внешние температуры реакции. Хроматографии осуществляли с помощью Combiflash Rf ускоренной системы очистки (Teledyne Isco), оснащенной Redisep (Teledyne Isco), на колонках с силикагелем (SiO2). Препаративные ВЭЖХ очистки осуществляли в системе Varian ProStar/PrepStar, используя воду, содержащую 0,05% трифторуксусной кислоты в качестве подвижной фазы А и ацетонитрил с 0,05% трифторуксусной кислотой в качестве подвижной фазы В. Градиент составлял 10-80% с подвижной фазой В в течение 12 мин, выдерживали при 80% в течение 2 мин и затем восстанавливали до 10% в течение 2 мин со скоростью потока 22 мл/мин. Могут использоваться другие методы, аналогичные описанному. Фракции собирали с помощью коллектора фракций Varian Prostar и упаривали с помощью вакуумного насоса Savant SpeedVac Plus. Соединения с солеобразующими центрами являлись солями с трифторуксусной кислотой (ТФУК). Микроволновое облучение осуществляли с помощью микроволнового реактора Biotage Initiator, оснащенного сосудами для микроволнового излучения Biotage. Использовали следующие сокращения: этилацетат (ЕА), триэтиламин (ТЭА), диэтиламин (DEA), диизопропилэтиламин(HOBt),гидрохлорид 1-этил-3-(3 диметиламинопропил)карбодиимида (EDC), изопропанол (IPA), диметилформамид (DMF), диметилацетамид (DMA). Норит представляет собой активированный уголь. Экспериментальные методики 5-Оксо-5,6,7,8-тетрагидронафталин-1-карбонитрил (INT-1)(50 мл) добавляли Zn(CN)2 (10,38 г, 88,4 ммоль). Смесь дегазировали дважды пропусканием N2 через раствор в течение 30 мин, затем вакуумировали. Добавляли Pd(Ph3)4 (0,5 г, 0,44 ммоль), и смесь нагревали при 110 С в атмосфере N2. Через 5 ч смесь охлаждали до комнатной температуры и выливали в лед(600 мл), используя воду (300 мл) для завершения переноса. После плавления льда раствор отфильтровывали, и полученное твердое вещество собирали, суспендировали в ДХМ и снова отфильтровывали. Твердое вещество собирали, промывали водой и очищали колоночной хроматографией (этилацетат/гексан) с получением 6,9 г (91%) 5-оксо-5,6,7,8-тетрагидронафталин-1-карбонитрила INT-1 в виде белого твердого вещества. LCMS-ESI (m/z) рассчитано для C11H9NO: 171,2; обнаружено 172,1 [М+Н]+, tR=2,95 мин. 1 К перемешиваемому раствору 5-оксо-5,6,7,8-тетрагидронафталин-1-карбонитрила INT-1 (3,0 г, 17,5 ммоль) в смеси 5:1 HCO2:NEt3 (24 мл) добавляли RuCl(n-цимен)[(R,R)-Ts-DPEN] (0,13 г, 0,26 ммоль). Смесь перемешивали при 30 С в течение 15 ч, затем разделяли между EA и Н 2 О. Объединенные органические слои сушили Na2SO4 и хроматографировали (этилацетат/гексан) с получением 2,99 г (99%) (R)-5 гидрокси-5,6,7,8-тетрагидронафталин-1-карбонитрила INT-2 в виде белого твердого вещества. LCMS-ESIINT-1 RuCl(п-цимен)[(S,S)-Ts-DPEN]. Хиральная ВЭЖХ: 99,4% ее, tR для (S)-энантиомера=17,99 мин. Общая методика 1. Получение амидоксимов. К (R)- или (S)-цианидам (1 экв.) в EtOH (0,56 М) добавляли гидрохлорид гидроксиламина (3 экв.) иNaHCO3 или ТЭА (3 экв.), и реакционную смесь нагревали при 85 С в течение 1-2 ч. Органические растворенные амидоксимы выделяли удалением растворителя и разделением между водой и ДХМ. Водорастворимые амидоксимы хроматографировали или использовали непосредственно в циклизации. Чистые амидоксимы могут быть получены перекристаллизацией из спиртовых растворителей. Получали используя общую методику 1. К перемешиваемому раствору (R)-5-гидрокси-5,6,7,8 тетрагидронафталин-1-карбонитрила INT-2 (79,1 мг, 0,46 ммоль) в EtOH (2 мл) добавляли гидрохлорид гидроксиламина (34,9 мг, 0,50 ммоль) и бикарбонат натрия (42,2 мг, 0,50 ммоль). Смесь нагревали при 70 С в течение 18 ч. Продукт очищали хроматографией (МеОН/ДХМ) с получением 27,3 мг (29%) (R)N,5-дигидрокси-5,6,7,8-тетрагидронафталин-1-карбоксимидамида INT-4 в виде белого твердого вещества. LCMS-ESI (m/z) рассчитано для C11H11NO: 173,2; обнаружено 174,1 [М+Н]+, 156,1 [M-NH4]+, tR=2,60 мин. (S)-N,5-Дигидрокси-5,6,7,8-тетрагидронафталин-1-карбоксимидамид INT-5 получали аналогично из(S)-5-гидрокси-5,6,7,8-тетрагидронафталин-1-карбонитрила INT-3. Общая методика 2. Циклизация в оксадиазоламины. Раствор подходящей кислоты (1 экв.), HOBt (1,3 экв.) и EDC (1,3 экв.) в DMF (0,08 М в кислоте) перемешивали при комнатной температуре в атмосфере N2. После полного образования комплекса HOBtкислота (1-3 ч) к смеси добавляли (R)- или (S)-амидоксим (1,1 экв.). После полного образования соединенного промежуточного соединения (около 0,5-2 ч) смесь нагревали при 75-95 С до окончания циклизации (8-12 ч). Реакционную смесь разбавляли насыщенным NaHCO3 и экстрагировали этилацетатом. Объединенные органические экстракты сушили, концентрировали и очищали хроматографией (этилацетат/гексан), препаративной ВЭЖХ или перекристаллизацией. Получали в соответствии с общей методикой 2. К перемешиваемому раствору 3-циано-4 изопропоксибензойной кислоты (16,7 мг, 0,08 ммоль) в DMF (1 мл) добавляли HOBt (14,3 мг, 0,11 ммоль) и EDCI (20,3 мг, 0,11 ммоль). После перемешивания в течение 30 мин добавляли (R)-N,5 дигидрокси-5,6,7,8-тетрагидронафталин-1-карбоксимидамид INT-4 (27,3 мг, 0,09 ммоль) в виде раствора в DMF (1,5 мл). После перемешивания при комнатной температуре в течение 60 мин смесь нагревали при 90 С в течение 15 ч. Смесь разбавляли этилацетатом и промывали NaHCO3. Объединенные органические слои сушили, концентрировали, хроматографировали (этилацетат/гексан) с получением 12,72 мг (42,4%)(R)-5-(3-(5-гидрокси-5,6,7,8-тетрагидронафталин-1-ил)-1,2,4-оксадиазол-5-ил)-2-изопропоксибензонитрила 1 в виде белого твердого вещества. LCMS-ESI (m/z) рассчитано для C22H21N3O3: 375,4; обнаружено 376,1 [М+Н]+, tR=3,73 мин. 1(S)-5-(3-(5-Гидрокси-5,6,7,8-тетрагидронафталин-1-ил)-1,2,4-оксадиазол-5-ил)-2-изопропоксибензонитрил 2 получали аналогично из (S)-5-гидрокси-5,6,7,8-тетрагидронафталин-1-карбонитрила INT-5. Хиральная ВЭЖХ: 99,1% ее, tR для (S)-энантиомера=38,19 мин. Перемешиваемый раствор (R)-5-гидрокси-5,6,7,8-тетрагидронафталин-1-карбонитрила INT-2 (3,00 г, 17,32 ммоль) в толуоле (16 мл) в атмосфере N2 охлаждали до 0 С. Добавляли DPPA (9,53 г, 34,64 ммоль), затем по каплям добавляли DBU (3,16 мл, 20,78 ммоль) в течение 20 мин. Смесь перемешивали при 0 С в течение 4 ч, затем медленно нагревали до комнатной температуры в течение 2 ч и затем концентрировали. Полученную сырую смесь разбавляли этилацетатом и промывали NaHCO3. Объединенные органические слои промывали насыщенным раствором хлорида натрия, сушили Na2SO4 и хроматографировали (этилацетат/гексан) с получением 2,49 г (72,6%) (S)-5-азидо-5,6,7,8-тетрагидронафталин-1 карбонитрила INT-6 в виде белого твердого вещества. LCMS-ESI (m/z) рассчитано для C11H10N4: 198,2; обнаружено 156,1 [M-N3]+, tR=3,65 мин. 1(R)-5-Азидо-5,6,7,8-тетрагидронафталин-1-карбонитрил INT-7 получали аналогично из (S)-5 гидрокси-5,6,7,8-тетрагидронафталин-1-карбонитрила INT-3. К перемешиваемому раствору (S)-5-азидо-5,6,7,8-тетрагидронафталин-1-карбонитрила INT-6 (3,1 г,15,63 ммоль) в МеОН (50 мл) добавляли 10% Pd/C (500 мг), (Вос)2 О (6,83 г, 31,27 ммоль) и Et3N (3,16 г,31,27 ммоль). Реакционную смесь насыщали и продували H2 (3) и перемешивали в атмосфере H2. Через 3 ч смесь отфильтровывали через целит, промывая МеОН. Фильтрат МеОН концентрировали, растворяли в этилацетате и промывали NaHCO3 и насыщенным раствором хлорида натрия. Органический слой сушили (MgSO4), концентрировали и хроматографировали (этилацетат/гексан). Полученный материал перекристаллизовывали из гексана с получением 3,45 г (81%) (S)-трет-бутил (5-циано-1,2,3,4 тетрагидронафталин-1-ил)карбамата INT-8 в виде белого твердого вещества. LCMS-ESI (m/z) рассчитано для C16H20N2O2: 272,34; обнаружено 156,1 [М-NHBoc]+, tR=3,77 мин. 1 Получали в соответствии с общей методикой 1. К перемешиваемому раствору (S)-трет-бутил (5 циано-1,2,3,4-тетрагидронафталин-1-ил)карбамата INT-8 (3,10 г, 11,38 ммоль) в EtOH (25 мл) добавляли гидрохлорид гидроксиламина (2,77 г, 39,84 ммоль) и NEt3 (3,17 мл, 22,77 ммоль). После нагревания при 85 С в течение 15 ч смесь концентрировали, растворяли в ДХМ и промывали NaHCO3. Объединенные органические слои сушили, концентрировали и хроматографировали (МеОН/ДХМ) с получением 3,56 г сырого (S)-трет-бутил (5-(N-гидроксикарбамимидоил)-1,2,3,4-тетрагидронафталин-1-ил)карбамата INT10 (58% продукт по площади УФ), который использовали в следующей реакции без дополнительной очистки. LCMS-ESI (m/z) рассчитано для C16H23N3O3: 305,37; обнаружено 306,2 [М+Н]+, tR=2,00 мин.(R)-трет-Бутил (5-(N-гидроксикарбамимидоил)-1,2,3,4-тетрагидронафталин-1-ил)карбамат INT-11 получали аналогично из (R)-трет-бутил (5-циано-1,2,3,4-тетрагидронафталин-1-ил)карбамата INT-9.(5-(N-гидроксикарбамимидоил)-1,2,3,4-тетрагидронафталин-1-ил)карбамат INT-10 (3,56 г сырой, около 2,99 ммоль). После перемешивания при комнатной температуре в течение 90 мин смесь нагревали при 90 С в течение 15 ч. Смесь разбавляли этилацетатом и промывали NaHCO3. Объединенные органические слои сушили, концентрировали и хроматографировали (этилацетат/гексан) с получением 1,89 г (46%)(S)-трет-бутил (5-(5-(3-циано-4-изопропоксифенил)-1,2,4-оксадиазол-3-ил)-1,2,3,4-тетрагидронафталин 1-ил)карбамата INT-12 в виде белого твердого вещества. LCMS-ESI (m/z) рассчитывали для C27H30N4O4: 474,6; M/Z не наблюдали, tR=4,23 мин. 1(5-(5-(3-циано-4-изопропоксифенил)-1,2,4-оксадиазол-3-ил-1,2,3,4-тетрагидронафталин-1-ил)карбамат INT-13 получали аналогично из (R)-трет-бутил (5-(N-гидроксикарбамимидоил)1,2,3,4-тетрагидронафталин-1-ил)карбамата INT-11. К перемешиваемому раствору (S)-трет-бутил (5-(5-(3-циано-4-изопропоксифенил)-1,2,4-оксадиазол 3-ил)-1,2,3,4-тетрагидронафталин-1-ил)карбамата INT-12 (0,90 г, 1,9 ммоль) в диоксане (10 мл) добавляли 4N HCl/диоксан (2,5 мл). После перемешивания при 60 С в течение 5,5 ч смесь концентрировали с получением 0,8 г (100%) соли HCl (S)-5-(3-(5-амино-5,6,7,8-тетрагидронафталин-1-ил)-1,2,4-оксадиазол 5-ил)-2-изопропоксибензонитрила 4 в виде белого твердого вещества. Аналитически чистые образцы очищали препаративной ВЭЖХ, и свободный амин получали разделением между NaHCO3 и этилацетатом. LCMS-ESI (m/z) рассчитано для C22H22N4O2: 374,4; обнаружено 358,1 [М-NH2]+, tR=2,45 мин. 1(R)-5-(3-(5-Амино-5,6,7,8-тетрагидронафталин-1-ил)-1,2,4-оксадиазол-5-ил)-2-изопропоксибензонитрил 3 получали аналогично из (R)-трет-бутил (5-(5-(3-циано-4-изопропоксифенил)-1,2,4-оксадиазол 3-ил)-1,2,3,4-тетрагидронафталин-1-ил)карбамата INT-13. Хиральная ВЭЖХ (хиральный способ 1): 99,9% ее, tR для (R)-энантиомера=39,72 мин. Общая методика 3. Получение тетрагидронафталинмочевин. К перемешиваемому раствору CDI (1,2 экв.) в ДХМ (0,16 М) добавляли раствор (R)- или (S)тетрагидронафталинамина (1 экв.) и Et3N (3 экв.) в ДХМ (0,01 М). После перемешивания в течение 15 ч этот раствор добавляли ко второму раствору, содержащему подходящий амин (3 экв.) и Et3N (3 экв.) в ДХМ (0,4 М), при комнатной температуре. Полученную смесь перемешивали при комнатной температуре в течение 4 ч до исчезновения исходного материала. Растворитель упаривали, и чистый продукт выделяли препаративной ВЭЖХ. Соединения 5-20 получали в соответствии с общей методикой 3. Получали в соответствии с общей методикой 3. К перемешиваемому раствору CDI 9,5 мг, 0,06 ммоль) в ДХМ (1 мл) добавляли по каплям раствор (R)-5-(3-(5-амино-5,6,7,8-тетрагидронафталин-1-ил)1,2,4-оксадиазол-5-ил)-2-изопропоксибензонитрила, HCl соли 3 (20 мг, 0,05 ммоль) и Et3N (20,3 мкл, 0,15 ммоль) в ДХМ (1 мл). После перемешивания в течение 15 ч при комнатной температуре этот раствор по каплям добавляли к другому раствору, содержащему (R)-3-диметиламинопирролидин (18,6 мг, 0,15 ммоль) в ДХМ (1 мл) при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение 6,5 ч. Растворитель упаривали, и чистый продукт выделяли препаративной ВЭЖХ с получением 17,5 мг (70%) (R)-N-R)-5-(5-(3-циано-4-изопропоксифенил)-1,2,4-оксадиазол-3-ил)1,2,3,4-тетрагидронафталин-1-ил)-3-(диметиламино)пирролидин-1-карбоксамида 20. LCMS-ESI (m/z) рассчитано для C29H34N6O3: 514,6; обнаружено 515,3 [М+Н]+, tR=2,56 мин. 1(dd, J=13,9, 6,1 Гц, 6 Н). Общая методика 4. Получение тетрагидронафталинамидов через хлорангидриды кислот. К перемешиваемому раствору (R)- или (S)-тетрагидронафталинамина HCl (1 экв.) в ДХМ добавляли хлорангидрид кислоты (2 экв.) и NEt3 (2 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Растворитель упаривали, и смесь очищали препаративной ВЭЖХ. Соединения 21-25 получали в соответствии с общей методикой 4. Получали в соответствии с общей методикой 4. К перемешиваемому раствору (R)-5-(3-(5-амино 5,6,7,8-тетрагидронафталин-1-ил)-1,2,4-оксадиазол-5-ил)-2-изопропоксибензонитрила HCl 3 (20 мг, 0,05 ммоль) в ДХМ (0,5 мл) добавляли ацетилхлорид (7 мкл, 0,10 ммоль) и NEt3 (14 мкл, 0,10 ммоль). После перемешивания в течение 1 ч растворитель упаривали, и остаток очищали препаративной ВЭЖХ с получением 11,3 мг (56%) (R)-N-(5-(5-(3-циано-4-изопропоксифенил)-1,2,4-оксадиазол-3-ил)-1,2,3,4-тетрагидронафталин-1-ил)ацетамида 21. LCMS-ESI (m/z) рассчитано для C24H24N4O3: 416,5; обнаружено 417,2(S)-N-(5-(5-(3-Циано-4-изопропоксифенил)-1,2,4-оксадиазол-3-ил)-1,2,3,4-тетрагидронафталин-1 ил)ацетамид 22 получали аналогично из (S)-5-(3-(5-амино-5,6,7,8-тетрагидронафталин-1-ил)-1,2,4 оксадиазол-5-ил)-2-изопропоксибензонитрила HCl 4. Общая методика 5. Получение тетрагидронафталинсульфамидов. К раствору (R)- или (S)-тетрагидронафталинамина HCl (1 экв.) в диоксане добавляли сульфамид (5 экв.) и DIEA (3 экв.). Реакционную смесь перемешивали при 110 С в течение 18 ч. Растворитель упаривали, и смесь очищали препаративной ВЭЖХ. Соединения 26 и 27 получали в соответствии с общей методикой 5. Получали в соответствии с общей методикой 5: К перемешиваемому раствору (R)-5-(3-(5-амино 5,6,7,8-тетрагидронафталин-1-ил)-1,2,4-оксадиазол-5-ил)-2-изопропоксибензонитрила HCl 3 (50 мг, 0,12 ммоль) в диоксане (3 мл) добавляли сульфамид (58 мг, 0,61 ммоль) и DIEA (47,2 мкл, 0,37 ммоль), и смесь нагревали при 110 С в течение 14 ч. Растворитель упаривали, и остаток очищали препаративной ВЭЖХ с получением 22,8 мг (42%) (R)-N-(5-(5-(3-циано-4-изопропоксифенил)-1,2,4-оксадиазол-3-ил)1,2,3,4-тетрагидронафталин-1-ил)сульфамида 26. LCMS-ESI (m/z) рассчитано для C22H23N5O4S: 453,5,обнаружено 454,1 [М+Н]+, tR=3,47 мин. 1(S)-N-(5-(5-(3-Циано-4-изопропоксифенил)-1,2,4-оксадиазол-3-ил)-1,2,3,4-тетрагидронафталин-1 ил)сульфамид 27 получали аналогично из (S)-5-(3-(5-амино-5,6,7,8-тетрагидронафталин-1-ил)-1,2,4 оксадиазол-5-ил)-2-изопропоксибензонитрила HCl 4. Общая методика 6. Получение тетрагидронафталинсульфонамидов через сульфонилхлориды. К раствору (R)- или (S)-тетрагидронафталинамина HCl (1 экв.) в ДХМ (0,05 М) добавляли ТЭА (2 экв.) и подходящий сульфонилхлорид (1-2 экв.) при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Растворитель упаривали, и продукт выделяли очисткой препаративной ВЭЖХ. Соединения 28-33 получали в соответствии с общей методикой 6. Получали в соответствии с общей методикой 6. К перемешиваемому раствору гидрохлорида (R)-5(3-(5-амино-5,6,7,8-тетрагидронафталин-1-ил)-1,2,4-оксадиазол-5-ил)-2-изопропоксибензонитрила 3 (20 мг, 0,05 ммоль) в ДХМ (1 мл) при 0 С добавляли ТЭА (20 мкл, 0,15 ммоль) и метансульфонилхлорид (4,5 мкл, 0,06 ммоль). Смесь оставляли нагреваться до комнатной температуры в течение 2 ч. Растворитель упаривали, и сырую смесь очищали препаративной ВЭЖХ с получением 12,8 мг (58%) (R)-N-(5-(5-(3 циано-4-изопропоксифенил)-1,2,4-оксадиазол-3-ил)-1,2,3,4-тетрагидронафталин-1-ил)метансульфонамида 28. LCMS-ESI (m/z) рассчитано для C23H24N4O4S: 452,5; обнаружено 453,1 [М+Н]+, tR=3,68 мин. 1(S)-N-(5-(5-(3-Циано-4-изопропоксифенил)-1,2,4-оксадиазол-3-ил)-1,2,3,4-тетрагидронафталин-1 ил)метансульфонамид 29 получали аналогично из гидрохлорида (S)-5-(3-(5-амино-5,6,7,8 тетрагидронафталин-1-ил)-1,2,4-оксадиазол-5-ил)-2-изопропоксибензонитрила 4.(S)-N-(5-(5-(3-Циано-4-изопропоксифенил)-1,2,4-оксадиазол-3-ил)-1,2,3,4-тетрагидронафталин-1 ил)-2-метоксиэтансульфонамид 33 получали аналогично из соединения 4. Хиральная ВЭЖХ: 99,04% ее,tR=18,57 мин (хиральный способ 2). Получали в соответствии с общей методикой 6. К перемешиваемому раствору гидрохлорида (R)-5(3-(5-амино-5,6,7,8-тетрагидронафталин-1-ил)-1,2,4-оксадиазол-5-ил)-2-изопропоксибензонитрила 3 (0,15 г, 0,37 ммоль) в ДХМ (5 мл) добавляли ТЭА (76 мкл, 0,55 ммоль) и метил-2-(хлорсульфонил)ацетат (76 мг, 0,44 ммоль). Добавляли дополнительно ТЭА и метил-2-(хлорсульфонил)ацетат до окончания реакции через 24 ч. Сырую реакционную смесь разделяли между ДХМ и насыщенным NaHCO3. Органический слой сушили Na2SO4, концентрировали и очищали колоночной хроматографией (ЕА/гексан) с получением 0,11 г (57%) (R)-метил 2-(N-(5-(5-(3-циано-4-изопропоксифенил)-1,2,4-оксадиазол-3-ил)-1,2,3,4 тетрагидронафталин-1-ил)сульфамоил)ацетата INT-14. LCMS-ESI (m/z) рассчитано для C25H26N4O6S: 510,6; обнаружено 511,1 [М+Н]+, tR=3,73 мин. 1(S)-Метил 2-(N-(5-(5-(3-циано-4-изопропоксифенил)-1,2,4-оксадиазол-3-ил)-1,2,3,4-тетрагидронафталин-1-ил)сульфамоил)ацетат INT-15 получали аналогично из гидрохлорида (S)-5-(3-(5-амино 5,6,7,8-тетрагидронафталин-1-ил)-1,2,4-оксадиазол-5-ил)-2-изопропоксибензонитрила 4. Общая методика 7. Получение тетрагидронафталинсульфонамидов кислот. К перемешиваемому раствору сложного эфира (R)- или (S)-тетрагидронафталинсульфонамида (1 экв.) в МеОН (0,2 М) добавляли 6N NaOH (2 экв.) при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение 6 ч. Сырую реакционную смесь разбавляли водой, подкисляли IN HCl и экстрагировали ДХМ и этилацетатом. Органический слой сушили Na2SO4, концентрировали и выделяли очисткой препаративной ВЭЖХ. Соединения 34 и 35 получали в соответствии с общей методикой 7. Получали в соответствии с общей методикой 7. К перемешиваемому раствору (R)-метил 2-(N-(5-(5(3-циано-4-изопропоксифенил)-1,2,4-оксадиазол-3-ил)-1,2,3,4-тетрагидронафталин-1-ил)сульфамоил)ацетата INT-14 (0,082 г, 0,16 ммоль) в МеОН (1,5 мл) добавляли 6N NaOH (0,08 мл). Реакционную смесь перемешивали при комнатной температуре в течение 6 ч. Сырую реакционную смесь разбавляли водой,подкисляли IN HCl и экстрагировали ДХМ и этилацетатом. Органический слой сушили Na2SO4, концентрировали и выделяли очисткой препаративной ВЭЖХ с получением 0,057 г (72%) (R)-2-(N-(5-(5-(3 циано-4-изопропоксифенил)-1,2,4-оксадиазол-3-ил)-1,2,3,4-тетрагидронафталин-1-ил)сульфамоил) уксусной кислоты 34. Аналитически чистый образец получали очисткой препаративной ВЭЖХ. LCMS-ESI(S)-2-(N-(5-(5-(3-Циано-4-изопропоксифенил)-1,2,4-оксадиазол-3-ил)-1,2,3,4-тетрагидронафталин-1 ил)сульфамоил)уксусную кислоту 35 получали аналогично из (S)-метил 2-(N-(5-(5-(3-циано-4 изопропоксифенил)-1,2,4-оксадиазол-3-ил)-1,2,3,4-тетрагидронафталин-1-ил)сульфамоил)ацетата INT-15. Общая методика 8. Получение тетрагидронафталинсульфонамидов спиртов. К перемешиваемому раствору сложного эфира (R)- или (S)-тетрагидронафталинсульфонамида (1 экв.) в ТГФ (0,06 М) добавляли боргидрид натрия (2,5 экв.) при комнатной температуре. Реакционную смесь нагревали при 75 С и по каплям добавляли метанол (1 экв.). Через 1 ч реакционную смесь охлаждали и концентрировали и очищали препаративной ВЭЖХ. Соединения 36 и 37 получали в соответствии с общей методикой 8. Получали в соответствии с общей методикой 8: К перемешиваемому раствору (R)-метил 2-(N-(5-(5(3-циано-4-изопропоксифенил)-1,2,4-оксадиазол-3-ил)-1,2,3,4-тетрагидронафталин-1-ил)сульфамоил)ацетата INT-14 (0,025 г, 0,05 ммоль) в ТГФ (25 мл) добавляли боргидрид натрия (0,05 г, 0,12 ммоль) при комнатной температуре. Реакционную смесь нагревали при 75 С и добавляли метанол (0,02 мл, 0,05 ммоль). Через 1 ч реакционную смесь охлаждали и концентрировали и очищали препаративной ВЭЖХ с получением 16,0 мг (66%) (R)-N-(5-(5-(3-циано-4-изопропоксифенил)-1,2,4-оксадиазол-3-ил)-1,2,3,4 тетрагидронафталин-1-ил)-2-гидроксиэтансульфонамида 37. LCMS-ESI (m/z) рассчитано для(S)-N-(5-(5-(3-Циано-4-изопропоксифенил)-1,2,4-оксадиазол-3-ил)-1,2,3,4-тетрагидронафталин-1 ил)-2-гидроксиэтансульфонамид 36 получали аналогично из (S)-метил 2-(N-(5-(5-(3-циано-4 изопропоксифенил)-1,2,4-оксадиазол-3-ил)-1,2,3,4-тетрагидронафталин-1-ил)сульфамоил)ацетата INT-15. Хиральная ВЭЖХ: 91,7% ее, tR=19,83 мин (хиральный способ 2). Общая методика 9. Получение тетрагидронафталинсульфонамидамидов. К перемешиваемому раствору (R)- или (S)-тетрагидронафталинсульфонамида кислоты (1 экв.) вDMF (0,25 М) добавляли EDC и N-гидроксибензотриазол. Через 5 мин добавляли амин, и реакционную смесь перемешивали в течение 18 ч при комнатной температуре. Сырую реакционную смесь разбавлялиNaHCO3, экстрагировали этилацетатом. Объединенные органические слои сушили Na2SO4 и очищали препаративной ВЭЖХ. Соединения 38-43 получали в соответствии с общей методикой 9. Получали в соответствии с общей методикой 9. К перемешиваемому раствору (R)-2-(N-(5-(5-(3 циано-4-изопропоксифенил)-1,2,4-оксадиазол-3-ил)-1,2,3,4-тетрагидронафталин-1-ил)сульфамоил) уксусной кислоты 34 (15 мг, 0,05 ммоль) в DMF (0,5 мл) добавляли N-гидроксибензотриазол (6,1 мг, 0,05 ммоль) и EDC (8,7 мг, 0,05 ммоль). Через 5 мин добавляли диметиламин (40 вес.% раствор в ТГФ, 50 мкл, 0,09 ммоль), и реакционную смесь перемешивали в течение 18 ч при комнатной температуре. Сырую реакционную смесь разбавляли насыщенным раствором NaHCO3 и экстрагировали этилацетатом. Объединенные органические слои сушили Na2SO4 и очищали препаративной ВЭЖХ с получением 4,41 мг (28%) (R)-2-(N-(5-(5-(3-циано-4-изопропоксифенил)-1,2,4-оксадиазол-3-ил)-1,2,3,4-тетрагидронафталин-1-ил)сульфамоил)-N,N-диметилацетамида 40. LCMS-ESI (m/z) рассчитано для C26H29N5O5S: 523,6; обнаружено 546,2 [M+Na]+, tR=3,58 мин. 1S)-2-(N-(5-(5-(3-Циано-4-изопропоксифенил)-1,2,4-оксадиазол-3-ил)-1,2,3,4-тетрагидронафталин 1-ил)сульфамоил)-N,N-диметилацетамид 41 получали аналогично из (S)-2-(N-(5-(5-(3-циано-4 изопропоксифенил)-1,2,4-оксадиазол-3-ил)-1,2,3,4-тетрагидронафталин-1-ил)сульфамоил)уксусной кислоты 35. К перемешиваемому раствору гидрохлорида (R)-5-(3-(5-амино-5,6,7,8-тетрагидронафталин-1-ил)1,2,4-оксадиазол-5-ил)-2-изопропоксибензонитрила 3 (100 мг, 0,24 ммоль) в ДХМ (5 мл) при 0 С добавляли ТЭА (170 мкл, 1,2 ммоль) и 2-хлорэтансульфонилхлорид (76 мкл, 0,73 ммоль). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 30 мин. Растворитель удаляли, и продукт очищали хроматографией (этилацетат/гексан) с получением 83,0 мг (75%) (R)-N-(5-(5-(3-циано-4 изопропоксифенил)-1,2,4-оксадиазол-3-ил)-1,2,3,4-тетрагидронафталин-1-ил)этенсульфонамида INT-16 в виде белого твердого вещества. LCMS-ESI (m/z) рассчитано для C24H24N4O4S: 464,5; обнаружено 465,1 ил)этенсульфонамид INT-17 получали аналогично из гидрохлорида (S)-5-(3-(5-амино-5,6,7,8 тетрагидронафталин-1-ил)-1,2,4-оксадиазол-5-ил)-2-изопропоксибензонитрила 4. Общая методика 10. Получение тетрагидронафталинсульфонамидов реакцией Михаэля. К перемешиваемому раствору (R)- или (S)-тетрагидронафталинвинилсульфонамида (1 экв.) в DMF(0,1 М) добавляли ТЭА (5 экв.) и подходящий амин (5 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Продукты очищали препаративной ВЭЖХ. Соединения 44-47 получали в соответствии с общей методикой 10.(40 мг, 0,09 ммоль) в DMF (1,0 мл) добавляли 2N метиламин в ТГФ (0,22 мл, 0,43 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Сырой продукт очищали препаративной ВЭЖХ с получением 24,6 мг (54%) соли ТФУК (R)-N-(5-(5-(3-циано-4-изопропоксифенил)-1,2,4 оксадиазол-3-ил)-1,2,3,4-тетрагидронафталин-1-ил)-2-(диметиламино)этансульфонамида 44 в виде белого твердого вещества. LCMS-ESI (m/z) рассчитано для C26H31N5O4S: 509,6; обнаружено 510,2 [М+Н]+,tR=2,61 мин. 1(S)-N-(5-(5-(3-Циано-4-изопропоксифенил)-1,2,4-оксадиазол-3-ил)-1,2,3,4-тетрагидронафталин-1 ил)-2-(диметиламино)этансульфонамид 45 получали аналогично из S)-N-(5-(5-(3-циано-4 изопропоксифенил)-1,2,4-оксадиазол-3-ил)-1,2,3,4-тетрагидронафталин-1-ил)этенсульфонамида INT-17. К раствору гидрохлорида (R)-5-(3-(5-амино-5,6,7,8-тетрагидронафталин-1-ил)-1,2,4-оксадиазол-5 ил)-2-изопропоксибензонитрила 3 (20 мг, 0,05 ммоль) в DMA (0,5 мл) добавляли ТЭА (136 мкл, 0,97 ммоль) и метилвинилсульфон (52 мг, 0,5 ммоль). Реакционную смесь нагревали при 80 С в течение 24 ч. Сырую реакционную смесь очищали препаративной ВЭЖХ с получением (R)-2-изопропокси-5-(3-(5-2(метилсульфонил)этил)амино)-5,6,7,8-тетрагидронафталин-1-ил)-1,2,4-оксадиазол-5-ил)бензонитрила 48.(S)-2-Изопропокси-5-(3-(5-2-(метилсульфонил)этил)амино)-5,6,7,8-тетрагидронафталин-1-ил)1,2,4-оксадиазол-5-ил)бензонитрил, соединение 49 получали аналогично из гидрохлорида (S)-5-(3-(5 амино-5,6,7,8-тетрагидронафталин-1-ил)-1,2,4-оксадиазол-5-ил)-2-изопропоксибензонитрила 4. К перемешиваемому раствору (R)-5-(3-(5-амино-5,6,7,8-тетрагидронафталин-1-ил)-1,2,4-оксадиазол-5-ил)-2-изопропоксибензонитрила 3 (119 мг, 0,32 ммоль) в CH3CN (5,0 мл) добавляли метилбромацетат (53,5 мкл, 0,35 ммоль) и K2CO3 (138 мг, 1,27 ммоль). После перемешивания в течение 18 ч смесь разбавляли насыщенным раствором хлорида натрия и промывали NaHCO3. Органический слой сушилиNa2SO4 и концентрировали. Полученное сырое твердое вещество очищали хроматографией (МеОН/ДХМ) с получением 113,1 мг (79%) (R)-метил 2-5-(5-(3-циано-4-изопропоксифенил)-1,2,4 оксадиазол-3-ил)-1,2,3,4-тетрагидронафталин-1-ил)амино)ацетата INT-18. LCMS-ESI (m/z) рассчитано для C25H26N4O4: 446,5; обнаружено 447,2 [М+Н]+, tR=2,52 мин.(S)-Метил 2-5-(5-(3-циано-4-изопропоксифенил)-1,2,4-оксадиазол-3-ил)-1,2,3,4-тетрагидронафталин-1-ил)амино)ацетат INT-19 получали аналогично из (S)-5-(3-(5-амино-5,6,7,8-тетрагидронафталин-1- 29
МПК / Метки
МПК: A01N 43/82, A61K 31/41
Метки: способы, синтеза, сфингозин-1-фосфата, модуляторы, хирального, рецептора
Код ссылки
<a href="https://eas.patents.su/30-23183-modulyatory-receptora-sfingozin-1-fosfata-i-sposoby-hiralnogo-sinteza.html" rel="bookmark" title="База патентов Евразийского Союза">Модуляторы рецептора сфингозин-1-фосфата и способы хирального синтеза</a>
Предыдущий патент: Привод для передачи усилия в очистном комбайне для длинного забоя
Следующий патент: Способ мониторинга переходных режимов в электроэнергетической системе и устройство для его реализации
Случайный патент: Способ и устройство для сжигания жидкого топлива.