Производные изохинолин-1(2h)-она в качестве ингибиторов parp-1, способы их получения, фармацевтическая композиция на их основе и применение
Номер патента: 23112
Опубликовано: 29.04.2016
Авторы: Лупи Розита, Черви Джованни, Дзуккотто Фабио, Бертран Джей Аарон, Сколаро Алессандра, Постери Элена, Папео Джанлука Мариано Энрико, Орсини Паоло, Форте Барбара, Монтаньоли Алессия
Формула / Реферат
1. Соединение формулы I
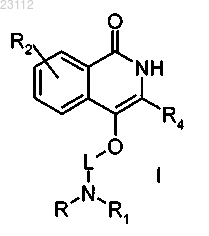
где L является линейной или разветвленной С2-С6алкильной группой или L-NRR1 группа является 5-8-членной азотсодержащей гетероциклильной или гетероциклилС1-С6алкильной группой;
R и R1 означают независимо атом водорода, линейную или разветвленную С1-С6алкильную или COR5-группу или взятые вместе с атомом азота, с которым они связаны, образуют 5-8-членную азотсодержащую гетероциклильную или гетероарильную группу, в свою очередь, замещенную линейной или разветвленной C1-С6алкильной или COR5-группой;
где R5 означает линейную или разветвленную С1-С6алкильную или фенильную группу или OR8, где R8 означает линейную или разветвленную С1-С6алкильную группу;
R2 означает атом водорода, галогена, нитро, линейную или разветвленную С1-6алкилкарбонильную группу, NH2 или линейную или разветвленную С1-С6алкильную группу;
R4 означает фенил или тиенил, в свою очередь, необязательно замещенный галогеном, гидроксигруппой, С1-С6алкоксигруппой и фенилоксигруппой;
или его фармацевтически приемлемая соль.
2. Соединение формулы I по п.1, отличающееся тем, что R2 означает атом водорода или галогена, нитро, амино, линейную или разветвленную С1-6алкилкарбонильную группу или линейную или разветвленную С1-С6алкильную группу; или его фармацевтически приемлемая соль.
3. Соединение формулы I по п.2, отличающееся тем, что
L представляет собой линейную или разветвленную С2-С4алкильную группу или L-NRR1 группа является 5-8-членной азотсодержащей гетероциклильной группой;
R и R1 означают независимо атом водорода, линейную или разветвленную С1-С4алкильную или COR5-группу или взятые вместе с атомом азота, с которым они связаны, образуют пиперидинильную, пирролидинильную, пиперазинильную или пирролильную группу;
R2 означает атом водорода, хлора или фтора, или нитро, амино, линейную или разветвленную С1-6алкилкарбонильную группу, или линейную или разветвленную С1-С4алкильную группу;
R4 означает необязательно замещенную фенильную или тиенильную группу;
R5 означает линейную или разветвленную С1-С4алкильную группу;
или его фармацевтически приемлемая соль.
4. Соединение формулы I по п.1, выбранное из группы, состоящей из
4-(2-аминоэтокси)-3-фенил-2Н-изохинолин-1-она,
N-[2-(1-оксо-3-фенил-1,2-дигидроизохинолин-4-илокси)этил]ацетамида,
4-(3-аминопропокси)-3-фенил-2Н-изохинолин-1-она,
N-[3-(1-оксо-3-фенил-1,2-дигидроизохинолин-4-илокси)пропил]ацетамида,
3-фенил-4-(3-пиперидин-1-илпропокси)-2Н-изохинолин-1-она,
3-фенил-4-(2-пиперазин-1-илэтокси)-2Н-изохинолин-1-она,
4-[2-(4-ацетилпиперазин-1-ил)этокси]-3-фенил-2Н-изохинолин-1-она,
N-[3-(1-оксо-3-фенил-1,2-дигидроизохинолин-4-илокси)пропил]бензамида,
3-(3-метоксифенил)-4-(2-пиперидин-1-илэтокси)-2Н-изохинолин-1-она,
3-(3-метоксифенил)-4-(3-пиперидин-1-илпропокси)-2Н-изохинолин-1-она,
4-(2-аминоэтокси)-3-(3-метоксифенил)-2Н-изохинолин-1-она,
4-(3-метиламинопропокси)-3-фенил-2Н-изохинолин-1-она,
3-фенил-4-(2-пиррол-1-илэтокси)-2Н-изохинолин-1-она,
3-фенил-4-(3-пиперазин-1-илпропокси)-2Н-изохинолин-1-она,
3-фенил-4-(3-пиррол-1-илпропокси)-2Н-изохинолин-1-она,
4-(2-метиламиноэтокси)-3-фенил-2Н-изохинолин-1-она,
4-(2-диметиламиноэтокси)-3-фенил-2Н-изохинолин-1-она,
4-(3-диэтиламинопропокси)-3-фенил-2Н-изохинолин-1-она,
4-[2-(4-метилпиперазин-1-ил)этокси]-3-фенил-2Н-изохинолин-1-она,
4-[3-(4-метилпиперазин-1-ил)пропокси]-3-фенил-2Н-изохинолин-1-она,
3-фенил-4-(3-пирролидин-1-илпропокси)-2Н-изохинолин-1-она,
4-(4-аминобутокси)-3-фенил-2Н-изохинолин-1-она,
3-(4-метоксифенил)-4-(3-пиперидин-1-илпропокси)-2Н-изохинолин-1-она,
4-(2-аминоэтокси)-3-(4-метоксифенил)-2Н-изохинолин-1-она,
4-(2-аминоэтокси)-7-фтор-3-(4-метоксифенил)-2Н-изохинолин-1-она,
4-(2-аминоэтокси)-3-(4-гидроксифенил)-2Н-изохинолин-1-она,
3-(4-гидроксифенил)-4-(3-пиперидин-1-илпропокси)-2Н-изохинолин-1-она,
4-(2-аминоэтокси)-7-фтор-3-(4-гидроксифенил)-2Н-изохинолин-1-она,
4-(2-аминоэтокси)-3-тиофен-3-ил-2Н-изохинолин-1-она,
7-ацетил-3-фенил-4-(2-пиперидин-1-илэтокси)-2Н-изохинолин-1-она,
6-нитро-3-фенил-4-(2-пиперидин-1-илэтокси)-2Н-изохинолин-1-она,
4-(2-аминоэтокси)-3-(3-гидроксифенил)-2Н-изохинолин-1-она,
3-(3-гидроксифенил)-4-(3-пиперидин-1-илпропокси)-2Н-изохинолин-2-она,
6-нитро-3-фенил-4-(3-пиперидин-1-илпропокси)-2Н-изохинолин-1-она,
7-нитро-3-фенил-4-(3-пиперидин-1-илпропокси)-2Н-изохинолин-1-она,
7-амино-3-фенил-4-(3-пиперидин-1-илпропокси)-2Н-изохинолин-1-она,
7-хлор-3-фенил-4-(3-пиперидин-1-илпропокси)-2Н-изохинолин-1-она,
7-фтор-3-фенил-4-(3-пиперидин-1-илпропокси)-2Н-изохинолин-1-она,
4-(2-аминоэтокси)-7-фтор-3-фенил-2Н-изохинолин-1-она,
6-амино-3-фенил-4-(3-пиперидин-1-илпропокси)-2Н-изохинолин-1-она,
6-хлор-3-фенил-4-(3-пиперидин-1-илпропокси)-2Н-изохинолин-1-она,
6-фтор-3-фенил-4-(3-пиперидин-1-илпропокси)-2Н-изохинолин-1-она,
7-фтор-3-(3-метоксифенил)-4-(3-пиперидин-1-илпропокси)-2Н-изохинолин-1-она,
3-(3-хлорфенил)-4-(3-пиперидин-1-илпропокси)-2Н-изохинолин-1-она,
7-фтор-3-(3-гидроксифенил)-4-(3-пиперидин-1-илпропокси)-2Н-изохинолин-1-она,
4-(2-аминоэтокси)-7-фтор-3-(3-метоксифенил)-2Н-изохинолин-1-она,
4-(2-аминоэтокси)-7-фтор-3-(3-гидроксифенил)-2Н-изохинолин-1-она,
4-(2-аминоэтокси)-3-(3-хлорфенил)-2Н-изохинолин-1-она,
4-(2-аминоэтокси)-5-метил-3-фенил-2Н-изохинолин-1-она,
4-(2-аминоэтокси)-3-(3-хлорфенил)-7-фтор-2Н-изохинолин-1-она,
3-фенил-4-(2-пиперидин-1-илэтокси)-2Н-изохинолин-1-она,
4-(2-диэтиламиноэтокси)-3-фенил-2Н-изохинолин-1-она,
3-фенил-4-(2-пирролидин-1-илэтокси)-2Н-изохинолин-1-она,
4-(2-морфолин-4-илэтокси)-3-фенил-2Н-изохинолин-1-она,
5-метил-3-фенил-4-(3-пиперидин-1-илпропокси)-2Н-изохинолин-1-она,
4-(2-аминоэтокси)-7-фтор-5-метил-3-фенил-2Н-изохинолин-1-она,
7-фтор-5-метил-3-фенил-4-(3-пиперидин-1-илпропокси)-2Н-изохинолин-1-она,
4-(2-аминоэтокси)-3-(3-хлорфенил)-5-метил-2Н-изохинолин-1-она,
3-(3-хлорфенил)-5-метил-4-(3-пиперидин-1-илпропокси)-2Н-изохинолин-1-она,
4-(2-аминоэтокси)-3-(3-хлорфенил)-7-фтор-5-метил-2Н-изохинолин-1-она,
3-(3-хлорфенил)-7-фтор-5-метил-4-(3-пиперидин-1-илпропокси)-2Н-изохинолин-1-она,
4-(2-аминоэтокси)-7-фтор-3-(4-метоксифенил)-5-метил-2Н-изохинолин-1-она,
7-фтор-3-(4-метоксифенил)-5-метил-4-(3-пиперидин-1-илпропокси)-2Н-изохинолин-1-она,
4-(2-аминоэтокси)-7-фтор-3-(3-метоксифенил)-5-метил-2Н-изохинолин-1-она,
7-фтор-3-(3-метоксифенил)-5-метил-4-(3-пиперидин-1-илпропокси)-2Н-изохинолин-1-она,
4-(2-аминоэтокси)-3-(4-хлор-3-метоксифенил)-7-фтор-5-метил-2Н-изохинолин-1-она,
3-(4-хлор-3-метоксифенил)-7-фтор-5-метил-4-(3-пиперидин-1-илпропокси)-2Н-изохинолин-1-она,
4-(2-аминоэтокси)-3-(3-хлор-4-метоксифенил)-7-фтор-5-метил-2Н-изохинолин-1-она,
3-(3-хлор-4-метоксифенил)-7-фтор-5-метил-4-(3-пиперидин-1-илпропокси)-2Н-изохинолин-1-она,
4-(2-аминоэтокси)-3-(3-хлор-4-метоксифенил)-5-метил-2Н-изохинолин-1-она,
3-(3-хлор-4-метоксифенил)-5-метил-4-(3-пиперидин-1-илпропокси)-2H-изохинолин-1-она,
4-(2-аминоэтокси)-3-(4-хлор-3-метоксифенил)-5-метил-2Н-изохинолин-1-она,
3-(4-хлор-3-метоксифенил)-5-метил-4-(3-пиперидин-1-илпропокси)-2Н-изохинолин-1-она,
4-(2-аминоэтокси)-3-(3-метоксифенил)-5-метил-2Н-изохинолин-1-она,
3-(3-метоксифенил)-5-метил-4-(3-пиперидин-1-илпропокси)-2Н-изохинолин-1-она,
4-(2-аминоэтокси)-3-(4-метоксифенил)-5-метил-2Н-изохинолин-1-она,
3-(4-метоксифенил)-5-метил-4-(3-пиперидин-1-илпропокси)-2Н-изохинолин-1-она,
4-(2-аминоэтокси)-7-фтор-3-(4-феноксифенил)-2Н-изохинолин-1-она,
7-фтор-3-(4-феноксифенил)-4-(3-пиперидин-1-илпропокси)-2Н-изохинолин-1-она,
4-(2-аминоэтокси)-3-бензил-7-фтор-2Н-изохинолин-1-она,
3-бензил-7-фтор-4-(3-пиперидин-1-илпропокси)-2Н-изохинолин-1-она,
4-(2-аминоэтокси)-8-фтор-3-фенил-2Н-изохинолин-1-она,
8-фтор-3-фенил-4-(3-пиперидин-1-илпропокси)-2Н-изохинолин-1-она,
4-[2-(диметиламино)этокси]-7-фтор-3-фенилизохинолин-1(2Н)-она,
7-фтор-3-фенил-4-(пиперидин-4-илокси)изохинолин-1(2Н)-она,
4-(3-аминопропокси)-7-фтор-3-фенилизохинолин-1(2Н)-она,
4-[3-(бензиламино)пропокси]-7-фтор-3-фенилизохинолин-1(2Н)-она,
4-[2-(диэтиламино)этокси]-7-фтор-3-фенилизохинолин-1(2Н)-она,
7-фтор-4-[2-(4-метилпиперазин-1-ил)этокси]-3-фенилизохинолин-1(2Н)-она и
7-фтор-3-фенил-4-[2-(фениламино)этокси]изохинолин-1(2Н)-она.
5. Способ получения соединений формулы I по п.1, включающий
стадию 1) алкилирования соединения формулы III
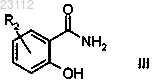
где R2 является таким, как определено в п.1,
соединением формулы IV
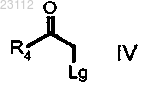
где R4 является группой, определенной в п.1, и Lg представляет собой соответствующую уходящую группу;
стадию 2) циклодегидратации образующегося соединения формулы V
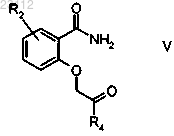
где R2 и R4 являются такими, как определено выше;
стадию 3) перегруппировки образующегося соединения формулы VI

где R2 и R4 являются такими, как определено выше,
с получением соединения формулы VII
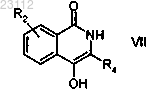
где R2 и R4 являются такими, как определено выше;
стадию 4) алкилирования соединения формулы VII согласно приведенному выше определению,
либо соединением формулы XI
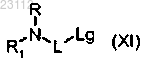
где R, R1, L и Lg являются такими, как определено выше, с получением соединения формулы I, как определено в п.1;
либо соединением формулы XII
X'-L-Lg,
где L означает необязательно замещенную линейную или разветвленную С2-С6алкильную группу, Lg является группой, определенной выше, и X' представляет собой соответствующую уходящую группу;
стадию 5) взаимодействия полученного соединения формулы XIII
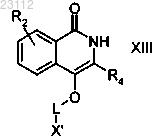
где R2, R4 и X' являются такими, как определено выше, L означает необязательно замещенную линейную или разветвленную С2-С6алкильную группу,
с соединением формулы XIV
R-NH-R1,
где R и R1 являются такими, как определено выше, с получением соединения формулы I согласно приведенному выше определению;
необязательно превращение соединения формулы I в другое соединение формулы I известными химическими реакциями и/или, если желательно, превращение соединения формулы I в его фармацевтически приемлемую соль или превращение соли в свободное соединение формулы I.
6. Способ получения соединений формулы I по п.1, включающий
стадию 4) взаимодействия соединения формулы VIII
с соединением формулы IX
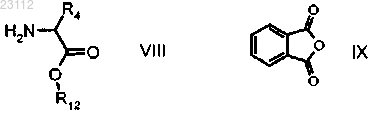
где R4 является группой, определенной выше, и R12 означает С1-С6алкильную или арилС1-С6алкильную группу;
стадию 3а) перегруппировки образующегося соединения формулы X
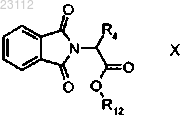
где R4 и R12 являются такими, как определено выше,
с получением соединения формулы VII
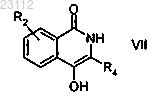
где группа R2 означает атом водорода, a R4 определена выше;
стадию 5) алкилирования соединения формулы VII согласно приведенному выше определению,
или соединением формулы XI

где L является группой по п.1 и R, R1 и Lg являются такими, как определено выше, с получением соединения формулы I по п.1;
или соединением формулы XII
X'-L-Lg,
где L означает необязательно замещенную линейную или разветвленную С2-С6алкильную группу, Lg является группой, определенной выше, и X' представляет собой соответствующую уходящую группу;
стадию 6) взаимодействия образующегося соединения формулы XIII
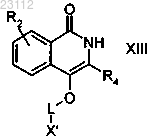
где R2, R4 и X' являются такими, как определено выше, L означает необязательно замещенную линейную или разветвленную С2-С6алкильную группу,
с соединением формулы XIV
R-NH-R1,
где R и R1 являются такими, как определено выше, с получением соединения формулы I согласно приведенному выше определению;
необязательно превращение соединения формулы I в другое соединение формулы I известными химическими реакциями и/или, если желательно, превращение соединения формулы I в его фармацевтически приемлемую соль или превращение соли в свободное соединение формулы I.
7. Фармацевтическая композиция для лечения заболевания, опосредованного белком PARP-1, содержащая терапевтически эффективное количество соединения формулы I по п.1 и по меньшей мере один фармацевтически приемлемый носитель и/или разбавитель.
8. Применение соединения формулы I, определенной в п.1 в качестве лекарственного средства для лечения заболевания, опосредованного белком PARP-1.
9. Фармацевтическая композиция по п.7, дополнительно содержащая средство, выбранное из группы, состоящей из цитостатических или цитотоксических средств, средств типа антибиотиков, алкилирующих средств, антиметаболитов, гормональных средств, иммунологических средств, средств типа интерферона, ингибиторов циклооксогеназы, ингибиторов матриксных металлопротеиназ, ингибиторов теломеразы, ингибиторов тирозинкиназы, средств против рецептора ростового фактора, анти-HER средств, анти-EGFR средств, средств против ангиогенеза, ингибиторов фарнезилтрансферазы, ингибиторов сигнальных путей ras-raf, ингибиторов клеточного цикла, других cdks-ингибиторов, тубулинсвязывающих средств, ингибиторов топоизомеразы I, ингибиторов топоизомеразы II.
10. Фармацевтический набор, содержащий соединение формулы I, определенной в п.1, или его фармацевтическую композицию, определенную в п.7, и средство, выбранное из группы, состоящей из цитостатических или цитотоксических средств, средств типа антибиотиков, алкилирующих средств, антиметаболитов, гормональных средств, иммунологических средств, средств типа интерферона, ингибиторов циклооксогеназы, ингибиторов матриксных металлопротеиназ, ингибиторов теломеразы, ингибиторов тирозинкиназы, средств против рецептора ростового фактора, анти-HER средств, анти-EGFR средств, средств против ангиогенеза, ингибиторов фарнезилтрансферазы, ингибиторов сигнальных путей ras-raf, ингибиторов клеточного цикла, других cdks-ингибиторов, тубулинсвязывающих средств, ингибиторов топоизомеразы I, ингибиторов топоизомеразы II, в виде комбинированного препарата для одновременного, раздельного или последовательного применения в противораковой терапии.
11. Применение соединения формулы I, определенной в п.1, в производстве лекарственного средства для лечения заболевания, опосредованного белком PARP-1.
Текст
ПРОИЗВОДНЫЕ ИЗОХИНОЛИН-1(2H)-ОНА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP-1,СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И ПРИМЕНЕНИЕ Джованни, Форте Барбара, Лупи Розита, Монтаньоли Алессия,Сколаро Алессандра, Дзуккотто Фабио, Орсини Паоло, Постери Элена Изобретение относится к замещенным производным изохинолин-1(2 Н)-она формулы (I), которые избирательно ингибируют активность поли(АДФ-рибоза)полимеразы PARP-1 относительно поли(АДФ-рибоза)полимеразы PARP-2. В связи с этим соединения согласно изобретению являются пригодными в лечении заболеваний, таких как рак, сердечно-сосудистые заболевания,повреждение центральной нервной системы и различные формы воспаления. Изобретение также относится к способам получения указанных соединений, фармацевтическим композициям,содержащим указанные соединения, и применению данных соединений для лечения заболеваний,опосредованных белком PARP-1. Изобретение также относится к применению соединения формулы (I) в производстве лекарственного средства для лечения заболевания, опосредованного белком PARP-1. Скрининг-метод для идентификации соединений, способных связываться с некоторыми белками PARP, а также зонды, используемые в таких методах, раскрывается в изобретении. Папео Джанлука Мариано Энрико,Бертран Джей Аарон, Черви(71)(73) Заявитель и патентовладелец: НЕРВИАНО МЕДИКАЛ САЙЕНСИЗ С.р.л. (IT) Настоящее изобретение относится к замещенным производным изохинолин-1(2 Н)-она, которые избирательно ингибируют активность поли(АДФ-рибоза)полимеразы PARP-1 относительно поли(АДФрибоза)полимеразы PARP-2. Поэтому соединения согласно настоящему изобретению пригодны в лечении заболеваний, таких как рак, сердечно-сосудистые заболевания, повреждение центральной нервной системы и различные формы воспаления. Настоящее изобретение также относится к способам получения указанных соединений, фармацевтическим композициям, содержащим данные соединения, и применению их для лечения заболеваний с использованием фармацевтических композиций, содержащих полученные соединения. Поли(АДФ-рибоза)полимеразы принадлежат к семейству, состоящему из 17 членов, которые катализируют добавление единиц АДФ-рибозы к ДНК или различным акцепторным белкам, которые влияют на клеточные процессы, такие разнообразные, как репликация, транскрипция, дифференцировка, генная регуляция, белковая деградация и сохранение веретена. Ферменты PARP-1 и PARP-2 являются единственными ферментами среди PARP, которые активируются при повреждении ДНК и участвуют в процессе репарации ДНК.PARP-1 является ядерным белком, состоящим из трех доменов: N-концевого ДНК-связывающего домена, содержащего два "цинковых пальца", аутомодифицирующего домена и С-концевого каталитического домена. PARP-1 связывается через домен "цинковые пальцы" с однонитевыми разрывами спирали ДНК (SSB), расщепляет НАД+ и присоединяет множество единиц АДФ-рибозы к белкам-мишеням, таким как гистоны и различные ферменты репарации ДНК. Это приводит к образованию сильно заряженной отрицательно мишени, что, в свою очередь, приводит к расплетению и восстановлению поврежденной ДНК путем эксцизионной репарации оснований. В моделях нокаутированных мышей делеция PARP1 ухудшает репарацию ДНК, но она не является летальной для эмбриона. Дважды нокаутированные мыши по PARP-1 и PARP-2, наоборот, погибают в течение раннего эмбриогенеза, что свидетельствует о том, что два фермента проявляют не полностью перекрывающиеся функции. Повышенная экспрессия и/или активность PARP-1 была выявлена в различных опухолевых клеточных линиях, включающих злокачественные лимфомы, гепатоклеточную карциному, карциному шейки матки, колоректальную карциному, лейкоз. Указанные факторы могут позволить опухолевым клеткам противостоять генотоксическому стрессу и повысить их устойчивость к средствам, повреждающим ДНК. Как следствие, было показано, что ингибирование PARP-1 малыми молекулами делает опухолевые клетки чувствительными к цитотоксической терапии (например, темозоломид, платины, ингибиторы топоизомеразы и облучение). Значительное окно, по-видимому, существует между способностью ингибитора PARP вызывать терапевтические эффекты и нежелательные побочные эффекты. В то время как терапевтическое использование ингибиторов PARP в комбинации с повреждающими ДНК средствами является не новым, использование указанных средств в качестве монотерапии, в частности генетическое окружение опухоли с дефицитом в гомологичной рекомбинации в репарации ДНК, представляет собой новый подход. Индивидуумы с гетерозиготными мутациями в клетках зародышевой линии либо в BRCA-1, либо BRCA-2 генах, кодирующих белки, участвующие в гомологичной рекомбинации и ДНК репарации, проявляют высокий риск развития рака молочной железы и других видов опухолей в течение жизни. Опухоли, возникающие у носителей мутаций, обычно лишены аллели дикого типа и не экспрессируют функциональные белкиBRCA-1 и BRCA-2. Следовательно, потеря указанных двух белков приводит к опухоль-специфической дисфункции в репарации двухнитевых разрывов при гомологичной рекомбинации. Известно, что когда фермент PARP1 подвергается ингибированию, эксцизионная репарация оснований снижается и однонитевые разрывы,которые возникают в течение нормального клеточного цикла, сохраняются. Также было установлено, что репликативные вилки, которые встречаются в неустраненном разрыве, могут образовывать двухнитевые разрывы, которые обычно восстанавливаются путем гомологичной рекомбинации. Опухолевые клетки,имеющие дефицит в гомологичной рекомбинантной репарации, такие как мутанты BRCA-1 и BRCA-2,поэтому являются весьма чувствительными к ингибированию PARP по сравнению с клетками дикого типа. Это полностью соответствует концепции искусственной летальности, в которой два дефекта пути гомологичной рекомбинации сами по себе являются безопасными, но объединенные дефекты становятся летальными: ингибиторы PARP могут быть более эффективными для больных с опухолями со специфическими дефектами репарации ДНК без воздействия на нормальные гетерозиготные ткани. Предполагаемая популяция больных включает, кроме мутантов BRCA, которые представляют собой большую часть наследственного рака молочной железы и рака яичника, также существенную часть случаев спорадического рака с дефектами в гомологичной рекомбинантной репарации, феномена, названного"BRCAness". Например, метилирование промоторов генов BRCA-1 или FANCF и амплификация генаEMSY, который кодирует взаимодействующий белок BRCA-2. При предоставлении логического объяснения искусственной летальности PARP и BRCA-1 и BRCA-2 можно предположить, что недостаточность любого гена, который не является излишним в репарации двухнитевого разрыва, должна быть чувствительной к ингибированию PARP. Например, недостаточность гена ATM, обнаруженная у больных с Тклеточным пролимфоцитарным лейкозом, В-клеточным хроническим лимфолейкозом, раком молочной железы и мутациями CHK2 зародышевой линии, идентифицированными в саркоме, раке молочной желе-1 023112 зы, раке яичника и опухолях мозга, как также было показано, представляется искусственно летальной в комбинации с недостаточностью PARP, а также дефицитами в других известных белках HR (включаяRAD51, DSS1, RAD54, RPA1, NBS1, ATR, CHK1, CHK2, FANCD2, FANCA и FANCC). Мутации в генах FANCC и FANCG были обнаружены в опухоли поджелудочной железы. Метилирование промотора FANCF было найдено в карциномах яичника, молочной железы, шейки матки, легких. Первое клиническое доказательство того, что опухоль, возникающая в результате BRCA-мутации,может быть чувствительна к монотерапии ингибитором PARP, возникает на основе предварительных данных I фазы испытания перорального низкомолекулярного ингибитора PARP, AZD2281. В фазе I испытания в расширенной популяции носителей BRCA-мутаций частичные ответы были показаны у 4 из 10 больных раком яичника с подтвержденными мутациями BRCA-1. Другие ингибиторы PARP, такие как AG014699 и BSI-201, в настоящее время известно, прошли фазу II клинических испытаний как в комбинации со средствами, повреждающими ДНК, так и в качестве единственных средств для лечения опухолей с дефицитом BRCA. Начальные показания свидетельствуют о том, что указанные терапии проявляют низкую токсичность. Во всяком случае, соединения с высокой избирательностью по отношению к PARP-1, как полагают, являются менее токсичными с учетом длительного курса лечения. Также PARP-1 участвует в ангиогенезе. В частности, ингибирование PARP-1, по-видимому, приводит к снижению накопления транскрипционного фактора 1, индуцируемого гипоксией, важного регулятора адаптации опухолевых клеток к гипоксии. Провоспалительные стимулы инициируют высвобождение провоспалительных медиаторов, которые индуцируют образование пероксинитратных и гидроксильных радикалов, которые, в свою очередь, приводят к расщеплению однонитевой ДНК с последующей активацией PARP-1. Повышенная активация PARP-1 приводит к истощению НАД+ и запасам энергии, что завершается клеточной дисфункцией и некрозом. Данный механизм самоубийства клетки был вовлечен в патомеханизм удара, ишемии миокарда, диабета, сердечно-сосудистой дисфункции, связанной с диабетом, шока, травматического повреждения центральной нервной системы, артрита, колита,аллергического энцефаломиелита и различных других форм воспаления. Особый интерес представляет усиление PARP-1 транскрипции, опосредованной ядерным фактором kB, который играет центральную роль в экспрессии воспалительных цитокинов, хемокинов и медиаторов воспаления. Настоящее изобретение относится к замещенным производным изохинолин-1(2 Н)-она, которые избирательно ингибируют активность поли(АДФ-рибоза)полимеразы PARP-1 относительно поли(АДФрибоза)полимеразы PARP-2. Поэтому соединения, представленные в описании, пригодны в лечении пролиферативных заболеваний, таких как рак и сердечно-сосудистые заболевания, повреждение центральной нервной системы и воспаление. Исследования азотсодержащих гетероциклов, 3-фенил-(2 Н)-изохинолинонов, описаны в публикации в Journal of the Chemical Society, Perkin Transactions 1, (1977), (9), 959-65. Изохинолин-1(2 Н)-оны с фармакологической активностью описаны в публикации в Science of Synthesis (2005), 15, 839-906. Некоторые патентные заявки описывают изохинолиновые производные для лечения глаукомы, ЕР 389995, и артериосклероза и гиперлипопротеинемии, ЕР 591937. Международная публикация WO2002090334 в названии KUDOS PHARM описывает изохинолиноновые производные, используемые для ингибирования активности PARP. Международная публикация WO2008092292 описывает способ лечения патологического состояния, связанного с рецептором мелатонина, при использовании 2-замещенных (2 Н)изохинолинонов. Настоящее изобретение относится к новым 1(2 Н)-изохинолинонам, которые обладают избирательной ингибиторной активностью по отношению к PARP-1 относительно PARP-2 и, таким образом, являются пригодными в терапии рака, сердечно-сосудистых заболеваний, повреждения нервной системы и воспаления. Таким образом, первой целью настоящего изобретения являются соединения формулы I где L является линейной или разветвленной С 2-С 6 алкильной группой или L-NRR1 группа является 5-8-членной азотсодержащей гетероциклильной или гетероциклилС 1-С 6 алкильной группой;R и R1 означают независимо атом водорода, линейную или разветвленную С 1-С 6 алкильную илиCOR5-группу или, взятые вместе с атомом азота, с которым они связаны, образуют 5-8-членную азотсодержащую гетероциклильную или гетероарильную группу, в свою очередь, замещенную линейной или разветвленной C1-С 6 алкильной или COR5-группой; где R5 означает линейную или разветвленную С 1-С 6 алкильную или фенильную группу или OR8, гдеR8 означает линейную или разветвленную C1-С 6 алкильную группу;R2 означает атом водорода, галогена, нитро, линейную или разветвленную С 1-6 алкилкарбонильную группу, NH2 или линейную или разветвленную С 1-С 6 алкильную группу;R4 означает фенил или тиенил, в свою очередь, необязательно замещенный галогеном, гидроксигруппой, С 1-С 6 алкоксигруппой и фенилоксигруппой; или их фармацевтически приемлемая соль. Настоящее изобретение раскрывает скрининг-метод для идентификации соединений, проявляющих способность к связыванию некоторых белков PARP, а также зондов, используемых в таком методе. Скрининг-метод включает следующие стадии: а) приготовление реакционной смеси, содержащей исследуемую изоформу белка PARP,соединение формулы II где R13 означает атом водорода или метильную группу; В означает (СН 2)n-NH-группу, где n равно от 2 до 6; m равно 0 или 1 и X- является противоионом, и несколько разведений испытуемого соединения;b) сравнение поляризации сигнала, произведенного в отсутствие испытуемого соединения, с сигналом, произведенным в присутствии различных концентраций испытуемого соединения, иc) оценка способности испытуемого соединения замещать соединение формулы II, как определено выше, исходя из снижения уровня флуоресцентной поляризации. Настоящее изобретение также относится к способам синтеза производных изохинолин-1(2 Н)-она формулы I, как определено выше, способом, состоящим из стандартных реакций синтеза. Как указано выше, авторы изобретения обнаружили, что соединения формулы I, как определено выше, являются эффективными и избирательными ингибиторами PARP-1 относительно PARP-2 и, таким образом, являются пригодными в лечении рака, сердечно-сосудистых заболеваний, повреждения нервной системы и для противовоспалительной терапии. Поэтому соединения настоящего изобретения могут быть пригодны для лечения заболеваний, опосредованных белком PARP-1, выбранных из группы, состоящей из рака, сердечно-сосудистых заболеваний, повреждения нервной системы и воспаления. Соединения настоящего изобретения пригодны для лечения отдельных типов рака, включающих,но не ограниченных ими, карциному, такую как карцинома мочевого пузыря, молочной железы, толстой кишки, почки, печени, легкого, включая мелкоклеточный рак легкого, пищевода, желчного пузыря, яичника, поджелудочной железы, желудка, шейки матки, щитовидной железы, простаты и кожи, включая плоскоклеточную карциному; гематобластозы, развивающиеся из клеток лимфоидного ряда, включающие лейкоз, острый лимфолейкоз, острый лимфобластный лейкоз, В-клеточную лимфому, Т-клеточную лимфому, лимфому Ходжкина, неходжкинскую лимфому, волосистоклеточный лейкоз и лимфому Беркитта; гематобластозы, развивающиеся из клеток миелоидного ряда, включающие острый и хронический миелобластный лейкоз, миелодиспластический синдром и промиелоцитарную лейкемию; опухоли мезенхимального происхождения, включающие фибросаркому и рабдомиосаркому; опухоли центральной и периферической нервной системы, включающие астроцитому, нейробластому, глиому и невриному; другие опухоли, включающие меланому, семиному, тератокарциному, остеосаркому, пигментную ксеродерму, кератоксантому, фолликулярный рак щитовидной железы и саркому Капоши. Также соединения настоящего изобретения пригодны для лечения отдельных типов сердечнососудистых заболеваний, включающих, но не ограниченных ими, реперфузионное повреждение миокарда, кардиомиопатию, диабетическую сердечно-сосудистую дисфункцию. Они также пригодны для лечения отдельных типов повреждения центральной нервной системы,включающих, но не ограниченных ими, удар, повреждение головного мозга и нейродегенеративные нарушения. Соединения формулы I настоящего изобретения могут применяться в комбинации с курсом лучевой терапии или химиотерапии для одновременного, раздельного или последовательного использования в противораковой терапии. Кроме того, соединения изобретения могут использоваться для избирательного ингибирования активности белка PARP-1, который включает контактирование указанного белка с соединением формулы I в эффективном количестве. Также настоящее изобретение относится к фармацевтической композиции, содержащей одно или более соединений формулы I или их фармацевтически приемлемую соль и фармацевтически приемлемый наполнитель, носитель или разбавитель. Также настоящее изобретение предоставляет фармацевтическую композицию, содержащую соединение формулы I в комбинации с известными цитостатическими или цитотоксическими средствами,-3 023112(например, ингибиторами СОХ-2), ингибиторами матриксных металлопротеиназ, ингибиторами теломеразы, ингибиторами тирозинкиназы, средствами против рецептора ростового фактора, анти-HER средствами, анти-EGFR средствами, средствами против ангиогенеза (например, ингибиторы ангиогенеза), ингибиторами фарнезилтрансферазы, ингибиторами сигнальных путей ras-raf, ингибиторами клеточного цикла, другими cdks-ингибиторами, тубулинсвязывающими средствами, ингибиторами топоизомеразы I,ингибиторами топоизомеразы II и тому подобное. Кроме того, соединения настоящего изобретения могут применяться в фармацевтическом наборе,включающем соединение формулы I или его фармацевтически приемлемую соль, как определено выше,или его фармацевтические композиции и одно или более химиотерапевтических средств в качестве комбинированного препарата для одновременного, раздельного или последовательного использования в противораковой терапии. В другом аспекте изобретение предоставляет соединение формулы I или его фармацевтически приемлемую соль, как определено выше, для использования в качестве лекарственного средства для лечения заболевания, опосредованного белком PARP-1. Кроме того, соединение формулы I или его фармацевтически приемлемая соль, как определено выше, может использоваться в производстве лекарственного средства для лечения заболевания, опосредованного белком PARP-1. Соединение формулы I или его фармацевтически приемлемая соль, как определено выше, пригодны для использования в лечении заболевания, опосредованного белком PARP-1, предпочтительно рака, сердечно-сосудистых заболеваний, повреждения нервной системы и воспаления. Настоящее изобретение также предоставляет способы синтеза замещенных производных формулыI, полученных способом, состоящим из стандартных реакций синтеза. Если хиральный центр или другая форма центра изомера присутствует в соединении согласно настоящему изобретению, все формы такого изомера или изомеров, включая энантиомеры и диастереомеры, предназначены быть охваченными изобретением. Соединения, содержащие хиральный центр, могут быть использованы в качестве рацемической смеси, смеси, обогащенной энантиомером, или рацемическая смесь может быть разделена хорошо известными способами, и индивидуальный энантиомер может быть использован сам по себе. В случаях, когда соединения содержат ненасыщенную углеродуглеродную двойную связь, как цис-(Z)-, так и транс-(Е)-изомеры входят в объем данного изобретения. Термин "фармацевтически приемлемая соль" соединений формулы I относится к таким солям, которые сохраняют биологическую эффективность и свойства родительского соединения. Такие соли включают аддитивные соли кислоты, образованные с неорганическими кислотами, такими как хлористоводородная, бромисто-водородная, азотная, фосфорная, серная, хлорная кислоты и тому подобное, или с органическими кислотами, такими как уксусная, аскорбиновая, трифторуксусная, пропионовая, гликолевая, (D)- или (L)-молочная, (D)- или (L)-яблочная, щавелевая, фумаровая, малеиновая, метансульфоновая, этансульфоновая, бензойная, п-толуолсульфоновая, салициловая, коричная, миндальная, винная,лимонная, янтарная, изетионовая и малоновая кислоты. Фармацевтически приемлемые соли соединений формулы I также включают соли, образованные с неорганическими или органическими основаниями, например щелочными и щелочно-земельными металлами, особенно гидроксидами, карбонатами или бикарбонатами натрия, калия, кальция, аммония или магния, ациклическими или циклическими аминами, предпочтительно метиламином, этиламином, диэтиламином, триэтиламином, пиперидином и тому подобное. В предпочтительном варианте скрининг-метода, который представляет собой вторую цель настоящего изобретения, белок PARP и соединение формулы II согласно приведенному выше определению предварительно смешивают. В другом предпочтительном варианте скрининг-метода белок PARP и испытуемое соединение предварительно смешивают. Если не указано иное, при ссылке на соединения формулы I как таковые, а также на любую их фармацевтическую композицию или на любое терапевтическое лечение с использованием указанных соединений, настоящее изобретение включает все изомеры, таутомеры, гидраты, сольваты, комплексы, носители, N-оксиды и фармацевтически приемлемые соли соединений согласно данному изобретению. В случаях, когда соединения могут существовать в таутомерных формах, таких как кетоенольные таутомеры, каждая таутомерная форма рассматривается как включенная в данное изобретение, существует ли она в равновесии или преимущественно в одной форме. В отношении термина "атом галогена" авторы изобретения подразумевают атом фтора, хлора, брома или йода. В отношении термина "линейный или разветвленный С 1-С 6 алкил" авторы изобретения подразумевают любую из групп, такую как, например, метил, этил, н-пропил, изопропил, н-бутил, изобутил, третбутил, втор-бутил, н-пентил, н-гексил и тому подобное. В отношении термина "С 2-С 6 алкенил" авторы изобретения подразумевают алифатическую С 2-4 023112 С 6 углеводородную цепь, содержащую по меньшей мере одну углерод-углеродную двойную связь, которая может быть линейной или разветвленной. Типичные примеры включают, но не ограничиваются ими,этенил, 1-пропенил, 2-пропенил, 1- или 2-бутенил и тому подобное. Относительно термина "С 2-С 6 алкинил" авторы изобретения подразумевают алифатическую С 2-С 6 углеводородную цепь, содержащую по меньшей мере одну углерод-углеродную тройную связь и которая может быть линейной или разветвленной. Типичные примеры включают, но не ограничиваются ими, этинил, 1-пропинил, 2-пропинил, 1- или 2-бутинил и тому подобное. Относительно термина "С 3-С 7 циклоалкил" авторы изобретения подразумевают, если не предусмотрено иное, от 3- до 7-членное моноциклическое кольцо, состоящее полностью из углеродов, которое может содержать одну или более двойные связи, но не имеет полностью конъюгированной -электронной системы. Примерами циклоалкильных групп, без ограничения, являются циклопропан, циклобутан, циклопентан, циклопентен, циклогексан, циклогексен и циклогексадиен. Относительно термина "гетероциклил" авторы изобретения подразумевают от 3- до 8-членное, насыщенное или частично ненасыщенное карбоциклическое кольцо, где один или более атомов углерода заменены гетероатомами, такими как азот, кислород или сера. Неограничивающими примерами гетероциклильных групп являются, например, пиран, пирролидин, пирролин, имидазолин, имидазолидин, пиразолидин, пиразолин, тиазолин, тиазолидин, дигидрофуран, тетрагидрофуран, 1,3-диоксолан, пиперидин, пиперазин, морфолин и тому подобное. Термин "арил" относится к моно-, би- или поликарбоциклическому углеводороду, состоящему из 14 кольцевых систем, необязательно также конденсированных или связанных друг с другом простыми связями, где по меньшей мере одно из карбоциклических колец является "ароматическим", где термин"ароматическая" относится к полностью конъюгированной -электронной системе связей. Неограничивающими примерами таких арильных групп являются фенильные, - или -нафтильные или бифенильные группы. Термин "гетероарил", как употребляют в описании, относится к ароматическим гетероциклическим кольцам, обычно от 5- до 8-членным гетероциклам, содержащим от 1 до 3 гетероатомов, выбранных между N, О или S; гетероарильное кольцо также может быть необязательно конденсировано или связано с ароматическими и неароматическими карбоциклическими или гетероциклическими кольцами. Неограничивающими примерами таких гетероарильных групп являются, например, пиридил, пиразинил, пиримидинил, пиридазинил, индолил, имидазолил, тиазолил, изотиазолил, пирролил, фенилпирролил, фурил,фенилфурил, оксазолил, изоксазолил, пиразолил, тиенил, бензотиенил, изоиндолинил, бензоимидазолил,индазолил, хинолинил, изохинолинил, 1,2,3-триазолил, 1-фенил-1,2,3-триазолил, 2,3-дигидроиндолил,2,3-дигидробензофуранил, 2,3-дигидробензотиофенил; бензопиранил, 2,3-дигидробензоксазинил, 2,3 дигидрохиноксалинил и тому подобное. Относительно термина "полифторированный алкил" или "полифторированный алкокси" авторы изобретения подразумевают любую из описанных выше линейных или разветвленных С 1-С 6 алкильных или алкоксигрупп, которые замещены более чем одним атомом фтора, таких как, например, трифторметил, трифторэтил, 1,1,1,3,3,3-гексафторпропил, трифторметокси и тому подобное. Относительно термина "гидроксиалкил" авторы изобретения подразумевают любую из описанных выше С 1-С 6 алкильных групп, несущих гидроксильную группу, таких как, например, гидроксиметил, 2 гидроксиэтил, 3-гидроксипропил и тому подобное. Из всего описанного выше следует, что специалисту в данной области будет понятно, что любая группа, чье название является составным названием, таким как, например, ариламино, должна рассматриваться, как обычным образом истолкованная в соответствии с частями, из которых она произведена,например, аминогруппы, которая, кроме того, замещена арилом, где арил является группой, определенной выше. Аналогично, любые из терминов, такие как, например, "алкилтио", "алкиламино", "диалкиламино","алкоксикарбонил", "алкоксикарбониламино", "гетероциклилкарбонил", "гетероциклилкарбониламино","циклоалкилоксикарбонил" и тому подобное, включают группы, где алкильные, алкокси, арильные,С 3-С 7 циклоалкильные и гетероциклильные фрагменты являются такими, как описано выше. Предпочтительно настоящее изобретение предоставляет соединения формулы I, где R2 означает атом водорода или галогена, нитро, амино, линейную или разветвленную С 1-6 алкилкарбонильную группу или линейную или разветвленную С 1-С 6 алкильную группу; или их фармацевтически приемлемую соль. Более предпочтительно предоставлены соединения формулы I согласно приведенному выше определению, гдеL представляет собой линейную или разветвленную С 2-С 4 алкильную группу или L-NRR1 группа является 5-8-членной азотсодержащей гетероциклильной группой;R и R1 означают независимо атом водорода, линейную или разветвленную С 1-С 4 алкильную илиCOR5-группу или взятые вместе с атомом азота, с которым они связаны, образуют пиперидинильную,пирролидинильную, пиперазинильную или пирролильную группу;R2 означает атом водорода, хлора или фтора, или нитро, амино, линейную или разветвленную С 1-6-5 023112 алкилкарбонильную группу, или линейную или разветвленную С 1-С 4 алкильную группу;R4 означает необязательно замещенную фенильную или тиенильную группу;R5 означает линейную или разветвленную С 1-С 4 алкильную группу; или их фармацевтически приемлемая соль. Наиболее предпочтительные соединения согласно настоящему изобретению перечислены ниже: Настоящее изобретение предоставляет способы получения соединений формулы I согласно приведенному выше определению. В связи с этим способ настоящего изобретения включает следующие стадии: либо стадию 1) алкилирования соединения формулы III где R4 является группой, определенной выше, и Lg представляет собой соответствующую уходящую группу; стадию 2) циклодегидратации полученного соединения формулы V где R2 и R4 являются такими, как определено выше; стадию 3) перегруппировки образующегося соединения формулы VI где R2 и R4 являются такими, как определено выше, с получением соединения формулы VII где R2 и R4 являются такими, как определено выше; стадию 4) алкилирования соединения формулы VII, согласно приведенному выше определению,либо соединением формулы XI где R, R1, L и Lg являются такими, как определено выше, с получением соединения формулы I, как определено в п.1; либо соединением формулы XIIX'-L-Lg,где L означает необязательно замещенную линейную или разветвленную С 2-С 6 алкильную группу,Lg является группой, определенной выше, иX' представляет собой соответствующую уходящую группу; стадию 5) взаимодействия полученного соединения формулы XIII где R2, R4 и X' являются такими, как определено выше, L означает необязательно замещенную линейную или разветвленную С 2-С 6 алкильную группу,с соединением формулы XIVR-NH-R1,где R и R1 являются такими, как определено выше, с получением соединения формулы I согласно приведенному выше определению; необязательно превращение соединения формулы I в другое соединение формулы I известными химическими реакциями и/или, если желательно, превращение соединения формулы I в его фармацевтически приемлемую соль или превращение соли в свободное соединение формулы I. Другой способ настоящего изобретения включает следующие стадии: стадию 4) взаимодействия соединения формулы VIII с соединением формулы IX где R4 является группой, определенной выше, и R12 означает С 1-С 6 алкильную или арилС 1 С 6 алкильную группу; стадию 3 а) перегруппировки образующегося соединения формулы X где R4 и R12 являются такими, как определено выше,с получением соединения формулы VII где группы R2 представляет собой атом водорода и R4 определен выше; и стадию 5) алкилирования соединения формулы VII согласно приведенному выше определению,либо соединением формулы XI где R, R1, L и Lg являются такими, как определено выше, с получением соединения формулы I согласно приведенному выше определению; либо соединением формулы XII X'-L-Lg, где L означает необязательно замещенную линейную или разветвленную С 2-С 6 алкильную группу, Lg является группой, определенной выше, и X' представляет собой соответствующую уходящую группу или группу; и стадию 6) взаимодействия полученного соединения формулы XIII где R2 R4 и X' являются такими, как определено выше, L означает необязательно замещенную линейную или разветвленную С 2-С 6 алкильную группу,с соединением формулы XIVR-NH-R1,где R и R1 являются такими, как определено выше, с получением соединения формулы I согласно приведенному выше определению. Если необходимо или желательно, способ включает превращение соединения формулы I в другое соединение формулы I известными химическими реакциями и/или, если желательно, превращение соединения формулы I в его фармацевтически приемлемую соль или превращение соли в свободное соединение формулы I. Известными химическими реакциями для возможных превращений соединений формулы I или формулы XIII в другое соединение формулы I или формулы XIII являются, например: превращение А) - удаление защитной группы, если необходимо, соединения формулы I согласно приведенному выше определению, когда R и/или R1 содержат защитную группу, с тем, чтобы получить соответствующее незащищенное соединение формулы I согласно приведенному выше определению; превращение В) - превращение соединения формулы I согласно приведенному выше определению,где R4 замещен в любых свободных положениях кольца -OR12-группой, где R12 является C1-С 6 алкильной группой, в соединение формулы I согласно приведенному выше определению, где R4 замещен в любых свободных положениях -ОН-группой; превращение С) - превращение соединения формулы I согласно приведенному выше определению,где R2 означает нитрогруппу, в соединение формулы I согласно приведенному выше определению, где R2 означает аминогруппу; превращение D) - превращение соединения формулы I согласно приведенному выше определению,где R2 означает аминогруппу, в соединение формулы I согласно приведенному выше определению, гдеR2 означает атом галогена, такой как Cl, Br, F или I, через соответствующее диазопроизводное; превращение Е) - превращение соединения формулы I согласно приведенному выше определению,где R и/или R1 означают атомы водорода, в соединение формулы I, где R и R1 являются такими, как определено выше, но не COR5 или не являются оба атомами водорода; превращение F) - превращение соединения формулы I согласно приведенному выше определению,где R и/или R1 являются атомами водорода, в соединение формулы I согласно приведенному выше определению, где R или R1 означает COR5, где R5 является группой, определенной выше; превращение G) - превращение соединения формулы XIII согласно приведенному выше определению в другое соединение формулы XIII способами, описанными в пп. превращение А-превращение D,или путем превращения группы X' в соответствующую уходящую группу. Все описанные выше способы аналогичны способам, которые могут быть осуществлены хорошо известными способами и при подходящих условиях, известных в данной области. Схема 1 ниже иллюстрирует последовательность стадий способа согласно настоящему изобретению. Согласно стадии 1 способа соединение формулы III, как определено выше, взаимодействует с соединением формулы IV, где Lg является уходящей группой, такой как галоген, например бром, хлор или йод, п-толуолсульфонат, метансульфонат или трифторметансульфонат, в присутствии основания, такого как карбонат натрия, калия или цезия, гидроксид натрия или калия, триэтиламин, диизопропилэтиламин и тому подобное, в подходящем растворителе, таком как N,N-диметилформамид, N,N-диметилацетамид,ацетонитрил, ацетон, этилацетат, тетрагидрофуран, диоксан, дихлорметан и тому подобное, при температуре от 0 С до температуры кипения с обратным холодильником с получением соединения формулы V согласно приведенному выше определению. Согласно стадии 2 способа соединение формулы V согласно приведенному выше определению кипятят с обратным холодильником в аппарате, подходящем для непрерывного удаления воды, в присутствии каталитического количества кислоты, такой как п-толуолсульфокислота, камфорсульфокислота и тому подобное, в растворителях, таких как этилацетат, бензол, толуол, ксилол и тому подобное, с получением соединения формулы VI согласно приведенному выше определению. Циклодегидратация может быть осуществлена, как описано в публикации Wang, S. et al., J. Bioorg. Med. Chem. Lett. 2002, 12, 23672370. Согласно стадии 3 способа соединение формулы VI согласно приведенному выше определению нагревают в подходящем растворителе, таком как N,N-диметилформамид, N,N-диметилацетамид, тетрагидрофуран, диоксан и тому подобное, в присутствии основания, такого как гидрид натрия, амид натрия и тому подобное, в инертной атмосфере с получением соединения формулы VII согласно приведенному выше определению. Перегруппировка может быть осуществлена, как описано в публикации Schenker, K.Helv. Chim. Acta 1968, 51, 413-21 или в публикации Wang, S. et al., J. Bioorg. Med. Chem. Lett. 2002, 12,2367-2370. Согласно стадии 4 способа соединение формулы VIII согласно приведенному выше определению,используемое в виде рацемической смеси, смеси, обогащенной энантиомером, или в виде индивидуального энантиомера, может подвергаться взаимодействию неразведенным с соединением формулы IX согласно приведенному выше определению при воздействии микроволнового излучения с получением соединения формулы X, определенной выше, как описано в публикации Peukert, S. et al., Synthesis 2005, 9,1550-1554. Согласно стадии 3 а) способа обработка соединения X согласно приведенному выше определению,полученного на стадии 4 в виде рацемической смеси, смеси, обогащенной энантиомером, или в виде индивидуального энантиомера, основанием, таким как метилат натрия, этилат натрия и тому подобное, в растворителе, таком как метанол или этанол, при кипячении с обратным холодильником приводит к образованию соединения формулы VII согласно приведенному выше определению. Перегруппировка может быть осуществлена, как описано в публикации Peukert, S. et al. Synthesis 2005, 9, 1550-1554. Согласно стадии 5 способа соединение формулы VII согласно приведенному выше определению взаимодействует с соединением формулы XI, определенной выше, в присутствии подходящего основания, такого как карбонат натрия, калия или цезия, бикарбонат натрия или калия, триэтиламин, диизопропилэтиламин, пиридин, гидрид натрия или калия и тому подобное, в подходящем растворителе, таком как N,N-диметилформамид, N,N-диметилацетамид, ацетонитрил, ацетон, метанол, этанол, тетрагидрофуран, диоксан, дихлорметан и тому подобное, при температуре от 0 С до температуры кипения с обратным холодильником, с получением соединения формулы I согласно приведенному выше определению. В случае, когда Lg является бромом, реакцию предпочтительно осуществляют при комнатной температуре в N,N-диметилацетамиде в качестве растворителя, используя карбонат цезия в качестве основания. В случае, когда Lg является хлором, йодид калия добавляют и реакцию предпочтительно осуществляют при воздействии микроволнового излучения, используя карбонат калия в качестве основания и метанол в качестве растворителя. Соединение формулы VII согласно приведенному выше определению также подвергают взаимодействию с соединением формулы XII, определенной выше, где Lg и X' являются такими, как определено выше, в присутствии подходящего основания, такого как, например, карбонат натрия, калия или цезия,бикарбонат натрия или калия, триэтиламин, диизопропилэтиламин, пиридин, гидрид натрия или калия и тому подобное, в растворителе, подобном, например, N,N-диметилформамиду, N,N-диметилацетамиду,ацетонитрилу, ацетону, метанолу, этанолу, тетрагидрофурану, диоксану, дихлорметану и тому подобное,при температуре от 0 С до температуры кипения с обратным холодильником с получением соединения формулы XIII согласно приведенному выше определению. Согласно стадии 6 способа соединение формулы XIII согласно приведенному выше определению затем взаимодействует с соединением формулы XIV согласно приведенному выше определению в присутствии основания, такого как, например, карбонат натрия, калия или цезия, бикарбонат натрия или калия, триэтиламин, диизопропилэтиламин, пиридин и тому подобное, в подходящем растворителе, таком как ацетонитрил, диоксан, метанол, этанол или N,N-диметилформамид, при температуре от 0 С до температуры кипения с обратным холодильником или, альтернативно, при использовании условий микроволнового излучения с получением соединения формулы I согласно приведенному выше определению. Согласно превращению А способа, когда R или R1 в соединении формулы I содержат азотзащитные группы, такие как трет-бутоксикарбонильная, 4-метоксибензильная, 2,4-диметоксибензильная и трифенилметильная защитная группа, другое соединение формулы I согласно приведенному выше определению может быть получено путем удаления указанных защитных групп в кислых условиях, предпочтительно в присутствии неорганической или органической кислоты, такой как хлористо-водородная, трифторуксусная или метансульфокислота, трехбромистый бор или трихлорид алюминия, в подходящем растворителе, таком как дихлорметан, дихлорэтан, диоксан, низший спирт, такой как метанол или этанол,при температуре от комнатной температуры до температуры кипения с обратным холодильником. В случае, когда R или R1 в соединении формулы I содержат азотзащитные группы, такие как бензилоксикарбонил и тому подобное, другое соединение формулы I согласно приведенному выше определению может быть получено путем удаления указанных защитных групп при восстанавливающих условиях, таких как, например, в присутствии водорода и катализатора гидрирования, в подходящем растворителе, таком как этанол, метанол, этилацетат или их смесь. Катализатором обычно является металл, чаще производное палладия, такое как, например, палладий-на-угле, гидроксид палладия или палладиевая чернь. В случае, когда R или R1 в соединении формулы I содержат азотзащитные группы, такие как метоксикарбонил, этоксикарбонил, 9-флуоренилметоксикарбонил и тому подобное, другое соединение формулы I согласно приведенному выше определению может быть получено путем удаления указанных защитных групп в основных условиях, таких как, например, карбонат натрия, калия или цезия, гидроксид натрия, калия или бария, гидразин, пиперидин, морфолин и тому подобное, в подходящем растворителе,таком как метанол, этанол, вода, N,N-диметилформамид, N,N-диметилацетамид и тому подобное, при температуре от комнатной температуры до температуры кипения с обратным холодильником. Согласно превращению В способа соединение формулы I согласно приведенному выше определению, где R4 замещен в любых свободных положениях кольца -OR12, где R12 является группой, определенной выше, может быть превращено в другое соединение формулы I, где R4 замещен в любых свободных положениях кольца -ОН-группой, путем использования кислоты, такой как бромисто-водородная кислота, трехбромистый бор, хлорид алюминия и тому подобное, в подходящем растворителе, таком как ацетонитрил, дихлорметан, дихлорэтан, уксусная кислота, уксусный ангидрид и тому подобное, при температуре от 0 С до температуры кипения с обратным холодильником. Согласно превращению С способа соединение формулы I согласно приведенному выше определению, где R2 означает нитрогруппу, может быть превращено в другое соединение формулы I, где R2 означает аминогруппу, путем взаимодействия с подходящим восстанавливающим агентом, таким как молекулярный водород, циклогексен, циклогексадиен, муравьиная кислота, формиат аммония и тому подобное, в присутствии катализатора гидрирования, такого как, например, палладий-на-угле, гидроксид палладия, палладиевая чернь, Ni Ренея и тому подобное, в подходящем растворителе, таком как, метанол,этанол, диоксан и тому подобное, при температуре от комнатной температуры до температуры кипения с обратным холодильником. Альтернативно, данное превращение может осуществляться с металлами, такими как олово, железо, цинк и тому подобное, в присутствии протонной кислоты, такой как хлористоводородная, уксусная кислота и тому подобное, необязательно в подходящем растворителе, таком как метанол, этанол, при температуре от комнатной температуры до температуры кипения с обратным холодильником. Согласно превращению D способа соединение формулы I согласно приведенному выше определению, где R2 означает аминогруппу, может быть превращено в другое соединение формулы I, где R2 означает галоген, такой как атом хлора или брома, путем взаимодействия с алкилнитритом и хлоридом меди(II) или бромидом меди(II) в подходящем растворителе, таком как ацетонитрил, тетрагидрофуран и тому подобное, при температуре от 0 С до комнатной температуры. Альтернативно, такое же превращение может быть осуществлено путем использования нитрита натрия или калия и хлорида меди(I) или бромида меди(I) в присутствии хлористо-водородной или бромисто-водородной кислоты при температуре от 0 С до комнатной температуры. Кроме того, соединение формулы I согласно приведенному выше определению, где R2 или R3 означает NH2-группу, может быть превращено в другое соединение формулыI, где R2 или R3 означает фтор, путем взаимодействия с тетрафторборатом нитрозония в растворителе,таком как o-дихлорбензол, при температуре от 0 С до температуры кипения с обратным холодильником. Альтернативно, такое же превращение может быть осуществлено с алкилнитритом и трехфтористым бором в растворителе, таком как о-дихлорбензол, или с четырехфтористым кремнием в дихлорметане или с нитритом натрия или калия и комплексом фтористого водорода и пиридина, при температуре от 0 С до температуры кипения с обратным холодильником. Согласно превращению Е способа соединение формулы I, где R и/или R1 означают атом(ы) водорода, может быть превращено в другое соединение формулы I, где R и/или R1 не являются COR5 или оба атомами водорода, путем взаимодействия исходного материала с подходящим альдегидом или кетоном в присутствии восстанавливающего агента, такого как триацетоксиборгидрид натрия, триацетоксиборгидрид тетраметиламмония, цианоборгидрид натрия, боргидрид натрия, цинк, необязательно в присутствии протонной кислоты, такой как хлористо-водородная, уксусная, трифторуксусная, муравьиная кислота и тому подобное, или в присутствии кислоты Льюиса, такой как хлорид цинка, бромид цинка, хлорид олова(IV), хлорид титана(IV), трехфтористый бор и тому подобное, в подходящем растворителе, таком как метанол, этанол, дихлорметан, уксусная кислота, N,N-диметилформамид и тому подобное, при температуре от 0 С до комнатной температуры. Альтернативно, превращение может осуществляться путем использования подходящих R или R1 производных, таких как соответствующий йодид, бромид, хлорид,метансульфонат, трифторметансульфонат и тому подобное, в присутствии подходящего основания, такого как, например, карбонат натрия, калия или цезия, бикарбонат натрия или калия, триэтиламин, диизопропилэтиламин, пиридин и тому подобное, при температуре от 0 С до температуры кипения с обратным холодильником. Согласно превращению F способа соединение формулы I согласно приведенному выше определению, где R и/или R1 означают атомы водорода, может быть превращено в другое соединение формулы I,где R и/или R1 означает COR5, путем взаимодействия с R5COCl, где R5 является группой, определенной выше, в присутствии подходящего основания, такого как триэтиламин, диизопропиоэтиламин, пиридин и тому подобное, в растворителе, таком как дихлорметан, тетрагидрофуран и тому подобное, при температуре от 0 С до температуры кипения с обратным холодильником. Альтернативно, превращение может быть осуществлено путем взаимодействия с соединением формулы R5COOH, где R5 является группой,определенной выше, в присутствии подходящего связывающего агента, такого как алкилхлорформиат,подходящего карбодиимида, такого как, например, дициклогексилкарбодиимид, 1-этил-3-(3 диметиламинопропил)карбодиимид и тому подобное, необязательно в присутствии HOBt (1 гидроксибензотриазол), или других связывающих агентов, таких как, например, карбонилдиимидазол,ВОР (бензотриазол-1-илокси)-трис-(диметиламино)фосфония гексафторфосфат), TBTU (2-(1 Нбензотриазол-1-ил)-1,1,3,3-тетраметилурония тетрафторборат), HATU (О-(7-азабензотриазол-1-ил)N,N,N',N'-тетраметилурония гексафторфосфат), и тому подобное в присутствии основания, такого как триэтиламин, диизопропилэтиламин, пиридин, 4-N,N-диметиламинопиридин и тому подобное, карбонат натрия или калия, в растворителе, таком как дихлорметан, N,N-диметилформамид, тетрагидрофуран,ацетонитрил и тому подобное, при температуре от 0 С до температуры кипения с обратным холодильником. Согласно превращению G способа соединение формулы XIII согласно приведенному выше определению, где X' означает OH-группу, может быть превращено в другое соединение формулы XIII, где X' означает другую уходящую группу. Указанное превращение может быть достигнуто в присутствии подходящей системы галогенирования, такой как I2/Ph3P или CBr4 с имидазолом, в подходящем растворителе, таком как, например, дихлорметан, N,N-диметилформамид, тетрагидрофуран, ацетонитрил и тому подобное, при температуре от 0 С до температуры кипения с обратным холодильником. Все описанные выше способы являются аналогичными способами, которые могут быть осуществлены хорошо известными способами и при подходящих условиях, известных в данной области, как сообщалось, например, в публикации Smith, Michael - March's Advanced Organic Chemistry: reactions mechanisms andstructure - 6th Edition, Michael B. Smith and Jerry March, John WileySons Inc., New York (NY), 2007. Любые из промежуточных соединений описанных выше способов могут быть превращены в другое промежуточное соединение посредством манипулирования аналогичным способом, как в любой реакции превращения, описанной выше. Исходя из описанного выше, специалисту в данной области будет понятно, что любое соединение формулы I, несущее функциональную группу, которая может быть в дальнейшем превращена в другую функциональную группу, превращающееся путем обработки способами, хорошо известными в данной области, в другие соединения формулы I, предназначено быть включенным в объем настоящего изобретения. Согласно любому варианту способа получения соединений формулы I исходные материалы и любые другие вещества, участвующие в реакции, являются известными или их легко получить известными методами. Соединения формулы III, (IV), (VIII), (IX), (XI) и (XII) являются коммерчески доступными или могут быть получены известными методами. Исходя из описанного выше, специалисту в данной области будет понятно, что при получении соединений формулы I любым из описанных выше вариантов способа необязательные функциональные группы в исходных материалах или в их промежуточных соединениях, которые могли вызывать нежелательные побочные реакции, следует соответствующе защитить согласно обычным процедурам. Аналогичным образом, превращение этих последних в незащищенные соединения может осуществляться согласно известным процедурам, описанным, например, в публикации Greene, Theodora W. and Wuts, PeterG.M. Protective Groups in Organic Synthesis, Third Edition, John WileySons Inc., New York (NY), 1999. Как можно легко оценить, если соединения формулы I, полученные способом, описанным выше,получают в виде смеси изомеров, их разделение при использовании обычных методов на индивидуальные изомеры формулы I входит в объем настоящего изобретения. Обычные методы разделения рацематов включают, например, разделительную кристаллизацию производных диастереоизомерной соли или препаративную хиральную ВЭЖХ и тому подобное. Обычные методы разделения соединений, содержащих один или более асимметричных центров, описаны, например, в публикации Jacques, Jean; Collet, Andr; Wilen, Samuel H., -Enantiomers, Racemates and Resolutions, John WileySons Inc., New York (NY), 1981. Кроме того, соединения формулы I согласно изобретению также могут быть получены методами комбинаторной химии, широко известными в данной области, например осуществлением описанных выше реакций между промежуточными соединениями, выполняемых параллельно и/или последовательно, и путем обработки в условиях твердофазного синтеза (SPS). Как установлено выше, зонды, используемые в скрининг-методе, являются соединениями формулыII, согласно приведенному выше определению. Предпочтительно настоящее изобретение раскрывает зонды формулы II согласно приведенному выше определению, характеризующиеся тем, что противоион,представленный X-, означает перхлорат, трифторацетат и тому подобное, R13 означает атом водорода или метил, m равно 0 или 1; когда m равно 1, n предпочтительно равно 6; более предпочтительно X- означает трифторацетат. Соединения формулы II, как определено выше, являются весьма эффективными зондами в связывании с белками PARP, охватывающими как нативные белки полной длины, так и их фрагменты. Поляризацию сигнала можно измерить, например, посредством устройства для прочтения планшета, такого как Saphire2 (Tecan). Способность испытуемого соединения к замещению коррелирует со сродством соединения к карману НАД фермента. Константа связывания по сродству (KD) и DC50 испытуемого соединения могут быть определены, как описано в разделе Примеры. Испытание изобретения основано на использовании в качестве зондов соединений формулы II согласно приведенному выше определению, которые образуют флуоресцентный сигнал. Предпочтительными соединениями формулы II, как определено выше, являются Р 1 9-диметиламино-11,11-диметил-1-(3-метил-[(6-оксо-5,6-дигидрофенантридин-2-илкарбамоил)метил]карбамоилпропил)-2,3,4,11-тетрагидронафто[2,3-g]хинолиния трифторацетат; Р 2 9-диметиламино-11,11-диметил-1-[3-(3-[(6-оксо-5,6-дигидрофенантридин-2-илкарбамоил)метил]аминопропилкарбамоил)пропил]-2,3,4,11-тетрагидронафто [2,3-g]хинолиния трифторацетат и Р 3 9-диметиламино-11,11-диметил-1-[3-(6-[(6-оксо-5,6-дигидрофенантридин-2-илкарбамоил)метил]аминогексилкарбамоил)пропил]-2,3,4,11-тетрагидронафто [2,3-g]хинолиния трифторацетат. Настоящее изобретение также раскрывает способ получения соединения формулы II, как определено выше, который включает стадию i) либо взаимодействие соединения формулы XV с получением соединения формулы XVII где R13 и В являются такими, как определено выше, и m равно 0; или стадию ia) взаимодействия соединения формулы XV согласно приведенному выше определению, с соединением формулы XVIa где R13 и В являются такими, как определено выше, m равно 1 и R14 означает атом водорода, метоксикарбонил, этоксикарбонил, трет-бутоксикарбонил, бензилоксикарбонил, 9-флуоренилметоксикарбонил или тому подобное; и стадию ib) превращения, если необходимо, получаемого соединения формулы XVIIa где R13 и В являются такими, как определено выше, m равно 1 и R14 означает метоксикарбонильную,этоксикарбонильную,трет-бутоксикарбонильную,бензилоксикарбонильную,9 флуоренилметоксикарбонильную группу или тому подобное, в соединение формулы XVII, где R14 означает атом водорода; стадию ii) сочетания получаемого соединения формулы XVII согласно приведенному выше определению с соединением формулы XVIII где X- является группой, определенной выше, с получением конечного соединения формулы II согласно приведенному выше определению и, если необходимо, превращение соединения формулы II в другое соединение формулы II, где X- является другой группой. Исходное соединение формулы XV может быть получено, как подробно описано, см., например,WO 2001042219; соединения формулы XVIII описаны в публикации Cha, J. H. et al., J. Med. Chem. 2005,48, 7513-7516, и АТТО 610 флуоресцентный фрагмент, активированный как его NHS-сложный эфир, является коммерчески доступным (АТТО-ТЕС GmbH, Siegen, Germany). На схеме 2 ниже представлено получение соединений формулы II, где R13, R14, B и m имеют значения, определенные выше. Схема 2 Согласно стадиям i) и ia) способа соединение формулы XV согласно приведенному выше определению взаимодействует с соединением формулы XVI или XVIa согласно приведенному выше определению в присутствии основания, такого как, например, гидроксид натрия или калия, карбонат натрия, калия или цезия, бикарбонат натрия или калия, триэтиламин, диизопропилэтиламин, пиридин и тому подобное, в подходящем растворителе, таком как ацетонитрил, диоксан, метанол, этанол или N,N-диметилформамид,- 17023112 при температуре от 0 С до температуры кипения с обратным холодильником с получением, исходя из соединения XVI согласно приведенному выше определению, соединения формулы XVII, определенной выше, или, исходя из соединения формулы XVIa, определенной выше, соединения формулы XVIIa согласно приведенному выше определению. Согласно стадии ib) способа соединение формулы XVIIa, где m=1, R14 означает метоксикарбонильную, этоксикарбонильную, трет-бутоксикарбонильную, бензилоксикарбонильную, 9-флуоренилметоксикарбонильную группу или тому подобное, превращают в соединение формулы XVI согласно приведенному выше определению путем удаления соответствующей азотзащитной группы. В частности,защитные группы, такие как трет-бутоксикарбонил и тому подобное, могут быть удалены в кислых условиях, предпочтительно в присутствии неорганической или органической кислоты, такой как хлористоводородная, трифторуксусная или метансульфокислота, в подходящем растворителе, таком как дихлорметан, дихлорэтан, диоксан, низший спирт, такой как метанол или этанол, при температуре от комнатной температуры до температуры кипения с обратным холодильником. Защитные группы, такие как бензилоксикарбонил и тому подобное, могут быть удалены посредством подходящего восстанавливающего агента, такого как молекулярный водород, циклогексан, муравьиная кислота, формиат аммония и тому подобное, в присутствии катализатора гидрирования, такого как, например, палладий-на-угле, гидроксид палладия, палладиевая чернь, Ni Ренея и тому подобное, в подходящем растворителе, таком как метанол,этанол, диоксан и тому подобное, при температуре от комнатной температуры до температуры кипения с обратным холодильником. Защитные группы, такие как метоксикарбонил, этоксикарбонил, 9-флуоренилметоксикарбонил и тому подобное, могут быть удалены в основных условиях, таких как, например, в присутствии карбоната натрия, калия или цезия, гидроксида натрия, калия или бария, гидразина, пиперидина, морфолина и тому подобное, в подходящем растворителе, таком как метанол, этанол, вода, N,N-диметилформамид, N,Nдиметилацетамид и тому подобное, при температуре от комнатной температуры до температуры кипения с обратным холодильником. Согласно стадии ii) способа соединение формулы XVII согласно приведенному выше определению взаимодействует с соединением формулы XVIII в присутствии подходящего основания, такого как триэтиламин, диизопропилэтиламин, пиридин и тому подобное, в растворителе, таком как N,Nдиметилформамид, N,N-диметилацетамид и тому подобное, при температуре от 0 С до комнатной температуры с получением желаемых соединений формулы II. Фармакология. Активности соединений оценивали путем измерения ингибирования образования цепей поли(АДФрибоза) (PAR) как маркера ингибирования PARP-1.PARP-1 является полимеразой, индуцируемой повреждением ДНК, которая катализирует расщепление НАД+ до никотинамида и АДФ-рибозы и затем использует АДФ-рибозу для синтеза разветвленных, подобных нуклеиновой кислоте полимеров поли(АДФ-рибоза). In vivo, наиболее распространенным поли(АДФ-рибозилированным) белком является PARP-1 как таковой, за которым следуют гистоны. Белок PARP-1 ответственен за 90% активности, индуцируемой повреждением ДНК, в то время как остальные 10% относятся к PARP-2. Краткие формы и сокращения, используемые в описании, имеют следующее значение:PAR - (поли(АДФ-рибоза,MEM - (минимальная поддерживающая среда),FCS - (фетальная телячья сыворотка),FBS - (фетальная бычья сыворотка),PBS - (забуференный фосфатом физиологический раствор),LC-MS - (жидкостная хроматография-масс-спектрометрия) (ЖХ-МС),HPLC - (высокоэффективная жидкостная хроматография) (ВЭЖХ),DC50 - (половина максимальной концентрации, приводящей к замещению),IC50 - (половина максимальной концентрации, приводящей к ингибированию),STD - (стандартное отклонение). Клеточный анализ. Активность ингибиторов PARP-1 в клетке оценивали путем измерения ингибирования образованияPAR, индуцированного перекисью водорода в клетках HeLa (ECACC). Уровни PAR в клетке измеряли посредством иммуноцитохимии и количественно определяли, используя прибор ArrayScan vTi (CellomicsThermo Scientific). Исследования выполняли следующим образом: 6000 клеток/лунка высевали в 96-луночные планшеты (Perkin Elmer) в среде MEM/10% FCS и инкубировали в течение 24 ч при 37 С, 5% диоксида углерода. Затем добавляли испытуемые соединения при требуемой концентрации в течение 30'. Затем повреждение ДНК индуцировали добавлением перекиси водорода при концентрации 0,1 мМ в течение 15 мин. Концентрационные кривые строили, используя для клеток среду MEM/10% FCS и растворы соединения в ДМСО, конечная концентрация ДМСО в пробе составляла 0,002% (об./об.). Две параллельные лунки для каждой концентрационной точки использовали с обычной самой высокой концентрацией соединения,- 18023112 составляющей 20 мкМ, и последовательное разведение 1:3. Планшеты сушили и фиксировали путем добавления холодного раствора смеси метанол/ацетон (70:30) в течение 15 мин при комнатной температуре, фиксирующий раствор отсасывали, лунки сушили на воздухе в течение 5 мин и затем подвергали дегидратации в PBS. Сайты неспецифического связывания блокировали путем инкубации лунок в течение 30 мин в буфере PBS, содержащем 5% (мас./об.) FBS, 0,05% твин 20. Затем лунки инкубировали в течение 1 ч при комнатной температуре в буфере PBS, содержащем моноклональное антитело мыши противPAR (анти-PAR, мышиное mAb 10 Н, Tulip Cat1020), разведенное 1:200 в блокирующем растворе. После 3 промывок в PBS лунки инкубировали в PBS (мас./об.) 5% FBS 0,05% твин 20, содержащем 2 мкг/мл Су 2-конъюгированного вторичного козьего антитела против антитела мыши (Amersham Pharmacia Biotech cat.PA 42002) (максимум абсорбции при 489 нм, максимум флуоресценции при 506 нм) и 1 мкг/мл DAPI (максимум абсорбции при 359 нм, максимум флуоресценции при 461 нм) (4',6-диамидино 2-фенилиндола дилактат) (Sigma cat. D9564), высокочувствительного красителя для окрашивания нуклеиновых кислот. После промывания 3 раза в PBS клеточную иммунореактивность PAR оценивали, используя прибор ArrayScan vTi с объективом Zeiss 10X 0,5 N.A., применяя программу Cytotoxicity.V3(Cellomics/Thermo Fisher) с фильтром XF100. По меньшей мере 10 полей, соответствующих по меньшей мере 900 клеткам, просчитывали для каждой лунки. Величины IC50 представляют собой концентрацию соединения, при которой сигнал PAR в клетке снижается на 50% по сравнению с необработанными контролями. Следующую формулу использовали:IC50=низшая точка + (верхняя точка-низшая точка)/(1+10LogEC50-X,где X является логарифмом концентрации; параметр IC50 представляет собой ответ; кривая IC50 начинается с низшей точки и уходит к верхней точке, имея сигмовидную форму. Принимая во внимание описанные выше исследования, соединения формулы I оказывают ингибирующее действие на образование PAR с величинами IC50 ниже чем 10 мкМ (табл. 3). Биохимический анализ. Сродство испытуемых соединений и их избирательность по отношению к различным изоформамPARP, представляющим интерес, количественно определяли с помощью анализа замещения. Анализ основан на использовании зонда формулы II, который связывается со связывающим карманом НАД и проявляет способность к значительному изменению поляризации сигнала, наблюдаемого при связывании зонда с PARP-1, -2 и -3. Зонд (II) испытывали относительно его способности связываться с FL PARP-1, -2 и -3 посредством титрования. Затем данные анализа оценивали (Z'-фактор), а также замещение зонда его остовом и известными коммерчески доступными ингибиторами PARP. Во всех экспериментах поляризацию сигнала измеряли, используя считывающее устройство для планшетов Saphire2 (Tecan). Анализ данных осуществляли, используя программу Dynafit. В частности, данные титрования подводили к следующему равновесию: фермент + зонд == комплекс фермент-зонд, в то время как данные анализа замещения подводили к следующему равновесию: фермент + зонд == комплекс фермент-зонд, фермент + соединение == комплекс фермент-соединение, тем самым связывание зонда и соединения с ферментом является взаимоисключающим (подлинный конкурентный механизм). Данные замещения также согласовывали, используя программу табличных расчетов Excel (Microsoft Inc. Seattle, USA) для четырех параметров логистической модели (4PL), или модель наклона Хилла для расчета DC50, где величина DC50 представляет собой концентрацию соединения, при которой поляризация сигнала снижается на 50% по сравнению с необработанными контролями. Эксперименты с титрованием осуществляли следующим образом: 50 нМ зонд (соединение PI), FLPARP-1, 2 и 3 при концентрациях от 5 мкМ до 0, с последовательностью разведений 1:1,5 в 50 мМ трисHCl, рН 7,8, 150 мМ NaCl, 10 мМ MgCl2, 0,001% тритон Х 100, 1% ДМСО (буфер 1). Подобную процедуру использовали для титрования соединения Р 3. Полученные результаты (представленные в табл. 1 ниже) указывают на то, что зонд (соединение Р 1) проявляет способность связываться со всеми из испытуемых изоформ PARP. Что касается соединения Р 3, значение KD получено только для PARP-1. Фактор Z' (Z'=1-(3(SD-зонд + белок + SD-зонд)/(среднее значение зонд + белок-среднее значение зонд определяли следующим образом: 50 нМ зонд (соединение Р 1), 250 нМ PARP-1 и 2, 200 нМ PARP-3. Концентрация PARP-1 была равна 100 нМ, когда соединение Р 3 использовали в качестве зонда. Во всех случаях величины Z' были выше чем 0,7, что указывает на то, что анализы были надежными (табл. 1). Исследование было проверено путем использования соединений 3-аминобензамида (3-АВ) и PJ-34 в анализе замещения, выполненном следующим образом: вначале были сделаны последовательные разведения испытуемых соединений в 100% ДМСО и затем растворы в ДМСО разбавлены буфером для анализа 1 до конечной концентрации ДМСО в пробе 1%. Соединение 3-АВ тестировали при концентрации 100 мкМ, как самой высокой концентрации, в то время как самой высокой концентрацией PJ-34 была концентрация 10 мкМ. Ферменты присутствовали при конечной концентрации 250 нМ для PARP-1 (100 нМ, когда соединение Р 3 использовали в качестве зонда) и PARP-2, в то время как 200 нМ использовали для PARP-3. Конечная концентрация зонда (соединение Р 1 или соединение Р 3) составляла 50 нМ. Смесь ферментов и зонда (соединение Р 1 или соединение Р 3) добавляли к предварительно разведенным соединениям. Результаты (табл. 2) указывают на то, что зонд (соединение Р 1 или соединение Р 3) мог быть полностью замещен 3-АВ и PJ-34 из всех испытуемых изоформ PARP, что указывает на то, что связывание зондов (соединение Р 1 или соединение Р 3) является специфическим. В соответствии с этим константы связывания по сродству (KD) определяли путем согласования с подлинным конкурентным механизмом. Величины KD являются средними из трех независимых экспериментов. 3-АВ, как предполагали, не оказался избирательным среди изоформ PARP и продемонстрировал низкое сродство относительно PJ-34. Таблица 2 Пределы чувствительности анализа, основанные на погрешности выравнивания 50%. Вместе взятые полученные результаты указывают на то, что анализ замещения является специфическим. Кроме того, он дает возможность количественно оценить активность стандартных испытуемых ингибиторов PARP и, следовательно, избирательность между образцами. Такой же анализ либо с соединением Р 1, либо соединением Р 3 использовали для оценки некоторых характерных соединений формулы I, данные которого представлены в табл. 3. Анализ осуществляли с соединением Р 3 в качестве зонда. Во всех других случаях соединение Р 1 использовали в качестве зонда. Из вышеприведенного следует, что специалисту в данной области будет понятно, что соединения формулы I являются эффективными и избирательными ингибиторами PARP-1, что продемонстрировано как биохимическими, так и клеточными исследованиями. Фармакокинетика. Фармакокинетический профиль и пероральную биодоступность соединений исследовали на мыши(Balb, Nu/Nu, Harlan, Italy) в специальном фармакокинетическом изучении. Соединения приготавливали в смеси 10% твин 80/декстроза для внутривенного струйного введения, в то время как пероральные введения осуществляли, используя соединения, приготовленные в 0,5% метилцеллюлозе. Одно введение при дозе 10 мг/кг было сделано, и три самца животных использовали для каждого способа. Все образцы крови брали из подкожной вены через 5, 30 мин, 1, 6, 24 ч после внутривенного введения и 15, 30 мин, 1,6, 24 ч после перорального введения. Образцы плазмы получали путем осаждения белков плазмы, добавляя 200 мкл метанола к 10 мкл плазмы в 96-луночном планшете. После закрытия крышкой и перемешивания встряхиванием планшет центрифугировали в течение 15 мин при 3700 об/мин при 6 С. Супернатант рассматривали как конечный экстракт и вносили в систему ЖХ-МС-МС (система ВЭЖХ: HewlettPackard 1100 series с использованием аналитической колонки Atlantis HILIC Silica 502,1 мм 5,0 мкМ; прибор МС: масс-спектрометр Perkin Elmer SCIEX API 2000, и ионизацию осуществляли с Turbo IonSpray в режиме определения положительных ионов). Низший предел количественного анализа составлял 5,0 нг/мл, верхний предел количественного анализа составлял 10000 нг/мл. Анализ осуществляли при использовании пакета программ Watson (версия 6.4.0.04) и электронных таблиц Excel (Microsoft Inc. Seattle, USA). Использовали некомпартментный метод (линейно-логарифмический метод трапеций и линейно-регрессионный анализ обычных логарифмически преобразованных концентраций в плазме против времени). После внутривенного дозирования С 0 была установлена равной С 0,083. Абсолютную биодоступность (F) рассчитывали, исходя из отношения средних значений дозонормализированной концентрации в плазме AUC (площадь под кривой концентрации) при пероральном введении к таковым при IVAUC - площадь под кривой концентрации в плазме против времени вплоть до последней определяемой концентрации,Cl - плазменный клиренс,Смакс - максимальная концентрация в плазме,Т 1/2 - конечный период полувыведения,Vdss - объем распределения при стационарном состоянии. Некоторые характерные соединения формулы I оценивали в отношении их фармакокинетических параметров, как представлено в табл. 4 в виде средней величины. Таблица 4 Из вышеприведенного следует, что специалисту в данной области будет понятно, что соединения формулы I обладают фармакокинетическими профилями и пероральной доступностью от хороших до превосходных степеней.In vivo исследования эффективности. Самцов мышей Balb, бестимусных Nu/Nu из Harlan (Italy) содержали в соответствии с Директивой Совета Европейского Сообщества no. 86/609/EEC, касающейся защиты животных, используемых для экспериментальных или других научных целей, в клетках с бумажным фильтрующим покрытием, пищей и стерилизованной и подкисленной водой. Фрагменты Capan-1 раковых опухолей поджелудочной железы человека имплантировали подкожно. Мышей, несущих пальпируемую опухоль (100-200 мм 3), отбирали и располагали в случайном порядке в контрольные и обрабатываемые группы. Каждая группа включала семь животных. Обработку начинали по прошествие одного дня после рандомизации. Соединение формулы I вводили пероральным путем в виде суспензии в метилцеллюлозе при дозах 100 мг/кг ежедневно или дважды в день в течение указанных периодов времени. Размер опухоли регулярно измеряли в течение экспериментов калиперами, массу опухоли рассчитывали, как описано в публикации Simeoni M.et al., Cancer Res 64, 1094-1101 (2004). Ингибирование роста опухоли (TGI, %) рассчитывали согласно уравнению: %TGI=100-(средняя масса опухоли обработанной группы/средняя масса опухоли контрольной группы)100. Некоторые характерные соединения формулы I, соединение (25), соединение (39) и соединение (11) оценивали относительно их противоопухолевой активности в качестве единственного средства на модели мыши с Capan-1 BRCA-2-мутациями. Токсичность оценивали на основе снижения массы тела и уровня выживаемости животного. Результаты представлены в табл. 5. Характерное соединение формулы I, соединение (39) оценивали относительно его противоопухолевой активности на модели мыши с Capan-1 BRCA-2-мутациями в комбинации с темозоломидом. Соединение (39) вводили пероральным путем при дозе 100 мг/кг два раза в день в течение десяти последующих дней (дни от 1 до 10). Темозоломид вводили пероральным путем при дозе 50 мг/кг на дни 3, 4, 5, 6 и 7. Рост опухоли и массу тела измеряли каждые 3 дня. Рост опухоли оценивали посредством калипера. Оба диаметра записывали, и массу опухоли рассчитывали по следующей формуле: длина (мм)ширина 2/2. Влияние противоопухолевой обработки оценивали как задержку начала экспоненциального роста опухоли (см. ссылку Anticancer drugs 7:437-60, 1996). Указанную задержку (Т-С величина) определяли как разницу времени (в днях), требуемого для достижения опухолями обрабатываемой группы (Т) и контрольной группы (С) предопределенного размера (1 г). Токсичность оценивали на основе снижения массы тела и уровня выживаемости животного. Результаты представлены в табл. 6. Таблица 6 Пероральные обработки, сделанные на дни от 1 до 10 дважды в день. Обработки, сделанные пероральным путем один раз в день на дни 3-7.Обработки соединением (39) на дни от 1 до 10, обработки темозоломидом, дни 3-7. Наблюдаемая задержка во времени (Т-С), когда соединение (39) комбинировали с темозоломидом,превосходила ожидаемую задержку при простом суммировании Т-С, полученной путем индивидуальных обработок указанными средствами, что свидетельствует о значительном синергизме действия соединения (39) и темозоломида. Из представленного выше следует, что специалист в данной области будет понимать, что соединения формулы I обладают хорошими ингибирующими рост опухоли активностями в качестве единственного средства и синергическими ингибирующими рост опухоли активностями в комбинации с цитотоксическими агентами. Экспериментальная часть. Что касается ссылки на любое соединение формулы I согласно изобретению, необязательно в виде фармацевтически приемлемой соли, следует смотреть экспериментальную часть и формулу изобретения. Ниже представлены примеры получения соединений настоящего изобретения и ссылочные примеры,которые даны только для общего сведения. Ссылаясь на последующие примеры, соединения согласно настоящему изобретению и ссылочные примеры были синтезированы при использовании представленных в описании способов или способов, которые хорошо известны в данной области. Краткие формы и сокращения, используемые в описании, имеют следующие значения: мин - минуты,ммоль - миллимоли,ДМСО - диметилсульфоксид (ДМСО),ESI - ионизация электрораспылением. С целью лучше иллюстрировать настоящее изобретение, без принятия его любого ограничения,следующие примеры представлены в данной работе. Как употребляют в описании, символы и условные обозначения, используемые в способах, на схемах и в примерах, соответствуют тем, которые используют в современной научной литературе, напримерJournal of the American Chemical Society или the Journal of Biological Chemistry. Если не указано иное, все материалы были получены от коммерческих фирм-поставщиков наилучшего качества и использовались без дальнейшей очистки. Безводные растворители, такие как N,N- 23023112 диметилформамид, тетрагидрофуран, дихлорметан и толуол, были получены от компании Aldrich Chemical Company. Все реакции с участием чувствительных к воздуху и влаге соединений проводили в атмосфере азота или аргона. Общая очистка и аналитические методы. Флэш-хроматографию осуществляли на силикагеле (Merck качество 9395, 60 А). ВЭЖХ осуществляли на колонке Waters X Terra RP 18 (4,650 мм, 3,5 мкм), используя систему ВЭЖХ Waters 2790, снабженную детектором 996 Waters PDA и одноквадрупольным масс-спектрометром Micromass mod. ZQ с источником ионизации электрораспылением (ESI). Подвижная фаза А состояла из 5 мМ аммонийацетатного буфера (рН 5,2 с уксусной кислотой-ацетонитрилом 95:5) и подвижная фаза В состояла из смеси вода-ацетонитрил (5:95). Градиент от 10 до 90% В за 8 мин, удерживание 90% В за 2 мин. УФ-детектор при 220 и 254 нм. Скорость потока 1 мл/мин. Впрыскиваемый объем 10 мкл. Сканирование в полном диапазоне массовых чисел от 100 до 800 а.е.м. Напряжение на капилляре было 2,5 кВ; температура источника составляла 120 С; напряжение на конусе составляло 10. В. Массы даны в виде отношения m/z. При необходимости, соединения очищали препаративной ВЭЖХ на колонке Waters Symmetry C18(1950 мм, 5 мкм) или на колонке Waters X Terra RP 18 (30150 мм, 5 мкм), используя систему препаративной ВЭЖХ Waters 600, снабженную детектором 996 Waters PDA и одноквадрупольным массспектрометром с ионизацией электрораспылением с режимом определения положительных ионов Micromass mod. ZMD. Подвижная фаза А состояла из смеси вода-0,01% трифторуксусная кислота и подвижная фаза В состояла из ацетонитрила. Градиент от 10 до 90% В за 8 мин, удерживание 90% В 2 мин. Скорость потока 20 мл/мин. В альтернативном варианте подвижная фаза А состояла из смеси вода-0,1%NH3 и подвижная фаза В состояла из ацетонитрила. Градиент от 10 до 100% В за 8 мин, удерживание 100% В 2 мин. Скорость потока 20 мл/мин. 1 Н ЯМР-спектрометрию осуществляли на спектрометре Mercury VX 400, работающем при 400,45 МГц, снабженном 5-мм зондом для метода двойного резонанса [1 Н (15N-31P) IDPFG Varian]. Некоторые сокращения, принятые для спектров ЯМР:sxt. - секстет. Пример 1. Стадия 1. 2-[2-(3-Метоксифенил)-2-оксоэтокси]бензамид. К суспензии 5 г (36,5 ммоль) салициламида в 60 мл N,N-диметилформамида добавляли 8,36 г (36,5 ммоль) 2-бром-1-(3-метоксифенил)этанона и 7,57 г (54,7 ммоль) карбоната калия. Смесь перемешивали при комнатной температуре в течение ночи. Воду добавляли при перемешивании и осадок фильтровали,промывали водой и сушили в вакууме с получением 9 г указанного в заголовке соединения (90%). 1H ЯМР (DMSO-d6)(м.д.): 8,41 (шир.с, 1 Н), 7,99 (дд, J=7,8, 1,8 Гц, 1 Н), 7,69 (шир.с, 1 Н), 7,67 (ддд,J=7,7, 1,5, 0,9 Гц, 1 Н), 7,57 (дд, J=2,5, 1,5 Гц, 1 Н), 7,52 (т, J=8,0 Гц, 1 Н), 7,51 (ддд, J=8,4, 7,3, 2,0 Гц, 1 Н),7,29 (ддд, J=8,3, 2,6, 0,9 Гц, 1 Н), 7,29 (дд, J=8,3, 0,9 Гц, 1 Н), 7,09 (ддд, J=7,8, 7,3, 1,0 Гц, 1 Н), 5,77 (с, 2 Н),3,85 (с, 3 Н). Согласно такой же методике, но используя соответственно замещенные исходные материалы, были получены следующие соединения. 2-(2-Оксо-2-фенилэтокси)бензамид. 1 Н ЯМР (DMSO-d6)(м.д.): 8,41 (шир.с, 1 Н), 8,08 (дд, J=8,4, 1,2 Гц, 2 Н), 7,99 (дд, J=7,7, 1,8 Гц, 1 Н),7,72 (т, J=7,4 Гц, 1 Н), 7,69 (шир.с, 1 Н), 7,60 (т, J=7,7 Гц, 2 Н), 7,51 (ддд, J=8,2, 7,4, 2,0 Гц, 1 Н), 7,28 (д,J=8,2 Гц, 1 Н), 7,09 (т, J=7,5 Гц, 1 Н), 5,78 (с, 2 Н). 5-Ацетил-2-(2-оксо-2-фенилэтокси)бензамид. 1 Н ЯМР (DMSO-d6)(м.д.): 8,56 (д, J=2,4 Гц, 1 Н), 8,35 (шир.с, 1 Н), 8,08 (дд, J=8,2, 1,5 Гц, 2 Н), 8,09(шир.с, 6 Н), 3,51 (т, J=6,23 Гц, 2 Н), 6,85 (д, J=8,79 Гц, 2 Н), 7,51 (ддд, J=8,00, 7,08, 1,28 Гц, 3 Н), 7,51 (д,J=8,67 Гц, 2 Н), 7,77 (ддд, J=8,18, 7,02, 1,28 Гц, 1 Н), 7,86 (д, J=7,95 Гц, 1 Н), 8,20 (ддд, J=7,93, 1,10, 0,49 Гц,1 Н), 9,75 (с, 1 Н), 11,05 (с, 1 Н). Стадия 2. 3-(3-Метоксифенил)-4 Н-бензо[f][1,4]оксазепин-5-он. Тщательно перемешиваемую суспензию 9 г (31,5 ммоль) 2-[2-(3-метоксифенил)-2 оксоэтокси]бензамида и 0,3 г (1,58 ммоль) п-толуолсульфокислоты в толуоле (0,3 л) кипятили с обратным холодильником с насадкой Дина-Старка в течение 2 ч. После концентрирования растворителя при пониженном давлении остаток обрабатывали этилацетатом и диэтиловым эфиром и полученное твердое вещество фильтровали, промывали смесью описанных выше растворителей, сушили в вакууме с получением 7,55 г указанного в заголовке соединения (83%). 1H ЯМР (DMSO-d6)(м.д.): 9,76 (с, 1 Н), 7,78 (дд, J=7,8, 1,6 Гц, 1 Н), 7,57 (ддд, J=8,1, 7,3, 1,8 Гц, 1 Н),7,30 (т, J=8,0 Гц, 1 Н), 7,29 (тд, J=7,5, 1,2 Гц, 1 Н), 7,14 (дд, J=8,1, 0,8 Гц, 1 Н), 7,05 (ддд, J=7,7, 1,6, 0,9 Гц,1 Н), 7,01 (дд, J=2,3, 1,8 Гц, 1 Н), 6,94 (ддд, J=8,3, 2,5, 0,8 Гц, 1 Н), 6,91 (д, J=0,4 Гц, 1 Н), 3,78 (с, 3 Н). Согласно такой же методике, но при использовании соответственно замещенных исходных материалов были получены следующие соединения. 3-Фенил-4 Н-бензо[f][1,4]оксазепин-5-он. 1H ЯМР (DMSO-d6)(м.д.): 7,10 (с, 1 Н), 7,14 (дд, J=8,12, 0,92 Гц, 1 Н), 7,28 (тд, J=7,50, 1,15 Гц, 1 Н),7,31 (дд, J=5,13, 1,34 Гц, 1 Н), 7,56 (ддд, J=8,39, 7,11, 1,83 Гц, 1 Н), 7,57 (дд, J=5,13, 2,93 Гц, 1 Н), 7,67 (дд,J=2,87, 1,28 Гц, 1 Н), 7,75 (дд, J=7,75, 1,65 Гц, 1 Н), 9,80 (с, 1 Н). Стадия 3. 4-Гидрокси-3-(3-метоксифенил)-2 Н-изохинолин-1-он. К суспензии 1 г (3,74 ммоль) 3-(3-метоксифенил)-4 Н-бензо[f][1,4]оксазепин-5-она в диоксане (20 мл) добавляли 0,225 г (5,6 ммоль) гидрида натрия (60% дисперсия в минеральном масле) в строго бескислородной атмосфере и смесь нагревали при 100 С в течение 45 мин. После охлаждения до комнатной температуры 2 N хлористо-водородную кислоту добавляли до создания рН, равного 1, затем добавляли воду до тех пор, пока не достигали полного осаждения продукта. Твердое вещество фильтровали, промывали водой и сушили в вакууме с получением 0,82 г указанного в заголовке соединения (82%). 1(дт, J=7,7, 1,2 Гц, 1 Н), 7,24 (дд, J=2,6, 1,6 Гц, 1 Н), 6,96 (ддд, J=8,2, 2,5, 1,0 Гц, 1 Н), 3,82 (с, 3 Н). Согласно такой же методологии, но при использовании соответственно замещенного исходного материала были получены следующие соединения. 4-Гидрокси-3-фенил-2 Н-изохинолин-1-он. 1(I, L=СН 2-СН 2, R=R2=R3=H, R1=трет-бутоксикарбонил и R4=3-метоксифенил.) К раствору 3,79 г (14,19 ммоль) 4-гидрокси-3-(3-метоксифенил)-2 Н-изохинолин-1-она в N,Nдиметилацетамиде (90 мл) добавляли 3,18 г (14,19 ммоль) трет-бутилового эфира (2 бромэтил)карбаминовой кислоты и 5,09 г (15,6 ммоль) карбоната цезия и полученную смесь перемешивали при комнатной температуре в течение 2 ч в атмосфере аргона. К реакционной смеси добавляли воду и смесь экстрагировали дважды этилацетатом. Объединенные органические слои промывали по меньшей мере три раза водой и затем упаривали досуха. Сырой продукт очищали флэш-хроматографией (элюент: этилацетат/гексан 1/1) с получением 3,2 г указанного в заголовке соединения (55%). 1H ЯМР (DMSO-d6)(м.д.): 11,18 (с, 1 Н), 8,23 (ддд, J=7,9, 1,2, 0,6 Гц, 1 Н), 7,89 (д, J=8,0 Гц, 1 Н),7,78 (ддд, J=8,1, 7,0, 1,3 Гц, 1 Н), 7,57 (ддд, J=8,0, 7,0, 1,2 Гц, 1 Н), 7,40 (т, J=7,9 Гц, 1 Н), 7,30 (дт, J=8,2, 1,2 Гц, 1 Н), 7,24 (дд, J=2,4, 1,5 Гц, 1 Н), 7,01 (ддд, J=8,2, 2,6, 0,9 Гц, 1 Н), 6,84 (т, J=5,4 Гц, 1 Н), 3,83 (с, 3 Н),3,49 (т, J=5,8 Гц, 2 Н), 3,08 (кв, J=6,0 Гц, 2 Н), 1,36 (с, 9 Н). Согласно такой же методологии, но при использовании соответственно замещенных исходных материалов были получены следующие соединения.(29 мл) добавляли 1,45 г (5,73 ммоль) 1-(3-хлорпропил)пиперидина гидрохлорид, 1,58 г (11,5 ммоль) карбоната калия и 47 мг (0,286 ммоль) йодида калия и смесь подвергали воздействию микроволнового излучения при 85 С с одновременным охлаждением в течение 15 мин. Растворитель концентрировали в вакууме и смесь обрабатывали дихлорметаном и насыщенным раствором бикарбоната натрия. Органический слой промывали насыщенным раствором соли и затем упаривали досуха. Сырой продукт очищали флэш-хроматографией (элюент: дихлорметан/метанол 96/4) с получением 456 мг указанного в заголовке соединения (41%). 1 Н ЯМР (DMSO-d6)(м.д.): 11,19 (с, 1 Н), 8,23 (дд, J=7,9, 0,6 Гц, 1 Н), 7,90 (д, J=7,9 Гц, 1 Н), 7,80(шир.с, 6 Н), 1,68 (шир.с, 2 Н), 1,45 (шир.с, 4 Н), 1,37 (шир.с, 2 Н). Согласно такой же методологии, но при использовании соответственно замещенных исходных материалов были получены следующие соединения. 3-(3-Метоксифенил)-4-(2-пиперидин-1-илэтокси)-2 Н-изохинолин-1-он (соединение 9).
МПК / Метки
МПК: A61P 9/00, C07D 401/04, A61K 31/472, A61K 31/4725, A61P 35/00, A61P 25/00, A61P 29/00, C07D 217/24
Метки: фармацевтическая, способы, качестве, ингибиторов, композиция, основе, изохинолин-1(2h)-она, применение, parp-1, получения, производные
Код ссылки
<a href="https://eas.patents.su/30-23112-proizvodnye-izohinolin-12h-ona-v-kachestve-ingibitorov-parp-1-sposoby-ih-polucheniya-farmacevticheskaya-kompoziciya-na-ih-osnove-i-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Производные изохинолин-1(2h)-она в качестве ингибиторов parp-1, способы их получения, фармацевтическая композиция на их основе и применение</a>
Предыдущий патент: Фунгицидные производные карбоксамидов пиразола
Следующий патент: Применение агрохимических смесей для увеличения жизнеспособности растения
Случайный патент: Сэндвич-элемент












