Производные индола
Номер патента: 22939
Опубликовано: 31.03.2016
Авторы: Бозо Эва, Беке Дьюла, Фаркаш Шандор, Бенеи Дьюла Аттила, Хорнок Каталин, Ваштаг Моника, Ваго Иштван, Пап Андреа, Борза Иштван
Формула / Реферат
1. Производные индола формулы (I)
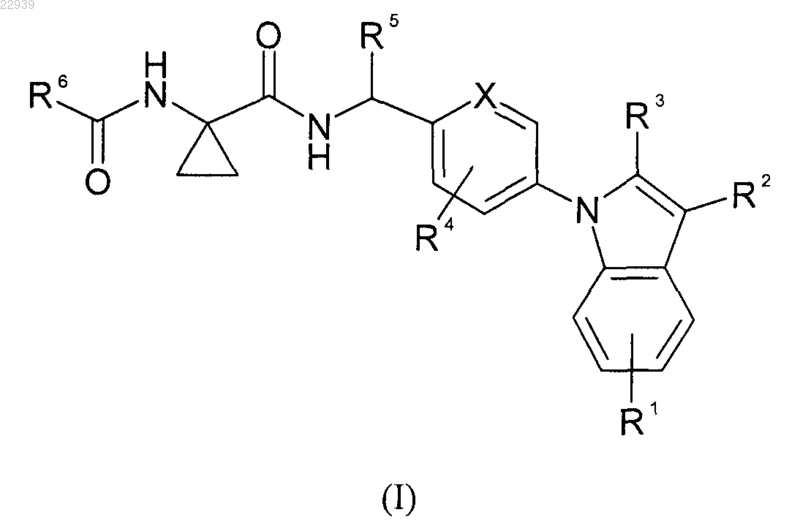
где R1 представляет собой атом водорода, атом галогена или С1-С4 алкоксигруппу;
R2 представляет собой атом водорода, атом галогена, С1-С4 алкильную группу или цианогруппу;
R3 выбран из (1) -COOR; (2) -CN; (3) -CONRaRb;
R4 представляет собой атом водорода или атом галогена;
R5 представляет собой атом водорода или С1-С4 алкильную группу;
R6 выбран из
(1) С3-С6 циклоалкила;
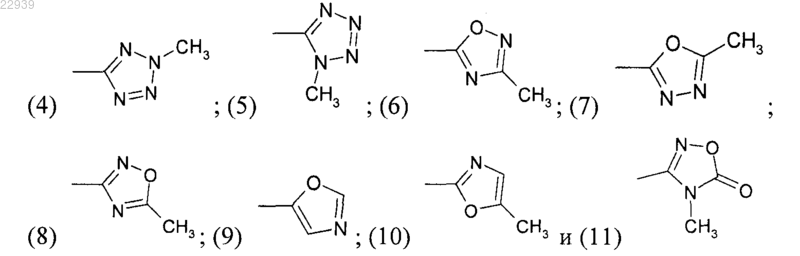
(2) пяти- или шестичленного ароматического цикла с двумя атомами азота, необязательно замещенного одной или двумя С1-С4 алкильной группой или C1-С4 алкилтиогруппой;
(3) пиридила, необязательно замещенного одной или двумя следующими группами: С1-С4 алкильной группой, трифторметильной группой, атомом галогена;
(4) пятичленного ароматического цикла с одним гетероатомом, выбранным из О или S, необязательно замещенного С1-С4 алкилтиогруппой;
(5) -CF3; (6) -CH2-CF3; (7) -СН2-СН2-CºСН; (8) -СН2-СН2-СН(СН3)2;
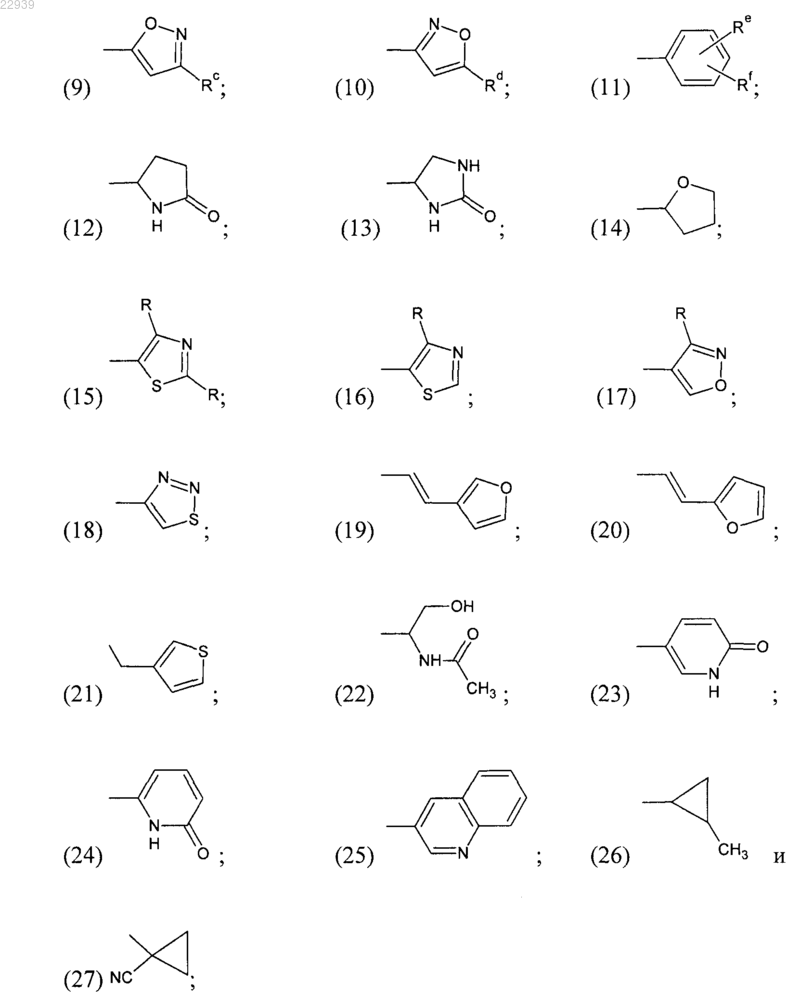
X представляет собой -СН- или атом азота;
R представляет собой С1-С4 алкильную группу;
Ra и Rb независимо друг от друга представляют собой атом водорода; C1-C4 алкильную группу или пирролидин-1-ильную группу;
Rc представляет собой атом водорода; С1-С4 алкил или С1-С4 алкоксигруппу;
Rd представляет собой атом водорода; С1-С4 алкил или С3-С6 циклоалкильную группу;
Re и Rf независимо друг от друга представляют собой атом водорода; атом галогена; С1-С4 алкокси; -CF3;
-CN или -NH2 группу;
и их оптические антиподы или рацематы и/или соли.
2. Соединение по п.1, выбранное из группы следующих соединений:
1-(2,2,2-трифторацетиламино)циклопропанкарбоновой кислоты 4-[3-хлор-2-(2-метил-2H-тетразол-5-ил)индол-1-ил]бензиламид,
3-метоксиизоксазол-5-карбоновой кислоты (1-{4-[3-хлор-2-(2-метил-2H-тетразол-5-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
3-метоксиизоксазол-5-карбоновой кислоты (1-{4-[2-(2-метил-2H-тетразол-5-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
1-(2,2,2-трифторацетиламино)циклопропанкарбоновой кислоты 4-[3-хлор-2-(2-метил-2H-тетразол-5-ил)индол-1-ил]-2-фторбензиламид,
3-метокси-N-[1-({4-[3-хлор-2-(5-метил-1,3,4-оксадиазол-2-ил)-1H-индол-1-ил]бензил}карбамоил)циклопропил]изоксазол-5-карбоксамид,
1-(2,2,2-трифторацетиламино)циклопропанкарбоновой кислоты 4-[3-хлор-2-(5-метил[1,3,4]оксадиазол-2-ил)индол-1-ил]бензиламид,
3-метоксиизоксазол-5-карбоновой кислоты (1-{4-[3-хлор-2-(1-метил-1H-тетразол-5-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
1-(2,2,2-трифторацетиламино)циклопропанкарбоновой кислоты 4-[3-хлор-2-(1-метил-1H-тетразол-5-ил)индол-1-ил]бензиламид,
3-метоксиизоксазол-5-карбоновой кислоты (1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
метиловый эфир 3-хлор-1-[4-({[1-(2,2,2-трифторацетиламино)циклопропанкарбонил]амино}метил)фенил]-1H-индол-2-карбоновой кислоты,
метиловый эфир 3-хлор-1-{4-[({1-[(3-метоксиизоксазол-5-карбонил)амино]циклопропанкарбонил}амино)метил]фенил}-1H-индол-2-карбоновой кислоты,
1-(2,2,2-трифторацетиламино)циклопропанкарбоновой кислоты 4-[3-хлор-5-фтор-2-(2-метил-2H-тетразол-5-ил)индол-1-ил]бензиламид,
3-метоксиизоксазол-5-карбоновой кислоты (1-{4-[3-хлор-5-фтор-2-(2-метил-2H-тетразол-5-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
метиловый эфир 1-{4-[({1-[(3-метоксиизоксазол-5-карбонил)амино]циклопропанкарбонил}амино)метил]фенил}-1H-индол-2-карбоновой кислоты,
3-метоксиизоксазол-5-карбоновой кислоты (1-{4-[3-хлор-2-(2-метил-2H-тетразол-5-ил)индол-1-ил]-2-фторбензилкарбамоил}циклопропил)амид,
3-метоксиизоксазол-5-карбоновой кислоты (1-{4-[3-хлор-2-(1,3-оксазол-5-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
1-(2,2,2-трифторацетиламино)циклопропанкарбоновой кислоты 4-[3,5-дихлор-2-(2-метил-2H-тетразол-5-ил)индол-1-ил]бензиламид,
3-метоксиизоксазол-5-карбоновой кислоты (1-{4-[3,5-дихлор-2-(2-метил-2H-тетразол-5-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
1-(2,2,2-трифторацетиламино)циклопропанкарбоновой кислоты 4-[3-хлор-5-фтор-2-(2-метил-2H-тетразол-5-ил)индол-1-ил]-2-фторбензиламид,
3-метоксиизоксазол-5-карбоновой кислоты (1-{4-[3-хлор-5-фтор-2-(2-метил-2H-тетразол-5-ил)индол-1-ил]-2-фторбензилкарбамоил}циклопропил)амид,
3-метоксиизоксазол-5-карбоновой кислоты (1-{4-[3-циано-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
1-(2,2,2-трифторацетиламино)циклопропанкарбоновой кислоты 4-[3,5-дихлор-2-(2-метил-2H-тетразол-5-ил)индол-1-ил]-2-фторбензиламид,
1-(2,2,2-трифторацетиламино)циклопропанкарбоновой кислоты 4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензиламид,
5-циклопропилизоксазол-3-карбоновой кислоты (1-{4-[3-хлор-2-(2-метил-2H-тетразол-5-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
5-метилпиразин-2-карбоновой кислоты (1-{4-[3-хлор-2-(2-метил-2H-тетразол-5-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
5-метилизоксазол-3-карбоновой кислоты (1-{4-[3-хлор-2-(2-метил-2H-тетразол-5-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
2-хлор-N-(1-{4-[3-хлор-2-(2-метил-2H-тетразол-5-ил)индол-1-ил]бензилкарбамоил}циклопропил)никотинамид,
N-(1-{4-[3-хлор-2-(2-метил-2H-тетразол-5-ил)индол-1-ил]бензилкарбамоил}циклопропил)-2-фторизоникотинамид,
1-(3,3,3-трифторпропиониламино)циклопропанкарбоновой кислоты 4-[3-хлор-2-(2-метил-2H-тетразол-5-ил)индол-1-ил]бензиламид,
N-(1-{4-[3-хлор-2-(2-метил-2H-тетразол-5-ил)индол-1-ил]бензилкарбамоил}циклопропил)-5-трифторметилникотинамид,
N-(1-{4-[3-хлор-2-(2-метил-2H-тетразол-5-ил)индол-1-ил]бензилкарбамоил}циклопропил)-3-фторбензамид,
3-хлор-1-[4-(1-{[1-(2,2,2-трифторацетиламино)циклопропанкарбонил]амино}этил)фенил]-1H-индол-2-карбоновой кислоты метиламид,
1-(2,2,2-трифторацетиламино)циклопропанкарбоновой кислоты (1-{4-[3-хлор-2-(пирролидин-1-карбонил)индол-1-ил]фенил}этил)амид,
этиловый эфир 3-хлор-1-{4-[({1-[(3-метоксиизоксазол-5-карбонил)амино]циклопропанкарбонил}амино)метил]фенил}-1H-индол-2-карбоновой кислоты,
диметиламид 3-хлор-1-{4-[({1-[(3-метоксиизоксазол-5-карбонил)амино]циклопропанкарбонил}амино)метил]фенил}-1H-индол-2-карбоновой кислоты,
1-(2,2,2-трифторацетиламино)циклопропанкарбоновой кислоты 4-[2-(2-метил-2H-тетразол-5-ил)индол-1-ил]бензиламид,
3-метоксиизоксазол-5-карбоновой кислоты (1-{4-[3-хлор-5-фтор-2-(5-метил[1,3,4]оксадиазол-2-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
3-метоксиизоксазол-5-карбоновой кислоты (1-{4-[3-хлор-2-(5-метилоксазол-2-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
3-метоксиизоксазол-5-карбоновой кислоты {1-[4-(3-хлор-2-цианоиндол-1-ил)бензилкарбамоил]циклопропил}амид,
(R)-1-(2,2,2-трифторацетиламино)циклопропанкарбоновой кислоты (1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]фенил}этил)амид,
(R)-3-метоксиизоксазол-5-карбоновой кислоты [1-(1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]фенил}этилкарбамоил)циклопропил]амид,
3-пропилизоксазол-5-карбоновой кислоты (1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
3-метоксиизоксазол-5-карбоновой кислоты {1-[4-(5-хлор-2-цианоиндол-1-ил)бензилкарбамоил]циклопропил}амид,
N-{1-[4-(2-циано-5-метоксииндол-1-ил)бензилкарбамоил]циклопропил}-5-трифторметилникотинамид,
N-{1-[4-(2-циано-5-фториндол-1-ил)бензилкарбамоил]циклопропил}-5-трифторметилникотинамид,
N-(1-{4-[5-фтор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)-5-трифторметилникотинамид,
3-метоксиизоксазол-5-карбоновой кислоты (1-{4-[5-фтор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
3-метоксиизоксазол-5-карбоновой кислоты {1-[4-(2-циано-5-метоксииндол-1-ил)бензилкарбамоил]циклопропил}амид,
3-метоксиизоксазол-5-карбоновой кислоты {1-[4-(2-циано-5-фториндол-1-ил)бензилкарбамоил]циклопропил}амид,
N-(1-{4-[3-хлор-5-метокси-2-(3-метил[1,2,4]оксадиазол-5-ил)индол-1-ил]бензилкарбамоил}циклопропил)-5-трифторметилникотинамид,
3-метоксиизоксазол-5-карбоновой кислоты (1-{4-[3-хлор-5-метокси-2-(3-метил[1,2,4]оксадиазол-5-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
3-метоксиизоксазол-5-карбоновой кислоты {1-[4-(3-хлор-2-циано-5-метоксииндол-1-ил)бензилкарбамоил]циклопропил}амид,
3-метоксиизоксазол-5-карбоновой кислоты (1-{4-[5-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
метиловый эфир 3-хлор-1-[3-фтор-4-({[1-(2,2,2-трифторацетиламино)циклопропанкарбонил]амино}метил)фенил]-1H-индол-2-карбоновой кислоты,
метиловый эфир 3-хлор-1-{3-фтор-4-[({1-[(3-метоксиизоксазол-5-карбонил)амино]циклопропанкарбонил}амино)метил]фенил}-1H-индол-2-карбоновой кислоты,
3-метоксиизоксазол-5-карбоновой кислоты [1-({5-[2-(3-метил[1,2,4]оксадиазол-5-ил)индол-1-ил]пиридин-2-илметил}карбамоил)циклопропил]амид,
3-метоксиизоксазол-5-карбоновой кислоты [1-({5-[2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]пиридин-2-илметил}карбамоил)циклопропил]амид,
3-метоксиизоксазол-5-карбоновой кислоты [1-({5-[3-хлор-2-(3-метил[1,2,4]оксадиазол-5-ил)индол-1-ил]пиридин-2-илметил}карбамоил)циклопропил]амид,
3-метоксиизоксазол-5-карбоновой кислоты [1-({5-[3-хлор-5-фтор-2-(2-метил-2H-тетразол-5-ил)индол-1-ил]пиридин-2-илметил}карбамоил)циклопропил]амид,
3-метоксиизоксазол-5-карбоновой кислоты [1-({5-[3-хлор-2-(2-метил-2H-тетразол-5-ил)индол-1-ил]пиридин-2-илметил}карбамоил)циклопропил]амид,
3-метоксиизоксазол-5-карбоновой кислоты [1-({5-[5-фтор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]пиридин-2-илметил}карбамоил)циклопропил]амид,
3-метоксиизоксазол-5-карбоновой кислоты [1-({5-[3-хлор-5-фтор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]пиридин-2-илметил}карбамоил)циклопропил]амид,
1-(2,2,2-трифторацетиламино)циклопропанкарбоновой кислоты 4-[3-хлор-5-метокси-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензиламид,
3-метоксиизоксазол-5-карбоновой кислоты (1-{4-[3-хлор-5-метокси-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
1-(2,2,2-трифторацетиламино)циклопропанкарбоновой кислоты 4-[3,5-дихлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензиламид,
3-метоксиизоксазол-5-карбоновой кислоты (1-{4-[3,5-дихлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
3-метоксиизоксазол-5-карбоновой кислоты (1-{4-[3-хлор-5-фтор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
метиловый эфир 3-хлор-4-фтор-1-{4-[({1-[(3-метоксиизоксазол-5-карбонил)амино]циклопропанкарбонил}амино)метил]фенил}-1H-индол-2-карбоновой кислоты,
метиловый эфир 3-хлор-4-фтор-1-[4-({[1-(2,2,2-трифторацетиламино)циклопропанкарбонил]амино}метил)фенил]-1H-индол-2-карбоновой кислоты,
2-хлор-N-(1-{4-[3,5-дихлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)никотинамид,
N-(1-{4-[3,5-дихлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]-бензилкарбамоил}циклопропил)-3-фторбензамид,
5-метилпиразин-2-карбоновой кислоты (1-{4-[3,5-дихлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
5-метилизоксазол-3-карбоновой кислоты (1-{4-[3,5-дихлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
N-(1-{4-[3,5-дихлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)-2-фторизоникотинамид,
5-циклопропилизоксазол-3-карбоновой кислоты (1-{4-[3,5-дихлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
N-(1-{4-[3,5-дихлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)-5-трифторметилникотинамид,
2-метилсульфанилпиримидин-5-карбоновой кислоты (1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
1-(3,3,3-трифторпропиониламино)циклопропанкарбоновой кислоты 4-[5-метокси-2-(3-метил[1,2,4]оксадиазол-5-ил)индол-1-ил]бензиламид,
N-(1-{4-[5-метокси-2-(3-метил[1,2,4]оксадиазол-5-ил)индол-1-ил]бензилкарбамоил}циклопропил)-5-трифторметилникотинамид,
3-метоксиизоксазол-5-карбоновой кислоты (1-{4-[5-метокси-2-(3-метил[1,2,4]оксадиазол-5-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
1-(3,3,3-трифторпропиониламино)циклопропанкарбоновой кислоты 4-[2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензиламид,
N-(1-{4-[2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)-5-трифторметилникотинамид,
N-(1-{4-[2-(3-метил[1,2,4]оксадиазол-5-ил)индол-1-ил]бензилкарбамоил}циклопропил)-5-трифторметилникотинамид,
N-{1-[4-(2-цианоиндол-1-ил)бензилкарбамоил]циклопропил}-5-трифторметилникотинамид,
2-хлор-N-(1-{4-[3-хлор-5-фтор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)никотинамид,
N-(1-{4-[3-хлор-5-фтор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)-3-фторбензамид,
5-метилпиразин-2-карбоновой кислоты (1-{4-[3-хлор-5-фтор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
5-метилизоксазол-3-карбоновой кислоты (1-{4-[3-хлор-5-фтор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
N-(1-{4-[3-хлор-5-фтор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)-2-фторизоникотинамид,
5-циклопропилизоксазол-3-карбоновой кислоты (1-{4-[3-хлор-5-фтор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
N-(1-{4-[3-хлор-5-фтор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)-5-трифторметилникотинамид,
N-(1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)-2-фтор-3-трифторметилбензамид,
N-(1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)-3-фтор-4-трифторметилбензамид,
N-(1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)-3-фтор-5-трифторметилбензамид,
N-(1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)-2-фторникотинамид,
N-(1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)-2-фтор-5-трифторметилбензамид,
N-(1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)-3-фторизоникотинамид,
N-(1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)-4-фтор-3-трифторметилбензамид,
N-(1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)-6-фторникотинамид,
N-{1-[4-(5-хлор-2-цианоиндол-1-ил)бензилкарбамоил]циклопропил}-5-трифторметилникотинамид,
1-(3,3,3-трифторпропиониламино)циклопропанкарбоновой кислоты 4-[5-фтор-2-(3-метил[1,2,4]оксадиазол-5-ил)индол-1-ил]бензиламид,
N-(1-{4-[5-фтор-2-(3-метил[1,2,4]оксадиазол-5-ил)индол-1-ил]бензилкарбамоил}циклопропил)-5-трифторметилникотинамид,
3-метоксиизоксазол-5-карбоновой кислоты (1-{4-[5-фтор-2-(3-метил[1,2,4]оксадиазол-5-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
2-хлор-N-(1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]-2-фторбензилкарбамоил}циклопропил)никотинамид,
N-(1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]-2-фторбензилкарбамоил}циклопропил)-3-фторбензамид,
5-метилпиразин-2-карбоновой кислоты (1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]-2-фторбензилкарбамоил}циклопропил)амид,
5-метилизоксазол-3-карбоновой кислоты (1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]-2-фторбензилкарбамоил}циклопропил)амид,
1-(3,3,3-трифторпропиониламино)циклопропанкарбоновой кислоты 4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]-2-фторбензиламид,
N-(1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]-2-фторбензилкарбамоил}циклопропил)-2-фторизоникотинамид,
5-циклопропилизоксазол-3-карбоновой кислоты (1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]-2-фторбензилкарбамоил}циклопропил)амид,
N-(1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]-2-фторбензилкарбамоил}циклопропил)-5-трифторметилникотинамид,
1-(3,3,3-трифторпропиониламино)циклопропанкарбоновой кислоты 4-[3-хлор-2-(3-метил[1,2,4]оксадиазол-5-ил)индол-1-ил]бензиламид,
N-(1-{4-[3-хлор-2-(3-метил[1,2,4]оксадиазол-5-ил)индол-1-ил]бензилкарбамоил}циклопропил)-2-фторизоникотинамид,
5-циклопропилизоксазол-3-карбоновой кислоты (1-{4-[3-хлор-2-(3-метил[1,2,4]оксадиазол-5-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
N-(1-{4-[3-хлор-2-(3-метил[1,2,4]оксадиазол-5-ил)индол-1-ил]бензилкарбамоил}циклопропил)-5-трифторметилникотинамид,
2-фтор-N-(1-{4-[5-метокси-2-(3-метил[1,2,4]оксадиазол-5-ил)индол-1-ил]бензилкарбамоил}циклопропил)никотинамид,
N-(1-{4-[3-хлор-5-фтор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)-2-фторникотинамид,
N-(1-{4-[3-хлор-5-метокси-2-(3-метил[1,2,4]оксадиазол-5-ил)индол-1-ил]бензилкарбамоил}циклопропил)-2-фторникотинамид,
N-(1-{4-[3-хлор-2-(2-метил-2H-тетразол-5-ил)индол-1-ил]бензилкарбамоил}циклопропил)-2-фторникотинамид,
2-фтор-N-(1-{4-[5-фтор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)никотинамид,
1-метил-1H-пиразол-4-карбоновой кислоты (1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
2-оксоимидазолидин-4-карбоновой кислоты (1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
3-этилизоксазол-5-карбоновой кислоты (1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
1-(3,3,3-трифторпропиониламино)циклопропанкарбоновой кислоты 4-[5-метокси-2-(5-метил[1,3,4]оксадиазол-2-ил)индол-1-ил]бензиламид,
N-(1-{4-[5-метокси-2-(5-метил[1,3,4]оксадиазол-2-ил)индол-1-ил]бензилкарбамоил}циклопропил)-5-трифторметилникотинамид,
3-метоксиизоксазол-5-карбоновой кислоты (1-{4-[5-метокси-2-(5-метил[1,3,4]оксадиазол-2-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
1-(3,3,3-трифторпропиониламино)циклопропанкарбоновой кислоты 4-[5-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензиламид,
N-(1-{4-[5-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)-5-трифторметилникотинамид,
5-метилпиразин-2-карбоновой кислоты (1-{4-[3-хлор-5-метокси-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
N-(1-{4-[3-хлор-5-метокси-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)-5-трифторметилникотинамид,
5-метилпиразин-2-карбоновой кислоты (1-{2-фтор-4-[5-фтор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
N-(1-{2-фтор-4-[5-фтор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)-5-трифторметилникотинамид,
3-метоксиизоксазол-5-карбоновой кислоты (1-{2-фтор-4-[5-фтор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
изоксазол-5-карбоновой кислоты (1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
5-метилизоксазол-3-карбоновой кислоты (1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
тетрагидрофуран-2-карбоновой кислоты (1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
фуран-3-карбоновой кислоты (1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
2-метилциклопропанкарбоновой кислоты (1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
1-пент-4-иноиламиноциклопропанкарбоновой кислоты 4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензиламид,
1-(4-метилпентаноиламино)циклопропанкарбоновой кислоты 4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензиламид,
1H-пиразол-4-карбоновой кислоты (1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
1-цианоциклопропанкарбоновой кислоты (1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
циклобутанкарбоновой кислоты (1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
циклопентанкарбоновой кислоты (1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
фуран-2-карбоновой кислоты (1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
N-(1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)-3-цианобензамид,
1-(2-тиофен-3-ил-ацетиламино)циклопропанкарбоновой кислоты 4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензиламид,
1,5-диметил-1H-пиразол-3-карбоновой кислоты (1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
4-метилтиазол-5-карбоновой кислоты (1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
2,4-диметилтиазол-5-карбоновой кислоты (1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
1-(2-ацетиламино-3-гидроксипропиониламино)циклопропанкарбоновой кислоты 4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензиламид,
5-метил-1H-пиразол-3-карбоновой кислоты (1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
2-хлор-N-(1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)никотинамид,
N-(1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)-6-метилникотинамид,
N-(1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)-2-метилникотинамид,
2-хлор-N-(1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)-6-метилникотинамид,
6-бромпиридин-2-карбоновой кислоты (1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
N-(1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)никотинамид,
хинолин-3-карбоновой кислоты (1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
6-оксо-1,6-дигидропиридин-3-карбоновой кислоты (1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
5-метилпиразин-2-карбоновой кислоты (1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
6-оксо-1,6-дигидропиридин-2-карбоновой кислоты (1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
1-(3,3,3-трифторпропиониламино)циклопропанкарбоновой кислоты 4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензиламид,
N-(l-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)-2-фторизоникотинамид,
5-циклопропилизоксазол-3-карбоновой кислоты (1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
пиримидин-5-карбоновой кислоты (1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
тиофен-3-карбоновой кислоты (1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
5-оксопирролидин-2-карбоновой кислоты (1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
1-(3-фуран-3-ил-акрилоиламино)циклопропанкарбоновой кислоты 4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензиламид,
N-(1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)-4-цианобензамид,
1-(3-фуран-2-ил-акрилоиламино)циклопропанкарбоновой кислоты 4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензиламид,
тиофен-2-карбоновой кислоты (1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
5-метилсульфанилтиофен-2-карбоновой кислоты (1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
[1,2,3]тиадиазол-4-карбоновой кислоты (1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
N-(1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)-3-метоксибензамид,
N-(1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)-3-иодобензамид,
N-(1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)-3-трифторметилбензамид,
N-(1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)-3-фторбензамид,
N-(1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)-3-метилбензамид,
N-(1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)-5-трифторметилникотинамид,
3-метилизоксазол-4-карбоновой кислоты (1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
хинолин-3-карбоновой кислоты (1-{4-[3-хлор-2-(5-метил[1,3,4]оксадиазол-2-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
1-(3,3,3-трифторпропиониламино)циклопропанкарбоновой кислоты 4-[3-хлор-2-(5-метил[1,3,4]оксадиазол-2-ил)индол-1-ил]бензиламид,
пиримидин-5-карбоновой кислоты (1-{4-[3-хлор-2-(5-метил[1,3,4]оксадиазол-2-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
2-метилпиримидин-5-карбоновой кислоты (1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
3-амино-N-(1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)бензамида гидрохлорид,
амид 3-хлор-1-[4-({[1-(2,2,2-трифторацетиламино)циклопропанкарбонил]амино}метил)фенил]1H-индол-2-карбоновой кислоты,
амид 3-хлор-1-{4-[({1-[(3-метоксиизоксазол-5-карбонил)амино]циклопропанкарбонил}амино)метил]фенил}-1H-индол-2-карбоновой кислоты,
1-(2,2,2-трифторацетиламино)циклопропанкарбоновой кислоты 4-[3-хлор-5-фтор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензиламид,
1-(2,2,2-трифторацетиламино)циклопропанкарбоновой кислоты ((R)-1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]-2-фторфенил}этил)амид,
3-метоксиизоксазол-5-карбоновой кислоты [1-((R)-1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]-2-фторфенил}этилкарбамоил)циклопропил]амид,
3-метоксиизоксазол-5-карбоновой кислоты (1-{4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]-2-фторбензилкарбамоил}циклопропил)амид,
3-метоксиизоксазол-5-карбоновой кислоты (1-{4-[3-хлор-2-(3-метил[1,2,4]оксадиазол-5-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
1-(2,2,2-трифторацетиламино)циклопропанкарбоновой кислоты 4-[3-хлор-2-(3-метил[1,2,4]оксадиазол-5-ил)индол-1-ил]бензиламид,
3-метоксиизоксазол-5-карбоновой кислоты (1-{4-[2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
3-метоксиизоксазол-5-карбоновой кислоты (1-{4-[2-(3-метил[1,2,4]оксадиазол-5-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
3-метоксиизоксазол-5-карбоновой кислоты (1-{4-[3-хлор-5-фтор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]-2-фторбензилкарбамоил}циклопропил)амид,
3-метоксиизоксазол-5-карбоновой кислоты (1-{4-[3,5-дифтор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид,
1-(2,2,2-трифторацетиламино)циклопропанкарбоновой кислоты 4-[3,5-дифтор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензиламид,
3-метоксиизоксазол-5-карбоновой кислоты (1-{4-[5-фтор-3-метил-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид и
3-метоксиизоксазол-5-карбоновой кислоты (1-{4-[3-хлор-2-(4-метил-5-оксо-4,5-дигидро[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил}циклопропил)амид
и их оптические антиподы или рацематы и/или соли.
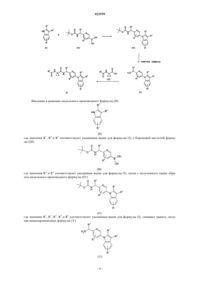
3. Способ получения соединения формулы (I) по п.1, отличающийся тем, что
вводят в реакцию индольное производное формулы (II)
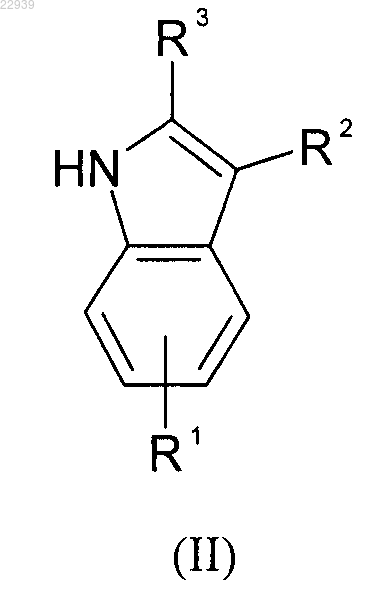
где значения R1, R2 и R3 соответствуют приведенным для формулы (I) в п.1, с бороновой кислотой формулы (III) или формулы (VII)
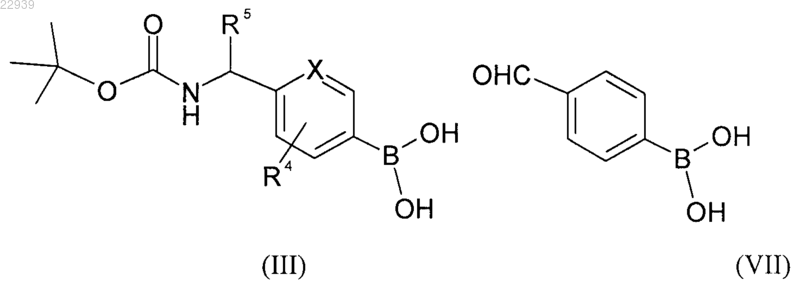
где значения R4 и R5 соответствуют приведенным для формулы (I) в п.1, с получением индольного производного формулы (IV) или формулы (VIII) соответственно
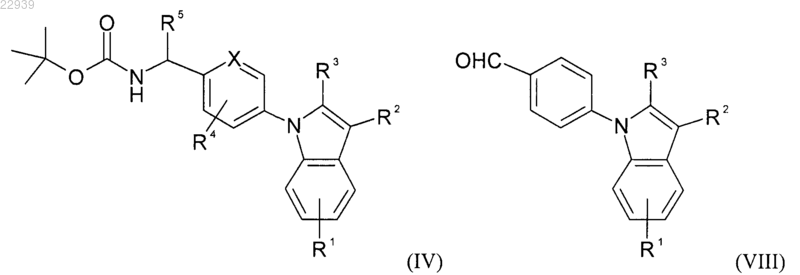
где значения R1, R2, R3, R4 и R5 соответствуют приведенным для формулы (I) в п.1, затем с полученного таким образом соединения формулы (IV) снимают защиту или полученное таким образом соединение формулы (VIII) вводят в реакцию с гидрохлоридом гидроксиламина, получая в результате аминопроизводное формулы (V) или индольное производное формулы (IX) соответственно
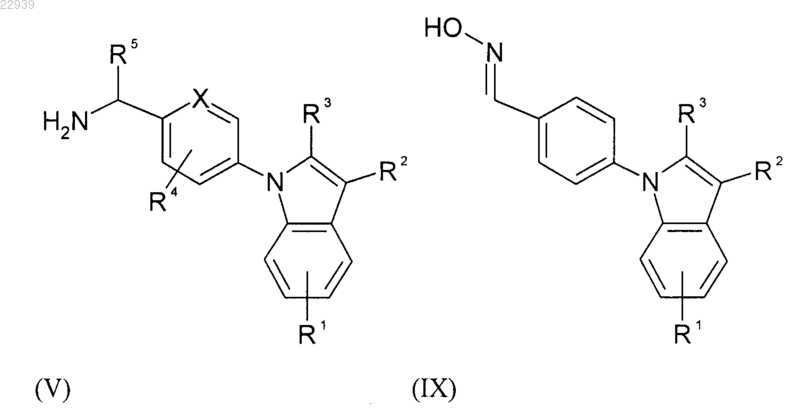
где значения R1, R2, R3, R4 и R5 соответствуют приведенным для формулы (I) в п.1, и, наконец, полученное соединение формулы (V) вводят в реакцию с кислотой формулы (VI)
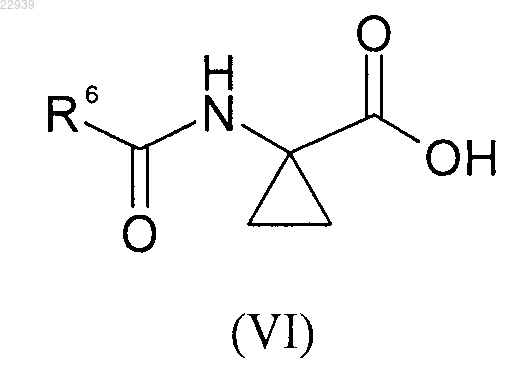
где значения R6 соответствуют приведенным для формулы (I) в п.1; или полученное соединение формулы (IX) гидрируют с получением аминопроизводного формулы (X)
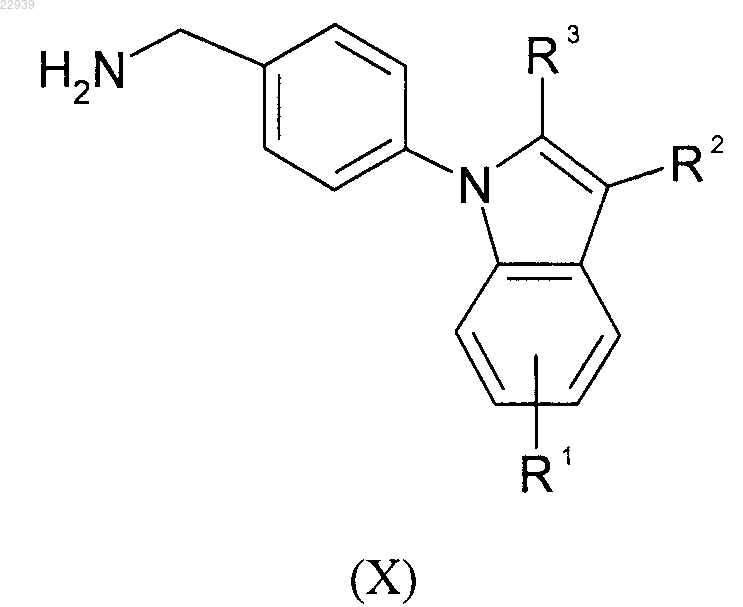
где значения R1, R2 и R3 соответствуют приведенным для формулы (I) в п.1, которое, в свою очередь, вводят в реакцию с кислотой формулы (VI)
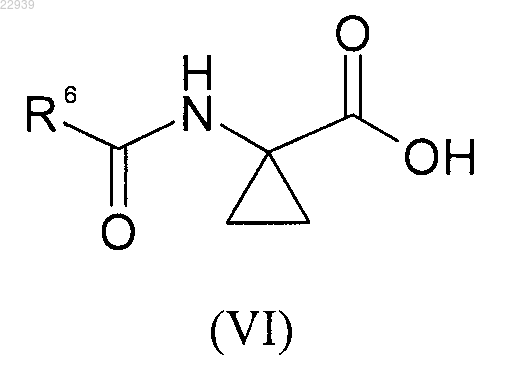
где значения R6 соответствуют приведенным для формулы (I) в п.1,
получая в результате соединение формулы (I),
и при необходимости полученное таким способом индольное производное формулы (I) и его оптические антиподы или рацематы и/или соли превращают в другое соединение формулы (I) и его оптические антиподы или рацематы и/или соли путем введения новых заместителей и/или модифицирования или удаления существующих заместителей.
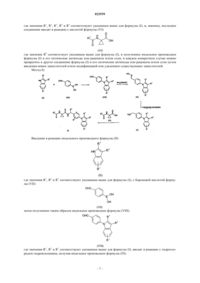
4. Способ получения соединения формулы (I) по п.1, отличающийся тем, что вводят в реакцию аминопроизводное формуы (V)
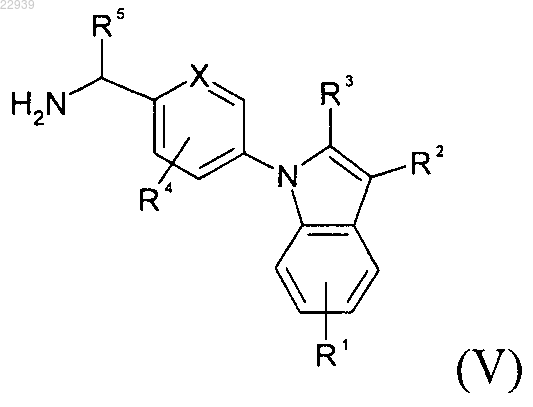
или формулы (Х)
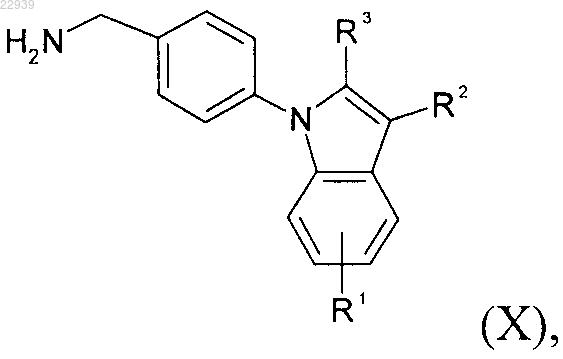
полученные по методике, описанной в способе по п.3, с производным аминокислоты формулы (XI)
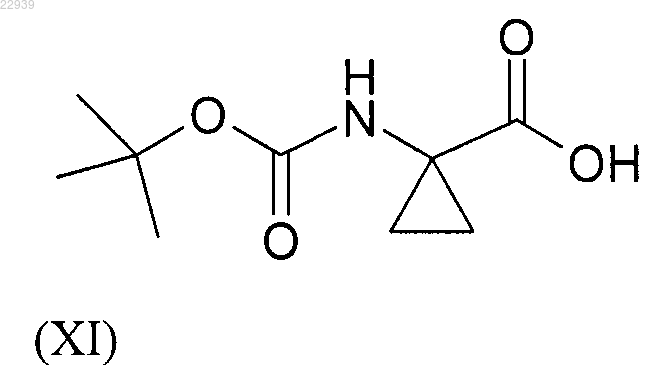
и с полученного таким образом индольного производного формулы (XII)
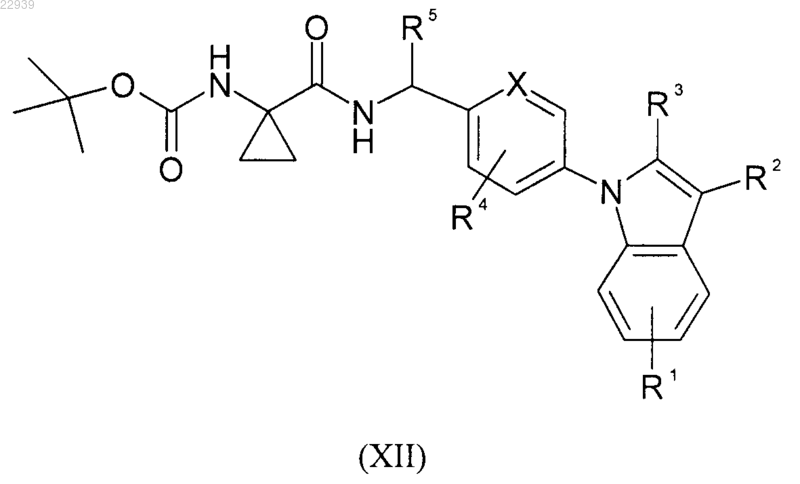
где значения R1, R2, R3, R4 и R5 соответствуют приведенным для формулы (I) в п.1, снимают защиту, получая аминопроизводное формулы (XIII)
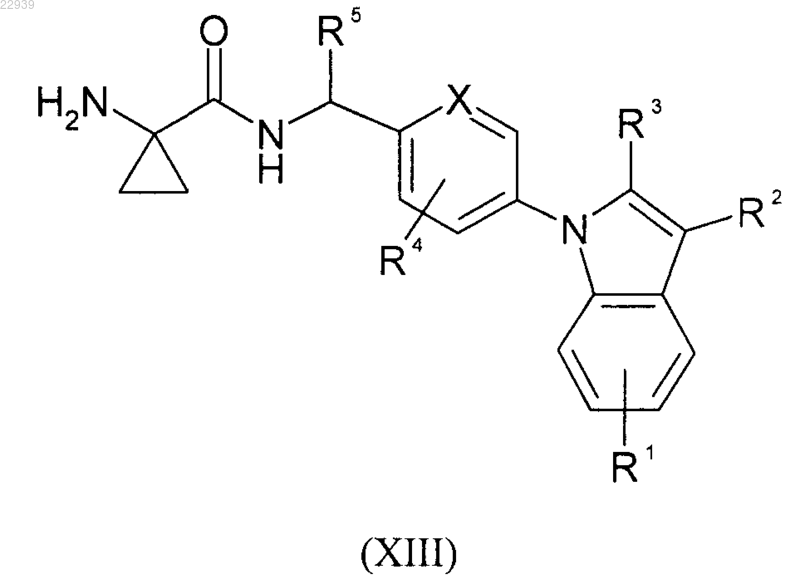
где значения R1, R2, R3, R4 и R5 соответствуют приведенным для формулы (I) в п.1, наконец, последнее вводят в реакцию с кислотой формулы (XIV)

где значения R6 соответствуют приведенным для формулы (I) в п.1; получая в результате соединение формулы (I),
и при необходимости полученное таким способом индольное производное формулы (I) и его оптические антиподы или рацематы и/или соли превращают в другое соединение формулы (I) и его оптические антиподы или рацематы и/или соли путем введения новых заместителей и/или модифицирования или удаления существующих заместителей.
5. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения формулы (I) по п.1 и его оптических антиподов или рацематов и/или солей в качестве активного ингредиента и фармацевтически приемлемые вспомогательные вещества.
6. Способ получения фармацевтической композиции, действующей как селективный антагонист рецептора брадикинина В1, отличающийся тем, что смешивают терапевтически эффективное количество соединения формулы (I) по п.1 и его оптических антиподов или рацематов и/или солей в качестве активных ингредиентов и вспомогательные вещества.
7. Применение соединения формулы (I) по п.1 и его оптических антиподов или рацематов и/или солей в качестве селективного антагониста рецептора брадикинина В1.
8. Применение соединения формулы (I) по п.1 и его оптических антиподов или рацематов и/или солей для лечения или профилактики нарушений, связанных с активностью рецептора брадикинина В1.
9. Применение по п.8, где нарушение выбрано из группы, состоящей из боли и воспаления, включая соматическую мышечно-скелетную боль, боль внизу спины, заболевания, вызванные повторяющимися движениями, миофасциальный болевой дисфункциональный синдром, артрит, включая остеоартрит, ревматоидный артрит и подагру, фибромиалгию, висцеральную боль, воспалительные нарушения кожи и повреждения кожи, осложнения, связанные с диабетом, такие как нейропатия, нефропатия, васкулопатия, ретинопатия, боль при раковых заболеваниях и воспалительная болезнь кишечника.
10. Способ лечения и/или профилактики нарушения, которое требует ингибирования рецептора брадикинина 1, отличающийся тем, что вводят эффективное количество соединения формулы (I) по п.1 и его оптических антиподов или рацематов и/или солей в индивидуальном виде или в комбинации с применяемыми в фармацевтике фармацевтически приемлемыми вспомогательными веществами млекопитающему, подвергающемуся лечению.
11. Способ по п.10, где нарушение выбрано из группы, состоящей из боли и воспаления, включая соматическую мышечно-скелетную боль, боль внизу спины, нарушения, связанные с повторяющимися движениями, миофасциальный болевой дисфункциональный синдром, артрит, включая остеоартрит, ревматоидный артрит и подагру, фибромиалгию, висцеральную боль, воспалительные нарушения кожи и повреждения кожи, осложнения, связанные с диабетом, такие как нейропатия, нефропатия, васкулопатия, ретинопатия, боль при раковых заболеваниях и воспалительная болезнь кишечника.
Текст
Настоящее изобретение касается производных индола формулы (I), где определения R1- R6 и X даны в формуле изобретения, и их оптических антиподов или рацематов и/или солей,которые являются селективными антагонистами брадикинина В 1, способа получения указанных соединений, содержащих их фармакологических композиций и их применения в терапии или профилактике болевых и воспалительных состояний. Область техники, к которой относится изобретение Настоящее изобретение касается новых индольных производных формулы (I) и их оптических антиподов или рацематов и/или солей, которые выступают в роли селективных антагонистов брадикинина 1. Настоящее изобретение также касается способа получения таких соединений. Настоящее изобретение касается также фармацевтических композиций, содержащих такие соединения, и применения таких соединений в методах лечения или предотвращения нарушений, включающих боль и воспаление. В настоящем изобретении также описан способ производства лекарственных средств, пригодных для лечения или предотвращения таких нарушений. Предшествующий уровень техники Кинины представляют собой эндогенные пептиды, образующиеся в плазме и периферийных тканях после протеолитического расщепления прекурсоров - кининогена ферментом калликреином (Bhoola,Pharmacol. Rev. 1992, 44, 1-80). Их биологическое действие опосредуется двумя сопряженными с Gбелком мембранными рецепторами, именуемыми В 1 и В 2 (Regoli and Barabe, Pharmacol. Rev. 1980, 32, 146, Marceau et al., Pharmacol. Rev. 1998, 50, 357-386). Первый набор кининов, брадикинин (BK) и каллидин (LysBK) участвуют в остром физиологическом процессе сердечно-сосудистой, почечной, нервной и иммуниой системы (Calixto et al., Pain, 2000,87, 1-5). Они действуют преимущественно через стимуляцию конституитивно экспрессированных и быстро десенсибилизирующихся В 2 рецепторов, которые широко распространены во многих тканях. С другой стороны, второй набор кининов, активные карбоксипептидазные метаболиты BK и LysBK,desArg9BK (DABK) и LysdesArg9BK (LysDABK) в патологических условиях активируют индуцируемые В 1 рецепторы в нескольких типах клеток эктодермального (например, нейроны, глия), мезодермального(например, клетки эндотелия, клетки гладких мышц, клетки крови, стромальные клетки) и эндодермального (например, клетки эпителия дыхательных путей) происхождения (Leeb-Lundberg et al., Pharmacol.Rev. 2005, 57, 27-77). В целом, B1 рецепторы, которые редко экспрессируются в непатологических условиях, быстро появляются после травм различной природы (травмы тканей, инфекции и т.д.), но в отличие от В 2 рецепторов вызывают незатухающий ответ вследствие ограниченной десенсибилизации и интернализации при очень низкой диссоциации лигандов (Couture et al., Eur. J. of Pharmacol., 2001, 429, 161176). Таким образом, представляется, что стимуляция В 1 рецептора является частью универсального ответа в виде воспаления и боли, который включает локальное соэкспрессирование (в конечном итоге стимулирование) ферментов, рецепторов, физиологически активных веществ, цитокинов и хемокинов, которые, как известно, играют ключевые роли в ранних и более поздних ответах тканей на различные типы травм. На животных моделях было показано, что имеет место переключение в доминировании функций от В 2 к В 1 рецептору при состояниях хронической воспалительной боли. В то время как В 2 рецептор участвует в острой фазе воспалительного ответа и ответа в виде боли, В 1 рецептор вовлечен в хроническую фазу этого ответа. Участие кининовых рецепторов в передаче воспаления и боли подтверждается результатами исследований на мышах, не имеющих рецепторов брадикинина B1. B1 рецептор-дефицитные мыши отличаются от мышей дикого типа по сенсорным функциям, демонстрируя повышенные болевые пороги в отношении вредоносных химических и тепловых стимулов, резкое уменьшение накопления полиморфоядерных лейкоцитов в местах воспаления, а также подавление спинального рефлекса (Pesquero et al.,PNAS, 2000, 97, 8140-8145). Уменьшение нейропатической боли, вызванной поражением нервов, также было подтверждено у мышей с выключенным рецептором брадикинина B1 (Ferreira et al., J. Neuroscience,2005, 25, 2405-2412). Кроме того, у мышей с выключенным рецептором брадикинина В 1 развивалась гипергликемия, а не гиперальгезия, в ответ на введение STZ (Gabra, Reg. Pept., 2005,127, 245-248). Растущее число фактов подтверждает важную роль рецепторов брадикинина В 1 в патологических состояниях, таких как воспаления (например, формирование эдемы, транспортировка лейкоцитов), инфекции, ишемических реперфузионных поражениях, росте раковых опухолей и метастазах. Также было подтверждено участие В 1 рецепторов в возникновении боли центральной и периферической природы,такой как острая, хроническая, нейропатическая и раковая боль (Calixto et al., Br. J. of Pharmacol., 2004,143, 803-818, Conley et al., Eur. J. Pharmacol., 2005, 527, 44-51, Sevcik et al., J. Pain, 2005, 6, 771-775). Рецептор брадикинина В 1 играет стратегическую роль в развитии и поддержании хронических воспалительных заболеваний, таких как астма, диабет, ревматоидный артрит (Couture et al., Eur. J. Pharmacol. 2001, 429, 161-176, Gabra et al., Biol. Chem., 2006, 387, 127-143, Cassim et al., Rheumatology, 2009, 48, 490496). Рецепторы брадикинина В 1 могут быть терапевтическими мишенями при неврологических расстройствах, таких как эпилепсия, рассеянный склероз, болезнь Паркинсона и болезнь Альцгеймера (Rodiet al., Cur. Pharm. Design 2005, 11, 1313-1326, Prediger et al., Neuroscience, 2008, 151, 631-643). В нескольких патентах и заявках на патенты описаны антагонисты рецептора брадикинина В 1,имеющие различную химическую структуру. Заявка на международный патент WO 09124733 касается замещенных сульфонамидных производных. В WO 09036996 и WO 09013299 раскрыто широкое разнообразие малых молекул с различной химической структурой, имеющих ценные свойства. В заявке на международный патент WO 07101007 раскрыты арилсульфонильные гетероциклы и их производные. Согласно заявке на международный патент WO 05004810 некоторые N-арилсульфонамидные производные также известны в качестве антагонистов брадикинина или обратных агонистов, которые могут применяться в лечении или профилактике таких симптомов, как боль и воспаление, связанных с контролируемым брадикинином В 1 биологическим путем. В WO 04054584 описаны производные 2 хиноксалинона, a WO 02099388 касается бензодиазепиновых соединений. В WO 02076964 описаны производные N-(арилсульфонил)аминокислот, содержащие замещенную аминометильную группу. Описанные в перечисленных источниках соединения могут применяться для модулирования активности рецептора брадикинина in vivo и in vitro и могут применяться в лечении у млекопитающих состояний, чувствительных к модулированию В 1, включая боль и воспаление. Но ни в одном из перечисленных источников из предшествующего уровня техники не описано какое-либо соединение из класса соединений,описанных ниже в настоящем тексте. Сущность изобретения Авторы настоящего изобретения идентифицировали класс индольных производных, имеющих высокое сродство к рецепторам брадикинина В 1 и селективность в сравнении с рецепторами брадикинина В 2, что позволяет им играть уникальную роль в лечении хронической боли и воспалительных процессов и расстройств. Кроме того, нацеливание на индуцируемый рецептор, который играет небольшую или вообще нулевую физиологическую роль в гомеостазе, дает гарантию от нежелательных побочных эффектов, связанных с конституитивными В 2 рецепторами. Настоящее изобретение касается соединений,являющихся селективными антагонистами рецептора брадикинина В 1, и их синтеза. Соединения по настоящему изобретению могут применяться для лечения расстройств, включающих воспаление и боль. Настоящее изобретение касается производных индола формулы (I) где R1 представляет собой атом водорода, атом галогена или С 1-С 4 алкоксигруппу;R2 представляет собой атом водорода, атом галогена, С 1-С 4 алкильную группу или цианогруппу;R4 представляет собой атом водорода или атом галогена;R5 представляет собой атом водорода или С 1-С 4 алкильную группу;(2) необязательно замещенного пяти- или шестичленного ароматического цикла с двумя атомами азота;(4) необязательно замещенного пятичленного ароматического цикла с одним гетероатомом, выбранным из О или S;Ra и Rb независимо друг от друга представляют собой атом водорода; С 1-С 4 алкильную группу или пирролидин-1-ильную группу;Rc представляет собой атом водорода; С 1-С 4 алкил или С 1-С 4 алкоксигруппу;Rd представляет собой атом водорода; С 1-С 4 алкил или С 3-С 6 циклоалкильную группу;Re и Rf независимо друг от друга представляют собой атом водорода; атом галогена; С 1-С 4 алкильную группу; С 1-С 4 алкокси; -CF3; -CN или -NH2 группу; и их оптические антиподы или рацематы и/или соли. Настоящее изобретение также касается фармацевтических композиций, содержащих соединения формулы (I) или их оптические антиподы или рацематы и/или соли в качестве активного ингредиента. Кроме того, настоящее изобретение касается синтеза соединений формулы (I) и их оптических антиподов или рацематов и/или солей, содержащих их фармацевтические композиции, и химического и фармацевтического производства лекарственных средств, содержащих данные соединения, а также способов лечения данными соединениями, что означает введение подвергающемуся лечению млекопитающему, включая человека, страдающему от нарушений, включающих боль и воспаление, эффективного количества соединений формулы (I) и их оптических антиподов или рацематов и/или солей по настоящему изобретению как таковых или как лекарственного средства. Осуществление изобретения Настоящее изобретение касается производных индола формулы (I) где R1 представляет собой атом водорода, атом галогена или С 1-С 4 алкоксигруппу;R2 представляет собой атом водорода, атом галогена, С 1-С 4 алкильную группу или цианогруппу;R4 представляет собой атом водорода или атом галогена;R5 представляет собой атом водорода или С 1-С 4 алкильную группу;(2) необязательно замещенного пяти- или шестичленного ароматического цикла с двумя атомами азота;(4) необязательно замещенного пятичленного ароматического цикла с одним гетероатомом, выбранным из О или S;Ra и Rb независимо друг от друга представляют собой атом водорода; С 1-С 4 алкильную группу или пирролидин-1-ильную группу;Rc представляет собой атом водорода; С 1-С 4 алкил или С 1-С 4 алкоксигруппу;Rd представляет собой атом водорода; С 1-С 4 алкил или С 3-С 6 циклоалкильную группу;Re и Rf независимо друг от друга представляют собой атом водорода; атом галогена; С 1-С 4 алкил; С 1-С 4 алкокси; -CF3; -CN или -NH2 группу; и их оптические антиподы или рацематы и/или соли. Когда R6 представляет собой необязательно замещенный шестичленный ароматический цикл с двумя атомами азота, термин "необязательно замещенный" означает, что данный цикл может иметь один заместитель, выбранный из атома галогена, C1-C4 алкила, -CF3 или -SCH3 групп. Когда R6 представляет собой необязательно замещенный пятичленный ароматический цикл с двумя атомами азота, термин "необязательно замещенный" означает, что данный цикл может иметь в качестве заместителя С 1-С 4 алкильную группу. Когда R6 представляет собой необязательно замещенный пятичленный ароматический цикл с одним гетероатомом, выбранным из О или S, термин "необязательно замещенный" означает, что данный цикл может иметь один заместитель, выбранный из С 1-С 4 алкила или S-(С 1-С 4) алкильной группы. Когда R6 представляет собой необязательно замещенную пиридильную группу, термин "необязательно замещенный" означает, что она может иметь один или два заместителя, выбранных из атома галогена, С 1-С 4-алкила или -CF3 группы. Термин "галоген" или "гало" в настоящем тексте при использовании отдельно или в качестве части другой группы, означает хлор, бром, фтор и иод. Термин "С 1-С 4 алкил" в настоящем тексте относится к разветвленным или линейным алкильным группам, содержащим от одного до четырех атомов углерода, включая метил, этил, пропил, н- и изопропил и различные бутильные группы. Термин "С 3-С 6 циклоалкил" в настоящем тексте относится к карбоциклическим группам, содержащим от 3 до 6 атомов углерода соответственно; например циклопропил, циклобутил, циклопентил и циклогексил. Термин "С 1-С 4 алкокси" в настоящем тексте относится к разветвленным или линейным алкильным группам, содержащим от одного до четырех атомов углерода, связанных через атом кислорода, включая(но не ограничиваясь только ими) метокси, этокси, пропокси и т-бутокси. В настоящем тексте, термин "селективный антагонист брадикинина-1" относится к веществу, например к органической молекуле, которое является потенциальным полным антагонистом человеческого рецептора В 1 и показывает по меньшей мере 50-кратную селективность в сравнении с В 2 рецепторами. Термин "млекопитающее" в настоящем тексте относится к любому представителю класса "Млекопитающие", включая человека, но не ограничиваясь только им. Термин "соль" означает нетоксичные кислотно-аддитивные соли соединений по настоящему изобретению, которые в целом получают реакцией основания с подходящей органической или неорганической кислотой. В типичном случае соли по настоящему изобретению представляют собой фармацевтически приемлемые соли, включая, например, гидрохлоридные и гидробромидные соли. В объем настоящего изобретения включены все стереоизомеры, геометрические изомеры и таутомерные формы соединений формулы (I), включая соединения, обладающие более чем одним типом изомерии, и смеси одного или более из них. цис/транс-Изомеры можно разделить по обычным методикам, хорошо известным квалифицированным специалистам в данной области техники, например, хроматографией или дробной кристаллизацией. Обычные методики для получения/выделения индивидуальных энантиомеров включают хиральный синтез из подходящего оптически чистого предшественника или разделение рацемата (или рацемата соли или производного) с применением, например, хиральной высокоэффективной жидкостной хроматографии (ВЭЖХ). Термин "фармацевтически приемлемый" описывает ингредиент, который может применяться в приготовлении фармацевтической композиции и является в целом безопасным, нетоксичным и не нежелательным в биологическом или каком-либо ещ смысле и включает ингредиенты, приемлемые для применения в ветеринарии, а также в фармацевтике для человека. Термин "фармацевтически эффективное количество" означает количество активного ингредиента,которое вызывает биологический или медицинский ответ ткани, системы или животного, необходимый исследователю или врачу. Термин "фармацевтическая композиция" означает смесь соединения по настоящему изобретению с другими химическими компонентами, такими как фармацевтически приемлемые вспомогательные вещества, например разбавители или носители. Фармацевтическая композиция облегчает введение соединения субъекту. Термин "вспомогательное вещество" означает химическое соединение, которое облегчает введение соединения в клетки или ткани. В настоящем тексте термин "лечение" означает применение эффективной терапии для уменьшения,смягчения или снятия симптомов, вызванных нарушениями, включающими боль и воспаление. В качестве другого аспекта настоящего изобретения описывается синтез соединений формулы (I). Соединения по настоящему изобретению были синтезированы согласно синтетическим путям и схемам, описанным ниже. Соответственно, соединения формулы (I) по настоящему изобретению можно синтезировать одним из описанных далее методов. Метод а) Введение в реакцию индольного производного формулы (II) где значения R1, R2 и R3 соответствуют указанным выше для формулы (I), с бороновой кислотой формулы (III) где значения R4 и R5 соответствуют указанным выше для формулы (I), затем с полученного таким образом индольного производного формулы (IV) где значение R1, R2, R3, R4 и R5 соответствуют указанным выше для формулы (I), снимают защиту, получая аминопроизводное формулы (V)-6 022939 где значения R1, R2, R3, R4 и R5 соответствуют указанным выше для формулы (I), и, наконец, последнее соединение вводят в реакцию с кислотой формулы (VI) где значение R6 соответствует указанным выше для формулы (I), и полученное индольное производное формулы (I) и его оптические антиподы или рацематы и/или соли, в каждом конкретном случае можно превратить в другое соединение формулы (I) и его оптические антиподы или рацематы и/или соли путем введения новых заместителей и/или модификацией или удалением существующих заместителей. Метод b) Введение в реакцию индольного производного формулы (II) где значения R1, R2 и R3 соответствуют указанным выше для формулы (I), с бороновой кислотой формулы (VII) затем полученное таким образом индольное производное формулы (VIII) где значения R1, R2 и R3 соответствуют указанным выше для формулы (I), вводят в реакцию с гидрохлоридом гидроксиламина, получая индольное производное формулы (IX) где значения R1, R2 и R3 соответствуют указанным выше для формулы (I), последнее соединение гидрируют, получая аминопроизводное формулы (X) где значения R1, R2 и R3 соответствуют указанным выше для формулы (I), и наконец последнее соединение вводят в реакцию с кислотой формулы (VI) где значения R6 соответствуют указанным выше для формулы (I), и полученное индольное производное формулы (I), и его оптические антиподы или рацематы и/или соли, в каждом конкретном случае можно превратить в другое соединение формулы (I) и его оптические антиподы или рацематы и/или соли путем введения новых заместителей и/или модификацией или удалением существующих заместителей. Метод с) Аминопроизводные формулы (V) или формулы (X), полученные по методике, описанной в методе а) и методе b), вводят в реакцию с производным аминокислоты формулы (XI) и с полученного таким образом индольного производного формулы (XII) где значения R1, R2, R3, R4 и R5 соответствуют указанным выше для формулы (I), снимают защиту, получая аминопроизводное формулы (XIII) где значения R1, R2, R3, R4 и R5 соответствуют указанным выше для формулы (I), и, наконец, последнее вещество вводят в реакцию с кислотой формулы (XIV) где значения R6 соответствуют указанным выше для формулы (I), и полученное индольное производное формулы (I), и его оптические антиподы или рацематы и/или соли, в каждом конкретном случае можно превратить в другое соединение формулы (I) и его оптические антиподы или рацематы и/или соли путем введения новых заместителей и/или модификацией или удалением существующих заместителей. Реакцию индольного производного формулы (II) с бороновой кислотой формулы (III) или с бороновой кислотой формулы (VII) предпочтительно проводят в подходящем растворителе, предпочтительно в присутствии соли меди(II). Прохождение реакций отслеживают методом тонкослойной хроматографии. Необходимое время реакции составляет 20-70 ч. Обработку реакционной смеси можно проводить описанными далее методами. Реакционную смесь фильтруют через целит и продукт выделяют из фильтрата экстракцией или колоночной хроматографией. Колоночную хроматографию проводят на нормальной фазе, применяя Kieselgel 60 в качестве адсорбента, и с различными системами растворителей, например н-гексан/этилацетат,хлороформ/метанол/уксусная кислота, дихлорметан/этилацетат или хлороформ/ацетон в качестве элюентов. Структуру продуктов определяют методами ИК, ЯМР и масс-спектрометрии. Снятие защиты с индольных производных формулы (IV) и формулы (XII) можно осуществлять в подходящем растворителе с применением органических или неорганических кислот, например трифторуксусной кислоты или хлороводорода. Образование амидной связи предпочтительно проводят путем получения активного производного карбоновой кислоты формулы (VI), (XI) или (XIV), которое вводят в реакцию с амином формулы (V), (X) или (XIII), соответственно, предпочтительно в присутствии основания. Превращение карбоновой кислоты в активное производное можно осуществлять in situ во время образования амидной связи в подходящем растворителе (например, в N,N-диметилформамиде, диметилсульфоксиде, ацетонитриле, хлорированных углеводородах или в углеводородах или в их смесях). Активными производными могут быть активные сложные эфиры (например, полученные из карбоновой кислоты с гидроксибензотриазолом (HOBt) и N-(3-диметиламинопропил)-N'-этилкарбодиимид гидрохлоридом (EDC) или O-(7-азабензотриазол-1-ил-N,N,N',N'-тетраметилурония гексафторфосфатом(HATU) или O-бензотриазол-1-ил-N,N,N',N'-тетраметилурония гексафторфосфатом (HBTU) в присутствии основания, например, триэтиламина, N,N-диизопропилэтиламина). Активные производные можно получать при температуре в диапазоне от 0 С до комнатной температуры. Подходящий амин формулы(V), (X) или (XIII) добавляют в виде свободного основания или соли, образованной с неорганической кислотой, в полученный таким образом раствор или суспензию в присутствии основания, например триэтиламина, N,N-диизопропилэтиламина, необходимого для высвобождения амина. Прохождение реакций конденсации отслеживают методом тонкослойной хроматографии. Необходимое время реакции составляет 6-20 ч. Обработку реакционной смеси можно проводить различными методами.a) Реакционную смесь выливали в воду и продукт выделяли фильтрованием или экстракцией под-9 022939 ходящим органическим растворителем, и в отдельных случаях очищали кристаллизацией или колоночной хроматографией. Колоночную хроматографию проводили на нормальной фазе, применяя Kieselgel 60 в качестве адсорбента и различные системы растворителей, например н-гексан/этилацетат, толуол/метанол, хлороформ/метанол или толуол/ацетон, в качестве элюентов.b) Реакционную смесь напрямую очищали колоночной хроматографией, как описано выше, получая чистый продукт. Строение продуктов определяли методами ИК, ЯМР и масс-спектрометрии. Полученные индольные производные формулы (I) и их оптические антиподы или рацематы и/или соли независимо от способа получения в отдельных случаях можно превращать в другое соединение формулы (I) и его оптические антиподы или рацематы и/или соли путем введения дополнительных заместителей и/или модифицирования и/или удаления существующих заместителей. Например, N-(трет-бутоксикарбонильную) группу можно отщепить органическими или неорганическими кислотами (например, трифторуксусной кислотой или хлороводородом). Большинство индольных производных формулы (II) либо коммерчески доступны, либо могут быть синтезированы различными известными методами. Синтез некоторых новых индольных производных формулы (II) описан в примерах. По описанным методикам можно также получить другие индольные производные формулы (II). Соединения по настоящему изобретению и их оптические антиподы или рацематы и/или соли могут применяться сами по себе или, при необходимости, в форме фармацевтических композиций. Настоящее изобретение также касается фармацевтических композиций, содержащих соединения формулы (I) или их оптические антиподы или рацематы и/или соли в качестве активного ингредиента для лечения определенных нарушений, связанных с активностью рецептора брадикинина В 1. Подходящие способы введения могут включать, например, пероральное, ректальное, трансмукозальное или желудочно-кишечное введение; парэнтеральное введение, включая внутримышечное, подкожное, внутривенное, инъекции в костный мозг, а также внутрисуставные, внутриоболочечные, прямые внутрижелудочковые, интраперитонеальные, интраназальные или внутриглазные инъекции и глазные капли. Альтернативно, можно вводить соединение локально, а не системно, например инъекцией соединения непосредственно в почечную или сердечную область, часто в форме депонированных препаратов или препаратов с замедленным высвобождением. Кроме того, можно вводить лекарственное средство в виде системы направленной доставки лекарств, например, в составе липосом, покрытых тканеспецифическим антителом. Такие липосомы нацелено направляются и селективно усваиваются определенным органом. Фармацевтические композиции можно вводить разнообразными путями и в виде разных дозированных форм. Соединение по настоящему изобретению можно вводить либо по отдельности, либо в виде комбинации с фармацевтически приемлемыми носителями, в виде одной или нескольких доз. Дозировка,необходимая для достижения терапевтического эффекта, может варьировать в широких пределах и в каждом конкретном случае должна соответствовать конкретным требованиям в зависимости от стадии заболевания, состояния и веса тела пациента, нуждающегося в лечении, а также от восприимчивости пациента к активному ингредиенту, способа введения и количества приемов в сутки. Необходимую и безопасную дозировку активного ингредиента может определить квалифицированный лечащий врач пациента, нуждающегося в лечении. Для простоты применения, фармацевтические композиции могут иметь вид дозированных форм,содержащих такое количество активного ингредиента, которое нужно принимать за один раз, или нужно принимать несколько таких форм, или половину, третью часть или четверть дозированной формы. Такими дозированными формами являются, например, таблетки, которые можно измельчить в порошок,снабженные бороздками, по которым таблетку можно разламывать на половинки или на четвертинки,чтобы можно было точно принять необходимое количество активного ингредиента. Фармацевтические композиции, содержащие активный ингредиент по настоящему изобретению,обычно содержат от 0,01 до 500 мг активного ингредиента в одной единице дозировки. Разумеется, допустимо, чтобы количество активного ингредиента в некоторых композициях превосходило описанные выше верхний или нижний пределы. В другом аспекте настоящего изобретения описано фармацевтическое производство лекарственных средств, содержащих соединения формулы (I) или их оптические антиподы или рацематы и/или соли. Фармацевтические композиции по настоящему изобретению можно получать известными способами, например путем обычного смешивания, растворения, гранулирования, изготовления драже, растирания в порошок, эмульгирования, инкапсулирования, включения или таблетирования. Фармацевтические композиции для применения по настоящему изобретению могут, таким образом,включаться в состав препарата обычным образом, с применением одного или более физиологически приемлемых наполнителей и вспомогательных веществ, которые облегчают изготовление из активных ингредиентов препаратов, которые могут применяться в фармацевтической практике. Конкретный вид препарата зависит от выбранного способа введения. Могут использоваться любые хорошо известные в дан- 10022939 ной области техники подходящие методики, носители и вспомогательные вещества. Подходящими вспомогательными веществами являются, например, наполнители, такие как сахара,включая лактозу, сахарозу, маннит или сорбит; препараты целлюлозы, такие как, например, кукурузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, желатин, трагакантовая камедь,метилцеллюлоза, гидроксипропил метилцеллюлоза, натрия карбоксиметилцеллюлоза и/или поливинилпирролидон (ПВП). При желании можно добавлять разрыхлители, такие как сшитый поливинилпирролидон, агар или альгиновая кислота или ее соли, такие как альгинат натрия. Описанные выше ингредиенты и различные пути производства служат только для иллюстрации. Могут также применяться другие вещества, а также методы обработки и т.д., хорошо известные в данной области техники. Соединения по настоящему изобретению представляют собой антагонисты рецептора брадикинина,в частности селективные антагонисты рецептора брадикинина В 1, и поэтому могут применяться в лечении и профилактике нарушений, включающих боль и воспаление, которые включают введение млекопитающему, подвергающемуся лечению, эффективного количества соединений формулы (I) по настоящему изобретению, в чистом виде или в виде лекарственного средства. Данные соединения эффективны в лечении соматической мышечно-скелетной боли и нарушений,включающих боль и нарушения в костях и суставах (например, артрит, включая ревматоидный и другие типы воспалительного артрита, остеоартрит, спондилит и инфекционный артрит, артрит, возникающий вследствие подагры или псевдоподагры, аутоиммунные и сосудистые нарушения суставов, такие как системная красная волчанка, ревматическая полимиалгия, множественный артрит, остеопороз), боль внизу спины, заболевания, вызванные повторяющимися движениями (например, теносиновит, тендонит,эпикондилит, бурсит, сухожильный ганглий, синдром запястного канала, синдром щелкающего пальца),миофасциальный болевой дисфункциональный синдром и фибромиалгия. Соединения по настоящему изобретению могут также применяться для лечения воспалительных заболеваний кожи, таких как псориаз, дерматит и экзема, повреждений кожи, включая ожоги и солнечные ожоги (например, УФ-эритема и боль), зуда и порезов. Соединения представляются эффективными в лечении висцеральной боли и нарушений грудной клетки и брюшной полости (стенокардия, язвенный колит, панкреатит, холецистит, заболевания печени,нефрит, гастрит, аппендицит, синдром раздраженного кишечника, воспалительное заболевание кишечника, болезнь Крона), висцеральные боли в тазу (цистит, гиперактивный мочевой пузырь, менструация). Они могут применяться в качестве мягкого мышечного релаксанта для лечения спазмов желудочнокишечного тракта или матки, а также спазмов и боли в желчевыводящих протоках и мочеиспускательной системе. Такие соединения могут применяться в терапии для лечения воспалительных заболеваний дыхательных путей, например хронической обструктивной болезни легких (ХОБЛ), синдрома острой дыхательной недостаточности (СОДН), бронхита, пневмонии, плеврита и астмы. Они могут применяться для контроля, смягчения или вызывания обратного развития астмы, для лечения наследственной и приобретенной бронхиальной астмы, включая аллергическую астму (включая атопическую и неатопическую),профессиональной бронхиальной астмы, астмы, отягощенной вирусным или бактериальным заболеванием, других видов неаллергической астмы, влажных хрипов у младенцев, а также бронхоспазмов, вызванных физической нагрузкой. Они могут эффективно работать против пневмокониоза, включая алюминоз,антракоз, асбестоз, халикоз, птилоз, сидероз, силикоз, табакоз и биссиноз. Кроме того, данные соединения могут применяться для лечения поражений, нарушений сосудов и таких воспалительных состояний,как отек Квинке, атеросклероз, септический шок, например средства против геморрагического шока и/или анти-гипотензивные средства, против ишемически-реперфузионного повреждения. Соединения могут применяться для лечения воспалительной боли различного происхождения (например, аллергического ринита, вазомоторного ринита, увеита, ретинита, гингивита), атопических и аллергических заболеваний. Соединения могут применяться для облегчения глаукомы, зубной боли и лихорадки. Соединения по настоящему изобретению могут применяться для лечения нейропатической боли(например, невралгии, повреждений нервов, фантомной боли, мононевропатии, полиневропатии, неврита и радикулита). Соединения представляются эффективными в лечении болезненной периферической невропатии, такой как инфекционный опоясывающий лишай (например, постгерпетическая невралгия), вызванные ВИЧ невропатии, пищевой недостаточности, токсины. Соединения представляются эффективными в лечении болей, вызванных раковыми заболеваниями, и побочных эффектов при химиотерапии,радиационных поражений или хирургических поражений. Соединения могут применяться в лечении фиброзных заболеваний (например, фиброз легких, фиброз почек, фиброз печени), гиперплазии (например, доброкачественная гиперплазия предстательной железы) и рака (например, рака молочной железы). Соединения представляются эффективными при иммунологических нарушениях (аутоиммунные заболевания, гиперчувствительность, отторжение транспланта, иммунная недостаточность). Соединения представляются эффективными в лечении периоперационной боли (например, при общей хирургии, гинекологических операциях), постоперационной боли (послеоперационный болевой синдром), посттравматических болей (например, при растяжении или переломе). Соединения также представляются эффективными в лечении травматических повреждений мозга. Соединения по настоящему изобретению могут являться полезными анальгетиками, применяемыми во время общей и управляемой анестезии. Кроме того, соединения представляются эффективными в лечении боли и нарушений, вызванных диабетом (например, диабетическая невропатия, диабетическая нефропатия, диабетическая васкулопатия, диабетическая ретинопатия, остеопатия, посткапиллярная резистентность или диабетические симптомы, связанные с инсулитом (например, гипергликемия, диурез, протеинурия и повышенное выделение нитритов и калликреина с мочой). Кроме того, они могут быть эффективны при некоторых нейрологических нарушениях, например в случае множественного склероза, болезни Альцгеймера, болезни Паркинсона, эпилепсии, инсульта, отека головного мозга, головной боли, включая кластерную головную боль, мигрень, включая профилактическое использование и применение в острых случаях, а также при закрытых травмах головы. Биологическое исследование Функциональный анализ. Оценка антагонистического потенциала к В 1 рецепторам in vitro путем измерения концентрации ионов кальция в цитозоле с использованием флуориметра для чтения планшетов в клетках, экспрессирующих рекомбинантные В 1 рецепторы человека. Клеточная культура. Клетки яичника китайского хомячка (СНО), стабильно экспрессирующие рекомбинантные В 1 рецепторы человека (СНО-В 1, Euroscreen) выращивали в модифицированной по способу Дульбекко среде Игла (DMEM), содержащей 10% эмбриональной телячьей сыворотки (FCS), 100 ед/мл пенициллина, 0,1 мг/мл стрептомицина, 0,25 мкг/мл амфотерицина В, 1% минимальной эссенциальной среды Игла (MEM),раствор не незаменимых аминокислот, 600 мкг/мл G418. Клетки выращивали при 37 С в увлажняемом инкубаторе в атмосфере 5% СО 2/95% воздух и пересеивали 1:4 три раза в неделю. Клетки помещали в стандартный 96-луночный микропланшет в концентрации 1,5-2,5104 клеток/лунку, измерения концентрации ионов кальция ([Ca2+]i) в цитозоле проводили через 1-2 дня после помещения клеток в микропланшет. Флуориметрическое измерение концентрации ионов кальция в цитозоле. Измерения концентрации [Са 2+]i проводили на СНО-В 1 клетках, устойчиво экспрессирующих В 1 рецепторы человека, соответственно. Клетки выращивали в стандартных 96-луночных микропланшетах и перед измерением в лунки добавляли флуоресцентный Са 2+-сензитивный краситель, fluo-4/AM (2 мкМ), после удаления среды для выращивания культур клеток к клеткам добавляли краситель (растворенный в буфере для проведения анализа: 145 мМ NaCl, 5 мМ KCl, 2 мМ MgCl2, 2 мМ CaCl2, 10 мМHEPES, 20 мМ D-глюкозы, 2 мМ пробенецид, 100 мкл/лунку) и клетки инкубировали при 37 С в увлажняемом инкубаторе в атмосфере 5% СО 2/95% воздух в течение 40-120 мин. Для остановки процесса клетки с добавленным красителем дважды промывали буфером для проведения анализа. После промывки в каждую лунку добавляли различные концентрации испытуемых соединений (разбавленных во внеклеточной среде из стоковых растворов в ДМСО, конечная концентрация ДМСО 0,1%) или буферный раствор в зависимости от модели постановки эксперимента. После инкубирования при 37 С в течение 20-25 мин на флуориметре для чтения планшетов (Fluoroskan Ascent, Labsystems) колонка за колонкой измеряли фоновые и спровоцированные агонистом изменения [Ca2+]i. Возбуждение и детектирование испускания осуществляли снизу планшета. Использовали фильтры для Fluo-4: фильтр возбуждающего излучения - 485 нм, эмиссионный фильтр - 538 нм. Весь процесс измерения проводили при 37 С и контролировали с помощью разработанного по заказу программного обеспечения. Ингибирующую способность испытуемых соединений оценивали путем измерения уменьшения вызванного агонистом роста[Са 2+]i в присутствии различных концентраций соединений. Агонистом для СНО-В 1 клеток служил LysDABK. Агонист применяли в EC50 концентрации; значения EC50 вычисляли из ежедневно фиксируемых кривых зависимости ответа от дозировки. Данные флуоресценции выражали в виде AF/F (изменение флуоресценции, нормализованное по базовой линии). Все обработки на одном планшете проводили в нескольких повторах. Данные для всех лунок с одной и той же обработкой усредняли и для анализа использовали усредненные данные. Ингибирующую способность соединения в отдельной точке концентрации выражали как процент ингибирования ответа на агонист в контрольном эксперименте. По полученным данным (по меньшей мере трех независимых экспериментов) строили сигмоидальные кривые зависимости ингибирования от концентрации, и значения IC50 вычисляли как концентрацию, которая обеспечивает половину максимального ингибирования, вызываемого соединением. В функциональных тестах и тестах связывания были протестированы следующие референсные соединения: 1) 4-2-[(2,2-дифенилэтил)амино]-5-4-[4-[(4-метил-1-пиперазинил)карбонил]-1-пиперидинил] сульфонилбензоилморфолин (NVP-SAA164, Br. J. Pharmacol.144 (2005), 889-899); Ki 8 нМ; IC50: 33 нМ; 2) Определенные нами значения Ki и IC50 для референсных соединений находятся в хорошем соответствии с литературными данными. В табл. I перечислены соединения по настоящему изобретению, подвергнутые функциональному тестированию. Таблица I Исследование связывания с рецептором. Оценка связывания лиганда с В 1 и В 2 рецепторами in vitro методом конкурентного радиолигандного связывания. 1. Связывание с рекомбинантным человеческим рецептором брадикинина В 1. Исследование связывания проводили на рекомбинантных человеческих рецепторах брадикинина В 1(экспрессированы в СНО клетках, hB1-A5) согласно Euroscreen Technical Data Sheet (Cat. No. ES-091). 20 мкг белка на пробирку инкубировали с [3,4-пролил-3,4-H(N)]-[Des-Arg10]каллидином в качестве радиолиганда. Неспецифическое связывание определяли в присутствии 10 мкМ Lys-des-Arg9-брадикинина. Конечный инкубируемый объем составил 250 мкл. Образцы инкубировали в течение 15 мин при 25 С,затем быстро фильтровали под вакуумом через GF/B фильтры, предварительно вымоченные в течение по меньшей мере 1 ч в 0,5% PEI. Радиоактивность определяли методом жидкостной сцинтилляционной спектроскопии. Замещение лиганда тестируемыми соединениями определяли, используя как минимум семь концентраций в трехкратном повторении, и эксперименты повторяли по меньшей мере два раза. Специфическое радиолигандное связывание определяют как разницу между общим связыванием и неспецифическим связыванием, определяемым в присутствии избытка немеченого лиганда. Результаты выражены в процентах ингибирования специфического связывания, полученных в присутствии RGH-478 или референсного лекарственного средства. Значения IC50 (т.е. концентрацию соединения, обеспечивающую 50%-ное ингибирование специфического связывания) вычисляли по кривым концентрация-замещение, приведенным к сигмоидальной форме, с помощью программы GraphPad Prism Software 4.0. Значения Ki (т.е. константы ингибирования) вычисляли с помощью уравнения Ченга-Прусофа. KD определяли из графика Скэтчарда (Editor-in-chief: Enna, S.J. and Williams, M. Current protocols in pharmacology vol. 1. John Wileysons Inc., 1998). В табл. II приведены соединения по настоящему изобретению, прошедшие анализ связывания. Таблица II+ Ki между 0,1 и 0,5 мкМKi между 20 и 100 нМKi20 нМ 2. Связывание с рекомбинантным человеческим рецептором брадикинина В 2. Исследование связывания проводили на рекомбинантных человеческих рецепторах брадикинина В 2(экспрессированы в СНО клетках) согласно Receptor Biology Technical Data Sheet (Cat. No. RBHB2M) с небольшими изменениями. 8,4 мкг белка на пробирку инкубировали с [2,3,-пролил-3,4-3 Н(N)]брадикинином в качестве радиолиганда. Неспецифическое связывание определяли в присутствии 5 мкМ брадикинина. Конечный инкубируемый объем составил 200 мкл. Образцы инкубировали в течение 90 мин при +4 С, затем быстро фильтровали под вакуумом через GF/B фильтры, предварительно вымоченные в течение по меньшей мере 1 ч в 0,5% PEI. Радиоактивность определяли методом жидкостной сцинтилляционной спектроскопии. Соединения тестировали в тестовой концентрации 5 мкМ. Специфическое радиолигандное связывание определяют как разницу между общим связыванием и неспецифическим связыванием, определяемым в присутствии избытка немеченого лиганда. Результаты выражены в процентах ингибирования специфического связывания, полученных в присутствии RGH-478 или референсного лекарственного средства. Значения IC50 (т.е. концентрацию соединения, обеспечивающую 50%-ное ингибирование специфического связывания) вычисляли по кривым концентрация- 16022939 замещение, приведенным к сигмоидальной форме, с помощью программы GraphPad Prism Software 4.0. Значения Ki (т.е. константы ингибирования) вычисляли с помощью уравнения Ченга-Прусофа. KD определяли из графика Скэтчарда. (Editor-in-chief: Enna, S.J. and Williams, M. Current protocols in pharmacologyvol. 1. John Wileysons Inc., 1998). Исследованные соединения продемонстрировали высокое сродство и селективность (50-кратное) в отношении человеческого рецептора В 1 по сравнению с человеческим рецептором В 2 согласно данным анализа связывания. Настоящее изобретение будет далее проиллюстрировано приведенными ниже неограничивающими примерами. Сравнительный пример 1. 3-Фтор-4-(трет-бутоксикарбониламинометил)фенилбороновая кислота.a) 4-Аминометил-3-фторфенилбороновая кислота. Перемешиваемую смесь 5 г (27,33 ммоль) 3-фтор-4-(гидроксииминометил)фенилбороновой кислоты (WO 2006/38100) и 0,6 г 10% Pd/C в 80 мл этанола и 4,6 мл (54,7 ммоль) концентрированной хлористо-водородной кислоты гидрировали при комнатной температуре в течение 3 ч. Начальный экзотермический период контролировали, погружая реакционную колбу в водяную баню. Реакционную смесь фильтровали через целит и фильтрат упаривали в вакууме. Остаток растирали в смеси диэтилового эфира и этилацетата, осадок отфильтровывали, промывали диэтиловым эфиром (215 мл) и сушили, получая 5,47 г (97%) указанного в заголовке соединения в виде белого аморфного твердого вещества. MS (EI) 153,1 ([M-NH]+).b) 3-Фтор-4-(трет-бутоксикарбониламинометил)фенилбороновая кислота. К раствору 5 г (29,6 ммоль) 4-аминометил-3-фторфенилбороновой кислоты в 30 мл воды и 50 мл тетрагидрофурана добавляли раствор 6,7 г (30,5 ммоль) ди-трет-бутилдикарбоната в 15 мл тетрагидрофурана, после чего добавляли 15,5 мл (88,8 ммоль) N,N-диизопропилэтиламина. Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Значение рН раствора доводили до 6 при 0 С путем добавления 2 М раствора хлористо-водородной кислоты и разделяли органическую и водную фазы. Водную фазу промывали 320 мл этилацетата, объединенные органические слои промывали 10 мл воды и 210 мл насыщенного раствора соли, сушили над безводным сульфатом натрия, фильтровали и упаривали в вакууме. Остаток растирали в гексане и перемешивали в течение 2 ч. Твердый осадок отфильтровывали и сушили, получая 5,44 г (68%) указанного в заголовке соединения в виде желтого масла. MS (EI) 292,1 [M+Na]+. Сравнительный пример 2. (R)-4-(1-трет-Бутоксикарбониламиноэтил)фенилбороновая кислота. В атмосфере аргона к раствору 119,74 г (400 ммоль) трет-бутилового эфира [(R)-1-(4-бромфенил) этил]карбаминовой кислоты в 1500 мл сухого тетрагидрофурана прикапывали 800 мл 2,5 M раствора нBuLi в гексане (2 моль) при -78 С в течение 1,5 ч. После перемешивания смеси при -78 С в течение 20 мин, прикапывали 125 мл (545 ммоль) триизопропилбората в течение 0,5 ч. Полученную таким образом смесь оставляли нагреваться до -20 С и перемешивали при этой температуре в течение 18 ч. Реакционную смесь гасили добавлением 500 мл насыщенного раствора хлорида аммония (рН 8) и оставляли нагреваться до комнатной температуры. Реакционную смесь экстрагировали этилацетатом, объединенные органические слои промывали водой, сушили над безводным сульфатом натрия, фильтровали и упаривали в вакууме. Остаток перемешивали с 500 мл н-гексана в течение ночи, затем фильтровали и сушили,получая 65,75 г (62%) указанного в заголовке соединения в виде белого твердого вещества. MS (EI) 288,2Med. Chem. Lett., 2006, 16, 1277-81) в 45 мл воды и 135 мл тетрагидрофурана добавляли раствор 8,5 г(38,9 ммоль) ди-трет-бутилдикарбоната в 10 мл тетрагидрофурана, после чего добавляли 27 мл (155 ммоль) N,N-диизопропилэтиламина. Реакционную смесь перемешивали при комнатной температуре в течение ночи. Разделяли органическую и водную фазы, водную фазу промывали этилацетатом (3160 мл). Объединенные органические слои промывали 80 мл воды и 80 мл насыщенного раствора соли, сушили над безводным сульфатом натрия, фильтровали и упаривали в вакууме, получая 9,64 г (74%) указанного в заголовке соединения в виде желтого масла. MS (EI) 253,2 (производное бороновой кислотыb) 6-(трет-Бутоксикарбониламинометил)-3-пиридинбороновая кислота. К раствору 9,64 г (26,26 ммоль) пинакол 6-(трет-бутоксикарбониламинометил)-3-пиридинбороната в 190 мл ацетона добавляли 5,63 г (73 ммоль) ацетата аммония в 90 мл воды, после чего добавляли 18,8 г(87,8 ммоль) периодата натрия. Полученную суспензию перемешивали при комнатной температуре в течение 3 ч и разбавляли, добавляя 180 мл этилацетата. Жидкую фазу декантировали с нерастворенного остатка и процесс повторяли с 20 мл этилацетата. Разделяли органическую и водную фазы, водную фазу промывали 210 мл этилацетата. Объединенные органические слои промывали 330 мл воды, 250 мл насыщенного раствора соли, сушили над безводным сульфатом натрия, фильтровали и упаривали в ва- 17022939 кууме. Остаток растворяли в 90 мл воды, значение рН в суспензии доводили до 6 путем добавления 1 М водного раствора гидроксида натрия и полученную таким образом смесь промывали 150 мл этилацетата. Органический слой промывали 250 мл воды и 250 мл насыщенного раствора соли, сушили над безводным сульфатом натрия, фильтровали и упаривали в вакууме. Полученную желтую пену растирали в смеси гексана и диэтилового эфира и полученную суспензию перемешивали в течение ночи. Твердый осадок отфильтровывали, промывали гексаном и сушили, получая 3,55 г (48%) указанного в заголовке соединения в виде не совсем белого твердого вещества. MS (EI) 253,2 (МН+). Сравнительный пример 4. 1-Аминоциклопропанкарбоновой кислоты 4-[3-хлор-2-(2-метил-2Hтетразол-5-ил)индол-1-ил]бензиламид гидрохлорид.a) 3-Хлор-1H-индол-2-карбоновая кислота. Смесь 40,0 г (0,248 моль) 1H-индол-2-карбоновой кислоты, 33,6 г (0,251 моль) N-хлорсукцинимида в 800 мл ацетонитрила кипятили в течение 5 ч. Реакционную смесь охлаждали, упаривали в вакууме и остаток перемешивали с 500 мл воды. Выпавший в осадок продукт отфильтровывали, промывали водой и сушили, получая 42,21 г (87,0%) указанного в заголовке соединения. Т.пл.: 192-193 С.b) Амид 3-хлор-1H-индол-2-карбоновой кислоты. Смесь 42,2 г (0,215 моль) 3-хлор-1H-индол-2-карбоновой кислоты, 42,2 мл (0,580 моль) тионилхлорида, 0,17 мл N,N-диметилформамида в 710 мл хлороформа кипятили в течение 3 ч. Реакционную смесь охлаждали до 20 С, выливали в смесь 420 мл 25%-го раствора аммиака и 1500 г льда, после чего перемешивали в течение 2 ч. Выпавший в осадок продукт отфильтровывали и промывали водой, получая 25,29 г (60,2%) указанного в заголовке соединения. Т.пл.: 191-192 С.c) 3-Хлор-1H-индол-2-карбонитрил. Смесь 28,05 г (144 ммоль) амида 3-хлор-1H-индол-2-карбоновой кислоты, 67,36 мл (722 ммоль) оксихлорида фосфора и 525 мл хлороформа кипятили в течение 3 ч. Реакционную смесь охлаждали до 20 С, выливали в смесь 40 мл 37%-ной хлористо-водородной кислоты и 1000 г льда, затем перемешивали в течение 2 ч. Органический слой отделяли и водную фазу экстрагировали 500 мл хлороформа. Объединенные органические слои промывали водой и насыщенным раствором карбоната натрия, сушили над безводным сульфатом натрия и упаривали. Остаток кристализовали из 1:1 смеси 2-пропанола и воды,получая 20,89 г (82,1%) указанного в заголовке соединения. Т.пл.: 150-154 С.d) 3-Хлор-2-(2-метил-2H-тетразол-5-ил)-1H-индол. Смесь 23,31 г (132 ммоль) 3-хлор-1H-индол-2-карбонитрила, 9,32 г (143 ммоль) азида натрия и 7,95 г (148 ммоль) хлорида аммония в 240 мл N,N-диметилформамида кипятили в течение 3,5 ч. Реакционную смесь охлаждали до 20 С, затем добавляли 12,0 мл (192 ммоль) иодметана и перемешивали в течение 16 ч. Реакционную смесь выливали в 500 мл воды, выпавший в осадок продукт отфильтровывали и перекристаллизовывали из 2-пропанола, получая 13,95 г (45,2%) указанного в заголовке соединения. Т.пл.: 197-199 С.e) трет-Бутиловый эфир 4-[3-хлор-2-(2-метил-2H-тетразол-5-ил)индол-1-ил]бензилкарбаминовой кислоты. Смесь 5,85 г (25 ммоль) 3-хлор-2-(2-метил-2H-тетразол-5-ил)-1H-индола, 9,4 г (37,4 ммоль) 4-(третбутоксикарбониламинометил)фенилбороновой кислоты, 7,6 г (50 ммоль) ацетата меди(II), 17,6 мл (100 ммоль) N,N-диизопропилэтиламина, 12,2 г молекулярных сит 3 в 200 мл N,N-диметилформамида интенсивно перемешивали при комнатной температуре, пропуская через смесь воздух, в течение 24 ч и добавляли ещ 2,0 г (7,9 ммоль) 4-(трет-бутоксикарбониламинометил)фенилбороновой кислоты. Полученную смесь перемешивали при комнатной температуре, пропуская через смесь воздух, в течение 48 ч, затем фильтровали через целит. Фильтрат упаривали в вакууме. Остаток очищали колоночной флэшхроматографией, используя в качестве адсорбента Kieselgel 60 (0,015-0,040 мм) (Merck) и смесь гексан:этилацетат = 4:1 в качестве элюента, получая 11,8 г указанного в заголовке соединения в виде желтого масла.f) 4-[3-Хлор-2-(2-метил-2H-тетразол-5-ил)индол-1-ил]бензиламина гидрохлорид. Ранее полученный продукт (25 ммоль) растворяли в 60 мл 10%-ного раствора хлороводорода в этилацетате и перемешивали при комнатной температуре в течение 16 ч. Выпавший в осадок продукт отфильтровывали и промывали диэтиловым эфиром, получая 9,34 г (99%) указанного в заголовке соединения. Т.пл.: 225-228 С.g) трет-Бутиловый эфир 1-4-[3-хлор-2-(2-метил-2H-тетразол-5-ил)индол-1-ил]бензилкарбамоил циклопропил)карбаминовой кислоты. Смесь 6,0 г (16 ммоль) 4-[3-хлор-2-(2-метил-2H-тетразол-5-ил)индол-1-ил]бензиламина гидрохлорида,3,3 г (16,4 ммоль) 1-трет-бутоксикарбониламиноциклопропанкарбоновой кислоты, 4,8 мл (34,5 ммоль) триэтиламина, 6,3 г (16,6 ммоль) HBTU [О-бензотриазол-1-ил-N,N,N',N'-тетраметилурония гексафторфосфат] и 75 мл N,N-диметилформамида перемешивали при комнатной температуре в течение 24 ч и упаривали в вакууме. Остаток очищали колоночной флэш-хроматографией, используя в качестве адсорбента Kieselgel 60 (0,015-0.040 мм) (Merck) и смесь толуол:метанол = 4:1 в качестве элюента, получая 6,42 г указанного в заголовке соединения в виде желтого масла. бензиламида гидрохлорид. Ранее полученный продукт (16 ммоль) растворяли в 50 мл 10%-ного раствора хлороводорода в этилацетате и перемешивали при комнатной температуре в течение 6 ч. Реакционную смесь упаривали в вакууме, остаток кристаллизовали из диэтилового эфира, получая 4,22 г (62,5%) указанного в заголовке соединения. Т.пл.: 70-80 С. Сравнительный пример 5. 4-[2-(2-Метил-2H-тетразол-5-ил)индол-ил]бензиламина гидрохлорид. а) 2-(2H-Тетразол-5-ил)-1H-индол. Смесь 1,0 г (7,04 ммоль) 1H-индол-2-карбонитрила (I. Borza at al. Bioorg. Med. Chem. Lett. 2005, 15,5439-5441), 1,5 г (7,28 ммоль) триметилолова азида и 50 мл толуола кипятили в течение 3 ч. Реакционную смесь охлаждали до 20 С и выпавший в осадок продукт отфильтровывали, получая 2,22 г комплекса олова с указанным в заголовке соединением. Т.пл.: 236-240 С.b) 4-[2-(2H-Тетразол-5-ил)индол-ил]бензальдегид. Смесь 0,4 г (1,4 ммоль) 2-(2H-тетразол-5-ил)-1H-индола, 0,31 г (2,06 ммоль) 4-формилфенилбороновой кислоты, 0,42 г (2,77 ммоль) ацетата меди(II), 0,98 мл (5,6 ммоль) N,Nдиизопропилэтиламина, 0,7 г молекулярных сит 3 в 15 мл N,N-диметилформамида интенсивно перемешивали при комнатной температуре, пропуская через смесь воздух, в течение 14 ч. Полученную смесь фильтровали через целит. Фильтрат упаривали в вакууме. Остаток очищали колоночной флэшхроматографией, используя в качестве адсорбента Kieselgel 60 (0,015-0,040 мм) (Merck) и смесь хлороформ:метанол:уксусная кислота = 10:1:0.1 в качестве элюента, получая после кристаллизации из 2 пропанола 0,12 г (19%) указанного в заголовке соединения. Т.пл.: 210-212 С. с) 4-[2-(2-Метил-2H-тетразол-5-ил)индол-ил]бензальдегид. Смесь 0,7 г (2,4 ммоль) 4-[2-(2H-тетразол-5-ил)индол-ил]бензальдегида, 0,2 мл (3,2 ммоль) подметана, 1,0 г (7,2 ммоль) карбоната калия и 50 мл ацетонитрила кипятили в течение 0,5 ч. Реакционную смесь охлаждали до 20 С, фильтровали и фильтрат упаривали в вакууме. Остаток очищали колоночной флэш-хроматографией, используя в качестве адсорбента Kieselgel 60 (0,015-0,040 мм) (Merck) и смесь толуол:метанол = 4:1 в качестве элюента, получая 0,238 г (32.4%) указанного в заголовке соединения (Rf: 0,8) и 0,21 г (28,6%) 4-[2-(1-метил-2H-тетразол-5-ил)индол-ил]бензальдегида (Rf: 0,7).d) 4-[2-(2-Метил-2H-тетразол-5-ил)индол-ил]бензальдегида оксим. Смесь 0,238 г (0,78 ммоль) 4-[2-(2-метил-2H-тетразол-5-ил)индол-ил]бензальдегида, 0,07 г (1,0 ммоль) гидрохлорида гидроксиламина, 0,09 мл (1,1 ммоль) пиридина и 10 мл этанола кипятили в течение 1 ч. Реакционную смесь охлаждали до 20 С, упаривали в вакууме и остаток обрабатывали водой. Выпавший в осадок продукт отфильтровывали, получая 0,19 г (75,6%) указанного в заголовке соединения. Т.пл.: 159-161 С.e) 4-[2-(2-Метил-2H-тетразол-5-ил)индол-ил]бензиламина гидрохлорид. Смесь 0,19 г (0,59 ммоль) 4-[2-(2-метил-2H-тетразол-5-ил)индол-ил]бензальдегида оксима, 20 мл метанола, 1 мл 36%-ной хлористо-водородной кислоты и 0,05 г 10% Pd/C катализатора гидрировали в течение 6 ч. Катализатор отфильтровывали, фильтрат упаривали в вакууме и остаток обрабатывали диэтиловым эфиром, получая 0,192 г (94,5%) указанного в заголовке соединения. Т.пл.: 289-290 С. Сравнительный пример 6. 4-[3-Хлор-2-(2-метил-2H-тетразол-5-ил)индол-1-ил]-2-фторбензиламина гидрохлорид. Указанное в заголовке соединение получали из 3-хлор-2-(2-метил-2H-тетразол-5-ил)-1H-индола(0,81 ммоль) ацетгидразида, 1,2 мл (0,86 ммоль) триэтиламина, 3,0 г (0,79 ммоль) HBTU и 45 мл N,Nдиметилформамида перемешивали при комнатной температуре в течение 24 ч, после чего упаривали в вакууме. Остаток очищали колоночной флэш-хроматографией, используя в качестве адсорбента Kieselgel 60 (0,015-0,040 мм) (Merck) и смесь толуол:метанол = 4:1 в качестве элюента, получая после кристаллизации из 2-пропанола 1,1 г (57,0%) указанного в заголовке соединения. Т.пл.: 253-255 С.b) 3-Хлор-2-(5-метил[1,3,4]оксадиазол-2-ил)-1H-индол. Смесь 1,1 г (4,37 моль) N'-ацетилгидразида 3-хлор-1H-индол-2-карбоновой кислоты и 13,19 мл оксихлорида фосфора кипятили в течение 1 ч. Реакционную смесь охлаждали до 20 С, выливали в 100 г льда, перемешивали в течение 2 ч, после чего экстрагировали этилацетатом. Объединенные органические слои промывали водой и насыщенным раствором карбоната натрия, сушили над безводным сульфатом натрия и упаривали в вакууме. Остаток очищали колоночной флэш-хроматографией, используя в качестве адсорбента Kieselgel 60 (0,015-0,040 мм) (Merck) и смесь толуол:метанол = 4:1 в качестве элюента,получая после кристаллизации из диэтилового эфира 0,38 г (37,0%) указанного в заголовке соединения. Т.пл.: 267-268 С. Указанное в заголовке соединение получали из 3-хлор-2-(5-метил[1,3,4]оксадиазол-2-ил)-1H-индола по методикам, описанным в сравнительном примере 4 е и 4f. Т.пл.:265-272 С. Сравнительный пример 8. 4-[2-(1-Метил-2H-тетразол-5-ил)индол-ил]бензиламина гидрохлорид. Указанное в заголовке соединение получали из 4-[2-(1-метил-2H-тетразол-5-ил)индол-ил]бензальдегида (сравнительный пример 5 с) по методикам, описанным в сравнительном примере 5d и 5 е. Т.пл.: 91107 С. Сравнительный пример 9. 1-Аминоциклопропанкарбоновой кислоты 4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензиламид.(110,04 ммоль) гидрохлорида гидроксиламина, 11,38 г (135,44 ммоль) гидрокарбоната натрия и 440 мл метанола перемешивали при комнатной температуре в течение 24 ч. Реакционную смесь выливали в 300 мл воды и перемешивали в течение 1 ч, выпавший в осадок продукт отфильтровывали, промывали водой и сушили, получая 17,19 г (96,8%) указанного в заголовке соединения в виде белого порошка.b) 3-Хлор-2-(5-метил[1.2.4]оксадиазол-3-ил)-1H-индол. Смесь 15,19 г (72,46 ммоль) 3-хлор-N-гидрокси-1H-индол-2-карбоксамидина, 306 мл уксусной кислоты и 17,07 мл (180 ммоль) уксусного ангидрида перемешивали при 90 С 10 ч. Реакционную смесь упаривали в вакууме и остаток перекристаллизовывали из 1:1 смеси метанола и воды, получая сырой продукт, который перекристаллизовывали из 2-пропанола, получая 12,29 г (72,6%) указанного в заголовке соединения.c) 4-[3-Хлор-2-(5-метил[1.2,4]оксадиазол-3-ил)индол-1-ил]бензиламина гидрохлорид. К перемешиваемой смеси 10,0 г (42,7 ммоль) 3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)-1H-индола,21,49 г (85,5 ммоль) 4-(трет-бутоксикарбониламинометил)фенилбороновой кислоты и 12,98 г (85,5 ммоль) ацетата меди(II) в 520 мл ДМСО добавляли 29,8 мл (310 ммоль) N,N-диизопропилэтиламина и 20 г молекулярных сит 3. Реакционную смесь интенсивно перемешивали при комнатной температуре,пропуская через смесь воздух, в течение 6 дней. Полученную смесь фильтровали через целит. Фильтрат разбавляли, добавляя 1000 мл этилацетата и промывали 2500 мл 25%-ного раствора гидроксида аммония. Органический слой промывали 500 мл 1 М раствора лимонной кислоты, сушили над безводным сульфатом натрия, фильтровали и упаривали в вакууме. Остаток растворяли в 350 мл 10%-ного раствора хлороводорода в этилацетате и перемешивали при комнатной температуре в течение 2 ч. Выпавший в осадок сырой продукт отфильтровывали, промывали холодным этилацетатом и перекристаллизовывали из 2-пропанола, получая 14,2 г (88,7%) указанного в заголовке соединения.d) трет-Бутиловый эфир (1-4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоилциклопропил)карбаминовой кислоты. Смесь 14,0 г (37,3 ммоль) 4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензиламина гидрохлорида, 200 мл ДМСО, 9,0 г (44,8 ммоль) 1-трет-бутоксикарбониламиноциклопропанкарбоновой кислоты, 19,0 г (44,8 ммоль) HBTU и 13,0 мл (74,6 ммоль) N,N-диизопропилэтиламина перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь выливали в 2000 мл воды и перемешивали в течение 1 ч. Выпавший в осадок продукт отфильтровывали, промывали водой и перекристаллизовывали из 1:1 смеси 2-пропанола и воды, получая 13,2 г (67,7%) указанного в заголовке соединения.e) 1-Аминоциклопропанкарбоновой кислоты 4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1 ил]бензиламид. Смесь 29,5 г (56,5 ммоль) трет-бутилового эфира (1-4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил) индол-1-ил]бензилкарбамоилциклопропил)карбаминовой кислоты и 450 мл 10%-ного раствора хлороводорода в этилацетате перемешивали при комнатной температуре в течение 12 ч. Реакционную смесь охлаждали и добавляли 500 мл 20%-ного раствора гидроксида натрия. После перемешивания в течение 20 мин органический слой отделяли, сушили над безводным сульфатом натрия, фильтровали и упаривали в вакууме, получая 23,5 г (98%) указанного в заголовке соединения. MS (EI) 422,2 (МН+). Сравнительный пример 10. 4-[3-Хлор-5-фтор-2-(2-метил-2H-тетразол-5-ил)индол-1-ил]бензиламина гидрохлорид. Указанное в заголовке соединение получали из 5-фтор-1H-индол-2-карбоновой кислоты по методикам, описанным в сравнительном примере 4a-f. Т.пл.: 216-220 С. Сравнительный пример 11. 4-[3,5-Дихлор-2-(2-метил-2H-тетразол-5-ил)индол-1-ил]бензиламина гидрохлорид. Указанное в заголовке соединение получали из 5-хлор-1H-индол-2-карбоновой кислоты по методикам, описанным в сравнительном примере 4a-f. Т.пл.: 267-270 С. Сравнительный пример 12. 4-[3-Хлор-5-фтор-2-(2-метил-2H-тетразол-5-ил)индол-1-ил]-2-фторбензиламина гидрохлорид. Указанное в заголовке соединение получали из 5-фтор-1H-индол-2-карбоновой кислоты и 3-фтор-4(трет-бутоксикарбониламинометил)фенилбороновой кислоты (сравнительный пример 1) по методикам,описанным в сравнительном примере 4 а-f. Т.пл.: 176-178 С. Сравнительный пример 13. 4-[3,5-Дихлор-2-(2-метил-2H-тетразол-5-ил)индол-1-ил]-2-фторбензил- 20022939 амина гидрохлорид. Указанное в заголовке соединение получали из 5-хлор-1H-индол-2-карбоновой кислоты и 3-фтор-4(трет-бутоксикарбониламинометил)фенилбороновой кислоты (сравнительный пример 1) по методикам,описанным в сравнительном примере 4a-f. Т.пл.: 186-189 С. Сравнительный пример 14. 1-(4-Аминометилфенил)-3-хлор-1H-индол-2-карбонитрила гидрохлорид.a) трет-Бутиловый эфир [4-(3-хлор-2-цианоиндол-1-ил)бензил]карбаминовой кислоты. К перемешиваемой смеси 0,353 г (2,0 ммоль) 3-хлор-1H-индол-2-карбонитрила (сравнительный пример 4 с), 0,753 г (3 ммоль) 4-(трет-бутоксикарбониламинометил)фенилбороновой кислоты и 0,606 г (4 ммоль) ацетата меди(II) в 24 мл ДМСО добавляли 1,4 мл (8 ммоль) N,N-диизопропилэтиламина. Реакционную смесь интенсивно перемешивали при комнатной температуре, пропуская через смесь воздух, в течение 6 дней. Полученную смесь разбавляли, добавляя 60 мл этилацетата, и промывали 250 мл 25%ного раствора гидроксида аммония. Органический слой промывали 50 мл 1 М раствора лимонной кислоты, сушили над безводным сульфатом натрия, фильтровали и упаривали в вакууме. Остаток очищали колоночной хроматографией, используя в качестве адсорбента Kieselgel 60 (0,015-0,040 мм) (Merck) и смесь гексан:этилацетат = 4:1 в качестве элюента, получая 0,428 г (56%) указанного в заголовке соединения. MS (EI) 404,1 [M+Na]+.b) 1-(4-Аминометилфенил)-3-хлор-1H-индол-2-карбонитрила гидрохлорид. К раствору 0,428 г (1,121 ммоль) трет-бутилового эфира [4-(3-хлор-2-цианоиндол-1-ил)бензил]карбаминовой кислоты в 12 мл этилацетата добавляли 24 мл 10%-ного раствора хлороводорода в этилацетате и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Полученную смесь разбавляли диэтиловым эфиром, выпавший в осадок продукт отфильтровывали, промывали диэтиловым эфиром и сушили, получая 0,32 г (90%) указанного в заголовке соединения. MS (EI) 282,1 (МН+). Сравнительный пример 15. (R)-1-4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]фенил этиламина гидрохлорид.a) трет-Бутиловый эфир (R)-(1-4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]фенил] этил)карбаминовой кислоты. Указанное в заголовке соединение получали из 3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)-1H-индолаb) 1H-1-4-[3-хлор-2-(5-метил[12,4]оксадиазол-3-ил)индол-1-ил]фенилэтиламина гидрохлорид. Указанное в заголовке соединение получали из трет-бутилового эфира (R)-(1-4-[3-хлор-2-(5-метилa) трет-Бутиловый эфир [4-(5-хлор-2-цианоиндол-1-ил)бензил]карбаминовой кислоты. Указанное в заголовке соединение получали из 5-хлор-1H-индол-2-карбонитрила (I. Borza at al. Bioorg. Med. Chem. Lett. 2005, 15, 5439-5441) по методике, описанной в сравнительном примере 14 а. MS (EI) 404,1 [M+Na]+.b) 1-(4-Аминометилфенил)-5-хлор-1H-индол-2-карбонитрила гидрохлорид. Указанное в заголовке соединение получали из трет-бутилового эфира [4-(5-хлор-2-цианоиндол-1 ил)бензил]карбаминовой кислоты по методике, описанной в сравнительном примере 14b. Сравнительный пример 17. 1-Аминоциклопропанкарбоновой кислоты 4-(2-циано-5-метоксииндол 1-ил)бензиламида гидрохлорид.a) 1-(4-Аминометилфенил)-5-метокси-1H-индол-2-карбонитрила гидрохлорид. Указанное в заголовке соединение получали из 5-метокси-1H-индол-2-карбонитрила (I. Borza at al.b) 1-Аминоциклопропанкарбоновой кислоты 4-(2-циано-5-метоксииндол-1-ил)бензиламида гидрохлорид. Указанное в заголовке соединение получали из 1-(4-аминометилфенил)-5-метокси-1H-индол-2 карбонитрила гидрохлорида по методике, описанной в сравнительном примере 4g и 4h. MS (EI) 361,2a) 1-(4-Аминометилфенил)-5-фтор-1H-индол-2-карбонитрила гидрохлорид. Указанное в заголовке соединение получали из 5-фтор-1H-индол-2-карбонитрила (I. Borza at al.b) 1-Аминоциклопропанкарбоновой кислоты 4-(2-циано-5-фториндол-1-ил)бензиламида гидрохлорид. Указанное в заголовке соединение получали из 1-(4-аминометилфенил)-5-фтор-1H-индол-2 карбонитрила гидрохлорида по методикам, описанным в сравнительном примере 4g и 4h. MS (EI) 349,2a) 5-Фтор-2-(5-метил[1,2,4]оксадиазол-3-ил)-1H-индол. Указанное в заголовке соединение получали из 5-фтор-1H-индол-2-карбонитрила (I. Borza at al.b) 1-Аминоциклопропанкарбоновой кислоты 4-[5-фтор-2-(5-метил[1.2,4]оксадиазол-3-ил)индол-1 ил]бензиламида гидрохлорид. Указанное в заголовке соединение получали из 5-фтор-2-(5-метил[1,2,4]оксадиазол-3-ил)-1Hиндола по методикам, описанным в сравнительном примере 9 с-е. MS (EI) 406,2 (МН+). Сравнительный пример 20. 1-Аминоциклопропанкарбоновой кислоты 4-[3-хлор-5-метокси-2-(3 метил[1,2,4]оксадиазол-5-ил)индол-1-ил]бензиламида гидрохлорид.a) 3-Хлор-5-метокси-1H-индол-2-карбоновой кислоты. Указанное в заголовке соединение получали из 5-метокси-1H-индол-2-карбоновой кислоты по методике, описанной в сравнительном примере 4 а.b) Метиловый эфир 3-хлор-5-метокси-1H-индол-2-карбоновой кислоты. К перемешиваемой смеси 24,63 г (109,3 ммоль) 3-хлор-5-метокси-1H-индол-2-карбоновой кислоты в 1200 мл метанола добавляли 20 мл концентрированной серной кислоты и реакционную смесь кипятили в течение 40 ч. Реакционную смесь упаривали до 300 мл и в смесь добавляли порциями 38 г карбоната натрия при охлаждении смесью воды и льда. Затем реакционную смесь разбавляли, добавляя 300 мл этилацетата, значение рН раствора доводили до 8 добавлением 40%-ного раствора гидроксида натрия. Фазы разделяли, водную фазу экстрагировали 3100 мл этилацетата, объединенные органические слои промывали водой и сушили над безводным сульфатом магния, фильтровали и упаривали, получая 23,68 гc) Метиловый эфир 1-[4-(трет-бутоксикарбониламинометил)фенил]-3-хлор-5-метокси-1H-индол-2 карбоновой кислоты. К перемешиваемой смеси 4,8 г (20 ммоль) метилового эфира 3-хлор-5-метокси-1H-индол-2 карбоновой кислоты, 7,53 г (30 ммоль) 4-(трет-бутоксикарбониламинометил)фенилбороновой кислоты и 6,0 г (40 ммоль) ацетата меди(II) в 150 мл N,N-диметилформамида добавляли 14 мл (80 ммоль) N,Nдиизопропилэтиламина и 10 г молекулярных сит 3. Реакционную смесь интенсивно перемешивали при комнатной температуре, пропуская через смесь воздух, в течение 6 дней. Полученную смесь фильтровали через целит. Фильтрат разбавляли, добавляя 500 мл этилацетата, и промывали 2200 мл 25%-ного раствора гидроксида аммония. Органический слой промывали 200 мл воды, сушили над безводным сульфатом магния, фильтровали и упаривали в вакууме. Остаток растирали в 2-пропаноле, твердый кристаллический осадок отфильтровывали и сушили, получая 4,28 г (48%) указанного в заголовке соединения. MS (EI) 467,2 [M+Na]+.d) трет-Бутиловый эфир 4-[3-хлор-5-метокси-2-(3-метил[1,2,4]оксадиазол-5-ил)индол-1-ил]бензилкарбаминовой кислоты. Перемешиваемую смесь 4,28 г (9,6 ммоль) метилового эфира 1-[4-(трет-бутоксикарбониламинометил)фенил]-3-хлор-5-метокси-1H-индол-2-карбоновой кислоты, 1,07 г (14,4 ммоль) N-гидроксиацетамидина, 3,58 г (25,9 ммоль) карбоната калия и 100 мл толуола кипятили в течение 20 ч, затем фильтровали и фильтрат упаривали, получая 4,23 г (94%) указанного в заголовке соединения. MS (EI) 491,1[M+Na]+. е) 4-[3-Хлор-5-метокси-2-(3-метил[1,2,4]оксадиазол-5-ил)индол-1-ил]бензиламина гидрохлорид. Указанное в заголовке соединение получали из трет-бутилового эфира 4-[3-хлор-5-метокси-2-(3 метил[1,2,4]оксадиазол-5-ил)индол-1-ил]бензилкарбаминовой кислоты по методике, описанной в сравнительном примере 14b. MS (EI) 352,1 [(M-NH2)]+.f) трет-Бутиловый эфир (1-4-[3-хлор-5-метокси-2-(3-метил[1,2,4]оксадиазол-5-ил)индол-1-ил]бензилкарбамоилциклопропил)карбаминовой кислоты. Смесь 3,94 г (9,7 ммоль) 4-[3-хлор-5-метокси-2-(3-метил[1,2,4]оксадиазол-5-ил)индол-1-ил]бензиламина гидрохлорида, 2,93 г (14,7 ммоль) 1-трет-бутоксикарбониламиноциклопропанкарбоновой кислоты, 4,43 г (11,4 ммоль) HATU [О-(7-азабензотриазол-1-ил-N,N,N,N-тетраметилурония гексафторфосфат], 7,6 г (43,7 ммоль) N,N-диизопропилэтиламина, 70 мл дихлорметана и 2 мл N,N-диметилформамида перемешивали при комнатной температуре в течение 1,5 ч, после чего разбавляли, добавляя 100 мл воды,и разделяли фазы. Водную фазу экстрагировали дихлорметаном, объединенные органические слои сушили над безводным сульфатом магния, фильтровали и упаривали. Остаток растирали в 2-пропаноле,твердый кристаллический осадок отфильтровывали и сушили, получая 4,22 г (79%) указанного в заголовке соединения. MS (EI) 574,2 [M+Na]+.g) 1-Аминоциклопропанкарбоновой кислоты 4-[3-хлор-5-метокси-2-(3-метил[1,2,4]оксадиазол-5 ил)индол-1-ил]бензиламида гидрохлорид. Указанное в заголовке соединение получали из трет-бутилового эфира (1-4-[3-хлор-5-метокси-2- 22022939a) 3-Хлор-5-метокси-1H-индол-2-карбонитрил. Указанное в заголовке соединение получали из 5-метокси-1H-индол-2-карбоновой кислоты по методикам, описанным в сравнительном примере 4 а-с.b) 1-(4-Аминометилфенил)-3-хлор-5-метокси-1H-индол-2-карбонитрила гидрохлорид. Указанное в заголовке соединение получали из 3-хлор-5-метокси-1H-индол-2-карбонитрила по методикам, описанным в сравнительном примере 14 а и 14b. MS (EI) 295,1 [(M-NH2)]+. Сравнительный пример 22. 4-[5-Хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензиламина гидрохлорид. Указанное в заголовке соединение получали из 5-хлор-1H-индол-2-карбонитрила (I. Borza at al. Bioorg. Med. Chem. Lett. 2005, 15, 5439-5441) по методикам, описанным в сравнительном примере 9 а-с. MS(EI) 322,1 [(M-NH2)]+. Сравнительный пример 23. Метиловый эфир 1-(4-аминометил-3-фторфенил)-3-хлор-1H-индол-2 карбоновой кислоты гидрохлорид. Указанное в заголовке соединение получали из метилового эфира 3-хлор-1H-индол-2-карбоновой кислоты и 3-фтор-4-(трет-бутоксикарбониламинометил)фенилбороновой кислоты (сравнительный пример 1) по методике, описанной в сравнительном примере 9 с. MS (EI) 333,1 (МН+). Сравнительный пример 24. 4-[3-Хлор-5-метокси-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензиламин.a) Амид 5-метокси-1H-индол-2-карбоновой кислоты. К суспензии 10 г (52,3 ммоль) 5-метокси-1H-индол-2-карбоновой кислоты в 300 мл дихлорметана и 1 мл N,N-диметилформамида прикапывали 8,85 мл (104,6 ммоль) оксалилхлорида. Реакционную смесь перемешивали при комнатной температуре в течение 3 ч, затем охлаждали на ледяной бане и медленно добавляли 56 мл концентрированного водного раствора гидроксида аммония. Полученную смесь перемешивали при комнатной температуре в течение ночи, выпавший в осадок продукт отфильтровывали,промывали водой и сушили в вакууме, получая 9,8 г (98,5%) указанного в заголовке соединения. MS (EI) 191,1 (МН+).b) Амид 3-хлор-5-метокси-1H-индол-2-карбоновой кислоты. К перемешиваемой суспензии 9,9 г (52,3 ммоль) амида 5-метокси-1H-индол-2-карбоновой кислоты в 500 мл ацетонитрила добавляли 7,68 г (57,5 ммоль) N-хлорсукцинимида. Реакционную смесь кипятили в течение 3 ч, после чего охлаждали до комнатной температуры. Выделившийся твердый кристаллический осадок отфильтровывали, промывали ацетонитрилом и перекристаллизовывали из 2-пропанола,получая 7,96 г (68%) указанного в заголовке соединения. MS (EI) 225,1 (МН+).c) 3-Хлор-5-метокси-1H-индол-2-карбонитрил. К перемешиваемой суспензии 5,5 г (24,2 ммоль) амида 3-хлор-5-метокси-1H-индол-2-карбоновой кислоты в 200 мл 1,4-диоксана добавляли 17 мл (183 ммоль) оксихлорида фосфора. Реакционную смесь кипятили в течение 3 ч. Полученный темный раствор охлаждали до комнатной температуры и выливали на измельченный лед. Ледяную смесь перемешивали 30 мин и экстрагировали дихлорметаном. Объединенные органические фазы экстрагировали водой, 10%-ным водным раствором гидрокарбоната натрия и насыщенным раствором соли, сушили над безводным сульфатом магния, фильтровали и упаривали в вакууме, получая 3,33 г (66,6%) указанного в заголовке соединения. MS (EI) 207,1 (МН+).d) 3-Хлор-N-гидрокси-5-метокси-1H-индол-2-карбоксамидин. К перемешиваемому раствору 2,2 г (10,6 ммоль) 3-хлор-5-метокси-1H-индол-2-карбонитрила в 50 мл этанола одновременно прикапывали раствор 1,5 г (21,2 ммоль) гидрохлорида гидроксиламина в 30 мл воды и раствор 2,4 мл (17 ммоль) триэтиламина в 20 мл этанола. Полученную смесь кипятили 3 ч, охлаждали до комнатной температуры, затем упаривали в вакууме. Остаток растирали в воде, твердый кристаллический осадок отфильтровывали и полученный сырой продукт перекристаллизовывали из 1:1 смеси 2-пропанола и воды, получая 1,6 г (63%) указанного в заголовке соединения. MS (EI) 241,1 (MIT).e) 3-Хлор-5-метокси-2-(5 -метил[1,2,4]оксадиазол-3-ил)-1H-индол. К раствору 1,6 г (6,7 ммоль) 3-хлор-N-гидрокси-5-метокси-1H-индол-2-карбоксамидина в 40 мл дихлорметана добавляли 2 мл (13,4 ммоль) диметилацеталя N,N-диметилацетамида и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь разбавляли, добавляя дихлорметан, и экстрагировали водой, сушили над безводным сульфатом магния, фильтровали через слой силикагеля, осадок на фильтре промывали хлороформом и фильтрат упаривали в вакууме. Остаток перекристаллизовывали из этилацетата, получая 1,37 г (81%) указанного в заголовке соединения. MS (EI) 264,1 (МН+).N,N-диметилформамида добавляли 1,14 г (4,55 ммоль) 4-(трет-бутоксикарбониламинометил)фенилбороновой кислоты, 1,2 г (7,58 ммоль) ацетата меди(II), 2,6 мл (15,2 ммоль) N,N-диизопропилэтиламина и 2 г молекулярных сит 3. Реакционную смесь интенсивно перемешивали и пропускали поток сухого воздуха при комнатной температуре в течение 6 ч. Полученную смесь фильтровали через целит. Осадок на фильтре промывали N,N-диметилформамидом и хлороформом, объединенные фильтраты упаривали в вакууме. Остаток растворяли в хлороформе и последовательно промывали насыщенным водным раствором гидроксида аммония, водой, 10%-ным водным раствором лимонной кислоты, водой, насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором соли, сушили над безводным сульфатом магния, фильтровали и упаривали в вакууме. Остаток очищали колоночной флэшхроматографией, используя в качестве адсорбента Kieselgel 60 (0,040-0,063 мм) (Merck) и смесь гексан:этилацетат = 2:1 в качестве элюента, получая 0,98 г (57,6%) указанного в заголовке соединения. MSg) 4-[3-Хлор-5-метокси-2-(5-метил[1.2,4]оксадиазол-3-ил)индол-1-ил]бензиламин. К охлажденному льдом раствору 0,9 г (1,9 ммоль) трет-бутилового эфира 4-[3-хлор-5-метокси-2(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбаминовой кислоты в 20 мл дихлорметана добавляли 2 мл (27 ммоль) трифторуксусной кислоты. Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 48 ч. Реакционную смесь упаривали в вакууме, остаток растворяли в дихлорметане и экстрагировали насыщенным водным раствором карбоната натрия и насыщенным раствором соли, сушили над сульфатом магния, фильтровали и упаривали в вакууме, получая 0,467 г (67%) указанного в заголовке соединения. MS (EI) 369,1 (МН+). Сравнительный пример 25. Метиловый эфир 1-(4-аминометилфенил)-3-хлор-4-фтор-1H-индол-2 карбоновой кислоты.a) Метиловый эфир 3-хлор-4-фтор-1H-индол-2-карбоновой кислоты. К перемешиваемой суспензии 1,1 г (5,7 ммоль) метилового эфира 4-фтор-1H-индол-2-карбоновой кислоты в 60 мл ацетонитрила добавляли 0,836 г (6,26 ммоль) N-хлорсукцинимида. Реакционную смесь кипятили в течение 6 ч, после чего охлаждали до комнатной температуры. Выделившийся твердый кристаллический осадок отфильтровывали, промывали ацетонитрилом и сушили в вакууме. Неочищенный продукт перекристаллизовывали из 2-пропанола, получая 1,05 г (81%) указанного в заголовке соединения.b) Метиловый эфир 1-[4-трет-бутоксикарбониламинометил)фенил]-3-хлор-4-фтор-1H-индол-2 карбоновой кислоты. К раствору 0,75 г (3,3 ммоль) метилового эфира 3-хлор-4-фтор-1H-индол-2-карбоновой кислоты в 30 мл N,N-диметилформамида добавляли 1,1 г (4,4 ммоль) 4-(трет-бутоксикарбониламинометил)фенилбороновой кислоты, 1,0 г (6,4 ммоль) ацетата меди(II), 2,2 мл (12,7 ммоль) N,Nдиизопропилэтиламина и 1,4 г молекулярных сит 3. Реакционную смесь интенсивно перемешивали и пропускали через нее поток сухого воздуха при комнатной температуре в течение 36 ч. Полученную смесь фильтровали через целит. Осадок на фильтре промывали N,N-диметилформамидом и хлороформом и объединенные фильтраты упаривали в вакууме. Остаток растворяли в хлороформе и последовательно промывали концентрированным водным раствором гидроксида аммония, водой, 10%-ным водным раствором лимонной кислоты, водой, насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором соли, сушили над безводным сульфатом магния, фильтровали и упаривали в вакууме. Остаток очищали колоночной флэш-хроматографией, применяя Kieselgel 60 (0,040-0,063 мм) в качестве адсорбента и смесь гексан:этилацетат = 2:1 в качестве элюента, получая 0,695 г (49%) указанного в заголовке соединения. MS (EI) 453,2 (M+Na)+.c) Метиловый эфир 1-(4-аминометилфенил)-3-хлор-4-фтор-1H-индол-2-карбоновой кислоты. К охлажденному льдом раствору 0,18 г (0,416 ммоль) метилового эфира 1-[4-(третбутоксикарбониламинометил)фенил]-3-хлор-4-фтор-1H-индол-2-карбоновой кислоты в 10 мл дихлорметана добавляли 0,8 мл (10,4 ммоль) трифторуксусной кислоты. Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 1 ч. Реакционную смесь упаривали в вакууме, остаток растворяли в дихлорметане и экстрагировали насыщенным водным раствором карбоната натрия и насыщенным раствором соли, сушили над сульфатом магния, фильтровали и упаривали в вакууме, получая 0,138 г (100%) указанного в заголовке соединения. Сравнительный пример 26. 1-Аминоциклопропанкарбоновой кислоты 4-[5-фтор-2-(3-метил[1,2,4]оксадиазол-5-ил)индол-1-ил]бензиламид. а) 5-Фтор-2-(3-метил[1,2,4]оксадиазол-5-ил)-1H-индол. К перемешиваемому раствору 2,70 г (14,29 ммоль) метилового эфира 5-фтор-1H-индол-2 карбоновой кислоты в 150 мл толуола добавляли 1,59 г (21,4 ммоль) N-гидроксиацетамидина и 3,0 г (21,7 ммоль) карбоната калия. Реакционную смесь кипятили в течение 24 ч, после чего охлаждали и разбавляли, добавляя 60 мл этилацетата и 60 мл воды. Полученную смесь отделяли, органический слой промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния, фильтровали и упаривали в вакууме, получая 2,95 г (97%) указанного в заголовке соединения в виде белого твердого вещества.b) трет-Бутиловый эфир 4-[5-фтор-2-(3-метил[1,2,4]оксадиазол-5-ил)индол-1-ил]бензил]карбаминовой кислоты. К раствору 1,5 г (6,9 ммоль) 5-фтор-2-(3-метил[1,2,4]оксадиазол-5-ил)-1H-индола в 80 мл N,Nдиметилформамида добавляли 2,6 г (10 ммоль) 4-(трет-бутоксикарбониламинометил)фенилбороновой кислоты, 2,1 г (13,8 ммоль) ацетата меди(II), 4,8 мл (27,6 ммоль) N,N-диизопропилэтиламина и 3 г молекулярных сит 3. Реакционную смесь интенсивно перемешивали и пропускали через нее поток сухого воздуха при комнатной температуре в течение 120 ч. Полученную смесь фильтровали через целит. Осадок на фильтре промывали N,N-диметилформамидом и хлороформом и объединенные фильтраты упаривали в вакууме. Остаток растворяли в этилацетате и последовательно промывали концентрированным водным раствором гидроксида аммония, водой, 10%-ным водным раствором лимонной кислоты, водой,насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором соли, сушили над безводным сульфатом магния, фильтровали и упаривали в вакууме. Остаток очищали колоночной флэшхроматографией, применяя Kieselgel 60 (0,040-0,063 мм) в качестве адсорбента и смеси гексан:этилацетат в качестве элюента, получая 1,456 г (50%) указанного в заголовке соединения. с) трет-Бутиловый эфир (1-4-[5-фтор-2-(3-метил[1,2,4]оксадиазол-5-ил)индол-1-ил]бензилкарбамоилциклопропил)карбаминовой кислоты. К охлажденному раствору 1,456 г (3,45 ммоль) трет-бутилового эфира 4-[5-фтор-2-(3-метил[1,2,4]оксадиазол-5-ил)индол-1-ил]бензилкарбаминовой кислоты в 40 мл дихлорметана добавляли 3 мл(3,9 ммоль) трифторуксусной кислоты. Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 20 ч. Реакционную смесь упаривали в вакууме, остаток растворяли в 80 мл дихлорметана и промывали насыщенным водным раствором карбоната натрия и насыщенным раствором соли, сушили над безводным сульфатом магния и фильтровали. К полученному перемешиваемому раствору 4-[5-фтор-2-(3-метил[1,2,4]оксадиазол-5-ил)индол-1-ил]бензиламина добавляли 0,73 г (3,63 ммоль) 1-трет-бутоксикарбониламиноциклопропанкарбоновой кислоты и 0,995 г (5,2 ммоль) EDC при 5 С. Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение ночи. Реакционную смесь промывали 15 мл воды, 215 мл 5%-ного водного раствора лимонной кислоты,водой, насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором соли, сушили над безводным сульфатом магния, фильтровали и упаривали в вакууме, получая 1,54 г (88%) указанного в заголовке соединения в виде белой пены.[1,2,4]оксадиазол-5-ил)индол-1-ил]бензилкарбамоилциклопропил)карбаминовой кислоты в 50 мл дихлорметана добавляли 6 мл (7,8 ммоль) трифторуксусной кислоты. Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 3 ч. Реакционную смесь упаривали в вакууме, остаток растворяли в дихлорметане и промывали насыщенным водным раствором карбоната натрия и насыщенным раствором соли, сушили над безводным сульфатом магния, фильтровали и упаривали в вакууме, получая 1,06 г (92%) указанного в заголовке соединения. Сравнительный пример 27. 1-Аминоциклопропанкарбоновой кислоты 4-[3,5-дихлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензиламид. а) 4-[3,5-Дихлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензиламин. Указанное в заголовке соединение получали из 5-хлор-1H-индол-2-карбоновой кислоты по методикам, описанным в сравнительном примере 24a-g. MS (EI) 322,1 [(M-NH2)]+.b) 1-Аминоциклопропанкарбоновой кислоты 4-[3,5-дихлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол 1-ил]бензиламид. Указанное в заголовке соединение получали из 4-[3,5-дихлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензиламина по методикам, описанным в сравнительном примере 9d и 9 е. MS (EI) 422,2 (МН+). Сравнительный пример 28. 1-Аминоциклопропанкарбоновой кислоты 4-[3-хлор-5-фтор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензиламид. а) 4-[3-Хлор-5-фтор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензиламин. Указанное в заголовке соединение получали из 5-фтор-1H-индол-2-карбоновой кислоты по методикам, описанным в сравнительном примере 24a-g. MS (EI) 357,1 (МН+).b) 1-Аминоциклопропанкарбоновой кислоты 4-[3-хлор-5-фтор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензиламид. Указанное в заголовке соединение получали из 4-[3,5-дихлор-2-(5-метил[1,2,4]оксадиазол-3 ил)индол-1-ил]бензиламина по методикам, описанным в сравнительном примере 9d и 9 е. MS (EI) 440,1a) 4-[5-Метокси-2-(5-метил[1,3,4]оксадиазол-2-ил)индол-1-ил]бензиламина гидрохлорид. Указанное в заголовке соединение получали из 5-метокси-1H-индол-2-карбоновой кислоты по методикам, описанным в сравнительном примере 7 а-с. MS (EI) 318,2 [(М-NH2)]+.b) 1-Аминоциклопропанкарбоновой кислоты 4-[5-метокси-2-(5-метил[1,3,4]оксадиазол-2-ил)индол 1-ил]бензиламид. Указанное в заголовке соединение получали из 4-[5-метокси-2-(5-метил[1,3,4]оксадиазол-2-ил)индол-1-ил]бензиламина гидрохлорида по методикам, описанным в сравнительном примере 9d и 9 е. MS(EI) 418,2 (МН+). Сравнительный пример 30. 1-Аминоциклопропанкарбоновой кислоты 4-[5-метокси-2-(3 метил[1,2,4]оксадиазол-5-ил)индол-1-ил]бензиламид. а) Метиловый эфир 5-метокси-1H-индол-2-карбоновой кислоты. Смесь 9,6 г (0,050 моль) 5-метокси-1H-индол-2-карбоновой кислоты и 4,5 мл концентрированной серной кислоты в 250 мл метанола кипятили в течение 6 ч. Реакционную смесь охлаждали, упаривали в вакууме и к остатку добавляли 200 мл воды и 200 мл дихлорметана. Органический слой отделяли и водную фазу экстрагировали 100 мл дихлорметана. Объединенные органические слои промывали водой и насыщенным раствором гидрокарбоната натрия, сушили над сульфатом натрия, упаривали и сушили, получая 10,17 г (98,7%) указанного в заголовке соединения. Т.пл.: 178-181 С.b) 5-Метокси-2-(3-метил[1,2,4]оксадиазол-5-ил)-1H-индол. Смесь 5,5 г (26,8 ммоль) метилового эфира 5-метокси-1H-индол-2-карбоновой кислоты, 3,0 г (40,5 ммоль) N-гидроксиацетамидина и 10 г (72,3 ммоль) карбоната калия в 150 мл толуола кипятили в течение 18 ч, после чего добавляли ещ 2,0 г (27 ммоль) N-гидроксиацетамидина и 5 г (36,1 ммоль) карбоната калия. Реакционную смесь кипятили в течение 20 ч, охлаждали до 20 С, фильтровали, фильтрат упаривали и сушили, получая 5,45 г (98,7%) указанного в заголовке соединения. Т.пл.: 141-142 С. MS (EI) 230,2 (МН+).c) трет-Бутиловый эфир (1-(4-[5-метокси-2-(3-метил[1,2,4]оксадиазол-5-ил)индол-1-ил]бензилкарбамоилциклопропил)карбаминовой кислоты. Указанное в заголовке соединение получали из 5-метокси-2-(3-метил[1,2,4]оксадиазол-5-ил)-1Hиндола по методике, описанной в сравнительном примере 4 е-g. Т.пл.: 212-214 С. MS (EI) 418,2 [(МВос)]+.d) 1-Аминоциклопропанкарбоновой кислоты 4-[5-метокси-2-(3-метил-[1,2,4]оксадиазол-5-ил)индол 1-ил]бензиламид. Смесь 1,56 г (3,0 ммоль) трет-бутилового эфира (1-4-[5-метокси-2-(3-метил[1,2,4]оксадиазол-5-ил) индол-1-ил]бензилкарбамоилциклопропил)карбаминовой кислоты, 15 мл трифторуксусной кислоты и 25 мл дихлорметана перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь упаривали и к остатку добавляли 100 мл насыщенного раствора гидрокарбоната натрия и 100 мл дихлорметана. Органический слой отделяли и экстрагировали водную фазу 50 мл дихлорметана. Объединенные органические слои промывали водой, сушили над сульфатом натрия и упаривали. Остаток очищали колоночной флэш-хроматографией, используя в качестве адсорбента Kieselgel 60 (0,015-0,040 мм) (Merck) и смесь толуол:метанол = 4:1 в качестве элюента. Полученный таким образом продукт кристаллизовали из диизопропилового эфира, получая 0,99 г (78,9%) указанного в заголовке соединения. Т.пл.: 145-146 С.MS (EI) 418,2 (МН+). Сравнительный пример 31. Метил 1-[4-(аминометил)фенил]-3-хлор-1H-индол-2-карбоксилата гидрохлорид. а) Метил 3-хлор-1-(4-формилфенил)-1H-индол-2-карбоксилат. Указанное в заголовке соединение получали из метил 3-хлор-1H-индол-2-карбоксилата (Zenecab) Метил 3-хлор-1-4-[(E)(гидроксиимино)метил]фенил-1H-индол-2-карбоксилат. Указанное в заголовке соединение получали из метил 3-хлор-1-(4-формилфенил)-1H-индол-2 карбоксилата по методике, описанной в сравнительном примере 5d. MS (EI) 329,1 (МН+).c) Метил 1-[4-(аминометил)фенил]-3-хлор-1H-индол-2-карбоксилата гидрохлорид. Указанное в заголовке соединение получали из метил 3-хлор-1-4-[(E)-(гидроксиимино)метил]фенил-1H-индол-2-карбоксилата по методике, описанной в сравнительном примере 5 е. MS (EI) 315,1(МН+). Сравнительный пример 32. 1-(4-Аминометилфенил)-3-хлор-1H-индол-2-карбоновой кислоты амида гидрохлорид. Указанное в заголовке соединение получали из 3-хлор-1H-индол-2-карбоксамида (сравнительный пример 4b) по методике, описанной в сравнительном примере 9 с. MS (EI) 283,1 [(M-NH2)]+. Сравнительный пример 33. (1R)-1-4-[3-хлор-2-(5-метил-1,2,4-оксадиазол-3-ил)-1H-индол-1-ил]-2 фторфенил)этанамина гидрохлорид. а) 3-Фтор-4-(R)-1-(2-метилпропан-2-сульфиниламино)этил]фенилбороновая кислота. В атмосфере аргона к раствору 6,42 г (19,9 ммоль) 2-метилпропан-2-сульфиновой кислоты прикапывали [(R)-1-(4-бром-2-фторфенил)этил]амид (S.D. Kuduk et al. J. Med. Chem., 2007, 50, 272-282) и 4,4 мл (30 ммоль) TMEDA (тетраметилэтилендиамин) в 520 мл сухого диэтилового эфира и 38,5 мл 2,5M раствора н-бутиллития в гексане (39,8 ммоль) при -78 С в течение 1,5 ч. После перемешивания смеси при-78 С в течение 20 мин, прикапывали 125 мл (545 ммоль) триизопропилбората в течение 0,5 ч. Полученную таким образом смесь оставляли нагреваться до комнатной температуры и перемешивали при этой температуре 18 ч. Реакционную смесь гасили добавлением 500 мл насыщенного раствора хлорида аммония (рН 8) и оставляли нагреваться до комнатной температуры. Реакционную смесь экстрагировали этилацетатом, объединенные органические слои промывали 100 мл 1 М раствора лимонной кислоты и водой, сушили над безводным сульфатом натрия, фильтровали и упаривали в вакууме. Остаток перемешивали с 50 мл н-гексана в течение ночи, затем фильтровали и сушили, получая 3,2 г (56%) указанного в заголовке соединения в виде белого твердого вещества. MS (EI) 288.1 (МН+).(1R)-1-(4-[3-хлор-2-(5-метил-1,2,4-оксадиазол-3-ил)-1H-индол-1-ил]-2-фторфенилэтанамина гидрохлорид. Указанное в заголовке соединение получали из 3-фтор-4-[(R)-1-(2-метилпропан-2-сульфиниламино) этил]фенилбороновой кислоты по методике, описанной в сравнительном примере 9 с. MS (EI) 354,1 [(MNH2)]+. Сравнительный пример 34. 4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]-2-фторбензиламина гидрохлорид. Указанное в заголовке соединение получали из 3-фтор-4-(трет-бутоксикарбониламинометил)фенилбороновой кислоты (сравнительный пример 1) по методике, описанной в сравнительном примере 9 с.a) 3-Хлор-2-(3-метил[1,2,4]оксадиазол-5-ил)-1H-индол. Указанное в заголовке соединение получали из метилового эфира 3-хлор-1H-индол-2-карбоновой кислоты по методике, описанной в сравнительном примере 20d. MS (EI) 234,1 (МН+).b) 4-[3-Хлор-2-(3-метил[1,2.4]оксадиазол-5-ил)индол-1-ил]бензиламина гидрохлорид. Указанное в заголовке соединение получали из 3-хлор-2-(3-метил-1,2,4-оксадиазол-5-ил)-1H-индола по методике, описанной в сравнительном примере 9 с. MS (EI) 339,1 (МН+).c) трет-Бутиловый эфир (1-4-[3-хлор-2-(3-метил[1,2,4]оксадиазол-5-ил)индол-1-ил]бензилкарбамоилциклопропил)карбаминовой кислоты. Указанное в заголовке соединение получали из 4-[3-хлор-2-(3-метил[1,2,4]оксадиазол-5-ил)индол-1 ил]бензиламина гидрохлорида по методике, описанной в сравнительном примере 9d. MS (EI) 422,2 [(МВос)]+.d) 1-Аминоциклопропанкарбоновой кислоты 4-[3-хлор-2-(3-метил[1,2,4]оксадиазол-5-ил)индол-1 ил]бензиламид. Указанное в заголовке соединение получали из трет-бутилового эфира (1-4-[3-хлор-2-(3-метил[1,2,4]оксадиазол-5-ил)индол-1-ил]бензилкарбамоилциклопропил)карбаминовой кислоты по методике,описанной в сравнительном примере 9 е. MS (EI) 422,2 (МН+). Сравнительный пример 36. 1-Аминоциклопропанкарбоновой кислоты 4-[2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензиламид. а) 2-(5-Метил[1,2,4]оксадиазол-3-ил)-1H-индол. Указанное в заголовке соединение получали из N-гидрокси-1H-индол-2-карбоксамидина (Merckb)-[2-(5-Метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензиламина гидрохлорид. Указанное в заголовке соединение получали из 2-(5-метил[1,2,4]оксадиазол-3-ил)-1H-индола по методике, описанной в сравнительном примере 9 с. MS (EI) 305,2 (МН+).c) трет-Бутиловый эфир (1-4-[2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбамоил)циклопропил)карбаминовой кислоты. Указанное в заголовке соединение получали из 4-[2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил] бензиламина гидрохлорида по методике, описанной в сравнительном примере 9d. MS (EI) 388,2 [(МВос)]+.d) 1-Аминоциклопропанкарбоновой кислоты 4-[2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензиламид. Указанное в заголовке соединение получали из трет-бутилового эфира (1-4-[2-(5-метилa) 2-(3-Метил[1,2,4]оксадиазол-5-ил)-1H-индол. Указанное в заголовке соединение получали из метилового эфира 1H-индол-2-карбоновой кислоты по методике, описанной в сравнительном примере 20d. MS (EI) 200,0 (МН+). Указанное в заголовке соединение получали из 2-(3-метил-1,2,4-оксадиазол-5-ил)-1H-индола по методикам, описанным в сравнительном примере 9 с. MS (EI) 288,2 [(М-NH2)]+.c) трет-Бутиловый эфир (1-(4-[2-(3-метил[1,2,4]оксадиазол-5-ил)индол-1-ил]бензилкарбамоил)циклопропил)карбаминовой кислоты. Указанное в заголовке соединение получали из 4-[2-(3-метил[1,2,4]оксадиазол-5-ил)индол-1-ил] бензиламина гидрохлорида по методике, описанной в сравнительном примере 9d. MS (EI) 388,2 [(МВос)]+.d) 1-Аминоциклопропанкарбоновой кислоты 4-[2-(3-метил[1,2,4]оксадиазол-5-ил)индол-1-ил]бензиламид. Указанное в заголовке соединение получали из трет-бутилового эфира (1-4-[2-(3 метил[1,2,4]оксадиазол-5-ил)индол-1-ил]бензилкарбамоилциклопропил)карбаминовой кислоты по методике, описанной в сравнительном примере 9 е. MS (EI) 388,2 (МН+). Сравнительный пример 38. 1-Аминоциклопропанкарбоновой кислоты 4-(2-цианоиндол-1-ил)бензиламид.a) 1-[4-(Аминометил)фенил]-1H-индол-2-карбонитрила гидрохлорид. Указанное в заголовке соединение получали из 1H-индол-2-карбонитрила (I. Borza at al. Bioorg.b) трет-Бутиловый эфир 1-[4-(2-цианоиндол-1-ил)бензилкарбамоил]циклопропилкарбаминовой кислоты. Указанное в заголовке соединение получали из 1-[4-(аминометил)фенил]-1H-индол-2-карбонитрила гидрохлорида по методикам, описанным в сравнительном примере 9d. MS (EI) 331,2 [(М-Вос)]+.c) 1-Аминоциклопропанкарбоновой кислоты 4-(2-цианоиндол-1-ил)бензиламид. Указанное в заголовке соединение получали из трет-бутилового эфира 1-[4-(2-цианоиндол-1-ил) бензилкарбамоил]циклопропилкарбаминовой кислоты по методикам, описанным в сравнительном примере 9 е. MS (EI) 331,2 (МН+). Сравнительный пример 39. 4-[3,5-Дифтор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензиламина гидрохлорид. а) 3,5-Дифтор-2-(5-метил[1,2,4]оксадиазол-3-ил)-1H-индол. К смеси 0,941 г (4,33 ммоль) 5-фтор-2-(5-метил[1,2,4]оксадиазол-3-ил)-1H-индола (сравнительный пример 19 а) и 30 мл ацетонитрила при перемешивании добавляли 1,535 г (4,33 ммоль) Selectfluor [1 хлорметил-4-фтор-1,4-диазониабицикло[2,2,2]октана бис(тетрафторборат)] и реакционную смесь перемешивали при 60 С в течение 18 ч. Полученную смесь разбавляли этилацетатом, промывали насыщенным раствором гидрокарбоната натрия и водой, сушили над безводным сульфатом натрия и упаривали. Остаток очищали колоночной хроматографией, используя в качестве адсорбента Kieselgel 60 (0,015-0,040 мм) (Merck) и смесь гексан:этилацетат = 2:1 в качестве элюента, получая 0,335 г (32,9%) указанного в заголовке соединения в виде желтого кристаллического твердого вещества. MS (EI) 236,1 (МН+).b) трет-Бутиловый эфир (4-[3,5-дифтор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензилкарбаминовой кислоты. Указанное в заголовке соединение получали из 3,5-дифтор-2-(5-метил[1,2,4]оксадиазол-3-ил)-1Hиндола по методике, описанной в сравнительном примере 4 е. MS (EI) 463,2 [M+Na]+.c) 4-[3,5-Дифтор-2-(5-метил[1,2,4]оксадиазол-3-ил)индол-1-ил]бензиламина гидрохлорид. Указанное в заголовке соединение получали из трет-бутилового эфира 4-[3,5-дифтор-2-(5-метил(25,8 ммоль) триэтиламина в 180 мл дихлорметана прикапывали 1,36 мл (9,8 ммоль) трифторуксусного ангидрида при температуре ниже 20 С и реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Затем в смесь добавляли 100 мл воды, органический слой отделяли, сушили над безводным сульфатом натрия и упаривали в вакууме. Остаток очищали колоночной флэш-хроматографией, используя в качестве адсорбента Kieselgel 60 (0,015-0,040 мм) (Merck) и смесь толуол:ацетон = 2:1 в качестве элюента, получая после кристаллизации из 2-пропанола 2,2 г (48,7%) указанного в заголовке соединения. температуре в течение 24 ч, после чего упаривали в вакууме. Остаток очищали колоночной флэшхроматографией, используя в качестве адсорбента Kieselgel 60 (0,015-0,040 мм) (Merck) и смесь толуол:метанол = 4:1 в качестве элюента, получая после кристаллизации из диэтилового эфира 0,12 г (51,5%) указанного в заголовке соединения. MS (EI) 548,1 (МН+). Пример 3. 3-Метоксиизоксазол-5-карбоновой кислоты (1-4-[2-(2-метил-2H-тетразол-5-ил)индол-1 ил]бензилкарбамоил)циклопропил)амид. Указанное в заголовке соединение получали из 4-[2-(2-метил-2H-тетразол-5-ил)индол-ил]бензиламина гидрохлорида (сравнительный пример 5) по методике, описанной в примере 2. MS (EI) 513,2(МН+). Пример 4. 1-(2,2,2-Трифторацетиламино)циклопропанкарбоновой кислоты 4-[3-хлор-2-(2-метил 2H-тетразол-5-ил)индол-1-ил]-2-фторбензиламид. Смесь 0,197 г (0,50 ммоль) 4-[3-хлор-2-(2-метил-2H-тетразол-5-ил)индол-1-ил]-2-фторбензиламина гидрохлорида (сравнительный пример 6), 0,105 г (0,53 ммоль) 1-(2,2,2-трифторацетиламино)циклопропанкарбоновой кислоты (M.R. Hickey et al. Synlett. 2005, 255-258), 0,15 мл (1,07 ммоль) триэтиламина, 0,2 г (0,53 ммоль) HBTU и 4 мл N,N-диметилформамида перемешивали при комнатной температуре в течение 24 ч, после чего упаривали в вакууме. Остаток очищали колоночной флэш-хроматографией, используя в качестве адсорбента Kieselgel 60 (0,015-0,040 мм) (Merck) и смесь гексан:этилацетат = 4:1 в качестве элюента, получая 0,14 г (52,2%) указанного в заголовке соединения. MS (EI) 536,2 (МН+). Пример 5. 3-Метокси-N-[1-(4-[3-хлор-2-(5-метил-1,3,4-оксадиазол-2-ил)-1H-индол-1-ил]бензил) карбамоил)циклопропил]изоксазол-5-карбоксамид. Указанное в заголовке соединение получали из 4-[3-хлор-2-(5-метил[1,3,4]оксадиазол-2-ил)индол-1 ил]бензиламина гидрохлорида (сравнительный пример 7) по методике, описанной в примере 2. MS (EI) 547,2 (МН+). Пример 6. 1-(2,2,2-Трифторацетиламино)циклопропанкарбоновой кислоты 4-[3-хлор-2-(5-метил[1,3,4]оксадиазол-2-ил)индол-1-ил]бензиламид. Указанное в заголовке соединение получали из 4-[3-хлор-2-(5-метил[1,3,4]оксадиазол-2-ил)индол-1 ил]бензиламина гидрохлорида (сравнительный пример 7) по методике, описанной в примере 4. MS (EI) 518,2 (МН+). Пример 7. 3-Метоксиизоксазол-5-карбоновой кислоты (1-(4-[3-хлор-2-(1-метил-1H-тетразол-5 ил)индол-1-ил]бензилкарбамоил)циклопропил)амид. Указанное в заголовке соединение получали из 4-[2-(1-метил-2H-тетразол-5-ил)индол-ил]бензиламина гидрохлорида (сравнительный пример 8) по методике, описанной в примере 2. MS (EI) 547,1(МН+). Пример 8. 1-(2,2,2-Трифторацетиламино)циклопропанкарбоновой кислоты 4-[3-хлор-2-(1-метил 1H-тетразол-5-ил)индол-1-ил]бензиламид. Указанное в заголовке соединение получали из 4-[2-(1-метил-2H-тетразол-5-ил)индол-ил]бензиламина гидрохлорида (сравнительный пример 8) по методике, описанной в примере 4. MS (EI) 518,1 (МН+). Пример 9. 3-Метоксиизоксазол-5-карбоновой кислоты (1-4-[3-хлор-2-(5-метил[1,2,4]оксадиазол-3 ил)индол-1-ил]бензилкарбамоилциклопропил)амид. Смесь 23,0 г (54,5 ммоль) 1-аминоциклопропанкарбоновой кислоты 4-[3-хлор-2-(5-метилN,N-диизопропилэтиламина перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь выливали в 3000 мл воды и перемешивали в течение 2 ч. Выпавший в осадок продукт отфильтровывали, промывали водой и перекристаллизовывали из 2-пропанола, получая 22,5 г (75,4%) указанного в заголовке соединения. MS (EI) 547,1 (МН+). Пример 10. Метиловый эфир 3-хлор-1-[4-([1-(2,2,2-трифторацетиламино)циклопропанкарбонил] амино)метил)фенил]-1H-индол-2-карбоновой кислоты. Указанное в заголовке соединение получали из метил 1-[4-(аминометил)фенил]-3-хлор-1H-индол-2 карбоксилата гидрохлорида (сравнительный пример 31) по методике, описанной в примере 4. MS (EI) 494,1 (МН+). Пример 11. Метиловый эфир 3-хлор-1-4-[(1-[(3-метоксиизоксазол-5-карбонил)амино]циклопропанкарбонил)амино)метил]фенил-1H-индол-2-карбоновой кислоты. Указанное в заголовке соединение получали из метил 1-[4-(аминометил)фенил]-3-хлор-1H-индол-2 карбоксилата гидрохлорида (сравнительный пример 31) по методике, описанной в примере 2. MS (EI) 523,1 (МН+). Пример 12. 1-(2,2,2-Трифторацетиламино)циклопропанкарбоновой кислоты 4-[3-хлор-5-фтор-2-(2 метил-2H-тетразол-5-ил)индол-1-ил]бензиламид. Указанное в заголовке соединение получали из 4-[3-хлор-5-фтор-2-(2-метил-2H-тетразол-5-ил)индол-1-ил]бензиламина гидрохлорида (сравнительный пример 10) по методике, описанной в примере 4.
МПК / Метки
МПК: C07D 403/14, C07D 403/04, C07D 413/12
Метки: индола, производные
Код ссылки
<a href="https://eas.patents.su/30-22939-proizvodnye-indola.html" rel="bookmark" title="База патентов Евразийского Союза">Производные индола</a>
Предыдущий патент: Система одноразовых форм, применяемая для создания модульной опалубки при возведении бетонных стен сложной формы
Следующий патент: Система единых направляющих и секционные подъемные ворота для низкой притолоки
Случайный патент: Новые соединения-аналоги камптотецина, способ их получения и фармацевтические композиции, которые их содержат