Производные индола и их применение
Номер патента: 13795
Опубликовано: 30.06.2010
Авторы: Барт Мартин, Лежендр Кристиан, Бине Жан, Доде Пьер, Бубиа Бенаисса, Пупардин-Оливье Оливия
Формула / Реферат
1. Производное индола, характеризующееся тем, что оно выбрано из:
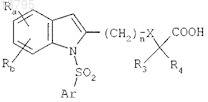
i) соединений формулы
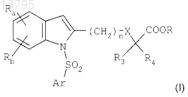
в которых Ra и Rb, каждый независимо, представляют собой атом водорода, атом галогена, нормальную, разветвленную или циклическую углеводородную цепь, содержащую до 6 атомов углерода, CF3, CN, CO-R2или OR2, либо фенильную группу, возможно замещенную нормальной, разветвленной или циклической углеводородной цепью, содержащей до 4 атомов углерода, или CF3;
R2 представляет собой нормальную, разветвленную или циклическую углеводородную цепь, содержащую до 4 атомов углерода, или CF3 либо фенильную группу, возможно замещенную нормальной, разветвленной или циклической углеводородной цепью, содержащей до 4 атомов углерода, или группой CF3;
R3 и R4, каждый независимо, представляют собой атом водорода или нормальную, разветвленную или циклическую углеводородную цепь, содержащую до 4 атомов углерода;
R представляет собой атом водорода или нормальную, разветвленную или циклическую углеводородную цепь, содержащую до 3 атомов углерода;
n = 1, 2 или 3;
X представляет собой простую связь, атом кислорода или атом серы и
Ar представляет собой ароматическое или гетероароматическое кольцо, выбранное из групп фенил, нафтил, хинолинил, изохинолинил, пиридинил, пиразолил, имидазолил, изоксазолил, тиазолил, бензимидазолил, бензотиазолил, 2,1,3-бензотиадиазолил, 3,4-дигидро-1,4-бензоксазинил, 5,6,7,8-тетрагидронафталинил, 1,2,3,4-тетрагидрохинолинил, 1,2,3,4-тетрагидроизохинолинил, 1,2,3,4-тетрагидро-2-оксохинолинил, 3,4-дигидро-2Н-бензопиранил, индолил, 2,3-дигидроиндолил, бензофуранил, 2,3-дигидробензофуранил, 1,3-бензодиоксолил, 1,4-бензодиоксанил и бензоксазолил, возможно замещенных одним или более чем одним из атомов или групп атомов, выбранных из атомов галогена, нормальной, разветвленной или циклической углеводородной цепи, содержащей до 6 атомов углерода, и групп фенил, CF3, CN, CO-R2, OR2, SR2, NH-COR2, морфолинил, амино и 4-морфолиносульфонил; и
ii) их фармацевтически приемлемых солей.
2. Соединение по п.1, характеризующееся тем, что по меньшей мере один из заместителей Ra и Rb не является атомом водорода.
3. Соединение по п.1 или 2, характеризующееся тем, что Ar представляет собой фенил или азотсодержащую гетероароматическую группу.
4. Соединение по одному из пп.1-3, характеризующееся тем, что n равно 1 или 2.
5. Применение соединения по одному из пп.1-4 в качестве фармакологически активного вещества.
6. Применение соединения по одному из пп.1-4 для изготовления лекарственного средства, предназначенного для лечения гипертриглицеридемии, гиперлипидемии, гиперхолестеринемии, ожирения и диабета.
7. Применение соединения по одному из пп.1-4 для изготовления лекарственного средства, предназначенного для лечения дисфункции эндотелия.
8. Применение соединения по одному из пп.1-4 для изготовления лекарственного средства, предназначенного для лечения сердечно-сосудистого заболевания, воспалительного заболевания и нейродегенеративного заболевания, такого как, в частности, болезнь Альцгеймера или болезнь Паркинсона.
9. Фармацевтическая композиция, характеризующаяся тем, что она содержит по меньшей мере одно соединение по одному из пп.1-4 в качестве активного вещества.
10. Способ получения соединения по п.1, характеризующийся тем, что он включает стадии, состоящие из:
а) использования реакции Соногаширы путем взаимодействия соединения формулы
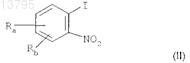
в котором Ra и Rb, каждый независимо, представляют собой атом водорода, фтора, хлора или брома или нормальную, разветвленную или циклическую углеводородную цепь, содержащую до 6 атомов углерода, CF3, CN, CO-R2или OR2; и
R2 представляет собой нормальную, разветвленную или циклическую углеводородную цепь, содержащую до 4 атомов углерода, или CF3 либо фенильную группу, возможно замещенную нормальной, разветвленной или циклической углеводородной цепью, содержащей до 4 атомов углерода, или CF3,
с производным ацетилена формулы

в котором n = 1, 2 или 3;
R3 и R4, каждый независимо, представляют собой атом водорода или нормальную, разветвленную или циклическую углеводородную цепь, содержащую до 4 атомов углерода;
R представляет собой нормальную, разветвленную или циклическую углеводородную цепь, содержащую до 3 атомов углерода; и
X представляет собой простую связь, атом кислорода или атом серы,
в присутствии йодида меди, катализатора на основе палладия и органического основания в растворителе при температуре между 0 и 60°С в течение 2-24 ч с получением соединения формулы
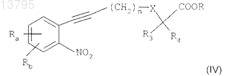
в котором Ra, Rb, n, X, R3, R4и R являются такими, как определено в исходных соединениях;
б) восстановления группы "нитро" в соединении формулы (IV) с получением анилина формулы
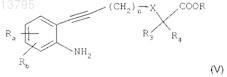
в котором Ra, Rb, n, X, R3, R4и R являются такими, как определено в исходном соединении;
в) взаимодействия соединения формулы (V) с арилсульфонилхлоридом формулы
![]()
в котором Ar представляет собой ароматическое или гетероароматическое кольцо, выбранное из групп фенил, нафтил, хинолинил, изохинолинил, пиридинил, пиразолил, имидазолил, изоксазолил, тиазолил, бензимидазолил, бензотиазолил, 2,1,3-бензотиадиазолил, 3,4-дигидро-1,4-бензоксазинил, 5,6,7,8-тетрагидронафталинил, 1,2,3,4-тетрагидрохинолинил, 1,2,3,4-тетрагидроизохинолинил, 1,2,3,4-тетрагидро-2-оксохинолинил, 3,4-дигидро-2Н-бензопиранил, индолил, 2,3-дигидроиндолил, бензофуранил, 2,3-дигидробензофуранил, 1,3-бензодиоксолил, 1,4-бензодиоксанил и бензоксазолил, возможно замещенных одним или более чем одним из атомов или групп атомов, выбранных из атомов галогена, нормальной, разветвленной или циклической углеводородной цепи, содержащей до 6 атомов углерода, групп фенил, CF3, CN, CO-R2, OR2, SR2, NH-COR2, морфолинил, амино и 4-морфолиносульфонил,
в присутствии пиридина при комнатной температуре в течение 10-120 мин с получением соединения формулы
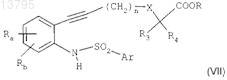
в котором Ra, Rb, n, X, R3, R4, R и Ar являются такими, как определено в исходных соединениях;
г) циклизации соединения формулы (VII) путем взаимодействия с ацетатом меди(II) в растворителе при температуре, близкой к температуре образования флегмы растворителя, в течение 4-24 ч с получением соединения формулы
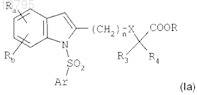
в котором Ra, Rb, n, X, R3, R4, R и Ar являются такими, как определено в исходных соединениях; и
д) при необходимости, гидролиза эфирной группы соединения формулы (Ia), а затем обработки продукта кислотой с получением соединения формулы (I) в форме его свободной кислоты
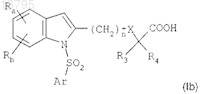
11. Способ по п.10, где восстановление «нитро» группы на стадии б) осуществляют путем взаимодействия с хлоридом олова в присутствии этанола, в растворителе при температуре, близкой к комнатной температуре, в течение 1-24 ч.
12. Способ получения соединения по п.1, характеризующийся тем, что он включает стадии, состоящие из:
а) проведения реакции галогенирования на анилине формулы
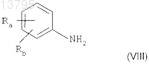
в котором Ra и Rb, каждый независимо, представляют собой атом водорода, атом галогена или нормальную, разветвленную или циклическую углеводородную цепь, содержащую до 6 атомов углерода, CF3, CN, CO-R2 или OR2; и
R2 представляет собой нормальную, разветвленную или циклическую углеводородную цепь, содержащую до 4 атомов углерода, или CF3 либо фенильную группу, возможно замещенную группой C1-C4-алкил или CF3,
с помощью галогенирующего агента в растворителе при комнатной температуре в течение 5-24 ч с получением соединения формулы

в котором Ra и Rb являются такими, как определено в исходных соединениях;
б) взаимодействия соединения формулы (IX) с производным ацетилена формулы
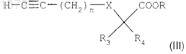
в котором n = 1, 2 или 3;
R3 и R4, каждый независимо, представляют собой атом водорода или нормальную, разветвленную или циклическую углеводородную цепь, содержащую до 4 атомов углерода;
R представляет собой нормальную, разветвленную или циклическую углеводородную цепь, содержащую до 3 атомов углерода; и
X представляет собой простую связь, атом кислорода или атом серы,
с использованием реакции Соногаширы в присутствии йодида меди, катализатора на основе палладия и органического основания в растворителе при температуре между 0 и 60°С в течение 2-24 ч,
с получением соединения формулы

в котором Ra, Rb, n, X, R3, R4и R являются такими, как определено в исходном соединении;
в) циклизации приведенного выше соединения формулы (V) путем взаимодействия с ацетатом меди(II) в растворителе при температуре, близкой к температуре образования флегмы растворителя, в течение 4-24 ч с получением соединения индола формулы
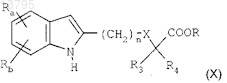
в котором Ra, Rb, n, X, R3, R4и R являются такими, как определено в исходном соединении;
г) взаимодействия приведенного выше соединения формулы (X) с арилсульфонилхлоридом формулы
![]()
в котором Ar представляет собой ароматическое или гетероароматическое кольцо, выбранное из групп фенил, нафтил, хинолинил, изохинолинил, пиридинил, пиразолил, имидазолил, изоксазолил, тиазолил, бензимидазолил, бензотиазолил, 2,1,3-бензотиадиазолил, 3,4-дигидро-1,4-бензоксазинил, 5,6,7,8-тетрагидронафталинил, 1,2,3,4-тетрагидрохинолинил, 1,2,3,4-тетрагидроизохинолинил, 1,2,3,4-тетрагидро-2-оксохинолинил, 3,4-дигидро-2Н-бензопиранил, индолил, 2,3-дигидроиндолил, бензофуранил, 2,3-дигидробензофуранил, 1,3-бензодиоксолил, 1,4-бензодиоксанил и бензоксазолил, возможно замещенных одним или более чем одним из атомов или групп атомов, выбранных из атомов галогена, нормальной, разветвленной или циклической углеводородной цепи, содержащей до 6 атомов углерода, групп фенил, CF3, CN, CO-R2, SR2, OR2, NH-COR2, морфолинил, амино и 4-морфолиносульфонил,
в растворителе при комнатной температуре в течение 1-12 ч с активацией или без активации соединений индола формулы (X) гидридом натрия с получением соединения формулы (Ia)

в котором Ra, Rb, n, X, R3, R4, R и Ar являются такими, как определено в исходных соединениях; и
д) при необходимости, гидролиза эфирной группы соединения формулы (Ia), после чего продукт обрабатывают кислотой с получением соединения формулы (I) в форме его свободной кислоты
13. Способ получения соединения по п.1, характеризующийся тем, что он включает стадии, состоящие из:
а) взаимодействия соединения формулы (IX)
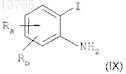
в котором Ra и Rb, каждый независимо, представляют собой атом водорода, фтора, хлора или брома или нормальную, разветвленную или циклическую углеводородную цепь, содержащую до 6 атомов углерода, CF3, CN, CO-R2или OR2; и
R2 представляет собой нормальную, разветвленную или циклическую углеводородную цепь, содержащую до 4 атомов углерода, или CF3 либо фенильную группу, возможно замещенную нормальной, разветвленной или циклической углеводородной цепью, содержащей до 4 атомов углерода, или CF3,
с арилсульфонилхлоридом формулы
![]()
в котором Ar представляет собой ароматическое или гетероароматическое кольцо, выбранное из групп фенил, нафтил, хинолинил, изохинолинил, пиридинил, пиразолил, имидазолил, изоксазолил, тиазолил, бензимидазолил, бензотиазолил, 2,1,3-бензотиадиазолил, 3,4-дигидро-1,4-бензоксазинил, 5,6,7,8-тетрагидронафталинил, 1,2,3,4-тетрагидрохинолинил, 1,2,3,4-тетрагидроизохинолинил, 1,2,3,4-тетрагидро-2-оксохинолинил, 3,4-дигидро-2Н-бензопиранил, индолил, 2,3-дигидроиндолил, бензофуранил, 2,3-дигидробензофуранил, 1,3-бензодиоксолил, 1,4-бензодиоксанил и бензоксазолил, возможно замещенных одним или более чем одним из атомов или групп атомов, выбранных из атомов галогена, нормальной, разветвленной или циклической углеводородной цепи, содержащей до 6 атомов углерода, и групп фенил, CF3, CN, CO-R2, OR2, SR2, NH-COR2, морфолинил, амино и 4-морфолиносульфонил,
в растворителе при комнатной температуре в течение 1-12 ч с получением соединения формулы
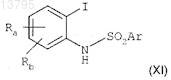
в котором Ra, Rb и Ar являются такими, как определено в исходных соединениях;
б) взаимодействия соединения формулы (XI) с производным ацетилена формулы
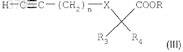
в котором n = 1, 2 или 3;
R3 и R4, каждый независимо, представляют собой атом водорода или нормальную, разветвленную или циклическую углеводородную цепь, содержащую до 4 атомов углерода;
R представляет собой нормальную, разветвленную или циклическую углеводородную цепь, содержащую до 3 атомов углерода; и
X представляет собой простую связь, атом кислорода или атом серы,
с использованием реакции Соногаширы в присутствии йодида меди, катализатора на основе палладия и органического основания в растворителе при температуре между 0 и 60°С в течение 2-24 ч,
с получением соединения формулы
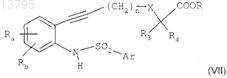
в котором Ra, Rb, n, X, R3, R4, R и Ar являются такими, как определено в исходных соединениях;
в) циклизации приведенного выше соединения формулы (VII) путем взаимодействия с ацетатом меди(II) в растворителе при температуре, близкой к температуре образования флегмы растворителя, в течение 4-24 ч с получением соединения индола формулы
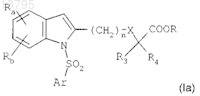
в котором Ra, Rb, n, X, R3, R4, R и Ar являются такими, как определено в исходных соединениях; и
г) при необходимости, гидролиза эфирной группы соединения формулы (Ia), после чего продукт обрабатывают кислотой с получением соединения формулы (I) в форме его свободной кислоты
14. Способ по п.13, характеризующийся тем, что две стадии б) и в) проводят в одной операции.
Текст
013795 Настоящее изобретение относится к новым индоловым соединениям, к способу их получения и к их применению в терапии для предупреждения или лечения патологических состояний, в которые вовлечено нарушение функции ядерных рецепторов типа PPAR (рецепторов активаторов пролиферации пероксисом). Предшествующий уровень техники В терапии известно, что заболевания сердечно-сосудистой системы представляют важный фактор риска для здоровья. Эти заболевания часто являются следствием высокого уровня холестерина и/или триглицеридов, и, следовательно, важно поддерживать эти уровни ниже значений, принятых в настоящее время профессиональной медициной. В случае холестерина особенно необходимо оценивать количества холестерина, связанного с различными липопротеинами, в целях адаптации терапий таким образом, чтобы устранять холестерин, связанный с ЛПНП (липопротеинами низкой плотности). Известные семейства соединений, применяемых для регуляции этих параметров, включают статины, которые являются ингибиторами HMG СоА-редуктазы и дают возможность, по существу, лечить избыточно высокие уровни холестерина ЛПНП, и соединения семейства фибратов, которые действуют посредством активации ядерных рецепторов PPAR (активируемых пролифератором пероксисом рецепторов альфа) и дают возможность снизить уровни триглицеридов и холестерина. Исследование ядерных рецепторов PPAR привело к идентификации трех подтипов, известных какPPAR, PPAR и PPAR. Эти различные рецепторы посредством связывания со специфичными фрагментами ДНК регулируют экспрессию генов-мишеней, которые кодируют белки, вовлеченные в механизмы регуляции метаболизма липидов. Таким образомPPAR экспрессируются, по существу, в печени и вовлечены в катаболизм жирных кислот посредством регуляции - и -окисления;PPAR экспрессируются повсеместно, но, в основном, присутствуют в почках, скелетных мышцах,сердце и кишечнике. Подобно другим рецепторам типа PPAR, PPAR образуют гетеродимер с RXR (рецептором ретиноида X), и затем становится способным к связыванию с определенными элементами генов-мишеней ядра и регуляции факторов транскрипции. Среди различных исследований, посвященных данному ядерному рецептору, продемонстрировано, например, что активация PPAR дает возможность повысить уровень холестерина ЛПВП у мышей db/db (FEBS Letters (2000), 473, 333-336) и инсулинозависимых макакрезусов с ожирением, а также способствует выделению холестерина через Аро А 1 в человеческих клетках ТНР-1 (Proc. Nat. Ac. Sci. USA (2001), 98, 5306-5311). В результате исследования этих различных ядерных рецепторов оказалось, что соединения, которые способны к активации либо рецепторов PPAR, либо рецепторов PPAR, либо обоих этих рецепторов одновременно, могут обладать крайне благоприятным фармакологическим профилем для лечения патологических состояний, таких как гиперлипидемия, гиперхолестеринемия и различные заболевания сердечно-сосудистой системы, которые являются следствием метаболического синдрома. Известные документы предшествующего уровня техники, в которых упомянуты такие соединения,включают, например, документ WO 97/28149, в котором описаны агонисты рецепторов PPAR, документWO 01/60807, в котором описаны агонисты рецепторов PPAR, или документы WO 05/009958 и 06/060535, в которых предложены соединения индола, действующие на рецепторы PPAR. Другие ссылки включают документы WO 02/071827 и Bioorg. Med. Chem. Lett., 14 (11), p.2759-2763(06/2004), где описаны производные, модулирующие рецепторы RXR, и их применение в терапии для лечения патологических состояний, вовлеченных в метаболический синдром. Кроме того, различные соединения индола описаны в предшествующем уровне техники в других публикациях. Таким образом в документах WO 00/46196 и 99/07678 раскрыты соединения, образованные от индол-2-карбоновой кислоты, в связи с их противовоспалительной активностью; в документе WO 98/41092 описаны производные индол-2-карбоксамида, которые действуют на боль.-1 013795 Сущность изобретения Настоящее изобретение относится к новым соединениям, производным индола, которые являются активаторами PPAR и выбраны из: в которых Ra и Rb, каждый независимо, представляет собой атом водорода, атом галогена, нормальную, разветвленную или циклическую углеводородную цепь, содержащую до 6 атомов углерода, CF3,CN, CO-R2 или OR2, либо фенильную группу, возможно замещенную нормальной, разветвленной или циклической углеводородной цепью, содержащей до 4 атомов углерода, или CF3;R2 представляет собой нормальную, разветвленную или циклическую углеводородную цепь, содержащую до 4 атомов углерода, или CF3, либо фенильную группу, возможно замещенную нормальной,разветвленной или циклической углеводородной цепью, содержащей до 4 атомов углерода, или CF3;R3 и R4, каждый независимо, представляет собой атом водорода или нормальную, разветвленную или циклическую углеводородную цепь, содержащую до 4 атомов углерода;R представляет собой атом водорода или нормальную, разветвленную или циклическую углеводородную цепь, содержащую до 3 атомов углерода;X представляет собой одинарную связь, атом кислорода или атом серы иAr представляет собой ароматическое или гетероароматическое кольцо, выбранное из групп фенил,нафтил, хинолинил, изохинолинил, пиридинил, пиразолил, имидазолил, изоксазолил, тиазолил, бензимидазолил, бензотиазолил, 2,1,3-бензотиадиазолил, 3,4-дигидро-1,4-бензоксазинил, 5,6,7,8-тетрагидронафталинил, 1,2,3,4-тетрагидрохинолинил, 1,2,3,4-тетрагидроизохинолинил, 1,2,3,4-тетрагидро-2-оксохинолинил, 3,4-дигидро-2 Н-бензопиранил, индолил, 2,3-дигидроиндолил, бензофуранил, 2,3-дигидробензофуранил, 1,3-бензодиоксолил, 1,4-бензодиоксанил и бензоксазолил, возможно замещенных одним или более чем одним из атомов или групп атомов, выбранных из атомов галогена, нормальной, разветвленной или циклической углеводородной цепи, содержащей до 6 атомов углерода, и групп фенил, CF3, CN,CO-R2, OR2, SR2, NH-COR2, морфолинил, амино и 4-морфолиносульфонил; иii) их фармацевтически приемлемых солей. Предпочтительными соединениями по изобретению являются соединения формулы (I), приведенной выше, в которых выполнено одно или более чем одно из приведенных ниже условий по меньшей мере один из Ra и Rb не является атомом водорода;Ar представляет собой фенил или азотсодержащую гетероароматическую группу, выбранную из групп хинолинил, изохинолинил, пиридинил, пиразолил, имидазолил, изоксазолил, тиазолил, бензимидазолил, бензотиазолил, 2,1,3-бензотиадиазолил, 1,2,3,4-тетрагидрохинолинил, 1,2,3,4-тетрагидроизохинолинил, 1,2,3,4-тетрагидро-2-оксохинолинил, индолил, 2,3-дигидроиндолил и бензоксазолил, возможно замещенных одним или более чем одним из атомов или групп атомов, выбранных из атомов галогена и групп С 1-С 6-алкил, CF3, CN, CO-R2, OR2, SR2, NH-COR2, морфолинил, амино и 4-морфолиносульфонил; иn равно 1 или 2. Первое конкретное семейство соединений по изобретению состоит из соединений формулы (I), в которых X представляет собой атом кислорода, и их фармацевтически приемлемых солей. Второе конкретное семейство соединений по изобретению состоит из соединений формулы (I), в которых X представляет собой одинарную связь и по меньшей мере один из R3 и R4 представляет собойC1-C4-алкильную группу, и их фармацевтически приемлемых солей. Третье конкретное семейство соединений по изобретению состоит из соединений формулы (I), в которых X представляет собой одинарную связь и R3 и R4 представляют собой атом водорода, и их фармацевтически приемлемых солей. Согласно второму аспекту изобретение относится к вышеупомянутым соединениям для их применения в качестве фармакологически активных веществ и к фармацевтическим композициям, в которых они присутствуют. Изобретение дополнительно относится к применению по меньшей мере одного соединения формулы (I) или одной из его фармацевтически приемлемых солей в качестве активного вещества для изготовления лекарственного средства, предназначенного для применения в терапии, в частности для борьбы с гиперхолестеринемией, гиперлипидемией, гипертриглицеридемией, дислипидемией, устойчивостью к инсулину, диабетом или ожирением, а также с сердечно-сосудистыми заболеваниями, которые являются следствием дисбаланса сывороточных липопротеинов. Соединения по изобретению также полезны в качестве активных веществ лекарственных средств, предназначенных для предупреждения или лечения-2 013795 заболеваний, обусловленных дисфункцией эндотелия, атеросклероза, инфаркта миокарда, гипертензии,проблем сосудов головного мозга, некоторых воспалительных заболеваний, например ревматоидного артрита, и нейродегенеративных заболеваний, таких как, в частности, болезнь Альцгеймера или болезнь Паркинсона. Подробное описание В настоящем описании группу C1-Cn-алкил (где n представляет собой целое число) понимают как означающую нормальную, разветвленную или циклическую углеводородную цепь, содержащую от 1 доn атомов углерода. Например, и без ограничения, группа C1-С 6-алкил может представлять собой нормальную или разветвленную группу общей формулы CnH2n+1, такую как метил, этил, пропил, бутил, пентил, гексил, 1-метилэтил, 1-метилпропил, 2-метилпропил, 1,1-диметилэтил, 1-метилбутил, 1,1-диметилпропил, 1-метилпентил или 1,1-диметилбутил, либо циклическую группу общей формулы CnH2n-1, такую как циклопропил, циклобутил, циклопентил, циклогексил или циклопентилметил. Галоген понимают как означающий атом фтора, хлора, брома или йода, где предпочтительны атомы фтора и хлора. Соединения формулы (I), в которых R представляет собой атом водорода, представляют собой карбоновые кислоты, которые можно использовать в форме свободных кислот или в форме солей, где указанные соли получают путем объединения кислоты с фармацевтически приемлемым нетоксичным неорганическим или органическим основанием. Примерами неорганических оснований, которые можно использовать, являются гидроксиды натрия, калия, магния или кальция. Примерами органических оснований, которые можно использовать, являются амины, аминоспирты, основные аминокислоты, такие как лизин или аргинин, или соединения, несущие функциональную группу четвертичного аммония, например бетаин или холин. Соединения формулы (I), в которых заместители R3 и R4 являются разными, имеют центр асимметрии. В случае этих соединений изобретение охватывает как рацемическое соединение, так и каждый из оптических изомеров, рассмотренный отдельно. Предпочтительными соединениями по изобретению являются те соединения, в которых Ar представляет собой фенильную группу или азотсодержащий гетероцикл. Другими предпочтительными соединениями являются те соединения, в которых Ra представляет собой атом галогена или группу трифторметил, а также те, в которых n равно 1 или 2. Соединения по изобретению могут быть получены первым способом, который состоит из: а) использования реакции Соногаширы (см., например, Tet. Lett., 1975, 4467) для взаимодействия соединения формулы в котором Ra и Rb, каждый независимо, представляют собой атом водорода, фтора, хлора или брома или группу С 1-С 6-алкил, CF3, CN, CO-R2 или OR2 иR2 представляет собой группу С 1-С 4-алкил или CF3 либо фенильную группу, возможно замещенную группой С 1-С 4-алкил или CF3,с производным ацетилена формулыR3 и R4, каждый независимо, представляют собой атом водорода или группу С 1-С 4-алкил;R представляет собой группу С 1-С 3-алкил иX представляет собой одинарную связь, атом кислорода или атом серы,в присутствии йодида меди, катализатора на основе палладия, например тетракис(трифенилфосфин)палладия, и органического основания, например триэтиламина, в растворителе,например в диметилформамиде (ДМФ), при температуре между 0 и 60 С в течение 2-24 ч с получением соединения формулы в котором Ra, Rb, n, X, R3, R4 и R являются такими, как определено в исходных соединениях; б) восстановления нитрогруппы, которую несет приведенное выше соединение формулы (IV), например, путем взаимодействия с хлоридом олова в присутствии этанола, в растворителе, например в этилацетате, при температуре, близкой к комнатной температуре, в течение 1-24 ч с получением анилина в котором Ra, Rb, n, X, R3, R4 и R являются такими, как определено в исходном соединении; в) взаимодействия соединения формулы (V) с арилсульфонилхлоридом формулы в котором Ar представляет собой ароматическое или гетероароматическое кольцо, выбранное из групп фенил,нафтил, хинолинил, изохинолинил, пиридинил, пиразолил, имидазолил, изоксазолил, тиазолил, бензимидазолил,бензотиазолил, 2,1,3-бензотиадиазолил, 3,4-дигидро-1,4-бензоксазинил, 5,6,7,8-тетрагидронафталинил, 1,2,3,4 тетрагидрохинолинил, 1,2,3,4-тетрагидроизохинолинил, 1,2,3,4-тетрагидро-2-оксохинолинил, 3,4-дигидро-2 Нбензопиранил, индолил, 2,3-дигидроиндолил, бензофуранил, 2,3-дигидробензофуранил, 1,3-бензодиоксолил, 1,4 бензодиоксанил и бензоксазолил, возможно замещенных одним или более чем одним из атомов или групп атомов, выбранных из атомов галогена и групп C1-C6-алкил, фенил, CF3, CN, CO-R2, SR2, OR2, NH-COR2, морфолинил, амино и 4-морфолиносульфонил,в присутствии пиридина при комнатной температуре в течение 10-120 мин с получением соединения формулы в котором Ra, Rb, n, X, R3, R4, R и Ar являются такими, как определено в исходных соединениях; г) циклизации соединения формулы (VII), например, путем взаимодействия с ацетатом меди(II) в котором Ra, Rb, n, X, R3, R4, R и Ar являются такими, как определено в исходных соединениях; и д) если необходимо, гидролиза эфирной группы соединения формулы (Ia), например, путем взаимодействия с неорганическим основанием, таким как гидроксид натрия или гидроксид лития, с помощью методик, хорошо известных специалистам в данной области техники, после чего продукт обрабатывают кислотой с получением соединения формулы (I) в форме его свободной кислоты При первом варианте способа получения соединения формулы (I) могут быть получены путем последовательности реакций, состоящей из: а) проведения реакции галогенирования, предпочтительно йодирования, на анилине формулы в котором Ra и Rb, каждый независимо, представляют собой атом водорода, атом галогена или группу C1-С 6-алкил, CF3, CN, СО-R2 или OR2 иR2 представляет собой группу С 1-С 4-алкил или CF3 либо фенильную группу, возможно замещенную группой С 1-С 4-алкил или CF3,с помощью галогенирующего агента, например бензилметиламмония дихлориодата, в растворителе,таком как дихлорметан или метанол, при комнатной температуре в течение 5-24 ч с получением соединения формулы в котором Ra и Rb являются такими, как определено в исходных соединениях; б) взаимодействия соединения формулы (IX) с производным ацетилена формулыR3 и R4, каждый независимо, представляют собой атом водорода или группу С 1-С 4-алкил;R представляет собой группу С 1-С 3-алкил иX представляет собой одинарную связь, атом кислорода или атом серы,в условиях, аналогичных описанным для стадии а) вышеописанного общего способа,с получением соединения формулы в котором Ra, Rb, n, X, R3, R4 и R являются такими, как определено в исходном соединении; в) циклизации приведенного выше соединения формулы (V) в условиях, аналогичных описанным для проведения стадии г) вышеописанного общего способа, с получением соединения индола формулы в котором Ra, Rb, n, X, R3, R4 и R являются такими, как определено в исходном соединении; г) взаимодействия приведенного выше соединения формулы (X) с арилсульфонилхлоридом формулы в котором Ar представляет собой ароматическое или гетероароматическое кольцо, выбранное из групп фенил, нафтил, хинолинил, изохинолинил, пиридинил, пиразолил, имидазолил, изоксазолил, тиазолил, бензимидазолил, бензотиазолил, 2,1,3-бензотиадиазолил, 3,4-дигидро-1,4-бензоксазинил, 5,6,7,8 тетрагидронафталинил, 1,2,3,4-тетрагидрохинолинил, 1,2,3,4-тетрагидроизохинолинил, 1,2,3,4-тетрагидро-2-оксохинолинил, 3,4-дигидро-2 Н-бензопиранил, индолил, 2,3-дигидроиндолил, бензофуранил,2,3-дигидробензофуранил, 1,3-бензодиоксолил, 1,4-бензодиоксанил и бензоксазолил, возможно замещенных одним или более чем одним из атомов или групп атомов, выбранных из атомов галогена и групп С 1-С 6-алкил, фенил, CF3, CN, CO-R2, SR2, OR2, NH-COR2, морфолинил, амино и 4-морфолиносульфонил,в растворителе, например в диметилформамиде, при комнатной температуре в течение 1-12 ч,обычно после активации соединений индола формулы (X) гидридом натрия с получением соединения формулы (Ia): в котором Ra, Rb, n, X, R3, R4, R и Ar являются такими, как определено в исходных соединениях; и д) если необходимо, гидролиза эфирной группы соединения формулы (Ia), например, путем взаимодействия с неорганическим основанием, таким как гидроксид натрия или гидроксид лития, с помощью методик, хорошо известных специалистам в данной области техники, после чего продукт обрабатывают кислотой с получением соединения формулы (I) в форме его свободной кислоты-5 013795 При втором варианте способа получения соединения формулы (I) могут быть получены путем серии реакций, состоящей из: а) взаимодействия соединения формулы (IX) в котором Ra и Rb, каждый независимо, представляют собой атом водорода, фтора, хлора или брома или группу С 1-С 6-алкил, CF3, CN, CO-R2 или OR2 иR2 представляет собой группу C1-C4-алкил или CF3 либо фенильную группу, возможно замещенную группой С 1-С 4-алкил или CF3,с арилсульфонилхлоридом формулы в котором Ar представляет собой ароматическое или гетероароматическое кольцо, выбранное из групп фенил, нафтил, хинолинил, изохинолинил, пиридинил, пиразолил, имидазолил, изоксазолил, тиазолил, бензимидазолил, бензотиазолил, 2,1,3-бензотиадиазолил, 3,4-дигидро-1,4-бензоксазинил, 5,6,7,8 тетрагидронафталинил, 1,2,3,4-тетрагидрохинолинил, 1,2,3,4-тетрагидроизохинолинил, 1,2,3,4-тетрагидро-2-оксохинолинил, 3,4-дигидро-2 Н-бензопиранил, индолил, 2,3-дигидроиндолил, бензофуранил,2,3-дигидробензофуранил, 1,3-бензодиоксолил, 1,4-бензодиоксанил и бензоксазолил, возможно замещенных одним или более чем одним из атомов или групп атомов, выбранных из атомов галогена и групп С 1-С 6-алкил, фенил, CF3, CN, CO-R2, OR2, SR2, NH-COR2, морфолинил, амино и 4-морфолиносульфонил,в растворителе, например в диметилформамиде, при комнатной температуре в течение 1-12 ч с получением соединения формулы в котором Ra, Rb и Ar являются такими, как определено в исходных соединениях; б) взаимодействия соединения формулы (XI) с производным ацетилена формулыR3 и R4, каждый независимо, представляют собой атом водорода или группу С 1-С 4-алкил;R представляет собой группу С 1-С 3-алкил иX представляет собой одинарную связь, атом кислорода или атом серы,в условиях, аналогичных описанным для стадии а) вышеописанного общего способа,с получением соединения формулы в котором Ra, Rb, n, X, R3, R4, R и Ar являются такими, как определено в исходных соединениях; в) циклизации приведенного выше соединения формулы (VII) в условиях, аналогичных описанным для проведения стадии г) вышеописанного общего способа, с получением соединения индола формулы в котором Ra, Rb, n, X, R3, R4, R и Ar являются такими, как определено в исходных соединениях; и г) если необходимо, гидролиза эфирной группы соединения формулы (Ia), например, путем взаимодействия с неорганическим основанием, таким как гидроксид натрия или гидроксид лития, с помощью методик, хорошо известных специалистам в данной области техники, после чего продукт обрабатывают кислотой с получением соединения формулы (I) в форме его свободной кислоты При данном последнем способе возможно проведение двух стадий б) и в) в одной операции. Соединения формулы (I) по изобретению, в которых Ra (данный способ также применим к Rb) представляет собой возможно замещенное фенильное кольцо, могут быть получены из галогенированного соединения формулы в котором Ra представляет собой атом галогена, предпочтительно атом брома, Rb представляет собой атом водорода, атом фтора или хлора или группу C1-С 6-алкил, CF3, CN, CO-R2 или OR2;R2 представляет собой группу C1-C4-алкил или CF3 либо фенильную группу, возможно замещенную группой C1-C4-алкил или CF3;R3 и R4, каждый независимо, представляют собой атом водорода или группу С 1-С 4-алкил;R представляет собой группу C1-C3-алкил;X представляет собой одинарную связь, атом кислорода или атом серы иAr представляет собой ароматическое или гетероароматическое кольцо, выбранное из групп фенил,нафтил, хинолинил, изохинолинил, пиридинил, пиразолил, имидазолил, изоксазолил, тиазолил, бензимидазолил, бензотиазолил, 2,1,3-бензотиадиазолил, 3,4-дигидро-1,4-бензоксазинил, 5,6,7,8-тетрагидронафталинил, 1,2,3,4-тетрагидрохинолинил, 1,2,3,4-тетрагидроизохинолинил, 1,2,3,4-тетрагидро-2-оксохинолинил, 3,4-дигидро-2 Н-бензопиранил, индолил, 2,3-дигидроиндолил, бензофуранил, 2,3-дигидробензофуранил, 1,3-бензодиоксолил, 1,4-бензодиоксанил и бензоксазолил, возможно замещенных одним или более чем одним из атомов или групп атомов, выбранных из атомов хлора и фтора и групп C1-C6 алкил, фенил, CF3, CN, CO-R2, OR2, SR2, NH-COR2, морфолинил, амино и 4-морфолиносульфонил,с фенилбороновой кислотой формулы в которой Rx представляет собой атом водорода, или группу С 1-С 4-алкил, или CF3,в соответствии с реакцией Сузуки (см., например, Chem. Rev., 1995, 95, 2457) в присутствии тетракис(трифенилфосфин)палладия и основания, например карбоната натрия, в растворителе, например в смеси тетрагидрофурана, метанола и воды, при температуре между 30 С и температурой кипения растворителя в течение 5-24 ч с получением соединения формулы (Id) в котором R, Rb, Rx, X, R3, R4, n и Ar являются такими, как определено в исходных соединениях. Соединения по изобретению в форме солей кислоты формулы (Ib) с неорганическим или органическим основанием могут быть получены общепринятым путем, используя способы, которые хорошо известны специалистам в данной области техники, например, путем смешивания стехиометрических количеств кислоты и основания в растворителе, например в воде или в водно-спиртовой смеси, а затем лиофилизации полученного раствора. На некоторых из стадий вышеописанных реакций предпочтительно возможна замена традиционных методов нагревания микроволновым нагреванием с использованием реакторов, приспособленных к данному виду реакции. В данном случае специалисту в данной области техники должно быть понятно, что время такого "нагревания" значительно меньше по сравнению со временем, необходимым для стандартного нагревания.-7 013795 Приведенные ниже примеры получения соединений формулы (I) дают лучшее понимание изобретения. В данных примерах, которые не ограничивают объем изобретения, "примеры получения" означают примеры, в которых описан синтез промежуточных соединений, а "примеры" представляют примеры, в которых описан синтез соединений формулы (I) по изобретению. Среди сокращений "мМ" означает миллимоль. Температуры плавления измеряют на установке Kfler либо с использованием аппарата Mettler,а спектральные значения ядерно-магнитного резонанса характеризуются химическим сдвигом, вычисленным относительно ТМС (тетраметилсилана), числом протонов, связанных с сигналом, и формой сигнала (s для синглета, d для дублета, dd для двойного дублета, t для триплета, q для квартета, quint для квинтета и m для мультиплета). Рабочая частота и используемый растворитель указаны для каждого соединения. Комнатная температура составляет 20 С 5 С. В некоторых случаях структуру соединений подтверждали масс-спектроскопией (MS) с последующей жидкостной (LC) хроматографией (сочетаниеLC/MS); измерения проводили на колонке Uptisphere HDO с фазой HDO (колонка: 502 мм 3 мкм),скорость тока: 0,6 мл/мин (расщепление: 1/3), подвижная фаза: А = Н 2 О + 0,5% ТФУ (трифторуксусная кислота), В = ацетонитрил + 0,5% ТФУ (программирование градиента: В = 10-90% за 7 мин, затем плато при 90% в течение 2 мин, затем возврат до 10% за 1 мин и стабилизация при 10% в течение 3 мин); рабочая температура: 45 С; УФ-обнаружение: от 210 до 260 нм. Масс-спектр получали с помощью ESI+, распыление: 3500 В, температура блока источника: 130 С, десольватация: 230 С, газ десольватации: 600 л/ч,газ диффузора: 100 л/ч, напряжение: 10 В/30 В/60 В. Результат выражен в массе (m/z) и времени удерживания (Tr). Пример получения 1. 5-(5-Хлор-2-нитрофенил)-4-пентиновой кислоты метиловый эфир. Смешивают 35,5 г (125 мМ) 4-хлор-2-йод-1-нитробензола, 510 мл триэтиламина, 2,88 г (2,5 мМ) тетракис(трифенилфосфин)палладия, 0,72 г йодида меди и 50 мл диметилформамида (ДМФ). Затем добавляют 14 г (125 мМ) метилового эфира 4-пентиновой кислоты при комнатной температуре при перемешивании и реакционную смесь перемешивают в течение 24 ч при комнатной температуре. Добавляют 100 мл толуола и растворители выпаривают при пониженном давлении. Остаток после выпаривания растворяют в 150 мл этилацетата и 80 мл нормальной соляной кислоты. Органическую фазу отделяют, промывают водой, а затем высушивают над сульфатом магния и концентрируют при пониженном давлении. Полученное коричневое масло очищают хроматографией на силикагеле, используя смесь циклогексан/этилацетат (9/1; об./об.) в качестве элюента с получением 21,5 г ожидаемого продукта в форме желтого твердого вещества (выход = 65%). Т.пл. = 75-78 С. Пример получения 2. 5-(2-Амино-5-хлорфенил)-4-пентиновой кислоты метиловый эфир. 90,6 г (400 мМ) хлорида олова, 70 мл этилацетата и 22 мл этанола вносят в круглодонную колбу. Эту смесь перемешивают в течение 15 мин при комнатной температуре, а затем медленно добавляют раствор 21,5 г (80 мМ) соединения, полученного согласно примеру получения 1. Реакционную смесь перемешивают в течение 24 ч при комнатной температуре, а затем наливают в смесь 200 г льда и 200 мл нормального раствора гидроксида натрия. Полученную смесь дважды экстрагируют 200 мл этилацетата; объединенные органические фазы промывают водой, высушивают над сульфатом магния и концентрируют при пониженном давлении. Полученное масло очищают хроматографией на силикагеле, используя смесь циклогексан/этилацетат (80/20; об./об.) в качестве элюента, с получением 9,1 г ожидаемого соединения в форме оранжево-желтого твердого вещества (выход = 30%). Т.пл. = 67 С. Пример получения 3. [5-Хлор-2-(фенилсульфониламино)фенил]-4-пентиновой кислоты метиловый эфир. Готовят раствор 1,2 г (5 мМ) соединения, полученного согласно примеру получения 2, в 15 мл пиридина и добавляют 0,77 мл (6 мМ) бензолсульфонилхлорида. Смесь перемешивают в течение 1 ч при комнатной температуре, а затем концентрируют при пониженном давлении. Остаточное масло очищают хроматографией на силикагеле, используя смесь циклогексан/этилацетат (8/2; об./об.) в качестве элюента, с получением 1,8 г ожидаемого соединения в форме бежевого твердого вещества (выход = 95%). 1 Н ЯМР (ДМСО-d6, 300 МГц)2,56 (s, 4H), 3,65 (s, 3 Н), 7,28-7,36 (m, 3 Н), 7,54-7,72 (m, 5H), 9,69 (s,1H). Пример 1. 5-Хлор-1-(фенилсульфонил)-1H-индол-2-пропановой кислоты метиловый эфир. Готовят раствор 300 мг (0,79 мМ) эфира, полученного согласно примеру получения 3, в 35 мл 1,2-дихлорэтана, добавляют 15 мг (0,08 мМ) ацетата меди и смесь кипятят с обратным холодильником в течение 24 ч при перемешивании. Затем растворитель отгоняют при пониженном давлении и остаточное вязкое твердое вещество очищают хроматографией на силикагеле, используя смесь толуол/этилацетат(9/1; об./об.) в качестве элюента, с получением 230 мг полученного соединения в форме желтого твердого вещества (выход = 77%). Т.пл. = 93-96 С.-8 013795 Пример 2. 5-Хлор-1-(фенилсульфонил)-1H-индол-2-пропановая кислота. 180 мг (0,46 мМ) эфира, полученного согласно примеру 1, смешивают с 16 мл ТГФ и 4 мл воды и добавляют 20 мг (0,48 мМ) гидроксида лития (LiOH, 1H2O). Смесь перемешивают в течение 3 ч при комнатной температуре, а затем концентрируют при пониженном давлении. Остаток после выпаривания растворяют в 10 мл воды и раствор подкисляют 1 н. раствором соляной кислоты. Белый осадок экстрагируют этилацетатом и органическую фазу отделяют, высушивают над сульфатом магния и концентрируют при пониженном давлении с получением 160 мг ожидаемого продукта в форме желтого твердого вещества (выход = 93%). Т.пл. = 165-168 С. Пример 2 а. 5-Хлор-1-(фенилсульфонил)-1H-индол-2-пропановой кислоты натриевая соль. 114 мг (0,313 мМ) кислоты, полученной согласно примеру 2, смешивают с 10 мл воды и 0,313 мл нормального раствора гидроксида натрия. Добавляют несколько капель метанола при перемешивании с получением раствора. Эту смесь перемешивают в течение 15 мин при комнатной температуре, а затем частично концентрируют при пониженном давлении. Затем остаточный раствор фильтруют и лиофилизируют с получением 115 мг ожидаемой соли в форме мелкого белого порошка (выход = 95%). Т.пл.250 С. Пример получения 4. 2-Йод-4-(трифторметил)анилин. Готовят раствор 5 г (31 мМ) 4-(трифторметил)анилина в 90 мл метанола и 30 мл дихлорметана и добавляют 3,56 г (35,6 мМ) карбоната кальция. Затем добавляют порциями 14,9 г (42,7 мМ) триметилбензиламмония дихлорида при комнатной температуре при перемешивании. Реакционную смесь перемешивают в течение 24 ч при комнатной температуре, а затем фильтруют для удаления неорганических солей. Фильтрат концентрируют при пониженном давлении и сырой продукт очищают хроматографией на силикагеле, используя смесь циклогексан/этилацетат (8/2; об./об.) в качестве элюента, с получением 6,65 г ожидаемого соединения в форме оранжевого масла (выход = 75%). 1 Н ЯМР (CDCl3, 300 МГц)5,0 (s, 2 Н), 6,82 (d, J = 5,5 Гц, 1H), 7,38 (dd, J = 5,5 Гц, 1,3 Гц, 1H), 7,79(d, J = 1,3 Гц, 1H). Пример получения 5. 5-[2-Амино-5-(трифторметил)фенил]-4-пентиновой кислоты метиловый эфир. Готовят раствор 1,5 г (5,23 мМ) соединения, полученного согласно примеру получения 4, 0,644 г(5,75 мМ) метил-4-пентиноата и 90 мг (0,13 мМ) дихлорбис(трифенилфосфин)палладия в 1 мл диметилформамида и 2 мл диэтиламина и добавляют 50 мг (0,26 мМ) йодида меди. Реакционную смесь облучают в микроволновой печи при 120 С в течение 10 мин. Затем растворители отгоняют при пониженном давлении и остаток после выпаривания очищают хроматографией на силикагеле, используя смесь циклогексан/этилацетат (8/2; об./об.) в качестве элюента, с получением 1,16 г ожидаемого соединения в форме оранжевого масла (выход = 82%). 1 Н ЯМР (ДМСО-d6, 300 МГц)2,65-2,75 (m, 4H), 3,64 (s, 3 Н), 5,99 (s, 2H), 6,78 (d, J = 8,3 Гц, 1 Н),7,31 (d, J = 8,3 Гц, 1 Н), 7,33 (s, 1 Н). Пример получения 6. 5-(Трифторметил)-1H-индол-2-пропановой кислоты метиловый эфир. Готовят раствор 1,16 г (4,28 мМ) эфира, полученного согласно примеру получения 5, в 5 мл 1,2-дихлорэтана и добавляют 1,3 г (6,4 мМ) ацетата меди. Реакционную смесь облучают в микроволновой печи при 150 С в течение 30 мин, а затем охлаждают и фильтруют. Фильтрат концентрируют при пониженном давлении с получением 1 г ожидаемого соединения в форме коричневого твердого вещества(3,69 мМ) эфира, полученного согласно примеру получения 6. Эту смесь перемешивают в течение 15 мин и добавляют 0,98 г (5,5 мМ) бензолсульфонилхлорида все еще при 0 С. Смесь перемешивают в течение 30 мин при комнатной температуре, а затем добавляют 100 мл 15% водного раствора хлорида аммония. Смесь экстрагируют 3 раза 50 мл дихлорметана. Объединенные органические фазы высушивают над сульфатом магния и концентрируют при пониженном давлении. Остаточное масло очищают хроматографией на силикагеле, используя смесь циклогексан/этилацетат (8/2; об./об.) в качестве элюента, с получением 0,95 г ожидаемого продукта в форме масла, которое кристаллизуется в виде оранжевых звездочек (выход = 62%). Т.пл. = 81-83 С. Пример 4. 1-(Фенилсульфонил)-5-(трифторметил)-1H-индол-2-пропановая кислота. Следуя методике, аналогичной примеру 2, начиная с соединения, полученного согласно примеру 3,ожидаемый продукт получают в форме бежевого твердого вещества (выход = 85%). Т.пл. = 170-172 С. Пример получения 7. 5-(2-Амино-5-бромфенил)-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 5, начиная с 4-бром-2-йоданилина, ожидаемое-9 013795 соединение получают в форме желтого масла (выход = 23%). 1 Н ЯМР (ДМСО-d6, 250 МГц)2,61-2,74 (m, 4H), 3,63 (s, 3H), 5,46 (s, 2H), 6,63 (dd, J = 8,3 Гц,0,7 Гц, 1 Н), 7,1-7,2 (m, 2H). Пример получения 8. 5-Бром-1H-индол-2-пропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 6, начиная с соединения, полученного согласно примеру получения 7, ожидаемое соединение получают в форме коричневого твердого вещества (выход= 98%). 1 Н ЯМР (ДМСО-d6, 250 МГц)2,75 (t, J = 7,3 Гц, 2 Н), 2,98 (t, J = 7,2 Гц, 2 Н), 3,60 (s, 3 Н), 6,14 (s,1 Н), 7,1 (dd, J = 8,5 Гц, 1,9 Гц, 1 Н), 7,2 (d, J = 8,5 Гц, 1 Н), 7,58 (d, J = 1,9 Гц, 1 Н), 11,1 (s, 1H). Пример 5. 5-Бром-1-(фенилсульфонил)-1H-индол-2-пропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 3, начиная с соединения, полученного согласно примеру получения 8, ожидаемое соединение получают в форме светло-коричневого твердого вещества (выход = 25%). Т.пл. = 109-113 С. Пример 6. 5-Бром-1-(фенилсульфонил)-1H-индол-2-пропановая кислота. Следуя методике, аналогичной примеру 2, начиная с соединения, полученного согласно примеру 5,ожидаемое соединение получают в форме бежевого твердого вещества (выход = 81%). Т.пл. = 188-190 С. Пример 7. 1-(Фенилсульфонил)-5-[4-(трифторметил)фенил]-1H-индол-2-пропановой кислоты метиловый эфир. Готовят раствор 0,5 г (1,18 мМ) эфира, полученного согласно примеру 5, и 0,68 г (0,59 мМ) тетракис(трифенилфосфин)палладия в 5 мл ТГФ и добавляют раствор 0,84 г (4,4 мМ) 4-(трифторметил)фенилбороновой кислоты в 2,5 мл метанола, а затем раствор 282 мг (2,6 мМ) карбоната натрия в 1 мл воды. Затем эту смесь перемешивают при температуре кипения растворителя в течение 24 ч. После этого ее возвращают к комнатной температуре, смесь разбавляют 20 мл дихлорметана и высушивают над сульфатом магния. Полученный раствор концентрируют при пониженном давлении и остаток после выпаривания растворяют в 50 мл этилового эфира до растворения. Полученный раствор промывают 3 раза 15 мл 1 н. раствора гидроксида натрия, а затем водой до тех пор, пока промывки не станут нейтральными,высушивают над сульфатом магния и концентрируют при пониженном давлении. Остаточное масло очищают хроматографией на силикагеле, используя смесь циклогексан/этилацетат (85/15; об./об.) в качестве элюента, с получением 57 мг ожидаемого соединения в форме бежевого масла (выход = 10%). 1 Н ЯМР (ДМСО-d6, 250 МГц)2,84 (t, J = 7,1 Гц, 2 Н), 3,32 (d, J = 7,2 Гц, 2 Н), 3,62 (s, 3 Н), 6,68 (s,1H), 7,56-7,71 (m, 5 Н), 7,78-7,91 (m, 6 Н), 8,13 (d, 1H). Пример 8. 1-(Фенилсульфонил)-5-[4-(трифторметил)фенил]-1H-индол-2-пропановая кислота. Следуя методике, аналогичной примеру 2, начиная с соединения, полученного согласно примеру 7,ожидаемый продукт получают в форме желтого твердого вещества (выход = 76%). Т.пл. = 162 С. Пример получения 9. 5-(2-Нитрофенил)-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 1, начиная с 1-йод-2-нитробензола, ожидаемый продукт получают в форме желтого твердого вещества (выход = 53%). Т.пл. = 44-46 С. Пример получения 10. 6-(5-Хлор-2-нитрофенил)-5-гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 1, начиная с метилового эфира 5-гексиновой кислоты, ожидаемый продукт получают в форме коричневого масла (выход = 73%). 1 Н ЯМР (ДМСО-d6, 250 МГц)1,81 (m, 2 Н), 2,54 (m, 4 Н), 3,60 (s, 3H), 7,69 (dd, 1H), 7,81 (d, 1H),8,09 (d, 1H). Пример получения 11. 7-(5-Хлор-2-нитрофенил)-6-гептиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 1, начиная с метилового эфира 6-гептиновой кислоты, ожидаемый продукт получают в форме коричневого масла (выход = 98%). 1 Н ЯМР (ДМСО-d6, 250 МГц)1,34-1,73 (m, 4H), 2,36 (t, 2H), 2,53 (t, 2H), 3,59 (s, 3 Н), 7,66 (dd, 1 Н),7,79 (d, 1 Н), 8,09 (d, 1 Н). Пример получения 12. 5-(2-Аминофенил)-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 2, начиная с соединения, полученного согласно примеру получения 9, ожидаемый продукт получают в форме бесцветного масла (выход = 53%). 1 Н ЯМР (ДМСО-d6, 250 МГц)2,67 (m, 4H), 3,63 (s, 3 Н), 5,25 (s, 2H), 6,46 (m, 1 Н), 6,65 (dd, 1 Н),7,02 (m, 2 Н). Пример получения 13. 6-(2-Амино-5-хлорфенил)-5-гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 2, начиная с соединения, полученного согласно примеру получения 10, ожидаемый продукт получают в форме желтого твердого вещества (выход = 41%). 1 Н ЯМР (ДМСО-d6, 250 МГц)1,83 (m, 2 Н), 2,48 (m, 4 Н), 3,59 (s, 3 Н), 5,40 (s, 2 Н), 6,67 (d, 1H), 7,03(dd, 1H), 7,08 (d, 1H). Пример получения 14. 7-(2-Амино-5-хлорфенил)-6-гептиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 2, начиная с соединения, полученного согласно примеру получения 11, ожидаемый продукт получают в форме желтого твердого вещества (выход = 68%). Т.пл. = 66 С. Пример получения 15. 5-(2-Амино-5-фторфенил)-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 5, начиная с 4-фтор-2-йоданилина, ожидаемый продукт получают в форме коричневого твердого вещества (выход = 45%). 1 Н ЯМР (ДМСО-d6, 300 МГц)2,6-2,75 (m, 4H), 3,63 (s, 3H), 5,16 (s, 2H), 6,6-6,7 (m, 1 Н), 6,8-6,85(m,2 Н). Пример получения 16. 5-(2-Амино-4,5-дихлорфенил)-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 5, начиная с 4,5-дихлор-2-йоданилина, ожидаемый продукт получают в форме бежевых кристаллов (выход = 87%). 1 Н ЯМР (ДМСО-d6, 300 МГц)2,65-2,75 (m, 4H), 3,63 (s, 3H), 5,70 (s, 2H), 6,87 (s, 1H), 7,24 (s, 1H). Пример получения 17. 5-(2-Амино-5,6-дихлорфенил)-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 5, начиная с 3,4-дихлор-2-йоданилина, ожидаемый продукт получают в форме бесцветного масла (выход = 49%). 1 Н ЯМР (ДМСО-d6, 300 МГц)2,6-2,8 (m, 4H), 3,63 (s, 3H), 5,74 (s, 2H), 6,65 (d, 1H), 7,20 (d,1H). Пример получения 18. 5-[2-Амино-4-(трифторметил)фенил]-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 5, начиная с 5-(трифторметил)-2-йоданилина,ожидаемый продукт получают в форме оранжевых кристаллов (выход = 71%). Т.пл. = 42 С. Пример получения 19. 5-(2-Амино-5-ацетилфенил)-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 5, начиная с 4-амино-3-йодацетофенона, ожидаемый продукт получают в форме желтого твердого вещества (выход = 39%). 1 Н ЯМР (ДМСО-d6, 300 МГц)2,39 (s, 3H), 2,65-2,75 (m, 4H), 3,64 (s, 3 Н), 6,15 (s, 2H), 6,69 (d, 1H),7,64 (dd, 1H), 7,69 (d, 1H). Пример получения 20. 5-(2-Амино-4-хлор-5-фторфенил)-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 5, начиная с 5-хлор-4-фтор-2-йоданилина, ожидаемый продукт получают в форме коричневых кристаллов (выход = 81%). Т.пл. = 67-68 С. Пример получения 21. 5-(2-Амино-5-цианофенил)-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 5, начиная с 4-амино-3-йодбензонитрила, ожидаемый продукт получают в форме бесцветного масла (выход = 52%). 1 Н ЯМР (ДМСО-d6, 300 МГц)2,65-2,75 (m, 4H), 3,63 (s, 3H), 6,27 (s, 2H), 6,73 (d, 1 Н), 7,38 (dd, 1 Н),7,46 (d, 1 Гц, 1 Н). Пример получения 22. 5-(2-Амино-5-бензоилфенил)-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 5, начиная с 4-амино-3-йодбензофенона, ожидаемый продукт получают в форме желтого масла (выход = 54%). 1 Н ЯМР (ДМСО-d6, 300 МГц)2,63-2,73 (m, 4H), 3,62 (s, 3H), 6,28 (s, 2H), 6,75 (d, 1H), 7,47-7,61 (m,7H). Пример получения 23. 5-(2-Амино-3,5-дихлорфенил)-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 5, начиная с 2,4-дихлор-6-йоданилина, ожидаемый продукт получают в форме масла темного цвета (выход = 87%). 1 Н ЯМР (ДМСО-d6, 300 МГц)2,6-2,8 (m, 4H), 3,64 (s, 3H), 5,55 (s, 2H), 7,13 (d, 1H), 7,33 (d, 1H). Пример получения 24. 5-[2-[(Фенилсульфонил)амино]фенил]-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 3, начиная с соединения, полученного согласно примеру получения 12, ожидаемый продукт получают в форме бесцветного масла (выход = 82%). 1 Н ЯМР (ДМСО-d6, 300 МГц)2,57 (s, 4H), 3,65 (s, 3H), 7,13 (m, 1H), 7,22-7,28 (m, 3 Н), 7,52-7,62(m, 3 Н), 7,71 (dd, 2H), 9,49 (s, 1H). Пример получения 25. 5-[5-Хлор-2-(4-метилфенил)сульфонил]амино]фенил]-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 3, начиная с паратолуолсульфонилхлорида,ожидаемый продукт получают в форме желтого масла (выход = 85%). 1 Н ЯМР (ДМСО-d6, 250 МГц)2,35 (s, 3H), 2,56 (s, 4H), 3,65 (s, 3 Н), 7,31 (m, 5 Н), 7,59 (d, 2H), 9,57- 11013795 Следуя методике, аналогичной примеру получения 3, начиная с 2,3-дихлор-бензолсульфонилхлорида, ожидаемый продукт получают в форме желтого твердого вещества (выход = 85%). Т.пл. = 64 С. Пример получения 27. 5-[5-Хлор-2-(3-метилфенил)сульфонил]амино]фенил]-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 3, начиная с метатолуолсульфонилхлорида,ожидаемый продукт получают в форме бежевого твердого вещества (выход = 82%). Т.пл. = 69 С. Пример получения 28. 5-[5-Хлор-2-(2,4-дихлорфенил)сульфонил]амино]фенил]-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 3, начиная с 2,4-дихлор-бензолсульфонилхлорида, ожидаемый продукт получают в форме бесцветного масла (выход = 96%). 1 Н ЯМР (ДМСО-d6, 300 МГц)2,56 (s, 4H), 3,64 (s, 3 Н), 7,27 (dd, J = 8,4, 0,78 Гц, 1H), 7,36 (m, 2H),7,58 (dd, 1H), 7,84 (d, 1H), 7,89 (s, 1H), 10,06 (s, 1H). Пример получения 29. 5-[5-Хлор-2-4-(трифторметил)фенил]сульфонил]амино]фенил]-4 пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 3, начиная с 4-(трифторметил)бензолсульфонилхлорида, ожидаемый продукт получают в форме розового твердого вещества (выход = 50%). Т.пл. = 80 С. Пример получения 30. 5-[5-Хлор-2-(4-метоксифенил)сульфонил]амино]фенил]-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 3, начиная с 4-метоксибензолсульфонилхлорида, ожидаемый продукт получают в форме желтого масла (выход = 84%). 1 Н ЯМР (ДМСО-d6, 300 МГц)2,58 (s, 4H), 3,65 (s, 3 Н), 3,80 (s, 3 Н), 7,05 (m, 2 Н), 7,29 (m, 2 Н), 7,36(dd, 1 Н), 7,63 (m, 2 Н), 9,47 (s, 1H). Пример получения 31. 5-[5-Хлор-2-(4-ацетилфенил)сульфонил]амино]фенил]-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 3, начиная с 4-ацетилбензолсульфонилхлорида,ожидаемый продукт получают в форме бежевого твердого вещества (выход = 59%). Т.пл. = 88 С. Пример получения 32. 5-[2-[([1,1'-Дифенил]-4-илсульфонил)амино]-5-хлорфенил]-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 3, начиная с (1,1'-дифенил)-4-илсульфонилхлорида, ожидаемый продукт получают в форме бежевого твердого вещества (выход = 81%). Т.пл. = 93 С. Пример получения 33. 5-[5-Хлор-2-2-(трифторметил)фенил]сульфонил]амино]фенил]-4 пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 3, начиная с 2-(трифторметил)бензолсульфонилхлорида, ожидаемый продукт получают в форме оранжевого масла (выход = 73%). 1 Н ЯМР (ДМСО-d6, 250 МГц)2,56 (s, 4 Н), 3,63 (s, 3 Н), 7,27-7,42 (m, 3 Н), 7,83 (m, 2 Н), 7,96 (m, 2 Н),9,95 (s, 1H). Пример получения 34. 5-[5-Хлор-2-(3-метоксифенил)сульфонил]амино]фенил]-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 3, начиная с 3-метоксибензолсульфонилхлорида, ожидаемый продукт получают в форме желтого масла (выход = 86%). 1 Н ЯМР (ДМСО-d6, 300 МГц)2,56 (s, 4H), 3,65 (s, 3H), 3,76 (s, 3H), 7,12-7,31 (m, 4 Н), 7,37 (dd, 1 Н),7,44 (m, 1 Н), 7,69 (s, 1H), 9,69 (s, 1H). Пример получения 35. 5-[5-Хлор-2-(2,5-диметоксифенил)сульфонил]амино]фенил]-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 3, начиная с 2,5-диметоксибензолсульфонилхлорида, ожидаемый продукт получают в форме желтого твердого вещества (выход = 92%).LC/MS: m/z = 438; Tr = 5,97 мин. Пример получения 36. 5-[5-Хлор-2-4-(1,1-диметилэтил)фенил]сульфонил]амино]фенил]-4 пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 3, начиная с 4-трет-бутилбензолсульфонилхлорида, ожидаемый продукт получают в форме бесцветного масла (выход = 88%).LC/MS: m/z = 434; Tr = 6,89 мин. Пример получения 37. 5-[5-Хлор-2-(4-этилфенил)сульфонил]амино]фенил]-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 3, начиная с 4-этилбензолсульфонилхлорида,ожидаемый продукт получают в форме желтого масла (выход = 37%).LC/MS: m/z = 406; Tr = 6,40 мин. Пример получения 38. 5-[5-Хлор-2-4-(1-метилэтил)фенил]сульфонил]амино]фенил]-4 пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 3, начиная с 4-изопропилбензолсульфонилхлорида, ожидаемый продукт получают в форме оранжевого масла (выход = 92%).LC/MS: m/z = 420; Tr = 6,95 мин. Пример получения 39. 5-[5-Хлор-2-(4-пропилфенил)сульфонил]амино]фенил]-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 3, начиная с 4-пропилбензолсульфонилхлорида,ожидаемый продукт получают в форме оранжевого масла (выход = 22%).LC/MS: m/z = 420; Tr = 6,92 мин. Пример получения 40. 5-[5-Хлор-2-(4-пентилфенил)сульфонил]амино]фенил]-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 3, начиная с 4-пентилбензолсульфонилхлорида,ожидаемый продукт получают в форме оранжевого масла (выход = 88%).LC/MS: m/z = 448; Tr = 7,61 мин. Пример получения 41. 5-[5-Хлор-2-(3,5-диметилфенил)сульфонил]амино]фенил]-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 3, начиная с 3,5-диметилбензолсульфонилхлорида, ожидаемый продукт получают в форме оранжевого масла (выход = 92%).LC/MS: m/z = 406; Tr = 6,70 мин. Пример получения 42. 5-[5-Хлор-2-(2,4,6-триметилфенил)сульфонил]амино]фенил]-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 3, начиная с 2,4,6-триметилбензолсульфонилхлорида, ожидаемый продукт получают в форме оранжевого масла (выход = 23%).LC/MS: m/z = 420; Tr = 6,66 мин. Пример получения 43. 5-[5-Хлор-2-(4-хлорфенил)сульфонил]амино]фенил]-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 3, начиная с 4-хлорбензолсульфонилхлорида,ожидаемый продукт получают в форме оранжевого масла (выход = 56%).LC/MS: m/z = 412; Tr = 6,27 мин. Пример получения 44. 5-[5-Хлор-2-(4-фторфенил)сульфонил]амино]фенил]-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 3, начиная с 4-фторбензолсульфонилхлорида,ожидаемый продукт получают в форме оранжевого масла (выход = 28%).LC/MS: m/z = 396; Tr = 5,99 мин. Пример получения 45. 5-[5-Хлор-2-(4-хлор-3-метилфенил)сульфонил]амино]фенил]-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 3, начиная с 4-хлор-3-метилбензолсульфонилхлорида, ожидаемый продукт получают в форме желтого масла (выход = 59%).LC/MS: m/z = 426; Tr = 6,80 мин. Пример получения 46. 5-[5-Хлор-2-3-(трифторметил)фенил]сульфонил]амино]фенил]-4 пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 3, начиная с 3-(трифторметил)бензолсульфонилхлорида, ожидаемый продукт получают в форме оранжевого масла (выход = 50%).LC/MS: m/z = 446; Tr = 6,58 мин. Пример получения 47. 5-[2-4-(Ацетиламино)фенил]сульфонил]амино]-5-хлорфенил]-4 пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 3, начиная с 4-(ацетиламино)бензолсульфонилхлорида, ожидаемый продукт получают в форме оранжевого твердого вещества (выход = 74%).LC/MS: m/z = 435; Tr = 5,15 мин. Пример получения 48. 5-[5-Хлор-2-(4-цианофенил)сульфонил]амино]фенил]-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 3, начиная с 4-цианобензолсульфонилхлорида,ожидаемый продукт получают в форме желтого твердого вещества (выход = 87%).LC/MS: m/z = 403; Tr = 5,71 мин. Пример получения 49. 5-[5-Хлор-2-(4-феноксифенил)сульфонил]амино]фенил]-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 3, начиная с 4-феноксибензолсульфонилхлорида, ожидаемый продукт получают в форме желтого твердого вещества (выход = 71%).- 13013795 метиловый эфир. Следуя методике, аналогичной примеру получения 3, начиная с 1-нафталинсульфонилхлорида,ожидаемый продукт получают в форме коричневого масла (выход = 89%). 1 Н ЯМР (ДМСО-d6, 300 МГц)2,15 (t, 2 Н), 2,44 (t, 2H), 3,63 (s, 3 Н), 7,18 (s, 1 Н), 7,34 (s, 2H), 7,62(m, 3H), 8,01 (dd, 1H), 8,04 (d, 1H), 8,22 (d, 1H), 8,72 (d, 1H), 10,01 (s, 1H). Пример получения 51. 5-[5-Хлор-2-[(2-нафталинилсульфонил)амино]фенил]-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 3, начиная с 2-нафталинсульфонилхлорида,ожидаемый продукт получают в форме бесцветного масла (выход = 22%).LC/MS: m/z = 428; Tr = 6,63 мин. Пример получения 52. 5-[5-Хлор-2-(4-метил-1-нафталинил)сульфонил]амино]фенил]-4 пентиновой кислоты метиловый эфир Следуя методике, аналогичной примеру получения 3, начиная с 4-метил-1-нафталинсульфонилхлорида, ожидаемый продукт получают в форме желтого масла (выход = 77%). 1 Н ЯМР (ДМСО-d6, 250 МГц)2,24 (t, 2H), 2,37 (t, 2H), 2,70 (s, 3H), 3,64 (s, 3H), 7,25 (s, 1 Н), 7,33 (s,2 Н), 7,45 (dd, 1 Н), 7,68 (m, 2 Н), 7,93 (d, 1 Н), 8,15 (m, 1 Н), 8,75 (m, 1 Н), 9,91 (s, 1H). Пример получения 53. 5-[2-5-(Ацетиламино)-1-нафталинил]сульфонил]амино]-5-хлорфенил]-4 пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 3, начиная с 5-(ацетиламино)-1 нафталинсульфонилхлорида, ожидаемый продукт получают в форме бесцветного масла (выход = 94%). 1 Н ЯМР (ДМСО-d6, 300 МГц)2,18 (s, 3H), 2,23 (t, 2H), 2,41 (t, 2H), 3,62 (s, 3H), 7,18 (s, 1H), 7,32 (s,2H), 7,62 (m, 2H), 7,76 (d, 1H), 8,04 (dd, 1H), 8,35 (d, 1H), 8,58 (d, 1H), 10,03 (s,1H). Пример получения 54. 5-[5-Хлор-2-[(8-хинолинилсульфонил)амино]фенил]-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 3, начиная с 8-хинолинсульфонилхлорида, ожидаемый продукт получают в форме желтого масла (выход = 76%).LC/MS: m/z = 429; Tr = 5,96 мин. Пример получения 55. 6-[5-Хлор-2-[(фенилсульфониламино)фенил]-5-гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 3, начиная с соединения, полученного согласно примеру получения 13, ожидаемый продукт получают в форме оранжевого твердого вещества (выход = 66%). Т.пл. = 90 С. Пример получения 56. 6-[5-Хлор-2-(2,3-дихлорфенил)сульфонил]амино]фенил]-5-гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 55, начиная с 2,3-дихлорбензолсульфонилхлорида, ожидаемый продукт получают в форме желтого масла (выход = 87%). 1 Н ЯМР (ДМСО-d6, 250 МГц)1,72 (m, 2H), 2,35 (t, 2H), 2,43 (t, 2H), 3,60 (s, 3H), 7,25-7,36 (m, 2 Н),7,39 (s, 1H), 7,48 (t, 1H), 7,79 (d, 1H), 7,90 (d, 1H), 10,28 (s, 1H). Пример получения 57. 6-[5-Хлор-2-(4-метоксифенил)сульфонил]амино]фенил]-5-гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 55, начиная с 4-метоксибензолсульфонилхлорида, ожидаемый продукт получают в форме желтого масла (выход = 43%). 1 Н ЯМР (ДМСО-d6, 250 МГц)1,73 (m, 2 Н), 2,35-2,48 (m, 4 Н), 3,62 (s, 3H), 3,81 (s, 3H), 7,04 (d, 2H),7,25-7,35 (m, 3H), 7,60 (d, 2H), 9,57 (s, 1H). Пример получения 58. 6-[5-Хлор-2-[(8-хинолинилсульфонил)амино]фенил]-5-гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 55, начиная с 8-хинолинсульфонилхлорида,ожидаемый продукт получают в форме белого порошка (выход = 48%). 1 Н ЯМР (ДМСО-d6, 300 МГц)1,77 (m, 2 Н), 2,44 (m, 4 Н), 3,61 (s, 3H), 7,29 (s, 2 Н), 7,43 (d, 1 Н), 7,75(m, 2 Н), 8,32 (d, 1H), 8,39 (d, 1H), 8,55 (d, 1H), 9,01 (s, 1H), 9,08 (d, 1H). Пример получения 59. 6-[5-Хлор-2-4-(1-метилэтил)фенил]сульфонил]амино]фенил]-5-гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 55, начиная с 4-изопропилбензолсульфонилхлорида, ожидаемый продукт получают в форме оранжевого масла (выход = 86%). 1 Н ЯМР (ДМСО-d6, 300 МГц)1,20 (d, 6H), 1,71 (m, 2H), 2,34 (t, 2H), 2,41 (t, 2 Н), 2,73 (m, 1 Н), 3,61(s, 3H), 7,26-7,62 (m, 5 Н), 9,71 (s, 1H). Пример получения 60. 6-[5-Хлор-2-[(2-нафталинилсульфонил)амино]фенил]-5-гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 55, начиная с 2-нафталинсульфонилхлорида,ожидаемый продукт получают в форме желтого масла (выход = 69%). Н ЯМР (ДМСО-d6, 300 МГц)1,59 (m, 2 Н), 2,20 (t, J = 7,1 Гц, 2 Н), 2,32 (t, J = 7,4 Гц, 2 Н), 3,61 (s,3H), 7,08-7,34 (m, 3H), 7,63-7,74 (m, 3H), 7,99-8,33 (m, 3H), 9,91 (s, 1 Н). Пример получения 61. 6-[5-Хлор-2-(3,5-диметилфенил)сульфонил]амино]фенил]-5-гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 55, начиная с 3,5-диметилбензолсульфонилхлорида, ожидаемый продукт получают в форме белого порошка (выход = 71%). Т.пл. = 92-94 С. Пример получения 62. 6-[5-Хлор-2-(3-метоксифенил)сульфонил]амино]фенил]-5-гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 55, начиная с 3-метоксибензолсульфонилхлорида, ожидаемый продукт получают в форме желтого порошка (выход = 82%). Т.пл. = 71-76 С. Пример получения 63. 6-[5-Хлор-2-(2,5-диметоксифенил)сульфонил]амино]фенил]-5-гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 55, начиная с 2,5-диметоксибензолсульфонилхлорида, ожидаемый продукт получают в форме белого порошка (выход = 80%). Т.пл. = 115-117 С. Пример получения 64. 6-[5-Хлор-2-[(1-нафталинилсульфонил)амино]фенил]-5-гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 55, начиная с 1-нафталинсульфонилхлорида,ожидаемый продукт получают в форме желтого порошка (выход = 81%). Т.пл. = 93-95 С. Пример получения 65. 5-Фтор-1H-индол-2-пропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 6, начиная с соединения, полученного согласно примеру получения 15, ожидаемый продукт получают в форме бежевого твердого вещества (выход = 71%). 1 Н ЯМР (ДМСО-d6, 300 МГц)2,75 (t, 2H), 2,98 (t, 2H), 3,61 (s, 3H), 6,14 (dd, 1 Н), 6,82 (ddd, 1 Н),7,15 (dd, 1 Н), 7,25 (dd, 4,68 Гц, 1 Н), 11,02 (s, 1H). Пример получения 66. 5,6-Дихлор-1H-индол-2-пропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 6, начиная с соединения, полученного согласно примеру получения 16, ожидаемый продукт получают в форме коричневого твердого вещества (выход = 100%). Т.пл. = 142 С. Пример получения 67. 4,5-Дихлор-1H-индол-2-пропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 6, начиная с соединения, полученного согласно примеру получения 17, ожидаемый продукт получают в форме коричневого твердого вещества (выход = 90%). 1 Н ЯМР (ДМСО-d6, 300 МГц)2,78 (t, 2H), 3,01 (t, 2H), 3,61 (s, 3H), 6,24 (s, 1H), 7,17 (d, 1H), 7,29 (d,1H), 11,49 (s, 1 Н). Пример получения 68. 6-(Трифторметил)-1H-индол-2-пропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 6, начиная с соединения, полученного согласно примеру получения 18, ожидаемый продукт получают в форме бежевого твердого вещества (выход = 91%). Т.пл. = 108-110 С. Пример получения 69. 5-Ацетил-1H-индол-2-пропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 6, начиная с соединения, полученного согласно примеру получения 19, ожидаемый продукт получают в форме бежевого твердого вещества (выход = 91%). 1 Н ЯМР (ДМСО-d6, 250 МГц)2,57 (s, 3H), 2,77 (t, 2H), 3,01 (t, 2H), 3,61 (s, 3H), 6,32 (s, 1H), 7,34 (d,1H), 7,66 (dd, 1H), 8,15 (d, 1H), 11,33 (s, 1H). Пример получения 70. 6-Хлор-5-фтор-1H-индол-2-пропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 6, начиная с соединения, полученного согласно примеру получения 20, ожидаемый продукт получают в форме серого твердого вещества (выход = 92%). Т.пл. = 138-139 С. Пример получения 71. 5,7-Дихлор-1H-индол-2-пропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 6, начиная с соединения, полученного согласно примеру получения 23, ожидаемый продукт получают в форме коричневого твердого вещества (выход = 30%). 1 Н ЯМР (ДМСО-d6, 250 МГц)2,77 (t, 2H), 3,02 (t, 2H), 3,61 (s, 3H), 6,26 (s, 1 Н), 7,15 (d, 1 Н), 7,47 (d,1 Н), 11,47 (s, 1 Н). Пример получения 72. 5-Циано-1H-индол-2-пропановой кислоты метиловый эфир.- 15013795 Следуя методике, аналогичной примеру получения 6, начиная с соединения, полученного согласно примеру получения 21, ожидаемый продукт получают в форме бежевого твердого вещества (выход = 72%). 1 Н ЯМР (ДМСО-d6, 250 МГц)2,77 (t, 2H), 3,02 (t, 2H), 3,60 (s, 3H), 6,33 (s, 1 Н), 7,35 (dd, 1H), 7,35(dd, 1,6 Гц, 1H), 7,4 (d, 1H), 7,93 (d, 1H), 11,56 (s, 1H). Пример получения 73. 5-Бензоил-1H-индол-2-пропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 6, начиная с соединения, полученного согласно примеру получения 22, ожидаемый продукт получают в форме коричневого твердого вещества (выход = 44%). 1 Н ЯМР (ДМСО-d6, 250 МГц)2,77 (t, 2H), 3,02 (t, 2H), 3,61 (s, 3H), 6,33 (s, 1 Н), 7,42 (d, 1H), 7,457,75 (m, 7H), 7,86 (d, 1H), 11,42 (s, 1H). Пример получения 74. 7-[5-Хлор-2-[(фенилсульфонил)амино]фенил]-6-гептиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 3, начиная с соединения, полученного согласно примеру получения 14, ожидаемый продукт получают в форме бесцветного масла (выход = 54%). 1 Н ЯМР (ДМСО-d6, 250 МГц)1,55 (m, 4H), 2,33 (m, 4H), 3,60 (s, 3H), 7,22 (m, 3H), 7,61 (m, 5 Н),9,75 (s, 1H). Пример получения 75. 6-[5-Хлор-2-(3,4-дигидро-4-метил-2H-1,4-бензоксазин-7-ил)сульфонил]амино]фенил]-5-гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 55, начиная с 3,4-дигидро-4-метил-2H-1,4 бензоксазин-7-сульфонилхлорида, ожидаемый продукт получают в форме белого порошка (выход = 88%). Т.пл. = 131-133 С. Пример получения 76. 6-[5-Хлор-2-1,2,3,4-тетрагидро-2-(трифторацетил)-7 изохинолинил]сульфонил]амино]фенил]-5-гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 55, начиная с 1,2,3,4-тетрагидро-2-(трифторацетил)-7-изохинолинсульфонилхлорида, ожидаемый продукт получают в форме желтого масла (выход= 89%). 1 Н ЯМР (ДМСО-d6, 300 МГц)1,70-1,75 (m, 2 Н), 2,35-2,45 (m, 4 Н), 3,0 (t, 2H), 3,85 (t, 2 Н), 4,80 (s,2 Н), 7,30-7,35 (m, 4 Н), 7,60 (dd, 1H), 7,65 (d, 1H), 9,80 (s, 1H). Пример получения 77. 6-[5-Хлор-2-(2,3-дигидро-1,4-бензодиоксин-6-ил)сульфонил]амино]фенил]5-гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 55, начиная с 2,3-дигидро-1,4-бензодиоксин-6 сульфонилхлорида, ожидаемый продукт получают в форме желтого масла (выход = 95%). 1 Н ЯМР (ДМСО-d6, 250 МГц)1,70-1,81 (m, 2H), 2,37-2,51 (m, 4H), 3,61 (s, 3H), 4,25-4,32 (m, 4H),6,59-7,37 (m, 6H), 9,63 (s, 1H). Пример получения 78. 6-[5-Хлор-2-(6-бензотиазолил)сульфонил]амино]фенил]-5-гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 55, начиная с 6-бензотиазолсульфонилхлорида,ожидаемый продукт получают в форме желтого масла (выход = 63%). 1 Н ЯМР (ДМСО-d6, 300 МГц)1,56-1,66 (m, 2H), 2,23 (t, 2H), 2,35 (t, 2H), 3,60 (s, 3H), 7,27-7,39 (m,3H), 7,79 (d, 1H), 8,21 (d, 1H), 8,60 (s, 1H), 9,61 (s, 1H), 9,97 (s, 1 Н). Пример получения 79. 6-[5-Хлор-2-6-(4-морфолинил)-3-пиридинил]сульфонил]амино]фенил]-5 гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 55, начиная с 6-(4-морфолинил)-3-пиридинсульфонилхлорида, ожидаемый продукт получают в форме желтого масла (выход = 66%). 1 Н ЯМР (ДМСО-d6, 300 МГц)1,69-1,79 (m, 2 Н), 2,36-2,51 (m, 4 Н), 3,55-3,58 (m, 4 Н), 3,60 (s, 3H),3,64-3,68 (m, 4 Н), 6,87 (d, 1H), 7,29-7,39 (m, 3H), 7,64 (dd, 1H), 8,30 (d, 1H), 9,58 (s, 1H). Пример получения 80. 6-[5-Хлор-2-(3,5-диметил-4-изоксазолил)сульфонил]амино]фенил]-5 гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 55, начиная с 3,5-диметил-4-изоксазолсульфонилхлорида, ожидаемый продукт получают в форме желтого порошка (выход = 62%). Т.пл. = 107-109 С. Пример получения 81. 6-[5-Хлор-2-(1,3,5-триметил-1H-пиразол-4-ил)сульфонил]амино]фенил]-5 гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 55, начиная с 1,3,5-триметил-1H-пиразол-4 сульфонилхлорида, ожидаемый продукт получают в форме желтого масла (выход = 86%). 1 Н ЯМР (ДМСО-d6, 250 МГц)1,73-1,81 (m, 2 Н), 2,05 (s, 3H), 2,15 (s, 3H), 2,36 (d, 2H), 2,42 (d, 2H),3,61 (s, 3H), 3,62 (s, 3H), 7,31-7,41 (m, 3H), 9,38 (s, 1H). Пример получения 82. 6-[5-Хлор-2-(1-метил-1H-имидазол-4-ил)сульфонил]амино]фенил]-5 гексиновой кислоты метиловый эфир.- 16013795 Следуя методике, аналогичной примеру получения 55, начиная с 1-метил-1H-имидазол-4-сульфонилхлорида, ожидаемый продукт получают в форме желтого порошка (выход = 89%). Т.пл. = 76-79 С. Пример получения 83. 6-[2-(2,1,3-Бензотиадиазол-4-ил)сульфонил]амино]-5-хлорфенил]-5 гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 55, начиная с 2,1,3-бензотиадиазол-4-сульфонилхлорида, ожидаемый продукт получают в форме желтого масла (выход = 87%). 1 Н ЯМР (ДМСО-d6, 300 МГц)1,49-1,59 (m, 2H), 2,03 (t, 2H), 2,32 (t, 2H), 3,60 (s, 3H), 7,25-7,38 (m,3H), 7,82 (dd, 1H), 8,13 (dd, 1H), 8,37 (dd, 1H), 9,83 (s, 1H). Пример получения 84. 6-[2-(2,1,3-Бензотиадиазол-5-ил)сульфонил]амино]-5-хлорфенил]-5 гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 55, начиная с 2,1,3-бензотиадиазол-5-сульфонилхлорида, ожидаемый продукт получают в форме желтого масла (выход = 22%). 1 Н ЯМР (ДМСО-d6, 300 МГц)1,52-1,62 (m, 2H), 2,20 (t, 2H), 2,33 (t, 2H), 3,59 (s, 3H), 7,31-7,40 (m,3H), 7,95 (dd, 1H), 8,31 (dd, 1H), 8,36 (dd, 1H), 10,3 (s, 1H). Пример получения 85. 6-[5-Хлор-2-(3,4-дигидро-2,2-диметил-2H-1-бензопиран-6-ил)сульфонил]амино]фенил]-5-гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 55, начиная с 3,4-дигидро-2,2-диметил-2 Н-1 бензопиран-6-сульфонилхлорида, ожидаемый продукт получают в форме желтого масла (выход = 88%). 1 Н ЯМР (ДМСО-d6, 300 МГц)1,28 (s, 6H), 1,70-1,79 (m, 4H), 2,35-2,51 (m, 4 Н), 2,72 (t, 2 Н), 3,60 (s,3H), 6,80 (d, 1 Н), 7,25-7,65 (m, 5 Н), 9,48 (s, 1H). Пример получения 86. 6-[5-Хлор-2-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафталинил)сульфонил]амино]фенил]-5-гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 55, начиная с 5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафталинсульфонилхлорида, ожидаемый продукт получают в форме желтого порошка (выход = 65%). Т.пл. = 113-115 С. Пример получения 87. 6-[2-(1-Ацетил-2,3-дигидро-1 Н-индол-5-ил)сульфонил]амино]-5-хлорфенил]-5-гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 55, начиная с 1-ацетил-2,3-дигидро-1H-индол-5 сульфонилхлорида, ожидаемый продукт получают в форме пастообразного твердого вещества (выход = 88%). 1 Н ЯМР (ДМСО-d6, 250 МГц)1,68-1,80 (m, 2H), 2,17 (s, 3H), 2,39 (t, 2H), 2,43 (t, 2 Н), 3,14 (t, 2 Н),3,61 (s, 3H), 4,14 (t, 2 Н), 7,25 (dd, 1 Н), 7,32-7,37 (m, 2 Н), 7,48 (d, 1H), 7,52 (d, 1H), 8,07 (d, 1H), 9,59 (s, 1H). Пример получения 88. 6-[5-Хлор-2-(2-метил-6-бензотиазолил)сульфонил]амино]фенил]-5-гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 55, начиная с 2-метил-6-бензотиазолсульфонилхлорида, ожидаемый продукт получают в форме желтого твердого вещества (выход = 68%). Т.пл. = 103-106 С. Пример получения 89. 6-[2-2-(Ацетиламино)-6-бензотиазолил]сульфонил]амино]-5-хлорфенил]5-гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 55, начиная с 2-(ацетиламино)-6-бензотиазолсульфонилхлорида, ожидаемый продукт получают в форме белого порошка (выход = 80%). Т.пл. = 138-140 С. Пример получения 90. 6-[2-(2-Амино-6-бензотиазолил)сульфонил]амино]-5-хлорфенил]-5 гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 55, начиная с 2-амино-6-бензотиазолсульфонилхлорида, ожидаемый продукт получают в форме оранжевого твердого вещества (выход = 96%). Т.пл. = 61-65 С. Пример получения 91. 6-[5-Хлор-2-(2-метил-6-бензоксазолил)сульфонил]амино]фенил]-5 гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 55, начиная с 2-метил-6-бензоксазолсульфонилхлорида, ожидаемый продукт получают в форме оранжевого масла (выход = 93%). 1 Н ЯМР (ДМСО-d6, 250 МГц)1,65 (m, 2H), 2,15 (t, 2H), 2,39 (t, 2H), 2,65 (s, 3H), 3,61 (s, 3H), 7,267,39 (m, 3H), 7,65 (dd, 1H), 7,81 (d, 1H), 7,95 (s, 1H), 9,93 (s, 1H). Пример получения 92. 6-[5-Хлор-2-(2,3-дигидро-5-бензофуранил)сульфонил]амино]фенил]-5 гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 55, начиная с 2,3-дигидро-5-бензофурансульфонилхлорида, ожидаемый продукт получают в форме оранжевого масла (выход = 99%). 1 Н ЯМР (ДМСО-d6, 300 МГц)1,76 (m, 2H), 2,40-2,49 (m, 4H), 3,23 (t, 2H), 3,85 (s, 3H), 4,62 (t, 2 Н),6,85 (d, 1 Н), 7,25-7,45 (m, 4 Н), 7,77 (s, 1H), 9,51 (s, 1H).- 17013795 Пример получения 93. 6-[5-Хлор-2-(2-метил-5-бензотиазолил)сульфонил]амино]фенил]-5 гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 55, начиная с 2-метил-5-бензотиазолсульфонилхлорида, ожидаемый продукт получают в форме желтого твердого вещества (выход = 42%). Т.пл. = 68-72 С. Пример получения 94. 6-[2-(2-Амино-6-бензоксазолил)сульфонил]амино]-5-хлорфенил]-5 гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 55, начиная с 2-амино-6-бензоксазолсульфонилхлорида, ожидаемый продукт получают в форме белого твердого вещества (выход = 9%). Т.пл. = 135 С. Пример получения 95. 6-[2-2-(Ацетиламино)-4-метил-5-тиазолил]сульфонил]амино]-5 хлорфенил]-5-гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 55, начиная с 2-(ацетиламино)-4-метил-5 тиазолсульфонилхлорида, ожидаемый продукт получают в форме белого порошка (выход = 62%). Т.пл. = 147-149 С. Пример получения 96. 6-[5-Хлор-2-(1,2,3,4-тетрагидро-2-оксо-6-хинолинил)сульфонил]амино]фенил]-5-гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 55, начиная с 1,2,3,4-тетрагидро-2-оксо-6 хинолинсульфонилхлорида, ожидаемый продукт получают в форме желтого порошка (выход = 27%). Т.пл. = 53-57 С. Пример получения 97. 5-[2-(6-Бензотиазолил)сульфонил]амино]-5-хлорфенил]-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 3, начиная с 6-бензотиазолсульфонилхлорида,ожидаемый продукт получают в форме желтого масла (выход = 92%). 1 Н ЯМР (ДМСО-d6, 300 МГц)2,44 (s, 4 Н), 3,63 (s, 3H), 7,26-7,39 (m, 3H), 7,25-7,65 (m, 5 Н), 7,80(dd, 1H), 8,21 (dd, 1H), 8,62 (d, 1H), 9,62 (s, 1H), 9,88 (s, 1H). Пример получения 98. 5-[2-2-(Ацетиламино)-6-бензотиазолил]сульфонил]амино]-5-хлорфенил]4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 3, начиная с 2-(ацетиламино)-6-бензотиазолсульфонилхлорида, ожидаемый продукт получают в форме бежевого твердого вещества (выход = 99%). Т.пл. = 85 С. Пример получения 99. 5-[2-(1-Ацетил-2,3-дигидро-1H-индол-5-ил)сульфонил]амино]-5 хлорфенил]-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 3, начиная с 1-ацетил-2,3-дигидро-1H-индол-5 сульфонилхлорида, ожидаемый продукт получают в форме бежевого твердого вещества (выход = 84%). Т.пл. = 154 С. Пример получения 100. 5-[2-(1,3-Бензодиоксол-5-ил)сульфонил]амино]-5-хлорфенил]-4 пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 3, начиная с 1,3-бензодиоксол-5-сульфонилхлорида, ожидаемый продукт получают в форме коричневого масла (выход = 98%). 1 Н ЯМР (ДМСО-d6, 300 МГц)2,60 (s, 4H), 3,65 (s, 3H), 6,15 (s, 2 Н), 7,01 (d, J = 8,73 Гц, 1H), 7,20(dd, 2H), 7,27 (s, H), 7,30-7,38 (m, 2H). Пример получения 101. 6-[2-(1,3-Бензодиоксол-5-ил)сульфонил]амино]-5-хлорфенил]-5 гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 55, начиная с 1,3-бензодиоксол-5 сульфонилхлорида, ожидаемый продукт получают в форме коричневого масла (выход = 89%). 1 Н ЯМР (ДМСО-d6, 300 МГц)1,76 (m, 2 Н), 2,37-2,45 (m, 4 Н), 3,61 (s, 3H), 6,14 (s, 2 Н), 7,0 (d, 1 Н),7,38-7,71 (m, 5 Н), 9,68 (s, 1H). Пример получения 102. 6-[5-Хлор-2-4-(4-морфолинилсульфонил)фенил]сульфонил]амино]фенил]-5-гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 55, начиная с 4-(4-морфолинилсульфонил)бензолсульфонилхлорида, ожидаемый продукт получают в форме белого твердого вещества (выход= 66%). Т.пл. = 135-139 С. Пример получения 103. 6-[2-Амино-5-(трифторметил)фенил]-5-гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 5, начиная с метилового эфира 5-гексиновой кислоты, ожидаемый продукт получают в форме коричневого масла (выход = 84%). 1 Н ЯМР (ДМСО-d6, 250 МГц)1,86 (q, 2H), 2,45-2,54 (m, 4H), 3,6 (s, 3H), 5,96 (s, NH2), 6,78 (d, 1H),7,30 (dd, 1H), 7,36 (d, 1H). Пример получения 104. 5-[2-(6-Бензотиазолил)сульфонил]амино]-5-(трифторметил)фенил]-4- 18013795 пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 97, начиная с метилового эфира 5-[2-амино-5(трифторметил)фенил]-4-пентиновой кислоты (пример получения 5), ожидаемый продукт получают в форме оранжевого масла (выход = 83%). 1 Н ЯМР (ДМСО-d6, 500 МГц)2,53 (d, 2H), 2,55 (d, 2H), 3,65 (s, 3H), 6,80 (d, 1 Н), 7,54-7,66 (m, 3H),7,90 (dd, J1H), 8,22 (d, 1H), 8,73 (d, 1H), 9,63 (s, 1H), 10,13 (s, 1 Н). Пример получения 105. 6-[2-(2-Метил-6-бензоксазолил)сульфонил]амино]-5-(трифторметил)фенил]-5-гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 91, начиная с метилового эфира 6-[2-амино-5(трифторметил)фенил]-5-гексиновой кислоты (пример получения 103) и 2-метил-6-бензоксазолсульфонилхлорида, ожидаемый продукт получают в форме оранжевого масла (выход = 54%). 1 Н ЯМР (ДМСО-d6, 300 МГц)1,65-1,75 (m, 2 Н), 2,33-2,43 (m, 4 Н), 2,65 (s, 3H), 3,60 (s, 3H), 7,49 (d,1H), 7,62 (s, 1H), 7,63 (d, 1H), 7,74 (dd, 1H), 7,82 (d, 1H), 8,07 (s, 1H), 10,16 (s, 1H). Пример получения 106. 6-[2-(1-Ацетил-2,3-дигидро-1H-индол-5-ил)сульфонил]амино]-5(трифторметил)фенил]-5-гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 105, начиная с 1-ацетил-2,3-дигидро-1H-индол 5-сульфонилхлорида, ожидаемый продукт получают в форме пастообразного твердого вещества (выход= 56%). 1 Н ЯМР (ДМСО-d6, 300 МГц)1,74-1,83 (m, 2H), 2,16 (s, 3H), 2,43-2,48 (m, 4 Н), 3,15 (t, 2 Н), 3,61 (s,3H), 4,13 (t, 2 Н), 7,44-7,47 (m, 1 Н), 7,58-7,61 (m, 4 Н), 8,07-8,10 (m, 1 Н), 9,86 (s, 1H). Пример получения 107. 6-[2-(2,3-Дигидро-5-бензофуранил)сульфонил]амино]-5-(трифторметил)фенил]-5-гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 105, начиная с 2,3-дигидро-5-бензофурансульфонилхлорида, ожидаемый продукт получают в форме желтой пасты (выход = 19%). 1 Н ЯМР (ДМСО-d6, 250 МГц)1,80 (t, 2H), 2,43-2,51 (m, 4H), 3,21 (t, 2H), 3,61 (s, 3H), 4,62 (t, 2H),6,87 (d, 1H), 7,48 (d, 1H), 7,55 (dd, 1H), 7,60-7,67 (m, 3H), 9,77 (s, 1 Н). Пример получения 108. 6-[2-(2-Метил-5-бензотиазолил)сульфонил]амино]-5-(трифторметил)фенил]-5-гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 105, начиная с 2-метил-5-бензотиазолсульфонилхлорида, ожидаемый продукт получают в форме желтой пасты (выход = 17%). 1 Н ЯМР (ДМСО-d6, 250 МГц)1,61-1,73 (m, 2H), 2,32 (t, 2H), 2,38 (t, 2H), 2,83 (s, 3H), 3,60 (s, 3H),7,52 (d, 1H), 7,60-7,66 (m, 3H), 7,72 (dd, 1H), 8,23 (d, 1H), 8,25 (s, 1 Н), 10,19 (s, 1H). Пример получения 109. 5-[2-(2-Амино-6-бензотиазолил)сульфонил]амино]-5-(трифторметил)фенил]-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 104, начиная с 2-амино-6-бензотиазолсульфонилхлорида, ожидаемый продукт получают в форме желтого масла (выход = 69%). 1 Н ЯМР (ДМСО-d6, 250 МГц)2,65 (m, 4H), 3,68 (s, 3H), 7,40 (d, 1H), 7,54-7,66 (m, 4 Н), 7,99 (s, 2H),8,19 (d, 1H), 9,71 (s, 1H). Пример получения 110. 5-[2-(2-Метил-6-бензотиазолил)сульфонил]амино]-5-(трифторметил)фенил]-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 104, начиная с 2-метил-6-бензотиазолсульфонилхлорида, ожидаемый продукт получают в форме желтого масла (выход = 24%). 1 Н ЯМР (ДМСО-d6, 300 МГц)2,54 (m, 4H), 2,84 (s, 3H), 3,65 (s, 3H), 7,53 (m, 2 Н), 7,56 (m, 1H), 7,65(dd, 1H), 7,83 (dd, 1H), 8,05 (dd, 1H), 8,57 (d, 1H), 10,05 (s, 1H). Пример получения 111. 5-[2-(2-Метил-5-бензотиазолил)сульфонил]амино]-5-(трифторметил)фенил]-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 104, начиная с 2-метил-5-бензотиазолсульфонилхлорида, ожидаемый продукт получают в форме желтого масла (выход = 46%). 1 Н ЯМР (ДМСО-d6, 250 МГц)2,55 (m, 4H), 2,83 (s, 3H), 3,65 (s, 3H), 7,55 (m, 2 Н), 7,66 (dd, 1H),7,72 (dd, 1H), 8,24 (d, 1H), 8,30 (d, 1H), 10,09 (s, 1H). Пример получения 112. 5-[2-(2-Метил-6-бензоксазолил)сульфонил]амино]-5-(трифторметил)фенил]-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 104, начиная с 2-метил-6-бензоксазолсульфонилхлорида, ожидаемый продукт получают в форме белого порошка (выход = 41%). 1 Н ЯМР (ДМСО-d6, 250 МГц)2,56 (m, 4H), 2,66 (s, 3H), 3,65 (s, 3H), 7,55 (m, 2 Н), 7,62 (d, 1H), 7,75(dd, 1H), 7,83 (dd, 1H), 8,12 (dd, 1H), 10,04 (s, 1H). Пример получения 113. 5-[2-(2-Метил-7-бензотиазолил)сульфонил]амино]-5-(трифторметил)фенил]-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 104, начиная с 2-метил-7-бензотиазолсульфонилхлорида, ожидаемый продукт получают в форме оранжевого масла (выход = 32%). 1 Н ЯМР (ДМСО-d6, 250 МГц)2,40 (m, 4H), 2,78 (s, 3H), 3,64 (s, 3H), 7,68 (m, 3H), 8,17 (dd, 1H),- 19013795 10,40 (s, 1H). Пример получения 114. 5-[2-(1-Ацетил-2,3-дигидро-1H-индол-5-ил)сульфонил]амино]-5-(трифторметил)фенил]-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 104, начиная с 1-ацетил-2,3-дигидро-1 Н-индол 5-сульфонилхлорида, ожидаемый продукт получают в форме желтого твердого вещества (выход = 32%). 1 Н ЯМР (ДМСО-d6, 300 МГц)2,63 (m, 4H), 3,16 (t, 2H), 3,66 (s, 3H), 4,13 (t, 2 Н), 7,50 (d, 1H), 7,62(m, 4H), 8,10 (d, 1H), 9,74 (s, 1H). Пример получения 115. 5-[2-(2,3-Дигидро-5-бензофуранил)сульфонил]амино]-5-(трифторметил)фенил]-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 104, начиная с 2,3-дигидро-5-бензофурансульфонилхлорида, ожидаемый продукт получают в форме желтого масла (выход = 53%). 1 Н ЯМР (ДМСО-d6, 250 МГц)2,66 (m, 4H), 3,20 (t, 2H), 3,66 (s, 3H), 4,63 (t, 2 Н), 6,88 (d, 1 Н), 7,59(m, 5 Н), 9,65 (s, 1H). Пример получения 116. 5-[2-4-(4-Морфолинилсульфонил)фенил]сульфонил]амино]-5-(трифторметил)фенил]-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 104, начиная с 4-(4-морфолинилсульфонил)бензолсульфонилхлорида, ожидаемый продукт получают в форме желтого масла (выход = 56%). 1 Н ЯМР (ДМСО-d6, 250 МГц)2,60 (s, 4H), 2,88 (t, 4H), 3,60 (t, 4H), 3,65 (s, 3H), 7,53 (s, 1H), 7,58 (d,1H), 7,92 (dd, 1H), 7,99 (dd, 2H), 10,37 (s, 1H). Пример получения 117. N-(4-хлор-2-йодфенил)-2-пиридинсульфонамид. Готовят раствор 1 г (3,95 мМ) 4-хлор-2-йоданилина и 0,65 мл пиридина в 10 мл дихлорметана и добавляют 1,68 г (9,5 мМ) 2-пиридинсульфонилхлорида при 0 С при перемешивании. Затем эту реакционную смесь перемешивают при комнатной температуре в течение 16 ч, а затем концентрируют при пониженном давлении. Остаточное масло очищают хроматографией на силикагеле, используя смесь циклогексан/этилацетат (8/2; об./об.) в качестве элюента, с получением 0,74 г ожидаемого продукта в форме белого твердого вещества (выход = 48%). Т.пл. = 112-124 С. Пример получения 118. 6-[2-(6-Бензотиазолил)сульфонил]амино]-5-(трифторметил)фенил]-5 гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 105, начиная с 6-бензотиазолсульфонилхлорида,ожидаемый продукт получают в форме оранжевой пасты (выход = 59%). 1 Н ЯМР (ДМСО-d6, 250 МГц)1,62-1,73 (m, 2H), 2,32 (t, 2H), 2,39 (t, 2H), 3,60 (s, 3H), 7,51 (d, 1 Н),7,61-7,65 (m, 2 Н), 7,89 (dd, 1H), 8,23 (d, 1H), 8,69 (s, 1H), 9,62 (s, 1 Н), 10,22 (s, 1H). Пример получения 119. 5-(Трифторметил)-1H-индол-2-бутановой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 6, начиная с эфира, полученного согласно примеру получения 103, ожидаемый продукт получают в форме бежевого твердого вещества (выход = 36%). Т.пл. = 115 С. Пример получения 120. N-(4-хлор-2-йодфенил)бензолсульфонамид. Готовят раствор 2 г (7,89 мМ) 4-хлор-2-йоданилина в 30 мл пиридина и добавляют 1,21 мл (9,5 мМ) бензолсульфонилхлорида при 0 С при перемешивании. Затем реакционную смесь перемешивают при комнатной температуре в течение 16 ч, а затем концентрируют при пониженном давлении. Остаточное масло растворяют в 50 мл этилацетата и полученный раствор промывают водой, а затем высушивают над сульфатом магния и концентрируют при пониженном давлении. Анализ сырого продукта показал присутствие примерно 12% N-(4-хлор-2-йодфенил)-N-(фенилсульфонил)бензолсульфонамида. Поэтому этот сырой продукт растворяют в 60 мл диоксана до растворения и обрабатывают 19 мл 3 М раствора гидроксида калия при слабом кипении с обратным холодильником в течение 8 ч. Растворитель отгоняют при пониженном давлении и остаток растворяют в воде и подкисляют до рН 2 разбавленным раствором соляной кислоты. Образовавшийся осадок отфильтровывают, промывают водой на фильтре и высушивают с получением 2,79 г ожидаемого продукта в форме белого твердого вещества (выход = 90%). Т.пл. = 126-128 С. Пример получения 121. N-[2-йод-4-(трифторметил)фенил]бензолсульфонамид. Следуя методике, аналогичной примеру получения 120, начиная с 2-йод-4-(трифторметил)анилина,ожидаемый продукт получают в форме белого твердого вещества (выход = 74%). Т.пл. = 84-86 С. Пример получения 122. 2-3-(2-Амино-5-хлорфенил)-2-пропинил]окси]-2-метилпропановой кислоты метиловый эфир. Готовят смесь 2 г (7,89 мМ) 4-хлор-2-йоданилина, 75 мг (0,395 мМ) йодида меди, 277 мг (0,39 мМ) бис(трифенилфосфин)дихлорпалладия, 221 мг (0,79 мМ) три(циклогексил)фосфина, 3,08 г (19,7 мМ) метилового эфира 2-метил-2-(2-пропинилокси)пропановой кислоты и 15 мл трет-бутиламина. Реакционную смесь осторожно кипятят с обратным холодильником в течение 16 ч, а затем охлаждают, подвергают гидролизу в 60 мл воды и экстрагируют 340 мл дихлорметана. Объединенные органические фазы про- 20013795 мывают водой, а затем высушивают над сульфатом магния и концентрируют при пониженном давлении. Остаточное масло очищают хроматографией на силикагеле, используя смесь дихлорметан/этилацетат(выход = 83%). 1 Н ЯМР (ДМСО-d6, 250 МГц)1,41 (s, 6H), 3,66 (s, 3H), 4,40 (s, 2H), 5,22 (широкий s, 2H), 6,69 (d,1H), 7,07 (dd, 1H), 7,13 (d, 1H). Пример получения 123. 2-3-[2-(6-Бензотиазолил)сульфонил]амино]-5-хлорфенил]-2-пропинил]окси]-2-метилпропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 117, начиная с соединения, полученного согласно примеру получения 122, и 6-бензотиазолсульфонилхлорида, ожидаемый продукт получают в форме желтого масла (выход = 53%). 1 Н ЯМР (ДМСО-d6, 300 МГц)1,63 (s, 6H), 3,67 (s, 3H), 4,14 (s, 2H), 7,30 (d, 1 Н), 7,38 (d, 1H), 7,41(dd, 1H), 7,85 (dd, 1H), 8,23 (d, 1H), 8,62 (d, 1H), 9,61 (s, 1H), 10,05 (s, 1H). Пример получения 124. 2-3-[2-Амино-5-(трифторметил)фенил]-2-пропинил]окси]-2-метилпропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 122, начиная с 2-йод-5-(трифторметил)анилина,ожидаемый продукт получают в форме оранжевого масла (выход = 80%). 1 Н ЯМР (ДМСО-d6, 300 МГц)1,42 (s, 6H), 3,65 (s, 3H), 4,41 (s, 2H), 6,08 (s, 2 Н), 6,79 (d, 1H), 7,34(d, 1H), 7,39 (s, 1H). Пример получения 125. 2-3-[2-(6-Бензотиазолил)сульфонил]амино]-5-(трифторметил)фенил]-2 пропинил]окси]-2-метилпропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 123, начиная с соединения, полученного согласно примеру получения 124, и 6-бензотиазолсульфонилхлорида, ожидаемый продукт получают в форме желтой пасты (выход = 23%). 1 Н ЯМР (ДМСО-d6, 300 МГц)1,38 (s, 6H), 3,67 (s, 3H), 4,25 (s, 2H), 7,52 (d, 1 Н), 7,66 (d, 2H), 7,94(dd, 1H), 8,24 (dd, 1H), 8,72 (d, 1H), 9,63 (s, 1H), 10,33 (s, 1H). Пример получения 126. 2-3-[2-(2-Метил-6-бензотиазолил)сульфонил]амино]-5-хлорфенил]-2 пропинил]окси]-2-метилпропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 117, начиная с соединения, полученного согласно примеру получения 122, и 2-метил-6-бензотиазолсульфонилхлорида, ожидаемый продукт получают в форме желтой пасты (выход = 58%). 1 Н ЯМР (ДМСО-d6, 250 МГц)1,36 (s, 6H), 2,84 (s, 3H), 3,68 (s, 3H), 4,14 (s, 2 Н), 7,28 (d, 1H), 7,36(d, 1H), 7,40 (dd, 1H), 7,78 (dd, 1H), 8,03 (d, 1H), 8,46 (d, 1H), 9,96 (s, 1H). Пример получения 127. 2-3-[2-(2-Метил-5-бензотиазолил)сульфонил]амино]-5-хлорфенил]-2 пропинил]окси]-2-метилпропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 117, начиная с соединения, полученного согласно примеру получения 122, и 2-метил-5-бензотиазолсульфонилхлорида, ожидаемый продукт получают в форме желтого масла (выход = 45%). 1 Н ЯМР (ДМСО-d6, 300 МГц)1,36 (s, 6H), 2,83 (s, 3H), 3,67 (s, 3H), 4,11 (s, 2 Н), 7,30 (d, 1H), 7,36(d, 1H), 7,41 (dd, 1H), 7,66 (dd, 1H), 8,18 (d, 1H), 8,21 (d, 1H), 10,01 (s, 1H). Пример получения 128. 2-3-(2-Амино-5-хлорфенил)-2-пропинил]окси]пропановой кислоты этиловый эфир. Следуя методике, аналогичной примеру получения 122, начиная с этилового эфира 2-(2-пропинилокси)пропановой кислоты, ожидаемый продукт получают в форме оранжевого масла (выход = 69%). 1 Н ЯМР (ДМСО-d6, 300 МГц)1,19 (t, 3H), 1,31 (d, 3H), 4,13 (q, 2H), 4,25 (q, 1 Н), 4,42 (d, 1H), 4,53(d, 1H), 5,56 (s, 2H), 6,69 (d, 1H), 7,08 (dd, 1H), 7,14 (d, 1H). Пример получения 129. 2-3-[2-(6-Бензотиазолил)сульфонил]амино]-5-хлорфенил]-2 пропинил]окси]пропановой кислоты этиловый эфир. Следуя методике, аналогичной примеру получения 123, начиная с соединения, полученного согласно примеру получения 128, и 6-бензотиазолсульфонилхлорида, ожидаемый продукт получают в форме белого твердого вещества (выход = 82%). Т.пл. = 166-168 С. Пример получения 130. 6-[2-(1,3-Бензодиоксол-5-ил)сульфонил]амино]-5-(трифторметил)фенил]5-гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 118, начиная с 1,3-бензодиоксол-5 сульфонилхлорида, ожидаемый продукт получают в форме коричневого масла, которое используют на следующей стадии без дальнейшей очистки (выход = 73%). Пример получения 131. 5-[2-2-(Ацетиламино)-6-бензотиазолил]сульфонил]амино]-5-(трифторметил)фенил]-4-пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 104, начиная с 2-(ацетиламино)-6 бензотиазолсульфонилхлорида, ожидаемый продукт получают в форме коричневого масла, которое ис- 21013795 пользуют на следующей стадии без дальнейшей очистки (выход = 66%). Пример получения 132. 2-3-[2-(2-Метил-5-бензотиазолил)сульфонил]амино]-5-(трифторметил)фенил]-2-пропинил]окси]-2-метилпропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 3, начиная с соединения, полученного согласно примеру получения 124, и 2-метил-5-бензотиазолсульфонилхлорида, ожидаемый продукт получают в форме оранжевого масла (выход = 16%). 1 Н ЯМР (ДМСО-d6, 300 МГц)10,30 (s, 1H), 8,27 (m, 2H), 7,76 (dd, 1H), 7,69 (m, 2 Н), 7,53 (d, 1H),4,22 (s, 2H), 3,67 (s, 3H), 2,83 (s, 3H), 1,39 (s, 6H). Пример получения 133. 2-3-[2-[(1,3-Бензодиоксол-5-илсульфонил)амино]-5-(трифторметил)фенил]-2-пропинил]окси]-2-метилпропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 3, начиная с соединения, полученного согласно примеру получения 124, и 1,3-бензодиоксол-5-сульфонилхлорида, ожидаемый продукт получают в форме желтого масла (выход = 21%). 1 Н ЯМР (ДМСО-d6, 250 МГц)9,99 (s, 1H), 7,69 (m, 2H), 7,47 (d, 1H), 7,34 (m, 2 Н), 7,04 (d, 1H), 6,15(s, 2H), 4,37 (s, 2H), 3,68 (s, 3H), 1,43 (s, 6H). Пример получения 134. 2-3-[2-2-(Ацетиламино)-6-бензотиазолил]сульфонил]амино]-5(трифторметил)фенил]-2-пропинил]окси]-2-метилпропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 3, начиная с соединения, полученного согласно примеру получения 124, и 2-(ацетиламино)-6-бензотиазолсульфонилхлорида, ожидаемый продукт получают в форме белого твердого вещества (выход = 63%). Т.пл. = 104-106 С. Пример получения 135. 2-3-[2-[(2,3-Дигидробензофуран-5-илсульфонил)амино]-5-(трифторметил)фенил]-2-пропинил]окси]-2-метилпропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 3, начиная с соединения, полученного согласно примеру получения 124, и 2,3-дигидро-5-бензофурансульфонилхлорида, ожидаемый продукт получают в форме желтого масла (выход = 87%). 1 Н ЯМР (ДМСО-d6, 250 МГц)9,88 (s, 1H), 7,68 (m, 3H), 7,61 (m, 1 Н), 7,49 (dd, 1H), 6,88 (d, 1H),4,63 (t, 2H), 4,38 (s, 2H), 3,68 (s, 3H), 3,22 (t, 2H), 1,43 (s, 6H). Пример получения 136. 2-3-[2-(2-Метил-7-бензотиазолил)сульфонил]амино]-5-(трифторметил)фенил]-2-пропинил]окси]-2-метилпропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 3, начиная с соединения, полученного согласно примеру получения 124, и 2-метил-7-бензотиазолсульфонилхлорида, ожидаемый продукт получают в форме желтого масла (выход = 44%). 1 Н ЯМР (ДМСО-d6, 250 МГц)10,57 (s, 1H), 8,15 (d, 1H), 7,75 (m, 1H), 7,64 (m, 3H), 7,46 (d, 1H),4,06 (s, 2H), 3,68 (s, 3H), 2,79 (s, 3H), 1,37 (s, 6H). Пример получения 137. 2-3-[2-(2,3-Дигидро-1,4-бензодиоксин-6-ил)сульфонил]амино]-5(трифторметил)фенил]-2-пропинил]окси]-2-метилпропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 3, начиная с соединения, полученного согласно примеру получения 124, и 2,3-дигидро-1,4-бензодиоксин-6-сульфонилхлорида, ожидаемый продукт получают в форме бежевой пасты (выход = 79%). 1 Н ЯМР (ДМСО-d6, 250 МГц)9,98 (s, 1H), 7,68 (m, 2H), 7,48 (d, 1H), 7,31 (m, 2 Н), 7,02 (d, 1 Н), 4,37(s, 2 Н), 4,29 (m, 4 Н), 3,68 (s, 3H), 1,43 (s, 6H). Пример получения 138. 2-3-[2-(3,4-Дигидро-4-метил-2H-1,4-бензоксазин-7-ил)сульфонил]амино]-5-(трифторметил)фенил]-2-пропинил]окси]-2-метилпропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 3, начиная с соединения, полученного согласно примеру получения 124, и 3,4-дигидро-4-метил-2H-1,4-бензоксазин-7-сульфонилхлорида, ожидаемый продукт получают в форме бежевого твердого вещества (выход = 69%). Т.пл. = 98-100 С. Пример получения 139. 2-3-[2-(1-Ацетил-2,3-дигидро-1H-индол-5-ил)сульфонил]амино]-5(трифторметил)фенил]-2-пропинил]окси]-2-метилпропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 3, начиная с соединения, полученного согласно примеру получения 124, и 1-ацетил-2,3-дигидро-1H-индол-5-сульфонилхлорида, ожидаемый продукт получают в форме бежевого твердого вещества (выход = 44%). Т.пл. = 134-136 С. Пример получения 140. 2-3-[2-(3,5-Диметилфенил)сульфонил]амино]-5-(трифторметил)фенил]2-пропинил]окси]-2-метилпропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 3, начиная с соединения, полученного согласно примеру получения 124, и 3,5-диметилбензолсульфонилхлорида, ожидаемый продукт получают в форме бежевого твердого вещества (выход = 70%). Т.пл. = 128-130 С. Пример получения 141. 2-3-[2-(2,5-Диметоксифенил)сульфонил]амино]-5-(трифторметил)фе- 22013795 нил]-2-пропинил]окси]-2-метилпропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 3, начиная с соединения, полученного согласно примеру получения 124, и 2,5-диметоксибензолсульфонилхлорида, ожидаемый продукт получают в форме желтого масла (выход = 76%). 1 Н ЯМР (ДМСО-d6, 300 МГц)9,13 (s, 1H), 7,13 (s, 1H), 7,66 (d, 1H), 7,56 (d, 1 Н), 7,32 (d, 1H), 7,20(dd, 1H), 7,15 (d, 1H), 4,42 (s, 2H), 3,76 (s, 3H), 3,74 (s, 3H), 3,68 (s, 3H), 1,42 (s, 6H). Пример получения 142. 2-3-[2-4-(1-Метилэтил)фенил]сульфонил]амино]-5-(трифторметил)фенил]-2-пропинил]окси]-2-метилпропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 3, начиная с соединения, полученного согласно примеру получения 124, и 4-(1-метилэтил)бензолсульфонилхлорида, ожидаемый продукт получают в форме желтого масла (выход = 77%). 1 Н ЯМР (ДМСО-d6, 250 МГц)10,08 (s, 1H), 8,23 (d, 1H), 8,03 (s, 1H), 7,92 (dd, 1 Н), 7,76 (d, 2 Н),7,67 (m, 2 Н), 7,46 (m, 4 Н), 4,33 (s, 2H), 3,67 (s, 3H), 2,96 (hep, 1 Н), 1,42 (s, 6H), 1,19 (d, 6H). Пример получения 143. 2-3-[2-[(1,3-Бензодиоксол-5-илсульфонил)амино]-5-хлорфенил]-2-пропинил]окси]-2-метилпропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 3, начиная с соединения, полученного согласно примеру получения 122, и 1,3-бензодиоксол-5-сульфонилхлорида, ожидаемый продукт получают в форме желтого масла (выход = 55%). 1 Н ЯМР (ДМСО-d6, 250 МГц)9,71 (s, 1H), 7,39 (m, 2H), 7,23 (m, 3H), 7,02 (d, 1 Н), 6,15 (s, 2H), 4,30(s, 2H), 3,67 (s, 3H), 1,42 (s, 6H). Пример получения 144. 2-3-[2-2-(Ацетиламино)-6-бензотиазолил]сульфонил]амино]-5 хлорфенил]-2-пропинил]окси]-2-метилпропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 3, начиная с соединения, полученного согласно примеру получения 122, и 2-(ацетиламино)-6-бензотиазолсульфонилхлорида, ожидаемый продукт получают в форме желтого твердого вещества (выход = 50%). Т.пл. = 80 С. Пример получения 145. 2-3-[2-(1-Ацетил-2,3-дигидро-1H-индол-5-ил)сульфонил]амино]-5 хлорфенил]-2-пропинил]окси]-2-метилпропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 3, начиная с соединения, полученного согласно примеру получения 122, и 1-ацетил-2,3-дигидро-1H-индол-5-сульфонилхлорида, ожидаемый продукт получают в форме желтой пасты (выход = 44%). 1 Н ЯМР (ДМСО-d6, 300 МГц)9,68 (s, 1H), 8,08 (d, 1H), 7,54 (m, 2H), 7,38 (m, 2 Н), 7,27 (dd, 1H),4,30 (s, 2H), 4,13 (t, 2H), 3,67 (s, 3H), 2,17 (s, 3H), 1,41 (s, 6H). Пример получения 146. 2-3-[5-Хлор-2-[(2,3-дигидробензофуран-5-илсульфонил)амино]фенил]-2 пропинил]окси]-2-метилпропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 3, начиная с соединения, полученного согласно примеру получения 122, и 2,3-дигидро-5-бензофурансульфонилхлорида, ожидаемый продукт получают в форме желтого масла (выход = 49%). 1 Н ЯМР (ДМСО-d6, 300 МГц)9,59 (s, 1H), 7,61 (d, 1H), 7,48 (dd, 1H), 7,39 (m, 2H), 7,27 (d, 1H), 6,85(d, 1H), 4,62 (t, 2H), 4,28 (s, 2H), 3,64 (s, 3H), 3,21 (t, 2H), 1,42 (s, 6H). Пример получения 147. 2-3-[5-Хлор-2-(2-метил-7-бензотиазолил)сульфонил]амино]фенил]-2 пропинил]окси]-2-метилпропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 3, начиная с соединения, полученного согласно примеру получения 122, и 2-метил-7-бензотиазолсульфонилхлорида, ожидаемый продукт получают в форме желтого масла (выход = 33%). 1 Н ЯМР (ДМСО-d6, 300 МГц)10,30 (s, 1H), 8,14 (dd, 1H), 7,64 (m, 2H), 7,41 (dd, 1H), 7,32 (d, 1H),7,26 (d, 1H), 3,91 (s, 2H), 3,67 (s, 3H), 2,79 (s, 3H), 1,34 (s, 6H). Пример получения 148. 2-3-[5-Хлор-2-(2,3-дигидро-1,4-бензодиоксин-6-ил)сульфонил]амино]фенил]-2-пропинил]окси]-2-метилпропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 3, начиная с соединения, полученного согласно примеру получения 122, и 2,3-дигидро-1,4-бензодиоксин-6-сульфонилхлорида, ожидаемый продукт получают в форме желтого масла (выход = 94%). 1 Н ЯМР (ДМСО-d6, 250 МГц)9,70 (s, 1H), 7,40 (m, 2H), 7,24 (m, 3H), 6,97 (d, 1 Н), 4,28 (m, 6 Н),3,67 (s, 3H), 1,41 (s, 6H). Пример получения 149. 2-3-[5-Хлор-2-(3,4-дигидро-4-метил-2H-1,4-бензоксазин-7-ил)сульфонил]амино]фенил]-2-пропинил]окси]-2-метилпропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 3, начиная с соединения, полученного согласно примеру получения 122, и 3,4-дигидро-4-метил-2H-1,4-бензоксазин-7-сульфонилхлорида, ожидаемый продукт получают в форме бежевого твердого вещества (выход = 69%). Т.пл. = 98-100 С. Пример получения 150. 2-3-[5-Хлор-2-4-(1-метилэтил)фенил]сульфонил]амино]фенил]-2-пропи- 23013795 нил]окси]-2-метилпропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 3, начиная с соединения, полученного согласно примеру получения 122, и 4-(1-метилэтил)бензолсульфонилхлорида, ожидаемый продукт получают в форме бежевого твердого вещества (выход = 86%). Т.пл. = 65-67 С. Пример получения 151. 2-3-[5-Хлор-2-(3,5-диметилфенил)сульфонил]амино]фенил]-2-пропинил]окси]-2-метилпропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 3, начиная с соединения, полученного согласно примеру получения 122, и 3,5-диметилбензолсульфонилхлорида, ожидаемый продукт получают в форме белого твердого вещества (выход = 62%). Т.пл. = 78-80 С. Пример получения 152. 2-3-[5-Хлор-2-(2,5-диметоксифенил)сульфонил]амино]фенил]-2-пропинил]окси]-2-метилпропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 3, начиная с соединения, полученного согласно примеру получения 122, и 2,5-диметоксибензолсульфонилхлорида, ожидаемый продукт получают в форме желтого масла (выход = 90%). 1 Н ЯМР (ДМСО-d6, 250 МГц)8,93 (s, 1H), 7,43 (d, 1H), 7,35 (m, 2H), 7,25 (d, 1 Н), 7,17 (m, 2 Н), 4,36(s, 2H), 3,77 (s, 3H), 3,73 (s, 3H), 3,68 (s, 3H), 1,41 (s, 6H). Пример получения 153. 2-3-[5-Хлор-2-(4-метоксифенил)сульфонил]амино]фенил]-2-пропинил]окси]-2-метилпропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 3, начиная с соединения, полученного согласно примеру получения 122, и 4-метоксибензолсульфонилхлорида, ожидаемый продукт получают в форме бежевого твердого вещества (выход = 83%). Т.пл. = 98-100 С. Пример получения 154. 2-3-[5-Хлор-2-(2-метил-6-бензотиазолил)сульфонил]амино]фенил]-2 пропинил]окси]пропановой кислоты этиловый эфир. Следуя методике, аналогичной примеру 3, начиная с соединения, полученного согласно примеру получения 128, и 2-метил-6-бензотиазолсульфонилхлорида, ожидаемый продукт получают в форме желтой пасты (выход = 49%). 1 Н ЯМР (ДМСО-d6, 300 МГц)10,04 (s, 1H), 8,45 (d, 1H), 8,03 (d, 1H), 7,78 (dd, 1 Н), 7,41 (m, 2 Н),7,27 (dd, 1 Н), 4,34 (d, 1 Н), 4,16 (m, 4 Н), 2,83 (s, 3H), 1,29 (d, 3H), 1,19 (t, 3H). Пример получения 155. 2-3-[5-Хлор-2-(2,3-дигидро-1,4-бензодиоксин-6-ил)сульфонил]амино]фенил]-2-пропинил]окси]пропановой кислоты этиловый эфир. Следуя методике, аналогичной примеру 3, начиная с соединения, полученного согласно примеру получения 128, и 2,3-дигидро-1,4-бензодиоксин-6-сульфонилхлорида, ожидаемый продукт получают в форме желтого масла (выход = 65%). 1 Н ЯМР (ДМСО-d6, 300 МГц)9,78 (s, 1H), 7,43 (dd, 2H), 7,25 (d, 1H), 7,19 (m, 2 Н), 6,97 (d, 1 Н), 4,45(d, 1 Н), 4,29 (m, 6 Н), 4,14 (m, 2 Н), 1,33 (d, 3H), 1,21 (t, 3H). Пример получения 156. 2-3-[5-Хлор-2-(3,4-дигидро-4-метил-2H-1,4-бензоксазин-7-ил)сульфонил]амино]фенил]-2-пропинил]окси]пропановой кислоты этиловый эфир. Следуя методике, аналогичной примеру 3, начиная с соединения, полученного согласно примеру получения 128, и 3,4-дигидро-4-метил-2H-1,4-бензоксазине-7-сульфонилхлорида, ожидаемый продукт получают в форме желтого масла (выход = 63%). 1 Н ЯМР (ДМСО-d6, 300 МГц)9,57 (s, 1H), 7,41 (m, 2 Н), 7,26 (d, 1H), 6,93 (m, 2 Н), 6,74 (d, 1 Н), 4,45(d, 1 Н), 4,26 (m, 4 Н), 4,15 (m, 2 Н), 3,26 (m, 2 Н), 2,79 (s, 3H), 1,32 (d, 3H), 1,21 (t, 3H). Пример получения 157. 2-3-[5-Хлор-2-(3,5-диметил-4-изоксазолил)сульфонил]амино]фенил]-2 пропинил]окси]пропановой кислоты этиловый эфир. Следуя методике, аналогичной примеру 3, начиная с соединения, полученного согласно примеру получения 128, и 3,5-диметил-4-изоксазолсульфонилхлорида, ожидаемый продукт получают в форме желтого масла (выход = 30%). 1 Н ЯМР (ДМСО-d6, 300 МГц)10,29 (s, 1H), 7,52 (m, 2H), 7,37 (d, 1H), 4,43 (d, 1 Н), 4,26 (m, 2 Н),4,15 (m, 2 Н), 2,27 (s, 3H), 2,16 (s, 3H), 1,32 (d, 3H), 1,22 (t, 3H). Пример получения 158. 2-3-[5-Хлор-2-(2,5-диметоксифенил)сульфонил]амино]фенил]-2 пропинил]окси]пропановой кислоты этиловый эфир. Следуя методике, аналогичной примеру 3, начиная с соединения, полученного согласно примеру получения 128, и 2,5-диметоксибензолсульфонилхлорида, ожидаемый продукт получают в форме желтого масла (выход = 62%). 1 Н ЯМР (ДМСО-d6, 300 МГц)9,11 (s, 1H), 7,46 (d, 1H), 7,37 (d, 1H), 7,29 (m, 1 Н), 7,24 (m, 1 Н), 7,16(m, 2 Н), 4,49 (d, 1 Н), 4,36 (d, 1 Н), 4,24 (q, 1 Н), 4,16 (m, 2 Н), 3,75 (s, 3H), 3,72 (s, 3H), 1,31 (d, 3H), 1,21 (t,3H). Пример получения 159. 2-3-[2-Амино-5-(трифторметил)фенил]-2-пропинил]окси]пропановой ки- 24013795 слоты этиловый эфир. Следуя методике, аналогичной примеру получения 122, начиная с соединения, полученного согласно примеру получения 4, и этилового эфира 2-(2-пропинилокси)пропановой кислоты, ожидаемый продукт получают в форме оранжевого масла (выход = 82%). 1 Н ЯМР (ДМСО-d6, 300 МГц)7,42 (d, 1H), 7,35 (dd, 1H), 6,80 (d, 1H), 6,11 (s, 2 Н), 4,54 (d, 1H), 4,43(d, 1H), 4,27 (q, 1H), 4,11 (m, 2H), 1,32 (d, 3H), 1,20 (t, 3H). Пример получения 160. 2-3-[2-(2-Метил-6-бензотиазолил)сульфонил]амино]-5-(трифторметил)фенил]-2-пропинил]окси]пропановой кислоты этиловый эфир. Следуя методике, аналогичной примеру 3, начиная с соединения, полученного согласно примеру получения 159, и 2-метил-6-бензотиазолсульфонилхлорида, ожидаемый продукт получают в форме желтого масла (выход = 44%). 1 Н ЯМР (ДМСО-d6, 300 МГц)10,33 (s, 1H), 8,55 (d, 1H), 8,06 (d, 1H), 7,87 (dd, 1 Н), 6,68 (m, 2 Н),7,50 (d, 1 Н), 4,43 (d, 1 Н), 4,26 (m, 2 Н), 4,15 (m, 2 Н), 2,84 (s, 3H), 1,31 (d, 3H), 1,20 (t, 3H). Пример получения 161. 2-3-[2-(6-Бензотиазолил)сульфонил]амино]-5-(трифторметил)фенил]-2 пропинил]окси]пропановой кислоты этиловый эфир. Следуя методике, аналогичной примеру 3, начиная с соединения, полученного согласно примеру получения 159, и 6-бензотиазолсульфонилхлорида, ожидаемый продукт получают в форме бледножелтого твердого вещества (выход = 28%). Т.пл. = 112-114 С. Пример получения 162. 2-3-[2-(2,3-Дигидро-1,4-бензодиоксин-6-ил)сульфонил]амино]-5-(трифторметил)фенил]-2-пропинил]окси]пропановой кислоты этиловый эфир. Следуя методике, аналогичной примеру 3, начиная с соединения, полученного согласно примеру получения 159, и 2,3-дигидро-1,4-бензодиоксин-6-сульфонилхлорида, ожидаемый продукт получают в форме желтого масла (выход = 68%). 1 Н ЯМР (ДМСО-d6, 300 МГц)10,07 (s, 1H), 7,70 (m, 2H), 7,48 (d, 1H), 7,29 (m, 2 Н), 7,00 (d, 1 Н),4,51 (d, 1 Н), 4,38 (d, 1 Н), 4,31 (m, 5 Н), 4,16 (m, 2 Н), 1,34 (d, 3H), 1,20 (t, 3H). Пример получения 163. 2-3-[2-(3,4-Дигидро-4-метил-2H-1,4-бензоксазин-7-ил)сульфонил]амино]-5-(трифторметил)фенил]-2-пропинил]окси]пропановой кислоты этиловый эфир. Следуя методике, аналогичной примеру 3, начиная с соединения, полученного согласно примеру получения 159, и 3,4-дигидро-4-метил-2H-1,4-бензоксазин-7-сульфонилхлорида, ожидаемый продукт получают в форме желтого масла (выход = 57%). 1 Н ЯМР (ДМСО-d6, 300 МГц)9,88 (s, 1H), 7,69 (m, 2H), 7,49 (d, 1H), 7,02 (m, 2 Н), 7,78 (d, 1 Н), 4,51(d, 1 Н), 4,37 (d, 1 Н), 4,28 (m, 3H), 4,15 (m, 2 Н), 3,27 (m, 2 Н), 2,80 (s, 3H), 1,33 (d, 3H), 1,20 (t, 3H). Пример получения 164. 2-3-[2-(2,5-Диметоксифенил)сульфонил]амино]-5-(трифторметил)фенил]-2-пропинил]окси]пропановой кислоты этиловый эфир. Следуя методике, аналогичной примеру 3, начиная с соединения, полученного согласно примеру получения 159, и 2,5-диметоксибензолсульфонилхлорида, ожидаемый продукт получают в форме желтого масла (выход = 65%). 1 Н ЯМР (ДМСО-d6, 250 МГц)9,29 (s, 1H), 7,74 (s, 1H), 7,67 (d, 1H), 7,56 (d, 1 Н), 7,31 (d, 1 Н), 7,18(m, 2 Н), 4,55 (d, 1 Н), 4,41 (d, 1 Н), 4,25 (q, 1 Н), 4,13 (m, 2 Н), 3,74 (s, 6H), 1,32 (d,3H), 1,20 (t, 3H). Пример получения 165. (2S)-2-3-[2-амино-5-хлорфенил]-2-пропинил]окси]пропановой кислоты этиловый эфир. а. Этиловый эфир (2S)-2-(2-пропинилокси)пропановой кислоты: Это соединение получают при выходе 24% путем взаимодействия пропаргилбромида с этиловым эфиром (S)-(-)-молочной кислоты, которая предварительно обработана гидридом натрия в тетрагидрофуране (т.кип. = 70-73 С при 13 гПа). б. Следуя методике, аналогичной примеру получения 122, начиная с этилового эфира (2S)-2-(2 пропинилокси)пропановой кислоты, ожидаемый продукт получают в форме желтого масла (выход = 99%). 1 Н ЯМР (ДМСО-d6, 300 МГц)7,14 (d, 1H), 7,08 (dd, 1H), 6,69 (d, 1H), 5,56 (s, 2 Н), 4,53 (d, 1H), 4,42(d, 1H), 4,25 (q, 1H), 4,13 (m, 2H), 1,30 (d, 3H), 1,21 (t, 3H). Пример получения 166. (2S)-2-3-[5-хлор-2-(6-бензотиазолил)сульфонил]амино]фенил]-2-пропинил]окси]пропановой кислоты этиловый эфир. Следуя методике, аналогичной примеру 3, начиная с соединения, полученного согласно примеру получения 165, и 6-бензотиазолсульфонилхлорида, ожидаемый продукт получают в форме белого твердого вещества (выход = 43%). 1 Н ЯМР (ДМСО-d6, 300 МГц)10,11 (s, 1H), 9,61 (s, 1H), 8,60 (d, 1H), 8,22 (d, 1H), 7,84 (dd, 1 Н),7,40 (m, 2 Н), 7,30 (d, 1 Н), 4,32 (d, 1 Н), 4,15 (m, 4 Н), 1,28 (d, 3H), 1,21 (t, 3H). Пример получения 167. (2R)-2-3-[2-амино-5-хлорфенил]-2-пропинил]окси]пропановой кислоты метиловый эфир. а. Метиловый эфир (2R)-2-(2-пропинилокси)пропановой кислоты: Это соединение получают при выходе 9,5% путем взаимодействия пропаргилбромида с метиловым эфиром (R)-(+)-молочной кислоты,- 25013795 которая предварительно обработана гидридом натрия в тетрагидрофуране (т.кип. = 81-88 С при атмосферном давлении). б. Следуя методике, аналогичной примеру получения 122, начиная с метилового эфира (2R)-2-(2 пропинилокси)пропановой кислоты, ожидаемый продукт получают в форме желтого масла (выход = 89%). 1 Н ЯМР (ДМСО-d6, 300 МГц)7,14 (d, 1H), 7,08 (dd, 1H), 6,69 (d, 1H), 5,57 (s, 2 Н), 4,53 (d, 1H), 4,41(d, 1H), 4,25 (q, 1H), 3,66 (s, 3H), 1,31 (d, 3H). Пример получения 168. (2R)-2-3-[5-хлор-2-(6-бензотиазолил)сульфонил]амино]фенил]-2-пропинил]окси]пропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 3, начиная с соединения, полученного согласно примеру получения 167, и 6-бензотиазолсульфонилхлорида, ожидаемый продукт получают в форме белого твердого вещества (выход = 65%). Т.пл. = 136 С. Пример получения 169. 6-[5-Хлор-2-(2-метил-7-бензотиазолил)сульфонил]амино]фенил]-5-гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 55, начиная с 2-метил-7-бензотиазолсульфонилхлорида, ожидаемый продукт получают в форме коричневого масла (выход = 97%). 1 Н ЯМР (ДМСО-d6, 300 МГц)10,21 (s, 1H), 8,13 (m, 1H), 7,60 (m, 2H), 7,38 (dd, 1 Н), 7,28 (m, 2 Н),3,61 (s, 3H), 2,78 (s, 3H), 2,33 (t, 2H), 2,04 (t, 2H), 1,55 (quin, 2H). Пример получения 170. 6-[2-(1-Ацетил-1H-индол-5-ил)сульфонил]амино]-5-хлорфенил]-5 гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 55, начиная с 1-ацетил-1H-индол-5 сульфонилхлорида, ожидаемый продукт получают в форме коричневого масла (выход = 79%). 1 Н ЯМР (ДМСО-d6, 300 МГц)9,72 (s, 1H), 8,42 (d, 1H), 8,00 (d, 1H), 7,99 (d, 1 Н), 7,62 (dd, 1H), 7,33(m, 3H), 6,87 (d, 1H), 3,59 (s, 3H), 2,67 (s, 3H), 2,35 (t, 2H), 2,27 (t,2H), 1,64 (quin, 2H). Пример получения 171. 5-[5-Хлор-2-(2-метил-7-бензотиазолил)сульфонил]амино]фенил]-4 пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру 3, начиная с соединения, полученного согласно примеру получения 2, и 2-метил-7-бензотиазолсульфонилхлорида, ожидаемый продукт получают в форме аморфного твердого вещества (выход = 45%). 1 Н ЯМР (ДМСО-d6, 300 МГц)10,15 (s, 1 Н), 8,15 (m, 1 Н), 7,60 (m, 2 Н), 7,40 (dd, 1 Н), 7,31 (d, 1 Н),7,23 (d, 1 Н), 3,63 (s, 3H), 2,79 (s, 3H), 2,37 (m, 2 Н), 2,25 (m, 2 Н). Пример получения 172. 5-[2-(2-Амино-6-бензоксазолил)сульфонил]амино]-5-хлорфенил]-4 пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру 3, начиная с соединения, полученного согласно примеру получения 2, и 2-амино-6-бензоксазолсульфонилхлорида, ожидаемый продукт получают в форме белого твердого вещества (выход = 9%). Т.пл. = 170-171 С. Пример получения 173. 5-[5-Хлор-2-(2,3-дигидро-5-бензофуранил)сульфонил]амино]фенил]-4 пентиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру 3, начиная с соединения, полученного согласно примеру получения 2, и 2,3-дигидро-5-бензофурансульфонилхлорида, ожидаемый продукт получают в форме аморфного твердого вещества (выход = 98%). 1 Н ЯМР (ДМСО-d6, 300 МГц)9,39 (s, 1H), 7,60 (d, 1H), 7,44 (dd, 1H), 7,31 (m, 3H), 6,85 (d, 1 Н), 4,62(t, 2 Н), 3,65 (s, 3H), 3,21 (t, 2 Н), 2,60 (m, 4 Н). Пример получения 174. 5-[2-(2-Амино-6-бензотиазолил)сульфонил]амино]-5-хлорфенил]-4-пентиновой кислоты метиловый эфир Следуя методике, аналогичной примеру 3, начиная с соединения, полученного согласно примеру получения 2, и 2-амино-6-бензотиазолсульфонилхлорида, ожидаемый продукт получают в форме белого твердого вещества (выход = 93%). Т.пл. = 175 С. Пример получения 175. N-(2-бром-4-метилфенил)-6-бензотиазолсульфонамид. Следуя методике, аналогичной примеру 3, начиная с 2-бром-4-метиланилина и 6-бензотиазолсульфонилхлорида, ожидаемый продукт получают в форме оранжевого твердого вещества (выход = 76%). Т.пл. = 171-174 С. Пример получения 176. N-(2-бром-4-метилфенил)бензолсульфонамид. Следуя методике, аналогичной примеру получения 120, начиная с 2-бром-4-метиланилина, ожидаемый продукт получают в форме бежевого твердого вещества (выход = 95%). 1 Н ЯМР (ДМСО-d6, 250 МГц)9,75 (s, 1H), 7,69 (m, 3H), 7,63 (m, 2 Н), 7,40 (s, 1 Н), 7,09 (d, 1H), 7,02- 26013795 Следуя методике, аналогичной примеру получения 120, начиная с 6-бензотиазолсульфонилхлорида и используя тетрабутиламмония фторид в реакции в ТГФ для удаления дважды конденсированного соединения, ожидаемый продукт получают в форме желтого твердого вещества (выход = 91%). Т.пл. = 162 С. Пример получения 178. 6-[5-Хлор-2-(4-фтор-3-нитрофенил)сульфонил]амино]фенил]-5-гексиновой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения 55, начиная с 4-фтор-3-нитробензолсульфонилхлорида и используя триэтиламин в качестве основного реагента, ожидаемый продукт получают в форме оранжевого масла (выход = 98%). 1 Н ЯМР (ДМСО-d6, 300 МГц)10,31 (s, 1H), 8,38 (dd, 1H), 8,00 (m, 1H), 7,81 (dd, 1 Н), 7,41 (s, 1 Н),7,38 (m, 1 Н), 7,23 (m, 1 Н), 3,60 (s, 3H), 2,41 (t, 2H), 2,34 (t, 2H), 1,68 (quin, 2H). Пример 9. 1-(Фенилсульфонил)-1H-индол-2-пропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 1, начиная с соединения, полученного согласно примеру получения 24, ожидаемый продукт получают в форме белого твердого вещества (выход = 75%). Т.пл. = 95-99 С. Пример 10. 1-(Фенилсульфонил)-1H-индол-2-пропановая кислота. Следуя методике, аналогичной примеру 2, начиная с соединения, полученного согласно примеру 9,ожидаемый продукт получают в форме белого твердого вещества (выход = 99%). Т.пл. = 180-185 С. Пример 11. 5-Хлор-1-[(4-метилфенил)сульфонил]-1H-индол-2-пропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 1, начиная с соединения, полученного согласно примеру получения 25, ожидаемый продукт получают в форме бежевого твердого вещества (выход = 89%). Т.пл. = 100-103 С. Пример 12. 5-Хлор-1-[(4-метилфенил)сульфонил]-1 Н-индол-2-пропановая кислота. Следуя методике, аналогичной примеру 2, начиная с соединения, полученного согласно примеру 11, ожидаемый продукт получают в форме бежевого твердого вещества (выход = 93%). Т.пл. =165-168 С. Пример 13. 5-Хлор-1-[(2,3-дихлорфенил)сульфонил]-1 Н-индол-2-пропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 1, начиная с соединения, полученного согласно примеру получения 26, ожидаемый продукт получают в форме желтого масла (выход = 96%). 1 Н ЯМР (ДМСО-d6, 300 МГц)= 2,77 (t, 2H), 3,15 (t, 2H), 3,59 (s, 3H), 6,65 (s, 1 Н), 7,26 (dd, 1H), 7,67(m, 3H), 7,84 (dd, 1H), 8,04 (dd, 1H). Пример 14. 5-Хлор-1-[(2,3-дихлорфенил)сульфонил]-1 Н-индол-2-пропановая кислота. Следуя методике, аналогичной примеру 2, начиная с соединения, полученного согласно примеру 13, ожидаемый продукт получают в форме белого твердого вещества (выход = 76%). Т.пл. = 163-166 С. Пример 15. 5-Хлор-1-[(3-метилфенил)сульфонил]-1H-индол-2-пропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 1, начиная с соединения, полученного согласно примеру получения 27, ожидаемый продукт получают в форме бежевого твердого вещества (выход = 68%). Т.пл. = 105-108 С. Пример 16. 5-Хлор-1-[(3-метилфенил)сульфонил]-1H-индол-2-пропановая кислота. Следуя методике, аналогичной примеру 2, начиная с соединения, полученного согласно примеру 15, ожидаемый продукт получают в форме белого твердого вещества (выход = 92%). Т.пл. = 161-165 С. Пример 17. 5-Хлор-1-[(2,4-дихлорфенил)сульфонил]-1H-индол-2-пропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 1, начиная с соединения, полученного согласно примеру получения 28, ожидаемый продукт получают в форме желтого масла (выход = 83%). 1 Н ЯМР (ДМСО-d6, 300 МГц)= 2,76 (t, 2H), 3,15 (t, 2H), 3,59 (s, 3H), 6,63 (s, 1 Н), 7,26 (dd, 1H), 7,71(m , 3H), 7,94 (m, 2H). Пример 18. 5-Хлор-1-[(2,4-дихлорфенил)сульфонил]-1H-индол-2-пропановая кислота. Следуя методике, аналогичной примеру 2, начиная с соединения, полученного согласно примеру 17, ожидаемый продукт получают в форме белого твердого вещества (выход = 76%). Т.пл. = 179-181 С. Пример 19. 5-Хлор-1-4-(трифторметил)фенил]сульфонил]-1H-индол-2-пропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 1, начиная с соединения, полученного согласно примеру получения 29, ожидаемый продукт получают в форме желтого твердого вещества (выход = 97%).- 27013795 Т.пл. = 82-86 С. Пример 20. 5-Хлор-1-4-(трифторметил)фенил]сульфонил]-1H-индол-2-пропановая кислота. Следуя методике, аналогичной примеру 2, начиная с соединения, полученного согласно примеру 19, ожидаемый продукт получают в форме бежевого твердого вещества (выход = 78%). Т.пл. = 179-182 С. Пример 21. 5-Хлор-1-[(4-метоксифенил)сульфонил]-1H-индол-2-пропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 1, начиная с соединения, полученного согласно примеру получения 30, ожидаемый продукт получают в форме желтого твердого вещества (выход = 68%). Т.пл. = 98-99 С. Пример 22. 5-Хлор-1-[(4-метоксифенил)сульфонил]-1H-индол-2-пропановая кислота. Следуя методике, аналогичной примеру 2, начиная с соединения, полученного согласно примеру 21, ожидаемый продукт получают в форме белого твердого вещества (выход = 86%). Т.пл. = 95-98 С. Пример 23. 1-[(4-Ацетилфенил)сульфонил]-5-хлор-1H-индол-2-пропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 1, начиная с соединения, полученного согласно примеру получения 31, ожидаемый продукт получают в форме желтого твердого вещества (выход = 93%). Т.пл. = 83-87 С. Пример 24. 1-[(4-Ацетилфенил)сульфонил]-5-хлор-1H-индол-2-пропановая кислота. Следуя методике, аналогичной примеру 2, начиная с соединения, полученного согласно примеру 23, ожидаемый продукт получают в форме желтого твердого вещества (выход = 70%). Т.пл. = 159-161 С. Пример 25. 5-Хлор-1-[(4-фенилфенил)сульфонил]-1H-индол-2-пропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 1, начиная с соединения, полученного согласно примеру получения 32, ожидаемый продукт получают в форме желтого масла (выход = 58%). 1 Н ЯМР (ДМСО-d6, 250 МГц)2,84 (t, 2H), 3,37 (t, 2H), 3,62 (s, 3H), 6,62 (s, 1H), 7,34 (dd, 1H), 7,47(m, 3H), 7,61 (s, 1H), 7,68 (dd, 2H), 7,88 (d, 4H), 8,07 (d, 1H). Пример 26. 5-Хлор-1-[(4-фенилфенил)сульфонил]-1H-индол-2-пропановая кислота. Следуя методике, аналогичной примеру 2, начиная с соединения, полученного согласно примеру 25, ожидаемый продукт получают в форме белого твердого вещества (выход = 78%). Т.пл. = 160-162 С. Пример 27. 5-Хлор-1-[(3-метоксифенил)сульфонил]-1H-индол-2-пропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 1, начиная с соединения, полученного согласно примеру получения 34, ожидаемый продукт получают в форме желтого твердого вещества (выход = 63%). Т.пл. = 106-109 С. Пример 28. 5-Хлор-1-[(3-метоксифенил)сульфонил]-1H-индол-2-пропановая кислота. Следуя методике, аналогичной примеру 2, начиная с соединения, полученного согласно примеру 27, ожидаемый продукт получают в форме белого твердого вещества (выход = 62%). Т.пл. = 182-184 С. Пример 29. 5-Хлор-1-[(2,5-диметоксифенил)сульфонил]-1H-индол-2-пропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 1, начиная с соединения, полученного согласно примеру получения 35, ожидаемый продукт получают в форме желтого твердого вещества (выход = 85%). Т.пл. = 120-124 С. Пример 30. 5-Хлор-1-[(2,5-диметоксифенил)сульфонил]-1H-индол-2-пропановая кислота. Следуя методике, аналогичной примеру 2, начиная с соединения, полученного согласно примеру 29, ожидаемый продукт получают в форме белого твердого вещества (выход = 88%). Т.пл. = 185-189 С. Пример 31. 5-Хлор-1-4-(1,1-диметилэтил)фенил]сульфонил]-1H-индол-2-пропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 1, начиная с соединения, полученного согласно примеру получения 36, ожидаемый продукт получают в форме бежевого твердого вещества (выход = 87%). Т.пл. = 130-133 С. Пример 32. 5-Хлор-1-4-(1,1-диметилэтил)фенил]сульфонил]-1H-индол-2-пропановая кислота. Следуя методике, аналогичной примеру 2, начиная с соединения, полученного согласно примеру 31, ожидаемый продукт получают в форме белого твердого вещества (выход = 98%). Т.пл. = 169-171 С. Пример 33. 5-Хлор-1-[(4-этилфенил)сульфонил]-1H-индол-2-пропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 1, начиная с соединения, полученного согласно примеру- 28013795 получения 37, ожидаемый продукт получают в форме желтого масла (выход = 86%). 1 Н ЯМР (ДМСО-d6, 300 МГц)1,12 (t, J = 7,56 Гц, 3H), 2,63 (q, 2H), 2,81 (t, J = 7,62 Гц, 2 Н), 3,28 (t, J= 4,08 Гц, 2 Н), 3,61 (s, 3H), 6,57 (s, 1H), 7,31 (dd, J = 8,9 Гц, 2,22 Гц, 1 Н), 7,45 (d, J = 12,8 Гц, 2 Н), 7,59 (s,1H), 7,74 (d, J = 12,78 Гц, 2 Н), 8,02 (d, J = 8,91, 1 Н). Пример 34. 5-Хлор-1-[(4-этилфенил)сульфонил]-1H-индол-2-пропановая кислота. Следуя методике, аналогичной примеру 2, начиная с соединения, полученного согласно примеру 33, ожидаемый продукт получают в форме белого твердого вещества (выход = 70%). Т.пл. = 130-133 С. Пример 35. 5-Хлор-1-4-(1-метилэтил)фенил]сульфонил]-1H-индол-2-пропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 1, начиная с соединения, полученного согласно примеру получения 38, ожидаемый продукт получают в форме белого твердого вещества (выход = 58%). Т.пл. = 90-94 С. Пример 36. 5-Хлор-1-4-(1-метилэтил)фенил]сульфонил]-1H-индол-2-пропановая кислота. Следуя методике, аналогичной примеру 2, начиная с соединения, полученного согласно примеру 35, ожидаемый продукт получают в форме белого твердого вещества (выход = 70%). Т.пл. = 150-154 С. Пример 37. 5-Хлор-1-[(4-пропилфенил)сульфонил]-1H-индол-2-пропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 1, начиная с соединения, полученного согласно примеру получения 39, ожидаемый продукт получают в форме белого твердого вещества (выход = 87%). Т.пл. = 85-88 С. Пример 38. 5-Хлор-1-[(4-пропилфенил)сульфонил]-1H-индол-2-пропановая кислота. Следуя методике, аналогичной примеру 2, начиная с соединения, полученного согласно примеру 37, ожидаемый продукт получают в форме желтого твердого вещества (выход = 92%). Т.пл. = 144-148 С. Пример 39. 5-Хлор-1-[(4-пентилфенил)сульфонил]-1H-индол-2-пропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 1, начиная с соединения, полученного согласно примеру получения 40, ожидаемый продукт получают в форме желтого масла (выход = 76%). 1 Н ЯМР (ДМСО-d6, 300 МГц)0,81 (t, 3H), 1,22 (m, 4H), 1,50 (m, 2H), 2,58 (t, 2 Н), 2,81 (t, 2H), 3,28(t, 2H), 3,61 (s, 3H), 6,58 (s, 1H), 7,31 (dd, 1H), 7,39 (d, 2H), 7,59 (d, 1H), 7,72 (d,2H), 8,02 (d, 1H). Пример 40. 5-Хлор-1-[(4-пентилфенил)сульфонил]-1H-индол-2-пропановая кислота. Следуя методике, аналогичной примеру 2, начиная с соединения, полученного согласно примеру 39, ожидаемый продукт получают в форме белого твердого вещества (выход = 79%). Т.пл. = 131-134 С. Пример 41. 5-Хлор-1-[(3,5-диметилфенил)сульфонил]-1H-индол-2-пропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 1, начиная с соединения, полученного согласно примеру получения 41, ожидаемый продукт получают в форме белого твердого вещества (выход = 90%). Т.пл. = 146-150 С. Пример 42. 5-Хлор-1-[(3,5-диметилфенил)сульфонил]-1H-индол-2-пропановая кислота. Следуя методике, аналогичной примеру 2, начиная с соединения, полученного согласно примеру 41, ожидаемый продукт получают в форме белого твердого вещества (выход = 88%). Т.пл. = 189-193 С. Пример 43. 5-Хлор-1-[(2,4,6-триметилфенил)сульфонил]-1H-индол-2-пропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 1, начиная с соединения, полученного согласно примеру получения 42, ожидаемый продукт получают в форме белого твердого вещества (выход = 75%). Т.пл. = 145-148 С. Пример 44. 5-Хлор-1-[(2,4,6-триметилфенил)сульфонил]-1H-индол-2-пропановая кислота. Следуя методике, аналогичной примеру 2, начиная с соединения, полученного согласно примеру 43, ожидаемый продукт получают в форме белого твердого вещества (выход = 50%). Т.пл. = 132-134 С. Пример 45. 5-Хлор-1-[(4-хлорфенил)сульфонил]-1H-индол-2-пропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 1, начиная с соединения, полученного согласно примеру получения 43, ожидаемый продукт получают в форме белого твердого вещества (выход = 98%). Т.пл. = 89-92 С. Пример 46. 5-Хлор-1-[(4-хлорфенил)сульфонил]-1H-индол-2-пропановая кислота. Следуя методике, аналогичной примеру 2, начиная с соединения, полученного согласно примеру 45, ожидаемый продукт получают в форме белого твердого вещества (выход = 81%).- 29013795 Т.пл. = 158-160 С. Пример 47. 5-Хлор-1-[(4-фторфенил)сульфонил]-1H-индол-2-пропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 1, начиная с соединения, полученного согласно примеру получения 44, ожидаемый продукт получают в форме белого твердого вещества (выход = 79%). Т.пл. = 129-131 С. Пример 48. 5-Хлор-1-[(4-фторфенил)сульфонил]-1H-индол-2-пропановая кислота. Следуя методике, аналогичной примеру 2, начиная с соединения, полученного согласно примеру 47, ожидаемый продукт получают в форме белого твердого вещества (выход = 78%). Т.пл. = 145-148 С. Пример 49. 5-Хлор-1-[(4-хлор-3-метилфенил)сульфонил]-1H-индол-2-пропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 1, начиная с соединения, полученного согласно примеру получения 45, ожидаемый продукт получают в форме желтого масла (выход = 59%). 1 Н ЯМР (ДМСО-d6, 300 МГц)2,35 (s, 3H), 2,82 (t, 2H), 3,27 (t, 2H), 3,60 (s, 3H), 6,61 (s, 1 Н), 7,31(dd, 1 Н), 7,62 (m, 3H), 7,90 (s, 1 Н), 8,00 (d, J = 9,48, 1 Н). Пример 50. 5-Хлор-1-[(4-хлор-3-метилфенил)сульфонил]-1H-индол-2-пропановая кислота. Следуя методике, аналогичной примеру 2, начиная с соединения, полученного согласно примеру 49, ожидаемый продукт получают в форме белого твердого вещества (выход = 81%). Т.пл. = 160-164 С. Пример 51. 5-Хлор-1-3-(трифторметил)фенил]сульфонил]-1H-индол-2-пропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 1, начиная с соединения, полученного согласно примеру получения 46, ожидаемый продукт получают в форме белого твердого вещества (выход = 39%). Т.пл. = 98-100 С. Пример 52. 5-Хлор-1-3-(трифторметил)фенил]сульфонил]-1H-индол-2-пропановая кислота. Следуя методике, аналогичной примеру 2, начиная с соединения, полученного согласно примеру 51, ожидаемый продукт получают в форме белого твердого вещества (выход = 81%). Т.пл. = 203-206 С. Пример 53. 1-4-(Ацетиламино)фенил]сульфонил]-5-хлор-1H-индол-2-пропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 1, начиная с соединения, полученного согласно примеру получения 47, ожидаемый продукт получают в форме бежевого твердого вещества (выход = 71%). Т.пл. = 154-157 С. Пример 54. 5-Хлор-1-[(4-цианофенил)сульфонил]-1H-индол-2-пропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 1, начиная с соединения, полученного согласно примеру получения 48, ожидаемый продукт получают в форме бежевого твердого вещества (выход = 72%). Т.пл. = 155-159 С. Пример 55. 5-Хлор-1-[(4-феноксифенил)сульфонил]-1H-индол-2-пропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 1, начиная с соединения, полученного согласно примеру получения 49, ожидаемый продукт получают в форме желтого масла (выход = 80%). 1 Н ЯМР (ДМСО-d6, 300 МГц)2,81 (t, 2 Н), 3,27 (t, 2H), 3,61 (s, 3H), 6,59 (s, 1 Н), 7,02-7,13 (m, 4 Н),7,30 (m, 2 Н), 7,45 (m, 2 Н), 7,60 (s, 1H), 7,83 (d, 2H), 8,01 (d, 1 Н). Пример 56. 5-Хлор-1-[(4-феноксифенил)сульфонил]-1H-индол-2-пропановая кислота. Следуя методике, аналогичной примеру 2, начиная с соединения, полученного согласно примеру 55, ожидаемый продукт получают в форме белого твердого вещества (выход = 93%). Т.пл. = 70-75 С. Пример 57. 5-Хлор-1-[(1-нафталинил)сульфонил]-1H-индол-2-пропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 1, начиная с соединения, полученного согласно примеру получения 50, ожидаемый продукт получают в форме желтого твердого вещества (выход = 80%). Т.пл. = 88-93 С. Пример 58. 5-Хлор-1-[(1-нафталинил)сульфонил]-1H-индол-2-пропановая кислота. Следуя методике, аналогичной примеру 2, начиная с соединения, полученного согласно примеру 57, ожидаемый продукт получают в форме белого твердого вещества (выход = 98%). Т.пл. = 165-175 С. Пример 59. 5-Хлор-1-[(2-нафталинил)сульфонил]-1H-индол-2-пропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 1, начиная с соединения, полученного согласно примеру получения 51, ожидаемый продукт получают в форме желтого масла (выход = 90%).
МПК / Метки
МПК: A61K 31/405, C07D 209/18, A61P 25/00, C07D 403/12, A61K 31/4178, A61P 3/00, C07D 413/14, C07D 405/12, C07D 413/12, C07D 401/12, A61K 31/4155
Метки: индола, применение, производные
Код ссылки
<a href="https://eas.patents.su/30-13795-proizvodnye-indola-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Производные индола и их применение</a>
Предыдущий патент: Удаление диоксида углерода из газового потока
Следующий патент: Слитые полипептиды, содержащие glp-1 (глюкагон-подобный пептид-1), с повышенной устойчивостью к пептидазам
Случайный патент: Способ окисления под давлением золотоносных руд, содержащих тугоплавкие сульфиды и органические углеродистые вещества












