Бензимидазол-имидазольные производные
Номер патента: 22839
Опубликовано: 31.03.2016
Авторы: Рабуассон Пьер Жан-Мари Бернар, Вандик Коэн, Хоупис Иоаннис Николаос, Ласт Стефан Жюльен
Формула / Реферат
1. Соединение формулы I
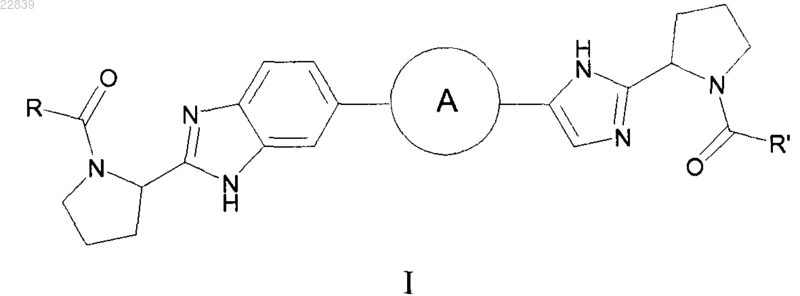
или его стереоизомерная форма, где А представляет собой фенилен или нафтилен;
каждый из R и R' независимо представляет собой -CR1R2R3; и где
R1 представляет собой С1-4алкил, необязательно замещенный метокси или гидрокси;
фенил; С3-6циклоалкил; тетрагидропиранил;
R2 представляет собой С1-4алкилоксикарбониламино;
R3 представляет собой водород или
R1 и R3 вместе образуют циклопропильную группу;
или его фармацевтически приемлемая соль или гидрат соли.
2. Соединение по п.1, где R1 представляет собой С1-4алкил, необязательно замещенный метокси;
фенил; С3-6циклоалкил или тетрагидропиранил.
3. Соединение по п.1, где А представляет собой нафтилен.
4. Соединение по п.2, где А представляет собой нафтилен.
5. Соединение по п.4, где А представляет собой 2,6-нафтилен.
6. Соединение по любому из пп.3-5, где соединение отличается от
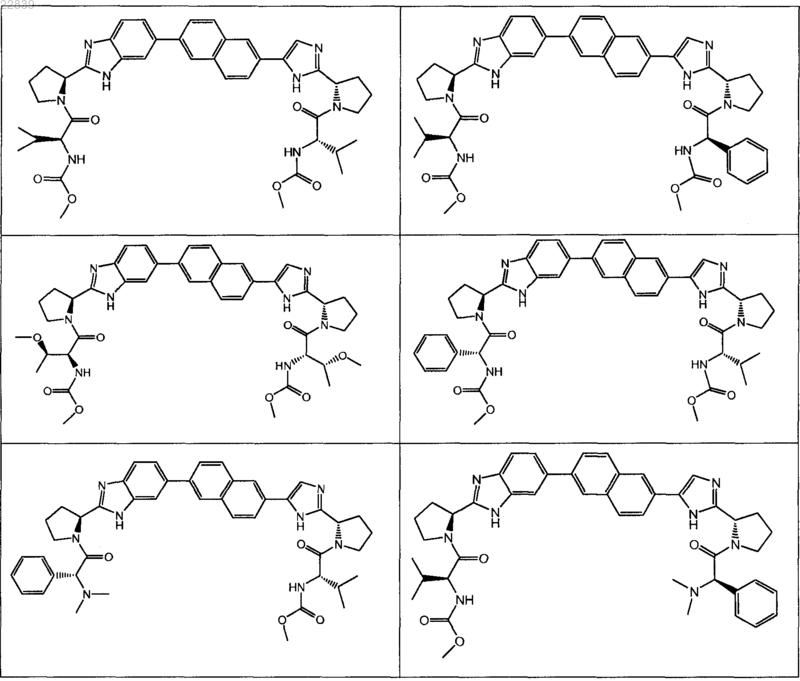
7. Соединение по любому из пп.3-5, где R1 отличается от незамещенного 2-пропила и, когда R1 в R представляет собой 1-метоксиэтил, то R1 в R' отличается от 1-метоксиэтила.
8. Соединение по любому из пп.3-5, где
R1 отличается от 2-пропила, когда R2 представляет собой метоксикарбониламино; и
R1 в R' отличается от 1-метоксиэтила, когда R2 в R' представляет собой метоксикарбониламино.
9. Соединение по любому из пп.1-8, где R и R' отличаются друг от друга.
10. Соединение по любому из пп.1-8, где R и R' являются одинаковыми.
11. Соединение по любому из пп.1-10, где каждый из R и R' независимо представляет собой -CR1R2R3.
12. Соединение по п.11, где каждый R2 независимо представляет собой С1-4алкилоксикарбониламино.
13. Соединение по любому из пп.11-12, где каждый R1 независимо выбран из разветвленного С3-4алкила, метоксиС2-3алкила, циклопентила или фенила.
14. Соединение по любому из пп.11-12, где R1 в R представляет собой 1-метилпропил, 2-метилпропил, 2-метоксиэтил, циклопентил или фенил; и R1 в R' представляет собой 1-метилэтил, 1-метилпропил, 2-метилпропил, 1-метоксиэтил, циклопентил или фенил.
15. Соединение по любому из пп.11-14, где оба атома углерода в R и R', несущие заместители R1, R2 и R3, имеют S-конфигурацию.
16. Соединение по любому из пп.1-15, где соединение имеет формулу Ia

17. Соединение, имеющее структуру

18. Фармацевтически приемлемая соль или гидрат соли соединения по п.17.
19. Соединение, имеющее структуру
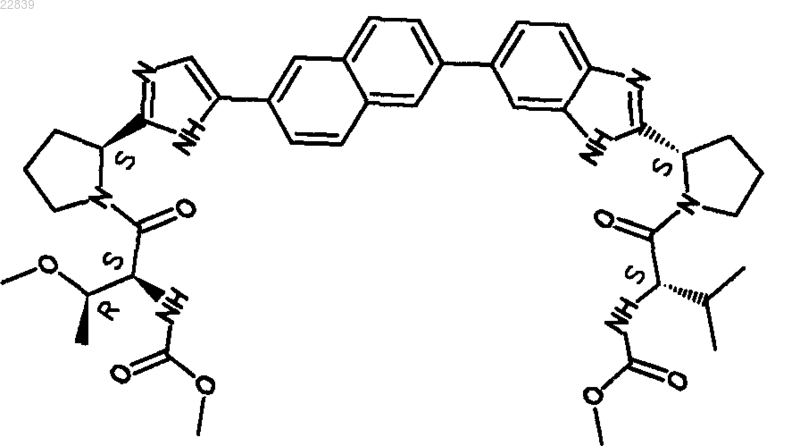
20. Фармацевтически приемлемая соль или гидрат соли соединения по п.19.
21. Соединение, имеющее структуру
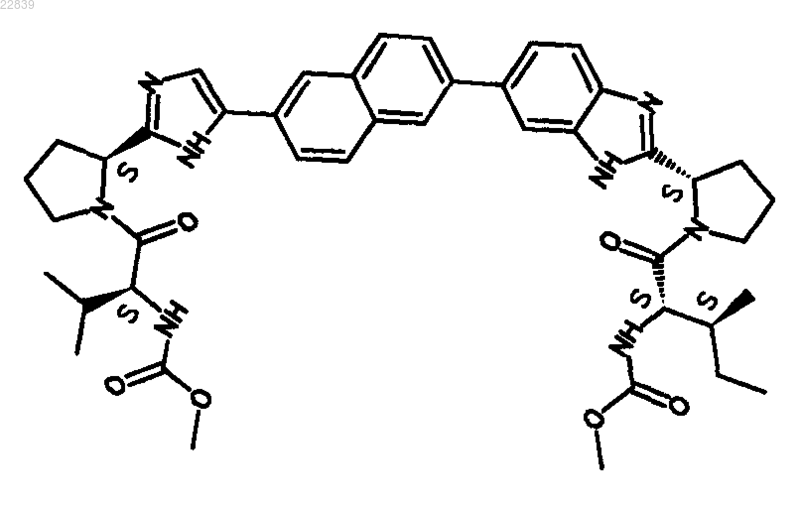
22. Фармацевтически приемлемая соль или гидрат соли соединения по п.21.
23. Соединение, имеющее структуру
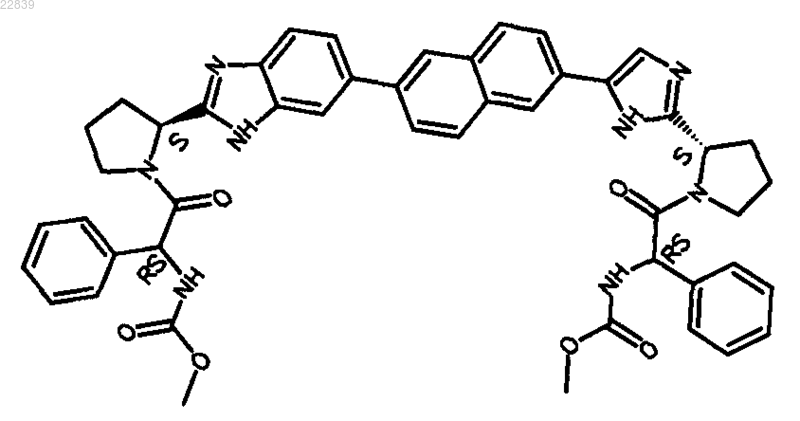
24. Фармацевтически приемлемая соль или гидрат соли соединения по п.23.
25. Соединение, имеющее структуру
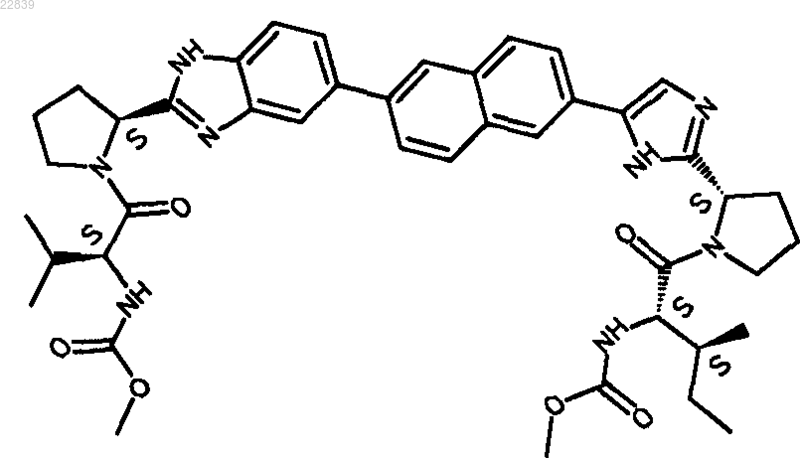
26. Фармацевтически приемлемая соль или гидрат соли соединения по п.25.
27. Соединение, имеющее структуру
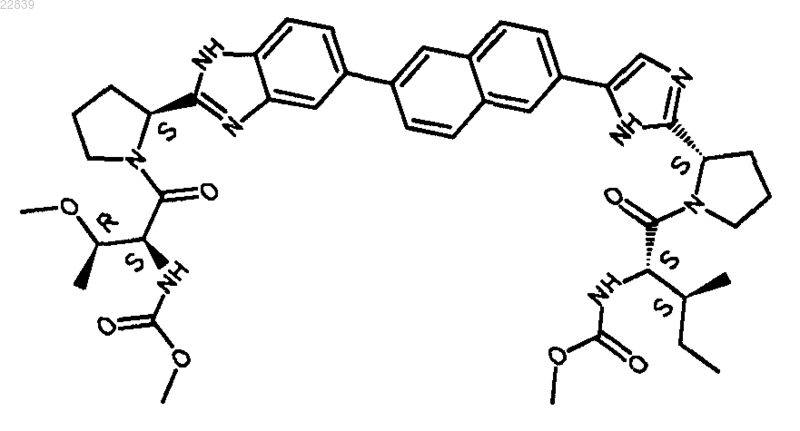
28. Фармацевтически приемлемая соль или гидрат соли соединения по п.27.
29. Соединение по п.27 в его форме ×2HCl×4H2O.
30. Соединение по п.27 в его форме ×H2SO4.
31. Соединение, имеющее структуру
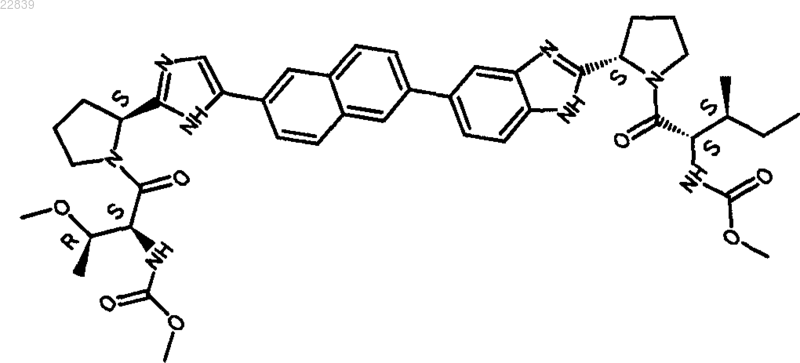
32. Фармацевтически приемлемая соль или гидрат соли соединения по п.31.
33. Соединение по п.31 в его форме ×2HCl×4H2O.
34. Фармацевтическая композиция, содержащая соединение по любому из пп.1-33, и фармацевтически приемлемый носитель.
35. Применение соединения по любому из пп.1-33 для профилактики или лечения инфекции HCV у млекопитающего.
36. Применение фармацевтической композиции по п.34 для профилактики или лечения инфекции HCV y млекопитающего.
37. Фармацевтический комбинированный препарат, содержащий (а) соединение, как определено в любом из пп.1-33, и (b) другой ингибитор HCV, в качестве комбинированного препарата для одновременного, отдельного или последовательного применения для лечения инфекций HCV.
38. Препарат по п.37, где другой ингибитор HCV представляет собой ингибитор протеазы HCV.
39. Препарат по п.38, где ингибитор протеазы HCV выбран из группы, состоящей из телапревира (VX-950), боцепревира (SCH-503034), нарлапревира (SCH-900518), ITMN-191 (R-7227), ТМС435350 (ТМС435), МК-7009, BI-201335, BI-2061 (цилупревира), BMS-650032, АСН-1625, АСН-1095, GS 9256, VX-985, IDX-375 (ингибитор кофактора протеазы HCV NS4A), VX-500, VX-813, РНХ-1766, РНХ2054, IDX-136, IDX-316, АВТ-450, ЕР-013420 и VBY-376.
40. Препарат по п.38, где ингибитор протеазы HCV выбран из группы, состоящей из ТМС435350 (ТМС435), МК-7009 или ITMN-191 (R-7227).
41. Препарат по п.37, где другой ингибитор HCV представляет собой нуклеозидный или ненуклеозидный ингибитор полимеразы HCV.
42. Препарат по п.41, где ингибитор полимеразы HCV выбран из группы, состоящей из R7128, PSI-7851, PSI 7977, IDX-189, IDX-184, IDX-102, R1479, UNX-08189, PSI-6130, PSI-938, PSI-879, HCV-796, HCV-371, VCH-759, VCH-916, VCH-222, ANA-598, МК-3281, АВТ-333, АВТ-072, PF-00868554, BI-207127, GS-9190, А-837093, JKT-109, GL-59728, GL-60667, АВТ-072, AZD-2795 и 16,16-диоксида 13-циклогексил-3-метокси-17,23-диметил-7Н-10,6-(метаноиминотиоиминоэтаноксиэтаниминометан)индол[2,1-а][2]бензазепин-14,24-диона.
43. Препарат по п.41, где ингибитор полимеразы HCV представляет собой PSI-6130 или его пролекарство.
44. Препарат по п.41, где ингибитор полимеразы HCV представляет собой
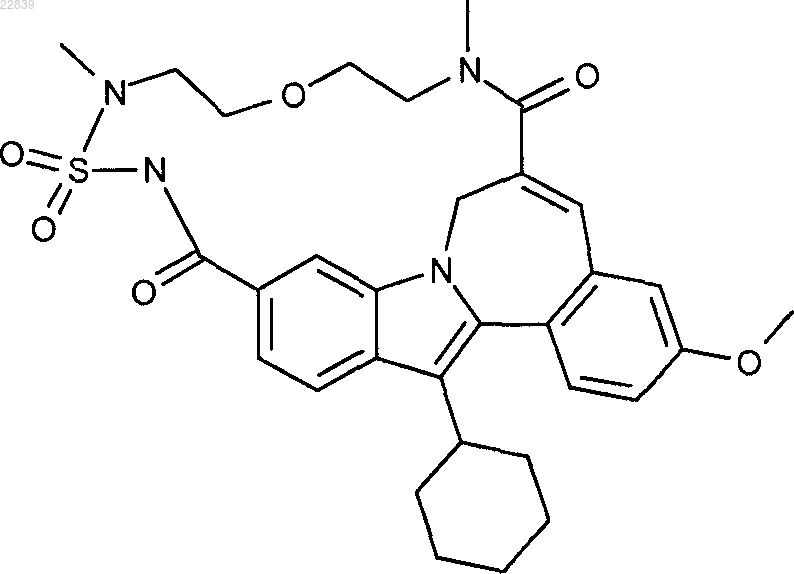
или его фармацевтически приемлемую соль или гидрат соли.
45. Фармацевтический комбинированный препарат, содержащий (а) соединение по любому из пп.1-33 и (b) иммуномодулирующее средство, в качестве комбинированного препарата для одновременного, отдельного или последовательного применения при лечении инфекций HCV.
Текст
Предложены ингибиторы репликации HCV формулы (I), включающие его стереохимически изомерные формы, соли и сольваты, Вандик Коэн, Ласт Стефан Жюльен,Хоупис Иоаннис Николаос, Рабуассон Пьер Жан-Мари Бернар (BE) Медведев В.Н. (RU) где каждый из R и R' независимо представляет собой -CR1R2R3, арил, гетероарил или гетероС 4-6 циклоалкил, причем арил и гетероарил могут быть необязательно замещены 1 или 2 заместителями,выбранными из галогена и метила. Также настоящее изобретение относится к способу получении указанных соединений, фармацевтическим композициям, содержащим их, и к их применению в терапии HCV.(71)(73) Заявитель и патентовладелец: ЯНССЕН САЙЕНСИЗ АЙРЛЭНД ЮCИ (IE) Техническая область Данное изобретение относится к бензимидазол-имидазольным производным, которые являются ингибиторами вируса гепатита С (HCV), их синтезу и их применению для лечения или профилактики HCV. Уровень техникиHCV представляет собой одноцепочечный положительный РНК-вирус, относящийся к семейству вирусов Flaviviridae рода hepacivirus. Геном вируса транслируется в единую открытую рамку считывания, которая кодирует множество структурных и неструктурных белков. Белок NS5A HCV расположен ниже белка NS4B и выше белка NS5B. После посттрансляционного расщепления вирусной сериновой протеазой NS3/4A, NS5A созревает в цинксодержащий фосфопротеин из трех доменов, который существует либо в виде гипофосфорилированной (56-кДа, р 56), либо гиперфосфорилированной формах (58-кДа, р 58). NS5A HCV вовлечен во множество аспектов жизненного цикла вируса, включая репликацию вируса и сборку инфекционных частиц, а также модулирование окружающей среды его клетки-хозяина. Хотя этому белку не приписывается ферментативная функция,описано, что он взаимодействует с многочисленными вирусными и клеточными факторами. В ряде патентов и патентных заявок описаны соединения с ингибирующей активностью в отношении HCV, в частности, нацеленные на NS5A. В WO 2006/133326 описаны производные стилбена, а в WO 2008/021927, WO 2008/021928, WO 2009/102325 и WO 2009/102318 описаны бифенильные производные,обладающие активностью ингибирования NS5A HCV. В US 2009/0202483 описаны соединенные мостиковой связью бифенильные производные. В WO 2008/048589 описаны производные 4-(фенилэтинил)-1 Нпиразола и их противовирусное применение. В WO 2008/070447 описан широкий диапазон ингибирующих HCV соединений, включающих бензимидазольную часть. В WO 2010/065668, WO 2010/065674 иNS5A. Например, соединения, имеющие следующую структуру и номер химической реферативной службы, описаны в табл. 1 WO 2010/065674. Таблица А-1 022839 После первоначальной острой инфекции у большинства инфицированных индивидов развивается хронический гепатит, поскольку HCV реплицируется предпочтительно в гепатоцитах, но не является непосредственно цитопатическим. В частности, отсутствие интенсивного Т-лимфоцитарного ответа и высокая способность вируса к мутациям, по-видимому, обеспечивают высокий уровень хронической инфекции. Хронический гепатит может прогрессировать в печеночный фиброз, приводящий к циррозу,заболеванию печени конечной стадии, и в НСС (печеночно-клеточную карциному), что делает его основной причиной трансплантаций печени. Существует шесть основных генотипов HCV и более 50 подтипов, которые географически распределены по-разному. HCV 1 генотипа представляет собой преобладающий генотип в Европе и США. Выраженная генетическая гетерогенность HCV имеет высокое диагностическое и клиническое значение,являясь возможным объяснением трудностей в разработке вакцины и отсутствия ответа на современную терапию.HCV может передаваться через контакт с зараженной кровью или продуктами крови, например, после переливания крови или внутривенного употребления наркотиков. Внедрение диагностических тестов, используемых для скрининга крови, вызвало тенденцию к понижению встречаемости посттрансфузионного заражения HCV. Однако учитывая медленное прогрессирование в заболевание печени конечной стадии, существующие инфекции будут оставаться серьезной медицинской и экономической проблемой в течение десятилетий. Современные способы лечения HCV основаны на (пегилированном) интерфероне-альфа (IFN-) в сочетании с рибавирином. Эта комбинированная терапия приводит к замедленному вирусологическому ответу более чем у 40% пациентов, инфицированных вирусами 1 генотипа HCV, и приблизительно у 80% пациентов, инфицированных 2 и 3 генотипами. Помимо ограниченной эффективности в отношении HCV 1 генотипа, эта комбинированная терапия обладает значительными побочными эффектами, включая гриппоподобные симптомы, гематологические нарушения и нейропсихиатрические симптомы. Таким образом, для преодоления недостатков современной терапии HCV, таких как побочные эффекты, ограниченная эффективность, возникновение устойчивости и несоблюдение пациентом режима лечения, а также для улучшения ответа в виде постоянной вирусной нагрузки, существует необходимость в более эффективных, более удобных и лучше переносимых способах лечения. Настоящее изобретение относится к группе бензимидазол-имидазольных производных, способных ингибировать цикл репликации HCV. Соединения по изобретению также являются привлекательными вследствие того факта, что они демонстрируют более высокую эффективность ингибирования цикла репликации HCV по сравнению с их способностью ингибировать репликацию ВИЧ. ВИЧ-инфицированные пациенты часто страдают от коинфекций, таких как HCV. Лечение таких пациентов ингибитором HCV, который также ингибирует ВИЧ, может привести к нежелательному появлению устойчивых к ВИЧ штаммов. Описание изобретения В одном аспекте настоящее изобретение относится к соединениям, которые могут быть представлены формулой I или их стереоизомерным формам, где А представляет собой фенилен или нафтилен; каждый из R и R' независимо представляет собой -CR1R2R3; и гдеR1 представляет собой С 1-4 алкил, необязательно замещенный метокси или гидрокси; фенил; С 3-6 циклоалкил; тетрагидропиранил;R1 и R3 вместе образуют циклопропильную группу; или их фармацевтически приемлемым солям или гидратам солей. В другом аспекте настоящее изобретение относится к соединениям, которые могут быть представлены следующими соединениями формулы (I-PR): или их стереоизомерным формам, где А представляет собой фенилен или нафтилен, каждый из которых может быть необязательно заме-2 022839 щен 1, 2 или 3 заместителями, выбранными из галогена или C1-3 алкила; каждый из R и R' независимо представляет собой -CR1R2R3, арил, гетероарил или гетероС 4-6 циклоалкил, причем арил и гетероарил могут быть необязательно замещены 1 или 2 заместителями, выбранными из галогена и метила; и гдеR1 представляет собой водород; С 1-4 алкил, необязательно замещенный метокси или диметиламино; фенил, необязательно замещенный 1, 2 или 3 заместителями, независимо выбранными из галогена,С 1-4 алкокси и трифторметокси; 1,3-бензодиоксоланил; бензил, необязательно замещенный 1, 2 или 3 заместителями, независимо выбранными из галогена или метокси; С 3-6 циклоалкил; гетероарил; гетероС 4-6 циклоалкил или гетероарилметил;R3 представляет собой водород,или R1 и R3 вместе образуют оксогруппу или циклопропильную группу; или их фармацевтически приемлемым солям и/или сольватам. В другом аспекте настоящее изобретение относится к соединениям, которые могут быть представлены формулой (I-COR) или их стереоизомерным формам, где А представляет собой фенилен или нафтилен, каждый из которых может быть необязательно замещен 1, 2 или 3 заместителями, выбранными из галогена или С 1-3-залкила; каждый из R и R' независимо представляет собой -CR1R2R3, арил, гетероарил или гетероС 4-6 циклоалкил, причем арил и гетероарил могут быть необязательно замещены 1 или 2 заместителями, выбранными из галогена и метила; и гдеR1 представляет собой водород; С 1-4 алкил, необязательно замещенный метокси или диметиламино; фенил, необязательно замещенный 1, 2 или 3 заместителями, независимо выбранными из галогена,С 1-4 алкокси и трифторметокси; 1,3-бензодиоксоланил; бензил, необязательно замещенный 1, 2 или 3 заместителями, независимо выбранными из галогена или метокси; С 3-6 циклоалкил; гетероарил; гетероС 4-6 циклоалкил; или гетероарилметил;R3 представляет собой водород,или R1 и R3 вместе образуют оксогруппу или циклопропильную группу; или их фармацевтически приемлемым солям и/или сольватам. В другом аспекте настоящее изобретение относится к соединениям, которые могут быть представлены формулой (I-PR-COR) или их стереоизомерным формам, где А представляет собой фенилен или нафтилен, каждый из которых может быть необязательно замещен 1, 2 или 3 заместителями, выбранными из галогена или С 1-3 алкила; каждый из R и R' независимо представляет собой -CR1R2R3, арил, гетероарил или гетероС 4-6 циклоалкил, причем арил и гетероарил могут быть необязательно замещены 1 или 2 заместителями, выбран-3 022839 ными из галогена и метила; и гдеR1 представляет собой водород; С 1-4 алкил, необязательно замещенный метокси или диметиламино; фенил, необязательно замещенный 1, 2 или 3 заместителями, независимо выбранными из галогена,С 1-4 алкокси и трифторметокси; 1,3-бензодиоксоланил; бензил, необязательно замещенный 1, 2 или 3 заместителями, независимо выбранными из галогена или метокси; С 3-6 циклоалкил; гетероарил; гетероС 3-6 циклоалкил или гетероарилметил;R1 и R3 вместе образуют оксогруппу или циклопропильную группу; или их фармацевтически приемлемым солям и/или сольватам. В другом аспекте настоящее изобретение относится к соединениям, которые могут быть представлены следующими соединениями формулы (I-PR): или их стереоизомерным формам, где А представляет собой фенилен или нафтилен, каждый из которых может быть необязательно замещен 1, 2 или 3 заместителями, выбранными из галогена или С 1-3 алкила; каждый из R и R' независимо представляет собой -CR1R2R3, арил, гетероарил или гетероС 4-6 циклоалкил, причем арил и гетероарил могут быть необязательно замещены 1 или 2 заместителями, выбранными из галогена и метила; и гдеR1 представляет собой водород; С 1-4 алкил, необязательно замещенный метокси или диметиламино; фенил, необязательно замещенный 1, 2 или 3 заместителями, независимо выбранными из галогена,С 1-4 алкокси и трифторметокси; 1,3-бензодиоксоланил; бензил, необязательно замещенный 1, 2 или 3 заместителями, независимо выбранными из галогена или метокси; С 3-6 циклоалкил; гетероарил; гетероС 4-6 циклоалкил или гетероарилметил;R1 и R3 вместе образуют оксогруппу или циклопропильную группу; или их фармацевтически приемлемым солям и/или сольватам,при условии, что соединение отличается от любого из 6 соединений, приведенных в таблице А. Когда используется в рамках настоящего изобретения, термин "соединения формулы I", "настоящие соединения", "соединения по настоящему изобретению" или подгруппы соединений формулы (I), такие как подгруппы, определенные в настоящем описании с помощью различных вариантов осуществления, а также "соединения формулы (I-PR)", "соединения формулы (I-COR)", "соединения формулы (I PR-COR)" или сходные термины, включают соединения формулы I или каждую из подгрупп, включая возможные стереоизомерные формы, и их фармацевтически приемлемые соли и сольваты, если нет иных указаний. В следующем аспекте изобретение относится к применению соединений формулы I или их подгрупп, как указано в настоящем описании, для ингибирования цикла репликации HCV. Альтернативно предусмотрено применение указанных соединений для изготовления лекарственного средства для ингибирования цикла репликации HCV. Варианты осуществления настоящего изобретения относятся к соединениям формулы (I) или любой их подгруппе, как определено в настоящем описании с помощью различных вариантов осуществления,где применимо одно или несколько определений для A, R, R', R1, R2 и R3, как описано в настоящем опи-4 022839 сании. Другой вариант осуществления настоящего изобретения относится к соединениям формулы I или любой их подгруппе, где R-(С=O)- и R'-C(=O)- независимо представляют собой -(С=O)-CR1R2R3, выбранные из обозначает точку присоединения к азоту пирролидина. В частности, R-(С=O)- и R'-C(=O)- независимо представляют собой -(С=O)-CR1R2R3, выбранный из и Другой вариант осуществления настоящего изобретения относится к соединениям формулы I или любой их подгруппе, где А представляет собой фенилен, в частности, где А представляет собой 1,4 где пунктирная линия указывает на точки присоединения к остальной части фенилен структуры молекулы. Другой вариант осуществления настоящего изобретения относится к соединениям формулы I или любой их подгруппе, где А представляет собой нафтилен, в частности, где А представляет собой 2,6 нафтилен структуры где пунктирная линия указывает на точки присоединения остальной части молекулы. Другой вариант осуществления относится к соединениям формулы (I) или любой их подгруппе, таким как соединения формулы (I-PR), где А представляет собой 2,6-нафтилен структуры и где соединения в этом варианте осуществления отличаются от любого из 6 соединений, приведенных в таблице А. Другой вариант осуществления относится к соединениям формулы (I) или любой их подгруппе, гдеR и R' отличаются друг от друга. Другой вариант осуществления относится к соединениям формулы (I), где каждый R2 независимо представляет собой C1-4 алкилкарбониламино или С 1-4 алкилоксикарбониламино. Другой вариант осуществления относится к соединениям формулы (I) или любой их подгруппе, где каждый R2 независимо представляет собой метоксикарбониламино. Другой вариант осуществления относится к соединениям формулы (I) или любой их подгруппе, где каждый R1 независимо выбран из разветвленного С 3-4 алкила, метоксиС 2-3 алкила, циклопентила или фенила. Другой вариант осуществления относится к соединениям формулы (I) или любой их подгруппе, гдеR' представляет собой 1-метилэтил, 1-метилпропил, 2-метилпропил, 1-метоксиэтил, циклопентил или фенил. Другой вариант осуществления относится к соединениям формулы (I) или любой их подгруппе, гдеR и R' независимо представляют собой -CR1R2R3, причем оба атома углерода, несущих заместитель R1,R2 и R3, имеют S-конфигурацию. Другой вариант осуществления относится к соединениям формулы (I) или любой их подгрупупе,такой как соединения формулы (I-PR), где соединение имеет формулу Ia Другой вариант осуществления относится к соединениям формулы (I) или любой их подгруппе, где соединение представляет собой одно из следующих соединений, представленных в табл. 1 а: соединение 9, соединение 11, соединение 13, соединение 14, соединение 16, соединение 17 или соединение 18, или их фармацевтически приемлемую соль.-5 022839 В следующем аспекте настоящее изобретение относится к соединениям формулы I и их фармацевтически приемлемым солям и сольватам для применения для лечения или профилактики (или изготовления лекарственного средства для лечения или профилактики) инфекции HCV. Типичные генотипы HCV в контексте лечения или профилактики в соответствии с настоящим изобретением включают генотип 1b(преобладающий в Европе) или 1 а (преобладающий в Северной Америке). Настоящее изобретение также относится к способу лечения или профилактики инфекции HCV, в частности, инфекции HCV генотипа 1 а или 1b. Чистые стереоизомерные формы соединений и промежуточных соединений, упоминаемых в настоящем описании, определяют как изомеры, по существу, свободные от других энантиомерных или диастереомерных форм той же основной молекулярной структуры указных соединений или промежуточных соединений. В частности, термин "стереоизомерно чистый" относится к соединениям или промежуточным соединениям, имеющим стереоизомерный избыток по меньшей мере 80% (т.е. минимум 90% одного изомера и максимум 10% других возможных изомеров) вплоть до стереоизомерного избытка 100% (т.е. 100% одного изомера и отсутствие другого изомера), более конкретно, соединения или промежуточные соединения, имеющие стереоизомерный избыток от 90% вплоть до 100%, еще более конкретно имеющие стереоизомерный избыток от 94% вплоть до 100% и наиболее конкретно имеющие стереоизомерный избыток от 97% вплоть до 100%. Термины "энантиомерно чистый" и "диастереомерно чистый" следует понимать аналогично, но рассматривая энантиомерный избыток и диастереомерный избыток, соответственно, данной смеси. Чистые стереоизомерные формы или стереоизомеры соединений и промежуточных соединений настоящего изобретения можно получать путем проведения известных в уровне техники процедур. Например, энантиомеры могут быть выделены из соответствующего соединения путем селективной кристаллизации их стереоизомерных солей с оптически активными кислотами или основаниями. Примерами таковых являются винная кислота, дибензоилвинная кислота, дитолуоилвинная кислота и камфорсульфоновая кислота. Альтернативно, энантиомеры могуть быть выделены путем техник хроматографии с использованием стационарных хиральных фаз. Указанные чистые стереохимические изомерные формы могут также быть получены из соответствующих чистых стереоизомерных форм подходящих исходных материалов, обеспечивающих прохождение стереоспецифической реакции. Предпочтительно, если требуется специфический стереоизомер, указанное соединение синтезируют стереоспецифическим способом получения. Такие способы будут преимущественно использовать чистые энантиомерные исходные материалы. Диастереомерные рацематы соединений формулы I можно получать по отдельности общепринятыми способами. Соответствующими способами физического разделения, которые можно преимущественно использовать, являются, например, селективная кристаллизация и хроматография, например, колоночная хроматография или сверхкритическая жидкостная хроматография. Соединения формулы I имеют несколько центров хиральности. Интерес представляют стереогенные центры пирролидинового кольца на 2 атоме углерода. Конфигурация в этом положении может представлять собой конфигурацию, соответствующую L-пролину, т.е. Также интерес представляют стереогенные центры, находящиеся в частях -CR1R2R3 соединений формулы I. Варианты осуществления настоящего изобретения, таким образом, относятся к соединениям формулы I или любой их подгруппе, где атом углерода С в -CR1R2R3 имеет его S-конфигурацию, в частности, когда R1 представляет собой С 1-4 алкил, необязательно замещенный метокси, гидрокси или диметиламино; бензил, необязательно замещенный 1, 2 или 3 заместителями, независимо выбранными из галогена или метокси; С 3-6 циклоалкил; гетероС 4-6 циклоалкил; или гетероарилметил. Конкретными примерами частей -(С=O)-CR1R2R3 соединений формулы I с указанной стереохимией являются гдеобозначает точку присоединения к остальной части молекулы. Фармацевтически приемлемые аддитивные соли включают терапевтически активные нетоксичные формы кислотных и основных аддитивных солей соединений формулы (I) или любой их подгруппы. Интерес представляют свободные, т.е. несолевые формы соединений формулы I или любой их подгруппы. Фармацевтически приемлемые кислотно-аддитивные соли можно удобным образом получать путем обработки основной формы такой подходящей кислотой. Подходящие кислоты включают, например,неорганические кислоты, такие как галогенводородные кислоты, например хлористо-водородная или бромисто-водородная кислота, серная, азотная, фосфорная кислоты и т.п.; или органические кислоты,например, такие как уксусная, пропионовая, гидроксиуксусная, молочная, пировиноградная, щавелевая(т.е. этандиовая), малоновая, янтарная (т.е. бутандиовая кислота), малеиновая, фумаровая, яблочная (т.е. гидроксилбутандиовая кислота), виннокаменная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламовая, салициловая, п-аминосалициловая, памовая кислоты и т.п. Напротив, указанные солевые формы можно превращать обработкой соответствующим основанием в форму свободного основания. Соединения формулы (I), содержащие кислотный протон, также можно превращать в их основноаддитивные соли, в частности, аддитивные солевые формы металлов или аминов, путем обработки подходящими органическими и неорганическими основаниями. Подходящие солевые формы включают, например, соли аммония, соли щелочных и щелочно-земельных металлов, например соли лития, натрия,калия, магния, кальция и т.п., соли с органическими основаниями, например бензатин, N-метил-Dглюкамин, соли гидрабамина и соли с аминокислотами, например, такими как аргинин, лизин и т.п. Некоторые из соединений формулы I также могут существовать в таутомерных формах. Например,таутомерными формами амидных (-C(=O)-NH-) групп являются иминоспирты (-C(OH)=N-). Подразумевается, что таутомерные формы, хотя и не указаны явно в структурных формулах, представленных в настоящем описании, включены в объем настоящего изобретения. Как используют в рамках настоящего изобретения, "С 1-4 алкил" в качестве группы или части группы определяет насыщенные прямые или разветвленные углеводородные группы, имеющие от 1 до 4 атомов углерода, например, такие как метил, этил, 1-пропил, 2-пропил, 1-бутил, 2-бутил, 2-метил-1-пропил, 2 метил-2-пропил. Для целей настоящего изобретения среди С 1-4 алкилов интерес представляют С 3-4 алкилы,т.е. прямые или разветвленные углеводородные группы, имеющие 3 или 4 атома углерода, такие как 1 пропил, 2-пропил, 1-бутил, 2-бутил, 2-метил-1-пропил, 2-метил-2-пропил. Особый интерес может представлять разветвленный С 3-4 алкил, такой как 2-пропил, 2-бутил, 2-метил-1-пропил, 2-метил-2-пропил. Термин "С 3-6 циклоалкил" является общим термином для циклопропила, циклобутила, циклопентила и циклогексила. Аналогично, "С 4-6 циклоалкил" является общим названием для циклобутила, циклопентила и циклогексила."С 1-4 алкокси" в качестве группы или части группы означает группу формулы -O-С 1-4 алкил, где С 1-4 алкил является таким, как определено выше. Примерами С 1-4 алкокси являются метокси, этокси, нпропокси, изопропокси. Термин "галоген" является общим термином для фтора, хлора, брома и йода. Как используют в рамках настоящего изобретения, термин "(=O)" или "оксо" формирует карбонильную часть, когда он присоединен к атому углерода. Следует отметить, что атом может быть замещен только оксогруппой, когда валентность этого атома допускает это. Как используют в рамках изобретения, "арил" является общим термином для фенила и нафтила. Как используют в рамках изобретения, термин "гетероарил" означает ароматическую кольцевую структуру, имеющую от 5 до 10 атомов кольца, в котором по меньшей мере один атом кольца выбран изN, О и S, в частности, из N и О. Как используют в рамках изобретения, термин "гетероС 4-6 циклоалкил" означает насыщенную циклическую углеводородную группу, как определено для "С 4-6 циклоалкила", где по меньшей мере один атом углерода заменен гетероатомом, выбранным из N, О и S, в частности из N и О. Примеры гетероС 4-6 циклоалкила включают тетрагидро-2 Н-пиранил, пиперидинил, тетрагидрофуранил и пирролидинил. Где положение группы на молекулярной части не указано (например, заместитель на фениле) или представлено с помощью плавающей связи, такая группа может быть расположена на любом атоме такой части, при условии, что полученная структура является химически стабильной. Когда какая-либо переменная присутствует в молекуле более одного раза, каждое определение является независимым. Соединения по настоящему изобретению можно синтезировать с использованием следующих методик синтеза. Сокращения, как используют в рамках изобретения, имеют следующее значение: На схеме 1 описан синтез соединений с II по VI. На первой стадии образуется амидная связь с использованием PG-пролина и 4-галогенбензол-1,2-диамина, где X представляет собой Cl, Br или I, в присутствии пригодного связующего реагента для ацилирования аминогруппы, например, такого как CDI. Как используют в рамках изобретения, PG представляет собой защитную группу на азоте пирролидина,например, такую как карбаматзащитная группа, такая как бензилоксикарбонил, или трет-бутоксикарбонил, или альтернативно PG может представлять собой R-C(=O)-, где R имеет значение, как определено для соединений формулы I. Полученное таким образом промежуточное соединение далее подвергают циклизации с получением бензимидазольного производного формулы II. Такую циклизацию можно проводить путем обработки кислотой, например, такой как уксусная кислота, в диапазоне температур от 0 до 150 С, более конкретно от 80 до 120 С. Промежуточное соединение формулы II можно конвертировать в бороновый сложный эфир формулы III в условиях, катализируемых Pd, например, в присутствииPd(dppf)Cl2, бис(пинаколато)дибора и основания, например, ацетата калия. Соединение IV (схема 1 В) можно получать после селективного удаления защитной группы PG из азота пирролидина промежуточного соединения II, в пригодных условиях, например, таких как использование HCl в изопропаноле, когда PG представляет собой трет-бутоксикарбонил. Затем полученное промежуточное соединение IV можно конвертировать в промежуточное соединение формулы V путем ацилирования подходящей кислотой формулы R-C(=O)-OH, где R имеет значение, как определено для соединений формулы I. Указанное ацилирование можно проводить путем реакции исходных материалов в присутствии связывающего агента или путем конвертирования карбоксильной функциональной группы в активную форму, такую как активный сложный эфир, смешанный ангидрид или хлорид или бромид карбоновой кислоты. Общее описание таких реакций присоединения и реагентов, используемых в них, может быть найдено в обычных справочниках по химии пептидов, например, М. Bodanszky, "Peptide Chemistry", 2nd rev.ed., Springer-Verlag, Berlin, Германия, (1993). Примеры реакций присоединения для ацилирования аминогруппы или образования амидной связи включают азидный способ, способ смешанного ангидрида угольная-карбоновая кислота (изобутилхлорформиат), способ карбодиимида (дициклогексилкарбодиимид, диизопропилкарбодиимид, или растворимый в воде карбодиимид, такой как N-этил-N'-[3-(диметиламино)пропил]карбодиимид), способ активного сложного эфира (например, п-нитрофенил, п-хлорфенил, трихлорфенил, пентахлорфенил, пентафторфенил, имидоэфиры и сходные сложные эфиры N-гидроксиянтарной кислоты), способ с реагентом К Вудворда, способ с 1,1-карбонилдиимидазолом, способ с фосфорными реагентами или окислительновосстановительные способы. Некоторые из этих способов могут быть усилены добавлением пригодных катализаторов, например, в способе с карбодиимидом, путем добавления 1-гидроксибензотриазола или 4DMAP. Другими связывающими агентами являются гексафторфосфат (бензотриазол-1-илокси)-трис(диметиламино)фосфония, либо сам по себе, либо в присутствии 1-гидроксибензотриазола или 4-DMAP;-8 022839 или тетрафторборат 2-(1 Н-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (TBTU) или гексафторфосфат О-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HATU). Эти реакции присоединения можно проводить либо в растворе (жидкая фаза), либо в твердой фазе. Для целей настоящего изобретения предпочтительным способом для проведения ацилирования является способ с использованием HATU. Реакции присоединения предпочтительно проводят в инертном растворителе, таком как галогенированные углеводороды, например дихлорметан, хлороформ, биполярные апротонные растворители,такие как ацетонитрил, диметилформамид, диметилацетамид, DMSO, НМРТ, простые эфиры, такие как тетрагидрофуран (THF). Во многих случаях реакции присоединения проводят в присутствии пригодного основания, такого как третичный амин, например триэтиламин, диизопропилэтиламин (DIPEA), N-метилморфолин, Nметилпирролидин, 4-DMAP или 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU). Температура реакции может находиться в диапазоне от 0 до 50 С и время реакции могут находиться в диапазоне от 15 мин до 24 ч. Затем промежуточное соединение V можно конвертировать в бороновый сложный эфир VI в катализируемых Pd условиях в присутствии бис(пинаколато)дибора, подобно тому, как при конвертировании из промежуточного соединения II в промежуточное соединение III. Схема 2 Другие конструктивные элементы, используемые в синтезе соединений формулы I, описаны на схеме 2. -Аминокетон VII (схема 2 А), где А имеет то же значение, как и для соединений формулы I, и X представляет собой галоген, связывают с пригодным образом защищенным пролином, где PG представляет собой защитную группу на азоте пирролидина, предпочтительно трет-бутоксикарбонил или бензилоксикарбонил, в присутствии связывающего реагента для ацилирования аминогруппы, как описано выше для конвертирования промежуточного соединения IV в промежуточное соединение V, предпочтительно с HATU в присутствии DIPEA. Полученное таким образом промежуточное соединение подвергают циклизации в имидазольные промежуточные соединения общей формулы VIII путем обработки ацетатом аммония, предпочтительно в диапазоне температур от 0 до 150 С, более конкретно от 80 до 150 С. Альтернативно промежуточное соединение VIII можно получать связыванием -галогенкетона VIIa, где каждый X независимо представляет собой атом галогена, с пригодным образом защищенным пролином,где PG представляет собой защитную группу на азоте пирролидина, предпочтительно третбутоксикарбонил или бензилоксикарбонил, в присутствии пригодного основания, например, DIPEA, с последующей циклизацией в имидазольное промежуточное соединение VIII, как описано выше, предпочтительно в толуоле или ксилоле. Это соединение можно далее превращать в промежуточное соединение формулы IX, аналогично превращению промежуточного соединения II в промежуточное соединениеIII. Альтернативно из промежуточного соединения VIII можно удалять защитную группу, например, путем обработки HCl в изопропаноле в случае, когда PG представляет собой трет-бутоксикарбонил, с получением промежуточного соединения X (схема 2 В) и далее превращать в промежуточное соединение XI, с-9 022839 использованием условий, сходных с условиями, использованными для превращения промежуточного соединения IV в промежуточное соединение V. Бороновый сложный эфир XII получают из промежуточного соединения XI с использованием условий, сходных с условиями, используемыми для конвертирования промежуточного соединения II в промежуточное соединение III. Имидазол XIII можно синтезировать за 4 стадии, начиная с PG-пролина (схема 2 С), где PG представляет собой защитную группу на азоте пирролидина, предпочтительно трет-бутоксикарбонил, как описано на схеме 2 С. Имидазол XIII' можно синтезировать с использованием по той же методике за исключением последних стадий, где в имидазол вносят йод вместо брома,что можно обеспечивать путем дийодирования посредством I2/NaOH с последующим удалением одного йодида с помощью Na2SO3. Схема 3 Другие возможные промежуточные соединения описаны на схеме 3. Здесь используют дигалогенидXIV формулы где А имеет значение, как определено для соединений формулы I, и X и X' представляют собой галогены; независимо выбранные из йода, хлора и брома. Альтернативно X и/или X' могут представлять собой трифлат, используемый в комбинации с галогеном. Промежуточное соединение III связывают с промежуточным соединением XIV, в условиях Сузуки-Майяра с использованием одного или нескольких эквивалентов промежуточного соединения XIV. Полученное промежуточное соединение XV далее превращают в XVI в условиях, сходных с условиями, описанными для конвертирования промежуточного соединения II в промежуточное соединение III. В случае, когда PG представляет собой R-C(=O), где R имеет значение, как определено для соединений формулы I, промежуточное соединение III является таким же, как и промежуточное соединение VI. Схема 4 Как проиллюстрировано на схеме 4, связывание боронового сложного эфира III и галогенида или трифлата VIII, где X представляет собой галоген или трифлат, в условиях Сузуки-Майяра приводит к образованию промежуточного соединения XVII. Аналогично связывание соответствующих промежуточных соединений, описанных на схемах 1-3 с использованием условий Сузуки-Майяра может также приводить к образованию промежуточных соединений XVII. Например, бромид II и бороновый сложный эфир IX можно связывать с получением промежуточного соединения XVII, как описано для промежуточных соединений III и VIII. Альтернативно соединения формулы I можно получать, как проиллюстрировано на схеме 5. Бороновый сложный эфир формулы XVI связывают с бромидом формулы XIII или Йодидом формулы XIII', с получением промежуточного соединения XVII. После удаления защитной группы азота пирролидина в подходящих условиях, например, таких как использование НС 1 в изопропаноле, в случае когда PG представляет собой трет-бутоксикарбонила, образуется промежуточное соединение XVIII. Связывание с кислотами общей формулы R-C(=O)-OH или R'-C(=O)-OH, где R и R' имеют значения, как определено для соединений формулы I, в условиях, как описано для конвертирования промежуточного соединения IV в промежуточное соединение V, приводит к образованию соединения формулы I, где R-C(=O)- и R'-C(=O)являются идентичными. Для способов, проиллюстрированных на схемах 4 и 5, где PG представляет собой R-C(=O)- или R'C(=O)-, промежуточное соединение XVII в действительности представляет собой соединение формулы I. В случае, когда только одна PG в промежуточном соединении XVII представляет собой R-C(=O)- или R'C(=O)-, a другая представляет собой защитную группу, например такую как трет-бутоксикарбонил, возможно селективное удаление защитной группы, подобно тому, как показано для конвертирования промежуточного соединения XIX (схема 6) в промежуточное соединение XX, или промежуточного соединения XXI в промежуточное соединение XXII. Затем промежуточные соединения XX и XXII можно конвертировать в соединение формулы I, как описано для конвертирования промежуточных соединенийXVIII в соединения формулы I, как проиллюстрировано на схеме 5. Схема 6 Способы, проиллюстрированные на схеме 4 и на первой стадии схемы 5, также можно использовать для получения промежуточного соединения XXV (схема 7), где группы пирролидина ортогонально защищены отличающимися защитными группами PG и PG', тем самым обеспечивая селективное удаление защитной группы с получением либо соединения XXVI, либо соединения XXVII, и последующего ацилирования подходящими группами R'-C(=O)- или R-C(=O)-, с получением соединения XXI или XIX', соответственно, (см. схему 7). На следующей стадии вторую защитную группу удаляют селективно и азот пирролидина ацилируют с получением соединения формулы I. Например, для целей настоящего изобретения, такое ортогональное внесение защитных групп можно обеспечивать с использованием группы tBoc на одном пирролидине в комбинации с бензилоксикарбонилом (Cbz) на другом пирролидине. Схема 7 Методики синтеза, представленные выше в схемах 1-7, можно выполнять с использованием рацемических производных пролина, производных L-пролина или производных D-пролина. Таким образом,можно получать соединения формулы I с альтернативной стереохимией. В следующем аспекте настоящее изобретение относится к фармацевтической композиции, содер- 11022839 жащей терапевтически или профилактически эффективное количество соединения формулы I, как описано в настоящем описании, и фармацевтически приемлемый носитель. Профилактически эффективное количество в этом контексте представляет собой количество, достаточное для предупреждения инфекцииHCV у индивидуумов, имеющих риск быть инфицированными. Терапевтически эффективное количество в данном случае представляет собой количество, достаточное стабилизации инфекции HCV, для уменьшения инфекции HCV или для устранения инфекции HCV y инфицированных индивидуумов. В следующем аспекте, это изобретение относится к способу получения фармацевтической композиции, как описано в настоящем описании, который включает смешение в однородную смесь фармацевтически приемлемого носителя с терапевтически эффективным количеством соединения формулы I, как описано в настоящем описании. Таким образом, для введения соединения по настоящему изобретению или любую их подгруппу можно изготавливать в виде различных фармацевтических форм. В качестве пригодных композиций можно назвать все композиции, обычно используемые для системного введения лекарственных средств. Для получения фармацевтических композиций по настоящему изобретению эффективное количество конкретного соединения, необязательно в форме аддитивной соли или комплекса с металлом, в качестве активного ингредиента смешивают в однородную смесь с фармацевтически приемлемым носителем, который может находиться в различных в формах в зависимости от желательной формы препарата для введения. Желательно, чтобы эти фармацевтические композиции были представлены в единичной дозированной форме, в частности, для перорального, ректального, подкожного введения или для парентеральной инъекции. Например, для получения композиций в пероральной дозированной форме, можно использовать любую обычную фармацевтическую среду, например, такую как вода, гликоли, масла, спирты и т.п. в случае пероральных жидких препаратов, таких как суспензии, сиропы, эликсиры, эмульсии и растворы; или твердые носители, такие как крахмалы, сахара, каолин, смазывающие вещества, связующие вещества, дезинтегрирующие вещества и т.п. в случае порошков, пилюль, капсул и таблеток. Вследствие простоты введения, таблетки и капсулы представляют собой наиболее предпочтительные пероральные единичные дозированные формы, в случае которых обычно используют твердые фармацевтические носители. В случае парентеральных композиций, носитель, как правило, содержит, стерильную воду, составляющую по меньшей мере большую его часть, хотя в него могут быть включены другие ингредиенты, например, для обеспечения растворимости. Например, можно получать инъецируемые растворы,в которых носитель содержит солевой раствор, раствор глюкозы или смесь солевого раствора и раствора глюкозы. Также можно получать инъецируемые суспензии, в случае которых можно использовать пригодные жидкие носители, суспендирующие вещества и т.п. Также предусмотрены препараты в твердой форме, которые необходимо превращать, непосредственно перед применением, в препараты в жидкой форме. В композициях, пригодных для чрескожного введения, носитель необязательно содержит усиливающее проницаемость вещество и/или пригодное смачивающее вещество, необязательно в сочетании с пригодными добавками любой структуры в небольших пропорциях, которые не оказывают значительных неблагоприятных эффектов на кожу. Соединения по настоящему изобретению также можно вводить посредством оральной ингаляции или инсуффляции в форме раствора, суспензии или сухого порошка с использованием любой из известных в данной области системы для доставки. Особенно предпочтительным является составление упомянутых выше фармацевтических композиций в единичную дозированную форму для простоты введения и единообразия дозирования. Как используют в настоящем описании, единичная дозированная форма относится к физически дискретным единицам, пригодным в качестве единичных доз, где каждая единица содержит определенное количество активного ингредиента, вычисленное для обеспечения требуемого терапевтического эффекта, совместно с требуемым фармацевтическим носителем. Примерами таких единичных дозированных форм являются таблетки (включая шероховатые или покрытые таблетки), капсулы, пилюли, суппозитории, пакеты с порошком, вафли, инъецируемые растворы или суспензии и т.п., и отдельные их типы. Соединения формулы I являются активными в качестве ингибиторов цикла репликации HCV и их можно использовать для лечения или профилактики инфекции HCV или заболеваний, обусловленных сHCV. Заболевания, обусловленные HCV, включают прогрессирующий фиброз печени, воспаление и некроз, ведущие к циррозу, заболевание печени конечной стадии и печеночно-клеточную карциному. Более того, о некоторых соединений по настоящему изобретению известно, что они являются активными в отношении мутантных штаммов HCV. Противовирусную активность соединений формулы I в отношении HCV in vitro можно тестировать в клеточной системе с репликоном HCV на основе Lohmann et al. (1999) Science 285: 110-113, с дополнительными модификациями, описанными Krieger et al. (2001) Journal of Virology 75: 4614-4624, которые далее проиллюстрированы в разделе "Примеры". Несмотря на то, что эта модель не является полной моделью инфекции HCV, эта модель широко распространена в качестве наиболее надежной и эффективной модели автономной репликации РНК HCV, доступной в настоящее время. Будет понятно, что важно отличать соединения, которые специфично препятствуют функционированию HCV, от соединений, которые оказывают цитотоксические или цитостатические эффекты в модели репликона HCV, и вследствие этого приводят к снижению РНК HCV или концентрации связанного с ней репортерного фермента. В- 12022839 данной области известны способы анализа для оценки клеточной цитотоксичности на основе, например,активности митохондриальных ферментов с использованием флуорогенных окислительно-восстановительных красителей, таких как резазурин. Более того, существуют способы скрининга с подсчетом клеток, для оценки неселективного ингибирования активности связанного репортерного гена, такого как гена люциферазы светляков. Пригодные типы клеток можно адаптировать посредством стабильной трансфекции репортерным геном люциферазы, экспрессия которого зависит от конститутивно активного промотора гена, и такие клетки можно использовать в качестве способа скрининга с подсчетом для устранения неселективных ингибиторов. Вследствие свойств, направленных против HCV, соединения формулы I или их подгруппы, как описано в настоящем описании, являются пригодными для ингибирования цикла репликации HCV, в частности, для лечения теплокровных животных, в частности людей, инфицированных HCV, и для профилактики инфекций HCV. Более того, настоящее изобретение относится к способу лечения теплокровного животного, в частности человека, инфицированного HCV, или обладающего риском инфицирования HCV, причем указанный способ включает введение терапевтически или профилактически эффективного количества соединения формулы I. Таким образом, соединения формулы I, как описано в настоящем описании, можно использовать в качестве лекарственного средства, в частности в качестве лекарственного средства для лечения или профилактики инфекции HCV. Указанное применение в качестве лекарственного средства или способа лечения включает системное введение инфицированным HCV индивидуумам или восприимчивым к инфекции HCV индивидуумов количества, эффективного для борьбы с состояниями, ассоциированными с инфекцией, или количества, эффективного для предупреждения инфекции HCV. Настоящее изобретение также относится к применению соединений по настоящему изобретению для изготовления лекарственного средства для лечения или профилактики инфекции HCV. Главным образом, предусматривается, что эффективное противовирусное суточное количество может составлять от приблизительно 0,01 до приблизительно 50 мг/кг, или от приблизительно 0,02 до приблизительно 30 мг/кг массы тела. Может быть пригодным введение требуемой дозы в качестве одной,двух, трех, четырех или более субдоз через соответствующие интервалы на протяжении суток. Указанные субдозы можно изготавливать в виде единичных дозированных форм, например, содержащих от приблизительно 1 до приблизительно 500 мг, или от приблизительно 1 до приблизительно 100 мг, или от приблизительно 2 до приблизительно 50 мг активного ингредиента на единичную дозированную форму. Настоящее изобретение также относится к комбинациям соединений формулы (I) или любой их подгруппы, как указано в настоящем описании, с другими средствами против HCV. Термин "комбинация" может относиться к продукту или набору, содержащему (а) соединение формулы I, как указано выше, и (b) по меньшей мере одно другое соединение, способное лечить инфекцию HCV (обозначаемое в настоящем описании как средство против HCV), в качестве комбинированного препарата для одновременного, отдельного или последовательного применения при лечении инфекций HCV. В одном варианте осуществления изобретение относится к комбинации соединений формулы (I) или любой их подгруппы по меньшей мере с одним средством против HCV. В конкретном варианте осуществления изобретение относится к комбинации соединений формулы (I) или любой их подгруппы по меньшей мере с двумя средствами против HCV. В конкретном варианте осуществления, изобретение относится к комбинации соединений формулы (I) или любой их подгруппы по меньшей мере с тремя средствами против HCV. В конкретном варианте осуществления, изобретение относится к комбинации соединений формулы (I) или любой их подгруппы по меньшей мере с четырьмя средствами против HCV. Комбинацию ранее известных средств против HCV, таких как интерферон- (IFN-), пегилированный интерферон-, рибавирин или их комбинация, и соединений формулы (I) или любой их подгруппы можно использовать в качестве лекарственного средства в комбинированной терапии. Средства, которые можно комбинировать с соединениями по настоящему изобретению, включают,например, нуклеозидные и ненуклеозидные ингибиторы полимеразы HCV, ингибиторы протеазы, ингибиторы хеликазы, ингибиторы NS4B и средства, которые функционально ингибируют участок внутренней посадки рибосомы (IRES) и другие средства, которые ингибируют прикрепление HCV к клетке или проникновение вируса внутрь, трансляцию РНК HCV, транскрипцию РНК HCV, репликацию или созревание HCV, сборку или высвобождение вируса. Конкретные соединения в этих классах включают ингибиторы протеазы HCV, такие как телапревир (VX-950), боцепревир (SCH-503034), нарлапревир (SCH900518), ITMN-191 (R-7227), ТМС 435350 (ТМС 435), МК-7009, BI-201335, BI-2061 (цилупревир), BMS650032, АСН-1625, АСН-1095, GS 9256, VX-985, IDX-375 (ингибитор кофактора протеазы NS4A HCV),VX-500, VX-813, РНХ-1766, РНХ 2054, IDX-136, IDX-316, ABT-450, EP-013420 (и родственные соединения) и VBY-37 6; нуклеозидные ингибиторы полимеразы HCV, пригодные для изобретения, включаютR7128, PSI-7851, PSI 7977, IDX-189, IDX-184, IDX-102, R1479, Х-08189, PSI-6130, PSI-938 и PSI-879 и различные другие аналоги нуклеозидов и нуклеотидов и ингибиторы HCV, включая ингибиторы, полученные в качестве 2'-С-метилмодифицированных нуклеозидов, 4'-азамодифицированных нуклеозидов, и 7'-деазамодифицированных нуклеозидов, например 4-амино-1-[5-азидо-4-гидрокси-5-гидроксиметил-3- 13022839 метилтетрагидрофуран-2-ил]пиримидин-2(1 Н)-он (ссылка 1) и его бис-2-метилпропаноатный сложный эфир. Ненуклеозидные ингибиторы полимеразы HCV, пригодные для изобретения, включают HCV-796,HCV-371, VCH-759, VCH-916, VCH-222, ANA-598, МК-3281, АВТ-333, АВТ-072, PF-00868554, BI207127, GS-9190, А-837093, JKT-109, GL-59728, GL-60667, АВТ-072, AZD-2795 и 13-циклогексил-3 метокси-17,23-диметил-7 Н-10,6-(метаноиминотиоиминоэтанооксиэтаноиминометано)индоло[2,1-а][2] бензазепин-14,24-диона 16,16-диоксид. Другие средства против HCV охватывают средства, выбранные из ингибиторов полимеразы HCV,R-7128, МК-0608, АВТ-333, VCH759, PF-868554, GS9190, NM283,VCH-222, VCH-916, BI207217, АВТ 072, IDX-102, PSI-7851, PSI-938, валопицитабина, PSI-6130, XTL-2125, NM-107, R7128 (R4048),GSK625433, R803, R-1626, BILB-1941, HCV-796, JTK-109 и JTK-003, ANA-598, IDX-184, МК-3281, МК 1220, производных бензимидазола, производных бензо-1,2,4-тиадиазина, производных фенилаланина, А 831 и А-689; ингибиторов протеаз HCV (NS2-NS3 и NS3-NS4A), соединений WO 02/18369 (см., например, стр. 273, строки 9-22, и со стр. 274, строка 4, по стр. 276, строка 11), BI-1335, TMC435, МК 7009,ITMN-191, МК-7009, BI-201335, SCH900518, VX-813, АВТ-450, VBY376, РНХ-1766, АСН-1625, BILN2061, VX-950, BILN-2065, BMS-605339, VX-500, SCH 503034; ингибиторы других мишеней в жизненном цикле HCV, включая ингибиторы хеликазы и металлопротеиназы, ISIS-14803; иммуномодулирующие средства, такие как -, - и -интерфероны такие как rIFN- 2b, rIFN-2ba, консенсусный IFN- (инферген), ферон, реаферон, интермакс , rIFN-, инферген + актиммун, IFN-омега с DUROS, альбуферон,локтерон, ребиф, пероральный IFN-, IFN- 2b XL, AVI-005, пегилированный инферген, пегилированные соединения-производные интерферона-, такие как пегилированный rIFN- 2b, пегилированныйrIFN- 2 а, пегилированный IFN-, соединения, которые стимулируют синтез интерферона в клетках,интерлейкины, агонисты Toll-подобного рецептора (TLR), соединения, которые усиливают развитие ответа хелперных Т-клеток типа 1 и тимозин; другие противовирусные средства, такие как рибавирин, аналоги рибавирина, такие как ребетол, копегус и вирамидин (тарибавирин), амантадин и телбувидин, ингибиторы внутренней посадки рибосомы, ингибиторы альфа-глюкозидазы 1, такие как МХ-3253 (целгосивир) и UT-231B, гепатопротекторы, такие как IDN-6556, МЕ-3738, LB-84451 и MitoQ, вирусные ингибиторы широкого спектра, такие как ингибиторы IMPDH (например, соединения US 5807876, US 6498178,US 6344465, US 6054472, WO 97/40028, WO 98/40381, WO 00/56331, микофеноловая кислота и ее производные и включая, но не ограничиваясь ими, VX-497, VX-148, и/или VX-944); и другие лекарственные средства для лечения HCV, такие как задаксин, нитазоксанид, BIVN-401 (виростат), PYN-17 (алтирекс),KPE02003002, актилон (CPG-10101), KRN-7000, сивасир, GI-5005, ANA-975, XTL-6865, ANA-971, NOV205, тарвацин, ЕНС-18, NIM811, DEBIO-025, VGX-410C, EMZ-702, AVI 4 065, бавитуксимаб и оглуфанид; или комбинации любого из указанных выше. Может быть полезной разработка определенных из упомянутых выше средств против HCV в их форме пролекарства, в частности, ингибитора полимеразы HCV с нуклеозидным аналогом. Примерами таких пролекарственных форм могут быть фосфаты, фосфорамидаты или формы сложных эфиров, включающие сложные моноэфиры и сложные диэфиры. Такие пролекарства требуют превращения in vivo в свободный нуклеозид, например, в стенке пищеварительного канала или в печени, перед внутриклеточным фосфорилированием в активные формы. Таким образом, для борьбы с инфекциями HCV или их лечения, соединения формулы (I) или любые их подгруппы можно вводить совместно в комбинации, например, с интерфероном- (IFN-), пегилированным интерфероном-, рибавирином или их комбинацией, а также с терапевтическими средствами на основе антител, направленных против эпитопов HCV, малыми интерфирирующими РНК (ми РНК), рибозимами, ДНК-зимами, антисмысловой РНК, низкомолекулярными антагонистами, например, протеазыNS3, хеликазы NS3 и полимеразы NS5B. Комбинации по настоящему изобретению можно использовать в качестве лекарственных средств. Таким образом, настоящее изобретение относится к применению соединений формулы (I) или любой их подгруппы, как определено выше, для изготовления лекарственного средства, пригодного для ингибирования активности HCV y млекопитающего, инфицированного вирусами HCV, где указанное лекарственное средство используют в комбинированной терапии, причем комбинированная терапия, в частности,включает соединение формулы (I) и по меньшей мере одного другое средство против HCV, напримерIFN-, пегилированный IFN-, рибавирин или их комбинацию. В предпочтительном варианте осуществления комбинация соединений формулы (I) или любой их подгруппы с другим средством, которое изменяет репликацию вируса HCV, может действовать синергично. Взаимодействия соединений можно анализировать различными механистическими и эмпирическими способами. Одним подходом для анализа таких комбинаций являются трехмерные графики и синергические объемные вычисления, производимые MacSynergy II на основе модули Bliss Independency model (Dr.Mark Pritchard, University of Alabama, Tuscaloosa, AL). По существу, соединения по настоящему изобретению в комбинации с другим средством, которое изменяет репликацию вируса HCV, называют действующими синергично или имеющими синергический эффект, когда величины, выраженные в нМ 2%(объем синергии) составляют от 25 до 50 нМ 2% (небольшая но значимая величина синергии), от 50 до 100 нМ 2% (умеренная синергия) или более 100 нМ 2% (сильная синергия). Следующие примеры предназначены для иллюстрации изобретения и их не следует истолковывать как ограничение его объема. Примеры Пример 1. Синтез соединений формулы XVIIIa (А=). 1.1. Получение промежуточного соединения IIa (PG=Boc; X=Br) К раствору Boc-L-пролина (2669 мг, 12,4 ммоль) в смеси пиридин/DMF (30 мл, 1/1) добавляли ди(1 Н-имидазол-1-ил)кетон (2205 мг, 13,6 ммоль). Смесь перемешивали при 45 С в течение 2 ч. Добавляли 4-бромбензол-1,2-диамин (2319 мг, 12,4 ммоль) и смесь перемешивали при температуре окружающей среды в течение ночи. Растворитель удаляли и осадок нагревали в уксусной кислоте (15 мл) при 100 С в течение 30 мин. После концентрирования осадка смесь распределяли между этилацетатом и насыщенным раствором бикарбоната натрия. Органическую фазу отделяли и промывали водой, смесь сушили над Na2SO4 и фильтровали, и фильтрат концентрировали в вакууме. Полученный осадок очищали флэш-хроматографией с использованием CH2Cl2/EtOAc от 90/10 до 50/50, с получением соединения На(3,146 г, 69%). 1.1 а. Получение промежуточного соединения IIb (PG=Cbz; X=Br)(300 мл) добавляли CDI (28,6 г, 176,4 ммоль). Реакционную смесь перемешивали при 45 С в течение 2 ч. Добавляли 4-бром-1,2-диаминобензол (30 г, 160,4 ммоль) и реакционную смесь далее перемешивали в течение 16 ч при комнатной температуре. Растворитель удаляли при пониженном давлении, осадок растворяли в уксусной кислоте (100 мл) и перемешивали в предварительно нагретом колбонагревателе при 100 С в течение 40 мин. Затем растворитель удаляли при пониженном давлении. Полученный осадок растворяли в дихлорметане (500 мл) и воде (300 мл). Органический слой отделяли от водного слоя, промывали 0,5 н. HCl (300 мл), а затем насыщенным раствором NaHCO3 (300 мл). После высушивания с помощью MgSO4 и концентрирования в вакууме продукт очищали колоночной хроматографией (градиентное элюирование дихлорметаном до 10% EtOAc в дихлорметане) с получением соединения IIb (17,1 г,25%). 1.2. Получение промежуточного соединения IIIa (PG=Boc) К смеси IIa (200 г, 546 ммоль), ацетата калия (160,8 г, 1,64 моль) и 4,4,4',4',5,5,5',5'-октаметил-2,2'бис(1,3,2-диоксаборолана) (416 г, 1,64 моль) в DMF (3 л) добавляли Pd(dppf)Cl2 (20 г) в газообразном азоте. Реакционную смесь перемешивали при 85 С в течение 15 ч. Смесь разбавляли этилацетатом, промывали водой и солевым раствором, сушили над сульфатом магния, твердые вещества удаляли фильтрацией и растворители фильтрата удаляли при пониженном давлении. Осадок очищали колоночной хроматографией на кремниземе (петролейный эфир:этилацетат от 10:1 до 2:1) с получением 125 г IIIa в виде белого твердого вещества (содержит 15% бороновой кислоты). 1.3. Получение промежуточного соединения VIIIa (PG=Boc, Х=Br; А=) Стадия 1 К смеси аминометил-(4-бромфенил)кетона (50 г, 0,2 моль), 2-(1 Н-7-азабензотриазол-1-ил)-1,1,3,3 тетраметилурония гексафторфосфата метанаминия (HATU; 53 г, 0,21 моль), N-Boc-L-пролина (43,0 г, 0,2 моль) в DMF (600 мл) по каплям добавляли N,N-диизопропилэтиламин (80,0 г, 0,62 моль) в течение 30- 15022839 мин. Реакционную смесь перемешивали при 5 С в течение 1 ч. Большинство летучих компонентов удаляли в вакууме и полученный осадок распределяли между этилацетатом (600 мл) и водой (300 мл). Органический слой промывали насыщенным водным NaHCO3 (500 мл) и солевым раствором (500 мл), сушили над MgSO4, твердые вещества удаляли фильтрацией и растворители фильтрата удаляли при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией (силикагель, петролейный эфир/этилацетат от 3:1 до 1:1) с получением 60 г (62%) промежуточного соединения XXIII в виде светложелтого твердого вещества. 1 Смесь промежуточного соединения XXIII (60 г, 0,14 моль) и ацетата аммония (89 г, 1,4 моль) в ксилоле (800 мл) нагревали при кипячении с обратным холодильником в течение 16 ч. Реакционную смесь распределяли между этилацетатом (700 мл) и насыщенным раствором NaHCO3 (500 мл). Слои разделяли и водный слой экстрагировали дополнительным этилацетатом (2300 мл). Органические слои объединяли, промывали солевым раствором (500 мл), сушили над MgSO4, твердые вещества удаляли фильтрацией и растворители фильтрата выпаривали при пониженном давлении. Полученный материал перекристаллизовывали из смеси этилацетат/петролейный эфир с получением желтого твердого вещества, VIIIa, 25 гH-ЯМР (CD3OD, 400 МГц):7,62 (д, J=8,4 Гц, 2 Н), 7,51 (д, J=8,4 Гц, 2 Н), 7,31-7,36 (м, 1 Н), 4,934,98 (м, 1 Н), 3,66-3,70 (м, 1 Н), 3,48-3,54 (м, 1 Н), 2,29-2,41 (м, 1 Н), 1,93-2,17 (м, 3 Н), 1,48 (с, 3 Н), 1,27 (с,6 Н). 1.4. Получение промежуточного соединения XVIIa (PG=Boc, К VIIIa (1138 мг, 2,90 ммоль) и тетракис(трифенилфосфин)палладию (140 мг, 0,121 ммоль) в толуоле в атмосфере азота добавляли 2 M Na2CO3 (2,5 мл, 5,0 ммоль) и соединение IIIa (1,0 г, 2,42 ммоль) в метаноле. Энергично перемешиваемую смесь нагревали до 80 С в атмосфере азота и перемешивали при этой температуре в течение ночи. После охлаждения до комнатной температуры добавляли CH2Cl2 (15 мл), а затем воду (10 мл). Органический слой отделяли и водный слой экстрагировали CH2Cl2. Объединенные органические слои сушили над Na2SO4 и после фильтрации концентрировали до сухого состояния при пониженном давлении с получением коричневого осадка. Этот осадок очищали колоночной хроматографией с от CH2Cl2 до CH2Cl2/метанол 90/10 в качестве элюента с получением соединенияXVIIa (878 мг, 61%). 1.5. Получение промежуточного соединения XVIIIa (А= К раствору XVIIa (878 мг, 1,47 ммоль) в изопропаноле (5 мл) добавляли HCl (5-6 M в изопропаноле,15 мл). Смесь перемешивали при комнатной температуре в течение ночи. Растворитель выпаривали, полученное твердое вещество XVIIIa сушили в вакууме и использовали как есть на следующей стадии. Пример 2. Синтез соединений формулы XVIIIb (A=2.1 Получение L-boc-пролинола Комплекс боранметилсульфид (180 мл, 1,80 моль) по каплям добавляли к раствору N-Boc-L- 16022839 пролина (300 г, 1,39 моль) в безводном THF (3,0 л), который охлаждали до 0 С. Когда выделение газа прекращалось, ледяную баню удаляли и раствор перемешивали при 10 С в течение 18 ч. Тонкослойная хроматография (TLC) показала, что исходного материала не осталось и что образовывался желаемый продукт. Раствор охлаждали до 0 С и медленно добавляли метанол (2,4 л). Растворители удаляли при пониженном давлении. Осадок разбавляли в дихлорметане (1 л), промывали NaHCO3 (500 мл, насыщенный, водный) и солевым раствором (500 мл), сушили над MgSO4, твердые вещества удаляли фильтрацией и растворители фильтрата удаляли при пониженном давлении с получением белого твердого вещества, 260 г (93%), используемого на следующей стадии без дальнейшей очистки. 2.2. Получение L-boc-пролиналя К раствору L-boc-пролинола (100 г, 500 ммоль) в CH2Cl2 (1,5 л) при 0 С последовательно добавляли при энергичном перемешивании 2,2,6,6-тетраметилпиперидин-1-оксил (TEMPO; 1,56 г, 10 ммоль) и NaBr(5,14 г, 50 ммоль) . К полученной смеси по каплям добавляли раствор NaHCO3 (6,3 г, 75 ммоль) и 6%NaClO в активном хлоре (750 мл, 750 ммоль) при 0 С в течение 1 ч. TLC показала, что исходного материала не осталось и что образовался желаемый продукт. Смесь быстро экстрагировали дихлорметаномNa2S2O3 (10%, 1 л) и солевым раствором (1,5 л), сушили над MgSO4, твердые вещества удаляли фильтрацией, и растворители упаривали с получением желтого масла, L-boc-пролиналя, (89 г, 92%), используемого на следующей стадии без дальнейшей очистки. 2.3. Получение промежуточного соединения XXIV К раствору L-boc-пролиналя (89 г, 0,44 моль) и глиоксаля (183 мл, 40% в воде) в метаноле (1 л) по каплям добавляли водный раствор аммиака (25-28%, 200 мл). Реакционную смесь закрывали и подвергали реакции при 10 С. Через 16 ч добавляли дополнительный глиоксаль (20 мл) и водный раствор аммиака (20 мл) и подвергали реакции в течение дополнительных 6 ч. Растворители удаляли при пониженном давлении и неочищенное вещество разбавляли этилацетатом (1,0 л), промывали водой и солевым раствором, сушили над MgSO4, твердые вещества удаляли фильтрацией и растворители удаляли при пониженном давлении. Неочищенное вещество очищали колоночной хроматографией (силикагель, от дихлорметана до смеси метанол/дихлорметан 1:70) с получением 73 г (70%) промежуточного соединения XXIV в виде белого твердого вещества. 1H-ЯМР (CD3OD, 400 МГц):6,95 (с, 2 Н), 4,82-4,94 (м, 1 Н), 3,60-3,70 (м, 1 Н), 3,41-3,50 (м, 1 Н),2,20-2,39 (м, 1 Н), 1,91-2,03 (м, 3 Н), 1,47 (с, 3 Н), 1,25 (с, 6 Н). 2.4. Получение промежуточного соединения XIIIa (PG=Boc) К охлажденному (баня с ледяным этанолом, -10 С) раствору XXIV (63,0 г, 0,26 моль) в CH2Cl2 (1,5 л) порционно добавляли N-бромсукцинимид (47,2 г, 0,26 моль) в течение 1 ч и перемешивали при сходной температуре в течение 2 ч. Реакционную смесь концентрировали в вакууме и осадок очищали препаративной ВЭЖХ с получением 25,3 г (30%) XIIIa в виде светло-желтого твердого вещества. 1 Н-ЯМР (CD3OD, 400 МГц)6,99-7,03 (с, 1 Н), 4,77-4,90 (м, 1 Н), 3,61-3,68 (м, 1 Н), 3,42-3,50 (м, 1 Н),2,20-2,39 (м, 1 Н), 1,89-2,05 (м, 3 Н), 1,47 (с, 3 Н), 1,27 (с, 6 Н). 2.4 а. Получение промежуточного соединения XIII'a (PG=Boc) К раствору йода (43,3 г, 170,5 ммоль, 2 экв.) в хлороформе (210 мл) в круглодонной колбе (1 л) добавляли суспензию XXIV (20 г, 84,3 ммоль) в водном растворе NaOH (2 M, 210 мл). Смесь перемешивали при комнатной температуре в течение 15 ч. К полученной реакционной смеси добавляли насыщенный водный раствор Na2S2O3 (100 мл) и органический слой отделяли. Водный слой экстрагировали хлороформом (4150 мл). Органические слои объединяли, промывали водой и сушили над сульфатом магния.- 17022839 Твердые вещества отфильтровывали и раствор упаривали до сухого состояния с получением дийодида(38,61 г, 89%). Описанное выше промежуточное соединение дийодид (2,24 г, 4,58 ммоль) и сульфит натрия (4,82 г, 38 ммоль) помещали в круглодонную колбу (100 мл) и суспендировали в смеси 30%EtOH/вода (80 мл). Полученную смесь кипятили с обратным холодильником в течение 40 ч. Растворитель удаляли, и после добавления H2O (20 мл) смесь перемешивали при комнатной температуре в течение ночи. Твердые вещества отфильтровывали, промывали водой и сушили в вакуумной печи с получением соединения XIII'а (1,024 г, 61%). 1H-ЯМР (400 МГц, DMSO-d6):м.д. 1,16 и 1,38 (2 ушир. с, 9 Н), 1,68-2,02 (м, 3 Н), 2,02-2,27 (м, 1 Н),3,18-3,38 (м, 1 Н), 3,38-3,59 (м, 1 Н), 4,53-4,88 (м, 1 Н), 6,81 (м, приблизительно 0,1 Н), 7,05-7,28 (м, приблизительно 0,9 Н), 11,90-12,20 (м, приблизительно 0,9 Н), 12,22-12,40 (м, приблизительно 0,1 Н). 2.5. Получение промежуточного соединения XVb (X=Br; 2,6-Дибромнафталин (6,92 г, 24,2 ммоль), бороновый сложный эфир IIIa (2 г, 4,84 ммоль), NaHCO3(813 мг, 9,68 ммоль), (dppf)PdCl2 (710 мг, 0,968 ммоль) растворяли в толуоле (75 мл). Добавляли воду (1 мл) и смесь нагревали в течение 7 ч при кипячении с обратным холодильником. Твердые вещества удаляли фильтрацией над дикалитом и фильтрат выпаривали до сухого состояния на кремниземе. Осадок очищали колоночной хроматографией элюированием градиентом от гептана до этилацетата. Соответствующие фракции объединяли и растворитель удаляли при пониженном давлении. Осадок (1,89 г, 79%) использовали как есть на следующей стадии. 2.6. Получение промежуточного соединения XVIb (A= Бромид XVb (1890 мг, 3,83 ммоль), 4,4,4',4',5,5,5',5'-октаметил-2,2'-бис(1,3,2-диоксаборолан) (2437 мг, 9,59 ммоль), KF (390 мг; 6,71 ммоль) и (dppf)PdCl2 (281 мг, 0,384 ммоль) растворяли в толуоле (50 мл) и нагревали в течение 3 суток при кипячении с обратным холодильником. Твердые вещества удаляли фильтрацией через дикалит и фильтрат выпаривали до сухого состояния на диоксиде кремния. Осадок очищали колоночной хроматографией с использованием градиента от гептана до этилацетата. Фракции,содержащие продукт, объединяли и растворитель удаляли при пониженном давлении. Осадок (1,22 г,59%) использовали как есть в следующей реакции. 2.6 а. Альтернативное получение промежуточного соединения XVIb (А=CH2Cl2 (50 мл) и водный слой отделяли. Органический слой сушили над MgSO4 и после фильтрации фильтрат концентрировали с получением клейкого твердого вещества. Осадок очищали колоночной хроматографией (петролейный эфир/этилацетат от 15/1 до 1/1) с получением XVb (20 г; 40,6 ммоль). Соединение XVb (1 г, 2,0 ммоль), ацетат калия (0,5 г, 5,0 ммоль), 4,4,4',4',5,5,5',5'-октаметил-2,2'-бис(1,3,2 диоксаборолан) (1,29 г, 5,0 ммоль) и Pd(dppf)Cl2 (0,1 г) перемешивали в DMF (15 мл) в атмосфере аргона. Смесь нагревали при 60 С в течение 5 ч. После охлаждения добавляли CH2Cl2 (50 мл) и смесь промывали насыщенным NaHCO3. Водный слой отделяли и экстрагировали CH2Cl2. Органические слои объединяли и сушили над MgSO4. После фильтрации растворитель удаляли и продукт очищали колоночной хроматографией (элюирование градиентом петролейный эфир/этилацетат от 10/1 до 1/1) с получением XVIb (0,7 г, 1,3 ммоль, 65%) в виде светло-желтого твердого вещества. 2.6b. Получение промежуточного соединения VIIIb (X=Br; А= Стадия 1 6-Бром-2-нафтойную кислоту (72,3 г, 282 ммоль, 1,0 экв.) суспендировали в дихлорметане (600 мл) и добавляли DMF (каталитический, 5 капель). Порционно добавляли оксалилхлорид (71,6 г, 564 ммоль,2,0 экв.) в течение 1 ч. Реакционную смесь перемешивали в течение ночи с сушильной трубкой с CaCl2,помещенной в колбу. Происходило полное растворение. Реакционную смесь концентрировали, добавляли дихлорметан (100 мл) и растворитель вновь выпаривали с получением 6-бром-2-нафтоилхлорида (76,1 г, 100%) в виде масла, которое использовали на следующей стадии. Стадия 2 Гидрохлорид N,О-диметилгидроксиламина (41,3 г, 423 ммоль, 1,5 экв.) растворяли в дистиллированной воде (200 мл) и порционно добавляли карбонат калия (117 г, 3,0 экв.) (выделение CO2). Добавляли воду (300 мл) и дихлорметан (200 мл) и к этой смеси при перемешивании добавляли раствор 6-бром 2-нафтоилхлорида (76,1 г, 282 ммоль, 1,00 экв.) в дихлорметане (300 мл). Реакционную смесь перемешивали в течение 1 ч. Органический слой отделяли, сушили над сульфатом натрия, фильтровали, концентрировали и сушили в вакууме в течение ночи с получением 6-бром-N-метокси-N-метил-2-нафтамида(82,9 г, 100%) в виде коричневого твердого вещества. Стадия 3(600 мл) в 4-горлой колбе в атмосфере азота. Реакционную смесь охлаждали на ледяной бане и по каплям добавляли метилмагнийбромид (3,2 M в метилтетрагидрофуране, 197 мл, 2,2 экв.) в течение 1 ч при поддержании температуры реакционной смеси между 10-15 С. Реакционную смесь перемешивали в течение последующих 30 мин на ледяной бане. Затем при охлаждении на ледяной бане осторожно по каплям добавляли водный раствор хлористо-водородной кислоты (2 М, 100 мл). Органический растворитель выпаривали и осажденный продукт экстрагировали дихлорметаном (500 мл). Раствор сушили над сульфатом натрия, фильтровали и концентрировали. Твердый осадок сушили в вакууме при 40 С с получением 1-(6 бромнафталин-2-ил)этанона (70,6 г, 99%). Альтернативная методика получения 1-(6-бромнафталин-2-ил)этанона Смесь 2-бромнафталина (41,4 г, 200 ммоль), ацетилхлорида (11,3 мл, 160 ммоль), нитробензола (250 мл) и AlCl3 (28 г, 210 ммоль) перемешивали в течение 4 ч при 100 С (температура масляной бани). Полученную реакционную смесь охлаждали, выливали в лед/воду (100 мл) и фильтровали. Фильтрат промывали водой (100 мл). Растворитель (нитробензол) удаляли дистилляцией. Полученный осадок кристаллизовали из гексана с получением 18 г желаемого продукта (выход 36%). 1-(6-Бромнафталин-2-ил) этанон: 1 Н-ЯМР (400 МГц, ацетонитрил-d3):м.д. 2,66 (с, 3 Н) 7,66 (дд,J=8,8, 2,0 Гц, 1 Н) 7,86 (д, J=8,8 Гц, 1 Н) 7,94 (д, J=8,8 Гц, 1 Н) 8,02 (дд, J=8,8, 1,8 Гц, 1 Н) 8,13 (д, J=2,0 Гц,1 Н) 8,53 (д, J=1,8 Гц, 1 Н). Стадия 4 1-(6-Бромнафталин-2-ил)этанон (55,6 г, 223 ммоль, 1,0 экв.) растворяли в дихлорметане (1,3 л). По каплям добавляли дибром (78,3 г, 4 90 ммоль, 2,2 экв.) в течение 30 мин. Реакционную смесь перемешивали в течение 1 ч и концентрировали с получением 2,2-дибром-1-(6-бромнафталин-2-ил)этанона в виде твердого вещества, которое использовали как есть на следующей стадии. 2,2-дибром-1-(6-бромнафталин 2-ил)этанон (90,0 г, 221 ммоль, 1,00) растворяли в тетрагидрофуране (800 мл), добавляли триэтиламин(27,67 мл, 199 ммоль, 0,9 экв.), а затем диэтилфосфат (45,8 г, 332 ммоль, 1,50 экв.). Реакционную смесь перемешивали в течение ночи. Реакционную смесь фильтровали и растворитель удаляли в вакууме. По- 19022839 лученный осадок растворяли в этилацетате (1,2 л) и промывали водой. Органический слой отделяли, сушили над сульфатом натрия, фильтровали и концентрировали с получением неочищенного 2-бром-1-(6 бромнафталин-2-ил)этанона (70,3 г). Перекристаллизация из ацетонитрила давала 30 г (первая партия) и 6,5 г (вторая партия) 2-бром-1-(6-бромнафталин-2-ил)этанона (50%). Стадия 5(150 мл) при 20 С. Добавляли (L)-Вос-пролин (3,22 г, 14,9 ммоль, 1 экв.), а затем N-этил-Nизопропилпропан-2-амин (2,83 мл, 16,4 ммоль, 1,10 экв.). Реакционную смесь перемешивали при 20 С в течение 30 мин. Реакционную смесь концентрировали. Осадок растворяли в дихлорметане и промывали последовательно водным раствором хлористоводородной кислоты (1%, 100 мл) и водным растворомNaHCO3. После высушивания над сульфатом натрия, фильтрации и концентрирования, остаточное масло(6,52 г, 94%) использовали как есть на следующей стадии. К соединению, полученному, как описано выше (6,52 г, 14,1 ммоль, 1,00 экв.), растворенному в толуоле (150 мл), добавляли ацетат аммония (16,3 г,212 ммоль, 15 экв.) и смесь кипятили с обратным холодильником в течение ночи. Реакционную смесь концентрировали и осадок кристаллизовали из ацетонитрила (100 мл). Кристаллы отфильтровывали и сушили в вакууме при 40 С с получением VIIIb (3,2 г, 51%). 2.6c. Получение промежуточного соединения Ixb (А=VIIIb (3,076 г, 6,95 ммоль), биспинаколатодибор (2,648 г, 10,43 ммоль), ацетат калия (1,365 г, 13,91 ммоль) и PdCl2 (dppf) (254 мг, 0,348 ммоль) растворяли в толуоле (30 мл) и нагревали в течение 17 ч при 85 С в атмосфере аргона. Реакционную смесь охлаждали до комнатной температуры, добавляли дихлорметан (50 мл) и смесь промывали насыщенным раствором NaHCO3. Органическую фазу сушили надMgSO4, фильтровали, концентрировали в вакууме и очищали колоночной хроматографией на силикагеле(градиентное элюирование от 20 до 50% EtOAc в гептане) с получением IXb (2,63 г, 77%). Продукт может быть осажден из смеси гексан/i-Pr2O (3/2). 2.6d. Получение промежуточного соединения VIIIc (X=Br, А= К раствору 2-бром-1-(6-бромнафталин-2-ил)этанона (57,7 г, 175,9 ммоль, чистый на 80%) в ацетонитриле (1 л), добавляли L-Cbz-пролин (43,8 г, 175,9 ммоль), а затем диизопропилэтиламин (33,4 мл,193,5 ммоль) и реакционную смесь перемешивали в течение 40 мин при комнатной температуре. Затем растворитель удаляли при пониженном давлении и полученный осадок перерастворяли в дихлорметане(500 мл), промывали 1% HCl (500 мл) и насыщенным водным раствором NaHCO3 (500 мл). Органическую фазу сушили посредством MgSO4, фильтровали и растворитель удаляли при пониженном давлении с получением коричневого маслянистого осадка (80 г), который использовали как есть на следующей стадии. Часть указанного выше осадка (69,8 г, 140,6 ммоль) и ацетата аммония (162,6 г, 2,11 моль) перемешивали в толуоле и кипятили с обратным холодильником в течение ночи. Реакционную смесь охлаждали до комнатной температуры и растворитель удаляли при пониженном давлении. Полученный осадок перемешивали в смеси дихлорметана и воды (1/1, 1500 мл) для осаждения соединения VIIIc. После фильтрации и промывания водой получали соединение VIIIc (61,3 г, 92%) в виде белого порошка. 1 Н-ЯМР (400 МГц, DMSO-d6):м.д. 1,84-2,38 (м, 4 Н), 3,42-3,56 (м, 1 Н), 3,58-3,73 (м, 1 Н), 4,84-5,20(м, 3 Н), 6,97-7,46 (м, 5 Н), 7,54-7,60 (м, 1 Н), 7,63-7,71 (м, 1 Н), 7,83-7,91 (м, 2 Н), 7,95-8,05 (м, 1 Н), 8,108,16 (м, 1 Н), 8,22-8,37 (м, 1 Н), 11,92-12,44 (м, 1 Н). 2.7. Получение промежуточного соединения XVIIb (А= К бороновому сложному эфиру XVIb (1,22 г, 2,26 ммоль), бромиду XIIIa (1072 мг, 3,39 ммоль), бикарбонату натрия (380 мг, 4,52 ммоль), Pd(dppf)Cl2 (166 мг, 0,226 ммоль) в толуоле (50 мл), добавляли воду (1 мл). Полученную смесь нагревали при кипячении с обратным холодильником в течение ночи. Реакционную смесь фильтровали, упаривали до сухого состоянии и очищали колоночной хроматографией посредством элюирования градиентом от гептана до этилацетата. Собранные фракции, содержащие продукт, объединяли и летучие вещества удаляли при пониженном давлении. Осадок (960 мг, 65%) использовали как есть в следующей реакции. 2.7 а. Альтернативная методика получения промежуточного соединения XVIIb (A=XVIb (10 г, 18,5 ммоль), ХШ'а (8,76 г, 24 ммоль ), NaHCO3 (9,32 г, 111 ммоль) и Pd(dppf)Cl2 (1 г) перемешивали в смеси диоксан/вода (140 мл, 6/1) в атмосфере аргона. Смесь нагревали до 85 С в течение 15 ч. Добавляли солевой раствор (100 мл) и смесь экстрагировали CH2Cl2, после высушивания надMgSO4, фильтрации и упаривания растворителя, осадок очищали колоночной хроматографией посредством элюирования градиентом от CH2Cl2 до EtOAc с получением XVIIb (7 г, 58%). 2.7b. Альтернативная методика получения промежуточного соединения XVIIb (A= К перемешиваемому дезоксигенированному раствору VIIIb (20,0 г, 45,2 ммоль, 1,00 экв.), IIIa (20,6 г, 49,7 ммоль, 1,1 экв.) и бикарбоната натрия (11,4 г, 136 ммоль, 3,0 экв.) в смеси 1, 4-диоксан/вода (500 мл, 5:1) в атмосфере азота добавляли комплекс 1,1'-бис(дифенилфосфино)ферроцен-палладий (II) дихлорида с дихлорметаном (2,50 г, 4,52 ммоль, 0,1 экв.). Смесь нагревали при 80 С в атмосфере аргона в течение 15 ч и охлаждали до комнатной температуры. Реакционную смесь разбавляли дихлорметаном (500 мл) и промывали солевым раствором (2150 мл), сушили над сульфатом магния; фильтровали и упаривали до сухого состояния с получением темно-коричневой пены (43 г). Пену очищали с использованием колоночной хроматографии на силикагеле (элюирование градиентом 0-6% МеОН в CH2Cl2) с получением XVIIb (19,52 г, 65%) в виде не совсем белого порошка. 2.8. Получение промежуточного соединения XVIIIb (А= К раствору XVIIb (960 мг, 1,48 ммоль ) в CH2Cl2 (25 мл) добавляли HCl (5-6 M в изопропаноле, 5 мл). Смесь перемешивали при комнатной температуре в течение ночи. Растворитель выпаривали, полу- 21022839 ченное твердое вещество сушили в вакууме и использовали как есть на следующей стадии. 2.8 а. Альтернативная методика получения промежуточного соединения XVIIIb (А=XVIIb (19,52 г, 30,1 ммоль, 1,00 экв.) растворяли в дихлорметане (200 мл) и добавляли HCl в изопропаноле (5-6 н., 300 мл). Реакционную смесь перемешивали в течение 1 ч при комнатной температуре. К суспензии добавляли tBuOMe (1000 мл) и взвесь перемешивали при комнатной температуре в течение 30 мин. Отфильтрованное твердое вещество ополаскивали tBuOMe (2100 мл) и сушили в вакууме в течение ночи с получением XVIIIb в виде порошка (15,2 г). 1 Н-ЯМР (400 МГц, MeOD-d4):м.д. 2,15-2,37 (м, 2 Н), 2,37-2,52 (м, 2 Н), 2,52-2,69 (м, 2 Н), 2,69-2,88(м, 2 Н), 3,56-3,71 (м, 4 Н), 5,19-5,41 (м, 2 Н), 7,90-8,02 (м, 3 Н), 8,05 (дд, J=8,6, 1,6 Гц, 1 Н), 8,10-8,25 (м,4H), 8,30 (д, J=1,4 Гц, 1 Н), 8,47 (д, J=1,2 Гц, 1 Н). Пример 2a. Синтез соединений формулы XXVI и XXVII А= 2 а.1. Получение промежуточного соединения XXVb (А= К IXb (2,63 г, 5,37 ммоль), IIb (2,80 г, 6,99 ммоль), PdCl2(dppf) (298 мг, 0,537 ммоль) и бикарбонату натрия (1,354 г, 16,12 ммоль) добавляли смесь диоксан/вода (50 мл, 5/1). Реакционную смесь нагревали в течение 13 ч при 80 С в атмосфере аргона. Реакционную смесь охлаждали до комнатной температуры,разбавляли дихлорметаном и добавляли солевой раствор, смесь фильтровали через декалит и органическую фазу отделяли. Органическую фазу сушили посредством MgSO4, растворитель удаляли при пониженном давлении и очищали колоночной хроматографией (градиент от 0 до 3% метанола в CH2Cl2) с получением XXVb (2,086 г, 57%). 2 а.2. Получение промежуточного соединения XXVc (А=(17,36 г, 206,7 ммоль) в смеси диоксан/вода (500 мл, 5/1) продували азотом в течение 10 мин, а затем добавляли PdCl2(dppf) (5,04 г, 6,889 ммоль). Смесь нагревали в течение 15 ч в атмосфере аргона при 80 С. Реакционную смесь охлаждали до комнатной температуры, разбавляли дихлорметаном (500 мл) и промывали солевым раствором (2300 мл). Органическую фазу сушили над MgSO4, фильтровали и упаривали с получением черной пены. Смесь перемешивали в EtOAc (300 мл), черный осадок отфильтровывали и осадок на фильтре промывали дополнительным EtOAc (200 мл). К смеси EtOAc-фильтрат медленно добавляли гептан (1,5 л) и осадок отфильтровывали. Выход XXVc (28,35 г, 60%). 2 а.3. Получение XXVIIb (A= К раствору XXVb (2,086 г, 3,054 ммоль), Pd/C (10%, 0,5 г) и нескольких капель воды в метаноле (40 мл) добавляли карбонат калия (334 мг, 2,42 ммоль). Реакционную смесь помещали в атмосферу водорода на 2,5 ч. Смесь фильтровали через декалит, растворитель удаляли при пониженном давлении и продукт очищали колоночной хроматографией на силикагеле (градиент метанола в CH2Cl2 0-3%, затем CH2Cl2 метанол/NH3 (7 н.) от 3-10%) с получением XXVIIb (1,018 г, 61%). 2 а.4. Получение XXVIb (A= К смеси 10% Pd/C (2 г), XXVc (26,35 г, 38,6 ммоль, 1,00 экв.), метанола (800 мл) и воды (5 мл) в круглодонной колбе (2 л) добавляли карбонат калия (4,8 г, 34,7 ммоль, 0,9 экв.). Реакционную смесь перемешивали в атмосфере водорода в течение ночи. Затем добавляли дополнительный катализатор (10% Pd/C, 2 г) и реакционную смесь далее перемешивали в атмосфере водорода в течение 2 ч. Затем добавляли дополнительный карбонат калия (4,8 г, 34,7 ммоль, 0,9 экв.) и катализатор(10% Pd/C, 2 г) и смесь далее перемешивали в атмосфере водорода в течение ночи. Реакционную смесь фильтровали через дикалит speed plus (диатомовая фильтрующая присадка) и промывали метанолом(2x50 мл). Растворитель выпаривали с получением коричневатого порошка, который растворяли в дихлорметане (400 мл) и промывали водой (2200 мл), сушили над сульфатом магния, фильтровали и упаривали до сухого состояния. Полученный неочищенный материал (23 г) подвергали колоночной хроматографии на силикагеле (элюирование градиентом 0-5% метанола в дихлорметане, а затем 5-10% метанолом (7 н. NH3) в дихлорметане) с получением XXVIb в виде светло-коричневого порошка (13,85 г,65%). Пример 2b. Синтез N-метоксикарбониламинокислот. 2b.1 Синтез (S)-2-(метоксикарбониламино)-3-метилбутановой кислоты К L-валину (20 г, 167,3 ммоль) в перемешиваемом водном растворе NaOH (1 M, 167 мл) в круглодонной колбе (1 л), добавляли карбонат натрия (8,866 г, 83,6 ммоль). Колбу охлаждали до 0 С на ледяной бане. По каплям добавляли метилхлорформиат (17,4 г, 184 ммоль) и реакционной смеси позволяли перемешиваться в течение 15 ч и достигнуть комнатной температуры. Реакционную смесь разделяли простым эфиром (3200 мл), и водный слой помещали в круглодонную колбу и охлаждали на бане с ледяной водой. По каплям добавляли концентрированную HCl (водную) до рН 2. Смесь доводили до комнатной температуры и экстрагировали дихлорметаном (3200 мл). Органические слои объединяли, сушили(сульфат натрия) и твердые вещества удаляли фильтрацией. Растворители фильтрата удаляли при пониженном давлении с получением белого твердого вещества. Белое твердое вещество далее сушили в вакууме (25,3 г, 86%). 2b.2. Синтез S)-2-циклопропил-2-(метоксикарбониламино)уксусной кислоты(S)-2-Циклопропил-2-(метоксикарбониламино)уксусную кислоту синтезировали аналогично Nметоксикарбонил-L-валину с использованием L-циклопропилглицина вместо L-валина. 2b.3. Синтез 2S,3S)-2-(метоксикарбониламино)-3-метилпентановой кислоты(2S,3S)-2-(метоксикарбониламино)-3-метилпентановую кислоту синтезировали аналогично Nметоксикарбонил-L-валину с использованием L-изолейцина вместо L-валина. 2b.4. 2-(Метоксикарбониламино)-2-(тетрагидро-2 Н-пиран-4-ил)уксусная кислота 2-(метоксикарбониламино)-2-(тетрагидро-2 Н-пиран-4-ил)уксусную кислоту синтезировали аналогично N-метоксикарбонил-L-валину с использованием (S)-2-амино-2-(тетрагидро-2 Н-пиран-4 ил)уксусной кислоты вместо L-валина. 2b.5. Синтез (2S, 3R)-3-метокси-2-(метоксикарбониламино)бутановой кислоты(2S,3R)-3-метокси-2-(метоксикарбониламино)бутановую кислоту синтезировали аналогично Nметоксикарбонил-L-валину с использованием О-метил-L-треонина вместо L-валина. Экстракцию дихлорметаном проводили 10 раз вместо 3 раз. 2b.6. Синтез (S)-2-(метоксикарбониламино)-4-метилпентановой кислоты В круглодонной колбе при перемешивании (250 мл) к L-лейцину (4 г, 30,5 ммоль) добавляли водный раствор NaOH (1 M, 2,6 мл). К этому раствору добавляли карбонат натрия (1,62 г, 15,2 ммоль). Колбу охлаждали до 0 С на бане с ледяной водой. По каплям добавляли метилхлорформиат (2,6 мл, 33,5 ммоль) и реакционной смеси позволяли перемешиваться в течение 15 ч и достигнуть комнатной температуры. Реакционную смесь разделяли простым эфиром (350 мл) и водный слой концентрировали в круглодонной колбе и охлаждали на бане с ледяной водой. По каплям добавляли концентрированнуюHCl (водную) до рН 2. Реакционную смесь доводили до комнатной температуры и экстрагировали посредством 2-Me-THF (350 мл). Органические слои объединяли, сушили (MgSO4), твердые вещества удаляли фильтрацией и растворители фильтрата удаляли при пониженном давлении. Соединение очищали хроматографией на силикагеле с элюированием градиентом от CH2Cl2 до CH2Cl2/МеОН/уксусная кислота 17/2/1. Фракции, содержавшие продукт, объединяли и растворитель удаляли в вакууме с получением N-метоксикарбонил-L-лейцина (1,9 г, 32%). 2b.7. Синтез (S)-4-метокси-2-(метоксикарбониламино)бутановой кислоты К Вос-О-метил-L-гомосерин-дициклогексиламиновой соли (5 г, 12,1 ммоль) добавляли HCl в изопропаноле (5-6 н., 50 мл). Смесь перемешивали в течение ночи. Летучие вещества удаляли и осадок сушили в вакууме. К полученному осадку при перемешивании добавляли воду (10 мл) и NaOH (19 M, 2 мл). К этому раствору добавляли карбонат натрия (2,89 г, 27,3 ммоль). Колбу охлаждали до 0 С на бане с ледяной водой. По каплям добавляли метилхлорформиат (2,17 мл, 27,3 ммоль) и реакционной смеси позволяли перемешиваться в течение 15 часов и достигнуть комнатной температуры. Растворитель удаляли и осадок очищали посредством ВЭЖХ (RP Vydac Denali C18-10 мкм, 250 г, 5 см) с подвижной фазой(0,25% раствор NH4HCO3 в воде, MeOH+CH3CN), желаемые фракции собирали и растворитель удаляли с получением N-метоксикарбонил-О-метил-L-гомосерина (1,77 г, 76%). 2b.8. Синтез (2S,3R)-3-гидрокси-2-(метоксикарбониламино)бутановой кислоты В круглодонной колбе (1 л) при перемешивании к L-треонину (20 г, 30,5 ммоль) добавляют водный раствор NaOH (1 M, 167 мл). К этому раствору добавляли карбонат натрия (9,8 г, 92,3 ммоль). Колбу охлаждали до 0 С на бане с ледяной водой. По каплям добавляли метилхлорформиат (14,3 мл, 184,7 ммоль) и реакционной смеси позволяли перемешиваться в течение 15 ч и достигнуть комнатной температуры.- 24022839 Реакционную смесь промывали CH2Cl2 (350 мл) и водный слой помещали в круглодонную колбу и охлаждали на бане с ледяной водой. По каплям добавляли концентрированную HCl (водную) до рН 2. Водный раствор доводили до комнатной температуры и воду удаляли в вакууме. Осадок отбирали в смесь 2:1 МеОН/CH2Cl2 (150 мл), фильтровали и промывали смесью 2:1 МеОН/CH2Cl2 (50 мл). Фильтрат концентрировали и сушили в вакууме при 40 С с получением белой пены (29,1 г, 98%). 2b.9. Синтез (S)-2-циклопентил-2-(метоксикарбониламино)уксусной кислоты(S)-2-Циклопентил-2-(метоксикарбониламино)уксусную кислоту синтезировали аналогично Nметоксикарбонил-L-валину с использованием (S)-2-амино-2-циклопентилуксусной кислоты вместо Lвалина. 2b.10. Синтез (2S,3R)-2-(метоксикарбониламино)-3-метилпентановой кислоты(2S,3R)-2-(метоксикарбониламино)-3-метилпентановую кислоту синтезировали аналогично Nметоксикарбонил-L-валину с использованием (2S,3R)-2-амино-3-метилпентановлой кислоты вместо Lвалина. 2b.11. Синтез (R)-2-(метоксикарбониламино)-2-фенилуксусной кислоты К раствору (R)-2-амино-2-фенилуксусной кислоты (14 г, 92,6 ммоль) в воде (250 мл) добавляли LiOH (14,8 г, 618,7 ммоль) при 0 С и смесь перемешивали в течение 15 минут. К этому раствору по каплям добавляли метилхлорформиат (17,9 мл, 231,5 ммоль) и смесь перемешивали в течение 2 часов при 0 С. Затем смесь подкисляли до рН 1 концентрированной HCl. Смесь экстрагировали EtOAc и органическую фазу концентрировали в вакууме. Осадок сушили в течение ночи в вакууме с получением (R)-2(метоксикарбониламино)-2-фенилуксусной кислоты (11,8 г; 60,9 ммоль). Пример 3. Синтез соединений формулы I. 3.1. Получение соединения 1 Сухой пиридин (5 мл) добавляли к соединению XVIIIa (267 мг, приблизительно 0,49 ммоль), и растворитель удаляли в вакууме, это повторяли еще два раза. Затем добавляли сухой DMF (5 мл), DIPEA(0,845 мл, 4,91 ммоль), HATU (466 мг, 1,23 ммоль) и N-метоксикарбонил-L-валин (215 мг, 1,23 ммоль). Смесь перемешивали в течение 2 ч при комнатной температуре. Те же эквиваленты реагентов добавляли вновь и смесь далее перемешивали в течение 2 ч. Добавляли CH2Cl2 (20 мл) и смесь промывали 10% лимонной кислотой (20 мл), а затем насыщенным NaHCO3. Органическую фазу сушили над MgSO4 и твердое вещество удаляли фильтрацией. Растворитель выпаривали и проводили очистку хроматографией на силикагеле (0-10% метанол в CH2Cl2), с получением соединения 1 в виде твердого вещества (170 мг,0,226 ммоль). Способ A: Rt: 4,18 мин, m/z = 713,4 (М+1)+, точная масса: 712,37; 1H-ЯМР (400 МГц, DMSO-d6): 12,99-11,63 (2 Н, с (ушир., 7,88-7,44 (8 Н, м), 7,36-7,26 (2 Н, м), 5,26-5,16 (1 Н, м), 5,06-5,14 (1 Н, м), 4,144,04 (2 Н, м), 3,90-3,77 (4 Н, м), 3,55 (6 Н, с), 2,32-1,94 (10 Н, м), 1,00-0,79 (12 Н, м). 3.2. Получение соединений 2-4. Соединение 2 синтезировали согласно методике, описанной для соединения 1, с использованием Nметоксикарбонил-О-метил-L-треонина вместо N-метоксикарбонил-L-валина. Соединение 2. 1 Н-ЯМР (400 МГц, DMSO-d6):м.д. 12,12-12,26 (1 Н, м), 11,69-11,83 (1 Н, с (ушир.,7,33-7,86 (8 Н, м), 7,18-7,31 (2 Н, м), 5,15-5,25 (1 Н, м), 5,05-5,13 (1 Н, м), 4,25-4,38 (2 Н, м), 3,77-3,95 (4 Н,м), 3,55 (6 Н, с), 3,45-3,52 (2 Н, м), 3,20 (6 Н, с), 1,79-2,38 (8 Н, м), 1,14-1,06 (6 Н, м). Соединение 3 получали согласно методике, описанной для синтеза соединения 1, с использованием промежуточного соединения XVIIIb вместо промежуточного соединения XVIIIa.[]20D=-148, 98 (с 0,3336 мас./об.%, МеОН). Альтернативная методика получения соединения 3 и соответствующей соли HClN-метоксикарбонил-L-валин (3,09 г, 17,7 ммоль, 2,1 экв.) растворяли в дихлорметане (300 мл). Добавляли триэтиламин (11,7 мл, 84,1 ммоль, 10 экв.) и гексафторфосфат (1-циано-2-этокси-2 оксоэтилиденаминоокси)диметиламиноморфолинокарбения (7,57 г, 17,7 ммоль, 2,1 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 5 мин, после чего добавляли XVIIIb (5 г, 8,41 ммоль в случае, когда хHCl равно 4HCl). Перемешивание продолжали в течение 30 мин. К смеси добавляли HCl в iPrOH (6 н.) (до рН 2), и полученную смесь перемешивали в течение 5 мин. Затем раствор промывали насыщенным водным раствором карбоната натрия (2200 мл) и один раз солевым раствором (200 мл). Органический слой отделяли, сушили над сульфатом магния и фильтровали. После удаления растворителя в вакууме полученный осадок далее сушили в вакууме с получением оранжевого порошка (6,84 г). Порошок очищали колоночной хроматографией на силикагеле с использованием элюирования градиентом от 0 до 10% МеОН (7 н. NH3) в дихлорметане с получением соединения 3 (2,81 г) в виде пены. Соединение 3 растворяли в iPrOH (40 мл) и добавляли HCl (6 н. в iPrOH, 10 мл). Летучие вещества удаляли в вакууме. Затем добавляли iPrOH (30 мл) и смесь нагревали при кипячении с обратным холодильником. Раствор охлаждали до комнатной температуры и перемешивали при комнатной температуре в течение 4 суток. К раствору добавляли tBuOMe (100 мл) с получением белого осадка, который отфильтровывали, сразу промывали tBuOMe (310 мл) в атмосфере азота и сушили в вакууме при 40 С. Осадок смешивали с ацетонитрилом и упаривали до сухого состояния (2). Осадок перемешивали в ацетонитриле (150 мл) и смесь обрабатывали ультразвуком в течение 10 мин. Осадок отфильтровывали в атмосфере азота, промывали два раза ацетонитрилом (50 мл) и сушили в вакууме при 40 С с получением светло-желтого порошка (4 г). Соль соединения 3 с HCl: []20D=-110,02 (589 нм, 20 С, с 0,429 мас./об.%,МеОН). 1 Н-ЯМР (600 МГц, диметилформамид-d7, 280 К):м.д. 0,86 (д, J=6,6 Гц, 6 Н), 0,95 (д, J=7,0 Гц, 6 Н),2,03-2,20 (м, 2 Н), 2,26-2,37 (м, 3 Н), 2,39-2,61 (м, 5 Н), 3,61-3,63 (м, 6 Н), 3,93-4,01 (м, 2 Н), 4,23-4,32 (м,2 Н), 4,32-4,39 (м, 2 Н), 5,49 (т, J=7,5 Гц, 1 Н), 5,52 (дд, J=8,3, 5,3 Гц, 1 Н), 7,22 (д, J=8,8 Гц, 1 Н), 7,27 (д,J=8,8 Гц, 1 Н), 7,98 (д, J=8,6 Гц, 1 Н), 8,01 (дд, J=8,6, 1,1 Гц, 1 Н), 8,03 (дд, J=8,8, 1,8 Гц, 1 Н), 8,09 (д, J=8,8 Гц, 1 Н), 8,19 (д, J=8,8 Гц, 1 Н), 8,22 (дд, J=8,4, 1,8 Гц, 1H), 8,25 (с, 1 Н), 8,32 (с, 1 Н), 8,41 (с, 1 Н), 8,88 (с,1 Н). Аналитически вычислено для C42H50N8O62HCl4H2O: С 55,56, H 6,66, N 12,34. Найдено: С 55,00, H 6,60, N 12,30. Соединение 4 получали согласно методике, описанной для синтеза соединения 2, с использованием промежуточного соединения XVIIIb вместо промежуточного соединения XVIIIa. 1(м, 3 Н), 7,21-7,33 (м, 2 Н), 5,18-5,24 (м, 1 Н), 5,06-5,16 (м, 1 Н), 4,31 (м, 2 Н), 3,80-3,95 (м, 4 Н), 3,56 (с, 6 Н),3,43-3,53 (м, 2 Н), 3,20 (с, 6 Н), 1,80-2,35 (м, 8 Н), 1,05-1,20 (м, 6 Н). 3.3. Получение соединений 9, 11, 13, 16, 17, 18. 3.3.1. Получение соединения 9. 3.3.1.1. Получение промежуточного соединения XIIIb К XIII'а (5,3 г, 14,6 ммоль) в CH2Cl2 (10 мл) при 0 С добавляли TFA (25 мл). Смесь нагревали до комнатной температуры и перемешивали в течение 30 мин. Летучие вещества удаляли и к полученной соли (S)-4-йод-2-(пирролидин-2-ил)-1 Н-имидазола с TFA добавляли CH2Cl2 (10 мл) и DIPEA (15 мл).- 26022839 Половину этой смеси использовали далее. В другой колбе к (S)-2-(метоксикарбониламино)-3 метилбутановой кислоте (1,77 г, 10,12 ммоль) и HATU (3,57 г, 9,4 0 ммоль) добавляли сухой DMF (5 мл). Добавляли DIPEA (5 мл, 28,7 ммоль), а затем половину указанной выше смеси (S)-4-йод-2-(пирролидин 2-ил)-1 Н-имидазола. Смесь перемешивали в течение ночи. Добавляли CH2Cl2 и смесь промывали солевым раствором,10% АсОН и насыщенным NaHCO3. После высушивания с помощью MgSO4 и фильтрации растворитель удаляли. Смесь очищали колоночной хроматографией с использованием элюирования градиентом от CH2Cl2 до CH2Cl2/МеОН 95/5. Фракции, содержащие продукт, объединяли и растворитель удаляли. Полученный осадок растворяли вCH2Cl2 и промывали 10% лимонной кислотой. Водный слой осторожно нейтрализовывали насыщенным водным раствором NaHCO3 и вновь экстрагировали CH2Cl2. Органические слои сушили с помощьюNa2SO4 и после фильтрации растворитель удаляли. Полученное XIII'b (7 90 мг, 26%) использовали как есть в следующей реакции. 3.3.1.2. Получение промежуточного соединения XXIb(dppf)Cl2 (138 мг, 0,188 ммоль) растворяли в смеси THF/H2O (2,5 мл, 4/1) и нагревали при облучении микроволновым излучением в течение 60 мин при 100 С. Реакционную смесь фильтровали через дикалит, летучие вещества удаляли из фильтрата путем выпаривания на ротационном испарителе и осадок очищали колоночной хроматографией на силикагеле (элюирование градиентом от CH2Cl2 доCH2Cl2/MeOH 9/1). Фракции, содержащие XXIb, объединяли и растворитель удаляли при пониженном давлении с получением XXIb в виде не совсем белого порошка (580 мг, 44%). Альтернативно соединение XXIb можно получать, начиная с соединения XXVIb, аналогично тому,как описано для синтеза соединения XXIc из XXVIb, за исключением того, что для синтеза XXIb вместо(2S,3S)-2-(метоксикарбониламино)-3-метилпентановой кислоты, которую используют для синтеза XXIc,используют (S)-2-(метоксикарбониламино)-3-метилбутановую кислоту. 3.3.1.3. Получение соединения 9 К XXIb (580 мг, 0,822 ммоль ) в CH2Cl2 (10 мл), добавляли HCl в iPrOH (5-6 н., 3 мл). Смесь перемешивали при комнатной температуре в течение 2 ч. Летучие вещества удаляли и добавляли основание Хунига (0,53 мл, 4 экв.) в DMF (5 мл). Эту смесь добавляли к предварительно смешанному (10 мин) раствору HATU (469 мг, 1,23 ммоль, 1,5 экв), (2S,3R)-3-метокси-2-(метоксикарбониламино)бутановой кислоты (318 мг, 1,64 ммоль, 2 экв.) и основания Хунига (0,15 мл, 1,1 экв.) в DMF (5 мл). Реакционную смесь перемешивали в течение 30 мин. Добавляли 15 капель концентрированной HCl и через 15 мин ле- 27022839 тучие вещества удаляли выпариванием на ротационном испарителе. Осадок очищали колоночной хроматографией на силикагеле элюированием градиентом от CH2Cl2 до 9/1 CH2Cl2/МеОН (7 н. NH3). Фракции,содержащие продукт, объединяли и растворитель удаляли при пониженном давлении с получением продукта 9 в виде белого порошка (121 мг, 18%).[]20D=-137,04 (с 0,3736 мас./об. %, МеОН). 1 Н-ЯМР (600 МГц, CD3OD-d4):м.д. 8,04-8,25 (2 Н, м) 7,37-7,97 (8 Н, м), 5,33 (1 Н, дд, J=4,7; 7,9 Гц),5,21 (1 Н, дд, J=5,6; 7,9 Гц) 4,48 (1 Н, д, J=4,7; Гц) 4,25 (1 Н, д, J=7,6 Гц), 3,86-4,04 (4 Н, м) 3,68-3,73 (1 Н, м) 3,63-3,68 (6 Н, м) 3,27 (3 Н, с) 1,99-2,49 (9 Н, м) 1,14-1,19 (3 Н, м) 0,95-0,99 (3 Н, м) 0,90-0,93 (3 Н, м). 3.3.1.4. Получение соединения 13. Соединение 13 можно синтезировать аналогично тому, как описано для превращения XXIb в соединение 9, с использованием (2S,3S)-2-(метоксикарбониламино)-3-метилпентановой кислоты вместоH-ЯМР (400 МГц, DMSO-d6):м.д. 11,71-12,51 (2 Н, м) 7,51-8,31 (10 Н, м) 7,22-7,39 (2 Н, м) 5,065,45 (2 Н, м) 4,02-4,19 (2 Н, м) 3,75-3,95 (4 Н, м) 3,52-3,57 (6 Н, м) 1,81-2,30 (9 Н, м) 1,65-1,79 (1 Н, м) 1,391,53 (1 Н, м) 1,02-1,14 (1 Н, м) 0,74-0,98 (12 Н, м). 3.3.2. Получение соединения 11. 3.3.2.1. Получение промежуточного соединения XIXbHATU (776 мг, 2,04 ммоль), DIPEA (0,48 мл, 2,78 ммоль) и (S)-2-(метоксикарбониламино)-3 метилбутановую кислоту (357 мг, 2,04 ммоль) растворяли в сухом DMF (10 мл) и перемешивали в течение 5 мин при комнатной температуре. Добавляли XXVIIb (1,018 г, 1,855 ммоль) и реакционную смесь перемешивали в течение 1 ч при комнатной температуре. Добавляли дихлорметан (100 мл) и смесь промывали насыщенным раствором NaHCO3 (3100 мл). Органическую фазу сушили над MgSO4, фильтровали и растворитель выпаривали. Осадок использовали как есть в следующей реакции. 3.3.2.2. Получение промежуточного соединения XXbXIXb (1,309 г, 1,855 ммоль) растворяли в CH2Cl2 (10 мл) и добавляли HCl в iPrOH (5-6 н., 15 мл). Смесь перемешивали в течение 35 мин при комнатной температуре. Добавляли tBuOMe (50 мл) и взвесь перемешивали при комнатной температуре в течение 30 мин. Отфильтрованное твердое вещество промывали tBuOMe (50 мл) и сушили в вакуумной печи при 40 С с получением XXb (1,137 г). 3.3.2.3. Получение соединения 11HATU (858 мг, 2,26 ммоль), DIPEA (0,808 мл, 4,69 ммоль) и (2S,3R)-3-метокси-2-метоксикарбо- 28022839 ниламино)бутановую кислоту (432 мг, 2,26 ммоль) растворяли в сухом DMF (10 мл) и перемешивали в течение 5 мин при комнатной температуре. Добавляли XXb (1,13 7 г, 1,59 ммоль) и реакционную смесь перемешивали в течение 2 ч при комнатной температуре, после чего добавляли дополнительный DIPEA(1,5 экв.) и смесь перемешивали в течение еще 1 ч. Добавляли дихлорметан (100 мл) и смесь промывали насыщенным раствором NaHCO3 (3100 мл), органическую фазу сушили над MgSO4, фильтровали, растворитель упаривали и очищали на колонке с использованием градиента от 0 до 5% метанола в дихлорметане с получением 11 (585 мг, 47%).(м, 1 Н) 5,18-5,26 (м, 1 Н), 7,53-8,33 (м, 10 Н). 3.3.3. Получение соединения 16 и 17. 3.3.3.1. Получение промежуточного соединения XXIc К (2S,3S)-2-(метоксикарбониламино)-3-метилпентановой кислоте (2,39 г, 12,6 ммоль, 1,05 экв.) в 100-мл круглодонной колбе добавляли диметилформамид (60 мл), триэтиламин (3,34 мл, 24,1 ммоль, 2,00 экв.) и HATU (4,80 г, 12,6 ммоль, 1,05 экв.). Реакционную смесь перемешивали в течение 5 мин и добавляли XXVIb (6,60 г, 12,0 ммоль, 1,00 экв.). Смесь обрабатывали ультразвуком в течение одной минуты для растворения всего содержимого. Реакционную смесь перемешивали в течение 20 мин при комнатной температуре. К смеси добавляли насыщенным водный раствор Na2CO3 (20 мл) (при проверке рН на индикаторной бумаге рН 11). Соединение экстрагировали из водной фазы дихлорметаном (5150 мл) и объединенные органические слои промывали насыщенным водным раствором Na2CO3 (150 мл), сушили над сульфатом магния, фильтровали и фильтрат выпаривали до сухого состояния с получением XXIc (9,3 г), которое использовали как есть на следующей стадии. 3.3.3.2. Получение промежуточного соединения XXIIc (А=XXIc (8,66 г, 12,0 ммоль, 1,0 экв.) растворяли в дихлорметане (40 мл) и добавляли 5-6 н. HCl в изопропаноле (40 мл, 200 ммоль, 17 экв.). Реакционную смесь перемешивали в течение ночи при комнатной температуре. К раствору добавляли tBuOMe (400 мл) и полученную взвесь перемешивали при комнатной температуре в течение 30 мин. Отфильтрованное твердое вещество промывали tBuOMe (2100 мл) и дихлорметаном (100 мл) и сушили в вакууме в течение ночи с получением XXIIc (8,35 г). 3.3.3.3 Получение соединения 16
МПК / Метки
МПК: A61K 31/4184, C07D 403/14, A61P 31/12
Метки: производные, бензимидазол-имидазольные
Код ссылки
<a href="https://eas.patents.su/30-22839-benzimidazol-imidazolnye-proizvodnye.html" rel="bookmark" title="База патентов Евразийского Союза">Бензимидазол-имидазольные производные</a>
Предыдущий патент: Электронагреваемая курительная система с улучшенным нагревателем
Следующий патент: Фармацевтическая композиция, набор, их применение и способ профилактики и лечения симптома, состояния или заболевания, связанного с инфекцией вируса гриппа
Случайный патент: Двигатель или насос с рычажным механизмом












