Кристаллические формы гидрохлорида (4a-r,9a-s)-1-(1h-бензоимидазол-5-карбонил)-2,3,4,4a,9,9a-гексагидро-1h-индено[2,1-b]пиридин-6-карбонитрила и их применение в качестве ингибиторов hsd 1
Номер патента: 22406
Опубликовано: 30.12.2015
Авторы: Экхардт Маттиас, Сик Сандра, Шюле Мартин, Ян Бин-Шиоу, Мартин Ханс-Юрген
Формула / Реферат
1. Соединение, представленное следующей структурной формулой:

в котором по меньшей мере 50 мас.% соединения представляют собой индивидуальную кристаллическую форму, характеризующуюся пиками порошковой рентгеновской дифракции при углах 2θ, выбранных из 12.5, 12.9, 14.8, 20.0, 22.2 и 26.1°.
2. Соединение, представленное следующей структурной формулой:
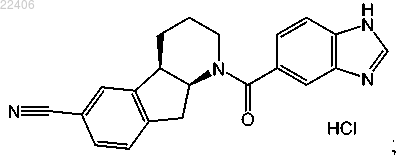
в котором по меньшей мере 50 мас.% соединения представляют собой индивидуальную кристаллическую форму, характеризующуюся пиками порошковой рентгеновской дифракции при углах 2θ 13.7, 17.6, 21.3, 21.9, 23.3, 25.6 и 26.5°.
3. Фармацевтическая композиция, содержащая соединение по любому из пп.1 или 2 и фармацевтически приемлемый носитель или разбавитель.
4. Применение соединения по любому из пп.1 или 2 для лечения или предупреждения заболеваний или состояний, на которые можно воздействовать путем ингибирования фермента 11β-гидроксистероиддегидрогеназы типа 1 (HSD).
5. Применение по п.4, где заболеванием или состоянием, на которое можно воздействовать путем ингибирования фермента 11β-гидроксистероиддегидрогеназы типа 1 (HSD), является болезнь обмена веществ.
6. Способ получения кристаллической формы I соединения, представленного следующей структурной формулой:

включающий растворение свободного основания указанного соединения в этаноле при температуре ниже 30°C;
протонирование растворенного свободного основания соляной кислотой;
охлаждение кристаллической формы I с образованием растворенного протонированного свободного основания.
7. Способ получения кристаллической формы II соединения, представленного следующей структурной формулой:
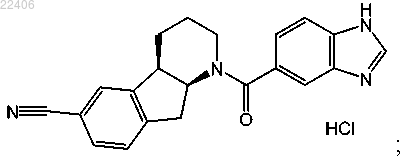
включающий приведение в контакт указанного соединения с этанолом с образованием суспензии;
перемешивание суспензии в течение времени, достаточного для образования кристаллической формы II.
8. Способ получения кристаллической формы II соединения, представленного следующей структурной формулой:
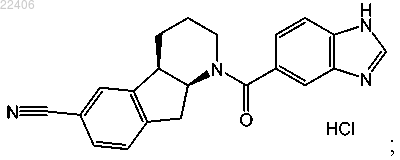
включающий растворение указанного соединения в этилацетате при температуре выше 40°C;
образование кристаллической формы II путем охлаждения растворенного соединения.
9. Способ получения кристаллической формы II соединения, представленного следующей структурной формулой:
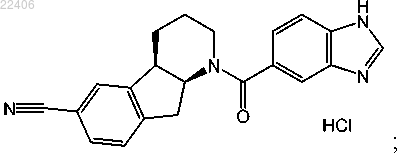
включающий растворение свободного основания указанного соединения в изопропаноле при температуре выше 40°C;
протонирование свободного основания соляной кислотой;
образование кристаллической формы II путем охлаждения растворенного протонированного свободного основания.
10. Способ получения кристаллической формы II соединения, представленного следующей структурной формулой:
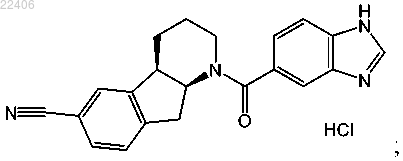
включающий растворение свободного основания указанного соединения в этаноле при температуре выше 40°C;
протонирование растворенного свободного основания соляной кислотой и поддержание растворенного протонированного основания при температуре выше 40°C в течение по меньшей мере 2 ч;
образование кристаллической формы II путем охлаждения растворенного протонированного свободного основания.
Текст
КРИСТАЛЛИЧЕСКИЕ ФОРМЫ ГИДРОХЛОРИДА (4A-R,9A-S)-1-(1HБЕНЗОИМИДАЗОЛ-5-КАРБОНИЛ)-2,3,4,4A,9,9A-ГЕКСАГИДРО-1H-ИНДЕНО[2,1B]ПИРИДИН-6-КАРБОНИТРИЛА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ Изобретение относится к кристаллическим соединениям согласно формуле (II) проявляющим полезную фармакологическую активность. В частности, соединения являются ингибиторами 11-гидроксистероиддегидрогеназы типа 1 (HSD) и, следовательно, являются пригодными для лечения и предупреждения заболеваний, на которые можно воздействовать путем ингибирования этого фермента, таких как болезни обмена веществ, в особенности диабета 2 типа,ожирения и дислипидемии.(71)(73) Заявитель и патентовладелец: БЕРИНГЕР ИНГЕЛЬХАЙМ ИНТЕРНЭШНЛ ГМБХ (DE) Родственные заявки По настоящим заявкам испрашивается приоритет предварительной заявки на патент США с серийным номером No. 61/484995, поданной 11 мая 2011 г По настоящим заявкам также испрашивается приоритет международной заявки с серийным номером No. PCT/US2010/055586, поданной 5 ноября 2010 г. Полное содержание этих двух заявок включено в настоящее описание посредством отсылки. Область техники Настоящее изобретение относится к гексагидроинденопиридинам и октагидробензохинолинам и их применению в качестве ингибиторов 11-гидроксистероиддегидрогеназы типа 1 (HSD-1), фармацевтическим композициям, содержащим указанные соединения, а также их применению для лечения болезней обмена веществ, таких как метаболический синдром, диабет, ожирение и дислипидемия. Кроме того,изобретение относится к способам приготовления фармацевтической композиции, а также предлагаемого в изобретении соединения. Уровень техники Для лечения метаболического синдрома, прежде всего диабета 2 типа, ожирения и дислипидемии в литературе предлагаются различные соединения, обладающие ингибирующим действием на фермент 11-гидроксистероиддегидрогеназу типа 1 (HSD-1). В Bulletin of the Chemical Society of Japan, 1959, 32, с. 1005-7 и Journal of Organic Chemistry, 1964,29, с. 1419-24 описаны соединения, имеющие следующие структуры: В Journal of Organic Chemistry, 1984, 49, с. 2504-6 предложены методы хроматографического разделения энантиомеров гетероциклических аминов, в том числе энантиомеров следующего рацемического соединения: В Journal of Medicinal Chemistry, 1981, 24, с. 1432-7 предложено следующее соединение в качестве промежуточного соединения для разделения цис- и транс-изомера: Сущность изобретения Совершенно неожиданно было обнаружено, что соединения настоящего изобретения обладают не только ингибирующем действием на HSD-1 in vitro и/или in vivo, но также проявляют высокую метаболическую стабильность, что делает их пригодными для применения в качестве лекарственных средств. Таким образом, целью настоящего изобретения является разработка гексагидроинденопиридинов и октагидробензохинолинов, которые in vitro и/или in vivo обладают ингибирующим действием на HSD-1 и проявляют пригодные фармакологические и фармакокинетические свойства для применения их в качестве лекарственных средств. В другом аспекте настоящего изобретения предложены новые фармацевтические композиции, пригодные для предупреждения и/или лечения болезней обмена веществ. Другой аспект изобретения относится к физиологически приемлемым солям соединений общей формулы I согласно данному изобретению с неорганическими или органическими кислотами или основаниями. В другом аспекте данное изобретение относится к фармацевтическим композициям, содержащим по меньшей мере одно соединение общей формулы I или физиологически приемлемую соль согласно изобретению, необязательно в комбинации с одним или несколькими инертными носителями и/или разбавителями. В другом аспекте данное изобретение относится к соединениям общей формулы I или их фармацевтически приемлемым солям для лечения или предупреждения заболеваний или состояний, на которые можно воздействовать путем ингибирования фермента 11-гидроксистероиддегидрогеназы типа 1 (HSD1), например болезней обмена веществ. В другом аспекте данное изобретение относится к применению по меньшей мере одного соединения общей формулы I или его фармацевтически приемлемой соли для приготовления фармацевтической композиции, которая является пригодной для лечения или предупреждения заболеваний или состояний,на которые можно воздействовать путем ингибирования фермента 11-гидроксистероиддегидрогеназы типа 1 (HSD-1), например болезней обмена веществ. Другие цели настоящего изобретения будут очевидны для опытного специалиста в данной области непосредственно исходя из предществующего и последующего описания. Краткое описание чертежей Фиг. 1 представляет собой картину XRPD, полученную от образца формы I соединения формулы(II); фиг. 2 представляет собой спектр 13 С SSNMR, полученный от образца формы I соединения формулы (II); фиг. 3 представляет собой график термического анализа, полученный от образца формы I соединения формулы (II), определенный путем измерений методом DSC; фиг. 4 представляет собой график термического анализа, полученный от образца формы I соединения формулы (II), определенный путем измерений методом TGA; фиг. 5 представляет собой картину XRPD, полученную от образца формы II соединения формулы(II); фиг. 6 представляет собой спектр 13 С SSNMR, полученный от образца формы II соединения формулы (II); фиг. 7 представляет собой график термического анализа, полученный от образца формы II соединения формулы (II), определенный путем измерений методом ДСК (DSC); фиг. 8 представляет собой график термического анализа, полученный от образца формы II соединения формулы (II), определенный путем измерений методом термогравиметрического анализа (TGA). Подробное описание изобретения В первом аспекте настоящее изобретение относится к соединениям общей формулы I в которой R1 выбран из группы R1a, состоящей из фенила, нафтила, пирролила, фуранила, тиенила,пиридила, индолила, бензофуранила, бензотиофенила, хинолинила, изохинолинила,при этом в пирролильной, фуранильной, тиенильной и пиридильной группе необязательно одна или две группы CH могут быть заменены на N и при этом в индолильной, бензофуранильной, бензотиофенильной, хинолинильной и изохинолинильной группе необязательно от одной до трех групп CH могут быть заменены на N,2-оксо-1,2-дигидропиридинила, 4-оксо-1,4-дигидропиридинила, 3-оксо-2,3-дигидропиридазинила,3,6-диоксо-1,2,3,6-тетрагидропиридазинила,2-оксо-1,2-дигидропиримидинила,4-оксо-3,4 дигидропиримидинила, 1,2,3,4-тетрагидро-2,4-диоксо-пиримидинила, 2-оксо-1,2-дигидропиразинила,2,3-диоксо-1,2,3,4-тетрагидропиразинила, инданила, 1-оксо-инданила, 2,3-дигидроиндолила, 2,3 дигидроизоиндолила, 2-оксо-2,3-дигидроиндолила, 1-оксо-2,3-дигидроизоиндолила, 2,3-дигидробензофуранила,2-оксо-2,3-дигидробензимидазолила,2-оксо-2,3-дигидробензоксазолила,бензо[1,3]диоксолила, 2-оксо-бензо[1,3]диоксолила, 1,2,3,4-тетрагидронафтила, 1,2,3,4-тетрагидрохинолинила, 2-оксо-1,2,3,4-тетрагидрохинолинила, 2-оксо-1,2-дигидрохинолинила, 4-оксо-1,4-дигидрохинолинила, 1,2,3,4-тетрагидроизохинолинила, 1-оксо-1,2,3,4-тетрагидроизохинолинила, 1-оксо-1,2-дигидроизохинолинила, 4-оксо-1,4-дигидроциннолинила, 2-оксо-1,2-дитетрагидроизохинолинила, 4-оксо-1,4 дитетрагидроизохинолинила, 2,4-диоксо-1,2,3,4-тетратетрагидроизохинолинила, 2-оксо-1,2-дигидрохиноксалинила, 3-оксо-1,2,3,4-тетрагидрохиноксалинила, 2,3-диоксо-1,2,3,4-тетрагидрохиноксалинила,1-оксо-1,2-дигидрофталазинила, 1,4-диоксо-1,2,3,4-тетрагидрофталазинила, хроманила, кумаринила, 2,3 дигидро-бензо[1,4]диоксинила, 3-оксо-3,4-дигидро-бензо[1,4]оксазинила, тетразолила, 2-оксо-2,3 дигидробензотиазолила и имидазо[1,2-а]пиридинила,при этом члены группы R1a присоединены к карбонильной группе в формуле I через посредство ароматического атома углерода и при этом члены группы R1a необязательно могут быть замещены одним R5, от одного до трех одинаковыми и/или различными R6 и/или одним R7 при условии, что в случае, когда R1 представляет собой фенильную группу, заместители R5, R6 и/или R7 не присоединены к атомам углерода, которые следуют за атомом углерода, присоединенным к карбонильной группе в формуле I;R2 выбран из группы R2a, состоящей из водорода, галогена, (гет)арила, циано, нитро, амино, гидрокси, C1-6-алкила, C3-6-циклоалкила, C2-6-алкенила и C2-6-алкинила,при этом в каждой C1-6-алкил-, C3-6-циклоалкил-, C2-6-алкенил- или С 2-6-алкинильной группе одна группа CH2 необязательно может быть заменена на CO или SO2, одна группа CH2 необязательно заменена на О или NRN и одна группа CH необязательно заменена на N и при этом каждая из этих групп необязательно может быть моно- или полифторированной и необязательно моно- или независимо друг от дру-2 022406 га дизамещенной хлором, C1-3-алкилом, циано, (гет)арилом, амино, C1-3-алкиламино, ди-(C1-3 алкил)амино, гидрокси, C1-3-алкилокси, (гет)арилокси, C1-3-алкилсульфанилом, C1-3-алкилсульфинилом или C3-6-циклоалкилом, при этом одна или две группы CH2 C3-6-циклоалкильной группы могут быть необязательно заменены независимо друг от друга карбонильной группой, О или NRN, одна группа CH необязательно заменена на N, которая необязательно может быть моно- или независимо замещенной атомом фтора или C1-3-алкилом;R3, R4 независимо друг от друга выбраны из группы R3/4 а, состоящей из водорода, галогена,C1-3-алкила, трифторметила, гидрокси, C1-3-алкилокси и циано; илиR3/4 а обозначает R3 и R4, которые присоединены к смежным атомам углерода и объединены с образованием метилендиокси-, этилендиокси- или C3-5-алкиленовой группы, каждая из которых необязательно может быть замещена одной или двумя группами, независимо выбранными из фтора и метила, или вместе с атомами углерода, к которым они присоединены, образуют бензольное, пиридольное, пиримидольное, пиразинольное, пиридазинольное, пиризольное, имидазольное, триазольное, оксазольное, тиазольное, изоксазольное или изотиазольное кольцо, каждое из которых необязательно может быть замещено одним или двумя заместителями, независимо выбранными из галогена, C1-3-алкила, трифторметила,амино, C1-3-алкиламино, ди-(C1-3-алкил)амино, гидрокси и C1-3-алкилокси;R5 выбран из группы R5a, состоящей из галогена, (гет)арила, циано, нитро, амино, гидрокси, C1-6 алкила, C3-6-циклоалкила, C2-6-алкенила и C2-6-алкинила, при этом в каждой группе одна группа CH2 необязательно может быть заменена на CO или SO2, одна группа CH2 необязательно заменена на О илиNRN и одна группа CH необязательно заменена на N, при этом каждая группа необязательно может быть моно- или полифторированной и необязательно моно- или независимо друг от друга дизамещенной хлором, C1-3-алкилом, циано, (гет)арилом, амино, C1-3-алкиламино, ди-(C1-3-алкил)амино, гидрокси, C1-3 алкилокси, (гет)арилокси, C1-3-алкилсульфанилом, C1-3-алкилсульфинилом или C3-6-циклоалкилом, при этом одна или две группы CH2 C3-6-циклоалкильной группы необязательно могут быть заменены независимо друг от друга на карбонильную группу, О или NRN, одна группа CH необязательно заменена на N,которая необязательно может быть моно- или независимо дизамещена фтором или C1-3-алкилом;R6, R7 выбраны независимо друг от друга из группы R6/7 а, состоящей из галогена, C1-3-алкила, C2-3 алкинила, трифторметила, гидрокси, C1-3-алкилокси и циано; и/илиR6/7a обозначает один R6, объединенный с R7, которые присоединены к смежным атомам углерода,которые образуют метилендиокси-, дифторметилендиокси-, этилендиокси-, C3-5-алкиленовую группу,или вместе с атомами углерода, к которым они присоединены, образуют пиразольное, имидазольное,оксазольное, изоксазольное, тиазольное или изотиазольное кольцо, каждое из которых необязательно может быть моно- или дизамещенным независимо друг от друга C1-3-алкилом, трифторметилом, амино,C1-3-алкиламино, ди-(C1-3-алкил)амино, гидрокси, C1-3-алкилокси;RN выбран независимо друг от друга из группы RNa, состоящей из водорода, C1-6-алкила, C3-6 циклоалкила, C3-6-алкенила, C3-6-алкинила, (гет)арила, C1-4-алкилкарбонила, (гет)арилкарбонила, C1-4 алкиламинокарбонила, ди-(C1-3-алкил)аминокарбонила, (гет)ариламинокарбонила, C1-4-алкилоксикарбонила, C1-4-алкилсульфонила и (гет)арилсульфонила, при этом каждая алкильная, алкенильная и алкинильная группа необязательно может быть моно- или полизамещенной фтором и необязательно монозамещенной (гет)арилом, циано, аминокарбонилом, C1-3-алкиламинокарбонилом, ди-(C1-3-алкил)аминокарбонилом, карбокси, C1-4-алкилоксикарбонилом, амино, C1-4-алкиламино, ди-(С 1-3-алкил)амино, C1-4 алкилкарбониламино, гидрокси, C1-4-алкилокси, C1-4-алкилсульфанилом, C1-4-алкилсульфинилом или(гетеро)арил выбран независимо друг от друга из группы HAa, состоящей из фенила, нафтила, пирролила, фуранила, тиенила, пиридила, индонила, бензофуранила, бензотиофенила, хинолинила, изохинолинила,при этом в пирролильной, фуранильной, тиенильной и пиридильной группе необязательно одна или две группы CH могут быть заменены на N, при этом в индолильной, бензофуранильной, бензотиофенильной, хинолинильной и изохинолинильной группе от одной до трех групп CH необязательно могут быть заменены на N,2-оксо-1,2-дигидропиридинила, 4-оксо-1,4-дигидропиридинила, 3-оксо-2,3-дигидропиридазинила,3,6-диоксо-1,2,3,6-тетрагидропиридазинила,2-оксо-1,2-дигидропиримидинила,4-оксо-3,4 дигидропиримидинила, 2,4-диоксо-1,2,3,4-тетрагидропиримидинила, 2-оксо-1,2-дигидропиразинила, 2,3 диоксо-1,2,3,4-тетрагидропиразинила, 2-оксо-2,3-дигидроиндолила, 2,3-дигидробензо-фуранила, 2-оксо 2,3-дигидро-бензимид азолила, 2-оксо-2,3-дигидробензоксазолила, 2-оксо-1,2-дигидрохинолинила, 4 оксо-1,4-дигидрохинолинила, 1-оксо-1,2-дигидро-изохинолинила, 4-оксо-1,4-дигидроциннолинила, 2 оксо-1,2-дитетрагидроизохинолинила,4-оксо-1,4-дитетрагидроизохинолинила,2,4-диоксо-1,2,3,4 тетратетрагидроизохинолинила,2-оксо-1,2-дигидрохиноксалинила,3-оксо-1,2,3,4 тетрагидрохиноксалинила, 2,3-диоксо-1,2,3,4-тетрагидрохиноксалинила, 1-оксо-1,2-дигидрофталазинила,1,4-диоксо-1,2,3,4-тетрагидрофталазинила, хроманила, кумаринила, 2,3-дигидро-бензо[1,4]диоксинила,3-оксо-3,4-дигидро-бензо[1,4]оксазинила и тетразолила,при этом указанные выше (гет)арильные группы необязательно могут быть замещены от одного до-3 022406 трех R10, которые могут быть одинаковыми или различными;R10 выбран независимо друг от друга из группы R10a, состоящей из галогена, C1-3-алкила, дифторметила, трифторметила, циано, аминокарбонила, C1-3-алкиламинокарбонила, ди-(С 1-3-алкил)аминокарбонила, карбокси, C1-4-алкилоксикарбонила, нитро, амино, C1-3-алкиламино, ди-(С 1-3-алкил)амино,ацетиламино, метилсульфониламино, гидрокси, C1-3-алкилокси, дифторметокси, трифторметокси, метилсульфанила, метилсульфинила, метилсульфонила, аминосульфонила и фенила,при этом фенильная группа необязательно может быть замещена одним или двумя заместителями,независимо друг от друга выбранными из фтора, метила, метокси, циано и гидрокси;m обозначает 0 или 1,при этом алифатическая часть трициклической структуры ядра общей формулы I замещена одной или двумя различными или идентичными группами;R8 выбран независимо друг от друга из группы R8a, состоящей из водорода, метила и этила,их таутомеры, стереоизомеры, их смеси и соли, при этом исключаются следующие соединения: В другом аспекте настоящее изобретение относится к способу приготовления соединений общей формулы I, отличающемуся тем, что соединение общей формулы II в котором переменные R2, R3, R4 и m имеют указанные выше или ниже значения,взаимодействует с соединением общей формулы R1-CO-Y, необязательно приготовленным in situ из соответствующей карбоновой кислоты (Y=OH), где R1 имеет указанное выше или ниже значение, и Y представляет собой уходящую группу и, в частности, обозначает фтор, хлор, бром, циано, C1-4-алкокси,C2-4-алкенилокси, C2-4-алкинилокси, C1-4-алкилсульфанил, арилтриазолокси, гетероарилтриазолокси, гетероар-N-ил, сукцинил-N-окси, C1-4-алкилкарбонилокси, ди-(С 1-4-алкил)аминокарбонилокси, пирролилкарбонилокси, пиперидинил-карбонилокси, морфолинилкарбонилокси, [три-(C1-4-алкил)карбамимидоил]окси, [ди-(С 1-4-алкил)амино][ди-(С 1-4-алкил)иминиумил]метокси=[(C1-4-алкил)2N]2C+-O-, (N,N'дициклогексилкарбамидоил)окси, ди-(C1-4-алкилокси)фосфорилокси, бис[ди-(С 1-4-алкил)амино]фосфорилокси, [бис-(пирролидин-1-ил)фосфорил]окси, арилокси, арилсульфанил, гетеросульфанил или гетероарилокси,при этом алкильная, алкенильная и алкинильная группы, упомянутые в определении указанных выше уходящих групп, необязательно могут быть моно- или полизамещенными фтором, хлором, C1-3 алкилом или С 1-3-алкокси,при этом арильные группы, упомянутые в определении указанных выше уходящих групп, по отдельности или как часть другой группы, обозначают фенил или нафтил и гетероарильные группы, упомянутые в определении указанных выше групп, по отдельности или как часть другой группы, обозначают пиридинил, пиримидинил, триазинил, имидазолил, пиразолил, триазолил или тетразолил, в то время как арильная и гетероарильная группы необязательно могут быть моно- или полизамещенными независимо друг от друга фтором, хлором, бромом, C1-3-алкилом, C1-3-алкилокси, нитро, циано и/или ди-(С 1-3 алкил)амино,необязательно в присутствии основания, такого как третичный или ароматический амин, например этилдиизопропиламин, триэтиламин, имидазол или пиридин, или неорганической соли, например карбоната калия или оксида кальция, и/или другого вспомогательного компонента, такого как 4-диметиламинопиридин или 1-гидроксибензотриазол, в растворителях, предпочтительно выбранных из тетрагидрофурана, 1,2-диметоксиэтана, эфира, 1,4-диоксана, N,N-диметилформамида, N,N-диметилацетамида, Nметилпирролидинона, ацетонитрила, этилацетата, дихлорметана, 1,2-дихлорэтана, толуола, бензола и гексанов, при этом для некоторых комбинаций можно использовать водные и спиртовые растворы, перечисленные выше, предпочтительно при температуре от -10 до 120C; необязательно любая используемая в описанных выше реакциях защитная группа отщепляется одновременно или последовательно; при желании, соединение общей формулы I, полученное таким способом, превращается в его стереоизомеры; при желании, соединение общей формулы I, полученное таким способом, превращается в его соли,в частности в его физиологически приемлемые соли, для фармацевтического применения. Подробное описание изобретения Если не указано иное, все группы, остатки и заместители, прежде всего R1, R2, R3, R4, R5, R6, R7, R8,R10, RN и m, имеют указанные выше и в последующем описании значения. При наличии в каком-либо соединении нескольких одних и тех же остатков, заместителей или групп они могут иметь идентичные или различные значения. Некоторые предпочтительные значения групп и заместителей соединений согласно изобретению будут представлены здесь далее. Предпочтительные варианты изобретения характеризуются следующими определениями: В другом варианте настоящего изобретения R1 выбран из группы R1b, состоящей из фенила, нафтила, пирролила, фуранила, тиенила, пиридила, индолила, бензофуранила, бензотиофенила, хинолинила,изохинолинила, при этом в пирролильной, фуранильной, тиенильной и пиридильной группе необязательно одна группа CH может быть заменена на N, при этом в индолильной, бензофуранильной, бензотиофенильной, хинолинильной и изохинолинильной группах необязательно одна или две группы CH могут быть заменены на N, инданила, 2,3-дигидроиндолила, 2-оксо-2,3-дигидроиндолила, 2,3-дигидробензофуранила,2-оксо-2,3-дигидробензимидазолила,2-оксо-2,3-дигидробензотиазолила,бензо[1,3]диоксолила,1,2,3,4-тетрагидронафтила,1,2,3,4-тетрагидрохинолинила,1,2,3,4 тетрагидроизохинолинила, 2-оксо-1,2-дигидрохиноксалинила, 3-оксо-1,2,3,4-тетрагидрохиноксалинила,хроманила и имидазо[1,2-а]пиридинила,при этом члены группы R1b присоединены к карбонильной группе в формуле I через посредство ароматического атома углерода и при этом члены группы R1b необязательно могут быть замещены одним R5, одним R6 и/или одним 7R при условии, что в случае, когда R1 является фенильной группой, заместители R5, R6 и/или R7 не присоединены к атомам углерода, следующим после атома углерода, который присоединен к карбонильной группе в формуле I. В другом варианте настоящего изобретения R1 выбран из группы R1c, состоящей из фенила, нафтила, фуранила, тиенила, пиразолила, имидазолила, оксазолила, изоксазолила, тиазолила, изотиазолила,пиридила, индолила, бензофуранила, бензотиофенила,при этом в индолильной, бензофуранильной и бензотиофенильной группах необязательно одна или две группы CH могут быть заменены на N,инданила, 2,3-дигидроиндолила, 2-оксо-2,3-дигидроиндолила, 2,3-дигидробензофу ранила, 2-оксо 2,3-дигидробензимидазолила,2-оксо-2,3-дигидробензотиазолила,бензо[1,3]диоксолила,1,2,3,4 тетрагидрохинолинила, 2-оксо-1,2-дигидрохиноксалинила, хроманила и имидазо[1,2-а]пиридинила,при этом члены группы R1c присоединены к карбонильной группе в формуле I через посредство ароматического атома углерода и при этом члены группы R1c необязательно могут быть замещены одним R5, одним R6 и/или одним 7R при условии, что в случае, когда R1 является фенильной группой, заместители R5, R6 и/или R7 не присоединены к атомам углерода, следующим после атома углерода, который присоединен к карбонильной группе в формуле I. В другом варианте настоящего изобретения R1 выбран из группы R1d, состоящей из фенила, индолила, 2-оксо-2,3-дигидроиндолила, бензимидазолила, индазолила, имидазол[1,2-а]пиридинила, 2-оксо 2,3-дигидробензоимидазолила, 2-оксо-2,3-дигидробензотиазолила, имидазопиридинила, бензотриазолила, бензотиазолила и 2-оксо-1,2-дигидрохиноксалинила,при этом члены группы R1d присоединены к карбонильной группе в формуле I через посредство ароматического атома углерода и при этом члены группы R1d необязательно могут быть замещены одним R5, одним R6 и/или одним 7R при условии, что в случае, когда R1 является фенильной группой, заместители R5, R6 и/или R7 не присоединены к атомам углерода, следующим после атома углерода, который присоединен к карбонильной группе в формуле I. В другом варианте настоящего изобретения R1 выбран из группы R1d2, состоящей из 4 гидроксифенила, 4-амино-3-метоксифенила, 3-фтор-4-гидроксифенила, 4-амино-3-хлорфенила, 3-хлор-4 гидроксифенила, индол-3-ила, индол-5-ила, индол-6-ила, 1-метилиндол-3-ила, бензимидазол-5-ила, 6 метилбензимидазол-5-ила, 7-метилбензимидазол-5-ила, индазол-5-ила и бензотиазол-6-ила. В другом варианте настоящего изобретения R1 выбран из группы R1e, состоящей из 4 гидроксифенила, 4-амино-3-метоксифенила, 3-фтор-4-гидроксифенила, 4-амино-3-хлорфенила, 3-хлор-4 гидроксифенила, индол-3-ила, индол-5-ила, индол-6-ила, 1-метилиндол-3-ила, бензимидазол-5-ила, индазол-5-ила и бензотиазол-6-ила. В другом варианте настоящего изобретения R1 выбран из группы R1f, состоящей из бензимидазол-5 ила, 6-метилбензимидазол-5-ила и 7-метилбензимидазол-5-ила. В другом варианте настоящего изобретения R2 выбран из группы R2b, состоящей из водорода, галогена, (гет)арила, циано, нитро, амино, гидрокси, C2-6-алкинила, C1-6-алкила и C3-6-циклоалкила,при этом в C1-6-алкильной и C3-6-циклоалкильной группе одна группа CH2 необязательно может быть заменена на CO или SO2, одна группа CH2 необязательно заменена на О или NRN и одна группа CH необязательно заменена на N, при этом обе эти группы необязательно могут быть моно- или полифтори-5 022406 рованными и необязательно моно- или независимо друг от друга замещенными хлором, C1-3-алкилом,циано, (гет)арилом, амино, C1-3-алкиламино, ди-(C1-3-алкил)амино, гидрокси, C1-3-алкилокси,(гет)арилокси, C1-3-алкилсульфанилом, C1-3-алкилсульфинилом и/или C3-6-циклоалкилом, при этом в C3-6 циклоалкильной группе одна или две CH2 группы могут быть необязательно заменены независимо друг от друга карбонилом, О или NRN и одна CH группа необязательно заменена на N, и может быть необязательно моно- или независимо замещенной фтором или C1-3-алкилом. В другом варианте настоящего изобретения R2 выбран из группы R2c, состоящей из водорода, фтора, хлора, брома, C1-3-алкила, C3-6-циклоалкилметила, циклопропила, (гет)арилметила, С 2-4-алкинила,(гет)арила, циано-C1-3-алкила, аминокарбонил-C1-3-алкила, C1-3-алкиламинокарбонил-C1-3-алкила, ди-(C13-алкил)аминокарбонил-C1-3-алкила, пирролидин-1-ил-карбонил-C1-3-алкила, пиперидин-1-ил-карбонилC1-3-алкила, морфолин-4-ил-карбонил-С 1-3-алкила, карбокси-C1-3-алкила, C1-3-алкоксикарбонил-C1-3 алкила, C1-3-алкилкарбониламино-C1-3-алкила, N-(C1-3-алкил)-C1-3-алкилкарбониламино-C1-3-алкила, 2 оксо-пирролидин-1-ил-C1-3-алкила,2-оксо-пиперидин-1-ил-С 1-3-алкила,3-оксо-морфолин-4-ил-С 1-3 алкила, гидрокси-C1-3-алкила, C1-3-алкилокси-C1-3-алкила, трифторметила, дифторметила, циано, аминокарбонила, C1-3-алкиламинокарбонила, ди-(С 1-3-алкил)аминокарбонила, пирролидин-1-ил-карбонила, пиперидин-1-ил-карбонила, морфолин-4-ил-карбонила, карбокси, C1-3-алкилоксикарбонила, амино, C1-3 алкиламино,C1-3-алкил-карбониламино,(гет)арил-карбониламино,N-(С 1-3-алкил)-С 1-3-алкилкарбониламино, N-(С 1-3-алкил)-(гет)арил-карбониламино, 2-оксо-пирролидин-1-ила, 2-оксо-пиперидин-1 ила, морфолин-4-ила, 3-оксо-морфолин-4-ила,C1-3-алкилсульфониламино,N-(C1-3-алкил)-С 1-3 алкилсульфониламино, N-(С 1-3-алкил)-(гет)арил-сульфониламино, гидрокси, C1-4-алкилокси, C3-6 циклоалкилокси, тетерагидрофуран-3-илокси, тетрагидрофуран-3-илокси, тетрагидропиран-4-илокси,дифторметокси, трифторметокси, (гет)арилокси, циано-C1-3-алкилокси, аминокарбонил-C1-3-алкилокси,C1-3-алкиламинокарбонил-C1-3-алкилокси, ди-(С 1-3-алкил)аминокарбонил-С 1-3-алкилокси, пирролидин-1 ил-карбонил-С 1-3-алкилокси, пиперидин-1-ил-карбонил-C1-3-алкилокси, морфолин-4-ил-карбонил-С 1-3 алкилокси, карбокси-C1-3-алкилокси, C1-3-алкилоксикарбонил-С 1-3-алкилокси, гидрокси-С 1-3-алкилокси,С 1-3-алкилокси-C1-3-алкилокси, тетрагидрофуранил-C1-3-алкилокси, тетрагидропиранил-C1-3-алкилокси,C1-4-алкилсульфонила, C3-6-циклоалкилсульфонила, аминосульфонила, C1-3-алкиламиносульфонила и ди(С 1-3-алкил)аминосульфонила,при этом указанный выше термин (гетеро)арил означает фенил, фуранил, тиенил, имидазолил, пиразолил, оксазолил, изоксазолил, тиазолил, триазолил, оксадиазолил, пиридинил, пиримидинил, пиразинил или пиридазинил, все из которых могут быть необязательно моно- или дизамещенными R10. В другом варианте настоящего изобретения R2 выбран из группы R2d, состоящей из водорода, фтора, хлора, брома, метила, этинила, циклопропила, C3-6-циклоалкилметила, фенилметила, гидрокси-C1-3 алкила, фенила, циано, аминокарбонила, метиламинокарбонила, диметиламинокарбонила, пирролидин-1 илкарбонила, морфолин-4-илкарбонила, карбокси, метоксикарбонила, амино, ацетиламино, метилсульфониламино, гидрокси, C1-3-алкилокси, фенилокси и пиридазинилокси,при этом упомянутые фенильная и пиридазинильная группы могут быть необязательно монозамещенными фтором, метилом, циано или метокси. В другом варианте настоящего изобретения R2 выбран из группы R2e, состоящей из водорода, фтора, брома, циклогексилметила, фенилметила, 4-метоксифенилметила, гидроксиметила, 2-гидроксипроп 2-ила, фенила, циано, аминокарбонила, метиламинокарбонила, диметиламинокарбонила, пирролидин-1 илкарбонила, морфолин-4-илкарбонила, карбокси, метоксикарбонила, амино, гидрокси, метокси, 4 метоксифенокси и 6-метилпиридазин-3-илокси. В другом варианте настоящего изобретения R2 выбран из группы R2f, состоящей из водорода и циано. В другом варианте настоящего изобретения R3, R4 выбраны независимо друг от друга из группы 3/4bR , состоящей из водорода, фтора, хлора, C1-3-алкила, трифторметила, циано, гидрокси и C1-3-алкокси,или R3/4b обозначает R3 и R4, которые присоединены к смежным углеродным атомам и объединены вместе с образованием метилендиокси- или этилендиоксигруппы, или вместе с углеродными атомами, к которым они присоединены, образуют имидазольное, оксазольное или тиазольное кольцо, каждое из которых может быть необязательно замещенным одним или двумя заместителями, независимо выбранными из метила, диметиламино, гидрокси и метокси. В другом варианте настоящего изобретения R3, R4 выбраны независимо друг от друга из группы 3/4cR , состоящей из водорода, фтора, хлора, метила, трифторметила, циано, гидрокси или метокси. В другом варианте настоящего изобретения R3, R4 выбраны независимо друг от друга из группы 3/4 с 2R , состоящей из водорода, фтора и метила. В другом варианте настоящего изобретения R3, R4 выбраны независимо друг от друга из группы 3/4dR , состоящей из водорода и фтора. В другом варианте настоящего изобретения R5 выбран из группы R5b, состоящей из фтора, хлора,брома, C1-4-алкила, C3-6-циклоалкил-С 1-3-алкила, C3-6-циклоалкила, (гет)арил-С 1-3-алкила, (гет)арила, циано-C1-3-алкила,аминокарбонил-C1-3-алкила,С 1-3-алкиламинокарбонил-С 1-3-алкила,ди-(C1-3 алкил)аминокарбонил-C1-3-алкила, пирролидин-1-ил-карбонил-C1-3-алкила, пиперидин-1-ил-карбонил-C1-6 022406 3-алкила, пиперазин-1-ил-карбонил-C1-3-алкила,4-(С 1-3-алкил)пиперазин-1-ил-карбонил-С 1-3-алкила,морфолин-4-ил-карбонил-С 1-3-алкила, карбокси-C1-3-алкила, C1-3-алкилоксикарбонил-C1-3-алкила, аминоC1-3-алкила, C1-3-алкиламино-C1-3-алкила, ди-(C1-3-алкил)амино-С 1-3-алкила, пирролидин-1-ил-C1-3-алкила,пиперидин-1-ил-C1-3-алкила, пиперазин-1-ил-C1-3-алкила, 4-(C1-3-алкил)пиперазин-1-ил-C1-3-алкила, морфолин-4-ил-C1-3-алкила, C1-3-алкилкарбониламино-C1-3-алкила, (гет)арилкарбониламино-С 1-3-алкила, 2 оксо-пирролидин-1-ил-C1-3-алкила,2-оксо-пиперидин-1-ил-C1-3-алкила,2-оксо-пиперазин-1-ил-C1-3 алкила, 3-оксо-пиперазин-1-ил-C1-3-алкила, 2-оксо-4-(C1-3-алкил)пиперазин-1-ил-С 1-3-алкила, 3-оксо-4(C1-3-алкил)пиперазин-1-ил-С 1-3-алкила, 3-оксо-морфолин-4-ил-C1-3-алкила, гидрокси-C1-3-алкила, C1-3 алкилалкокси-C1-3-алкила, (гет)арилокси-C1-3-алкила, дифторметила, трифторметила, 2,2,2-трифтор-1 гидроксиэтила,2,2,2-трифтор-1-гидрокси-1-метилэтила,2,2,2-трифтор-1-гидрокси-1(трифторметил)этила, циано, аминокарбонила, C1-3-алкиламинокарбонила, ди-(C1-3-алкил)аминокарбонила, (гет)арил-C1-3-алкиламинокарбонила, N-(C1-3-алкил)-(гет)арил-C1-3-алкиламинокарбонила,(гет)ариламинокарбонила, N-(C1-3-алкил)-(гет)арил-аминокарбонила, пирролидин-1-ил-карбонила, пиперидин-1-ил-карбонила, пиперазин-1-ил-карбонила, 4-(С 1-3-алкил)пиперазин-1-ил-карбонила, морфолин-4 ил-карбонила, карбокси, C1-3-алкоксикарбонила, нитро, амино, C1-3-алкиламино, ди-(C1-3-алкил)амино,пирролидин-1-ила,пиперидин-1-ила,пиперазин-1-ила,4-(C1-3-алкил)пиперазин-1-ила,4-(С 1-3 алкилкарбонил)пиперазин-1-ила,4-(С 1-3-алкилоксикарбонил)пиперазин-1-ила,4-(С 1-3-алкилсульфонил)пиперазин-1-ила,морфолин-4-ила,C1-3-алкилкарбониламино,N-(C1-3-алкил)-C1-3-алкилкарбониламино, (гет)арилкарбониламино, N-(С 1-3-алкил)-(гет)арилкарбониламино, (гет)арил-С 1-3-алкилкарбониламино, N-(С 1-3-алкил)-(гет)арил-C1-3-алкил-карбониламино, 2-оксо-пирролидин-1-ила, 2-оксопиперидин-1-ила, 2-оксо-пиперазин-1-ила, 2-оксо-4-(С 1-3-алкил)пиперазин-1-ила, 3-оксо-пиперазин-1 ила, 3- оксо-4-(С 1-3-алкил)пиперазин-1-ила, 3-оксо-морфолин-4-ила, аминокарбониламино, N(аминокарбонил)-С 1-3-алкиламино, C1-3-алкиламинокарбониламино, N-(C1-3-алкиламинокарбонил)-С 1-3 алкиламино, N-[ди-(С 1-3-алкил)аминокарбонил]-C1-3-алкиламино, ди-(С 1-3-алкил)аминокарбонил-амино,пирролидин-1-ил-карбониламино, пиперидин-1-ил-карбониламино, пиперазин-1-ил-карбониламино, 4(С 1-3-алкил)пиперазин-1-ил-карбониламино,морфолин-4-ил-карбониламино,C1-3-алкилоксикарбониламино, N-(C1-3-алкил)-С 1-3-алкилоксикарбониламино, C1-3-алкилсульфониламино, N-(С 1-3-алкил)-C1(гет)арилсульфониламино, N-(C1-3-алкил)-(гет)арилсульфониламино, оксо 3-алкилсульфониламино,имидазолидин-1-ила, гидрокси, C1-4-алкилокси, C3-6-циклоалкил-C1-3-алкилокси, (гет)арил-С 1-3-алкилокси,C3-6-циклоалкилокси, (гет)арилокси, циано-C1-3-алкилокси, аминокарбонил-C1-3-алкилокси, C1-3 алкиламинокарбонил-C1-3-алкилокси, ди-(С 1-3-алкил)аминокарбонил-С 1-3-алкилокси, пирролидин-1-илкарбонил-С 1-3-алкилокси,пиперидин-1-ил-карбонил-С 1-3-алкилокси,пиперазин-1-ил-карбонил-C1-3 алкилокси,4-(C1-3-алкил)пиперазин-1-ил-карбонил-C1-3-алкилокси,морфолин-4-ил-карбонил-С 1-3 алкилокси, карбокси-C1-3-алкилокси, C1-3-алкилоксикарбонил-C1-3-алкилокси, амино-C1-3-алкилокси, C1-3 алкиламино-C1-3-алкилокси, ди-(С 1-3-алкил)амино-С 1-3-алкилокси, пирролидин-1-ил-C1-3-алкилокси, пиперидин-1-ил-C1-3-алкилокси,пиперазин-1-ил-C1-3-алкилокси,4-(С 1-3-алкил)пиперазин-1-ил-C1-3 алкилокси, морфолин-4-ил-C1-3-алкилокси, 2-оксо-пирролидин-1-ил-C1-3-алкилокси, 2-оксо-пиперидин-1 ил-С 1-3-алкилокси, 2-оксо-пиперазин-1-ил-С 1-3-алкилокси, 3-оксо-пиперазин-1-ил-C1-3-алкилокси, 2-оксо 4-(С 1-3-алкил)пиперазин-1-ил-С 1-3-алкилокси, 3-оксо-4-(С 1-3-алкил)пиперазин-1-ил-С 1-3-алкилокси, 3 оксо-морфолин-4-ил-С 1-3-алкилокси, гидрокси-C1-3-алкилокси, C1-3-алкилокси-C1-3-алкилокси, тетрагидрофуран-3-ил-окси, тетрагидропиран-3-ил-окси, тетрагидропиран-4-ил-окси, тетрагидрофуранил-C1-3 алкилокси, тетрагидропиранил-C1-3-алкилокси, дифторметокси, трифторметокси, C1-3-алкилсульфанилC1-3-алкилокси,C1-3-алкилсульфинил-C1-3-алкилокси,C1-3-алкилсульфонил-C1-3-алкилокси,C1-3 алкилсульфонила, (гет)арилсульфонила, аминосульфонила, C1-3-алкиламиносульфонила, ди-(С 1-3 алкил)аминосульфонила, пирролидин-1-ил-сульфонила, пиперидин-1-ил-сульфонила, морфолин-4-илсульфонила, пиперазин-1-ил-сульфонила и 4-(С 1-3-алкил)пиперазин-1-ил-сульфонила,при этом упомянутый выше термин (гетеро)арил имеет указанные выше или ниже значения. В другом варианте настоящего изобретения R5 выбран из группы R5c, состоящей из фтора, хлора, C14-алкила, (гет)арил-С 1-3-алкила, (гет)арила, аминосульфонила, амино-C1-3-алкила, C1-3-алкиламнно-C1-3 алкила, ди-(С 1-3-алкил)амино-С 1-3-алкила, пирролидин-1-ил-C1-3-алкила, морфолин-4-ил-С 1-3-алкила, C1-3 алкилкарбониламино-C1-3 алкила, (гетеро)арилкарбониламино-С 1-3-алкила, 2-оксо-пирролидин-1-ил-С 1-3 алкила, 3-оксо-морфолин-4-ил-С 1-3-алкила, гидрокси-C1-3-алкила, C1-3-алкилокси-C1-3-алкила, 2,2,2 трифтор-1-гидроксиэтила,2,2,2-трифтор-1-гидрокси-1-метилэтила,2,2,2-трифтор-1-гидрокси-1 трифторметил-этила, трифторметила, циано, аминокарбонила, C1-3-алкиламинокарбонила, ди-(С 1-3 алкил)аминокарбонила, (гет)ариламинокарбонила, пирролидин-1-ил-карбонила, пиперидин-1-илкарбонила,пиперазин-1-ил-карбонила,морфолин-4-ил-карбонила,4-(С 1-3-алкил)пиперазин-1-илкарбонила, карбокси, C1-3-алкилоксикарбонила, амино, C1-3-алкиламино, ди-(С 1-3-алкил)амино, пирролидин-1-ила, пиперидин-1-ила, пиперазин-1-ила, морфолин-4-ила, 2-оксо-пирролидин-1-ила, 2-оксопиперидин-1-ила, 2-оксо-пиперазин-1-ила, 3-оксо-пиперазин-1-ила, 3-оксо-морфолин-4-ила, C1-3-алкилкарбониламино, (гет)арилкарбониламино, аминокарбониламино, C1-3-алкиламинокарбониламино, ди-(С 13-алкил)аминокарбониламино, пирролидин-1-ил-карбониламино, пиперидин-1-ил-карбониламино, пиперазин-1-ил-карбониламино, морфолин-4-ил-карбониламино, C1-3-алкилоксикарбониламино, гидрокси, С 1-7 022406(гет)арилокси,при этом упомянутый выше термин (гетеро)арил означает фенил, пирролил, пиразолил, имидазолил, фуранил, оксазолил, изоксазолил, тиенил, тиазолил, триазолил, оксадиазолил, пиридил, пиридазинил, пиримидинил и пиразинил, каждый из которых необязательно может быть замещен одним или двумя R10. В другом варианте настоящего изобретения R5 выбран из группы R5d, состоящей из фтора, хлора,C1-3-алкила, гидрокси-C1-3-алкила, аминокарбонила, C1-3-алкиламинокарбонила, амино, C1-3-алкиламино,C1-3-алкилкарбониламино, гидрокси, C1-3-алкилокси, трифторметила, дифторметокси, трифторметокси и аминосульфонила. В другом варианте настоящего изобретения R5 выбран из группы R5e, состоящей из фтора, хлора,метила, амино, гидрокси и метокси. В другом варианте настоящего изобретения R6, R7 выбраны независимо друг от друга из группы 6/7bR , состоящей из фтора, хлора, брома, C1-3-алкила, C2-3-алкинила, трифторметила, гидрокси, C1-3 алкилокси и циано, и/или R6/7b означает один R6 и R7, которые присоединены к смежным углеродным атомам и объединены вместе с образованием метилендиокси-, дифторметилендиокси-, этилендиоксиили C3-5-алкиленовой группы. В другом варианте настоящего изобретения R6, R7 выбраны независимо друг от друга из группы 6/7cR , состоящей из фтора, хлора, метила, этила, трифторметила, гидрокси, метокси и этокси. В другом варианте настоящего изобретения R6, R7 выбраны независимо друг от друга из группы 6/7dR , состоящей из фтора, хлора, метила, гидрокси и метокси. В другом варианте настоящего изобретения R10 выбран независимо друг от друга из группы R10b,состоящей из фтора, хлора, брома, C1-3-алкила, фенила, дифторметила, трифторметила, циано, аминокарбонила, C1-3-алкиламинокарбонила, ди-(C1-3-алкил)аминокарбонила, карбокси, C1-4-алкилоксикарбонила,нитро, амино, ацетиламино, метилсульфониламино, гидрокси, C1-3-алкилокси, дифторметокси, трифторметокси, метилсульфанила, метилсульфинила, метилсульфонила и аминосульфонила. В другом варианте настоящего изобретения R10 выбран независимо друг от друга из группы R10c,состоящей из фтора, хлора, метила, дифторметила, трифторметила, циано, гидрокси, метокси, дифторметокси и трифторметокси. В другом варианте настоящего изобретения R10 выбран независимо друг от друга из группы R10d,состоящей из фтора, метила, циано и метокси. В другом варианте настоящего изобретения RN выбран независимо друг от друга из группы RNb, состоящей из водорода, C1-6-алкила, C3-6-циклоалкила, C3-6-алкенила, фенила, C1-4-алкилкарбонила, фенилкарбонила,C1-3-алкиламинокарбонила,фениламинокарбонила,C1-4-алкилоксикарбонила,C1-4 алкилсульфонила и фенилсульфонила,при этом C1-6-алкильная группа необязательно может быть моно- или полизамещенной фтором и необязательно монозамещенной фенилом, циано, аминокарбонилом, C1-3-алкиламинокарбонилом,ди-(С 1-3-алкил)аминокарбонилом, карбокси, C1-4-алкоксикарбонилом, C1-4-алкилкарбониламино, гидрокси или C1-4-алкокси. В другом варианте настоящего изобретения RN выбран независимо друг от друга из группы RNc, состоящей из водорода,фенила,C1-4-алкилкарбонильной,фенилкарбонильной,C1-3-алкиламинокарбонильной, фениламинокарбонильной, C1-4-алкилоксикарбонильной, C1-4-алкилсульфонильной,фенилсульфонильной и C1-4-алкильной группы, которая необязательно может быть моно- или полифторированной и необязательно монозамещенной гидрокси, C1-4-алкокси, циано или фенилом. В другом варианте настоящего изобретения RN выбран независимо друг от друга из группы RNd, состоящей из водорода, метила, бензила, фенила, ацетила, трет-бутоксикарбонила и метилсульфонила. В другом варианте настоящего изобретения R8 выбран независимо друг от друга из группы R8b, состоящей из водорода и метила. В другом варианте настоящего изобретения R8 выбран независимо друг от друга из группы R8c, состоящей из водорода. В другом варианте настоящего изобретения m равно 0. Каждый R1x, R2x, R3/4x, R5x, R6/7x, RNx, R8x, R10x, m представляет собой отличительный, конкретный вариант для соответствующего заместителя, как описано выше. Таким образом, принимая во внимание указанные выше определения, предпочтительные конкретные варианты первого аспекта изобретения полностью характеризуются термином (R1x, R2x, R3/4x, R5x, R6/7x, RNx, R8x, R10x, m), где для каждого индекса x определена конкретная цифра, которая изменяется от "а" до заглавной буквы, приведенной выше. Индексы x и m могут изменяться независимо друг от друга. Все отдельные варианты, описанные термином в скобках с полной перестановкой индексов x и m, относящиеся к определениям выше, должны быть охвачены настоящим изобретением. Следующая табл. 1 иллюстрирует в качестве примера и в порядке увеличения предпочтения от первой строки к последней такие варианты от E-1 до E-36 изобретения. Это означает, что самым предпочтительным вариантом является вариант E-36, представленный данными в последнем ряду табл. 1. Таблица 1 Предпочтительные варианты изобретения E-1-E-36- Означает, что соответствующая переменная не существует в соответствующем воплощении. А также таутомеры соединений, их стереоизомеры, их смеси и их соли, при этом следующие соединения исключены: Соответственно Е-24 охватывает соединения формулы I, в которыхR1 выбран из группы R1e, состоящей из 4-гидроксифенила, 4-амино-3-метоксифенила, 3-фтор-4 гидроксифенила, 4-амино-3-хлорфенила, 3-хлор-4-гидроксифенила, индол-3-ила, индол-5-ила, индол-6 ила, 1-метилиндол-3-ила, бензимидазол-5-ила, индазол-5-ила и бензотиазол-6-ила;R2 выбран из группы R2e, состоящей из водорода, фтора, брома, циклогексилметила, фенилметила,4-метоксифенилметила, гидроксиметила, 2-гидроксипроп-2-ила, фенила, циано, аминокарбонила, метиламинокарбонила, диметиламинокарбонила, пирролидин-1-илкарбонила, морфолин-4-илкарбонила, карбокси, метоксикарбонила, амино, гидрокси, метокси, 4-метоксифенокси и 6-метилпиридазин-3-илокси;R3, R4 выбраны независимо друг от друга из группы R3/4d, состоящей из водорода и фтора;R8 выбран независимо друг от друга из группы R8c, состоящей из водорода;m равно 0,их таутомеры, стереоизомеры, смеси и соли. Соответственно Е-28 охватывает соединения формулы I, в которыхR1 выбран из группы R1e, состоящей из 4-гидроксифенила, 4-амино-3-метоксифенила, 3-фтор-4 гидроксифенила, 4-амино-3-хлорфенила, 3-хлор-4-гидроксифенила, индол-3-ила, индол-5-ила, индол-6 ила, 1-метилиндол-3-ила, бензимидазол-5-ила, индазол-5-ила и бензотиазол-6-ила;R2 выбран из группы R2f, состоящей из водорода и циано;R3, R4 выбраны независимо друг от друга из группы R3/4d, состоящей из водорода и фтора;R8 выбран независимо друг от друга из группы R8c, состоящей из водорода;m равно 0,их таутомеры, стереоизомеры, смеси и соли. Соответственно Е-33 охватывает соединения формулы I, в которыхR1 выбран из группы R1d2, состоящей из 4-гидроксифенила, 4-амино-3-метоксифенила, 3-фтор-4 гидроксифенила, 4-амино-3-хлорфенила, 3-хлор-4-гидроксифенила, индол-3-ила, индол-5-ила, индол-6 ила, 1-метилиндол-3-ила, бензимидазол-5-ила, 6-метилбензимидазол-5-ила, 7-метилбензимидазол-5-ила,индазол-5-ила и бензотиазол-6-ила;R2 выбран из группы R2f, состоящей из водорода и циано;R3, R4 выбраны независимо друг от друга из группы R3/4d, состоящей из водорода и фтора;R8 выбран независимо друг от друга из группы R8b, состоящей из водорода и метила;m равно 0,их таутомеры, стереоизомеры, смеси и соли. Соответственно Е-36 охватывает соединения формулы I, в которыхR1 выбран из группы R1f, состоящей из бензимидазол-5-ила, 6-метилбензимидазол-5-ила и 7 метилбензимидазол-5-ила;R2 выбран из группы R2f, состоящей из водорода и циано;R3, R4 выбраны независимо друг от друга из группы R3/4d, состоящей из водорода и фтора;R8 выбран независимо друг от друга из группы R8c, состоящей из водорода;m равно 0,их таутомеры, стереоизомеры, смеси и соли. Другой предпочтительный вариант данного изобретения описан формулой I.a где подструктура пиперидина и подструктура тетралина (m=1) или индана (m=0) образует цис конфигурированную структуру трициклического ядра, при этом переменные R1, R2, R3, R4 и m имеют указанные выше или ниже значения, их таутомеры, стереоизомеры, смеси и соли. Другой предпочтительный вариант данного изобретения описан формулой I.b где структура трициклического ядра R конфигурирована при С-10b (для m=1)/С-4 а (для m=0) и S конфигирована при С-4 а (для m=1)/С-9 а (для m=0), при этом переменные R1, R2, R3, R4 и m имеют указанные выше или ниже значения, их таутомеры, стереоизомеры, смеси и соли. Соответственно один вариант предпочтительных соединений согласно изобретению включает соединения формулы I.b где R1 выбран из группы R1e, состоящей из 4-гидроксифенила, 4-амино-3-метоксифенила, 3-фтор-4 гидроксифенила, 4-амино-3-хлорфенила, 3-хлор-4-гидроксифенила, индол-3-ила, индол-5-ила, индол-6 ила, 1-метилиндол-3-ила, бензимидазол-5-ила, индазол-5-ила и бензотиазол-6-ила;R2 выбран из группы R2e, состоящей из водорода, фтора, брома, циклогексилметила, фенилметила,4-метоксифенилметила, гидроксиметила, 2-гидроксипроп-2-ила, фенила, циано, аминокарбонила, метиламинокарбонила, диметиламинокарбонила, пирролидин-1-илкарбонила, морфолин-4-илкарбонила, карбокси, метоксикарбонила, амино, гидрокси, метокси, 4-метоксифенокси и 6-метилпиридазин-3-илокси;R3, R4 выбраны независимо друг от друга из группы R3/4d, состоящей из водорода и фтора;R8 выбран независимо друг от друга из группы R8c, состоящей из водорода;m равно 0,их таутомеры, стереоизомеры, смеси и соли. Другим вариантом предпочтительных соединений согласно изобретению являются соединения формулы 1.b, гдеR1 выбран из группы R1e, состоящей из 4-гидроксифенила, 4-амино-3-метоксифенила, 3-фтор-4 гидроксифенила, 4-амино-3-хлорфенила, 3-хлор-4-гидроксифенила, индол-3-ила, индол-5-ила, индол-6 ила, 1-метилиндол-3-ила, бензимидазол-5-ила, индазол-5-ила и бензотиазол-6-ила;R2 выбран из группы R2f, состоящей из водорода и циано;R3, R4 выбраны независимо друг от друга из группы R3/4d, состоящей из водорода и фтора;R8 выбран независимо друг от друга из группы R8c, состоящей из водорода;m равно 0,их таутомеры, стереоизомеры, смеси и соли. Другим вариантом предпочтительных соединений согласно изобретению являются соединения формулы 1.b, гдеR1 выбран из группы R1f, состоящей из бензимидазол-5-ила, 6-метилбензимидазол-5-ила и 7 метилбензимидазол-5-ила;R2 выбран из группы R2f, состоящей из водорода и циано;R3, R4 выбраны независимо друг от друга из группы R3/4d, состоящей из водорода и фтора;R8 выбран независимо друг от друга из группы R8c, состоящей из водорода;m равно 0,их таутомеры, стереоизомеры, смеси и соли. В отношении определений N-содержащих гетероароматических групп, таких как (гет)арил, имеющий один или несколько атомов азота в своем остове, который несет гидроксильную группу при атоме углерода, прилегающем к азоту или в другом положении кольца, что делает возможным мезомерное взаимодействие с азотом, то эти группы могут образовывать таутомерную амидную подструктуру, которая является частью изобретения; таутомерный амид, полученный в результате объединения гидроксильной группы и N-содержащего гетероароматического соединения, может нести заместители, отличные от водорода при амидном атоме азота. Примеры таких подструктур гетероароматических групп, в которых может быть образован таутомерный амид, представлены следующей подборкой: где RN определен, как описано выше. Эти таутомерные структуры можно отнести к гетероароматическим и ароматическим группам, например, таким, которые образованы (гет)арилом. В некоторых вариантах в настоящем изобретении предложены кристаллические соединения следующей структурной формулы (II): Используемый здесь термин "кристаллический" относится к твердому веществу, в котором молекулы распределены с периодически повторяющейся в трех измерениях плотностью. Кристаллические соединения формулы (II) могут представлять собой индивидуальную кристаллическую форму или смесь различных кристаллических форм. Индивидуальная кристаллическая форма означает соединение формулы (II) в виде индивидуального кристалла или множества кристаллов, при этом каждый кристалл имеет одинаковую кристаллическую форму. В конкретном варианте, по меньшей мере, определенный процент по массе соединения формулы(II) представляет собой индивидуальную кристаллическую форму. Определенные массовые проценты включают 50, 52, 55, 57, 60, 62, 65, 67, 70, 72, 75, 77, 80, 82, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97,98, 99, 99.5, 99.9% или процент в интервале от 50 до 100%. В случае, когда определенный процент по массе соединения формулы (II) определен как кристаллическая форма, оставшаяся часть соединения формулы (II) представляет собой некоторую комбинацию аморфных форм соединения формулы (II). В случае, когда процент по массе соединения формулы (II) определен как индивидуальная кристаллическая форма, оставшаяся часть соединения формулы (II) представляет собой некоторую комбинацию аморфных форм соединения формулы (II) и/или одну или несколько кристаллических форм соединения формулы (II), отличных от индивидуальной кристаллической формы. Примеры индивидуальных кристаллических форм включают формы I и II соединения формулы(II), а также индивидуальные кристаллические формы, характеризующиеся одним или несколькими свойствами, как описано здесь. В последующем описании конкретных кристаллических форм соединения формулы (II) варианты изобретения могут быть описаны в отношении конкретной кристаллической "Формы" соединения формулы (II). Тем не менее, конкретные кристаллические формы могут также характеризоваться одним или несколькими свойствами кристаллических форм, как описано здесь, относительно или безотносительно привязки к конкретной "Форме". Форма I. В одном варианте индивидуальная кристаллическая форма соединения формулы (II) характеризуется как кристаллическая форма I. В другом варианте, по меньшей мере, определенный процент по массе соединения формулы (II) представляет собой кристаллическую форму I. Определенные массовые проценты включают 50, 52, 55, 57, 60, 62, 65, 67, 70, 72, 75, 77, 80, 82, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95,96, 97, 98, 99, 99.5, 99.9% или процент в интервале от 50 до 100%. В некоторых вариантах кристаллическая форма характеризуется картиной порошковой рентгеновской дифракции (называемой здесь как "XRPD"), показанной на фиг. 1, например, с величинами углов 2, d-расстояниями и относительными интенсивностями, перечисленными в табл. 1, полученными с использованием CuK-излучения. В некоторых вариантах кристаллическая форма характеризуется одним,двумя, тремя, четырьмя, пятью или шестью пиками XRPD при углах 2, выбранных из 12.5, 12.9, 14.8,20.0, 22.2 и 26.1. В некоторых вариантах кристаллическая форма характеризуется по меньшей мере тремя пиками XRPD при углах 2, выбранных из 12.5, 12.9, 14.8, 20.0, 22.2 и 26.1. В некоторых вариантах кристаллическая форма характеризуется по меньшей мере четырьмя пиками XRPD при углах 2, выбранных из 12.5, 12.9, 14.8, 20.0, 22.2 и 26.1. В некоторых вариантах кристаллическая форма характеризуется по меньшей мере пятью пиками XRPD при углах 2, выбранных из 12.5, 12.9, 14.8, 20.0, 22.2 и 26.1. В некоторых вариантах кристаллическая форма характеризуется пиками XRPD при углах 2, выбранных из 12.5, 12.9, 14.8, 20.0, 22.2 и 26.1. В некоторых вариантах кристаллическая форма характеризуется одним, двумя, тремя или четырьмя пиками XRPD при углах 2, выбранных из 12.5, 14.8, 22.2 и 26.1. В некоторых вариантах кристаллическая форма характеризуется по меньшей мере тремя пикамиXRPD при углах 2, выбранных из 12.5, 14.8, 22.2 и 26.1. В некоторых вариантах кристаллическая форма характеризуется пиками XRPD при углах 2, выбранных из 12.5, 14.8, 22.2 и 26.1. В некоторых вариантах кристаллическая форма характеризуется одним, двумя, тремя или четырьмя главными пикамиXRPD при углах 2, выбранных из 12.5, 14.8, 22.2 и 26.1. В некоторых вариантах кристаллическая форма характеризуется главными пиками XRPD при углах 2, выбранных из 12.5, 14.8, 22.2 и 26.1. Следует понимать, что указанный угол 2 означает указанное значение 0.1. Используемый здесь "главный пик XRPD" относится к пику XRPD с относительной интенсивностью больше чем 25%. Относительная интенсивность рассчитывается как отношение максимальной интенсивности интересующего пика к максимальной интенсивности самого большого пика. Таблица 1 Пики XRPD на фиг. 1 В некоторых вариантах кристаллическая форма характеризуется спектром 13 С ядерного магнитного резонанса в твердом состоянии (называемым здесь как "SSNMR"), показанным на фиг. 2, например, с химическими сдвигами, перечисленными в табл. 2, полученными с использованием вращения под магическим углом. В конкретном варианте кристаллическая форма характеризуется 1, 2, 3, 4, 5, 6, 7, 8, 9, 10,11, 12, 13, 14, 15,16, 17 или 18 пиками 13 С SSNMR при химических сдвигах, выбранных из 170.3, 146.5,142.8, 135.0, 130.6, 128.1, 122.1, 116.7, 115.6, 112.8, 109.8, 107.6, 44.6, 43.3, 41.4, 30.3, 26.3 и 23.9 ppm. В одном варианте кристаллическая форма характеризуется по меньшей мере десятью пиками 13 С SSNMR при химических сдвигах, выбранных из 170.3, 146.5, 142.8, 135.0, 130.6, 128.1, 122.1, 116.7, 115.6, 112.8,109.8, 107.6, 44.6, 43.3, 41.4, 30.3, 26.3 и 23.9 ppm. В одном варианте кристаллическая форма характеризуется по меньшей мере пятнадцатью пиками 13 С SSNMR при химических сдвигах, выбранных из 170.3,- 13022406ppm. В одном варианте кристаллическая форма характеризуется пиками 13 С SSNMR при химических сдвигах 170.3, 146.5, 142.8, 135.0, 130.6, 128.1, 122.1, 116.7, 115.6, 112.8, 109.8, 107.6, 44.6, 43.3, 41.4, 30.3,26.3 и 23.9 ppm. Таблица 2 Химические сдвиги 13 С ЯМР из фиг. 2 В некоторых вариантах кристаллическая форма характеризуется эндотермическим переходом,имеющим начало примерно при 231.70.5C на графике дифференциального сканирования (называемом здесь как "DSC"). В некоторых вариантах кристаллическая форма характеризуется графиком DSC, показанным на фиг. 3. График изображает тепловой поток как функцию температуры образца, содержащего форму I. DSC выполняли на образце с использованием скорости сканирования 10C/мин. Кроме того, форма I характеризуется графиком термического гравиметрического анализа (называемым здесь как "TGA"), показанным на фиг. 4. График изображает процент потери массы образца как функцию температуры при скорости изменения температуры 10C/мин. График показывает потерю массы приблизительно 2.1% при изменении температуры образца от комнатной температуры до 150C, что указывает на то, что форма I является безводной. Форма II. В одном варианте индивидуальная кристаллическая форма соединения формулы (II) характеризуется как кристаллическая форма II. В другом варианте, по меньшей мере, определенный процент по массе соединения формулы (II) представляет собой кристаллическую форму II. Определенные массовые проценты включают 50, 52, 55, 57, 60, 62, 65, 67, 70, 72, 75, 77, 80, 82, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95,96, 97, 98, 99, 99.5, 99.9% или процент в интервале от 50 до 100%. В некоторых вариантах кристаллическая форма характеризуется картиной XRPD, показанной на фиг. 5, например, с величинами углов 2, d-расстояниями и относительными интенсивностями, перечисленными в табл. 3, полученными с использованием CuK-излучения. В конкретном варианте кристаллическая форма характеризуется одним, двумя, тремя, четырьмя, пятью, шестью или семью, восьмью, девятью, десятью, одиннадцатью или двенадцатью пиками XRPD при углах 2, выбранных из 13.3, 13.7,15.7, 17.6, 19.3, 19.7, 20.9, 21.3, 21.9, 23.3, 25.6 и 26.5. В конкретном варианте кристаллическая форма характеризуется, по меньшей мере, семью, восьмью, девятью, десятью или одиннадцатью пиками XRPD при углах 2, выбранных из 13.3, 13.7, 15.7, 17.6, 19.3, 19.7, 20.9, 21.3, 21.9, 23.3, 25.6 и 26.5. В некото- 14022406 рых вариантах кристаллическая форма характеризуется пиками XRPD при углах 2 13.3, 13.7, 15.7, 17.6,19.3, 19.7, 20.9, 21.3, 21.9, 23.3, 25.6 и 26.5. В некоторых вариантах кристаллическая форма характеризуется пиками XRPD при углах 2 13.7, 17.6, 21.3, 21.9, 23.3, 25.6 и 26.5. В некоторых вариантах кристаллическая форма характеризуется пиками XRPD при углах 2 13.7, 17.6, 19.7, 21.3, 21.9, 23.3, 25.6 и 26.5. В некоторых вариантах кристаллическая форма характеризуется пиками XRPD при углах 2 13.7, 17.6,19.7, 20.9, 21.3, 21.9, 23.3, 25.6 и 26.5. В некоторых вариантах кристаллическая форма характеризуется пиками XRPD при углах 2 13.7, 17.6, 19.3, 19.7, 20.9, 21.3, 21.9, 23.3, 25.6 и 26.5. В некоторых вариантах кристаллическая форма характеризуется пиками XRPD при углах 2 13.3, 13.7, 17.6, 19.3, 19.7, 20.9,21.3, 21.9, 23.3, 25.6 и 26.5. В некоторых вариантах кристаллическая форма характеризуется пикамиXRPD при углах 2 13.3, 13.7, 15.7, 17.6, 19.3, 19.7, 20.9, 21.3, 21.9, 23.3, 25.6 и 26.5. В некоторых вариантах кристаллическая форма характеризуется одним, двумя, тремя, четырьмя, пятью, шестью или семью главными пиками XRPD при углах 2, выбранных из 13.7, 17.6, 21.3, 21.9, 23.3, 25.6 и 26.5. В некоторых вариантах кристаллическая форма характеризуется главными пиками XRPD при углах 2 13.7, 17.6,21.3, 21.9, 23.3, 25.6 и 26.5. Таблица 3 Пики XRPD на фиг. 5 В некоторых вариантах кристаллическая форма характеризуется спектром 13 С SSNMR, показанным на фиг. 6, например, с химическими сдвигами, перечисленными в табл. 4, полученными с использованием вращения под магическим углом. В конкретном варианте кристаллическая форма характеризуется 1,2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15,16, 17 или 18 пиками 13 С SSNMR при химических сдвигах, выбранных из 172.6, 147.1, 144.1, 132.9, 129.6, 125.9, 121.2, 119.5, 117.7, 114.6, 110.2, 45.1, 42.4, 32.6, 28.3 и 24.4 ppm. В одном варианте кристаллическая форма характеризуется по меньшей мере десятью пиками 13 С SSNMR при химических сдвигах, выбранных из 172.6, 147.1, 144.1, 132.9, 129.6, 125.9, 121.2, 119.5,117.7, 114.6, 110.2, 45.1, 42.4, 32.6, 28.3 и 24.4 ppm. В одном варианте кристаллическая форма характеризуется по меньшей мере тринадцатью пиками 13 С SSNMR при химических сдвигах, выбранных из 172.6,147.1, 144.1, 132.9, 129.6, 125.9, 121.21, 119.5, 117.7, 114.6, 110.2, 45.1, 42.4, 32.6, 28.3 и 24.4 ppm. В одном варианте кристаллическая форма характеризуется пиками 13 С SSNMR при химических сдвигах 172.6, 147.1, 144.1, 132.9, 129.6, 125.9, 121.2, 119.5, 117.7, 114.6, 110.2, 45.1, 42.4, 32.6, 28.3 и 24.4 ppm. Таблица 4 Химические сдвиги 13 С ЯМР на фиг. 6 В некоторых вариантах кристаллическая форма характеризуется эндотермическим переходом,имеющим начало примерно при 235.50.5C на графике DSC. В некоторых вариантах кристаллическая форма характеризуется графиком DSC, показанным на фиг. 7. График изображает тепловой поток как функцию температуры образца, содержащего форму II. DSC выполняли на образце со скоростью сканирования 10C/мин. В некоторых вариантах кристаллическая форма характеризуется графиком термического гравиметрического анализа (называемым здесь как "TGA"), показанным на фиг. 8. График изображает процент потери массы образца как функцию температуры со скоростью изменения температуры 10C/мин. График показывает потерю массы приблизительно 0.1% при изменении температуры образца от комнатной температуры до 150C, что указывает, что форма II является безводной. Другие варианты изобретения относятся к индивидуальной кристаллической форме соединения формулы (II), которая характеризуется комбинацией вышеуказанных характеристик любой из описанных здесь индивидуальных кристаллических форм. Характеристикой может являться любая комбинация одной или нескольких из XRPD, TGA, DSC и SSNMR, описанных для конкретной кристаллической формы. Например, индивидуальная кристаллическая форма соединения формулы (II) может быть охарактеризована любой комбинацией 2 пиков на рентгенограмме XRPD, и/или любой комбинацией пиков химических сдвигов на спектре SSNMR, и/или любой комбинацией информации, полученной из данных измерений DSC, и/или изменения массы образца, полученных методом TGA. Следует понимать, что настоящее изобретение включает любую комбинацию аналитических методов для характеристики кристалли- 16022406 ческой формы. Настоящее изобретение также включает композиции, которые содержат любое из описанных здесь соединений. В некоторых вариантах настоящее изобретение обеспечивает фармацевтическую композицию, содержащую любое из описанных здесь соединений и фармацевтически приемлемый носитель или разбавитель. В некоторых вариантах настоящее изобретение обеспечивает фармацевтическую композицию, содержащую кристаллическое соединение формулы (II) и фармацевтически приемлемый носитель или разбавитель. Некоторые термины, используемые здесь выше или ниже для описания соединений согласно изобретению, будут определены здесь более подробно. Термины, специально не определенные здесь, имеют значения, данные им опытными специалистами в данной области с учетом описания и контекста. Однако при использовании в описании, если не указано иное, следующие термины имеют указанное значение и придерживаются следующих правил. В группах, радикалах или звеньях, определенных ниже, число атомов углерода, как правило, предшествует названию группы, например C1-6-алкил означает алкильную группу или радикал, имеющий от 1 до 6 атомов углерода. Как правило, для групп, содержащих две или несколько подгрупп, последняя названная подгруппа является местом присоединения радикала, например заместитель "арил-C1-3-алкил-" означает арильную группу, которая присоединена к C1-3-алкильной группе, которая присоединена к ядру или группе, к которой присоединен заместитель. Как правило, место присоединения конкретного остатка к другой группе должно быть изменяемым,то есть любой доступный атом, несущий атомы водорода, подлежащие замене, в пределах этого остатка,может быть связующим местом для присоединяемой группы, если не указано иное. Если не указано иное, во всем описании и прилагаемой формуле изобретения данная химическая формула или название должны охватывать все возможные структурные изомеры и стереоизомеры,включая энантиомеры, диастереомеры, цис-/транс-изомеры, E/Z изомеры и подобные, а также их смеси,например смеси 1:1 энантиомеров (называемых рацематами), смеси отдельных энантиомеров в различных пропорциях, смеси диастереомеров или смеси любых вышеперечисленных форм, где такие изомеры существуют, а также соли, включая их фармацевтически приемлемые соли, и их сольваты, такие как гидраты, включая сольваты свободных соединений или сольваты солей соединения. Используемое здесь выражение "фармацевтически приемлемый" относится к таким соединениям,продуктам, композициям и/или лекарственным формам, которые, не выходя за пределы медицинской оценки, являются пригодными для использования в контакте с тканями человека и животного без чрезмерной токсичности, раздражения, аллергической реакции или другой проблемы или осложнения, которые соответствуют отношению разумная польза/риск. Используемый здесь термин "замещенный" означает, что любой один или большее число атомов водорода на обозначенном атоме замещен с выбором из обозначенной группы при условии, что обозначенная атомарная нормальная валентность не превышена и что замещение дает стабильное соединение. Используемый здесь термин "частично ненасыщенный" означает, что в обозначенной группе или звене имеется одна, две или более, предпочтительно одна или две двойные связи. Предпочтительно, чтобы используемый здесь термин "частично ненасыщенный" не включал полностью ненасыщенных групп или звеньев. Термин "галоген" обозначает атом, выбранный из группы, включающей F, Cl, Br, и I. Термин "C1-n-алкил", где n может иметь значение от 1 до 18, обозначает насыщенную разветвленную или неразветвленную углеводородную группу, содержащую от 1 до n C-атомов. В качестве примеров таких групп можно назвать метил, этил, n-пропил, изопропил, бутил, изобутил, втор-бутил, третбутил, n-пентил, изопентил, неопентил, трет-пентил, n-гексил, изогексил и т.д. Термин "C1-n-алкилен", где n является целым числом от 1 до n, отдельно или в комбинации с другим радикалом, обозначает ациклический двухвалентный алкильный радикал с прямой или разветвленной цепью, содержащий от 1 до n атомов углерода. Например, термин C1-4-алкилен включает -(CH2)-,-(CH2-CH2)-,-(CH(CH3-,-(CH2-CH2-CH2)-,-(C(CH3)2)-,-(CH(CH2CH3-,-(CH(CH3)-CH2)-,-(CH2-CH(CH3-, -(CH2-CH2-CH2-CH2)-, -(CH2-CH2-CH(CH3-, -(CH(CH3)-CH2-CH2)-, -(CH2-CH(CH3)CH2)-, -(CH2-C(CH3)2)-, -(C(CH3)2-CH2)-, -(CH(CH3)-CH(CH3-, -(CH2-CH(CH2CH3-, -(CH(CH2CH3)-CH2), -(CH(CH2CH2CH3-, -(CHCH(CH3)2)- и -C(CH3)(CH2CH3)-. Термин "C2-n-алкилен", где n имеет значение от 3 до 10, обозначает разветвленную или неразветвленную углеводородную группу, содержащую от 2 до n атомов C и C=C двойную связь. В качестве примеров таких групп можно назвать этенил, 1-пропенил, 2-пропенил, 1-бутенил, 2-бутенил, 3-бутенил, 1 пентенил, 2-пентенил, 3-пентенил, 4-пентенил, 1-гексенил, 2-гексенил, 3-гексенил, 4-гексенил, 5 гексенил и т.д. Термин "C2-n-алкинил", где n имеет значение от 3 до 10, обозначает разветвленную или неразветвленную углеродородную группу, содержащую от 2 до n C-атомов, и тройную C=C связь. В качестве примеров таких групп можно назвать этинил, 1-пропинил, 2-пропинил, 1-бутинил, 2-бутинил, 3-бутинил, 1 пентинил, 2-пентинил, 3-пентинил, 4-пентинил, 1-гексинил, 2-гексинил, 3-гексинил, 4-гексинил, 5 гексинил и т.д. Если не указано иное, алкинильные группы соединены через C-атом в положении 1 с ос- 17022406 тальной частью молекулы. В соответствии с этим такие обозначения, как 1-пропинил, 2-пропинил, 1 бутинил и т.д., равнозначны обозначениям 1-пропин-1-ил, 2-пропин-1-ил, 1-бутин-1-ил и т.д. Сказанное аналогичным образом относится и к C2-n-алкенильным группам. Термин "C1-n-алкоксигруппа" обозначает C1-n-алкил-O-группу, в которой C1-n-алкил имеет указанные выше значения. В качестве примеров таких групп можно назвать метоксигруппу, этоксигруппу, nпропоксигруппу, изопропоксигруппу, n-бутоксигруппу, изобутоксигруппу, втор-бутоксигруппу, третбутоксигруппу, n-пентоксигруппу, изопентоксигруппу, неопентоксигруппу, трет-пентоксигруппу, nгексоксигруппу, изогексоксигруппу и т.д. Термин "C1-n-алкилкарбонил" обозначает C1-n-алкил-C(=O)-группу, в которой C1-n-алкил имеет указанные выше значения. В качестве примеров таких групп можно назвать метилкарбонил, этилкарбонил,n-пропилкарбонил, изопропилкарбонил, n-бутилкарбонил, изобутилкарбонил, втор-бутилкарбонил, третбутилкарбонил, n-пентилкарбонил, изопентилкарбонил, неопентилкарбонил, трет-пентилкарбонил, nгексилкарбонил, изогексилкарбонил и т.д. Термин "C3-n-циклоалкил" обозначает насыщенную моно-, би-, три- или спирокарбоциклическую группу, содержащую от 3 до n C-атомов. В качестве примеров таких групп можно назвать циклопропил,циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклононил, циклододецил, бицикло[3.2.1]октил, спиро[4.5]децил, норпинил, норборнил, норкарил, адамантил и т.д. В предпочтительном варианте под обозначением "C3-7-циклоалкил" подразумеваются насыщенные моноциклические группы. Термин "C5-n-циклоалкенил" обозначает C5-n-циклоалкильную группу, которая определена выше и дополнительно имеет по меньшей мере одну двойную C=C связь. Термин "C3-n-циклоалкилкарбонил" обозначает C3-n-циклоалкил-C(=O)-группу, где C3-n-циклоалкил имеет указанные здесь значения. Термин "C3-n-гетероциклоалкил" обозначает насыщенную моно-, би-, три- или спирокарбоциклическую группу, которая определена выше и содержит от 3-m до n-m атомов С, где m атомы углерода заменены на m гетероатомы, независимо выбранные из N, NRN, О, S, SO и SO2. В качестве примеров таких групп можно назвать азиридинил, оксиранил, азетидинил, оксетанил, пирролидинил, тетрагидрофуранил,тетрагидротиофенил, пиперидинил, тетрагидропиранил, тетрагидротиопиранил, пиперазинил, морфолинил, 1,3-диоксанил, 1,4-диоксанил, тиоморфолинил, азепанил, оксепанил, тиепанил, 1-азабицикло[2.2.2]октан, 1,4-диаза-бицикло[2.2.2]октан и т.д. В предпочтительном варианте под обозначением "гетероциклоалкил" подразумеваются насыщенные моноциклические C2-6-циклоалкильные группы, в которых один или два атома углерода заменены на N и/или О. Термин "три-(С 1-4-алкил)силил" обозначает силильные группы с одинаковыми или двумя либо тремя различными алкильными группами. Термин "ди-(С 1-3-алкил)аминогруппа" обозначает аминогруппы с двумя одинаковыми или различными алкильными группами. Если группы или остатки необязательно являются замещенными, это относится к любой форме группы или остатка. Например, если алкильная группа необязательно является моно- или полифторированной, это включает также алкильные остатки, которые являются частью более крупных групп, например алкилокси, алкилкарбонил, алкоксиалкил и других, или если (гет)арильная группа необязательно является моно- или полизамещенной конкретным заместителем или набором заместителей, это также включает (гет)арильные группы, которые являются частью более крупных групп, например(гет)арил-C1-n-алкил, (гет)арилокси, (гет)арилокси-C1-n-алкил, (гет)арил-C1-n-алкилокси и других. Соответственно в случаях, когда, например, R2 или R5 имеют, например, значение (гет)арилокси, в то время как (гет)арильные остатки являются необязательно моно- или полифторированными и (гетеро)арил означает, в частности, фенил, значения моно-, ди-, три-, тетра- и пентафторфенокси являются также включенными. Это относится к группам или остаткам, в которых часть группы или остаток заменен другой группой, например группа CH2 необязательно заменена на О, S, NRN, CO или SO2. Например,если остаток обозначает, в частности, гидрокси-C1-3-алкил, где группа CH2 необязательно заменена на CO(=карбонил), то это также включает карбокси, карбоксиметил, гидроксиметилкарбонил, 1-гидрокси-2 оксо-этил, карбоксиэтил, 2-карбоксиэтил, 1-карбоксиэтил, гидроксиметилкарбонилметил, 1-гидрокси-2 оксо-пропил, гидроксиэтилкарбонил, (2-гидроксиэтил)карбонил, гидрокси-3-оксо-пропил, 1-гидрокси-3 оксо-пропил, 2-гидрокси-3-оксо-пропил, (1-гидроксиэтил)карбонил, 2-гидрокси-1-оксо-проп-2-ил, гидрокси-2-оксо-проп-2-ил и 3-гидрокси-1-оксо-проп-2-ил. Аналогично, определение, такое как C1-n-алкил,где одна или несколько групп CH2 необязательно заменены, например, карбонилом, и который является необязательно замещенным, например, гидрокси или амино, также содержит конкретные остатки, не имеющие группы CH и/или CH2, например карбокси и аминокарбонил. Все атомы/элементы, описанные здесь, включая атомы, которые являются частью группы, включают все стабильные изотопные формы соответствующего элемента. Например, в случаях, когда упоминается водород, конкретно или как часть группы, такой как метил, это включает водород и дейтерий как стабильные изотопные формы элемента водорода. Предлагаемые в изобретении соединения могут быть получены известными методами синтеза. Предпочтительно получать такие соединения более подробно рассмотренными ниже предлагаемыми в изобретении способами. На схеме 1 показан общий способ получения основных структур соединений изобретения с использованием трициклического пиридина в качестве предшественника для трициклического пиперидинового остова; R2, R3, R4 и m имеют указанные выше или ниже значения. Трициклический пиридин можно получить из 2-инданонов (m=0) или 2-тетралонов (m=1) и пропаргиламина или его производного путем объединения двух исходных соединений в присутствии катализатора, такого как соли или комплексы золота и меди, предпочтительно NaAuCl4 и CuCl2 (см. J. Org. Chem., 2003, 68, 6959-6966). Реакцию обычно проводят в спиртах, таких как этанол, при температуре от 20 до 120C путем обычного нагревания или нагревания микроволновым излучением. Полученная структура пиридина превращается в производное пиперидина путем восстановления водородом в присутствии катализатора на основе переходного металла, такого как PtO2, Pt/C, Pd/C, Rh/C, Ni-Ренея, или их смесей. В число предпочтительных растворителей входят спирты, например метанол и этанол, этилацетат, уксусная кислота, вода, эфир, тетрагидрофуран, 1,4-диоксан, N,N-диметилформамид, N,N-диметилацетамид, N-метилпирролидинон, гексаны,метилциклогексан или их смеси, необязательно в комбинации с добавками, такими как кислота, например трифторуксусная кислота, соляная кислота и серная кислота, при температуре от 10 до 150C, предпочтительно от 20 до 80C, и давлении водорода от 1 до 150 бар, предпочтительно от 1 до 20 бар. Или же, восстановление можно осуществить после превращения пиридина в ион пиридиния путем Nалкилирования, N-ацилирования или N-сульфонилирования путем обработки источником гидрида, таким как NaBH4 или LiAlH4. Последний реагент предпочтительно использовать в углеводородах, эфире, тетрагидрофуране, 1,4-диоксане, бензоле или толуоле, в то время как первый предпочтительно использовать в спиртах, например метаноле или этаноле, и воде, необязательно в комбинации с корастворителем, таким как тетрагидрофуран, 1,4-диоксан или N-метилпирролидинон, а также добавкой, такой как кислота, например уксусная кислота, или основание, например гидроксид натрия. Схема 1 Стратегия 1 построения трициклического остова Другой способ, альтернативный способу синтеза предшественника трициклического пиридина,описанному на схеме 1, показан на схеме 2; R2, R3, R4 и m имеют указанные выше или ниже значения. Катализируемое переходным металлом связывание фенилметильного (для m=0) или фенетильного (дляm=1) производного металла с 2,3-дигалогенидом или псевдогалогенидом пиридина обеспечивает получение необходимого промежуточного соединения. Пригодными остатками металла в фенилалкильном производном металла могут быть, например, MgCl, MgBr, B(OH)2, B(ОСМе 2 СМе 2 О), BF3K, ZnCl, ZnBr или ZnI, и пригодным галогенидом или псевдогалогенидом при пиридине предпочтительно является Cl,Br, I, F3CSO3, p-TolSO3 и MeSO3. В зависимости от партнеров связывания могут использоваться различные катализаторы, главным образом на основе Pd, Ni, Cu или Fe. Pd(PPh3)4, Pd[1,1'-бис-(дифенилфосфино)ферроцен)]Cl2, Pd(PPh3)2Cl2, Ni(PPh3)2Cl2, или Pd на С, наночатиц Pd или Fe, Pd(II), Ni(II), Fe(II),или солей Fe(III), таких как Pd(O2CCH3)2, PdCl2, NiCl2 или FeCl3, необязательно в комбинации с 2(необязательно замещенный фенил)фенилдициклогексилом или ди-трет-бутилфосфином, трифенилфосфином, тритолилфосфином, трифурилфосфином, три-трет-бутилфосфином, трициклогексилфосфином,при этом соль 1,3-диарил-имидазолидиния или соль 1,3-диарил-дигидроимидазолидиния являются наиболее часто используемыми катализаторами. Связывания предпочтительно проводить в толуоле, тетрагидрофуране, 1,4-диоксане, 1,2-диметоксиэтане, N,N-диметилформамиде, N,N-диметилацетамиде, Nметилпирролидиноне или их смесях в зависимости от партнеров связывания, необязательно в комбинации со спиртом, например метанолом, водой, солями щелочных металлов, такими как LiCl, NaOH,Na2CO3, K2CO3, CS2CO3, NaO2CCH3 или K3PO4, солями аммония, например Bu4NCl, или солями серебра,например AgO3SCF3, при температуре от -10 до 150C. Последующую циклизацию бензил- или фенетилпиридина для получения трициклической структуры пиридина можно проводить с помощью другой реакции, катализируемой переходным металлом, предпочтительно Pd, например, на основе Pd(O2CC3)2 илиPd(O2CCMe3)2, и фосфинового лиганда, такого как, например, ди-трет-бутилметилфосфин, трициклогексилфосфин, трифенилфосфин, три(4-фторфенил)фосфин или 2-(2-диметиламинофенил)фенилдифенилфосфин. Предпочтительно циклизацию проводить в присутствии соли калия, например K2CO3 илиKO2CCH3, необязательно в комбинации с солью серебра, например Ag2CO3 или AgO3SCF3, и/или пивалевой кислоты в N,N-диметилацетамиде при температуре от 40 до 160C (см., например, Tetrahedron, 2008,64, 6015-20 и размещенные в них ссылки). На схеме 3 показана стратегия получения предшественника трициклического пиридина, альтернативная описанной на схеме 1; R2, R3, R4 и m имеют указанные выше или ниже значения. Катализируемое переходным металлом связывание фенильного производного металла, при этом металлом является, например MgCl, MgBr, B(OH)2, B(OCMe2CMe2O), BF3K, ZnCl, ZnBr или ZnI, с производным пиридин-2 карбоновой кислоты или замещенным 3-галогенидом или псевдогалогенидом производным пиридин-2 карбоновой кислоты (m=0), или производным пирид-2-илуксусной кислоты (m=1), где производным карбоновой кислоты предпочтительно является карбоновая кислота, сложный эфир карбоновой кислоты или карбонитрил, обеспечивает получение первого промежуточного соединения. В зависимости от партнеров связывания могут использоваться различные катализаторы, предпочтительно на основе Pd, напримерPd(PPh3)4, Pd[1,1'-бис-(дифенилфосфино)ферроцен]Cl2, Pd(PPh3)2Cl2, Pd на С, наночастиц Pd, солей Pd(II),таких как Pd(O2CCH3)2 или PdCl2, необязательно в комбинации с 2-(необязательно замещенный фенил)фенил-дициклогексилом или ди-трет-бутилфосфином, трифенилфосфином, тритолилфосфином,трифурилфосфином,три-трет-бутилфосфином,трициклогексилфосфином,солью 1,3-диарилимидазолидиния или солью 1,3-диарил-дигидроимидазолидиния, необязательно в присутствии солей щелочных металлов, таких как LiCl, NaOH, NaOtBu, KOtBu, Na2CO3, K2CO3, Cs2CO3, NaO2CCH3 илиK3PO4, солей аммония, например Bu4NCl, и/или солей серебра, например AgO3SCF3, предпочтительно используемых в толуоле, тетрагидрофуране, 1,4-диоксане, N,N-диметилформамиде, N,Nдиметилацетамиде, N-метилпирролидиноне или их смесях, необязательно в комбинации с водой, при температуре от -10 до 150C. Последующее внутримолекулярное ацилирование по фриделю-Крафтсу обеспечивает получение трициклического пиридинового остова путем активации функциональной карбоксигруппы, например карбоновой кислоты, ангидрида, смешанного ангидрида, или эфира, карбонилхлорида или нитрила, с кислотой Льюиса, в зависимости от типа карбоксигруппы и электронной природы подструктуры бензола, например бромисто-водородной кислоты, соляной кислоты, серной кислоты,фосфорной кислоты, трифторуксусной кислоты, метансульфоновой кислоты, толуолсульфоновой кислоты, трифторметансульфоновой кислоты, SnCl4, FeCl3, AlBr3, AlCl3, SbCl5, BCl3, BF3, ZnCl2, монтмориллонитов, POCl3 и PCl5, предпочтительно в инертном растворителе, например ацетонитриле, дихлорметане,1,2-дихлорметане, 1,4-диоксане, 1,2-диметоксиэтане, углеводородах, нитробензоле или хлорбензоле при температуре от 0 до 180C. Восстановление полученной таким способом кетогруппы предпочтительно осуществлять водородом в присутствии катализатора на основе переходного металла, например Pd/C,Pd(OH)2, PtO2, Pt/C или Rh/C, в спирте, например метаноле, гликоле или этаноле, воде, уксусной кислоте этилацетате, N-метилпирролидиноне, тетрагидрофуране, 1,4-диоксане, эфире или их смесях, необязательно в присутствии кислоты, например соляной кислоты, при температуре от 0 до 180C, предпочтительно от 20 до 120C, и давлении водорода от 1 до 100 бар, предпочтительно от 1 до 10 бар. Или же,восстановление кетогруппы можно провести с помощью гидрида, например триэтилсилана, борана, борогидрида натрия или литий-алюминий гидрида, необязательно в присутствии кислоты Льюиса, например BF3, AlCl3, InCl3, SnCl4, FeCl3, ZnCl2, уксусной кислоты, трифторуксусной кислоты, соляной кислоты, метансульфоновой кислоты или трифторметансульфоновой кислоты при температуре от 0 до 140C. На схеме 4 показана стратегия, пригодная для получения остова соединений изобретения, где m равно 0; R2, R3 и R4 имеют указанные выше или ниже значения. Фенилпиридильная структура собрана путем катализируемого переходным металлом связывания, как описано на схеме 3. Для этой цели использовали нуклеофильную фенильную группу, несущую M, и электрофильную пиридиновую группу,несущую Y, несмотря на то, что для сборки могут использоваться элементы структуры с противоположной реакционной способностью, то есть фенил, несущий Y, и пиридин, несущий M, обеспечивая такой же продукт связывания. Полученное соединение несет две потенциальные уходящие группы, предпочтительно фтор, хлор, бром, арилсульфонат, нитро или арилсульфонил, по одной на каждом (гетеро)ароматическом кольце, прилегающем к фенилпиридильной связи. Дианионный метиленовый синтон,например малоновая кислота, сложный малоновый диэфир, малодинитрил, цианоуксусная кислота или цианоуксусный сложный эфир, в комбинации с основанием, например Cs2CO3, K2CO3, Na2CO3, KOtBu,NaOEt, NaOMe, NEt3, iPr2NEt, 1,8-диазабицикло[5.4.0]-ундек-7-ене, последовательно заменяет обе уходящие группы ароматическими нуклеофильными заместителями с образованием инденопиридинового остова. Предпочтительными растворителями для этого превращения, которое предпочтительно проводят при температуре от 0 до 180C, среди прочих, являются N-метилпирролидинон, N,N-диметилацетамид,N,N-диметилформамид, спирт, например этанол, изопропанол или трет-бутанол, вода, диметилсульфоксид, 1,4-диоксан, тетрагидрофуран или их смеси. Карбоксильные электроноакцепторные группы удаляют гидролизом с помощью основания, например NaOH или KOH, или кислоты, например HCl или H2SO4, в водном или спиртовом растворе с образованием карбоксигруппы, которая декарбоксилируется спонтанно или при нагревании в кислой или основной среде. Такая обработка является особенно подходящей для соединений, несущих одну или несколько электроноакцепторных групп на фенильном кольце. Схема 4 Стратегия 4 построения трициклического остова На схеме 5 показана сборка трициклического остова изобретения, начиная с соответствующего пирролидин енамина 2-инданонов или 2-тетралонов и акриламида; R2, R3, R4 и m имеют значения, которые определены здесь выше или ниже. Требуемую трициклическую структуру в виде дигидропиридинона получали путем нагревания двух партнеров реакции при температуре от 60 до 150C. Восстановление двойной связи водородом в присутствии переходного металла, такого как палладий на угле, или источником гидрида, таким как триалкилсилан, например триэтилсилан, борогидрид, например NaBH4,NaBH(O2CCH3)3 или NaH3BCN, или аланатом, например LiAlH4, необязательно в присутствии добавки,такой как кислота Льюиса, например уксусной кислоты, трифторуксусной кислоты, AlCl3 или BF3OEt2,обеспечило получение трициклического пиперидинона. Предпочтительно возможное восстановление амида выполнять с помощью источника гидрида, например NaBH4, в комбинации с уксусной кислотой в 1,4-диоксане, LiAlH4 в тетрагидрофуране или эфире, или дигидро-бис-(2-метоксиэтокси)алюмината натрия в этиленгликолевом диметиловом эфире при температуре от 0 до 100C. Другой общеприменимый подход к получению основных структур соединений изобретения основан на реакции электрофильного ароматического замещения (схема 6); R2, R3, R4 и m имеют указанные выше или ниже значения. Соответственно ароматическая часть молекулы реагирует с положительно заряженным атомом углерода пиперидинового кольца с образованием трициклического остова. Реакционноспособное промежуточное соединение, несущее положительно заряженный атом углерода в азацикле,можно получить путем добавления кислоты Льюиса к олефиновой связи или карбонильной группе, или активацией соответствующим образом расположенной уходящей группы, такой как Cl, Br, I, OH, O3SCF3,O3SMe или O3S-p-Tol. Для этой классической реакции описано большое количество кислот Льюиса, которые здесь могут использоваться. Наиболее широко используемыми являются бромисто-водородная кислота, иодисто-водородная кислота, соляная кислота, серная кислота, фосфорная кислота, P4O10, трифторуксусная кислота, метансульфоновая кислота, толуолсульфоновая кислота, трифторметансульфоновая кислота, Sc(O3SCF3)3, InCl3, InBr3, SnCl4, FeCl3, AlBr3, AlCl3, SbCl5, BCl3, BF3, ZnCl2, монтмориллониты, POCl3 и PCl5. В зависимости от отклонения подлежащей замещению уходящей группы и электронной природы ароматического кольца используются более или менее сильные кислотные катализаторы. Помимо упомянутых кислотных катализаторов, соли серебра, например AgO3SCF3, могут быть эффективными в реакциях с использованием галогенидов в качестве уходящих групп. Предпочтительными растворителями являются углеводороды, такие как гексан или циклогексан, хлорированные углеводороды,такие как дихлорметан или 1,2-дихлорметан, перфторированные углеводороды, нитробензол, ацетонитрил, хлорированные бензолы, гетероароматические соединения, такие как хинолин, 1,2-диметоксиэтан,1,4-диоксан, эфир, ионные липиды, вода, уксусная кислота, или их смеси, несмотря на то, что не все из этих растворителей могут быть использованы с перечисленными выше кислотами Льюиса. Реакции проводили при температуре от -10 до 220C, предпочтительно от 20 до 180C. Реакции можно также проводить в условиях микроволнового излучения. Схема 6 Стратегия построения трициклического остова Представленный путь синтеза основан на использовании защитных групп. Подходящие защитные группы для соответствующих функциональных групп и их удаление описаны здесь далее и могут использоваться аналогично (см. также Protecting Groups, Philip J. Kocienski, 3rd edition, Georg Thieme Verlag,Stuttgart, 2004 и указанные в нем ссылки). В дальнейшем предложено несколько подходящих способов получения производных соединений общей формулы I или их предшественников, полученных, как описано выше, несущих конкретные функциональные группы для сборки других соединений общей формулы I или их предшественников. Эта подборка не является полной, но лишь предлагает некоторые возможности с помощью примера. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит амино-, алкиламино- или иминогруппу, то путем ацилирования или сульфонилирования его можно перевести в соответствующее ацильное или сульфонильное соединение общей формулы I или его предшественник. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит гидроксильную группу, то путем ацилирования или сульфонилирования его можно перевести в соответствующее ацильное или сульфонильное соединение общей формулы I или его предшественник. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит гидроксильную группу, то путем алкилирования его можно перевести в соответствующий эфир общей формулы I или его предшественник. Если в способе согласно изобретению получено соединение общей формулы I или его предшест- 22022406 венник, которое содержит амино-, алкиламино- или иминогруппу, то путем алкилирования или восстановительного алкилирования его можно перевести в соответствующее алкильное соединение общей формулы I или его предшественник. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит нитрогруппу, то путем восстановления его можно перевести в соответствующее аминосоединение. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит иминогруппу, то путем нитрозирования и последующего восстановления его можно перевести в соответствующее N-амино-иминосоединение. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит C1-4-алкилоксикарбонильную группу, то путем расщепления эфира его можно перевести в соответствующее карбоксисоединение. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит карбоксильную группу, то путем этерификации его можно перевести в соответствующий сложный эфир общей формулы I или его предшественник. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит карбоксильную или сложноэфирную группу, то путем реакции с амином его можно перевести в соответствующий амид общей формулы I или его предшественник. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит ароматическую подструктуру, то путем реакции электрофильного замещения его можно дериватизировать с помощью атома хлора, брома или иода, или группы нитро, сульфоновой кислоты, хлорсульфонильной или ацильной группы в соответствующее соединение общей формулы I или его предшественник. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит аминогруппу, присоединенную к ароматической или гетероароматической группе, то его можно перевести в соответствующее циано-, фтор-, хлор-, бром-, иод-, гидрокси-, меркапто- или азидо-дериватизированное соединение общей формулы I и его предшественник путем диазотирования и последующей замены диазогруппы на цианид, фторид, хлорид, бромид, иодид, гидроксид, алкил или сероводород, или азид соответственно. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит аминогруппу, присоединенную к ароматической или гетероароматической группе, то его можно перевести в соответствующее арил-дериватизированное ароматическое соединение общей формулы I или его предшественник путем диазотирования аминогруппы и последующей замены полученной диазогруппы на соответствующий арильный нуклеофил, опосредованной подходящим переходным металлом. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит атом хлора, брома или иода, или трифторметилсульфонилокси-, мезилоксиили тозилоксигруппу, которая присоединена к ароматической или гетероароматической группе, его можно перевести в соответствующее арил-, алкенил-, алкинил- или алкил-дериватизированное соединение общей формулы I или его предшественник путем замены соответствующей группы на арил, алкенил,алкинил или алкил, опосредованной переходным металлом. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит атом хлора, брома или иода, или трифторметилсульфонилокси-, мезилоксиили тозилоксигруппу, которая присоединена к ароматической или гетероароматической группе, то можно произвести замену на циано для получения соответствующего ароматического соединения общей формулы I или его предшественника. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит атом хлора, брома или иода, или трифторметилсульфонилокси-, мезилоксиили тозилоксигруппу, которая присоединена к ароматической или гетероароматической группе, то можно произвести замену на водород для получения соответствующего ароматического соединения общей формулы I или его предшественника. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит два гетероатома у смежных атомов углерода, которыми являются амино и гидрокси, амино или меркапто, то эти гетероатомы могут быть связаны через посредство углеродного атома карбокси для формирования подструктуры циклического амидина, иминового эфира или иминотиоэфира, которая может являться частью ароматического кольца. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит цианогруппу, то его можно перевести путем восстановления в аминоалкилдериватизированное соединение общей формулы I или его предшественник. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит цианогруппу, то ее можно перевести в N-гидроксикарбамимидоильную группу путем обработки гидроксиламином. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит N-гидроксикарбамимидоильную группу, то его можно перевести в оксадиазол-дериватизированное соединение общей формулы I или его предшественник путем обработки карбоксильной или родственной группой. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит аминокарбонильную группу, то его можно перевести путем дегидрирования в соответствующее цианосоединение общей формулы I или его предшественник. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит кето- или альдегидную группу, то его можно перевести путем восстановления в соответствующее гидроксильное соединение общей формулы I или его предшественник. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит карбоновую кислоту или аминокарбонильную группу, то его можно перевести путем реакции перегруппировки в соответствующее амино-дериватизированное соединение общей формулы I или его предшественник. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит кето- или альдегидную группу, то его можно перевести в алкенилдериватизированное соединение общей формулы I или его предшественник. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит олефиновую двойную C=C или тройную C=C связь, то его можно восстановить для получения соответствующего насыщенного соединения общей формулы I или его предшественника. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит кето- или альдегидную группу, то его можно перевести в соответствующее третичное или вторичное гидроксильное соединение общей формулы I или его предшественник. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит группу эфира карбоновой кислоты, то его можно перевести в третичный спирт путем добавления двух эквивалентов органометаллического соединения. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит первичную или вторичную гидроксигруппу, то его можно перевести путем оксисления в соответствующее карбонильное соединение общей формулы I или его предшественник. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит олефиновую связь, то его можно перевести в соответствующее гидроксильное соединение общей формулы I или его предшественник путем гидроборирования с последующим окислением. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит олефиновую связь, то его можно перевести путем дигидроксилирования в соответствующее 1,2-дигидроксисоединение общей формулы I или его предшественник. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит олефиновую связь, то его можно перевести путем озонолиза в соответствующее карбонильное соединение общей формулы I или его предшественник. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит олефиновую связь, то его можно перевести в соответствующее гидроксильное соединение общей формулы I или его предшественник путем эпоксидирования с последующим раскрытием оксиранового кольца с помощью источника гидрида. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит олефиновую связь, то его можно перевести путем Вакер-окисления в соответствующее карбонильное соединение общей формулы I или его предшественник. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит олефиновую связь, то его можно перевести путем гидроцианирования в соответствующее цианосоединение общей формулы I или его предшественник. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит цианогруппу, то его можно перевести путем добавления воды в соответствующее аминокарбонильное соединение общей формулы I или его предшественник. Последующая этерификация необязательно проводится в растворителе, таком как метиленхлорид,N,N-диметилформамид, бензол, толуол, хлорбензол, тетрагидрофуран, 1,4-диоксан или их смеси, или особенно предпочтительно в соответствующем спирте, необязательно в присутствии кислоты, например соляной кислоты, или обезвоживающего агента, например изобутилового эфира хлормуравьиной кислоты, тионилхлорида, триметилхлорсилана, серной кислоты, метансульфокислоты, п-толуолсульфоновой кислоты,трихлорида фосфора,пентоксида фосфора,N,N'-карбонилимидазола,N,N'дициклогексилкарбодиимида, трифенилфосфина/четыреххлористого углерода, или их комбинаций, необязательно в присутствии 4-диметиламинопиридина и/или 1-гидроксибензотриазола. Реакции проводят при температуре от 0 до 150C, предпочтительно от 0 до 80C. Сложный эфир может быть получен при взаимодействии соединения, содержащего карбоксигруппу, с соответствующим алкилгалогенидом в присутствии основания. Последующее ацилирование или сульфонилирование необязательно проводят в растворителе, таком как метиленхлорид, N,N-диметилформамид, бензол, толуол, хлорбензол, тетрагидрофуран, 1,4 диоксан или их смеси, с помощью соответствующего ацильного или сульфонильного электрофила, необязательно в присутствии третичного органического основания, неорганического основания или обезвоживающего агента. Как правило, используемыми обезвоживающими агентами являются, например,изобутиловый эфир хлорформуравьиной кислоты, тионилхлорид, триметилхлорсилан, серная кислота,метансульфоновая кислота, п-толуолсульфоновая кислота, трихлорид фосфора, пентоксид фосфора,N,N'-дициклогексилкарбодиимид, N,N'-карбонилдиимидазол, трифенилфосфина/четыеххлористого углерода или их комбинации, которые могут использоваться в присутствии 4-диметиламинопиридина и/или 1-гидроксибензотриазола при температуре от 0 до 150C, предпочтительно от 0 до 80C. Последующее алкилирование необязательно проводят в метиленхлориде, N,N-диметилформамиде,бензоле, толуоле, хлорбензоле, тетрагидрофуране, 1,4-диоксане или их смесях с помощью алкилирующего средства, такого как соответствующий галогенид или сложный эфир сульфоновой кислоты, например с помощью метилиодида, этилбромида, диметилсульфата или бензилхлорида, необязательно в присутствии третичного органического основания или неорганического основания при температуре от 0 до 150C,предпочтительно от 0 до 100C. Последующее восстановительное алкилирование проводят с помощью соответствующего карбонильного соединения, такого как формальдегид, ацетальдегид, пропионовый альдегид, ацетон или бутиральдегид, в присутствии комплексного гидрида металла, такого как борогидрид натрия, борогидрид лития, триацетоксиборогидрид натрия или цианоборогидрид натрия, целесообразнее при значении pH от 6 до 7 и при комнатной температуре, или в присутствии катализатора гидрирования, например, с помощью водорода в присутствии палладия-на-угле, при давлении водорода от 1 до 5 бар. Метилирование можно также проводить в присутствии муравьиной кислоты в качестве восстановителя при повышенных температурах, например от 60 до 120C. Последующее восстановление нитрогруппы проводят, например, с помощью водорода и катализатора, такого как палладий-на-угле, диоксид платины или никель-Ренея, или с использованием других восстанавливающих агентов, таких как хлорид олова(II), железа или цинка, необязательно в присутствии кислоты, такой как уксусная кислота. Последующее нитрозирование аминогруппы с последующим восстановлением для получения Nамино-иминосоединения проводят, например, с помощью алкилнитрита, такого как изоамилнитрит, с образованием N-нитрозо-иминосоединения, которое затем восстанавливают до N-аминоиминосоединения с использованием, например, цинка в присутствии кислоты, такой как уксусная кислота. Последующее отщепление C1-4-алкилоксикарбонильной группы для получения карбоксигруппы проводят, например, путем гидролиза с помощью кислоты, такой как соляная кислота, или серная кислота, или гидроксида щелочного металла, такого как гидроксид лития, гидроксид натрия или гидроксид калия. трет-Бутильная группа предпочтительно удаляется путем обработки сильной кислотой, например трифторуксусной кислотой или соляной кислотой в инертном растворителе, таком как дихлорметан, 1,4 диоксан или этилацетат. Последующее амидирование проводят путем взаимодействия соответствующего реакционноспособного производного карбоновой кислоты с соответствующим амином в растворителе, таком как метиленхлорид, N,N-диметилформамид, бензол, толуол, хлорбензол, тетрагидрофуран, 1,4-диоксан или их смесях, или без растворителя в избыточном амине, необязательно в присутствии неорганического либо третичного органического основания, 4-диметиламинопиридина и/или 1-гидроксибензотриазола при температуре от 0 до 150C, предпочтительно от 0 до 80C. Использование карбоновой кислоты может привести к образованию требуемого амида путем in situ активации функциональной карбоксигруппы,например, с помощью изобутилового эфира хлормуравьиной кислоты, тионилхлорида, оксалилхлорида,триметилхлорсилана, трихлорида фосфора, пентоксида фосфора, N,N'-карбонилдиимидазола, смеси трифенилфосфина с тетрахлоридом углерода, 2-(1 Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония тетрафторбората, N,N'-дициклогексилкарбодиимида или их комбинации. Последующее введение атома хлора, брома или иода в ароматическую подструктуру проводят с помощью реакции ароматического соединения с соответствующим электрофилом соответствующего атома галогена. Подходящими хлорсодержащими или бромсодержащими электрофилами могут являться,например, N-галосукцинимид, HOCl, HOBr, трет-BuOCl, трет-BuOBr, хлор, бром, дибромизоциануровая кислота, дихлорбромат пиридиния, трибромид пиридиния или хлористый сульфурил, которые могут использоваться отдельно или в комбинации с кислотой, например соляной кислотой, бромисто-водородной кислотой, тетрафторборной кислотой, трифликовой кислотой, серной кислотой или уксусной кислотой,или кислотой Льюиса, например галогенидом железа(III), гидратом трехфтористого бора, эфиратом трифтористого бора или галогенидом алюминия. Другими эффективными комбинациями могут быть LiBr и цериевый нитрат аммония, KCl или KBr с Oxone, или KBr и перборат натрия. Подходящие иодсодер- 25022406 жащие электрофилы могут быть получены из иода и окислителя, такого как азотная кислота, серный ангидрид, двуокись марганца, HIO3, перекись водорода, периодат натрия, пероксидисульфаты и Oxone. Другим подходящими иодсодержащими электрофилами могут являться, например, хлорид иода, дихлориодаты и N-иодосукцинимид. Эти иодсодержащие электрофилы могут необязательно использоваться без добавок или в присутствии кислоты, такой как уксусная кислота, трифторуксусная кислота или серная кислота, или кислота Льюиса, такая как гидрат трифторида бора или соли меди. Если введению подлежит нитрогруппа, то соответствующими источниками азотсодержащего электрофила могут быть, например, азотная кислота, ацетилнитрат, цериевый нитрат аммония, нитрат натрия, N2O5, алкилнитрат и тетрафторборат нитрония. Некоторые из этих реагентов могут использоваться без добавок несмотря на то, что некоторые из них предпочтительнее использовать в комбинации с кислотой, например серной кислотой или трифликовой кислотой, уксусным ангидридом, трифторуксусным ангидридом, кислотой Льюиса, например трифлатом иттербия или ацетатом железа, Р 2 О 5, или основанием. SO3H-группа может быть введена путем взаимодействия ароматического соединения, например, с концентрированной серной кислотой, SO3, ClSO3H или ClSO2NMe2 в комбинации с трифлатом индия. Взаимодействие ароматического соединения с ClSO3H позволяет получить соответствующее хлорсульфонилированное производное, которое может быть гидролизовано до сульфоновой кислоты. Ацилирование ароматической части выполняется с использованием ацилсодержащего электрофила, который можно получить из соответствующего ацилгалогенида, например хлорида, или ацилангидрида и кислоты Льюиса, такой как галогенид алюминия, галогенид диэтилалюминия, галогенид индия, галогенид железа(III), галогенид олова(IV),трифторид бора, галогенид титана(IV), или кислоты Бронстеда, например серной кислоты или трифликовой кислоты. Формильная группа предпочтительно вводится с использованием так называемых условий по Вильсмайеру и Вильсмайеру-Хааку: диалкилформамида, в сочетании с фосгеном, тионилхлоридом,POCl3 или оксалилхлоридом. Предпочтительные растворители для описанных электрофильных заместителей могут различаться в зависимости от используемого электрофила; некоторыми наиболее часто используемыми являются метиленхлорид, 1,2-дихлорэтан, хлорбензол, дихлорбензол, эфир, 1,4-диоксан,фторированные углеводороды, гексаны, хинолин и ацетонитрил. Предпочтительно использовать температурный интервал от 0 до 180C. Последующую замену аминогруппы, которая присоединена к ароматической или гетероароматической группе, инициируют диазотированием аминогруппы с помощью азотистой кислоты или источника нитрозония, или эквивалента, такого как соль азотистой кислоты, объединенная с кислотой, например нитрита натрия с соляной кислотой, тетрафторбората нитрозония или алкилнитрита, например третбутил нитрита или изоамил нитрита. Диазотирование необязательно проводят в метиленхлориде, 1,2 дихлорэтане, N,N-диметилформамиде, N-метилпирролидиноне, бензоле, толуоле, хлорбензоле, тетрагидрофуране, воде, этилацетате, спирте, эфире, 1,2-диметоксиэтане, 1,4-диоксане или их смесях при температуре от -10 и 100C (диазотирование аминогрупп подробно описано, например, в Angew. Chem. Int.Ed., 1976, 15, 251). Последующая замена диазогруппы цианогруппой, атомом хлора или брома с использованием цианида меди, хлорида или бромида соответственно известна как реакция Зандмейера (см.,например, March's Advanced Organic Chemistry, Michael В. Smith and Jerry March, John WileySons Inc.,6. Ed., New Jersey, 2007, и ссылки, размещенные в них); реакцию необязательно проводят при температуре от -10 до 120C в одном из растворителей или смесях, упомянутых выше. Замену диазогруппы атомом фтора можно осуществить с помощью тетрафторборатной соли или тетрафторборной кислоты и нагревания от 20 до 160C; реакция известна как реакция Шиеманна. Иод можно ввести путем обработки диазосоединения иодидом, например иодидом натрия, предпочтительно с использованием воды или водной смеси растворителей при температуре от 0 до 120C. Диазогруппу заменяют гидрокси с помощью воды или водной смеси растворителей при температуре от 0 до 180C. Реакцию обычно проводят без использования дополнительных добавок, но предпочтительным является добавление оксида меди или сильной кислоты. Меркапто или алкилмеркапто можно ввести с помощью их соответствующих дисульфидных солей или диалкилдисульфидов при температуре от 0 до 120C; в зависимости от используемых серасодержащих веществ предпочтительным может быть инертный растворитель или водная система растворителя (см., например, Synth. Commun., 2001, 31, 1857, и ссылки, размещенные в них). Последующую замену аминогруппы, присоединенной к ароматической или гетероароматической группе с помощью арильной группы, можно выполнить с помощью соответствующего диазосоединения,которое можно получить, как описано выше. Реакцию с арильным нуклеофилом, предпочтительно арилборной кислотой, эфиром борной кислоты, трифторборатом, галогенидом цинка или станнаном, проводят в присутствии соединений, содержащих переходный металл на основе палладия, никеля, родия, меди или железа, предпочтительно палладия. Активным катализатором может являться комплекс переходного металла с лигандами, такими как, например, фосфины, фосфиты, карбены имидазола, карбены имидазолидина, дибензилиденацетон, аллил или нитрилы, элементная форма переходного металла, такая как палладий-на-угле или наночастицы, или соли, такие как хлорид, бромид, ацетат или трифторацетат. Диазосоединение предпочтительно использовать в виде его тетрафторборатной соли, необязательно в воде,N-метилпирролидиноне, N,N-диметилформамиде, метиленхлориде, бензоле, толуоле, тетрагидрофуране,этилацетате, спирте, эфире, 1,2-диметоксиэтане, 1,4-диоксане или их смесях при температуре от 10 до 180C, предпочтительно от 20 до 140C. Последующая замена атома хлора, брома или иода, или трифторметилсульфонилокси-, мезилоксиили тозилоксигруппы, которая присоединена к ароматической или гетероароматической группе с помощью арильного, алкенильного, алкинильного или алкильного остатка, предпочтительно опосредована соединениями переходного металла на основе палладия, никеля, меди или железа. Активным катализатором может являться комплекс переходного металла с лигандами, такими как фосфины, например тритрет-бутилфосфин, трициклогексилфосфин, 2-(субзамещенный фенил)фенил-дициклогексилфосфины, 2(субзамещенный фенил)фенил-ди-трет-бутилфосфины, 1,1'-бис-(дифенилфосфино)ферроцен, трифенилфосфин, тритолилфосфин или трифурилфосфин, фосфиты, 1,3-дизамещенные карбены имидазола, 1,3 дизамещенные карбены имидазолидина, дибензилиденацетон, аллил или нитрилы, элементная форма переходного металла, такая как палладий-на-угле или наночастицы железа или палладия, или соль, такая как фторид, хлорид, бромид, ацетат, трифлат или трифторацетат. Реакцию замены предпочтительно проводить с помощью трифторбората, борной кислоты или эфира борной кислоты (реакция Сузуки или реакция типа Сузуки), галогенида цинка (реакция Негиши или реакция типа Негеши), станнана (реакция Стилле или реакция типа Стилле), силана (реакция Хияма или реакция типа Хияма), галогенида магния(реакция Кумада или реакция типа Кумады) арильного, алкенильного или алкильного остатка, подлежащего введению. Предпочтительно использовать концевой алкин как таковой или в виде его цинк ацетиленидного производного. В зависимости от природы электрофильных и нуклеофильных участников реакции, предпочтительными или даже основными могут быть добавки, такие как галогениды, например хлорид лития, фторид калия, тетрабутиламмония фторид, источники гидроксида, такие как гидроксид калия или карбонат калия, соли серебра, такие как оксид серебра или трифлат, и/или соли меди, такие как хлорид меди или тиофен-2-карбоксилат меди. Иодид меди является предпочтительной добавкой в связывании с концевыми алкинами (реакция Соногашира). Реакцию связывания предпочтительно проводить в бензоле, толуоле, эфире, тетрагидрофуране, 1,2-диметоксиэтане, 1,4-диоксане, N,Nдиметилформамиде, N,N-диметилацетамиде, N-метилпирролидиноне, спирте, воде или их смесях несмотря на то, что в зависимости от нуклеофила некоторые из них являются менее подходящими или неподходящими. Предпочтительные температуры изменяются от -10 до 180C. Последующую замену атома хлора, брома или иода, или мезилокси-, трифторметилсульфонилоксиили тозилоксигруппы, которая присоединена к ароматической или гетероароматической группе с помощью цианогруппы, предпочтительно проводить с помощью опосредованного переходным металлом процесса. Медь, никель и палладий являются наиболее часто используемыми металлами для этого превращения и используются в качестве элементов, солей или комплексов в сочетании с источником цианида. Иодид меди, сульфат меди, цианид меди, хлорид никеля, бромид никеля, цианид никеля, бис(трифенилфосфин)никеля дихлорид, палладий-на-угле, тетракис(трифенилфосфин)палладий, трис(дибензилиденацетон)дипалладий, ацетат палладия, трифторацетат палладия, хлорид палладия, цианид палладия, необязательно объединенные с лигандом, таким как трициклогексилфосфин, три-трет-бутилфосфин, трифенилфосфин, 1,1'-бис-(дифенилфосфино)ферроцен, диадамантил-н-бутил-фосфин илиXantphos, входят в число обычно используемых катализаторов. Обычно используемыми источниками цианида являются цианид натрия, цианид калия, цианид цинка, цианид меди, цианид никеля, гексацианоферрат калия и цианогидрин ацетона. Реакции предпочтительно проводить в N,N-диметилформамиде,N,N-диметилацетамиде, N-метилпирролидиноне, диметилсульфоксиде, пиридине, ацетонитриле, хинолине, толуоле, тетрагидрофуране, 1,2-диметоксиэтане, 1,4-диоксане или их смесях при температуре от 20 до 280C, предпочтительно от 60 до 200C. Для некоторых условий реакции могут быть предпочтительными такие добавки, как цинк, карбонат натрия, иодид калия, вода и пиридин, и/или использование микроволнового излучения. Последующая замена атома хлора, брома или иода, или трифторметилсульфонилокси-, мезилоксиили тозилоксигруппы, которая присоединена к ароматической или гетероароматической группе с помощью атома водорода, предпочтительно опосредована соединениями переходного металла на основе палладия, никеля, платины или родия. Активным катализатором может являться комплекс переходного металла с лигандами, элементная форма или соль переходного металла, как указано выше. Никель Ренея или палладий-на-угле входят в число предпочтительных катализаторов. Подходящими источниками водорода могут быть водород, предпочтительно при давлении от 1 до 10 бар, силаны, например триалкоксисилан или полиметилгидросилоксан, бораны, гидриды, например борогидрид щелочного металла, муравьиная кислота или формиаты, например формиат аммония. Реакции предпочтительно проводят в N,Nдиметилформамиде, N,N-диметилацетамиде, N-метилпирролидиноне, бензоле, толуоле, тетрагидрофуране, воде, этилацетате, спирте, эфире, 1,2-диметоксиэтане, 1,4-диоксане или их смесях при температуре от-10 до 180C, более предпочтительно от 20 до 140C. Последующую циклизацию, начиная с соединения, несущего два гетероатома при смежных атомах углерода, необязательно выполняют с эквивалентом карбокси, таким как нитрил, хлорид или фторид карбоновой кислоты, карбоновая кислота, кетен, эфир карбоновой кислоты или тиоэфир карбоновой кислоты. Весь процесс превращения предусматривает две стадии реакции: присоединение эквивалента карбокси к одному из двух гетероатомов с последующей циклизацией с другим гетероатомом. На первой стадии происходит образование амида с функциональной аминогруппой, как описано здесь выше. Следующую стадию реакции, которая предусматривает циклизацию со вторым гетероатомом, можно осуществить путем нагревания в присутствии кислоты, например уксусной кислоты, трифторуксусной кислоты, серной кислоты или соляной кислоты или основания, например гидроксида натрия, этоксида натрия или трет-бутоксида натрия. Может быть предпочтительным использование обезвоживающих агентов,таких как ангидриды, например уксусный ангидрид, ортоэфиры, например триметил ортоформиат, тионилхлорид, фосген, дифосген, трифосфген, оксихлорид фосфора, пентахлорид фосфора, диалкилкарбодиимиды, комбинаций с фосфинами, например трифенилфосфин или триалкилфосфин с диалкил азодикарбоксилатами, бромом, иодом или 1,2-дигалоэтанами, например 1,2-дибромтетрафторэтаном. Реакции предпочтительно проводить в инертных растворителях или смесях, таких как метиленхлорид, 1,2 дихлорэтан, бензол, толуол, тетрагидрофуран, эфир или их комбинации, несмотря на то, что циклизация в присутствии кислоты или основания может также выполняться в воде или спирте, например метаноле,этаноле, изопропаноле или трет-бутаноле, или в комбинациях с этими растворителями. Реакции проводят при температуре от 0 до 200C, предпочтительно от 20 до 140C. Последующее восстановление цианогруппы для получения аминометильной группы предпочтительно проводить с помощью водорода в присутствии соединений переходного металла или с помощью гидрида. Подходящие переходные металлы могут быть на основе палладия, никеля, платины, родия или рутения, такие как палладий-на-угле, гидроксид палладия, оксид платины или никель-Ренея, которые можно использовать в растворителях, таких как этилацетат, спирты, например метанол или этанол, дихлорметан, тетрагидрофуран, эфир, бензол, толуол, N,N-диметилформамид или N-метилпирролидинон при давлении водорода от 1 до 10 бар и при температуре от 0 до 160C. Добавки, такие как кислоты, например соляная кислота, метансульфоновая кислота, серная кислота и уксусная кислота, могут быть предпочтительными для восстановления с помощью катализаторов на основе переходных металлов. В число предпочтительных источников гидрида входят, например, борогидриды, например борогидрид натрия, три-сек-бутилборогидрид калия, боран или триэтилборогидрид лития, и аланаты, например литий-алюминий гидрид или диизобутилалюминия гидрид. Некоторые из этих реагентов лучше всего использовать в сочетании с хлоридом никеля или хлоридом кобальта, таким как борогидрид натрия. Эти реагенты можно применять, например, в тетрагидрофуране, эфире, 1,4-диоксане, 1,2-диметоксиэтане,дихлорметане, 1,2-дихлорэтане, бензоле или толуоле; некоторые также совместимы со спиртовыми или водными растворами. Предпочтительные температуры реакций изменяются в интервале от -80 до 160C,более предпочтительно от -40 до 80C. Последующее образование N-гидроксикарбамимидоильной группы из цианогруппы можно осуществить путем обработки цианосоединения гидроксиламином. Реакцию предпочтительно проводить в водных или спиртовых растворителях при температуре от 0 до 140C. Последующее образование оксадиазола из N-гидроксикарбамимидоила проводится с эквивалентом карбокси, таким как нитрил, хлорид или фторид карбоновой кислоты, карбоновая кислота, кетен, эфир карбоновой кислоты или тиоэфир карбоновой кислоты. Превращение относится к формированию кольца,начиная с двух гетероатомов при смежных атомах углерода, описанных выше, и может проводиться аналогично. Последующее образование цианогруппы из аминокарбонильной группы предпочтительно проводить с использованием дегидратирующего агента, такого как ангидрид, например уксусный ангидрид,трифторуксусный ангидрид или трифликовый ангидрид, фосген, тионилхлорид, оксалилхлорид, POCl3,PCl5, P4O10, трифенилфосфит или трифенил- или триалкилфосфин в комбинации с тетрахлорметаном,1,2-дибромтетрафторэтаном или бромом. Реакции предпочтительно проводят в дихлорметане, 1,2 дихлорэтане, гексанах, эфире, 1,4-диоксане, бензоле, толуоле, ацетонитриле, их смесях или без растворителя при температуре от 0 до 140C. Предпочтительными могут быть добавки, такие как амины, например пиридин или триэтиламин, или N,N-диметилформамид. Последующее восстановление кето- или альдегидной группы для получения вторичного или первичного спирта можно осуществить с помощью комплексного гидрида металла, такого как борогидрид натрия, борогидрид лития, триэтилборогидрид лития, гидрид диизобутилалюминия или литий-алюминий гидрид. Восстановления можно проводить, например, в дихлорметане, 1,2-дихлорэтане, гексанах, эфире,1,4-диоксане, тетрагидрофуране, N,N-диметилформамиде, N-метилпирролидоне, бензоле, толуоле, спиртах, например метаноле, воде или их смесях, при этом не все агенты восстановления совместимы со всеми этими растворителями. Предпочтительные температуры изменяются от -80 до 140C в зависимости от восстанавливающей активности реагента. Или же, для восстановления можно использовать водород в присутствии катализатора на основе переходного металла. Последующее превращение карбоксигруппы в аминогруппу путем перегруппировки можно осуществить путем нагревания ацилазида с образованием изоцианата (перегруппировка Курциуса). Изоцианат можно гидролизовать до свободного амина или перевести в производное мочевины или карбамата обработкой амином или спиртом соответственно. Ацилазид можно получить обработкой соотвествующего ацилсодержащего электрофила, например ацилхлорида, ангидрида карбоновой кислоты или эфира карбоновой кислоты, источником азида, таким как, например, азид натрия или азид триметилсилила, в рас- 28022406 творителе, таком как 1,4-диоксан, 1,2-диметоксиэтан, ацетонитрил, тетрагидрофуран, дихлорметан, 1,2 дихлорэтан, N-метилпирролидинон, N,N-диметилформамид, толуол, бензол, гексаны или их смеси; кроме того, в некоторых случаях можно использовать воду или спирты. Реакции обычно проводят при температуре от -10 до 120C. Или же, ацилсодержащий электрофил можно получить in situ из кислоты и затем перевести в ацилазид: дифенилфосфорилазид в присутствии основания, например триэтиламина или этилдиизопропиламина, в растворителе, таком как ацетонитрил, бензол, толуол или спирт, при повышенной температуре доказал свою эффективность в качестве реагента для этого прямого превращения. Прямое превращение может быть достигнуто с помощью гидразоевой кислоты и кислотного катализатора, такого как серная кислота, например, в хлороформе, при повышенных температурах (реакция Шмидта). Другим способом осуществления полного превращения является перегруппировка Лоссена: начиная с ацилсодержащего электрофила, такого как ацилхлорид, получено соответствующее подходящее производное гидроксаминовой кислоты, которое, в свою очередь, перегруппируется с получением изоцианата и затем амина путем нагревания и/или обработки основанием, например гидроксидом натрия(см., например, J. Org. Chem., 1997, 62, 3858 and Synthesis, 1990, 1143 и размещенные там ссылки). Незамещенный амид карбоновой кислоты может быть превращен в амин путем так называемой перегруппировки Хоффмана. В число подходящих реагентов для этого превращения входят NaOBr, бром,объединенный с метоксидом натрия, N-бромсукцинимид и метоксид натрия, PhI(O2CCF3)2 и PhI(OH)OTs(Ts представляет собой 4-толилсульфонил). Последующее превращение альдегидной или кето функциональности в олефин может быть выполнено, например, с помощью так называемой реакции Виттига и ее модикаций, олефинирования по Петерсону и реакции Жюлия и их модификаций. Эти реакции широко используются в органическом синтезе и подробно описаны, например, в March's Advanced Organic Chemistry, Michael В. Smith и Jerry March,John WileySons Inc., 6. Ed., New Jersey, 2007 и размещенных в них ссылках. Последующее восстановление C=C двойной или CC тройной связи предпочтительно осуществлять с помощью водорода в присутствии соединений переходного металла на основе палладия, никеля, платины, рутения или родия, предпочтительно никеля-Ренея, палладия-на-угле, оксида платины иRhCl(PPh)3. Реакции предпочтительно проводят в метиленхлориде, N,N-диметилформамиде, N,Nдиметилацетамиде, N-метилпирролидиноне, бензоле, толуоле, тетрагидрофуране, воде, этилацетате,спирте, эфире, 1,2-диметоксиэтане, 1,4-диоксане или их смесях при температуре от 0 до 180C, более предпочтительно от 20 до 140C, и давлении водорода от 1 до 10 бар, предпочтительно от 1 до 5 бар. Последующее превращение альдегида или кетона во вторичный или третичный спирт предпочтительно осуществлять путем добавления углеродсодержащего нуклеофила, например алкила, аллила, алкенила, арила или алкинила лития, магния или соединения церия в тетрагидрофуране, эфире, 1,4 диоксане, 1,2-диметоксиэтане, толуоле, гексанах или их смесях при температуре от -80 до 80C. Последующее превращение сложного эфира карбоновой кислоты в третичную гидроксигруппу предпочтительно осуществлять с помощью двух или более эквивалентов углеродсодержащего нуклеофила, например алкила, аллила, алкенила, арила или алкинила лития, магния или соединения церия в тетрагидрофуране, эфире, 1,4-диоксане, 1,2-диметоксиэтане, толуоле, гексанах или их смесях при температуре от -80 до 80C. Последующее окисление первичного или вторичного гидроксисоединения можно осуществить с помощью окислителя, такого как диметилсульфоксид, в комбинации, например, с оксалилхлоридом, уксусным ангидридом, SO3 пиридином или дициклогексилкарбодиимидом, хлорхроматом пиридиния(РСС), дихроматом пиридиния (PDC), периодинаном Десса-Мартина, двуокисью марганца, 2,2,6,6 тетраметилпиперидин-N-оксидом (TEMPO), необязательно в комбинации с соокислителем, или тетрапропиламмония перрутенатом (ТРАР) в комбинации с соокислителем, таким как N-метилморфолин-Nоксид, который необязательно используются в присутствии основания, например триэтиламина, предпочтительно в толуоле, дихлорметане или 1,2-дихлорэтане, при температуре от -70 до 60C. Или же, превращение можно выполнить как окисление по Оппенауэру, например, с помощью Al(OtBu)3 и ацетона. Последующее гидроборирование и окисление олефиновой связи проводят с помощью борана, например боранового комплекса с тетрагидрофураном, триметиламином или диметилсульфидом, диэтилбораном, тексилбораном, 9-борабицикло[3.3.1]нонаном, NaBH4 в комбинации с BF3 или TiCl4, или дихлорбораном, предпочтительно в тетрагидрофуране при температуре от -20 до 60C. Продукт гидроборирования последовательно обрабатывают, например, пероксидом водорода и гидроксидом натрия в водном растворе для замены группы бора в промежуточном соединении на гидрокси. Последующее дигидроксилирование олефиновой связи предпочтительно проводят с помощью тетроксида осмия или осмата калия в комбинации с соокислителем, например N-метилморфолин-N-оксидом или K3Fe(CN)6, предпочтительно в воде в комбинации с трет-BuOH, тетрагидрофуране и/или 1,4 диоксане при температуре от -20 до 60C. Последующее расщепление олефиновой связи путем озонолиза проводят с помощью озона, предпочтительно в дихлорметане при температуре от -50 до -78C. Промежуточное соединение, полученное таким способом, может быть превращено в карбонильное соединение путем обработки, например, диме- 29
МПК / Метки
МПК: A61P 3/00, A61K 31/435, C07D 401/06
Метки: применение, гидрохлорида, ингибиторов, кристаллические, формы, качестве, 4a-r,9a-s)-1-(1h-бензоимидазол-5-карбонил)-2,3,4,4a,9,9a-гексагидро-1h-индено[2,1-b]пиридин-6-карбонитрила
Код ссылки
<a href="https://eas.patents.su/30-22406-kristallicheskie-formy-gidrohlorida-4a-r9a-s-1-1h-benzoimidazol-5-karbonil-2344a99a-geksagidro-1h-indeno21-bpiridin-6-karbonitrila-i-ih-primenenie-v-kachestve-ingibitorov-hsd-1.html" rel="bookmark" title="База патентов Евразийского Союза">Кристаллические формы гидрохлорида (4a-r,9a-s)-1-(1h-бензоимидазол-5-карбонил)-2,3,4,4a,9,9a-гексагидро-1h-индено[2,1-b]пиридин-6-карбонитрила и их применение в качестве ингибиторов hsd 1</a>
Предыдущий патент: Устройство для открывания и закрывания, а также упаковочная тара, содержащая такое устройство
Следующий патент: Противогрибковые 5,6-дигидро-4h-пирроло[1,2-a][1,4]бензодиазепины и 6h-пирроло[1,2-a][1,4]бензодиазепины, замещенные бициклическими производными бензола
Случайный патент: Замещённые пирролы и имидазолы, содержащие их композиции, способ получения и применение












