Противогрибковые 5,6-дигидро-4h-пирроло[1,2-a][1,4]бензодиазепины и 6h-пирроло[1,2-a][1,4]бензодиазепины, замещенные бициклическими производными бензола
Номер патента: 22407
Опубликовано: 30.12.2015
Авторы: Де Вит Келли, Мас Луи Жюль Роже Мари, Мерпул Ливен
Формула / Реферат
1. Соединение формулы (I)
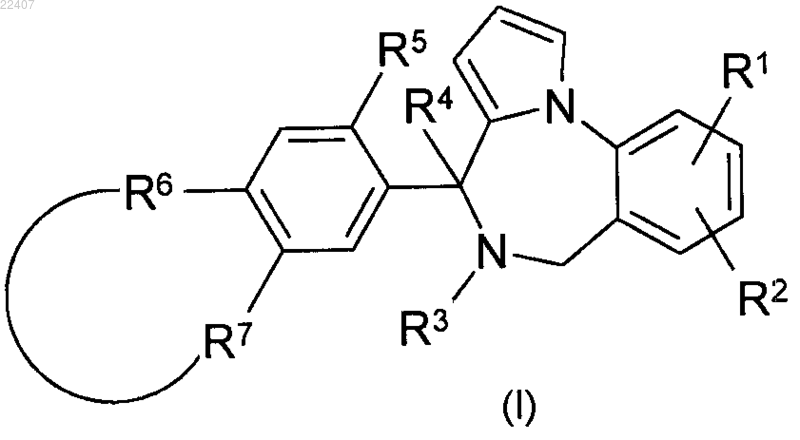
где R1 представляет собой водород, галоген, С1-4алкил или C1-4алкилокси;
R2 представляет собой водород или галоген;
R3 и R4 представляют собой водород;
или R3 и R4, взятые вместе, образуют связь;
R5 представляет собой водород или С1-4алкилокси;
R6 и R7, взятые вместе, образуют бивалентный радикал -R6-R7-, имеющий формулу
-(CH2)m-Y1-(CH2)n-m- (a), -Y2a-(CH2)t-Y2b- (d), или
-(CH2)n-m-Y1-(CH2)m- (b), -(CH2)r-Y2a-CH2-Y2b-(CH2)q- (е);
-(CH2)s- (с),
где бивалентный радикал -R6-R7- может, где возможно, быть замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена, С1-4алкила, гидроксила, C1-4алкилокси и оксо;
Y1 представляет О, NR8a или S;
Y2a и Y2b каждый независимо представляют О, R8b или S;
R8a представляет водород или С1-4алкил;
R8b представляет водород или С1-4алкил;
m представляет 0, 1 или 2;
n представляет 2, 3 или 4;
s представляет 3, 4 или 5;
t представляет 1, 2 или 3;
r представляет 0 или 1;
q представляет 0 или 1;
при условии, что по меньшей мере один из r и q равен 1,
или его фармацевтически приемлемая аддитивная соль,
при условии, что соединение не представляет собой 4-(1,3-бензодиоксол-5-ил)-5,6-дигидро-4Н-пирроло[1,2-а][1,4]бензодиазепин или 4-(1,3-бензодиоксол-5-ил)-5,6-дигидро-4Н-пирроло[1,2-a][1,4]бензодиазепин.HCl.
2. Соединение по п.1, где
R6 и R7, взятые вместе, образуют бивалентный радикал -R6-R7-, имеющий формулу
-(CH2)m-Y1-(CH2)n-m- (a), -(CH2)s- (с), или
-(CH2)n-m-Y1-(CH2)m- (b), -Y2a-(CH2)t-Y2b- (d);
где бивалентный радикал -R6-R7- может, где возможно, быть замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена, C1-4алкила и оксо;
Y1 представляет О или NR8a;
Y2a и Y2b каждый независимо представляют О или R8b;
R8a представляет водород или C1-4алкил;
R8b представляет водород или C1-4алкил;
m представляет 0, 1 или 2;
n представляет 2 или 3;
s представляет 3 или 4;
t представляет 1.
3. Соединение по п.1, где
R1 представляет собой водород, галоген или C1-4алкилокси;
R6 и R7, взятые вместе, образуют бивалентный радикал -R6 R7-, имеющий формулу
-(CH2)m-Y1-(CH2)n-m- (a), -(CH2)s- (с), или
-Y2a-(CH2)t-Y2b- (d);
где бивалентный радикал -R6-R7- может, где возможно, быть замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена, C1-4алкила и оксо;
Y1 представляет О или Н;
Y2a представляет О;
Y2b представляет О или NH;
m представляет 0, 1 или 2;
n представляет 2 или 3;
s представляет 3 или 4;
t представляет 1.
4. Соединение по п.1, где
R1 является галогеном;
R2 представляет собой водород;
R5 представляет собой водород;
R6 и R7, взятые вместе, образуют бивалентный радикал -R6-R7-, имеющий формулу
-(CH2)m-O-(CH2)n-m-,
-(CH2)s-, или -O-CH2-O-,
где бивалентный радикал -(CH2)m-O-(CH2)n-m- или -(CH2)s- может, где возможно, быть замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена и оксо;
где бивалентный радикал -O-CH2-O- замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена и оксо;
m представляет 0 или 1;
n представляет 3;
s представляет 3 или 4.
5. Соединение по п.1, где R1 представляет собой галоген.
6. Соединение по п.1, где R6 и R7, взятые вместе, образуют бивалентный радикал -R6-R7-, где -R6-R7- выбран из группы, состоящей из -(CH2)3-, -(CH2)4-, -(CH2)2-O-, -CH2-CH(CH3)-O-, -С(=O)-(CH2)2-, -С(=O)-(CH2)3-, -O-(CH2)2-, -O-(CH2)3-, -CH2-O-(CH2)2-, -(СН2)2-С(=O)-, -O-CF2-(CH2)2-, -(CH2)2-С(=O)-, -CF2-(CH2)2-, -C(=O)-O-CH2-, -CH2-O-C(=O)-, -O-CF2-O-, -O-C(=O)-N(CH3)-, -N(CH3)-(CH2)2- и -N(CH3)-С(=O)-C(CH3)2-.
7. Соединение по п.1, где R6 и R7, взятые вместе, образуют бивалентный радикал -R6-R7-, имеющий формулу -O-CH2-O-, где -O-CH2-O- замещен одним или двумя заместителями, выбранными из группы, состоящей из галогена, C1-4алкила, гидроксила, C1-4алкилокси и оксо.
8. Соединение по любому из пп.1-7, где R3 и R4 взяты вместе с образованием связи.
9. Соединение по п.1, где соединение представляет собой
7-хлор-4-(2,3-дигидро-1Н-инден-5-ил)-5,6-дигидро-4Н-пирроло[1,2-a][1,4]бензодиазепин,
7-хлор-4-(2,3-дигидро-1H-инден-5-ил)-5,6-дигидро-4Н-пирроло[1,2-a][1,4]бензодиазепин.HCl,
7-хлор-4-(2,3-дигидро-1H-инден-5-ил)-5,6-дигидро-4Н-пирроло[1,2-a][1,4]бензодиазепин.HBr,
7-хлор-4-(2,3-дигидро-1H-инден-5-ил)-6Н-пирроло[1,2-а][1,4]бензодиазепин,
7-хлор-4-(5,6,7,8-тетрагидро-2-нафталинил)-6Н-пирроло[1,2-а][1,4]бензодиазепин,
7-хлор-4-(2,2-дифтор-1,3-бензодиоксол-5-ил)-6Н-пирроло[1,2-a][1,4]бензодиазепин,
4-(2,2-дифтор-1,3-бензодиоксол-5-ил)-7,9-дифтор-6Н-пирроло[1,2-a][1,4]бензодиазепин,
4-(2,2-дифтор-1,3-бензодиоксол-5-ил)-7-фтор-6Н-пирроло[1,2-a][1,4]бензодиазепин,
6-(7-фтор-6Н-пирроло[1,2-a][1,4]бензодиазепин-4-ил)-3,4-дигидро-1(2Н)-нафталинон,
7-хлор-4-(2,2-дифтор-3,4-дигидро-2Н-1-бензопиран-6-ил)-6Н-пирроло[1,2-a][1,4]бензодиазепин,
4-(3,4-дигидро-1Н-2-бензопиран-6-ил)-7-фтор-6Н-пирроло[1,2-a][1,4]бензодиазепин,
7-хлор-4-(3,4-дигидро-1Н-2-бензопиран-6-ил)-6Н-пирроло[1,2-a][1,4]бензодиазепин,
9-хлор-4-(2,2-дифтор-1,3-бензодиоксол-5-ил)-6Н-пирроло[1,2-a][1,4]бензодиазепин или
10-хлор-4-(3,4-дигидро-2Н-1-бензопиран-6-ил)-6Н-пирроло[1,2-a][1,4]бензодиазепин,
их стереоизомерную форму или их фармацевтически приемлемую аддитивную соль.
10. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по любому из пп.1-9 и фармацевтически приемлемый носитель.
11. Применение соединения по любому из пп.1-9 в качестве лекарственного средства для лечения или профилактики грибковой инфекции.
12. Применение соединения по любому из пп.1-9 при лечении или профилактике грибковой инфекции.
13. Применение по п.12, где грибковая инфекция вызывается одним или несколькими грибками, выбранными из группы, состоящей из Candida spp.; Aspergillus spp.; Cryptococcus neoformans; Sporothrix schenckii; Epidermophyton floccosum; Microsporum spp.; Trichophyton spp.; Fusarium spp.; Rhizomucor spp.; Mucor circinelloides; Rhizopus spp.; Malassezia furfur; Acremonium spp.; Paecilomyces; Scopulariopsis; Arthrographis spp.; Scytalidium; Scedosporium spp.; Trichoderma spp.; Penicillium spp.; Penicillium marneffei; Blastoschizomyces.
14. Применение по п.12, где грибковая инфекция вызывается одним или несколькими грибками, выбранными из группы, состоящей из Candida parapsilosis, Aspergillus spp., Cryptococcus neoformans, Microsporum spp. и Trichophyton spp.
15. Применение по п.12, где грибковая инфекция вызывается одним или несколькими грибками, выбранными из группы, состоящей из Microsporum canis, Trichophyton mentagrophytes, Trichophyton rubrum и Aspergillus fumigates.
Текст
ПРОТИВОГРИБКОВЫЕ 5,6-ДИГИДРО-4H-ПИРРОЛО[1,2-a][1,4]БЕНЗОДИАЗЕПИНЫ И 6H-ПИРРОЛО[1,2-a][1,4]БЕНЗОДИАЗЕПИНЫ, ЗАМЕЩЕННЫЕ БИЦИКЛИЧЕСКИМИ ПРОИЗВОДНЫМИ БЕНЗОЛА Настоящее изобретение относится к новым противогрибковым 5,6-дигидро-4H-пирроло-[1,2-a][1,4]бензодиазепинам и 6H-пирроло[1,2-a][1,4]бензодиазепинам, замещенным бициклическими производными бензола формулы (I), где R1, R2, R3, R4, R5, R6 и R7 имеют значения, определенные в формуле изобретения. Соединения в соответствии с настоящим изобретением являются активными, в основном, против дерматофитов и системных грибковых инфекций. Изобретение дополнительно относится к способам получения таких новых соединений, фармацевтическим композициям, содержащим указанные соединения в качестве активного ингредиента, а также применению указанных соединений в качестве лекарственного средства. Мерпул Ливен, Мас Луи Жюль Роже Мари, Де Вит Келли (BE) Медведев В.Н. (RU)(71)(73) Заявитель и патентовладелец: ЯНССЕН ФАРМАЦЕВТИКА НВ (BE) Область изобретения Настоящее изобретение относится к новым противогрибковым 5,6-дигидро-4H-пирроло-[1,2a][1,4]бензодиазепинам и 6H-пирроло[1,2-a][1,4]бензодиазепинам, замещенным бициклическими производными бензола, активным, в основном, против дерматофитов и системных грибковых инфекций. Изобретение дополнительно относится к способам получения таких новых соединений, фармацевтическим композициям, содержащим указанные соединения в качестве активного ингредиента, а также применению указанных соединений в качестве лекарственного средства. Предпосылки создания изобретения Дерматофит является общепринятым названием группы из 3 типов грибков, которые обычно вызывают кожное заболевание у животных и людей. Эти анаморфные (асексуальные или несовершенные грибки) принадлежат к родам: Microsporum, Epidermophyton и Trichophyton. В этих 3 родах насчитывают приблизительно 40 видов. Дерматофиты вызывают инфекции кожи, волос и ногтей вследствие их способности получать питательные компоненты из кератинизированного материала. Организмы колонизируют кератиновые ткани,и воспаление вызывается ответом хозяина на метаболические побочные продукты. Они обычно ограничены ороговевшим слоем эпидермиса вследствие их неспособности проникать в жизнеспособную ткань иммунокомпетентного хозяина. Однако, иногда организмы инвазируют подкожные ткани, что приводит к развитию кериона. Инвазия вызывает ответ хозяина в диапазоне от слабого до тяжелого. Кислотные протеазы, эластаза, кератиназы, и другие протеазы, как сообщается, действуют, как факторы вирулентности. Системные грибковые инфекции (СГИ) представляют собой угрожающие для жизни состояния, которые наиболее часто поражают пациентов со сниженным иммунитетом, часто являющимся результатом терапевтических интервенций для лечения злокачественных заболеваний. Число СГИ в современных больницах продолжает расти, и число различных грибков, которые вовлечены в СГИ, является большим и все растущим. Несмотря на многие случаи инвазивного кандидоза и аспергиллеза, существует увеличенная заболеваемость от инфекций вследствие других плесневых грибков, таких как Scedosporium apiospermum, Fusarium spp. и Zygomycetes, Rhizopus и Mucor spp. Эффективные терапевтические средства,лечащие все эти инфекции, очень сильно, следовательно, нуждаются в очень широком спектре активности. За последние несколько десятилетий итраконазол, флуконазол, кетоконазол и внутривенный или липосомальный амфотерицин В применялись для лечения СГИ, и все эти средства имеют свои ограничения относительно спектра, безопасности или простоты введения. Более недавно, третье поколение азолов было исследовано и поступило на рынок, улучшая лечебные возможные в блоках интенсивной терапии. Вориконазол (Vfend) и посаконазол (Noxafil) показывают значительное улучшение при лечении против угрожающих жизни инвазивных СГИ, таких как кандидоз, аспергиллез, и инфекции вследствие действия видов Fusarium при клинически уместных дозировках. Кроме того, посаконазол проявляет эффективность действия против инфекций, вызываемых появляющимися Zygomycetes spp. Echinocandins, такой как анидулафунгин, каспофунгин и микафунгин,которые являются неконкурентными ингибиторами синтеза 1,3 глюкана в клеточных стенках грибков,проявляют высокую эффективность действия против Candida spp. и Aspergillus spp., но не имеют активности против Cryptococcus, Fusarium, или Zygomycetes spp. Из всех антимикотических средств, азолы еще представляют уникальный класс соединений, проявляющий широчайший противогрибковый спектр действия через ингибирование 1,4 деметилазы, фермента, являющегося существенным для биосинтеза эргостерина у грибков. Онихомикоз является наиболее общим заболеванием ногтей и составляет примерно половину от всех ногтевых патологий. Распространенность онихомикоза составляет приблизительно 6-8% у взрослого населения. Патогены-возбудители онихомикоза включают дерматофиты, Candida, и недерматофитные плесневые грибы. Дерматофиты являются грибками, наиболее часто ответственными за онихомикоз в западных странах с умеренным климатом; в то время, как Candida и недерматофитные плесневые грибы более часто встречаются в тропиках и субтропиках. Trichophyton rubrum является дерматофитом, наиболее часто вовлеченным в онихомикоз. Другие дерматофиты, которые могут быть вовлечены, представляют собой Trichophyton interdigitale, Epidermophyton floccosum, Trichophyton violaceum, Microsporumgypseum, Trichophyton tonsurans, Trichophyton soudanense и Trichophyton verrucosum. Другие патогенывозбудители инфекции включают Candida и недерматофитных плесневых грибов, в частности представителей плесневой генерации Scytalidium (также Neoscytalidium), Scopulariopsis и Aspergillus. 5,6-Дигидро-4 Н-пирроло[1,2-а][1,4]бензодиазепины были описаны в J. Chem. Soc. (С), 2732-2734(1971); J. Heterocyclic Chem., 13, 711-716 (1976); и J. Heterocyclic Chem., 16, 241-244 (1979). Все соединения, раскрытые в этих ссылках, имеют различное замещение на фенильном остатке в 4-положении, и,кроме того, ни в одной из этих ссылок не сообщалось о биологических активностях. Новый путь синтеза к арил(гетероарил)аннелированным пирроло[1,2-а][1,4]диазепинам был описан в Org. Biomol. Chem., 8, 3316-3327 (2010). Соединения 4-(1,3-бензодиоксол-5-ил)-5,6-дигидро-4 Н-пирроло[1,2-а][1,4]бензодиазепина (регист-1 022407 рационный номер CAS [845288-06-4]) и 4-(1,3-бензодиоксол-5-ил)-5,6-дигидро-4 Н-пирроло[1,2-а][1,4]бензодиазепинаHCl (регистрационный номер CAS [1215546-57-8]) являются доступными для приобретения,но никакого применения неизвестно для этих соединений.WO 02/34752 описывает 4-замещенные 5,6-дигидро-4 Н-пирроло[1,2-a][1,4]бензодиазепины как новый класс противогрибковых соединений. Однако WO 02/34752 не раскрывает настоящую картину замещения на фенильном остатке в 4-положении. Кандидатская диссертация De Wit К. описывает реализацию платформы микологической оценки invitro и in vivo и профилирование активности противогрибковых пирролобензодиазепинов (PhD Thesis;Biomedical Sciences; 2011; 220 p.). Противогрибковые соединения настоящего изобретения или часть соединений настоящего изобретения являются структурно различными и могут иметь улучшенную активность действия, улучшенные свойства метаболической стабильности, улучшенную растворимость, улучшенное связывание в плазме,сниженное ингибирование канала hERG, сниженные потенциалы цитохрома Р 450 или улучшенную биодоступность по сравнению с соединениями, раскрытыми в предшествующем уровне техники. Предпочтительно указанные соединения имеют широкий спектр противогрибкового действия, и поддерживают достаточно высокую терапевтическую эффективность действия и достаточно низкую токсичность или другие побочные эффекты. Соответственно, целью настоящего изобретения является предоставить новые соединения с противогрибковой активностью, для преодоления или уменьшения степени, по меньшей мере, одного из недостатков предшествующего, или предоставить применимые альтернативные соединения. Краткое изложение сущности изобретения Было обнаружено, что соединения настоящего изобретения являются применимыми в качестве противогрибковых соединений. Настоящее изобретение касается новых соединений формулы (I)R2 представляет собой водород или галоген;R5 представляет собой водород или С 1-4 алкилокси;R6 и R7, взятые вместе, образуют бивалентный радикал -R6- R7-, имеющий формулу-(CH2)m-Y1-(CH2)n-m- (a), -Y2a-(CH2)t-Y2b- (d), или -(CH2)n-m-Y1-(CH2)m- (b), -(CH2)r-Y2a-CH2-Y2b(CH2)q- (е); -(CH2)s- (с),где бивалентный радикал -R6-R7- может, где возможно, быть замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена, С 1-4 алкила, гидроксила, C1-4 алкилокси и оксо;Y2a и Y2b каждый независимо представляют О, NR8b или S;R8a представляет водород или С 1-4 алкил;R8b представляет водород или С 1-4 алкил;q представляет 0 или 1; при условии, что по меньшей мере один из r и q равен 1; и его фармацевтически приемлемые аддитивные соли и сольваты; при условии, что соединение не представляет собой 4-(1,3-бензодиоксол-5-ил)-5,6-дигидро-4 Нпирроло[1,2-а][1,4]бензодиазепин или 4-(1,3-бензодиоксол-5-ил)-5,6-дигидро-4 Н-пирроло[1,2-a][1,4]бензодиазепин.HCl. Настоящее изобретение также касается способов получения соединений формулы (I) и фармацевтических композиций, содержащих их. Настоящие соединения являются полезными средствами для борьбы с грибками in vivo. Новые соединения, описанные в настоящем изобретении, могут быть применимыми при лечении или профилактике инфекций, вызываемых дерматофитами, системных грибковых инфекций и онихоми-2 022407 коза. Новые соединения, описанные в настоящем изобретении, могут быть активными против широкого разнообразия грибков, таких как Candida spp., например, Candida albicans, Candida glabrata, CandidaRhizopus spp., например, Rhizopus oryzae, Rhizopus microspores; Malassezia furfur; Acremonium spp.; Paecilomyces; Scopulariopsis; Arthrographis spp.; Scytalidium; Scedosporium spp., например, Scedosporium apiospermum, Scedosporium prolificans; Trichoderma spp.; Penicillium spp.; Penicillium marneffei; Blastoschizomyces. Принимая во внимание упомянутую выше фармакологию настоящих соединений, следует, что они являются подходящими для применения в качестве лекарственного средства. Изобретение также относится к соединению в соответствии с общей формулой (I), его стереоизомерным формам и фармацевтически приемлемым аддитивным солям и его сольватам для применения при лечении или профилактике грибковых инфекций. Одно преимущество соединений или части соединений настоящего изобретения может состоять в их увеличенной биодоступности, улучшенных свойствах метаболической стабильности, улучшенных ФК свойствах, сниженном ингибировании канала hERG или сниженных потенциалах цитохрома Р 450 по сравнению с соединениями, раскрытыми в предшествующем уровне техники. Настоящее изобретение теперь будет дополнительно описано. В последующих параграфах, различные аспекты изобретения определены более подробно. Каждый аспект, определенный таким образом может быть скомбинирован с любым другим аспектом или аспектами, если ясно не указано на противоположное. В частности, любой признак, указанный как предпочтительный или преимущественный может комбинироваться с любым другим признаком или признаками, указанные как предпочтительные или преимущественные. Подробное описание изобретения При описании соединений изобретения используемые термины следует рассматривать в соответствии со следующими определениями, если контекст не диктует иным образом. Во всех случаях, когда термин "замещенный" используют в настоящем изобретении, это означает,если не указано иным образом или очевидно из контекста, что он указывает на то, что один или несколько водородов, в особенности, от 1 до 4 водородов, предпочтительно от 1 до 3 водородов, более предпочтительно 1 водород, на атоме или радикале, указанном в выражении с использованием термина "замещенный" заменены на выбор из указанной группы, при условии, что нормальная валентность не превышена, и то, что замещение приводит в результате к химически стабильному соединению, т.е. соединению, которое является достаточно прочным, чтобы перенести выделение до применимой степени чистоты из реакционной смеси и составление в терапевтическое средство. Во всех случаях, когда бивалентный радикал -R6-R7- замещен одним или несколькими заместителями, эти заместители могут заменять любой атом водорода, связанный с атомом углерода. Термин "гало" или "галоген" как группа или часть группы является общим для фтора, хлора, брома,йода, если не указано иным образом или является очевидным из контекста. Термин "С 1-4 алкил" как группа или часть группы относится к углеводородному радикалу формулыCnH2n+1, где n является номером в интервале от 1 до 4. С 1-4 алкильные группы содержат от 1 до 4 атомов углерода, предпочтительно от 1 до 3 атомов углерода, еще более предпочтительно от 1 до 2 атомов углерода. Алкильные группы могут быть линейными или разветвленными и могут быть замещены, как указано здесь. Когда нижний индекс применяют здесь после атома углерода, нижний индекс относится к числу углеродных атомов, которое названная группа может содержать. Таким образом, например, С 1-4 алкил включает все линейные или разветвленные алкильные группы с 1-4 атомами углерода, и, таким образом, включает такие группы как, например, метил, этил, н- пропил, изопропил, 2-метилэтил, бутил и его изомеры (например, н-бутил, изобутил и трет-бутил) и т.п. Термин "С 1-4 алкилокси" как группа или часть группы относится к радикалу, имеющему формулу-ORa, где Ra представляет собой С 1-4 алкил. Неограничивающие примеры подходящих C1-4 алкилокси включают метилокси (также метокси), этилокси (также этокси), пропилокси, изопропилокси, бутилокси,изобутилокси, втор-бутилокси и трет-бутилокси. Химические названия соединений настоящего изобретения были созданы в соответствии с правилами номенклатуры согласованных Chemical Abstracts Service, с использованием программного обеспечения номенклатуры от Advanced Chemical Development, Inc., (ACD/Название продукта версия 10.01;Build 15494, 1 Дек. 2006). В случае таутомерных форм должно быть ясно, что другая неизображенная таутомерная форма Следует учитывать, что некоторые соединения формулы (I) и их фармацевтически приемлемые аддитивные соли и сольваты могут содержать один или несколько центров хиральности и существовать в виде стереоизомерных форм. Как применяют в описании, во всех случаях, когда используют термин "соединение(соединения) формулы (I)", это означает, что он включает их стереоизомерные формы, и их фармацевтические приемлемые аддитивные соли и сольваты. Термины "стереоизомерные", "стереоизомерные формы" или "стереохимически изомерные формы" выше по тексту или далее по тексту в данном документе используют взаимозаменяемо. Термин "стереоизомерные формы", как используют здесь выше по тексту, определяет все возможные изомерные формы, которыми соединения формулы (I) могут обладать. Если не приведено или указано иным образом, химическое название соединений обозначает смесь всех возможных стереохимически изомерных форм. Определение "соединение формулы (I)" по сути включает все стереоизомеры соединения формулы(I) либо в виде чистого стереоизомера или в виде смеси двух или более стереоизомеров. Энантиомеры представляют собой стереоизомеры, которые являются ненакладываемыми зеркальными отображениями друг друга. 1:1 смесь пары энантиомеров представляет собой рацемат или рацемическую смесь. Диастереомеры (или диастереоизомеры) представляют собой стереоизомеры, которые не являются энантиомерами, т.е. они не относятся друг к другу как зеркальные отображения. Более конкретно, стереогенные центры могут иметь R- или S-конфигурацию; заместители на бивалентных циклических (частично) насыщенных радикалах могут иметь либо цис- или транс-конфигурацию. Соединения, заключающие двойные связи, могут иметь E- или Z-стереохимию по указанной двойной связи. Стереоизомерные формы соединений формулы (I) охватываются объемом притязаний этого изобретения. Следовательно, изобретение включает энантиомеры, диастереомеры, рацематы, E изомеры, Z изомеры, цис-изомеры, транс изомеры и их смеси, всякий раз, когда это химически возможно. Абсолютную конфигурацию устанавливают в соответствии с системой Кана-Ингольда-Прелога. Конфигурацию по асимметрическому атому устанавливают как либо R или S. Разделенные соединения,чья абсолютная конфигурация неизвестна, могут быть обозначены посредством ( + ) или (-) в зависимости от направления, в котором они вращают плоскополяризованный свет. Когда указана конкретная стереоизомерная форма, это означает, что указанная форма является, по существу, не содержащей, т.е. ассоциированной с менее чем 50%, предпочтительно менее чем 20%, более предпочтительно менее чем 10%, даже более предпочтительно менее чем 5%, дополнительно предпочтительно менее чем 2% и наиболее предпочтительно менее чем 1% других изомеров(изомера). Таким образом, когда соединение настоящего изобретения обозначено, например, как (R), это означает, что соединение не содержит, по существу, (S) изомера; когда соединение настоящего изобретения, например,обозначено как Е, это означает, что соединение не содержит, по существу, Z изомера; когда соединение настоящего изобретения обозначено, например, как цис, это означает, что соединение не содержит, по существу, транс-изомера. Некоторые из соединений формулы (I) могут также существовать в их таутомерной форме. Подразумевают, что такие формы, несмотря на то, что они явным образом не указаны в приведенной выше формуле, включены в объем настоящего изобретения. Соединения формулы (I) изображены в настоящем описании в единственной таутомерной форме,различные таутомеры являются эквивалентными друг другу, и все возможные таутомерные формы включены в объем изобретения. Для терапевтического применения соли соединений формулы (I) являются солями, где противоион является фармацевтически приемлемым. Однако, соли кислот и оснований, которые являются фармацевтически неприемлемыми, могут также найти применение, например, при получении или очистке фармацевтически приемлемого соединения. Все соли, являются ли они фармацевтически приемлемыми или нет, включены в объем настоящего изобретения. Подразумевают, что фармацевтически приемлемые аддитивные соли кислоты и основания, как указаны здесь выше или здесь далее, включают терпапевтически активные нетоксичные формы кислотно- и основно-аддитивной соли, которые соединения формулы (I) способны образовывать. Фармацевтически приемлемые кислотно-аддитивные соли могут быть удобным образом получены посредством обработки основной формы такой соответствующей кислотой. Соответствующие кислоты включают, например,неорганические кислоты, такие как галогенводородные кислоты, например, хлористо-водородная или(т.е. этандиовая), малоновая, янтарная (т.е. бутандиовая кислота), малеиновая, фумаровая, яблочная,винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламиновая, салициловая, п-аминосалициловая, памоевая и т.п. кислоты. Напротив, указанные солевые формы могут быть преобразованы посредством обработки соответствующим основанием в свободную основную форму. Соединения формулы (I), содержащие кислотный протон, могут также быть преобразованы в их нетоксичные формы аддитивных солей металла или амина посредством обработки соответствующими органическими и неорганическими основаниями. Соответствующие основные солевые формы включают,например, соли аммония, соли щелочных и щелочно-земельных металлов, например, соли лития, натрия,калия, магния, кальция и т.п., соли с органическими основаниями, например, первичными, вторичными и третичными алифатическими и ароматическими аминами, такими как метиламин, этиламин, пропиламин, изопропиламин, четыре изомера бутиламина, диметиламин, диэтиламин, диэтаноламин, дипропиламин, диизопропиламин, ди-н-бутиламин, пирролидин, пиперидин, морфолин, триметиламин, триэтиламин, трипропиламин, хинуклидин, пиридин, хинолин и изохинолин; соли бензамина, N-метил-Dглюкамина, гидрабамина, и соли с аминокислотами, такими как, например аргинин, лизин и т.п. Напротив, солевая форма может быть преобразована посредством обработки кислотой в свободную кислотную форму. Термин сольват включает гидраты и формы присоединения растворителя, которые соединения формулы (I) способны образовывать, а также их соли. Примерами таких форм являются, например, гидраты, алкоголяты и т.п. Соединения формулы (I), как полученные в способах, описанных ниже, могут быть синтезированы в виде смесей энантиомеров, конкретно, рацемических смесей энантиомеров, которые могут быть отделены друг от друга, следуя известным в области методикам разделения. Метод разделения энантиомерных форм соединений формулы (I) включает жидкостную хроматографию с использованием хиральной неподвижной фазы. Указанные чистые стереохимически изомерные формы могут также быть извлечены из соответствующих чистых стереохимически изомерных форм соответствующих исходных веществ,при условии, что реакция происходит стереоспецифически. Предпочтительно, если желательным является конкретный стереоизомер, чтобы указанное соединение было бы синтезировано посредством стереоспецифических способов получения. В этих способах преимущественно будут использоваться энантиомерно чистые исходные вещества. Подразумевают, что в рамках данной заявки соединение в соответствии с изобретением заведомо включает все изотопные комбинации его химических элементов. В рамках данной заявки химический элемент, в особенности, когда указан в отношении соединения в соответствии с формулой (I), включает все изотопы и изотопные смеси данного элемента. Например, когда указан водород, следует понимать,что это относится к 1H, 2H, 3H и их смесям. Соединение в соответствии с изобретением, следовательно, заведомо включает соединение с одним или более изотопами одного или более элемента, и их смеси, включая радиоактивное соединение, также называемое как соединение, меченное радиоактивным изотопом, где один или более нерадиоактивных атомов были заменены на на один из их радиоактивных изотопов. Термин "соединение, меченное радиоактивным изотопом" означает любое соединение в соответствии с формулой (I), или его фармацевтически приемлемую соль, которое содержит по меньшей мере один радиоактивный атом. Например, соединение может быть мечено позитрон- или гамма-излучающими радиоактивными изотопами. Для методов связывания с радиолигандом, 3 Н-атом или 125I-атом является атомом выбора для замены. Для визуализации, наиболее часто применяемыми позитрон-излучающими (ПЭТ) радиоактивными изотопами являются 11C, 18F, 15O и 11N, все из которых получают в ускорителе и имеют периоды полураспада, равные 20,100, 2 и 10 мин соответственно. Поскольку периоды полураспада этих радиоактивных изотопов являются такими короткими, целесообразно применять их только в учреждениях, которые имеют ускоритель на сайте для их получения, что, таким образом, ограничивает их применение. Наиболее широко используемыми из них являются 18F, 99mTc, 201T1 и 123I. Манипуляции с этими радиоактивными изотопами, их получение, выделение и введение в молекулу являются известными квалифицированному специалисту. В частности, радиоактивный атом выбирают из группы водорода, углерода, азота, серы, кислорода и галогена. Конкретно, радиоактивный изотоп выбирают из группы из 3H, 11C, 18F, 122I, 123I, 125I, 131I, 75Br,76Br, 77Br и 82Br. Как применяют в описании и прилагаемой формуле изобретения, формы единственного числа также включают ссылки на множественное число, если контекст ясным образом не диктует иначе. Например, "соединение" означает одно соединение или более, чем одно соединение. Термины, описанные выше, и другие термины, используемые в описании, являются хорошо понятными специалистам в области. Теперь излагают предпочтительные признаки соединений данного изобретения. Настоящее изобретение имеет отношение к новым соединениям формулы (I)R2 представляет собой водород или галоген;R5 представляет собой водород или C1-4 алкилокси;R6 и R7, взятые вместе, образуют бивалентный радикал -R6-R7-, имеющий формулу-(CH2)m-Y1-(CH2)n-m- (a), -Y2a-(CH2)t-Y2b- (d), или -(CH2)n-m-Y1-(CH2)m- (b), -(CH2)r-Y2a-CH2-Y2b(CH2)q- (е); -(CH2)s- (с),где бивалентный радикал -R6-R7- может, где возможно, быть замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена, С 1-4 алкила, гидроксила, C1-4 алкилокси и оксо;Y2a и Y2b каждый независимо представляют О, NR8b или S;R8a представляет водород или С 1-4 алкил;R8b представляет водород или С 1-4 алкил;q представляет 0 или 1; при условии, что по меньшей мере один из r и q является I; и его фармацевтически приемлемые аддитивные соли и сольваты; при условии, что соединение не представляет собой 4-(1,3-бензодиоксол-5-ил)-5,6-дигидро-4 Нпирроло[1,2-а][1,4]бензодиазепин или 4-(1,3-бензодиоксол-5-ил)-5,6-дигидро-4 Н-пирроло[1,2-а][1,4]бензодиазепин.HCl. В варианте осуществления, изобретение относится к соединениям формулы (I) и их стереоизомерным формам, гдеR2 представляет собой водород или галоген;R5 представляет собой водород или С 1-4 алкилокси;R6 и R7, взятые вместе, образуют бивалентный радикал -R6-R7-, имеющий формулу-(CH2)s- (с),где бивалентный радикал -R6-R7- может, где возможно, быть замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена, С 1-4 алкила, гидроксила, C1-4 алкилокси и оксо;Y2a и Y2b каждый независимо представляют О, NR8b или S;R8a представляет водород или С 1-4 алкил;R8b представляет водород или С 1-4 алкил;r представляет 0 или 1; q представляет 0 или 1; при условии, что по меньшей мере один из r и q является I; и их фармацевтически приемлемым аддитивным солям и сольватам. В варианте осуществления, изобретение относится к соединениям формулы (I) и их стереоизомерным формам, гдеR2 представляет собой водород или галоген;R5 представляет собой водород или С 1-4 алкилокси;R6 и R7, взятые вместе, образуют бивалентный радикал -R6-R7- , имеющий формулу-(CH2)m-Y1-(CH2)n-m- (a), -Y2a-(CH2)t-Y2b- (d) , или -(CH2)n-m-Y1-(CH2)m- (b), -(CH2)r-Y2a-CH2-Y2b(CH2)q- (е); -(CH2)s- (с),где бивалентный радикал -R6-R7-, имеющий формулу (а), (b), (c) или (е), может, где возможно, быть замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена, С 1-4 алкила, гидроксила, С 1-4 алкилокси и оксо; и где бивалентный радикал -R6-R7-, имеющий формулу (d), замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена, С 1-4 алкила, гидроксила, C1-4 алкилокси и оксо;Y2a и Y2b каждый независимо представляют О, NR8b или S;R8a представляет водород или С 1-4 алкил;R8b представляет водород или С 1-4 алкил;q представляет 0 или 1; при условии, что по меньшей мере один из r и q является 1; и их фармацевтически приемлемым аддитивным солям и сольватам. В варианте осуществления изобретение относится к соединениям формулы (I) и их стереоизомерным формам, гдеR2 представляет собой водород или галоген;R5 представляет собой водород или С 1-4 алкилокси;R6 и R7, взятые вместе, образуют бивалентный радикал -R6-R7- , имеющий формулу-(CH2)m-Y1-(CH2)n-m- (a), -(CH2)s- (с), или -(CH2)n-m-Y1-(CH2)m- (b), -Y2a-(CH2)t-Y2b- (d) где бивалентный радикал -R6-R7- может, где возможно, быть замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена, C1-4 алкила и оксо;Y2a и Y2b каждый независимо представляют О или NR8b;R8a представляет водород или C1-4 алкил; конкретно, R8a представляет водород;R8b представляет водород или C1-4 алкил; конкретно, R8b представляет водород;t представляет 1; и их фармацевтически приемлемым аддитивным солям и сольватам; при условии, что соединение не представляет собой 4-(1,3-бензодиоксол-5-ил)-5,6-дигидро-4 Нпирроло[1,2-а][1,4]бензодиазепин или 4-(1,3-бензодиоксол-5-ил)-5,6-дигидро-4 Н-пирроло[1,2-а][1,4]бензодиазепинHCl. В варианте осуществления, изобретение относится к соединениям формулы (I) и их стереоизомерным формам, гдеR2 представляет собой водород или галоген;R5 представляет собой водород или С 1-4 алкилокси;R6 и R7, взятые вместе, образуют бивалентный радикал -R6-R7-, имеющий формулу-(CH2)m-Y1-(CH2)n-m- (a), -(CH2)s- (с), или -(CH2)n-m-Y1-(CH2)m- (b), -Y2a-(CH2)t-Y2b- (d); где бивалентный радикал -R6-R7-, имеющий формулу (а), (b) или (с) может, где возможно, быть замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена, C1-4 алкила и оксо; где бивалентный радикал -R6-R7-, имеющий формулу (d), замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена, С 1-4 алкила и оксо;Y2a и Y2b каждый независимо представляют О или NR8b;R8a представляет водород или С 1-4 алкил; конкретно R8a представляет водород;R8b представляет водород или С 1-4 алкил; конкретно R8b представляет водород;t представляет 1; и их фармацевтически приемлемым аддитивным солям и сольватам. В варианте осуществления, изобретение относится к соединениям формулы (I) и их стереоизомерным формам, гдеR2 представляет собой водород или галоген;R5 представляет собой водород или С 1-4 алкилокси;R6 и R7, взятые вместе, образуют бивалентный радикал -R6-R7-, имеющий формулу(CH2)s- (с),где бивалентный радикал -R6-R7-, имеющий формулу (а), (b), (c) или (e), может, где возможно, быть замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена, С 1-4 алкила, гидроксила, С 1-4 алкилокси и оксо; и, где бивалентный радикал -R6-R7-, имеющий формулу (d), замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена, С 1-4 алкила, гидроксила, C1-4 алкилокси и оксо;Y2a и Y2b каждый независимо представляют О, NR8b или S;R8a представляет водород или С 1-4 алкил;R8b представляет водород или С 1-4 алкил;q представляет 0 или 1; при условии, что по меньшей мере один из r и q является 1; и их фармацевтически приемлемым аддитивным солям и сольватам. В варианте осуществления, изобретение относится к соединениям формулы (I) и их стереоизомерным формам, гдеR2 представляет собой водород или галоген; конкретно водород, хлор или фтор;R5 представляет собой водород или С 1-4 алкилокси; конкретно водород, метокси или этокси;R6 и R7, взятые вместе, образуют бивалентный радикал -R6-R7-, имеющий формулу-Y2a-(CH2)t-Y2b- (d); где бивалентный радикал -R6-R7- может, где возможно, быть замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена, C1-4 алкила и оксо; конкретно фтора, метила и оксо;t представляет 1; и их фармацевтически приемлемым аддитивным солям и сольватам; при условии, что соединение не представляет собой 4-(1,3-бензодиоксол-5-ил)-5,6-дигидро-4 Нпирроло[1,2-а][1,4]бензодиазепин или 4-(1,3-бензодиоксол-5-ил)-5,6-дигидро-4 Н-пирроло[1,2-а][1,4]бензодиазепин.HCl. В варианте осуществления изобретение относится к соединениям формулы (I) и их стереоизомерным формам, где R1 представляет собой водород, галоген или С 1-4 алкилокси; конкретно водород, хлор,фтор или метокси;R2 представляет собой водород или галоген; конкретно водород, хлор или фтор;R5 представляет собой водород или С 1-4 алкилокси; конкретно водород, метокси или этокси;R6 и R7, взятые вместе, образуют бивалентный радикал -R6- R7-, имеющий формулу-Y2a-(CH2)t-Y2b- (d) ; где бивалентный радикал -R6-R7-, имеющий формулу (а) или (с), может, где возможно, быть замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена, C1-4 алкила и оксо; конкретно, фтора, метила и оксо; где бивалентный радикал -R6-R7-, имеющий формулу (d), замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена, С 1-4 алкила и оксо; конкретно галогеном; более конкретно фтором;t представляет 1; и их фармацевтически приемлемым аддитивным солям и сольватам. В варианте осуществления изобретение относится к соединениям формулы (I) и их стереоизомерным формам, гдеR6 и R7, взятые вместе, образуют бивалентный радикал -R6-R7-, имеющий формулу-(CH2)m-O-(CH2)n-m-,-(CH2)s-, или -O-CH2-O-,где бивалентный радикал -R6-R7- может, где возможно, быть замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена и оксо; конкретно галогена;s представляет 3 или 4; и их фармацевтически приемлемым аддитивным солям и сольватам. В варианте осуществления изобретение относится к соединениям формулы (I) и его стереоизомерным формам, гдеR6 и R7, взятые вместе, образуют бивалентный радикал -R6-R7-, имеющий формулу-(CH2)m-O-(CH2)n-m-,-(CH2)s-, или -O-CH2-O-,где бивалентный радикал -(CH2)m-O-(CH2)n-m- или -(CH2)s- может, где возможно, быть замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена и оксо; конкретно галогена; где бивалентный радикал -O-CH2-O- замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена и оксо; конкретно, галогена; более конкретно фтора;s представляет 3 или 4; и их фармацевтически приемлемым аддитивным солям и сольватам. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или любой их подгруппе, как указано в любом из других вариантов осуществления, где бивалентный радикал-R6-R7-, когда он имеет формулу (d), всегда является замещенным одним или несколькими заместителя-9 022407 ми, выбранными из группы, состоящей из галогена, C1-4 алкила и оксо; конкретно галогеном; более конкретно фтором. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или любой их подгруппе, как указано в любом из других вариантов осуществления, где R3 и R4 представляют собой водород. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или любой их подгруппе, как указано в любом из других вариантов осуществления, где R3 и R4, взятые вместе, образуют связь. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или любой их подгруппе, как указано в любом из других вариантов осуществления, где R5 представляет собой водород. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или любой их подгруппе, как указано в любом из других вариантов осуществления, где R1 представляет собой галоген. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или любой их подгруппе, как указано в любом из других вариантов осуществления, где R1 представляет собой галоген, С 1-4 алкил или С 1-4 алкилокси. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или любой их подгруппе, как указано в любом из других вариантов осуществления, где R2 представляет собой галоген. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или любой их подгруппе, как указано в любом из других вариантов осуществления, где R1 представляет собой галоген, a R3 и R4 взяты вместе с образованием связи. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или любой их подгруппе, как указано в любом из других вариантов осуществления, где R1 представляет собой галоген и находится в положении 7, a R3 и R4 взяты вместе с образованием связи. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или любой их подгруппе, как указано в любом из других вариантов осуществления, где R2 представляет собой водород. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или любой их подгруппе, как указано в любом из других вариантов осуществления, где R1 представляет собой галоген и R2 представляет собой водород. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или любой их подгруппе, как указано в любом из других вариантов осуществления, где R1 представляет собой галоген и находится в положении 9; конкретно где R1 представляет собой хлор или фтор и находится в положении 9; более конкретно, где R1 представляет собой хлор и находится в положении 9. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или любой их подгруппе, как указано в любом из других вариантов осуществления, где R1 представляет собой галоген и находится в положении 7; конкретно где R1 представляет собой хлор или фтор и находится в положении 7; более конкретно где R1 представляет собой хлор и находится в положении 7. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или любой их подгруппе, как указано в любом из других вариантов осуществления, где R1 представляет собой галоген и находится в положении 7, и R2 представляет собой водород; конкретно где R1 представляет собой хлор или фтор и находится в положении 7 и R2 представляет собой водород; более конкретно гдеR1 представляет собой хлор и находится в положении 7, и R2 представляет собой водород. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или любой их подгруппе, как указано в любом из других вариантов осуществления, где R1 представляет собой галоген и находится в положении 7, и R2 представляет собой водород или галоген и находится в положении 9; конкретно, где R1 представляет собой хлор или фтор и находится в положении 7, и R2 представляет собой водород, хлор или фтор и находится в положении 9; более конкретно, где R1 представляет собой хлор и находится в положении 7, и R2 представляет собой водород или хлор и находится в положении 9. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или любой их подгруппе, как указано в любом из других вариантов осуществления, где R1 представляет собой галоген и находится в положении 7, R2 представляет собой водород, a R3 и R4 взяты вместе с образованием связи. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или любой их подгруппе, как указано в любом из других вариантов осуществления, где R1 представляет собой хлор и находится в положении 7, R2 представляет собой водород, и R3 и R4 взяты вместе с образованием связи. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или любой их подгруппе, как указано в любом из других вариантов осуществления, где R6 и R7, взятые вме- 10022407 сте, образуют бивалентный радикал -R6-R7-, имеющий формулу (а), (b), (с) или (d), конкретно, имеющий формулу (а), (с) или (d), где указанный бивалентный радикал -R6-R7- может, где возможно, быть замещен в соответствии с любым из других вариантов осуществления. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или любой их подгруппе, как указано в любом из других вариантов осуществления, где R6 и R7, взятые вместе, образуют бивалентный радикал -R6-R7-, имеющий формулу (а), (b), (с) или (e), конкретно, имеющий формулу (а), (b) или (c), где указанный бивалентный радикал -R6-R7- может, где возможно, быть замещен в соответствии с любым из других вариантов осуществления. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или любой их подгруппе, как указано в любом из других вариантов осуществления, где R6 и R7, взятые вместе, образуют бивалентный радикал -R6-R7-, имеющий формулу (а) или (b), где указанный бивалентный радикал -R6-R7- может, где возможно, быть замещен в соответствии с любым из других вариантов осуществления. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или любой их подгруппе, как указано в любом из других вариантов осуществления, где R6 и R7, взятые вместе, образуют бивалентный радикал -R6-R7-, имеющий формулу (c), где указанный бивалентный радикал-R6-R7- может, где возможно, быть замещен в соответствии с любым из других вариантов осуществления. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или любой их подгруппе, как указано в любом из других вариантов осуществления, где R6 и R7, взятые вместе, образуют бивалентный радикал -R6-R7-, имеющий формулу (d) или (е), конкретно, имеющий формулу (d), где указанный бивалентный радикал -R6-R7- может, где возможно, быть замещен в соответствии с любым из других вариантов осуществления. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или любой их подгруппе, как указано в любом из других вариантов осуществления, где R6 и R7, взятые вместе, образуют бивалентный радикал -R6-R7-, имеющий формулу (d); где указанный бивалентный радикал-R6-R7- может, где возможно, быть замещен в соответствии с любым из других вариантов осуществления; где t представляет 1; и где Y2a и Y2b каждый независимо представляет О или NR8b, конкретно, где 2aY и Y2b представляют О. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или любой их подгруппе, как указано в любом из других вариантов осуществления, где R6 и R7, взятые вместе, образуют бивалентный радикал -R6-R7-, имеющий формулу-(CH2)m-Y1-(CH2)n-m-, -(CH2)n-m-Y1-(CH2)m-, -(CH2)s-, -O-CH2-O-, -O-CF2-O- или -O-C(=O)-N(CH3)-; где бивалентный радикал -(CH2)m-Y1-(CH2)n-m-, -(CH2)n-m-Y1-(CH2)m-, или -(CH2)s-, может, где возможно, быть замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена, С 1-4 алкила, гидроксила, С 1-4 алкилокси и оксо;R8a представляет водород или С 1-4 алкил;s представляет 3, 4 или 5. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или любой их подгруппе, как указано в любом из других вариантов осуществления, где R6 и R7, взятые вместе, образуют бивалентный радикал -R6-R7-, имеющий формулу-(CH2)m-Y1-(CH2)n-m-, -(CH2)n-m-Y1-(CH2)m-, -(CH2)s-, -O-CF2-O- или -O-C(=O)-N(CH3)-; где бивалентный радикал -(CH2)m-Y1-(CH2)n-m-, -(CH2)n-m-Y1-(CH2)m-, или -(CH2)s-, может, где возможно, быть замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена, С 1-4 алкила, гидроксила, С 1-4 алкилокси и оксо;R8a представляет водород или С 1-4 алкил;s представляет 3, 4 или 5. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или любой их подгруппе, как указано в любом из других вариантов осуществления, где R6 и R7, взятые вместе, образуют бивалентный радикал -R6-R7-, имеющий формулу -(CH2)m-O- (CH2)n-m-, -(CH2)s-, или -OCH2-O-; где бивалентный радикал -R6-R7- может, где возможно, быть замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена и оксо. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или любой их подгруппе, как указано в любом из других вариантов осуществления, где R6 и R7, взятые вме- 11022407 сте, образуют бивалентный радикал -R6-R7-, имеющий формулу: -(CH2)m-O- (CH2)n-m-, -(CH2)s-, или -OCH2-O-; где бивалентный радикал -(CH2)m-O- (CH2)n-m- или -(CH2)s- может, где возможно, быть замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена и оксо; и где бивалентный радикал -O-CH2-O- замещен одним или несколькими заместителями, выбранными из группы,состоящей из галогена и оксо. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или любой их подгруппе, как указано в любом из других вариантов осуществления, где m представляет 0, 1 или 2; n представляет 2 или 3; s представляет 3 или 4; t представляет 1; r представляет 0 или 1; q представляет 0 или 1; при условии, что в точности один из q и r представляет 0, а один другой представляет 1. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или любой их подгруппе, как указано в любом из других вариантов осуществления, где R6 и R7, взятые вместе, образуют бивалентный радикал -R6-R7-, имеющий формулу -(CH2)m-Y1-(CH2)n-m- (a), -Y2a-(CH2)t-Y2b(d) ; -(CH2)n-m-Y1-(CH2)m- (b), -(CH2)s- (с), где бивалентный радикал -R6-R7- может, где возможно, быть замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена, С 1-4 алкила, гидроксила, C1-4 алкилокси и оксо; где m представляет 0, 1 или 2; n представляет 2 или 3; s представляет 3 или 4; t представляет 1. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или любой их подгруппе, как указано в любом из других вариантов осуществления, где R6 и R7, взятые вместе, образуют бивалентный радикал -R6-R7-, имеющий формулу -(CH2)m-Y1-(CH2)n-m- (a), -Y2a-(CH2)t-Y2b(d) ; -(CH2)n-m-Y1-(CH2)m- (b), -(CH2)s- (с),где бивалентный радикал -R6-R7-, имеющий формулу (а), (b) или (с) может, где возможно, быть замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена, C1-4 алкила, гидроксила, С 1-4 алкилокси и оксо; где бивалентный радикал -R6-R7-, имеющий формулу (d), замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена, С 1-4 алкила, гидроксила, C1-4 алкилокси и оксо; где m представляет 0, 1 или 2; n представляет 2 или 3; s представляет 3 или 4; t представляет 1. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или любой их подгруппе, как указано в любом из других вариантов осуществления, где R6 и R7, взятые вместе, образуют бивалентный радикал -R6-R7-, где -R6-R7- выбирают из группы, состоящей из -O-CH2-O-,-(CH2)3-, -(CH2)4-, -(CH2)2-O-, -CH2-CH(CH3)-O-, -С(=O)-(CH2)2-, -С(=O)-(CH2)3-, -O-(CH2)2-, -O-(CH2)3-,-CH2-O-(CH2)2-, -(CH2) ,-С (=O)-, -O-CF2-(CH2)2-, -(CH2)2-С (=O)-, -CF2-(CH2)2-, -С(=O)-O-CH2-, -CH2-OC(=O)-, -O-CF2-O-, -O-C (=O)-N(CH3)-, -N(CH3)-(CH2)2- и -N(CH3)-С(=O)-С(CH3)2-, конкретно, где -R6-R7 выбирают из группы, состоящей из -(CH2)3-, -(CH2)4-, -(CH2)2-O-, -CH2-CH(CH3)-O-, -С(=O)-(CH2)2-,-С(=O)-(CH2)3-, -O-(CH2)2-, -O-(CH2)3-, -CH2-O-(CH2)2-, -(CH2)2-C(=O)-, -O-CF2-(CH2)2-, -(CH2)2-С(=O)-,-CF2-(CH2)2-, -С (=O)-O-CH2-, -CH2-O-C(=O)-, -O-CF2-O-, -O-С(=O)-N(CH3)-, -N(CH3)-(CH2)2- и -N(CH3)С(=O)-С(CH3)2-. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или любой их подгруппе, как указано в любом из других вариантов осуществления, где R6 и R7, взятые вместе, образуют бивалентный радикал -R6-R7-, где -R6-R7- выбирают из группы, состоящей из -O-CH2-O- и O-CF2-O-; конкретно, где -R6-R7- представляет собой -O-CF2-O-. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или любой их подгруппе, как указано в любом из других вариантов осуществления, где R6 и R7, взятые вместе, образуют бивалентный радикал -R6-R7-, имеющий формулу - O-CH2-O-, где -O-CH2-O- может быть замещен одним или двумя заместителями, выбранными из группы, состоящей из галогена, C1-4 алкила,гидроксила, С 1-4 алкилокси и оксо; конкретно галогена и С 1-4 алкила. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или любой их подгруппе, как указано в любом из других вариантов осуществления, где R6 и R7, взятые вместе, образуют бивалентный радикал -R6-R7-, имеющий формулу -O-CH2-O-, где -O-CH2-O- замещен одним или двумя заместителями, выбранными из группы, состоящей из галогена, С 1-4 алкила, гидроксила,С 1-4 алкилокси и оксо; конкретно галогена и C1-4 алкила; более конкретно галогена; даже более конкретно фтора. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или любой их подгруппе, как указано в любом из других вариантов осуществления, где R6 и R7, когда они представляют бивалентный радикал формулы (d), всегда являются замещенными заместителем, как определено в любом из других вариантов осуществления. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или любой их подгруппе, как указано в любом из других вариантов осуществления, где R8a и R8b представляют водород. Вариант осуществления настоящего изобретения относится к тем соединениям формулы (I) или любой их подгруппе, как указано в любом из других вариантов осуществления, где Y2a и Y2b представляют О. В следующем варианте осуществления соединение формулы (I) выбирают из группы, включающей 4-(1,3-бензодиоксол-5-ил)-5,6-дигидро-4 Н-пирроло[1,2-а][ 1,4]бензодиазепин.HBr,4-(1,3-бензодиоксол-5-ил)-7-хлор-5,6-дигидро-4 Н-пирроло[1,2-а][1,4]бензодиазепин,4-(1,3-бензодиоксол-5-ил)-7-хлор-5,6-дигидро-4 Н-пирроло[1,2-а][1,4]бензодиазепин.HBr,4-(1,3-бензодиоксол-5-ил)-8-хлор-5,6-дигидро-4 Н-пирроло[1,2-a][1,4]бензодиазепин.HBr,4-(1,3-бензодиоксол-5-ил)-8-хлор-5,6-дигидро-4 Н-пирроло[1,2-a][1,4]бензодиазепин,4-(1,3-бензодиоксол-5-ил)-9-хлор-5,6-дигидро-4 Н-пирроло[1,2-a][1,4]бензодиазепин.HBr,4-(1,3-бензодиоксол-5-ил)-9-хлор-5,6-дигидро-4 Н-пирроло[1,2-a][1,4]бензодиазепин,4-(1,3-бензодиоксол-5-ил)-10-хлор-5,6-дигидро-4 Н-пирроло[1,2-a][1,4]бензодиазепин.HBr,4-(1,3-бензодиоксол-5-ил)-10-хлор-5,6-дигидро-4 Н-пирроло[1,2-a][1,4]бензодиазепин,4- (1,3-бензодиоксол-5-ил)-5,6-дигидро-7-метокси-4 Н-пирроло[1,2-a][1,4]бензодиазепин.HBr,4-(1,3-бензодиоксол-5-ил)-5,6-дигидро-7-метокси-4 Н-пирроло[1,2-a][1,4]бензодиазепин,4-(1,3-бензодиоксол-5-ил)-6 Н-пирроло[1,2-а][1,4]бензодиазепин,4-(1,3-бензодиоксол-5-ил)-7-хлор-6 Н-пирроло[1,2-а][1,4]бензодиазепин,4-(1,3-бензодиоксол-5-ил)-8-хлор-6 Н-пирроло[1,2-а][1,4]бензодиазепин,7-хлор-4-(2,3-дигидро-1 Н-инден-5-ил)-5,6-дигидро-4 Н-пирроло[1,2-a][1,4]бензодиазепин.HCl,7-хлор-4-(2,3-дигидро-1 Н-инден-5-ил)-5,6-дигидро-4 Н-пирроло[1,2-a][1,4]бензодиазепин.HBr,7-хлор-4-(2,3-дигидро-1 Н-инден-5-ил)-5,6-дигидро-4 Н-пирроло[1,2-a][1,4]бензодиазепин,7-хлор-4-(6-этокси-2,3-дигидро-1 Н-инден-5-ил)-5,6-дигидро-4 Н-пирроло[1,2-a][1,4]бензодиазепин.HBr,7-хлор-4-(6-этокси-2,3-дигидро-1 Н-инден-5-ил)-5,6-дигидро-4 Н-пирроло[1,2-a][1,4]бензодиазепин,7-хлор-5,6-дигидро-4-(5,6,7,8-тетрагидро-3-метокси-2-нафталинил)-4 Н-пирроло-[1,2-a][1,4]бензодиазепин.HBr,7-хлор-5,6-дигидро-4-(5,6,7,8-тетрагидро-3-метокси-2-нафталинил)-4 Н-пирроло-[1,2-a][1,4]бензодиазепин,7,10-дихлор-4-(2,3-дигидро-1 Н-инден-5-ил)-5,6-дигидро-4 Н-пирроло[1,2-a][1,4]бензодиазепин.HCl,7,10-дихлор-4-(2,3-дигидро-1 Н-инден-5-ил)-5,6-дигидро-4 Н-пирроло[1,2-a][1,4] бензодиазепин,8,10-дихлор-4-(2,3-дигидро-1 Н-инден-5-ил)-5,6-дигидро-4 Н-пирроло[1,2-a][1,4]бензодиазепин.HCl,8,10-дихлор-4-(2,3-дигидро-1 Н-инден-5-ил)-5,6-дигидро-4 Н-пирроло[1,2-a][1,4]бензодиазепин,7,8-дихлор-4-(2,3-дигидро-1 Н-инден-5-ил)-5,6-дигидро-4 Н-пирроло[1,2-a][1,4]бензодиазепин.HCl,7,8-дихлор-4-(2,3-дигидро-1 Н-инден-5-ил)-5,6-дигидро-4 Н-пирроло[1,2-a][1,4]бензодиазепин,7,9-дихлор-4-(2,3-дигидро-1 Н-инден-5-ил)-5,6-дигидро-4 Н-пирроло[1,2-a][1,4]бензодиазепин.HCl,7,9-дихлор-4-(2,3-дигидро-1 Н-инден-5-ил)-5,6-дигидро-4 Н-пирроло[1,2-a][1,4]бензодиазепин,7-хлор-4-(2,3-дигидро-1 Н-инден-5-ил)-6 Н-пирроло[1,2-а][1,4]бензодиазепин,7-хлор-4-(5,6,7,8-тетрагидро-2-нафталинил)-6 Н-пирроло[1,2-а][1,4]бензодиазепин,7,8-дихлор-4-(2,3-дигидро-1 Н-инден-5-ил)-6 Н-пирроло[1,2-а][1,4]бензодиазепин,7,9-дихлор-4-(2,3-дигидро-1 Н-инден-5-ил)-6 Н-пирроло[1,2-а][1,4]бензодиазепин,7,10-дихлор-4-(2,3-дигидро-1 Н-инден-5-ил)-6 Н-пирроло[1,2-а][1,4]бензодиазепин,8,10-дихлор-4(2,3-дигидро-1 Н-инден-5-ил)-6H-пирроло[1,2-a][1,4]бензодиазепин,7-хлор-4-(2,3-дигидро-5-бензофуранил)-5,6-дигидро-4 Н-пирроло[1,2-a][1,4]бензодиазепин.HCl,7-хлор-4-(2,3-дигидро-5-бензофуранил)-5,6-дигидро-4 Н-пирроло[1,2-a][1,4]бензодиазепин,7-хлор-4-(2,3-дигидро-6-бензофуранил)-5,6-дигидро-4 Н-пирроло[1,2-a][1,4]бензодиазепин.HCl,7-хлор-4-(2,3-дигидро-6-бензофуранил)-5,6-дигидро-4 Н-пирроло[1,2-a][1,4]бензодиазепин,7-хлор-4-(3,4-дигидро-1 Н-2-бензопиран-6-ил)-5,6-дигидро-4 Н-пирроло[1,2-a][1,4]бензодиазепин.HCl,7-хлор-4-(3,4-дигидро-1 Н-2-бензопиран-6-ил)-5,6-дигидро-4 Н-пирроло[1,2-a][1,4]бензодиазепин,4-(3,4-дигидро-1 Н-2-бензопиран-6-ил)-7-фтор-5,6-дигидро-4 Н-пирроло[1,2-a][1,4]бензодиазепин.HCl,4-(3,4-дигидро-1 Н-2-бензопиран-6-ил)-7-фтор-5,6-дигидро-4 Н-пирроло[1,2-a][1,4]бензодиазепин,7,8-дихлор-4-(2,3-дигидро-5-бензофуранил)-5,6-дигидро-4 Н-пирроло[1,2-a][1,4]бензодиазепин.HCl,7,8-дихлор-4-(2,3-дигидро-5-бензофуранил)-5,6-дигидро-4 Н-пирроло[1,2-a][1,4]бензодиазепин,7,9-дихлор-4-(2,3-дигидро-5-бензофуранил)-5,6-дигидро-4 Н-пирроло[1,2-а][1,4]бензодиазепин.HCl,7,9-дихлор-4-(2,3-дигидро-5-бензофуранил)-5,6-дигидро-4 Н-пирроло[1,2-а][1,4]бензодиазепин,7,10-дихлор-4-(2,3-дигидро-5-бензофуранил)-5,6-дигидро-4 Н-пирроло[1,2-а][1,4]бензодиазепин.HCl,7,10-дихлор-4-(2,3-дигидро-5-бензофуранил)-5,6-дигидро-4 Н-пирроло[1,2-а][1,4]бензодиазепин,7,10-дихлор-4-(2,3-дигидро-6-бензофуранил)-5,6-дигидро-4 Н-пирроло[1,2-а][1,4]бензодиазепин.HCl,7,10-дихлор-4-(2,3-дигидро-6-бензофуранил)-5,6-дигидро-4 Н-пирроло[1,2-а][1,4]бензодиазепин,8,10-дихлор-4-(2,3-дигидро-5-бензофуранил)-5,6-дигидро-4 Н-пирроло[1,2-а][1,4]бензодиазепин.HCl,8,10-дихлор-4-(2,3-дигидро-5-бензофуранил)-5,6-дигидро-4 Н-пирроло[1,2-а][1,4]бензодиазепин,7-хлор-4-(2,3-дигидро-5-бензофуранил)-6 Н-пирроло[1,2-а][1,4]бензодиазепин,7-хлор-4-(2,3-дигидро-6-бензофуранил)-6 Н-пирроло[1,2-а][1,4]бензодиазепин,7-хлор-4-(3,4-дигидро-1 Н-2-бензопиран-6-ил)-6 Н-пирроло[1,2-а][1,4]бензодиазепин,7-хлор-4-(3,4-дигидро-2 Н-1-бензопиран-6-ил)-6 Н-пирроло[1,2-а][1,4]бензодиазепин,4-(3,4-дигидро-1 Н-2-бензопиран-6-ил)-7-фтор-6 Н-пирроло[1,2-а][1,4]бензодиазепин,- 13022407 9-хлор-4-(3,4-дигидро-1 Н-2-бензопиран-6-ил)-5,6-дигидро-4 Н-пирроло[1,2-a][1,4]бензодиазепин,10-хлор-4-(2,2-дифтор-3,4-дигидро-2 Н-1-бензопиран-6-ил)-5,6-дигидро-4 Н-пирроло[1,2-a][1,4]бензодиазепин,7-хлор-4-(1,1-дифтор-2,3-дигидро-1 Н-инден-5-ил)-9-фтор-6 Н-пирроло[1,2-a][1,4]бензодиазепин,5-(7-хлор-6 Н-пирроло[1,2-a][1,4]бензодиазепин-4-ил)-1,3-дигидро-1,3,3-триметил-2 Н-индол-2-он,включая их стереоизомерные формы,и их фармацевтически приемлемые аддитивные соли и сольваты. В следующем варианте осуществления соединение формулы (I) выбирают из группы, содержащей 7-хлор-4-(2,3-дигидро-1 Н-инден-5-ил)-5,6-дигидро-4 Н-пирроло[1,2-а][1,4]бензодиазепин,7-хлор-4-(2,3-дигидро-1 Н-инден-5-ил)-6 Н-пирроло[1,2-а][1,4]бензодиазепин,7-хлор-4-(5,6,7,8-тетрагидро-2-нафталинил)-6 Н-пирроло[1,2-а][1,4]бензодиазепин,7-хлор-4-(2,2-дифтор-1,3-бензодиоксол-5-ил)-6 Н-пирроло[1,2-а][1,4]бензодиазепин,4-(2,2-дифтор-1,3-бензодиоксол-5-ил)-7,9-дифтор-6 Н-пирроло[1,2-a][1,4]бензодиазепин,4-(2,2-дифтор-1,3-бензодиоксол-5-ил)-7-фтор-6 Н-пирроло[1,2-a][1,4]бензодиазепин,6-(7-фтор-6 Н-пирроло[1,2-a][1,4]бензодиазепин-4-ил)-3,4-дигидро-1(2 Н)-нафталинон,7-хлор-4-(2,2-дифтор-3,4-дигидро-2 Н-1-бензопиран-6-ил)-6 Н-пирроло[1,2-a][1,4]бензодиазепин,4-(3,4-дигидро-1 Н-2-бензопиран-6-ил)-7-фтор-6 Н-пирроло[1,2-a][1,4]бензодиазепин,7-хлор-4-(3,4-дигидро-1 Н-2-бензопиран-6-ил)-6 Н-пирроло[1,2-a] [1,4]бензодиазепин,9-хлор-4-(2,2-дифтор-1,3-бензодиоксол-5-ил)-6 Н-пирроло[1,2-a][1,4]бензодиазепин и 10-хлор-4-(3,4-дигидро-2 Н-1-бензопиран-6-ил)-6 Н-пирроло[1,2-a][1,4]бензодиазепин. В следующем варианте осуществления соединение формулы (I) выбирают из группы, содержащей 7-хлор-4-(2,3-дигидро-1 Н-инден-5-ил)-5,6-дигидро-4 Н-пирроло[1,2-a][1,4]бензодиазепин,7-хлор-4-(2,3-дигидро-1 Н-инден-5-ил)-5,6-дигидро-4 Н-пирроло[1,2-a][1,4]бензодиазепин.HCl,7-хлор-4-(2,3-дигидро-1 Н-инден-5-ил)-5,6-дигидро-4 Н-пирроло[1,2-a][1,4]бензодиазепин.HBr,7-хлор-4-(2,3-дигидро-1 Н-инден-5-ил)-6 Н-пирроло[1,2-а][1,4]бензодиазепин,7-хлор-4-(5,6,7,8-тетрагидро-2-нафталинил)-6 Н-пирроло[1,2-а][1,4]бензодиазепин,7-хлор-4-(2,2-дифтор-1,3-бензодиоксол-5-ил)-6 Н-пирроло[1,2-а][1,4]бензодиазепин,4-(2,2-дифтор-1,3-бензодиоксол-5-ил)-7,9-дифтор-6 Н-пирроло[1,2-а][1,4]бензодиазепин,4-(2,2-дифтор-1,3-бензодиоксол-5-ил)-7-фтор-6 Н-пирроло[1,2-а][1,4]бензодиазепин,6-(7-фтор-6 Н-пирроло[1,2-а][1,4]бензодиазепин-4-ил)-3,4-дигидро-1(2 Н)-нафталинон,7-хлор-4-(2,2-дифтор-3,4-дигидро-2 Н-1-бензопиран-6-ил)-6 Н-пирроло[1,2-а][1,4]бензодиазепин,4-(3,4-дигидро-1 Н-2-бензопиран-6-ил)-7-фтор-6 Н-пирроло[1,2-а][1,4]бензодиазепин,7-хлор-4-(3,4-дигидро-1 Н-2-бензопиран-6-ил)-6 Н-пирроло[1,2-а][1,4]бензодиазепин,9-хлор-4-(2,2-дифтор-1,3-бензодиоксол-5-ил)-6 Н-пирроло[1,2-а][1,4]бензодиазепин и 10-хлор-4-(3,4-дигидро-2 Н-1-бензопиран-6-ил)-6 Н-пирроло[1,2-а][1,4]бензодиазепин,включая их стереоизомерные формы, и их фармацевтически приемлемые аддитивные соли и сольваты. Все возможные комбинации вышеуказанных, представляющих интерес вариантов осуществления считают включенными в объем данного изобретения. Настоящее изобретение также охватывает способы получения соединений формулы (I) и их подгрупп. Соединения формулы (I) и их подгруппы могут быть получены посредством ряда стадий, как описано здесь ниже. Их обычно получают из исходных веществ, которые либо являются доступными для приобретения или получают стандартными способами, очевидными для специалистов в области. Соединения настоящего изобретения могут быть также получены с использованием стандартных способов синтеза, обычно применяемых специалистами в области органической химии. Соединения настоящего изобретения, могут быть получены в соответствии со схемой I. Соединения формулы (I), где R3 и R4 вместе образуют дополнительную связь, то указанные соединения, представленные формулой (I-b), могут быть получены из соединения, представленного формулой(I-а), с последующими известными в области реакциями окисления амина до имина. Эти реакции окисления могут быть проведены посредством взаимодействия соединения формулы (I-а) с окислителем, таким как, например, тетраацетат свинца или диоксид марганца, в реакционно-инертном растворителе, таком как галогенированный углеводород, например дихлорметан (ДХМ) или трихлорметан. Скорость реакции может быть увеличена посредством перемешивания и необязательно с нагревом реакционной смеси. Альтернативно, соединение формулы (I-b) может быть получено посредством внутримолекулярной циклизации промежуточного соединения формулы (II). В присутствии кислоты, такой как, например,POCl3, амид в промежуточном соединении формулы (II) может функционировать как С-электрофил,приводя к замыканию цикла. Реакция может осуществляться в подходящих растворителях, таких, например, ДХМ (CH2Cl2). Перемешивание и нагрев могут увеличить скорость реакции. Соединение формулы (I-а) может быть получено из промежуточного соединения формулы (IV) посредством преобразования его в соль (III) посредством реакции с кислотой H+X- формулы (XI), и взаимодействия указанной соли формулы (III) с альдегидом формулы (XII) в соответствующем растворителе,таком как спирт, например метанол (MeOH), этанол (EtOH), изопропанол, при повышенной температуре,предпочтительно при температуре кипения с обратным холодильником. Альтернативно, промежуточное соединение формулы (IV) может взаимодействовать сначала с альдегидом формулы (XII) и, таким образом образованный имин может быть циклизован в присутствии кислоты H+X- формулы (XI) в соединение формулы (I-а). Альтернативно, соединение формулы (I-а) может быть получено посредством восстановления соединения формулы (I-b) посредством способов, хорошо известных специалистам в данной области. Промежуточное соединение формулы (II) может быть получено посредством реакции сочетания между промежуточным соединением формулы (III) и (XIII). Указанная реакция может осуществляться в присутствии связывающих агентов, таких как обычно 1-гидрокси-1 Н-бензотриазол (HOBT) и N'(этилкарбонимидоил)-N,N-диметил-1,3-пропандимина моногидрохлорид (EDCI). Реакция может осуществляться в присутствии основания, такого как триэтиламин (Et3N) и в подходящем растворителе, таком как, например, ДХМ. Альтернативно, хлорангидридное производное (XIII) или реакционноспособное производное сложного эфира (XIII) могут также применяться в данном типе реакции для получения промежуточного соединения формулы (II). Промежуточное соединение формулы (XIII) или его хлорангидрид кислоты или сложноэфирное производное, могут быть легко получены специалистами в данной области. Промежуточные соединения формулы (III) и (IV) получают посредством восстановления 1-(2 цианофенил)пиррольного производного формулы (V). Некоторые методики, хорошо известные специалистам в данной области, могут применяться для восстановления нитрильной функции, такие как, например: 1. LiAlH4/ТГФ [S. Raines, S.Y. Chai and F.P. Palopoli; J. Heterocyclic Chem., 13, 711-716 (1976)] 2. i. бис(2-метоксиэтокси)алюминат натрия (Red-Al) 70% м/м Толуол, КТ: ii. NaOH 10%, KT[G.W.H. Cheeseman and S.G. Greenberg; J. Heterocyclic Chem., 16, 241-244(1979)] 3 а. i. KBH4/CF3COOH, ТГФ; ii. H2O; iii. HCl [P. Trinka, P. Siegel и J. Reiter; J. Prakt. Chem., 338, 675678(1996)] 3b. Боран-диметилсульфид (1:1), ТГФ 4a. RaNi (Никель Рэнея)/H2 4b. RaNi/раствор тиофена/(MeOH/NH3) Могут также применяться другие хорошо известные способы восстановления нитрильной функции. Промежуточное соединение формулы (V), в свою очередь, является доступным для приобретения или альтернативно может быть легко получено, например, обработки 2-аминобензонитрильного производного формулы (VI) тетрагидро-2,5-диметоксифураном в инертном растворителе, таком как диоксан или тетрагидрофуран (ТГФ) в присутствии кислоты, такой как гидрохлорид 4-хлорпиридина или в кислом растворителе, таком как ледяная уксусная кислота, при повышенной температуре, предпочтительно при температуре кипения с обратным холодильником. Альтернативно, промежуточное соединение формулы (V) может также быть получено из промежуточного соединения формулы (X). Обычно промежуточное соединение формулы (X), где галоген определен как Br, I, Cl или F, взаимодействует с пирролом в присутствии основания, такого как, например, Cs2CO3 или NaH, в подходящем растворителе, таком как обычно ДМФА. Альтернативно, промежуточное соединение формулы (IV) может быть получено посредством обработки промежуточного соединения формулы (VII) боран-диметилсульфидом (1:1) в подходящем растворителе таком как, например, ТГФ. Реакция обычным образом может осуществляться в присутствии кислоты, такой как HCl. После протекания реакции, реакционная смесь может быть подщелочена подходящим основанием, таким как NaOH. Реакция может осуществляться при повышенной температуре, предпочтительно при температуре кипения с обратным холодильником. Промежуточное соединение формулы (VII) может быть получено из промежуточного соединения формулы (VIII). Промежуточное соединение формулы (VIII) может взаимодействовать с источником азота, таким как NH3H2O в присутствии HOBT и EDCI. Этот тип реакции обычно может осуществляться в подходящем растворителе, подобном ДМФА. Перемешивание реакционной смеси может повышать скорость реакции. Промежуточное соединение формулы (VIII) может быть легко получено посредством обработки промежуточного соединения формулы (IX) тетрагидро-2,5-диметоксифураном в инертном растворителе, таком как диоксан в присутствии кислоты, такой как гидрохлорид пиридина (1:1) при повышенной температуре, предпочтительно при температуре кипения с обратным холодильником. Альтернативно, реакционноспособное производное сложного эфира (IX) может также применяться в данном типе реакции для получения промежуточного соединения формулы (VIII). Все другие промежуточные соединения и исходные вещества являются доступными для приобретения или могут быть легко получены специалистами в данной области. Синтез некоторых промежуточных соединений и некоторых исходных веществ продемонстрирован примерами в экспериментальной части. Специалист в данной области сможет понять, что для некоторых из указанных выше реакций необходимо использовать безводные условия и/или должна применяться инертная защищающая атмосфера,такая как, например, N2 или аргон. Во всех этих получениях, продукты реакции могут быть выделены из реакционной среды и, если необходимы, дополнительно очищаться в соответствии с методологией, общеизвестной в данной области такой как, например, экстракция, кристаллизация, растирание и хроматография. Конкретно, стереоизомеры могут быть выделены хроматографически с использованием хиральной неподвижной фазы, такой как, например, Chiralpak AD (амилоза-3,5-диметилфенилкарбамат) или Chiralpak AS, оба приобретают от Daicel Chemical Industries, Ltd., в Японии. Чистые стереоизомерные формы соединений и промежуточных соединений данного изобретения могут быть получены посредством применения известных в области методик. Энантиомеры могут быть отделены друг от друга посредством селективной кристаллизации их диастереомерных солей с оптически активными кислотами. Альтернативно, энантиомеры могут быть разделены посредством хроматографических методов с использованием хиральных неподвижных фаз. Указанные чистые стереоизомерные формы могут также быть производными из соответствующих чистых стереоизомерных форм соответствующих исходных веществ, при условии, что реакция происходит стереоселективно или стероспецифически. Предпочтительно, если желательным является конкретный стереоизомер, указанное соединение будет синтезировано посредством стереоселективных или стереоспецифических способов получения. В этих способах предпочтительно будутиспользоваться преимущественно хирально чистые исходные вещества. Стереоизомерные формы соединений формулы (I) очевидно предназначены для включения в объем изобретения. Хирально чистые формы соединений формулы (I) образуют предпочтительную группу соединений. Следовательно, хирально чистые формы промежуточных соединений и их солевые формы являются особенно применимыми при получении хирально чистых соединений формулы (I). Также энантиомерные смеси промежуточных соединениий являются применимыми при получении соединений формулы (I) с соответствующей конфигурацией. Соединения формулы (I) и их стереоизомерные формы, и их фармацевтически приемлемые аддитивные соли и сольваты могут быть активными против темных гифомицетов, диморфных патогенов,дерматофитов, зигомицетов, гиалиновых гифомицетов, дрожжей и дрожжеподобных организмов. Соединения формулы (I) и их стереоизомерные формы и их фармацевтически приемлемые аддитивные соли и сольваты могут быть активными против диморфных патогенов, дрожжей и дрожжеподобных организмов. Соединения формулы (I) и их стереоизомерные формы и их фармацевтически приемлемые аддитивные соли и сольваты могут быть активными против плесневых грибов. Соединения формулы (I) и их стереоизомерные формы и их фармацевтически приемлемые аддитивные соли и сольваты могут быть активными против широкого разнообразия грибков, таких какPaecilomyces; Scopulariopsis; Arthrographis spp.; Scytalidium; Scedosporium spp., например, Scedosporium apiospermum, Scedosporium proliflcans; Trichoderma spp.; Penicillium spp.; Penicillium marneffei; Blastoschizomyces. Соединения формулы (I) и их стереоизомерные формы и их фармацевтически приемлемые аддитивные соли и сольваты могут быть активными против широкого разнообразия грибков, таких как Candida parapsilosis; Aspergillus spp., например, Aspergillus fumigatus, Aspergillus niger, Aspergillus flavus;Cryptococcus neoformans; Sporothrix schenckii; Epidermophyton floccosum; Microsporum spp., например,Microsporum canis, Microsporum gypseum; Trichophyton spp., например, Trichophyton mentagrophytes, Trichophyton rubrum, Trichophyton quinckeanum, Trichophyton tonsurans, Trichophyton verrucosum, Trichophyton violaceum, Trichophyton inter digitale , Trichophyton soudanense; Fusarium spp., например, Fusarium solani, Fusarium oxysporum, Fusarium proliferatum, Fusarium verticillioides; Rhizomucor spp., например, Rhizomucor miehei, Rhizomucor pusillus; Mucor circinelloides; Rhizopus spp., например, Rhizopus oryzae,Rhizopus microspores; Acremonium spp.; Paecilomyces; Scopulariopsis; Arthrographi spp.; Scytalidium; Scedosporium spp., например, Scedosporium apiospermum, Scedosporium prolificans; Trichoderma spp.; Penicillium spp.; Penicillium marneffei; Blastoschizomyces. Соединения формулы (I) и их стереоизомерные формы и их фармацевтически приемлемые аддитивные соли и сольваты могут быть активными против широкого разнообразия грибков, таких как Can- 18022407Scedosporium spp., например, Scedosporium apiospermum, Scedosporium prolificans; Trichoderma spp.; Penicillium spp.; Penicillium marneffei; Blastoschizomyces. Соединения формулы (I) и их стереоизомерные формы и их фармацевтически приемлемые аддитивные соли и сольваты могут быть активными против широкого разнообразия грибков, таких как Candida parapsilosis; Aspergillus spp. Cryptococcus neoformans; Sporothrix schenckii; Microsporum spp.; Fusarium spp.; Scedosporium spp.; конкретно Candida parapsilosis; Aspergillus spp.; Cryptococcus neoformans;Microsporum spp.; Fusarium spp.; Scedosporium spp.; более конкретно, Aspergillus spp.; Cryptococcus neoformans; Microsporum spp.; Fusarium spp.; Scedosporium spp. Соединения формулы (I) и их стереоизомерные формы и их фармацевтически приемлемые аддитивные соли и сольваты могут быть активными против широкого разнообразия грибков, таких как Candida parapsilosis; Aspergillus spp.; Cryptococcus neoformans; Trichophyton spp.; Sporothrix schenckii; Microsporum spp.; Fusarium spp.; Scedosporium spp.; конкретно, Aspergillus spp.; Microsporum spp.; Trichophytonspp. Соединения формулы (I) и их стереоизомерные формы и их фармацевтически приемлемые аддитивные соли и сольваты могут быть активными против грибков, таких как Candida parapsilosis, Aspergillus spp., Cryptococcus neoformans, Microsporum spp., и Trichophyton spp. Соединения формулы (I) и их стереоизомерные формы и их фармацевтически приемлемые аддитивные соли и сольваты могут быть активными против грибков, таких как Соединения формулы (I) и их стереоизомерные формы и их фармацевтически приемлемые аддитивные соли и сольваты могут быть активными против Candida parapsilosis, Aspergillus fumigatus, Cryptococcus neoformans, Sporothrix schenckii, Microsporum canis, Trichophyton mentagrophytes, Trichophyton rubrum, Scedosporium apiospermum и Scedosporium prolificans; конкретно, Aspergillus fumigatus, Microsporum canis, Trichophyton mentagrophytes, Trichophyton rubrum, Scedosporium apiospermum и Scedosporium prolifwans. Соединения формулы (I) и их стереоизомерные формы и их фармацевтически приемлемые аддитивные соли и сольваты могут быть активными против грибков, таких как Candida parapsilosis; Aspergillus spp.; Cryptococcus neoformans; Microsporum spp.; Trichophyton spp.; Scedosporium spp. Соединения формулы (I) и их стереоизомерные формы и их фармацевтически приемлемые аддитивные соли и сольваты могут быть активными против Candida parapsilosis, Aspergillus fumigatus, Cryptococcus neoformans, Sporothrix schenckii, Microsporum canis, Trichophyton mentagrophytes, Trichophyton rubrum, Scedosporium apiospermum, Scedosporium prolifwans; конкретно Candida parapsilosis, Aspergillusfumigatus, Cryptococcus neoformans, Microsporum canis, Trichophyton mentagrophytes, Trichophyton rubrum,Scedosporium apiospermum и Scedosporium prolifwans; более конкретно Aspergillus fumigatus, Cryptococcus neoformans, Microsporum canis, Trichophyton mentagrophytes, Trichophyton rubrum, Scedosporium apiospermum и Scedosporium prolifwans. Соединения формулы (I) и их стереоизомерные формы и их фармацевтически приемлемые аддитивные соли и сольваты могут быть активными против Candida parapsilosis, Aspergillus fumigatus, Cryptococcus neoformans, Sporothrix schenckii, Microsporum canis, Trichophyton mentagrophytes, Trichophyton rubrum, Scedosporium apiospermum, Scedosporium prolifwans, Rhizopus oryzae, Rhizomucor miehei. Соединения формулы (I) и их стереоизомерные формы и их фармацевтически приемлемые аддитивные соли и сольваты могут быть активными против Candida parapsilosis В 66126, Aspergillus fumigatus В 42928, Cryptococcus neoformans B66663, Sporothrix schenckii B62482, Microsporum canis B68128, Trichophyton mentagrophytes B 70554, Trichophyton rubrum B 68183, Scedosporium apiospermum IHEM3817, Scedosporium prolifwans IHEM21157. Соединения формулы (I) и их стереоизомерные формы и их фармацевтически приемлемые аддитивные соли и сольваты могут быть активными против Candida parapsilosis В 66126, Aspergillus fumigatus В 42928, Cryptococcus neoformans B66663, Sporothrix schenckii В 62482, Microsporum canis B68128, Trichophyton mentagrophytes B 70554, Trichophyton rubrum B68183, Scedosporium apiospermum IHEM3817, Scedosporium prolificans IHEM21157, Rhizopus oryzae IHEM5223 и Rhizomucor miehei IHEMl 3391. Соединения формулы (I) и их стереоизомерные формы и их фармацевтически приемлемые аддитивные соли и сольваты могут быть активными против Candida parapsilosis, Aspergillus fumigatus, Cryptococcus neoformans, Microsporum canis, Trichophyton mentagrophytes, Trichophyton rubrum. Соединения формулы (I) и их стереоизомерные формы и их фармацевтически приемлемые аддитивные соли и сольваты могут быть активными против Microsporum canis, Trichophyton rubrum, Aspergillus fumigatus, Cryptococcus neoformans и Trichophyton mentagrophytes; конкретно, Microsporum canis В 68128, Trichophyton rubrum В 68183, Aspergillus fumigatus В 42928, Cryptococcus neoformans B66663 иTrichophyton mentagrophytes В 70554. Соединения формулы (I) и их стереоизомерные формы и их фармацевтически приемлемые аддитивные соли и сольваты могут быть активными против Candida parapsilosis В 66126, Aspergillus fumigatus В 42928, Cryptococcus neoformans B66663, Microsporum canis В 68128, Trichophyton mentagrophytes В 70554, Trichophyton rubrum В 68183, Rhizopus oryzae IHEM5223, Rhizomucor miehei IHEM 13391. Соединения формулы (I) и их стереоизомерные формы и их фармацевтически приемлемые аддитивные соли и сольваты могут быть активными против Candida parapsilosis В 66126, Aspergillus fumigatus В 42928, Cryptococcus neoformans В 66663, Microsporum canis В 68128, Trichophyton mentagrophytes В 70554, Trichophyton rubrum В 68183. Соединения Формулы (I) и их стереоизомерные формы и их фармацевтически приемлемые аддитивные соли и сольваты могут быть активными против разнообразных грибков, которые инфицируют кожу, волосы и ногти, а также подкожных и системных грибковых патогенов. Соединения формулы (I) и их стереоизомерные формы и их фармацевтически приемлемые аддитивные соли и сольваты могут быть активными против 3-х родов дерматофитов: Trichophyton, Microsporum и Epidermophyton; конкретно, против Trichophyton и Microsporum. Соединения формулы (I) и их стереоизомерные формы и их фармацевтически приемлемые аддитивные соли и сольваты могут быть активными против дерматофитов и Aspergillus spp.; конкретно, дерматофитов и Aspergillus fumigatus; более конкретно, Microsporum canis, Trichophyton mentagrophytes, Trichophyton rubrum и Aspergillus fumigatus; даже более конкретно, Microsporum canis, Trichophyton mentagrophytes и Trichophyton rubrum. Соединения формулы (I) и их стереоизомерные формы и их фармацевтически приемлемые аддитивные соли и сольваты могут быть активными против Trichophyton mentagrophytes, Trichophyton rubrum и Aspergillus spp.; конкретно, Trichophyton mentagrophytes, Trichophyton rubrum и Aspergillus fumigatus. Соединения формулы (I) и их стереоизомерные формы и их фармацевтически приемлемые аддитивные соли и сольваты, могут быть активными против Trichophyton mentagrophytes; TrichophytonScedosporium spp.; Microsporum canis; Sporothrix schenckii; Cryptococcus neoformans и Candida parapsilosis. Соединения формулы (I) и их стереоизомерные формы и их фармацевтически приемлемые аддитивные соли и сольваты могут быть активными против дерматофитов. Соединения формулы (I) и их стереоизомерные формы и их фармацевтически приемлемые адди- 20022407 тивные соли и сольваты могут быть активными против Aspergillus fumigatus. Соединения формулы (I) и их стереоизомерные формы и их фармацевтически приемлемые аддитивные соли и сольваты могут быть активными против Microsporum canis, конкретно, Microsporum canis В 68128. Соединения формулы (I) и их стереоизомерные формы и их фармацевтически приемлемые аддитивные соли и сольваты, могут быть активными против Trichophyton rubrum, конкретно, Trichophytonrubrum В 68183. Соединения формулы (I) и их стереоизомерные формы и их фармацевтически приемлемые аддитивные соли и сольваты, могут быть активными против широкого разнообразия грибков, таких как один или несколько грибков, указанных здесь прежде. Соединения формулы (I) и их стереоизомерные формы и их фармацевтически приемлемые аддитивные соли и сольваты являются сильнодействующими противогрибковыми средствами при введении перорально или местно. Соединения настоящего изобретения могут быть применимыми в качестве ингибиторов синтеза эргостерина. С точки зрения применимости соединения формулы (I), предоставлен способ лечения теплокровных животных, включая людей, страдающих от любого из заболеваний, указанных здесь выше, или способ предотвращения теплокровных животных, включая людей, от любого из этих заболеваний. Следовательно, соединения формулы (I) предоставлены для применения в качестве лекарственного средства. Также предоставлено применение соединения формулы (I) в производстве лекарственного средства,применимого для лечения грибковых инфекций. Дополнительно, соединения формулы (I) предоставлены для применения при лечении грибковых инфекций. Как применяют здесь, термин "лечение" предназначен для ссылки на все процессы, где может происходить замедление, прерывание, прекращение или остановка развития инфекции, но необязательно указывает на полное устранение всех симптомов. Изобретение относится к соединению общей формулы (I), его стереоизомерным формам и его фармацевтически приемлемым аддитивным солям кислоты или основания и сольватам, для применения в качестве лекарственного средства. Изобретение также относится к соединению общей формулы (I), его стереоизомерным формам и его фармацевтически приемлемым аддитивным солям кислоты или основания и сольватам, для лечения или профилактики грибковой инфекциий; конкретно, грибковых инфекций, вызываемых одним или несколькими грибками, указанными здесь выше. Изобретение также относится к соединению общей формулы (I), его стереоизомерным формам и его фармацевтически приемлемым аддитивным солям кислоты или основания и сольватам, для лечения грибковых инфекций; конкретно, грибковых инфекций, вызываемых одним или несколькими грибками,указанными здесь выше. Изобретение также относится к соединению общей формулы (I), его стереоизомерным формам и его фармацевтически приемлемым аддитивным солям кислоты или основания и сольватам, для применения при лечении или профилактики грибковых инфекций; конкретно, грибковых инфекций, вызываемых одним или несколькими грибками, указанными здесь выше. Изобретение также относится к соединению общей формулы (I), его стереоизомерным формам и его фармацевтически приемлемым аддитивным солям кислоты или основания и сольватам, для применения при лечении грибковых инфекций; конкретно, грибковых инфекций, вызываемых одним или несколькими грибками, указанными здесь выше. Изобретение также относится к соединениям общей формулы (I), их стереоизомерным формам и их фармацевтически приемлемым аддитивным солям кислоты или основания и сольватам, для применения при лечении или профилактики, конкретно лечении грибковых инфекций; конкретно, грибковых инфекций, вызываемых одним или несколькими грибками, выбранными из группы, состоящей из грибков, указанных здесь выше. Изобретение также относится к соединениям общей формулы (I), их стереоизомерным формам и их фармацевтически приемлемым аддитивным солям кислоты или основания и сольватам, для применения при лечении или профилактики грибковой инфекции, конкретно, грибковой инфекции, вызываемой одним или несколькими грибками, указанными здесь выше. Изобретение также относится к соединениям общей формулы (I), его стереоизомерным формам и его фармацевтически приемлемым аддитивным солям кислоты или основания и сольватам, для применения при лечении или профилактики грибковой инфекции, где грибковая инфекция вызывается одним или несколькими грибками, выбранными из группы, состоящей из Candida spp.; Aspergillus spp. CryptococcusPaecilomyces; Scopulariopsis; Arthrographis spp.; Scytalidium; Scedosporium spp.; Trichoderma spp.; Penicillium spp.; Penicillium marneffei; и Blastoschizomyces; конкретно, где грибковая инфекция вызывается одним или несколькими грибками, выбранными из группы, состоящей из Candida parapsilosis; Aspergillusspp.; Penicillium marneffei; и Blastoschizomyces; даже более конкретно, где грибковая инфекция вызывается одним или несколькими грибками, выбранными из группы, состоящей из Microsporum canis, Trichophyton mentagrophytes, Trichophyton rubrum и Aspergillus fumigatus. Новые соединения, описанные в настоящем изобретении, могут быть применимыми при лечении или профилактике заболеваний или состояний, выбранных из группы, состоящей из инфекций, вызываемых дерматофитами, системных грибковых инфекций и онихомикоза. Новые соединения, описанные в настоящем изобретении, могут быть применимыми при лечении или профилактике заболеваний или состояний, таких как, например, инфекции, вызываемые дерматофитами, системные грибковые инфекции или онихомикоз. Изобретение также относится к применению соединения общей формулы (I), его стереоизомерных форм и его фармацевтически приемлемых аддитивных солей кислоты или основания и сольватов для производства лекарственного средства. Изобретение также относится к применению соединения общей формулы (I), его стереоизомерных форм и его фармацевтически приемлемых аддитивных солей кислоты или основания и сольватов для производства лекарственного средства для лечения или профилактики, конкретно лечения, грибковых инфекций, конкретно, грибковых инфекций, вызываемых одним или несколькими грибками, указанными здесь выше. Соединения настоящего изобретения могут вводиться млекопитающим, предпочтительно людям,для лечения или профилактики, конкретно, лечения грибковых инфекций, конкретно, грибковых инфекций, вызываемых одним или несколькими грибками, указанными здесь выше. С учетом применимости соединения формулы (I), предоставлен способ лечения теплокровных животных, включая людей, страдающих от грибковых инфекциий, или способ предотвращения теплокровных животных, включая людей, от грибковых инфекций, конкретно, грибковых инфекциий, вызываемых одним или несколькими грибками, указанными здесь выше. Указанные способы включают введение, т.е. системное или местное введение, предпочтительно пероральное введение, эффективного количества соединения формулы (I), его стереоизомерной формы или его фармацевтически приемлемой аддитивной соли или сольвата теплокровным животным, включая людей. Указанные способы включают введение, т.е. системное или местное введение, предпочтительно пероральное введение, эффективного количества соединения формулы (I) теплокровным животным, включая людей. Специалисты, имеющие квалификацию для лечения таких заболеваний, смогут определить эффективное терапевтическое суточное количество из результатов тестов, представленных здесь ниже. Эффективное терапевтическое суточное количество будет составлять от приблизительно 0,005 до 50 мг/кг, конкретно от 0,01 мг/кг до 50 мг/кг массы тела, более конкретно от 0,01 до 25 мг/кг массы тела, предпочтительно от приблизительно 0,01 до приблизительно 15 мг/кг, более предпочтительно от приблизительно 0,01 до приблизительно 10 мг/кг, даже более предпочтительно от приблизительно 0,01 до приблизительно 1 мг/кг, наиболее предпочтительно от приблизительно 0,05 до приблизительно 1 мг/кг массы тела. Количество соединения в соответствии с настоящим изобретением, также указанного здесь в качестве активного ингредиента, который требуется для достижения терапевтического эффекта, будет несомненно изменяться от случая к случаю, например, для конкретного соединения, пути введения, возраста и состояния реципиента, и конкретного нарушения или заболевания, подвергаемого лечению. Способ лечения может также включать введение активного ингредиента в режиме между одним и четырьмя приемами в день. В этих способах лечения соединения в соответствии с изобретением предпочтительно составляют перед введением. Как описано здесь ниже, подходящие фармацевтические композиции получают по известным методикам с использованием хорошо известных и легко доступных ингредиентов. В то время как для активного ингредиента возможно введение его одного, предпочтительно представлять его в виде фармацевтической композиции. Настоящее изобретение также предоставляет композиции для лечения или предотвращения грибковых инфекций, содержащие терапевтически эффективное количество соединения формулы (I) и фармацевтически приемлемый носитель или разбавитель. Носитель или разбавитель должен быть "приемлемым" в смысле того, что он является совместимым с другими ингредиентами композиции, и не являться вредным для его реципиентов. Соединения настоящего изобретения, которые являются подходящими или предотвращения грибковых инфекций, могут вводиться одни или в комбинации с одним или несколькими дополнительными терапевтическими средствами. Комбинированная терапия включает введение единичной фармацевтической дозированной формы, которая содержит соединение формулы (I) и одно или несколько дополнительных терапевтических средств, а также введение соединения формулы (I) и каждого из дополнительных терапевтических средств в их собственной раздельной фармацевтической дозированной форме. Например, соединение формулы (I) и терапевтическое средство могут вводиться пациенту вместе в единой пероральной дозированной композиции, такой как таблетка или капсула, или каждое средство может вводиться в раздельных пероральных дозированных формах. С учетом их полезных фармакологических свойств рассматриваемые соединения могут быть составлены в разнообразные фармацевтические формы для целей введения. Соединения в соответствии с изобретением, конкретно соединения формулы (I), их фармацевтически приемлемые аддитивные соли,кислоты или основания, их стереохимически изомерные формы или любая их подгруппа или комбинация могут быть составлены в разнообразные фармацевтические формы для целей введения. В качестве подходящих композиций можно привести примеры всех композиций, обычно используемых для системного введения лекарственных средств. Для получения фармацевтических композиций данного изобретения, эффективное количество конкретного соединения, необязательно в форме аддитивной соли, в качестве активного ингредиента, объединяют в тщательно приготовленной смеси с фармацевтически приемлемым носителем, причем носитель может принимать большое разнообразие форм в зависимости от формы препарата, желательной для введения. Эти фармацевтические композиции являются желаемыми в единичной дозированной форме,пригодной, конкретно, для введения перорально, ректально, чрескожно, посредством парентеральной инъекции или посредством ингаляции. Например, при получении композиций в пероральной дозированной форме, могут использоваться любые из обычных фармацевтических сред, такие как, например, вода,гликоли, масла, спирты и т.п., в случае пероральных жидких препаратов, таких как суспензии, сиропы,эликсиры, эмульсии и растворы; или твердые носители, такие как крахмалы, сахара, каолин, разбавители,лубриканты, связующие, дезинтегранты и т.п., в случае порошков, пилюль, капсул и таблеток. Вследствие легкости их введения, таблетки и капсулы представляют наиболее преимущественные пероральные единичные дозированные формы, в которых очевидно используют твердые фармацевтические носители. Для парентеральных композиций, носитель обычно будет содержать стерильную воду, по меньшей мере,в большей части, хотя могут быть включены другие ингредиенты, например, для улучшения растворимости. Могут быть получены, например, растворы для инъекций, в которых носитель содержит физиологический раствор, раствор глюкозы или смесь физраствора и раствора глюкозы. Могут быть получены растворы для инъекций, например, в которых носитель содержит физиологический раствор, раствор глюкозы или смесь физраствора и раствора глюкозы. Растворы для инъекций, содержащие соединения формулы (I), могут быть составлены в масле для пролонгированного действия. Соответствующие масла для этой цели представляют собой, например, кокосовое масло, кунжутное масло, хлопковое масло, кукурузное масло, соевое масло, синтетические сложные эфиры глицерина и жирных кислот с длинной цепью и смеси этих и других масел. Могут также быть получены суспензии для инъекций, в которых могут использоваться соответствующие жидкие носители, суспендирующие средства и т.п. Также включены препараты в твердой форме, которые предназначены для превращения, незадолго перед применением, в препараты в жидкой форме. В композициях, пригодных для чрескожного введения, носитель необязательно содержит средство усиления проницаемости и/или подходящий увлажнитель, необязательно объединенный с подходящими добавками любой природы в минорных пропорциях, причем добавки не оказывают существенного вредного эффекта на кожу. Указанные добавки могут способствовать введению в кожу и/или могут быть полезными для получения желательных композиций. Эти композиции могут вводиться различными путями, например, в виде трансдермального пластыря, точечного нанесения, в виде мази. Аддитивные соли кислоты или основания соединений формулы (I) вследствие их увеличенной растворимости в воде по сравнению с соответствующей основной или кислотной формой, являются более подходящими при получении водных композиций. Композиции для введения через ногти находятся в форме раствора, и носитель необязательно содержит средство усиления проницаемости, которое благоприятствует проницаемости противогрибкового средства в и через кератинизированный ногтевой слой ногтя. Среда растворителя содержит воду, смешанную с со-растворителем, таким как спирт, имеющий от 2 до 6 атомов углерода, например этанол. Чтобы повысить растворимость и/или стабильность соединений формулы (I) в фармацевтических композициях, может иметь преимущество использование -, - или -циклодекстринов или их производных, конкретно, гидроксиалкилзамещенных циклодекстринов, например, 2-гидроксипропил-циклодекстрина или сульфобутил- циклодекстрина. Сорастворители, такие как спирты, могут также улучшить растворимость и/или стабильность соединений в соответствии с изобретением в фармацевтических композициях. Отношение активного ингредиента к циклодекстрину может изменяться в широких пределах. Например, могут применяться отношения от 1/100 до 100/1. Представляющие интерес отношения активного ингредиента к циклодекстрину находятся в интервале от приблизительно 1/10 до 10/1. Представляющие больший интерес отношения активного ингредиента к циклодекстрину находятся в интервале от приблизительно 1/5 до 5/1. В зависимости от способа введения фармацевтические композиции будут предпочтительно содержать от 0,05 до 99 мас.%, более предпочтительно от 0,1 до 70 мас.%, даже более предпочтительно от 0,1 до 50 мас.%, соединения формулы (I) и от 1 до 99, 95 мас.%, более предпочтительно от 30 до 99,9 мас.%,- 23022407 даже более предпочтительно от 50 до 99,9 мас.%, от фармацевтически приемлемого носителя, причем все значения процентные содержания основаны на общей массе композиции. Для парентеральных композиций могут быть включены также другие ингредиенты, чтобы способствовать растворимости, например циклодекстрины. Соответствующие циклодекстрины представляют собой -, -, -циклодекстрины или их простые эфиры и смешанные эфиры, где одна или несколько из гидроксильных групп единиц ангидроглюкозы циклодекстрина являются замещенными С 1-6 алкилом,конкретно метилом, этил или изопропилом, например статистически метилированный -CD; гидроксиC1-6 алкилом, конкретно гидроксиэтилом, гидроксипропилом или гидроксибутилом; карбокси C1-6 алкилом, конкретно карбоксиметилом или карбоксиэтилом; C1-6 алкилкарбонилом, конкретно, ацетилом. В качестве комплексообразователей и/или солюбилизаторов заслуживают особого внимания -CD,статистически метилированный -CD, 2,6-диметилCD, 2-гидроксиэтилCD, 2-гидроксиэтил- -CD,2-гидроксипропил- -CD и (2-карбоксиметокси)пропилCD, и конкретно, 2-гидроксипропилCD (2HPCD). Термин "смешанный эфир" обозначает производные циклодекстрина, где, по меньшей мере, две циклодекстриновых гидроксигруппы этерифицированы различными группами, такими как, например,гидроксипропил и гидроксиэтил. Среднее молярное замещение (M.S.) используют в качестве меры среднего числа молей алкоксиединиц на моль ангидроглюкозы. Средняя степень замещения (D.S.) относится к среднему числу замещенных гидроксилов на единицу ангидроглюкозы. Значение M.S. и D.S может определяться разнообразными аналитическими методами, такими как ядерный магнитный резонанс(ЯМР), Масс-спектрометрия (MC) и инфракрасная спектроскопия (ИК). В зависимости от применяемого метода, для одного взятого производного циклодекстрина могут быть получены слегка различные значения. Предпочтительно, по данным масс-спектрометрии, M.S. находится в интервале от 0,125 до 10 и D.S. находится в интервале от 0,125 до 3. Другие подходящие композиции для перорального или ректального введения содержат частицы,состоящие из твердой дисперсии, содержащей соединение формулы (I) и один или несколько соответствующих фармацевтически приемлемых водорастворимых полимеров. Термин "твердая дисперсия" определяет систему, в твердом состоянии (в противоположность жидкому или газообразному состоянию), содержащую по меньшей мере два компонента, в случае соединения формулы (I), и водорастворимый полимер, где один компонент диспергирован более или менее однородно по всему объему другого компонента или компонентов (в случае дополнительных фармацевтически приемлемых составляющих средств, общеизвестных в области, включены, такие как пластификаторы, консерванты и т.п). Когда указанная дисперсия компонентов является такой, что система является химически и физически однородной или гомогенной по всему объему или состоит из одной фазы, как определено в термодинамике, такую твердую дисперсию будут называть "твердым раствором". Твердые растворы являются предпочтительными физическими системами вследствие того, что компоненты в них обычно являются легко биодоступными для организмов, которым их вводят. Это преимущество вероятно может объясняться простотой, с которой указанные твердые растворы могут образовывать жидкие растворы при контакте с жидкой средой, такой как желудочно-кишечные соки. Простота растворения может быть отнесена за счет, по меньшей мере, частично, того факта, энергия, требуемая для растворения компонентов из твердого раствора, является меньшей, чем требуется для растворения компонентов из кристаллической или микрокристаллической твердой фазы. Термин "твердая дисперсия" также включает дисперсии, которые являются менее гомогенными по объему, чем твердые растворы. Такие дисперсии не являются химически и физически однородными по всему объему или содержат более одной фазы. Например, термин "твердая дисперсия" также относится к системе, имеющей домены или небольшие области, где аморфное, микрокристаллическое или кристаллическое соединение формулы (I), или аморфный, микрокристаллический или кристаллический водорастворимый полимер, или оба, диспергированы более или менее однородно в еще одной фазе, содержащей водорастворимый полимер, или соединение формулы (I), или твердый раствор, содержащий соединение формулы (I) и водорастворимый полимер. Указанные домены являются областями внутри твердой дисперсии, отчетливо отмеченными некоторым физическим признаком, небольшими по размеру и равномерно и разупорядоченно распределенными по всему объему твердой дисперсии. Может быть дополнительно удобным составлять настоящие противогрибковые соединения в виде наночастиц, которые имеют модификатор поверхности, адсорбированный на их поверхности в количестве, достаточном для поддержания эффективного среднего размера частиц, менее чем 1000 нм. Полагают,что применимые модификаторы поверхности включают те модификаторы, которые физически прилипают к поверхности противогрибкового средства, но не связываются химически с противогрибковым средством.Подходящие модификаторы поверхности могут предпочтительно быть выбраны из известных органических и неорганических фармацевтических эксципиентов. Такие эксципиенты включают разнообразные полимеры, низкомолекулярные олигомеры, природные продукты и поверхностно-активные вещества. Предпочтительные модификаторы поверхности включают неионные и анионные поверхностноактивные вещества. Еще один представляющий интерес путь составления настоящих соединений включает фармацевтические композиции, в которых настоящие противогрибковые средства включены в гидрофильные полимеры и нанесение этой смеси в качестве пленочного покрытия на множество маленьких шариков. Таким образом, получают композицию, которая может удобным образом производиться, и, которая является пригодной для получения фармацевтических дозированных форм для перорального введения. Указанные шарики содержат центральную, закругленную или сферическую сердцевину, покрывающую пленку гидрофильного полимера и противогрибковое средство и герметично покрывающий слой. Существуют разнообразные вещества, пригодные для использования в качестве сердцевин в шариках, при условии, что указанные вещества являются фармацевтически приемлемыми и имеют соответствующие размеры и жесткость. Примерами таких веществ являются полимеры, неорганические вещества,органические вещества, и сахариды и их производные. Особенно преимущественным является составлять вышеуказанные фармацевтические композиции в единичной дозированной форме для простоты введения и однородности дозировки. Единичная дозированная форма, как используют здесь в описании и формуле изобретения, относится к физически дискретным единицам, пригодным для разовых дозировок, причем каждая дозировка содержит предварительно определенное количество активного ингредиента, рассчитанное для получения желательного терапевтического эффекта в ассоциации с требуемым фармацевтическим носителем. Примеры таких единичных дозированных форм представляют собой таблетки (включая с нанесенной насечкой или покрытые оболочкой таблетки), капсулы, пилюли, суппозитории, пакеты с порошком, облатки, растворы или суспензии для инъекций, чайные ложки с верхом, столовые ложки с верхом и т.п., и их сегрегированные множественные части. Поскольку соединения в соответствии с изобретением являются сильнодействующими перорально вводимыми соединениями, фармацевтические композиции, содержащие указанные соединения для введения перорально, являются особенно преимущественными. Следующие примеры иллюстрируют настоящее изобретение. Экспериментальная часть Далее, в данном описании термин "ДХМ" означает дихлорметан; "ЖХМС" означает Жидкостная Хроматография/Масс-спектрометрия; "Pd(OAc)2 означает палладия (II) ацетат; "Et3N" означает триэтиламин; "ДМФА" означает N,N-диметилформамид; "ТСХ" означает тонкослойная хроматография; "ПЭ" означает петролейный эфир; "ТФУ" означает трифторуксусную кислоту; "psi" означает фунт-силы на квадратный дюйм; "ВЭЖХ" означает высокоэффективная жидкостная хроматография; "к.т." означает комнатная температура; "т.пл." означает температура плавления; "мин" означает минута(минуты); "ч" означает час(ы); "EtOAc" означает этилацетат; "EtOH" означает этанол; "МеОН" означает метанол;"EDCI" означает моногидрохлорид N'-(этилкарбонимидоил)-N,N-диметил-1,3-пропандиамина. Специалист в области поймет, что для некоторых реакций в примерах необходимо использовать безводные условия и/или должна применяться инертная защитная атмосфера, такая как, например, N2 или аргон. А. Получение промежуточных соединений Пример A1. а) Получение промежуточного соединения 1 Смесь 2-амино-6-хлорбензонитрила (17,72 г, 0,116 моль) и тетрагидро-2,5-диметоксифурана (0,116 моль) в HOAc (100 мл) перемешивали и кипятили с обратным холодильником в течение 30 мин. В последующем, смесь охлаждали и упаривали. Остаток очищали на силикагеле на стеклянном фильтре (элюент: ДХМ), фракции продукта собирали и растворитель упаривали. Остаток кристаллизовали из EtOH. Выход: 18,83 г промежуточного соединения 1 (80% выход).b) Получение промежуточного соединения 2 Борандиметилсульфид (1:1) (2,5 мл 10 N раствора BH3 в Me2S, 0,0247 моль) добавляли при к.т. под атмосферой N2 к раствору промежуточного соединения 1 (5,0 г, 0,0247 моль) в ТГФ (20 мл). Смесь нагревали при кипячении с обратным холодильником в течение 10 ч. После охлаждения до к.т., HCl (6 N водный раствор; 15 мл) добавляли по каплям. В последующем, смесь нагревали в условиях кипячения с обратным холодильником в течение 30 мин. Раствор охлаждали до 0 С и затем добавляли NaOH (6N;q.s.). Смесь экстрагировали ДХМ (50 мл 3) и отделенный органический слой сушили (Na2SO4) , фильтровали, и растворитель упаривали с получением на выходе масла. HCl/диоксан (6N; 5 мл) и диоксан (20 мл) добавляли и осадок собирали посредством фильтрации и сушили. Выход: 5,14 г промежуточного соединения 2 (86% выход; .HCl). Пример А 2. а) Получение промежуточного соединения 3NaH (60% в минеральном масле; 5,66 г, 141,48 ммоль) добавляли по частям к смеси 5-бром-1,3 дигидро-2 Н-индол-2-она (10,0 г, 47,16 ммоль) в ТГФ (100 мл) при 0 С. Смесь перемешивали в течение 30 мин и затем добавляли CH3I (21,42 г, 150,91 ммоль). Р.см. перемешивали при 0 С в течение 30 мин. В последующем Н 2 О (2 мл) добавляли по каплям. Растворитель удаляли под вакуумом. Остаток растворяли в Н 2 О (q.s.) и экстрагировали EtOAc. Отделенный органический слой промывали насыщенным солевым раствором, сушили (Na2SO4), фильтровали и упаривали под вакуумом. Остаток очищали колоночной хроматографией (элюент: ПЭ/EtOAc 20/1). Желательные фракции собирали и растворитель упаривали. Выход: 9,5 г промежуточного соединения 3 (79% выход).b) Получение промежуточного соединения 4Pd (OAc)2 (0,31 г, 1,38 ммоль) добавляли к смеси промежуточного соединения 3 (5,0 г, 19,7 ммоль),DPPP (0,568 г, 1,38 ммоль) и Et3N (27 мл) в MeOH (200 мл) и ДМФА (200 мл). Раствор перемешивали и подвергали воздействию давления 40 psi с помощью CO при 70 С в течение 4 ч. В последующем, смесь охлаждали до к.т. и разбавляли H2O. Смесь экстрагировали EtOAc. Отделенный органический слой промывали H2O и насыщенным солевым раствором, сушили (Na2SO4), фильтровали и концентрировали под вакуумом. Неочищенный продукт очищали колоночной хроматографией (элюент: ПЭ/EtOAc 10/1). Желательные фракции собирали и растворитель упаривали. Выход: 2,4 г промежуточного соединения 4(52% выход). с) Получение промежуточного соединения 5 Смесь промежуточного соединения 4 (2,4 г, 10,3 ммоль) в NaOH (2N; 20 мл) и EtOH (30 мл) перемешивали при к.т. в течение 4 ч. В последующем добавляли HCl до pH 1-2. Смесь экстрагировали EtOAc. Отделенный органический слой сушили (Na2SO4), фильтровали и растворитель упаривали под вакуумом с получением 2,1 г промежуточного соединения 5 в виде белого твердого вещества (100% выход).d) Получение промежуточного соединения 6 Промежуточное соединение 5 (1,35 г, 6,17 ммоль) растворяли в ДХМ (30 мл). Et3N (4,5 мл, 30, 86 ммоль), HOBT (0,83 г, 6,17 ммоль), EDCI (1,18 г, 6,17 ммоль) и промежуточное соединение 2 (1,5 г, 6,17 ммоль) добавляли к раствору. Р.см. перемешивали в течение ночи при к.т. Смесь концентрировали и к остатку добавляли H2O. Эту водную смесь экстрагировали ДХМ. Отделенный органический слой сушили (Na2SO4), фильтровали и растворитель упаривали. Неочищенный продукт очищали посредством ВЭЖХ (YMC колонка 25150 мм; подвижная фаза: 35-45% CH2CN (0,1% ТФУ)/H2O (0,1% ТФУ); объемная скорость потока 20 мл/мин; 20 мин). Фракции продукта собирали и растворитель упаривали. Выход: 0,77 г промежуточного соединения 6 (34% выход). Пример А 3. Получение промежуточного соединения 7 Смесь промежуточного соединения 2 (1,0 г, 4,2 ммоль), 5,6,7,8-тетрагидро-2-нафталинкарбоновой кислоты (0,88 г, 5,0 ммоль), Et3N (5,0 мл, 3 6,2 ммоль), HOBT (0,62 г, 4,6 ммоль) и EDCI (0,96 г, 5,0 ммоль) в ДХМ (50 мл) перемешивали в течение ночи при к.т. В последующем, смесь промывали H2O(3100 мл), сушили (MgSO4), фильтровали и растворитель упаривали. Остаток промывали MeOH. Твердое вещество собирали и сушили под вакуумом. Выход: 0,9 г промежуточного соединения 7 (59% выход). Пример А 4. а) Получение промежуточного соединения 8 Смесь 1,2-этандитиола (1,88 г, 20 ммоль) в ДХМ (20 мл) добавляли к триметилалюминию (20 мл) при -78 С. После добавления смесь нагревали до к.т. в течение 30 мин. В последующем смесь охлаждали снова до -20 С и смесь 6-бром-3,4-дигидро-2 Н-1-бензопиран-2-она (4,54 г, 20 ммоль) в ДХМ (80 мл) добавляли по каплям. Р.см. перемешивали в течение ночи при к.т., выливали в воду со льдом, подкисляли(концентрированная HCl), и экстрагировали ДХМ. Отделенный органический слой сушили (MgSO4) ,фильтровали и растворитель упаривали. Остаток очищали колоночной хроматографией на силикагеле(элюент: ПЭ/EtOAc 100/1). Желательные фракции собирали и растворитель упаривали с получением 3,5 г промежуточного соединения 8 (58% выход; белое твердое вещество).b) Получение промежуточного соединения 9 Тригидрофторид триэтиламина (8,05 г, 50 ммоль, (C2H5)3N3HF) добавляли к смеси промежуточного соединения 8 (3,0 г, 10 ммоль) в ДХМ (50 мл) при -78 С. Затем 1,3-дибром-5,5-диметил-2,4 имидазолидиндион (14,3 г, 50 ммоль) в ДХМ (30 мл) добавляли в течение 30 мин. Смесь перемешивали в течение 2 ч при к.т. В последующем, раствор гасили NaOH (1N, q.s.) и экстрагировали ДХМ (200 мл). Отделенный органический слой сушили (MgSO4), фильтровали и концентрировали под вакуумом. Остаток очищали колоночной хроматография на силикагеле (элюент: ПЭ) желательные фракции собирали и растворитель упаривали. Выход: 2 г промежуточного соединения 9 (80% выход; масло). с) Получение промежуточного соединения 10Et3N (13 мл, 92,4 ммоль) добавляли к смеси промежуточного соединения 9 (2,0 г, 8,03 ммоль), DPPP(0,267 г, 0,646 моль) и Pd(OAc)2 (0,145 г, 0,646 моль) в H2O (40 мл) и CH2CN (100 мл). Р.см. перемешивали и подвергали воздействию давления при 4 мПас CO при 1000C в течение 24 ч. Затем смесь охлаждали до к.т. и разбавляли H2O. Осадок отфильтровывали и фильтрат доводили с помощью HCl. Осадок отфильтровывали, промывали H2O и сушили под вакуумом с получением 0,3 г промежуточного соединения 10 (17% выход).d) Получение промежуточного соединения 11Et3N (2 мл, 12,18 ммоль), HOBT (0,1 г, 0,77 ммоль), EDCI (0,15 г, 0,77 ммоль) и промежуточное соединение 2 (0,17 г, 0,7 ммоль) добавляли к раствору промежуточного соединения 10 (0,17 г, 0,77 ммоль) в ДХМ (15 мл). Р.см. перемешивали при к.т. в течение ночи. Добавляли H2O и водную смесь экстрагировали ДХМ. Отделенный органический слой сушили (Na2SO4), фильтровали и растворитель упаривали. Остаток очищали колоночной хроматографией (элюент: ПЭ/EtOAc от 15/1 до 10/1). Фракции продукта собирали и растворитель упаривали под вакуумом с получением 0,180 г промежуточного соединения 11(64% выход). Пример А 5. а) Получение промежуточного соединения 12 ммоль) в ДМФА (500 мл) перемешивали и нагревали в течение ночи при 80 С. Смесь охлаждали до к.т.,твердое вещество отфильтровывали и растворитель удаляли. Остаток очищали колоночной хроматографией на силикагеле (элюент: ПЭ/EtOAc 5/1). Желательные фракции собирали и растворитель упаривали с получением 19 г промежуточного соединения 12 (51% выход; белое твердое вещество).b) Получение промежуточного соединения 13 Боран-диметилсульфид (1:1) (12 мл 10 M раствор BH3 в Me2S, 0,120 моль) добавляли при к.т. под атмосферой N2 к раствору промежуточного соединения 12 (19 г, 0,102 моль) в ТГФ (250 мл). Смесь нагревали при кипячении с обратным холодильником в течение ночи под N2. Затем HCl (6N; 10 мл) добавляли к смеси, в то время как смесь охлаждали на водяной бане со льдом. Смесь кипятили с обратным холодильником снова в течение 30 мин и затем твердый NaOH добавляли до достижения рН 9, в то время как смесь охлаждали на водяной бане со льдом. Смесь экстрагировали ДХМ (2x300 мл). Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель упаривали. Коричневый остаток превращали в HCl-соль (1:1) с помощью HCl/2-пропанола. Выход: 17 г промежуточного соединения 13 (75% выход; .HCl). с) Получение промежуточного соединения 14 Смесь промежуточного соединения 13 (0,95 г, 4,2 ммоль), 2,2-дифтор-1,3-бензодиоксол-5 карбоновой кислоты (1,0 г, 5,0 ммоль), Et3N (5,0 мл, 36 ммоль), HOBT (0,62 г) и EDCI (0,95 г) в ДХМ (50 мл) перемешивали в течение ночи при к. т. Смесь промывали H2O (3100 мл), сушили (MgSO4), фильтровали и растворитель упаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: ПЭ/EtOAc от 20/1 до 10/1). Желательные фракции собирали и растворитель упаривали под вакуумом. Выход: 0,8 г промежуточного соединения 14 (51% выход). Пример А 6. а) Получение промежуточного соединения 15(145,7 ммоль), и гидрохлорида 4- хлорпиридина (1:1) в диоксане (300 мл) нагревали при кипячении с обратным холодильником в течение ночи. Реакционную смесь промывали H2O (3300 мл) и экстрагировали ДХМ (3200 мл). Отделенный органический слой сушили и упаривали под вакуумом. Выход: 32 г неочищенного промежуточного соединения 15 (99% выход), использованного как такового на следующей стадии реакции.b) Получение промежуточного соединения 16 Смесь промежуточного соединения 15 (32 г неочищенного вещества, приблизительно 145 ммоль),HOBT (22,3 г, 165 ммоль), EDCI (31,6 г, 165 ммоль) и NH3H2O (35 мл) в ДМФА (300 мл) перемешивали в течение ночи при к.т. Смесь гасили H2O (300 мл), и продукт отфильтровывали. Выход: 23 г промежуточного соединения 16 (72% выход). с) Получение промежуточного соединения 17 Реакция под атмосферой N2: Промежуточное соединение 16 (2,0 г, 9,1 ммоль) растворяли в ТГФ (50 мл). Добавляли LiAlH4 (1,7 г, 45,5 ммоль), в то время как раствор охлаждали на водяной бане со льдом. В последующем смесь нагре- 28022407 вали при кипячении с обратным холодильником в течение 3 ч и затем раствор охлаждали до к.т. Добавляли H2O (5 мл), в то время как р.см. охлаждали на водяной бане со льдом. Добавляли EtOAc (50 мл) и смесь фильтровали. Фильтрат экстрагировали EtOAc (325 мл). Отделенный органический слой сушилиd) Получение промежуточного соединения 18 Смесь промежуточного соединения 17 (1,1 г, 5,3 ммоль), 3,4-дигидро-2 Н-1-бензопиран-6 карбоновой кислоты (1,1 г, 6,4 ммоль) Et3N (7,5 мл, 4 7,7 ммоль), HOBT (0,77 г, 5,7 ммоль) и EDCI (1,1 г,5,8 ммоль) в ДХМ (40 мл) нагревали при кипячении с обратным холодильником в течение 5 ч, и затем охлаждали до к.т. Раствор выливали в воду со льдом. Добавляли 2 M NaOH раствор до pH 8. Эту смесь экстрагировали ДХМ (350 мл). Органические слои объединяли, промывали H2O (320 мл), промывали насыщенным солевым раствором (320 мл), сушили (Na2SO4), фильтровали и растворитель упаривали под вакуумом. Остаток очищали посредством ВЭЖХ (колонка Luna 50300 мм; подвижная фаза: 0-30%CH3CN (0,1% ТФУ)/H2O (0,1% ТФУ); объемная скорость потока 80 мл/мин; 25 мин). Фракции продукта собирали и нейтрализовали насыщенным раствором NaHCO3. Смесь экстрагировали ДХМ. Отделенный органический слой сушили (Na2SO4) , фильтровали, и растворитель упаривали. Выход: 0,8 г промежуточного соединения 18 (41% выход). Пример A7. а) Получение промежуточного соединения 19 Реакция под атмосферой N2. Тетрагидро-2,5-диметоксифуран (11,1 г, 83,6 ммоль) добавляли к смеси 2-амино-4-хлорбензонитрила (10 г, 65,5 ммоль) в уксусной кислоте (45 мл). Смесь нагревали при кипячении с обратным холодильником и перемешивали в течение 1 ч. В последующем, растворитель упаривали в вакууме. Остаток очищали колоночной хроматографией на силикагеле (элюент: ПЭ/EtOAc 4/1). Желательные фракции собирали и растворитель упаривали в вакууме. Выход: 13,0 г промежуточного соединения 19 (98% выход).b) Получение промежуточного соединения 20(1:1) (6,9 мл 10 M раствора BH3 в Me2S, 69,3 ммоль) добавляли медленно в раствор под N2. Р.см. перемешивали и кипятили с обратным холодильником в течение ночи. В последующем смесь охлаждали. К смеси добавляли MeOH (15 мл) (при охлаждении на водяной бане со льдом). Смесь перемешивали в течение 30 мин. Медленно добавляли HCl/МеОН (15 мл 4 N раствора). Растворитель из смеси упаривали под вакуумом и дополнительное количество HCl/МеОН (20 мл 4 N раствор) добавляли к остатку. Растворитель из смесь упаривали под вакуумом. Неочищенное промежуточное соединение 20 (15 г) использовали как таковое на следующей стадии реакции. Пример А 8. а) Получение промежуточного соединения 21 1,2-Этандитиол (4,7 г, 50 ммоль) в ДХМ (100 мл) добавляли к триметилалюминию (50 мл 2 M раствор в толуоле; 100 ммоль) при -78 С. После добавления, смесь нагревали до к.т. в течение 30 мин. Смесь охлаждали до -20 С и затем 6-бром-3,4-дигидро-2 Н-1-бензопиран-2-он (11,35 г, 50 ммоль) в ДХМ(200 мл) добавляли по каплям к смеси. Смесь перемешивали в течение ночи. Смесь выливали в воду со льдом, подкисляли концентрированной HCl и экстрагировали ДХМ. Отделенный органический слой сушили (Na2SO4), фильтровали и растворитель упаривали. Остаток очищали колоночной хроматографией(градиент элюента: ПЭ/EtOAc от 80/1 до 50/1). Фракции продукта собирали, и растворитель упаривали под вакуумом с получением 2 г промежуточного соединения 21 (15% выход).
МПК / Метки
МПК: A61P 31/10, C07D 487/04, A61K 31/5517
Метки: 6h-пирроло[1,2-a][1,4]бензодиазепины, замещенные, бициклическими, 5,6-дигидро-4h-пирроло[1,2-a][1,4]бензодиазепины, бензола, противогрибковые, производными
Код ссылки
<a href="https://eas.patents.su/30-22407-protivogribkovye-56-digidro-4h-pirrolo12-a14benzodiazepiny-i-6h-pirrolo12-a14benzodiazepiny-zameshhennye-biciklicheskimi-proizvodnymi-benzola.html" rel="bookmark" title="База патентов Евразийского Союза">Противогрибковые 5,6-дигидро-4h-пирроло[1,2-a][1,4]бензодиазепины и 6h-пирроло[1,2-a][1,4]бензодиазепины, замещенные бициклическими производными бензола</a>
Следующий патент: Производные санглиферина и способы их получения
Случайный патент: Соединения, проявляющие активность в отношении св1












