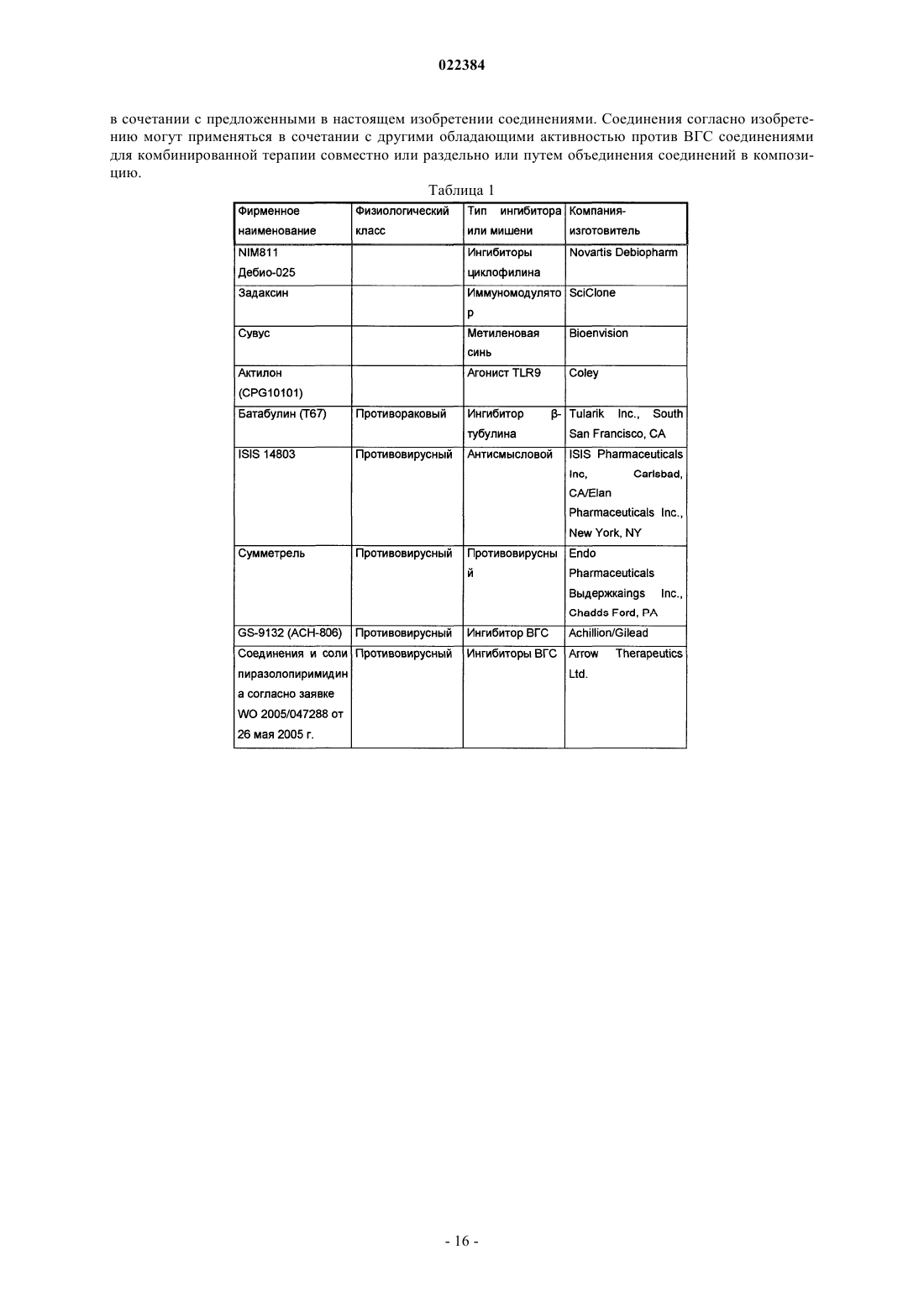
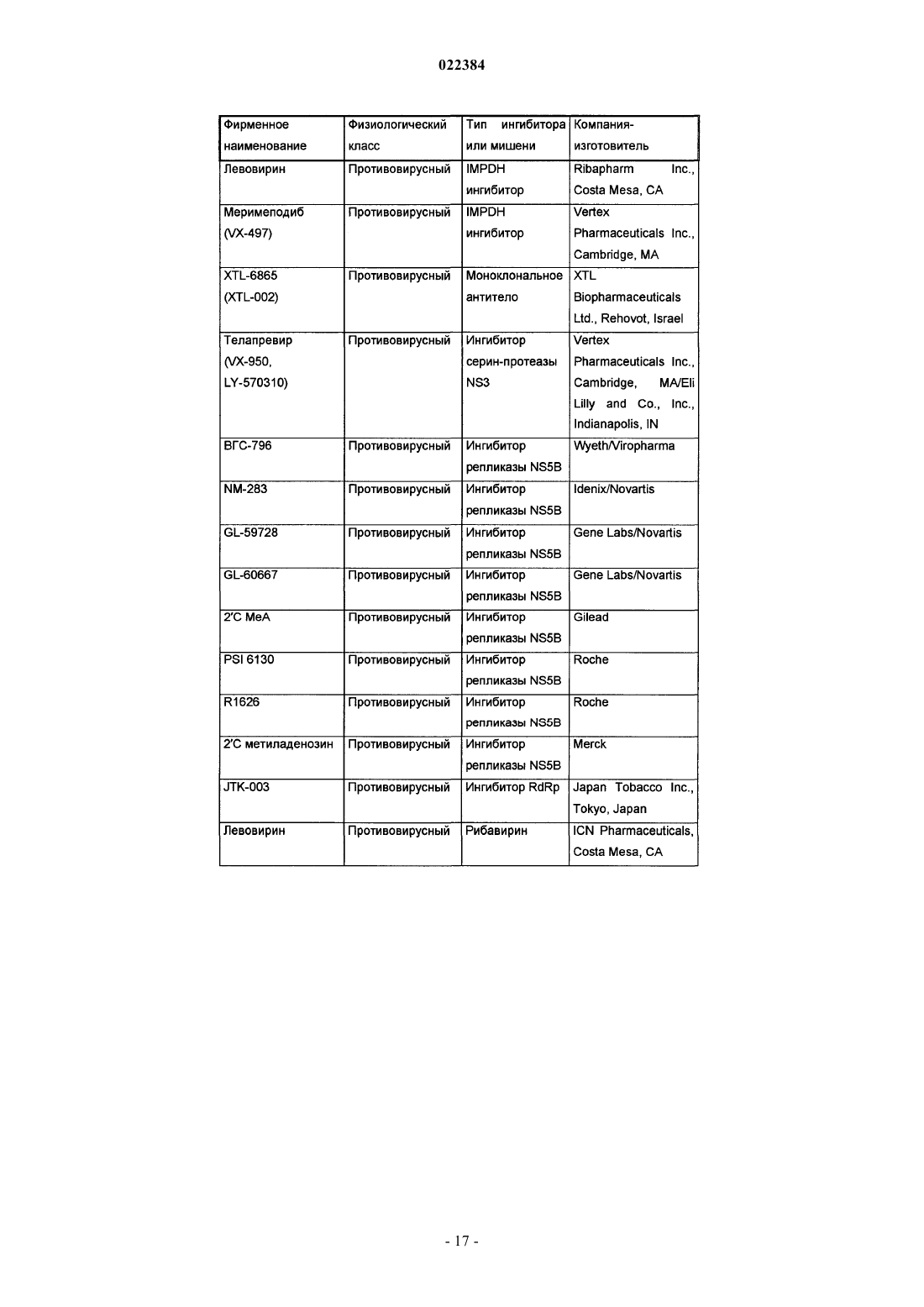
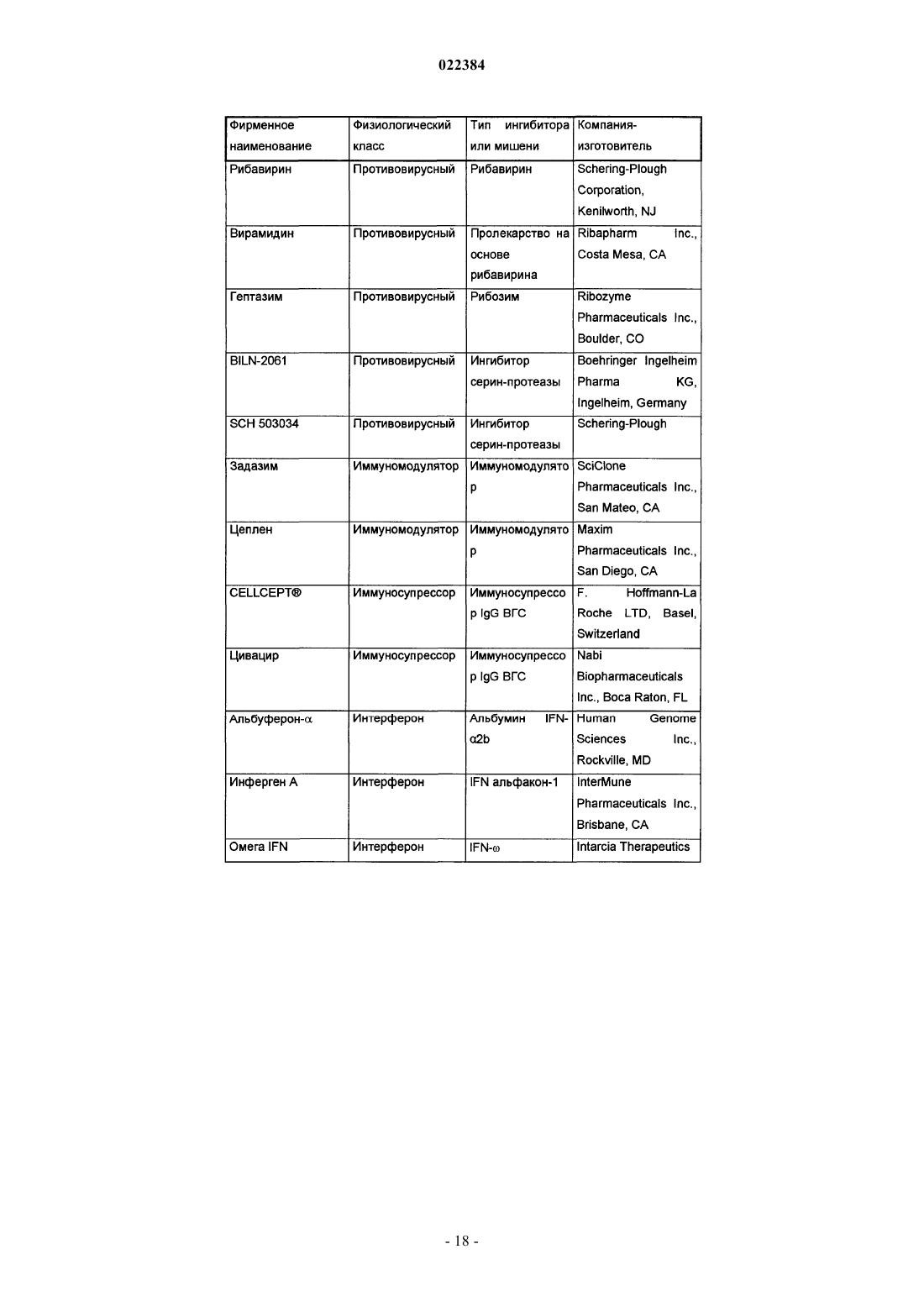
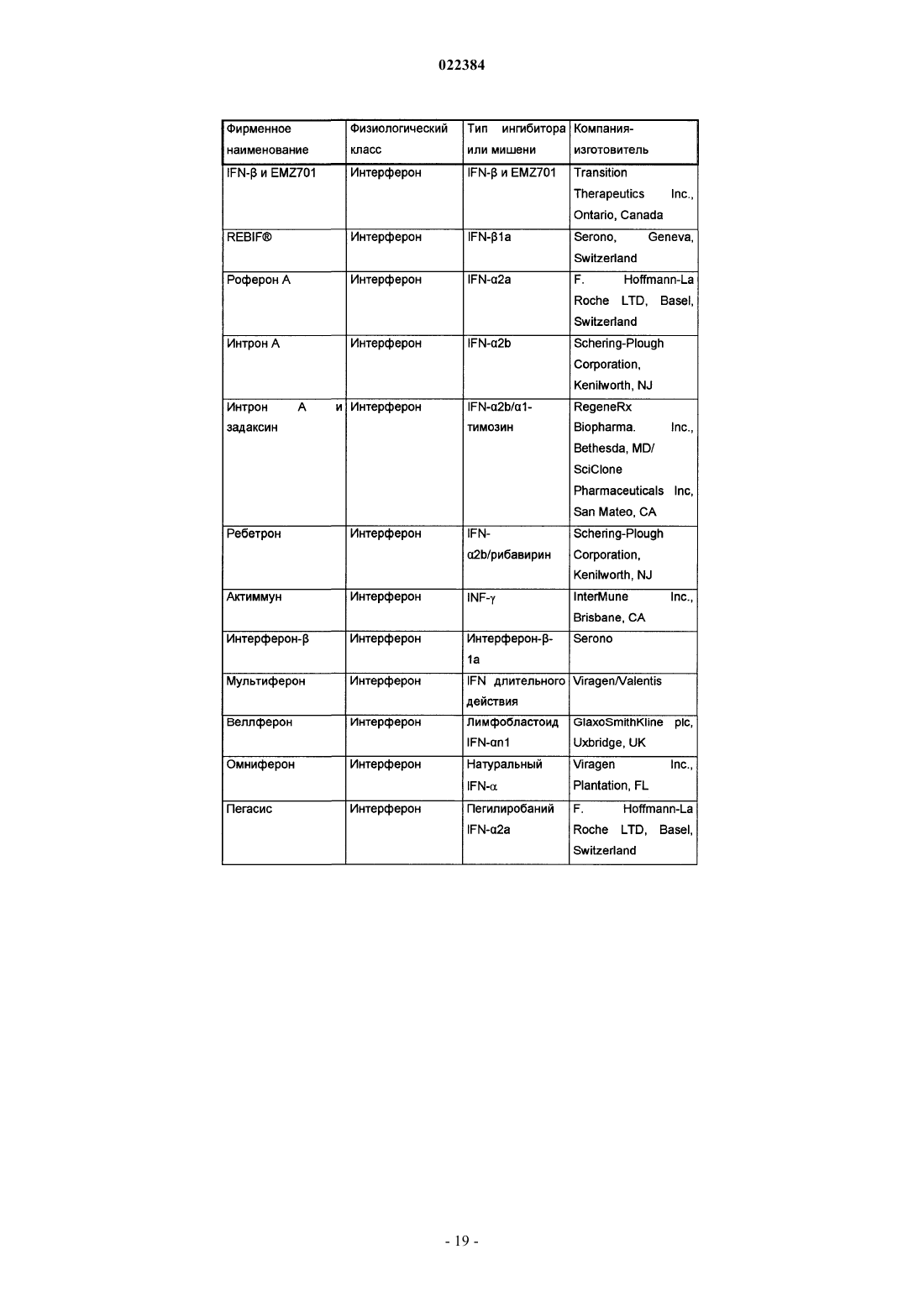
Ингибиторы вируса гепатита c
Номер патента: 22384
Опубликовано: 30.12.2015
Авторы: Кэдоу Джон Ф., Минвелл Николас А., Ван Гань, Бендер Джон А., Сюй Ниннин, Хевавасам Пиясена, Белема Маконен, Сент Лоран Дэнис Р., Лопез Омар Д., Ромин Джеффри Ли, Снайдер Лоуренс Б., Нгуен Ван Н.
Формула / Реферат
1. Соединение формулы (I)
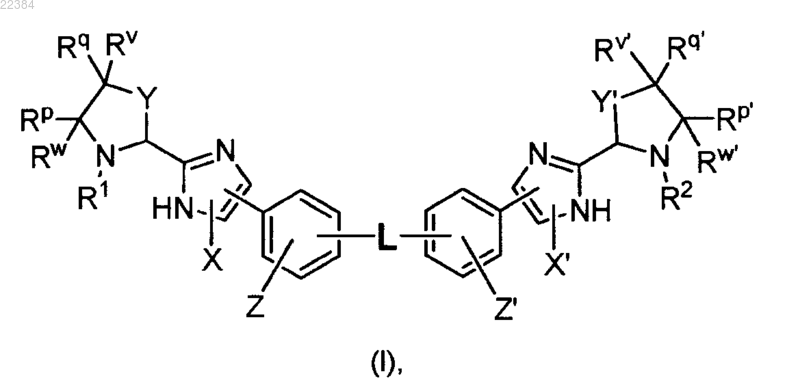
или его фармацевтически приемлемая соль, при этом в формуле (I)
L выбирают из -О-, -СН2СН2-, -СН=СН-, -ОСН2-, -CH2O-, -СН2ОСН2-

X означает водород (Н) или галоген, a
Z означает водород или
X и Z вместе с атомами углерода, с которыми они связаны, образуют 5-8-членное ароматическое кольцо или неароматическое сочлененное кольцо, не содержащее гетероатомов,
X' означает водород (Н) или галоген, a Z' означает водород или
X' и Z', вместе с атомами углерода, с которыми они связаны, образуют 5-8-членное ароматическое кольцо или неароматическое сочлененное кольцо, не содержащее гетероатомов,
Y и Y' каждый по отдельности означает -СН2-, -СН2СН2- или -CH2O-, при этом
-CH2O-содержит атом кислорода, связанный с атомом углерода, который замещен Rv и Rq или Rv' и Rq',
Rp означает водород или С1-С4алкил,
Rq означает водород, алкильную или галогруппу или
Rp и Rq вместе с атомами углерода, с которыми они связаны, образуют циклоалкильное кольцо,
Rv выбирают из водорода, алкильной, гало и гидроксильной группы или
Rv и Rq вместе с атомом углерода, с которым они связаны, образуют этилениловую группу,
Rp' означает водород или С1-С4алкил,
Rq' означает водород, алкильную или галогруппу или
Rp' и Rq' вместе с атомами углерода, с которыми они связаны, образуют циклоалкильное кольцо,
Rv' выбирают из водорода, алкильной, гало и гидроксильной группы или
Rv' и Rq' вместе с атомом углерода, с которым они связаны, образуют этилениловую группу,
Rw и Rw' независимо выбирают из водорода и алкила,
R1 означает водород или -C(O)Rx,
R2 означает водород или -C(O)Ry,
Rx и Ry независимо выбирают из алкоксильной и алкильной группы, при этом алкильная группа замещена одним или несколькими заместителями, независимо выбранными из арила, гетероциклила, -OR3 и -NRaRb,
R3 означает водород,
Ra и Rb независимо выбирают из водорода, алкила, -C(O)OR7, -C(O)NRcRd;
R7 означает алкил и
Rc и Rd независимо выбирают из водорода, алкила и циклоалкила;
при этом, если не указано иначе, алкил означает насыщенный углеводород с прямой или разветвленной цепью, который содержит от одного до десяти атомов углерода;
алкокси означает алкильную группу, связанную с основной молекулярной группой посредством атома кислорода;
арил означает ароматическую карбоциклическую группу, которая может быть моноциклической, бициклической или полициклической, где в бициклической или полициклической арильной группе ароматическое углеродное кольцо может быть сопряжено с другим 4-6-членным ароматическим или неароматическим углеродным кольцом;
циклоалкил означает насыщенную карбоциклическую группу, содержащую 3-8 атомов углерода;
гетероциклил означает моноциклическую, бициклическую или полициклическую группу, соединения, содержащие один-три гетероатома, независимо выбранных из азота, кислорода и серы.
2. Соединение по п.1, отличающееся тем, что оно имеет формулу (Ia)
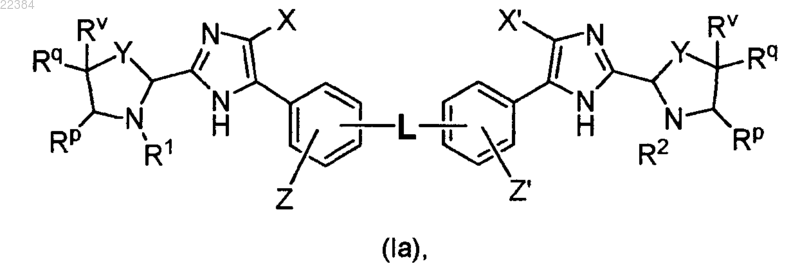
или его фармацевтически приемлемая соль, при этом в формуле (Ia)
X означает водород или хлор (Cl), a Z означает водород или
X и Z вместе с атомами углерода, с которыми они связаны, образуют 6-членное ароматическое или неароматическое сочлененное кольцо,
X' означает водород или хлор (Cl) и Z' означает водород или
X' и Z' вместе с атомами углерода, с которыми они связаны, образуют 6-членное ароматическое или неароматическое сочлененное кольцо,
Y означает -СН2-, -СН2СН2- или -CH2O-, при этом -CH2O- содержит атом кислорода, связанный с атомом углерода, который замещен на Rv и Rq,
Rp означает водород или С1-С4алкил,
Rq означает водород, алкильную или галогруппу или
Rp и Rq вместе с атомами углерода, с которыми они связаны, образуют циклоалкильное кольцо, и
Rv выбирают из водорода, алкильной, гало и гидроксильной группы или
Rv и Rq вместе с атомом углерода, с которым они связаны, образуют этилениловую группу.
3. Соединение по п.2, отличающееся тем, что оно имеет формулу (Ib)
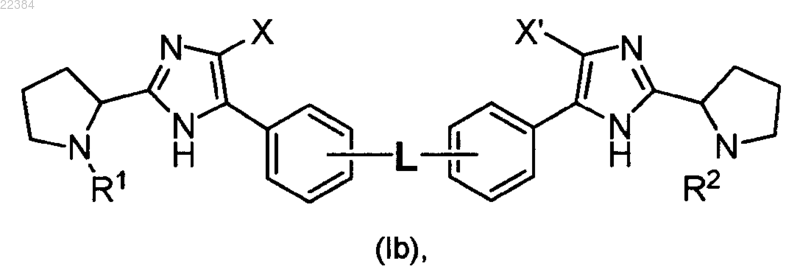
или его фармацевтически приемлемая соль.
4. Соединение по п.2, отличающееся тем, что оно имеет формулу (Ic)
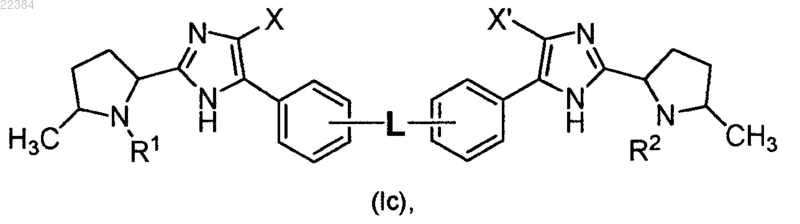
или его фармацевтически приемлемая соль.
5. Соединение по п.2, отличающееся тем, что оно имеет формулу (Id)
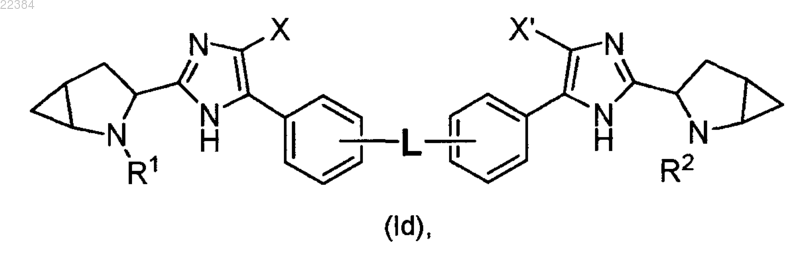
или его фармацевтически приемлемая соль.
6. Соединение по п.2 или его фармацевтически приемлемая соль, в котором
R1 означает -C(O)Rx;
R2 означает -C(O)Ry;
Rx и Ry независимо друг от друга означают алкил, замещенный по меньшей мере одним -NRaRb формулы (А)
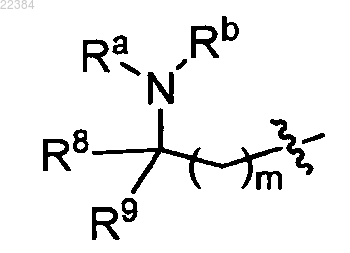
в которой
m означает 0 или 1,
R8 означает водород или алкил,
R9 выбирают из водорода, арила, гетероциклила и алкила, необязательно замещенного заместителем, выбранным из арила, гетероциклила-OR3, -NRaRb, и
R3, Ra, Rb имеют значения, указанные в п.1.
7. Соединение по п.6 или его фармацевтически приемлемая соль, в котором
m означает 0,
R8 означает водород или С1-С4алкил,
R9 выбирают из водорода, С1-С6алкила, необязательно замещенного -OR12,
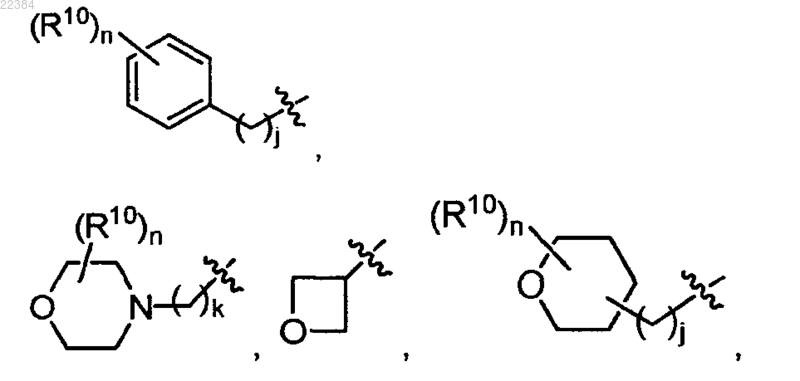
j означает 0 или 1,
k означает 1, 2 или 3,
n означает 0,
каждый R10 независимо означает водород,
R12 означает водород,
Ra означает водород или С1-С4алкил,
Rb означает С1-С4алкил, -C(O)OR7 или -C(O)NRcRd,
R7 означает C1-C4алкил,
Rc означает водород или С1-С4алкил и
Rd означает водород, С1-С4алкил или С3-С6циклоалкил.
8. Соединение по п.6 или его фармацевтически приемлемая соль, в котором m означает 0, R8 означает водород, R9 означает фенил.
9. Соединение по п.6 или его фармацевтически приемлемая соль, в котором
m обозначает 1,
R8 означает водород,
R9 означает C1-C6алкил, арилалкил или гетероарилалкил,
Ra означает водород и
Rb означает -C(O)OR7, при этом R7 означает С1-С6алкил.
10. Соединение по п.2 или его фармацевтически приемлемая соль, в котором R1 и R2 имеют одинаковое значение и выбраны из группы, включающей
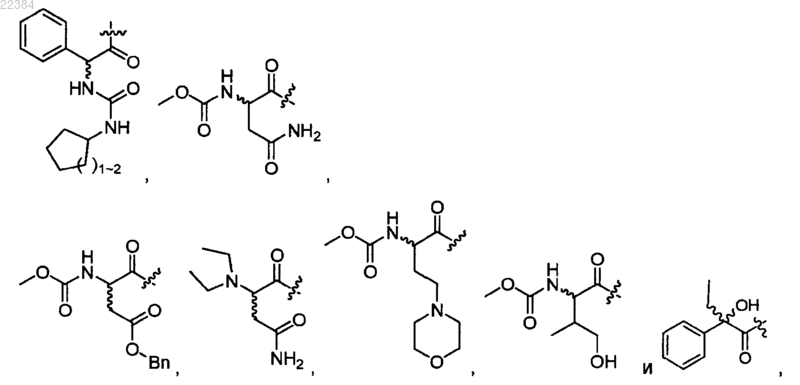 при этом обозначенная тильдами связь
при этом обозначенная тильдами связь в структуре указывает, что стереогенный центр, к которому присоединена связь, может иметь (R)- или (S)-конфигурацию при условии соблюдения принципов образования химических связей.
в структуре указывает, что стереогенный центр, к которому присоединена связь, может иметь (R)- или (S)-конфигурацию при условии соблюдения принципов образования химических связей.11. Соединение по п.1 или его фармацевтически приемлемая соль, в котором
R1 означает -C(O)Rx,
R2 означает -C(O)Ry и
Rx и Ry в обоих случаях означают t-бутоксильную группу.
12. Соединение по п.1 или его фармацевтически приемлемая соль, в котором R1 и R2 в обоих случаях означают водород.
13. Соединение формулы (II)
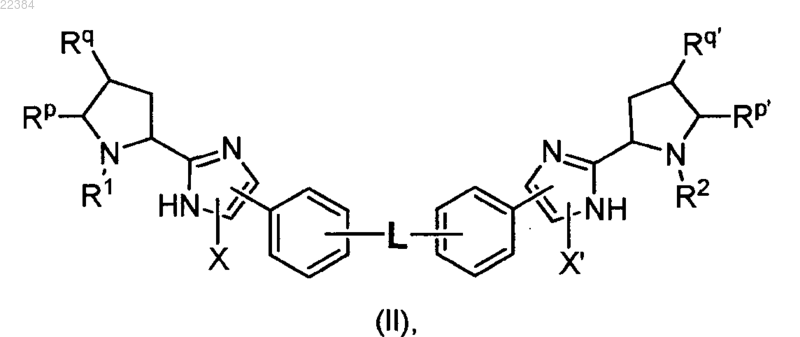
или его фармацевтически приемлемая соль, при этом в формуле (II)
L выбирают из -О-, -CH2CH2-, -CH=CH-, -OCH2-, -CH2O-, -CH2OCH2-,
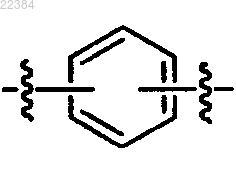 и
и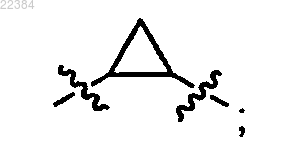
X и X' независимо означают водород (Н) или галоген,
Rp означает водород или C1-С4алкил, a
Rq означает водород или, в качестве альтернативы, Rp и Rq вместе с атомами углерода, с которыми они связаны, образуют циклопропильное кольцо,
Rp' означает водород или С1-С4алкил, a Rq' означает водород или, в качестве альтернативы, Rp' и Rq' вместе с атомами углерода, с которыми они связаны, образуют циклопропильное кольцо,
R1 означает водород или -C(O)Rx,
R2 означает водород или -C(O)Ry,
Rx и Ry независимо выбирают из алкоксильной и алкильной группы, при этом упомянутая алкильная группа замещена одним или несколькими заместителями, независимо выбранными из арила, гетероциклила, -OR3,
-NRaRb;
Ra и Rb независимо выбирают из водорода, алкила, -C(O)OR7, -C(O)NRcRd;
R3 означает водород,
R7 означает алкил и
Rc и Rd независимо выбирают из водорода, алкила или циклоалкила,
при этом, если не указано иначе, алкил означает насыщенный углеводород с прямой или разветвленной цепью, который содержит от одного до десяти атомов углерода;
алкокси означает алкильную группу, связанную с основной молекулярной группой посредством атома кислорода;
арил означает ароматическую карбоциклическую группу, которая может быть моноциклической, бициклической или полициклической, где в бициклической или полициклической арильной группе ароматическое углеродное кольцо может быть сопряжено с другим 4-6-членным ароматическим или неароматическим углеродным кольцом;
циклоалкил означает насыщенную карбоциклическую группу, содержащую 3-8 атомов углерода;
гетероциклил означает моноциклическую, бициклическую или полициклическую группу, соединения, содержащие один-три гетероатома, независимо выбранных из азота, кислорода и серы.
14. Соединение или его фармацевтически приемлемая соль, выбранная из группы, включающей
(1R)-2-((2S)-2-(4-(4-(4-(2-((2S)-1-((2R)-2-(диметиламино)-2-фенилацетил)-2-пирролидинил)-1Н-имидазол-5-ил)фенокси)фенил)-1Н-имидазол-2-ил)-1-пирролидинил)-N,N-диметил-2-оксо-1-фенилэтанамин,
(1R)-2-((2S)-2-(4-(4-(4-(2-((2S)-1-((2R)-2-гидрокси-2-фенилацетил)-2-пирролидинил)-1Н-имидазол-5-ил)фенокси)фенил)-1Н-имидазол-2-ил)-1-пирролидинил)-2-оксо-1-фенилэтанол,
диметил(оксибис(4,1-фенилен-1Н-имидазол-4,2-диил(2S)-2,1-пирролидиндиил((1R)-2-оксо-1-фенил-2,1-этандиил)))бискарбамат,
(1R)-2-((2S)-2-(4-(3-(4-(2-((2S)-1-((2R)-2-(диметиламино)-2-фенилацетил)-2-пирролидинил)-1Н-имидазол-4-ил)фенокси)фенил)-1Н-имидазол-2-ил)-1-пирролидинил)-N,N-диметил-2-оксо-1-фенилэтанамин,
(1R)-2-((2S)-2-(4-(3-(4-(2-((2S)-1-((2R)-2-гидрокси-2-фенилацетил)-2-пирролидинил)-1Н-имидазол-4-ил)фенокси)фенил)-1Н-имидазол-2-ил)-1-пирролидинил)-2-оксо-1-фенилэтанол,
метил((1R)-2-((2S)-2-(4-(3-(4-(2-((2S)-1-((2R)-2-((метоксикарбонил)амино)-2-фенилацетил)-2-пирролидинил)-1Н-имидазол-4-ил)фенокси)фенил)-1Н-имидазол-2-ил)-1-пирролидинил)-2-оксо-1-фенилэтил)карбамат,
(1R)-2-((2S)-2-(4-(4-((4-(2-((2S)-1-((2R)-2-(диметиламино)-2-фенилацетил)-2-пирролидинил)-1Н-имидазол-4-ил)бензил)окси)фенил)-1Н-имидазол-2-ил)-1-пирролидинил)-N,N-диметил-2-оксо-1-фенилэтанамин,
метил((1R)-2-((2S)-2-(4-(4-((4-(2-((2S)-1-((2R)-2-((метоксикарбонил)амино)-2-фенилацетил)-2-пирролидинил)-1Н-имидазол-4-ил)бензил)окси)фенил)-1Н-имидазол-2-ил)-1-пирролидинил)-2-оксо-1-фенилэтил)карбамат,
(1R)-2-((2S)-2-(4-(4-(2-(4-(2-((2S)-1-((2R)-2-(диметиламино)-2-фенилацетил)-2-пирролидинил)-1Н-имидазол-5-ил)фенил)этил)фенил)-1Н-имидазол-2-ил)-1-пирролидинил)-N,N-диметил-2-оксо-1-фенилэтанамин,
(1R,1'R)-2,2'-(1,2-этандиилбис(4,1-фенилен-1Н-имидазол-4,2-диил(2S)-2,1-пирролидиндиил))бис(2-оксо-1-фенилэтанол),
диметил(1,2-этандиилбис(4,1-фенилен-1Н-имидазол-4,2-диил(2S)-2,1-пирролидиндиил((1R)-2-оксо-1-фенил-2,1-этандиил)))бискарбамат,
N',N'"-(1,2-этандиилбис(4,1-фенилен-1Н-имидазол-4,2-диил(2S)-2,1-пирролидиндиил((1R)-2-оксо-1-фенил-2,1-этандиил)))бис(1-этилмочевину);
1-циклопентил-3-((1R)-2-((2S)-2-(4-(4-(2-(4-(2-((2S)-1-((2R)-2-((циклопентилкарбамоил)амино)-2-фенилацетил)-2-пирролидинил)-1Н-имидазол-5-ил)фенил)этил)фенил)-1Н-имидазол-2-ил)-1-пирролидинил)-2-оксо-1-фенилэтил)мочевину,
(1R)-2-((2S)-2-(4-(4-(((4-(2-((2S)-1-((2R)-2-(диметиламино)-2-фенилацетил)-2-пирролидинил)-1Н-имидазол-5-ил)бензил)окси)метил)фенил)-1Н-имидазол-2-ил)-1-пирролидинил)-N,N-диметил-2-оксо-1-фенилэтанамин,
(1R)-2-((2S)-2-(4-(4-(((4-(2-((2S)-1-((2R)-2-гидрокси-2-фенилацетил)-2-пирролидинил)-1Н-имидазол-5-ил)бензил)окси)метил)фенил)-1Н-имидазол-2-ил)-1-пирролидинил)-2-оксо-1-фенилэтанол,
диметил(оксибис(метилен-4,1-фенилен-1Н-имидазол-4,2-диил(2S)-2,1-пирролидиндиил((1R)-2-оксо-1-фенил-2,1-этандиил)))бискарбамат,
1-метил-3-((1R)-2-((2S)-2-(4-(4-(((4-(2-((2S)-1-((2R)-2-((метилкарбамоил)амино)-2-фенилацетил)-2-пирролидинил)-1Н-имидазол-5-ил)бензил)окси)метил)фенил)-1Н-имидазол-2-ил)-1-пирролидинил)-2-оксо-1-фенилэтил)мочевину,
1-этил-3-((1R)-2-((2S)-2-(4-(4-(((4-(2-((2S)-1-((2R)-2-((этилкарбамоил)амино)-2-фенилацетил)-2-пирролидинил)-1Н-имидазол-5-ил)бензил)окси)метил)фенил)-1Н-имидазол-2-ил)-1-пирролидинил)-2-оксо-1-фенилэтил)мочевину,
1-циклопентил-3-((1R)-2-((2S)-2-(4-(4-(((4-(2-((2S)-1-((2R)-2-((циклопентилкарбамоил)амино)-2-фенилацетил)-2-пирролидинил)-1Н-имидазол-5-ил)бензил)окси)метил)фенил)-1Н-имидазол-2-ил)-1-пирролидинил)-2-оксо-1-фенилэтил)мочевину,
((1R)-2-((2S)-2-(4-(3-(((4-(2-((2S)-1-((2R)-2-(диметиламино)-2-фенилацетил)-2-пирролидинил)-1Н-имидазол-4-ил)бензил)окси)метил)фенил)-1Н-имидазол-2-ил)-1-пирролидинил)-N,N-диметил-2-оксо-1-фенилэтанамин,
(1R)-2-((2S)-2-(4-(3-(((4-(2-((2S)-1-((2R)-2-гидрокси-2-фенилацетил)-2-пирролидинил)-1Н-имидазол-4-ил)бензил)окси)метил)фенил)-1Н-имидазол-2-ил)-1-пирролидинил)-2-оксо-1-фенилэтанол,
(метил((1R)-2-((2S)-2-(4-(3-(((4-(2-((2S)-1-((2R)-2-((метоксикарбонил)амино)-2-фенилацетил)-2-пирролидинил)-1Н-имидазол-4-ил)бензил)окси)метил)фенил)-1Н-имидазол-2-ил)-1-пирролидинил)-2-оксо-1-фенилэтил)карбамат,
1-метил-3-((1R)-2-((2S)-2-(4-(3-(((4-(2-((2S)-1-((2R)-2-((метилкарбамоил)амино)-2-фенилацетил)-2-пирролидинил)-1Н-имидазол-4-ил)бензил)окси)метил)фенил)-1Н-имидазол-2-ил)-1-пирролидинил)-2-оксо-1-фенилэтил)мочевину,
1-этил-3-((1R)-2-((2S)-2-(4-(3-(((4-(2-((2S)-1-((2R)-2-((этилкарбамоил)амино)-2-фенилацетил)-2-пирролидинил)-1Н-имидазол-4-ил)бензил)окси)метил)фенил)-1Н-имидазол-2-ил)-1-пирролидинил)-2-оксо-1-фенилэтил)мочевину,
1-циклопентил-3-((1R)-2-((2S)-2-(4-(3-(((4-(2-((2S)-1-((2R)-2-((циклопентилкарбамоил)амино)-2-фенилацетил)-2-пирролидинил)-1Н-имидазол-4-ил)бензил)окси)метил)фенил)-1Н-имидазол-2-ил)-1-пирролидинил)-2-оксо-1-фенилэтил)мочевину,
диметил(1,1':4',1"-терфенил-4,4"-диилбис(1Н-имидазол-4,2-диил(2S)-2,1-пирролидиндиил((1R)-2-оксо-1-фенил-2,1-этандиил)))бискарбамат,
(1R)-2-((2S)-2-(4-(4"-(2-((2S)-1-((2R)-2-(диметиламино)-2-фенилацетил)-2-пирролидинил)-1Н-имидазол-5-ил)-1,1':4',1"-терфенил-4-ил)-1Н-имидазол-2-ил)-1-пирролидинил)-N,N-диметил-2-оксо-1-фенилэтанамин,
метил((1S)-1-(((1R,3S,5R)-3-(4-(4-((1S,2S)-2-(4-(2-((1R,3S,5R)-2-((2S)-2-((метоксикарбонил)амино)-3-метилбутаноил)-2-азабицикло[3,1,0]гекс-3-ил)-1Н-имидазол-4-ил)фенил)циклопропил)фенил)-1Н-имидазол-2-ил)-2-азабицикло[3,1,0]гекс-2-ил)карбонил)-2-метилпропил)карбамат,
диметил((1S,2S)-1,2-циклопропандиилбис(4,1-фенилен-1Н-имидазол-4,2-диил(1R,3S,5R)-2-азабицикло[3,1,0]гексан-3,2-диил((1S)-2-оксо-1-(тетрагидро-2Н-пиран-4-ил)-2,1-этандиил)))бискарбамат,
метил((1S)-1-(((1R,3S,5R)-3-(4-(4-((1R,2R)-2-(4-(2-((1R,3S,5R)-2-((2S)-2-((метоксикарбонил)амино)-3-метилбутаноил)-2-азабицикло[3,1,0]гекс-3-ил)-1Н-имидазол-4-ил)фенил)циклопропил)фенил)-1Н-имидазол-2-ил)-2-азабицикло[3,1,0]гекс-2-ил)карбонил)-2-метилпропил)карбамат,
диметил((1R,2R)-1,2-циклопропандиилбис(4,1-фенилен-1H-имидазол-4,2-диил(1R,3S,5R)-2-азабицикло[3,1,0]гексан-3,2-диил((1S)-2-оксо-1-(тетрагидро-2Н-пиран-4-ил)-2,1-этандиил)))бискарбамат,
метил((1S)-1-(((2S,4S)-2-(4-(4-((1S,2S)-2-(4-(2-((2S,4S)-1-((2S)-2-((метоксикарбонил)амино)-3-метилбутаноил)-4-метил-2-пирролидинил)-1Н-имидазол-4-ил)фенил)циклопропил)фенил)-1Н-имидазол-2-ил)-4-метил-1-пирролидинил)карбонил)-2-метилпропил)карбамат,
метил((1S)-1-(((1R,3S,5R)-3-(4-(4-((E)-2-(4-(2-((1R,3S,5R)-2-((2S)-2-((метоксикарбонил)амино)-3-метилбутаноил)-2-азабицикло[3,1,0]гекс-3-ил)-1Н-имидазол-4-ил)фенил)винил)фенил)-1Н-имидазол-2-ил)-2-азабицикло[3,1,0]гекс-2-ил)карбонил)-2-метилпропил)карбамат,
диметил((Е)-1,2-этендиилбис(4,1-фенилен-1Н-имидазол-4,2-диил(1R,3S,5R)-2-азабицикло[3,1,0]гексан-3,2-диил((1S)-2-оксо-1-(тетрагидро-2Н-пиран-4-ил)-2,1-этандиил)))бискарбамат,
метил((1S)-2-((1R,3S,5R)-3-(4-(4-((E)-2-(4-(2-((1R,3S,5R)-2-((2S)-2-((метоксикарбонил)амино)-3-метилбутаноил)-2-азабицикло[3,1,0]гекс-3-ил)-1Н-имидазол-4-ил)фенил)винил)фенил)-1Н-имидазол-2-ил)-2-азабицикло[3,1,0] гекс-2-ил)-2-оксо-1-(тетрагидро-2Н-пиран-4-ил)этил)карбамат,
диметил((1S,2S)-1,2-циклопропандиилбис(4,1-фенилен-1Н-имидазол-4,2-диил((2S,4S)-4-метил-2,1-пирролидиндиил)((1S)-2-оксо-1-(тетрагидро-2Н-пиран-4-ил)-2,1-этандиил)))бискарбамат,
метил((1S)-1-(((2S)-2-(4-(4'-((4-(2-((2S)-1-((2S)-2-((метоксикарбонил)амино)-3-метилбутаноил)-2-пирролидинил)-1Н-имидазол-4-ил)фенил)этинил)-4-бифенилил)-1Н-имидазол-2-ил)-1-пирролидинил)карбонил)-2-метилпропил)карбамат и их соответствующие стереоизомеры и таутомеры.
15. Фармацевтическая композиция для ингибирования функции белка NS5A, содержащая соединение по п.1 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
16. Способ лечения инфицированного вирусом гепатита С пациента, в котором пациенту вводят терапевтически эффективное количество соединения по п.1 или его фармацевтически приемлемую соль.
Текст
ИНГИБИТОРЫ ВИРУСА ГЕПАТИТА C Изобретение относится к новым соединениям формулы (I), где все заместители раскрыты в формуле изобретения, и композициям, содержащим такие соединения. Эти соединения являются эффективными противовирусными средствами, в особенности, в качестве ингибиторов функции белка NS5A, кодированного вирусом гепатита С (ВГС). Описан способ лечения связанных с ВГС заболеваний или состояний путем применения этих соединений или композиций, содержащих такие соединения. Бендер Джон А., Хевавасам Пиясена,Кэдоу Джон Ф., Лопез Омар Д.,Минвелл Николас А., Нгуен Ван Н.,Ромин Джеффри Ли, Снайдер Лоуренс Б., Сент Лоран Дэнис Р., Ван Ган, Сюй Ниннин, Белема Маконен (US) Угрюмов В.М. (RU) Перекрестная ссылка на родственные заявки Настоящая заявка испрашивает приоритет по предварительной заявке США 61/164531, поданной 30 марта 2009 г. Область техники Настоящее изобретение относится в целом к противовирусным соединениям, более точно, к соединениям, способным ингибировать функцию белка NS5A, кодируемого вирусом гепатита С (ВГС), композициям, содержащим такие соединения, и способам ингибирования функции белка NS5A. Уровень техники ВГС является одним из основных патогенов человека, которым инфицировано приблизительно 170 миллионов человек в мире, что примерно в 5 раз превышает число инфицированных вирусом иммунодефицита человека 1 типа. У значительной части индивидов, инфицированных ВГС, развиваются серьезное прогрессирующее заболевание печени, включая цирроз и гепатоцеллюлярную карциному. Существующие способы лечения ВГС с применением комбинации пегилированного интерферона и рибавирина не обеспечивают оптимальную долю успешных попыток достижения устойчивой противовирусной реакции и вызывают множество побочных эффектов. Соответственно, существует ясная и давно назревшая потребность в разработке эффективных терапий для решения этой медицинской задачи. ВГС является РНКвирусом с плюс-цепью. В результате сравнения выведенной аминокислотной последовательности и обнаружения значительного сходства в 5'-нетранслируемой области ВГС был отнесен к отдельной разновидности семейства Flaviviridae. Все члены семейства Flaviviridae имеют оболочечные вирионы, которые содержат РНК-геном с плюс-цепью, кодирующий все известные вирусоспецифические белки посредством трансляции единой непрерывной открытой рамки считывания. В геноме ВГС обнаружена значительная гетерогенность нуклеотида и кодированной аминокислотной последовательности вследствие высокой частоты повторения ошибок кодированной РНК-зависимой РНК-полимеразы, которая не обладает способностью к исправлению ошибок. Описано по меньшей мере шесть основных генотипов и более 50 подтипов, распространенных по всему миру. Генетическая гетерогенность ВГС клинически проявляется в форме предрасположенности к мутациям, возникающим при проведении монотерапии, в связи с чем желательны дополнительные варианты лечения. Остается неясным возможное модулирующее воздействие генотипов на патогенез и терапию. Образованный РНК с плюс-цепью геном ВГС состоит приблизительно из 9500 нуклеотидов и имеет единую открытую рамку считывания (ОРС), которая кодирует единый длинноцепочечный полипептид длиной около 3000 аминокислот. В инфицированных клетках этот полипротеин расщепляется на множестве сайтов клеточными и вирусными протеазами, в результате чего образуются структурированные и неструктурированные (NS) белки. В случае ВГС на образование зрелых неструктурированных белков(NS2, NS3, NS4A, NS4B, NS5A и NS5B) влияют две вирусные протеазы. Предполагается, что первой из них является металлопротеаза, которая отвечает за расщепление в месте соединения NS2-NS3, а второй является серин-протеаза, содержащаяся NS3 в N-концевой области (также называемая в изобретении протеазой NS3) и являющаяся промежуточным звеном всех последующих расщеплений после NS, как в цис-положении в сайте расщепления NS3-NS4A, так и в транс-положениях в остальных сайтах расщепления NS4A-NS4B, NS4B-NS5A, NS5A-NS5B. Вероятно, белок NS4A выполняет множество функций,действуя в качестве кофактора протеазы NS3, а также способствуя локализации мембран NS3 и других компонентов вирусной репликазы. Для обеспечения соответствующей активности протеазы необходимо образование комплекса NS3-NS4A, в результате чего повышается протеолитическая эффективность расщепления. Белок NS3 также обладает нуклеозидтрифосфатазной и РНК-хеликазной активностью. БелокNS5B (также называемый в изобретении полимеразой ВГС) представляет собой РНК-зависимую РНКполимеразу, которая вместе с другими белками, включая NS5A, участвует в репликации ВГС в репликазном компексе. Для лечения инфицированных ВГС пациентов необходимы соединения, которые избирательно ингибируют репликацию вируса ВГС. В частности, необходимы соединения, способные ингибировать функцию белка NS5A. Содержащийся в ВГС белок NS5A описан, например, в следующих документах: S.L. Tan и др., Virology, 284:1-12 (2001); K.-J. Park и др., J. Biol. Chem., 30711-30718 (2003); Т. L. Tellinghuisen, и др., Nature, 435, 374 (2005); R. A. Love и др., J. Virol, 83, 4395 (2009); N. Appel и др., J. Biol. Chem.,281, 9833 (2006); L. Huang, J. Biol. Chem., 280, 36417 (2005); С Rice и др., WO 2006093867. В настоящем изобретении предложены избирательно ингибирующие репликацию вируса ВГС соединения формулы (I) или их фармацевтически приемлемая соль, при этом в упомянутой формуле (I):X означает водород (Н) или галоген, a Z означает водород или X и Z вместе с атомами углерода, с которыми они связаны, образуют 5-8-членное ароматическое кольцо или неароматическое сочлененное кольцо, не содержащее гетероатомов,X' означает водород (Н) или галоген, a Z' означает водород или X' и Z', вместе с атомами углерода, с которыми они связаны, образуют 5-8-членное ароматическое кольцо или неароматическое сочлененное кольцо, не содержащее гетероатомов,Y и Y' каждый по отдельности означает -СН 2-, -СН 2 СН 2- или -CH2O-, при этом -СН 2O- содержит атом кислорода, связанный с атомом углерода, который замещен Rv и Rq или Rv' Rq', Rp означает водород или С 1-С 4 алкил, Rq означает водород, алкильную или гало группу или Rp и Rq вместе с атомами углерода, с которыми они связаны, образуют циклоалкильное кольцо,Rv выбирают из водорода, алкильной, гало и гидроксильной группы или Rv и Rq вместе с атомом углерода, с которым они связаны, образуют этилениловую группу,Rp' означает водород или С 1-С 4 алкил, Rq' означает водород, алкильную или галогруппу илиRv' и Rq' вместе с атомом углерода, с которым они связаны, образуют этилениловую группу,Rw и Rw' независимо выбирают из водорода и алкила,R1 означает водород или -C(O)Rx,R2 означает водород или -C(O)Ry,Rx и Ry независимо выбирают из алкоксильной и алкильной группы, при этом алкильная группа замещена одним или несколькими заместителями, независимо выбранными из арила, гетероциклила, -OR3,-и NRaRb,R3 означает водород,Ra и Rb независимо выбирают из водорода, алкила, -C(O)OR7, -C(O)NRcRd;Rc и Rd независимо выбирают из водорода, алкила и циклоалкила; при этом, если не указано иначе, алкил означает насыщенный углеводород с прямой или разветвленной цепью, который содержит от одного до десяти атомов углерода; алкокси означает алкильную группу, связанную с основной молекулярной группой посредством атома кислорода; арил означает ароматическую карбоциклическую группу, которая может быть моноциклической,бициклической или полициклической, где в бициклической или полициклической арильной группе ароматическое углеродное кольцо может быть сопряжено с другим 4-6-членным ароматическим или неароматическим углеродным кольцом; циклоалкил означает насыщенную карбоциклическую группу, содержащую 3-8 атомов углерода; гетероциклил означает моноциклическую, бициклическую или полициклическую группу соединения, содержащую один-три гетероатома, независимо выбранных из азота, кислорода и серы. Согласно первому варианту осуществления первого аспекта настоящего изобретения предложено соединение формулы (I), дополнительно отличающееся тем, что имеет формулу (Ia) или его фармацевтически приемлемая соль, при этом в упомянутой формуле (Ia)X означает водород или хлор (Cl), a Z означает водород илиX и Z вместе с атомами углерода, с которыми они связаны, образуют 6-членное ароматическое или неароматическое сочлененное кольцо,X' означает водород или хлор (Cl) и Z' означает водород илиX' и Z' вместе с атомами углерода, с которыми они связаны, образуют 6-членное ароматическое или неароматическое сочлененное кольцо,Y означает -СН 2-, -СН 2 СН 2- или -CH2O-, при этом -CH2O- содержит атом кислорода, связанный с атомом углерода, который замещен на Rv и Rq,Rp означает водород или С 1-С 4 алкил,Rq означает водород, алкильную или галогруппу илиRv и Rq вместе с атомом углерода, с которым они связаны, образуют этилениловую группу. Согласно второму варианту осуществления первого аспекта настоящего изобретения предложено соединение формулы (I), отличающееся тем, что имеет формулу (Ib) или его фармацевтически приемлемая соль. Согласно третьему варианту осуществления первого аспекта настоящего изобретения предложено соединение формулы (I), отличающееся тем, что имеет формулу (Ic) или его фармацевтически приемлемая соль. Согласно четвертому варианту осуществления первого аспекта настоящего изобретения предложено соединение формулы (I), отличающееся тем, что имеет формулу (Id) или его фармацевтически приемлемая соль. Согласно пятому варианту осуществления первого аспекта настоящего изобретения предложено соединение формулы (Ia) или его фармацевтически приемлемая соль, при этом в упомянутой формуле (Ia)Rx и Ry независимо друг от друга означают алкил, замещенный по меньшей мере одним -NRaRb формулы (А)m означает 0 или 1,R8 означает водород или алкил,R9 выбирают из водорода, арила, гетероциклила и алкила, необязательно замещенного заместителем, выбранным из арила, гетероциклила-OR3, -NRaRb, иR3, Ra, Rb имеют значения, указанные в формуле (I). Согласно шестому варианту осуществления первого аспекта настоящего изобретения предложено соединение формулы (Ia) или его фармацевтически приемлемая соль, при этом в упомянутой формуле (Ia)m означает 0,R8 означает водород или С 1-С 4 алкил,R9 выбирают из водорода, С 1-С 6 алкила, необязательно замещенного -OR12,j означает 0 или 1,k означает 1, 2 или 3,n означает 0,каждый R10 независимо означает водород,R12 означает водород,Ra означает водород или С 1-С 4 алкил,Rb означает C1-C4 алкил, -C(O)OR7 или -C(O)NRcRd,R7 означает С 1-С 4 алкил,Rc означает водород или С 1-С 4 алкил иRd означает водород, С 1-С 4 алкил или С 3-С 6 циклоалкил. Согласно седьмому варианту осуществления первого аспекта настоящего изобретения предложено соединение формулы (Ia) или его фармацевтически приемлемая соль, при этом в упомянутой формулеm означает 0,R8 означает водород,R9 означает фенил. Соединение или его фармацевтически приемлемая соль, в которомRb означает -C(O)OR7, при этом R7 означает С 1-С 6 алкил. Согласно восьмому варианту осуществления первого аспекта настоящего изобретения предложено соединение формулы (Ia) или его фармацевтически приемлемая соль, при этом в упомянутой формуле(Ia) R1 и R2 имеют одинаковое значение и выбраны из группы, включающей при этом обозначенная тильдами связь в структуре указывает, что стереогенный центр, к которому присоединена связь, может иметь (R)- или (S)-конфигурацию при условии соблюдения принципов образования химических связей. Согласно десятому варианту осуществления первого аспекта настоящего изобретения предложено соединение формулы (Ia) или его фармацевтически приемлемая соль,при этом в упомянутой формуле (Ia) R1 означает -C(O)Rx, R2 означает -C(O)Ry,Rx и Ry в обоих случаях означают t-бутоксильную группу. Согласно следующему варианту осуществления первого аспекта настоящего изобретения предложено соединение формулы (I) или его фармацевтически приемлемая соль, при этом в упомянутой формуле (I) R1 и R2 в обоих случаях означают водород. Во втором аспекте настоящего изобретения предложено соединение формулы (II) или его фармацевтически приемлемая соль, при этом в упомянутой формуле (II) L выбирают из -О-,-СН 2 СН 2-, -СН=СН-, -ОСН 2-, -CH2O-, -CH2OCH2X и X' независимо означают водород (Н) или галоген,Rp означает водород или С 1-С 4 алкил, a Rq означает водород или, в качестве альтернативы, Rp и Rq вместе с атомами углерода, с которыми они связаны, образуют циклопропильное кольцо,Rp' означает водород или С 1-С 4 алкил, a Rq' означает водород или, в качестве альтернативы, Rp' и Rq' вместе с атомами углерода, с которыми они связаны, образуют циклопропильное кольцо,R1 означает водород или -C(O)Rx,R2 означает водород или -C(O)Ry,Rx и Ry независимо выбирают из алкоксильной и алкильной группы, при этом упомянутая алкильная группа замещена одним или несколькими заместителями, независимо выбранными из арила, гетероциклила, -OR3, -NRaRb,Ra и Rb независимо выбирают из водорода, алкила, -C(O)OR7, -C(O)NRcRd;Rc и Rd независимо выбирают из водорода, алкила или циклоалкила,при этом, если не указано иначе, алкил означает насыщенный углеводород с прямой или разветвленной цепью, который содержит от одного до десяти атомов углерода; алкокси означает алкильную группу, связанную с основной молекулярной группой посредством атома кислорода; арил означает ароматическую карбоциклическую группу, которая может быть моноциклической,бициклической или полициклической, где в бициклической или полициклической арильной группе ароматическое углеродное кольцо может быть сопряжено с другим 4-6-членным ароматическим или неароматическим углеродным кольцом; циклоалкил означает насыщенную карбоциклическую группу, содержащую 3-8 атомов углерода; гетероциклил означает моноциклическую, бициклическую или полициклическую группу, соединения, содержащую один-три гетероатома, независимо выбранных из азота, кислорода и серы. Соединение по изобретению или его фармацевтически приемлемая соль могут быть выбраны из группы, включающей метилбутаноил)-2-азабицикло[3,1,0]гекс-3-ил)-1 Н-имидазол-4-ил)фенил)винил)фенил)-1 Н-имидазол-2 ил)-2-азабицикло[3,1,0]гекс-2-ил)карбонил)-2-метилпропил)карбамат,диметилЕ)-1,2-этендиилбис(4,1-фенилен-1 Н-имидазол-4,2-диил(1R,3S,5R)-2-азабицикло[3,1,0]гексан-3,2-диил 1S)-2-оксо-1-(тетрагидро-2 Н-пиран-4-ил)-2,1-этандиилбискарбамат,метил 1S)-2-1R,3S,5R)-3-(4-(4-Е)-2-(4-(2-1R,3S,5R)-2-2S)-2-метоксикарбонил)амино)-3 метилбутаноил)-2-азабицикло[3,1,0]гекс-3-ил)-1 Н-имидазол-4-ил)фенил)винил)фенил)-1 Н-имидазол-2 ил)-2-азабицикло[3,1,0]гекс-2-ил)-2-оксо-1-(тетрагидро-2 Н-пиран-4-ил)этил)карбамат,диметил 1S,2S)-1,2-циклопропандиилбис(4,1-фенилен-1 Н-имидазол-4,2-диил 2S,4S)-4-метил-2,1 пирролидиндиил)1S)-2-оксо-1-(тетрагидро-2 Н-пиран-4-ил)-2,1-этандиилбискарбамат,метил 1S)-1-2S)-2-(4-(4'-4-(2-2S)-1-2S)-2-метоксикарбонил)амино)-3-метилбутаноил)-2 пирролидинил)-1 Н-имидазол-4-ил)фенил)этинил)-4-бифенилил)-1 Н-имидазол-2-ил)-1-пирролидинил)карбонил)-2-метилпропил)карбамат и их соответствующие стереоизомеры. В третьем аспекте настоящего изобретения предложена композиция, содержащая соединение формулы (I) или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель, при этом формулой (I) является формула согласно любому из описанных выше вариантов осуществления первого аспекта настоящего изобретения. Согласно первому варианту осуществления третьего аспекта композиция дополнительно содержит по меньшей мере одно дополнительное соединение, обладающее активностью против ВГС. Согласно второму варианту осуществления третьего аспекта по меньшей мере одним из дополнительных соединений является интерферон или рибавирин. Согласно третьему варианту третьего аспекта интерферон выбирают из интерферона альфа-2b, пегилированного интерферона альфа, консенсусного интерферона, интерферона альфа-2 а и лимфобластоидного интерферона тау. Согласно четвертому варианту осуществления третьего аспекта настоящего изобретения предложена композиция, содержащая соединение формулы (I) или его фармацевтически приемлемую соль, фармацевтически приемлемый носитель и по меньшей мере одно дополнительное соединение, обладающее активностью против ВГС, при этом по меньшей мере одно из дополнительных соединений выбирают из интерлейкина 2, интерлейкина 6, интерлейкина 12, соединения, способствующего развитию иммунной реакции 1 типа на Т-клеткихелперы, интерферирующей РНК, антисмысловой РНК, имиквимода, рибавирина, ингибитора инозин-5'монофосфат-дегидрогеназы, амантадина и римантадина. Согласно пятому варианту осуществления третьего аспекта настоящего изобретения предложена композиция, содержащая соединение формулы (I) или его фармацевтически приемлемую соль, фармацевтически приемлемый носитель и по меньшей мере одно дополнительное соединение, обладающее активностью против ВГС, при этом по меньшей мере одно из дополнительных соединений способно ингибировать функцию мишени, выбранной из металлопротеазы ВГС, серин-протеазы ВГС, полимеразы ВГС, хеликазы ВГС, белка NS4B ВГС, входных ворот ВГС, структуры ВГС, выходных ворот ВГС, белкаNS5A ВГС и IMPDH, с целью лечения инфицирования ВГС. В четвертом аспекте настоящего изобретения предложен способ лечения инфицированного ВГС пациента, в котором вводят пациенту терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли, при этом упомянутая формула (I) означает формулу согласно любому из описанных выше вариантов осуществления первого аспекта настоящего изобретения. Согласно первому варианту осуществления четвертого аспекта при осуществлении способа дополнительно вводят по меньшей мере одно дополнительное соединение, обладающее активностью против ВГС, до, после или одновременно с введением соединения формулы (I) или его фармацевтически приемлемой соли. Согласно второму варианту осуществления четвертого аспекта по меньшей мере одним из дополнительных соединений является интерферон или рибавирин. Согласно третьему варианту четвертого аспекта интерферон выбирают из интерферона альфа-2b, пегилированного интерферона альфа, консенсусного интерферона, интерферона альфа-2 а и лимфобластоидного интерферона тау. Согласно четвертому варианту осуществления четвертого аспекта настоящего изобретения предложен способ лечения инфицированного ВГС пациента, в котором вводят пациенту терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли и по меньшей мере одно дополнительное соединение, обладающей активностью против ВГС, до, после или одновременно с введением соединения формулы (I) или его фармацевтически приемлемой соли, при этом в упомянутой формуле (I) по меньшей мере одно из дополнительных соединений выбирают из интерлейкина 2, интерлейкина 6, интерлейкина 12, соединения, способствующего развитию иммунной реакции 1 типа на Т-клетки-хелперы,интерферирующей РНК, антисмысловой РНК, имиквимода, рибавирина, ингибитора инозин-5'монофосфат-дегидрогеназы, амантадина и римантадина. Согласно пятому варианту осуществления четвертого аспекта настоящего изобретения предложен способ лечения инфицированного ВГС пациента, в котором вводят пациенту терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли и по меньшей мере одно дополнительное соединение, обладающее активностью против ВГС, до, после или одновременно с введением соединения формулы (I) или его фармацевтически приемлемой соли, при этом в упомянутой формуле (I) по меньшей мере одно из дополнительных соединений способно ингибировать функцию мишени, выбранной из металлопротеазы ВГС, серин-протеазы ВГС, полимеразы ВГС, хеликазы ВГС,белка NS4B ВГС, входных ворот ВГС, структуры ВГС, выходных ворот ВГС, белка NS5A ВГС иIMPDH, с целью лечения инфицирования ВГС. Предложенные в настоящем изобретении соединения способны ингибировать функцию белка NS5A ВГС. В частности, предложенные в настоящем изобретении соединения способны ингибировать генотип 1b ВГС или множество генотипов ВГС. Соответственно, настоящее изобретение также относится к: (1) композициям, содержащим соединение формулы (I) или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель, и (2) способу лечения инфицированного ВГС пациента, в котором вводят пациенту терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли. Другие аспекты настоящего изобретения могут предусматривать соответствующие комбинации описанных в изобретении вариантов осуществления. В следующем далее описании также могут быть раскрыты иные аспекты и варианты осуществления изобретения. Описание настоящего изобретения следует интерпретировать в соответствии с законами и принципами образования химических связей. В некоторых случаях для помещения заместителя в какое-либо заданное положение может быть необходимым удалить атом водорода. Далее проиллюстрированы некоторые аспекты структурной формулы (I) В приведенной выше формуле (I) "пирролидинил-имидазол" слева от "линкера" не зависит от "пирролидинилзимидазола" справа от линкерной группы в том, что касается, например, (1) таутомерной формы имидазольного кольца, (2) абсолютной конфигурации стереогенных центров в пирролидиновом кольце и (3) заместителей азота в пирролидине, т.е. R1 и R2 не зависят друг от друга, хотя в некоторых случаях они предпочтительно являются одинаковыми. Подразумевается, что изображение пирролидина "слева" или "справа" служит лишь целям иллюстрации и никоим образом не ограничивает объем изобретения. В линкерной группе формулы (I) связь между "L" и двумя бензольными кольцами предусматривает все проиллюстрированные далее комбинации при этом предпочтительными являются связи "пара-пара", пара-мета" и "мета-мета". Аналогичным образом, когда L в формуле (I) означает фениленовую быть следующим образом связана с соседними двумя бензольными кольцами: при этом предпочтительными являются связи "пара" и "мета", а связь "пара" является более пред-8 022384 почтительной. Когда L в формуле (I) означает виниленовую (-СН=СН-) группу, она может иметь проиллюстрированную далее транс- или цис-конфигурацию Когда L в формуле (I) означает циклопропиленовую группу, оба заместителя бензола иметь транс- или цис-сочленены друг с другом и образовывать одну из следующих четырех конфигураций: В пирролидиновом кольце пирролидинил имидазола стереогенный углеродный центр, с которым связана имидазольная группа, может иметь показанную далее (R)- или (S)-конфигурацию: Когда циклопропильное кольцо сочленено с пирролидиновым кольцом пирролидинил-имидазола,т.е. когда (Rp, Rq) вместе означают -СН 2-, СН 2 группа сочлененного циклопропильного кольца может занимать показанное далее - или -положение относительно пирролидинового кольца: Соответственно, подразумевается, что в объем настоящего изобретения входят все возможные стереоизомеры, даже если при описании какой-либо структуры упоминается один стереоизомер или не упоминаются стереизомеры. В формуле (I) связь между бензольным кольцом линкерной группы и имидазольным кольцом пирролидинил-имидазола может осуществляться в положении С-4 и С-5 (см. далее) имидазольного кольца. Как поймет специалист в данной области техники, вследствие таутомеризации имидазольного кольца связывание бензольного кольца в положении С-4 может быть эквивалентным связыванию бензольного кольца в положении С-5, как показано в следующем уравнении: Такой же принцип применим к заместителю X или X'. Соответственно, подразумевается, что в объем настоящего изобретения входят все возможные таутомеры, даже если в структуре присутствует лишь один из них. Используемая в описании плавающая связь (например,или плавающий заместитель (например, -R13) в структуре указывает на то, что связь или заместитель могут занимать любое доступное в структуре положение в результате удаления водорода из этого доступного положения. Подразумевается,что в бициклической или полициклической кольцевой структуре, если конкретно не указано иное, положение плавающей связи или плавающего заместителя не ограничено положением такой связи или заместителя в конкретном кольце. Соответственно, следующие два заместителя следует интерпретировать как эквивалентные Подразумевается, что в объем настоящего изобретения входят соединения, обладающие приемле-9 022384 мой стабильностью для применения в качестве лекарственного средства. Подразумевается, что определение любого заместителя или переменной в конкретном положении в молекуле не зависит от их определений в каких-либо иных положениях в этой молекуле. Например, в случае заместителя (R10)n, когда n означает 2, две R10 группы могут быть одинаковыми или различаться. Содержание всех патентов, патентных заявок и литературы, приведенной в описании, во всех полноте в порядке ссылки включено в настоящую заявку. В случае противоречий преобладающую силу имеет настоящее описание, включая определения. Определения Выше были приведены определения каждой из рассмотренных групп. Кроме того, в описании будут использованы следующие определения. Используемые в описании формы единственного числа включают ссылку на множественное число,если из контекста ясно не следует иное. Если не указано иное, все арильные, циклоалкильные, гетероарильные и гетероциклильные группы согласно настоящему изобретению могут быть замещены, как описано в соответствующем определении каждой из них. Например, арильная составляющая арилалкильной группы может быть замещена, как описано в определении термина "арил". Термин "ацетил", используемый в изобретении, означает -С(O)СН 3. Термин "алкенил", используемый в изобретении, означает одновалентную, прямую или разветвленную углеводородную цепочку с одной или несколькими, предпочтительно одной-двумя двойными связями. Двойная связь алкенильной группы может являться несопряженной или сопряженной связью с другой ненасыщенной группой. Применимые алкенильные группы включают без ограничения С 2-С 10 алкенильные группы, такие как винил, аллил, бутенил, пентенил, гексенил, бутадиенил, пентадиенил,гексадиенил, 2-этилгексенил, 2-пропил-2-бутенил, 4-(2-метил-3-бутен)пентенил. Алкенильная группа может являться незамещенной или замещенной одним или двумя применимыми заместителями. Термин "алкокси", используемый в изобретении, означает алкильную группу, связанную с материнской молекулярной составляющей посредством атома кислорода. Наглядные примеры алкоксильной группы включают без ограничения метокси (CH3O-), этокси (CH3CH2O-) и t-бутоксильную группу СН 3)3 СО-). Термин "алкоксиалкил", используемый в изобретении, означает алкильную группу,замещенную одной, двумя или тремя алкоксильными группами. Термин "алкоксикарбонил", используемый в изобретении, означает алкоксильную группу, связанную с материнской молекулярной составляющей посредством карбонильной группы. Термин "алкил", используемый в изобретении, означает группу, полученную из насыщенного углеводорода с прямой или разветвленной цепью путем удаления водорода из одного из насыщенных атомов углерода. Алкильная группа предпочтительно содержит от одного до десяти атомов углерода. Наглядные примеры алкильной группы включают без ограничения, метил, этил, изопропил и трет-бутил. Термин "алкилкарбонил", используемый в изобретении, означает алкильную группу, связанную с материнской молекулярной составляющей посредством карбонильной группы. Наглядные примеры алкилкарбонильной группы включают без ограничения ацетил (-С(O)СН 3), пропаноил (-С(O)СН 2 СН 3), nбутирил (-С(O)СН 2 СН 2 СН 3) и 2,2-диметилпропаноил или пивалоил (-С(O)С(СН 3)3). Термин "алкилсульфонил", используемый в изобретении, означает алкильную группу, связанную с материнской молекулярной составляющей посредством сульфонильной группы. Термин "аллил", используемый в изобретении, означает -СН 2 СН=СН 2 группу. Термин "арил", используемый в изобретении, означает группу, полученную из ароматического углеродного кольца путем удаления атома водорода из ароматического кольца. Арильная группа может являться моноциклической, бициклической или полициклической, при этом в бициклической или полициклической арильной группе ароматическое углеродное кольцо может быть сопряжено с другим 4-6 членным ароматическим или неароматическим углеродным кольцом. Наглядные примеры арильной группы включают без ограничения фенил, инданил, инденил, нафтил и 1,2,3,4-тетрагидронафт-5-ил. Термин "арилалкил", используемый в изобретении, означает алкильную группу, замещенную одной, двумя или тремя арильными группами, при этом арильная составляющая арилалкильной группы может быть необязательно замещена 1-5 заместителями, независимо выбранным из C1-С 6 алкильной, C1 С 4 галоалкильной, C1-С 6 алкокси, гало, циано и нитрогруппы. Наглядные примеры арилалкила включают без ограничения, бензил, 2-фенил-1-этил(PhCH2CH2-), (нафт-1-ил)метил и (нафт-2-ил)метил. Термин "арилсульфонил", используемый в изобретении, означает арильную группу, связанную с материнской молекулярной составляющей посредством сульфонильной группы. Термин "бензил", используемый в изобретении, означает метильную группу, в которой один из атомов водорода заменен фенильной группой, при этом упомянутая фенильная группа может быть необязательно замещена 1-5 заместителями, независимо выбранными из метильной, трифторметильной (-CF3), метокси (-ОСН 3),галогеновой и нитро (-NO2) группы. Наглядные примеры бензильной группы включают без ограничения,PhCH2-, 4-МеО-С 6 Н 4 СН 2- и 2,4,6-три-метил-С 6 Н 4 СН 2-. Термин "бициклическое кольцо с внутренним мостиком",используемый в изобретении, означает кольцевую структуру, содержащую голову мостика между двумя эле- 10022384 ментами кольца, при этом кольцо и голова мостика необязательно могут независимо содержать один или несколько, предпочтительно один-два гетероатома, независимо выбранных из азота, кислорода и сера. Наглядные примеры мостиковой бициклической кольцевой структуры включают без ограничения Термин "кэп", используемый в изобретении, означает группу, которая находится в атоме азота пирролидинового кольца соединения формулы (I). Подразумевается, что "кэп" также может означать реактив, который является окончательным "кэпом" в соединении формулы (I) и используется в качестве одного из исходных материалов в реакции присоединения какой-либо группы к азоту в пирролидине, в результате которой получают конечный продукт, т.е. соединение, которое содержит функционализированный пирролидин, который будет присутствовать в соединении формулы (I). Термин "карбонил", используемый в изобретении, означает -С(О)-. Термин "карбоксил" или "карбокси", используемый в изобретении, означает -CO2H. Термин "циано", используемый в изобретении, означает-CN. Термин "циклоалкил", используемый в изобретении, означает группу, полученную из насыщенного углеродного кольца, содержащего предпочтительно 3-8 атомов углерода, путем удаления атома водорода из насыщенного углеродного кольца, которое необязательно может быть сопряжено с одним или двумя другими ароматическими или неароматическими углеродными кольцами. Наглядные примеры циклоалкильных групп включают без ограничения, циклопропил, циклопентил, циклогексил и 1,2,3,4 тетрагидронафт-1-ил. Термин "формил", используемый в изобретении, означает -СНО. Термины "гало" и"галоген", используемые в изобретении, означают F, Cl, Br или I. Термин "галоалкокси", используемый в изобретении, означает галоалкильную группу, связанную с материнской молекулярной составляющей посредством атома кислорода. Термин "галоалкил", используемый в изобретении, означает алкильную группу, замещенную по меньшей мере одним атомом галогена. Галоалкильной группой может являться алкильная группа, все атомы водорода которой замещены галогенами. Наглядные примеры галоалкила включают без ограничения трифторметил(CF3-), 1-хлорэтил (ClCH2CH2-) и 2,2,2-трифторэтил (CF3CH2-). Термин "гетероарил", используемый в изобретении, означает группу, полученную из моноциклического, бициклического или полициклического соединения, имеющего по меньшей мере одно ароматическое кольцо, содержащее один или несколько, предпочтительно один-три гетероатома, независимо выбранных из азота, кислорода и серы, путем удаления атома водорода из его ароматического кольца. Как хорошо известно специалистам в данной области техники, гетероарильные кольца являются менее ароматическими по своему характеру, чем их аналоги, содержащие только атомы углерода. Соответственно,в контексте описания гетероарильная группа должна обладать лишь некоторой степенью ароматизации. Наглядные примеры гетероарильных групп включают без ограничения пиридил, пиридазинил, пиримидил, пиразил, триазинил, пирролил, пиразолил, имидазолил, (1,2,3,)- и (1,2,4)-триазолил, пиразинил, пиримидинил, тетразолил, фурил, тиенил, изоксазолил, тиазолил, изоксазолил, оксазолил, индолил, хинолинил, изохинолинил, бензизоксазолил, бензотиазолил, бензотиенил и пирролопиридинил. Термин "гетероарилалкил", используемый в изобретении, означает алкильную группу, замещенную одной, двумя или тремя гетероарильными группами. Термин "гетеробициклил", используемый в изобретении, означает циклическую структуру, имеющую два сочлененных или соединенных мостиком кольца, которые содержат углерод и один или несколько, предпочтительно один-три гетероатома, независимо выбранных из азота, кислорода и серы. Гетеробициклическая кольцевая структура является частью гетециклического кольца и может быть насыщенной или ненасыщенной. Примеры гетеробициклических кольцевых структур включают без ограничения тропан, хинуклидин и 7-азабицикло[2,2,1]гептан. Термин "гетероциклил", используемый в изобретении, означает группу, полученную из моноциклического, бициклического или полициклического соединения, имеющего по меньшей мере одно неароматическое кольцо, содержащее один или несколько, предпочтительно один-три гетероатома, независимо выбранных из азота, кислорода и серы, путем удаления атома водорода из неароматического кольца. В гетероциклильную группу входит гетеробициклильная группа. Гетероциклильные группы согласно настоящему изобретению могу быть связаны с материнской молекулярной составляющей посредством атом углерода или атомом азота в группе. Примеры гетероциклильных групп включают без ограничения морфолинил, оксазолидинил, пиперазинил, пиперидинил, пирролидинил, тетрагидрофурил, тиоморфолинил и индолинил. Термин "гетероциклилалкил", используемый в изобретении, означает алкильную группу, замещенную одной, двумя или тремя гетероциклильными группами. Термины "гидрокси" или "гидроксил", используемые в изобретении, означают -ОН. Термин "гидроксиалкил", используемый в изобретении, означает алкильную группу, замещенную одной, двумя или тремя гидроксильными группами. Термин "нитро", используемый в изобретении, означает -NO2. Термин "-NRaRb", используемый в изобретении, означает две группы, а именно Ra и Rb, которые связаны с материнской молекулярной составляющей посредством атома азота, или, в качестве альтернативы, Ra и Rb вместе с атомом азота, с которым они связаны, образуют 5- или 6-членное кольцо или сопряженную или соединенную мостиком бициклическую кольцевую структуру, необязательно содержащую один, два или три дополнительных гетероатома, независимо выбранных из азота, кислорода и серы. Определение термина "-NRcRd" является аналогичным. Термин "(NRaRb)алкил", используемый в изобретении, означает алкильную группу, замещенную одной, двумя или тремя -NRaRb группами. Определение термина "(NRcRd)алкил" является аналогичным. Термин "оксо", используемый в изобретении, означает =O. Термин "сульфонил", используемый в изобретении, означает -SO2-. Термин "триалкилсилил", используемый в изобретении, означает -SiR3, в котором каждая R группа означает С 1-С 4 алкил или фенил. Три R группы могут быть одинаковыми или различаться. Наглядные примеры "триалкилсилила" включают без ограничения триметилсилил (TMS), трет-бутилдифенилсилил(TBDPS), трет-бутилдиметилсилил (TBS или TBDMS) и триизопропилсилил (TIPS). В предложенных в настоящем изобретении соединениях существуют центры асимметрии. Эти центры обозначены как"R"или "S" В зависимости от конфигурации заместителей вокруг хирального атома углерода. Подразумевается, что в объем изобретения входят все стереохимические изомерные формы или их смеси, которые обладают способностью ингибировать NS5A. Отдельные стереоизомеры соединений могут быть получены путем синтеза с использованием имеющихся на рынке исходных веществ, которые содержат хиральные центры, или путем приготовления смесей энантиомеров с последующим разделением, например,путем конверсии, на смесь диастереомеров с последующим разделением или рекристаллизацией методами хроматографии или путем прямого разделения энантиомеров в хиральных хроматографических колонках. Исходные соединения с конкретными стереохимическими свойствами имеются на рынке или могут быть получены известными из техники способами. Некоторые предложенные в настоящем изобретении соединения также могут существовать в различных стабильных конформационных формах, которые могут являться разделимыми. Для разделения различных конформационных изомеров может использоваться торсионная асимметрия вследствие ограниченного вращения вокруг асимметричной одинарной связи, например, из-за стерического препятствия или деформации кольца. В объем настоящего изобретения входит каждый конформационный изомер этих соединений и их смесей. Термин "предложенные в настоящем изобретении соединения" и эквивалентные выражения означают соединения формулы (I) и их фармацевтически приемлемые энантиомеры, диастереомеры и соли. Аналогичным образом, при упоминании промежуточных продуктов имеются в виду их соли, если это допускает контекст. В объем настоящего изобретения входят все изотопы атомов, содержащихся в соединениях. Изотопы включают атомы, имеющие такое атомное число, но отличающиеся массовые числа. В качестве общего примера и без ограничения, изотопы водорода включают дейтерий и тритий. Изотопы углерода включают 13 С и 14 С. Меченые изотопами соединения согласно изобретению в целом могут быть получены обычными способами, известными специалистам в данной области техники, или способами,аналогичными, описанным в изобретении, с использованием соответствующего меченого изотопами реактива вместо используемого в противном случае немеченого реактива. Такие соединения могут иметь разнообразные потенциальные применения, например, в качестве образцов и реактивов при определении биологической активности. В случае применения стабильных изотопов такие соединения могут обладать потенциалом благоприятного модифицирования биологических, фармакологических и фармакокинетических свойств. Предложенные в настоящем изобретении соединения могут существовать в форме фармацевтически приемлемых солей. Термин "фармацевтически приемлемая соль", используемый в изобретении, означает соли или цвиттер-ионные формы предложенных в настоящем изобретении соединений, растворимые или диспергируемые в воде или масле, применимые согласно здравому медицинскому суждению для использования в контакте с тканями пациентов, без чрезмерной токсичности, раздражения, аллергической реакции или других осложнений соразмерно оправданному соотношению между выгодой и риском и эффективные для применения по назначению. Соли могут быть получены при окончательном выделении и очистке соединений или отдельно путем введения в реакцию соответствующего атома азота с применимой кислотой. Наглядные примеры солей, образованных присоединением кислот, включают ацетат, адипат, альгинат, цитрат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, камфорат,камфорсульфонат; диглюконат, глицерофосфат, гемисульфат, гептаноат, гексаноат, формиат, фумарат,гидрохлорид, гидробромид, гидроиодид, 2-гидроксиэтансульфонат, лактат, малеат, мезитиленсульфонат,метансульфонат, нафтилепесульфонат, никотинат, 2-нафталинсульфат, оксалат, пальмоат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат, пропионат, сукцинат, тартрат, трихлорацетат, трифторацетат, фосфат, глутамат, бикарбонат, пара-толуолсульфонат и ундеканоат. Примеры кислот, которые могут применяться для получения фармацевтически приемлемых солей присоединения, включают неорганические кислоты, такие как соляная кислота, бромисто-водородная кислота, серная кислота и фосфорная кислота, и органические кислоты, такие как щавелевая кислота, малеиновая кислота, янтарная кислота и лимонная кислота. Образованные присоединением оснований соли могут быть получены при окончательном выделении и очистке соединений путем введения в реакцию карбоксильной группы с применимым основанием, таким гидроксид, карбонат или бикарбонат катиона металла или с аммиаком или органическим, первичным, вторичным или третичным амином. Катионы фармацевтически приемлемых солей включают катионы лития, натрия, калия, кальция, магния и алюминия, а также нетоксичные катионы четвертичного амина, такие аммоний, тетраметиламмоний, тетраэтиламмоний, метиламин, диметиламин,триметиламин, триэтиламин, диэтиламин, этиламин, трибутиламин, пиридин, N,N-диметиланилин, Nметилпиперидин,N-метилморфолин,дициклогексиламин,прокаин,дибензиламин,N,Nдибензилфенетиламин и N,N'-дибензилэтилендиамин. Другие наглядные примеры органических аминов,применимых для получения солей присоединения оснований, включают этилендиамин, этаноламин, диэтаноламин, пиперидин и пиперазин. Когда в целях терапии терапевтически эффективные количества соединения формулы (I), а также его фармацевтически приемлемых солей могут применяться в виде исходного химического вещества,действующий ингредиент может представлять собой лекарственную композицию. Соответственно, в изобретении дополнительно предложены лекарственные композиции, которые содержат терапевтически эффективные количества соединения формулы (I) или фармацевтически приемлемых солей и один или несколько, предпочтительно один-три фармацевтически приемлемых носителя, разбавителя или наполнителя. Термин "терапевтически эффективное количество", используемый в изобретении, означает общее количество каждого действующего компонента, достаточное для оказания значимого благоприятного воздействия на пациента, например, устойчивого снижения вирусной нагрузки. В случае отдельного действующего ингредиента, применяемого по отдельности, этот термин означает только такой ингредиент. В случае комбинации ингредиентов этот термин означает комбинированные количества действующих ингредиентов, которые обеспечивают лечебный эффект при их применении в комбинации, последовательно или одновременно. Соединениями формулы (I) и их фармацевтически приемлемыми солями являются описанные выше соединения и соли. Носитель(-и), разбавитель(-и) или наполнитель(-и) должны быть приемлемыми с точки зрения их совместимости с другими ингредиентами композиции и не наносить вреда их реципиенту. Согласно другому аспекту настоящего изобретения также предложен способ получения лекарственной композиции, в котором смешивают соединение формулы (I) или его фармацевтически приемлемую соль с одним или несколькими, предпочтительно одним-тремя фармацевтически приемлемыми носителями, разбавителями или наполнителям. Термин "фармацевтически приемлемый", используемый в изобретении, означает соединения, вещества, композиции и(или) лекарственные формы, применимые согласно здравому медицинскому суждению для использования в контакте с тканями пациентов, без чрезмерной токсичности, раздражения, аллергической реакции или других осложнений соразмерно оправданному соотношению между выгодой и риском и эффективные для применения по назначению. Лекарственные композиции могут представлять собой содержащие порционные лекарственные формы, содержащие заданное количество действующего ингредиента на стандартную дозу. Стандартные уровни дозировки предложенных в настоящем изобретении соединений при монотерапии с целью профилактики и лечения опосредованного ВГС заболевания составляют от около 0,01 до около 250 миллиграммов на килограмм ("мг/кг") массы тела в сутки, предпочтительно от около 0,05 до около 100 мг/кг массы тела в сутки. Обычно лекарственные композиции согласно настоящему изобретению вводят от 1 до около 5 раз в сутки или, в качестве альтернативы, путем непрерывной инфузии. Такое применение может использоваться для постоянного или неотложного лечения. Количество действующего ингредиента, которое может комбинироваться с веществами носителя с целью получения содержащей разовую дозу лекарственной формы, может изменяться в зависимости от требующего лечения состояния,тяжести состояния, времени применения, способа применения, скорости выведения применяемого соединения, длительности лечения и возраста, пола, веса и состояния пациента. Предпочтительными порционными лекарственными формами являются формы, содержащие указанную выше суточную дозу или субдозу действующего ингредиента или ее соответствующую часть. Обычно лечение начинают с небольших дозировок, значительно меньших, чем оптимальная доза соединения. После этого дозировку увеличивают небольшими шагами приращения, пока не будет достигнут оптимальный эффект при сложившихся обстоятельствах. Обычно соединение наиболее желательно применять в количестве, которое в целом обеспечивает действенный противовирусный эффект и не вызывает вредных или отрицательных побочных эффектов. Если предложенные в настоящем изобретении композиции содержат комбинацию предложенного в настоящем изобретении соединения и одного или нескольких дополнительных лекарственных или профилактических средств, как соединение, так и дополнительное средство обычно содержатся в количестве от около 10 до 150%, более предпочтительно от около 10 до 80% дозировки, которую обычно применяют в режиме монотерапии. Лекарственные композиции могут быть рассчитаны на применение любым соответствующим способом, например пероральным (включая трансбуккальный или сублингвальный), ректальным, назальным, местным (включая трансбуккальный, сублингвальный или трансдермальный), вагинальным или парентеральным (включая подкожные, внутрикожные, внутримышечные, внутрисуставные, интрасиновиальные, надчревные, интратекальные, внутрирубцовые, внутривенные или интрадермальные инъекции или инфузии). Такие композиции могут быть получены любым известным из фармацевтики способом,например, путем сочетания действующего ингредиента с носителем(-ями) или наполнителем(-ями). Предпочтительным является пероральное введение или введение в форме инъекций. Лекарственные композиции, применимые для перорального введения, могут представлять собой дискретные изделия, такие как капсулы или таблетки; порошки или гранулы; растворы или суспензии в водных или неводных жидкостях; съедобные вспененные или взбитые массы или жидкие эмульсии типа масло в воде или эмульсии типа вода в масле. В частности, в случае перорального введения в форме таблетки или капсулы действующий ингредиент может сочетаться с пероральным нетоксичным фармацевтически приемлемым инертным носителем, таким как этанол, глицерин, вода и т.п. Для получения порошков соединение измельчают в мелкие частицы соответствующего размера и смешивают с аналогичным образом измельченным носителем, таким как съедобный углевод, таким как, например, крахмал или маннит. Также может использоваться отдушка, консервант, диспергатор и краситель. С целью изготовления капсул получают описанную выше смесь порошков, которой заполняют сформированные желатиновые оболочки. До заполнения в смесь порошков могут добавляться усилители скольжения и смазки, такие как коллоидный кремнезем, тальк,стеарат магния, стеарат кальция или твердый полиэтиленгликоль. Может также добавляться вызывающее дезинтеграцию средство или солюбилизатор, такой как агар-агар, карбонат кальция или карбонат натрия с целью повышения доступности лекарственного препарата при проглатывании капсулы. Кроме того, по желанию или при необходимости в смесь также могут включаться применимые связующие,смазки, вызывающие дезинтеграцию средства и красители. Применимые связующие включают крахмал,желатин, натуральные сахара, такие как глюкоза или бета-лактоза, сахаристые вещества из кукурузы,натуральные и синтетические камеди, такие как аравийская камедь, трагакант или альгинат натрия, карбоксиметилцеллюлоза, полиэтиленгликоль и т.п. Смазки, используемые в этих лекарственных формах,включают олеат натрия, хлорид натрия и т.п. Вызывающие дезинтеграцию средства включают без ограничения крахмал, метилцеллюлозу, агар, бетонит, ксантановую камедь и т.п. Таблетки изготавливают,например, путем получения смеси порошков, гранулирования или агрегирования, добавления смазки и вызывающего дезинтеграцию средства и изготовления таблеток методом прессования. Смесь порошков получают путем смешивания соответствующим образом измельченного соединения с описанным разбавителем или основанием и необязательно со связующим, таким как карбоксиметилцеллюлоза, альгинат,желирующим веществом или поливинилпирролидоном, замедлителем растворения, таким как парафин,усилителем всасывания, таким как четвертичная соль и(или) поглощающим веществом, таким как бетонит, каолин или дикальцийфосфат. Смесь порошков может быть гранулирована путем увлажнения связующим, таким как сироп, крахмальная паста, акациевый клей или растворы целлюлоз или полимеров,продавливания через сито. В качестве альтернативы гранулированию, смесь порошков может быть подана в таблетировочную машину, в результате чего получают неполностью сформиробание массы, разбитые на гранулы. Во избежание прилипания к фасонным штампам гранулы могут быть смазаны путем добавления стеариновой кислоты, соли стеариновой кислоты, талька или минерального масла. Затем из смазанной смеси прессуют таблетки. Предложенные в настоящем изобретении соединения также могут сочетаться со свободнотекучим инертным носителем и непосредственно прессоваться в таблетки без осуществления стадий гранулирования или агрегирования. Может использоваться прозрачное или матовое защитное покрытие из герметизирующего слоя шеллак, покрытие из сахара или полимерного материала и глянцевое покрытие из воска. В эти покрытия могут добавляться красящие вещества для распознавания различных стандартных доз. Пероральные жидкости, такие как растворы, сиропы и эликсиры могут быть получены в виде содержащей стандартную дозу формы, в заданном количестве которой содержится заданное количество соединения. Сиропы могут быть получены путем растворения соединения в соответствующим образом ароматизированном растворе, а эликсиры получают путем использования нетоксичного носителя. Могут также добавляться солюбилизаторы и эмульгаторы, такие как этоксилированные изостеариловые спирты и простые полиоксиэтиленовые эфиры сорбита, консерванты, вкусовая добавка, такая как масло перечной мяты или натуральные подсластители или сахарин или другие искусственные подсластители и т.п. Когда это уместно, содержащие стандартную дозу композиции для перорального введения могут быть микроинкапсулированы. Может быть также получена композиция с пролонгированным или замедленным высвобождением, например, путем нанесения на частицы вещества покрытия или их внедрения в полимеры, воск и т.п. Соединения формулы (I) и их фармацевтически приемлемые соли также могут применяться в форме липосомных систем доставки, таких как малые моноламеллярные везикулы, большие моноламеллярные везикулы и мультиламеллярные везикулы. Липосомы могут быть получены из разнообразных фосфолипидов, таких как холестерин, стеариламин или фосфатидилхолины. Соединения формулы (I) и их фармацевтически приемлемые соли также могут доставляться путем использования моноклональных антител в качестве индивидуальных носителей, с которыми связаны молекулы соединения. Соединения также могут быть связаны с растворимыми полимерами в качестве нацеливаемых но- 14022384 сителей лекарственных средств. Такие полимеры могут включать поливинилпирролидон, сополимер пирана, полигидроксипропилметакриламидфенол, полигидроксиэтиласпартамидфенол или полиэтиленоксидполилизин, замещенный пальмитоильными остатками. Кроме того, соединения могут быть связаны с полимерами биоразлагаемого класса, применимыми для достижения регулируемого высвобождения лекарственного средства, например полимолочной кислотой, полиэпсилон-капролактоном, полигидроксимасляной кислотой, полиортоэфирами, полиацеталями, полидигидропиранами, полицианоакрилатами и сшитыми или амфипатическими блок-сополимерами гидрогелей. Лекарственные композиции, применимые для трансдермального введения, могут представлять собой дискретные пластыри, рассчитанные на тесный контакт с эпидермисом реципиента в течение длительного времени. Например, действующий ингредиент может доставляться из пластыря путем ионтофореза, как описано в Pharm. Res., 3(6):318 (1986). Лекарственные композиции, применимые для местного введения, могут представлять собой мази,кремы, суспензии, лосьоны, порошки, растворы, пасты, гели, распыляемые растворы, аэрозоли или масла. Для лечения глаз или других наружных тканей, например рта и кожи, композиции предпочтительно применяют в качестве местной мази или крема. Когда композиция имеет форму мази, действующий ингредиент может применяться в сочетании с парафиновой или смешивающейся с водой основой. В качестве альтернативы, действующий ингредиент может иметь форму крема в сочетании с основой типа масло в воде или типа вода в масле. Лекарственные композиции, применимые для местного введения в глаза, включают глазные капли,в которых действующий ингредиент растворен или суспендирован в соответствующем носителе, в особенности, водном растворителе. Лекарственные композиции, применимые для местного введения в рот, включают пластинки, пастилки и полоскания. Лекарственные композиции, применимые для ректального введения, могут представлять собой суппозитории или клизмы. Лекарственные композиции, применимые для назального введения с использованием твердого носителя, включают крупный порошок с размером частиц, например, в интервале 20-500 мкм, который вводят путем быстрого вдыхания через носовой ход из контейнера с порошком, который держат близко к носу. Применимые композиции для введения в качестве назального распыляемого раствора или каплей в нос с использованием жидкого носителя включают водные или масляные растворы действующего ингредиента. Лекарственные композиции, применимые для введения путем вдыхания, включают мелкодисперсную пыль или туман, который может быть создан посредством различного рода дозированных аэрозолей,распылителей или инсуффляторов под давлением. Лекарственные композиции, применимые для вагинального введения, могут представлять собой пессарии, тампоны, кремы, гели, пасты, пены или распыляемыеь растворы. Лекарственные композиции, применимые для парентерального введения, включают водные и неводные стерильные растворы для инъекций, которые могут содержать ингибиторы окисления, буферы,бактериостаты и средства, которые делают композицию изотонической по отношению к крови предполагаемого реципиента; и водные и неводные стерильные суспензии, которые могут содержать суспендирующие вещества и загустители. Композиции могут содержаться в упаковках на один прием или множество приемов, например, в герметичных ампулах и пробирках в сублимированном (лиофилизированном) состоянии с необходимостью лишь добавить стерильный жидкий носитель, например воду для инъекций, непосредственно перед их применением. Из стерильных порошков, гранул и таблеток могут быть приготовлены растворы и суспензии для инъекций для немедленного применения. Подразумевается, что помимо конкретно упомянутых выше ингредиентов композиции могут содержать другие обычные вещества, применимые в рассматриваемых композициях, например композиции для перорального введения могут содержать вкусовые вещества. Термин "пациент" означает как людей, так и других млекопитающих. Термин "лечение" означает: (i) предотвращение возникновения заболевания, нарушения или состояния у пациента, который может быть предрасположен к заболеванию, нарушению и(или) состоянию,но у которого оно еще не диагностировано; (ii) подавление заболевания, нарушения или состоянии, т.е. сдерживание его развития; и (iii) облегчение заболевания, нарушения или состояния, т.е. обратное развитие заболевания, нарушения и(или) состояния. Предложенные в настоящем изобретении соединения также могут применяться в сочетании с циклоспорином, например циклоспорином А. В клинических исследованиях доказано, что циклоспорин А обладает активностью против ВГС (Hepatology, 38:1282 (2003); Biochem. Biophys. Res. Commun., 313:42(2004); J. Gastroenterol., 38:567 (2003. Далее в табл. 1 приведены некоторые наглядные примеры соединений, которые могут применяться в сочетании с предложенными в настоящем изобретении соединениями. Соединения согласно изобретению могут применяться в сочетании с другими обладающими активностью против ВГС соединениями для комбинированной терапии совместно или раздельно или путем объединения соединений в композицию. Таблица 1 Предложенные в настоящем изобретении соединения также могут использоваться в качестве лабораторных реактивов. Соединения могут быть полезными в качестве орудия исследований репликации вирусов, проверки систем исследований на животных и исследований в области структурной биологии с целью дальнейшего изучения механизмов заболевания ВГС. Кроме того, предложенные в настоящем изобретении соединения применимы для установления или определения сайта связывания других противовирусных соединений, например, путем конкурентного ингибирования. Предложенные в настоящем изобретении соединения также могут использоваться для устранения или предотвращения инфицирования материалов и тем самым снижения риска инфицирования лабораторного или медицинского персонала или пациентов, контактирующих с такими материалами, например,кровью, тканями, хирургическими инструментами и одеждой, лабораторными инструментами и одеждой и оборудованием и материалами для взятия или переливания крови. В объем настоящего изобретения входят соединения формулы (I), полученные путем синтеза или посредством процессов метаболизма,включая процессы, протекающие в организме человека или животного (in vivo), или процессы, протекающие in vitro. Используемые в настоящей заявке сокращения, включая, в частности, в следующих далее примерах,хорошо известны специалистам в данной области техники. Далее приведены некоторые из используемых сокращений: TFA означает трифторуксусную кислоту; мин означает минуты; MeCN или ACN означает ацетонитрил; LDA означает литийдиизопропиламид; DMSO означает диметилсульфоксид; ч означает часы; Boc или ВОС означает трет-бутоксикарбонил; HATU означает O-(7-азабензотриазол-1-ил)N,N,N',N'-тетраметилуроний гексафторфосфат; RT или Rt или rt означает время удержания или комнатную температуру (в зависимости от контекста); Me означает метил; DMF означает N,Nдиметилформамид; Pd(Ph3P)4 означает тетракис(трифенилфосфин)палладий; МеОН означает метанол; диазометан; H-D-Ser-OBzl означает бензиловый эфир D-серина; i-PrOH означает изопропанол; LiHMDS означает литий гексаметилдисилазид; DIBAL или DIBALH означает гибрид диизобутилалюминия;TBDMS означает трет-бутилдиметилсилил; CBz означает карбобензилокси; Bn означает бензил; DEAD означает диэтилазодикарбоксилат; mCPBA означает мета-хлорнадбензойную кислоту; TMSCN означает триметилсилилцианид; dpppe означает 1,5-бис(дифенилфосфино)пентан; TMEDA означает тетраметилэтилендиамин; ОАс означает ацетат; DMA означает N,N-диметилацетамид; и сут. означает сутки. Далее настоящее изобретение будет описано применительно к некоторым вариантам осуществления, которые не имеют целью ограничить его объем. Напротив, в объем настоящего изобретения входят все альтернативы, модификации и эквиваленты, которые могут быть включены в объем формулы изобретения. Соответственно, следующие далее примеры, в которых приведены конкретные варианты осуществления, иллюстрируют одну из практических реализаций настоящего изобретения, при этом подразумевается, что примеры служат целям иллюстрации некоторых вариантов осуществления и приведены с целью описания, как предполагается, в наиболее эффективной и простой для понимания форме их процедур и концептуальных особенностей. Исходные материалы могут быть приобретены у промышленных производителей или получены общепринятыми в литературе способами, хорошо известными специалистам в данной области техники. Примеры Если не указано иное, оценка степени чистоты осуществлялась в системе Shimadzu LC, а определение времени удержания (Rt) и анализ масс с низким разрешением осуществлялись в системе ShimadzuLC, связанной с системой Waters MICROMASS ZQ MS. Следует отметить, что время удержания может несколько различаться в зависимости от аппаратуры. Условие 1. Колонка = PHENOMENEX, C18, 3,050 мм, 10 м Начальный % В = 0 Конечный % В= 100 Градиент времени = 2 мин Время останова = 3 мин Скорость потока = 4 мл/мин Длина волны = 220 нм Растворитель А = 0,1% TFA в 10% метанола/90% воды Растворитель В = 0,1% TFA в 90% метанола/10% воды Условие 2. Колонка = XTERRA, С 18, 3,050 мм, S7 Начальный % В = 0 Конечный % В= 100 Градиент времени = 2 мин. Время останова = 3 мин. Скорость потока = 5 мл/мин. Длина волны = 220 нм Растворитель А = 0,2% H3PO4 в 10% метанола/90% воды Растворитель В = 0,2% H3PO4 в 90% метанола/10% воды Условие 3. Колонка = PHENOMENEX, C18, 3,050 мм, 10 м Начальный % В = 0 Конечный % В= 100 Градиент времени = 3 мин Время останова = 4 мин Скорость потока = 4 мл/мин Длина волны = 220 нм Растворитель А = 0,1% TFA в 10% метанола/90% воды Растворитель В = 0,1% TFA в 90% метанола/10% воды Условие 4. Колонка = XTERRA, С 18, 3,050 мм, S7 Начальный % В = 0 Конечный % В= 100 Градиент времени = 10 мин Время останова = 11 мин Скорость потока = 5 мл/мин Длина волны = 220 нм Растворитель А = 0,2% H3PO4 в 10% метанола/90% воды Растворитель В = 0,2% H3PO4 в 90% метанола/10% воды Условие 5. Колонка = PHENOMENEX, C18, 3,050 мм, 10 м Начальный % В = 0 Конечный % В= 100 Градиент времени = 4 мин Время останова = 5 мин Скорость потока = 4 мл/мин Длина волны = 220 нм Растворитель А = 0,1% TFA в 10% метанола/90% воды Растворитель В = 0,1% TFA в 90% метанола/10% воды Условие 6. Колонка = Phenomenex-Luna, C18, 4,650 мм, S10 Начальный % В = 0 Конечный % В= 100 Градиент времени = 3 мин Время останова = 4 мин Скорость потока = 4 мл/мин Длина волны = 220 нм Растворитель А = 0,1% TFA в 10% метанола/90% воды Растворитель В = 0,1% TFA в 90% метанола/10% воды Условие 7. Колонка = Phenomenex-Luna, C18, 3,050 мм, S10 Начальный % В = 0 Конечный % В= 100 Градиент времени = 2 мин Время останова = 3 мин Скорость потока = 4 мл/мин Длина волны = 220 нм Растворитель А = 0,1% TFA в 10% метанола/90% воды Растворитель В = 0,1% TFA в 90% метанола/10% воды Условие 9. Колонка = Waters Sunfire, С 18, 4,6150 мм, 3,5 м Начальный % В = 10 Конечный % В = 50 Градиент времени = 20 мин Время останова = 25 мин Скорость потока = 1 мл/мин Длина волны = 220254 нм Растворитель А = 0,1% TFA в 5% CH3CN/95%H2O Растворитель В = 0,1% TFA в 95% CH3CN/5% H2O Условие 9 а. Аналогично условию 9 за исключением времени останова = 35 мин Условие 9 а, 1. Колонка = Waters Sunfire, С 18, 4,6150 мм, 3,5 м Начальный % В = 30 Конечный % В= 100 Градиент времени = 20 мин Время останова = 25 мин Скорость потока = 1 мл/мин Длина волны = 220254 нм Растворитель А = 0,1% TFA в 5% CH3CN/95%H2O Растворитель В = 0,1% TFA в 95% CH3CN/5% H2O Условие 10. Колонка = Waters Xbridge phenyl, C18, 4,6150 мм, 3 м Начальный % В= 10 Конечный % В = 50 Градиент времени = 20 мин Время останова = 25 мин Скорость потока = 1 мл/мин Длина волны = 220254 нм Растворитель А = 0,1% TFA в 5% CH3CN/95%H2O Растворитель В = 0,1% TFA в 95% CH3CN/5% H2O Условие 10 а. Аналогично Условию 10 за исключением времени останова = 35 мин Условие 10 а, 1. Колонка = Waters Xbridge phenyl, C18, 4,6150 мм, 3 м Начальный % В = 40 Конечный % В= 100 Градиент времени = 20 мин Время останова = 25 мин Скорость потока = 1 мл/мин Длина волны = 220254 нм Растворитель А = 0,1% TFA в 5% CH3CN/95%H2O Растворитель В = 0,1% TFA в 95% CH3CN/5% H2O Условие 10b. Колонка = Sunfire, C18, 3,0150 мм, 3,5 м Начальный % В= 10 Конечный % В = 40 Градиент времени = 15 мин Время останова = 18 мин Скорость потока = 1 мл/мин Длина волны 1 = 220 нм Длина волны 2 = 254 нм Растворитель А = 0,1% TFA в 5% MeCN/95% воды Растворитель В = 0,1% TFA в 95% MeCN/5% воды Условие 10 с. Колонка = Xbridge phenyl, С 18, 3,0150 мм, 3,5 м Начальный % В= 10 Конечный % В = 40 Градиент времени = 15 мин Время останова = 18 мин Скорость потока = 1 мл/мин Длина волны 1 = 220 нм Длина волны 2 = 254 нм Растворитель А = 0,1% TFA в 5% MeCN/95% воды Растворитель В = 0,1% TFA в 95% MeCN/5% воды Условие 10d. Колонка = PHENOMENEX-Luna, C18, 2,050 мм, 3 м Начальный % В = 0 Конечный % В = 100 Градиент времени = 4 мин Время останова = 5 мин Скорость потока = 0,8 мл/мин Длина волны = 220 нм Растворитель А = 0,1% TFA в 10% метанола/90% воды Растворитель В = 0,1% TFA в 90% метанола/10% воды Температура в печи = 40 С Условие 10 е (система Agilent 1200, серия LC). Колонка = Xbridge phenyl, C18, 4,6150 мм, 3,5 м Растворитель А = буфер: CH3CN (95:5) Растворитель В = буфер: CH3CN (5:95) Буфер = 0,05% TFA в H2O (рН 2,5, достигнут путем разбавления аммиаком) Начальный % В = 10 Конечный % В= 100 Градиент времени = 12 мин. Время изократической хроматографии = 3 мин Время останова = 23 мин Скорость потока = 1 мл/мин Длина волны = 220254 нм Условие 10f (система Agilent LC-1200, связанная с масс-спектрометром 6140 с одной квадрупольной линзой, режим ESI +ve) Колонка = Zorbax SB, C18, 4,650 мм, 5 м Растворитель А = МеОН (10%) + 0,1% TFA в H2O (90%) Растворитель В = МеОН (90%) + 0,1% TFA в H2O (10%) Начальный % В = 0 Конечный % В= 100 Градиент времени = 3 мин Время изократической хроматографии = 1 мин Время останова = 5 мин Скорость потока = 5 мл/мин Длина волны = 220 нм Условие 10g (система Agilent LC-1200, связанная с масс-спектрометром 6140 с одной квадрупольной линзой, режим ESI +ve) Колонка = Ascentis Express, C-8, 2,15 мм, 2,7 м Растворитель А = CH3CN (2%) + 10 мМ NH4COOH в H2O (98%) Растворитель В = CH3CN (98%) + 10 мМ NH4COOH в H2O (2%) Начальный % В = 0 Конечный % В= 100 Градиент времени = 1,5 мин Время изократической хроматографии = 1,7 мин Время останова = 4 мин Скорость потока = 1 мл/мин. Длина волны = 220 нм Условие 10h. Колонка = PHENOMENEX-Luna, C18, 4,630 мм, S10 Начальный % В = 0 Конечный % В= 100 Градиент времени = 3 мин Время останова = 4 мин Скорость потока = 4 мл/мин Длина волны = 220 нм Растворитель А = 0,1% TFA в 10% метанола/90% воды Растворитель В = 0,1% TFA в 90% метанола/10% воды Условие 11. Колонка = PHENOMENEX-Luna, C18, 502 мм, 3 м Начальный % В = 0 Конечный % В= 100 Градиент времени = 4 мин Время останова = 5 мин Скорость потока = 0,8 мл/мин Длина волны = 220 нм Растворитель А= 5% метанола/95% воды/10 мМ ацетата аммония Растворитель В = 95% метанола/5% воды/10 мМ ацетата аммония Температура в печи = 40 С Условие 12 (система ВЭЖХ Waters Acquity в сочетании с системой спектрофотометрического анализа в видимой и ультрафиолетовой областях света Waters PDA и зондом Waters SQ MS-ESCI) Колонка = Waters Acquity ВЕН, С 18,1502,1 мм ID, 1,7 м (35C) Подвижная фаза А = 0,05% TFA в воде Подвижная фаза В = 0,05% TFA в ацетонитриле Система растворителей: выдержка 10% В: 0-1 мин.; 10-98% В: 1-32 мин.; выдержка 98% В: 32-35 мин.; 98-10% В: 35-35,3 мин; выдержка 10% В: 35,3-40 мин Скорость потока = 0,35 мл/мин УФ-детектирование = 335 нм Примеры Пример OL-1. диметиловый эфир 4,4'-оксибис-(бензойной кислоты) (1,5 г, 5,24 ммоль) и охладили полученный раствор до температуры -78 С. По каплям добавили 1,8 М раствора LDA (29 мл, 52 ммоль) в тетрагидрофуране и в течение 15 мин перемешивали полученную коричневую суспензию при температуре -78 С. Затем медленно добавили раствор ледяной уксусной кислоты в тетрагидрофуране (10 мл в 50 мл), и в течение 10 мин перемешивали коричневую смесь при температуре -78 С, после позволили ее нагреться до комнатной температуры. Смесь поглотили этилацетатом и соляным раствором (1:1, 50 мл), а затем отделили органический слой, который промыли насыщенным раствором бикарбоната натрия и соляного раствора,высушили (MgSO4), профильтровали и концентрировали в вакууме. Остаток подвергли флешхроматографии (силикагель; 15% этилацетата/гексанов) и получили OL-1a в виде бледно-коричневого твердого вещества (0,6 г). 1 Н-ЯМР (500 МГц, DMSO-d6)част./млн 5,17 (s, 4 Н), 7,22 (d, J = 8,85 Гц, 4 Н), 8,06 (d, J = 8,85 Гц,4 Н). ЖХ (Условие 2): RT = 1,53 мин, показатель гомогенизации 97%; ЖХ-МС: вычислено аналитическим методом для (М-Н)+ C16H11Cl2O3: 321,01; обнаружено: 321,30. Пример OL-1, стадия b. Смесь OL-1a (0,6 г, 1,85 ммоль) и диформиламида натрия (0,42 г, 4,45 ммоль) в ацетонитриле (20 мл) в течение 4 ч нагревали с целью дефлегмации. Затем удалили растворитель при пониженном давлении, повторно растворили остаток в 5% растворе HCl в этаноле (30 мл) и в течение 2 ч нагрели до температуры флегмы. Охладили смесь в водяной бане со льдом, профильтровали полученную выпавшую фазу,промыли этанолом и простым эфиром и высушили в вакууме. Полученное бледно-коричневое твердое вещество использовали без дальнейшей очистки (0,66 г). 1 Н-ЯМР (500 МГц, DMSO-d6)част./млн 4,54 (s, 4 Н), 7,25 (d, J = 8,85 Гц, 4 Н), 8,11 (d, J = 8,55 Гц,4 Н), 8,52 (br. s, 6 Н). ЖХ (Условие 1): RT = 1,24 мин; МС низкого разрешения: вычислено аналитическим методом для (М+Н)+ C16H17N2O3 285,12; обнаружено: 285,19. Пример OL-1, стадия с. В гетерогенную смесь N-Boc-L-пролина (0,8 г, 3,73 ммоль), HATU (1,48 г, 3,88 ммоль), OL-1b (0,66 г, 1,85 ммоль) и диметилформамида (15 мл) в течение 15 мин по каплям добавили N,Nдиизопропилэтиламин (1,13 мл, 6,47 ммоль) и в течение 4 ч перемешивали при комнатной температуре. Удалили большую часть летучих компонентов в вакууме и распределили полученный остаток между этилацетатом (30 мл) и водой (20 мл). Промыли органический слой водой (20 мл) и соляным раствором,высушили (MgSO4), профильтровали и концентрировали в вакууме. Из остатка изготовили силикагелевую матрицу и подвергли флеш-хроматографии (силикагель; 65-85% этилацетата/гексанов), в результате чего получили OL-1c в виде бледно-коричневого твердого вещества (0,7 г). 1 Н-ЯМР (500 МГц, DMSO-d6)част./млн 1,39/1,34 (ротамеры, s, 18 Н), 1,70-1,91 (m, 6 Н), 2,00-2,25 (m, J = 8,55 Гц, 2 Н), 3,22-3,33 (m, 2 Н), 3,32-3,47 (m, J = 10,68, 10,68 Гц, 2 Н), 4,08-4,26 (m, 2 Н), 4,56 (ddd, J = 36,93,18,16, 5,34 Гц, 4 Н), 7,19 (d, J = 8,85 Гц, 4 Н), 8,06 (d, J = 7,93 Гц, 4 Н), 8,11-8,24 (m, J = 5,49 Гц, 2 Н). ЖХ (Условие 1): RT = 2,55 мин; МС низкого разрешения: вычислено аналитическим методом для (М+Н)+ C36H47N4O9 679,33; обнаружено: 679,44. Пример OL-1, стадия d. В течение 1,2 ч нагревали сверхвысокочастотным излучением при температуре 140 С находящуюся в герметично закрытой пробирке смесь OL-1c (0,7 г, 1,025 ммоль) и ацетата аммония (0,79 г, 10 ммоль) в ксилолах (5 мл). Удалили летучий компонент в вакууме и осторожно распределили остаток между этилацетатом и водой, при этом добавили достаточно насыщенного раствора бикарбоната натрия, чтобы довести рН водной фазы до слабоосновного показателя после встряхивания двухфазной системы. Разделили слои и извлекли водный слой с помощью дополнительного количества этилацетата. Промыли комбинированную органическую фазу соляным раствором, высушили (MgSO4), профильтровали и концентрировали в вакууме. Подвергли полученное вещество флеш-хроматографии (силикагель; 15-25% ацетона/дихлорметана), в результате чего получили OL-1d (0,13 г). 1 Н-ЯМР (500 МГц, DMSO-d6)част./млн 1,17/1,48 (ротамеры, s, 18 Н), 1,76-1,93 (m 4 Н), 1,93-2,06 7,02 Гц, 1 Н), 6,97 (d, J = 7,93 Гц, 4 Н), 7,00-7,22 (m, 1 Н), 7,40/7,62 (ротамеры, m, 2 Н), 7,73 (d, J = 8,55 Гц,3 Н), 11,74/11,81/12,07 (ротамеры, s, 2 Н). ЖХ (Условие 2): время удерживания (RT) = 1,53 мин, показатель гомогенизации 93%; ЖХ-МС: вычислено аналитическим методом для (М+Н)+ C36H44N6O5 641,34; обнаружено: 641,50. Пример OL-1, стадия е. В раствор OL-1d (0,13 г, 0,2 ммоль) в 30 мл дихлорметана добавили 1 мл 4,0 М раствора HCl в диоксане. Перемешивали реакционную смесь в течение 2 ч. при комнатной температуре и концентрировали при пониженном давлении. Повторно растворили полученный остаток в минимальном количестве метанола, растерли целевой продукт в порошок с простым эфиром, профильтровали и высушили в вакууме. Получили бледно-коричневое твердое вещество (0,11 г), которое использовали без дальнейшей очистки. 1 Н-ЯМР (500 МГц, DMSO-d6)част./млн 1,92-2,07 (m, 2H), 2,12-2,25 (m, 2H), 2,37-2,47 (m, 4H),3,30-3,47 (m, 4H), 4,90-5,02 (m, 2H), 7,15 (d, J = 8,55 Гц, 4H), 7,91 (d, J = 8,24 Гц, 4H), 7,97 (s, 2H), 9,74 (br.s, 2H), 10,25 (br. s, 2H). Примечание: сигнал имидазола NH имел слишком широкую полосу, чтобы классифицировать химический сдвиг. ЖХ (Условие 1): RT = 1,68 мин; МС низкого разрешения: вычислено аналитическим методом для (М+Н)+ C26H29N6O 441,24; обнаружено: 441,30. Пример OL-1. В смесь OL-1 е (35 мг, 0,06 ммоль), диизопропилэтиламина (58 мкл, 0,33 ммоль) и кэпа 1 (22 мг, 0,12 ммоль) в диметилформамиде (3 мл) добавили HATU (52 мг, 0,137 ммоль) и в течение 3 ч перемешивали полученную смесь при комнатной температуре. Удалили летучий компонент в вакууме и очистили остаток в системе ВЭЖХ с обращенной фазой (вода/метанол/TFA), в результате чего получили OL-1 в форме соли TFA в виде беловатого твердого вещества (32 мг). 1 Н-ЯМР (500 МГц, DMSO-D6)част./млн 1,82-1,93 (m, 2 Н), 1,94-2,08 (m, 4 Н), 2,14-2,24 (m, 2 Н),2,29-2,40 (m, 4 Н), 2,83 (s, 4 Н), 2,97-3,07 (m, 4 Н), 3,97 (t, J = 8,24 Гц, 2 Н), 4,89-5,20 (m, 2 Н), 5,34-5,73 (m,2 Н), 7,00-7,22 (m, 6 Н), 7,49-7,64 (m, 9 Н), 7,70-7,89 (m, 5 Н), 10,20 (br. s, 2 Н). ЖХ (Условие 1): RT = 2,48 мин; МС низкого разрешения: вычислено аналитическим методом для (М+Н)+ C46H51N8O3 763,41; обнаружено: 763,56; МС высокого разрешения: вычислено аналитическим методом для (М+Н)+ C46H51N8O3 763,4084; обнаружено: 763,4109. Примеры OL-2 и OL-3. В примерах OL-2 и OL-3 получили вещества в форме солей TFA путем замещения соответствующих кислот на кэп 1 способом, который описан в примере OL-1. В герметичную закрытую пробирку с диоксаной (100 мл) поместили метил-3-бромбензоат (5 г, 23,2 ммоль), метил 4-гидроксибензоат (5,3 г, 34,87 ммоль), карбонат цезия (15,12 г, 46,4 ммоль), йодид меди(I) (0,44 г, 2,32 ммоль) и N,N-диметил гидрохлорид (0,97 г, 6,96 ммоль) и в течение 15 ч нагрели полученную смесь до 90 С. Удалили растворитель при пониженном давлении и поглотили остаток этилацетатом этилацетат/водой (1:1, 200 мл). Промыли органический слой насыщенным водным карбонатом натрия, водой и соляным раствором, высушили (MgSO4), профильтровали и концентрировали в вакууме. Очистили полученное вещество путем флеш-хроматографии (силикагель, 5% этилацетата/гексанов), в результате чего получили OL-4a в виде прозрачного масла, которое затвердело после отстаивания (5,8 г). 1 Н-ЯМР (500 МГц, DMSO-d6)част./млн 3,83 (s, 6 Н), 7,10 (d, J = 8,55 Гц, 2 Н), 7,43 (dd, J = 8,09, 2,59 Гц, 1 Н), 7,56 (s, 1 Н), 7,61 (t, J = 7,93 Гц, 1 Н), 7,81 (d, J = 7,63 Гц, 1 Н), 7,98 (d, J = 8,55 Гц, 2 Н). ЖХ (Условие 2): RT = 1,53 мин; ЖХ-МС: вычислено аналитическим методом для (М+1)+ C16H15O5: 287,01; обнаружено: 287,23. Пример OL-4, стадия b. Из OL-4a получили OL-4b тем же способом, который использовался для получения OL-1 а. 1 Н-ЯМР (500 МГц, DMSO-d6)част./млн 5,14 (s, 2 Н), 5,20 (s, 2 Н), 7,13 (d, J = 8,85 Гц, 2 Н), 7,43-7,49(Условие 1): RT = 1,51 мин; МС низкого разрешения: вычислено аналитическим методом для (М+Н)+ Из OL-4b получили OL-4c тем же способом, который использовался для получения OL-1b. Н-ЯМР (500 МГц, DMSO-d6)част./млн 4,52 (s, 2 Н), 4,56 (s, 2 Н), 7,16 (d, J = 8,85 Гц, 2 Н), 7,51 (dd,J = 8,24, 2,44 Гц, 1 Н), 7,68 (t, J = 7,93 Гц, 1 Н), 7,71-7,75 (m, 1 Н), 7,91 (d, J = 7,63 Гц, 1 Н), 8,07 (d, J = 8,85 Гц, 2 Н), 8,60 (s, 6 Н). ЖХ (Условие 2): вычислено аналитическим методом для C16H17N2O3 (М+Н)+ 285,12; обнаружено: 285,15. Пример OL-4d. 1 Из OL-4c получили OL-4d тем же способом, который использовался для получения OL-1c. Н-ЯМР (500 МГц, DMSO-d6)част./млн 1,38/1,33 (ротамеры, s, 18 Н), 1,69-1,91 (m, 6 Н), 1,95-2,19(m, 2 Н), 3,20-3,31 (m, 2 Н), 3,32-3,47 (m, 2 Н), 4,08-4,23 (m, 2 Н), 4,43-4,68 (m, 4 Н), 7,10 (d, J = 8,55 Гц, 2 Н),7,42 (dd, J = 8,09, 1,98 Гц, 1 Н), 7,57-7,70 (m, 2 Н), 7,86 (d, J = 7,02 Гц, 1 Н), 8,03 (d, J = 7,93 Гц, 2 Н), 8,088,24 (m, 2 Н). ЖХ (Условие 1): RT = 2,53 мин; МС низкого разрешения: вычислено аналитическим методом для C36H47N4O9 (М+Н)+ 679,33; обнаружено: 679,42. Пример OL-4e. 1 Из OL-4d получили OL-4e тем же способом, который использовался для получения OL-1d. Н-ЯМР (500 МГц, DMSO-d6)част./млн 1,14/1,17/1,38/1,40 (ротамеры, s, 18 Н), 1,71-2,06 (m, 6 Н),2,09-2,28 (m, J = 25,79, 13,89 Гц, 2 Н), 3,31-3,40 (m, 2 Н), 3,51 (s, 2 Н), 4,65-4,89 (m, 2 Н), 6,80 (t, J = 8,39 Гц,1 Н), 6,91-7,10 (m, 2 Н), 7,28-7,55 (m, 5 Н), 7,58-7,80 (m, 2 Н), 11,66-12,21 (m, 2 Н). ЖХ (Условие 1): RT = 2,98 мин; МС низкого разрешения: вычислено аналитическим методом для C36H45N6O5 (М+Н)+ 641,34; обнаружено: 641,39. Пример OL-4f. Из OL-4e получили OL-4f тем же способом, который использовался для получения OL-1e. 1 Н-ЯМР (500 МГц, DMSO-d6)част./млн 1,94-2,06 (m, 2 Н), 2,09-2,23 (m, 2 Н), 2,28-2,38 (m, 1 Н),2,37-2,47 (m, 3 Н), 3,27-3,50 (m, 4 Н), 4,90 (br. S, 1 Н), 4,99 (br. S, 1 Н), 7,00 (d, J = 7,93 Гц, 1 Н), 7,13 (d, J = 8,55 Гц, 2 Н), 7,49 (t, J = 7,93 Гц, 1 Н), 7,62 (s, 1 Н), 7,69 (d, J = 7,63 Гц, 1 Н), 7,92 (d, J = 8,55 Гц, 2 Н), 7,99 (s,2 Н), 9,58 (br. s, 1 Н), 9,84 (br. s, 1 Н), 10,25 (Br. d, J = 22,28 Гц, 2 Н). Примечание: сигнал имидазола NH имел слишком широкую полосу, чтобы классифицировать химический сдвиг. ЖХ (Условие 1): RT = 1,72 мин; МС низкого разрешения: вычислено аналитическим методом для C26H29N6O (M+H)+ 441,24; обнаружено: 441,29. Пример OL-4. Из OL-4f получили OL-4 тем же способом, который использовался для получения OL-1. 1 Н-ЯМР (500 МГц, DMSO-d6)част./млн 1,83-1,92 (m, 4 Н), 1,95-2,09 (m, 8 Н), 2,11-2,23 (m, 4 Н),2,75-2,88 (m, 2 Н), 2,92 (s, 1 Н), 2,96-3,12 (m, 2 Н), 3,97 (t, J = 8,39 Гц, 2 Н), 5,14 (dd, J = 17,70, 7,02 Гц, 2 Н),5,41 (s, 2 Н), 6,91-7,11 (m, J = 49,75 Гц, 2 Н), 7,14 (d, J = 7,93 Гц, 2 Н), 7,44-7,68 (m, 12 Н), 7,79 (d, J = 8,54 Гц, 2 Н), 7,84-8,02 (m, J = 9,16 Гц, 2 Н), 10,21 (s, 1 Н). Примечание: сигнал имидазола NH имел слишком широкую полосу, чтобы классифицировать химический сдвиг. ЖХ (Условие 1): RT = 1,78 мин; МС низкого разрешения: вычислено аналитическим методом для C46H51N8O3 (M+H)+ 763,41; обнаружено: 763,56. МС высокого разрешения: вычислено аналитическим методом для C46H51N8O3 (M+H)+763,4084; обнаружено: 763,4067. Примеры OL-5 и OL-6. В примерах OL-5 и OL-6 получили вещества в форме солей TFA путем замещения соответствующих кислот на кэп 1 способом, который описан в примере OL-4.
МПК / Метки
МПК: A61K 31/4178, A61P 31/14, C07D 405/14, C07D 403/04, C07D 403/14
Метки: вируса, гепатита, ингибиторы
Код ссылки
<a href="https://eas.patents.su/30-22384-ingibitory-virusa-gepatita-c.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы вируса гепатита c</a>