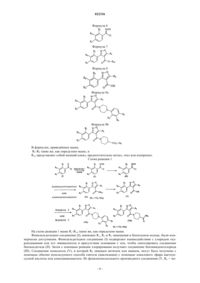
Производные фенилизоксазола и способ его получения
Номер патента: 22336
Опубликовано: 30.12.2015
Авторы: Воо Сеок Хун, Лее Гонг Йеал, Лее Хае Ун, Ким Донг Йеон, Ким Хонг Йоуб, Ким Сунг Моо, Йоон Сеунг Бин, Чо Дае Джин, Ахн Чоонг Ам
Формула / Реферат
1. Соединение, представленное формулой 1, или его фармацевтически приемлемая соль, гидрат, сольват
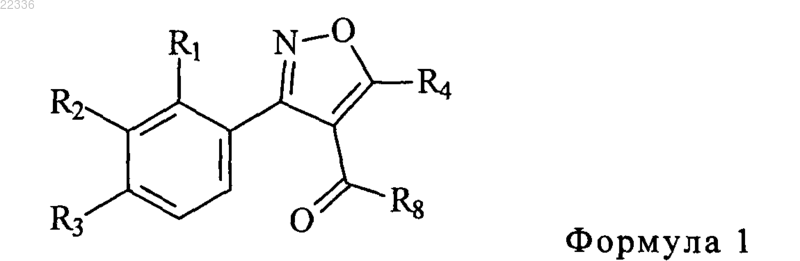
где R1, R3 и R3 каждый независимо представляет собой водород, метил, необязательно замещенный галогеном, метоксигруппу, необязательно замещенную галогеном, или галоген,
R4 представляет собой метил или амин,
R8 представляет собой радикал формулы 2 или радикал формулы 3

где R5, R6 и R7 каждый независимо представляет собой водород, метил, необязательно замещенный галогеном, гидроксил, метоксигруппу или галоген;
R9 обозначает С1-С2 алкил;
где, когда R8 представляет собой радикал формулы 2
два из радикалов R1, R2 и R3 означают водород, а один оставшийся радикал представляет собой метил, необязательно замещенный галогеном, метоксигруппу, необязательно замещенную галогеном, или галоген, R4 означает метил или амин и один или два из радикалов R5, R6 и R7 каждый независимо представляет собой водород, метил, необязательно замещенный галогеном, гидроксил, метоксигруппу или галоген, или
два из радикалов R1, R2 и R3 означают водород, а один оставшийся представляет собой трифторметил, фтор или трифторметокси, R4 представляет собой метил или амин и один или два из радикалов R5, R6 и R7 каждый независимо представляет собой водород, метокси, хлор, фтор, трифторметил или гидроксил, или
R1 представляет собой галоген, предпочтительно хлор, R4 представляет собой метил или амин, R2, R3, R5 и R7 каждый представляет собой водород и R6 представляет метоксигруппу; или
где, когда R8 представляет собой радикал формулы 3:
два из радикалов R1, R2 и R3 означают водород, а один оставшийся представляет собой метил, необязательно замещенный галогеном, метоксигруппу, необязательно замещенную галогеном, или галоген, R4 обозначает амин и R9 обозначает C1-C2 алкил, или
два из радикалов R1, R2 и R3 означают водород, R4 представляет собой амин, а один оставшийся представляет собой трифторметил, фтор или трифторметокси и R9 представляет собой метил или этил.
2. Соединение или его фармацевтически приемлемая соль, гидрат, сольват по п.1, в котором, когда R8 представляет собой радикал формулы 2:
R1 обозначает трифторметил или трифторметокси, R2 и R3 означают водород, R4 означает метил или амин и один или два из радикалов R5, R6 и R7 каждый независимо представляет собой водород, гидроксил, метоксигруппу или хлор;
R1 представляет собой хлор, R4 представляет собой метил, R2, R3, R5 и R7 каждый обозначает водород и R6 представляет собой метокси или
R2 обозначает фтор, трифторметил или трифторметокси, R1 и R3 каждый представляет собой водород, R4 представляет собой метил или амин и один или два из радикалов R5, R6 и R7 каждый независимо представляет собой водород, гидроксил, метоксигруппу, трифторметил или хлор.
3. Соединение или его фармацевтически приемлемая соль, гидрат, сольват по п.1, в котором, когда R8 представляет собой радикал формулы 3, R1 представляет собой трифторметокси, R2 и R3 каждый представляет собой водород, R4 представляет собой амин и R9 означает этил.
4. Соединение или его фармацевтически приемлемая соль, гидрат, сольват или их смесь по п.1, где указанное соединение включает
(4-(2-фторфенил)пиперазин-1-ил)(5-метил-3-(2-(трифторметил)фенил)изоксазол-4-ил)метанон,
(4-(3,4-дихлорфенил)пиперазин-1-ил)(5-метил-3-(2-(трифторметил)фенил)изоксазол-4-ил)метанон,
(4-(3-метоксифенил)пиперазин-1-ил)(5-метил-3-(2-(трифторметил)фенил)изоксазол-4-ил)метанон,
(4-(2-метоксифенил)пиперазин-1-ил)(5-метил-3-(2-(трифторметил)фенил)изоксазол-4-ил)метанон,
(5-метил-(3-(2-трифторметил)фенил)изоксазол-4-ил)(4-(3-(трифторметил)фенил)пиперазин-1-ил)метанон,
(4-(4-гидроксифенил)пиперазин-1-ил)(5-метил-(3-(2-трифторметил)фенил)изоксазол-4-ил)метанон,
(4-(2-гидроксифенил)пиперазин-1-ил)(5-метил-(3-(2-трифторметил)фенил)изоксазол-4-ил)метанон,
(4-(4-фторфенил)пиперазин-1-ил)(5-метил-3-(2-(трифторметил)фенил)изоксазол-4-ил)метанон,
(3-(2-хлорфенил)-5-метилизоксазол-4-ил)(4-(3-метоксифенил)пиперазин-1-ил)метанон,
(3-(3-фторфенил)-5-метилизоксазол-4-ил)(4-(2-фторфенил)пиперазин-1-ил)метанон,
(3-(3-фторфенил)-5-метилизоксазол-4-ил)(4-(2-фторфенил)пиперазин-1-ил)метанон,
(4-(3,4-дихлорфенил)пиперазин-1-ил)(3-(3-фторфенил)-5-метилизоксазол-4-ил)метанон,
(3-(3-фторфенил)-5-метилизоксазол-4-ил)(4-(3-метоксифенил)пиперазин-1-ил)метанон,
(3-(3-фторфенил)-5-метилизоксазол-4-ил)(4-(2-метоксифенил)пиперазин-1-ил)метанон,
(3-(3-фторфенил)-5-метилизоксазол-4-ил)(4-(3-(трифторметил)фенил)пиперазин-1-ил)метанон,
(3-(3-фторфенил)-5-метилизоксазол-4-ил)(4-(4-гидроксифенил)пиперазин-1-ил)метанон,
(3-(3-фторфенил)-5-метилизоксазол-4-ил)(4-(2-гидроксилфенил)пиперазин-1-ил)метанон,
(3-(3-фторфенил)-5-метилизоксазол-4-ил)(4-(4-фторфенил)пиперазин-1-ил)метанон,
(3-(2-фторфенил)-5-метилизоксазол-4-ил)(4-(2-фторфенил)пиперазин-1-ил)метанон,
(4-(3,4-дихлофенил)пиперазин-1-ил)(3-(2-фторфенил)-5-метилизоксазол-4-ил)метанон,
(3-(2-фторфенил)-5-метилизоксазол-4-ил)(4-(3-метоксифенил)пиперазин-1-ил)метанон,
(3-(2-фторфенил)-5-метилизоксазол-4-ил)(4-(2-метоксифенил)пиперазин-1-ил)метанон,
(3-(2-фторфенил)-5-метилизоксазол-4-ил)(4-(3-(трифторметил)фенил)пиперазин-1-ил)метанон,
(3-(2-фторфенил)-5-метилизоксазол-4-ил)(4-(4-гидроксифенил)пиперазин-1-ил)метанон,
(3-(2-фторфенил)-5-метилизоксазол-4-ил)(4-(2-гидроксифенил)пиперазин-1-ил)метанон,
(3-(2-фторфенил)-5-метилизоксазол-4-ил)(4-(4-фторфенил)пиперазин-1-ил)метанон,
(4-(2-фторфенил)пиперазин-1-ил)(5-метил-3-(4-(трифторметокси)фенил)изоксазол-4-ил)метанон,
(4-(3,4-дихлорфенил)пиперазин-1-ил)(5-метил-3-(4-(трифторметокси)фенил)изоксазол-4-ил)метанон,
(4-(3,4-метоксифенил)пиперазин-1-ил)(5-метил-(3-(4-трифторметокси)фенил)изоксазол-4-ил)метанон,
(4-(2-метоксифенил)пиперазин-1-ил)(5-метил-3-(4-(трифторметокси)фенил)изоксазол-4-ил)метанон,
(5-метил-(3-(4-трифторметокси)фенил)изоксазол-4-ил)(4-(3-(трифторметил)фенил)пиперазин-1-ил)метанон,
(4-(4-гидроксифенил)пиперазин-1-ил)(5-метил-(3-(4-трифторметокси)фенил)изоксазол-4-ил)метанон,
(4-(2-гидроксифенил)пиперазин-1-ил)(5-метил-3-(4-(трифторметокси)фенил)изоксазол-4-ил)метанон,
(4-(4-фторфенил)пиперазин-1-ил)(5-метил-3-(4-(трифторметокси)фенил)изоксазол-4-ил)метанон,
(4-(2-фторфенил)пиперазин-1-ил)(5-метил-3-(2-(трифторметокси)фенил)изоксазол-4-ил)метанон,
(4-(3,4-дихлорфенил)пиперазин-1-ил)(5-метил-3-(2-(трифторметокси)фенил)изоксазол-4-ил)метанон,
(4-(3-метоксифенил)пиперазин-1-ил)(5-метил-3-(2-(трифторметокси)фенил)изоксазол-4-ил)метанон,
(4-(2-метоксифенил)пиперазин-1-ил)(5-метил-3-(2-(трифторметокси)фенил)изоксазол-4-ил)метанон,
(5-метил-(3-(2-трифторметокси)фенил)изоксазол-4-ил)(4-(3-(трифторметил)фенил)пиперазин-1-ил)метанон,
(4-(4-гидроксифенил)пиперазин-1-ил)(5-метил-3-(2-(трифторметокси)фенил)изоксазол-4-ил)метанон,
(4-(2-гидроксифенил)пиперазин-1-ил)(5-метил-3-(2-(трифторметокси)фенил)изоксазол-4-ил)метанон,
(4-(4-фторфенил)пиперазин-1-ил)(5-метил-3-(2-(трифторметокси)фенил)изоксазол-4-ил)метанон,
(4-(2-фторфенил)пиперазин-1-ил)(5-метил-3-(3-(трифторметил)фенил)изоксазол-4-ил)метанон,
(4-(3,4-дихлорфенил)пиперазин-1-ил)(5-метил-3-(3-трифторметил)изоксазол-4-ил)метанон,
(4-(3-метооксифенил)пиперазин-1-ил)(5-метил-3-(3-(трифторметил)фенил)изоксазол-4-ил)метанон,
(4-(2-метоксифенил)пиперазин-1-ил)(5-метил-3-(3-(трифторметил)фенил)изоксазол-4-ил)метанон,
(5-метил-(3-(3-трифторметил)фенил)изоксазол-4-ил)(4-(3-(трифторметил)фенил)пиперазин-1-ил)метанон,
(4-(4-гидроксифенил)пиперазин-1-ил)(5-метил-(3-(3-трифторметил)фенил)изоксазол-4-ил)метанон,
(4-(2-гидроксифенил)пиперазин-1-ил)(5-метил-(3-(3-трифторметил)фенил)изоксазол-4-ил)метанон,
(4-(4-фторфенил)пиперазин-1-ил)(5-метил-(3-(3-трифторметил)фенил)изоксазол-4-ил)метанон,
(4-(2-фторфенил)пиперазин-1-ил)(5-метил-(3-(3-трифторметокси)фенил)изоксазол-4-ил)метанон,
(4-(3,4-дихлорфенил)пиперазин-1-ил)(5-метил-(3-(3-трифторметокси)фенил)изоксазол-4-ил)метанон,
(4-(3-метоксифенил)пиперазин-1-ил)(5-метил-(3-(3-трифторметокси)фенил)изоксазол-4-ил)метанон,
(4-(2-метоксифенил)пиперазин-1-ил)(5-метил-(3-(3-трифторметокси)фенил)изоксазол-4-ил)метанон,
(5-метил-(3-(3-трифторметокси)фенил)изоксазол-4-ил)(4-(3-(трифторметил)фенил)пиперазин-1-ил)метанон,
(4-(4-гидроксифенил)пиперазин-1-ил)(5-метил-(3-(3-трифторметокси)фенил)изоксазол-4-ил)метанон,
(4-(2-гидроксифенил)пиперазин-1-ил)(5-метил-(3-(3-трифторметокси)фенил)изоксазол-4-ил)метанон,
(4-(4-фторфенил)пиперазин-1-ил)(5-метил-(3-(3-трифторметокси)фенил)изоксазол-4-ил)метанон,
(5-амино-3-(2-хлорфенил)изоксазол-4-ил)(4-(2-фторфенил)пиперазин-1-ил)метанон,
(5-амино-3-(2-хлорфенил)изоксазол-4-ил)(4-(3,4-дихлорфенил)пиперазин-1-ил)метанон,
(5-амино-3-(2-хлорфенил)изоксазол-4-ил)(4-(3-метоксифенил)пиперазин-1-ил)метанон,
(5-амино-3-(2-хлорфенил)изоксазол-4-ил)(4-(2-метоксифенил)пиперазин-1-ил)метанон,
(5-амино-3-(2-хлорфенил)изоксазол-4-ил)(4-(3-(трифторметил)фенил)пиперазин-1-ил)метанон,
(5-амино-3-(2-хлорфенил)изоксазол-4-ил)(4-(4-гидроксифенил)пиперазин-1-ил)метанон,
(5-амино-3-(2-хлорфенил)изоксазол-4-ил)(4-(2-гидроксифенил)пиперазин-1-ил)метанон,
(5-амино-3-(2-хлорфенил)изоксазол-4-ил)(4-(4-фторфенил)пиперазин-1-ил)метанон,
(5-амино-3-(3-фторфенил)изоксазол-4-ил)(4-(2-фторфенил)пиперазин-1-ил)метанон,
(5-амино-3-(3-фторфенил)изоксазол-4-ил)(4-(3,4-дихлорфенил)пиперазин-1-ил)метанон,
(5-амино-3-(3-фторфенил)изоксазол-4-ил)(4-(3-метоксифенил)пиперазин-1-ил)метанон,
(5-амино-3-(3-фторфенил)изоксазол-4-ил)(4-(2-метоксифенил)пиперазин-1-ил)метанон,
(5-амино-3-(3-фторфенил)изоксазол-4-ил)(4-(3-(трифторметил)фенил)пиперазин-1-ил)метанон,
(5-амино-3-(3-фторфенил)изоксазол-4-ил)(4-(4-гидроксифенил)пиперазин-1-ил)метанон,
(5-амино-3-(3-фторфенил)изоксазол-4-ил)(4-(2-гидроксифенил)пиперазин-1-ил)метанон,
(5-амино-3-(3-фторфенил)изоксазол-4-ил)(4-(4-фторфенил)пиперазин-1-ил)метанон,
(5-амино-3-(2-фторфенил)изоксазол-4-ил)(4-(2-фторфенил)пиперазин-1-ил)метанон,
(5-амино-3-(2-фторфенил)изоксазол-4-ил)(4-(3,4-дихлорфенил)пиперазин-1-ил)метанон,
(5-амино-3-(2-фторфенил)изоксазол-4-ил)(4-(3-(метоксифенил)пиперазин-1-ил)метанон,
(5-амино-3-(2-фторфенил)изоксазол-4-ил)(4-(2-метоксифенил)пиперазин-1-ил)метанон,
(5-амино-3-(2-фторфенил)изоксазол-4-ил)(4-(3-(трифторметил)фенил)пиперазин-1-ил)метанон,
(5-амино-3-(2-фторфенил)изоксазол-4-ил)(4-(4-гидроксифенил)пиперазин-1-ил)метанон,
(5-амино-3-(2-фторфенил)изоксазол-4-ил)(4-(4-фторфенил)пиперазин-1-ил)метанон,
(5-амино-3-(2-(трифторметокси)фенил)изоксазол-4-ил)(4-(2-фторфенил)пиперазин-1-ил)метанон,
(5-амино-3-(2-(трифторметокси)фенил)изоксазол-4-ил)(3,4-(дихлорфенил)пиперазин-1-ил)метанон,
(5-амино-3-(2-(трифторметокси)фенил)изоксазол-4-ил)(4-(3-метоксифенил)пиперазин-1-ил)метанон,
(5-амино-3-(2-(трифторметокси)фенил)изоксазол-4-ил)(4-(2-метоксифенил)пиперазин-1-ил)метанон,
(5-амино-3-(2-(трифторметокси)фенил)изоксазол-4-ил)(4-((3-трифторметил)фенил)пиперазин-1-ил)метанон,
(5-амино-3-(2-(трифторметокси)фенил)изоксазол-4-ил)(4-(4-гидроксифенил)пиперазин-1-ил)метанон,
(5-амино-3-(2-(трифторметокси)фенил)изоксазол-4-ил)(4-(2-гидроксифенил)пиперазин-1-ил)метанон,
(5-амино-3-(2-(трифторметокси)фенил)изоксазол-4-ил)(4-(4-фторфенил)пиперазин-1-ил)метанон,
(5-амино-3-(2-(трифторметил)фенил)изоксазол-4-ил)(4-(2-фторфенил)пиперазин-1-ил)метанон,
(5-амино-3-(2-(трифторметил)фенил)изоксазол-4-ил)(4-(3,4-дихлорфенил)пиперазин-1-ил)метанон,
(5-амино-3-(2-(трифторметил)фенил)изоксазол-4-ил)(4-(3-метоксифенил)пиперазин-1-ил)метанон,
(5-амино-3-(2-(трифторметил)фенил)изоксазол-4-ил)(4-(2-метоксифенил)пиперазин-1-ил)метанон,
(5-амино-3-(2-(трифторметил)фенил)изоксазол-4-ил)(4-(3-(трифторметил)фенил)пиперазин-1-ил)метанон,
(5-амино-3-(2-(трифторметил)фенил)изоксазол-4-ил)(4-(4-гидроксифенил)пиперазин-1-ил)метанон,
(5-амино-3-(2-(трифторметил)фенил)изоксазол-4-ил)(4-(2-гидроксифенил)пиперазин-1-ил)метанон,
(5-амино-3-(2-(трифторметил)фенил)изоксазол-4-ил)(4-(4-фторфенил)пиперазин-1-ил)метанон,
(5-амино-3-(4-(трифторметокси)фенил)изоксазол-4-ил)(4-(2-фторфенил)пиперазин-1-ил)метанон,
(5-амино-3-(4-(трифторметокси)фенил)изоксазол-4-ил)(4-(3,4-дихлорфенил)пиперазин-1-ил)метанон,
(5-амино-3-(4-(трифторметокси)фенил)изоксазол-4-ил)(4-(3-метоксифенил)пиперазин-1-ил)метанон,
(5-амино-3-(4-(трифторметокси)фенил)изоксазол-4-ил)(4-(2-метоксифенил)пиперазин-1-ил)метанон,
(5-амино-3-(4-(трифторметокси)фенил)изоксазол-4-ил)(4-(3-(трифторметил)фенил)пиперазин-1-ил)метанон,
(5-амино-3-(4-(трифторметокси)фенил)изоксазол-4-ил)(4-(4-гидроксифенил)пиперазин-1-ил)метанон,
(5-амино-3-(4-(трифторметокси)фенил)изоксазол-4-ил)(4-(2-гидроксифенил)пиперазин-1-ил)метанон,
(5-амино-3-(4-(трифторметокси)фенил)изоксазол-4-ил)(4-(4-фторфенил)пиперазин-1-ил)метанон,
(5-амино-3-(3-(трифторметил)фенил)изоксазол-4-ил)(4-(2-фторфенил)пиперазин-1-ил)метанон,
(5-амино-3-(3-(трифторметил)фенил)изоксазол-4-ил)(4-(3,4-дихлорфенил)пиперазин-1-ил)метанон,
(5-амино-3-(3-(трифторметил)фенил)изоксазол-4-ил)(4-(3-метоксифенил)пиперазин-1-ил)метанон,
(5-амино-3-(3-(трифторметил)фенил)изоксазол-4-ил)(4-(2-метоксифенил)пиперазин-1-ил)метанон,
(5-амино-3-(3-(трифторметил)фенил)изоксазол-4-ил)(4-(3-(трифторметил)фенил)пиперазин-1-ил)метанон,
(5-амино-3-(3-(трифторметил)фенил)изоксазол-4-ил)(4-(4-гидроксифенил)пиперазин-1-ил)метанон,
(5-амино-3-(3-(трифторметокси)фенил)изоксазол-4-ил)(4-(2-гидроксифенил)пиперазин-1-ил)метанон,
(5-амино-3-(3-(трифторметил)фенил)изоксазол-4-ил)(4-(4-фторфенил)пиперазин-1-ил)метанон,
(5-амино-3-(3-(трифторметокси)фенил)изоксазол-4-ил)(4-(2-фторфенил)пиперазин-1-ил)метанон,
(5-амино-3-(3-(трифторметокси)фенил)изоксазол-4-ил)(3,4-(дихлорфенил)пиперазин-1-ил)метанон,
(5-амино-3-(3-(трифторметокси)фенил)изоксазол-4-ил)(4-(3-метоксифенил)пиперазин-1-ил)метанон,
(5-амино-3-(3-(трифторметокси)фенил)изоксазол-4-ил)(4-(2-метоксифенил)пиперазин-1-ил)метанон,
(5-амино-3-(3-(трифторметокси)фенил)изоксазол-4-ил)(4-(3-(трифторметил)фенил)пиперазин-1-ил)метанон,
(5-амино-3-(3-(трифторметокси)фенил)изоксазол-4-ил)(4-(4-гидроксифенил)пиперазин-1-ил)метанон,
(5-амино-3-(3-(трифторметокси)фенил)изоксазол-4-ил)(4-(2-гидрофенил)пиперазин-1-ил)метанон,
(5-амино-3-(3-(трифторметокси)фенил)изоксазол-4-ил)(4-(4-фторфенил)пиперазин-1-ил)метанон,
этил-1-(5-амино-3-(2-хлорфенил)изоксазол-4-карбонил)пиперидин-4-карбоксилат,
метил-1-(5-амино-3-(2-фторфенил)изоксазол-4-карбонил)пиперидин-4-карбоксилат,
этил-1-(5-амино-3-(2-(трифторметокси)фенил)изоксазол-4-карбонил)пиперидин-4-карбоксилат или
этил-1-(5-амино-3-(2-(трифторметил)фенил)изоксазол-4-карбонил)пиперидин-4-карбоксилат.
5. Соединение или его фармацевтически приемлемая соль, гидрат, сольват по любому одному из пп.1-3, где указанное соединение включает
(4-(3-метоксифенил)пиперазин-1-ил)(5-метил-3-(2-(трифторметил)фенил)изоксазол-4-ил)метанон,
(4-(2-метоксифенил)пиперазин-1-ил)(5-метил-3-(2-(трифторметил)фенил)изоксазол-4-ил)метанон,
(3-(2-хлорфенил)-5-метилизоксазол-4-ил)(4-(3-метоксифенил)пиперазин-1-ил)метанон,
(4-(3,4-дихлорфенил)пиперазин-1-ил)(3-(3-фторфенил)-5-метилизоксазол-4-ил)метанон,
(3-(3-фторфенил)-5-метилизоксазол-4-ил)(4-(3-метоксифенил)пиперазин-1-ил)метанон,
(3-(3-фторфенил)-5-метилизоксазол-4-ил)(4-(2-гидроксифенил)пиперазин-1-ил)метанон,
(4-(3,4-дихлорфенил)пиперазин-1-ил)(3-(2-фторфенил)-5-метилизоксазол-4-ил)метанон,
(3-(2-фторфенил)-5-метилизоксазол-4-ил)(4-(3-метоксифенил)пиперазина-1-ил)метанон,
(4-(3,4-дихлорфенил)пиперазин-1-ил)(5-метил-3-(4-(трифторметокси)фенил)изоксазол-4-ил)метанон,
(4-(3,4-дихлорфенил)пиперазин-1-ил)(5-метил-3-(2-(трифторметокси)фенил)изоксазол-4-ил)метанон,
(4-(3-метоксифенил)пиперазин-1-ил)(5-метил-3-(3-(трифторметил)фенил)изоксазол-4-ил)метанон,
(4-(2-гидроксифенил)пиперазин-1-ил)(5-метил-3-(3-(трифторметил)фенил)изоксазол-4-ил)метанон,
(4-(3,4-дихлорфенил)пиперазин-1-ил)(5-метил-3-(3-(трифторметокси)фенил)изоксазол-4-ил)метанон,
(4-(3-метоксифенил)пиперазин-1-ил)(5-метил-3-(3-(трифторметокси)фенил)изоксазол-4-ил)метанон,
(5-амино-3-(2-хлорфенил)изоксазол-4-ил)(4-(3-метоксифенил)пиперазин-1-ил)метанон,
(5-амино-3-(2-хлорфенил)изоксазол-4-ил)(4-(2-метоксифенил)пиперазин-1-ил)метанон,
(5-амино-3-(3-фторфенил)изоксазол-4-ил)(4-(3,4-дихлорфенил)пиперазин-1-ил)метанон,
(5-амино-3-(3-фторфенил)изоксазол-4-ил)(4-(2-гидроксифенил)пиперазин-1-ил)метанон,
(5-амино-3-(2-фторфенил)изоксазол-4-ил)(4-(3,4-дихлорфенил)пиперазин-1-ил)метанон,
(5-амино-3-(2-фторфенил)изоксазол-4-ил)(4-(3-метоксифенил)пиперазин-1-ил)метанон,
(5-амино-3-(2-(трифторметокси)фенил)изоксазол-4-ил)(3,4-(дихлорфенил)пиперазин-1-ил)метанон,
(5-амино-3-(2-(трифторметокси)фенил)изоксазол-4-ил)(4-(3-метоксифенил)пиперазин-1-ил)метанон,
(5-амино-3-(2-(трифторметил)фенил)изоксазол-4-ил)(4-(3,4-дихлорфенил)пиперазин-1-ил)метанон,
(5-амино-3-(2-(трифторметил)фенил)изоксазол-4-ил)(4-(3-метоксифенил)пиперазин-1-ил)метанон,
(5-амино-3-(3-(трифторметил)фенил)изоксазол-4-ил)(4-(3,4-дихлорфенил)пиперазин-1-ил)метанон,
(5-амино-3-(3-(трифторметил)фенил)изоксазол-4-ил)(4-(3-метоксифенил)пиперазин-1-ил)метанон,
(5-амино-3-(3-(трифторметил)фенил)изоксазол-4-ил)(4-(2-гидроксифенил)пиперазин-1-ил)метанон,
(5-амино-3-(3-(трифторметокси)фенил)изоксазол-4-ил)(4-(3,4-дихлорфенил)пиперазин-1-ил)метанон,
(5-амино-3-(3-(трифторметокси)фенил)изоксазол-4-ил)(4-(3-метоксифенил)пиперазин-1-ил)метанон,
(5-амино-3-(3-(трифторметокси)фенил)изоксазол-4-ил)(4-(2-гидрофенил)пиперазин-1-ил)метанон,
этил-1-(5-амино-3-(2-хлорфенил)изоксазол-4-карбонил)пиперидин-4-карбоксилат или
этил-1-(5-амино-(3-(2-трифторметокси)фенил)изоксазол-4-карбонил)пиперидин-4-карбоксилат.
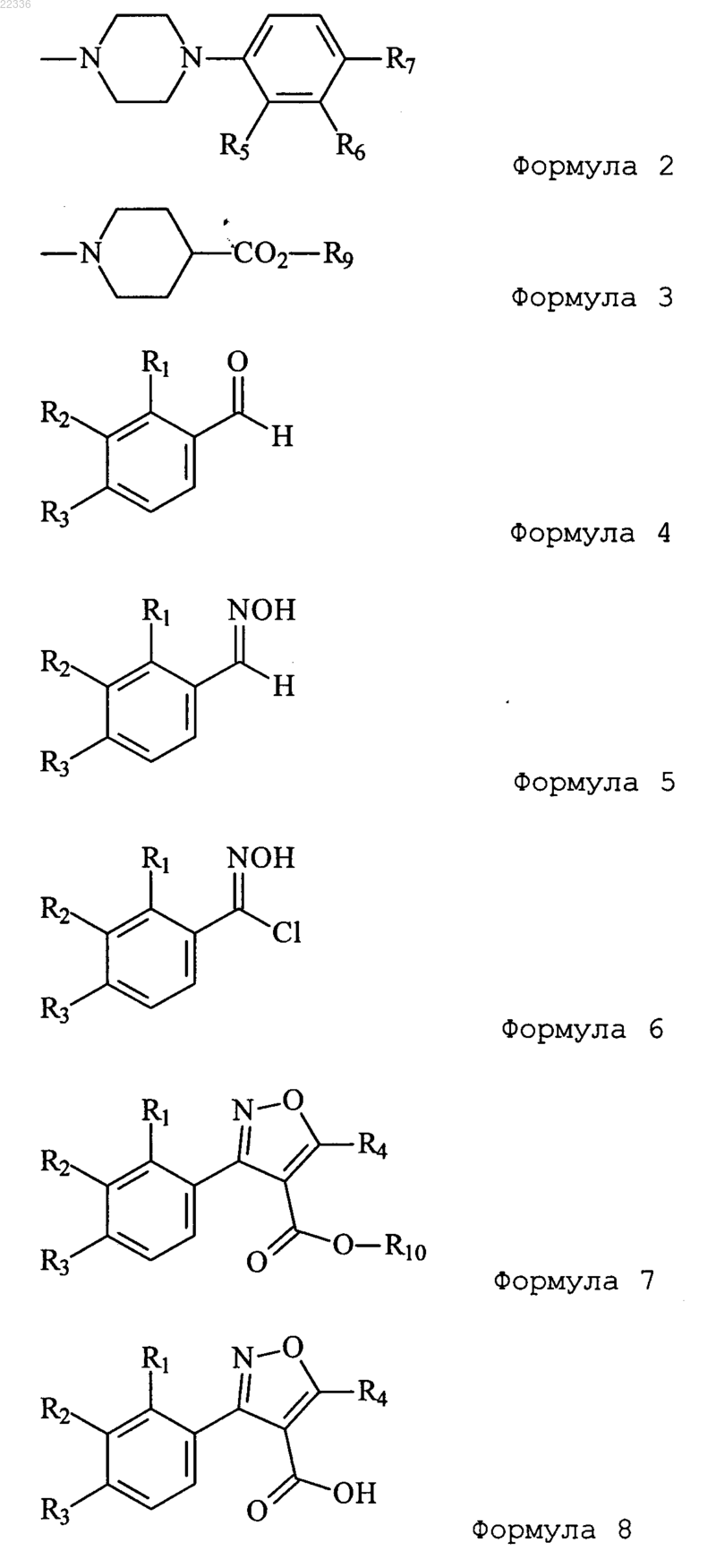
6. Способ получения соединения, представленного формулой 1, по п.1, включающий следующие стадии:
взаимодействие соединения, представленного формулой 4, с хлоридом гидроксиаммония в присутствии основания с получением соединения, представленного формулой 5;
хлорирование соединения, представленного формулой 5, с получением соединения, представленного формулой 6;
циклизация соединения, представленного формулой 6, с получением соединения, представленного формулой 7, в качестве соединения изоксазола;
удаление R10 как алкильной группы формулы 7 с получением соединения, представленного формулой 8; и
взаимодействие соединения, представленного формулой 8, с соединением, представленным формулой 2 или 3, с получением соединения, представленного формулой 9а или 9b
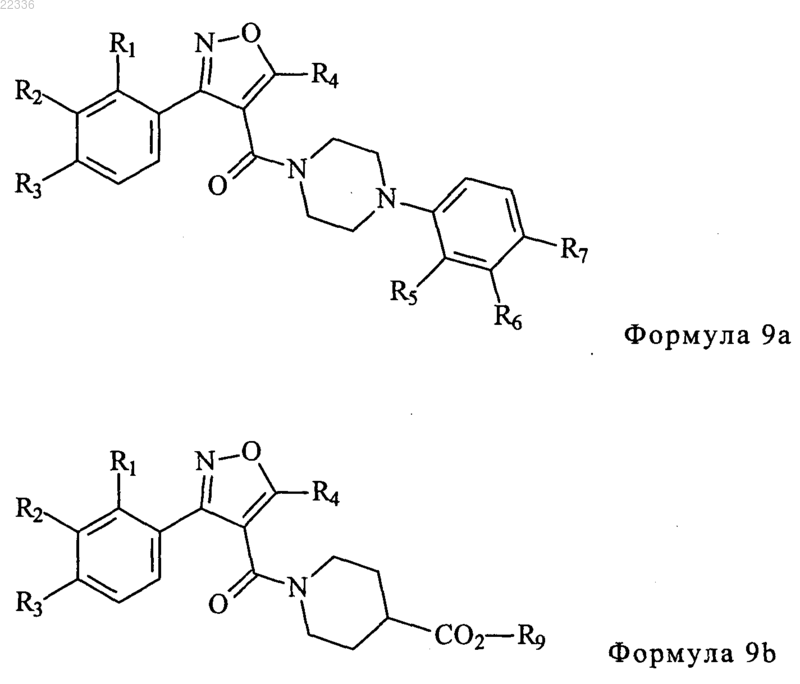
где в формулах R1-R9 такие же, как определено в п.1, и R10 представляет метил- или этилгруппу.
7. Способ по п.6, в котором указанный способ осуществляют в присутствии растворителя и/или кислоты или основания, в котором растворитель, кислота и основание не оказывают отрицательного воздействия на реакцию.
8. Способ по п.7, в котором растворитель представляет собой по меньшей мере один растворитель, выбранный из группы, включающей тетрагидрофуран, метиленхлорид, этанол, N,N-диметилформамид, N,N-диметилацетамид, этилацетат, трет-бутанол, толуол и диоксан.
9. Способ по п.7, где основание представляет собой по меньшей мере одно основание, выбранное из группы, включающей пиридин, триэтиламин, диэтиламин, карбонат натрия, карбонат калия, гидроксид натрия, гидроксид калия, гидрид натрия, метоксид натрия, этоксид натрия, трет-бутоксид натрия, трет-бутоксид калия, литий-алюминий-гидрид, боргидрид лития, нитрат натрия и карбонат цезия.
10. Способ по п.7, в котором кислота представляет собой по меньшей мере одну кислоту, выбранную из группы, состоящей из трифторуксусной кислоты, соляной кислоты, азотной кислоты, серной кислоты, бромноватой кислоты, бромид цинка и уксусной кислоты.
11. Композиция для лечения и профилактики вирусной инфекции, содержащая соединение по любому из пп.1-4 или его фармацевтически приемлемую соль, гидрат, сольват или их смесь и фармацевтически приемлемый носитель или наполнитель.
12. Фармацевтическая композиция для лечения или профилактики вирусной инфекции, содержащая соединение по любому из пп.1-4 или его фармацевтически приемлемую соль, гидрат, сольват или их смесь и его фармацевтически приемлемый носитель или наполнитель.
13. Применение соединения по любому из пп.1-4 или его фармацевтически приемлемой соли, гидрата, сольвата или их смеси для получения фармацевтической композиции для лечения или профилактики вирусной инфекции.
14. Способ профилактики или лечения вирусной инфекции, включающий введение терапевтически эффективного количества соединения по любому из пп.1-4 или его фармацевтически приемлемой соли, гидрата, сольвата или их смеси млекопитающему, включая людей.
Текст
Раскрыты соединение - производное фенилизоксазола или его фармацевтически приемлемое производное, которое пригодно для применения в качестве препарата для лечения вирусных инфекций, в частности инфекции вируса гриппа, способ его получения, а также фармацевтическая композиция для лечения заболеваний, содержащая указанное соединение в качестве активного ингредиента. Ким Донг Йеон, Чо Дае Джин, Лее Гонг Йеал, Ким Хонг Йоуб, Воо Сеок Хун, Лее Хае Ун, Ким Сунг Моо, Ахн Чоонг Ам, Йоон Сеунг Бин (KR) Харченко Е.А. (RU) Область техники Настоящее изобретение относится к новому производному фенилизоксазола, обладающему антивирусной активностью против вируса гриппа и других похожих вирусов, которое пригодно для лечения и предупреждения вирусной инфекции. Также настоящее изобретение относится к способу, использующему это соединение для лечения и предупреждения инфекции вируса гриппа и других похожих вирусов, к композиции, содержащей указанное соединение, к способу получения указанного соединения и к промежуточным соединениям для синтеза, используемым в указанном способе получения. Предшествующий уровень техники Вирус гриппа вызывает инфекционное острое лихорадочное респираторное заболевание у хозяина. Когда вирус гриппа является эпидемическим, он может легко распространяться через границы ввиду его сильной инфекционности. Кроме того, он может быть непредсказуемым образом мутированным, тем самым вызывая межвидовую инфекцию. Таким образом, необходимо обеспечить общемировые методы противодействия и системы мониторинга. Вирус гриппа таксономически определяется как член Orthomyxovirus и имеет три типа А, В и С. В особенности типы А и В являются эпидемически распространяющимися. Грипп типа А имеет высокую изменчивость и заражает птиц, свиней и лошадей, а также людей природно-очаговым способом. Кроме того, грипп типа А включает в себя различные подтипы в зависимости от комбинации поверхностных антигенов (НА и NA). В отличие от гриппа типа А грипп типа В вызывает относительно лгкие симптомы и заражает людей и тюленей. В частности, у людей он главным образом вызывает заболевание у детей. Тип С гриппа может инфицировать людей и свиней, но, как известно, имеет относительно низкую патогенность по отношению к человеку. На поверхности этих вирусов находятся два вида поверхностных антигенов (то есть гликопротеины гемагглютинина (НА) и нейраминидазы (NA. Кроме того, внутри вирусов находятся 8 фрагментированных РНК. Гемагглютинин имеет тримерную структуру, включающую головку и стебель. В области головки находится большинство антигенных мутаций, а сама головка прикрепляет вирус к клетке-хозяину путм связывания с концевым остатком сиаловой кислоты на поверхности клетки-хозяина и в дальнейшем позволяет вирусу проникнуть в клетку-хозяина. Нейраминидазы представляют собой грибовидные тетрамером с головкой и стебелем. На поверхности головки находится активная область, которая расщепляет альфа-кетозидную связь, соединяющую остаток концевой нейраминовой кислоты с олигосахаридным фрагментом на поверхности клетки. Это расщепление выполняет важную роль, когда реплицированный и размножившийся внутри инфицированной клетки вирус выходит из клетки-хозяина и проникает через мембрану клетки слизистой оболочки органа дыхания. Поверхностные антигены вируса мутируют внутри одного подтипа, и каждый год появляется мутантный штамм с новым антигеном. В особенности, среди вирусов гриппа вирус птичьего гриппа, который недавно был проблемным, заражает различные виды птиц, таких как куры, индейки, утки, а также диких птиц посредством антигенного сдвига и быстро распространяется. Когда куры заражаются вирусом, уровень смертности составляет 80% или более. Таким образом, это вирус, вызывающий серьезный ущерб и угрожающий сельскохозяйственному производству домашней птицы по всему миру. Кроме того, сообщалось, что его волновой эффект не ограничивается отраслью птицеводства. Другими словами,вирус может передаваться человеку, заражая организм человека. Таким образом, исследование по лечению вируса может включать в себя ингибирование адсорбции вируса на эпителиальные клетки, ингибирование проникновения в клетку, ингибирование транскрипции и репликации гена, ингибирование синтеза белка, ингибирование высвобождения из клетки и тому подобное. Каждое из перечисленного является целью разработки новых противовирусных препаратов. Традиционно разрабатываемые представители терапевтических агентов для лечения вируса гриппа включают в себя 4 вещества, такие как амантадин, римантадин, занамивир и осельтамивир, которые бы-1 022336 ли утверждены Управлением по Контролю Качества Продуктов и Лекарств США (FDA) (см. фиг. 1-4). Амантадин или римантадин являются блокаторами М 2 ионных каналов, обладающими активностью только против штамма вируса Hamagglutinin (вирус гриппа) и прерывающими репликацию вирусной частицы, внедрнной в клетку-хозяин. Эти препараты эффективны только против вируса гриппа типа А. Кроме того, поскольку они использовались в течение 40 лет, известно, что появился вирус, устойчивый к лекарствам, а указанные препараты вызывают серьезные побочные эффекты в нервной системе и желудке. При этом осельтамивир (Корейская патентная публикация 10-1998-0703600) или занамивир (зарегистрированный патент Кореи 0169496) представляют собой ингибиторы нейраминидазы, обладающие активностью только против штамма вируса Neuraminidase (вирус гриппа), и предотвращают выход реплицированного вируса из клетки-хозяина. Два вида терапевтических агентов вмешиваются в один процесс инфекции вируса гриппа и прерывают этот процесс, тем самым ингибируя распространение вируса. Тем не менее, занамивир обладает высоким противовирусным действием, но имеет недостатки, такие как низкая биодоступность и быстрое высвобождение через почки. Кроме того, сообщалось о том, что у осельтамивира имеются некоторые побочные эффекты, такие как генерация устойчивого вируса и серьезные рвотные симптомы. После использования этих препаратов в качестве противовирусных терапевтических агентов недавно быстро появились мутантные вирусы, вызывающие серьезные побочные эффекты, обладающие высокой переносимостью и высокой устойчивостью. Таким образом, их применение требует большой осторожности. Кроме того, при разработке вакцины существует проблема в том, что когда тип эпидемии вируса не соответствует вирусу вакцины, эффект будет незначительным. Таким образом, крайне необходимо разработать улучшенный препарат, который обладает высокой эффективностью в лечении и профилактике инфекции гриппа и имеет высокую стабильность. Описание изобретения Техническая проблема Проводя исследования, авторы настоящего изобретения изобрели в качестве противовирусного агента, лучшего, чем традиционно используемый агент, новое соединение фенилизоксазола, имеющее высокую ингибирующую активность вируса гриппа и высокий профилактический эффект репликации вируса, которое может лечить или предупреждать болезнь, вызванную вирусом гриппа. Настоящее изобретение было призвано решить вышеупомянутые недостатки. В результате авторы изобретения обнаружили соединение, представленное формулой 1, которое имеет новую структуру, отличную от структуры традиционно разработанных соединений. Затем, основываясь на этой находке, они завершили это изобретение. Решение проблемы В соответствии с одним аспектом настоящего изобретения предложено производное фенилизоксазола, представленное формулой 1, приведнной ниже, или его фармацевтически приемлемая соль, гидрат, сольват, пролекарство или композиция. Формула 1 В указанной выше формуле R1, R2 и R3 каждый независимо представляет собой водород, низший алкил, необязательно замещенный галогеном, низшую алкоксигруппу, необязательно замещенную галогеном, или галоген,R4 представляет собой метил или амин иR8 может быть замещен радикалом формулы 2, приведнной ниже, или замещен радикалом формулы 3, приведнной ниже Формула 2 где R5, R6 и R7 каждый независимо представляет собой водород, низший алкил, необязательно замещенный галогеном, гидроксильную группу, низшую алкоксигруппу или галоген, и В соответствии с другим аспектом настоящего изобретения предлагается композиция, включающая соединение согласно настоящему изобретению или его фармацевтически приемлемую соль, гидрат,сольват, пролекарство или композицию и фармацевтически приемлемый носитель или наполнитель. В соответствии с еще одним аспектом настоящего изобретения предложена фармацевтическая композиция для лечения или профилактики вирусной инфекции, при этом указанная композиция включает соединение согласно настоящему изобретению или его фармацевтически приемлемую соль, гидрат,сольват, пролекарство или композицию и фармацевтически приемлемый носитель или наполнитель. В соответствии с ещ одним аспектом настоящего изобретения обеспечивается применение профилактического соединения или его фармацевтически приемлемой соли, гидрата, сольвата, пролекарства или композиции для получения фармацевтической композиции для лечения или профилактики вирусной инфекции. В соответствии с еще одним аспектом настоящего изобретения предлагается способ профилактики или лечения вирусной инфекции, при этом способ включает стадию введения терапевтически эффективного количества соединения согласно настоящему изобретению или его фармацевтически приемлемой соли, гидрата, сольвата, пролекарства или композиции для млекопитающих, включая людей, требующих лечения вирусной инфекции или е профилактики. Способ осуществления настоящего изобретения Далее настоящее изобретение будет описано более подробно. Инфекция вируса гриппа, вызванная вирусом гриппа, это болезнь, часто смертельная для человека и животных. Вирус гриппа вызывает инфекционное острое лихорадочное заболевание органов дыхания в организме хозяина. Когда вирус гриппа является эпидемическим, он может легко распространяться через границы ввиду его сильной инфекционности. Кроме того, он может быть непредсказуемо по-разному мутированным, тем самым вызывая межвидовые инфекции. Таким образом, необходимо обеспечить общемировые контрмеры и мониторинг. Однако в отличие от противогрибкового средства и т.д. существуют лишь ограниченные виды лекарств, применимые к гриппу. Например, в настоящее время представители терапевтических агентов,которые были недавно использованы как ингибиторы нейраминидазы, включают осельтамивир и занамивир. Эти терапевтические агенты выполняют роль ингибиторов распространения вируса гриппа. Тем не менее, занамивир имеет высокий противовирусный эффект, но имеет недостатки, такие как низкую биодоступность и быстрое выведение через почки. Кроме того, для осельтамивира имеются сообщения о некоторых побочных эффектах, таких как генерация устойчивого вируса и серьезные симптомы рвоты. Авторы настоящего изобретения обнаружили соединение, представленное формулой 1, приведнной ниже, а именно производное фенилизоксазола, которое имеет более высокую противовирусную активность в отношении вируса гриппа, а также придат более высокую восприимчивость к ингибиторам репликации вируса, ингибирующих репликацию вируса, чем восприимчивость, соответствующую фосфату осельтамивира. Соответственно настоящее изобретение обеспечивает соединение, представленное формулой 1,приведнной ниже, и его фармацевтически приемлемые производные. Формула 1 В формуле 1 R1, R2, R3, R4 и R8 являются такими же, как определено выше. В настоящем изобретении следует понимать, что "соединение, представленное формулой 1" (или"соединение согласно настоящему изобретению"), пока явно не указано иное, включает его гидрат, сольват фармацевтически приемлемой соли, пролекарство, композицию и его фармацевтически приемлемое производное, в том числе диастереомер или энантиомер. В настоящем изобретении термин "низший алкил" означает линейный или разветвленный насыщенный алифатический углеводородный радикал, который предпочтительно включает от 1 до 12 атомов углерода, в качестве альтернативы 1 до 8 атомов углерода или в качестве альтернативы от 1 до 6 атомов углерода. Примеры алкильного радикала могут включать метил, этил, н-пропил, изопропил, н-бутил,изобутил, вторичный бутил, третичный бутил, пентил, изоамил, н-гексил и подобные им, но настоящее изобретение не ограничивается ими. В настоящем изобретении алкильная группа может быть необязательно замещенной. Кроме того, термин "алкокси" обозначает кислород, добавленный к алкильному заместителю. В настоящем изобретении алкоксигруппа может быть необязательно замещенной. Кроме того, термин "низший галогеналкил" обозначает прямой или разветвленный насыщенный алифатический радикал, который предпочтительно содержит от 1 до 12 атомов углерода, в качестве альтернативы 1 до 8 атомов углерода или в качестве альтернативы от 1 до 6 атомов углерода, в которых во-3 022336 дород замещен галогеном. Кроме того, термин "галоген" означает атом фтора, хлора, брома или иода и предпочтительно обозначает фтор или хлор. В настоящем изобретении галогенная группа может быть необязательно замещенной. Соединение согласно настоящему изобретению также включает соль в рамки настоящего изобретения. Следует понимать, что соединение согласно настоящему изобретению, например соединение, представленное формулой 1, пока прямо не указано иначе, включает его соли. В данном описании термин "соль" означает кислые и/или основные соли, образованные неорганическими и/или органическими кислотой и основанием. Соли соединения согласно настоящему изобретению могут быть, например, получены реакцией соединения согласно настоящему изобретению с кислотой или основанием в том же количестве, что и соединение в среде или водной среде, допускающей осаждение соли. Неограничивающие примеры соли могут включать в себя следующие соли. Соединение может быть подвергнуто действию уксусной кислоты, адипиновой кислоты, бензолсульфоновой кислоты, бензойной кислоты, камфорной кислоты, камфорсульфоновой кислоты, лимонной кислоты, цикламата, этан-1,2 дисульфоновой кислоты, этансульфоновой кислоты, 2-гидроксиэтансульфоновой кислоты, муравьиной кислоты, фумаровой кислоты, бромной кислоты, соляной кислоты, серной кислоты, азотной кислоты,фосфорной кислоты, яблочной кислоты, малеиновой кислоты, метансульфоновой кислоты, нафталин-2 сульфоновой кислоты, нафталин-1,5-дисульфоновой кислоты, 1-гидрокси-2-нафталата, никотиновой кислоты, трифторуксусной кислоты, щавелевой кислоты, п-толуолсульфоновой кислоты, пропионовой кислоты, гликолевой кислоты, янтарной кислоты, винной кислоты, щавелевой кислоты, аминокислоты (например, лизина), салициловой кислоты, 2,2-хлоруксусной кислоты, L-аспарагиновой кислоты, (+)-(1S)камфора-10-сульфокислоты, 4-ацетамидобензойной кислоты, капроновой кислоты, коричной кислоты,2,5-дигидроксибензойной кислоты, глутаровой кислоты, малоновой кислоты, миндальной кислоты, аскорбиновой кислоты памоата, аминосалициловой кислоты или подобных им, чтобы сформировать кислотно-аддитивную соль. Когда существует большое количество основных групп, моно- или полиаддитивная соль кислоты может быть образована. Кроме того, соединение, представленное формулой 1, имеет этиловый эфир в качестве функциональной группы и таким образом может образовывать карбоксильную группу. В кислых или основных условиях, например при рН 11-12 (с основанием, таким как гидроксид натрия, гидроксид калия, карбонат натрия, гидрокарбонат натрия или гидроксид аммония) или при рН 2-3 (с кислотой, такой как соляная кислота или серная кислота), этиловый эфир соединения, представленного формулой 1, может быть гидролизован. Гидролизованное соединение, представленное формулой 1, включает карбоксильную группу,затем образующую катион и соль. Нет конкретных ограничений в отношении вида такой соли, пока она является фармацевтически приемлемой. Примеры таких солей могут включать соли щелочных металлов,такие как соли натрия, калия и лития, соли щелочно-земельных металлов, такие как соли кальция и магния, соли других металлов, таких как соли алюминия, железа, цинка, меди, никеля и кобальта;другие неорганические соли, такие как соли аммония, соль амина, такого как трет-октиламин, дибензиламин,морфолин, глюкозамин, алкиловый эфира фенилглицина, этилендиамин, метилглюкамин, гуанидин, диэтиламин, триэтиламин, дициклогексиламин, N,N-дибензилэтилендиамин, хлорпрокаин, прокаин, диэтаноламин, бензилфенилэтиламин, пиперазин, соли тетраэтиламмония и трис-(гидроксиметил)аминометана. В данном описании термин "фармацевтически приемлемое производное" означает гидрат соединения согласно настоящему изобретению, сольват, фармацевтически приемлемую соль, пролекарство или композицию, которые обеспечивают необходимую биологическую активность соединения и не проявляют нежелательные токсикологические эффекты. Настоящее изобретение также включает пролекарства соединения согласно настоящему изобретению. Термин "пролекарство" означает соединение, ковалентно связанное с носителем. Пролекарство может высвобождать активный ингредиент будучи введенным субъекту млекопитающего. Высвобождение активного ингредиента может происходить в живом организме, а пролекарства могут быть получены с помощью технологии, известной специалистам в данной области. В таких технологиях в определенном соединении модифицируется соответствующая функциональная группа. Тем не менее, изменнная функциональная группа восстанавливает оригинальную функциональную группу посредством общего действия или в живом организме. Неограничивающие примеры пролекарства включают сложный эфир(например, ацетат, формиат и бензоат производной) и подобные им. Соединение согласно настоящему изобретению обладает ингибирующей активностью в отношении штамма вируса гриппа и является весьма эффективным для лечения и профилактики инфекции гриппа,имеющей чувствительность к ингибиторам репликации вируса, ингибирующих репликацию вируса, и других подобных вирусов. В соответствии с вариантом осуществления настоящего изобретения в соединении, представленном формулой 1, предпочтительно, что когда радикал формулы 2 заменяет R8, два радикала из R1, R2 и R3 означают водород, один оставшийся представляет собой низший алкил, необязательно замещенный гало-4 022336 геном, низшую алкоксигруппу, необязательно замещенную галогеном, или галоген, предпочтительно фтор или хлор. R4 представляет собой метил или амин, а один или два из R5, R6 и R7, каждый независимо,представляет собой водород, низший алкил, необязательно замещенный галогеном, гидроксильной группой, низшей алкоксигруппой или галогеном, или R1 представляет собой галоген, предпочтительно хлор,R4 представляет собой метил или амин, R2, R3, R5 и R7 каждый обозначает водород и R6 означает алкоксигруппу, предпочтительно метоксигруппу. Когда радикал формулы 3 заменяет R8, два радикала из R1,R2 и R3 означают водород, а один оставшийся представляет собой низший алкил, необязательно замещенный галогеном, низшую алкоксигруппу, необязательно замещенную галогеном, или галоген, R4 обозначает амин, a R9 представляет собой низший алкил. Формула 2 В другом варианте осуществления настоящего изобретения соединение, представленное формулой 1, более предпочтительно, когда радикал формулы 2 заменяет R8, два из радикалов R1, R2 и R3 означают водород, а оставшийся обозначает трифторметил, фтор или трифторметоксигруппу, R4 представляет собой метил или амин, один или два из R5, R6 и R7, один или два каждый независимо представляет собой водород, метокси, хлор, фтор, трифторметил или гидроксил, или R1 представляет собой галоген, предпочтительно хлор, R4 представляет собой метил или амин, R2, R3, R5 и R7 каждый означает водород и R6 обозначает алкокси-, предпочтительно метоксигруппу. Когда радикал формулы 3 заменяет R8, R4 представляет собой амин, два из числа R1, R2 и R3 означают водород, один оставшийся представляет собой трифторметил, фтор или трифторметокси, и R9 представляет собой метил или этил. Для ингибирования вируса гриппа особенно предпочтительно, когда радикал формулы 2 заменяет R8, R1 обозначает трифторметил или трифторметокси, R2 и R3 означают водород, R4 означает метил, и один или два из радикалов R5, R6 и R7, один или два каждый независимо представляет собой водород, гидрокси, метокси или хлор; R1 обозначает хлор, R4 обозначает метил, R2, R3, R5 и R7 означают водород и R6 обозначает метокси или R2 представляет собой фтор, трифторметил или трифторметокси, R1 и R3 означают водород, R4 представляет собой метил или амин, и один или два из радикалов R5, R6 и R7 каждый независимо представляет собой водород, гидрокси, метокси, трифторметил или хлор. Между тем, когда радикал формулы 3 заменяет R8, R1 представляет трифторметокси, R2 и R3 представляют собой водород, R4 представляет собой амин и R9 представляет собой этил. Соединение согласно настоящему изобретению, представленное формулой 1, может быть получено с помощью следующего процесса синтеза. Изомер и сольват (например, гидрат) соединения, представленного формулой 1, также входят в объм настоящего изобретения. Метод сольватации, как правило,известен в данной области техники. Соответственно соединения согласно настоящему изобретению могут быть использованы в виде фармацевтически приемлемой соли или гидрата и могут быть получены в соответствии со способом, описанным на схеме реакции ниже. Соединение формулы 1 согласно настоящему изобретению получают в ходе следующих стадий: взаимодействие соединения, представленного формулой 4 ниже, предпочтительно с хлоридом гидроксиламиния в присутствии основания с получением соединения, представленного формулой 5 ниже; хлорирования соединения, представленного формулой 5, таким образом, чтобы получить соединение, представленное формулой 6 ниже; циклизации соединения, представленного формулой 6, таким образом,чтобы получить соединение, представленное формулой 7 ниже, в качестве соединения изоксазола; удаление R10 в качестве защитной группы формулы 7 с тем, чтобы получить соединение, представленное формулой 8; и взаимодействие соединения, представленного формулой 8, с соединением, представленным формулой 2 или 3, с тем, чтобы получить соединение, представленное формулой 9 а или 9b. Формула 4R10 представляет собой низший алкил, предпочтительно метил, этил или изопропил. Схема реакции 1 На схеме реакции 1 выше R1-R10 такие же, как определено выше. Фенилальдегидное соединение (I), имеющее R1, R2 и R3 замещения в бензольном кольце, были коммерчески доступными. Фенилальдегидное соединение (I) подвергают взаимодействию с хлоридом гидроксиаминия или его эквивалентом в присутствии основания с тем, чтобы синтезировать соединение бензальдегида (II). Затем с помощью реакции хлорирования получают соединение бензимидоилхлорида(III). Соединение изоксазола (V), в которой R4 замещен метилом или амином, могут быть получены с помощью обычно используемого способа синтеза (циклизации) с помощью алкилового эфира ацетоуксусной кислоты или алкилцианоацетата. Из фенилизоксазольного производного соединения (V, R4 = ме-6 022336 тил) или соединения (V, R4 = амин), содержащего карбоксильную группу и аминогруппу, получают фенилизоксазольное производное соединения (VIa или VIb), используя 1-этил-3-(3'-диметиламинопропил)карбодимидгидрохлорид (EDCl) или гидроксибензотриазол (HOBt) в присутствии основания. Способ получения согласно настоящему изобретению может быть осуществлн предпочтительно в растворителе в присутствии основания или кислоты. При этом нет никаких конкретных ограничений по отношению к растворителю, кислоте и основанию до тех пор, пока они не оказывают отрицательного влияния на реакцию. Например, растворителем может быть по меньшей мере одно соединение, выбранное из группы, включающей тетрагидрофуран, метиленхлорид, этанол, N,N-диметилформамид, N,Nдиметилацетамид, этилацетат, трет-бутанол, толуол и диоксан. Основанием может быть по меньшей мере одно соединение, выбранное из группы, включающей пиридин, триэтиламин, диэтиламин, карбонат натрия, карбонат калия, гидроксид натрия, гидроксид калия, гидрид натрия, метоксид натрия, этоксид натрия, трет-бутоксид натрия, трет-бутоксид калия, литийалюминийгидрид, боргидрид лития, нитрат натрия и карбонат цезия. Кислотой может быть по меньшей мере одна кислота, выбранная из группы,состоящей из трифторуксусной кислоты, соляной кислоты, азотной кислоты, серной кислоты, бромистой кислоты и уксусной кислоты. Исходные материалы, используемые при получении соединений согласно настоящему изобретению в соответствии с указанным способом, коммерчески доступны или могут быть легко куплены. Реакция может быть проведена при охлаждении или нагревании. После завершения реакции конечное соединение может быть очищено в соответствии с обычным методом последующей обработки, таким как колоночная хроматография, перекристаллизация и т.п. Между тем, настоящее изобретение относится к фармацевтической композиции для лечения или профилактики вирусной инфекции, в котором соединение, представленное формулой 1, или его фармацевтически приемлемое производное вводят в количестве, эффективном для млекопитающих, включая человека. В частности, указанная композиция является эффективной в ингибировании инфекции гриппа и, следовательно, может быть эффективно использована при лечении таких заболеваний. Когда установлено, что соединения согласно настоящему изобретению являются эффективными в ингибировании болезни, вводят одну дозу или многократные дозы, обычно находящиеся в интервале от 0,01 до 750 мг/кг в день, предпочтительно в диапазоне от 0,1 до 100 мг и наиболее предпочтительно в диапазоне от 0,5 до 25 мг. Однако конкретная доза для конкретного пациента может варьироваться в зависимости от конкретного соединения, веса пациента, пола, диеты, времени введения препарата, способа введения, скорости высвобождения, соотношения препарата в смеси, состояния пациента, возраста и т.д. Соединение согласно настоящему изобретению может быть использовано в лечении без предварительной подготовки. Однако предпочтительно, чтобы активный ингредиент был представлен в виде фармацевтического препарата. Соответственно настоящее изобретение относится к фармацевтической композиции, полученной смешиванием соединения, представленного формулой 1, или его фармацевтически приемлемого производного вместе с фармацевтически приемлемым носителем и/или наполнителем. Кроме того, соединение согласно настоящему изобретению можно вводить любым подходящим способом. Однако предпочтительно, чтобы соединение вводили путм инъекции или в форме для орального применения. Инъекционный препарат, например стерильные инъекции водной или масляной суспензии, может быть получен с использованием соответствующего материала, такого как диспергатор, смачивающий агент или суспензия в соответствии с известным уровнем техники. В качестве растворителя могут быть использованы вода, раствор Рингера или изотонический раствор NaCl. Кроме того, стерильные нелетучие масла также обычно используются в качестве растворителя или суспендирующей среды. Для этого может быть использовано любое нераздражающее нелетучее масло, включая моноглицерид или диглицерид. Кроме того, в инъекционном препарате может использоваться жирная кислота, такая как олеиновая кислота. Тврдая форма введения для перорального введения может включать капсулы, таблетки, пилюли,порошки и гранулированные формы. В частности, капсулированные и таблетированные формы являются предпочтительными. Таблетки и пилюли предпочтительно могут быть получены в виде кишечных препаратов. Тврдые формы введения могут быть приготовлены путм смешивания активного соединения согласно настоящему изобретению, представленному формулой 1, по крайней мере с одним инертным разбавителем (таким как сахароза, лактоза, крахмал), смазывающим веществом (например, стеарат магния) и носителем (таким как дезинтегрирующий агент, связующий агент и т.д.). Соединение согласно настоящему изобретению обладает ингибирующей активностью в отношении штамма вируса гриппа и может быть использовано для лечения и профилактики инфекции гриппа, имеющей чувствительность к ингибиторам нейраминидазы или ингибиторам репликации вируса, ингибирующих репликацию вируса, и других подобных вирусов. При этом оно может быть использовано в сочетании с вспомогательным терапевтическим агентом, обладающим активностью против того же вируса. Это соединение, например, может быть использовано в сочетании с занамивиром, осельтамивиром,амантадином, римантадином или подобным им агентом. Вводимое количество каждого соединения мо-7 022336 жет быть одинаковым или различным в сравнении с введением количества одного соединения. Далее настоящее изобретение будет описано более подробно со ссылкой на примеры получения и примеры. Однако примеры получения и примеры, описанные ниже, являются только иллюстративными и не ограничивают настоящее изобретение. Пример получения 1. Синтез 2-(трифторметил)бензальдегидоксима 2-(Трифторметил)бензальдегид (34,82 г, 200,0 ммоль) растворяли в этаноле (200 мл) и добавляли гидроксид натрия (12,00 г, 300,0 ммоль), растворнный в очищенной воде (50 мл). Солянокислую соль гидроксиламина (16,68 г, 240 ммоль) растворяли в очищенной воде (50 мл) с последующим перемешиванием в течение 3 ч. После завершения реакции к полученному продукту был добавлен лд. Полученное тврдое вещество отфильтровывали, промывали очищенной водой (600 мл) и сушили до получения тврдого белого вещества целевого соединения (32,15 г, 171 ммоль, 8,5%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 7.23 (dd, 1H), 7.59 (dd, 1H), 7.76 (m, 2H), 8.39 (s, 1H), 11.63 (s, 1H). Пример получения 2. Синтез 2-хлорбензальдегидоксима Таким же образом, как описано в примере получения 1, с использованием 2-хлорбензальдегида(29,14 г, 200,0 ммоль), гидроксида натрия (12,00 г, 300,0 ммоль) и солянокислого гидроксиламина (16,68 г, 240 ммоль) получили тврдое белое вещество целевого соединения (29,73 г, 189 ммоль, 95%). 1 Н-ЯМР(24,82 г, 200,0 ммоль), гидроксида натрия (12,00 г, 300,0 ммоль) и солянокислого гидроксиламина (16,68 г, 240 ммоль) получали тврдое белое вещество целевого соединения (22,48 г, 162 ммоль, 81%). 1 Н-ЯМР(24,82 г, 200,0 ммоль), гидроксида натрия (12,00 г, 300,0 ммоль) и солянокислого гидроксиламина (16,68 г, 240 ммоль) получали тврдое белое вещество целевого соединения (25,96 г, 186 ммоль, 93%). 1 Н-ЯМР(400 МГц, CDCl3, ) = 7.22 (m, 1H), 7.45 (m, 1H), 7.65 (m, 2H), 8.15 (s, 1H). Пример получения 5. Синтез 4-(трифторметокси)бензальдегидоксима Таким же образом, как описано в примере получения 1, с использованием 4-(трифторметокси)бензальдегида (38,02 г, 200,0 ммоль), гидроксида натрия (12,00 г, 300,0 ммоль) и солянокислого гидрокисламина (16,68 г, 24 0 ммоль) получали тврдое белое вещество целевого соединения (38,68 г, 188 ммоль,94%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 7.38 (d, 2H), 7.72 (tt, 2H), 8.20 (s, 1H), 11.43 (s, 1H). Пример получения 6. Синтез 2-(трифторметокси)бензальдегидоксима Таким же образом, как описано в примере получения 1, с использованием 2-(трифторметокси)бензальдегида (38,03 г, 200,0 ммоль), гидроксида натрия (12,00 г, 300,0 ммоль) и солянокислого гидроксиламина (16,6 г, 240 ммоль) получали тврдое белое вещество целевого соединения (38,67 г, 188 ммоль,94%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 7.43 (m, 2H), 7.54 (m, 1 Н), 7.89 (m, 1 Н), 8.24 (s, 1H), 11.76 (s, 1H). Пример получения 7. Синтез 3-(трифторметил)бензальдегидоксима Таким же образом, как описано в примере получения 1, с использованием 3-(трифторметил)бензальдегида (34,82 г, 200,0 ммоль), гидроксида натрия (12,00 г, 300,0 ммоль) и солянокислого гидроксиламина (16,68 г, 240 ммоль) получали белое тврдое целевое соединение (35,33 г, 187 ммоль, 93%). 1HЯМР (400 МГц, CDCl3, ) = 7.33 (m, 1H), 7.72 (m, 3 Н), 8.44 (s, 1H), 11.62 (s, 1H). Пример получения 8. Синтез 3-(трифторметокси)бензальдегидоксима Таким же образом, как описано в примере получения 1, с использованием 3-(трифторметокси)бензальдегида (38,03 г, 200,0 ммоль), гидроксида натрия (12,00 г, 300,0 ммоль) и солянокислого гидроксиламина (16,6 г, 240 ммоль) получали тврдое белое вещество целевого соединения (39,74 г, 193 ммоль, 97%). 1H-ЯМР (400 МГц, CDCl3, ) = 7.53 (m, 1H), 7.69 (m, 3 Н), 8.31 (s, 1H), 11.71 (s, 1H). Пример получения 9. Синтез N-гидрокси-2-(трифторметил)бензимидоилхлорида 2-(Трифторметил)бензальдегидоксим (30,0 г, 158,60 ммоль) растворяли в диметилформимиде (300 мл) и добавляли N-хлорсукцинимид (23,31 г, 174,46 ммоль) с последующим перемешиванием в течение 15 ч. После того как реакция завершалась, полученный раствор выпаривали в вакууме, добавляли этилацетат (1500 мл), промывали насыщенным водным раствором хлорида натрия (1,000 мл) и очищенной водой (1000 мл), соответственно сушили над безводным сульфатом натрия и выпаривали под вакуумом с получением бледно-жлтого тврдого вещества целевого соединения (32,81 г, 146,70 ммоль, 93%). 1 НЯМР (400 МГц, CDCl3, ) = 7.73 (m, 2H), 7.80 (t, 1 Н), 7.86 (d, 1H), 12.61 (s, 1H). Пример получения 10. Синтез 2-хлор-N-гидроксибензимидоилхлорида Таким же образом, как описано в примере получения 9, с использованием диметилформамида (240 мл), 2-хлорбензальдегидоксима (19,97 г, 128,32 ммоль) и N-хлорсукцинимида (18,85 г, 141,14 ммоль) получали бледно-жлтое тврдое вещество целевого соединения (20,04 г, 105,21 ммоль, 82%). 1 Н-ЯМР Пример получения 11. Синтез 3-фтор-N-гидроксибензимидоилхлорида Таким же образом, как описано в примере получения 9, с использованием диметилформамида (240 мл), 3-фторбензальдегидоксима (20,0 г, 143,77 ммоль) и N-хлорсукцинимида (21,12 г, 158,12 ммоль) получали бледно-жлтое тврдое вещество целевого соединения (22,52 г 129,79 ммоль, 90%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 7.37 (m, 1H), 7.60 (m, 3 Н). Пример получения 12. Синтез 2-фтор-N-гидроксибензимидоилхлорида Таким же образом, как описано в примере получения 9, с использованием диметилформамида (240 мл), 2-фторбензальдегидоксима (20,0 г, 143,76 ммоль) и N-хлорсукцинимида (21,12 г, 158,12 ммоль) получали бледно-жлтое тврдое вещество целевого соединения (23,32 г 134,40 ммоль, 94%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 7.29 (m, 1H), 7.47 (m, 1H), 7.62 (m, 2H). Пример получения 13. Синтез N-гидрокси-4-(трифторметокси)бензимидоилхлорида Таким же образом, как описано в примере получения 9, с использованием диметилформамида (240 мл), 4-(трифторметокси)бензальдегидоксима (20,0 г, 97,51 ммоль) и N-хлорсукцинимида (14,31 г, 107,26 ммоль) получали бледно-жлтое тврдое вещество целевого соединения (21,10 г, 88,04 ммоль, 90%). 1HЯМР (400 МГц, CDCl3, ) = 7.47 (dd, 1H), 7.72 (tt, 2H), 12.60 (s, 1H). Пример получения 14. Синтез N-гидрокси-2-(трифторметокси)бензимидоилхлорида Таким же образом, как описано в примере получения 9, с использованием диметилформамида (240 мл), 4-(трифторметокси)бензальдегидоксима (20,0 г, 97,50 ммоль) и N-хлорсукцинимида (14,32 г, 107,26 ммоль) получали бледно-жлтое тврдое вещество целевого соединения (19,48 г, 81,30 ммоль, 83%). 1HЯМР (400 МГц, CDCl3, ) = 7.49 (m, 1H), 7.62 (m, 1H), 7.68 (dd, 1H), 12.67 (s, 1H). Пример получения 15. Синтез N-гидрокси-3-(трифторметил)бензимидоилхлорида Таким же образом, как описано в примере получения 9, с использованием 3-(трифторметил)бензальдегидоксима (30,0 г 158,60 ммоль), диметилформимида (300 мл) и N-хлорсукцинимида (23,31 г,174,46 ммоль) получали бледно-жлтое тврдое вещество целевого соединения (33,81 г, 151,22 ммоль,95%). 1H-ЯМР (400 МГц, CDCl3, ) = 7.79 (m, 3 Н), 7.83 (m, 1 Н), 12.64 (s, 1H). Пример получения 16. Синтез N-гидрокси-3-(трифторметокси)бензимидоилхлорида Таким же образом, как описано в примере получения 9, с использованием диметилформамида (240 мл), 3-(трифторметокси)бензальдегидоксима (20,0 г, 97,50 ммоль) и N-хлорсукцинимида (14,32 г, 107,26 ммоль) получали бледно-жлтое тврдое вещество целевого соединения (19,43 г, 81,10 ммоль, 82%). 1 НЯМР (400 МГц, CDCl3, ) = 7.56 (m, 1H), 7.64 (m, 3 Н), 12.61 (s, 1H). Пример получения 17. Синтез метил-5-метил-3-(2-(трифторметил)фенил)изоксазол-4-карбоновой кислотыN-гидрокси-2-(трифторметил)бензимидоилхлорид (8,0 г, 35,78 ммоль) и метилацетоацетат (8,30 г,71,56 ммоль) растворяли в метаноле (160 мл). Полученный раствор перемешивали в течение 30 мин, в то время как реактор охлаждали до -10 С. Затем к нему медленно добавляли метоксид натрия (5,80 г, 107,34 ммоль). Полученный продукт нагревали до комнатной температуры, перемешивали в течение 3 ч и упаривали под вакуумом для удаления метанола. Затем к нему добавляли этилацетат (200 мл). Полученный продукт промывали очищенной водой (200 мл) и насыщенным водным раствором хлорида натрия (200 мл), соответственно сушили над безводным сульфатом натрия и упаривали под вакуумом. Посредством колоночной хроматографии получали очищенное белое тврдого вещество целевого соединения (5,79 г,20,31 ммоль, 57%). 1H-ЯМР (400 МГц, CDCl3, ) = 2.75 (s, 3 Н), 3.58 (s, 3 Н), 7.56 (m, 1 Н), 7.78 (m, 1 Н),7.90 (m, 1 Н). Пример получения 18. Синтез метил-3-(2-хлорфенил)-5-метилизоксазол-4-карбоновой кислоты Таким же образом, как описано в примере получения 17, с использованием метанола (160 мл), 2 хлор-N-гидроксибензимидоилхлорида (8,0 г, 42,10 ммоль), метилацетоацетата (9,78 г, 84,20 ммоль) и метилата натрия (6,83 г, 126,30 ммоль) получали тврдое белое вещество целевого соединения (6,32 г, 25,11 ммоль, 60%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 2.59 (s, 3 Н), 3.86 (s, 3 Н), 7.62 (m, 3 Н). Пример получения 19. Синтез метил-3-(3-фторфенил)-5-метилизоксазол-4-карбоновой кислоты Таким же образом, как описано в примере получения 17, с использованием метанола (160 мл), 3 фтор-N-гидроксибензимидоилхлорида (8,00 г, 46,09 ммоль), метилацетоацетата (10,07 г, 92,18 ммоль) и метилата натрия (7,47 г, 138,27 ммоль) получали тврдое белое вещество целевого соединения (7,60 г,32,14 ммоль, 70%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 2.58 (s, 3 Н) 3 Н), 3.91 (s, 3 Н), 7.21 (m, 1H), 7.42 (m, 3 Н). Пример получения 20. Синтез метил-3-(2-фторфенил)-5-метилизоксазол-4-карбоновой кислоты Таким же образом, как описано в примере получения 17, с использованием метанола (160 мл), 2 фтор-N-гидроксибензимидоилхлорида (8,00 г, 46,09 ммоль), метилацетоацетата (10,07 г, 92,18 ммоль) и метилата натрия (7,47 г, 138,27 ммоль) получали тврдое белое вещество целевого соединения (7,84 г,33,33 ммоль, 72%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 2.59 (s, 3 Н), 3.92 (s, 3 Н), 7.22 (m, 1 Н), 7.43 (m, 1H),7.55 (m, 2H). Пример получения 21. Синтез метил-5-метил-3-(4-(трифторметокси)фенил)изоксазол-4-карбоновой кислоты Таким же образом, как описано в примере получения 17, с использованием метанола (160 мл), N-9 022336 гидрокси-4-(трифторметокси)бензимидоилхлорида (8,00 г, 33,39 ммоль), метилацетоацетата (7,76 г, 66,78 ммоль) и метоксида натрия (5,41 г, 100,17 ммоль) получали тврдое белое вещество целевого соединения(6,74 г, 22,36 ммоль, 67%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 2.71 (s, 3 Н), 3.73 (s, 3 Н), 7.48 (d, 2H), 7.76 (d,2H). Пример получения 22. Синтез метил-5-метил-3-(2-(трифторметокси)фенил)изоксазол-4-карбоновой кислоты Таким же образом, как описано в примере получения 17, с использованием метанола (160 мл), Nгидрокси-4-(трифторметокси)бензимидоилхлорида (8,00 г, 33,39 ммоль), метилацетоацетата (7,76 г, 66,78 ммоль) и метоксида натрия (5,41 г, 100,17 ммоль) получали тврдое белое вещество целевого соединения(7,04 г, 23,37 ммоль, 70%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 2.73 (s, 3 Н), 3.64 (s, 3 Н), 7.53 (m, 1 Н), 7.61 (m,1H), 7.69 (m, 1H). Пример получения 23. Синтез метил-5-метил-3-(3-(трифторметил)фенил)изоксазол-4-карбоновой кислоты Таким же образом, как описано в примере получения 17, с использованием метанола (160 мл), Nгидрокси-3-(трифторметил)бензимидоилхлорида (8,0 г, 35,78 ммоль), метилацетоацетата (8,30 г, 71,56 ммоль) и метоксида натрия (5,80 г, 107,34 ммоль) получали тврдое белое вещество целевого соединения(5,82 г, 20,41 ммоль, 57%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 2.73 (s, 3 Н), 3.56 (s, 3 Н), 7.58 (m, 1H), 7.97 (m,3H). Пример получения 24. Синтез метил-5-метил-3-(3-(трифторметокси)фенил)изоксазол-4-карбоновой кислоты Таким же образом, как описано в примере получения 17, с использованием метанола (160 мл), Nгидрокси-3-(трифторметокси)бензимидоилхлорида (8,00 г, 33,39 ммоль), метилацетоацетата (7,76 г, 66,78 ммоль) и метоксида натрия (5,41 г, 100,17 ммоль) получали тврдое белое вещество целевого соединения(6,82 г, 22,64 ммоль, 68%). 1H-ЯМР (400 МГц, CDCl3, ) = 2.76 (s, 3 Н), 3.62 (s, 3 Н), 7.54 (m, 1H), 7.61 (m,3 Н). Пример получения 25. Синтез 5-метил-3-(2-(трифторметил)фенил)изоксазол-4-карбоновой кислоты Метил-5-метил-3-(2-(трифторметил)фенил)изоксазол-4-карбоксилат (6,0 г, 21,03 ммоль) растворяли в метаноле (60 мл), добавляли 3%-ный водный раствор гидроксида натрия (60 мл), перемешивали при 30 С в течение 7 ч и упаривали под вакуумом, чтобы удалить метанол. Оставшийся раствор промывали этилацетатом (20 мл) и водный слой нейтрализовали водным раствором соляной кислоты. Затем полученные кристаллы отфильтровывали, промывали очищенной водой (50 мл) и сушили до получения белого тврдого вещества целевого соединения (5,48 г, 20,12 ммоль, 96%). 1 Н-ЯМР (400 МГц, ДМСО, ) = 2.69 (s, 3 Н), 7.49 (m, 1 Н), 7.72 (m, 1 Н), 7.83 (m, 1 Н), 13.12 (brs, 1H). Пример получения 26. Синтез 3-(2-хлорфенил)-5-метилизоксазол-4-карбоновой кислоты Таким же образом, как описано в примере получения 25, с использованием метанола (60 мл), метил 3-(2-хлорфенил)-5-метилизоксазол-4-карбоновой кислоты (6,0 г, 23,84 ммоль) и 3% водного раствора гидроксида натрия (60 мл) получали белое тврдое целевое соединение (5,10 г, 21,44 ммоль, 90%). 1 НЯМР (400 МГц, ДМСО, ) = 2.75 (s, 3 Н), 7.46 (m, 2 Н), 7.53 (m, 1 Н), 7.59 (m, 1 Н), 13.00 (brs, 1H). Пример получения 27. Синтез 3-(3-фторфенил)-5-метилизоксазол-4-карбоновой кислоты Таким же образом, как описано в примере получения 25, с использованием метанола (60 мл), метил 3-(3-фторфенил)-5-метилизоксазол-4-карбоновой кислоты (6,0 г, 25,51 ммоль) и 3% водного раствора гидроксида натрия (60 мл) получали белое тврдое целевое соединение (5,51 г, 24,92 ммоль, 98%). 1 НЯМР (400 МГц, ДМСО, ) = 2.58 (s, 3 Н), 7.21 (m, 1 Н), 7.42 (m, 3 Н), 13.04 (brs, 1H). Пример получения 28. Синтез 3-(3-фторфенил)-5-метилизоксазол-4-карбоновой кислоты Таким же образом, как описано в примере получения 25, с использованием метанола (60 мл), метил 3-(3-фторфенил)-5-метилизоксазол-4-карбоновой кислоты (6,0 г, 25,51 ммоль) и 3% водного раствора гидроксида натрия (60 мл) получали тврдое белое вещество целевого соединения (5,21 г, 23,44 ммоль,92%). 1H-ЯМР (400 МГц, ДМСО, ) = 2.60 (s, 3 Н), 7.21 (m, 1 Н), 7.43 (m, 1 Н), 7.54 (m, 2 Н). Пример получения 29. Синтез 5-метил-3-(4-(трифторметокси)фенил)изоксазол-4-карбоновой кислоты Таким же образом, как описано в примере получения 25, с использованием метанола (60 мл), метил 5-метил-3-(4-(трифторметокси)фенил)изоксазол-4-карбоновой кислоты (6,0 г, 19,91 ммоль) и 3% водного раствора гидроксида натрия (60 мл) получали белое тврдое целевое соединение (5,55 г, 19,32 ммоль,97%). 1 Н-ЯМР (400 МГц, ДМСО, ) = 2.71 (s, 3 Н), 7.48 (d, 2 Н), 7.76 (d, 2H), 13.15 (brs, 1H). Пример получения 30. Синтез 5-метил-3-(2-(трифторметокси)фенил)изоксазол-4-карбоновой кислоты Таким же образом, как описано в примере получения 25, с использованием метанола (60 мл), метил 5-метил-3-(2-(трифторметокси)фенил)изоксазол-4-карбоновой кислоты (6,0 г, 19,91 ммоль) и 3% водного раствора гидроксида натрия (60 мл) получали белое тврдое целевое соединение (5,34 г, 18,59 ммоль,93%). 1 Н-ЯМР (400 МГц, ДМСО, ) = 2.72 (s, 3 Н), 7.50 (m, 2 Н), 7.58 (m, 1 Н), 7.67 (m, 1 Н), 13.62 (brs, 1H). Пример получения 31. Синтез 5-метил-3-(3-(трифторметил)фенил)изоксазол-4-карбоновой кислоты Таким же образом, как описано в примере получения 25, с использованием метанола (60 мл), метил 5-метил-3-(3-(трифторметил)фенил)изоксазол-4-карбоновой кислоты (6,0 г, 21,03 ммоль) и 3% водного раствора гидроксида натрия (60 мл) получали белое тврдое целевое соединение (5,37 г, 19,80 ммоль,94%). 1 Н-ЯМР (400 МГц, ДМСО, ) = 2.67 (s, 3 Н), 7.48 (m, 1 Н), 7.80 (m, 3 Н), 13.11 (brs, 1H). Пример получения 32. Синтез 5-метил-3-(3-(трифторметокси)фенил)изоксазол-4-карбоновой кислоты Таким же образом, как описано в примере получения 25, с использованием метанола (60 мл), метил 5-метил-3-(3-(трифторметокси)фенил)изоксазол-4-карбоновой кислоты (6,0 г, 19,91 ммоль) и 3% водного раствора гидроксида натрия (60 мл) получали белое тврдое целевое соединение (5,47 г, 19,04 ммоль,96%). 1 Н-ЯМР (400 МГц, ДМСО, ) = 2.71 (s, 3 Н), 7.48 (m, 2 Н), 7.64 (m, 2 Н), 13.57 (brs, 1H). Пример получения 33. Синтез метил-5-амино-3-(2-(трифторметил)фенил)изоксазол-4-карбоновой кислоты Таким же образом, как описано в примере получения 17, с использованием метанола (160 мл), Nгидрокси-2-(трифторметил)бензимидоилхлорида (8,00 г, 33,39 ммоль), метилцианоацетата (4,14 г, 41,74 ммоль) и метоксида натрия (3,61 г, 66,78 ммоль) получали белое тврдое целевое соединение (8,13 г,28,42 ммоль, 85%). 1 Н-ЯМР (400 МГц, ДМСО, ) = 3.59 (s, 3 Н), 6.12 (brs, 2 Н), 7.36 (m, 1 Н), 7.57 (m, 2 Н),7.69 (m, 1 Н). Пример получения 34. Синтез метил-5-амино-3-(2-хлорфенил)изоксазол-4-карбоновой кислоты Таким же образом, как описано в примере получения 17, с использованием метанола (160 мл), 2 хлор-N-гидроксибензимидоилхлорида (8,00 г, 42,10 ммоль) метилцианоацетата (5,22 г, 52,63 ммоль) и метилата натрия (4,55 г, 84,20 ммоль) получали белое тврдое целевое соединение (9,40 г, 37,21 ммоль,88%). 1 Н-ЯМР (400 МГц, ДМСО, ) = 3.65 (s, 3H), 6.20 (brs, 2H), 7.41 (m, 4H). Пример получения 35. Синтез метилового эфира 5-амино-3-(3-фторфенил)изоксазол-4-карбоновой кислоты Таким же образом, как описано в примере получения 17, с использованием метанола (160 мл), 3 фтор-N-гидроксибензимидоилхлорида (8,00 г, 46,09 ммоль), метилцианоацетата (5,94 г, 59,92 ммоль) и метилата натрия (4,98 г, 92,18 ммоль) получали белое тврдое целевое соединение (8,42 г, 35,64 ммоль,77%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 3.92 (s, 3H), 6.30 (brs, 2H), 7.21 (m, 1H), 7.42 (m, 3 Н). Пример получения 36. Синтез метил-5-амино-3-(2-фторфенил)изоксазол-4-карбоновой кислоты Таким же образом, как описано в примере получения 17, с использованием метанола (160 мл), 2 фтор-N-гидроксибензимидоилхлорида (8,00 г, 46,09 ммоль), метилцианоацетата (5,94 г, 59,92 ммоль) и метоксида натрия (4,98 г, 92,18 ммоль) получали белое тврдое целевое соединение (8,23 г, 34,82 ммоль,76%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 3.89 (s, 3 Н), 6.31 (brs, 2 Н), 7.22 (m, 1 Н), 7.41 (m, 1 Н), 7.55 (m, 2 Н). Пример получения 37. Синтез метилового эфира 5-амино-3-(4-(трифторметокси)фенил)изоксазол-4 карбоновой кислоты Таким же образом, как описано в примере получения 17, с использованием метанола (160 мл), Nгидрокси-4-(трифторметокси)бензимидоилхлорида (8,00 г, 33,39 ммоль), метилцианоацетата (4,31 г,43,41 ммоль) и метоксида натрия (3,61 г, 66,78 ммоль) получали белое тврдое целевое соединение (8,27 г, 27,35 ммоль, 82%). 1 Н-ЯМР (400 МГц, ДМСО, ) = 3.51 (s, 3H), 6.21 (brs, 2H), 7.26 (d, 2H), 7.77 (d, 2H). Пример получения 38. Синтез метилового эфира 5-амино-3-(2-(трифторметокси)фенил)изоксазол-4 карбоновой кислоты Таким же образом, как описано в примере получения 17, с использованием метанола (160 мл), Nгидрокси-2-(трифторметокси)бензимидоилхлорида (8,00 г, 33,39 ммоль), метилцианоацетата (4,31 г,43,41 ммоль) и метоксида натрия (3,61 г, 66,78 ммоль) получали белое тврдое целевое соединение (9,07 г, 30,02 ммоль, 90%). 1H-ЯМР (400 МГц, ДМСО, ) = 3.38 (s, 3H), 6.18 (brs, 2 Н), 7.41 (m, 2 Н), 7.42 (m,1 Н), 7.47 (m, 1 Н). Пример получения 39. Синтез метил-5-амино-3-(3-(трифторметил)фенил)изоксазол-4-карбоновой кислоты Таким же образом, как описано в примере получения 17, с использованием метанола (160 мл), Nгидрокси-3-(трифторметил)бензимидоилхлорида (8,00 г, 33,39 ммоль), метилцианоацетата (4,14 г, 41,74 ммоль) и метоксида натрия (3,61 г, 66,78 ммоль) получали белое тврдое целевое соединение (7,46 г,26.06 ммоль, 78%). 1H-ЯМР (400 МГц, ДМСО, ) = 3.61 (s, 3H), 6.11 (brs, 2 Н), 7.32 (m, 1 Н), 7.62 (m, 3 Н). Пример получения 40. Синтез метил-5-амино-3-(3-(трифторметокси)фенил)изоксазол-4-карбоновой кислоты Таким же образом, как описано в примере получения 17, с использованием метанола (160 мл), Nгидрокси-3-(трифторметокси)бензимидоилхлорида (8,00 г, 33,39 ммоль), метилцианоацетата (4,31 г,43,41 ммоль) и метилата натрия (3,61 г, 66,78 ммоль) получали белое тврдое целевое соединение (8,42 г,27,87 ммоль, 83%). 1H-ЯМР (400 МГц, ДМСО, ) = 3.42 (s, 3H), 6.22 (brs, 2 Н), 7.46 (m, 2 Н), 7.53 (m, 2 Н). Пример получения 41. Синтез 5-амино-3-(2-(трифторметил)фенил)изоксазол-4-карбоновой кислоты Таким же образом, как описано в примере получения 25, с использованием метанола (60 мл), 5 амино-3-(2-(трифторметил)фенил)изоксазол-4-карбоновой кислоты (6,0 г, 20,96 ммоль) и 3% водного раствора гидроксида натрия (60 мл) получали белое тврдое целевое соединение (4,06 г, 14,92 ммоль,71%). 1H-ЯМР (400 МГц, ДМСО, ) = 7.40 (m, 1H), 7.70 (m, 2 Н), 7.76 (m, 1 Н), 7.81 (brs, 2H), 12.18 (brs,1H). Пример получения 42. Синтез 5-амино-3-(2-хлорфенил)изоксазол-4-карбоновой кислоты Таким же образом, как описано в примере получения 25, с использованием метанола (60 мл), метил 5-амино-3-(2-хлорфенил)изоксазол-4-карбоновой кислоты (6,0 г, 23,75 ммоль) и 3% водного раствора гидроксида натрия (60 мл) получали белое тврдое целевое соединение (3,66 г, 15,33 ммоль, 65%). 1HЯМР (400 МГц, ДМСО, ) = 7.45 (m, 3H), 7.54 (m, 1 Н), 7.85 (brs, 2H), 12.04 (brs, 1H). Пример получения 43. Синтез 5-амино-3-(3-фторфенил)изоксазол-4-карбоновой кислоты Таким же образом, как описано в примере получения 25, с использованием метанола (60 мл), метил 5-амино-3-(3-фторфенил)изоксазол-4-карбоновой кислоты (6,0 г, 25,40 ммоль) и 3% водного гидроксида натрия раствор (60 мл) получали белое тврдое целевое соединение (3,08 г, 13,86 ммоль, 55%). 1 Н-ЯМР(400 МГц, ДМСО, ) = 6.28 (brs, 2H), 7.20 (m, 1 Н), 7.44 (m, 3 Н). Пример получения 44. Синтез 5-амино-3-(2-фторфенил)изоксазол-4-карбоновой кислоты Таким же образом, как описано в примере получения 25, с использованием метанола (60 мл), метил 5-амино-3-(2-фторфенил)изоксазол-4-карбоновой кислоты (6,0 г, 25,40 ммоль) и 3% водного раствора гидроксида натрия (60 мл) получали белое тврдое целевое соединение (3,18 г, 14,33 ммоль, 56%). 1HЯМР (400 МГц, ДМСО, ) = 6.22 (brs, 2H), 7.25 (m, 1 Н), 7.45 (m, 1 Н), 7.59 (m, 2 Н), 12.13 (brs, 1H). Пример получения 45. Синтез 5-амино-3-(4-(трифторметокси)фенил)изоксазол-4-карбоновой кислоты Таким же образом, как описано в примере получения 25, с использованием метанола (60 мл), метил 5-амино-3-(4-(трифторметокси)фенил)изоксазол-4-карбоновой кислоты (6,0 г, 19,85 ммоль) и 3% водного раствора гидроксида натрия (60 мл) получали белое тврдое целевое соединение (4,32 г, 15,02 ммоль,76%). 1H-ЯМР (400 МГц, ДМСО, ) = 7.31 (d, 2H), 7.83 (d, 2 Н), 7.85 (brs, 2 Н), 12.01 (brs, 1H). Пример получения 46. Синтез 5-амино-3-(2-(трифторметокси)фенил)изоксазол-4-карбоновой кислоты Таким же образом, как описано в примере получения 25, с использованием метанола (60 мл), метил 5-амино-3-(2-(трифторметокси)фенил)изоксазол-4-карбоновой кислоты (6,0 г, 19,85 ммоль) и 3% водного раствора гидроксида натрия (60 мл) получали белое тврдое целевое соединение (4,00 г, 13,89 ммоль,70%). 1H-ЯМР (400 МГц, ДМСО, ) = 7.45 (m, 3H), 7.59 (m, 1 Н), 7.82 (brs, 2H), 12.04 (brs, 1H). Пример получения 47. Синтез 5-амино-3-(3-(трифторметил)фенил)изоксазол-4-карбоновой кислоты Таким же образом, как описано в примере получения 25, с использованием метанола (60 мл), 5 амино-3-(3-(трифторметил)фенил)изоксазол-4-карбоновой кислоты (6,0 г, 20,96 ммоль) и 3% водного раствора гидроксида натрия (60 мл) получали белое тврдое целевое соединение (4,14 г, 15,21 ммоль,73%). 1H-ЯМР (400 МГц, ДМСО, ) = 7.34 (m, 1H), 7.68 (m, 3 Н), 7.87 (brs, 2H), 12.31 (brs, 1H). Пример получения 48. Синтез 5-амино-3-(3-(трифторметокси)фенил)изоксазол-4-карбоновой кислоты Таким же образом, как описано в примере получения 25, с использованием метанола (60 мл), метилового эфира 5-амино-3-(3-(трифторметокси)фенил)изоксазол-4-карбоновой кислоты (6,0 г, 19,85 ммоль) и 3% водного раствора гидроксида натрия (60 мл) получали белое тврдое целевое соединение (4,16 г,14,43 ммоль, 73%). 1 Н-ЯМР (400 МГц, ДМСО, ) = 7.43 (m, 3 Н), 7.63 (m, 1 Н), 7.84 (brs, 2H), 12.04 (brs,1H). Пример 1. Синтез (4-(2-фторфенил)пиперазин-1-ил)(5-метил-3-(2-(трифторметил)фенил)изоксазол 4-ил)метанона 5-Метил-3-(2-(трифторметил)фенил)изоксазол-4-карбоновую кислоту (500 мг, 1,84 ммоль,), 1-этил 3-(диметиламинопропил)карбодиимид (388 мг, 2,02 ммоль) и 1-(2-фторфенил)пиперазин (332 мг, 1,84 ммоль) растворяли в дихлорметане (30 мл) и перемешивали при комнатной температуре в течение 8 ч. Полученный раствор промывали насыщенным водным раствором карбоната натрия (30 мл), очищенной водой (30 мл) и насыщенным водным раствором хлорида натрия (30 мл) соответственно. Затем органический слой сушили над безводным сульфатом натрия, концентрировали и очищали с помощью колоночной хроматографии до получения белого тврдого вещества целевого соединения (528 мг, 1,34 ммоль, 73%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 2.56 (s, 3 Н), 2.73 (brs, 2H), 3.01 (brs, 2H), 3.41 (brs, 2H), 3.72(brs, 2 Н), 6.04 (m, 3 Н), 6.81 (t, 1H), 7.49 (m, 1H), 7.72 (m, 1H), 7.83 (m, 1H). Пример 2. Синтез (4-(3,4-дихлорфенил)пиперазин-1-ил)(5-метил-3-(2-(трифторметил)фенил)изоксазол-4-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-метил-3-(2(трифторметил)фенил)изоксазол-4-карбоновой кислоты (500 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(3,4-дихлорфенил)пиперазина (425 мг, 1,84 ммоль) получали белое тврдое целевое соединение (644 мг, 1,33 ммоль, 72%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 2.58 (s,3 Н), 2.75 (brs, 2H), 3.03 (brs, 2H), 3.42 (brs, 2 Н), 3.74 (brs, 2 Н), 6.69 (dd, 1 Н), 6.89 (d, 1H), 7.28 (m, 1H), 7.55 Пример 3. Синтез (4-(3-метоксифенил)пиперазин-1-ил)(5-метил-3-(2-(трифторметил)фенил)изоксазол-4-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-метил-3-(2(трифторметил)фенил)изоксазол-4-карбоновой кислоты (500 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль) и 1-(3-метоксифенил)пиперазина (354 мг, 1,84 ммоль) получали гелеобразное целевое соединение (602 мг, 1,35 ммоль, 73%). 1 Н-ЯМР (400 МГц, CDCl3,) = 2.64 (brs, 2H), 2.67 (s, 3 Н), 3.13 (brs, 2H), 3.38 (brs, 2H), 4.06 (brs, 2H), 6.43 (brs, 1H), 6.53 (m, 2H), 7.39(dd, 1 Н), 7.49 (m, 1 Н), 7.70 (m, 1 Н), 7.80 (dd, 1 Н), 7.81 (m, 1 Н). Пример 4. Синтез (4-(2-метоксифенил)пиперазин-1-ил)(5-метил-3-(2-(трифторметил)фенил)изоксазол-4-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-метил-3-(2(трифторметил)фенил)изоксазол-4-карбоновой кислоты (500 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль) и 1-(2-метоксифенил)пиперазина (354 мг, 1,84 ммоль) получали белое тврдое целевое соединение (504 мг, 1,13 ммоль, 62%). 1 Н-ЯМР (400 МГц, CDCl3,) = 2.59 (S, 3 Н), 2.75 (brs, 2H), 3.06 (brs, 2H), 3.42 (brs, 2H), 3.76 (brs, 2 Н), 3.82 (s, 3 Н), 6.49 (brs, 1 Н), 6.49(m, 2H), 7.19 (t, 1H), 7.55 (d, 1H), 7.67 (m, 2H), 7.82 (d, 1H). Пример 5. Синтез (5-метил-3-(2-(трифторметил)фенил)изоксазол-4-ил)(4-(3-(трифторметил)фенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-метил-3-(2(трифторметил)фенил)изоксазол-4-карбоновой кислоты (500 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль) и 1-(3-(трифторметил)фенил)пиперазина (424 мг,1,84 ммоль) получали гелеобразное целевое соединение (593 мг, 1,23 ммоль, 67%). 1 Н-ЯМР (400 МГц,CDCl3, ) = 2.63 (brs, 2 Н), 2.69 (s, 3 Н), 3.15 (brs, 2 Н), 3.37 (brs, 2H), 3.39 (brs, 2H), 4.02 (brs, 2 Н), 6.91 (m,2 Н), 7.03 (m, 1 Н), 7.26 (m, 1 Н), 7.51 (m, 1 Н), 7.70 (m, 2 Н), 7.82 (m, 1 Н). Пример 6. Синтез (4-(4-гидроксифенил)пиперазин-1-ил)(5-метил-3-(2-(трифторметил)фенил)изоксазол-4-ил)метанона Таким же образом, как описано в примере 1, с использованием диметилформимида (15 мл), 5 метил-3-(2-(трифторметил)фенил)изоксазол-4-карбоновой кислоты (500 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль), гидроксибензотриазола (299 мг, 2,21 ммоль) и 4-(пиперазин-1-ил)фенола (328 мг, 1,84 ммоль) получали белое тврдое целевое соединение(467 мг, 1,08 ммоль, 59%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 2.64 (brs, H), 2.69 (s, 3 Н), 3.91 (brs, 4H), 6.78 (m,4H), 7.49 (m, 2H), 7.72 (m, 1 Н), 7.83 (m, 1 Н). Пример 7. Синтез (4-(2-гидроксифенил)пиперазин-1-ил)(5-метил-3-(2-(трифторметил)фенил)изоксазол-4-ил)метанона Таким же образом, как описано в примере 1, с использованием диметилформимида (15 мл), 5 метил-3-(2-(трифторметил)фенил)изоксазол-4-карбоновой кислоты (500 мг, 1,84 ммоль), 1-этил-3(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль), гидроксибензотриазола (299 мг, 2.21 ммоль) и 2-(пиперазин-1-ил)фенола (328 мг 1,84 ммоль) получали белое тврдое целевое соединение (451 мг, 1.05 ммоль, 57%). 1H-ЯМР (400 МГц, CDCl3, ) = 2.49 (brs, 2H), 2.61 (s, 3 Н), 2.78 (brs, 2H), 3.50 (brs, 2H), 3.80(brs, 2H), 6.93 (m, 3 Н), 7.13 (m, 1 Н), 7.58 (m, 1H), 7.70 (m, 2H), 7.86 (m, 1H). Пример 8. Синтез (4-(4-фторфенил)пиперазин-1-ил)(5-метил-3-(2-(трифторметил)фенил)изоксазол 4-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-метил-3-(2(трифторметил)фенил)изоксазол-4-карбоновой кислоты (500 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль) и 1-(4-фторфенил)пиперазина (332 мг, 1,84 ммоль) получали белое тврдое целевое соединение (548 мг, 1,26 ммоль, 69%). 1H-ЯМР (400 МГц, CDCl3,) = 2.68 (s, 3 Н), 2.91 (brs, 4H), 3.42 (brs, 4H), 6.91 (m, 2H), 7.05 (m, 2H), 7.45 (m, 1 Н), 7.71 (m, 1H), 7.82(m, 1H). Пример 9. Синтез (3-(2-хлорфенил)-5-метилизоксазол-4-ил)(4-(3-метоксифенил)пиперазин-1 ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 3-(2 хлорфенил)-5-метилизоксазол-4-карбоновой кислоты (437 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(3-метоксифенил)пиперазина (354 мг, 1,84 ммоль) получали белое тврдое целевое соединение (576 мг, 1,40 ммоль, 76%). 1H-ЯМР (400 МГц, CDCl3, ) = 2.61 (s, 3 Н),3.10 (brs, 2H), 3.33 (brs, 2H), 3.74 (brs, 4H), 3.79 (s, 3 Н), 6.36 (t, 1 Н), 6.46 (m, 2 Н), 7.18 (t, 1 Н), 7.41 (m, 2 Н),7.50 (m, 1 Н), 7.56 (dd, 1H). Пример 10. Синтез (3-(3-фторфенил)-5-метилизоксазол-4-ил)(4-(2-фторфенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 3-(3-фторфенил)-5-метилизоксазол-4-карбоновой кислоты (407 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(2-фторфенил)пиперазина (332 мг, 1,84 ммоль) получали бе- 13022336 лое тврдое целевое соединение (562 мг, 1,41 ммоль, 76%). 1H-ЯМР (400 МГц, CDCl3, ) = 2.56 (s, 3 Н),2.70 (brs, 2H), 3.14 (brs, 2H), 3.28 (brs, 2H), 3.96 (brs, 2 Н), 6.70 (m, 2H), 7.02 (m, 2H), 7.17 (m, 1H), 7.45 (m,3 Н). Пример 11. Синтез (4-(3,4-дихлорфенил)пиперазин-1-ил)(3-(3-фторфенил)-5-метилизоксазол-4 ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 3-(3-фторфенил)-5-метилизоксазол-4-карбоновой кислоты (407 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(3,4-дихлорфенил)пиперазина (425 мг, 1,84 ммоль) получали белое тврдое целевое соединение (619 мг, 1,43 ммоль, 78%). 1 Н-ЯМР (CDCl3, 400 МГц, ) = 2.56 (s, 3 Н),2.66 (brs, 2H), 3.16 (brs, 2 Н), 3.27 (brs, 2H), 3.91 (brs, 2 Н), 6.67 (dd, 1 Н), 6.88 (d, 1H), 7.19 (m, 1H), 7.29 (m,1H), 7.44 (m, 3H). Пример 12. Синтез (3-(3-фторфенил)-5-метилизоксазол-4-ил)(4-(3-метоксифенил)пиперазин-1 ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 3-(3-фторфенил)-5-метилизоксазол-4-карбоновой кислоты (407 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(3-метоксифенил)пиперазина (354 мг, 1,84 ммоль) получали белое тврдое целевое соединение (612 мг, 1,55 ммоль, 84%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 2.56 (s, 3 Н),2.73 (brs, 2H), 3.19 (brs, 2H), 3.30 (brs, 2H), 3.80 (s, 3 Н), 3.93 (brs, 2 Н), 6.41(m, 1 Н), 6.49 (m, 2H), 7.18 (m,2H), 7.46 (m, 3 Н). Пример 13. Синтез (3-(3-фторфенил)-5-метилизоксазол-4-ил)(4-(2-метоксифенил)пиперазин-1 ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 3-(3 фторфенил)-5-метилизоксазол-4-карбоновой кислоты (407 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(2-метоксифенил)пиперазина (354 мг, 1,84 ммоль) получали белое тврдое целевое соединение (586 мг, 1,48 ммоль, 81%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 2.56 (s, 3 Н),2.61 (brs, 2H), 3.07 (brs, 2H), 3.34 (brs, 2H), 3.86 (s, 3 Н), 3.97 (brs, 2H), 6.53 (m, 1H), 6.90 (m, 2H), 7.18 (m,1H), 7.05 (m, 1H), 7.46 (m, 3H). Пример 14. Синтез (3-(3-фторфенил)-5-метилизоксазол-4-ил)(4-(3-(трифторметил)фенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 3-(3 фторфенил)-5-метилизоксазол-4-карбоновой кислоты (407 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(3-(трифторметил)фенил)пиперазина (424 мг, 1,84 ммоль) получали белое тврдое целевое соединение (506 мг, 1,17 ммоль, 64%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 2.56 (s, 3 Н), 2.59 (brs, 2 Н), 3.03 (brs, 2 Н), 3.32 (brs, 2 Н), 3.88 (brs, 2 Н), 6.99 (m, 1H), 7.21 (m, 4H), 7.42 (m,3 Н). Пример 15. Синтез (3-(3-фторфенил)-5-метилизоксазол-4-ил)(4-(4-гидроксифенил)пиперазин-1 ил)метанона Таким же образом, как описано в примере 1, с использованием диметилформимида (15 мл), 3-(3 фторфенил)-5-метилизоксазол-4-карбоновой кислоты (407 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль), гидроксибензотриазола (299 мг, 2,21 ммоль) и 4-(пиперазин-1 ил)фенола (424 мг, 1,84 ммоль) получали белое тврдое целевое соединение (486 мг, 1,27 ммоль, 69%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 2.56 (s, 3 Н), 2.61 (brs, 2H), 3.07 (brs, 2H), 3.32 (brs, 2H), 3.95 (brs, 2 Н), 6.78(m, 4H), 7.19 (m, 1H), 7.45 (m, 3 Н). Пример 16. Синтез (3-(3-фторфенил)-5-метилизоксазол-4-ил)(4-(2-гидроксифенил)пиперазин-1 ил)метанона Таким же образом, как описано в примере 1, с использованием диметилформимида (15 мл), 3-(3 фторфенил)-5-метилизоксазол-4-карбоновой кислоты (407 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль), гидроксибензотриазола (299 мг, 2,21 ммоль) и 2-(пиперазин-1 ил)фенола (424 мг, 1,84 ммоль) получали белое тврдое целевое соединение (462 мг, 1,21 ммоль, 66%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 2.58 (s, 3 Н), 2.63 (brs, 2 Н), 3.00 (brs, 2 Н), 3.39 (brs, 2 Н), 4.02 (brs, 2 Н), 6.89(m, 1 Н), 7.01 (m, 2 Н), 7.17 (m, 1 Н), 7.24 (m, 1 Н), 7.45 (m, 1 Н), 7.51 (m, 2 Н). Пример 17. Синтез (3-(3-фторфенил)-5-метилизоксазол-4-ил)(4-(4-фторфенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 3-(3 фторфенил)-5-метилизоксазол-4-карбоновой кислоты (407 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(4-фторфенил)пиперазина (332 мг, 1,84 ммоль) получали белое тврдое целевое соединение (511 мг, 1,33 ммоль, 72%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 2.55 (s, 3 Н),2.66 (brs, 2H), 2.99 (brs, 2H), 3.44 (brs, 2H), 3.88 (brs, 2 Н), 6.74 (m, 2H), 7.03 (m, 2H), 7.17 (m, 1H), 7.45 (m,3 Н). Пример 18. Синтез (3-(2-фторфенил)-5-метилизоксазол-4-ил)(4-(2-фторфенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 3-(2-фторфенил)-5-метилизоксазол-4-карбоновой кислоты (407 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(2-фторфенил)пиперазина (332 мг, 1,84 ммоль) получали белое тврдое целевое соединение (578 мг, 1,51 ммоль, 82%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 2.56 (s, 3 Н),2.71 (brs, 2 Н), 3.06 (brs, 2H), 3.38 (brs, 2H), 3.75 (brs, 2 Н), 6.10 (m, 3 Н), 6.79 (t, 1 Н), 7.19 (m, 1H), 7.40 (m,1H), 7.57 (m, 2H). Пример 19. Синтез (4-(3,4-дихлорфенил)пиперазин-1-ил)(3-(2-фторфенил)-5-метилизоксазол-4 ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 3-(2 фторфенил)-5-метилизоксазол-4-карбоновой кислоты (407 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,0 мг, 2 ммоль) и 1-(3,4-дихлорфенил)пиперазина (425 мг, 1,84 ммоль) получали белое тврдое целевое соединение (587 мг, 1,35 ммоль, 74%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 2.57 (s,3 Н), 2.79 (brs, 2H), 3.01 (brs, 2H), 3.40 (brs, 2H), 3.73 (brs, 2 Н), 6.65 (dd, 1 Н), 6.87 (d, 1H), 7.16 (m, 1H), 7.27(m, 1H), 7.40 (m, 1H), 7.54 (m, 2H). Пример 20. Синтез (3-(2-фторфенил)-5-метилизоксазол-4-ил)(4-(3-метоксифенил)пиперазин-1 ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 3-(2 фторфенил)-5-метилизоксазол-4-карбоновой кислоты (407 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(3-метоксифенил)пиперазина (354 мг, 1,84 ммоль) получали белое тврдое целевое соединение (622 мг, 1,57 ммоль, 86%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 2.57 (s, 3 Н),2.63 (brs, 2H), 3.11 (brs, 2H), 3.32 (brs, 2H), 3.83 (brs, 2 Н), 3.82 (s, 3 Н), 6.43 (brs, 1H), 6.48 (m, 2H), 7.19 (m,1H), 7.42 (m, 1H), 7.46 (dd, 1H), 7.54 (m, 1H), 7.78 (dd, 2H). Пример 21. Синтез (3-(2-фторфенил)-5-метилизоксазол-4-ил)(4-(2-метоксифенил)пиперазин-1 ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 3-(2 фторфенил)-5-метилизоксазол-4-карбоновой кислоты (407 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(2-метоксифенил)пиперазина (354 мг, 1,84 ммоль) получали белое тврдое целевое соединение (532 мг, 1,35 ммоль, 73%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 2.56 (s, 3 Н),2.61 (brs, 2H), 2.99 (brs, 2H), 3.31 (brs, 2H), 3.79 (brs, 2 Н), 3.83 (s, 3 Н), 6.78 (brs, 1H), 6.84 (t, 1H), 6.91 (t,1 Н), 7.19 (m, 1 Н), 7.42 (m, 1 Н), 7.59 (m, 2 Н), 7.69 (dd, 1 Н). Пример 22. Синтез (3-(2-фторфенил)-5-метилизоксазол-4-ил)(4-(3-(трифторметил)фенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 3-(2-фторфенил)-5-метилизоксазол-4-карбоновой кислоты (407 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(3-(трифторметил)фенил)пиперазина (424 мг, 1,84 ммоль) получали белое тврдое целевое соединение (501 мг, 1,15 ммоль, 63%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 2.55 (s, 3 Н), 2.62 (brs, 2H), 3.03 (brs, 2H), 3.38 (brs, 2H), 7.02 (m, 2H), 7.19 (m, 1 Н), 7.23 (m, 1H), 7.42 (m,1H), 7.54 (m, 2H). Пример 23. Синтез (3-(2-фторфенил)-5-метилизоксазол-4-ил)(4-(4-гидроксифенил)пиперазин-1 ил)метанона Таким же образом, как описано в примере 1, с использованием диметилформимида (15 мл), 3-(2 фторфенил)-5-метилизоксазол-4-карбоновой кислоты (407 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль), гидроксибензотриазола (299 мг, 2,21 ммоль) и 4(пиперазин-1-ил)фенола (424 мг, 1,84 ммоль) получали белое тврдое целевое соединение (542 мг, 1,42 ммоль, 77%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 2.56 (s, 3 Н), 2.61 (brs, 2H), 3.07 (brs, 2H), 3.32 (brs, 2H), 3.95(brs, 2 Н), 6.78 (m, 4H), 7.19 (m, 1H), 7.40 (m, 1H), 7.57 (m, 2H). Пример 24. Синтез (3-(2-фторфенил)-5-метилизоксазол-4-ил)(4-(2-гидроксифенил)пиперазин-1 ил)метанона Таким же образом, как описано в примере 1, с использованием диметилформимида (15 мл), 3-(2 фторфенил)-5-метилизоксазол-4-карбоновой кислоты (407 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль), гидроксибензотриазола (299 мг, 2,21 ммоль) и 2-(пиперазин-1 ил)фенола (424 мг, 1,84 ммоль) получали белое тврдое целевое соединение (4 33 мг, 1,13 ммоль, 62%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 2.57 (s, 3 Н), 2.61 (brs, 2H), 3.04 (brs, 2H), 3.35 (brs, 2H), 4.01 (brs, 2 Н), 6.91(m, 1 Н), 7.03 (m, 2H), 7.17 (m, 1H), 7.20 (m, 1H), 7.43 (m, 1H), 7.58 (m, 2H). Пример 25. Синтез (3-(2-фторфенил)-5-метилизоксазол-4-ил)(4-(4-фторфенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 3-(2 фторфенил)-5-метилизоксазол-4-карбоновой кислоты (407 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(4-фторфенил)пиперазина (332 мг, 1,84 ммоль) получали бе- 15022336 лое тврдое целевое соединение (538 мг, 1,40 ммоль, 16%). 1H-ЯМР (400 МГц, CDCl3, ) = 2.55 (s, 3 Н),2.87 (brs, 4 Н), 3.05 (brs, 4 Н), 6.91 (m, 2 Н), 7.04 (m, 2 Н), 7.19 (m, 1 Н), 7.43 (m, 1 Н), 7.59 (m, 2 Н). Пример 26. Синтез (4-(2-фторфенил)пиперазин-1-ил)(5-метил-3-(4-(трифторметокси)фенил)изоксазол-4-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-метил-3-4(трифторметокси)изоксазол-4-карбоновой кислоты (500 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(2-фторфенил)пиперазина (332 мг, 1,84 ммоль) получали белое тврдое целевое соединение (536 мг, 1,20 ммоль, 65%). 1H-ЯМР (400 МГц, CDCl3, ) = 2.56 (s, 3 Н),2.63 (brs, 2H), 3.06 (brs, 2H), 3.33 (brs, 2H), 3.94 (brs, 2 Н), 6.80 (t, 1 Н), 6.04 (m, 3 Н), 7.32 (d, 2H), 7.76 (d,2H). Пример 27. Синтез (4-(3,4-дихлорфенил)пиперазин-1-ил)(5-метил-3-(4-(трифторметокси)фенил)изоксазол-4-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-метил-3-(4(трифторметокси)изоксазол-4-карбоновой кислоты (500 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(3,4-дихлорфенил)пиперазина (425 мг, 1,84 ммоль) получали гелеобразное целевое соединение (589 мг, 1,17 ммоль, 64%). 1H-ЯМР (400 МГц, CDCl3, ) = 2.55 (s, 3 Н),2.68 (brs, 2H), 3.15 (brs, 2H), 3.28 (brs, 2H), 3.89 (brs, 2 Н), 6.65 (dd, 1 Н), 6.87 (d, 1H), 7.28 (t, 1H), 7.32 (dd,2H), 7.74 (dd, 2H). Пример 28. Синтез (4-(3-метоксифенил)пиперазин-1-ил)(5-метил-3-(4-(трифторметокси)фенил)изоксазол-4-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-метил-3-4(трифторметокси)изоксазол-4-карбоновой кислоты (500 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(3-метоксифенил)пиперазина (353 мг, 1,84 ммоль) получали белое тврдое целевое соединение (622 мг, 1,35 ммоль, 73%). 1H-ЯМР (400 МГц, CDCl3, ) = 2.59 (s, 3 Н),2.64 (brs, 2H), 3.17 (brs, 2 Н), 3.29 (brs, 2H), 3.75 (brs, 2 Н), 3.80 (s, 3 Н), 6.42 (brs, 1H), 6.52 (m, 2H), 7.43 (dd,1H), 7.47 (d, 2H), 7.75 (d, 2H), 7.78 (dd, 1H). Пример 29. Синтез (4-(2-метоксифенил)пиперазин-1-ил)(5-метил-3-(4-(трифторметокси)фенил)изоксазол-4-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-метил-3-4(трифторметокси)изоксазол-4-карбоновой кислоты (500 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(2-метоксифенил)пиперазина (353 мг, 1,84 ммоль) получали белое тврдое целевое соединение (604 мг, 1,33 ммоль, 72%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 2.60 (brs,5H), 2.98 (brs, 2H), 3.31 (brs, 2H), 3.85 (s, 3 Н), 6.76 (s, 1H), 6.87 (t, 1H), 6.91 (t, 1H), 7.65 (dd, 1H), 7.43 (d,2H), 7.73 (d, 2H), 7.78 (brs, 2H). Пример 30. Синтез (5-метил-3-(4-(трифторметокси)фенил)изоксазол-4-ил)(4-(3-(трифторметил)фенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-метил-3-4(трифторметокси)изоксазол-4-карбоновой кислоты (500 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(3-(трифторметил)фенил)пиперазина (424 мг, 1,84 ммоль) получали гелеобразное целевое соединение (574 мг, 1,15 ммоль, 63%). 1H-ЯМР (400 МГц, CDCl3, ) = 2.61 (s, 3 Н), 2.65 (brs, 2H), 3.13 (brs, 2H), 3.32 (brs, 2H), 7.10 (m, 2H), 7.14 (d, 1 Н), 7.41 (m, 1 Н), 7.46 (d,2H), 7.77 (d, 2H). Пример 31. Синтез (4-(4-гидроксифенил)пиперазин-1-ил)(5-метил-3-(4-(трифторметокси)фенил)изоксазол-4-ил)метанона Таким же образом, как описано в примере 1, с использованием диметилформимида (15 мл), 5 метил-3-(4-(трифторметокси)изоксазол-4-карбоновой кислоты (500 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль), гидроксибензотриазола (299 мг, 2,21 ммоль) и 4-(пиперазин-1-ил)фенола (328 мг, 1,84 ммоль) получали белое тврдое целевое соединение (502 мг, 1,12 ммоль, 61%). 1H-ЯМР (400 МГц, ДМСО, ) = 2.60 (brs, 2H), 2.62 (s, 3 Н), 3.08 (brs, 2H), 3.29 (brs, 2H), 3.91(brs, 2H), 6.74 (m, 2H), 6.74 (m, 2H), 7.46 (d, 2H), 7.78 (d, 2H). Пример 32. Синтез (4-(2-гидроксифенил)пиперазин-1-ил)(5-метил-3-(4-(трифторметокси)фенил)изоксазол-4-ил)метанона Таким же образом, как описано в примере 1, с использованием диметилформимида (15 мл), 5 метил-3-(4-(трифторметокси)изоксазол-4-карбоновой кислоты (500 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль), гидроксибензотриазола (299 мг, 2,21 ммоль) и 2(пиперазин-1-ил)фенола (328 мг, 1,84 ммоль) получали белое тврдое целевое соединение (538 мг, 1,02 ммоль, 65%). 1H-ЯМР (400 МГц, ДМСО, ) = 2.62 (s, 3H), 2.63 (brs, 2H), 3.01 (brs, 2H), 3.38 (brs, 2H), 4.02(трифторметокси)изоксазол-4-карбоновой кислоты (500 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(4-фторфенил)пиперазина (332 мг, 1,84 ммоль) получали белое тврдое целевое соединение (610 мг, 1,35 ммоль, 74%). 1H-ЯМР (400 МГц, CDCl3, ) = 2.62 (s, 3 Н),2.91 (brs, 4H), 4.47 (brs, 4H), 6.96 (m, 2H), 7.07 (m, 2H), 7.44 (d, 2H), 7.75 (d, 2H). Пример 34. Синтез (4-(2-фторфенил)пиперазин-1-ил)(5-метил-3-(2-(трифторметокси)фенил)изоксазол-4-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-метил-3-(2(трифторметокси)изоксазол-4-карбоновой кислоты (500 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(2-фторфенил)пиперазина (332 мг, 1,84 ммоль) получали белое тврдое целевое соединение (593 мг, 1,32 ммоль, 72%). 1H-ЯМР (400 МГц, CDCl3, ) = 2.56 (brs, 2H),2.61 (s, 3 Н), 3.01 (brs, 2H), 3.31 (brs, 2H), 3.81 (brs, 2H), 6.80 (t, 1 Н), 6.99 (m, 2 Н), 7.05 (m, 1 Н), 7.40 (m,1 Н), 7.44 (dd, 1 Н), 7.55 (m, 1 Н), 7.77 (dd, 1H). Пример 35. Синтез (4-(3,4-дихлорфенил)пиперазин-1-ил)(5-метил-3-(2-(трифторметокси)фенил)изоксазол-4-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-метил-3-2(трифторметокси)изоксазол-4-карбоновой кислоты (500 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(3,4-дихлорфенил)пиперазина (381 мг, 1,84 ммоль) получали белое тврдое целевое соединение (652 мг, 1,30 ммоль, 71%). 1H-ЯМР (400 МГц, CDCl3, ) = 2.60 (s, 3 Н),2.61 (brs, 2H), 3.09 (brs, 2H), 3.27 (brs, 2H), 3.70 (brs, 2 Н), 6.66 (dd, 1 Н), 6.86 (d, 1H), 7.29 (t, 1H), 7.39 (d,1H), 7.43 (t, 1H), 7.55 (t, 1H), 7.66 (dd, 1H). Пример 36. Синтез (4-(3-метоксифенил)пиперазин-1-ил)(5-метил-3-(2-(трифторметокси)фенил)изоксазол-4-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-метил-3-(2(трифторметокси)изоксазол-4-карбоновой кислоты (500 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(3-метоксифенил)пиперазина (354 мг, 1,84 ммоль) получали гелеобразное целевое соединение (564 мг, 1,22 ммоль, 66%). 1H-ЯМР (400 МГц, CDCl3, ) = 2.60 (s, 3 Н),2.65 (brs, 2H), 3.12 (brs, 2H), 3.31 (brs, 2H), 3.79 (brs, 2 Н), 3.81 (s, 3 Н), 6.40 (brs, 1H), 6.50 (m, 2H), 7.19 (t,1 Н), 7.39 (m, 1 Н), 7.44 (dd, 1 Н), 7.54 (m, 1 Н), 7.77 (dd, 1H). Пример 37. Синтез (4-(2-метоксифенил)пиперазин-1-ил)(5-метил-3-(2-(трифторметокси)фенил)изоксазол-4-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-метил-3-2(трифторметокси)изоксазол-4-карбоновой кислоты (500 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(2-метоксифенил)пиперазина (354 мг, 1,84 ммоль) получали белое тврдое целевое соединение (570 мг, 1,24 ммоль, 67%). 1H-ЯМР (400 МГц, CDCl3, ) = 2.60 (brs,2H), 2.61 (S, 3 Н), 2.99 (brs, 2H), 3.33 (brs, 2H), 3.78 (brs, 2H), 3.85 (s, 3H), 6.77 (brs, 1H), 6.89 (t, 1H), 6.92 (t,1 Н), 7.05 (t, 1H), 7.42 (m, 2H), 7.55 (t, 1H), 7.66 (dd, 1 Н). Пример 38. Синтез (5-метил-3-(2-(трифторметокси)фенил)изоксазол-4-ил)(4-(3-(трифторметил)фенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-метил-3-(2(трифторметокси)изоксазол-4-карбоновой кислоты (500 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(3-(трифторметил)фенил)пиперазина (424 мг, 1,84 ммоль) получали гелеобразное целевое соединение (486 мг, 0,97 ммоль, 53%). 1H-ЯМР (400 МГц, CDCl3, ) = 2.61 (s, 3 Н), 2.69 (brs, 2H), 3.17 (brs, 2H), 3.32 (brs, 2H), 3.82 (brs, 2 Н), 7.01 (d, 1 Н), 7.02 (s, 1H), 7.16 (d,1H), 7.40 (m, 2H), 7.45 (t, 1H), 7.55 (t, 1H), 7.68 (dd, 1H). Пример 39. Синтез (4-(4-гидроксифенил)пиперазин-1-ил)(5-метил-3-(2-(трифторметокси)фенил)изоксазол-4-ил)метанона Таким же образом, как описано в примере 1, с использованием диметилформимида (15 мл), 5 метил-3-(2-(трифторметокси)изоксазол-4-карбоновой кислоты (500 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль), гидроксибензотриазола (299 мг, 2,21 ммоль) и 4(пиперазин-1-ил)фенола (328 мг, 1,84 ммоль) получали белое тврдое целевое соединение (502 мг, 1,12 ммоль, 61%). 1H-ЯМР (400 МГц, ДМСО, ) = 2.61 (brs, 2H), 2.64 (s, 3 Н), 3.04 (brs, 2H), 3.29(brs, 2H), 3.91(brs, 2H), 6.76 (m, 4 Н), 7.53 (m, 2 Н), 7.60 (m, 1 Н), 7.69 (m, 1 Н). Пример 40. Синтез (4-(2-гидроксифенил)пиперазин-1-ил)(5-метил-3-(2-(трифторметокси)фенил)изоксазол-4-ил)метанона Таким же образом, как описано в примере 1, с использованием диметилформимида (15 мл), 5 метил-3-(2-(трифторметокси)изоксазол-4-карбоновой кислоты (500 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль), гидроксибензотриазола (299 мг, 2,21 ммоль) и 2(пиперазин-1-ил)фенола (328 мг, 1,84 ммоль) получали белое тврдое целевое соединение (536 мг, 1,20 ммоль, 65%). 1H-ЯМР (400 МГц, CDCl3, ) = 2.39 (brs, 2H), 2.63 (s, 3 Н), 2.89 (brs, 2H), 3.36 (brs, 2H), 3.86 сазол-4-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-метил-3-2(трифторметокси)изоксазол-4-карбоновой кислоты (500 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(4-фторфенил)пиперазина (332 мг, 1,84 ммоль) получали белое тврдое целевое соединение (536 мг, 1,20 ммоль, 65%). 1H-ЯМР (400 МГц, CDCl3, ) = 2.63 (s, 3 Н),2.91(brs, 4H), 3.51 (brs, 4H), 6.94 (m, 2H), 7.07 (m, 2H), 7.53 (m, 2H), 7.63 (m, 1H), 7.74 (m, 1H). Пример 42. Синтез (4-(2-фторфенил)пиперазин-1-ил)(5-метил-3-(3-(трифторметил)фенил)изоксазол-4-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), метил-3-(3(трифторметил)фенил)изоксазол-4-карбоновой кислоты (500 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(2-фторфенил)пиперазина (332 мг, 1,84 ммоль) получали белое тврдое целевое соединение (536 мг, 1,24 ммоль, 67%). 1H-ЯМР (400 МГц, CDCl3, ) = 2.68 (s,3 Н), 2.73 (brs, 2H), 3.01 (brs, 2H), 3.41 (brs, 2H), 3.72 (brs, 2 Н), 6.09 (m, 3 Н), 6.83 (t, 1H), 7.34 (m, 1H), 7.72(m, 1H), 7.86 (m, 2H). Пример 43. Синтез (4-(3,4-дихлорфенил)пиперазин-1-ил)(5-метил-3-(3-(трифторметил)фенил)изоксазол-4-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-метил-3-(3(трифторметил)фенил)изоксазол-4-карбоновой кислоты (500 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль) и 1-(3,4-дихлорфенил)пиперазина (425 мг,1,84 ммоль) получали белое тврдое целевое соединение (644 мг, 1,24 ммоль, 68%). 1H-ЯМР (400 МГц,CDCl3, ) = 2.62 (s, 3 Н), 2.73 (brs, 2H), 3.12 (brs, 2H), 3.48 (brs, 2H), 3.76 (brs, 2 Н), 6.70 (dd, 1 Н), 6.84 (d,1H), 7.31 (m, 1H), 7.54 (d, 1H), 7.72 (m, 1H), 7.82 (m, 2H). Пример 44. Синтез (4-(3-метоксифенил)пиперазин-1-ил)(5-метил-3-(3-(трифторметил)фенил)изоксазол-4-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-метил-3-(3(трифторметил)фенил)изоксазол-4-карбоновой кислоты (500 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль) и 1-(3-метоксифенил)пиперазина (354 мг, 1,84 ммоль) получали гелеобразное целевое соединение (602 мг, 1,37 ммоль, 75%). 1 Н-ЯМР (400 МГц, CDCl3,) = 2.61 (brs, 2H), 2.69 (s, 3 Н), 3.15 (brs, 2H), 3.46 (brs, 2H), 4.12 (brs, 2H), 6.48 (brs, 1 Н), 6.50 (m, 2H), 7.31(dd, 1H), 7.37 (m, 1H), 7.75 (m, 1H), 7.85 (m, 2H). Пример 45. Синтез (4-(2-метоксифенил)пиперазин-1-ил)(5-метил-3-(3-(трифторметил)фенил)изоксазол-4-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-метил-3-(3(трифторметил)фенил)изоксазол-4-карбоновой кислоты (500 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль) и 1-(2-метоксифенил)пиперазина (354 мг, 1,84 ммоль) получали белое тврдое целевое соединение (524 мг, 1,18 ммоль, 64%). 1 Н-ЯМР (400 МГц, CDCl3,) = 2.59 (S, 3 Н), 2.73 (brs, 2H), 2.08 (brs, 2H), 3,41 (brs, 2H), 3.73 (brs, -2 Н), 3.84 (s, 3 Н), 6.47 (brs, 1H), 6.52(m, 2H), 7.13 (t, 1 Н), 7.32 (m, 1 Н), 7.76 (m, 1 Н), 7.83 (m, 2 Н). Пример 46. Синтез (5-метил-(3-(3-трифторметил)фенил)изоксазол-4-ил)(4-(3-(трифторметил)фенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-метил-3-(3(трифторметил)фенил)изоксазол-4-карбоновой кислоты (500 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль) и 1-(3-(трифторметил)фенил)пиперазина (424 мг, 1,84 ммоль) получали гелеобразное целевое соединение (501 мг, 1,04 ммоль, 56%). 1H-ЯМР (400 МГц,CDCl3, ) = 2.60 (brs, 2H), 2.62 (s, 3 Н), 3.28 (brs, 2H), 3.42 (brs, 2H), 3.54 (brs, 2H), 4.03 (brs, 2H), 6.92 (m,2H), 7.04 (m, 1H), 7.32 (m, 1H), 7.76 (m, 2H), 7.85 (m, 2H). Пример 47. Синтез (4-(4-гидроксифенил)пиперазин-1-ил)(5-метил-3-(3-(трифторметил)фенил)изоксазол-4-ил)метанона Таким же образом, как описано в примере 1, с использованием диметилформимида (15 мл), 5 метил-3-(3-(трифторметил)фенил)изоксазол-4-карбоновой кислоты (500 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль), гидроксибензотриазола (299 мг, 2,21 ммоль) и 4-(пиперазин-1-ил)фенола (328 мг, 1,84 ммоль) получали белое тврдое целевое соединение(m, 4H), 7.36 (m, 1H), 7.72 (m, 1H), 7.86 (m, 2H). Пример 48. Синтез (4-(2-гидроксифенил)пиперазин-1-ил)(5-метил-3-(3-(трифторметил)фенил)изоксазол-4-ил)метанона Таким же образом, как описано в примере 1, с использованием диметилформимида (15 мл), 5 метил-3-(3-(трифторметил)фенил)изоксазол-4-карбоновой кислоты (500 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль), гидроксибензотриазола (299 мг, 2,21 ммоль) и 2-(пиперазин-1-ил)фенола (328 мг, 1,84 ммоль) получали белое тврдое целевое соединение(brs, 2H), 3.87 (brs, 2H), 6.92 (m, 3 Н), 7.19 (m, 1 Н), 7.36 (m, 1H), 7.72 (m, 1H), 7.84 (m, 2H). Пример 49. Синтез (4-(4-фторфенил)пиперазин-1-ил)(5-метил-3-(3-(трифторметил)фенил)изоксазол-4-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-метил-3-(3(трифторметил)фенил)изоксазол-4-карбоновой кислоты (500 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль) и 1-(4-фторфенил)пиперазина (332 мг, 1,84 ммоль) получали белое тврдое целевое соединение (566 мг, 1,31 ммоль, 71%). 1H-ЯМР (400 МГц, CDCl3,) = 2.68 (s, 3 Н), 2.94 (brs, 4H), 3.38 (brs, 4H), 6.94 (m, 2H), 7.06 (m, 2H), 7.39 (m, 1 Н), 7.75 (m, 1H), 7.84(m, 2H). Пример 50. Синтез (4-(2-фторфенил)пиперазин-1-ил)(5-метил-3-(3-(трифторметокси)фенил)изоксазол-4-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-метил-3-3(трифторметокси)изоксазол-4-карбоновой кислоты (500 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(2-фторфенил)пиперазина (332 мг, 1,84 ммоль) получали белое тврдое целевое соединение (542 мг, 1,21 ммоль, 65%). 1H-ЯМР (400 МГц, CDCl3, ) = 2.53 (brs, 2H),2.41 (s, 3 Н), 3.03 (brs, 2H), 3.48 (brs, 2H), 3.79 (brs, 2H), 6.84 (t, 1H), 7.02 (m, 2H), 7.06 (m, 2H), 7.42 (m,2H), 7.61 (m, 2H). Пример 51. Синтез (4-(3,4-дихлорфенил)пиперазин-1-ил)(5-метил-3-(3-(трифторметокси)фенил)изоксазол-4-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-метил-3-(3(трифторметокси)изоксазол-4-карбоновой кислоты (500 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(3,4-дихлорфенил)пиперазина (381 мг, 1,84 ммоль) получали белое тврдое целевое соединение (602 мг, 1,20 ммоль, 65%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 2.59 (brs,2H), 2.72 (s, 3 Н), 3.12 (brs, 2H), 3.28 (brs, 2H), 3.70 (brs, 2H), 6.69 (dd, 1 Н), 6.82 (d, 1H), 7.20 (t, 1H), 7.44(m, 2H), 7.58 (m, 2H). Пример 52. Синтез (4-(3-метоксифенил)пиперазин-1-ил)(5-метил-3-(3-(трифторметокси)фенил)изоксазол-4-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-метил-3-(3(трифторметокси)изоксазол-4-карбоновой кислоты (500 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(3-метоксифенил)пиперазина (354 мг, 1,84 ммоль) получали гелеобразное целевое соединение (564 мг, 1,22 ммоль, 66%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 2.69 (s, 3 Н),2.72 (brs, 2H), 3.16 (brs, 2H), 3.33 (brs, 2H), 3.82 (brs, 2 Н), 3.83 (s, 3 Н), 6.42 (brs, 1H), 6.58 (m, 2H), 7.22 (t,1 Н), 7.44 (m, 2 Н), 7.59 (m, 2 Н). Пример 53. Синтез (4-(2-метоксифенил)пиперазин-1-ил)(5-метил-3-(3-(трифторметокси)фенил)изоксазол-4-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-метил-3-(3(трифторметокси)изоксазол-4-карбоновой кислоты (500 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(2-метоксифенил)пиперазина (354 мг, 1,84 ммоль) получали белое тврдое целевое соединение (633 мг, 1,37 ммоль, 75%). 1H-ЯМР (400 МГц, CDCl3, ) = 2.68 (brs,2H), 2.70 (s, 3 Н), 2.98 (brs, 2H), 3.43 (brs, 2H), 3.87 (brs, 2H), 3.82 (s, 3 Н), 6.76 (brs, 1H), 6.91 (t, 1H), 6.96 (t,1 Н), 7.04 (t, 1H), 7.41 (m, 2H), 7.65 (m, 2H). Пример 54. Синтез (5-метил-3-(3-(трифторметокси)фенил)изоксазол-4-ил)(4-(3-(трифторметил)фенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-метил-3-(3(трифторметокси)изоксазол-4-карбоновой кислоты (500 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(3-(трифторметил)фенил)пиперазина (424 мг, 1,84 ммоль) получали гелеобразное целевое соединение (501 мг, 1,00 ммоль, 55%). 1H-ЯМР (400 МГц, CDCl3, ) = 2.64 (s, 3 Н), 2.70 (brs, 2 Н), 3.21 (brs, 2 Н), 3.30 (brs, 2H), 3.84 (brs, 2 Н), 7.02 (d, 1H), 7.08 (s, 1H), 7.18 (d,1H), 7.40 (m, 1 Н), 7.43 (m, 2 Н), 7.68 (m, 2 Н). Пример 55. Синтез (4-(4-гидроксифенил)пиперазин-1-ил)(5-метил-3-(3-(трифторметокси)фенил)изоксазол-4-ил)метанона Таким же образом, как описано в примере 1, с использованием диметилформимида (15 мл), 5 метил-3-(3-(трифторметокси)изоксазол-4-карбоновой кислоты (500 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль), гидроксибензотриазола (299 мг, 2,21 ммоль) и 4-(пиперазин-1-ил)фенола (328 мг, 1,84 ммоль) получали белое тврдое целевое соединение (502 мг, 1,12 ммоль,61%). 1 Н-ЯМР (400 МГц, ДМСО, ) = 2.62 (brs, 4H), 2.69 (s, 3 Н), 3.49 (brs, 4 Н), 6.74 (m, 4 Н), 7.47 (m, 2 Н),7.69 (m, 2 Н). Пример 56. Синтез (4-(2-гидроксифенил)пиперазин-1-ил)(5-метил-3-(3-(трифторметокси)фенил)изоксазол-4-ил)метанона Таким же образом, как описано в примере 1, с использованием диметилформимида (15 мл), 5 метил-3-3-(трифторметокси)изоксазол-4-карбоновой кислоты (500 мг, 1,84 ммоль), 1-этил-3-(диметил- 19022336 аминопропил)карбодиимида (388 мг, 2,02 ммоль), гидроксибензотриазола (299 мг, 2,21 ммоль) и 2(пиперазин-1-ил)фенола (328 мг, 1,84 ммоль) получали белое тврдое целевое соединение (536 мг, 1,20 ммоль, 65%). 1H-ЯМР (400 МГц, CDCl3, ) = 2.34 (brs, 2H), 2.63 (s, 3 Н), 2.85 (brs, 2H), 3.35 (brs, 2H), 3.84(brs, 2H), 6.85 (m, 1 Н), 6.97 (m, 2H), 7.20 (m, 1H), 7.45 (m, 2H), 7.69 (m, 2H). Пример 57. Синтез (4-(4-фторфенил)пиперазин-1-ил)(5-метил-3-(3-(трифторметокси)фенил)изоксазол-4-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-метил-3-3(трифторметокси)изоксазол-4-карбоновой кислоты (500 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(4-фторфенил)пиперазин (332 мг, 1,84 ммоль) получали белое тврдое целевое соединение (536 мг, 1,20 ммоль, 65%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 2.64 (s, 3 Н),2.94 (brs, 4H), 3.58 (brs, 4H), 6.90 (m, 2 Н), 7.21 (m, 2 Н), 7.50 (m, 2H), 7.63 (m, H). Пример 58. Синтез (5-амино-3-(2-хлорфенил)изоксазол-4-ил)(4-(2-фторфенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(2 хлорфенил)изоксазол-4-карбоновой кислоты (440 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(2-фторфенил)пиперазина (332 мг, 1,84 ммоль) получали белое тврдое целевое соединение (532 мг, 1,33 ммоль, 72%). 1 Н-ЯМР (400 МГц, ДМСО, ) = 2.73 (brs, 2H),3.04 (brs, 2H), 3.45 (brs, 2H), 3.73 (brs, 2H), 6.09 (m, 3 Н), 6.86 (m, 1 Н), 7.41 (s, 2 Н), 7.44 (m, 3 Н), 7.54 (m,1 Н). Пример 59. Синтез (5-амино-3-(2-хлорфенил)изоксазол-4-ил)(4-(3,4-дихлорфенил)пиперазин-1 ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(2 хлорфенил)изоксазол-4-карбоновой кислоты (440 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(3,4-дихлорфенил)пиперазина (425 мг, 1,84 ммоль) получали белое тврдое целевое соединение (577 мг, 1,35 ммоль, 73%). 1 Н-ЯМР (400 МГц, ДМСО, ) = 2.98 (brs,4H), 3.43 (brs, 4H), 6.86 (t, 1H), 7.10 (d, 1H), 7.40 (s, 2H), 7.50 (m, 5H). Пример 60. Синтез (5-амино-3-(2-хлорфенил)изоксазол-4-ил)(4-(3-метоксифенил)пиперазин-1 ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(2 хлорфенил)изоксазол-4-карбоновой кислоты (440 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(3-метоксифенил)пиперазина (354 мг, 1,84 ммоль) получали белое тврдое целевое соединение (516 мг, 1,25 ммоль, 68%). 1 Н-ЯМР (400 МГц, ДМСО, ) = 2.88 (brs, 4H),3.43 (brs, 4H), 3.71 (s, 3H), 6.38 (m, 2H), 6.46 (dd, 1H), 7.10 (m, 1 Н), 7.38 (s, 2 Н), 7.51 (m, 4 Н). Пример 61. Синтез (5-амино-3-(2-хлорфенил)изоксазол-4-ил)(4-(2-метоксифенил)пиперазин-1 ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(2 хлорфенил)изоксазол-4-карбоновой кислоты (440 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(2-метоксифенил)пиперазина (354 мг, 1,84 ммоль) получали белое тврдое целевое соединение (523 мг, 1.27 ммоль, 69%). 1 Н-ЯМР (400 МГц, ДМСО, ) = 2.66 (brs,4H), 3.40 (brs, 4H), 3.76 (s, 3H), 6.76 (d, 1H), 6.85 (t, 1H), 6.95 (m, 2 Н), 7.38 (,s, 2 Н), 7.50 (m, 3 Н), 7.57 (m,1 Н). Пример 62. Синтез (5-амино-3-(2-хлорфенил)изоксазол-4-ил)(4-(3-(трифторметил)фенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(2 хлорфенил)изоксазол-4-карбоновой кислоты (440 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(3-(трифторметил)фенил)пиперазина (424 мг, 1,84 ммоль) получали белое тврдое целевое соединение (633 мг, 1,40 ммоль, 76%). 1 Н-ЯМР (400 МГц, ДМСО, ) = 2.61 (brs, 2 Н), 3.14 (brs, 2H), 3.35 (brs, 2H), 7.15 (m, 2H), 7.17 (d, 1H), 7.46 (m, 1 Н), 7.39 (s, 2 Н), 7.54 (m,3 Н), 7.59 (m, 1 Н). Пример 63. Синтез (5-амино-3-(2-хлорфенил)изоксазол-4-ил)(4-(4-гидроксифенил)пиперазин-1 ил)метанона Таким же образом, как описано в примере 1, с использованием диметилформимида (15 мл), 5 амино-3-(2-хлорфенил)изоксазол-4-карбоновой кислоты (440 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль), гидроксибензотриазола (299 мг, 2,21 ммоль) и 4-(пиперазин 1-ил)фенола (328 мг, 1,84 ммоль) получали белое тврдое целевое соединение (504 мг, 1,26 ммоль, 69%). 1 Н-ЯМР (400 МГц, ДМСО, ) = 2.62 (brs, 2H), 3.09 (brs, 2H), 3.31 (brs, 2H), 3.95 (brs, 2H), 6.80 (m, 4H),7.31 (s, 2 Н), 7.50 (m, 3 Н), 7.53 (m, 1 Н). Пример 64. Синтез (5-амино-3-(2-хлорфенил)изоксазол-4-ил)(4-(2-гидроксифенил)пиперазин-1 ил)метанона Таким же образом, как описано в примере 1, с использованием диметилформимида (15 мл), 5 амино-3-(2-хлорфенил)изоксазол-4-карбоновой кислоты (440 мг, 1,84 ммоль), 1-этил-3-(диметиламино- 20022336 пропил)карбодиимида (388 мг, 2,02 ммоль), гидроксибензотриазола (299 мг, 2,21 ммоль) и 2-(пиперазин 1-ил)фенола (328 мг, 1,84 ммоль) получали белое тврдое целевое соединение (518 мг, 1,30 ммоль, 71%). 1 Н-ЯМР (400 МГц, ДМСО, ) = 2.60 (brs, 2H), 3.04 (brs, 2H), 3.32 (brs, 2H), 3.99 (brs, 2H), 6.87 (m, 1H),7.00 (m, 2 Н), 7.19 (m, 1 Н), 7.41 (s, 2H), 7.54 (m, 3 Н), 7.56 (m, 1 Н). Пример 65. Синтез (5-амино-3-(2-хлорфенил)изоксазол-4-ил)(4-(4-фторфенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(2 хлорфенил)изоксазол-4-карбоновой кислоты (440 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(4-фторфенил)пиперазина (332 мг, 1,84 ммоль) получали белое тврдое целевое соединение (561 мг, 1,40 ммоль, 76%). 1 Н-ЯМР (400 МГц, ДМСО, ) = 2.84 (brs, 4H), 3.45(brs, 4 Н), 6.91 (m, 2 Н), 7.03 (m, 2 Н), 7.36 (s, 2H), 7.52 (m, 3 Н), 7.59 (m, 1 Н). Пример 66. Синтез (5-амино-3-(3-фторфенил)изоксазол-4-ил)(4-(2-фторфенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(3 фторфенил)изоксазол-4-карбоновой кислоты (409 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(2-фторфенил)пиперазина (332 мг, 1,84 ммоль) получали белое тврдое целевое соединение (508 мг, 1,32 ммоль, 72%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 2.72 (brs, 2H), 3.04 (brs,2H), 3.39 (brs, 2H), 3.69 (brs, 2H), 6.05 (m, 3 Н), 6.83 (t, 1 Н), 7.26 (m, 1H), 7.35 (brs, 2H), 7,45 (m, 3H). Пример 67. Синтез (5-амино-3-(3-фторфенил)изоксазол-4-ил)(4-(3,4-дихлорфенил)пиперазин-1 ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(3 фторфенил)изоксазол-4-карбоновой кислоты (409 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(3,4-дихлорфенил)пиперазина (425 мг, 1,84 ммоль) получали белое тврдое целевое соединение (596 мг, 1,37 ммоль, 74%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 2.73 (brs, 2H), 3.02(brs, 2H), 3.39 (brs, 2H), 3.69 (brs, 2H), 6.65 (dd, 1 Н), 6.87 (d, 1H), 7.20 (m, 1H), 7.21 (m, 1H), 7.36 (brs, 2H),7.43 (m, 3H). Пример 68. Синтез (5-амино-3-(3-фторфенил)изоксазол-4-ил)(4-(3-метоксифенил)пиперазин-1 ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(3 фторфенил)изоксазол-4-карбоновой кислоты (409 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(3-метоксифенил)пиперазина (354 мг, 1,84 ммоль) получали белое тврдое целевое соединение (601 мг, 1,52 ммоль, 82%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 2.61 (brs, 2H), 3.14(brs, 2H), 3.30 (brs, 2H), 3.78 (brs, 2H), 3.80 (s, 3 Н), 6.42 (brs, 1 Н), 6.53 (m, 2H), 7.19 (m, 1H), 7.37 (brs, 2H),7.43 (m, 3H), 7.46 (dd, 1H), 7.76 (dd, 1H). Пример 69. Синтез (5-амино-3-(3-фторфенил)изоксазол-4-ил)(4-(2-метоксифенил)пиперазин-1 ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(3 фторфенил)изоксазол-4-карбоновой кислоты (409 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(2-метоксифенил)пиперазина (354 мг, 1,84 ммоль) получали белое тврдое целевое соединение (482 мг, 1,21 ммоль, 66%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 2.63 (brs, 2H), 3.02(brs, 2H), 3.36 (brs, 2H), 3.76 (brs, 2H), 3.89 (brs, 2 Н), 6.75 (brs, 1 Н), 6.89 (m, 1H), 6.90 (m, 1H), 7.24 (m, 1H),7.33 (brs, 2H), 7.45 (m, 3H), 7.65 (dd, 1H). Пример 70. Синтез (5-амино-3-(3-фторфенил)изоксазол-4-ил)(4-(3-(трифторметил)фенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(3 фторфенил)изоксазол-4-карбоновой кислоты (409 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(3-трифторметил)фенил)пиперазина (424 мг, 1,84 ммоль) получали белое тврдое целевое соединение (639 мг, 1,47 ммоль, 80%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 2.61 (brs,2H), 3.17 (brs, 2H), 3.35 (brs, 2H), 7.01 (m, 2H), 7.15 (d, 1H), 7.21 (m, 1H), 7.39 (brs, 2H), 7.42 (m, 3H), 7.45(m, 1H). Пример 71. Синтез (5-амино-3-(3-фторфенил)изоксазол-4-ил)(4-(4-гидроксифенил)пиперазин-1 ил)метанона Таким же образом, как описано в примере 1, с использованием диметилформимида (15 мл), 5 амино-3-(3-фторфенил)изоксазол-4-карбоновой кислоты (409 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль), гидроксибензотриазола (299 мг, 2,21 ммоль) и 4-(пиперазин-1-ил)фенола (328 мг, 1,84 ммоль) получали белое тврдое целевое соединение (483 мг, 1,26 ммоль, 68%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 2.60 (brs, 2H), 3.14 (brs, 2H), 3.36 (brs, 2H), 3.99 (brs, 2H),6.83 (m, 4H), 7.20 (m, 1 Н), 7.39 (brs, 2H), 7.45 (m, 3 Н). Пример 72. Синтез (5-амино-3-(3-фторфенил)изоксазол-4-ил)(4-(2-гидроксифенил)пиперазин-1 ил)метанона Таким же образом, как описано в примере 1, с использованием диметилформимида (15 мл), 5- 21022336 амино-3-(3-фторфенил)изоксазол-4-карбоновой кислоты (409 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль), гидроксибензотриазола (299 мг, 2,21 ммоль) и 2-(пиперазин 1-ил)фенола (312 мг, 1,84 ммоль) получали белое тврдое целевое соединение (381 мг, 0,81 ммоль, 44%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 2.61 (brs, 2H), 3.06 (brs, 2H), 3.42 (brs, 2H), 4.02 (brs, 2H), 6.89 (m, 1 Н), 7.06(m, 1H), 7.24 (m, 2H), 7.41 (brs, 2H), 7.48 (m, 3H). Пример 73. Синтез (5-амино-3-(3-фторфенил)изоксазол-4-ил)(4-(4-фторфенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(3 фторфенил)изоксазол-4-карбоновой кислоты (409 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(4-фторфенил)пиперазина (332 мг, 1,84 ммоль) получали белое тврдое целевое соединение (576 мг, 1,50 ммоль, 81%). 1 Н-ЯМР (400 МГц, ДМСО, ) = 2.91 (brs, 4H),3.50 (brs, 4 Н), 6.97 (m, 2 Н), 7.10 (m, 2 Н), 7.28 (m, 1 Н), 7.37 (brs, 2H), 7.46 (m, 3 Н). Пример 74. Синтез (5-амино-3-(2-фторфенил)изоксазол-4-ил)(4-(2-фторфенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(2 фторфенил)изоксазол-4-карбоновой кислоты (409 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(2-фторфенил)пиперазина (332 мг, 1,84 ммоль) получали белое тврдое целевое соединение (533 мг, 1,39 ммоль, 75%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 2.69 (brs, 2H), 2.92 (brs,2H), 3.40 (brs, 2H), 3.85 (brs, 2H), 6.62 (m, 1H), 6.78 (m, 1H), 7.06 (m, 2H), 7.27 (m, 1H), 7.37 (brs, 2H), 7.47(m, 1 Н), 7.56 (m, 2H). Пример 75. Синтез (5-амино-3-(2-фторфенил)изоксазол-4-ил)(4-(3,4-дихлорфенил)пиперазин-1 ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(2 фторфенил)изоксазол-4-карбоновой кислоты (409 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(3,4-дихлорфенил)пиперазина (425 мг, 1,84 ммоль) получали белое тврдое целевое соединение (613 мг, 1,49 ммоль, 81%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 2.63 (brs, 2H), 3.09(brs, 2H), 3.22 (brs, 2H), 3.87 (brs, 2H), 6.66 (dd, 1 Н), 6.87 (d, 1H), 7.28 (m, 1H), 7.36 (s, 2H), 7.37 (m, 1H),7.48 (m, 1H), 7.57 (m, 2H). Пример 76. Синтез (5-амино-3-(2-фторфенил)изоксазол-4-ил)(4-(3-метоксифенил)пиперазин-1 ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(2 фторфенил)изоксазол-4-карбоновой кислоты (409 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(3-метоксифенил)пиперазина (354 мг, 1,84 ммоль) получали белое тврдое целевое соединение (558 мг, 1,41 ммоль, 77%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 2.64 (brs,2H), 3.19 (brs, 2H), 3.30 (brs, 2H), 3.80 (s, 3 Н), 3.93 (brs, 2H), 6.42 (m, 1 Н), 6.48 (m, 2H), 7.13 (m, 1H), 7.26(m, 1H), 7.36 (brs, 2H), 7.47 (m, 1H), 7.61 (m, 2H). Пример 77. Синтез (5-амино-3-(2-фторфенил)изоксазол-4-ил)(4-(2-метоксифенил)пиперазин-1 ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(2 фторфенил)изоксазол-4-карбоновой кислоты (409 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(2-метоксифенил)пиперазина (354 мг, 1,84 ммоль) получали белое тврдое целевое соединение (464 мг, 1,17 ммоль, 77%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 2.57 (brs,2H), 3.03 (brs, 2H), 3.32 (brs, 2H), 3.83 (s, 3 Н), 3.95 (brs, 2H), 6.55 (m, 1 Н), 6.90 (m, 2H), 7.04 (m, 1H), 7.25(m, 1H), 7.37 (brs, 2H), 7.45 (m, 1H), 7.59 (m, 2H). Пример 78. Синтез (5-амино-3-(2-фторфенил)изоксазол-4-ил)(4-(3-(трифторметил)фенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(2 фторфенил)изоксазол-4-карбоновой кислоты (409 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(3-трифторметил)фенил)пиперазина (424 мг, 1,84 ммоль) получали белое тврдое целевое соединение (596 мг, 1,37 ммоль, 75%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 2.62 (brs,2H), 3.07 (brs, 2H), 3.33 (brs, 2H), 3.90 (brs, 2H), 7.00 (m, 1H), 7.24 (m, 4H), 7.32 (brs, 2H), 7.44 (m, 1H), 7.59(m, 2H). Пример 79. Синтез (5-амино-3-(2-фторфенил)изоксазол-4-ил)(4-(4-гидроксифенил)пиперазин-1 ил)метанона Таким же образом, как описано в примере 1, с использованием диметилформимида (15 мл), 5 амино-3-(2-фторфенил)изоксазол-4-карбоновой кислоты (409 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль), гидроксибензотриазола (299 мг, 2,21 ммоль) и 4-(пиперазин 1-ил)фенола (328 мг, 1,84 ммоль) получали белое тврдое целевое соединение (412 мг, 1,08 ммоль, 59%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 2.61 (brs, 2H), 3.07 (brs, 2H), 3.32 (brs, 2H), 3.95 (brs, 2H), 6.77 (m, 4H), 7.22 Пример 80. Синтез (5-амино-3-(2-фторфенил)изоксазол-4-ил)(4-(2-гидроксифенил)пиперазин-1 ил)метанона Таким же образом, как описано в примере 1, с использованием диметилформимида (15 мл), 5 амино-3-(2-фторфенил)изоксазол-4-карбоновой кислоты (409 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль), гидроксибензотриазола (299 мг, 2,21 ммоль) и 2-(пиперазин 1-ил)фенола (328 мг, 1,84 ммоль) получали белое тврдое целевое соединение (439 мг, 1,15 ммоль, 62%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 2.62 (brs, 2H), 3.02 (brs, 2H), 3.38 (brs, 2H), 4.01 (brs, 2H), 6.60 (m, 1H), 6.83(m, 3 Н), 7.25 (m, 1H), 7.33 (brs, 2H), 7.47 (m, 1H), 7.63 (m, 2H). Пример 81. Синтез (5-амино-3-(2-фторфенил)изоксазол-4-ил)(4-(4-фторфенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(2 фторфенил)изоксазол-4-карбоновой кислоты (409 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(4-фторфенил)пиперазина (332 мг, 1,84 ммоль) получали белое тврдое целевое соединение (538 мг, 1,40 ммоль, 76%). 1 Н-ЯМР (400 МГц, ДМСО, ) = 2.89 (brs, 4H), 3.49(brs, 4 Н), 6.92 (m, 2 Н), 7.06 (m, 2 Н), 7.31 (m, 2 Н), 7.33 (brs, 2 Н), 7.54 (m, 2 Н). Пример 82. Синтез (5-амино-3-(2-(трифторметокси)фенил)изоксазол-4-ил)(4-(2-фторфенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(2(трифторметокси)фенил)изоксазол-4-карбоновой кислоты (530 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,0 ммоль) и 1-(2-фторфенил)пиперазина (332 мг, 1,84 ммоль) получали белое тврдое целевое соединение (576 мг, 1,28 ммоль, 70%). 1 Н-ЯМР (400 МГц,ДМСО, ) = 2.71 (brs, 2H), 3.04 (brs, 2H), 3.43 (brs, 2H), 3.69 (brs, 2H), 6.07 (m, 3H), 6.79 (t, 1 Н), 7.31 (brs,2 Н), 7.41 (m, 3 Н), 7.54 (m, 1 Н). Пример 83. Синтез (5-амино-3-(2-(трифторметокси)фенил)изоксазол-4-ил)(3,4-дихлорфенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(2(трифторметокси)фенил)изоксазол-4-карбоновой кислоты (530 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(3,4-дихлорфенил)пиперазина (425 мг, 1,84 ммоль) получали белое тврдое целевое соединение (713 мг, 1,42 ммоль, 77%). 1 Н-ЯМР (400 МГц, ДМСО, ) = 2.73(brs, 2H), 3.03 (brs, 2H), 3.45 (brs, 2H), 3.71 (brs, 2H), 6.65 (dd, 1 Н), 6.87 (d, 1H), 7.29 (m, 1H), 7.31 (brs, 2H),7.41 (m, 3 Н), 7.54 (m, 1 Н). Пример 84. Синтез (5-амино-3-(2-(трифторметокси)фенил)изоксазол-4-ил)(4-(3-метоксифенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(2(трифторметокси)фенил)изоксазол-4-карбоновой кислоты (530 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль) и 1-(3-метоксифенил)пиперазина (354 мг, 1,84 ммоль) получали белое тврдое целевое соединение (592 мг, 1,28 ммоль, 70%). 1 Н-ЯМР (400 МГц,ДМСО, ) = 2.65 (brs, 2H), 3.12 (brs, 2H), 3.31 (brs, 2H), 3.79 (brs, 2H), 3.81 (s, 3H), 6.40 (brs, 1H), 6.50 (m,2 Н), 7.32 (brs, 2H), 7.45 (m, 3 Н), 7.44 (dd, 1 Н), 7.59 (m, 1 Н), 7.77 (dd, 1H). Пример 85. Синтез (5-амино-3-(2-(трифторметокси)фенил)изоксазол-4-ил)(4-(2-метоксифенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(2(трифторметокси)фенил)изоксазол-4-карбоновой кислоты (530 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль) и 1-(2-метоксифенил)пиперазина (354 мг, 1,84 ммоль) получали белое тврдое целевое соединение (559 мг, 1,21 ммоль, 66%). 1 Н-ЯМР (400 МГц,ДМСО, ) = 2.62 (brs, 2H), 2.95 (brs, 2H), 3.31 (brs, 2H), 3.75 (brs, 2H), 3.89 (s, 3 Н), 6.78 (brs, 1H), 6.86 (t,1H), 6.91 (t, 1H), 7.32 (brs, 2 Н), 7.41 (m, 3 Н), 7.54 (m, 1 Н), 7.69 (dd, 1H). Пример 86. Синтез (5-амино-3-(2-(трифторметокси)фенил)изоксазол-4-ил)(4-(3-(трифторметил)фенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(2(трифторметокси)фенил)изоксазол-4-карбоновой кислоты (530 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль) и 1-(3-(трифторметил)фенил)пиперазина(424 мг, 1,84 ммоль) получали белое тврдое целевое соединение (633 мг, 1,27 ммоль, 69%). 1 Н-ЯМР (400 МГц, ДМСО, ) = 2.61 (brs, 2H), 3.13 (brs, 2H), 3.35 (brs, 2H), 7.01 (m, 2H), 7.15 (d, 1H), 7.31 (brs, 2 Н), 7.45(m, 4 Н), 7.58 (m, 1 Н). Пример 87. Синтез (5-амино-3-(2-(трифторметокси)фенил)изоксазол-4-ил)(4-(4-гидроксифенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием диметилформимида (15 мл), 5 амино-3-(2-(трифторметокси)фенил)изоксазол-4-карбоновой кислоты (530 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль), гидроксибензотриазола (299 мг, 2,21 ммоль) и 4(пиперазин-1-ил)фенола (328 мг, 1,84 ммоль) получали белое тврдое целевое соединение (608 мг, 1,36- 23022336 ммоль, 73%). 1 Н-ЯМР (400 МГц, ДМСО, ) = 2.60 (brs, 2H), 3.34 (brs, 2H), 3.29 (brs, 2H), 3.98 (brs, 2H),6.71 (m, 4H), 7.31 (brs, 2 Н), 7.45 (m, 3 Н), 7.55 (m, 1 Н). Пример 88. Синтез (5-амино-3-(2-(трифторметокси)фенил)изоксазол-4-ил)(4-(2-гидроксифенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием диметилформимида (15 мл), 5 амино-3-(2-(трифторметокси)фенил)изоксазол-4-карбоновой кислоты (530 мг, 1,84 ммоль), 1-этил-3(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль), гидроксибензотриазола (299 мг,2,21 ммоль) и 2-(пиперазин-1-ил)фенола (328 мг, 1,84 ммоль) получали белое тврдое целевое соединение (551 мг, 1,23 ммоль, 67%). 1 Н-ЯМР (400 МГц, ДМСО, ) = 2.63 (brs, 2H), 3.04 (brs, 2H), 3.33 (brs, 2H),4.03 (brs, 2H), 6.85 (m, 1H), 7.04 (m, 2 Н), 7.20 (m, 1 Н), 7.30 (brs, 2H), 7.47 (m, 3 Н), 7.61 (m, 1 Н). Пример 89. Синтез (5-амино-3-(2-(трифторметокси)фенил)изоксазол-4-ил)(4-(4-фторфенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(2(трифторметокси)фенил)изоксазол-4-карбоновой кислоты (530 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль) и 1-(4-фторфенил)пиперазина (332 мг, 1,84 ммоль) получали белое тврдое целевое соединение (607 мг, 1,35 ммоль, 73%). 1 Н-ЯМР (400 МГц,ДМСО, ) = 2.87 (brs, 4H), 3.47 (brs, 4 Н), 6.91 (m, 2 Н), 7.05 (m, 2 Н), 7.31 (brs, 2H), 7.44 (m, 3 Н), 7.62 (m,1 Н). Пример 90. Синтез (5-амино-3-(2-(трифторметил)фенил)изоксазол-4-ил)(4-(2-фторфенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(2 трифторметил)фенил)изоксазол-4-карбоновой кислоты (501 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль) и 1-(2-фторфенил)пиперазина (332 мг, 1,84 ммоль) получали белое тврдое целевое соединение (573 мг, 1,32 ммоль, 72%). 1 Н-ЯМР (400 МГц,ДМСО, ) = 2.72 (brs, 2H), 3.06 (brs, 2H), 3.39 (brs, 2H), 3.69 (brs, 2H), 6.04 (m, 3 Н), 6.83 (m, 1H), 7.42. (brs,2H), 7.40 (m, 1H), 7.75 (m, 2H), 7.79 (m, 1H). Пример 91. Синтез (5-амино-3-(2-(трифторметил)фенил)изоксазол-4-ил)(4-(3,4-дихлорфенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(2 трифторметил)фенил)изоксазол-4-карбоновой кислоты (501 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль) и 1-(3,4-дихлорфенил)пиперазина (425 мг, 1,84 ммоль) получали белое тврдое целевое соединение (633 мг, 1,30 ммоль, 71%). 1 Н-ЯМР (400 МГц,ДМСО, ) = 2.72 (brs, 2H), 3.09 (brs, 2H), 3.38 (brs, 2H), 3.76 (brs, 2H), 6.66 (dd, 1 Н), 6.84 (d, 1H), 7.28 (m,1H), 7.41 (brs, 2H), 7.40 (m, 1H), 7.73 (m, 2H), 7.78 (m, 1H). Пример 92. Синтез (5-амино-(3-(2-трифторметил)фенил)изоксазол-4-ил)(4-(3-метоксифенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(2 трифторметил)фенил)изоксазол-4-карбоновой кислоты (501 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль) и 1-(3-метоксифенил)пиперазина (354 мг, 1,84 ммоль) получали белое тврдое целевое соединение (549 мг, 1,23 ммоль, 67%). 1 Н-ЯМР (400 МГц,ДМСО, ) = 2.62 (brs, 2H), 3.15 (brs, 2H), 3.33 (brs, 2H), 3.81 (brs, 2H), 3.87 (s, 3 Н), 6.43 (s, 1 Н), 6.51 (m,2 Н), 7.40 (m, 1 Н), 7.43 (brs, 2 Н), 7.44 (dd, 1 Н), 7.73 (m, 2 Н), 7.79 (dd, 1H). Пример 93. Синтез (5-амино-3-(2-(трифторметил)фенил)изоксазол-4-ил)(4-(2-метоксифенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(2 трифторметил)фенил)изоксазол-4-карбоновой кислоты (501 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(2-метоксифенил)пиперазина (354 мг, 1,84 ммоль) получали белое тврдое целевое соединение (473 мг, 1,06 ммоль, 58%). 1 Н-ЯМР (400 МГц, ДМСО, ) = 2.61(brs, 2H), 3.02 (brs, 2H), 3.34 (brs, 2H), 3.75 (brs, 2H), 3.83 (s, 3H), 6.72 (brs, 1H), 6.89 (t, 1H), 6.92 (t, 1H),7.43 (brs, 2 Н), 7.44 (m, 1 Н), 7.65 (dd, 1 Н), 7.72 (m, 2 Н), 7.75 (m, 1 Н). Пример 94. Синтез 5-амино-3-(2-(трифторметил)фенил)изоксазол-4-ил)(4-(3-(трифторметил)фенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(2 трифторметил)фенил)изоксазол-4-карбоновой кислоты (501 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль) и 1-(3-(трифторметил)фенил)пиперазина (424 мг, 1,84 ммоль) получали белое тврдое целевое соединение (631 мг, 1,30 ммоль, 71%). 1 Н-ЯМР (400 МГц, ДМСО, ) = 2.65 (brs, 2H), 3.15 (brs, 4H), 3.37 (brs, 2H), 7.03 (m, 2H), 7.16 (d, 1H), 7.40 (m, 1 Н), 7.43 амино-3-(2-трифторметил)фенил)изоксазол-4-карбоновой кислоты (501 мг, 1,84 ммоль), 1-этил-3(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль), гидроксибензотриазола (299 мг,2,21 ммоль) и 4-(пиперазин-1-ил)фенола (328 мг, 1,84 ммоль) получали белое тврдое целевое соединение (434 мг, 1,00 ммоль, 55%). 1 Н-ЯМР (400 МГц, ДМСО, ) = 2.61 (brs, 2H), 3.04 (brs, 2H), 3.32 (brs, 2H),3.89 (brs, 2H), 6.79 (m, 4H), 7.38 (m, 1 Н), 7.46 (brs, 2 Н), 7.70 (m, 2 Н), 7.76 (m, 1 Н). Пример 96. Синтез (5-амино-3-(2-(трифторметил)фенил)изоксазол-4-ил)(4-(2-гидроксифенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием диметилформамиде (15 мл), 5 амино-3-(2-трифторметил)фенил)изоксазол-4-карбоновой кислоты (501 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль), гидроксибензотриазола (299 мг, 2,21 ммоль) и 2-(пиперазин-1-ил)фенола (328 мг, 1,84 ммоль) получали белое тврдое целевое соединение(brs, 2H), 6.81 (m, 1H), 7.06 (m, 2 Н), 7.19 (m, 1 Н), 7.42 (brs, 2H), 7.48 (m, 1 Н), 7.73 (m, 2 Н), 7.78 (m, 1 Н). Пример 97. Синтез (5-амино-3-(2-(трифторметил)фенил)изоксазол-4-ил)(4-(4-фторфенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(2 трифторметил)фенил)изоксазол-4-карбоновой кислоты (501 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль) и 1-(4-фторфенил)пиперазина (332 мг, 1,84 ммоль) получали белое тврдое целевое соединение (603 мг, 1,39 ммоль, 75%). 1 Н-ЯМР (400 МГц, CDCl3,) = 2.86 (brs, 4H), 3.47 (brs, 4H), 6.90 (m, 2H), 7.04 (m, 2H), 7.43 (brs, 2H), 7.49 (m, 1 Н), 7.70 (m, 2H), 7.76(m, 1H). Пример 98. Синтез (5-амино-3-(4-(трифторметокси)фенил)изоксазол-4-ил)(4-(2-фторфенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(4(трифторметокси)фенил)изоксазол-4-карбоновой кислоты (530 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль) и 1-(2-фторфенил)пиперазина (332 мг, 1,84 ммоль) получали белое тврдое целевое соединение (533 мг, 1,18 ммоль, 64%). 1 Н-ЯМР (400 МГц,ДМСО, ) = 2.72 (brs, 2H), 3,03 (brs, 2H), 3.43 (brs, 2H), 3.70 (brs, 2H), 6.08 (m, 3H), 6.79 (t, 1H), 7.31 (brs,2H), 7.38 (d, 2H), 7.44 (d, 2H). Пример 99. Синтез (5-амино-3-(4-(трифторметокси)фенил)изоксазол-4-ил)(3,4-(дихлорфенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(4(трифторметокси)фенил)изоксазол-4-карбоновой кислоты (530 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль) и 1-(3,4-дихлорфенил)пиперазина (425 мг, 1,84 ммоль) получали белое тврдое целевое соединение (688 мг, 1,37 ммоль, 75%). 1 Н-ЯМР (400 МГц,ДМСО, ) = 2.72 (brs, 2 Н), 3.03 (brs, 2H), 3.47 (brs, 2H), 3.71 (brs, 2H), 6.64 (dd, 1 Н), 6.86 (d, 1H), 7.32 (brs,2H), 7.33 (d, 2H), 7.45 (d, 2H), 7.54 (m, 1H). Пример 100. Синтез (5-амино-3-(4-(трифторметокси)фенил)изоксазол-4-ил)(4-(3-метоксифенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(4(трифторметокси)фенил)изоксазол-4-карбоновой кислоты (530 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль) и 1-(3-метоксифенил)пиперазина (354 мг, 1,84 ммоль) получали белое тврдое целевое соединение (588 мг, 1,27 ммоль, 69%). 1 Н-ЯМР (400 МГц,ДМСО, ) = 2.65 (brs, 2H), 3.12 (brs, 2H), 3.31 (brs, 2H), 3.79 (brs, 2H), 3.81 (s, 3H), 6.40 (brs, 1H), 6.50 (m,2H), 7.30 (brs, 2H), 7.36 (d, 2 Н), 7.44 (dd, 1H), 7.49 (d, 2H), 7.77 (dd, 1H). Пример 101. Синтез (5-амино-3-(4-(трифторметокси)фенил)изоксазол-4-ил)(4-(2-метоксифенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(4(трифторметокси)фенил)изоксазол-4-карбоновой кислоты (530 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль) и 1-(2-метоксифенил)пиперазина (354 мг, 1,84 ммоль) получали белое тврдое целевое соединение (603 мг, 1,30 ммоль, 71%). 1 Н-ЯМР (400 МГц,ДМСО, ) = 2.62 (brs, 2H), 2.95 (brs, 2H), 3.31 (brs, 2H), 3.75 (brs, 2H), 3.89 (s, 3H), 6.78 (brs, 1H), 6.86 (t,1H), 6.91 (t, 1H), 7.32 (brs, 2 Н), 7.36 (d, 2 Н), 7.45 (d, 2 Н), 7.69 (dd, 1H). Пример 102. Синтез (5-амино-3-(4-(трифторметокси)фенил)изоксазол-4-ил)(4-(3-(трифторметил)фенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(4(трифторметокси)фенил)изоксазол-4-карбоновой кислоты (530 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль) и 1-(3-(трифторметил)фенил)пиперазина(424 мг, 1,84 ммоль) получали белое тврдое целевое соединение (597 мг, 1,19 ммоль, 65%). 1 Н-ЯМР (400 МГц, ДМСО, ) = 2.63 (brs, 2H), 3.12 (brs, 2H), 3.33 (brs, 2H), 7.02 (m, 2H), 7.14 (d, 1H), 7.33 (brs, 2 Н), 7.38 Пример 103. Синтез (5-амино-3-(4-(трифторметокси)фенил)изоксазол-4-ил)(4-(4-гидроксифенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием диметилформимида (15 мл), 5 амино-3-(4-(трифторметокси)фенил)изоксазол-4-карбоновой кислоты (530 мг, 1,84 ммоль), 1-этил-3(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль), гидроксибензотриазола (299 мг,2,21 ммоль) и 4-(пиперазин-1-ил)фенола (328 мг, 1,84 ммоль) получали белое тврдое целевое соединение (566 мг, 1,26 ммоль, 69%). 1 Н-ЯМР (400 МГц, ДМСО, ) = 2.62 (brs, 2H), 3.29 (brs, 2H), 3.34 (brs, 2H),3.94 (brs, 2H), 6.71 (m, 4H), 7.33 (brs, 2H), 7.37. (d, 2H), 7.42 (d, 2H). Пример 104. Синтез (5-амино-3-(4-(трифторметокси)фенил)изоксазол-4-ил)(4-(2-гидроксифенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием диметилформимида (15 мл), 5 амино-3-(4-(трифторметокси)фенил)изоксазол-4-карбоновой кислоты (530 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль), гидроксибензотриазола (299 мг,2,21 ммоль) и 2-(пиперазин-1-ил)фенола (328 мг, 1,84 ммоль) получали белое тврдое целевое соединение (591 мг, 1,32 ммоль, 72%). 1 Н-ЯМР (400 МГц, ДМСО, ) = 2.63 (brs, 2H), 3.04 (brs, 2H), 3.33 (brs, 2H),4.03 (brs, 2H), 6.85 (m, 1H), 7.03 (m, 2 Н), 7.22 (m, 1 Н), 7.31 (brs, 2H), 7.38 (d, 2 Н), 7.46 (d, 2H). Пример 105. Синтез (5-амино-3-(4-(трифторметокси)фенил)изоксазол-4-ил)(4-(4-фторфенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(4(трифторметокси)фенил)изоксазол-4-карбоновой кислоты (530 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль) и 1-(4-фторфенил)пиперазина (332 мг, 1,84 ммоль) получали белое тврдое целевое соединение (621 мг, 1,38 ммоль, 75%). 1 Н-ЯМР (400 МГц,ДМСО, ) = 2.83 (brs, 4H), 3.47 (brs, 4 Н), 6.91 (m, 2 Н), 7.05 (m, 2 Н), 7.31 (brs, 2H), 7.36 (d, 2H), 7.46 (d,2H). Пример 106. Синтез (5-амино-3-(3-(трифторметил)фенил)изоксазол-4-ил)(4-(2-фторфенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(3 трифторметил)фенил)изоксазол-4-карбоновой кислоты (501 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль) и 1-(2-фторфенил)пиперазина (332 мг, 1,84 ммоль) получали белое тврдое целевое соединение (566 мг, 1,31 ммоль, 71%). 1 Н-ЯМР (400 МГц,ДМСО, ) = 2.73 (brs, 2H), 3.02 (brs, 2 Н), 3.31 (brs, 2H), 3.72 (brs, 2H), 6.14 (m, 3H), 6.87 (m, 1 Н), 7.29 (m,1 Н), 7.49 (brs, 2H), 7.63 (m, 1 Н), 7.71 (m, 2 Н). Пример 107. Синтез (5-амино-3-(3-(трифторметил)фенил)изоксазол-4-ил)(4-(3,4-дихлорфенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(3 трифторметил)фенил)изоксазол-4-карбоновой кислоты (501 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(3,4-дихлорфенил)пиперазина (425 мг, 1,84 ммоль) получали белое тврдое целевое соединение (633 мг, 1,30 ммоль, 71%). 1 Н-ЯМР (400 МГц, ДМСО, ) = 2.73(brs, 2H), 3.08 (brs, 2H), 3.35 (brs, 2H), 3.72 (brs, 2H), 6.62 (dd, 1 Н), 6.84 (d, 1 Н), 7.24 (m, 1 Н), 7.31 (m, 1 Н),7.44 (brs, 2 Н), 7.61 (m, 1 Н), 7.71 (m, 2 Н). Пример 108. Синтез (5-амино-3-(3-(трифторметил)фенил)изоксазол-4-ил)(4-(3-метоксифенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(3(трифторметил)фенил)изоксазол-4-карбоновой кислоты (501 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль) и 1-(3-метоксифенил)пиперазина (354 мг, 1,84 ммоль) получали белое тврдое целевое соединение (549 мг, 1,23 ммоль, 67%). 1 Н-ЯМР (400 МГц,ДМСО, ) = 2.63 (brs, 2H), 3.18 (brs, 2H), 3.30 (brs, 2H), 3.82 (brs, 2H), 3.85 (s, 3H), 6.39 (s, 1 Н), 6.48 (m,2 Н), 7.29 (m, 1 Н), 7.37 (m, 1 Н), 7.40 (brs, 2 Н), 7.60 (m, 1 Н), 7.69 (m, 2 Н). Пример 109. Синтез (5-амино-3-(3-(трифторметил)фенил)изоксазол-4-ил)(4-(2-метоксифенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(3(трифторметил)фенил)изоксазол-4-карбоновой кислоты (501 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль) и 1-(2-метоксифенил)пиперазина (354 мг, 1,84 ммоль) получали белое тврдое целевое соединение (473 мг, 1,06 ммоль, 58%). 1 Н-ЯМР (400 МГц,ДМСО, ) = 2.63 (brs, 2H), 3.12 (brs, 2H), 3.37 (brs, 2H), 3.79 (brs, 2H), 3.81 (s, 3H), 6.74 (brs, 1H), 6.82 (t,1H), 6.91 (t, 1H), 7.29 (m, 1 Н), 7.46 (m, 3 Н), 7.65 (m, 1 Н), 7.70 (m, 2 Н). Пример 110. Синтез (5-амино-3-(3-(трифторметил)фенил)изоксазол-4-ил)(4-(3-(трифторметил)фенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(3 трифторметил)фенил)изоксазол-4-карбоновой кислоты (501 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и 1-(3-(трифторметил)фенил)пиперазина (424 мг, 1,84 ммоль)- 26022336 получали белое тврдое целевое соединение (631 мг, 1,30 ммоль, 71%). 1 Н-ЯМР (400 МГц, ДМСО, ) = 2.69 (brs, 2H), 3.14 (brs, 4H), 3.35 (brs, 2H), 7.01 (m, 2H), 7.21 (d, 1H), 7.33 (m, 1H), 7.41 (m, 1H), 7.45 (brs,2H), 7.63 (m, 1H), 7.70 (m, 2H). Пример 111. Синтез (5-амино-3-(3-(трифторметил)фенил)изоксазол-4-ил)(4-(4-гидроксифенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием диметилформамида (15 мл), 5 амино-3-(3-(трифторметил)фенил)изоксазол-4-карбоновой кислоты (501 мг, 1,84 ммоль), 1-этил-3(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль), гидроксибензотриазола (299 мг,2,21 ммоль) и 4-(пиперазин-1-ил)фенола (328 мг, 1,84 ммоль) получали белое тврдое целевое соединение (460 мг, 106 ммоль, 58%). 1 Н-ЯМР (400 МГц, ДМСО, ) = 2.69 (brs, 4H), 3.82 (brs, 4 Н), 6.72 (m, 4 Н),7.32 (m, 1 Н), 7.46 (brs, 2H), 7.64 (m, 1 Н), 7.73 (m, 1 Н). Пример 112. Синтез (5-амино-3-(3-(трифторметил)фенил)изоксазол-4-ил)(4-(2-гидроксифенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием диметилформамида (15 мл), 5 амино-3-(3-(трифторметил)фенил)изоксазол-4-карбоновой кислоты (501 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль), гидроксибензотриазола (299 мг, 2,21 ммоль) и 2-(пиперазин-1-ил)фенола (328 мг, 1,84 ммоль) получали белое тврдое целевое соединение(brs, 2H), 6.85 (m, 1H), 7.12 (m, 2 Н), 7.17 (m, 1 Н), 7.29 (m, 1 Н), 7.46 (brs, 2 Н), 7.63 (m, 1 Н), 7.71 (m, 2 Н). Пример 113. Синтез (5-амино-3-(3-(трифторметил)фенил)изоксазол-4-ил)(4-(4-фторфенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(3 трифторметил)фенил)изоксазол-4-карбоновой кислоты (501 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль) и 1-(4-фторфенил)пиперазина (332 мг, 1,84 ммоль) получали белое тврдое целевое соединение (603 мг, 1,39 ммоль, 75%). 1 Н-ЯМР (400 МГц, CDCl3,) = 2.89 (brs, 4 Н), 3.46 (brs, 4H), 6.91 (m, 2 Н), 7.05 (m, 2H), 7.31 (m, 1H), 7.47 (brs, 2H), 7.60 (m, 1H), 7.76(m, 2H). Пример 114. Синтез (5-амино-3-(3-(трифторметокси)фенил)изоксазол-4-ил)(4-(2-фторфенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(3(трифторметокси)фенил)изоксазол-4-карбоновой кислоты (530 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль) и 1-(2-фторфенил)пиперазина (332 мг, 1,84 ммоль) получали белое тврдое целевое соединение (538 мг, 1,19 ммоль, 65%). 1 Н-ЯМР (400 МГц,ДМСО, ) = 2.74 (brs, 2H), 3.06 (brs, 2H), 3.41 (brs, 2H), 3.69 (brs, 2 Н), 6.12 (m, 3H), 6.78 (t, 1 Н), 7.33 (brs,2 Н), 7.36 (m, 2 Н), 7.53 (m, 1 Н), 7.69 (m, 1 Н). Пример 115. Синтез (5-амино-3-(3-(трифторметокси)фенил)изоксазол-4-ил)(4-(3,4-дихлорфенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(3(трифторметокси)фенил)изоксазол-4-карбоновой кислоты (530 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль) и 1-(3,4-дихлорфенил)пиперазина (425 мг, 1,84 ммоль) получали белое тврдое целевое соединение (652 мг, 1,31 ммоль, 71%). 1 Н-ЯМР (400 МГц,ДМСО, ) = 2.75 (brs, 2H), 3.09 (brs, 2H), 3.51 (brs, 2H), 3.78 (brs, 2H), 6.60 (dd, 1 Н), 6.89 (d, 1H), 7.36 (m,1H), 7.37 (brs, 2 Н),7.53 (m, 3 Н), 7.69 (m, 1 Н). Пример 116. Синтез (5-амино-3-(3-(трифторметокси)фенил)изоксазол-4-ил)(4-(3-метоксифенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(3(трифторметокси)фенил)изоксазол-4-карбоновой кислоты (530 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль) и 1-(3-метоксифенил)пиперазина (354 мг, 1,84 ммоль) получали белое тврдое целевое соединение (562 мг, 1,22 ммоль, 66%). 1 Н-ЯМР (400 МГц,ДМСО, ) = 2.63 (brs, 2H), 3.15 (brs, 2H), 3.29 (brs, 2H), 3.82 (brs, 2H), 3.82 (s, 3 Н), 6.43 (brs, 1 Н), 6.52 (m,2 Н), 7.31 (brs, 2H), 7.36 (m, 2 Н), 7.51 (m, 1 Н), 7.70 (m, 1H), 7.77 (dd, 1H). Пример 117. Синтез (5-амино-3-(3-(трифторметокси)фенил)изоксазол-4-ил)(4-(2-метоксифенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(3(трифторметокси)фенил)изоксазол-4-карбоновой кислоты (530 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль) и 1-(2-метоксифенил)пиперазина (354 мг, 1,84 ммоль) получали белое тврдое целевое соединение (622 мг, 1,35 ммоль, 73%). 1 Н-ЯМР (400 МГц,ДМСО, ) = 2.60 (brs, 2H), 2.99 (brs, 2H), 3.29 (brs, 2H), 3.74 (brs, 2H), 3.85 (s, 3H), 6.71 (brs, 1H), 6.85 (t,1H), 6.93 (t, 1H), 7.31 (brs, 2 Н), 7.36 (m, 2 Н), 7.53 (m, 1 Н), 7.65 (m, 1 Н), 7.69 (dd, 1 Н). Пример 118. Синтез (5-амино-3-(3-(трифторметокси)фенил)изоксазол-4-ил)(4-(3-(трифторметил)фенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(3(трифторметокси)фенил)изоксазол-4-карбоновой кислоты (530 мг, 1,8 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль) и 1-(3-(трифторметил)фенил)пиперазина (424 мг, 1,84 ммоль) получали белое тврдое целевое соединение (542 мг, 1,19 ммоль, 59%). 1 Н-ЯМР (400 МГц, ДМСО, ) = 2.60 (brs, 2H), 3.10 (brs, 2H), 3.35 (brs, 2H), 7.01 (m, 2H), 7.15 (d, 1H), 7.31 (brs, 2 Н), 7.36(m, 2 Н), 7.43 (m, 1 Н), 7.51 (m, 1 Н), 7.53 (m, 1 Н), 7.65 (m, 1 Н). Пример 119. Синтез (5-амино-3-(3-(трифторметокси)фенил)изоксазол-4-ил)(4-(4-гидроксифенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием диметилформимида (15 мл), 5 амино-3-(3-(трифторметокси)фенил)изоксазол-4-карбоновой кислоты (530 мг, 1,84 ммоль), 1-этил-3(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль), гидроксибензотриазола (299 мг,2,21 ммоль) и 4-(пиперазин-1-ил)фенола (328 мг, 1,84 ммоль) получали белое тврдое целевое соединение (601 мг, 1,34 ммоль, 72%). 1 Н-ЯМР (400 МГц, ДМСО, ) = 2.61 (brs, 2H), 3.31 (brs, 2H), 3.32 (brs, 2H),3.95 (brs, 2H), 6.69 (m, 4H), 7.31 (brs, 2 Н), 7.38 (m, 2 Н), 7.52 (m, 1 Н), 7.72 (m, 1 Н). Пример 120. Синтез (5-амино-3-(3-(трифторметокси)фенил)изоксазол-4-ил)(4-(2-гидроксифенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием диметилформимида (15 мл), 5 амино-3-(3-(трифторметокси)фенил)изоксазол-4-карбоновой кислоты (530 мг, 1,84 ммоль), 1-этил-3(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль), гидроксибензотриазола (299 мг,2,21 ммоль) и 2-(пиперазин-1-ил)фенола (328 мг, 1,84 ммоль) получали белое тврдое целевое соединение (588 мг, 1,31 ммоль, 71%). 1 Н-ЯМР (400 МГц, ДМСО, ) = 2.61 (brs, 2H), 3.06 (brs, 2H), 3.31 (brs, 2H),4.02 (brs, 2H), 6.84 (m, 1H), 7.01 (m, 2 Н), 7.23 (m, 1 Н), 7.31 (brs, 2H), 7.38 (m, 2 Н), 7.54 (m, 1 Н), 7.66 (m,1 Н). Пример 121. Синтез (5-амино-3-(3-(трифторметокси)фенил)изоксазол-4-ил)(4-(4-фторфенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(3(трифторметокси)фенил)изоксазол-4-карбоновой кислоты (530 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль) и 1-(4-фторфенил)пиперазина (332 мг, 1,84 ммоль) получали белое тврдое целевое соединение (609 мг, 1,35 ммоль, 73%). 1 Н-ЯМР (400 МГц,ДМСО, ) = 2.81 (brs, 4H), 3.45 (brs, 4 Н), 6.92 (m, 2 Н), 7.09 (m, 2 Н), 7.34 (brs, 2H), 7.39 (m, 2H), 7.51 (m,1H), 7.68 (m, 1H). Пример 122. Синтез этил-1-(5-амино-3-(2-хлорфенил)изоксазол-4-карбонил)пиперидин-4-карбоновой кислоты Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(2 хлорфенил)изоксазол-4-карбоновой кислоты (439 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и этилпиперазин-4-карбоксилата (289 мг, 1,84 ммоль) получали белое тврдое целевое соединение (422 мг, 1,12 ммоль, 60%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 1.14 (m, 5H), 1.66(m, 2 Н), 2.51 (m, 1 Н), 2.81 (q, 2H), 3.76 (d, 2H), 4.05 (q, 2H), 7.25 (s, 2H), 7.46 (m, 3 Н), 7.57 (m, 1H). Пример 123. Синтез метил-1-(5-амино-3-(2-фторфенил)изоксазол-4-карбонил)пиперидин-4-карбоновой кислоты Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(2 фторфенил)изоксазол-4-карбоновой кислоты (409 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимида (388 мг, 2,02 ммоль) и метилпиперазин-4-карбоксилата (263 мг, 1,84 ммоль) получали белое тврдое целевое соединение (463 мг, 1,33 ммоль, 72%). 1 Н-ЯМР (400 МГц, CDCl3, ) = 1.58 (m, 2H), 1.81(m, 2H), 2.03 (m, 2H), 2.29 (m, 1H), 7.76 (m, 2H), 3.71 (s, 3 Н), 7.26 (m, 1H), 7.45 (m, 1H), 7.64 (m, 2H). Пример 124. Синтез этил-1-(5-амино-(3-(2-трифторметокси)фенил)изоксазол-4-карбонил)пиперидин-4-карбоновой кислоты Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(2(трифторметокси)фенил)изоксазол-4-карбоновой кислоты (530 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль) и этилпиперазин-4-карбоксилата (289 мг, 1,84 ммоль) получали белое тврдое целевое соединение (429 мг, 1,00 ммоль, 55%). 1 Н-ЯМР (400 МГц, CDCl3,) = 1.16 (m, 5H), 1.65 (m, 2 Н), 2.54 (m, 1 Н), 2.83 (q, 2H), 3.74 (d, 2H), 4.06 (q, 2H), 7.41, (brs, 2H), 7.45 (m,3 Н), 7.59 (m, 1H). Пример 125. Синтез этил-1-(5-амино-(3-(2-трифторметил)фенил)изоксазол-4-карбонил)пиперидин 4-карбоновой кислоты Таким же образом, как описано в примере 1, с использованием дихлорметана (30 мл), 5-амино-3-(2(трифторметил)фенил)изоксазол-4-карбоновой кислоты (501 мг, 1,84 ммоль), 1-этил-3-(диметиламинопропил)карбодиимидгидрохлорида (388 мг, 2,02 ммоль) и этилпиперазин-4-карбоксилата (289 мг, 1,84 ммоль) получали белое тврдое целевое соединение (495 мг, 1,20 ммоль, 65%). 1 Н-ЯМР (400 МГц, CDCl3,- 28022336(4-(3,4-Дихлорфенил)пиперазин-1-ил)(5-метил-3-(2-(трифторметокси)фенил)изоксазол-4-ил)метанон (100 мг, 0,20 ммоль) растворяли в ацетоне (10 мл), охлаждали до 0 С и медленно добавляли к соляной кислоте в этаноле (10%, 73 мг, 0,20 ммоль). Полученный продукт перемешивали при комнатной температуре в течение 8 ч, затем фильтровали и сушили до получения белого тврдого целевого соединения(brs, 2H), 3.58 (brs, 2 Н), 6.88 (dd, 1H), 7.10 (d, 1H), 7.40 (d, 1H), 7.56 (m, 2 Н), 7.68 (m, 2 Н). Пример 127. Синтез солянокислого (3-(2-хлорфенил)-5-метилизоксазол-4-ил)(4-(3-метоксифенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 126, с использованием ацетона (10 мл), 3-(2-хлорфенил)5-метилизоксазол-4-ил)(4-(3-метоксифенил)пиперазин-1-ил)метанона (82 мг, 0,20 ммоль) и хлороводорода в этаноле (10%, 73 мг, 0,20 ммоль) получали белое тврдое целевое соединение (58 мг, 0,13 ммоль,65%). 1 Н-ЯМР (400 МГц, ДМСО, ) = 2.56 (s, 3H), 2.74 (brs, 2H), 3.06 (brs, 2H), 3.53 (brs, 2H), 3.72 (brs,2 Н), 3.74 (s, 3 Н), 6.66 (m, 1 Н), 7.12 (m, 2 Н), 7.52 (m, 4 Н), 7.66 (m, 1 Н). Пример 128. Синтез солянокислого этил-1-(5-метил-3-(2-(трифторметокси)фенил)изоксазол-4-карбомил)пиперазин-4-карбоновой кислоты Таким же образом, как описано в примере 126, с использованием ацетона (10 мл), этил-1-(5-метил 3-2-(трифторметоксифенил)изоксазол-4-карбомил)пиперазин-4-карбоновой кислоты (85 мг, 0,20 ммоль) и хлороводорода в этаноле (10%, 73 мг, 0,20 ммоль) получали белое тврдое целевое соединение (64 мг,0,14 ммоль, 69%). 1 Н-ЯМР (400 МГц, ДМСО, ) = 1.18 (m, 5H), 1.70 (m, 2 Н), 2.53 (m, 1 Н), 2.82 (q, 2H),3.70 (d, 2H), 4.18 (q, 2 Н), 7.42 (m, 3 Н), 7.63 (brs, 2 Н), 7.72 (m, 1 Н). Пример 129. Синтез солянокислого (4-(2-метоксифенил)пиперазин-1-ил)(5-метил-3-(2-(трифторметил)фенил)изоксазол-4-ил)метанона Таким же образом, как описано в примере 126, с использованием ацетона (10 мл), (4-(2 метоксифенил)пиперазин-1-ил)(5-метил-3-(2-(трифторметил)фенил)изоксазол-4-ил)метанона (90 мг, 0,20 ммоль) и соляной кислоты в этаноле (10%, 73 мг, 0,20 ммоль) получали белое тврдое целевое соединение (53 мг, 0,11 ммоль, 55%). 1 Н-ЯМР (400 МГц, ДМСО, ) = 2.36 (brs, 2H), 2.57 (s, 3H), 2.87 (brs, 2H),3.31 (brs, 2H), 3.74 (brs, 2H), 3.82 (s, 3 Н), 6.39 (m, 2 Н), 7.12 (m, 2 Н), 7.71 (m, 2 Н), 7.87 (m, 1 Н). Пример 130. Синтез солянокислого (3-(3-фторфенил)-5-метилизоксазол-4-ил)(4-(2-гидроксифенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 126, с использованием ацетона (10 мл), 3-(3-фторфенил)5-метилизоксазол-4-ил)(4-(2-гидроксифенил)пиперазин-1-ил)метанона (76 мг, 0,20 ммоль) и хлороводорода в этаноле (10%, 73 мг, 0,20 ммоль) получали белое тврдое целевое соединение (48 мг, 0,12 ммоль,57%). 1 Н-ЯМР (400 МГц, ДМСО, ) = 2.48 (brs, 2H), 2.53 (s, 3 Н), 2.86 (brs, 2H), 3.17 (brs, 2H), 3.84 (brs,2H), 7.24 (m, 3 Н), 7.42 (m, 3 Н), 7.56 (m, 2 Н). Пример 131. Синтез солянокислого (5-амино-3-(2-хлорфенил)изоксазол-4-ил)(4-(3-метоксифенил)пиперазин-1-ил)метанона Таким же образом, как описано в примере 126, с использованием ацетона (10 мл), (5-амино-3-(2 хлорфенил)изоксазол-4-ил)(4-(3-метоксифенил)пиперазин-1-ил)метанона (83 мг, 0,20 ммоль) и соляной кислоты в этаноле (10%, 73 мг, 0,20 ммоль) получали белое тврдое целевое соединение (63 мг, 0,14 ммоль, 70%). 1 Н-ЯМР (400 МГц, ДМСО, ) = 2.58 (brs, 4H), 3.29 (brs, 2H), 3.53 (brs, 2H), 3.66 (s, 3 Н), 6.49(m, 2H), 6.58 (m, 1 Н), 7.24 (m, 1 Н), 7.62 (s, 2 Н), 7.66 (m, 4 Н). Экспериментальный пример 1. Отборочная проверка с использованием вируса гриппа с экспрессирующимся GFP Клетку (MDCK) инфицировали вирусом гриппа (K09), экспрессирующим GFP (зеленый флуоресцентный белок) в течение 1 ч, и культивировали в среде с добавлением соединения при различных концентрациях. Через 24-72 ч с помощью флуоресцентного микроскопа наблюдали за сигналом GFP. Затем клетки, вообще не обработанные вирусом и соединением, и клетки, инфицированные только вирусом гриппа, использовали в качестве контрольных групп. Если соединение обладает противовирусным действием, можно обнаружить, что сигнал GFP уменьшается при увеличении концентрации соединения. Экспериментальный пример 2. Вирулицидный анализ путм анализа уменьшения количества и размера бляшек В этом эксперименте перед тем как клетку инфицировали вирусом, указанный вирус непосредственно обрабатывали соединением с тем, чтобы определить, обладает ли соединение эффектом по ингибированию проникновения вируса гриппа внутрь клетки. Для этого, во-первых, вирус гриппа выдерживали при различных концентрациях соединения при комнатной температуре в течение 1 ч. Затем клеткиMDCK инфицировали вирусом в течение 1 ч, промывали PBS и культивировали в среде, содержащей 2% агар Oxoid. Через 72 ч клетки окрашивали кристаллическим фиолетовым. Затем определяли, сформиро- 29
МПК / Метки
МПК: A61K 31/496, C07D 413/06, A61P 31/16
Метки: получения, способ, фенилизоксазола, производные
Код ссылки
<a href="https://eas.patents.su/30-22336-proizvodnye-fenilizoksazola-i-sposob-ego-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Производные фенилизоксазола и способ его получения</a>
Предыдущий патент: Секционный радиатор водяного отопления и опора для его установки
Следующий патент: Серно-цементные продукты
Случайный патент: Предохранительная крышка для бутылок