Способ лечения резистентности к инсулину средствами, стимулирующими секрецию гормона роста
Номер патента: 2089
Опубликовано: 24.12.2001
Авторы: Пэн Лидиа Кодетта, Тредуэй Джудит Ли, Лефкер Брюс Аллен, Завистоски Майкл Пол, Чью Чарлз Куок-Фанг, Карпайно Филип Алберт
Формула / Реферат
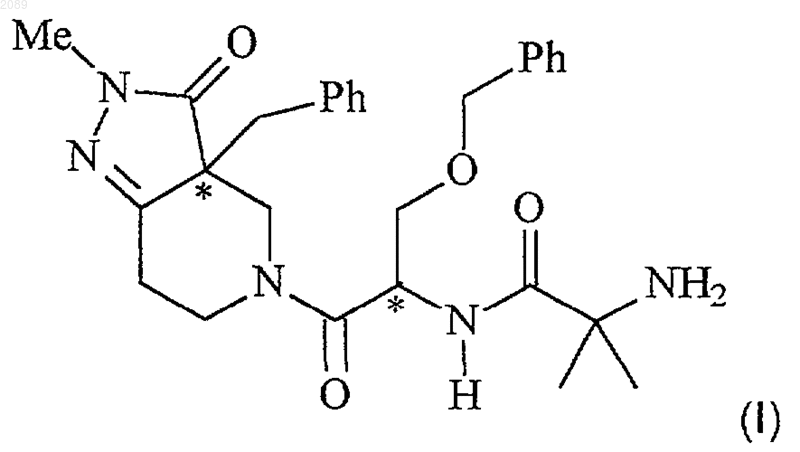
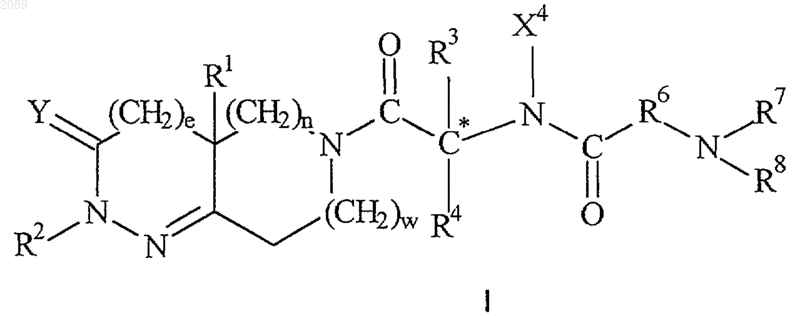
1. Способ лечения резистентности к инсулину у млекопитающего, при котором указанному млекопитающему вводят эффективное количество соединения формулы I

или его стереоизомерных смесей, диастереомерно обогащенных, диастереомерно чистых, энантиомерно обогащенных или энантиомерно чистых изомеров, или фармацевтически приемлемых солей и пролекарств,
где е равно 0 или 1;
n и w каждое независимо равно 0, 1 или 2, при условии, что w и n одновременно не могут быть равны 0;
Y представляет собой кислород или серу;
R1 представляет собой водород, -CN, -(CH2)qN(X6)C(O)X6, -(СH2)qN(X6)C(O)(CH2)t-А1, -(CH2)qN(X6)SO2(CH2)t-A1, -(CH2)qN(X6)SO2X6, -(CH2)qN(X6)C(O)N(X6)(CH2)t-A1, -(CH2)qN(X6)C(O)N(X6)(X6), -(CH2)qC(O)N(X6)(X6), -(CH2)qC(O)N(X6)(CH2)t-A1, -(CH2)qC(O)OX6, -(CH2)qC(O)O(CH2)t-A1, -(CH2)qOX6, -(CH2)qOC(O)X6, -(CH2)qOC(O)(CH2)t-A1, -(CH2)qOC(O)N(X6)(CH2)t-A1, -(СH2)qOC(O)N(X6)(Х6), -(CH2)qC(O)X6, -(CH2)qC(O)(CH2)t-A1, -(CH2)qN(X6)C(O)OX6, -(CH2)qN(X6)SO2N(X6)(X6), -(CH2)qS(O)mX6, -(CH2)qS(O)m(CH2)t-A1, -(С1-С10)алкил, -(CH2)tA1, -(CH2)q-(C3-C7)циклоалкил, -(СH2)q-Y1-(C1-С6)алкил, -(CH2)q-Y1-(CH2)t-A1 или -(CH2)q-Y1-(CH2)t-(C3-C7)циклoaлкил;
где алкильные и циклоалкильные группы в определении R1 возможно замещены (С1-C4)алкилом, гидроксилом, (С1-С4)алкоксигруппой, карбоксилом, группой -CONH2, группой -S(O)m(С1-С6)алкил, сложноэфирной группой -СO2(С1-С4)алкил, 1Н-тетразол-5-илом или 1, 2 или 3 атомами фтора;
Y1 представляет собой О, S(О)m, -C(О)NX6-, -CH=CH-, -Cу C-, -N(X6)C(О)-, -C(О)NX6-, -C(O)O-, -OC(O)N(X6)- или -ОС(O)-;
q равно 0, 1, 2, 3 или 4;
t равно 0, 1, 2 или 3;
указанные группы (CH2)q и (CH2)t каждая возможно может быть замещена гидроксилом, (С1-С4)алкоксигруппой, карбоксилом, группой -СОNН2, группой -S(O)m(С1-С6)алкил, сложноэфирной группой -СО2(С1-С4)алкил, 1Н-тетразол-5-илом, 1, 2 или 3 атомами фтора или 1 или 2 (С1-С4)алкилами;
R2 представляет собой водород, (С1-С8)алкил, -(С0-С3)алкил-(С3-С8)циклоалкил, -(С1-С4)алкил-А1 или А1;
где алкильные группы и циклоалкильные группы в определении R2 возможно замещены гидроксилом, группой -С(O)ОХ6, группой -С(O)N(X6)(Х6), группой -N(Х6)(Х6), группой -S(O)m(С1-С6)алкил, группой -С(O)А1, группой -С(O)(Х6), СF3, CN или 1, 2 или 3 галогенами;
R3 представляет собой А1, (С1-С10)алкил, -(С1-С6)алкил-А1, -(С1-С6)алкил-(С3-С7)циклоалкил, -(С1-С5)aлкил-X1-(C1-C5)aлкил, -(C1-C5)aлкил-X1-(C0-C5)aлкил-A1 или -(C1-C5)aлкил-X1-(C1-C5)aлкил-(C3-C7)циклoaлкил;
где алкильные группы в определении R3 возможно замещены группой -S(O)m(С1-С6)алкил, группой -С(O)ОХ3, 1, 2, 3, 4 или 5 галогенами или 1, 2 или 3 группами OX3;
X1 представляет собой О, S(O)m, -N(X2)C(О)-, -C(O)N(X2)-, -ОС(O)-, -С(O)O-, -СХ2=СХ2-, -N(X2)C(O)O-, OC(O)N(X2)- или -Су С-;
R4 представляет собой водород, (С1-С6)алкил или (С3-С7)циклоалкил, или R4 вместе с R3 и атомом углерода, к которому они присоединены, образуют (С5-С7)циклоалкильное, (С5-С7)циклоалкенильное, частично насыщенное или полностью насыщенное 4-8-членное кольцо, имеющее от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из кислорода, серы и азота, или бициклическую кольцевую систему, состоящую из частично насыщенного или полностью насыщенного 5- или 6-членного кольца, конденсированного с частично насыщенным, полностью ненасыщенным или полностью насыщенным 5- или 6-членным кольцом, возможно имеющим от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из азота, серы и кислорода;
X4 представляет собой водород или (С1-С6)алкил или X4 вместе с R4 и атомом азота, к которому присоединен X4, и атомом углерода, к которому присоединен R4, образуют 5-7-членное кольцо;
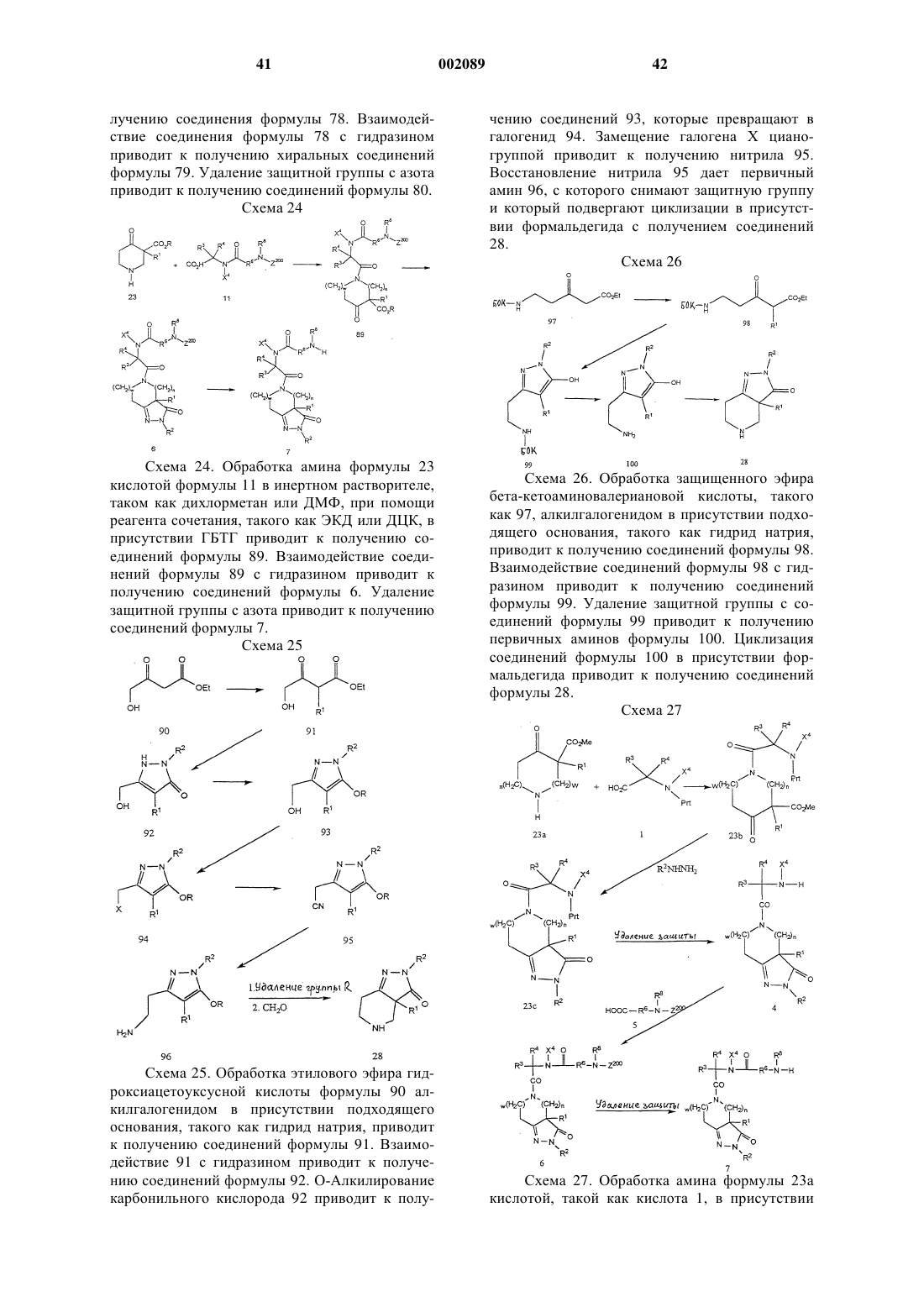
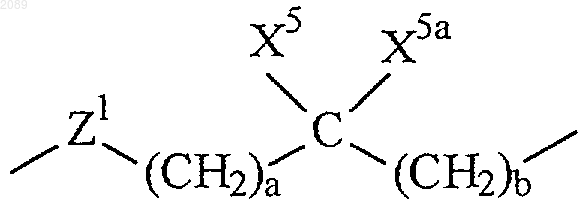
R6 представляет собой связь или
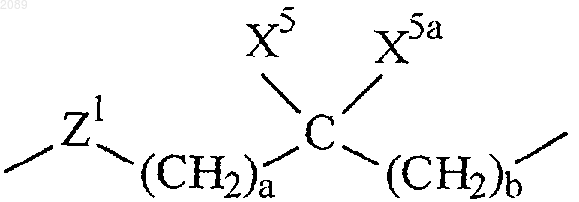
где а и b независимо равны 0, 1, 2 или 3;
X5 и X5a каждый независимо выбран из группы, состоящей из водорода, трифторметила, А1 и возможно замещенного (С1-С6)алкила;
причем возможно замещенный (С1-С6)алкил в определении X5 и X5a возможно замещен заместителем, выбранным из группы, состоящей из А1, группы ОХ2, группы -S(O)m(С1-С6)алкил, группы -С(O)ОХ2, (С3-С7)циклоалкила, группы -N(Х2)(Х2) и группы -С(O)N(Х2)(Х2);
или атом углерода, несущий X5 или X5a, образует один или два алкиленовых мостика с атомом азота, несущим R7 и R8, где каждый алкиленовый мостик содержит от 1 до 5 атомов углерода, при условии, что когда образуется один алкиленовый мостик, тогда X5 или X5a, но не оба, могут находиться у атомa углерода, а R7 или R8, но не оба, могут находиться у атома азота, и далее при условии, что когда образуются два алкиленовых мостика, тогда X5 и X5а не могут находиться у атома углерода, а R7 и R8 не могут находиться у атома азота;
или X5 вместе с X5а и атомом углерода, к которому они присоединены, образуют частично насыщенное или полностью насыщенэюх 3-7-членное кольцо, или частично насыщенное или полностью насыщенное 4-8-членное кольцо, имеющее от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из кислорода, серы и азота;
или X5 вместе с X5а и атомом углерода, к которому они присоединены, образуют бициклическую кольцевую систему, состоящую из частично насыщенного или полностью насыщенного 5- или 6-членного кольца, возможно имеющего 1 или 2 гетероатома, независимо выбранных из группы, состоящей из азота, серы и кислорода, конденсированного с частично насыщенным, полностью насыщенным или полностью ненасыщенным 5- или 6-членным кольцом, возможно имеющим от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из азота, серы и кислорода;
Z1 представляет собой связь, О или N-X2, при условии, что если а и b оба равны 0, то Z1 не представляет собой N-X2 или О;
R7 и R8 независимо представляют собой водород или возможно замещенный (C1-С6)алкил;
где возможно замещенный алкил в R7 и R8 возможно независимо замещен А1, группой -С(O)O-(С1-С6)алкил, группой -S(O)m(C1-С6)алкил, от 1 до 5 галогенами, от 1 до 3 гидроксигруппами, от 1 до 3 группами -O-С(O)(С1-С10)алкил или от 1 до 3 (С1-С6)алкоксигруппами; или R7 и R8 вместе могут образовывать -(CH2)r-L-(CH2)r-;
где L представляет собой С(X2)(Х2), S(O)m или N(Х2);
А1 для каждого случая независимо представляет собой (C5-С7)циклоалкенил, фенил или частично насыщенное, полностью насыщенное или полностью ненасыщенное 4-8-членное кольцо, возможно имеющее от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из кислорода, серы и азота, бициклическую кольцевую систему, состоящую из частично насыщенного, полностью ненасыщенного или полностью насыщенного 5- или 6-членного кольца, возможно имеющего от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из азота, серы и кислорода, конденсированного с частично насыщенным, полностью насыщенным или полностью ненасыщенным 5- или 6-членным кольцом, возможно имеющим от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из азота, серы и кислорода;
А1 для каждого случая независимо возможно замещен в одном или возможно в обоих кольцах, если А1 представляет собой бициклическую кольцевую систему, заместителями в количестве от одного до трех, причем каждый заместитель независимо выбран из группы, состоящей из F, Cl, Вr, I, ОСF3, OCF2H, СF3, СН3, ОСН3, -OX6, -C(O)N(X6)(X6), -С(O)ОХ6, оксо, (С1-С6)алкила, нитро, циано, бензила, группы -S(O)m(C1-С6)алкил, 1Н-тетразол-5-ила, фенила, феноксигруппы, фенилалкоксигруппы, галогенофенила, метилендиоксигруппы, -N(X6)(X6), -N(X6)C(O)(X6), -SO2N(X6)(X6), -N(X6)SO2-фенила, -N(X6)SO2X6, -CONX11X12, -SO2NX11X12, -NX6SO2X12, -NX6CONX11X12, -NX6SO2NX11X12, -NX6C(O)X12, имидазолила, тиазолила и тетразолила, при условии, что если А1 возможно замещен метилендиоксигруппой, то он может быть замещен только одной метилендиоксигруппой;
где X11 представляет собой водород или возможно замещенный (C1-С6)алкил, причем возможно замещенный (С1-С6)алкил в определении X11 возможно независимо замещен фенилом, феноксигруппой, (С1-С6)алкоксикарбонилом, группой -S(O)m(C1-С6)алкил, от 1 до 5 галогенами, от 1 до 3 гидроксигруппами, от 1 до 3 (С1-С10)алканоилоксигруппами или от 1 до 3 (C1-С6)алкоксигруппами;
X12 представляет собой водород, (С1-С6)алкил, фенил, тиазолил, имидазолил, фурил или тиенил, при условии, что если X12 не является водородом, то X12 возможно замещен заместителями в количестве от одного до трех, независимо выбранными из группы, состоящей из Cl, F, СН3, ОСН3, ОСF3 и CF3;
или X11 и X12 вместе образуют -(CH2)r-L1-(CH2)r-,
где L1 представляет собой С(Х2)(Х2), О, S(O)m или N(X2);
r для каждого случая независимо равно 1, 2 или 3;
X2 для каждого случая независимо представляет собой водород, возможно замещенный (С1-С6)алкил или возможно замещенный (С3-С7)циклоалкил, где возможно замещенный (С1-С6)алкил и возможно замещенный (С3-С7)циклоалкил в определении X2 возможно независимо замещены группой -S(O)m(С1-С6)алкил, группой -С(O)ОХ3, от 1 до 5 галогенами или от 1 до 3 группами ОХ3;
X3 для каждого случая независимо представляет собой водород или (C1-С6)алкил;
X6 независимо представляет собой водород, возможно замещенный (С1-С6)алкил, (С2-С6)галогенированный алкил, возможно замещенный (С3-С7)циклоалкил, (С3-С7)галогенированный циклоалкил, где возможно замещенный (С1-С6)алкил и возможно замещенный (С3-С7)циклоалкил в X6 возможно независимо замещены 1 или 2 (С1-С4)алкилами, гидроксилами, (С1-С4)алкоксигруппами, карбоксилами, группами CONH2, группами -S(O)m(С1-С6)алкил, сложноэфирными группами -СO2(С1-С4)алкил или 1Н-тетразол-5-илами; или
если имеются две группы Х6 у одного атома и обе группы Х6 независимо представляют собой (С1-С6)алкил, то две (С1-С6)алкильные группы возможно могут быть соединены и вместе с атомом углерода, к которому они присоединены, образуют 4-9-членное кольцо, возможно имеющее кислород, серу или NX7;
X7 представляет собой водород или (С1-С6)алкил, возможно замещенный гидроксилом; и
m для каждого случая независимо равно 0, 1 или 2;
при условии, что
X6 и X12 не могут представлять собой водород, когда X6 или X12 присоединен к С(O) или SO2 в виде С(O)Х6, С(O)Х12, SO2X6 или SO2X12; и
когда R6 представляет собой связь, тогда L представляет собой N(X2), a каждый r в -(CH2)r-L-(CH2)r- независимо равен 2 или 3.
2. Способ по п.1, где указанное соединение формулы I представляет собой соединение следующей формулы
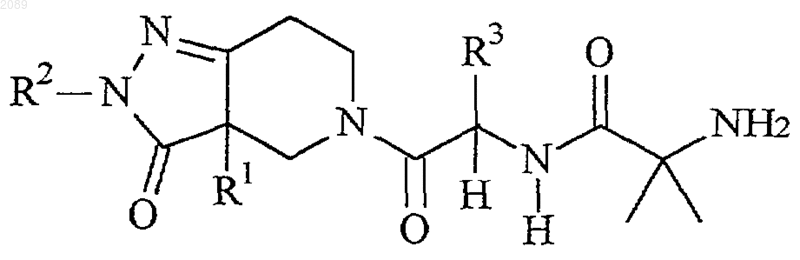
или его стереоизомерные смеси, диастереомерно обогащенные, диастереомерно чистые, энантиомерно обогащенные или энантиомерно чистые изомеры, или фармацевтически приемлемые соли и пролекарства, где
R1 представляет собой -СН2-фенил, R2 представляет собой метил и R3 представляет собой -(СН2)3-фенил;
R1 представляет собой -СН2-фенил, R2 представляет сосющ метил и R3 представляет собой 3-индолил-СН2-;
R1 представляет собой -СН2-фенил, R2 представляет собой этил и R3 представляет собой -3-индолил-СН2-;
R1 представляет собой -СН2-4-фторфенил, R2 представляет собой метил и R3 представляет собой 3-индолил-СН2-;
R1 представляет собой -СН2-фенил, R2 представляет собой метил и R3 представляет собой -СН2-О-СН2-фенил;
R1 представляет собой -СН2-фенил, R2 представляет собой этил и R3 представляет собой -СН2-О-СН2-фенил;
R1 представляет собой -СН2-фенил, R2 представляет собой -СН2СF3 и R3 представляет собой -СН2-O-СН2-фенил;
R1 представляет собой -СН2-4-фторфенил, R2 представляет собой метил и R3 представляет собой -СН2-О-СН2-фенил;
R1 представляет собой -СН2-фенил, R2 представляет собой трет-бутил и R3 представляет собой -СН2-О-СН2-фенил; или
R1 представляет собой -СН2-фенил, R2 представляет собой метил и R3 представляет собой -СН2-O-СН2-3,4-дифторфенил.
3. Способ по п.1, где указанное соединение формулы I представляет собой соединение формулы
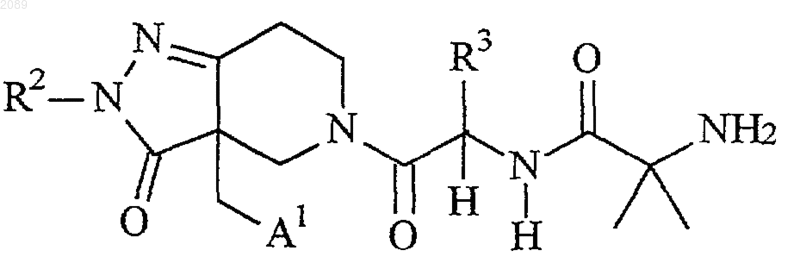
или его стереоизомерные смеси, диастереомерно обогащенные, диастереомерно чистые, энантиомерно обогащенные или энантиомерно чистые изомеры, или его фармацевтически приемлемые соли и пролекарства, где
R2 представляет собой метил, А1 представляет собой 2-пиридил и R3 представляет собой -СН2-O-СН2-фенил;
R2 представляет собой СН2СF3, А1 представляет собой 2-пиридил и R3 представляет собой -СН2-O-СН2-3-хлорфенил;
R2 представляет собой СН2СF3, А1 представляет собой 2-пиридил и R3 представляет собой -СН2-O-СН2-4-хлорфенил;
R2 представляет собой CH2CF3, А1 представляет собой 2-пиридил и R3 представляет собой -СН2-O-СН2-2,4-дихлорфенил;
R2 представляет собой СН2СF3, А1 представляет собой 2-пиридил и R3 представляет собой -СН2-О-СН2-3-хлортиофен или
R2 представляет собой CH2CF3, А1 представляет собой 2-пиридил и R3 представляет собой -СН2-O-СН2-2,4-дифторфенил.
4. Способ по п.1, где указанное соединение формулы I или его стереоизомерные смеси, диастереомерно обогащенные, диастереомерно чистые, энантиомерно обогащенные или энантиомерно чистые изомеры, или фармацевтически приемлемые соли и пролекарства представляют собой 3a(R,S),1(R) диастереомерную смесь, 3a(R),1(R) диастереомер или 3a(S),1(R) диастереомер соединения, выбранного из группы, состоящей из
2-амино-N-[1-(3а-бензил-2-метил-3-оксо-2,3,3а,4,6,7-гексагидропиразоло[4,3-с]пиридин-5-карбонил)-4-фенилбутил]-изобутирамида,
2-амино-N-[2-(3а-бензил-2-метил-3-оксо-2,3,3а,4,6,7-гексагидропиразоло[4,3-с]пиридин-5-ил)-1-(1Н-индол-3-илметил)-2-оксоэтил]-изобутирамида,
2-амино-N-[2-(3а-бензил-2-этил-3-оксо-2,3,3а,4,6,7-гексагидропиразоло[4,3-с]пиридин-5-ил)-1-(1Н-индол-3-илметил)-2-оксоэтил]-изобутирамида,
2-амино-N-[2-[3а-(4-фторбензил)-2-метил-3-оксо-2,3,3а,4,6,7-гексагидропиразоло[4,3-с]пиридин-5-ил)-1-(1Н-индол-3-илметил)-2-оксоэтил]-изобутирамида,
2-амино-N-[2-(3а-бензил-2-метил-3-оксо-2,3,3а,4,6,7-гексагидропиразоло[4,3-с]пиридин-5-ил)-1-бензилоксиметил-2-оксоэтил]-изобутирамида,
2-амино-N-[2-(3а-бензил-2-этил-3-оксо-2,3,3а,4,6,7-гексагидропиразоло[4,3-с]пиридин-5-ил)-1-бензилоксиметил-2-оксоэтил]-изобутирамида,
2-амино-N-{2-[3а-бензил-3-оксо-2-(2,2,2-трифторэтил)-2,3,3а,4,6,7-гексагидропиразоло[4,3-с]пиридин-5-ил]-1-бензилоксиметил-2-оксоэтил}-изобутирамида,
2-амино-N-{1-бензилоксиметил-2-[3а-(4-фторбензил)-2-метил-3-оксо-2,3,3а,4,6,7-гексагидропиразоло[4,3-с]пиридин-5-ил]-2-оксоэтил}-изобутирамида,
2-амино-N-[2-(3а-бензил-2-трет-бутил-3-оксо-2,3,3а,4,6,7-гексагидропиразоло[4,3-с]пиридин-5-ил)-1-бензилоксиметил-2-оксоэтил]-изобутирамида и
2-амино-N-[2-(3а-бензил-3-оксо-2,3,3а,4,6,7-гексагидропиразоло[4,3-с]пиридин-5-ил)-1-бензилоксиметил-2-оксоэтил]-изобутирамида.
5. Способ по п.4, где указанное соединение представляет собой соль L-винной кислоты 2-амино-N-[2-(3а-(R)-бензил-2-метил-3-оксо-2,3,3а,4,6,7-гексагидропиразоло[4,3-с]пиридин-5-ил)-1-(R)-бензилоксиметил-2-оксоэтил]-изобутирамида.
6. Способ по п.1, где указанное соединение формулы I или его стереоизомерные смеси, диастереомерно обогащенные, диастереомерно чистые, энантиомерно обогащенные или энантиомерно чистые изомеры, или фармацевтически приемлемые соли и пролекарства представляют собой 3а-(R,S),1-(R) диастереомерную смесь, 3a-(R),1-(R) энантиомер или 3a-(S),1-(R) энантиомер соединения, выбранного из группы, состоящей из
2-амино-N-[1-бензилоксиметил-2-(2-метил-3-оксо-3а-пиридин-2-илметил-2,3,3а,4,6,7-гексагидропиразоло[4,3-с]пиридин-5-ил)-2-оксоэтил]-2-метилпропионамида;
2-амино-N-{1-(3-хлорбензилоксиметил)-2-оксо-2-[3-оксо-3а-пиридин-2-илметил-2-(2,2,2-трифторэтил)-2,3,3а,4,6,7-гексагидропиразоло[4,3-с]пиридин-5-ил]-этил}-2-метилпропионамида;
2-амино-N-{1-(4-хлорбензилоксиметил)-2-оксо-2-[3-оксо-3а-пиридин-2-илметил-2-(2,2,2-трифторэтил)-2,3,3а,4,6,7-гексагидропиразоло[4,3-с]пиридин-5-ил]-этил}-2-метилпропионамида;
2-амино-N-{1-(2,4-дихлорбензилоксиметил)-2-оксо-2-[3-оксо-3а-пиридин-2-илметил-2-(2,2,2-трифторэтил)-2,3,3а,4,6,7-гексагидропиразоло[4,3-с]пиридин-5-ил]-этил}-2-метилпропионамида;
2-амино-N-{1-(4-хлортиофен-2-илметоксиметил)-2-оксо-2-[3-оксо-3а-пиридин-2-илметил-2-(2,2,2-трифторэтил)-2,3,3а,4,6,7-гексагидропиразоло[3,4-с]пиридин-6-ил]-этил}-2-метилпропионамида; и
2-амино-N-{1-(2,4-дифторбензилоксиметил)-2-оксо-2-[3-оксо-3а-пиридин-2-илметил-2-(2,2,2-трифторэтил)-2,3,3а,4,6,7-гексагидропиразоло[4,3-с]пиридин-5-ил]-этил}-2-метилпропионамида.
7. Способ лечения резистентности к инсулину у млекопитающего по п.1, при котором млекопитающему, нуждающемуся в этом, дополнительно вводят рилизинг-гормон гормона роста или его функциональный аналог.
8. Фармацевтическая композиция, пригодная для лечения резистентности к инсулину у млекопитающего, которая включает в себя фармацевтически приемлемый носитель и эффективное количество соединения формулы I

или его стереоизомерных смесей, диастереомерно обогащенных, диастереомерно чистых, энантиомерно обогащенных или энантиомерно чистых изомеров, или фармацевтически приемлемых солей и пролекарств,
где е равно 0 или 1;
n и w каждое независимо равно 0, 1 или 2, при условии, что w и n одновременно не могут быть равны 0;
Y представляет собой кислород или серу;
R1 представляет собой водород, -CN, -(СН2)qN(X6)C(O)Х6, -(СH2)qN(X6)C(O)(CH2)t-А1, -(CH2)qN(X6)SO2(CH2)t-A1, -(CH2)qN(X6)SO2X6, -(CH2)qN(X6)C(O)N(X6)(CH2)t-A1, -(CH2)qN(X6)C(O)N(X6)(X6), -(CH2)qC(O)N(X6)(X6), -(CH2)qC(O)N(X6)(CH2)t-A1, -(CH2)qC(O)OX6, -(CH2)qC(O)O(CH2)t-A1, -(CH2)qOX6, -(СН2)qОС(О)Х6, -(CH2)qOC(O)(CH2)t-A1, -(CH2)qOC(O)N(X6)(CH2)t-A1, -(CH2)qOC(O)N(X6)(X6), -(CH2)qC(O)X6, -(CH2)qC(O)(CH2)t-A1, -(CH2)qN(X6)C(O)OX6, -(CH2)qN(X6)SO2N(X6)(X6), -(CH2)qS(O)mX6, -(CH2)qS(O)m(CH2)t-A1, -(С1-С10)алкил, -(CH2)t-A1, -(CH2)q-(C3-C7)циклоалкил, -(CH2)q-Y1-(С1-С6)aлкил, -(CH2)q-Y1-(CH2)t-A1 или -(CH2)q-Y1-(CH2)t-(С3-С7)циклoaлкил;
где алкильные и циклоалкильные группы в определении R1 возможно замещены (С1-С4)алкилом, гидроксилом, (С1-С4)алкоксигруппой, карбоксилом, группой -CONH2, группой -S(O)m(С1-С6)алкил, сложноэфирной группой -СO2(С1-С4)алкил, 1Н-тетразол-5-илом или 1, 2 или 3 атомаvb фтора;
Y1 представляет собой О, S(O)m, -C(O)NX6-, -CH=CH-, -Cу C-, -N(X6)C(O)-, -C(O)NX6-, -C(O)O-, -OC(O)N(X6)- или -ОС(O)-;
q равно 0, 1, 2, 3 или 4;
t равно 0, 1, 2 или 3;
указанные группы (CH2)q и (СН2)t каждая возможно может быть замещена гидроксилом, (С1-С4)алкоксигруппой, карбоксилом, группой -СОNН2, группой -S(O)m(С1-С6)алкил, сложноэфирной группой -СO2(С1-С4)алкил, 1Н-тетразол-5-илом, 1, 2 или 3 атомами фтора или 1 или 2 (С1-С4)алкилами;
R2 представляет собой водород, (С1-С8)алкил, -(С0-С3)алкил-(С3-С8)циклоалкил, -(С1-С4)алкил-А1 или А1;
где алкильные группы и циклоалкильные группы в определении R2 возможно замещены гидроксилом, группой -С(O)ОХ6, группой -C(O)N(X6)(X6), группой -N(Х6)(Х6), группой -S(O)m(С1-С6)алкил, группой -С(O)А1, группой -С(O)(Х6), CF3, CN или 1, 2 или 3 галогенами;
R3 представляет собой А1, (С1-С10)алкил, -(С1-С6)алкил-А1, -(С1-С6)алкил-(С3-С7)циклоалкил, -(C1-C5)aлкил-X1-(C1-C5)aлкил, -(C1-C5)aлкил-X1-(C0-C5)aлкил-A1 или -(С1-С5)aлкил-X1-(C1-C5)aлкил-(C3-C7)циклoaлкил;
где алкильные группы в R3 возможно замещены группой -S(O)m(С1-С6)алкил, группой -С(O)ОХ3, 1, 2, 3, 4 или 5 галогенами или 1, 2 или 3 группами OX3;
X1 представляет собой О, S(O)m, -N(X2)C(О)-, -C(O)N(X2)-, -ОС(O)-, -С(O)O-, -СХ2=СХ2-, -N(X2)C(O)O-, OC(O)N(X2)- или -Су С-;
R4 представляет собой водород, (С1-С6)алкил или (С3-С7)циклоалкил, или R4 вместе с R3 и атомом углерода, к которому они присоединены, образуют (C5-С7)циклоалкильное, (С5-С7)циклоалкенильное, частично насыщенное или полностью насыщенное 4-8-членное кольцо, имеющее от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из кислорода, серы и азота, или бициклическую кольцевую систему, состоящую из частично насыщенного или полностью насыщенного 5- или 6-членного кольца, конденсированного с частично насыщенным, полностью ненасыщенным или полностью насыщенным 5- или 6-членным кольцом, возможно имеющим от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из азота, серы и кислорода;
X4 представляет собой водород или (С1-С6)алкил, или X4 вместе с R4 и атомом азота, к которому присоединен X4, и атомом углерода, к которому присоединен R4, образуют 5-7-членное кольцо;
R6 представляет собой связь или
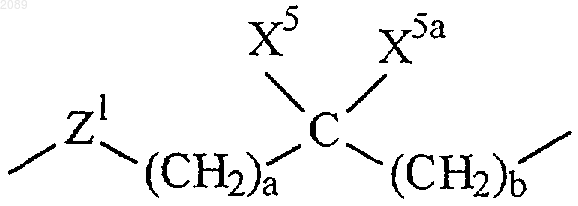
где а и b независимо равны 0, 1, 2 или 3;
X5 и X5a каждый независимо выбран из группы, состоящей из водорода, трифторметила, А1 и возможно замещенного (С1-С6)алкила;
причем возможно замещенный (С1-С6)алкил в X5 и X5a возможно замещен заместителем, выбранным из группы, состоящей из А1, группы ОХ2, группы -S(O)m(С1-С6)алкил, группы -С(O)ОХ2, (С3-С7)циклоалкила, группы -N(Х2)(Х2) и группы -C(O)N(X2)(Х2);
или атом углерода, несущий X5 или X5a, образует один или два алкиленовых мостика с атомом азота, несущим R7 и R8, где каждый алкиленовый мостик содержит от 1 до 5 атомов углерода, при условии, что когда образуется один алкиленовый мостик, тогда X5 или X5a, но не оба, могут находиться у атома углерода, а R7 или R8, но не оба, могут находиться у атома азота, и далее при условии, что когда образуются два алкиленовых мостика, тогда X5 и X5а не могут находиться у атома углерода, а R7 и R8 не могут находиться у атома азота;
или X5 вместе с X5а и атомом углерода, к которому они присоединены, образуют частично насыщенное или полностью насыщенное 3-7-членное кольцо, или частично насыщенное или полностью насыщенное 4-8-членное кольцо, имеющее от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из кислорода, серы и азота;
или X5 вместе с X5а и атомом углерода, к которому они присоединены, образуют бициклическую кольцевую систему, состоящую из частично насыщенного или полностью насыщенного 5- или 6-членного кольца, возможно имеющего 1 или 2 гетероатома, независимо выбранных из группы, состоящей из азота, серы и кислорода, конденсированного с частично насыщенным, полностью насыщенным или полностью ненасыщенным 5- или 6-членным кольцом, возможно имеющим от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из азота, серы и кислорода;
Z1 представляет собой связь, О или N-X2, при условии, что если а и b оба равны 0, то Z1 не представляет собой N-X2 или О;
R7 и R8 независимо представляют собой водород или возможно замещенный (C1-С6)алкил;
где возможно замещенный алкил в определении R7 и R8 возможно независимо замещен А1, группой -С(О)О-(С1-С6)алкил, групяющ -S(О)m(C1-С6)алкил, от 1 до 5 галогенами, от 1 до 3 гидроксигруппами, от 1 до 3 группами -O-С(O)(С1-С10)алкил или от 1 до 3 (С1-С6)алкоксигруппами; или R7 и R8 вместе могут образовывать -(CH2)r-L-(CH2)r-;
где L представляет собой C(Х2)(Х2), S(O)m или N(Х2);
А1 для каждого случая независимо представляет собой (C5-С7)циклоалкенил, фенил или частично насыщенное, полностью насыщенное или полностью ненасыщенное 4-8-членное кольцо, возможно имеющее от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из кислорода, серы и азота, бициклическую кольцевую систему, состоящую из частично насыщенного, полностью ненасыщенного или полностью насыщенного 5- или 6-членного кольца, возможно имеющего от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из азота, серы и кислорода, конденсированного с частично насыщенным, полностью насыщенным или полностью ненасыщенным 5- или 6-членным кольцом, возможно имеющим от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из азота, серы и кислорода;
А1 для каждого случая независимо возможно замещен в одном или возможно в обоих кольцах, если А1 представляет собой бициклическую кольцевую систему, заместителями в количестве от одного до трех, причем каждый заместитель независимо выбран из группы, состоящей из F, Cl, Вr, I, ОСF3, OCF2H, СF3, СН3, ОСН3, -ОХ6, -C(O)N(X6)(X6), -С(O)ОХ6, оксо, (С1-С6)алкила, нитро, циано, бензила, группы -S(O)m(C1-С6)алкил, 1Н-тетразол-5-ила, фенила, феноксигруппы, фенилалкоксигруппы, галогенофенила, метилендиоксигруппы, -N(X6)(X6), -N(X6)C(O)(X6), -SO2N(X6)(X6), -N(X6)SO2-фeнилa, -N(X6)SO2X6, -CONX11X12, -SO2NX11X12, -NX6SO2X12, -NX6CONX11X12, -NX6SO2NX11X12, -NX6C(O)X12, имидазолила, тиазолила и тетразолила, при условии, что если А1 возможно замещен метилендиоксигруппой, то он может быть замещен только одной метилендиоксигруппой;
где X11 представляет собой водород или возможно замещенный (C1-С6)алкил, причем возможно замещенный (С1-С6)алкил в определении X11 возможно независимо замещен фенилом, феноксигруппой, (С1-С6)алкоксикарбонилом, группой -S(O)m(C1-С6)алкил, от 1 до 5 галогенами, от 1 до 3 гидроксигруппами, от 1 до 3 (С1-С10)алканоилоксигруппами или от 1 до 3 (C1-С6)алкоксигруппами;
X12 представляет собой водород, (С1-С6)алкил, фенил, тиазолил, имидазолил, фурил или тиенил при условии, что если X12 не является водородом, то X12 возможно замещен заместителями в количестве от одного до трех, независимо выбранными из группы, состоящей из Cl, F, СН3, ОСН3, ОСF3 и CF3;
или X11 и X12 вместе образуют -(CH2)r-L1-(CH2)r-,
где L1 представляет собой C(Х2)(Х2), О, S(O)m или N(Х2);
r для каждого случая независимо равно 1, 2 или 3;
X2 для каждого случая независимо представляет собой водород, возможно замещенный (С1-С6)алкил или возможно замещенный (С3-С7)циклоалкил, где возможно замещенный (С1-С6)алкил и возможно замещенный (С3-С7)циклоалкил в определении X2 возможно независимо замещены группой -S(O)m(С1-С6)алкил, группой -С(O)ОХ3, от 1 до 5 галогенами или от 1 до 3 группами ОХ3;
X3 для каждого случая независимо представляет собой водород или (C1-С6)алкил;
X6 независимо представляет собой водород, возможно замещенный (С1-С6)алкил, (С2-С6)галогенированный алкил, возможно замещенный (С3-С7)циклоалкил, (С3-С7)галогенированный циклоалкил, где возможно замещенный (С1-С6)алкил и возможно замещенный (С3-С7)циклоалкил в определении X6 возможно независимо замещены 1 или 2 (С1-С4)алкилами, гидроксилами, (С1-С4)алкоксигруппами, карбоксилами, группами CONH2, группами -S(O)m(С1-С6)алкил, сложноэфирными группами -СO2(С1-С4)алкил или 1Н-тетразол-5-илами; или
если имеется две группы Х6 у одного атома и обе группы Х6 независимо представляют собой (С1-С6)алкил, то две (С1-С6)алкильные группы возможно могут быть соединены и вместе с атомом углерода, к которому они присоединены, образуют 4-9-членное кольцо, возможно имеющее кислород, серу или NX7;
X7 представляет собой водород или (С1-С6)алкил, возможно замещенный гидроксилом; и
m для каждого случая независимо равно 0, 1 или 2;
при условии,что
X6 и X12 не могут представлять собой водород, когда X6 или X12 присоединен к С(О) или SО2 в виде С(O)Х6, С(O)Х12, SО2Х6 или SО2Х12; и
когда R6 представляет собой связь, тогда L представляет собой N(X2), a каждый r в -(CH2)r-L-(CH2)r- независимо равен 2 или 3.
9. Способ увеличения уровней эндогенного гормона роста, при котором человеку или другому животному, нуждающемуся в этом, вводят эффективные количества функционального антагониста соматостатина и соединения формулы
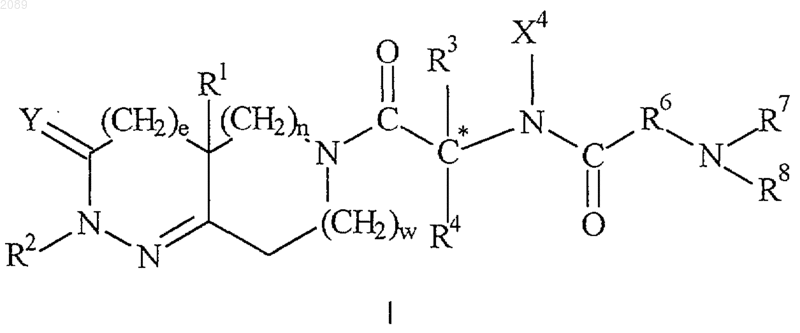
или его стереоизомерных смесей, диастереомерно обогащенных, диастереомерно чистых, энантиомерно обогащенных или энантиомерно чистых изомеров, или фармацевтически приемлемых солей и пролекарств,
где е равно 0 или 1;
n и w каждое независимо равно 0, 1 или 2 при условии, что w и n одновременно не могут быть равны 0;
Y представляет собой кислород или серу;
R1 представляет собой водород, -CN, -(СH2)qN(X6)C(O)Х6, -(CH2)qN(X6)C(O)(CH2)t-А1, -(CH2)qN(X6)SO2(CH2)t-A1, -(CH2)qN(X6)SO2X6, -(CH2)qN(X6)C(O)N(X6)(CH2)t-A1, -(СH2)qN(X6)C(O)N(X6)(Х6), -(СН2)qC(O)N(X6)(Х6), -(CH2)qC(O)N(X6)(CH2)t-A1, -(CH2)qC(O)OX6 -(CH2)qC(O)O(CH2)t-A1, -(CH2)qOX6, -(CH2)qOC(O)X6, -(CH2)qOC(O)(CH2)t-A1, -(CH2)qOC(O)N(X6)(CH2)t-A1, -(CH2)qOC(O)N(X6)(X6), -(CH2)qC(O)X6, -(CH2)qC(O)(CH2)t-A1, -(СH2)qN(Х6)C(O)ОХ6, -(CH2)qN(X6)SO2N(X6)(X6), -(CH2)qS(O)mX6, -(CH2)qS(O)m(CH2)t-A1, -(С1-С10)алкил, -(СН2)t-А1, -(СН2)q-(С3-С7)циклоалкил, -(CH2)q-Y1-(С1-С6)aлкил, -(CH2)q-Y1-(CH2)t-A1 или -(СH2)q-Y1-(CH2)t-(C3-C7)циклоалкил;
где алкильные и циклоалкильные группы в определении R1 возможно замещены (С1-С4)алкилом, гидроксилом, (С1-С4)алкоксигруппой, карбоксилом, группой -CONH2, группой -S(O)m(С1-С6)алкил, сложноэфирной группой -СO2(С1-С4)алкил, 1Н-тетразол-5-илом или 1, 2 или 3 атомами фтора;
Y1 представляет собой О, S(О)m, -C(О)NX6-, -CH=CH-, -Cу C-, -N(X6)C(О)-, -C(О)NX6-, -C(О)О-, -OC(О)N(X6)- или -ОС(О)-;
q равно 0, 1, 2, 3 или 4;
t равно 0, 1, 2 или 3;
указанные группы (CH2)q и (CH2)t каждая возможно может быть замещена гидроксилом, (С1-С4)алкоксигруппой, карбоксилом, группой -CONH2, группой -S(O)m(С1-С6)алкил, сложноэфирной группой -СO2(С1-С4)алкил, 1Н-тетразол-5-илом, 1, 2 или 3 атомами фтора или 1 или 2 (С1-С4)алкилами;
R2 представляет собой водород, (С1-С8)алкил, -(С0-С3)алкил-(С3-С8)циклоалкил, -(С1-С4)алкил-А1 или А1;
где алкильные группы и циклоалкильные группы в определении R2 возможно замещены гидроксилом, группой -С(О)ОХ6, группой -C(О)N(X6)(X6), группой -N(X6)(X6), группой -S(O)m(С1-С6)алкил, группой -С(O)А1, группой -С(O)(Х6), СF3, CN или 1, 2 или 3 галогенами;
R3 представляет собой А1, (С1-С10)алкил, -(С1-С6)алкил-А1, -(С1-С6)алкил-(С3-С7)циклоалкил, -(C1-C5)aлкил-X1-(C1-C5)aлкил, -(C1-C5)aлкил-X1-(C0-C5)aлкил-A1 или -(C1-C5)aлкил-X1-(C1-C5)aлкил-(C3-C7)циклoaлкил;
где алкильные группы в определении R3 возможно замещены группой -S(O)m(С1-С6)алкил, группой -С(O)ОХ3, 1, 2, 3, 4 или 5 галогенами или 1, 2 или 3 группами OX3;
X1 представляет собой О, S(O)m, -N(X2)C(O)-, -C(O)N(X2)-, -OC(O)-, -С(O)O-, -СХ2=СХ2-, -N(X2)C(O)O-, OC(O)N(X2)- или -Су С-;
R4 представляет собой водород, (С1-С6)алкил или (С3-С7)циклоалкил, или R4 вместе с R3 и атомом углерода, к которому они присоединены, образуют (C5-С7)циклоалкильное, (С5-С7)циклоалкенильное, частично насыщенное или полностью насыщенное 4-8-членное кольцо, имеющее от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из кислорода, серы и азота, или бициклическую кольцевую систему, состоящую из частично насыщенного или полностью насыщенного 5- или 6-членного кольца, конденсированного с частично насыщенным, полностью ненасыщенным или полностью насыщенным 5- или 6-членным кольцом, возможно имеющим от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из азота, серы и кислорода;
X4 представляет собой водород или (С1-С6)алкил, или X4 вместе с R4 и атомом азота, к которому присоединен X4, и атомом углерода, к которому присоединен R4, образуют 5-7-членное кольцо;
R6 представляет собой связь или
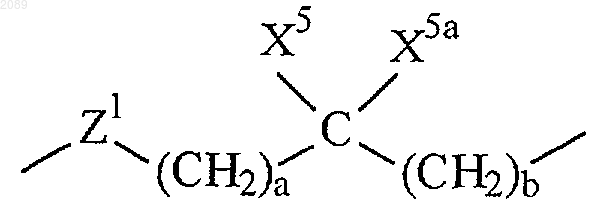
где а и b независимо равны 0, 1, 2 или 3;
X5 и X5a каждый независимо выбран из группы, состоящей из водорода, трифторметила, А1 и возможно замещенного (С1-С6)алкила;
причем возможно замещенный (С1-С6)алкил в определении X5 и X5a возможно замещен заместителем, выбранным из группы, состоящей из А1, группы ОХ2, группы -S(O)m(С1-С6)алкил, группы -С(O)ОХ2, (С3-С7)циклоалкила, группы -N(X2)(Х2) и группы -С(O)N(X2)(Х2);
или атом углерода, несущий X5 или X5a, образует один или два алкиленовых мостика с атомом азота, несущим R7 и R8, где каждый алкиленовый мостик содержит от 1 до 5 атомов углерода, при условии, что когда образуется один алкиленовый мостик, тогда X5 или X5a, но не оба, могут находиться у атома углерода, а R7 или R8, но не оба, могут находиться у атома азота, и далее при условии, что когда образуются два алкиленовых мостика, тогда X5 и X5а не могут находиться у атома углерода, а R7 и R8 не могут находиться у атома азота;
или X5 вместе с X5а и атомом углерода, к которому они присоединены, образуют частично насыщенное или полностью насыщенное 3-7-членное кольцо, или частично насыщенное или полностью насыщенное 4-8-членное кольцо, имеющее от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из кислорода, серы и азота;
или X5 вместе с X5а и атомом углерода, к которому они присоединены, образуют бициклическую кольцевую систему, состоящую из частично насыщенного или полностью насыщенного 5- или 6-членного кольца, возможно имеющего 1 или 2 гетероатома, независимо выбранных из группы, состоящей из азота, серы и кислорода, конденсированного с частично насыщенным, полностью насыщенным или полностью ненасыщенным 5- или 6-членным кольцом, возможно имеющим от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из азота, серы и кислорода;
Z1 представляет собой связь, О или N-X2, при условии, что если а и b оба равны 0, то Z1 не представляет собой N-X2 или О;
R7 и R8 независимо представляют собой водород или возможно замещенный (С1-С6)алкил;
где возможно замещенный алкил в определении R7 и R8 возможно независимо замещен А1, группой -С(O)O-(С1-С6)алкил, группой -S(O)m(C1-С6)алкил, от 1 до 5 галогенами, от 1 до 3 гидроксигруппами, от 1 до 3 группами -O-С(O)(С1-С10)алкил или от 1 до 3 (С1-С6)алкоксигруппами; или
R7 и R8 вместе могут образовывать -(CH2)r-L-(CH2)r-;
где L представляет собой С(X2)(Х2), S(O)m или N(Х2);
А1 для каждого случая независимо представляет сосющ (C5-С7)циклоалкенил, фенил или частично насыщенное, полностью насыщенное или полностью ненасыщенное 4-8-членное кольцо, возможно имеющее от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из кислорода, серы и азота, бициклическую кольцевую систему, состоящую из частично насыщенного, полностью ненасыщенного или полностью насыщенного 5- или 6-членного кольца, возможно имеющего от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из азота, серы и кислорода, конденсированного с частично насыщенным, полностью насыщенным или полностью ненасыщенным 5- или 6-членным кольцом, возможно имеющим от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из азота, серы и кислорода;
А1 для каждого случая независимо возможно замещен в одном или возможно в обоих кольцах, если А1 представляет собой бициклическую кольцевую систему, заместителями в количестве от одного до трех, причем каждый заместитель независимо выбран из группы, состоящей из F, Cl, Вr, I, OCF3, OCF2H, CF3, СН3, ОСН3, -ОХ6, -С(O)N(Х6)(Х6), -С(O)ОХ6, оксо, (С1-С6)алкила, нитро, циано, бензила, группы -S(O)m(C1-С6)алкил, 1Н-тетразол-5-ила, фенила, феноксигруппы, фенилалкоксигруппы, галогенофенила, метилендиоксигруппы, -N(Х6)(Х6), -N(Х6)С(O)(Х6), -SO2N(X6)(X6), -N(X6)SO2-фeнилa, -N(X6)SO2X6, -CONX11X12, -SO2NX11X12, -NX6SO2X12, -NX6CONX11X12, -NX6SO2NX11X12, -NХ6С(O)Х12, имидазолила, тиазолила и тетразолила, при условии, что если А1 возможно замещен метилендиоксигруппой, то он может быть замещен только одной метилендиоксигруппой;
где X11 представляет собой водород или возможно замещенный (C1-С6)алкил, причем возможно замещенный (С1-С6)алкил в X11 возможно независимо замещен фенилом, феноксигруппой, (С1-С6)алкоксикарбонилом, группой -S(O)m(C1-С6)алкил, от 1 до 5 галогенами, от 1 до 3 гидроксигруппами, от 1 до 3 (С1-С10)алканоилоксигруппами или от 1 до 3 (C1-С6)алкоксигруппами;
X12 представляет собой водород, (С1-С6)алкил, фенил, тиазолил, имидазолил, фурил или тиенил при условии, что если X12 не является водородом, то X12 возможно замещен заместителями в количестве от одного до трех, независимо выбранными из группы, состоящей из Cl, F, СН3, ОСН3, ОСF3 и СF3;
или X11 и X12 вместе образуют -(CH2)r-L1-(CH2)r-,
где L1 представляет собой C(Х2)(Х2), О, S(O)m или N(Х2);
r для каждого случая независимо равно 1, 2 или 3;
X2 для каждого случая независимо представляет собой водород, возможно замещенный (С1-С6)алкил или возможно замещенный (С3-С7)циклоалкил, где возможно замещенный (С1-С6)алкил и возможно замещенный (С3-С7)циклоалкил в X2 возможно независимо замещены группой -S(O)m(С1-С6)алкил, группой -С(O)ОХ3, от 1 до 5 галогенами или от 1 до 3 группами ОХ3;
X3 для каждого случая независимо представляет собой водород или (С1-С6)алкил;
X6 независимо представляет собой водород, возможно замещенный (С1-С6)алкил, (С2-С6)галогенированный алкил, возможно замещенный (С3-С7)циклоалкил, (С3-С7)галогенированный циклоалкил, где возможно замещенный (С1-С6)алкил и возможно замещенный (С3-С7)циклоалкил в определении X6 возможно независимо замещены 1 или 2 (С1-С4)алкилами, гидроксилами, (С1-С4)алкоксигруппами, карбоксилами, группами CONH2, группами -S(O)m(С1-С6)алкил, сложноэфирными группами -СO2(С1-С4)алкил или 1Н-тетразол-5-илами; или
если имеется две группы Х6 у одного атома и обе группы Х6 независимо представляют собой (С1-С6)алкил, то две (С1-С6)алкильные группы возможно могут быть соединены и вместе с атомом углерода, к которому они присоединены, образуют 4-9-членное кольцо, возможно имеющее кислород, серу или NX7;
X7 представляет собой водород или (С1-С6)алкил, возможно замещенный гидроксилом; и
m для каждого случая независимо равно 0, 1 или 2;
при условии,что
X6 и X12 не могут представлять собой водород, когда X6 или X12 присоединен к С(О) или SО2 в виде С(О)Х6, С(О)Х12, SO2X6 или SО2X12; и
когда R6 представляет собой связь, тогда L представляет собой N(X2), a каждый r в определении -(CH2)r-L-(CH2)r- независимо равен 2 или 3.
10. Способ лечения или предупреждения застойной сердечной недостаточности, ожирения или слабости, связанной со старением, при котором млекопитающему, нуждающемуся в этом, вводят эффективные количества функционального антагониста соматостатина и соединения формулы I
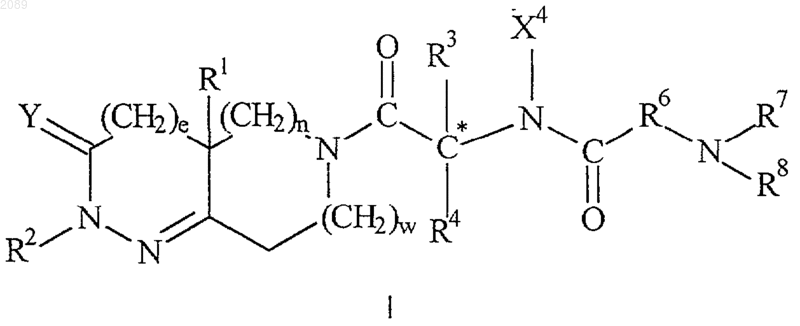
или его стереоизомерных смесей, диастереомерно обогащенных, диастереомерно чистых, энантиомерно обогащенных или энантиомерно чистых изомеров, или фармацевтически приемлемых солей и пролекарств,
где е равно 0 или 1;
n и w каждое независимо равно 0, 1 или 2, при условии, что w и n одновременно не могут быть равны 0;
Y представляет собой кислород или серу;
R1 представляет собой водород, -CN, -(CH2)qN(X6)C(O)X6, -(CH2)qN(X6)C(O)(CH2)t-А1, -(CH2)qN(X6)SO2(CH2)t-A1, -(CH2)qN(X6)SO2X6, -(CH2)qN(X6)C(O)N(X6)(CH2)t-A1, -(CH2)qN(X6)C(O)N(X6)(X6), -(CH2)qC(O)N(X6)(X6), -(CH2)qC(O)N(X6)(CH2)t-A1, -(CH2)qC(O)OX6, -(CH2)qC(O)O(CH2)t-A1, -(CH2)qOX6, -(СH2)qОС(О)Х6, -(CH2)qOC(O)(CH2)t-A1, -(СH2)qОС(O)N(Х6)(СH2)t-А1, -(СH2)qОС(O)N(Х6)(Х6), -(CH2)qC(O)X6, -(CH2)qC(O)(CH2)t-A1, -(CH2)qN(X6)C(O)OX6, -(CH2)qN(X6)SO2N(X6)(X6), -(CH2)qS(O)mX6, -(CH2)qS(O)m(CH2)t-A1, -(С1-С10)алкшы, -(CH2)t-A1, -(CH2)q-(C3-C7)циклоалкил, -(CH2)q-Y1-(C1-C6)aлкил, -(CH2)q-Y1-(CH2)t-A1 или -(CH2)q-Y1-(CH2)t-(C3-C7)циклоалкил;
где алкильные и циклоалкильные группы в определении R1 возможно замещены (С1-С4)алкилом, гидроксилом, (С1-С4)алкоксигруппой, карбоксилом, группой -СОNН2, группой -S(O)m(С1-С6)алкил, сложноэфирной группой -СO2(С1-С4)алкил, 1Н-тетразол-5-илом или 1, 2 или 3 фторо;
Y1 представляет собой О, S(O)m, -C(O)NX6-, -CH=CH-, -Cу C-, -N(X6)C(O)-, -C(O)NX6-, -C(O)O-, -OC(O)N(X6)- или -ОС(O)-;
q равно 0, 1, 2, 3 или 4;
t равно 0, 1, 2 или 3;
указанные группы (СН2)q и (CH2)t каждая возможно может быть замещена гидроксилом, (С1-С4)алкоксигруппой, карбоксилом, группой -CONH2, группой -S(O)m(С1-С6)алкил, сложноэфирной группой -СO2(С1-С4)алкил, 1Н-тетразол-5-илом, 1, 2 или 3 атомами фтора или 1 или 2 (С1-С4)алкилами;
R2 представляет собой водород, (С1-С8)алкил, -(С0-С3)алкил-(С3-С8)циклоалкил, -(С1-С4)алкил-А1 или А1;
где алкильные группы и циклоалкильные группы в определении R2 возможно замещены гидроксилом, группой -С(O)ОХ6, группой -С(O)N(Х6)(Х6), группой -N(Х6)(Х6), группой -S(O)m(С1-С6)алкил, группой -С(O)А1, группой -С(O)(Х6), СF3, CN или 1, 2 или 3 галогенами;
R3 представляет собой А1, (С1-С10)алкил, -(С1-С6)алкил-А1, -(С1-С6)алкил-(С3-С7)циклоалкил, -(С1-С5)aлкил-X1-(C1-C5)aлкил, -(C1-C5)aлкил-X1-(C0-C5)aлкил-A1 или -(C1-C5)aлкил-X1-(C1-C5)aлкил-(C3-C7)циклoaлкил;
где алкильные группы в определении R3 возможно замещены группой -S(O)m(С1-С6)алкил, группой -С(O)ОХ3, 1, 2, 3, 4 или 5 галогенами или 1, 2 или 3 группами OX3;
X1 представляет собой О, S(O)m, -N(X2)C(O)-, -C(O)N(X2)-, -OC(O)-, -С(O)O-, -СХ2=СХ2-, -N(X2)C(O)O-, OC(O)N(X2)- или -Су С-;
R4 представляет собой водород, (С1-С6)алкил или (С3-С7)циклоалкил, или R4 вместе с R3 и атомом углерода, к которому они присоединены, образуют (C5-С7)циклоалкильное, (С5-С7)циклоалкенильное, частично насыщенное или полностью насыщенное 4-8-членное кольцо, имеющее от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из кислорода, серы и азота, или бициклическую кольцевую систему, состоящую из частично насыщенного или полностью насыщенного 5- или 6-членного кольца, конденсированного с частично насыщенным, полностью ненасыщенным или полностью насыщенным 5- или 6-членным кольцом, возможно имеющим от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из азота, серы и кислорода;
X4 представляет собой водород или (С1-С6)алкил, или X4 вместе с R4 и атомом азота, к которому присоединен X4, и атомом углерода, к которому присоединен R4, образуют 5-7-членное кольцо;
R6 представляет собой связь или
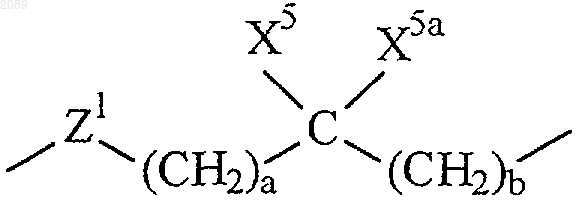
где а и b независимо равны 0,1,2 или 3;
X5 и X5a каждый независимо выбран из группы, состоящей из водорода, трифторметила, А1 и возможно замещенного (С1-С6)алкила;
причем возможно замещенный (С1-С6)алкил в определении X5 и X5a возможно замещен заместителем, выбранным из группы, состоящей из А1, группы ОХ2, группы -S(O)m(С1-С6)алкил, группы -С(O)ОХ2, (С3-С7)циклоалкила, группы -N(Х2)(Х2) и группы -C(O)N(Х2)(Х2);
или атом углерода, несущий X5 или X5a, образует один или два алкиленовых мостика с атомом азота, несущим R7 и R8, где каждый алкиленовый мостик содержит от 1 до 5 атомов углерода, при условии, что когда образуется один алкиленовый мостик, тогда X5 или X5a, но не оба, могут находиться на атоме углерода, а R7 или R8, но не оба, могут находиться на атоме азота, и далее при условии, что когда образуются два алкиленовых мостика, тогда X5 и X5a не могут находиться у атомa углерода, а R7 и R8 не могут находиться у атомa азота;
или X5 вместе с X5a и атомом углерода, к которому они присоединены, образуют частично насыщенное или полностью насыщенное 3-7-членное кольцо, или частично насыщенное или полностью насыщенное 4-8-членное кольцо, имеющее от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из кислорода, серы и азота;
или X5 вместе с X5a и атомом углерода, к которому они присоединены, образуют бициклическую кольцевую систему, состоящую из частично насыщенного или полностью насыщенного 5- или 6-членного кольца, возможно имеющего 1 или 2 гетероатома, независимо выбранных из группы, состоящей из азота, серы и кислорода, конденсированного с частично насыщенным, полностью насыщенным или полностью ненасыщенным 5- или 6-членным кольцом, возможно имеющим от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из азота, серы и кислорода;
Z1 представляет собой связь, О или N-X2 при условии, что если а и b оба равны 0, то Z1 не представляет собой N-X2 или О;
R7 и R8 независимо представляют собой водород или возможно замещенный (C1-С6)алкил;
где возможно замещенный алкил в определении R7 и R8 возможно независимо замещен А1, группой -С(O)O-(С1-С6)алкил, группой -S(O)m(C1-С6)алкил, от 1 до 5 галогенами, от 1 до 3 гидроксигруппами, от 1 до 3 группами -O-С(O)(С1-С10)алкил или от 1 до 3 (С1-С6)алкоксигруппами; или R7 и R8 вместе могут образовывать -(CH2)r-L-(CH2)r-;
где L представляет собой C(Х2)(Х2), S(O)m или N(Х2);
А1 для каждого случая независимо представляет собой (C5-С7)циклоалкенил, фенил или частично насыщенное, полностью насыщенное или полностью ненасыщенное 4-8-членное кольцо, возможно имеющее от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из кислорода, серы и азота, бициклическую кольцевую систему, состоящую из частично насыщенного, полностью ненасыщенного или полностью насыщенного 5- или 6-членного кольца, возможно имеющего от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из азота, серы и кислорофр, конденсированного с частично насыщенным, полностью насыщенным или полностью ненасыщенным 5- или 6-членным кольцом, возможно имеющим от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из азота, серы и кислорода;
А1 для каждого случая независимо возможно замещен в одном или возможно в обоих кольцах, если А1 представляет собой бициклическую кольцевую систему, заместителями в количестве от одного до трех, причем каждый заместитель независимо выбран из группы, состоящей из F, Cl, Br, I, OCF3, OCF2H, СF3, СН3, ОСН3, -OX6, -С(O)N(Х6)(Х6), -С(O)ОХ6, оксо, (С1-С6)алкила, нитро, циано, бензила, группы -S(O)m(C1-С6)алкил, 1Н-тетразол-5-ила, фенила, феноксигруппы, фенилалкоксигруппы, галогенофенила, метилендиоксигруппы, -N(X6)(X6), -N(X6)C(O)(X6), -SO2N(X6)(X6), -N(X6)SO2-фенила, -N(Х6)SО2Х6, -CONX11X12, -SO2NX11X12, -NX6SO2X12, -NX6CONX11X12, -NX6SO2NX11X12, -NX6C(O)X12, имидазолила, тиазолила и тетразолила, при условии, что если А1 возможно замещен метилендиоксигруппой, то он может быть замещен только одной метилендиоксигруппой;
где X11 представляет собой водород или возможно замещенный (C1-С6)алкил, причем возможно замещенный (С1-С6)алкил в определении X11 возможно независимо замещен фенилом, феноксигруппой, (С1-С6)алкоксикарбонилом, группой -S(O)m(C1-С6)алкил, от 1 до 5 галогенами, от 1 до 3 гидроксигруппами, от 1 до 3 (С1-С10)алканоилоксигруппами или от 1 до 3 (C1-С6)алкоксигруппами;
X12 представляет собой водород, (С1-С6)алкил, фенил, тиазолил, имидазолил, фурил или тиенил, при условии, что если X12 не является водородом, то X12 возможно замещен заместителями в количестве от одного до трех, независимо выбранными из группы, состоящей из Cl, F, СН3, ОСН3, ОСF3 и СF3;
или X11 и X12 вместе образуют -(CH2)r-L1-(CH2)r-,
где L1 представляет собой C(X2)(X2), О, S(O)m или N(X2);
r для каждого случая независимо равно 1, 2 или 3;
X2 для каждого случая независимо представляет собой водород, возможно замещенный (С1-С6)алкил или возможно замещенный (С3-С7)циклоалкил, где возможно замещенный (С1-С6)алкил и возможно замещенный (С3-С7)циклоалкил в определении X2 возможно независимо замещены группой -S(O)m(С1-С6)алкил, группой -С(O)ОХ3, от 1 до 5 галогенами или от 1 до 3 группами ОХ3;
X3 для каждого случая независимо представляет собой водород или (C1-С6)алкил;
X6 независимо представляет собой водород, возможно замещенный (C1-С6)алкил, (С2-С6)галогенированный алкил, возможно замещенный (С3-С7)циклоалкил, (С3-С7)галогенированный циклоалкил, где возможно замещенный (С1-С6)алкил и возможно замещенный (С3-С7)циклоалкил в определении X6 возможно независимо замещены 1 или 2 (С1-С4)алкилами, гидроксилами, (С1-С4)алкоксигруппами, карбоксилами, группами CONH2, группами -S(O)m(С1-С6)алкил, сложноэфирными группами -СО2(С1-С4)алкил или 1Н-тетразол-5-илами; или
если имеется две группы Х6 у одного атома, и обе группы Х6 независимо представляют собой (С1-С6)алкил, то две (С1-С6)алкильные группы возможно могут быть соединены и вместе с атомом углерода, к которому они присоединены, образуют 4-9-членное кольцо, возможно имеющее кислород, серу или NX7;
X7 представляет собой водород или (С1-С6)алкил, возможно замещенный гидроксилом; и
m для каждого случая независимо равно 0, 1 или 2;
при условии,что
X6 и X12 не могут представлять собой водород, когда X6 или X12 присоединен к С(O) или SO2 в виде С(O)Х6, С(O)Х12, SO2X6 или SO2X12; и
когда R6 представляет собой связь, тогда L представляет собой N(X2), a каждый r в -(CH2)r-L-(CH2)r- независимо равен 2 или 3.
11. Способ по п.10, где указанным функциональным антагонистом соматостатина является альфа-2-адренергический агонист.
12. Способ по п.11, где указанный альфа-2-адренергический агонист выбран из группы, состоящей из клонидина, ксилазина и медетомидина.
13. Способ по п.12, где указанным соединением формулы I является соль L-винной кислоты 2-амино-N-[2-(3а-(R)-бензил-2-метил-3-оксо-2,3,3а,4,6,7-гексагидропиразоло-[4,3-с]пиридин-5-ил)-1-(R)-бензилоксиметил-2-оксоэтил]-изобутирамида.
14. Фармацевтическая композиция, которая включает в себя фармацевтически приемлемый носитель, некоторое количество альфа-2-адренергического агониста и некоторое количество соединения формулы I

или стереоизомерных смесей, диастереомерно обогащенных, диастереомерно чистых, энантиомерно обогащенных или энантиомерно чистых изомеров, или фармацевтически приемлемых солей и пролекарств,
где е равно 0 или 1;
n и w каждое независимо равно 0, 1 или 2, при условии, что w и n одновременно не могут быть равны 0;
Y представляет собой кислород или серу;
R1 представляет собой водород, -CN, -(CH2)qN(X6)C(O)X6, -(СH2)qN(X6)C(O)(CH2)t-А1, -(CH2)qN(X6)SO2(CH2)t-A1, -(CH2)qN(X6)SO2X6, -(CH2)qN(X6)C(O)N(X6)(CH2)t-A1, -(CH2)qN(X6)C(O)N(X6)(X6), -(CH2)qC(O)N(X6)(X6), -(CH2)qC(O)N(X6)(CH2)t-A1, -(CH2)qC(O)OX6, -(CH2)qC(O)O(CH2)t-A1, -(CH2)qOX6, -(CH2)qOC(O)X6, -(CH2)qOC(O)(CH2)t-A1, -(CH2)qOC(O)N(X6)(CH2)t-A1, -(СН2)qОС(O)N(X6)(Х6), -(CH2)qC(O)X6, -(CH2)qC(O)(CH2)t-A1, -(CH2)qN(X6)C(O)OX6, -(CH2)qN(X6)SO2N(X6)(X6), -(CH2)qS(O)mX6, -(CH2)qS(O)m(CH2)t-A1, -(С1-С10)алкил, -(CH2)t-A1, -(CH2)q-(C3-C7)циклоалкил, -(CH2)q-Y1-(С1-С6)aлкил, -(СH2)q-Y1-(CH2)t-А1 или -(CH2)q-Y1-(CH2)t-(C3-C7)циклoaлкил;
где алкильные и циклоалкильные группы в определении R1 возможно замещены (С1-С4)алкилом, гидроксилом, (С1-С4)алкоксигруппой, карбоксилом, группой -CONH2, группой -S(O)m(С1-С6)алкил, сложноэфирной группой -СO2(С1-С4)алкил, 1Н-тетразол-5-илом или 1, 2 или 3 фторо;
Y1 представляет собой О, S(O)m, -C(O)NX6-, -CH=CH-, -Cу C-, -N(X6)C(O)-, -C(O)NX6-, -C(O)O-, -OC(O)N(X6)- или -ОС(O)-;
q равно 0, 1, 2, 3 или 4;
t равно 0, 1, 2 или 3;
указанные группы (CH2)q и (CH2)t каждая возможно может быть замещена гидроксилом, (С1-С4)алкоксигруппой, карбоксилом, группой -СОNН2, группой -S(O)m(С1-С6)алкил, сложноэфирной группой -СO2(С1-С4)алкил, 1Н-тетразол-5-илом, 1, 2 или 3 атомами фтора или 1 или 2 (С1-С4)алкилами;
R2 представляет собой водород, (С1-С8)алкил, -(С0-С3)алкил-(С3-С8)циклоалкил, -(С1-С4)алкил-А1 или А1;
где алкильные группы и циклоалкильные группы в определении R2 возможно замещены гидроксилом, группой -С(O)ОХ6, группой -С(O)N(X6)(Х6), группой -N(X6)(X6), группой -S(O)m(С1-С6)алкил, группой -С(O)А1, группой -С(O)(Х6), CF3, CN или 1, 2 или 3 галогенами;
R3 представляет собой А1, (С1-С10)алкил, -(С1-С6)алкил-А1, -(С1-С6)алкил-(С3-С7)циклоалкил, -(C1-C5)aлкил-X1-(C1-C5)aлкил, -(C1-C5)aлкил-X1-(C0-C5)aлкил-A1 или -(С1-С5)aлкил-X1-(С1-С5)aлкил-(C3-C7)циклoaлкил;
где алкильные группы в R3 возможно замещены группой -S(O)m(С1-С6)алкил, группой -С(O)ОХ3, 1, 2, 3, 4 или 5 галогенами или 1, 2 или 3 группами OX3;
X1 представляет собой О, S(O)m, -N(X2)C(O)-, -C(O)N(X2)-, -OC(O)-, -С(O)O-, -СХ2=СХ2-, -N(X2)C(O)O-, OC(O)N(X2)- или -Су С-;
R4 представляет собой водород, (С1-С6)алкил или (С3-С7)циклоалкил, или R4 вместе с R3 и атомом углерода, к которому они присоединены, образуют (C5-С7)циклоалкильное, (С5-С7)циклоалкенильное, частично насыщенное или полностью насыщенное 4-8-членное кольцо, имеющее от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из кислорода, серы и азота, или бициклическую кольцевую систему, состоящую из частично насыщенного или полностью насыщенного 5- или 6-членного кольца, конденсированного с частично насыщенным, полностью ненасыщенным или полностью насыщенным 5- или 6-членным кольцом, возможно имеющим от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из азота, серы и кислорода;
X4 представляет собой водород или (С1-С6)алкил, или X4 вместе с R4 и атомом азота, к которому присоединен X4, и атомом углерода, к которому присоединен R4, образуют 5-7-членное кольцо;
R6 представляет собой связь или
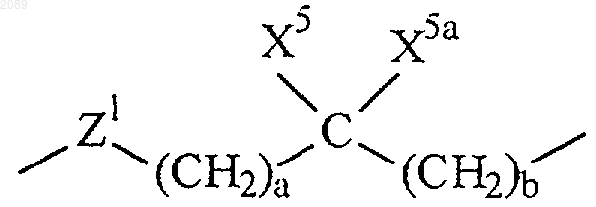
где а и b независимо равны 0, 1, 2 или 3;
X5 и X5a каждый независимо выбран из группы, состоящей из водорода, трифторметила, А1 и возможно замещенного (С1-С6)алкила;
причем возможно замещенный (С1-С6)алкил в определении X5 и X5a возможно замещен заместителем, выбранным из группы, состоящей из А1, группы ОХ2, группы -S(O)m(С1-С6)алкил, группы -С(O)ОХ2, (С3-С7)циклоалкила, группы -N(X2)(X2) и группы -С(О)N(Х2)(Х2);
или атом углерода, несущий X5 или X5a, образует один или два алкиленовых мостика с атомом азота, несущим R7 и R8, где каждый алкиленовый мостик содержит от 1 до 5 атомов углерода, при условии, что когда образуется один алкиленовый мостик, тогда X5 или X5a, но не оба, могут находиться у атома углерода, а R7 или R8, но не оба, могут находиться у атома азота, и далее при условии, что когда образуются два алкиленовых мостика, тогда X5 и X5а не могут находиться у атома углерода, а R7 и R8 не могут находиться у атома азота;
или X5 вместе с X5а и атомом углерода, к которому они присоединены, образуют частично насыщенное или полностью насыщенное 3-7-членное кольцо, или частично насыщенное или полностью насыщенное 4-8-членное кольцо, имеющее от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из кислорода, серы и азота;
или X5 вместе с X5а и атомом углерода, к которому они присоединены, образуют бициклическую кольцевую систему, состоящую из частично насыщенного или полностью насыщенного 5- или 6-членного кольца, возможно имеющего 1 или 2 гетероатома, независимо выбранных из группы, состоящей из азота, серы и кислорода, конденсированного с частично насыщенным, полностью насыщенным или полностью ненасыщенным 5- или 6-членным кольцом, возможно имеющим от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из азота, серы и кислорода;
Z1 представляет собой связь, О или N-X2 при условии, что если а и b оба равны 0, то Z1 не представляет собой N-X2 или О;
R7 и R8 независимо представляют собой водород или возможно замещенный (С1-С6)алкил;
где возможно замещенный алкил в R7 и R8 возможно независимо замещен А1, группой -С(O)O-(С1-С6)алкил, группой -S(O)m(C1-С6)алкил, от 1 до 5 галогенами, от 1 до 3 гидроксигруппами, от 1 до 3 группами -O-С(O)(С1-С10)алкил или от 1 до 3 (С1-С6)алкоксигруппами; или R7 и R8 вместе могут образовывать -(СН2)r-L-(СН2)r-;
где L представляет собой С(X2)(Х2), S(O)m или N(X2);
А1 для каждого случая независимо представляет собой (C5-С7)циклоалкенил, фенил или частично насыщенное, полностью насыщенное или полностью ненасыщенное 4-8-членное кольцо, возможно имеющее от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из кислорода, серы и азота, бициклическую кольцевую систему, состоящую из частично насыщенного, полностью ненасыщенного или полностью насыщенного 5- или 6-членного кольца, возможно имеющего от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из азота, серы и кислорода, конденсированного с частично насыщенным, полностью насыщенным или полностью ненасыщенным 5- или 6-членным кольцом, возможно имеющим от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из азота, серы и кислорода;
А1 для каждого случая независимо возможно замещен в одном или возможно в обоих кольцах, если А1 представляет собой бициклическую кольцевую систему, заместителями в количестве от одного до трех, причем каждый заместитель независимо выбран из группы, состоящей из F, Cl, Br, I, OCF3, OCF2H, СF3, СН3, ОСН3, -OX6, -C(O)N(X6)(X6), -С(O)ОХ6, оксо, (С1-С6)алкила, нитро, циано, бензила, группы -S(O)m(C1-С6)алкил, 1Н-тетразол-5-ила, фенила, феноксигруппы, фенилалкоксигруппы, галогенофенила, метилендиоксигруппы, -N(Х6)(Х6), -N(X6)C(O)(X6), -SO2N(X6)(X6), -N(X6)SO2-фенила, -N(X6)SO2X6, -CONX11X12, -SO2NX11X12, -NX6SO2X12, -NX6CONX11X12, -NX6SO2NX11X12, -NX6C(O)X12, имидазолила, тиазолила и тетразолила, при условии, что
если А1 возможно замещен метилендиоксигруппой, то он может быть замещен только одной метилендиоксигруппой;
где X11 представляет собой водород или возможно замещенный (C1-С6)алкил, причем возможно замещенный (С1-С6)алкил в определении X11 возможно независимо замещен фенилом, феноксигруппой, (С1-С6)алкоксикарбонилом, группой -S(O)m(C1-С6)алкил, от 1 до 5 галогенами, от 1 до 3 гидроксигруппами, от 1 до 3 (С1-С10)алканоилоксигруппами или от 1 до 3 (C1-С6)алкоксигруппами;
X12 представляет собой водород, (С1-С6)алкил, фенил, тиазолил, имидазолил, фурил или тиенил, при условии, что если X12 не является водородом, то X12 возможно замещен заместителями в количестве от одного до трех, независимо выбранными из группы, состоящей из Cl, F, СН3, ОСН3, ОСF3 и СF3;
или X11 и X12 вместе образуют -(CH2)r-L1-(CH2)r-,
где L1 представляет собой С(X2)(Х2), О, S(O)m или N(X2);
r для каждого случая независимо равно 1, 2 или 3;
X2 для каждого случая независимо представляет собой водород, возможно замещенный (С1-С6)алкил или возможно замещенный (С3-С7)циклоалкил, где возможно замещенный (С1-С6)алкил и возможно замещенный (С3-С7)циклоалкил в определении X2 возможно независимо замещены группой -S(O)m(С1-С6)алкил, группой -С(O)ОХ3, от 1 до 5 галогенами или от 1 до 3 группами ОХ3;
X3 для каждого случая независимо представляет собой водород или (C1-С6)алкил;
X6 независимо представляет собой водород, возможно замещенный (C1-С6)алкил, (С2-С6)галогенированный алкил, возможно замещенный (С3-С7)циклоалкил, (С3-С7)галогенированный циклоалкил, где возможно замещенный (С1-С6)алкил и возможно замещенный (С3-С7)циклоалкил в определении X6 возможно независимо замещены 1 или 2 (С1-С4)алкилами, гидроксилами, (С1-С4)алкоксигруппами, карбоксилами, группами CONH2, группами -S(O)m(С1-С6)алкил, сложноэфирными группами -СO2(С1-С4)алкил или 1Н-тетразол-5-илами; или
если имеется две группы Х6 у одного атома и обе группы Х6 независимо представляют собой (С1-С6)алкил, то две (С1-С6)алкильные группы возможно могут быть соединены и вместе с атомом углерода, к которому они присоединены, образуют 4-9-членное кольцо, возможно имеющее кислород, серу или NX7;
X7 представляет собой водород или (С1-С6)алкил, возможно замещенный гидроксилом; и
m для каждого случая независимо равно 0, 1 или 2;
при условии, что
X6 и X12 не могут представлять собой водород, когда X6 или X12 присоединен к С(O) или SO2 в виде С(O)Х6, С(O)Х12, SО2Х6 или SO2X12; и
когда R6 представляет собой связь, тогда L представляет собой N(X2), a каждый r в -(CH2)r-L-(CH2)r- независимо равен 2 или 3.
15. Способ по п.1, где состоянием, связанным с резистентностью к инсулину, является диабет типа I, диабет типа II, гипергликемия, нарушение толерантности к глюкозе или инсулинрезистентный синдром или состояние.
16. Способ по п.1, где состояние, связанное с резистентностью к инсулину, связано с ожирением или старостью.
17. Способ лечения резистентности к инсулину у млекопитающего, при котором млекопитающему, нуждающемуся в этом, вводят эффективное количество рилизинг-пептида гормона роста или миметика рилизинг-пептида гормона роста или их фармацевтически приемлемой соли.
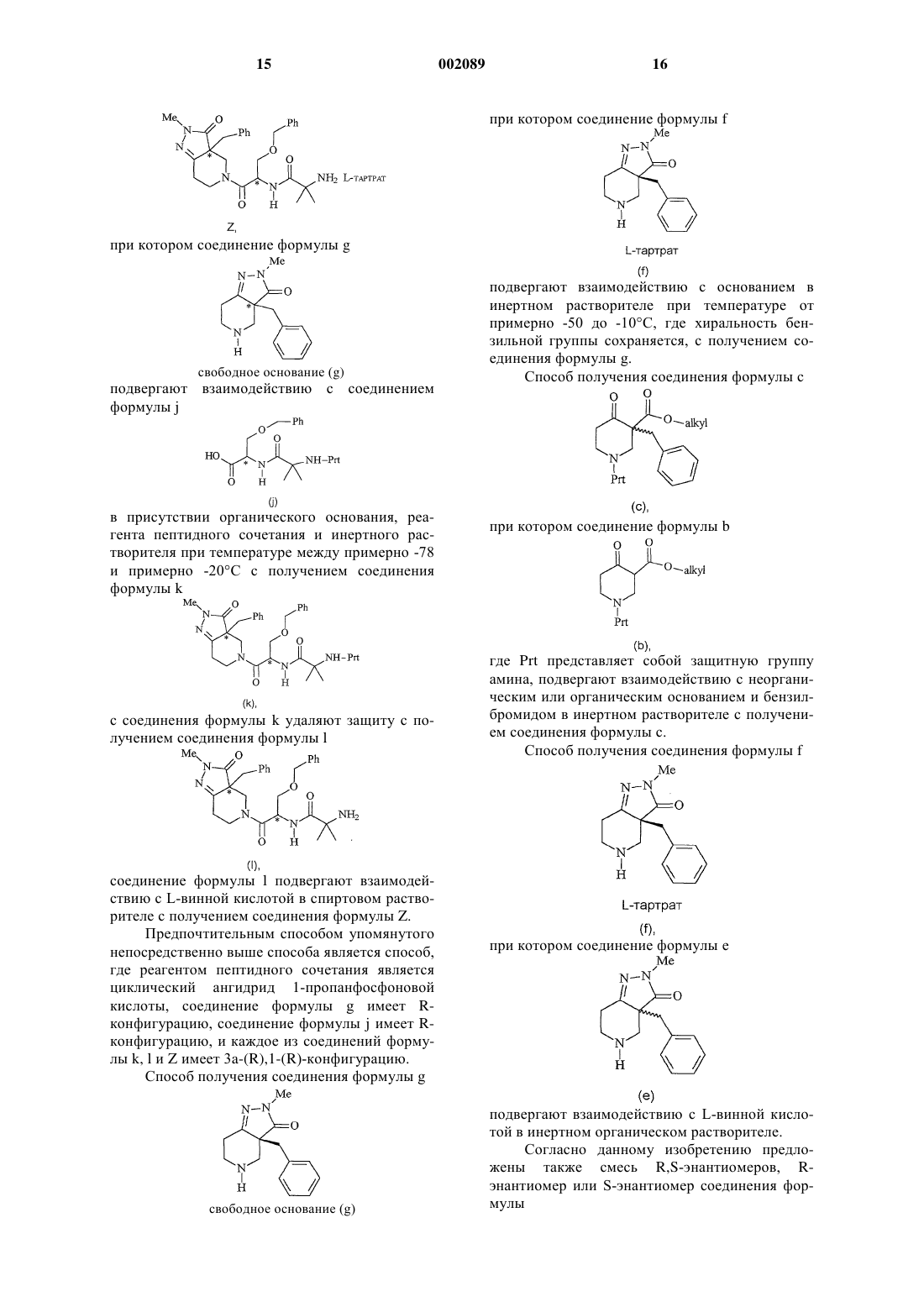
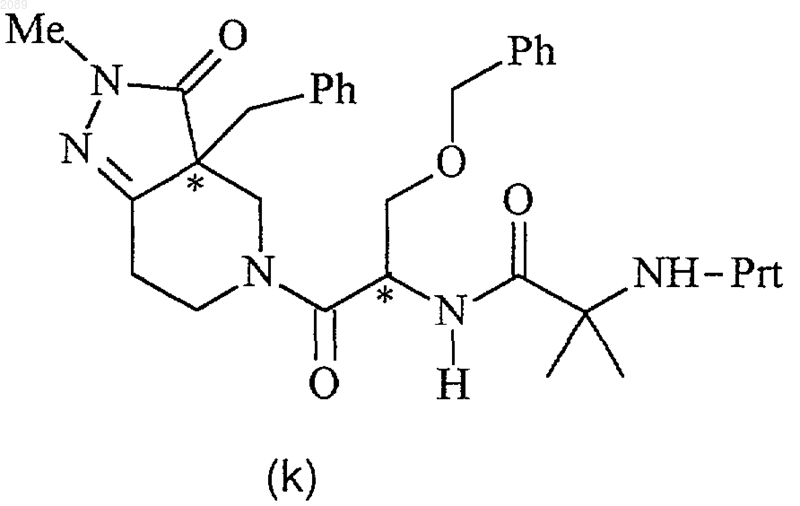
18. Способ получения соединения формулы k
при котором соединение формулы g
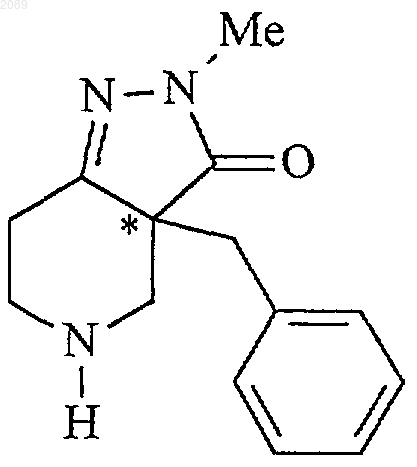
свободное основание (g)
подвергают взаимодействию с соединением формулы j
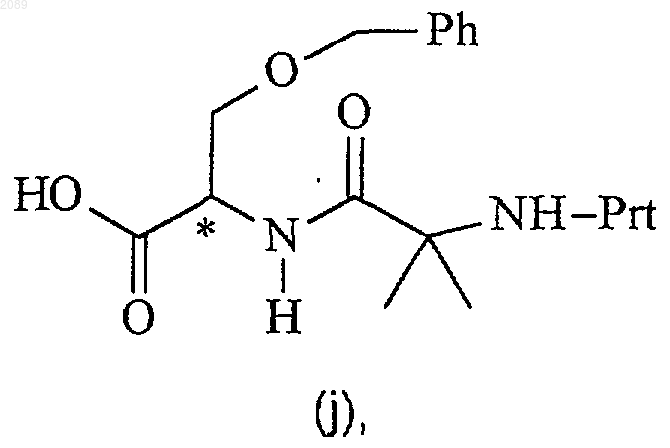
где Prt представляет собой защитную группу амина, в присутствии органического основания, реагента пептидного сочетания и инертного растворителя при температуре между примерно -78шС и примерно -20шС с получением соединения формулы k.
19. Способ по п.18, где реагентом пептидного сочетания является циклический ангидрид 1-пропанфосфоновой кислоты, соединение формулы g имеет R-конфигурацию, соединение формулы j имеет R-конфигурацию и соединение формулы k имеет 3a-(R),1-(R) конфигурацию.
20. Способ получения соединения формулы Z
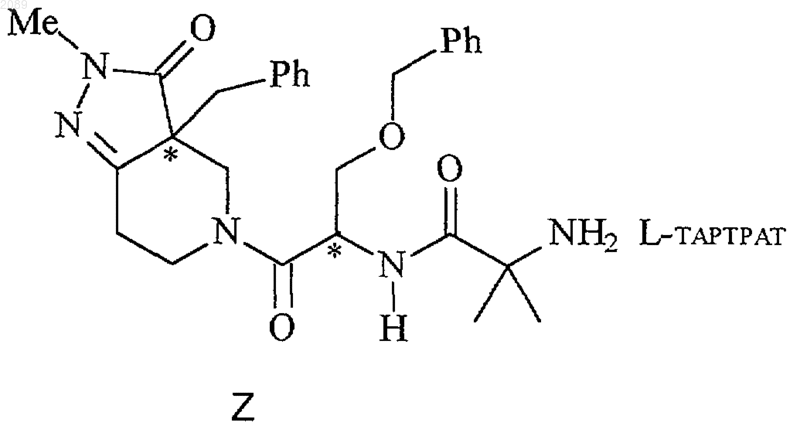
при котором соединение формулы g
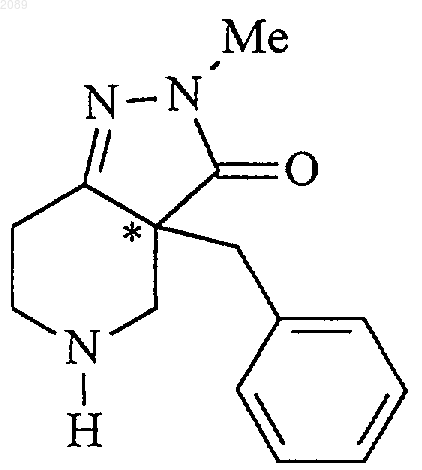
свободное основание (g)
подвергают взаимодействию с соединением формулы j
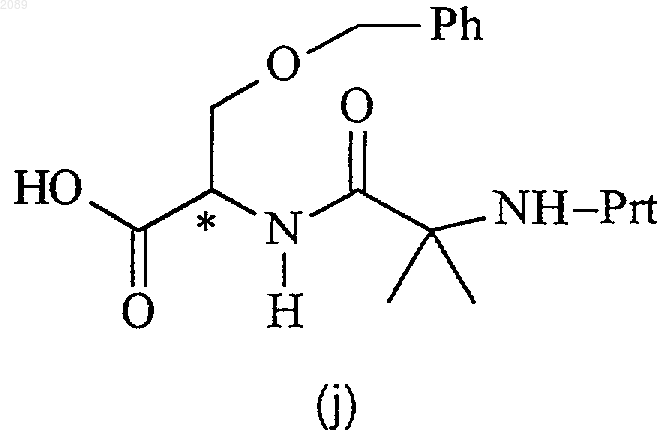
в присутствии органического основания, реагента пептидного сочетания и инертного растворителя при температуре между примерно -78ш C и примерно -20шС с получением соединения формулы k

с соединения формулы k удаляют защиту с получением соединения формулы l
соединение формулы l подвергают взаимодействию с L-винной кислотой в спиртовом растворителе с получением соединения формулы Z.
21. Способ по п.20, где реагентом пептидного сочетания является циклический ангидрид 1-пропанфосфоновой кислоты, соединение формулы g имеет R-конфигурацию, соединение формулы j имеет R-конфигурацию и каждое из соединений формулы k, l и Z имеет 3a-(R),1-(R) конфигурацию.
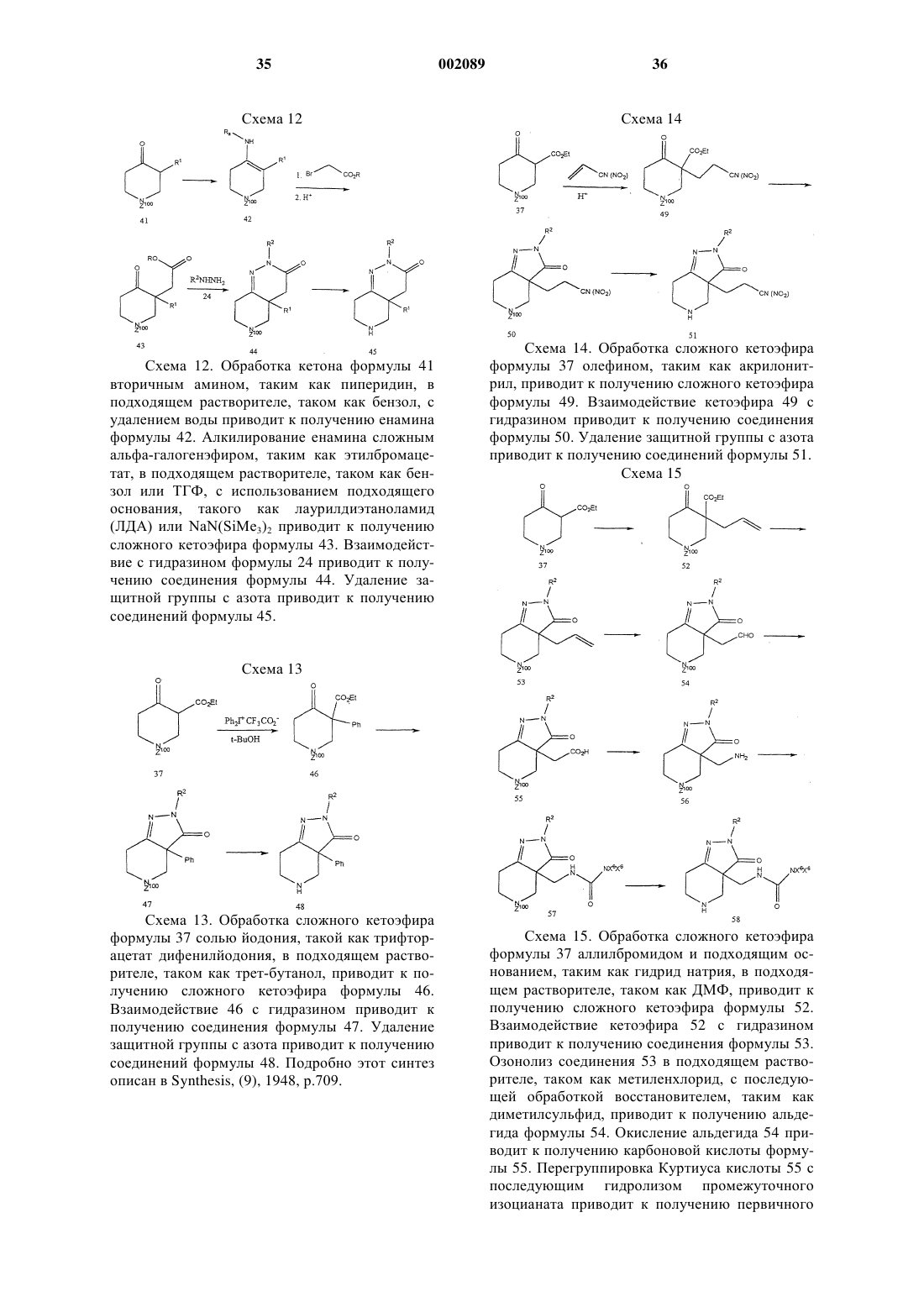
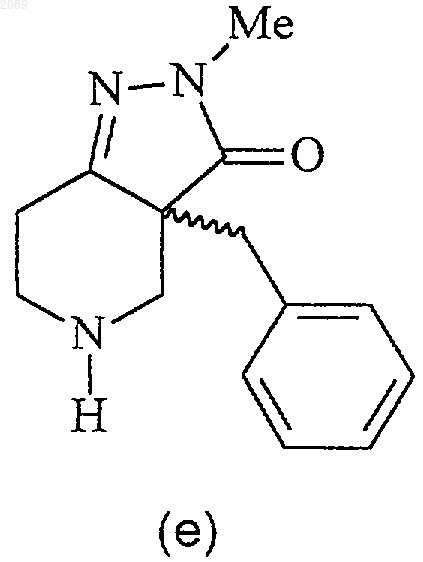
22. Способ получения соединения формулы g
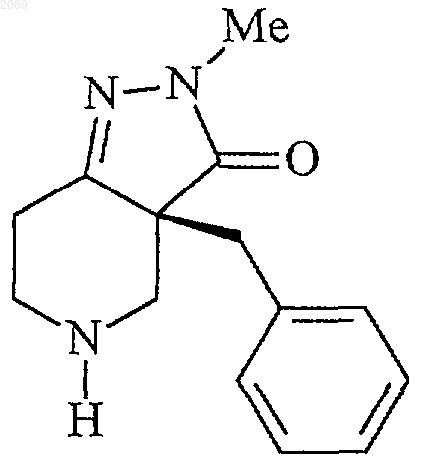
свободное основание (g)
при котором соединение формулы f
подвергают взаимодействию с основанием в инертном растворителе при температуре примерно от -50 до -10шС, причем хиральность бензильной группы сохраняется, с получением соединения формулы g.
23. Способ получения соединения формулы с
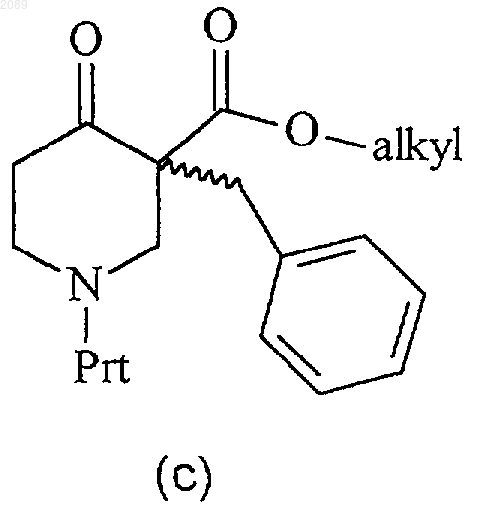
при котором соединение формулы b
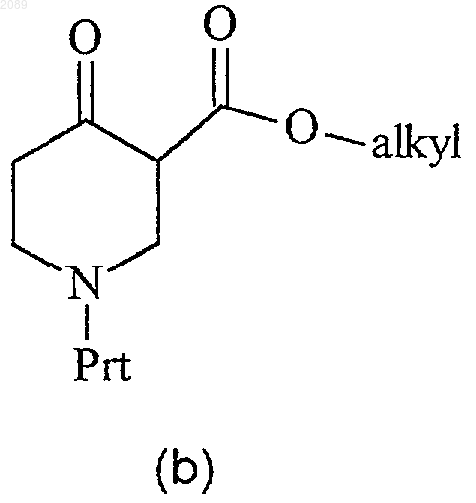
где Prt представляет собой защитную группу амина, подвергают взаимодействию с неорганическим или органическим основанием и бензилбромидом в инертном растворителе с получением соединения формулы с.
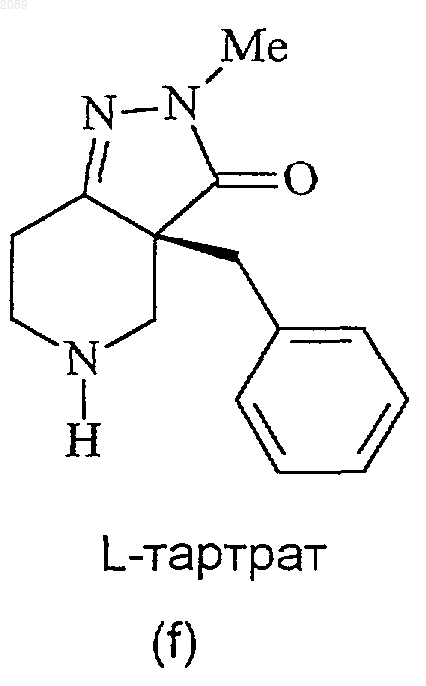
24. Способ получения соединения формулы f
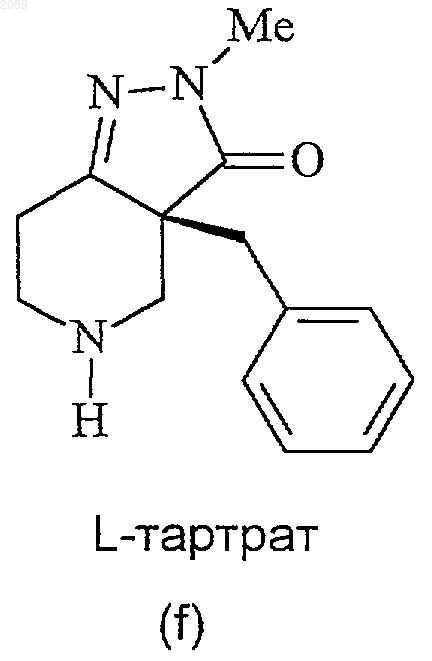
при котором соединение формулы е
подвергают взаимодействию с L-винной кислотой в инертном органическом растворителе.
25. Смесь R,S-энантиомеров, R-энантиомер или S-энантиомер соединения формулы
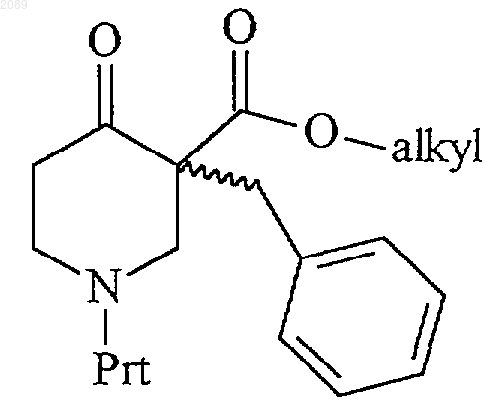
где Prt представляет собой водород или защитную группу амина.
26. Способ лечения расстройств сна у млекопитающего, страдающего от расстройств сна, при котором указанному млекопитающему вводят эффективное количество соединения формулы I
или его стереоизомерных смесей, диастереомерно обогащенных, диастереомерно чистых, энантиомерно обогащенных или энантиомерно чистых изомеров, или фармацевтически приемлемых солей и пролекарств,
где е равно 0 или 1;
n и w каждое независимо равно 0, 1 или 2, при условии, что w и n одновременно не могут быть равны 0;
Y представляет собой кислород или серу;
R1 представляет собой водород, -CN, -(CH2)qN(X6)C(O)X6, -(CH2)qN(X6)C(O)(CH2)t-А1, -(CH2)qN(X6)SO2(CH2)t-A1, -(СН2)qN(X6)SО2Х6, -(CH2)qN(X6)C(O)N(X6)(CH2)t-A1, -(CH2)qN(X6)C(O)N(X6)(X6), -(CH2)qC(O)N(X6)(X6), -(CH2)qC(O)N(X6)(CH2)t-A1, -(CH2)qC(O)OX6, -(CH2)qC(O)O(CH2)t-A1, -(CH2)qOX6 -(CH2)qOC(O)X6, -(CH2)qOC(O)(CH2)t-A1, -(CH2)qOC(O)N(X6)(CH2)t-A1, -(CH2)qOC(O)N(X6)(X6), -(CH2)qC(O)X6, -(CH2)qC(O)(CH2)t-A1, -(CH2)qN(X6)C(O)OX6, -(CH2)qN(X6)SO2N(X6)(X6), -(CH2)qS(O)mX6, -(CH2)qS(O)m(CH2)t-A1, -(С1-С10)алкил, -(CH2)t-A1, -(CH2)q-(C3-C7)циклоалкил, -(CH2)q-Y1-(С1-С6)aлкил, -(CH2)q-Y1-(CH2)t-A1 или -(CH2)q-Y1-(CH2)t-(C3-C7)циклoaлкил;
где алкильные и циклоалкильные группы в определении R1 возможно замещены (С1-С4)алкилом, гидроксилом, (С1-С4)алкоксигруппой, карбоксилом, группой -CONH2, группой -S(O)m(С1-С6)алкил, сложноэфирной группой -СO2(С1-С4)алкил, 1Н-тетразол-5-илом или 1, 2 или 3 фторо;
Y1 представляет собой О, S(O)m, -C(O)NX6-, -CH=CH-, -Cу C-, -N(X6)C(O)-, -C(O)NX6-, -C(O)O-, -OC(O)N(X6)- или -ОС(O)-;
q равно 0, 1, 2, 3 или 4;
t равно 0, 1, 2 или 3;
указанные группы (CH2)q и (CH2)t каждая возможно может быть замещена гидроксилом, (С1-С4)алкоксигруппой, карбоксилом, группой -CONH2, группой -S(O)m(С1-С6)алкил, сложноэфирной группой -СO2(С1-С4)алкил, 1Н-тетразол-5-илом, 1, 2 или 3 атомами фтора или 1 или 2 (С1-С4)алкилами;
R2 представляет собой водород, (С1-С8)алкил, -(С0-С3)алкил-(С3-С8)циклоалкил, -(С1-С4)алкил-А1 или А1;
где алкильные группы и циклоалкильные группы в определении R2 возможно замещены гидроксилом, группой -С(O)ОХ6, группой -С(O)N(X6)(Х6), группой -N(Х6)(Х6), группой -S(O)m(С1-С6)алкил, группой -С(O)А1, группой -С(O)(Х6), СF3, CN или 1, 2 или 3 галогенами;
R3 представляет собой А1, (С1-С10)алкил, -(С1-С6)алкил-А1, -(С1-С6)алкил-(С3-С7)циклоалкил, -(C1-C5)aлкил-X1-(C1-C5)aлкил, -(C1-C5)aлкил-X1-(C0-C5)aлкил-A1 или -(C1-C5)aлкил-X1-(C1-C5)aлкил-(C3-C7)циклoaлкил;
где алкильные группы в R3 возможно замещены группой -S(O)m(С1-С6)алкил, группой -С(O)ОХ3, 1, 2, 3, 4 или 5 галогенами или 1, 2 или 3 группами OX3;
X1 представляет собой О, S(O)m, -N(X2)C(O)-, -C(O)N(X2)-, -OC(O)-, -С(O)O-, -СХ2=CХ2-, -N(X2)C(O)O-, OC(O)N(X2)- или -Су С-;
R4 представляет собой водород, (С1-С6)алкил или (С3-С7)циклоалкил, или R4 вместе с R3 и атомом углерода, к которому они присоединены, образуют (C5-С7)циклоалкильное, (С5-С7)циклоалкенильное, частично насыщенное или полностью насыщенное 4-8-членное кольцо, имеющее от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из кислорода, серы и азота, или бициклическую кольцевую систему, состоящую из частично насыщенного или полностью насыщенного 5- или 6-членного кольца, конденсированного с частично насыщенным, полностью ненасыщенным или полностью насыщенным 5- или 6-членным кольцом, возможно имеющим от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из азота, серы и кислорода;
X4 представляет собой водород или (С1-С6)алкил, или X4 вместе с R4 и атомом азота, к которому присоединен X4, и атомом углерода, к которому присоединен R4, образуют 5-7-членное кольцо;
R6 представляет собой связь или
где а и b независимо равны 0, 1, 2 или 3;
X5 и X5a каждый независимо выбран из груяяы, состоящей из водорода, трифторметила, А1 и возможно замещенного (С1-С6)алкила;
причем возможно замещенный (С1-С6)алкил в X5 и X5a возможно замещен заместителем, выбранным из группы, состоящей из А1, группы ОХ2, группы -S(O)m(С1-С6)алкил, группы -С(O)ОХ2, (С3-С7)циклоалкила, группы -N(Х2)(Х2) и группы -С(O)N(X2)(Х2);
или атом углерода, несущий X5 или X5a, образует один или два алкиленовых мостика с атомом азота, несущим R7 и R8, где каждый алкиленовый мостик содержит от 1 до 5 атомов углерода, при условии, что когда образуется один алкиленовый мостик, тогда X5 или Х5a, но не оба, могут находиться у атома углерода, а R7 или R8, но не оба, могут находиться у атома азота, и далее при условии, что когда образуются два алкиленовых мостика, тогда X5 и X5а не могут находиться у атома углерода, а R7 и R8 не могут находиться у атома азота;
или X5 вместе с X5а и атомом углерода, к которому они присоединены, образуют частично насыщенное или полностью насыщенное 3-7-членное кольцо, или частично насыщенное или полностью насыщенное 4-8-членное кольцо, имеющее от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из кислорода, серы и азота;
или X5 вместе с Х5а и атомом углерода, к которому они присоединены, образуют бициклическую кольцевую систему, состоящую из частично насыщенного или полностью насыщенного 5- или 6-членного кольца, возможно имеющего 1 или 2 гетероатома, независимо выбранных из группы, состоящей из азота, серы и кислорода, конденсированного с частично насыщенным, полностью насыщенным или полностью ненасыщенным 5- или 6-членным кольцом, возможно имеющим от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из азота, серы и кислорода;
Z1 представляет собой связь, О или N-X2 при условии, что если а и b оба равны 0, то Z1 не представляет собой N-X2 или О;
R7 и R8 независимо представляют собой водород или возможно замещенный (С1-С6)алкил;
где возможно замещенный алкил в определении R7 и R8 возможно независимо замещен А1, группой -С(O)O-(С1-С6)алкил, группой -S(O)m(C1-С6)алкил, от 1 до 5 галогенами, от 1 до 3 гидроксигруппами, от 1 до 3 группами -O-С(O)(С1-С10)алкил или от 1 до 3 (С1-С6)алкоксигруппами; или
R7 и R8 вместе могут образовывать -(CH2)r-L-(CH2)r-;
где L представляет собой С(Х2)(Х2), S(O)m или N(Х2);
А1 для каждого случая независимо представляет собой (C5-С7)циклоалкенил, фенил или частично насыщенное, полностью насыщенное или полностью ненасыщенное 4-8-членное кольцо, возможно имеющее от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из кислорода, серы и азота, бициклическую кольцевую систему, состоящую из частично насыщенного, полностью ненасыщенного или полностью насыщенного 5- или 6-членного кольца, возможно имеющего от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из азота, серы и кислорода, конденсированного с частично насыщенным, полностью насыщенным или полностью ненасыщенным 5- или 6-членным кольцом, возможно имеющим от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из азота, серы и кислорода;
А1 для каждого случая независимо возможно замещен в одном или возможно в обоих кольцах, если А1 представляет собой бициклическую кольцевую систему, заместителями в количестве от одного до трех, причем каждый заместитель независимо выбран из группы, состоящей из F, Cl, Вr, I, ОСF3, OCF2H, CF3, СН3, ОСН3, -OX6, -C(O)N(X6)(X6), -С(O)ОХ6, оксо, (С1-С6)алкила, нитро, циано, бензила, группы -S(O)m(C1-С6)алкил, 1Н-тетразол-5-ила, фенила, феноксигруппы, фенилалкоксигруппы, галогенофенила, метилендиоксигруппы, -N(Х6)(Х6), -N(X6)C(O)(X6), -SO2N(X6)(X6), -N(X6)SO2-фенила, -N(X6)SO2X6, -CONX11X12, -SO2NX11X12, -NX6SO2X12, -NX6CONX11X12, -NX6SO2NX11X12, -NX6C(O)X12, имидазолила, тиазолила и тетразолила, при условии, что если А1 возможно замещен метилендиоксигруппой, то он может быть замещен только одной метилендиоксигруппой;
где X11 представляет собой водород или возможно замещенный (С1-С6)алкил, причем возможно замещенный (С1-С6)алкил в определении X11 возможно независимо замещен фенилом, феноксигруппой, (С1-С6)алкоксикарбонилом, группой -S(O)m(C1-С6)алкил, от 1 до 5 галогенами, от 1 до 3 гидроксигруппами, от 1 до 3 (С1-С10)алканоилоксигруппами или от 1 до 3 (C1-С6)алкоксигруппами;
X12 представляет собой водород, (С1-С6)алкил, фенил, тиазолил, имидазолил, фурил или тиенил, при условии, что если X12 не является водородом, то X12 возможно замещен заместителями в количестве от одного до трех, независимо выбранными из группы, состоящей из Cl, F, СН3, ОСН3, ОСF3 и СF3;
или X11 и X12 вместе образуют -(CH2)r-L1-(CH2)r-,
где L1 представляет собой С(Х2)(Х2), О, S(O)m или N(X2);
r для каждого случая независимо равно 1, 2 или 3;
X2 для каждого случая независимо представляет собой водород, возможно замещенный (С1-С6)алкил или возможно замещенный (С3-С7)циклоалкил, где возможно замещенный (С1-С6)алкил и возможно замещенный (С3-С7)циклоалкил в определении X2 возможно независимо замещены группой -S(O)m(С1-С6)алкил, группой -С(O)ОХ3, от 1 до 5 галогенами или от 1 до 3 группами ОХ3;
X3 для каждого случая независимо представляет собой водород или (C1-С6)алкил;
X6 независимо представляет собой водород, возможно замещенный (С1-С6)алкил, (С2-С6)галогенированный алкил, возможно замещенный (С3-С7)циклоалкил, (С3-С7)галогенированный циклоалкил, где возможно замещенный (С1-С6)алкил и возможно замещенный (С3-С7)циклоалкил в определении X6 возможно независимо замещены 1 или 2 (С1-С4)алкилами, гидроксилами, (С1-С4)алкоксигруппами, карбоксилами, группами CONH2, группами -S(O)m(С1-С6)алкил, сложноэфирными группами -СO2(С1-С4)алкил или 1Н-тетразол-5-илами; или
если имеются две группы X6 на одном атоме и обе группы X6 независимо представляют собой (С1-С6)алкил, то две (С1-С6)алкильные группы возможно могут быть соединены и вместе с атомом углерода, к которому они присоединены, образуют 4-9-членное кольцю, возможно имеющее кислород, серу или NX7;
X7 представляет собой водород или (С1-С6)алкил, возможно замещенный гидроксилом; и
m для каждого случая независимо равно 0, 1 или 2;
при условии,что
X6 и X12 не могут представлять собой водород, когда X6 или X12 присоединен к С(O) или SO2 в виде С(O)Х6, С(O)Х12, SO2X6 или SO2X12; и когда R6 представляет собой связь, тогда L представляет собой N(X2), a каждый r в определении -(CH2)r-L-(CH2)r- независимо равен 2 или 3.
Текст
1 Предпосылки изобретения Гормон роста (ГР), который вырабатывается из гипофиза, стимулирует рост всех тканей человека, которые способны к росту. Кроме того, известно, что гормон роста обладает следующим основным действием на процессы метаболизма в организме: 1) повышение скорости синтеза белков по существу во всех клетках организма; 2) понижение скорости утилизации углеводов в клетках организма; и 3) повышение мобилизации свободных жирных кислот и использование жирных кислот для энергии. Недостаток гормона роста приводит к множеству медицинских расстройств. У детей он является причиной карликовости. У взрослых последствия приобретенного дефицита гормона роста включают в себя существенное уменьшение нежировой массы тела и сопутствующее увеличение общей массы жира, особенно в области туловища. Уменьшение скелетной и сердечной мышечной массы и мышечной силы приводят к значительному снижению способности выполнять физические упражнения. Плотность кости также понижается. Показано,что введение экзогенного гормона роста поворачивает в обратном направлении многие метаболические изменения. Дополнительные преимущества терапии включают в себя снижение холестерина липидов низкой плотности (ЛНП) и и улучшение психологического здоровья. В случаях, когда требуются повышенные уровни гормона роста, проблему обычно решают обеспечением экзогенного гормона роста или введением агента, который стимулирует выработку и/или высвобождение гормона роста. В любом случае пептидильная природа соединения делает необходимым введение этого соединения путем инъекции. Первоначально источником гормона роста была экстракция гипофиза трупов. Это приводило к получению дорогого продукта и сопровождалось риском, что болезнь, связанная с источником гипофиза, может быть передана реципиенту гормона роста(например, болезнь Якоба-Крейтцфельдта). Недавно стал доступным рекомбинантный гормон роста, который, хотя больше и не сопровождается никаким риском переноса болезни, все еще является очень дорогим продуктом, который следует вводить путем инъекции или в виде аэрозоля через нос. Наибольшие дефициты ГР вызываются нарушениями высвобождения ГР, а не первичными нарушениями гипофизарного синтеза ГР. Следовательно, альтернативной концепцией для нормализации сывороточных уровней ГР является концепция, в основе которой лежит стимулирование или ингибирование различных систем нейромедиаторов в головном мозге и гипоталамусе. В результате продолжается создание синтетических высвобождающих гормон роста 2 агентов для стимулирования гипофизарной секреции ГР, и их создание может иметь некоторые преимущества перед дорогой и неудобной ГРзаместительной терапией. Действуя по физиологическим проводящим путям, наиболее подходящие агенты будут стимулировать пульсирующую секрецию ГР, а чрезмерные уровни ГР,которые связаны с нежелательными побочными эффектами экзогенного введения ГР, будут исключены в силу неповрежденных нервных узлов отрицательной обратной связи. Физиологические и фармакологические стимуляторы секреции ГР включают в себя аргинин,L-3,4-дигидроксифенилаланин(LДОФА), глюкагон, вазопрессин, а гипогликемия, вызванная инсулином, а также деятельность, такая как сон и физкультура, косвенно вызывают высвобождение гормона роста из гипофиза, воздействуя некоторым образом на гипоталамус, возможно чтобы либо уменьшить секрецию соматостатина, либо увеличить секрецию известных средств, стимулирующих секрецию рилизинг-фактора гормона роста (GHRF),или неизвестного эндогенного рилизинггормона гормона роста, или всех их. Были разработаны другие соединения, которые стимулируют высвобождение эндогенного гормона роста, такие как аналогичные пептидильные соединения, родственные рилизингфактору гормона роста (GRF) или пептидам по патенту США 4411890. Эти пептиды, хотя и значительно меньше, чем гормоны роста, все же чувствительны к разным протеазам. Как у большинства пептидов, их возможность для пероральной биодоступности является низкой. Известны (WO 94/13696) некоторые спиропипериды и гомологи, которые промотируют высвобождение гормона роста. Сообщается (WO 94/11012, WО 94/13696),что некоторые соединения можно применять при лечении остеопороза в комбинации с паратиреоидным гормоном или бисфосфонатом. В одном аспекте данное изобретение относится к способу лечения инсулинрезистентных состояний, таких как инсулиннезависимый сахарный диабет (ИНЗСД) и ослабленный гликемический контроль, связанный с ожирением или старостью, у млекопитающего, нуждающегося в этом, при котором указанному млекопитающему вводят эффективное количество соединения формулы I, определенного ниже, или его фармацевтически приемлемой соли. Данное изобретение ориентировано на использование средств, стимулирующих секрецию гормона роста, особенно рилизинг-пептидов гормона роста (GHRP) или GHRP-миметиков формулы I, которые определены ниже, для улучшения гликемического контроля. Не следует ожидать, что агенты, которые повышают уровни гормона роста (ГР), обладают этим эффектом, так как официально признано, что ГР является диабетогенным для животных и чело 3 века. При акромегалии нарушаются утилизация глюкозы и прекращение выработки глюкозы в печени (Hansen, I., et al., Am. J. Physiol.,250:E269 (1986. При этой болезни, связанной с избытком ГР, операция на гипофизе или химиотерапия, которые понижают уровни ГР, изменяют в обратном направлении нарушенное регулирование глюкозы и гиперинсулинемию(1981. Более того, многочисленные исследования показали, что введение ГР пожилым людям приводит к гипергликемии, интолерантности к глюкозе и гиперинсулинемии (Aloia, J.F., et al.,J. Clin. Endocrinol. Metab., 43:992, (1976); Binnerts et al., J. Clin. Endocrinol. Metab., 67:1313,(1988); Marcus, R., et al., J. Clin. Endocrinol. Metab., 70:519, (1990. Следовательно, ГР-терапия противопоказана людям, больным диабетом,или тем людям, которые подвержены риску заболеть диабетом. Ожирение является главным фактором риска заболеть диабетом, и большая часть ИНЗСД-пациентов страдают ожирением. Оба состояния характеризуются повышенными уровнями циркулирующего инсулина и ослабленными уровнями ГР. Было показано, что ГРлечение взрослых пациентов с дефицитом ГР(Rudman, D., et al., Horm. Res., 36 (Suppl 1):73,(1991 вызывает рост нежировой массы тела,массы печени и мышечной массы и в то же время уменьшает массу жира. Таким образом, ГРтерапия ожирения, по-видимому, была бы привлекательной, если бы не диабетогенные эффекты ГР. Альтернативой введению экзогенного ГР является терапия, которая стимулирует секрецию эндогенного ГР. Было показано, что у гипофиз-интактных пациентов с недостатком ГР и пожилых людей имеется существенный гипофизный резерв ГР, и поэтому пониженные сывороточные уровни ГР являются следствием гипосекреции. Гипосекреция ГР при некоторых клинических состояниях (ожирение, старение, глюкокортикоидная супрессия) является относительно резистентной к стимуляции GHRH (Gertz В. J.,et al., J. Clin. Endocrinol. Metab., 79:745 (1994);Arvat, E., et al., J. Clin. Endocrinol. Metab.,79:1440 (1994); Maccario, M., et al., Metabolism,44:134 (1995. Напротив, введение GHRP или комбинированное введение GHRH и GHRP этим пациентам может вызывать сильный ГР-ответGHRP продемонстрировали отсутствие сильного влияния на уровни циркулирующего инсулина или глюкозы. Инсулин и глюкозу вообще не контролировали при постоянных исследованиях 4 за исключением того, чтобы документально подтвердить отсутствие неблагоприятных изменений (Jacks, Т., et al., J. Endocrinol. 143:399(1993. До настоящего изобретения использованиеGHRP или GHRP-миметиков для улучшения гликемического контроля конкретно не исследовали. Способ лечения резистентности к инсулину у млекопитающего, при котором вводят соединение формулы I, практикуют предпочтительно у пациентов, которые имеют функциональную гипоталамо-гипофизарную ось, способную на ГР-секреторные ответы на GHRP, и у которых диабет (типа I или типа II) или резистентость к инсулину, или у которых нарушена толерантность к глюкозе. В другом аспекте данное изобретение относится к способам лечения или предупреждения застойной сердечной недостаточности,ожирения или слабости, связанной со старением, у млекопитающего, нуждающегося в этом,при котором указанному млекопитающему вводят одновременно, последовательно в любом порядке или в виде комбинации функциональный антагонист соматостатина, такой как альфа 2-адренергический агонист, например клонидин, ксилазин и медетомидин, и соединение формулы I, которое определено ниже. В другом аспекте данного изобретения предложены способы ускорения восстановления кости после перелома и заживления ран, ослабления белкового катаболического ответа после тяжелой операции и уменьшения кахексии и потери белка вследствие хронического заболевания у млекопитающего, нуждающегося в этом, при котором указанному млекопитающему вводят одновременно, последовательно в любом порядке или в виде комбинации альфа-2 адренергический агонист, такой как клонидин,ксилазин и медетомидин, и соединение формулы I, которое определено ниже. Клонидин описан в патенте США 3202660, раскрытие которого приводится в настоящем описании посредством ссылки, ксилазин описан в патенте США 3235550, раскрытие которого приводится в настоящем описании посредством ссылки, а медетомидин описан в патенте США 4544664, раскрытие которого приводится в настоящем описании посредством ссылки. Было показано, что альфа-2-адренергические агонисты вызывают высвобождение эндогенного гормона роста у человека и собак (Cella et al.,Life Sciences (1984), 34:447-454; Hampshire J,Altszuler N. American Journal of Veterinary Research (1981), 42:6, 1073-1076; Valcavi et al.,Clinical Endocrinology (1988), 29:309-316; Morrison et al., American Journal of Veterinary Research(1990), 51:1, 65-70) и что совместное введение альфа-2-адренергического агониста с рилизингфактором гормона роста восстанавливает недостаточную секрецию гормона роста у старых собак (Аrсе et al., Brain Research (1990), 537:359 5 362; Cella et al., Neuroendocrinology (1993),57:432-438). В еще одном аспекте данного изобретения предложен способ синтеза соединения формулы где этот способ описан ниже. Кроме того, данное изобретение относится к способам получения некоторых промежуточных соединений, приведенных ниже, которые можно использовать в синтезе соединения формулы Z. Соединения формулы I, используемые в настоящем изобретении, и соединения формулыZ раскрыты и заявлены в одновременно рассматриваемой Международной заявке WO 97/24369, поданной 4 декабря 1996 г., которая переуступлена правопреемнику. В этой заявке сказано, что указанные соединения обладают активностью как средства, стимулирующие секрецию гормона роста, и повышают уровень эндогенного гормона роста. Краткое описание изобретения В способах по данному изобретению используют соединения, которые имеют формулу или их стереоизомерные смеси, диастереомерно обогащенные, диастереомерно чистые, энантиомерно обогащенные или энантиомерно чистые изомеры, или фармацевтически приемлемые соли и пролекарства,где е равно 0 или 1;n и w каждое независимо равно 0, 1 или 2,при условии, что w и n одновременно не могут быть равны 0;Y представляет собой кислород или серу;t равно 0, 1, 2 или 3; указанные группы (CH2)q и (СН 2)t каждая возможно может быть замещена гидроксилом,(С 1-С 4)алкоксигруппой, карбоксилом, группойR2 представляет собой водород, (С 1 С 8)алкил, -(С 0-С 3)алкил-(С 3-С 8)циклоалкил, -(С 1 С 4)алкил-А 1 или А 1; где алкильные группы и циклоалкильные группы в определении R2 возможно замещены гидроксилом, группой -С(O)ОХ 6, группойaлкил-X1-(C0-C5)aлкил-A1 или -(C1-C5)aлкил-X1(C1-C5)aлкил-(C3-C7)циклoaлкил; где алкильные группы в определении R3 возможно замещены группой -S(O)m(С 1 С 6)алкил, группой -С(O)ОХ 3, 1, 2, 3, 4 или 5 галогенами или 1, 2 или 3 группами OX3;R3 и атомом углерода, к которому они присоединены, образуют (C5-С 7)циклоалкильное, (С 5 С 7)циклоалкенильное, частично насыщенное или полностью насыщенное 4-8-членное кольцо, 7 имеющее от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из кислорода,серы и азота, или бициклическую кольцевую систему, состоящую из частично насыщенного или полностью насыщенного 5- или 6-членного кольца, конденсированного с частично насыщенным, полностью ненасыщенным или полностью насыщенным 5- или 6-членным кольцом,возможно имеющим от 1 до 4 гетероатомов,независимо выбранных из группы, состоящей из азота, серы и кислорода;X4 представляет собой водород или (С 1 С 6)алкил, или X4 вместе с R4 и атомом азота, к которому присоединен X4, и атомом углерода, к которому присоединен R4, образуют 5-7 членное кольцо;R6 представляет собой связь илиX5 и X5a каждый независимо выбран из группы, состоящей из водорода, трифторметила,А 1 и возможно замещенного (С 1-С 6)алкила; причем возможно замещенный (С 1 С 6)алкил в определении X5 и X5a возможно замещен заместителем, выбранным из группы,состоящей из А 1, группы ОХ 2, группы-С(O)N(X2)(Х 2), или атом углерода, несущий X5 или X5a, образует один или два алкиленовых мостика с атомом азота, несущим R7 и R8, где каждый алкиленовый мостик содержит от 1 до 5 атомов углерода, при условии, что когда образуется один алкиленовый мостик, тогда X5 илиX5a, но не оба, могут находиться на атоме углерода, а R7 или R8, но не оба, могут находиться на атоме азота, и далее при условии, что когда образуются два алкиленовых мостика, тогда X5 и X5a не могут находиться на атоме углерода, аR7 и R8 не могут находиться на атоме азота; или X5 вместе с X5a и атомом углерода, к которому они присоединены, образуют частично насыщенное или полностью насыщенное 3-7 членное кольцо, или частично насыщенное или полностью насыщенное 4-8-членное кольцо,имеющее от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из кислорода,серы и азота; или X5 вместе с X5a и атомом углерода, к которому они присоединены, образуют бициклическую кольцевую систему, состоящую из частично насыщенного или полностью насыщенного 5- или 6-членного кольца, возможно имеющего 1 или 2 гетероатома, независимо выбранных из группы, состоящей из азота, серы и кислорода, конденсированного с частично насыщенным, полностью насыщенным или полностью ненасыщенным 5- или 6-членным кольцом, возможно имеющим от 1 до 4 гетероато 002089 8 мов, независимо выбранных из группы, состоящей из азота, серы и кислорода;Z1 представляет собой связь, О или N-X2,при условии, что если а и b оба равны 0, то Z1 не представляет собой N-X2 или О;R7 и R8 независимо представляют собой водород или возможно замещенный (С 1 С 6)алкил; где возможно замещенный алкил в определении R7 и R8 возможно независимо замещен А 1, группой -С(O)O-(С 1-С 6)алкил, группой-S(O)m(C1-С 6)алкил, от 1 до 5 галогенами, от 1 до 3 гидроксигруппами, от 1 до 3 группами -OС(O)(С 1-С 10)алкил или от 1 до 3 (С 1-С 6) алкоксигруппами; или R7 и R8 вместе могут образовывать -(СН 2)r-L-(СН 2)r-; где L представляет собой C(X2)(X2), S(O)m или N(Х 2); А 1 для каждого случая независимо представляет собой (C5-С 7)циклоалкенил, фенил или частично насыщенное, полностью насыщенное или полностью ненасыщенное 4-8-членное кольцо, возможно имеющее от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из кислорода, серы и азота, бициклическую кольцевую систему, состоящую из частично насыщенного, полностью ненасыщенного или полностью насыщенного 5- или 6-членного кольца, возможно имеющего от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из азота, серы и кислорода, конденсированного с частично насыщенным, полностью насыщенным или полностью ненасыщенным 5 или 6-членным кольцом, возможно имеющим от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из азота, серы и кислорода; А 1 для каждого случая независимо возможно замещен в одном или возможно в обоих кольцах, если А 1 представляет собой бициклическую кольцевую систему, заместителями в количестве от одного до трех, причем каждый заместитель независимо выбран из группы, состоящей из F, Cl, Br, I, OCF3, OCF2H, CF3, СН 3,ОСН 3, -ОХ 6, -С(O)N(Х 6)(Х 6), -С(O)ОХ 6, оксо,(С 1-С 6)алкила, нитро, циано, бензила, группы-S(O)m(С 1-С 6)алкил, 1 Н-тетразол-5-ила, фенила,феноксигруппы, фенилалкоксигруппы, галогенофенила, метилендиоксигруппы, -N(X6)(X6),-N(X6)C(O)(X6),-SO2N(X6)(X6),-N(X6)SO26 6 11 12 фенила, -N(X )SO2X , -CONX X , -SO2NX11X12,-NX6SO2X12, -NX6CONX11X12, -NX6SO2NX11X12,-NX6C(O)X12, имидазолила, тиазолила и тетразолила, при условии, что если А 1 возможно замещен метилендиоксигруппой, то он может быть замещен только одной метилендиоксигруппой; где X11 представляет собой водород или возможно замещенный (С 1-С 6)алкил, причем возможно замещенный (С 1-С 6)алкил в определении X11 возможно независимо замещен фенилом, феноксигруппой, (С 1-С 6)алкоксикарбонилом, группой -S(O)m(C1-С 6)алкил, от 1 до 5X12 представляет собой водород, (С 1 С 6)алкил, фенил, тиазолил, имидазолил, фурил или тиенил, при условии, что если X12 не является водородом, то X12 возможно замещен заместителями в количестве от одного до трех,независимо выбранными из группы, состоящей из Cl, F, СН 3, ОСН 3, ОСF3 и CF3, или X11 и X12 вместе образуют -(СН 2)r-L1-(CH2)r-,где L1 представляет собой C(Х 2)(Х 2), О,S(O)m или N(X2), r для каждого случая независимо равно 1, 2 или 3;X2 для каждого случая независимо представляет собой водород, возможно замещенный(С 1-С 6)алкил или возможно замещенный (С 3 С 7)циклоалкил, где возможно замещенный (С 1 С 6)алкил и возможно замещенный (С 3 С 7)циклоалкил в определении X2 возможно независимо замещены группой-S(O)m(С 1 С 6)алкил, группой -С(O)ОХ 3, от 1 до 5 галогенами или от 1 до 3 группами ОХ 3;X3 для каждого случая независимо представляет собой водород или (С 1-С 6)алкил;X6 независимо представляет собой водород, возможно замещенный (С 1-С 6)алкил, (С 2 С 6)галогенированный алкил, возможно замещенный (С 3-С 7)циклоалкил, (С 3-С 7)галогенированный циклоалкил, где возможно замещенный(С 1-С 6)алкил и возможно замещенный (С 3 С 7)циклоалкил в определении X6 возможно независимо замещены 1 или 2 (C1-С 4)алкилами,гидроксилами, (С 1-С 4)алкоксигруппами, карбоксилами, группами CONH2, группами -S(O)m(С 1 С 6)алкил, сложноэфирными группами -СO2(С 1 С 4)алкил или 1 Н-тетразол-5-илами; или если имеется две группы X6 на одном атоме, и обе группы X6 независимо представляют собой (С 1 С 6)алкил, то две (С 1-С 6)алкильные группы возможно могут быть соединены и, вместе с атомом углерода, к которому они присоединены,образуют 4-9-членное кольцо, возможно имеющее кислород, серу или NX7;X7 представляет собой водород или (С 1 С 6)алкил, возможно замещенный гидроксилом; иm для каждого случая независимо равно 0,1 или 2; при условии, чтоX6 и X12 не могут представлять собой водород, когда X6 или X12 присоединен к С(O) илиSO2 в виде С(O)Х 6, С(O)Х 12, SO2 Х 6 или SO2 Х 12; и когда R6 представляет собой связь, тогда L представляет собой N(X2), a каждый r в определении -(CH2)r-L-(CH2)r- независимо равен 2 или 3. В одном аспекте данного изобретения предложен способ лечения резистентности к инсулину у млекопитающего, при котором указанному млекопитающему вводят эффективное количество соединения формулы I, как оно определено выше, или его стереоизомерных сме 002089 10 сей, диастереомерно обогащенных, диастереомерно чистых, энантиомерно обогащенных или энантиомерно чистых изомеров, или фармацевтически приемлемых солей и пролекарств. Предпочтительным способом упомянутого выше способа является способ, где состоянием,связанным с резистентностью к инсулину, является диабет типа I, диабет типа II, гипергликемия, нарушение толерантности к глюкозе или инсулинрезистентный синдром или состояние. Другим предпочтительным способом упомянутого выше способа является способ, где состояние, связанное с резистентностью к инсулину, связано с ожирением или старостью. Предпочтительным способом упомянутого выше способа является способ, где указанное соединение формулы I представляет собой соединение следующей формулы или его стереоизомерную смесь, диастереомерно обогащенные, диастереомерно чистые, энантиомерно обогащенные или энантиомерно чистые изомеры, или фармацевтически приемлемые соли и пролекарства, гдеR1 представляет собой -СН 2-фенил, R2 представляет собой метил и R3 представляет собой -(СH2)3-фенил;R1 представляет собой -СН 2-фенил, R2 представляет собой метил и R3 представляет собой 3-индолил-СН 2-;R1 представляет собой -СН 2-фенил, R2 представляет собой этил и R3 представляет собой 3-индолил-СH2-;R представляет собой метил и R3 представляет собой 3-индолил-СН 2-;R1 представляет собой -СН 2-фенил, R2 представляет собой метил и R3 представляет собой -СН 2-O-СН 2-фенил;R1 представляет собой -СН 2-фенил, R2 представляет собой этил и R3 представляет собой -СН 2-O-СН 2-фенил;R1 представляет собой -СН 2-4-фторфенил,R2 представляет собой метил и R3 представляет собой -СН 2-O-СН 2-фенил;R1 представляет собой -СН 2-фенил, R2 представляет собой метил и R3 представляет собой -СН 2-O-СН 2-3,4-дифторфенил. Другим предпочтительным способом упомянутого выше способа является способ, где указанное соединение формулы I представляет собой соединение формулы или его стереоизомерные смеси, диастереомерно обогащенные, диастереомерно чистые, энантиомерно обогащенные или энантиомерно чистые изомеры, или фармацевтически приемлемые соли и пролекарства, гдеR2 представляет собой СН 2 СF3, А 1 представляет собой 2-пиридил и R3 представляет собой -СН 2-O-СН 2-3-хлорфенил;R2 представляет собой СН 2 СF3, А 1 представляет собой 2-пиридил и R3 представляет собой -СН 2-O-СН 2-3-хлортиофен илиR2 представляет собой СН 2 СF3, А 1 представляет собой 2-пиридил и R3 представляет собой -СН 2-O-СН 2-2,4-дифторфенил. Еще одним предпочтительным способом упомянутого выше способа является способ, где указанное соединение формулы I или его стереоизомерные смеси, диастереомерно обогащенные, диастереомерно чистые, энантиомерно обогащенные или энантиомерно чистые изомеры, или фармацевтически приемлемые соли и пролекарства представляет собой 3a(R,S),1(R) диастереомерную смесь, 3a(R),1(R) диастереомер или 3a(S),1(R) диастереомер соединения,выбранного из группы, состоящей из 2-амино-N-[1-(3 а-бензил-2-метил-3-оксо 2,3,3 а,4,6,7-гексагидропиразоло[4,3-с]пиридин 5-карбонил)-4-фенилбутил]-изобутирамида,2-амино-N-[2-(3 а-бензил-2-метил-3-оксо 2,3,3 а,4,6,7-гексагидропиразоло[4,3-с]пиридин 5-ил)-1-(1 Н-индол-3-илметил)-2-оксоэтил]изобутирамида,2-амино-N-[2-(3 а-бензил-2-этил-3-оксо 2,3,3 а,4,6,7-гексагидропиразоло[4,3-с]пиридин 5-ил)-1-(1 Н-индол-3-илметил)-2-оксоэтил]изобутирамида,2-амино-N-[2-[3 а-(4-фторбензил)-2-метил 3-оксо-2,3,3 а,4,6,7-гексагидропиразоло[4,3-с] пиридин-5-ил]-1-(1 Н-индол-3-илметил)-2-оксоэтил]-изобутирамида,2-амино-N-[2-(3 а-бензил-2-метил-3-оксо 2,3,3 а,4,6,7-гексагидропиразоло[4,3-с]пиридин 5-ил)-1-бензилоксиметил-2-оксоэтил]-изобутирамида,2-амино-N-[2-(3 а-бензил-2-этил-3-оксо 2,3,3 а,4,б,7-гексагидропиразоло[4,3-с]пиридин 5-ил)-1-бензилоксиметил-2-оксоэтил]-изобутирамида, 002089[4,3-с]пиридин-5-ил]-1-бензилоксиметил-2 оксоэтил-изобутирамида,2-амино-N-1-бензилоксиметил-2-[3 а-(4 фторбензил)-2-метил-3-оксо-2,3,3 а,4,6,7 гексагидропиразоло[4,3-с]пиридин-5-ил]-2 оксоэтил-изобутирамида,2-амино-N-[2-(3 а-бензил-2-трет-бутил-3 оксо-2,3,3 а,4,6,7-гексагидропиразоло[4,3-с] пиридин-5-ил)-1-бензилоксиметил-2-оксоэтил]изобутирамида и 2-амино-N-[2-(3 а-бензил-3-оксо-2,3,3 а,4,6,7-гексагидропиразоло[4,3-с]пиридин-5-ил)-1 бензилоксиметил-2-оксоэтил]-изобутирамида. Предпочтительным способом упомянутого непосредственно выше способа является способ,где указанное соединение формулы I представляет собой соль L-винной кислоты 2-амино-N[2-(3 а-(R)-бензил-2-метил-3-оксо-2,3,3 а,4,6,7 гексагидропиразоло[4,3-с]пиридин-5-ил)-1-(R)бензилоксиметил-2-оксоэтил]-изобутирамида. Еще одним предпочтительным способом упомянутого выше способа является способ, где указанное соединение формулы I или его стереоизомерные смеси, диастереомерно обогащенные, диастереомерно чистые, энантиомерно обогащенные или энантиомерно чистые изомеры, или фармацевтически приемлемые соли и пролекарства представляют собой смесь 3a(R,S),1-(R) диастереомеров, 3a-(R),1-(R) энантиомер или 3a-(S),1-(R) энантиомер соединения,выбранного из группы, состоящей из 2-амино-N-[1-бензилоксиметил-2-(2-метил-3-оксо-3 а-пиридин-2-илметил-2,3,3 а,4,6,7 гексагидропиразоло[4,3-с]пиридин-5-ил)-2 оксоэтил]-2-метилпропионамида; 2-амино-N-1-(3-хлорбензилоксиметил)-2 оксо-2-[3-оксо-3 а-пиридин-2-илметил-2-(2,2,2 трифторэтил)-2,3,3 а,4,6,7-гексагидропиразоло 13 Еще один предпочтительный способ упомянутого выше способа дополнительно включает в себя введение млекопитающему, нуждающемуся в этом, рилизинг-гормона гормона роста или его функционального аналога, которые получают известными способами, и некоторые примеры которых описаны в Европейском патенте ЕР 511003. В другом аспекте данного изобретения предложена фармацевтическая композиция,пригодная для лечения резистентности к инсулину у млекопитающего, которая включает в себя фармацевтически приемлемый носитель и эффективное количество соединения формулы I,такого, как показано выше, или его стереоизомерных смесей, диастереомерно обогащенных,диастереомерно чистых, энантиомерно обогащенных или энантиомерно чистых изомеров,или фармацевтически приемлемых солей и пролекарств. В еще одном аспекте данного изобретения предложены способы повышения уровней эндогенного гормона роста, при котором человеку или другому животному, нуждающемуся в этом,вводят эффективные количества функционального антагониста соматостатина и соединения формулы I, такого, как показано выше, или его стереоизомерных смесей, диастереомерно обогащенных, диастереомерно чистых, энантиомерно обогащенных или энантиомерно чистых изомеров, или фармацевтически приемлемых солей и пролекарств. В еще одном аспекте данного изобретения предложены способы лечения или предупреждения застойной сердечной недостаточности,ожирения или слабости, связанной со старением, при которых млекопитающему, нуждающемуся в этом, вводят эффективные количества функционального антагониста соматостатина и соединения формулы I, такого, как показано выше, или его стереоизомерных смесей, диастереомерно обогащенных, диастереомерно чистых, энантиомерно обогащенных, или энантиомерно чистых изомеров, или фармацевтически приемлемых солей и пролекарств. Предпочтительным способом упомянутого непосредственно выше способа является способ, где указанным функциональным антагонистом соматостатина является альфа-2-адренергический агонист. Предпочтительным способом непосредственно упомянутого выше способа является способ, где указанный альфа-2-адренергический агонист выбран из группы, состоящей из клонидина,ксилазина и медетомидина. Предпочтительным способом упомянутого непосредственно выше способа является способ, где указанным соединением формулы I является соль L-винной кислоты 2-амино-N-[2-(3 а-(R)-бензил-2-метил-3 оксо-2,3,3 а,4,6,7-гексагидропиразоло-[4,3-с] пиридин-5-ил)-1-(R)-бензилоксиметил-2-оксоэтил]-изобутирамида. 14 Данное изобретение также относится к фармацевтическим композициям,которые включают в себя фармацевтически приемлемый носитель, некоторое количество альфа-2 адренергического агониста и некоторое количество соединения формулы I, такого, как определено выше, или его стереоизомерных смесей,диастереомерно обогащенных, диастереомерно чистых, энантиомерно обогащенных, или энантиомерно чистых изомеров, или его фармацевтически приемлемых солей и пролекарств. Кроме того, данное изобретение относится к способам лечения резистентности к инсулину у млекопитающего, при которых млекопитающему, нуждающемуся в этом, вводят эффективное количество рилизинг-пептида гормона роста, или миметика рилизинг-пептида гормона роста, или их фармацевтически приемлемой соли. В одном аспекте данное изобретение относится к способам, описанным ниже, где указывает на стереохимические центры. Способ получения соединения формулы k при котором соединение формулы g где Prt представляет собой защитную группу амина, в присутствии органического основания,реагента пептидного сочетания и инертного растворителя при температуре между примерно-78 и примерно -20 С с получением соединения формулы k. Предпочтительным способом упомянутого выше способа является способ, где реагентом пептидного сочетания является циклический ангидрид 1-пропанфосфоновой кислоты, соединение формулы g имеет R-конфигурацию, соединение формулы j имеет R-конфигурацию, а соединение формулы k имеет 3a-(R),1-(R)конфигурацию. Способ получения соединения формулы Z 16 при котором соединение формулы f при котором соединение формулы g в присутствии органического основания, реагента пептидного сочетания и инертного растворителя при температуре между примерно -78 и примерно -20 С с получением соединения формулы k с соединения формулы k удаляют защиту с получением соединения формулы l соединение формулы l подвергают взаимодействию с L-винной кислотой в спиртовом растворителе с получением соединения формулы Z. Предпочтительным способом упомянутого непосредственно выше способа является способ,где реагентом пептидного сочетания является циклический ангидрид 1-пропанфосфоновой кислоты, соединение формулы g имеет Rконфигурацию, соединение формулы j имеет Rконфигурацию, и каждое из соединений формулы k, l и Z имеет 3a-(R),1-(R)-конфигурацию. Способ получения соединения формулы g подвергают взаимодействию с основанием в инертном растворителе при температуре от примерно -50 до -10 С, где хиральность бензильной группы сохраняется, с получением соединения формулы g. Способ получения соединения формулы с при котором соединение формулы b где Prt представляет собой защитную группу амина, подвергают взаимодействию с неорганическим или органическим основанием и бензилбромидом в инертном растворителе с получением соединения формулы с. Способ получения соединения формулы f при котором соединение формулы е подвергают взаимодействию с L-винной кислотой в инертном органическом растворителе. Согласно данному изобретению предложены также смесь R,S-энантиомеров, Rэнантиомер или S-энантиомер соединения формулы где Prt представляет собой водород или защитную группу амина. Подробное описание изобретения В общем случае соединения формулы I или их стереоизомерные смеси, диастереомерно обогащенные, диастереомерно чистые, энантиомерно обогащенные, или энантиомерно чистые изомеры, или фармацевтически приемлемые соли и пролекарства, используемые в способах по настоящему изобретению, могут быть получены способами, которые включают в себя известные в химии способы. В приведенных выше структурных формулах и везде в настоящей заявке следующие термины имеют указанные значения, если специально не указано иначе. Подразумевается, что алкильные группы включают в себя алкильные группы обозначенной длины в либо неразветвленной, либо разветвленной конфигурации, которые возможно могут содержать двойные или тройные связи. Примерами таких алкильных групп являются метил, этил, пропил, изопропил, бутил, вторбутил, трет-бутил, пентил, изопентил, гексил,изогексил, аллил, этинил, пропенил, бутадиенил, гексенил и тому подобное. Когда в определении встречается обозначение С 0-алкил, то это означает простую ковалентную связь. Имеется в виду, что алкоксигруппы, которые определены выше, включают в себя алкоксигруппы обозначенной длины в либо неразветвленной, либо разветвленной конфигурации,которые возможно могут содержать двойные или тройные связи. Примерами таких алкоксигрупп являются метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, трет-бутокси,пентокси, изопентокси, гексокси, изогексокси,аллилокси, 2-пропинилокси, изобутенилокси,гексенилокси и тому подобное. Имеется в виду, что термин "галоген" или"галогено" включает в себя атомы галогенов фтора, хлора, брома и йода. Имеется в виду, что термин "галогенированный алкил" включает в себя алкильную группу, такую как определено выше, замещенную одним или более чем одним атомом галогена, таким как определено выше. Имеется в виду, что термин "галогенированный циклоалкил" включает в себя циклоалкильную группу, замещенную одним или более чем одним атомами галогена, такими как здесь определено выше. Имеется в виду, что термин "арил" включает в себя фенил и нафтил и ароматические 5 и 6-членные кольца с 1-4 гетероатомами или 18 конденсированные 5- или 6-членные бициклические кольца с 1-4 гетероатомами азота, серы или кислорода. Примерами таких гетероциклических ароматических колец являются пиридин,тиофен (также известный как тиенил), фуран,бензотиофен, тетразол, индол, N-метилиндол,дигидроиндол, индазол, N-формилиндол, бензимидазол, тиазол, пиримидин и тиадиазол. Рядовой химик признает, что некоторые комбинации гетероатомсодержащих заместителей, перечисленные в данном изобретении, определяют соединения, которые будут менее стабильными в физиологических условиях (например, соединения, содержащие ацетальную или аминальную связи). Соответственно, такие соединения являются менее предпочтительными. Выражение "пролекарство" относится к соединениям, которые являются предшественниками лекарства, которые после введения высвобождают лекарство in vivo через какой-то химический или физиологический процесс (например, пролекарство, которое при установлении физиологического рН превращается в требуемую форму лекарства). Типичные пролекарства при гидролизе высвобождают соответствующую свободную кислоту, и такие гидролизуемые сложный эфиробразующие остатки соединений по данному изобретению включают в себя, но не ограничиваются ими, карбоксильные заместители (например, R1 представляет собойR2 либо А 1 содержит карбоновую кислоту), где свободный водород заменен (С 1-С 4)алкилом,(С 2-С 12)алканоилоксиметилом, (С 4-С 9)-1-(алканоилокси)этилом,1-метил-1-(алканоилокси)этилом, имеющим от 5 до 10 атомов углерода,алкоксикарбонилоксиметилом, имеющим от 3 до 6 атомов углерода, 1-(алкоксикарбонилокси) этилом, имеющим от 4 до 7 атомов углерода, 1 метил-1-(алкоксикарбонилокси)этилом, имеющим от 5 до 8 атомов углерода, N(алкоксикарбонил)аминометилом, имеющим от 3 до 9 атомов углерода, 1-(N-(алкоксикарбонил) амино)этилом, имеющим от 4 до 10 атомов углерода, 3-фталидилом, 4-кротонолактонилом,гамма-бутиролактон-4-илом, ди-N,N-(С 1-С 2)алкиламино(С 2-С 3)алкилом (таким как -диметиламиноэтил), карбамоил-(С 1-С 2)алкилом, N,Nди(С 1-С 2)алкилкарбамоил-(С 1-С 2)алкилом и пиперидино-, пирролидино- или морфолино(С 2 С 3)алкилом. Другие типичные пролекарства высвобождают спирт формулы I, где свободный водород гидроксильного заместителя (например, R1 содержит гидроксил) заменен (С 1-С 6)алканоилоксиметилом, 1-C1-С 6)алканоилокси)этилом,1-метил-1-С 1-С 6)алканоилокси)этилом, (C1-С 6) алкоксикарбонилоксиметилом, N-(С 1-С 6)алкоксикарбониламинометилом, сукциноилом, (С 1-амино(С 1-С 4)алканоилом,С 6)алканоилом,арилацетилом и -аминоацилом или 19 аминоациламиноацилом, где указанные аминоацильные группировки независимо представляют собой любые существующие в природе L-аминокислоты, обнаруживаемые в белках,Р(O)(ОН)2, -Р(O)(O(С 1-С 6)алкил)2 или гликозил(радикал, являющийся результатом отрыва гидроксила полуацеталя углевода). Пролекарства соединений формулы I, где карбоксильная группа в карбоновой кислоте формулы I заменена сложноэфирной, могут быть получены присоединением карбоновой кислоты к соответствующему алкилгалогениду в присутствии основания, такого как карбонат калия, в инертном растворителе, таком как ДМФ, при температуре от примерно 0 до примерно 100 С в течение от примерно 1 до примерно 24 ч. Альтернативно, кислоту присоединяют к соответствующему спирту как растворителю в присутствии каталитического количества кислоты, такой как концентрированная серная кислота, при температуре от примерно 20 до 120 С, предпочтительно при температуре дефлегмации, в течение от примерно 1 до примерно 24 ч. Другой способ представляет собой взаимодействие кислоты в инертном растворителе, таком как ТГФ, с одновременным удалением воды физическим (например, ловушка Дина-Старка) или химическим (например, молекулярные сита) способами. Пролекарства соединений формулы I, где спиртовую функциональную группу преобразуют в эфирную, могут быть получены соединением спирта с соответствующим алкилбромидом или йодидом в присутствии основания, такого как карбонат калия, в инертном растворителе, таком как ДМФ, при температуре от примерно 0 до примерно 100 С в течение от примерно 1 до примерно 24 ч. Алканоиламинометиловые эфиры могут быть получены взаимодействием спирта с бис-(алканоиламино) метаном в присутствии каталитического количества кислоты в инертном растворителе, таком как ТГФ, согласно способу, описанному в патенте США 4997984. Альтернативно, эти соединения могут быть получены другими известными способами (Hoffman et al., J. Org. Chem. 1994, 59, p. 3530). В приведенной выше формуле некоторые определенные выше термины могут встречаться более чем один раз, и в таком случае каждый термин должен определяться независимо от другого. Везде в описании и в прилагаемой формуле изобретения использованы следующие сокращения со следующими значениями: БОК - трет-бутоксикарбонил БОФ - гексафторфосфат бензотриазол-1 илокситрис(диметиламино)фосфония БЗОК - бензилоксикарбонил КДИ - N,N'-карбонилдиимидазолHex - гексан ГАБТ - 1-гидрокси-7-азабензотриазол ГБТГ - гидроксибензотриазолгидрат ЖХВД - жидкостная хроматография высокого давления МГц - мегагерц МС - масс-спектр ЯМР - ядерный магнитный резонанс ПТГ - паратиреоидный гормон ТФУК - трифторуксусная кислота ТГФ - тетрагидрофуран ТСХ - тонкослойная хроматография РГТ - рилизинг-гормон тиреотропина ТХЭК - 2,2,2-трихлорэтоксикарбонил. Соединения, используемые в способе по настоящему изобретению, имеют, по меньшей мере, один асимметрический центр, обозначенный звездочкой в вышеупомянутой структурной формуле I. В молекуле могут присутствовать дополнительные асимметрические центры в зависимости от природы различных заместителей в молекуле. Каждый такой асимметрический центр будет давать два оптических изомера, и подразумевается, что все такие оптические изомеры, как индивидуальные, чистые или частично очищенные оптические изомеры, рацемические смеси или диастереомерные смеси,включены в объем настоящего изобретения. Обнаружено, что в случае наличия асимметрического центра, отмеченного звездочкой, абсолютная стереохимия более активного и поэтому более предпочтительного изомера, показана в формуле IA. Эта предпочтительная абсолютная конфигурация также применима к формуле Пространственная конфигурация ассиметрического центра с заместителем R4 в виде водорода соответствует конфигурацииDаминокислоты. В большинстве случаев эту конфигурацию обозначают так же как Rконфигурацию, несмотря на то, что она может изменяться в соответствии со значениями R3 иR4, используемыми в образовании R- или Sстереохимических конфигураций. Соединения формулы I, используемые в способах по настоящему изобретению, обычно выделяют в форме их фармацевтически приемлемых солей присоединения кислоты, таких как соли, полученные от использования минераль 21 ных и органических кислот. Примерами таких кислот являются соляная, азотная, серная, фосфорная, муравьиная, уксусная, трифторуксусная, пропионовая, малеиновая, янтарная, Dвинная, L-винная, малоновая, метансульфоновая кислота и тому подобное. Кроме того, некоторые соединения, содержащие кислотную функциональную группу, такую как карбоксигруппу,могут быть выделены в форме их неорганической соли, в которой противоположный ион может быть выбран из натрия, калия, лития,кальция, магния и тому подобного, а также из органических оснований. Фармацевтически приемлемые соли образуются взятием примерно 1 эквивалента соединения формулы I и приведением его в контакт с примерно 1 эквивалентом подходящей кислоты,которая соответствует требуемой соли. Смешивание веществ и выделение полученной соли хорошо известны рядовым специалистам в данной области. Настоящее изобретение охватывает в своем объеме фармацевтические композиции, содержащие в качестве активного ингредиента, по меньшей мере, одно из соединений формулы I в количестве, необходимом для лечения резистентности к инсулину, вместе с фармацевтически приемлемым носителем. Более того, настоящее изобретение охватывает в своем объеме фармацевтические композиции, содержащие в качестве активного ингредиента, по меньшей мере, один альфа-2-адренергический агонист и,по меньшей мере, одно из соединений формулыI вместе с фармацевтически приемлемым носителем. Возможно, фармацевтические композиции могут, кроме того, содержать анаболический агент в дополнение, по меньшей мере, к одному из соединений формулы I или другое соединение, которое проявляет другую активность, например антибиотический стимулятор роста, или с другими фармацевтически активными материалами, причем такая комбинация повышает эффективность и минимизирует побочные эффекты. Анализ на стимулирование высвобождения ГР из питуицитов крыс Соединения, которые обладают способностью стимулировать секрецию ГР из культивируемых клеток гипофиза крысы, идентифицируют используя следующую методику. Это испытание также является полезным для сравнения со стандартами в целях определения уровней доз. Клетки выделяют из гипофиза крыссамцов Wistar в возрасте 6 недель. После декапитации передние доли гипофиза помещают в холодный стерильный уравновешенный солевой раствор Хенка, не содержащий кальций или магний (HBSS). Ткани мелко измельчают, затем подвергают двум циклам ферментативного механического диспергирования, используя раствор бактериальной протеазы (ЕС 3.4.24.4,Sigma P-6141, St. Louis, Missouri) в HBSS с кон 002089 22 центрацией 10 ед./мл. Смесь ткань-фермент перемешивают во вращающейся колбе со скоростью 30 об./мин в атмосфере, содержащей 5%CO2, примерно при 37 С в течение примерно 30 мин с тритурацией вручную примерно через 15 мин и в течение примерно 30 мин, используя 10 мл пипетку. Смесь центрифугируют при 200g в течение примерно 5 мин. К надосадочной жидкости для нейтрализации избытка протеазы добавляют лошадиную сыворотку (конечная концентрация 35%). Осадок ресуспендируют в свежем растворе протеазы (10 ед./мл), снова перемешивают в течение примерно 30 мин в предыдущих условиях и наконец тритурируют вручную через иглу 23 размера. Снова добавляют лошадиную сыворотку (конечная концентрация 35%), затем клетки из обоих гидролизатов объединяют, осаждают центрифугированием (200g в течение 15 мин), ресуспенидруют в культуральной среде (модифицированной по способу Дульбекко среде Игла (D-MEM) с добавлением 4,5 г/л глюкозы, 10% лошадиной сыворотки, 2,5% сыворотки плода коровы, 1% заменимых аминокислот, 100 ед./мл нистатина и 50 мг/мл сульфата гентамицина, Gibco, grandIsland, New York) и подсчитывают. Клетки засевают в количестве 6,0-6,5104 клеток на см 2 в 48-луночные чашки Costar (Cambridge, Massachusetts) и культивируют в течение 3-4 дней в культуральной среде. Непосредственно перед до анализом на секрецию ГР лунки для культивирования два раза промывают средой высвобождения, затем уравновешивают в течение примерно 30 мин в среде высвобождения (D-МЕМ, забуференной 25 мМ HEPES, рН 7,4 и содержащей 0,5% бычьего сывороточного альбумина при 37 С). Тестируемые соединения растворяют в ДМСО, затем разводят в предварительно нагретой среде высвобождения. Каждый анализ проводят четыре раза. Анализ инициируют добавлением 0,5 мл среды высвобождения (с носителем или тестируемым соединением) в каждую культуральную лунку. Культивирование проводят примерно при 37 С в течение примерно 15 мин, а затем завершают, удаляя среду высвобождения, которую центрифугируют при 2000g в течение примерно 15 мин для удаления клеточного материала. Концентрации гормона роста крыс в надосадочных жидкостях определяют по стандартной методике радиоиммунного анализа,описанной ниже. Измерение гормона роста крыс Концентрации гормона роста крысы определяют двойным радиоиммуным анализом антител с использованием эталонного препарата гормона роста крысы (NIDDK-rGH-RP-2) и антисыворотки гормона роста крысы, выращенного в обезьяне (NIDDK-anti-rGH-S-5), полученной от Dr. A. Parlow (Harbor-UCLA Medical 23 роста крысы (1,5 ед./мг, G2414, Scripps Labs,San Diego, CA) йодируют до удельной активности приблизительно 30 мкКи/мкг хлорамин Тметодом для использования в качестве индикатора. Иммунные комплексы получают, добавляя к IgG обезьяны (ICN/Cappel, Aurora, ОН) козью сыворотку и полиэтиленгликоль, ММ 1000020000, до конечной концентрации 4,3%; извлечение осуществляют центрифугированием. Этот образец имеет рабочий предел вышеупомянутых базальных уровней 0,08-2,5 мкг ГР крысы на пробирку. Анализ на экзогенно-стимулированное высвобождение гормона роста у крысы после внутривенного введения испытуемых соединений Крыс-самок Sprague-Dawley в возрасте двадцать один день (Charles River laboratory,Wilmington, MA) оставляют акклиматизироваться к местным условиям вивария (24 С, цикл: 12 ч - свет, 12 ч - темнота) в течение приблизительно 1 недели до испытания соединения. Всем крысам оставляют доступ к воде и покупному пищевому рациону в виде пилюль (AgwayCountry Food, Syracuse, NY) ad libitum. Эксперименты проводят в соответствии с указаниями Национального института здоровья по содержанию и использованию лабораторных животныхAnimals). В день эксперимента тестируемые соединения растворяют в носителе, содержащем 1% этанола, 1 мМ уксусную кислоту и 0,1% бычий сывороточный альбумин в солевом растворе. Каждый эксперимент проводят на трех крысах. Крыс взвешивают и анестезируют внутрибрюшинной инъекцией пентобарбитала натрия(Nembutol, 50 мг/кг веса тела). Через 14 мин после введения анестезирующего агента берут образец крови, отрезая кончик хвоста и оставляя кровь капать в микроцентрифужную пробирку(базовый образец крови, приблизительно 100 мкл). Через 15 мин после введения анестезирующего агента испытуемое соединение доставляют внутривенной инъекцией в хвостовую вену суммарным объемом 1 мл/кг веса тела. Дополнительные образцы крови берут из хвоста через 5, 10 и 15 мин после введения соединения. Образцы крови держат во льду до отделения сыворотки центрифугированием (1430g в течение 10 мин при 10 С). Сыворотку хранят при-80 С до определения сывороточного гормона роста радиоиммунным анализом, описанным выше. Оценка экзогенно-стимулированного высвобождения гормона роста у собаки после перорального введения В день введения дозы испытуемое соединение отвешивают для соответствующей дозы и растворяют в воде. Дозы объемом 0,5-3 мл/кг доставляют 2-4 собакам в течение каждого режима дозирования через желудочный зонд. Об 002089 24 разцы крови (5 мл) отбирают прямой венoпункцией яремной вены перед дозированием и через 0,17, 0,33, 0,5, 0,75, 1, 2, 4, 6, 8 и 24 ч после введения, используя 5 мл вакунтейнеры,содержащие литиевый гепарин. Приготовленную плазму хранят при -20 С до анализа. Измерение собачьего гормона роста Концентрации собачьего гормона роста определяют по стандартной методике радиоиммунного анализа с использованием собачьего гормона роста (антигена для йодирования и эталонного препарата AFP-1983B) и антисыворотки собачьего гормона роста, выращенной в обезьяне (AFP-21452578), полученной от Dr. A.Parlow (Harbor-UCLA Medical Center, Тоrrenсе,СА). Индикатор создают хлорамин Т-йодированием собачьего гормона роста до удельной активности 20-40 мкКи/мкг. Иммунные комплексы получают, добавляя к IgG обезьяны(ICN/Cappel, Aurora, ОН) козью сыворотку и полиэтиленгликоль, ММ 10000-20000, до конечной концентрации 4,3%; извлечение осуществляют центрифугированием. Этот образец имеет рабочий предел 0,08-2,5 мкг ГР собаки/пробирку. Оценка уровней собачьего гормона роста и инсулиноподобного фактора роста 1 у собаки после постоянного перорального введения Собаки получают тестируемое соединение ежедневно в течение либо 7, либо 14 дней. В каждый из этих дней испытуемое соединение отвешивают для соответствующей дозы и растворяют в воде. Дозы, объемом 0,5-3 мл/кг, доставляют 5 собакам в течение каждого режима дозирования через желудочный зонд. Образцы крови отбирают в день 0, 3, 7, 10 и 14. Образцы крови (5 мл) получают прямой венепункцией яремной вены перед дозированием и через 0,17,0,33, 0,5, 0,754, 1, 2, 3, 6, 8, 12 и 24 ч после введения в день 0, 7 и 14, используя 5 мл вакунтейнеры, содержащие литиевый гепарин. Кроме того, кровь отбирают перед дозированием и в 8 ч в день 3 и 10. Приготовленную плазму хранят при -20 С до анализа. Исследование крыс-самок Данное исследование позволяет оценить эффект постоянной обработкиGHRPмиметиком на вес, структуру тела и неголодную концентрацию глюкозы, инсулина,лактата и липидов в плазме у крыс-самок с дефицитом эстрогена и избытком эстрогена. Сильную чувствительность сывороточных уровней ГР к внутривенному введению высвобождающего ГР агента определяют в последний день дозирования. Вес тела контролируют еженедельно в течение всего периода обработки; дополнительно в конце обработки определяют структуру тела и уровни глюкозы, инсулина,лактата, холестерина и триглицеридов в плазме. Девственных интактных крыс-самок Sprague-Dawley получают из лаборатории CharlesRiver Laboratories (Wilmington, MA) и подвер 25 гают билатеральной овариэктомии (Ovx) или мнимой операции (Sham) в возрасте приблизительно 12 недель. Для мнимой операции яичники извлекают наружу и помещают обратно в брюшную полость. После операции крыс размещают по отдельным клеткам размером 20 см 32 см 20 см в стандартных условиях вивария(примерно 24 С при следующем цикле: примерно 12 ч свет/12 ч темнота). Всем крысам оставляют свободный доступ к воде и покупному пищевому рациону в виде пилюль (Agway ProLab 3000, Agway Country Food, Inc., Syracuse,NY). Эксперимент проводят в соответствии с указаниями Национального Института Здоровья по содержанию и использованию лабораторных животных (NIH Guidelines for the Care and Use ofSham- и Ovx-крыс через приблизительно 7 месяцев после операции взвешивают и произвольно распределяют по группам. Ежедневно крысам перорально вводят дозу 0,5 мг/кг или 5 мг/кг высвобождающего гормон роста агента в 1 мл любого из двух растворителей (1%-ный раствор этанола в дистиллированной-деионизированной воде) в течение 90 дней при помощи желудочного зонда. Крыс взвешивают еженедельно в продолжение всего исследования. Через двадцать четыре часа после последней пероральной дозы по следующей ниже методике определяют острую чувствительность сывороточного ГР к тестируемому соединению. Крыс анестезируют пентобарбиталом натрия (50 мг/кг). Анестезированных крыс взвешивают и из хвостовой вены отбирают базовый образец крови (100 мкл). Затем внутривенно через хвостовую вену вводят тестируемый агент (высвобождающий гормон роста агент или носитель) в 1 мл. Через приблизительно 10 мин после инъекции из хвоста отбирают второй 100 мкл образец крови. Кровь оставляют свертываться примерно при 4 С, затем центрифугируют при 2000g в течение примерно 10 мин. Сыворотку хранят при примерно -70 С. Концентрации сывороточного гормона роста определяют радиоиммунным анализом, описанным ранее. Следуя этой методике все тело каждой анестезированной крысы подвергают сканированию при помощи двухэнергетической рентгеновской абсорбциометрии (DEXA, Hologic QDR 1000/W,Walthman МА). Конечные образцы крови отбирают кардиальной пункцией в гепаринизированные пробирки. Плазму отделяют центрифугированием и хранят замороженной так, как это описано выше. Инсулин плазмы определяют радиоиммунным анализом с использованием набора Binax Corp. (Portland, Maine). Коэффициент отклонения результатов анализа составляет 10%. Уровни плазменных триглицеридов, полного холестерина, глюкозы и лактата измеряют с использованием Abbott VP и VP Super SystemAutoanalyzer (Abbott Laboratories, Irving, Texas),с использованием систем A-Gent тестреагентов на триглицериды, холестерин и глюкозу, и лактатного набора Sigma, соответственно. Плазменные инсулин, триглицериды, полный холестерин и лактат, которые понижают активность рилизинг-пептида гормона роста(GHRP) или GHRP-миметика, такого как соединение формулы I, определяют статистическим анализом (непарный т-тест) у контрольной группы, обработанной носителем. Соединения формулы I, используемые в способе по данному изобретению, можно вводить пероральным, парентеральным (например,внутримышечной, внутрибрюшинной, внутривенной или подкожной инъекцией или имплантацией), назальным, вагинальным, ректальным,подъязычным или наружным путями введения,и фармацевтические препараты могут быть приготовлены с использованием фармацевтически приемлемых носителей для обеспечения получения лекарственных форм, соответствующих каждому пути введения. Твердые лекарственные формы для перорального введения включают в себя капсулы,таблетки, пилюли, порошки и гранулы. В таких твердых лекарственных формах активное соединение смешано, по меньшей мере, с одним инертным фармацевтическим носителем, таким как сахароза, лактоза или крахмал. Такие лекарственные формы могут содержать так же, как это имеет место в обычной практике, дополнительные вещества, отличные от таких инертных разбавителей, например связывающие агенты,такие как стеарат магния. В случае капсул, таблеток и пилюль лекарственные формы могут содержать также буферные агенты. Таблетки и пилюли, кроме того, могут быть приготовлены с энтеральными покрытиями. Жидкие лекарственные формы для перорального введения включают в себя фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы, эликсиры, содержащие инертные разбавители, обычно используемые на практике, например воду. Кроме таких инертных разбавителей, композиции также могут включать в себя адъюванты, такие как смачивающие агенты, эмульгаторы и суспендирующие агенты, и подсластители, корригенты и ароматизаторы. Препараты по данному изобретению для парентерального введения включают в себя стерильные водные или неводные растворы, суспензии или эмульсии. Примерами неводных растворителей или носителей являются пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло и кукурузное масло, желатин и сложные органические эфиры для инъекций, такие как этиловый эфир олеиновой кислоты. Такие лекарственные формы также могут содержать адъюванты, такие как консерванты, эмульгаторы, смачивающие и диспер 27 гирующие агенты. Они могут быть простерилизованы, например, фильтрованием через фильтр,удерживающий бактерии, включением стерилизующих агентов в композиции, облучением композиций или нагреванием композиций. Их также можно готовить в форме стерильных твердых композиций, которые непосредственно перед применением можно растворять в стерильной воде или некоторых других стерильных средах для инъекции. Композициями для ректального или вагинального введения предпочтительно являются суппозитории, которые могут содержать, кроме активного вещества, эксципиенты, такие как масло какао или суппозиторный воск. Композиции для подъязычного введения или через нос также готовят с использованием стандартных хорошо известных эксципиентов. Доза активного ингредиента в композициях по данному изобретению может изменяться; однако, необходимо, чтобы количество активного ингредиента было таким, чтобы получить соответствующую лекарственную форму. Выбранная доза зависит от требуемого терапевтического эффекта, от пути введения и от продолжительности лечения. Обычно человеку или другим животным, например млекопитающим,для получения эффективного высвобождения гормона роста ежедневно вводят уровни доз между 0,0001 и 100 мг/кг веса тела. Предпочтительный диапазон доз для человека составляет от 0,01 до 5,0 мг/кг веса тела в сутки, причем эти дозы можно вводить в виде однократной дозы или в виде разделенной многократной дозы. Предпочтительный диапазон доз для животных, отличных от человека, составляет от 0,01 до 10,0 мг/кг веса тела в сутки, причем эти дозы можно вводить в виде однократной дозы или в виде разделенной многократной дозы. Наиболее предпочтительный диапазон доз для животных, отличных от человека, составляет от 0,1 до 5 мг/кг веса тела в сутки, причем эти дозы можно вводить в виде однократной дозы или в виде разделенной многократной дозы. Получение соединений формулы I, используемых в способе по настоящему изобретению,можно проводить последовательными или конвергентными путями синтеза. Синтезы, подробно описывающие получение соединений формулы I последовательным способом, представлены на схемах реакций, приведенных ниже. Коммерчески доступными являются многие защищенные производные аминокислот,например, где защитные группы Prt, Z100 и Z200 представляют собой БОК, БЗОК, бензильную,этоксикарбонильную, СF3 С(О)-, ФМОК, ТХЭК,тритильную или тозильную группы. Другие защищенные производные аминокислот могут быть получены способами, известными из литературы. Некоторые 3-оксо-2-карбоксильные пирролидины и 4-оксо-3-карбоксильные пипе 002089 28 ридины коммерчески доступны, а многие другие родственные пирролидины и 4-замещенные пиперидины известны из литературы. Многие из схем, представленных ниже,описывают соединения, которые содержат защитные группы Prt, Z100 и Z200. Бензилоксикарбонильные группы могут быть удалены целым рядом способов, в том числе каталитическим гидрированием в присутствии палладиевого или платинового катализатора в протонном растворителе, таком как метанол. Предпочтительными катализаторами являются гидроксид палладия на угле или палладий на угле. Можно использовать давление водорода от 6,9 до 6894,8 кПа (11000 фунт/кв. дюйм); предпочтительным является давление от 68,9 до 482,6 кПа (10-70 фунт/кв. дюйм). Альтернативно, бензилоксикарбонильная группа может быть удалена обменным гидрированием. Удаление БОК защитных групп можно проводить с использованием сильной кислоты,такой как трифторуксусная кислота или соляная кислота, в присутствии или в отсутствии сорастворителя, такого как дихлорметан, этилацетат,эфир или метанол, при температуре от примерно -30 до 70 С, предпочтительно от примерно -5 до примерно 35 С. Бензилэфирные защитные группы аминов могут быть удалены рядом способов, в том числе каталитическим гидрированием водородом в присутствии палладиевого катализатора в протонном растворителе, таком как метанол. Можно использовать давление водорода от 6,9 до 6894,8 кПа (1-1000 фунт/кв. дюйм); предпочтительным является давление от 68,9 до 482,6 кПа(10-70 фунт/кв. дюйм). Присоединение и удаление этих и других защитных групп обсуждается в литературе (Т. Greene, Protective Groups in Organic Synthesis, John WileySons, New York,1981). Схема 1 Схема 1. Защищенные производные аминокислот 1 во многих случаях коммерчески дос 29 тупны, например те, у которых защитная группаPrt представляет собой группы БОК, ФМОК или БЗОК. Другие аминокислоты могут быть получены известными способами. Как показано на схеме 1, реакцию сочетания аминов формулы 2 с защищенными аминокислотами формулы 1, где Prt представляет собой соответствующую защитную группу, удобно проводить в инертном растворителе, таком как дихлорметан или ДМФ, при помощи реагента сочетания, такого как ЭКД или ДЦК, в присутствии ГБТГ или ГАБТ. В случае, если амин присутствует в форме гидрохлоридной соли, в реакционную смесь предпочтительно добавлять один или два эквивалента подходящего основания, такого как триэтиламин. Альтернативно,реакцию сочетания можно осуществлять с использованием реагента сочетания, такого как БОФ, в инертном растворителе, таком как метанол. Такие реакции сочетания обычно проводят при температурах от примерно -30 до примерно 80 С, предпочтительно от -10 до примерно 25 С. Другие условия пептидного сочетания описаны в литературе (Houben-Weyl, Vol. XV,part II, Е. Wunsch, Ed., George Theime Verlag,1974, Stuttgart). Отделение нежелательных побочных продуктов и очистку промежуточных соединений успешно осуществляют хроматографией на силикагеле, используя флэшхроматографию (W.C. Still, М. Kahn and A. Mitra, J. Org. Chem., 43, 2923, 1978), кристаллизацией или тритурацией. Соединения формулы 3 могут быть превращены в промежуточные соединения формулы 4 путем удаления защитной группы Prt, как описано выше. Реакция сочетания промежуточных соединений формулы 4 с аминокислотой формулы 5 может быть осуществлена так, как описано выше, с получением промежуточных соединений формулы 6. Удаление защитной группы с амина 6 приводит к получению соединений формулы 7. Схема 2 Схема 2. Альтернативно, соединения формулы 7 могут быть получены конвергентным путем, как показано на схеме 2. Промежуточные 30 сложные эфиры формулы 8 могут быть получены обработкой аминокислот 1, где Prt представляет собой соответствующую защитную группу,основанием, таким как карбонат калия, а затем алкилгалогенидом, таким как йодметан, в подходящем растворителе, таком как ДМФ. Удаление защитной группы с амина превращает 8 в 9. Альтернативно, многие аминокислоты формулы 9 являются коммерчески доступными. Промежуточное соединение 10 получают реакцией сочетания соединения 9 с аминокислотой 5. Промежуточный сложный эфир 10 может быть превращен в промежуточную кислоту 11 известными способами. Например, метиловые или этиловые сложные эфиры могут быть гидролизованы гидроксидом лития в протонном растворителе, таком как водный метанол или водный ТГФ, при температуре от примерно -20 до 120 С, предпочтительно от примерно 0 до 50 С. Кроме того, бензильную группу можно удалить известными в данной области восстановительными способами, в том числе гидрированием в присутствии платинового или палладиевого катализатора в протонном растворителе, таком как метанол. Затем кислоту 11 можно подвергнуть реакции сочетания с амином 2 с получением промежуточных соединений формулы 6. Превращение соединения 6 в соединение 7 можно успешно выполнить путем удаления защитной группы Z200. Схема 3 Схема 3. Сложные эфиры формулы 6 могут быть превращены в промежуточные кислоты формулы 13 известными способами. Например, метиловые или этиловые сложные эфиры можно подвергнуть гидролизу гидроксидом лития в протонном растворителе, таком как водный метанол или водный ТГФ, при температуре от примерно -20 до 120 С, предпочтительно от примерно 0 до 50 С. Кроме того, бензильная группа может быть удалена восстановительными способами, в том числе гидрированием в 31 присутствии платинового или палладиевого катализатора в протонном растворителе, таком как метанол. Реакция сочетания кислоты 13 с амином 16 приводит к получению промежуточных соединений формулы 14. Превращение соединений 14 в соединения 15 можно успешно выполнять путем удаления защитной группы Z200. Схема 4 Схема 4. Сложные эфиры формулы 17 могут быть получены обработкой кислоты формулы 5 гидроксисукцинимидом в присутствии связующего агента, такого как ЭКД, в инертном растворителе, таком как метиленхлорид, как показано на схеме 4. Обработка сложного эфира 17 аминокислотой формулы 1 в растворителе,таком как диоксан, ТГФ или ДМФ, в присутствии основания, такого как диизопропилэтиламин, приводит к образованию соединений 11. Схема 5 Схема 5. Как показано на схеме 5, алкилирование дифенилоксазинона формулы 18 циннамилбромидом в присутствии бис(триметилсилил)амида натрия приводит к получению соединения 19, которое затем превращают в требуемую (D)-2-амино-5-фенилвалериановую кислоту 20 путем удаления защитной группы (Prt) и гидрирования над катализатором PdCl2. Схема 6 Схема 6. Обработка сложного эфира формулы 21 основанием, таким как гидрид натрия,в растворителе, таком как ДМФ, а затем алкил 002089 32 галогенидом 22, приводит к получению соединения формулы 23, как показано на схеме 6. Обработка соединения формулы 23 гидразином формулы 24, таким как гидразин или метилгидразин, в растворителе, таком как этанол, при нагревании с обратным холодильником с последующим концентрированием и нагреванием остатка в толуоле при температуре образования флегмы или близкой к этому значению приводит к получению соединения формулы 25. Альтернативно, 23 можно обрабатывать солью гидразина в присутствии ацетата натрия в этаноле при нагревании с обратным холодильником с получением 25. Удаление защитной группы с амина приводит к получению соединения формулы 28. Тиоамиды формулы 26 могут быть образованы обработкой 25 реагентом Лавессона в флегмообразующем толуоле или бензоле. Удаление защитной группы превращает соединения 26 в соединения 27. Схема 7 Схема 7. Обработка соединения формулы 21 гидразином формулы 24 в растворителе, таком как этанол, при нагревании с обратным холодильником, с последующим концентрированием и нагреванием остатка в толуоле при температуре образования флегмы или близкой к этому значению приводит к получению соединений формулы 29. Альтернативно, соединения 21 можно обрабатывать солью гидразина в присутствии ацетата натрия в этаноле при нагревании с обратным холодильником с получением соединения 29. Амид формулы 29 можно обрабатывать основанием, таким как гидрид натрия,в растворителе, таком как ДМФ, а затем алкилгалогенидом с получением соединений 25. Удаление защитной группы с амина приводит к получению соединения формулы 28. Схема 8. Взаимодействие сложного кетоэфира формулы 30 с хиральным амином, таким как альфа-метилбензиламин, и подходящим альдегидом, таким как формальдегид, или взаимодействие сложного винилового кетоэфира формулы 31 с хиральным амином, таким как альфа-метилбензиламин, и подходящим альдегидом, таким как формальдегид, приводит к получению соединения формулы 32 через двойную реакцию Манниха. Взаимодействие соединения 32 с гидразином приводит к получению хирального соединения формулы 33. Удаление защитной группы с азота с использованием водорода и подходящего катализатора, такого как палладий, приводит к получению соединения формулы 34. Схема 9 34 Схема 9. Обработка соединения формулы 81 восстановителем, таким как борогидрид натрия, и защита азота приводит к получению соединения формулы 34. Защита спирта приводит к получению соединения 83. Омыление сложного эфира приводит к получению соединения формулы 84. Взаимодействие соединения 84 с тионилхлоридом с последующей обработкой диазометаном приводит к получению гомологичной кислоты формулы 85. Этерификация кислоты 85 приводит к получению соединения формулы 86, с которого удаляют O-защитную группу с получением соединения 87. Окисление соединения 87 приводит к получению кетона формулы 88. Взаимодействие кетона 88 с гидразином с последующим удалением защитной группы с азота приводит к получению соединения формулы 44. Схема 10 Схема 10. Обработка соединения формулы 35 основанием, таким как гидрид натрия, в растворителе, таком как ДМФ, а затем диэтилкарбонатом приводит к получению сложного этилового эфира формулы 36. Удаление защитной группы с амина превращает соединение 36 в соединение 37. Схема 11 Схема 11. Обработка сложного эфира малоновой кислоты формулы 38 основанием, таким как гидрид натрия, в растворителе, таком как ДМФ, с последующим гидрогенолизом бензильной группы с использованием водорода и катализатора, такого как палладий, в подходящем растворителе, таком как метанол, приводит к получению сложного эфира формулы 39. Удаление защитной группы с амина приводит к получению соединений формулы 40. Схема 12. Обработка кетона формулы 41 вторичным амином, таким как пиперидин, в подходящем растворителе, таком как бензол, с удалением воды приводит к получению енамина формулы 42. Алкилирование енамина сложным альфа-галогенэфиром, таким как этилбромацетат, в подходящем растворителе, таком как бензол или ТГФ, с использованием подходящего основания, такого как лаурилдиэтаноламид(ЛДА) или NaN(SiМе 3)2 приводит к получению сложного кетоэфира формулы 43. Взаимодействие с гидразином формулы 24 приводит к получению соединения формулы 44. Удаление защитной группы с азота приводит к получению соединений формулы 45. Схема 14. Обработка сложного кетоэфира формулы 37 олефином, таким как акрилонитрил, приводит к получению сложного кетоэфира формулы 49. Взаимодействие кетоэфира 49 с гидразином приводит к получению соединения формулы 50. Удаление защитной группы с азота приводит к получению соединений формулы 51. Схема 15 Схема 13. Обработка сложного кетоэфира формулы 37 солью йодония, такой как трифторацетат дифенилйодония, в подходящем растворителе, таком как трет-бутанол, приводит к получению сложного кетоэфира формулы 46. Взаимодействие 46 с гидразином приводит к получению соединения формулы 47. Удаление защитной группы с азота приводит к получению соединений формулы 48. Подробно этот синтез описан в Synthesis, (9), 1948, р.709. Схема 15. Обработка сложного кетоэфира формулы 37 аллилбромидом и подходящим основанием, таким как гидрид натрия, в подходящем растворителе, таком как ДМФ, приводит к получению сложного кетоэфира формулы 52. Взаимодействие кетоэфира 52 с гидразином приводит к получению соединения формулы 53. Озонолиз соединения 53 в подходящем растворителе, таком как метиленхлорид, с последующей обработкой восстановителем, таким как диметилсульфид, приводит к получению альдегида формулы 54. Окисление альдегида 54 приводит к получению карбоновой кислоты формулы 55. Перегруппировка Куртиуса кислоты 55 с последующим гидролизом промежуточного изоцианата приводит к получению первичного 37 амина формулы 56. Обработка соединения формулы 56 изоцианатом или карбаматом приводит к получению мочевины формулы 57. Удаление защитной группы с азота приводит к получению соединений формулы 58. Схема 18. Обработка соединения формулы 63 фосфином, таким как трифенилфосфин, азосоединением, таким как диэтилазодикарбоксилат (ДЭАД), и оксииндолом приводит к получению соединения формулы 66. Удаление защитной группы с азота приводит к получению соединения формулы 67. Схема 19 Схема 16. Обработка соединения формулы 54 первичным амином приводит к получению имина формулы 59. Восстановление соединения формулы 59 приводит к получению соединения формулы 60. Обработка соединения формулы 60 ацилирующим агентом приводит к получению соединения формулы 61. Удаление защитной группы с азота приводит к получению соединений формулы 62. Схема 17 Схема 17. Обработка соединения формулы 54 восстановителем, таким как борогидрид натрия, приводит к получению соединения формулы 63. Взаимодействие 63 с ацилирующим агентом, таким как изоцианат или карбамат,приводит к получению соединений формулы 64. Удаление защитной группы с азота приводит к получению соединений формулы 65. Схема 19. Обработка сложного кетоэфира формулы 37 хиральным диолом и кислотным катализатором с удалением воды в подходящем растворителе, таком как бензол, приводит к получению хирального кеталя формулы 68. Алкилирование кеталя 68 алкилгалогенидом в присутствии основания, такого как ЛДА, с последующим гидролизом кеталя в присутствии кислоты в качестве катализатора приводит к получению хиральных сложных кетоэфиров формулы 69. Взаимодействие кетоэфиров 69 с гидразином приводит к получению хиральных соединений формулы 70. Удаление защитной группы с азота приводит к получению соединений формулы 71. Схема 20. Обработка сложного кетоэфира формулы 37 хиральным сложным эфиром аминокислоты, таким как трет-бутиловый эфир валина, приводит к получению хирального енамина формулы 72. Алкилирование 72 алкилгалогенидом в присутствии основания, такого как ЛДА, с последующим гидролизом енамина в присутствии кислоты в качестве катализатора приводит к получению хиральных сложных кетоэфиров формулы 69. Взаимодействие кетоэфиров 69 с гидразином приводит к получению хиральных соединений формулы 70. Удаление защитной группы с азота приводит к получению соединений формулы 71. Схема 21 Схема 21. Удаление защитной группы с азота соединения 25 приводит к получению соединений формулы 28. Реакция образования 40 соли 28 с хиральной кислотой приводит к получению смеси диастереомерных солей формулы 73. Кристаллизация диастереомерных солей приводит к получению кислой соли хиральных соединений формулы 70. При разложении соли 70 основанием высвобождаются хиральные соединения формулы 71. Схема 22 Схема 22. Алкилирование соединений формулы 25 аллилацетатом в присутствии подходящего катализатора, такого как тетракис(трифенилфосфин)палладий, приводит к получению соединений формулы 74. Удаление защитной группы с азота приводит к получению соединений формулы 75. Подробно этот синтез описан в Tetrahedron (50), р.515, 1994. Схема 23 Схема 23. Обработка сложного кетодиэфира формулы 76 алкилгалогенидом в присутствии основания, такого как гидрид натрия, с последующим гидролизом в присутствии кислоты в качестве катализатора, декарбоксилированием и этерификацией метилйодидом и подходящим основанием приводит к получению соединения формулы 77. Взаимодействие соединения формулы 77 с подходящим альдегидом, таким как формальдегид, и бензиламином приводит к по 41 лучению соединения формулы 78. Взаимодействие соединения формулы 78 с гидразином приводит к получению хиральных соединений формулы 79. Удаление защитной группы с азота приводит к получению соединений формулы 80. Схема 24 Схема 24. Обработка амина формулы 23 кислотой формулы 11 в инертном растворителе,таком как дихлорметан или ДМФ, при помощи реагента сочетания, такого как ЭКД или ДЦК, в присутствии ГБТГ приводит к получению соединений формулы 89. Взаимодействие соединений формулы 89 с гидразином приводит к получению соединений формулы 6. Удаление защитной группы с азота приводит к получению соединений формулы 7. Схема 25 Схема 25. Обработка этилового эфира гидроксиацетоуксусной кислоты формулы 90 алкилгалогенидом в присутствии подходящего основания, такого как гидрид натрия, приводит к получению соединений формулы 91. Взаимодействие 91 с гидразином приводит к получению соединений формулы 92. O-Алкилирование карбонильного кислорода 92 приводит к полу 002089 42 чению соединений 93, которые превращают в галогенид 94. Замещение галогена Х цианогруппой приводит к получению нитрила 95. Восстановление нитрила 95 дает первичный амин 96, с которого снимают защитную группу и который подвергают циклизации в присутствии формальдегида с получением соединений 28. Схема 26 Схема 26. Обработка защищенного эфира бета-кетоаминовалериановой кислоты, такого как 97, алкилгалогенидом в присутствии подходящего основания, такого как гидрид натрия,приводит к получению соединений формулы 98. Взаимодействие соединений формулы 98 с гидразином приводит к получению соединений формулы 99. Удаление защитной группы с соединений формулы 99 приводит к получению первичных аминов формулы 100. Циклизация соединений формулы 100 в присутствии формальдегида приводит к получению соединений формулы 28. Схема 27 Схема 27. Обработка амина формулы 23 а кислотой, такой как кислота 1, в присутствии 43 ЭКД или ГБТГ в подходящем растворителе обеспечивает получение сложных кетоэфиров формулы 23b. Сложный кетоэфир 23b можно обрабатывать солью гидразина в присутствии ацетата натрия в флегмообразующем этаноле с получением гидразинов формулы 23 с. Удаление защитной группы в подходящих условиях дает амины формулы 4. Реакцию сочетания промежуточных соединений формулы 4 с аминокислотами формулы 5 можно осуществлять так, как описано выше, с получением промежуточных соединений формулы 6. Удаление защитной группы с амина 6 приводит к получению соединений формулы 7. Схема 28 Схема 28. Prt представляет собой защитную группу амина, которая хорошо известна специалистам в данной области. БОК использован как Prt для того, чтобы показать предпочтительную защитную группу, однако, использование БОК не следует рассматривать, как ограничение объема данного описания. Кроме того,хотя на схеме представлен синтез соединения формулы m с использованием конкретных изомеров, другие изомеры и/или смеси изомеров также находятся в объеме настоящего описания. Стадия А. К раствору гидрохлорида этилового эфира 4-оксопиперидин-3-карбоновой кислоты в инертном органическом растворителе, таком как изопропиловый эфир (ИПЭ), ТГФ, метиленхлорид и EtOAc, с или без воды в качестве сорастворителя, предпочтительно в ИПЭ и воде, добавляют неорганическое или органическое основание, такое как триэтиламин (ТЭА), диметиламинопиридин (ДМАП), гидроксид или карбонат, предпочтительно ТЭА, с последующей защитой аминогруппы, предпочтительно (БОК)2 О. Смесь перемешивают в течение примерно 1-24 44 ч, предпочтительно в течение ночи, предпочтительно в атмосфере азота. Органическую фазу отделяют и обрабатывают в соответствии со стандартными методиками, известными специалистам в данной области, и концентрируют с получением требуемого продукта в виде кристаллов. Стадия Б. К раствору 1-трет-бутил-3-этилового эфира 4-оксопиперидин-1,3-дикарбоновой кислоты в органическом растворителе, таком как ТГФ,ИПЭ, спирт, ДМФ или ДМСО, предпочтительно ДМФ, добавляют неорганическое или органическое основание, такое как ТЭА, ДМАП, гидроксид или карбонат, предпочтительно карбонат лития, а затем бензилбромид. Смесь нагревают до примерно 25-100 С, предпочтительно 60 С, и перемешивают в течение примерно 1-24 ч,предпочтительно 20 ч. Затем реакционную смесь охлаждают до комнатной температуры и экстрагируют органическим растворителем,таким как ИПЭ, толуол, ТГФ или EtOAc, и обрабатывают в соответствии со стандартными методиками, известными специалистам, с получением требуемого соединения. Стадия В. К раствору 1-трет-бутил-3-этилового эфира 3-бензил-4-оксопиперидин-1,3-дикарбоновой кислоты в органическом растворителе, таком как спирт, ТГФ или толуол, добавляют метилгидразин, а затем кислоту, такую как серная кислота, HCl, АсОН или TsOH, предпочтительно уксусную кислоту, при температуре от примерно 0 С до комнатной. Реакционную смесь медленно нагревают до примерно 40-100 С,предпочтительно до примерно 65 С, и перемешивают в течение примерно 3-10 ч, предпочтительно примерно 7,5 ч. После охлаждения до комнатной температуры органический слой промывают 10%-ным раствором бикарбоната натрия и обрабатывают в соответствии со стандартными методиками, известными специалистам, и концентрируют с получением требуемого соединения. Стадия Г. Концентрированный раствор со стадии В смешивают с органическим растворителем, таким как ИПЭ, охлаждают примерно до 10 10 С, предпочтительно 0 С, повторно вносят кислоту, такую как МеSО 3 Н, ТФУК или HCl,предпочтительно HCl (газ), и перемешивают при комнатной температуре до завершения гидролиза. Смесь концентрируют, добавляют органический растворитель, такой как метиленхлорид, ИПЭ или ТГФ, а затем основание, такое как гидроксид, карбонат, предпочтительно NH4OH. Затем смесь экстрагируют метиленхлоридом,ИПЭ или ТГФ и концентрируют с получением требуемого соединения. Стадия Д. К раствору 3 а-бензил-2-метил-2,3 а,4,5,6,7 гексагидропиразоло[4,3-с]пиридин-3-она в сме 45 си ацетон/вода (вода: 1-11%; предпочтительно 5% воды в ацетоне) добавляют L-винную кислоту. Смесь нагревают до 25-60 С, предпочтительно до примерно 50 С, и перемешивают предпочтительно в течение ночи. Реакционную смесь охлаждают до предпочтительно примерно 10-15 С, осадки отфильтровывают, промывают холодной смесью ацетон/вода и сушат с получением требуемого соединения. Стадия Ж. 2-Аминоизомасляную кислоту, основание,такое как гидроксид, предпочтительно 1 н.NaOH, (БОК)2 О и органический растворитель,такой как ТГФ, ИПЭ или диоксан, смешивают и перемешивают при комнатной температуре в течение ночи. Реакционную смесь разбавляют органическим растворителем, таким как этилацетат, и доводят рН до примерно 3-7, добавляя водный раствор кислоты, такой как HCl. Органическую фазу отделяют и обрабатывают в соответствии со стандартными методиками, известными специалистам, с получением требуемого соединения. Стадия З. К раствору 2-амино-3-бензилоксипропионовой кислоты в воде и неорганическом или органическом основании, предпочтительно ТЭА,добавляют 2,5-диоксопирролидин-1 иловый эфир 2-трет-бутоксикарбониламино-2 метилпропионовой кислоты в органическом растворителе, таком как ТГФ. Смесь перемешивают предпочтительно в течение ночи предпочтительно при комнатной температуре предпочтительно в атмосфере азота. К этой смеси добавляют водный раствор кислоты, такой как 10%-ный раствор лимонной кислоты. Смесь перемешивают в течение нескольких минут,затем разбавляют органическим растворителем,таким как этилацетат. Органическую фазу отделяют от смеси и обрабатывают в соответствии со стандартными методиками, известными специалистам, а затем концентрируют с получением требуемого соединения. Стадии Е и И. К раствору L-тартрата 3 а-(R)-бензил-2 метил-2,3 а,4,5,6,7-гексагидрoпиразоло[4,3-с] пиридин-3-она в органическом растворителе,таком как этилацетат, при температуре примерно от -78 до -20 С, предпочтительно -66 С, добавляют основание, такое как ТЭА. Смесь перемешивают в течение 1-24 ч, предпочтительно примерно 1,5 ч. После удаления выпавшей в осадок соли добавляют 3-бензилокси-2-(2-третбутоксикарбониламино-2-метилпропиониламино)пропионовую кислоту и основание, такое как ТЭА, при температуре примерно от -50 до 0 С,предпочтительно примерно -35 С, а затем добавляют реагент пептидного сочетания, предпочтительно 50%-ный циклический ангидрид 1 пропанфосфоновой кислоты (АПФК) в этилацетате. Смесь перемешивают в течение примерно 1-6 ч, предпочтительно примерно 2 ч при тем 002089 46 пературе от -50 до 0 С, предпочтительно от примерно -20 до примерно -27 С, затем температуру медленно повышают предпочтительно до примерно 0 С. Реакционную смесь вливают в воду и экстрагируют органическим растворителем, таким как ИПЭ, органический слой отделяют и обрабатывают в соответствии со стандартными методиками, известными специалистам, с получением требуемого соединения. Стадия К. К раствору трет-бутилового эфира 1-[2(3 а-(R)-бензил-2-метил-3-оксо-2,3,3 а,4,6,7-гексагидропиразоло[4,3-с]пиридин-5-ил)-1-(R)бензилоксиметил-2-оксоэтилкарбамоил]-1 метилэтил-карбаминовой кислоты в органическом растворителе, таком как метиленхлорид,при температуре примерно от -10 до 10 С,предпочтительно примерно 0-5 С, добавляют ТФУК, при этом температуру предпочтительно поддерживают примерно ниже 5 С. Затем температуру увеличивают до комнатной температуры. Смесь перемешивают в течение примерно 1-6 ч, предпочтительно примерно 3 ч. Метиленхлорид заменяют другим органическим растворителем, таким как этилацетат. Затем водным основанием, таким как насыщенный раствор бикарбоната натрия, доводят рН смеси до значения от примерно 7 до 9, предпочтительно рН 8, а потом обрабатывают в соответствии со стандартными методиками, известными специалистам, с получением требуемого соединения. Стадия Л. К раствору 2-амино-N-[2-(3 а-(R)-бензил-2 метил-3-оксо-2,3,3 а,4,6,7-гексагидропиразоло[4,3-с]пиридин-5-ил)-1-(R)-бензилоксиметил-2 оксоэтил]-2-метилпропионамида со стадии И в спирте, таком как метанол, добавляют L-(+)винную кислоту, и эту смесь перемешивают в течение ночи. Полученный раствор фильтруют и концентрируют. Добавляют органический растворитель, такой как ИПЭ или этилацетат, а оставшийся спирт удаляют в виде азеотропа. Твердое вещество выделяют и растворяют в этилацетате; раствор нагревают с обратным холодильником, затем оставляют охлаждаться до комнатной температуры с получением кристаллов требуемого продукта. Следующие примеры приведены только с целью дальнейшей иллюстрации изобретения и не предназначены для ограничения раскрываемого изобретения. Основные экспериментальные методики Для колоночной хроматографии использовали диоксид кремния Amicon (30 мкМ, размер пор 60 ). Температуры плавления определяли на приборе Buchi 510 и они не откорректированы. Протонный и углеродный ЯМР-спектры снимали на Varian XL-300, Bruker AC-300, Varian Unity 400 или Bruker AC-250 при 25 С. Химические сдвиги выражены в миллионных долях по нисходящей от триметилсилана. Массспектры пучка частиц получали на спектромет 47 ре Hewlett-Packard 5989A с использованием аммиака в качестве источника химической ионизации. Для растворения образца использовали хлороформ или метанол. Жидкостные вторичные ионные масс-спектры (LSIMS) получали на спектрометре Kratos Concept-1S высокого разрешения, используя бомбардировку ионами цезия образца, растворенного в смеси дитиоэритрита и дитиотреита (1:5) или в тиоглицерине. Для растворения образца использовали хлороформ или метанол. Представленные данные представляют собой суммы 3-20 анализов, откалиброванные по отношению к йодиду цезия. ТСХ-анализы выполняли с использованием пластинок из диоксида кремния E.Merck Kieselgel 60 F254, проявляемых (после элюирования указанным(и) растворителем(ями путем окрашивания 15%-ной фосфорно-молибденовой кислотой в этаноле и нагревания на горячей плитке. Основная Методика А (пептидное сочетание с использованием ЭКД). А 0,2-0,5 М раствор первичного амина (1,0 эквивалент) в дихлорметане (или гидрохлорида первичного амина и 1,0-1,3 эквивалентов триэтиламина) последовательно обрабатывают 1,01,2 эквивалентами карбоновой кислоты как реагента реакции сочетания, 1,5-1,8 эквивалентами гидроксибензотриазолгидрата (ГБТГ) или ГАБТ и 1,0-1,2 эквивалентами (стехиометрический эквивалент к количеству карбоновой кислоты),гидрохлорида 1-(3-диметиламинопропил)-3 этилкарбодиимида (ЭКД), и эту смесь перемешивают в течение ночи в ледяной бане (ледяную баню оставляют нагреваться, и таким образом температуру реакционной смеси обычно удерживают при примерно 0-20 С в течение примерно 4-6 ч и примерно 20-25 С в течение оставшегося периода времени). Смесь разбавляют этилацетатом или другим растворителем,таким как указано, и полученную смесь промывают два раза 1 н. NaOH, два раза 1 н. HCl (если продукт не является основным), один раз рассолом, сушат над Na2SO4 и концентрируют с получением неочищенного продукта, который очищают так, как указано. В реакции сочетания с первичным амином или гидрохлоридом последнего можно использовать компонент карбоновой кислоты в виде соли дициклогексиламина; триэтиламин в этом случае не используют. Пример 1. Гидрохлорид 2-амино-N-1(R)бензилоксиметил-2-[3 а-(R)-(4-фторбензил)-2 метил-3-оксо-2,3,3 а,4,6,7-гексагидропиразоло 48 Смесь 8,00 г (38,5 ммоль) гидрохлорида этилового эфира 4-оксопиперидин-3-карбоновой кислоты, 9,23 г (42,4 ммоль) ди-третбутилдикарбоната и 3,89 г (38,5 ммоль) триэтиламина в 150 мл ТГФ перемешивают при комнатной температуре в течение примерно 72 ч. Смесь концентрируют, остаток растворяют в этилацетате и промывают три раза, причем каждый раз 10%-ным водным раствором HCl, насыщенным водным раствором бикарбоната натрия и рассолом, сушат над МgSO4 и концентрируют с получением 10,0 г соединения 1 А в виде белого твердого вещества. МС (химическая ионизация (ХИ), NH3 272 (MH+). Б. 1-трет-Бутиловый эфир 3-этиловый эфир 3-(R,S-(4-фторбензил)-4-оксопиперидин 1,3-дикарбоновой кислоты. К раствору 2,00 г (7,4 ммоль) соединения 1 А в 10 мл ДМФ добавляют 282 мг (7,4 ммоль) гидрида натрия (60%-ная дисперсия в масле) и эту смесь перемешивают при комнатной температуре в течение примерно 15 мин. К перемешиваемому раствору добавляют раствор 1,39 г(7,4 ммоль) 4-фторбензилбромида в 7 мл ДМФ,и смесь перемешивают в течение примерно 72 ч при комнатной температуре. Смесь разбавляют этилацетатом и промывают один раз водой и четыре раза рассолом, сушат над МgSO4 и концентрируют с получением 2,8 г соединения 1 Б. МС (ХИ, NН 3) 380 (МН+). В. трет-Бутиловый эфир 3 а-(R,S)-(4-фторбензил)-2-метил-3-оксо-2,3,3 а,4,6,7-гексагидропиразоло[4,3-с]пиридин-5-карбоновой кислоты. Смесь 2,54 г (6,7 ммоль) соединения 1 Б и 309 мг (6,7 ммоль) метилгидразина в 100 мл этанола нагревают с обратным холодильником в течение примерно 8 ч. Смесь концентрируют,остаток растворяют в 100 мл толуола и нагревают с обратным холодильником в течение примерно 17 ч. Смесь концентрируют и остаток очищают хроматографией на силикагеле с использованием градиентного элюирования смесью этилацетат:гексан от 18:82 об./об. до 75:25 об./об. с получением 1,0 г соединения 1 В в виде прозрачного бесцветного масла. МС (ХИ, NН 3) 362 (MH+). Г. Трифторацет 3 а-(R,S)-(4-фторбензил)-2 метил-3-оксо-2,3 а,4,5,6,7-гексагидропиразоло[4,3-с]пиридин-3-она. К 1,00 г (2,8 ммоль) соединения 1 В добавляют 10 мл трифторуксусной кислоты при примерно 0 С и смесь перемешивают в течение примерно 1 ч. Добавляют этилацетат и смесь концентрируют с получением 1,0 г соединения 1 Г. МС (ХИ, NН 3) 263 (MH+). Д. (R)-3-Бензилокси-2-(2-трет-бутоксикарбониламино-2-метилпропиониламино)пропионовая кислота. К 1,83 г (6,2 ммоль) N-трет-БОК-О-бензилD-серина в 35 мл ДМФ добавляют 1,02 г (7,4 ммоль) карбоната калия, а затем 0,92 г (6,5 ммоль) йодметана. Смесь перемешивают в те 49 чение ночи при примерно 24 С в атмосфере азота. Реакционную смесь разбавляют 200 мл воды и три раза экстрагируют этилацетатом. Объединенные органические экстракты промывают пять раз водой и один раз рассолом, сушат надMgSO4 и концентрируют. Неочищенный метиловый эфир (R)-3-бензилокси-2-трет-бутоксикарбониламинопропионовой кислоты растворяют в 15 мл холодной трифторуксусной кислоты при примерно 0 С и смесь перемешивают в течение примерно 2 ч. Смесь концентрируют, остаток разбавляют 1 н. NaOH и три раза экстрагируют этилацетатом. Объединенные органические экстракты промывают рассолом и сушат над Na2SO4 с получением 0,84 г (4,02 ммоль) метилового эфира (R)-2-амино-3-бензилоксипропионовой кислоты, который подвергают реакции сочетания с 0,81 г (4,02 ммоль) N-третБОКметилаланина с получением 1,80 г метилового эфира (R)-3-бензилокси-2-(2-трет-бутоксикарбониламино-2-метилпропиониламино)пропионовой кислоты. Неочищенный продукт растворяют в 20 мл смеси ТГФ:вода (4:1) и к этому раствору добавляют раствор 335 мг (7,98 ммоль) гидрата гидроксида лития в 1 мл воды и смесь перемешивают в течение ночи при комнатной температуре. Смесь концентрируют,остаток разбавляют этилацетатом, подкисляют водным раствором HCl и три раза экстрагируют этилацетатом. Органические экстракты объединяют и один раз промывают рассолом, сушат над Na2SO4 и концентрируют с получением 1,60 г соединения 1 Д в виде масла, которое затвердевает при стоянии. 1H ЯМР (CDCl3 300 МГц)7.30 (m, 5 Н), 7.10 (d, 1H), 5.07 (bs, 1H), 4.68 (m,1H), 4.53 (q, 2H), 4.09 (m, 1H), 3.68 (m, 1H), 1.31.5 (m, 15 Н). Е. трет-Бутиловый эфир (1-1(R)-бензилоксиметил-[2-(3 а-(R,S)-(4-фторбензил)-2-метил 3-оксо-2,3,3 а,4,6,7-гексагидропиразоло[4,3-с] пиридин-5-ил]-2-оксоэтилкарбамоил-1-метилэтил)-карбаминовой кислоты. В соответствии со способом, изложенным в общих чертах в Основной методике А, 193 мг(0,51 ммоль) соединения 1 Г и 196 мг (0,51 ммоль) соединения 1 Д подвергают реакции сочетания с получением смеси диастереомеров. Остаток очищают хроматографией на силикагеле с использованием градиентного элюирования смесью этилацетат:гексан от 1:1 об./об. до 100%-ного этилацетата с получением 60 мг менее полярного изомера 1 соединения 1 Е и 100 мг более полярного изомера 2 соединения 1 Е. МС (ХИ, NН 3) 624 (МН+) для обоих изомеров. Ж. Гидрохлорид 2-амино-N-1(R)-бензилоксиметил-2-[3 а-(R)-(4-фторбензил)-2-метил-3 оксо-2,3,3 а,4,6,7-гексагидропиразоло[4,3-с] пиридин-5-ил]-2-оксоэтил-изобутирамида. К 60 мг (0,10 ммоль) изомера 1 соединения 1 Е в 10 мл этанола добавляют 4 мл концентрированной HCl и эту смесь перемешивают при 50 комнатной температуре в течение примерно 2 ч. Смесь концентрируют и остаток осаждают из смеси этанол/гексан с получением 50 мг изомера 1 соединения 1 Ж в виде белого порошка. МС(m, 7H), 2.66 (m, 2H), 1.57 (s, 6H). З. Гидрохлорид 2-амино-N-1(R)-бензилоксиметил-2-[3 а-(S)-(4-фторбензил)-2-метил-3 оксо-2,3,3 а,4,6,7-гексагидропиразоло[4,3-с] пиридин-5-ил]-2-оксоэтил-изобутирамида. К 100 мг (0,16 ммоль) изомера 2 соединения 1 Е в 10 мл этанола добавляют 4 мл концентрированной HCl и смесь перемешивают при комнатной температуре в течение примерно 2 ч. Смесь концентрируют и остаток осаждают из смеси этанол/гексан с получением 60 мг изомера 2 соединения 13 в виде белого порошка. МС(m, 2H), 2.58 (m, 3 Н), 1.58 (s, 6H). Пример 2. Гидрохлорид 2-амино-N-[2-[3 а(R,S)-(4-фторбензил)-2-метил-3-оксо-2,3,3 а,4,6,7-гексагидропиразоло[4,3-с]пиридин-5-ил]1(R)-(1 Н-индол-3-илметил)-2-оксоэтил]-изобутирамида. А. Метиловый эфир (R)-2-амино-3-(1 Ниндол-3-ил)-пропионовой кислоты. К 4,92 г (16,2 ммоль) Nтрет-БОК-Dтриптофана в 100 мл ДМФ добавляют 2,46 г(17,0 ммоль) йодметана и смесь перемешивают в течение ночи при 24 С в атмосфере азота. Реакционную смесь разбавляют водой и три раза экстрагируют этилацетатом. Объединенные органические экстракты промывают пять раз 500 мл воды и один раз рассолом, сушат над MgSO4 и концентрируют с получением 4,67 г белого твердого вещества. К неочищенному метиловому эфиру (R)-2-трет-бутоксикарбониламино-3(1 Н-индол-3-ил)-пропионовой кислоты добавляют 15 мл холодной трифторуксусной кислоты при примерно 0 С и смесь перемешивают в течение примерно 2 ч. Смесь концентрируют и остаток разбавляют 1 н. NaOH и три раза экстрагируют этилацетатом. Объединенные органические экстракты промывают рассолом и сушат над Nа 2SO4 с получением метилового эфира (R)2-амино-3-(1 Н-индол-3-ил)-пропионовой кислоты в виде оранжевого масла с количественным выходом. Б. Метиловый эфир(R)-2-(2-третбутоксикарбониламино-2-метилпропиониламино)-3-(1 Н-индол-3-ил)-пропионовой кислоты. Неочищенный продукт со стадии 2 А 1,55 г(7,1 ммоль) подвергают реакции сочетания с 1,44 г (7,1 ммоль) N-трет-БОКметилаланина в соответствии с Методикой А с получением 51 масла, которое очищают хроматографией на силикагеле, используя градиентное элюирование 10%, 20%, 30%, 40% и 50% этилацетата в гексане. Выделяют 1,32 г метилового эфира (R)2-(2-трет-бутоксикарбониламино-2-метил-пропиониламино)-3-(1 Н-индол-3-ил)-пропионовой кислоты. В. (R)-2-(2-трет-Бутоксикарбониламино-2 метил-пропиониламино)-3-(1 Н-индол-3-ил)пропионовая кислота. К раствору 1,03 г (2,64 ммоль) соединения 2 Б в 10 мл ТГФ добавляют 381 мг (9,1 ммоль) гидрата гидроксида лития в 2 мл воды, и смесь перемешивают в течение ночи при комнатной температуре. Избыток ТГФ удаляют выпариванием, основную водную смесь три раза экстрагируют этилацетатом, а затем подкисляют до рН 4 разбавленной уксусной или соляной кислотой. Продукт экстрагируют этилацетатом и объединенные органические экстракты промывают рассолом, сушат над МgSO4 и упаривают с получением 1,03 г соединения 2 В в виде оранжевой пены. МС (ХИ, NH3) 390 (МН+). 1H ЯМР(0,51 ммоль) соединения 1 Г и 200 мг (0,51 ммоль) соединения 2 В подвергают реакции сочетания и остаток очищают хроматографией на силикагеле с использованием градиентного элюирования смесью этилацетат:гексан от 1:1 об./об. до 100%-ного этилацетата с получением 230 мг соединеня 2 Г. МС (ХИ, NН 3) 633 (МН+). Д. Гидрохлорид 2-амино-N-[2-[3 а-(R,S)-(4 фторбензил)-2-метил-3-оксо-2,3,3 а,4,6,7-гексагидропиразоло[4,3-с]пиридин-5-ил 1-1(R)-(1 Ниндол-3-илметил)-2-оксоэтил]-изобутирамида. К 230 мг (0,36 ммоль) соединения 2 Г в 10 мл этанола добавляют 4 мл концентрированнойHCl и смесь перемешивают при комнатной температуре в течение примерно 2 ч. Смесь концентрируют и остаток осаждают из смеси этанол/гексан с получением 130 мг соединения 2 Д в виде белого порошка. МС (ХИ, NН 3) 533 52 А. 1-трет-Бутиловый эфир 3-метиловый эфир 4-оксо-пиперидин-1,3-дикарбоновой кислоты. К смеси 7,00 г (36,2 ммоль) метилового эфира 4-оксопиперидин-3-карбоновой кислоты и 8,82 г (72,3 ммоль) 4,4-диметиламинопиридина в 200 мл метиленхлорида примерно при 0 С добавляют раствор 7,88 г (36,2 ммоль) ди-трет-бутилдикарбоната в 150 мл метиленхлорида примерно за период 30 мин. Смесь нагревают до комнатной температуры, а затем перемешивают в течение примерно 17 ч. Смесь концентрируют, остаток разбавляют хлороформом и три раза промывают, причем каждый раз,10%-ной водной HCl, насыщенным водным раствором бикарбоната натрия и рассолом, сушат над МgSO4 и концентрируют с получением 9,18 г прозрачного желтого масла. Б. 1-трет-Бутиловый эфир-3-метиловый эфир 3-(R,S)-бензил-4-оксопиперидин-1,3-дикарбоновой кислоты. К раствору 5,00 г (19,4 ммоль) соединения 3 А в 10 мл ДМФ добавляют 745 мг (7,4 ммоль) гидрида натрия (60%-ная дисперсия в масле) и смесь перемешивают при комнатной температуре в течение примерно 15 мин. К перемешиваемому раствору при помощи канюли добавляют раствор 3,32 г (19,4 ммоль) бензилбромида в 15 мл ДМФ, и смесь перемешивают в течение примерно 42 ч при комнатной температуре. Смесь разбавляют этилацетатом и промывают один раз водой и четыре раза рассолом, сушат над MgSO4 и концентрируют с получением 6,0 г соединения 3 Б в виде желтого масла. МС (ХИ, NН 3) 348[4,3-с]пиридин-5-карбоновой кислоты. Смесь 4,00 г (11,5 ммоль) соединения 3 Б и 530 мг (11,5 ммоль) метилгидразина в 100 мл этанола нагревают с обратным холодильником в течение примерно 8 ч. Смесь концентрируют и остаток растворяют в 100 мл толуола и нагревают с обратным холодильником в течение примерно 17 ч. Смесь концентрируют и остаток очищают хроматографией на силикагеле с использованием градиентного элюирования смесью этилацетат:гексан от 18:82 об./об. до 75:25oб./oб. с получением 2,6 г соединения 3 В в виде прозрачного бесцветного масла. МС (ХИ, NН 3) 344 (МН+). Г. 3 а-(R,S)-Бензил-2-метил-2,3 а,4,5,6,7 гексагидропиразоло[4,3-с]пиридин-3-он. К 2,60 г (7,6 ммоль) соединения 3 В добавляют 20 мл трифторуксусной кислоты примерно при 0 С и смесь перемешивают в течение примерно 2,5 ч. Добавляют этилацетат и раствор промывают 6 н. NaOH, сушат над MgSO4 и концентрируют с получением 1,8 г соединения 3 Г. МС (ХИ, NНз) 244 (МН+). Д. трет-Бутиловый эфир 1-[2-(3 а-(R,S)бензил-2-метил-3-оксо-2,3,3 а,4,6,7-гексагидро 53 пиразоло[4,3-с]пиридин-5-ил)-1R-(1 Н-индол-3 илметил)-2-оксоэтилкарбамоил]-1-метилэтилкарбаминовой кислоты. В соответствии со способом, изложенным в общих чертах в Основной методике А, 125 мг(4,6 ммоль) соединения 3 В и 1,75 г (0,51 ммоль) соединения 2 В подвергают реакции сочетания,и остаток очищают хроматографией на силикагеле с использованием градиентного элюирования смесью от 6:4 об./об. этилацетат:гексан до 7% метанола в этилацетате с получением 150 мг соединения 3 Д. Е. Гидрохлорид 2-амино-N-[2-(3 а-(R,S)бензил-2-метил-3-оксо-2,3,3 а,4,6,7-гексагидропиразоло[4,3-с]пиридин-5-ил)-1R-(1 Н-индол-3 илметил)-2-оксоэтил]-изобутирамида. К 150 мг (0,24 ммоль) соединения 3 Д в 15 мл этанола добавляют 5 мл концентрированнойHCl и смесь перемешивают при комнатной температуре в течение примерно 3 ч. Смесь концентрируют и остаток кристаллизуют из смеси этанол/гексан с получением 100 мг соединения 3 Е. МС (ХИ, NН 3) 515 (MH+). 1H ЯМР (CD3OD):7.20-6.91 (m, 9H), 6.56 (m, 1 Н), 5.17 (m, 1H),4.05 (m, 1H), 2.96 (s, 3H), 2.62 (m, 1H), 2.38 (m,1H), 2.06 (m, 2H), 1.61 (m, 8H). Пример 4. Гидрохлорид 2-амино-N-[2-(3 а(R)-бензил-2-метил-3-оксо-2,3,3 а,4,6,7-гексагидропиразоло[4,3-с]пиридин-5-ил)-1-(R)-бензилоксиметил-2-оксоэтил]-изобутирамида и гидрохлорид 2-амино-N-[2-(3 а-(S)-бензил-2 метил-3-оксо-2,3,3 а,4,6,7-гексагидропиразоло(4,6 ммоль) соединения 3 В и 1,75 г (0,51 ммоль) соединения 1 Д подвергают реакции сочетания с получением смеси диастереомеров. Остаток очищают хроматографией на силикагеле с использованием градиентного элюирования смесью этилацетат:гексан от 1:1 об./об. до 100%ного этилацетата с получением 350 мг менее полярного изомера 1 соединения 4 А и 250 мг более полярного изомера 2 соединения 4 А. МС(ХИ, NН 3) 606 (МН+) для обоих изомеров. Б. Гидрохлорид 2-амино-N-[2-(3 а-(R)бензил-2-метил-3-оксо-2,3,3 а,4,6,7-гексагидропиразоло[4,3-с]пиридин-5-ил)-1-(R)-бензилоксиметил-2-оксоэтил]-изобутирамида. К 250 мг (0,41 ммоль) изомера 1 соединения 4 А в 15 мл этанола добавляют 5 мл концентрированной HCl и смесь перемешивают при комнатной температуре в течение примерно 5 ч. Смесь концентрируют и остаток осаждают из смеси этанол/гексан и сушат под вакуумом с получением 130 мг изомера 1 соединения 4 Б.(m, 3 Н), 3.80 (m, 2H), 3.14 (m, 1H), 3.04 (s, 3 Н),2.96 (m, 2H), 2.61 (m, 2H), 1.63 (m, 7H). В. Гидрохлорид 2-амино-N-[2-(3 а-(S)бензил-2-метил-3-оксо-2,3,3 а,4,6,7-гексагидропиразоло[4,3-с]пиридин-5-ил)-1-(R)-бензилоксиметил-2-оксоэтил]-изобутирамида. К 250 мг (0,41 ммоль) изомера 2 соединения 4 А в 15 мл этанола добавляют 5 мл концентрированной HCl и смесь перемешивают при комнатной температуре в течение примерно 5 ч. Смесь концентрируют и остаток осаждают из смеси этанол/гексан и сушат под вакуумом с получением 120 мг изомера 2 соединения 4 В. МС (ХИ, NН 3) 506 (МН+). 1 Н ЯМР (СD3OD):7.31 (m, 5H), 7.13 (m, 5H), 6.78 (m, 1H), 5.28(m, 1H), 4.62 (m, 3 Н), 3.81 (m, 2H), 3.14 (m, 1H),2.62 (m, 3 Н), 1.58 (m, 7H). Г. Метансульфонат 2-амино-N-[2-(3 а-(R)бензил-2-метил-3-оксо-2,3,3 а,4,6,7-гексагидропиразоло[4,3-с]пиридин-5-ил)-1-(R)-бензилоксиметил-2-оксоэтил]-изобутирамида. Насыщенный водный бикарбонат натрия добавляют к 3,60 г (6,6 ммоль) изомера 1 соединения 4 Б и смесь экстрагируют этилацетатом. Органический слой сушат над МgSO4 и концентрируют. Остаток растворяют в этилацетате,охлаждают примерно до 0 С, добавляют 0,43 мл(6,6 ммоль) метансульфоновой кислоты и смесь перемешивают в течение примерно 0,5 ч. К раствору добавляют гексан (200 мл) и смесь перемешивают в течение примерно 1 ч и фильтруют с получением 3,40 г белого твердого вещества. Твердое вещество перекристаллизовывают из 3%-ного водного этилацетата с получением 2,55 г изомера 1 соединения 4 Г в виде белого кристаллического твердого вещества. МС (ХИ, NН 3) 506 (MH+). Пример 5. Гидрохлорид 2-амино-N-[1-(3 а(R)-бензил-2-метил-3-оксо-2,3,3 а,4,6,7-гексагидропиразоло[4,3-с]пиридин-5-карбонил)-4 фенил-(R)-бутил]-изобутирамида и гидрохлорид 2-амино-N-[1-(3 а-(S)-бензил-2-метил-3-оксо 2,3,3 а,4,6,7-гексагидропиразоло[4,3-с]пиридин 5-карбонил)-4-фенил-(R)-бутил]-изобутирамида. А. трет-Бутиловый эфир 2-оксо-5,6 дифенил-3-(3-фенилаллил)-морфолин-4-карбоновой кислоты. К раствору 13,8 г (70,0 ммоль) циннамилбромида и 4,94 г (14,0 ммоль) трет-бутил(2S,3R)-(+)-6-оксо-2,3-дифенил-4-морфолинкарбоксилата в 350 мл безводного ТГФ примерно при -78 С добавляют 28 мл (28 ммоль) 1 М бистриметилсилиламида натрия в ТГФ. Смесь перемешивают примерно при -78 С в течение примерно 1,5 ч, а затем вливают в 750 мл этилацетата. Смесь промывают два раза рассолом, сушат над MgSO4 и концентрируют с получением желтого масла. Масло перемешивают в 150 мл гексана в течение ночи и выпавшее в осадок 55 твердое вещество затем собирают фильтрованием с получением 3,2 г соединения 5 А в виде белого твердого вещества. Б. 5(S),6(R)-Дифенил-3(R)-(3-фенилаллил)морфолин-2-он. К 2,97 г (6,33 ммоль) соединения 5 А добавляют 20 мл трифторуксусной кислоты примерно при 0 С и смесь перемешивают в течение примерно 2 ч, а затем концентрируют. Остаток растворяют в воде и подщелачивают водным раствором NaOH до рН 10. Смесь экстрагируют три раза этилацетатом и объединенные органические экстракты промывают рассолом, сушат над MgSO4 и концентрируют с получением оранжевого масла, которое очищают хроматографией на силикагеле (10:90 об./об. этилацетат:гексан) с получением 880 мг соединения 5 Б в виде желтого твердого вещества. В. 2-(R)-Амино-5-фенилвалериановая кислота. Смесь 440 мг (1,19 ммоль) соединения 5 Б и 120 мг хлорида палладия в 20 мл этанола и 10 мл ТГФ гидрируют при 310,26 кПа (45 фунт/кв. дюйм) в течение примерно 16 ч. Смесь фильтруют через кизельгур и концентрируют и остаток растирают с эфиром с получением 240 мг соединения 5 В в виде белого твердого вещества. Г. 2,5-Диоксопирролидин-1-иловый эфир 2-трет-бутоксикарбониламино-5-метилпропионовой кислоты. К взвеси 5,0 г (24,6 ммоль) N-трет-БОК-метилаланина в 13,5 мл метиленхлорида добавляют 3,40 г (29,6 ммоль) N-гидроксисукцинимида и 5,65 г (29,6 ммоль) ЭКД. Взвесь перемешивают в течение примерно 17 ч при комнатной температуре. Взвесь разбавляют этилацетатом и два раза промывают водой, насыщенным раствором бикарбоната натрия и рассолом. Сушат над МgSO4 и концентрируют. Продукт очищают хроматографией на силикагеле (1:1 об./об. этилацетат:гексаны) с получением 5,2 г указанного в заголовке раздела Г соединения в виде белого твердого вещества. Д. (R)-2-(2-трет-Бутоксикарбониламино-2 метил-пропиониламино)-5-фенилвалериановая кислота. Смесь 203 мг (1,05 ммоль) соединения 5 Г,378 мг (1,26 ммоль) соединения 5 В и 434 мг(3,36 ммоль) диизопропилэтиламина в 2 мл ДМФ перемешивают в течение ночи. Смесь разбавляют этилацетатом и два раза экстрагируют 1 н. HCl. Водную фазу один раз экстрагируют этилацетатом. Объединенные органические экстракты три раза промывают водой и один раз рассолом. Смесь сушат над MgSO4 и концентрируют. Остаток очищают хроматографией на силикагеле с использованием 80%-ного хлороформа в гексане, потом 100%-ного хлороформа,а затем 10%-ного метанола в хлороформе с получением 127 мг соединения 5 Д. Е. трет-Бутиловый эфир 1-[1-(3 а-(R,S)бензил-2-метил-3-оксо-2,3,3 а,4,6,7-гексагидро 002089(0,53 ммоль) соединения 3 В и 200 мг (0,53 ммоль) соединения 5 Д подвергают реакции сочетания с получением смеси диастереомеров. Остаток очищают хроматографией на силикагеле с использованием градиентного элюирования смесью этилацетат:гексан от 1:1 об./об. до 100%-ного этилацетата с получением 40 мг менее полярного изомера 1 соединения 5 Е и 40 мг более полярного изомера 2 соединения 5 Е. МС(ХИ, NН 3) 604 (МH+) для обоих изомеров. Ж. Гидрохлорид 2-амино-N-[1-(3 а-(R)бензил-2-метил-3-оксо-2,3,3 а,4,6,7-гексагидропиразоло[4,3-с]пиридин-5-карбонил)-4-фенил(RК)-бутил]-изобутирамида. К 40 мг (0,07 ммоль) изомера 1 соединения 5 Е в 10 мл этанола добавляют 4 мл концентрированной HCl и смесь перемешивают при комнатной температуре в течение примерно 4 ч. Смесь концентрируют и остаток осаждают из смеси метиленхлорид/гексан и сушат под вакуумом с получением 30 мг изомера 1 соединения 5 Ж. МС (ХИ, NН 3) 504 (MH+). 1H ЯМР(s, 6H), 1.28 (m, 1 Н). З. Гидрохлорид 2-амино-N-[1-(3 а-(S)бензил-2-метил-3-оксо-2,3,3 а,4,6,7-гексагидропиразоло[4,3-с]пиридин-5-карбонил)-4-фенил(R)-бутил]-изобутирамида. К 40 мг (0,07 ммоль) изомера 2 соединения 5 Е в 10 мл этанола добавляют 4 мл концентрированной HCl и смесь перемешивают при комнатной температуре в течение примерно 4 ч. Смесь концентрируют и остаток осаждают из смеси метиленхлорид/гексан и сушат под вакуумом с получением 30 мг изомера 2 соединения 53. МС (ХИ, NН 3) 504 (МН+). 1H ЯМР(0,82 ммоль) соединения 3 В и 320 мг (0,82 ммоль) соединения 1 Д подвергают реакции сочетания с получением смеси диастереомеров. Остаток очищают хроматографией на силикагеле с использованием градиентного элюирования 57 от смеси этилацетат:гексан (1:1 об./об.) до 10%ного метанола в этилацетате с получением 170 мг соединения 6 А. Б. Гидрохлорид 2-амино-N-[2-(3 а-(R,S)бензил-2-метил-3-оксо-2,3,3 а,4,6,7-гексагидропиразоло[4,3-с]пиридин-5-ил)-1-(R)-бензилоксиметил-2-оксоэтил]-изобутирамида. К 170 мг (0,28 ммоль) соединения 6 А в 20 мл этанола добавляют 5 мл концентрированнойHCl и смесь перемешивают при комнатной температуре в течение примерно 2,5 ч. Смесь концентрируют и остаток осаждают из смеси этанол/гексан с получением 70 мг соединения 6 Б. МС (ХИ, NH3) 506 (МН+). 1H ЯМР (CD3OD):7.32 (m, 5H), 7.16 (m, 5 Н), 5.22 (m, 1H), 4.67 (m,1H), 4.55 (m, 2H), 3.79 (m, 2 Н), 3.12 (m, 2H), 3.00(m, 6 Н), 2.71 (m, 3H), 1.56 (m, 8H). Пример 7. Гидрохлорид 2-амино-N-[2-(3 абензил-2-этил-3-оксо-2,3,3 а,4,6,7-гексагидропиразоло[4,3-с]пиридин-5-ил)-1-(1 Н-индол-3 илметил)-2-оксоэтил]-изобутирамида. А. трет-Бутиловый эфир 3 а-(R,S)-бензил-2 этил-3-оксо-2,3,3 а,4,6,7-гексагидропиразоло[4,3 с]пиридин-5-карбоновой кислоты. К 555 мг (1,60 ммоль) соединения 3 Б в 27 мл этанола добавляют 240 мг (1,60 ммоль) этилгидразиноксалата, и смесь нагревают с обратным холодильником в течение примерно 4 ч. Смесь концентрируют и остаток очищают хроматографией на силикагеле с использованием градиентного элюирования смесью гексан:этилацетат (от 10:1 об./об. до 3:7 об./об.) с получением 357 мг соединения 7 А. МС (ХИ,NН 3) 358 (МН+). Б. 3 а-(R,S)-Бензил-2-этил-2,3 а,4,5,6,7 гексагидропиразоло[4,3-с]пиридин-3-он. К 350 мг (0,98 ммоль) соединения 7 А в 3 мл этанола добавляют 1,5 мл концентрированной HCl и смесь перемешивают при комнатной температуре в течение примерно 2 ч. Смесь концентрируют с получением 257 мг соединения 7 Б. МС (ХИ, NН 3) 258 (МH+). В. трет-Бутиловый эфир 1-[2-(3 а-(R,S)бензил-2-этил-3-оксо-2,3,3 а,4,6,7-гексагидропиразоло[4,3-с]пиридин-5-ил)-1-(R)-(1 Н-индол 3-илметил)-2-оксоэтилкарбамоил]-1-метилэтил-карбаминовой кислоты. В соответствии со способом, изложенным в общих чертах в Основной методике А, 82 мг(0,28 ммоль) соединения 7 Б и 100 мг (0,26 ммоль) соединения 2 В подвергают реакции сочетания и остаток очищают хроматографией на силикагеле с использованием градиентного элюирования от 100%-ного метиленхлорида до 2%-ного метанола в метиленхлориде с получением 110 мг соединения 7 В. МС (ХИ, NH3) 629 58 К 100 мг (0,15 ммоль) соединения 7 В в 2 мл этанола добавляют 1 мл концентрированнойHCl и смесь перемешивают при комнатной температуре в течение примерно 2 ч. Смесь концентрируют с получением 72 мг соединения 7 Г в виде бесцветной пены. МС (ХИ, NН 3) 529(0,29 ммоль) соединения 7 Б и 100 мг (0,26 ммоль) соединения 1 Д подвергают реакции сочетания с получением смеси диастереомеров. Остаток очищают хроматографией на силикагеле с использованием градиентного элюирования от 100%-ного метиленхлорида до 2%-ного метанола в метиленхлориде с получением 6 мг менее полярного 1 изомера соединения 8 А и 11 мг более полярного изомера 2 соединения 8 А. МС (ХИ, NН 3) 620 (MH+) для обоих изомеров. Б. Гидрохлорид 2-амино-N-[2-(3 а-(R)бензил-2-этил-3-оксо-2,3,3 а,4,6,7-гексагидропиразоло[4,3-с]пиридин-5-ил)-1-(R)-бензилоксиметил-2-оксоэтил]-изобутирамида. К 5,7 мг (0,009 ммоль) изомера 1 соединения 8 А в 1 мл этанола добавляют 0,4 мл концентрированной HCl и смесь перемешивают при комнатной температуре в течение примерно 3 ч. Смесь концентрируют с получением 4,7 мг изомера 1 соединения 8 Б. МС (ХИ, NН 3) 520 (MH+). 1H ЯМР (CD3OD): (частичный)7.41-7.05 (m,10 Н), 5.20 (m, 1 Н), 4.61 (m, 1H), 4.52 (s, 2 Н),3.71 (m, 1H), 3.60 (m, 1H), 2.61 (m, 3 Н), 1.39 (m,9H). В. Гидрохлорид 2-амино-N-[2-(3 а-(S)бензил-2-этил-3-оксо-2,3,3 а,4,6,7-гексагидропиразоло[4,3-с]пиридин-5-ил)-1-(R)-бензилоксиметил-2-оксоэтил]-изобутирамида. К 10 мг (0,016 ммоль) изомера 2 соединения 8 А в 1 мл этанола добавляют 0,4 мл концентрированной HCl и смесь перемешивают при комнатной температуре в течение примерно 3 ч. Смесь концентрируют с получением 8 мг изомера 2 соединения 8 В. МС (ХИ, NН 3) 520[4,3-с]пиридин-5-ил)-1-(R)-бензилоксиметил-2 оксоэтил]-изобутирамида. А. трет-Бутиловый эфир 2-бензил-3 гидрокси-2,4,6,7-тетрагидропиразоло[4,3-с] пиридин-5-карбоновой кислоты. Смесь 800 мг (3,11 ммоль) соединения 3 Б и 495 мг (3,11 ммоль) дигидрохлорида бензилгидразина и 423 мг (3,11 ммоль) тригидрата ацетата натрия в 15 мл этанола нагревают с обратным холодильником в течение примерно 17 ч. Смесь концентрируют, и остаток растворяют в 100 мл толуола и нагревают с обратным холодильником в течение примерно 48 ч. Смесь разбавляют этилацетатом и промывают рассолом, сушат над МgSO4 и концентрируют и остаток очищают хроматографией на силикагеле с использованием 100%-ного этилацетата, а затем 5%-ного метанола в метиленхлориде с получением 530 мг соединения 9 А в виде светло-коричневого твердого вещества. МС (ХИ, NН 3) 330 (МН+). Б. 2-Бензил-4,5,6,7-тетрагидро-2 Н-пиразоло[4,3-с]пиридин-3-ол. К 411 мг (1,24 ммоль) соединения 3 Д в 30 мл этанола добавляют 10 мл концентрированной HCl и смесь перемешивают при комнатной температуре в течение примерно 30 мин. Смесь концентрируют и остаток кристаллизуют из смеси метанол/этилацетат с получением 353 мг соединения 9 Б. МС (ХИ, NН 3) 230 (MH+). В. трет-Бутиловый эфир 1-[2-(2-бензил-3 гидрокси-2,4,6,7-тетрагидропиразоло[4,3-с] пиридин-5-ил)-1-R-бензилоксиметил-2-оксоэтилкарбамоил]-1-метил-этил-карбаминовой кислоты. В соответствии со способом, изложенным в общих чертах в Основной методике А, 100 мг(0,38 ммоль) соединения 9 Б и 145 мг (0,38 ммоль) соединения 1 Д подвергают реакции сочетания и остаток очищают хроматографией на силикагеле (95:5 об./об. метанол:метиленхлорид) с получением 42 мг соединения 9 В в виде белого твердого вещества. МС (ХИ, NН 3) 592 (МН+). Г. Гидрохлорид 2-амино-N-[2-(2-бензил-3 оксо-2,3,3 а,4,6,7-гексагидропиразоло[4,3-с] пиридин-5-ил)-1-(R)-бензилоксиметил-2-оксоэтил]-изобутирамида. К 42 мг (0,07 ммоль) соединения 9 Г в 20 мл этанола добавляют 6 мл концентрированнойHCl и смесь перемешивают при комнатной температуре в течение примерно 30 мин. Смесь разбавляют этанолом, концентрируют и остаток осаждают из смеси метанол/этилацетат с получением 35 мг соединения 9 Г в виде белого твердого вещества. МС (ХИ, NН 3) 492 (МH+). 1H ЯМР (CD3OD): (частичный)7.41-7.16 (m,10 Н), 5.19 (m, 3H), 4.48 (m, 4H), 3.88 (m, 1H),3.74 (m, 2 Н), 2.68 (m, 2H), 1.58 (m, 6H). Пример 10. Гидрохлорид 2-амино-N-2[3 а-(R)-бензил-3-оксо-2-(2,2,2-трифторэтил)2,3,3 а,4,6,7-гексагидропиразоло[4,3-с]пиридин 5-ил]-1-(R)-бензилоксиметил-2-оксоэтил 002089(70% в воде) в 20 мл этанола нагревают с обратным холодильником в течение примерно 5 ч и затем концентрируют. Остаток растворяют в 40 мл толуола и нагревают с обратным холодильником в течение примерно 17 ч. Смесь концентрируют и остаток очищают хроматографией на силикагеле (9:1 об./об. гексан:этилацетат) с получением 703 мг соединения 10 А в виде желтого масла. МС (ХИ, NH3) 412 (МН+). Б. 3 а-(R,S)-Бензил-2-(2,2,2-трифторэтил)2,3 а,4,5,6,7-гексагидропиразоло[4,3-с]пиридин 3-он. К 600 мг (1,46 ммоль) соединения 10 А примерно при 0 С добавляют 3 мл холодной трифторуксусной кислоты и смесь перемешивают в течение примерно 3 ч, оставляя раствор нагреваться до комнатной температуры. Смесь концентрируют, остаток растворяют в воде и раствор подщелачивают до рН 11 5 н. NaOH, а затем насыщают карбонатом калия. Раствор экстрагируют три раза этилацетатом и объединенные органические экстракты промывают рассолом, сушат над МgSO4 и концентрируют с получением 345 мг соединения 10 Б в виде темного масла. МС (ХИ, NН 3) 312 (МН+). В. трет-Бутиловый эфир (1-2-[3 а-(R,S)бензил-3-оксо-2-(2,2,2-трифторэтил)-2,3,3 а,4,6,7-гексагидропиразоло[4,3-с]пиридин-5-ил]-1(R)-бензилоксиметил-2-оксоэтилкарбамоил-1 метил-этил)-карбаминовой кислоты. В соответствии со способом, изложенным в общих чертах в Основной методике А, 137 мг(0,44 ммоль) соединения 10 Б и 167 мг (0,44 ммоль) соединения 1 Д подвергают реакции сочетания с получением смеси диастереомеров. Остаток очищают хроматографией на силикагеле с использованием градиентного элюирования от 100%-ного метиленхлорида до 5%-ного метанола в метиленхлориде с получением 128 мг менее полярного изомера 1 соединения 10 В и 63 мг более полярного изомера 2 соединения 10 В. МС (ХИ, NН 3) 674 (МН+) для обоих изомеров. Г. Гидрохлорид 2-амино-N-2-[3 а-(R)бензил-3-оксо-2-(2,2,2-трифторэтил)-2,3,3 а,4,6,7-гексагидропиразоло[4,3-с]пиридин-5-ил]-1(R)-бензилоксиметил-2-оксоэтил-изобутирамида. К 120 мг (0,18 ммоль) изомера 1 соединения 10 В в 3,5 мл этанола добавляют 1,5 мл концентрированной HCl и смесь перемешивают при комнатной температуре в течение примерно 2 ч.
МПК / Метки
МПК: C07D 471/04, A61K 38/05, C07K 5/06
Метки: способ, стимулирующими, средствами, роста, инсулину, резистентности, гормона, секрецию, лечения
Код ссылки
<a href="https://eas.patents.su/30-2089-sposob-lecheniya-rezistentnosti-k-insulinu-sredstvami-stimuliruyushhimi-sekreciyu-gormona-rosta.html" rel="bookmark" title="База патентов Евразийского Союза">Способ лечения резистентности к инсулину средствами, стимулирующими секрецию гормона роста</a>
Предыдущий патент: Фунгицидная смесь
Следующий патент: Синергетическая гербицидная композиция
Случайный патент: Система и способ для преобразования энергии волн в электрическую энергию